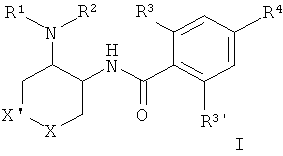
Изобретение относится к соединению общей формулы I
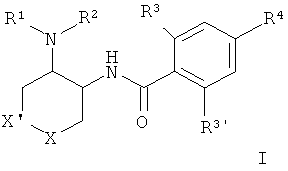
где R1/R2 независимо друг от друга представляют собой водород, (CR2)o-циклоалкил, возможно замещенный низшим алкилом или гидрокси, или представляют собой низший алкил или гетероциклоалкил, и
o представляет собой 0 или 1; и
R могут быть одинаковыми или различаться и представляют собой водород или низший алкил; или
R1 и R2 могут образовывать вместе с атомом N, к которому они присоединены, гетероциклоалкильную группу, выбранную из группы, состоящей из пирролидинила, пиперидинила, 3-аза-бицикло[3.1.0]гекс-3-ила или 2-аза-бицикло[3.1.0]гекс-2-ила, которые возможно замещены гидрокси;
R3 представляет собой S-низший алкил, низший алкил, низший алкокси или циклоалкил;
R3' представляет собой водород, низший алкил, замещенный галогеном, низший алкил или низший алкокси;
R4 представляет собой низший алкил, замещенный галогеном, низший алкил или низший алкокси;
X представляет собой -О- или -CH2-;
X' представляет собой -О- или -СН2-; при условии, что один из Х или X' всегда представляет собой -О- и другой представляет собой -CH2-;
или к фармацевтически приемлемой кислотно-аддитивной соли, к рацемической смеси, или к соответствующему энантиомеру и/или оптическому изомеру.
Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим соединения формулы I, и к их применению при лечении неврологических и психоневрологических расстройств.
Неожиданно было обнаружено, что соединения общей формулы I являются хорошими ингибиторами глицинового переносчика 1 (GlyT-1) и что они обладают хорошей селективностью в отношении ингибиторов глицинового переносчика 2 (GlyT-2).
Шизофрения представляет собой прогрессирующее и изнуряющее неврологическое заболевание, характеризующееся эпизодическими позитивными симптомами, такими как бред, галлюцинации, расстройства мышления и психоз, и стойкими негативными симптомами, такими как притупленный аффект, нарушение внимания и социальная самоизоляция, и когнитивными нарушениями (Lewis DA and Lieberman JA, Neuron, 2000, 28:325-33). В течение нескольких десятилетий исследование было сконцентрировано на гипотезе «дофаминергической гиперактивности», что привело к терапевтическим вмешательствам, включающим блокаду дофаминергической системы (Vandenberg RJ and Aubrey KR., Exp.Opin. Ther. Targets, 2001, 5(4): 507-518; Nakazato A and Okuyama S, et al., 2000, Exp. Opin. Ther. Patents, 10(1): 75-98). Этот фармакологический подход плохо соответствует лечению негативных и когнитивных симптомов, которые являются лучшими показателями функционального результата (Sharma Т., Br.J. Psychiatry, 1999, 174(suppl. 28): 44-51).
В середине 1960-х годов была предложена дополнительная модель шизофрении, основанная на психотомиметическом действии, вызываемом блокадой глутаматной системы соединениями, подобными фенциклидину (РСР) и родственным агентам (кетамину), которые являются неконкурентными антагонистами NMDA-рецептора. Интересно, что у здоровых волонтеров РСР-индуцированное психотомиметическое действие включает позитивные и негативные симптомы, а также когнитивную дисфункцию и, таким образом, сильно напоминает шизофрению у пациентов (Javitt DC et al., 1999, Biol. Psychiatry, 45: 668-679 и ссылки). Кроме того, трансгенные мыши, экспрессирующие пониженные уровни NMDAR1 субъединицы, проявляют аномалии в поведении, подобные тем, которые наблюдают в фармакологически индуцированных моделях шизофрении, что подтверждает модель, в которой уменьшение активности NMDA рецептора приводит к шизофреническому поведению (Mohn AR et al., 1999, Cell, 98: 427-236).
Глутаматная нейротрансмиссия, в частности активность NMDA рецептора, играет ключевую роль в синаптической пластичности, обучении и памяти, а именно NMDA рецепторы, по-видимому, служат в качестве дифференцированного переключателя для синхронизации порогового значения синаптической пластичности и формирования памяти (Hebb DO, 1949, The organization of behavior, Wiley, NY; Bliss TV and Collingridge GL, 1993, Nature, 361: 31-39). Трансгенные мыши, сверхэкспрессирующие NR2B субъединицу NMDA, проявляют повышенную синаптическую пластичность, лучшие способности к обучению и лучшую память (Tang JP et al., 1999, Nature: 401-63-69).
Таким образом, если патофизиология шизофрении включает дефицит глутамата, можно ожидать, что увеличение глутаматной трансмиссии, в частности посредством активации NMDA рецептора, будет вызывать как антипсихотические эффекты, так и эффекты повышения когнитивной функции.
Известно, что в ЦНС аминокислота глицин имеет по меньшей мере две важные функции. Связываясь со стрихнин-чувствительными глициновыми рецепторами, она действует как тормозная аминокислота, а, действуя в качестве основного коагониста глутамата на функцию рецептора N-метил-D-аспартата (NMDA), эта аминокислота оказывает влияние также на возбудительную активность. В то время как глутамат высвобождается из синаптических окончаний в зависимости от активности, глицин присутствует предположительно на более постоянном уровне и, по-видимому, модулирует/контролирует рецептор для его ответа на глутамат.
Один из наиболее эффективных путей контроля синаптических концентраций нейромедиатора состоит в том, чтобы воздействовать на его обратный захват в синапсах. Путем удаления нейромедиаторов из внеклеточного пространства переносчики нейромедиаторов могут контролировать их внеклеточное время жизни и тем самым модулировать параметры синаптической передачи (Gainetdinov RR et al, 2002, Trends in Pharm. Sci., 23(8): 367-373).
Глициновые переносчики, которые принадлежат натрий- и хлорид-зависимому семейству переносчиков нейромедиаторов, играют важную роль как в терминации постсинаптических глицинергических воздействий и поддержании низкой внеклеточной концентрации глицина путем обратного захвата глицина в пресинаптических нервных окончаниях, так и в близлежащих тонких глиальных отростках.
Из головного мозга млекопитающих были клонированы два разных гена глициновых переносчиков (GlyT-1 и GlyT-2), которые дают начало двум переносчикам примерно с 50% гомологией аминокислотной последовательности. GlyT-1 представлен четырьмя изоформами, являющимися результатом альтернативного сплайсинга и альтернативного использования промоторов (1а, 1b, 1с и 1d). Только две из этих изоформ были найдены в головном мозге грызунов (GlyT-1а и GlyT-1b). GlyT-2 также показывает некоторую степень гетерогенности. В головном мозге грызунов были идентифицированы две изоформы GlyT-2 (2а и 2b). Известно, что GlyT-1 локализуется в ЦНС и в периферических тканях, тогда как GlyT-2 является специфичным для ЦНС. GlyT-1 имеет преимущественно глиальное распределение, и его находят не только в областях, соответствующих стрихнин-чувствительным глициновым рецепторам, но также за пределами этих областей, где, как предполагается, он участвует в модуляции функции NMDA рецептора (Lopez-Corcuera В et al., 2001, Mol. Mem. Biol., 18: 13-20). Соответственно, один из способов повышения активности NMDA рецептора состоит в увеличении концентрации глицина в локальном микроокружении синаптических NMDA рецепторов путем ингибирования GlyT-1 переносчика (Bergereon R. Et al., 1998, Proc. Natl. Acad. Sci. USA, 95: 15730-15734; Chen L et al., 2003, J. Neurophysiol., 89 (2): 691-703).
Ингибиторы глициновых переносчиков подходят для лечения неврологических и психоневрологических расстройств. Большинство связанных с ними болезненных состояний представляют собой психоз, шизофрению (Armer RE and Miller DJ, 2001, Exp.Opin. Ther. Patents, 11 (4): 563-572), психотические расстройства настроения, такие как большое депрессивное расстройство тяжелого типа, расстройства настроения, связанные с психотическими расстройствами, такими как острый маниакальный синдром или депрессия, связанная с биполярными расстройствами, и расстройства настроения, связанные с шизофренией (Pralong ET et al., 2002, Prog. Neurobiol., 67: 173-202), аутистические расстройства (Carlsson ML, 1998, J. Neural Transm. 105: 525-535), когнитивные расстройства, такие как деменции, включая возрастную деменцию и сенильную деменцию Альцгеймеровского типа, нарушения памяти у млекопитающих, включая человека, синдромы дефицита внимания и боль (Armer RE and Miller DJ, 2001, Exp. Opin. Ther. Patents, 11 (4): 563-572).
Таким образом, увеличение активации NMDA рецепторов посредством ингибирования GlyT-1 может привести к агентам, которые лечат психоз, шизофрению, слабоумие и другие заболевания, при которых нарушены когнитивные процессы, такие как синдромы дефицита внимания или болезнь Альцгеймера.
Предметами настоящего изобретения являются соединения формулы I по существу, применение соединений формулы I и их фармацевтически приемлемых солей для изготовления лекарств для лечения заболеваний, относящихся к активации NMDA рецепторов посредством ингибирования GlyT-1, их изготовление, лекарства, основанные на соединении согласно данному изобретению, и их производство, а также применение соединений формулы I для лечения или предотвращения болезней, таких как психоз, дисфункция памяти и обучения, шизофрения, слабоумие и другие заболевания, при которых нарушены когнитивные процессы, такие как синдромы дефицита внимания или болезнь Альцгеймера.
Предпочтительными показаниями для применения соединений по настоящему изобретению являются шизофрения, когнитивное нарушение и болезнь Альцгеймера.
Кроме того, изобретение включает все рацемические смеси, все соответствующие энантиомеры и/или оптические изомеры.
Как используется здесь, термин «низший алкил» обозначает группу с насыщенной неразветвленной или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например, метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и подобные. Предпочтительными алкильными группами являются группы с 1-4 атомами углерода.
Как используется здесь, термин «низший алкокси» обозначает низшую алкильную группу, как определено выше, которая соединена с атомом O.
Термин «циклоалкил» обозначает насыщенное или частично насыщенное кольцо, содержащее от 3 до 7 атомов углерода, например, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил или циклогептенил. Предпочтительными циклоалкильными кольцами являются циклопропил и циклопентил.
Термин «гетероциклоалкил» обозначает насыщенное или частично насыщенное кольцо, содержащее от 3 до 6 атомов углерода, где по меньшей мере один атом углерода замещен гетероатомом, выбранным из N, S или О, например пиперазинил, пирролидинил, оксетанил, морфолинил, пиперидинил или тетрагидропиранил.
Термин «галоген» обозначает хлор, йод, фтор и бром.
Термин «низший алкил, замещенный галогеном» обозначает алкильную группу, как определено выше, где по меньшей мере один атом водорода замещен атомом галогена, например следующие группы: CF3, CHF2, CH2F, CH2CF3, CH2CHF2, CH2CH2F, CH2CH2CF3, CH2CH2CH2CF3, CH2CH2CI, CH2CF2CF3, CH2CF2CHF2, CF2CHFCF3, С(СН3)2CF3, СН(СН3)CF3 или CH(CH2F)CH2F.
Термин «фармацевтически приемлемые кислотно-аддитивные соли» охватывает соли с неорганическими и органическими кислотами, такие как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и подобные.
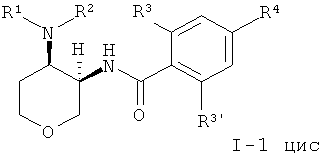
Одно воплощение изобретения представляет собой соединения формулы I, где X представляет собой О и X' представляет собой СН2, которые имеют следующую структуру:
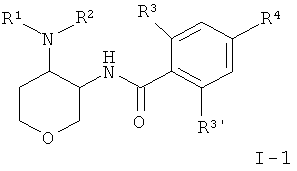
где R1/R2 независимо друг от друга представляют собой водород, (CR2)o-циклоалкил, возможно замещенный низшим алкилом или гидрокси, или представляют собой низший алкил или гетероциклоалкил, и
o представляет собой 0 или 1; и
R могут быть одинаковыми или различаться, и представляют собой водород или низший алкил; или
R1 и R2 могут образовывать вместе с атомом N, к которому они присоединены, гетероциклоалкильную группу, выбранную из группы, состоящей из пирролидинила, пиперидинила, 3-аза-бицикло[3.1.0]гекс-3-ила или 2-аза-бицикло[3.1.0]гекс-2-ила, которые возможно замещены гидрокси;
R3 представляет собой S-низший алкил, низший алкил, низший алкокси или циклоалкил;
R3' представляет собой водород, низший алкил, замещенный галогеном, низший алкил или низший алкокси;
R4 представляет собой низший алкил, замещенный галогеном, низший алкил или низший алкокси;
или фармацевтически приемлемую кислотно-аддитивную соль, рацемическую смесь, или соответствующий энантиомер и/или оптический изомер.
Особым воплощением этой группы являются соединения, где R1 и R2 могут образовывать вместе с атомом N, с которым они связаны, гетероциклоалкильную группу, выбранную из группы, состоящей из пирролидинила, пиперидинила, 3-аза-бицикло[3.1.0]гекс-3-ила или 2-аза-бицикло[3.1.0]гекс-2-ила, которые возможно замещены гидрокси, например следующие соединения:
2-метокси-6-метилсульфанил-N-((3RS,4SR)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(-)-2-метокси-6-метилсульфанил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
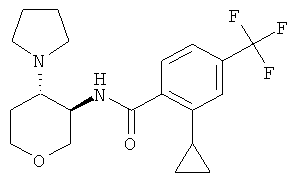
2-циклопропил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
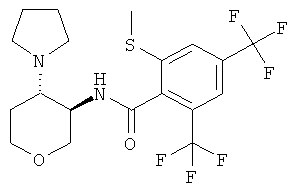
2-метилсульфанил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
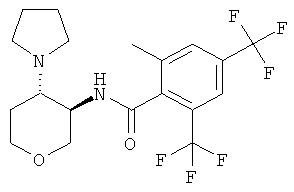
2-метил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
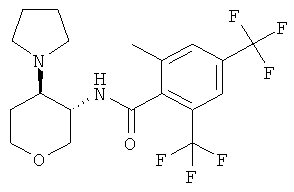
2-циклопропил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
2-циклопропил-N-((3SR,4RS)-4-пиперидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
2,6-диметил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
2,6-диэтил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
2-этил-6-метокси-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
2-этил-6-метил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
2-циклопропил-6-метокси-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
N-[(3S,4R)-4-(3-аза-бицикло[3.1.0]гекс-3-ил)-тетрагидро-пиран-3-ил]-2-циклопропил-4-трифторметил-бензамид,
(+)-2-циклопропил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(-)-2-циклопропил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(+)-2-метил-N-транс-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
(-)-2-метил-N-транс-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
(+)-2-метилсульфанил-N-транс-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
(-)-2-метилсульфанил-N-транс-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
(+)-2-циклопропил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
(-)-2-циклопропил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
(+)-2,6-диметил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(-)-2,6-диметил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(+)-2-метокси-6-метил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(-)-2-метокси-6-метил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(+)-2-этил-6-метокси-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(-)-2-этил-6-метокси-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(+)-2-циклопропил-6-метокси-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(-)-2-циклопропил-6-метокси-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
N-[(3SR,4RS)-4-(2-аза-бицикло[3.1.0]гекс-2-ил)-тетрагидро-пиран-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид.
Дополнительным особым воплощением этой группы являются соединения, где R1 и R2 независимо друг от друга представляют собой водород или (CR2)o-циклоалкил, и о представляет собой 0 или 1; и R могут быть одинаковыми или различаться, и представляют собой водород или низший алкил, например:
N-((3SR,4RS)-4-циклопентиламино-тетрагидро-пиран-3-ил)-2-циклопропил-4-трифторметил-бензамид,
2-циклопропил-N-[(3RS,4SR)-4-(1-циклопропил-этиламино)-тетрагидро-пиран-3-ил]-4-трифторметил-бензамид,
(+)-N-(транс-4-циклопентиламино-тетрагидро-пиран-3-ил)-2-циклопропил-4-трифторметил-бензамид или
(+)-N-(4-циклогексиламино-тетрагидро-пиран-3-ил)-2-циклопропил-4-трифторметил-бензамид.
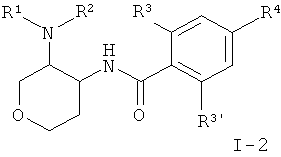
Другое воплощение изобретения представляет собой соединения формулы I, где Х представляет собой СН2 и X' представляет собой О, следующей структуры:
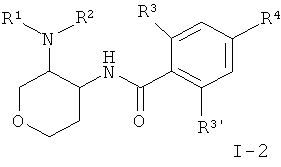
где R1/R2 независимо друг от друга представляют собой водород, (CR2)o-циклоалкил, возможно замещенный низшим алкилом или гидрокси, или представляют собой низший алкил или гетероциклоалкил, и
o представляет собой 0 или 1; и
R могут быть одинаковыми или различаться, и представляют собой водород или низший алкил; или
R1 и R2 могут образовывать вместе с атомом N, к которому они присоединены, гетероциклоалкильную группу, выбранную из группы, состоящей из пирролидинила, пиперидинила, 3-аза-бицикло[3.1.0]гекс-3-ила или 2-аза-бицикло[3.1.0]гекс-2-ила, которые возможно замещены гидрокси;
R3 представляет собой S-низший алкил, низший алкил, низший алкокси или циклоалкил;
R3' представляет собой водород, низший алкил, замещенный галогеном, низший алкил или низший алкокси;
R4 представляет собой низший алкил, замещенный галогеном, низший алкил или низший алкокси;
или фармацевтически приемлемую кислотно-аддитивную соль, рацемическую смесь, или соответствующий энантиомер и/или оптический изомер, например следующие соединения:
цис-2-метокси-6-метилсульфанил-N-(3-пирролидин-1-ил-тетрагидро-пиран-4-ил)-4-трифторметил-бензамид,
(-)-2-метокси-6-метилсульфанил-N-(3-пирролидин-1-ил-тетрагидро-пиран-4-ил)-4-трифторметил-бензамид или
(+)-2-метокси-6-метилсульфанил-N-(3-пирролидин-1-ил-тетрагидро-пиран-4-ил)-4-трифторметил-бензамид.
Настоящие соединения формулы I и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области, например способами, описанными ниже, согласно которым
а) подвергают взаимодействию соединение формулы
с соединением формулы
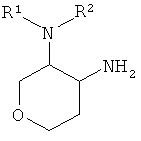
в присутствии активирующего агента, такого как HATU (O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат), до соединения формулы
где заместители являются такими, как определено выше, или
b) проводят восстановительное аминирование соединения формулы
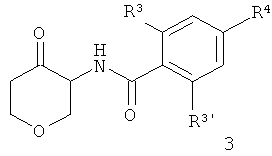
с соединением формулы
NHR1R2
и разделяют полученное соединение с помощью колоночной хроматографии, чтобы получить соединения формул
 и
и 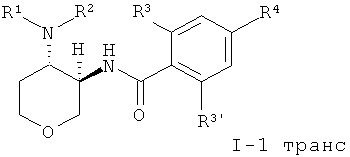
где заместители являются такими, как определено выше, или
с) алкилируют или проводят восстановительное аминирование соединения формулы
до соединения формулы
где заместители являются такими, как определено выше, и,
при желании переводят полученные соединения в фармацевтически приемлемые кислотно-аддитивные соли.
Соединения формулы 1 могут быть получены согласно варианту способа а), или b), или c), и следующим схемам 1-7. Исходные вещества имеются в продаже, или могут быть получены в соответствии с известными способами.
Общий синтез
Схема 1
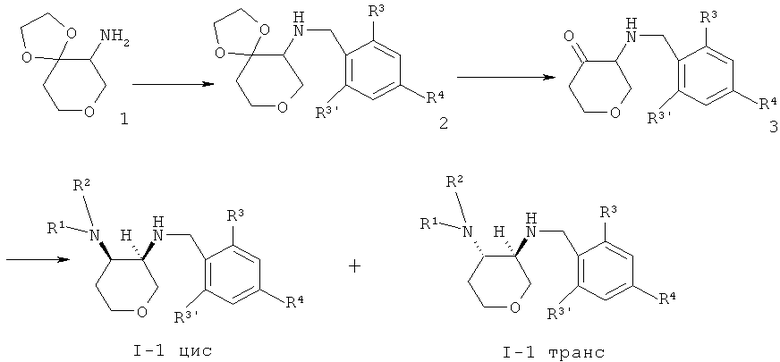
1,4,8-Триоксаспиро[4,5]декан-6-амин (CAS 1068523-26-1) 1 соединяли с кислотой, используя связующий агент O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (=HATU) в диметилформамиде, чтобы получить амид 2. Защитную группу отщепляли с HCl, что давало кетон 3. Восстановительное аминирование давало смесь I-1 цис и I-1 транс, которую разделяли с помощью колоночной хроматографии.
Схема 2
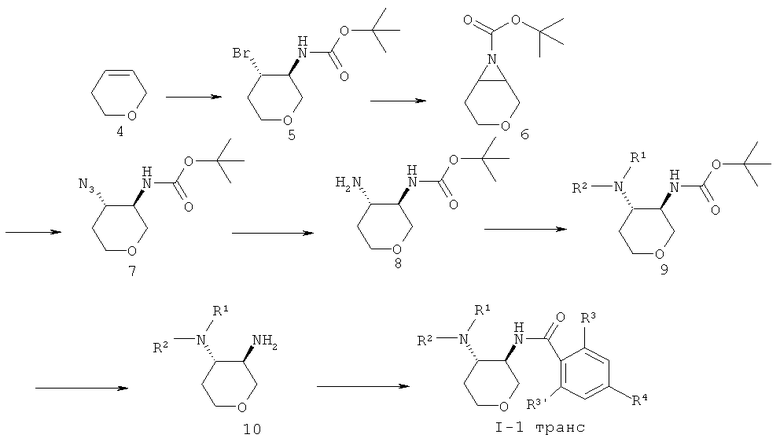
3,6-Дигидро-2H-пиран 4 подвергали взаимодействию с mpem-бутиловым эфиром N,N-дибром-карбаминовой кислоты (CAS 358365-86-3) до промежуточного соединения 5, которое обрабатывали с гидридом натрия, что давало азиридин 6. Раскрытие кольца с азидом натрия давало азид 7 с транс-конфигурацией, который восстанавливали с водородом и платиновым катализатором до амина 8. Алкилирование или восстановительное аминирование давало амин 9. Отщепление Boc-защитной группы достигалось с HCl, что давало диамин 10, который соединяли с кислотой, используя связующий агент O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (=HATU) в диметилформамиде, чтобы получить амид I-1 транс.
Схема 3
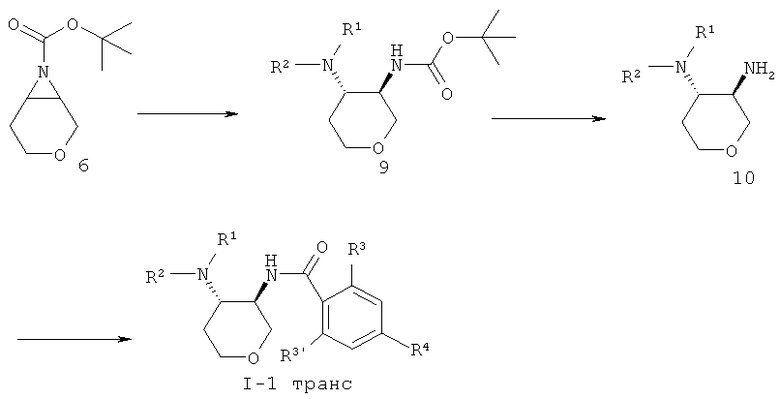
Азиридин 6 обрабатывали с амином R1R2NH, что давало транс амин 9. Отщепление Вос-защитной группы достигалось с HCl, что давало диамин 10, который соединяли с кислотой, используя связующий агент O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (=HATU) в диметилформамиде, чтобы получить амид 1-1 транс.
Схема 4
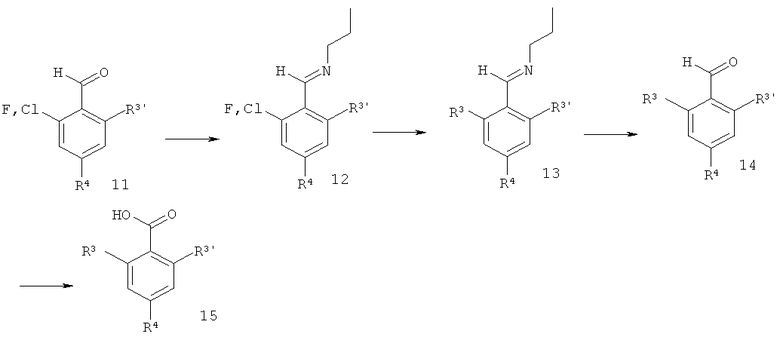
орто-Фтор или орто-хлор бензальдегид 11 подвергали взаимодействию с бутиламином, что давало имин 12. Добавление реактива Гриньяра R'MgBr давало 13. Гидролиз приводил к альдегиду 14, который окисляли до кислоты 15.
Схема 5
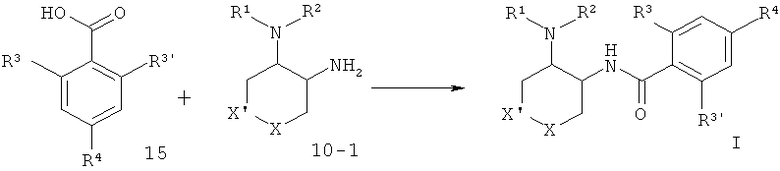
Диамин 10-1, соединяли с кислотой 15, используя связующий агент O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (=HATU) в диметилформамиде, чтобы получить амид I.
Схема 6
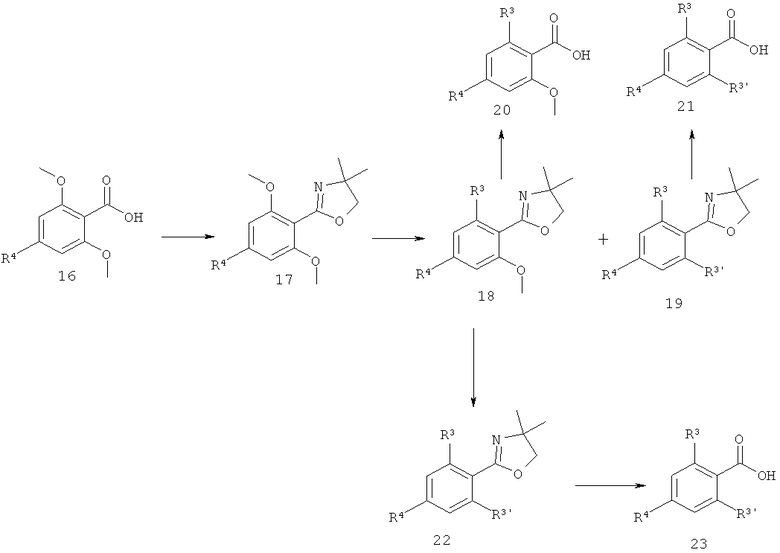
Заместители являются такими, как описано выше, и R3 и R3 отличаются от низшего алкокси.
Некоторые орто-орто' замещенные кислоты получают согласно схеме 6, следуя методике, описанной A. I. Meyers et al. JOC, 1978, 43, 1372. Сначала орто-орто' метокси производное кислоты 16 переводят в оксазолидинон 17, который обрабатывают с реактива Гриньяра R3MgX, что дает промежуточное соединение 18 (полученное в результате монодобавления R3MgX) и промежуточное соединение 19 (полученное в результате добавления R3MgX), которые затем гидролизуют до соответствующих кислот 20 и 21. Также промежуточное соединение 18 можно подвергнуть взаимодействию с другим реактивом Гриньяра R3MgX, что дает промежуточное соединение 22, которое затем гидролизуют до кислоты 23.
Схема 2
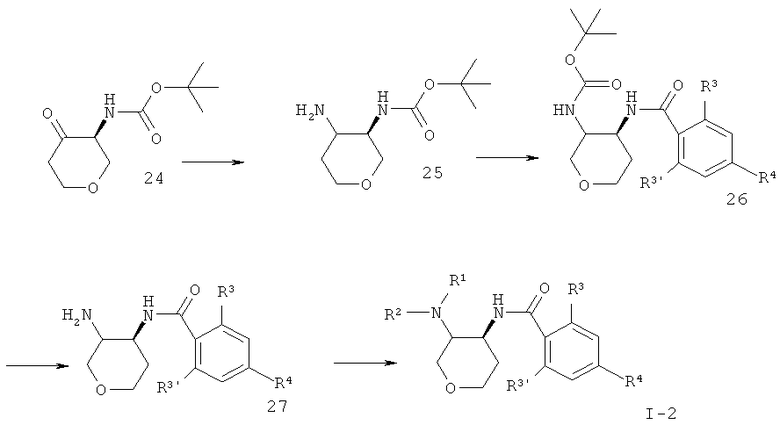
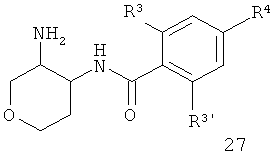
Кетон 24 (CAS 477584-38-6) подвергают восстановительному аминированию, что дает смесь цис- и транс-25, которую соединяют с кислотой, используя связующий агент 0-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (=HATU) в диметилформамиде, чтобы получить амид цис- и транс-26. Отщепление Вос-защитной группы и последующее алкилирование или восстановительное аминирование дают конечное соединение 1-2 в виде смеси цис и транс.
Синтез промежуточных соединений
Промежуточное соединение А
2-Метокси-6-метилсульфанил-4-трифторметил-бензойная кислота
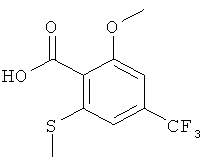
N,N,N',N'-Тетраметилэтилендиамин (21 г, 177 ммоль) добавляли по каплям при -70°С к раствору emop-бутиллития (110 мл, 1,4 М в циклогексане, 154 ммоль) в 180 мл тетрагидрофурана. 2-Метокси-4-трифторметил-бензойную кислоту (13 г, 59 ммоль) в 60 мл тетрагидрофурана добавляли по каплям при -70°С в течение 2 часов. После завершения добавления продолжали перемешивать при -70°С в течение еще 2 часов. Диметилдисульфид (20 г, 207 ммоль) добавляли при -70°С в течение 10 минут. Продолжали перемешивать при -70°С в течение еще часа и реакционную смесь нагревали. Реакционную смесь гасили 150 мл воды и экстрагировали 200 мл этилацетата. Доводили pH водной фазы до 1, добавляя 25% HCl, и экстрагировали дважды дихлорметаном. Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и выпаривали. Неочищенный продукт кристаллизовали с гептаном и получали указанное в заголовке соединение в виде белого твердого вещества (1,75 г, 11%), MS: m/e=265,1 [(М-Н]-).
Промежуточное соединение В
2-Метокси-6-метилсульфанил-4-трифторметил-N-(1,4,8-триокса-спиро[4.5]дек-6-ил)-бензамид
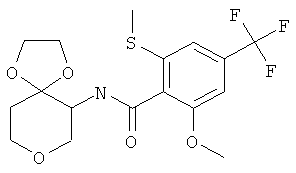
2-Метокси-6-метилсульфанил-4-трифторметил-бензойную кислоту (промежуточное соединение А, 400 мг, 1,5 ммоль) растворяли в 10 мл диметилформамида. Добавляли N,N-диизопропилэтиламин (505 мг, 3,9 ммоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (571 мг, 1,5 ммоль). Через 10 минут перемешивания при комнатной температуре добавляли 1,4,8-триоксаспиро[4,5]декан-6-амин (CAS 1068523-26-1) (359 мг, 2,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали. Остаток переносили в 2 н. раствор карбоната натрия и этилацетата и экстрагировали три раза этилацетатом. Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и выпаривали. Очистка остатка с помощью флэш-хроматографии на силикагеле (гептан/этилацетат/триэтиламин 1:0:0→10:10:1) давала 2-метокси-6-метилсульфанил-4-трифторметил-N-(1,4,8-триокса-спиро[4.5]дек-6-ил)-бензамид в виде белого твердого вещества (462 мг, 75%), MS: m/e=408,2 [(M+H)+.
Промежуточное соединение С
2-Метокси-6-метилсульфанил-N-(4-оксо-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид
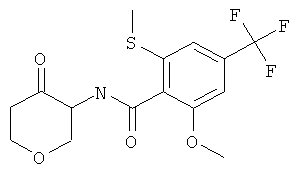
2-Метокси-6-метилсульфанил-4-трифторметил-Л/-(1,4,8-триокса-спиро[4.5]дек-6-ил)-бензамид (промежуточное соединение В, 200 мг, 0,49 ммоль) растворяли в 1 мл тетрагидрофурана и добавляли 1 мл 4 н HCI в диоксане. Реакционную смесь нагревали с обратным холодильником в течение 2 часов. Смесь разбавляли водой, этилацетатом и нейтрализовали насыщенным раствором гидрокарбоната натрия. Смесь экстрагировали два раза этилацетатом. Объединенные органические слои высушивали с сульфатом натрия, фильтровали и выпаривали. Неочищенный продукт использовали на следующей стадии.
Промежуточное соединение D
трет-Бутиловый эфир транс-(4-бром-тетрагидро-пиран-3-ил)-карбаминовой кислоты
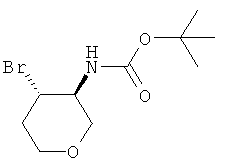
трет-Бутиловый эфир N,N-дибром-карбаминовой кислоты (CAS 358365-86-3) (8,98 г, 28 ммоль) растворяли в 90 мл дихлорметана и охлаждали до -20°С. Комплекс диэтилового эфира и трифторида бора (3,99 г, 28 ммоль) добавляли по каплям, и смесь перемешивали при -20°С в течение 10 минут. Раствор 3,6-дигидро-2Н-пирана (2,5 г, 27 ммоль) в 20 мл дихлорметана добавляли по каплям и продолжали перемешивать при -20°С в течение 1 часа. Реакционную смесь гасили при +10°С 33 мл 12% водного раствора сульфита натрия. Смесь экстрагировали три раза дихлорметаном. Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и выпаривали. Очистка остатка с помощью флэш-хроматографии на силикагеле (пентан/диэтиловый эфир 1:0→0:1) давала указанное в заголовке соединение в виде белого твердого вещества (4,24 г, 56%), MS: m/e=223 [(M-бутен)+].
Промежуточное соединение Е
трет-Бутиловый эфир 3-окса-7-аза-бицикло[4.1.0]гептан-7-карбоновой кислоты
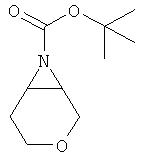
трет-Бутиловый эфир транс-(4-бром-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение D) (1,0 г, 3,5 ммоль) растворяли в 35 мл диметилформамида. Добавляли гидрид натрия (60%, 214 мг, 5,4 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь гасили, аккуратно добавляя воду. Смесь экстрагировали три раза диэтиловым эфиром. Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и выпаривали. Очистка остатка с помощью флэш-хроматографии на силикагеле (гептан/этилацетат 1:0→1:1) давала указанное в заголовке соединение в виде бесцветного масла (499 мг, 70%), MS: m/e=143 [(M-бутен)+].
Промежуточное соединение F
трет-Бутиловый эфир транс-(4-азидо-тетрагидро-пиран-3-ил)-карбаминовой кислоты
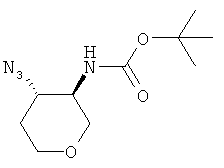
трет-Бутиловый эфир 3-окса-7-аза-бицикло[4.1.0]гептан-7-карбоновой кислоты (промежуточное соединение Е) (5,2 г, 26 ммоль) растворяли в 100 мл ацетонитрила. Перхлорат лития (23 г, 207 ммоль) и азид натрия (6,8 г, 104 ммоль) добавляли и реакционную смесь перемешивали при 80°С в течение ночи. Добавляли 200 мл воды. Смесь экстрагировали три раза диэтиловым эфиром. Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и выпаривали. Очистка остатка с помощью флэш-хроматографии на силикагеле (гептан/этилацетат 1:0→1:1) давала указанное в заголовке соединение в виде бесцветного масла (3,3 г, 52%), MS: m/e=186 [(М-бутен)+].
Промежуточное соединение G
трет-Бутиловый эфир транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты

трет-Бутиловый эфир транс-(4-азидо-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение F) (3,3 г, 14 ммоль) растворяли в 27 мл метанола. Добавляли оксид платины (IV) (307 мг, 1,4 ммоль), реакционную смесь гидрировали, используя H2-баллон, при комнатной температуре в течение ночи. Катализатор отфильтровывали и растворитель выпаривали. Неочищенное вещество, твердое вещество белого оттенка (2,74 г, 93%), MS: m/e=161 [(M-бутен)+] использовали без дополнительной очистки.
Промежуточное соединение Н
трет-Бутиловый эфир транс-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-карбаминовой кислоты

трет-Бутиловый эфир транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение G, 330 мг, 1,53 ммоль) растворяли в 8 мл ацетонитрила. Добавляли карбонат калия (1,05 г, 7,6 ммоль) и 1,4-дибромбутан (672 мг, 3,11 ммоль) и реакционную смесь нагревали с обратным холодильником в течение ночи. Растворитель выпаривали. Остаток переносили в воду и экстрагировали три раза диэтиловым эфиром. Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и выпаривали. Очистка остатка с помощью флэш-хроматографии на силикагеле (дихлорметан / метанол/аммиак 1:0:0→140:10:1) давала указанное в заголовке соединение в виде желтого масла (347 мг, 84%), MS: m/e=271,3 [(M+H)+].
Промежуточное соединение I
транс-4-Пирролидин-1-ил-тетрагидро-пиран-3-иламинадигидрохлорид
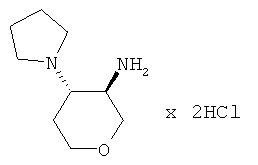
трет-Бутиловый эфир транс-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение Н, 345 мг, 1,28 ммоль) растворяли в 6,4 мл диоксана. Добавляли соляную кислоту (4 н. в диоксане, 3,2 мл, 13 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Растворитель выпаривали. Неочищенное вещество, светло-коричневое твердое вещество (378 мг, > 100%), MS: m/e=171,2 [(M+H)+] использовали без дополнительной очистки.
Промежуточное соединение J
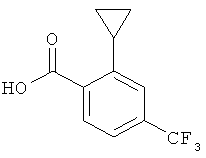
2-Циклопропил-4-трифторметил-бензойная кислота
Стадия 1: Метиловый эфир 2-бром-4-трифторметил-бензойной кислоты
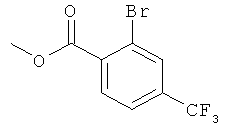
К раствору 2 г (7,434 ммоль) 2-бром-4-трифторметил-бензойной кислоты (CAS: 328-89-2) в 20 мл диметилформамида в атмосфере азота при комнатной температуре добавляли 1,13 г (8,177 ммоль) карбоната калия и 557 мкл (8,921 ммоль) метилиодида. Смесь перемешивали в течение ночи в атмосфере азота. Смесь выливали в воду (300 мл). Водный слой экстрагировали этилацетатом (2×80 мл). Объединенные экстракты высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное масло очищали на силикагеле (элюент: гептан/этилацетат 0 до 10%), что давало 1,75 г (83%) указанного в заголовке соединения в виде оранжевого масла.
Стадия 2: Метиловый эфир 2-цикпопропил-4-трифторметил-бензойной кислоты
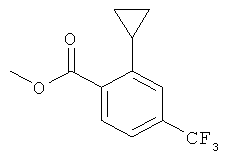
К раствору 400 мг (1,413 ммоль) метилового эфира 2-бром-4-трифторметил-бензойной кислоты, 146 мг (1,696 ммоль) циклопропил бороновой кислоты, 1,21 г (4,946 ммоль) моногидрата фосфата калия и 40,9 мг (0,141 ммоль) трициклогексилфосфина в 6 мл толуола и 0,3 мл воды в атмосфере азота при комнатной температуре добавляли 15,9 мг (0,0707 ммоль) ацетата палладия. Смесь перемешивали на 100°С масляной бане в течение 4 часов и в течение ночи при комнатной температуре в атмосфере азота. Смесь охлаждали до комнатной температуры. Добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали один раз солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное соединение очищали на силикагеле (элюент: гептан/этилацетат 0 до 10%), что давало 0,24 г (71%) указанного в заголовке соединения в виде желтого масла.
Стадия 3: 2-Циклопропил-4-трифторметил-бензойная кислота

К суспензии 485 мг (1,986 ммоль) метилового эфира 2-циклопропил-4-трифторметил-бензойной кислоты в 8 мл этанола при комнатной температуре добавляли 1,99 мл (3,972 ммоль) 2 н. NaOH. Смесь нагревали на 80°С масляной бане в течение 30 минут. Раствор охлаждали до комнатной температуры и этанол выпаривали. Остаток разбавляли водой, подкисляли 2 н. HCl до pH 2 и добавляли дихлорметан. Водную фазу экстрагировали дважды дихлорметаном. Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0 до 100%), что давало 0,197 г (27%) указанного в заголовке соединения в виде светло-желтого твердого вещества. MS(m/e): 229,0 (М-Н).
Промежуточное соединение K
трет-Бутиловый эфир транс-(4-циклопентиламино-тетрагидро-пиран-3-ил)-карбаминовой кислоты
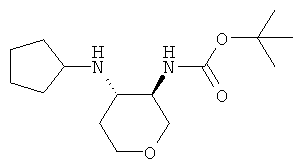
трет-Бутиловый эфир транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение G, 1,0 г, 4,63 ммоль) растворяли в 90 мл метанола. Добавляли уксусную кислоту (1,4 г, 23 ммоль) и циклопентанон (1,18 г, 14 ммоль) и реакционную смесь перемешивали при 45°С в течение ночи. Добавляли цианоборгидрид натрия (612 мг, 9,7 ммоль) и продолжали перемешивать при 45°С в течение 2 часов. Смесь экстрагировали 2 н. раствором карбоната натрия и этилацетатом. Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и выпаривали. Очистка остатка с помощью флэш-хроматографии на силикагеле (дихлорметан/метанол/аммиак 100:0:0→90:10:1) давала указанное в заголовке соединение в виде желтого твердого вещества (815 мг, 62%), MS: m/e=229,4 [(М-бутен)+].
Промежуточное соединение L
транс-N-4-Циклопентил-тетрагидро-пиран-3,4-диамина дигидрохлорид
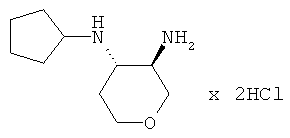
Указанное в заголовке соединение, светло-коричневое твердое вещество, MS: m/e=185,2 [(М+Н)+], получали согласно общему способу промежуточного соединения I из трет-бутилового эфира транс-(4-циклопентиламино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение K).
Промежуточное соединение М
Бутил-[1-(2-фтор-4,6-бис-трифторметил-фенил)-метилиден]-амин
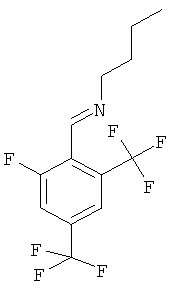
2-Фтор-4,6-бис(трифторметил)бензальдегид (10 г, 38 ммоль) растворяли в 30 мл толуола. Добавляли п-толуолсульфоновую кислоту (140 мг, 0,74 ммоль) и N-бутиламин (2,94 г, 40 ммоль). Реакционную смесь нагревали с обратным холодильником в течение ночи. Смесь экстрагировали 2 н. раствором карбоната натрия и этилацетатом. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и выпаривали. Неочищенное вещество, оранжевое масло (12 г, > 100%), использовали без дополнительной очистки.
Промежуточное соединение N
Бутил-[1-(2-циклопропил-4,6-бис-трифторметил-фенил)-метилиден]-амин
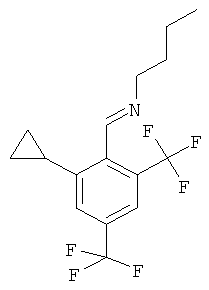
Циклопропилбромид (3,84 г, 32 ммоль) добавляли к магнию (771 мг, 32 ммоль) в 20 мл диэтилового эфира и нагревали с обратным холодильником в течение 10 минут. Добавляли хлорид марганца (II) (160 мг, 1,27 ммоль) и бутил-[1-(2-фтор-4,6-бис-трифторметил-фенил)-метилиден]-амин (промежуточное соединение М, 4 г, 13 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 2 часов. Реакционную смесь гасили 8 мл воды и фильтровали через дикалит. Органическую фазу отделяли и сушили над сульфатом натрия, фильтровали и выпаривали. Неочищенное вещество, коричневое масло (3,54 г, 82%), использовали без дополнительной очистки.
Промежуточное соединение O
2-Циклопропил-4,6-бис-трифторметил-бензальдегид
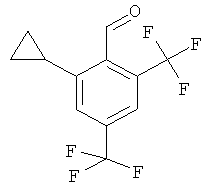
Неочищенный бутил-[1-(2-циклопропил-4,6-бис-трифторметил-фенил)-метилиден]-амин (промежуточное соединение М, 3,54 г, 10,5 ммоль) растворяли в 8 мл воды. Добавляли соляную кислоту (25%, 0,49 мл) и смесь нагревали с обратным холодильником в течение 2 часов. Смесь экстрагировали три раза этилацетатом. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и выпаривали. Неочищенное вещество, коричневое масло (1,01 г, 34%), использовали без дополнительной очистки.
Промежуточное соединение Р 2-Циклопропил-4,6-бис-трифторметил-бензойная кислота
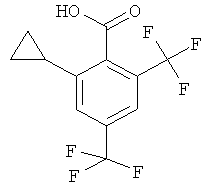
Неочищенный 2-циклопропил-4,6-бис-трифторметил-бензальдегид (промежуточное соединение О, 1,01 г, 3,58 ммоль) растворяли в 8,5 мл трет-бутилового спирта и 4,5 мл 2-метил-2-бутена. При 0°С добавляли раствор хлорита натрия (340 мг, 3,76 ммоль) и дигидрофосфата натрия (451 мг, 3,76 ммоль) в 3 мл воды. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворители выпаривали. Остаток переносили в 1 н. NaOH и экстрагировали дважды трет-бутилметиловым эфиром. Доводили pH водной фазы до 2, добавляя 25% HCl, и экстрагировали дважды трет-бутилметиловым эфиром. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и выпаривали. Неочищенное вещество, твердое вещество белого оттенка (1,01 г, 54%), использовали без дополнительной очистки.
Промежуточное соединение Q
транс-N,4-Циклогексил-тетрагидро-пиран-3,4-диамина гидрохлорид
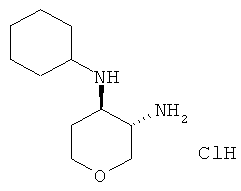
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=199,4 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-(4-циклогексиламино-тетрагидро-пиран-3-ил)-карбаминовой кислоты, который получали, следуя процедуре, описанной для промежуточного соединения K, из трет-бутилового эфира транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение G) и циклопентанона.
Промежуточное соединение R
транс-N-4-Изопропил-тетрагидро-пиран-3,4-диамина гидрохлорид
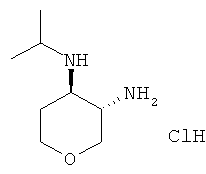
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=159,3 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-(4-изопропиламино-тетрагидро-пиран-3-ил)-карбаминовой кислоты, который получали, следуя процедуре, описанной для промежуточного соединения K, из трет-бутилового эфира транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение G) и ацетона.
Промежуточное соединение S
транс-N-4-(Тетрагидро-пиран-4-ил)-тетрагидро-пиран-3,4-диамина дигидрохлорид
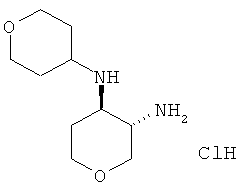
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=201,3 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-[4-(тетрагидро-пиран-4-иламино)-тетрагидро-пиран-3-ил]-карбаминовой кислоты, который получали, следуя процедуре, описанной для промежуточного соединения К, из трет-бутилового эфира транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение G) и тетрагидропиранона.
Промежуточное соединение Т
транс-N-4-Циклопропилметил-тетрагидро-пиран-3,4-диамина дигидрохлорид
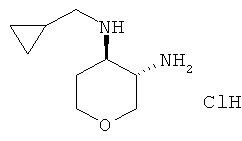
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=171,3 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-[4-(циклопропилметил-амино)-тетрагидро-пиран-3-ил]-карбаминовой кислоты, который получали, следуя процедуре, описанной для промежуточного соединения K, из трет-бутилового эфира транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение G) и циклопропанкарбальдегида.
Промежуточное соединение U
транс-4-Пиперидин-1-ил-тетрагидро-пиран-3-ил-амина дигидрохлорид
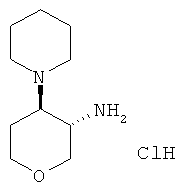
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=185,2 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-(4-пиперидин-1-ил-тетрагидро-пиран-3-ил)-карбаминовой кислоты, который получали, следуя процедуре, описанной для промежуточного соединения Н, из трет-бутилового эфира транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение G) и 1,5-дибромпропана.
Промежуточное соединение V
транс-N-4-Циклопропил-тетрагидро-пиран-3,4-диамина дигидрохлорид

Указанное в заголовке соединение, белое твердое вещество, MS: m/e -157,3 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-(4-циклопропиламино-тетрагидро-пиран-3-ил)-карбаминовой кислоты, который получали, следуя процедуре, описанной для промежуточного соединения К, из трет-бутилового эфира транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение G) и [(1-этоксициклопропил)окси]-триметилсилана.
Промежуточное соединение W
трет-Бутиловый эфир транс-4-(1-метил-циклогексиламино)-тетрагидро-пиран-3-ил]-карбаминовой кислоты
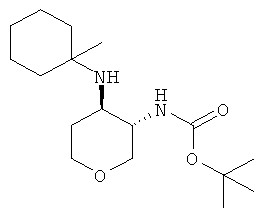
К раствору 350 мг (1,405 ммоль) mpem-бутилового эфира 3-окса-7-аза-бицикло[4.1.0]гептан-7-карбоновой кислоты (промежуточное соединение Е) в 6,0 мл ацетонитрила добавляли 430 мг (2,8 ммоль) 1-амино-1-метилциклогексана гидрохлорида (CAS: 89854-70-6), 505 мкл (2,951 ммоль) N-этилдиизопропиламина и 1,2 г (11,24 ммоль) перхлората лития. Смесь нагревали при 70°С в течение 6 часов и затем перемешивали при комнатной температуре в течение ночи. Смесь охлаждали до комнатной температуры и разбавляли дихлорметаном. Раствор промывали один раз водой. Промывные растворы экстрагировали один раз дихлорметаном. Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Очистка остатка с помощью флэш-хроматографии на силикагеле (гептан, этилацетат 100:0→0:100) давала указанное в заголовке соединение в виде светло-желтого твердого вещества (53 мг, 12%), MS: m/e=313,2 [M+H+].
Промежуточное соединение X
транс-N-4-(1-Метил-циклогексил)-тетрагидро-пиран-3,4-диамина дигидрохлорид
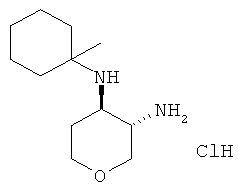
Указанное в заголовке соединение, белое твердое вещество, MS: m/e -213,4 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-[4-(1-метил-циклогексиламино)-тетрагидро-пиран-3-ил]-карбаминовой кислоты.
Промежуточное соединение Y
транс-N-4-(1-Метил-циклопентил)-тетрагидро-пиран-3,4-диамина гидрохлорид
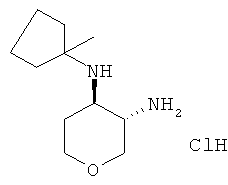
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=199,3 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-[4-(1-метил-циклопентиламино)-тетрагидро-пиран-3-ил]-карбаминовой кислоты, который получали, следуя процедуре, описанной для промежуточного соединения W, из трет-бутилового эфира 3-окса-7-аза-бицикло[4.1.0]гептан-7-карбоновой кислоты (промежуточное соединение Е) и 1-амино-1-метилциклопентана гидрохлорида (CAS: 102014-58-4).
Промежуточное соединение Z
транс-N-4-(1-Циклопропил-этил)-тетрагидро-пиран-3,4-диамина дигидрохлорид
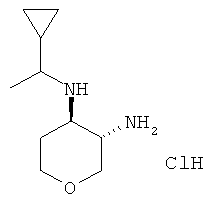
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=185,2 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-[4-(1-циклопропил-этиламино)-тетрагидро-пиран-3-ил]-карбаминовой кислоты, который получали, следуя процедуре, описанной для промежуточного соединения K, из mpem-бутилового эфира транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение G) и 1-циклопропил-этанона.
Промежуточное соединение АА
транс-N-4-Циклобутил-тетрагидро-пиран-3,4-диаминадигидрохлорид
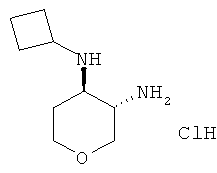
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=171,3 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-(4-циклобутиламино-тетрагидро-пиран-3-ил)-карбаминовой кислоты, который получали, следуя процедуре, описанной для промежуточного соединения K, из трет-бутилового эфира транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение G) и циклобутанона.
Промежуточное соединение АВ
транс-4-(3-Амино-тетрагидро-пиран-4-иламино)-циклогексанола дигидрохлорид
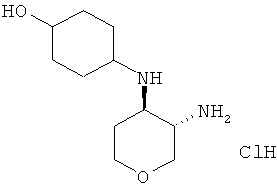
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=215,4 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-[4-(4-гидрокси-циклогексиламино)-тетрагидро-пиран-3-ил]-карбаминовой кислоты, который получали, следуя процедуре, описанной для промежуточного соединения K, из трет-бутилового эфира транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение G) и 4-гидроксициклогексанона.
Промежуточное соединение АС
транс-4-(3-Аза-бицикло[3.1.0]гекс-3-ил)-тетрагидро-пиран-3-иламина дигидрохлорид
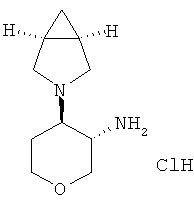
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=183,2 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-[4-(3-аза-бицикло[3.1.0]гекс-3-ил)-тетрагидро-пиран-3-ил]-карбаминовой кислоты, который получали, следуя процедуре, описанной для промежуточного соединения W, из трет-бутилового эфира 3-окса-7-аза-бицикло[4.1.0]гептан-7-карбоновой кислоты (промежуточное соединение Е) и 3-аза-бицикло[3.1.0]гексана гидрохлорида (CAS: 73799-64-1).
Промежуточное соединение AD
2,6-Диметил-4-трифторметил-бензойная кислота
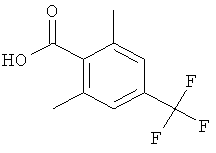
Стадия 1. Получение 2,6-диметокси-4-трифторметил-бензойной кислоты
К раствору гидроксида натрия (5,66 г, 141,4 ммоль) в 33 мл воды и 33 мл этанола при комнатной температуре в атмосфере азота добавляли 2,6-диметокси-4-трифторметил-бензонитрил (CAS: 51271-36-4) (3,27 г, 14,14 ммоль). Реакционную смесь нагревали на 90°С масляной бане в течение 37 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли 130 мл воды. Продукт собирали путем фильтрации и сушили, что давало 3,05 г твердого вещества белого оттенка. К раствору нитрозилсерной кислоты (15,6 г, 110,2 ммоль) в 9,5 мл воды при 0°С в атмосфере азота добавляли по каплям суспензию ранее полученного вещества в 19 мл дихлорметана. Реакционную смесь перемешивали при 0°С в течение 4,5 часов. Реакционную смесь выливали в лед и экстрагировали дихлорметаном. Объединенные органические слои высушивали над Na2SO4, фильтровали и сушили, что давало 1,51 г продукта. Водную фазу фильтровали и белое твердое вещество сушили, что давало 1,36 г продукта. Обе порции смешивали, что давало 2,87 г (93,7%) указанного в заголовке соединения в виде белого твердого вещества. MS (m/e): 249,1 (М-Н).
Стадия 2. Получение 2,6-диметокси-4-трифторметил-бензоилхлорида
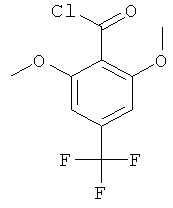
К суспензии 14,47 г (57,84 ммоль) 2,6-диметокси-4-трифторметил-бензойной кислоты в 160 мл толуола, содержащей четыре капли ДМФА, в атмосфере азота при комнатной температуре добавляли 42 мл (578,4 ммоль) тионилхлорида. Смесь нагревали на 85°С масляной бане в течение 3 часов. Растворитель удаляли в вакууме, что давало 15,37 г (выход: 98,9%) указанного в заголовке соединения в виде твердого вещества белого оттенка.
Стадия 3. Получение N-(2-гидрокси-1,1-диметил-этил)-2,6-диметокси-4-трифторметил-бензамида
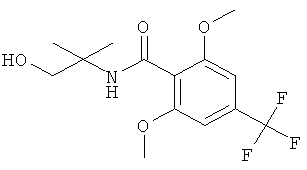
К раствору 3,7 мл (37,22 ммоль) 2-амино-2-метил-1-пропанола в 42 мл дихлорметана в атмосфере азота при 0°С добавляли по каплям раствор 5 г (18,61 ммоль) 2,6-диметокси-4-трифторметил-бензоилхлорида в 12 мл дихлорметана. Температуру повышали до 7°С. Смесь перемешивали при комнатной температуре в течение 4 часов. Смесь выливали в 75 мл воды. Органический слой отделяли, и водный слой экстрагировали дважды дихлорметаном. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, что давало 5,66 г (выход: 94,6%) указанного в заголовке соединения в виде желтого твердого вещества. MS (m/e): 322,2 (M+H+).
Стадия 4. Получение 2-(2,6-диметокси-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола
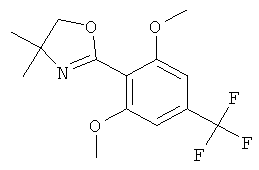
Раствор 5,66 г (17,62 ммоль) N-(2-гидрокси-1,1-диметил-этил)-2,6-диметокси-4-трифторметил-бензамида в 60 мл дихлорметана охлаждали до 10°С. По каплям добавляли 3,8 мл (52,85 ммоль) тионилхлорида. Температуру повышали до 15°С. Смесь перемешивали при комнатной температуре в течение 1 часа. Раствор добавляли по каплям к 130 мл охлажденного 2 М раствора карбоната натрия. Эмульсию разбавляли водой и фильтровали, чтобы удалить белое твердое вещество. Органический слой отделяли, и водный слой экстрагировали дважды дихлорметаном. Объединенные экстракты высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное светло-желтое твердое вещество (5,27 г) очищали с помощью флэш-хроматографии на диоксиде кремния (70 г), элюируя градиентом, образованным н-гептаном и этилацетотом (0 до 50%), что давало 4,8 г (выход: 89,8%) указанного в заголовке соединения в виде белого твердого вещества. MS (m/e): 304,2 (М+Н+).
Стадия 5. Получение 2-(2,6-диметил-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола (соединение А)
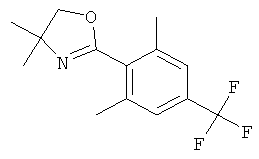
и 2-(2-метокси-6-метил-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола (соединение В)
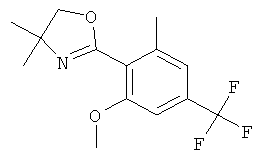
К 0°С раствору 1,5 г (4,946 ммоль) 2-(2,6-диметокси-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола в 9 мл тетрагидрофурана через молекулярное сито добавляли по каплям 9,89 мл (29,68 ммоль) 3 М раствора метилмагнийбромида в диэтиловом эфире, поддерживая температуру ниже 5°С. Смесь нагревали до комнатной температуры и затем нагревали на 70°С масляной бане в течение 24 часов. Смесь охлаждали на ледяной бане и гасили 60 мл насыщенного раствора аммония. Добавляли этилацетат. Органический слой отделяли, и водный слой экстрагировали один раз этилацетатом. Объединенные экстракты высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное оранжевое масло (1,38 г) очищали с помощью флэш колоночной хроматографии на диоксиде кремния, элюируя градиентом, полученным из н-гептана и этилацетата (0 до 35%), что давало 419 мг (выход: 31,2%) 2-(2,6-диметил-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола (соединение А) в виде белого твердого вещества, MS (m/e): 272,2 (M+H+), и 532 мг (выход: 37,4%) 2-(2-метокси-6-метил-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола (соединение В) в виде бесцветного масла. MS (m/e): 288,1 (M+H+).
Стадия 6. Получение 2-метил-2-нитро-пропилового эфира 2,6-диметил-4-трифторметил-бензойной кислоты

К раствору 415 мг (1,530 ммоль) 2-(2,6-диметил-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола в 17 мл ацетонитрила добавляли 15,3 мл (0,0061 ммоль) 0,4 мМ водного раствора Na2-ЭДТА при комнатной температуре. Сразу добавляли 1,4 мл (15,30 ммоль) 1,1,1-трифторацетона с помощью предварительно охлажденного шприца. Смесь 3,86 г (45,90 ммоль) гидрокарбоната натрия и 9,41 г (15,30 ммоль) оксона добавляли частями в течение 15 минут. Смесь перемешивали в течение 30 минут. Реакционную смесь разбавляли 90 мл воды. Водный слой экстрагировали 3 раза дихлорметаном. Объединенные экстракты высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, что давало 477 мг (выход: 97,7%) указанного в заголовке соединения в виде бесцветного масла.
Стадия 7. Получение 2,6-диметил-4-трифторметил-бензойной кислоты К раствору 475 мг (1,488 ммоль) 2-метил-2-нитро-пропилового эфира 2,6-диметил-4-трифторметил-бензойной кислоты в 4,7 мл диоксана добавляли 3 мл (14,88 ммоль) 5 М водного раствора NaOH. Смесь нагревали на 100°С масляной бане в течение 24 часов. Диоксан удаляли в вакууме. Остаток разбавляли водой и экстрагировали дважды этилацетатом. Водный слой подкисляли 5 н. HCl и экстрагировали 3 раза дихлорметаном. Объединенные дихлорметановые экстракты высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, что давало 301 мг (выход: 92,7%) указанного в заголовке соединения в виде светло-желтого твердого вещества. MS (m/e): 217,1 (М-Н).
Промежуточное соединение АЕ
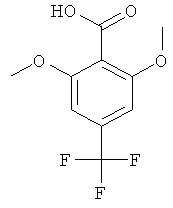
2-Метокси-6-метил-4-трифторметил-бензойная кислота
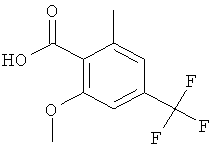
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=232,9 (М-Н), получали согласно процедуре, описанной для промежуточного соединения AD из 2-(2-метокси-6-метил-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола (промежуточное соединение AD, стадия 5, соединение В).
Промежуточное соединение AF
2,6-Диэтил-4-трифторметил-бензойная кислота
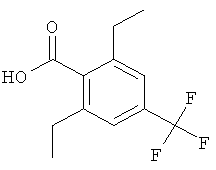
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=245,1 (М-Н), получали согласно процедуре, описанной для промежуточного соединения AD из 2-(2,6-диметокси-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола, используя этилмагнийбромид в качестве реактива Гриньяра.
Промежуточное соединение AG
2-Этил-6-метокси-4-трифторметил-бензойная кислота
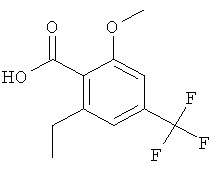
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=247,0 (М-Н), получали согласно процедуре, описанной для промежуточного соединения AD из 2-(2,6-диметокси-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола, используя этилмагнийбромид в качестве реактива Гриньяра.
Промежуточное соединение АН 2-Этил-6-метил-4-трифторметил-бензойная кислота
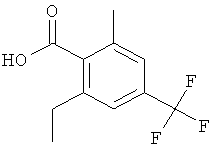
Стадия 1: 2-(2-Этил-6-метил-4-триФторметил-фенил)-4.4-диметил-4.5-дигидро-оксазол
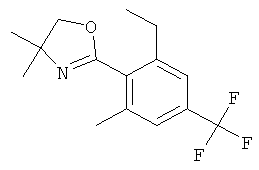
К 0°С раствору 100 мг (0,332 ммоль) 2-(2-этил-6-метокси-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола (полученного в ходе реакции 2-(2,6-диметокси-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола с этилмагнийбромидом) в 0,6 мл тетрагидрофурана добавляли по каплям 0,332 мл (0,996 ммоль) 3 М раствора метилмагнийбромида в диэтиловом эфире, поддерживая температуру ниже 5°С. Смесь нагревали до комнатной температуры и перемешивали в течение 3,5 часов, и затем нагревали на 70°С масляной бане в течение 4 дней. Смесь охлаждали на ледяной бане и гасили, по каплям добавляя 3 мл насыщенного раствора хлорида аммония. Добавляли этилацетат. Органический слой отделяли, и водный слой экстрагировали три раза этилцетатом. Объединенные экстракты высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное оранжевое масло (286 мг) очищали с помощью флэш колоночной хроматографии на диоксиде кремния, элюируя градиентом, полученным из н-гептана и этилацетата (0 до 10%), что давало 50 мг (выход: 50,4%) указанного в заголовке соединения в виде светло-желтого масла. MS (m/e): 286,2 (М+Н+).
Стадия 2: 2-Этил-6-метил-4-трифторметил-бензойная кислота
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=245,1 (М-Н), получали согласно процедуре, описанной для промежуточного соединения AD (стадия 6-7) из 2-(2-этил-6-метил-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола.
Промежуточное соединение AI
2-Циклопропил-6-метокси-4-трифторметил-бензойная кислота
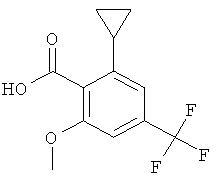
Указанное в заголовке соединение, твердое вещество белого оттенка, MS: m/e=258,9 (М-Н), получали согласно процедуре, описанной для промежуточного соединения AD из 2-(2,6-диметокси-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола, используя циклопропилмагнийбромид в качестве реактива Гриньяра.
Промежуточное соединение AJ
транс-4-(2-Аза-бицикло[3.1.0]гекс-2-ил)-тетрагидро-пиран-3-иламина гидрохлорид-диастереоизомер 1
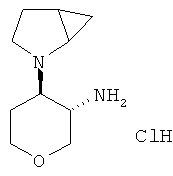
Указанное в заголовке соединение, желтое твердое вещество, MS: m/e=183,2 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-[4-(2-аза-бицикло[3.1.0]гекс-2-ил)-тетрагидро-пиран-3-ил]-карбаминовой кислоты (диастереоизомер 1), который получали, следуя процедуре, описанной для промежуточного соединения W, из трет-бутилового эфира 3-окса-7-аза-бицикло[4.1.0]гептан-7-карбоновой кислоты (промежуточное соединение Е) и 2-аза-бицикло[3.1.0]гексана гидрохлорида (CAS: 841302-37-2).
Промежуточное соединение AK
транс-4-(2-Аза-бицикло[3.1.0]гекс-2-ил)-тетрагидро-пиран-3-иламина гидрохлорид-диастереоизомер 2

Указанное в заголовке соединение, желтое твердое вещество, MS: m/e -183,2 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-[4-(2-аза-бицикло[3.1.0]гекс-2-ил)-тетрагидро-пиран-3-ил]-карбаминовой кислоты (диастереоизомер 2), который получали, следуя процедуре, описанной для промежуточного соединения W, из трет-бутилового эфира 3-окса-7-аза-бицикло[4.1.0]гептан-7-карбоновой кислоты (промежуточное соединение Е) и 2-аза-бицикло[3.1.0]гексана гидрохлорида (CAS: 841302-37-2).
Промежуточное соединение AL
транс-1-(3-Амино-тетрагидро-пиран-4-ил)-пирролидин-3-ола дигидрохлорид-диастереоизомер 1
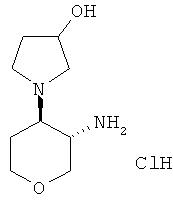
Указанное в заголовке соединение, светло-коричневое твердое вещество, MS: m/e=187,3 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-[4-(3-гидрокси-пирролидин-1-ил)-тетрагидро-пиран-3-ил]-карбаминовой кислоты, диастереоизомер 1, который получали, следуя процедуре, описанной для промежуточного соединения Н, из трет-бутилового эфира транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение G) и 1,4-дибром-2-бутанола.
Промежуточное соединение AM
транс-1-(3-Амино-тетрагидро-пиран-4-ил)-пирролидин-3-ола дигидрохлорид-диастереоизомер 2

Указанное в заголовке соединение, светло-коричневое твердое вещество, MS: m/e=187,3 [(М+Н)+], получали согласно общему способу получения промежуточного соединения L из трет-бутилового эфира транс-[4-(3-гидрокси-пирролидин-1-ил)-тетрагидро-пиран-3-ил]-карбаминовой кислоты, диастереоизомер 2, который получали, следуя процедуре, описанной для промежуточного соединения Н, из трет-бутилового эфира транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение G) и 1,4-дибром-2-бутанола.
Промежуточное соединение AN
трет-Бутиловый эфир (4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (смесь диастереоизомеров)
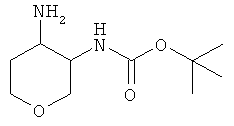
трет-Бутиловый эфир (4-оксо-тетрагидро-пиран-3-ил)-карбаминовой кислоты (CAS 477584-38-6, 446 мг, 2,07 ммоль) растворяли в 20 мл метанола. Добавляли ацетат аммония (1,63 г, 21 ммоль) и цианоборгидрид натрия (507 мг, 8,1 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 дней. Добавляли этилацетат и 2 н. раствор карбоната натрия. Органический слой отделяли, и водный слой экстрагировали три раза этилацетатом. Объединенные экстракты высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью флэш колоночной хроматографии на диоксиде кремния, элюируя градиентом (дихлорметан/метанол/аммиак 100:0:0→140:10:1), что давало 199 мг (44%) указанного в заголовке соединения в виде белого твердого вещества. MS (m/e): 161,2 (М-бутен)+.
Промежуточное соединение AO
трет-Бутиловый эфир [4-(2-метокси-6-метилсульфанил-4-трифторметил-бензоиламино)-тетрагидро-пиран-3-ил]-карбаминовой кислоты (смесь диастереоизомеров)
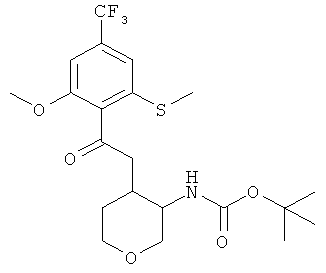
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=465,3 [(М+Н)+], получали согласно общему способу примера 8 из трет-бутилового эфира (4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (смесь диастереоизомеров, промежуточное соединение AM) и 2-метокси-6-метилсульфанил-4-трифторметил-бензойной кислоты (промежуточное соединение А).
Промежуточное соединение АР
N-(3-Амино-тетрагидро-пиран-4-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамида гидрохлорид (смесь диастереоизомеров)
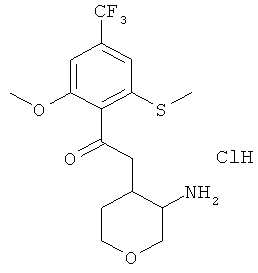
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=365,1 [(М+Н)+], получали согласно общему способу получения промежуточного соединения I из трет-бутилового эфира [4-(2-метокси-6-метилсульфанил-4-трифторметил-бензоиламино)-тетрагидро-пиран-3-ил]-карбаминовой кислоты (смесь диастереоизомеров, промежуточное соединение АО).
Синтез примеров Примеры 1 и 2
2-Метокси-6-метилсульфанил-N-((3RS,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид и 2-метокси-6-метилсульфанил-N-((3RS,4SR)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид
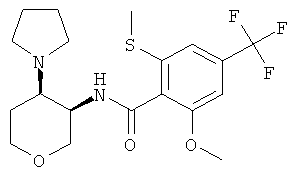 и
и 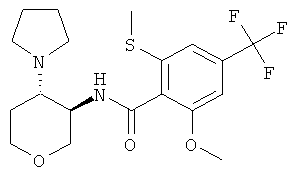
2-Метокси-6-метилсульфанил-N-(4-оксо-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид (промежуточное соединение С, 300 мг, 0,83 ммоль) растворяли в 5 мл тетрагидрофурана. Добавляли уксусную кислоту (86 мг, 1,4 ммоль) и пирролидин (70 мг, 0,99 ммоль) и реакционную смесь перемешивали 1 час при комнатной температуре. Добавляли триацетоксиборгидрид натрия (209 мг, 0,99 ммоль) и продолжали перемешивать при комнатной температуре в течение ночи. Смесь экстрагировали 2 н. раствором карбоната натрия и этилацетатом. Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и выпаривали. Очистка остатка с помощью флэш-хроматографии на силикагеле (дихлорметан/метанол/аммиак 100:0:0→140:10:1) давала цис-2-метокси-6-метилсульфанил-N-((3RS,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид в виде светло-коричневого твердого вещества (80 мг, 40%), MS: m/e=419,1 [(М+Н)+], и транс-2-метокси-6-метилсульфанил-N-((3RS,4SR)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид в виде светло-коричневого твердого вещества (25 мг, 12%), MS: m/e=419,1 [(M+H)+].
Примеры 3 и 4
N-((3RS,4RS)-4-Циклобутиламино-тетрагидро-пиран-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид и N-((3RS,4SR)-4-циклобутиламино-тетрагидро-пиран-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид
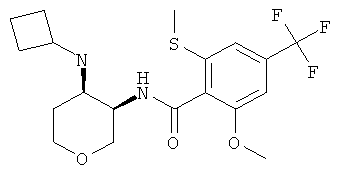 и
и 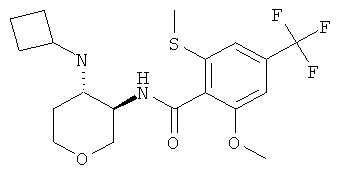
цис-N-((3RS,4RS)-4-Циклобутиламино-тетрагидро-пиран-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид, светло-коричневое твердое вещество, MS: m/e=419,2 [(М+Н)+], и транс-N-((3RS,4SR)-4-циклобутиламино-тетрагидро-пиран-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид, светло-коричневое твердое вещество, MS: m/e=419,2 [(М+Н)+], получали согласно общему способу примера 1 и 2 из 2-метокси-6-метилсульфанил-N-(4-оксо-тетрагидро-пиран-3-ил)-4-трифторметил-бензамида (промежуточное соединение С) и циклобутиламина.
Пример 5 и 6
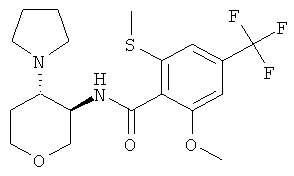
(+)-2-Метокси-6-метилсульфанил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид и (-)-2-метокси-6-метилсульфанил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид
 и
и 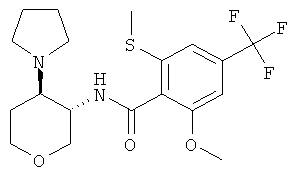
2-Метокси-6-метилсульфанил-N-((3RS,4SR)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид (пример 2) разделяли на Chiralpak AD с 15% этанолом в гептане. Первый элюируемый энантиомер представлял собой (+)-2-метокси-6-метилсульфанил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид, второй энантиомер представлял собой (-)-2-метокси-6-метилсульфанил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид. Абсолютную стереохимию не определяли.
Пример 7
N-[(3RS,4SR)-4-(3-Гидрокси-пирролидин-1-ил)-тетрагидро-пиран-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид
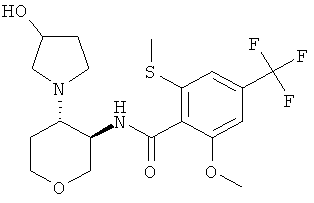
N-[(3RS,4SR)-4-(3-Гидрокси-пирролидин-1-ил)-тетрагидро-пиран-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид, желтое твердое вещество, MS: m/e=435,3 [(М+Н)+], получали согласно общему способу примера 1 и 2 из 2-метокси-6-метилсульфанил-N-(4-оксо-тетрагидро-пиран-3-ил)-4-трифторметил-бензамида (промежуточное соединение С) и рац-3-пирролидинола.
Пример 8
2-Циклопропил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид
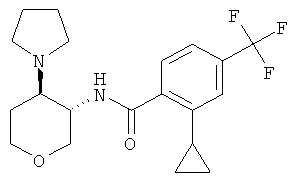
2-Циклопропил-4-трифторметил-бензойную кислоту (промежуточное соединение J, 118 мг, 0,513 ммоль) растворяли в 2,5 мл диметилформамида. Добавляли N,N-диизопропилэтиламин (338 мг, 2,62 ммоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (195 мг, 0,513 ммоль). Через 10 минут перемешивания при комнатной температуре добавляли транс-4-пирролидин-1-ил-тетрагидро-пиран-3-иламина дигидрохлорид (промежуточное соединение I, 187 мг, 0,769 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали. Остаток переносили в 2 н. раствор карбоната натрия и этилацетата и экстрагировали три раза этилацетатом. Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и выпаривали. Очистка остатка с помощью флэш-хроматографии на силикагеле (гептан/этилацетат/триэтиламин 1:0:0→10:10:1) давала указанное в заголовке соединение в виде белого твердого вещества (121 мг, 62%), MS: m/e=383,3 [(M+H)+].
Следующие примеры получали согласно способу примера 8:
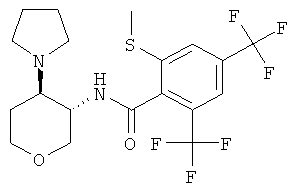
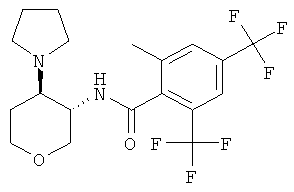
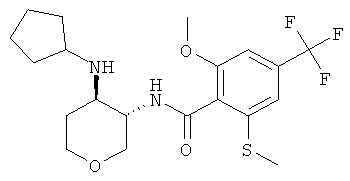
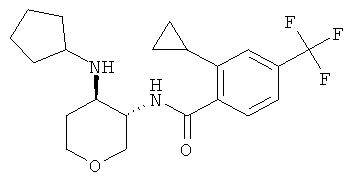
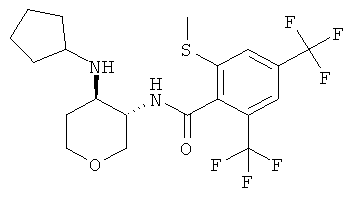
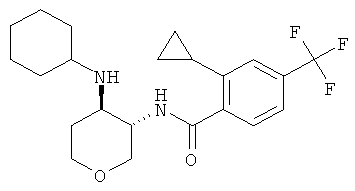
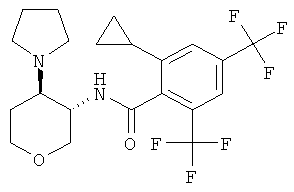
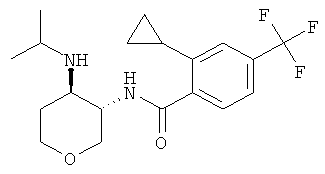
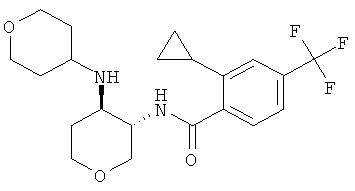

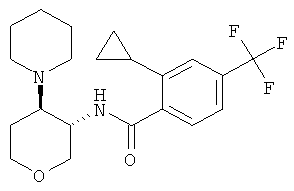

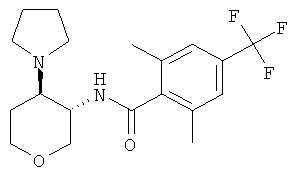
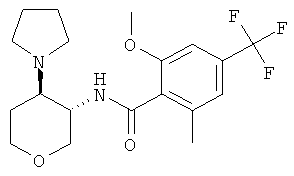

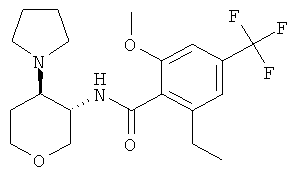
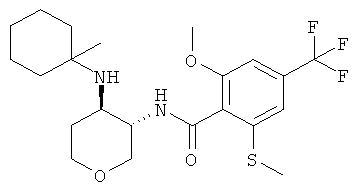
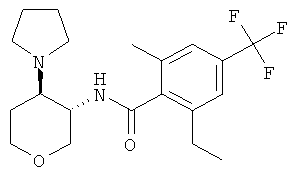
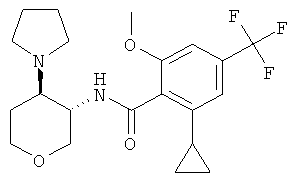
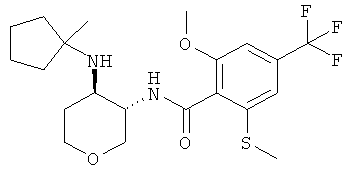
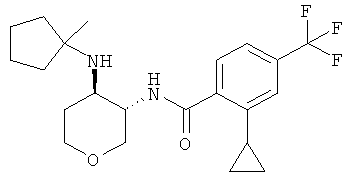
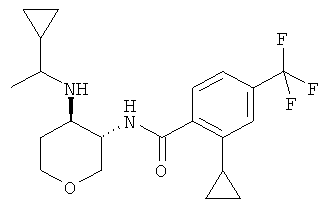
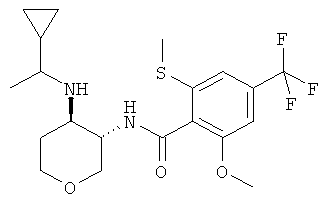

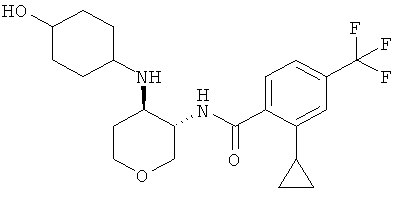
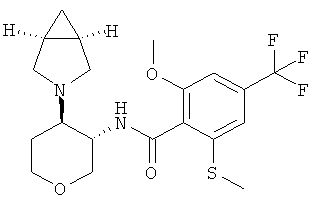
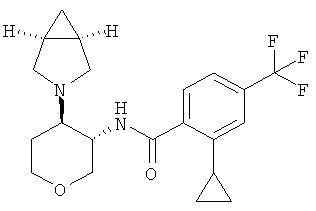
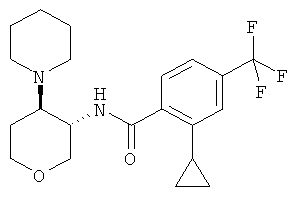
Пример 36
2-Циклопропил-N-(3SR,4RS)-4-(4-гидрокси-пиперидин-1-ил)-тетрагидро-пиран-3-ил]-4-трифторметил-бензамид
Стадия 1: Получение трет-бутилового эфира (3SR.4RS)-4-(4-oxo-пиперидин-1-ил)-тетрагидро-пиран-3-ил1-карбаминовой кислоты
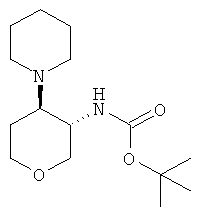
К раствору 100 мг (0,462 ммоль) трет-бутилового эфира транс-(4-амино-тетрагидро-пиран-3-ил)-карбаминовой кислоты (промежуточное соединение G) в 3 мл этанола добавляли 51 мг (0,37 ммоль) карбоната калия. Смесь нагревали с обратным холодильником на 90°С масляной бане. Раствор 187 мг (0,693 ммоль) 1-этил-1-метил-4-оксо-пиперидиния иодида в 1 мл воды добавляли по каплям в течение 30 минут. Смесь нагревали с обратным холодильником в течение 45 минут, охлаждали до комнатной температуры и разбавляли водой. Водный слой экстрагировали 3 раза дихлорметаном. Объединенные экстракты высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали с помощью флэш колоночной хроматографии на диоксиде кремния, элюируя градиентом, образованным н-гептаном и этилацетатом (0 до 50%), что давало 100 мг (выход: 73%) указанного в заголовке соединения в виде белого твердого вещества. MS (m/e): 299,5 (M+H+).
Стадия 2: Получение 1-((3SR,4RS)-3-амино-тетрагидро-пиран-4-ил)-пиперидин-4-она гидрохлорида
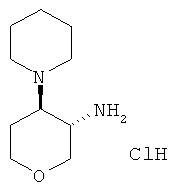
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=199,3 [(М+Н)+], получали, следуя процедуре, описанной для промежуточного соединения L, из трет-бутилового эфира (3SR,4RS)-4-(4-оксо-пиперидин-1-ил)-тетрагидро-пиран-3-ил]-карбаминовой кислоты.
Стадия 3: Получение 2-циклопропил-N-[(3RS,4SR)-4-(4-оксо-пиперидин-1-ил)-тетрагидро-пиран-3-ил1-4-трифторметил-бензамида
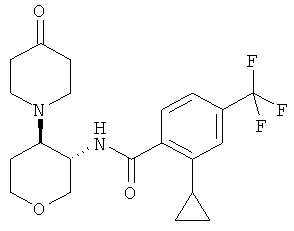
Указанное в заголовке соединение, неяркое твердое вещество, MS: m/e=411,3 [(М+Н)+], получали согласно общему способу примера 8 из 1-((3SR,4RS)-3-амино-тетрагидро-пиран-4-ил)-пиперидин-4-она гидрохлорида и 2-циклопропил-4-трифторметил-бензойной кислоты (промежуточное соединение J).
Стадия 4: Получение 2-циклопропил-N-[(3SR,4RS)-4-(4-гидрокси-пиперидин-1-ил)-тетрагидро-пиран-3-ил]-4-трифторметил-бензамида
К 10-20°С перемешиваемому раствору 2-циклопропил-N-[(3RS,4SR)-4-(4-оксо-пиперидин-1-ил)-тетрагидро-пиран-3-ил]-4-трифторметил-бензамида (73 мг) в этаноле (1,8 мл) добавляли боргидрид натрия (13,5 мг) и раствор перемешивали в течение 30 минут. Реакционную смесь нагревали до комнатной температуры, перемешивали в течение еще 3 часов и концентрировали в вакууме. Полученный в результате остаток разделяли между водой и дихлорметаном. Водную фазу промывали три раза дихлорметаном, и объединенные органические фазы промывали солевым раствором, высушивали над сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали с помощью флэш колоночной хроматографии на диоксиде кремния, элюируя градиентом, полученным из н-гептана и этилацетата (0 до 100%), что давало 44 мг (выход: 60%) указанного в заголовке соединения в виде белого твердого вещества. MS (m/e): 413,3 (M+H+).
Следующие примеры получали в ходе разделения с помощью хиральной ВЭЖХ:
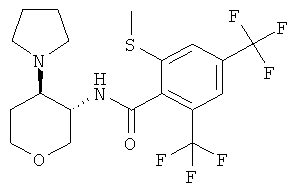
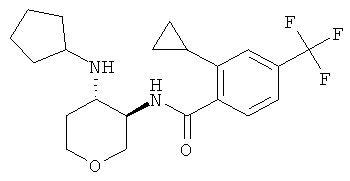
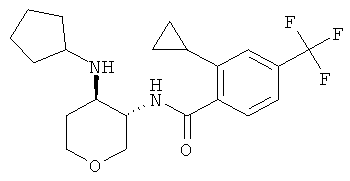
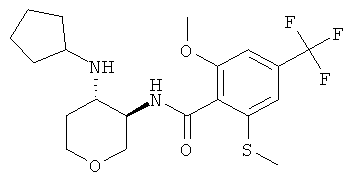
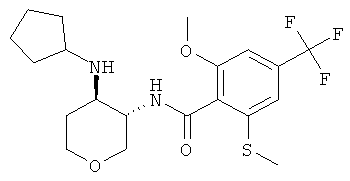
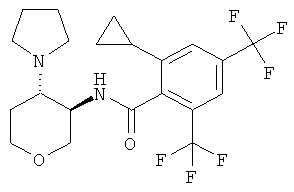

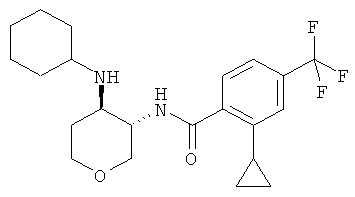
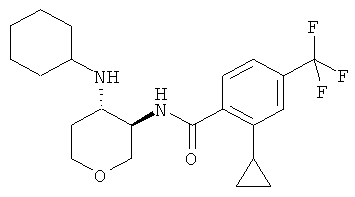
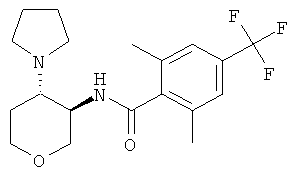
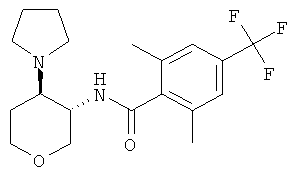
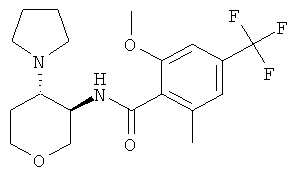
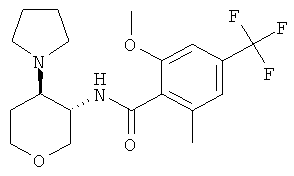

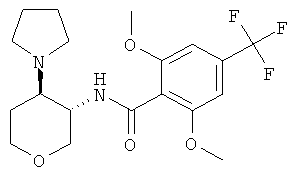
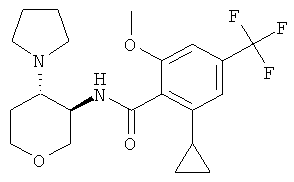
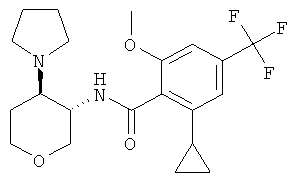

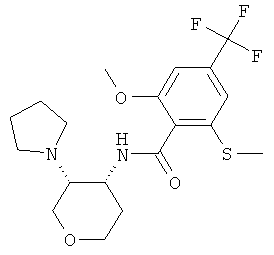
бензамид
Пример 59
N-[(3SR,4RS)-4-(2-Аза-бицикло[3.1.0]гекс-2-ил)-тетрагидро-пиран-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид
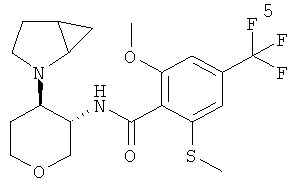
Указанное в заголовке соединение, желтое твердое вещество, MS: m/e=431,2 [(М+Н)+], получали согласно общему способу примера 8 из транс-4-(2-аза-бицикло[3.1.0]гекс-2-ил)-тетрагидро-пиран-3-иламина гидрохлорида диастереоизомер 1 (промежуточное соединение AJ) и 2-метокси-6-метилсульфанил-4-трифторметил-бензойной кислоты (промежуточное соединение А).
Пример 60
N-[(3SR,4RS)-4-(2-Аза-бицикло[3.1.0]гекс-2-ил)-тетрагидро-пиран-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид
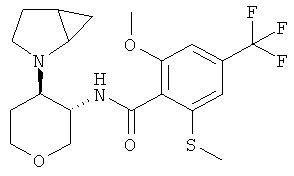
Указанное в заголовке соединение, желтое твердое вещество, MS: m/e=431,2 [(М+Н)+], получали согласно общему способу примера 8 из транс-4-(2-аза-бицикло[3.1 -0]гекс-2-ил)-тетрагидро-пиран-3-иламина гидрохлорида диастереоизомер 2 (промежуточное соединение АК) и 2-метокси-6-метилсульфанил-4-трифторметил-бензойной кислоты (промежуточное соединение А).
Пример 61
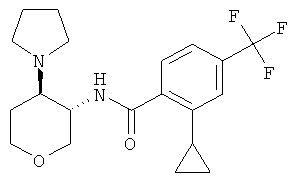
2-Циклопропил-N-[(3RS,4SR)-4-(3-гидрокси-пирролидин-1-ил)-тетрагидро-пиран-3-ил]-4-трифторметил-бензамид
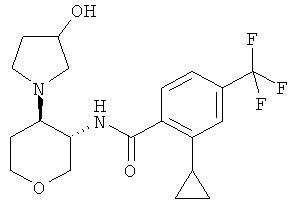
Указанное в заголовке соединение, желтое твердое вещество, MS: m/e=399,2 [(М+Н)+], получали согласно общему способу примера 8 из транс-1-(3-амино-тетрагидро-пиран-4-ил)-пирролидин-3-ола дигидрохлорида - диастереоизомер 1 (промежуточное соединение AL) и 2-циклопропил-4-трифторметил-бензойной кислоты (промежуточное соединение J).
Пример 62
2-Циклопропил-N-[(3RS,4SR)-4-(3-гидрокси-пирролидин-1-ил)-тетрагидро-пиран-3-ил]-4-трифторметил-бензамид

Указанное в заголовке соединение, желтое твердое вещество, MS: m/e=399,2 [(М+Н)+], получали согласно общему способу примера 8 из транс-1-(3-амино-тетрагидро-пиран-4-ил)-пирролидин-3-ола дигидрохлорида - диастереоизомер 2 (промежуточное соединение AM) и 2-циклопропил-4-трифторметил-бензойной кислоты (промежуточное соединение J).
Пример 63
цис-2-Метокси-6-метилсульфанил-N-(3-пирролидин-1-ил-тетрагидро-пиран-4-ил)-4-трифторметил-бензамид
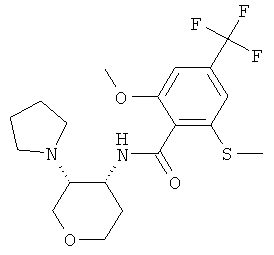
Указанное в заголовке соединение, коричневое твердое вещество, MS: m/e=419,3 [(М+Н)+], получали согласно общему способу получения промежуточного соединения Н из N-(3-амино-тетрагидро-пиран-4-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамида гидрохлорида (промежуточное соединение АР) и 1,4-дибромпропана. Два диастереомера разделяли с помощью колоночной хроматографии.
Соединения формулы I и их фармацевтически приемлемые соли присоединения обладают ценными фармакологическими свойствами. А именно, было установлено, что соединения по настоящему изобретению являются хорошими ингибиторами глицинового переносчика I (GlyT-1).
Соединения были исследованы в соответствии с тестом, приведенным ниже.
Растворы и вещества
Полная среда DMEM: питательная смесь F-12 (Gibco Life-technologies), эмбриональная бычья сыворотка (FBS) 5%, (Gibco life technologies), пенициллин/стрептомицин 1% (Gibco life technologies), гигромицин 0,6 мг/мл (Gibco life technologies), глутамин 1 мМ (Gibco life technologies).
Буфер для захвата (UB): 150 мМ NaCl, 10 мМ Hepes-Tris, pH 7,4, 1 мМ CaCl2, 2,5 мМ KCI, 2,5 мМ MgSO4, 10 мМ (+) D-глюкоза.
Клетки Flp-in™-CHO (Invitrogen Cat №R758-07), стабильно трансфицированные mGlyT1b кДНК.
Анализ ингибирования захвата глицина (mG1yT-1b)
В первый день клетки млекопитающих (Flp-in™-CHO), трансфицированные mGlyT-1b кДНК, засевали с плотностью 40000 клеток/лунка в полную среду F-12 без гигромицина в 96-луночные культуральные планшеты. Во второй день среду отсасывали, и клетки дважды промывали буфером для захвата (UB). Затем клетки инкубировали в течение 20 минут при 22°С либо без потенциального конкурирующего соединения (1), либо с 10 мМ нерадиоактивным глицином (2), либо с потенциальным ингибитором в какой-либо концентрации (3). Для того чтобы получить данные для вычисления концентрации ингибитора, приводящей к 50%-ному ингибированию (например ИК50, концентрации конкурирующего соединения, обеспечивающей 50%-ное ингибирование захвата глицина), использовали диапазон концентраций потенциального ингибитора. Сразу после этого добавляли раствор, содержащий 60 нМ [3H]-глицин (11-16 Ки/ммоль) и 25 мкМ нерадиоактивный глицин. Планшеты инкубировали при мягком покачивании, и реакцию останавливали путем отсасывания смеси и промывания (три раза) охлажденным до 0°С UB. Клетки лизировали сцинтилляционной жидкостью, покачивали в течение 3 часов, и радиоактивность клеток подсчитывали с использованием сцинтилляционного счетчика.
Соединения, описанные в примерах 1-60, имеют значения ИК50<1,0 мкМ. Предпочтительные значения ИК50 (<0,2 мкМ) для соединений 1-128 представлены в таблице 1.
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I можно применять в качестве лекарств, например, в форме фармацевтических препаратов. Данные фармацевтические препараты могут быть введены перорально, например, в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако также может быть сделано ректальное введение, например, в форме суппозиториев, или парентеральное введение, например в форме растворов для инъекций.
Для изготовления фармацевтических препаратов соединения формулы I могут быть использованы вместе с фармацевтически инертными неорганическими или органическими носителями. Например, в качестве таких носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул может быть использована лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и тому подобное. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и тому подобное. Однако в зависимости от природы активного вещества в случае мягких желатиновых капсул носители обычно не требуются. Подходящими носителями для изготовления растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и тому подобное. Подходящими носителями для суппозиториев являются, например, натуральные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и тому подобное.
Более того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизирующие агенты, увлажняющие агенты, эмульгаторы, подсластители, красящие вещества, корригенты, соли для регулирования осмотического давления, буферные агенты, маскирующие агенты или антиоксиданты. Они также могут содержать еще и другие терапевтически полезные вещества.
Лекарства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются предметом настоящего изобретения, как и способ их изготовления, который включает доведение одного или более чем одного соединения формулы I и/или фармацевтически приемлемых солей присоединения кислот и, при желании, одного или более чем одного другого терапевтически полезного вещества до формы галенова препарата вместе с одним или более чем одним терапевтически инертным носителем.
Наиболее предпочтительными показаниями согласно настоящему изобретению являются те, которые включают расстройства центральной нервной системы, например лечение или предотвращение шизофрении, когнитивного нарушения и болезни Альцгеймера.
Конечно, дозировку можно варьировать в широких пределах, и обычно в каждом конкретном случае она должна быть подобрана в соответствии с индивидуальными потребностями. В случае перорального введения доза для взрослых может меняться от приблизительно 0,01 мг до приблизительно 1000 мг в сутки соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Суточная доза может быть введена в виде однократной дозы или в виде дробных доз, и, кроме того, также может быть превышен верхний предел, когда для этого имеются показания.

Методика изготовления
1. Смешивают вещества 1, 2, 3 и 4 и гранулируют с очищенной водой.
2. Сушат гранулы при 50°С.
3. Пропускают гранулы через подходящее помольное оборудование.
4. Добавляют вещество 5 и перемешивают в течение трех минут; прессуют на подходящем прессе.

Методика изготовления
1. Смешивают вещества 1, 2 и 3 в подходящем смесителе в течение 30 минут.
2. Добавляют вещества 4 и 5 и смешивают в течение 3 минут.
3. Заполняют подходящую капсулу.
| название | год | авторы | номер документа |
|---|---|---|---|
| АРОИЛАМИНО- И ГЕТЕРОАРОИЛАМИНО-ЗАМЕЩЕННЫЕ ПИПЕРИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ GLYT-1 | 2010 |
|
RU2517701C2 |
| ПРОИЗВОДНЫЕ (3-МЕТИЛПИРРОЛИДИН-3-ИЛ)-МЕТИЛ ПИРИДИНИЛОВОГО ЭФИРА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА NK-3 | 2011 |
|
RU2625798C2 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ТИОФЕНИЛАМИДА | 2013 |
|
RU2644565C2 |
| ПОЗИТИВНЫЕ АЛЛОСТЕРИЧЕСКИЕ МОДУЛЯТОРЫ (РАМ) | 2010 |
|
RU2561920C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛИДИНА В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА NK-3 | 2010 |
|
RU2561271C2 |
| ЗАМЕЩЕННЫЕ БЕНЗАМИДНЫЕ ПРОИЗВОДНЫЕ | 2010 |
|
RU2595902C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛИДИНА | 2010 |
|
RU2562605C2 |
| АМИДЫ КОНДЕНСИРОВАННОГО ПИПЕРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2014 |
|
RU2741810C2 |
| З-АМИНОПИРИДИНЫ В КАЧЕСТВЕ АГОНИСТОВ GPBAR1 | 2012 |
|
RU2594886C2 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ДВОЙНЫХ ИНГИБИТОРОВ АУТОТАКСИНА (ATX)/КАРБОАНГИДРАЗЫ (CA) | 2016 |
|
RU2725138C2 |
Изобретение относится к соединению общей формулы I, где R1/R2 независимо друг от друга представляют собой водород, (CR2)о-C3-7 циклоалкил, возможно замещенный низшим алкилом или гидрокси, или представляют собой низший алкил или тетрагидропиранил, и о представляет собой 0 или 1; и R могут быть одинаковыми или различаться и представляют собой водород или низший алкил; или R1 и R2 могут образовывать вместе с атомом N, к которому они присоединены, гетероциклоалкильную группу, выбранную из группы, состоящей из пирролидинила, пиперидинила, 3-аза-бицикло[3.1.0]гекс-3-ила или 2-аза-бицикло[3.1.0]гекс-2-ила, которые возможно замещены гидрокси; R3 представляет собой S-низший алкил, низший алкил, низший алкокси или С3-7 циклоалкил; R3′ представляет собой водород, низший алкил, замещенный галогеном, низший алкил или низший алкокси; R4 представляет собой низший алкил, замещенный галогеном; X представляет собой -О- или -СН2-; X′ представляет собой -О- или -СН2-; при условии, что один из X или X′ всегда представляет собой -О- и другой представляет собой -СН2-; или фармацевтически приемлемая кислотно-аддитивная соль, рацемическая смесь, или соответствующий энантиомер и/или оптический изомер. Cоединения общей формулы (I) являются хорошими ингибиторами глицинового переносчика 1 (GlyT-1) и, следовательно, могут быть использованы для лечения шизофрении, психоза и других неврологических состояний, включая боль. 4 н. и 9 з.п. ф-лы, 1 табл., 63 пр.

1. Соединение общей формулы I
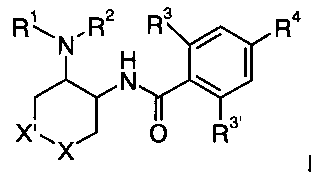
где
R1/R2 независимо друг от друга представляют собой водород, (CR2)о-C3-7 циклоалкил, возможно замещенный низшим алкилом или гидрокси, или представляют собой низший алкил или тетрагидропиранил, и о представляет собой 0 или 1; и
R могут быть одинаковыми или различаться и представляют собой водород или низший алкил; или
R1 и R2 могут образовывать вместе с атомом N, к которому они присоединены, гетероциклоалкильную группу, выбранную из группы, состоящей из пирролидинила, пиперидинила, 3-аза-бицикло[3.1.0]гекс-3-ила или 2-аза-бицикло[3.1.0]гекс-2-ила, которые возможно замещены гидрокси;
R3 представляет собой S-низший алкил, низший алкил, низший алкокси или С3-7 циклоалкил;
R3′ представляет собой водород, низший алкил, замещенный галогеном,
низший алкил или низший алкокси;
R4 представляет собой низший алкил, замещенный галогеном;
X представляет собой -О- или -СН2-;
X′ представляет собой -О- или -СН2-; при условии, что один из X или X′ всегда представляет собой -О- и другой представляет собой -СН2-; или фармацевтически приемлемая кислотно-аддитивная соль, рацемическая смесь, или соответствующий энантиомер и/или оптический изомер.
2. Соединение формулы I-1, охватываемое формулой I по п. 1,
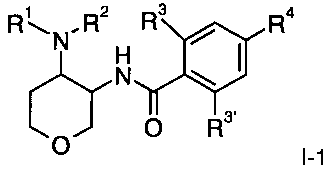
где
R1/R2 независимо друг от друга представляют собой водород, (CR2)0-C3-7 циклоалкил, возможно замещенный низшим алкилом или гидрокси, или представляют собой низший алкил или тетрагидропиранил, и о представляет собой 0 или 1; и
R могут быть одинаковыми или различаться и представляют собой водород или низший алкил; или
R1 и R2 могут образовывать вместе с атомом N, к которому они присоединены, гетероциклоалкильную группу, выбранную из группы, состоящей из пирролидинила, пиперидинила, 3-аза-бицикло[3.1.0]гекс-3-ила или 2-аза-бицикло[3.1.0]гекс-2-ила, которые возможно замещены гидрокси;
R3 представляет собой S-низший алкил, низший алкил, низший алкокси или С3-7 циклоалкил;
R3′ представляет собой водород, низший алкил, замещенный галогеном,
низший алкил или низший алкокси;
R4 представляет собой низший алкил, замещенный галогеном; или фармацевтически приемлемая кислотно-аддитивная соль, рацемическая смесь, или соответствующий энантиомер и/или оптический изомер.
3. Соединение формулы 1-1 по п. 2, где R1 и R2 могут образовывать вместе с атомом N, с которым они связаны, гетероциклоалкильную группу, выбранную из группы, состоящей из пирролидинила, пиперидинила, 3-аза-бицикло[3.1.0]гекс-3-ила или 2-аза-бицикло[3.1.0]гекс-2-ила, которые возможно замещены гидрокси.
4. Соединение формулы I-1 по п. 3, где соединения представляют собой
2-метокси-6-метилсульфанил-N-((3RS,4SR)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(-)-2-метокси-6-метилсульфанил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
2-циклопропил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
2-метилсульфанил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
2-метил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
2-циклопропил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
2-циклопропил-N-((3SR,4RS)-4-пиперидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
2,6-диметил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
2,6-диэтил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
2-этил-6-метокси-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
2-этил-6-метил-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
2-циклопропил-6-метокси-N-((3SR,4RS)-4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
N-[(3S,4R)-4-(3-аза-бицикло[3.1.0]гекс-3-ил)-тетрагидро-пиран-3-ил]-2-циклопропил-4-трифторметил-бензамид,
(+)-2-циклопропил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(-)-2-циклопропил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(+)-2-метил-N-транс-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
(-)-2-метил-N-транс-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
(+)-2-метилсульфанил-N-транс-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
(-)-2-метилсульфанил-N-транс-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
(+)-2-циклопропил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
(-)-2-циклопропил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4,6-бис-трифторметил-бензамид,
(+)-2,6-диметил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(-)-2,6-диметил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(+)-2-метокси-6-метил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(-)-2-метокси-6-метил-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(+)-2-этил-6-метокси-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(-)-2-этил-6-метокси-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(+)-2-циклопропил-6-метокси-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид,
(-)-2-циклопропил-6-метокси-N-(4-пирролидин-1-ил-тетрагидро-пиран-3-ил)-4-трифторметил-бензамид или
N-[(3SR,4RS)-4-(2-аза-бицикло[3.1.0]гекс-2-ил)-тетрагидро-пиран-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид.
5. Соединение формулы I-1 по п. 2, где R1 и R2 независимо друг от друга представляют собой водород или (СR2)0-С3-7циклоалкил, о представляет собой О или 1, и R могут быть одинаковыми или различаться, и представляют собой водород или низший алкил.
6. Соединение формулы I-1 по п. 5, где соединения представляют собой N-((3SR,4RS)-4-циклопентиламино-тетрагидро-пиран-3-ил)-2-циклопропил-4-трифторметил-бензамид,
2-циклопропил-N-[(3RS,4SR)-4-(1-циклопропил-этиламино)-тетрагидро-пиран-3-ил]-4-трифторметил-бензамид,
(+)-N-(транс-4-циклопентиламино-тетрагидро-пиран-3-ил)-2-циклопропил-4-трифторметил-бензамид или
(+)-N-(4-циклогексиламино-тетрагидро-пиран-3-ил)-2-циклопропил-4-трифторметил-бензамид.
7. Соединение формулы I-2, охватываемое формулой I по п. 1,
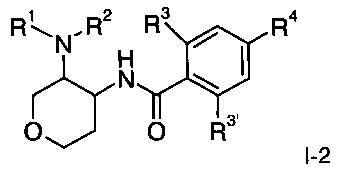
где
R1/R2 независимо друг от друга представляют собой водород, (CR2)0-C3-7 циклоалкил, возможно замещенный низшим алкилом или гидрокси, или представляют собой низший алкил или тетрагидропиранил, и о представляет собой 0 или 1; и
R могут быть одинаковыми или различаться и представляют собой водород или низший алкил; или
R1 и R2 могут образовывать вместе с атомом N, к которому они присоединены, гетероциклоалкильную группу, выбранную из группы, состоящей из пирролидинила, пиперидинила, 3-аза-бицикло[3.1.0]гекс-3-ила или 2-аза-бицикло[3.1.0]гекс-2-ила, которые возможно замещены гидрокси;
R3 представляет собой S-низший алкил, низший алкил, низший алкокси или С3-7 циклоалкил;
R3′ представляет собой водород, низший алкил, замещенный галогеном, низший алкил или низший алкокси;
R4 представляет собой низший алкил, замещенный галогеном; или фармацевтически приемлемая кислотно-аддитивная соль, рацемическая смесь, или соответствующий энантиомер и/или оптический изомер.
8. Соединение формулы I-2 по п. 7, где соединения представляют собой цис-2-метокси-6-метилсульфанил-N-(3-пирролидин-1-ил-тетрагидро-пиран-4-ил)-4-трифторметил-бензамид,
(-)-2-метокси-6-метилсульфанил-N-(3-пирролидин-1-ил-тетрагидро-пиран-4-ил)-4-трифторметил-бензамид или
(+)-2-метокси-6-метилсульфанил-N-(3-пирролидин-1-ил-тетрагидро-пиран-4-ил)-4-трифторметил-бензамид.
9. Соединение по любому из пп. 1-8 для применения в качестве ингибитора GIyT-1.
10. Фармацевтическая композиция, обладающая активностью ингибирования GIyT-1, содержащая одно или более чем одно соединение по любому из пп. 1-8 и фармацевтически приемлемые эксципиенты.
11. Фармацевтическая композиция по п. 10, где заболевания, которые можно лечить, представляют собой психоз, боль, дисфункцию памяти и обучения, синдром дефицита внимания, шизофрению, слабоумие или болезнь Альцгеймера.
12. Применение соединения по любому из пп. 1-8 для лечения психоза, боли, дисфункции памяти и обучения, синдрома дефицита внимания, шизофрении, слабоумия или болезни Альцгеймера.
13. Применение соединения по любому из пп. 1-8 для изготовления лекарств для лечения психоза, боли, дисфункции памяти и обучения, синдрома дефицита внимания, шизофрении, слабоумия или болезни Альцгеймера.
| WO 2006067423 A1 29.06.2006 | |||
| Stan V.D Andres et al, "trans-3,4-Diaminopiperidines", J.Org.Chem.,1991,v.56,p.3133-3137 | |||
| WO 2005068463 A1 28.07.2005 | |||
| WO 2009105509 A1 27.08.2009 | |||
| RU 2005133990 A 20.03.2006 |
Авторы
Даты
2015-06-27—Публикация
2011-01-28—Подача