Изобретение относится к области биотехнологии и селекции растений, и может быть использовано для получения новых генотипов гречихи посевной - продуцентов ценного для фармакологической промышленности флавоноидного соединения рутина, а также в исследованиях по генетике, физиологии и биохимии растений.
В России и ряде других стран для промышленного получения рутина используются бутоны и цветки софоры японской (Sophora japonica L.), которые закупают в Китае (Растения для нас. Справочное издание / под ред. Г.П. Яковлева, К.Ф. Блиновой. - СПб: Учебная книга, 1996. - 653 с.), Бразилии, Германии (Куркин В.А. Фармакогнозия: Учебник для фармац. вузов. - 2-е изд., пере-раб. и доп. - Самара: Офорт, ГОУ ВПО «СамГМУ Росздра-ва», 2007. - 1239 с.), что невыгодно с экономической точки зрения. Альтернативным источником получения флавоноидов является клеточно-тканевая культура растений in vitro.
Известны способы повышения индукции биологически активных флавоноидов и тритерпеновых сапонинов в клеточной культуре Atragene speciosa Weinm. (Княжик сибирский) (патент RU 2714403) на модифицированной гормональной питательной среде с использованием освещения белым светом интенсивностью (2-4)×103 лк, а также с применением аналогичной питательной среды, дополненной 24-эпибрассинолидом.
Недостатком изобретения является дороговизна используемых гормональных препаратов и дополнительного оборудования.
Известна культура корня Hed.th. (Hedysarum theinum Krasnob.) - продуцента изофлавонов (патент RU 2360964), обладающая интенсивным ростом на питательных средах простого состава, не содержащих фитогормоны, и способностью к синтезу видоспецифичных изофлавонов (ононина, гликозида тексазина, малонилононина, формононетина), характерных для корней целого растения.
Недостатком известного способа является низкий уровень содержания получаемого целевого продукта (изофлавонов).
Клеточная культура гречихи in vitro широко используется в качестве продуцента вторичных метаболитов (Гумерова Е.А., Утина Д.Б., Румянцева Н.И. Фенольные соединения и антиоксидантная активность в суспензионных и каллусных культурах гречихи татарской. Биоантиоксидант: тез. докл. VIII Междунар. конф. Москва: РУДН, 2010. - Р. 129-131; Suvorova G. Buckwheat tissue cultures and genetic transformation // Molecular Breeding and Nutritional Aspects of Buckwheat. - 2016. - P. 365-375. http://dx.doi.org/10.1016/B978-0-12-803692-1.00029-8). Группой китайских ученых была создана высокофлавоноид-продуцирующая красная каллусная линия F. cymosum, которая использовалась для молекулярного клонирования изофлавонредуктазоподобного гена FcIRL (Zhu Q., Guo Т., Sui S., Liu G., Lei X., Luo L., Li M. Molecular cloning and characterization of a novel isoEavone reductase-like gene (FcIRL) from high Flavonoids-producing callus of Fagopyrum cymosum // Acta Pharm. Sinica. - 2009. - Vol. 44 (7). - P. 809-819). По данным L. Tumova et al. (Tumova L., Píchová M., Dušek J. Fagopyrum esculentum in vitro // Ceska Slov. Farm. - 2007. - V. 56(3). - P. 125-128; Tumova L., Tuma J., Dusek, J. Fagopyrum esculentum in vitro - callus growth and flavonoid production // Cereal Research Communications. - 2008. - V. 36. - P. 859-862), питательная среда Мурасиге и Скуга с комбинацией регуляторов роста 2,4-D (1 мг/л) и кинетина (1 мг/л) при нормальном световом режиме является оптимальной как для культивирования F. esculentum in vitro, так и для производства флавоноидов, в т.ч. рутина. Однако стрессовое состояние гречихи значительно увеличивает продуцирование флавоноидных соединений растениями, что нашло применение в биотехнологии для оценки и получения F. esculentum с высокой способностью к индукции флавоноидов. Критические условия могут быть легко смоделированы в лабораторных условиях с помощью различных факторов, в частности с использованием режимов освещения, пестицидов, тяжелых металлов, инфицирования и многими другими.
Тестирование эффекта влияния гербицида паракват на повышение биосинтеза флавоноидов у гречихи посевной показал, что максимальное содержание рутина (0,25%) в культуре каллуса было продемонстрировано после 72 часов элиминации в концентрации параквата 2,1929⋅10-3 моль/л, в суспензионной культуре (0,02%) - после 24-часовой обработки в концентрации 2,1929⋅10-5 моль/л (Tumova L., Tuma J. The effect of paraquat on flavonoid production in Fagopyrum esculentum cultures in vitro // Cer. Res. Communic. - 2009. - V. 37. - P. 557-560. https://doi.org/10.1556/CRC.37.2009. Suppl.4).
Недостатком данного способа является невысокий уровень биосинтеза рутина, а также затратность по времени и средствам в связи с использованием параквата, получением и культивированием каллусной и суспензионной культуры.
При инфицировании клонов культуры волосистых корней гречихи Agrobacterium rhizogenes MAFF 03-01724 после 4 недель культивирования в жидкой среде Мурасиге-Скуга был выявлен образец, синтезировавший рутин в количестве 0,24% от сухого веса, что в 10 раз больше, чем в корнях полевых культур (Tanaka N. Rutin and other polyphenols in Fagopyrum esculentum hairy roots // Nat. Med. - 1996. - V. 50(4). - P. 269-273). Обработка листовых эксплантов Agrobacterium rhizogenes R1000 влияла на рост и производство рутина в культуре волосистых корней F. esculentum, в результате чего S.-Y. Lee et al. (Lee S.-Y., Cho S.-I., Park M.-H., Kim Y.-K., Choi J.-E., Park S.-U. Growth and rutin production in hairy root cultures of buckwheat (Fagopy-rum esculentum M.) // Prep.Biochem. Biotechnol. - 2007. - V. 37. - P. 239-246. https://doi.org/10.1080/10826060701386729) выбрали клон H8, который имел высокие скорости роста (312 мг сухого веса на 30 мл) и выработки рутина (1,2 мг/г сухого веса).
Однако проведение процесса агробактериальной трансформации требует существенных дополнительных затрат и характеризуется высокой трудоемкостью.
Известен способ увеличения биосинтеза флавоноида рутина до 2,83% in vitro у растений гречихи посевной сорта Изумруд (в 1,25 раз по сравнению с контролем) под воздействием повышенной концентрации ZnSO4×7Н2О (404 мг/л) (Барсукова Е.Н., Клыков А.Г., Чайкина Е.Л. Использование метода культуры ткани для создания новых форм Fagopyrum esculentum Moench // Российская сельскохозяйственная наука. - 2019. - №5. - С. 3-6; Клыков А.Г., Барсукова Е.Н. Биотехнология и селекция гречихи на Дальнем Востоке России. - Владивосток: ООО «ПСП95», 2021. - 352 с.). Авторами также было установлено, что влияние CuSO4×5Н2О в дозах 161 и 184 мг/л приводило к увеличению синтеза рутина до 2,72 и 2,77%.
Недостаток способа - недостаточно высокие уровни повышения накопления рутина в регенерантах гречихи.
Наиболее близким по технической сущности к заявляемому изобретению является способ повышения флавоноид-образующей способности тканевой культуры in vitro гречихи посевной у сорта Изумруд (увеличение биосинтеза флавоноида рутина до 3,05%) при использовании селективного фактора in vitro - ZnSO4×7Н2О в дозе 909 мг/л в питательной среде с минеральной основой по Мурасиге-Скуга (Borovaya S., Klykov А., Barsukova Е., Chaikina Е. Study of the effect of selective media with high zinc doses on the survival, growth and development of common buckwheat in vitro // Plants. - 2022. - V. 11, №3. DOI: 10.3390/plants11030264).
Представленный способ имеет существенный недостаток - незначтельное повышение индукции образования рутина по сравнению с контролем. В данной статье также рассматривается гибрид Изумруд × Инзерская, у которого биосинтез рутина достиг уровня 4,20-4,25%). Однако для получения генетически выровненной гибридной популяции (поколение F5 -F7) требуется длительное время и дополнительные затраты, к тому же этот процесс сортоспецифичен и не гарантирует получения высокого содержания целевого продукта (рутина).
Цель настоящего изобретения - повысить флавоноид-образующую способность тканевой культуры in vitro гречихи посевной за счет применения высоких концентраций цинка в питательной среде, увеличить генетическое разнообразие исходного материала F. esculentum с использованием методов биотехнологии.
Указанная цель достигается тем, что способ повышения флавоноид-образующей способности тканевой культуры in vitro гречихи посевной, включает культивирование микрочеренков с пазушной почкой на среде Мурасиге и Скуга (далее МС), содержащей аммоний азотнокислый, калий азотнокислый, калий фосфорнокислый однозамещенный, магний сернокислый семиводный, кальций хлористый двухводный, железо сернокислое семиводное, борную кислоту, марганец сернокислый четырехводный, кобальт хлористый шестиводный, медь сернокислую пятиводную, цинк сернокислый семиводный, натрий молибденовокислый двухводный, калий йодистый, тиамин хлорид, пиридоксин хлорид, сахарозу, агар и воду, получение пробирочных растений, их черенкование и субкультивирование на среде Мурасиге и Скуга. Согласно изобретению, микрочеренки поэтапно культивируют на среде Мурасиге и Скуга с добавлением меди сернокислой пятиводной в концентрации 161 и 184 мг/л, цинка сернокислого семиводного в количестве 808-1313 мг/л в течение 30-33 дней, и далее при III-V субкультивировании на средах без токсикантов проводят исследование содержания рутина в регенерантах гречихи (без корней) хроматоспектрофотометрическим методом, отбирают линии с наибольшим уровнем флавоноид-образующей способности.
По сравнению с прототипом признаками изобретательского уровня предлагаемого способа повышения флавоноид-образующей способности тканевой культуры in vitro гречихи посевной являются:
1 «…микрочеренки поэтапно культивируют на среде Мурасиге и Скуга с добавлением меди сернокислой пятиводной в концентрации 161 и 184 мг/л, цинка сернокислого семиводного в количестве 808-1313 мг/л в течение 30-33 дней», что позволяет:
- индуцировать генетические изменения в растениях гречихи, что выражается в получении линий, обладающих повышенной способностью к биосинтезу рутина.
2 «…далее при III-V субкультивировании на средах без токсикантов проводят исследование содержания рутина в регенерантах гречихи (без корней) хроматоспектрофотометрическим методом, отбирают линии с наибольшим уровнем флавоноид-образующей способности», что позволяет:
- предложить биотехнологический способ повышения синтеза флавоноидных соединений у растений F. esculentum;
- круглогодично получать сырье с высоким содержанием биологически активных веществ в промышленных масштабах для фармацевтической промышленности и медицины;
- регулировать получение флавоноидов для получения конечного продукта с высоким выходом, избегнув влияния факторов окружающей среды.
Признаки, указанные в отличительной части описания достижения цели, доказывают, что заявляемый способ повышения флавоноид-образующей способности тканевой культуры in vitro гречихи посевной обладает новизной. Совокупность признаков, приведенных в сравнении свойств заявляемого и известного решения, дает основание сделать вывод, что заявляемый способ имеет изобретательский уровень.
Предлагаемый способ повышения флавоноид-образующей способности тканевой культуры in vitro гречихи посевной осуществляется следующим образом. Готовят питательную среду согласно прописи, представленной в таблице 1.

В питательную среду МС вносят CuSO4×5Н2О в концентрации 161 и 184 мг/л. Асептические одноузловые черенки гречихи посевной сорта Изумруд культивируют в течение 30-33 суток на селективных средах с медью. Выжившие и микроклонально размноженные микрорастения повторно культивируют на питательных средах МС с добавлением соли цинка (ZnSO4×7Н2О) в следующих количествах по вариантам опыта: 808, 909, 1010, 1111 и 1313 мг/л. Микрорастения выращивают в течение 30-33 суток на среде МС со стандартным содержанием (8,6 мг/л) сульфата цинка (контроль) и селективных средах с цинком по вариантам опыта. Выжившие генотипы микроклонируют на питательные среды МС и осуществляют последующие субкультивирования.
Изолированные in vitro объекты культивируют в пробирках с ватно-марлевыми пробками при освещенности 4 тыс.лк, температуре 22-25°С, фотопериоде 16 ч в условиях культуральной комнаты. Приготовление и стерилизация бокса, посуды, инструментов проводится по общепринятым методикам.
Содержание рутина определяют в культивируемых in vitro на обычных питательных средах МС в течение III-V пассажей регенерантах гречихи посевной (без корней), полученных после воздействия селективных сред с медью и цинком по общепринятым методикам.
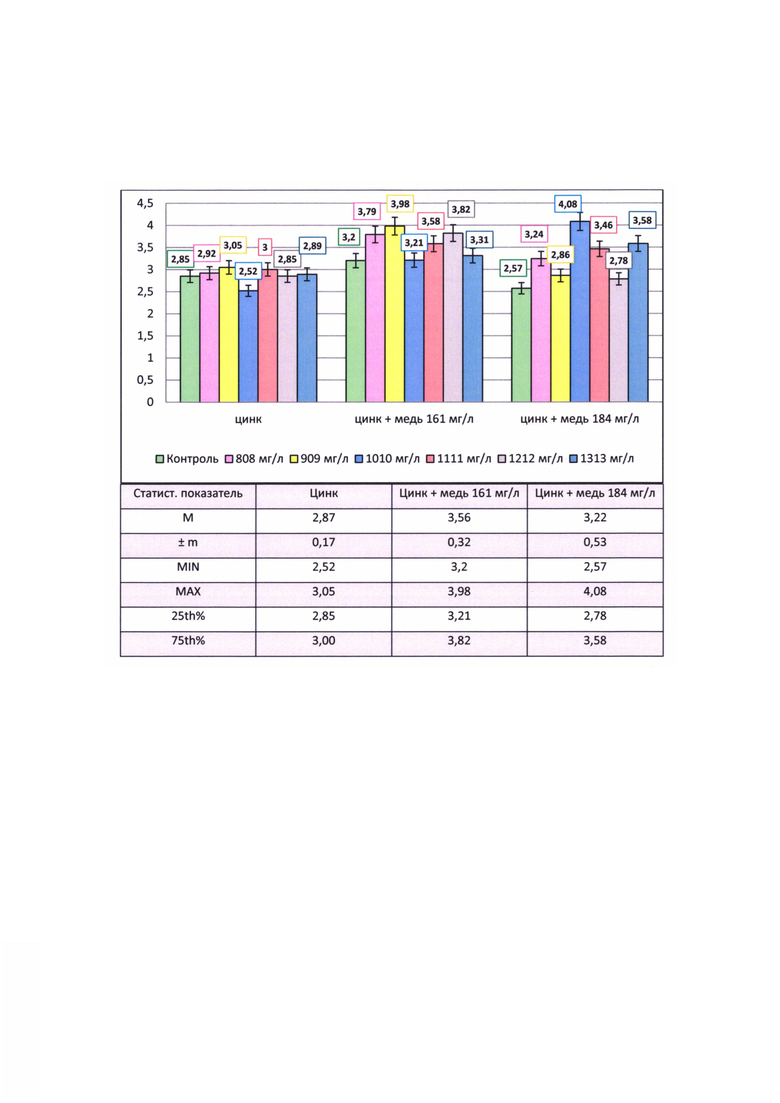
Результаты исследования содержания флавоноида рутина в пробирочных растениях-регенерантах F. esculentum, культивируемых in vitro, представлены на фиг. В качестве объекта для сравнения использовалась группа регененерантов гречихи посевной сорта Изумруд, полученных с использованием одного селективного фактора - цинка в концентрациях 808-1313 мг/л (Borovaya S., Klykov A., Barsukova Е., Chaikina Е. Study of the effect of selective media with high zinc doses on the survival, growth and development of common buckwheat in vitro // Plants. - 2022. - V. 11, №3. DOI: 10.3390/plants11030264). Она характеризовалась содержанием рутина в пределах 2,52-3,05%.
При воздействии исследуемых концентраций соли цинка на регенерантные линии гречихи посевной, полученные после меди (161 мг/л CuSO4×5Н2О), обнаружено значительное превышение содержания рутина в исследуемых пробирочных растениях (3,21-3,98%) - в 1,1-1,6 раз выше, чем в группе растений, полученных с применением одного цинка. В то же время, в варианте использования селективного агента соли меди без цинка отмечено меньшее содержание рутина (3,2%) по сравнению с вариантами совместного применения меди и цинка. Исключение составил вариант 1010 мг/л цинка, где различия несущественны.
Исследование группы линий, культивируемой после комплексного стресса с использованием цинк+медь 184 мг/л, показало, что минимальное накопление рутина характерно для контрольной группы растений (2,57%), где в питательную среду добавляли одну медь. По остальным вариантам показатель варьировал от 2,78 до 4,08% (максимум в варианте 1010 мг/л), существенно превышая контроль.
Анализируя полученные данные в целом, выявлено, что пробирочные растения гречихи посевной, полученные после комплексного стресса (медь 161 мг/л+цинк; медь 184 мг/л+цинк), обладают повышенной флавоноид-образующей способностью. У них содержание рутина в среднем составило 3,56 и 3,22% соответственно, что в 1,12-1,24 раза выше, чем у растений, полученных после цинка (2,87%). При этом в группе медь 161 мг/л + цинк отмечено максимальное его накопление - 75% растений данной выборки содержали 3,82% рутина, 25% растений - 3,21%. Несколько меньшие показатели в группе медь 184 мг/л+цинк, где 75% микрорастений в выборке синтезировали в среднем 3,58% рутина, что в 1,2 раза выше аналогичного показателя в группе с использованием одного селективного агента - цинка.
Таким образом, полученные нами данные свидетельствуют о том, что поэтапное воздействие селективных агентов - сульфатов меди и цинка, на культуру ткани гречихи посевной индуцирует генетические изменения и способствует созданию новых генотипов гречихи посевной с повышенной флавоноид-образующей способностью. При этом повышенный уровень экспрессии генов биосинтеза рутина у подвергшихся влиянию комплексного стресса (медь+цинк) пробирочных растений сохраняется при последующих микроклонированиях. Тканевые культуры F. esculentum являются особыми биосистемами синтеза рутина, что может быть положено в основу новых биологических методов и подходов, позволяющих получать растительное сырье гречихи посевной in vitro с высоким содержанием биологически активных веществ в промышленных масштабах.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения новых генотипов гречихи in vitro | 2022 |
|
RU2789885C1 |
| Питательная среда для микроклонального размножения гречихи посевной | 2022 |
|
RU2789883C1 |
| Способ микроклонального размножения гречихи in vitro | 2022 |
|
RU2783357C1 |
| Способ микроклонального размножения жимолости in vitro | 2023 |
|
RU2807118C1 |
| Питательная среда для микроклонального размножения безвирусных растений картофеля | 2024 |
|
RU2835038C1 |
| Способ предпосевной обработки семян вики яровой | 2021 |
|
RU2775314C1 |
| Способ оздоровления картофеля от вирусных инфекций in vitro | 2023 |
|
RU2805356C1 |
| Способ повышения содержания флавоноидов в плодах гречихи | 2020 |
|
RU2729743C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕГЕНЕРАНТОВ РИСА В КУЛЬТУРЕ ПЫЛЬНИКОВ IN VITRO | 2018 |
|
RU2681339C1 |
| Способ борьбы с фитофторозом картофеля | 2023 |
|
RU2821582C1 |
Изобретение относится к области биотехнологии. Предлагаемый способ повышения флавоноид-образующей способности тканевой культуры in vitro гречихи посевной включает культивирование микрочеренков с пазушной почкой на среде Мурасиге и Скуга, содержащей аммоний азотнокислый, калий азотнокислый, калий фосфорнокислый однозамещенный, магний сернокислый семиводный, кальций хлористый двухводный, железо сернокислое семиводное, борную кислоту, марганец сернокислый четырехводный, кобальт хлористый шестиводный, медь сернокислую пятиводную, цинк сернокислый семиводный, натрий молибденовокислый двухводный, калий йодистый, тиамин хлорид, пиридоксин хлорид, сахарозу, агар и воду, получение пробирочных растений, их черенкование и субкультивирование на среде Мурасиге и Скуга. Отличительной особенностью способа является то, что микрочеренки поэтапно культивируют на среде Мурасиге и Скуга с добавлением меди сернокислой пятиводной в концентрации 161 или 184 мг/л, цинка сернокислого семиводного в количестве 808-1313 мг/л в течение 30-33 дней, и далее при III-V субкультивировании на средах без токсикантов проводят исследование содержания рутина в регенерантах гречихи (без корней) хроматоспектрофотометрическим методом, отбирают линии с наибольшим уровнем флавоноид-образующей способности. Предлагаемое изобретение позволит повысить флавоноид-образующую способность тканевой культуры in vitro гречихи посевной за счет применения высоких концентраций цинка в питательной среде, увеличить генетическое разнообразие исходного материала F. esculentum. 1 ил., 1 табл.
Способ повышения флавоноид-образующей способности тканевой культуры in vitro гречихи посевной, включающий культивирование микрочеренков с пазушной почкой на среде Мурасиге и Скуга, содержащей аммоний азотнокислый, калий азотнокислый, калий фосфорнокислый однозамещенный, магний сернокислый семиводный, кальций хлористый двухводный, железо сернокислое семиводное, борную кислоту, марганец сернокислый четырехводный, кобальт хлористый шестиводный, медь сернокислую пятиводную, цинк сернокислый семиводный, натрий молибденовокислый двухводный, калий йодистый, тиамин хлорид, пиридоксин хлорид, сахарозу, агар и воду, получение пробирочных растений, их черенкование и субкультивирование, отличающийся тем, что микрочеренки поэтапно культивируют на среде Мурасиге и Скуга с добавлением меди сернокислой пятиводной в концентрации 161 или 184 мг/л, затем цинка сернокислого семиводного в количестве 808-1313 мг/л в течение 30 дней, далее субкультивируют на среде Мурасиге и Скуга и проводят исследование содержания рутина в регенерантах гречихи без корней хроматоспектрофотометрическим методом, отбирают линии с наибольшим уровнем флавоноид-образующей способности.
| BOROVAYA S., et al., Study of the effect of selective media with high zinc doses on the survival, growth and development of common buckwheat in vitro, Plants | |||
| Способ получения продуктов конденсации фенолов с формальдегидом | 1924 |
|
SU2022A1 |
| - V | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| TANAKA N., Rutin and other polyphenols in Fagopyrum esculentum hairy roots, Nat | |||
| Med., 1996, V | |||
| Устройство для выпрямления многофазного тока | 1923 |
|
SU50A1 |
| Нож для надрезывания подошвы рантовой обуви | 1917 |
|
SU269A1 |
| СПОСОБ ПОЛУЧЕНИЯ КОРНЕВОЙ КУЛЬТУРЫ IN VITRO POTENTILLA ALBA L. - ПРОДУЦЕНТА ФЛАВОНОИДОВ | 2019 |
|
RU2714403C1 |
Авторы
Даты
2024-01-10—Публикация
2023-04-20—Подача