Настоящее изобретение относится к частицам и к фармацевтическим препаратам, содержащим такие частицы, где частицы в качестве вещества, усиливающего контрастность, содержат покрытые ядра из металлического элемента вольфрама или из вольфрама в смеси с другими металлическими элементами. Изобретение также относится к применению таких фармацевтических препаратов в качестве контрастных веществ в диагностической визуализации, в частности в рентгеновской визуализации, и к контрастным средам, содержащим такие ядра из металлического элемента вольфрама или из вольфрама в смеси с другими металлическими элементами.
Вся диагностическая визуализация основана на достижении различных уровней сигнала от различных структур внутри организма. Так, например, в рентгеновской визуализации для того чтобы данная структура организма была видна на изображении, ослабление рентгеновских лучей данной структурой должно отличаться от ослабления рентгеновских лучей окружающими тканями. Отличие в сигнале между структурой организма и ее окружением часто называют контрастностью, и средствам усиления контрастности в диагностической визуализации посвящено много усилий, поскольку чем больше контрастность между структурой организма и ее окружением, тем выше качество изображений и тем больше их ценность для врача, ставящего диагноз. Более того, чем больше контрастность, тем меньше структуры организма, которые могут быть обнаружены методиками визуализации, то есть увеличение контрастности может привести к увеличению пространственного разрешения.
Для данного пространственного разрешения диагностическое качество изображений сильно зависит от уровня собственного шума в методике визуализации, и, таким образом, можно видеть, что отношение уровня контрастности к уровню шума представляет собой эффективный показатель диагностического качества диагностических изображений.
Достижение улучшения такого показателя диагностического качества уже давно стало важной задачей и до сих пор остается таковой. В таких методиках, как рентгеновская визуализация, магнитно-резонансная визуализация (MRI) и ультразвуковое исследование, один из подходов для улучшения показателя диагностического качества состоит во введении веществ, усиливающих контрастность, контрастных веществ, в область организма, которую визуализируют.
Так, например, первыми примерами контрастных веществ для рентгеновской визуализации являлись нерастворимые неорганические соли бария, которые усиливали ослабление рентгеновских лучей в тех зонах организма, в которых они были распределены. Позднее в области рентгеноконтрастных веществ преобладали растворимые иод-содержащие соединения, такие как иод-содержащие соединения, продаваемые Amersham Health AS с товарными знаками Omnipaque и Visipaque.
Продолжение работы над рентгеноконтрастными веществами, имеющими в качестве элемента, усиливающего контрастность, тяжелые металлы, в большой степени сконцентрировано на хелатных соединениях ионов тяжелых металлов с аминополикарбоновыми кислотами (АРСА). Исходя из признания того, что эффективная визуализация многих участков организма требует локализации в данных участках организма относительно высоких концентраций ионов металла, были сделаны предположения, что для достижения этой цели могли бы быть использованы полихелатирующие агенты, которые представляют собой вещества, обладающие более чем одной независимой хелатирующей группировкой. Другая работа была сконцентрирована на использовании многоядерных комплексов, которые представляют собой комплексы, в которых входящая в комплекс группировка сама включает два или более атомов, усиливающих контрастность (см. Yu, S.B. и Watson, A.D. в Chem. Rev. 1999, 2353-2377). Соответственно, в случае рентгеновской визуализации или ультразвукового исследования, эти комплексы содержат два или более атомов тяжелого металла, а в случае MRI этот комплекс содержит два или более атомов металла с парамагнитными свойствами.
Yu, S.B. и Watson, A.D. в Chem. Rev. 1999, 2353-2377 рассматривают использование рентгеноконтрастных сред на основе металла. Отмечено использование порошка вольфрама в качестве рентгеноконтрастной добавки в эмболические агенты, используемые в лечении и предоперационной эмболизации гиперваскулярных опухолей. Однако они считают, что широкое внутрисосудистое использование комплексов тяжелых металлов может быть ограничено соображениями безопасности и требованиями дозирования.
Хорошо известно, что нанокристаллический порошок вольфрама является пирофорным и на воздухе самопроизвольно воспламеняется. Вследствие своей реакционной способности наночастицы вольфрама не нашли применения в качестве фармацевтических препаратов, таких как рентгеноконтрастные вещества.
Предложены, например, в патенте США 5728590, металл-конъюгированные соединения элементов тяжелых металлов золота, серебра, платины и палладия, а также их использование в качестве контрастных веществ, таких как рентгеноконтрастные вещества. Кроме того, в патенте США 6203778 отмечено, что в методе рентгеновской визуализации могут быть использованы частицы с неорганическим ядром из металлической меди, никеля, палладия, золота и серебра и органическим покрытием.
В частности, в WO 03/075961 рассматривается использование металлических наночастиц для усиления контрастности рентгеновских лучей. Данная патентная заявка сосредоточена на частицах золота в нанометрическом диапазоне, включая частицы, ковалентно связанные с антителами. Чтобы сделать частицы золота более физиологически приемлемыми, их покрывают тиоглюкозой; были испытаны другие покрытия, такие как глутатион, но было обнаружено, что они являются менее приемлемыми. В качестве возможных альтернативных металлов также отмечены платина, палладий, таллий, висмут, осмий, иридий, серебро, вольфрам, свинец, тантал и уран.
Золотые ядра наночастиц, описанные в WO 03/075961, имеют по существу инертную поверхность, и назначение тиоглюкозного покрытия состоит не в том, чтобы пассивировать эту поверхность.
Тиоглюкозное покрытие частиц золота является способным к обмену, а связывание между поверхностью частиц золота и данным покрытием является относительно слабым. Поэтому частицы золота с данным покрытием будут иметь тенденцию к тому, чтобы иметь длительный период полувыведения из организма, обусловленный замещением лигандов в данном покрытии группами ткани, например сульфгидрильными группами белков. Поэтому в кровотоке будут оставаться частицы золота без покрытия (см., например, Hostetler, М.J.; Templeton, А.С.; Murray, R.W.; "Dynamics of Place-Exchange Reactions on Monolayer-Protected Gold Cluster Molecules" Langmuir, 1999, 15, 3782-3789). Длительный период полувыведения из организма является нежелательным, поскольку это могло бы приводить к более высокой токсичности, и в случае рентгеновских исследований длительный период полувыведения обычно не дает преимущества.
Как отмечено выше, из уровня техники известны различные металлы, используемые в качестве контрастных веществ, включающих ядра из этих элементов в их металлическом (0) окислительном состоянии. В качестве рентгеноконтрастных веществ предложены наночастицы с покрытием. Наночастицы из по существу инертных металлов, таких как золото, серебро, палладий и платина, являются предпочтительными для использования в качестве фармацевтических препаратов. Однако многие из инертных металлов, такие как золото, гадолиний, эрбий и другие редкоземельные элементы, являются дорогими и менее жизнеспособными для использования в качестве коммерческих контрастных веществ. Другие, такие как уран, являются радиоактивными и поэтому непригодны в качестве рентгеноконтрастных веществ. Токсичность таких металлов, как свинец, ртуть и таллий, делает их менее желательными для использования in vivo. Висмут, барий и вольфрам являются потенциальными кандидатами для данного конкретного использования, однако висмут и особенно барий обладают относительно низкими способностями ослаблять рентгеновские лучи. Вольфрам в форме вольфрамового порошка является пирофорным и как таковой не может быть использован в качестве фармацевтического препарата.
Хотя имеющиеся в продаже растворимые иод-содержащие соединения считают весьма безопасными, и в США их ежегодно используют в более 20 миллионах рентгеновских исследований, все еще существует желание разрабатывать новые контрастные вещества. В идеале такие агенты, по сравнению с растворимыми иод-содержащими соединениями, должны иметь улучшенные свойства по одной или более из следующих характеристик: почечной токсичности, вязкости, объемах инъекций и ослаблению/дозе облучения.
В настоящее время обнаружено, что частицы, содержащие ядро из металлического элемента вольфрама, возможно смешанного с другими металлическими элементами, и где на указанное ядро нанесен слой покрытия, такой как полимерный слой или мономерный слой, обладают неожиданными и подходящими свойствами в качестве фармацевтических препаратов, и, в частности, в качестве контрастных веществ. Слой покрытия будет пассивировать реакционноспособную поверхность ядер вольфрамовых частиц и обеспечивать безопасные наночастицы с подходящими свойствами.
Следует отметить, что далее в этом документе термины "частицы" и "наночастицы" использованы как взаимозаменяемые, когда частицы имеют нанометрический размер, и что термины "ядро" и "ядро вольфрама" также использованы как взаимозаменяемые. В выражение "фармацевтические препараты" также включены частицы/наночастицы, которые составляют действующее начало фармацевтического препарата. Другие воплощения определены в прилагаемой формуле изобретения и будут изложены в данном описании.
Соединения по данному изобретению представляют собой частицы, содержащие ядро и слой покрытия. Диаметры этих частиц находятся в нанометрическом диапазоне, и поэтому они называются наночастицами. Хотя эти частицы могут варьировать в диапазоне от приблизительно 1,5 нм до более 20 нм, более предпочтительно от 1,5 до 15 нм, часто предпочтительно, чтобы они выводились почками. Поэтому предпочтительно размер этих частиц должен быть меньше пороговой величины для почек, составляющей приблизительно от 6 до 7 нм (Kobayashi, H.; Brechbiel, M.W. Molecular Imaging 2, 1 (2003)), и предпочтительно размер этих частиц должен находиться в диапазоне от 1,5 нм до 7 нм или более предпочтительно от 2 до 6 нм.
Ядро частицы содержит вольфрам в его металлической форме или вольфрам в смеси с другими пригодными металлическими элементами. Предпочтительно содержание вольфрама находится в диапазоне от 20 до 100 мас.%, более предпочтительное диапазоне от 50 до 100%, и даже более предпочтительно в диапазоне от 85 до 100 мас.%, и особенно предпочтительно в диапазоне от 95 до 100 мас.%. Обычно предпочтительными являются ядра, содержащие приблизительно 100% вольфрама.
Введение в вольфрамовое ядро других металлических элементов может обеспечить улучшение характеристик этого ядра, например, улучшить стабильность, монодисперсность, синтез и/или скорость образования металлического ядра. Предпочтительными допустимыми добавками являются рений, иридий, ниобий, тантал или молибден в количестве от 5 до 15 мас.% как в виде одного элемента, так и в виде смесей элементов, наиболее предпочтительными являются рений и иридий. Все эти элементы могут смешиваться с вольфрамом, а небольшие количества рения и/или иридия улучшают пластичность металлического ядра при низких температурах.
Важно, чтобы металлическое ядро, которое обеспечивает ослабляющие свойства частиц, с учетом предпочтительного общего размера наночастицы, имело размер, достаточный для этого свойства. Поэтому, чтобы обеспечивать требуемые ослабляющие свойства, ядро должно содержать по возможности оптимальное количество атомов металла. Если ядро состоит из приблизительно 100 мас.% металлического вольфрама, то ядро должно содержать от 15 до 5000 атомов вольфрама, предпочтительно от 100 до 3000 атомов вольфрама и более предпочтительно от 200 до 2500 атомов вольфрама. При условии, что атомы вольфрама упакованы в объемно-центрированные кубические кристаллы, одно ядро из атомов вольфрама, насчитывающее 15 атомов, будет иметь диаметр ядра приблизительно 0,6 нм, 100 атомов вольфрама будут иметь диаметр 1,5 нм, 1500 атомов вольфрама будут иметь диаметр приблизительно 4,2 нм, тогда как ядро размером 5 нм будет содержать приблизительно 2500 атомов вольфрама, а ядро, содержащее 5000 атомов вольфрама, будет иметь диаметр приблизительно 6,5 нм.
Поскольку ядро, содержащее вольфрам, в большей или меньшей степени является реакционноспособным, чтобы пассивировать реакционноспособную поверхность, на это металлическое ядро должно быть нанесено покрытие. Свойства этого покрытия должны обеспечивать такую защиту данного металлического ядра, чтобы ядро не реагировало, например не воспламенялось при воздействии воздуха, или не реагировало при приготовлении в виде препарата для использования in vivo, или не реагировало в in vivo окружении. Предпочтительно покрытие должно сохранять свои свойства в такой степени, чтобы вольфрамовая поверхность ядра не стала реакционноспособной до тех пор, пока частицы не будут выведены из организма, в который они введены. Покрытие также должно обеспечивать наночастицы, которые имеют пригодный короткий период полувыведения in vivo. Если наночастицы содержат группировки, обеспечивающие направленную доставку, период полувыведения этих частиц мог бы быть пролонгирован, но необходимо, чтобы период полувыведения являлся приемлемым, если принимать во внимание токсичность. Поэтому важно, чтобы покрытие являлось таким, чтобы эти частицы проявляли незначительную тенденцию к образованию агрегатов, особенно in vivo. В то же время покрытие должно быть относительно тонким, для того чтобы обеспечить достаточно маленькие частицы, предпочтительно частицы, имеющие размер меньше пороговой величины для почек, составляющей приблизительно от 6 до 7 нм, хотя более крупные частицы также являются полезными для этой цели. Связывание металлического ядра с покрытием также должно быть достаточно сильным, чтобы избежать дезинтеграции между металлическим ядром и покрытием.
Если фармацевтический препарат приготавливают для парентерального введения, например для инъекции в вену или артерию, растворимость наночастиц в воде должна быть высокой.
Приготовленный фармацевтический препарат также должен иметь достаточно низкую вязкость, с тем чтобы фармацевтический препарат можно было легко вводить. Вязкость является важным фактором для фармацевтических препаратов, предназначенных для парентерального введения. Для фармацевтических препаратов, вводимых через внешние полости организма, вязкость имеет меньшее значение. Объемная доля контрастного вещества лопамидола в водном растворе при концентрации иода 350 мг/мл составляет 0,26, а вязкость составляет 7,6 мПа·с при 37°С. При условии, что авторы изобретения могут использовать ту же самую объемную долю ϕ=0,26 для наночастиц по настоящему изобретению, где вязкость растворителя η0=0,653·10-3 Па·с для воды при 37°С, вязкость η такого раствора при 37°С будет равна:
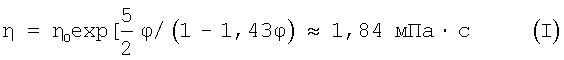
(см. "The viscosity of a concentrated suspension of spherical particles" Mooney, M.J.Colloid. Sci. vol.6, page 162, (1951)). Для такой высокой концентрации частиц эта вязкость является очень низкой и основана на предположении, что частицы представляют собой раствор твердых сфер. Эта вязкость является также низкой по сравнению с вязкостью иодированных рентгеноконтрастных веществ.
Металлический вольфрам имеет относительно высокий показатель ослабления рентгеновских лучей, низкую токсичность и является доступным по приемлемой цене.
Осмоляльность приготовленных фармацевтических препаратов представляет собой дополнительный важный фактор, оказывающий влияние на токсичность продукта. Осмоляльность раствора определяется количеством растворенных частиц на единицу растворителя, обычно воды. Препараты с высокой осмоляльностью имеют тенденцию вызывать более тяжелый неблагоприятный эффект, возникающий, в частности, в результате внутривенных и внутриартериальных инъекций. Препараты с высокой осмоляльностью вызывают транспорт воды через полупроницаемые мембраны, приводя к нежелательным физиологическим эффектам. Поэтому в идеале эти препараты должны быть по существу изоосмоляльными, однако слабо гиперосмоляльные или гипоосмоляльные препараты являются приемлемыми.
Обнаружено, что конкретные формы покрытий могут удовлетворять рассматриваемым свойствам, таким как давать наночастицы, содержащие ядро и покрытие, которые могут быть использованы в качестве фармацевтических препаратов, в частности в качестве контрастных веществ в рентгенографии, таких как ренгеноконтрастные вещества.
В первом воплощении предложены наночастицы, содержащие металлическое ядро, покрытое заряженным покрытием. Под "зарядом" подразумевают химические объекты с отрицательно или положительно заряженными группами. Это заряженное покрытие содержит до 50 зарядов на наночастицу, предпочтительно до 40 зарядов на наночастицу, еще более предпочтительно до 25 зарядов на наночастицу. Каждая наночастица должна содержать не менее 4 зарядов, предпочтительно не менее 8 зарядов на частицу. Количество зарядов зависит от размера металлического ядра и также от размера наночастиц с покрытием. Покрытие, содержащее заряженные группы либо с отрицательными, либо с положительными зарядами, будет давать частицы, которые, находясь в растворе, отталкиваются друг от друга, и, таким образом, в значительной степени или частично предотвращается образование кластеров наночастиц. Предотвращение образования кластеров частиц с покрытием повышает растворимость этих частиц. Кроме того, вязкость препарата из этих частиц будет поддерживаться в предпочтительном диапазоне.
С другой стороны, препарат заряженных частиц содержит нейтрализующие противоионы, а это приводит к увеличению осмоляльности. Однако поскольку эти наночастицы содержат большое количество атомов вольфрама, можно получать растворы, концентрация которых в отношении атомов вольфрама составляет 12 М; концентрация этих растворов в отношении количества свободных частиц типично составляла бы только 60 мМ. Поскольку каждый заряд приносит с собой один противоион, акцептирование нескольких зарядов на частицу является в значительной степени критическим, поскольку изоосмотические препараты могут быть приготовлены в виде препаратов, содержащих до 0,5 М свободных частиц (включая противоионы).
Заряженные группы должны находиться в своей ионной форме при значении рН среды, в которой это соединение используется. Наиболее важно, что они должны находиться в заряженной форме при физиологических рН, в частности при рН крови. Если фармацевтический препарат предназначен для непарентерального введения, такого как введение через внешние каналы и полости организма, такие как желудочно-кишечный тракт, мочевой пузырь и матка, тогда покрытие должно иметь заряженную форму при конкретном рН органа-мишени.
Вещество покрытия может содержать группы положительных или отрицательных зарядов. Анионные группы, сообщающие отрицательные заряды, могут быть представлены большим разнообразием групп, известных специалисту в данной области. Особенно важными являются кислотные группы, такие как группы карбоновых кислот, группы сульфоновых кислот, группы фосфорных кислот и также кислотные гетероциклические группы, такие как тетразолы или 5-гидроксиизооксазолы. Катионные группы также являются пригодными для этой цели, и доступно большое разнообразие групп. Могут быть использованы основные группы, такие как аминогруппа, амидиновая и гуанидиновая группы, а также группы четвертичного аммония или фосфония.
Слой покрытия может содержать материал из полимерного или мономерного вещества. Покрытие из мономерного вещества предпочтительно должно содержать гидрофильный слой из неметаллического вещества, содержащего по меньшей мере часть молекул, которые являются гидрофильными, и предпочтительно каждая молекула должна иметь по меньшей мере одну гидрофильную группу. В то же время данное покрытие должно быть нанесено на поверхность ядра (например на поверхность волфрамового ядра) достаточно плотно, чтобы его пассивировать. Пассивация имеет место на поверхности ядра в том случае, когда существует перенос электронов между координационной группой металла и поверхностью ядра. Примерами координационных групп металла являются группы А в нижеприведенной формуле An-Lo-Mp. В предпочтительном аспекте покрытие представляет собой монослойное покрытие, означающее, что толщина этого покрытия представлена только одной единственной молекулой. Мономерные покрытия имеют то преимущество, что слой покрытия может быть сделан тонким и может обладать вполне определенными свойствами. Эффективность таких наночастиц определяется тем, что вольфрамовое ядро наночастцы составляет наибольшую возможную часть частицы. В то же время, для парентерального использования общий диаметр этой частицы должен быть небольшим, наиболее предпочтительно меньше приблизительно 6-7 нм, что является пороговым значением для почечной экскреции. Ориентированный мономолекулярный слой также обеспечивает улучшение контроля над растворимостью и токсичностью, поскольку будет вполне определенный наружный конец молекулы, где могут находиться гидрофильные группы, которые действуют как солюбилизирующие группы, и заряженные группы, при этом другой конец молекулы обращен к металлу и связан с ним.
В предпочтительном аспекте изобретения монослойное покрытие построено в соответствии с общей формулой An-Lo-Mp, где А представляет собой одну или более координационных групп металла, предпочтительно выбранных из Таблицы 1, L отсутствует или присутствует, и, когда присутствует, представляет собой одну или более связывающих групп, предпочтительно выбранных из Таблицы 2, и М представляет собой одну или более заряженных и гидрофильных групп, предпочтительно выбранных из Таблицы 3. Предпочтительно связывающая группа содержит любое число фрагментов из Таблицы 2, расположенных линейно, разветвленно или в одном или более кольцах. Ответвление может быть направлено в сторону А-группы, создавая мультидентатные покрытия, или оно может ответвляться в направлении М-группы, создавая более высокую степень гидрофильности. Также существует возможность ответвления в обоих направлениях. Связывающие фрагменты из Таблицы 2 могут быть комбинированы с фенильными кольцами или ароматическими или неароматическими гетероциклическими группами, n представляет собой любое положительное целое число и предпочтительно от 1 до 10 или более предпочтительно от 1 до 4; о представляет собой ноль или любое положительное целое число и предпочтительно от 1 до 10 или более предпочтительно от 1 до 2; р представляет собой любое положительное целое число и предпочтительно от 1 до 10 или более предпочтительно от 1 до 4. Пунктирная линия в группах А указывает связь с элементом вольфрамом, связь с Н-атомом, связь с L-группой, связь с другой А-группой или связь с М-группой, если о является нулем. Пунктирная линия в группах L указывает связь с А-группой, связь с Н-атомом, связь с другой L-группой или связь с М-группой. Пунктирная линия в группах М указывает связь с L-группой, связь с Н-атомом, связь с другой М-группой или связь с А-группой, если о является нулем.
Координационные А-группы металла: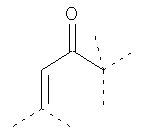
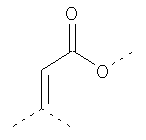

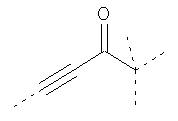
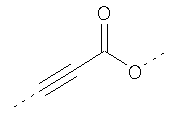

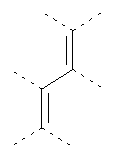



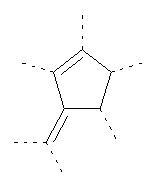
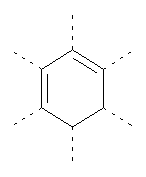
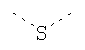

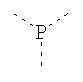
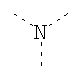

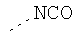


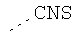
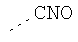
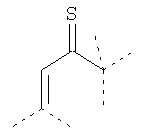
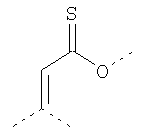
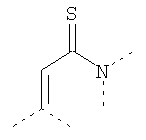
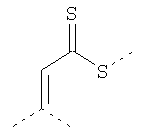
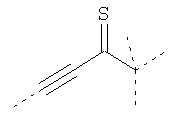
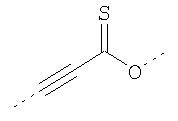

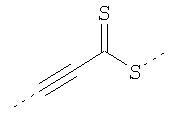
Связывающие L-группы: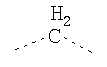
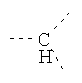
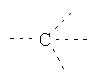
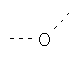
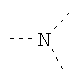
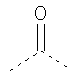

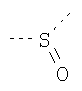
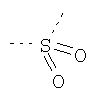

Гидрофильные М-группы: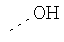
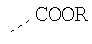

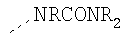
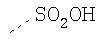



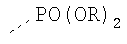
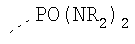
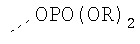
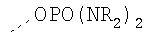
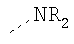
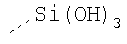
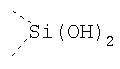
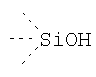
R-группы независимо представляют собой любую(ые) группу(ы), выбранную(ые) из Н и С1-С6алкильной группы, возможно замещенной одной или более -ОН-группами, и где один или более С-атомов C1-С6алкильной группы могут быть замещены эфирной группой.
Покрытие из полимерного вещества содержит слой любого пригодного для фармацевтического использования полимерного вещества, содержащего минимальное количество заряженных групп на наночастицу и являющегося гидрофильным. Это покрытие должно покрывать поверхность вольфрама достаточно плотно, чтобы его пассивировать. Полимерный поверхностный слой может быть ковалентно связан с поверхностью металлического ядра или может быть адсорбирован и удерживаться нековалентными силами. Как описано выше для мономерного покрытия, предпочтительно, чтобы слой покрытия был как можно более тонким и в то же время обеспечивал необходимую пассивацию поверхности вольфрамового ядра. Данный полимер может быть природным или синтетическим гомополимером или сополимером. Многочисленные полимеры для этой цели являются доступными, и специалист в данной области будет способен выбрать пригодные полимеры, известные из уровня техники. Полезные типы полимеров включают простые полиэфиры (например PEG (полиэтиленгликоль) и возможно разветвленный), полиацетали, поливиниловые спирты и их полярные производные, сложные полиэфиры, поликарбонаты, полиамиды, включая алифатические и ароматические полиамиды, и полипептиды, типы углеводов, таких как крахмал и целлюлоза, полицианоакрилаты и полицианометакрилаты, при условии, что эти полимеры содержат минимальное количество заряженных групп, и наиболее предпочтительно также являются гидрофильными. Особенно предпочтительными являются полимеры, полученные из мономеров акриловой кислоты. Для того чтобы получить слой с контролируемым и пригодным числом заряженных групп, предпочтительными являются также сополимеры, где сополимер может содержать 2 или более мономерных единиц или блоков. По меньшей мере один из этих мономеров должен обеспечивать в полимерном покрытии заряженные группы. Данный заряд увеличивает растворимость в воде и уменьшает риск агрегации частиц, но также увеличивает осмолярность этих частиц. Соответственно, количество групп, несущих заряд, должно поддерживаться на минимуме. В препаратах нейтральный мономер, комбинированный с заряженным мономером в молярных отношениях менее 20:1, предпочтительно от 10:1 до 10:1,5, может давать полимер с пригодным количеством зарядов для наночастиц диаметром от 2 до 6 нм. Возможно, это отношение может быть увеличено даже еще больше. Использование мономера F приводит к образованию сетчатого полимера.
Примерами пригодных мономеров, которые могут быть использованы для образования полимерного покрытия, являются:
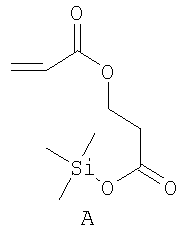
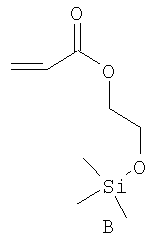
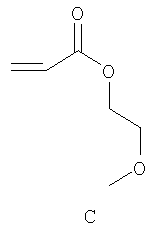
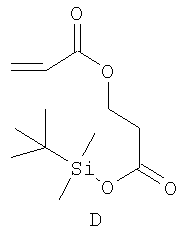
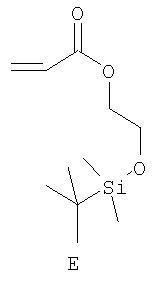

Наночастицы, покрытые полимером, обычно получают термическим разложением источника вольфрама (0), например гексакарбонила вольфрама, W(CO)6, в высококипящем, сухом и дезоксигенированном растворителе в присутствии одного или более мономеров. Имеет место термически индуцированная полимеризация этих мономеров, в результате которой на вольфрамовые частицы, образованные при разложении, наносится полимерное покрытие. Если эти мономеры содержат защищенные силиловым эфиром полярные группы (-ОН, -СООН), эти защитные группы отщепляют в водном растворе с получением частиц, покрытых гидрофильным полимером.
Обычно необходимо использовать сухие растворители. Гигроскопичные растворители (диглим (диметиловый эфир диэтиленгликоля), триглим (диметиловый эфир триэтиленгликоля)) необходимо перколировать через оксид алюминия и хранить на молекулярных ситах. Все растворители перед тем, как они будут использованы в реакциях, должны быть дезоксигенированы путем пропускания потока пузырьков аргона через растворитель в течение 25-30 минут. Выбор растворителя для этого способа является критическим, поскольку существует несколько критериев, которым необходимо удовлетворять. Один из критериев состоит в способности растворять исходные вещества и в то же время удерживать в растворе конечные частицы, покрытые полимером. Простые полиэфиры ди- и триглим являются здесь особенно полезными. Высокая точка кипения в частности триглима позволяет достигать температурного уровня, когда из частиц выходят последние молекулы моноксида углерода. Другими полезными растворителями будут дифениловый эфир и другие инертные высококипящие ароматические соединения. Триоктилфосфиноксид (и другие алкильные аналоги), триоктилфосфин (и другие алкильные аналоги), высококипящие амиды и сложные эфиры также будут полезными.
Другим важным параметром способа является возможность контролировать тенденцию W(CO)6 к сублимации из реакционной смеси. Этого можно достичь путем подмешивания небольшой порции низкокипящего растворителя, для того чтобы твердый гексакарбонил вольфрама со стенок холодильника или сосуда непрерывно смывать назад. Хорошим выбором будут циклооктан и н-гептан при использовании объемной доли от 5 до 15%.
Для обработки частиц удобно использовать осаждение путем добавления пентана или других низкокипящих алканов. Растворитель с низкой точкой кипения является предпочтительным в том случае, когда частицы нужно сушить.
Методики получения и обработки дополнительно описаны в конкретных примерах.
Во втором воплощении на ядро наносят гидрофильный слой, не содержащий заряженных групп. Предпочтительно данное покрытие должно представлять собой слой покрытия из мономерного вещества и должно включать гидрофильный слой из неметаллических молекул, содержащий по меньшей мере часть молекул, которые являются гидрофильными, а предпочтительно каждая молекула должна иметь по меньшей мере одну гидрофильную группу, такую, как описано выше.
Поверхностное покрытие может включать группировку для направленной доставки, такую как антитело, фрагмент антитела, пептид, липид, углевод, нуклеиновая кислота, лекарство или фрагмент лекарства или любую другую молекулу, которая может направлять фармацевтический препарат к конкретному органу или структуре в организме, которые подлежат исследованию. Примерами органов или структур, которые должны стать мишенями, являются эндоретикулярная система печени и селезенки, компоненты тромбов в кровотоке, компоненты атеросклеротической бляшки, маркеры опухолей и макрофаги.
Контрастные среды часто вводят парентерально, например внутривенно, внутриартериально или подкожно. Контрастные среды также можно вводить перорально или через внешние каналы, например в желудочно-кишечный тракт, мочевой пузырь или матку. Пригодные носители хорошо известны в данной области и будут изменяться в зависимости от, например, пути введения. Выбор носителей находится в пределах компетенции специалиста в данной области. При получении контрастных сред для растворения или суспендирования фармацевтического препарата, например контрастного вещества, обычно используют водные носители. Могут быть использованы различные водные носители, такие как вода, забуференная вода, солевой раствор, глицин, гиалуроновая кислота и тому подобное.
Возможно приготовить растворы, содержащие наночастицы по изобретению, имеющие от приблизительно 1,0 до приблизительно 4,5 г вольфрама/мл раствора, конкретнее от 1,5 до приблизительно 3,0 г вольфрама/мл воды и совсем конкретно приблизительно 2,2 г вольфрама/мл воды. Это соответствует содержанию вольфрама приблизительно 12 М. Предпочтительно типичный препарат наночастиц имеет в ядре от 200 до 2500 атомов вольфрама.
Для применения в качестве фармацевтических препаратов наночастицы, содержащие вольфрам, должны быть стерилизованы; это может быть выполнено с помощью методик, хорошо известных из уровня техники. Данные частицы могут быть предложены в стерильном растворе или дисперсии или альтернативно в сухой форме, например лиофилизированной форме.
Ниже изобретение будет дополнительно проиллюстрировано неограничивающими примерами.
В примерах 1-5 описано получение вольфрамовых ядер, покрытых мономерным слоем, тогда как в примерах 6-10 описано заряженное полимерное покрытие вольфрамовых ядер. Все температуры даны в °С.
Мономеры A-G, использованные в этих примерах, представляют собой:







Анализ покрытых полимером частиц выполняли, главным образом, при помощи ЯМР (13С, 1Н), инфракрасной (ИК) и рентгеновской флуоресцентной спектроскопии (XFS). В одном случае была получена ТЕМ (просвечивающий электронный микроскоп)-микрофотография.
В общем случае, расширенные 1Н-ЯМР пики и отсутствие резонансов в области двойной связи означало полную полимеризацию. 13С-ЯМР спектры показали, дополнительно к резонансам от алифатической части полимера, несколько близко расположенных (в пределах 3 м.д. (миллионных долей)) резонансов в карбонильной области. С помощью ЯМР никаких резонансов от остаточных карбонилов металла обнаружено не было.
ИК-спектры показали сильное поглощение от карбонильных групп полимера и, в различной степени, от остаточных карбонилов металла.
Содержание вольфрама в частицах определяли путем ренгеновской флуресцентной спектроскопии.
Эксперименты по деградации частиц выполняли с помощью спектроскопии в видимой и ультрафиолетовой областях (300-800 нм) в дезоксигенированных трис-глициновых буферных растворах.
Эксперименты с использованием электрофореза, выполненные в трис-глициновом буфере (рН 7,5), указывали на отрицательный заряд частиц, содержащих мономеры А и D.
Для определения размера частиц в одном из препаратов использовали прибор Malvern Zetasizer с использованием диффузного светорассеяния (DLS).
Растворимость в воде определяли путем растворения частиц в трис-глициновом буфере (0,1 М, рН 7,5) и лиофилизации раствора. Затем определяли приблизительную растворимость полученного порошка.
Пример 1: Получение вольфрамовых наночастиц путем восстановления в органическом растворителе
Данную реакцию выполняют в атмосфере инертного газа. Соединение вольфрама (например WCl6) и покрытие, у которого реакционноспособные сайты защищены защитными группами, растворяют в апротонном не смешивающимся с водой органическом растворителе и добавляют растворимый восстановитель. После завершения реакции добавляют воду и органический растворитель и разделяют фазы. Органический слой промывают водой и упаривают до небольшого объема. Добавляют большой избыток смеси этанол/вода и твердым веществам дают возможность выпасть в осадок. Отфильтровывают твердые вещества и повторяют еще раз методику растворения-осаждения. Частицы сушат в вакууме.
Защитные группы удаляют с помощью подходящей методики. При необходимости раствор обессоливают путем диализа, гель-хроматографии или каких-либо других пригодных методик. Окончательный продукт обычно получают путем лиофилизации.
Пример 2: Получение вольфрамовых наночастиц путем восстановления в воде
Водорастворимое соединение вольфрама, например вольфрамат натрия, и молекулу покрытия растворяют в дезоксигенированной воде в инертной атмосфере. рН доводят до требуемого значения. Затем данный раствор добавляют к интенсивно перемешиваемому раствору восстановителя в дегазированной воде. После завершения восстановления уменьшают объем раствора, раствор обессоливают путем диализа и затем лиофилизируют с получением окончательного продукта.
Пример 3: Получение вольфрамовых наночастиц путем восстановления в инверсных мицеллах
Водный раствор водорастворимого соединения вольфрама, например вольфрамата натрия, доведенный до требуемого значения рН, вводят в качестве водной фазы в инверсную мицеллу в органическом растворителе путем добавления большой порции сурфактанта. Также получают похожий препарат инверсной мицеллы водного восстановителя. К данному восстановителю добавляют вольфрамсодержащую жидкость. Добавляют молекулы покрытия. После уравновешивания, чтобы расслоить данную эмульсию, добавляют воду. Собирают водную фазу, а органическую фазу промывают еще двумя порциями воды. Собранные водные фазы уменьшают в объеме и обессоливают путем диализа. Затем этот водный раствор лиофилизируют с получением конечного продукта.
Пример 4: Получение вольфрамовых наночастиц путем разложения комплекса вольфрама (0)
Термолабильный W(0)-комплекс, например W(CO)6, разлагают в инертном высококипящем растворителе, например циклооктане, в присутствии молекул покрытия, где реакционноспособные сайты защищены защитными группами, например гексилакрилата. После завершения реакции добавляют полярный растворитель, такой как этанол, черный порошок отфильтровывают и промывают.
Защитные группы удаляют путем, например, гидролиза или других подходящих методик. Раствор уменьшают в объеме и обессоливают. Затем водный раствор лиофилизируют с получением конечного продукта.
Пример 5: Синтез вольфрамовых наночастиц. покрытых N,N-бис(2-гидроксиэтил)акрилатом
Данную реакцию выполняют в безвоздушных условиях. Гексакарбонил вольфрама и N,N-бис(2-диметил-трет-бутилсилилоксиэтил)акрилат растворяют в циклооктане и нагревают до температуры дефлегмации в течение 12 часов. Большую часть растворителя удаляют под вакуумом, а черный остаток три раза промывают метанолом.
Защитные группы удаляют путем гидролиза в 10% водной муравьиной кислоте. Жидкости упаривают, остаток растворяют в воде и снова подвергают сушке. Продукт образуется в виде черного порошка, в котором слой покрытия содержит молекулу H2C=C-CO-N(CH2-CH2OH)2.
Пример 6: Получение покрытой полимером вольфрамовой наночастицы. содержащей мономеры В и С
В круглодонную колбу, снабженную магнитной мешалкой и холодильником, вносили: гексакарбонил вольфрама WO(CO)6 (500 мг, 1,4 ммоль) этиленгликольметиловый эфир-акрилат (С) (390 мг, 3,0 ммоль) и триметилсилил-защищенный 2-карбоксиэтилакрилат (В) (120 мг, 0,55 ммоль). Холодильник снабжали мембраной и выполняли несколько циклов вакуум/аргон для деаэрирования колбы и холодильника. Через мембрану с помощью шприца добавляли деаэрированный диглим (30 мл) и гептан (2 мл). Данную реакционную смесь нагревали до температуры дефлегмации в атмосфере аргона. Через 3 часа реакционную смесь, теперь черный раствор с небольшими количествами черного осадка, охлаждали до комнатной температуры, вливали в деаэрированный пентан (60 мл) и центрифугировали. Осадок промывали пентаном и сушили под вакуумом.
Выход: 430 мг темно-серого порошка. Рентгеновский флуресцентный спектроскопический анализ показал, что содержание вольфрама составляет приблизительно 60%.
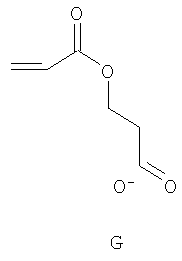
Комментарии: гептан необходим для предотвращения сублимационных отложений гексакарбонила вольфрама в холодильнике. Триметилсилильная защитная группа самопроизвольно отщепляется в водных растворах с получением предпочтительного карбоксилата G.
Данные частицы имеют ядро из кристаллического вольфрама, на которое нанесено тонкое покрытие из сополимеризованных мономеров С и В. Частицы имеют размер от 3 до 5 нм.
Пример 7: Получение и анализ покрытых полимером вольфрамовых наночастиц. содержащих мономеры В и D
В стеклянную колбу, оснащенную холодильником и магнитной мешалкой, вносили гексакарбонил вольфрама (440 мг, 1,2 ммоль), мономер В (970 мг, 5,0 ммоль) и мономер D (300 мг, 1,1 ммоль). Колбу и холодильник подвергали нескольким циклам вакуум/аргон, оставляя атмосферу аргона. Через мембрану в верхней части холодильника шприцем добавляли циклооктан (30 мл). Данный реакционный раствор перемешивали и нагревали до температуры дефлегмации в течение 18 часов. В течение первых часов раствор медленно темнел, в итоге становясь черным (как крепкий кофе). После завершения реакции раствор охлаждали до комнатной температуры и вливали в пентан (50 мл). Полученную суспензию центрифугировали и осадок промывали пентаном и сушили под вакуумом.
Выход: 400 мг темного порошка.
Анализ:
1H ЯМР: расширенные резонансы появлялись при (м.д.) 4,3, 4,1, 3,8, 3,5, 2,8, 2,7-2,2, 1,8-1,2, 0,8, 0,1.
ИК: 1939 w, 1852 w, 1731 vs, 1560 m.
XFS: 57% W.
Растворимость в воде: более 500 мг/мл.
Пример 8: Получение и анализ покрытых полимером вольфрамовых наночастиц, содержащих мономеры А и С
Следуя методике из примера 7, в стеклянную колбу добавляли гексакарбонил вольфрама (500 мг, 1,4 ммоль), мономер А (120 мг, 0,55 ммоль) и мономер С (390 мг, 3,0 ммоль). Через холодильник добавляли диглим (30 мл) и гептан (2 мл). Данный реакционный раствор перемешивали и затем нагревали до температуры дефлегмации в течение 3 часов. Выход: 410 мг темного порошка.
Анализ:
1H ЯМР: расширенные резонансы появлялись при (м.д.) 4,1, 3,5, 3,2, 2,5-2,2, 1,9-1,3.
ИК: 1995 w, 1894 w, 1727 vs, 1540 s.
XFS: 55% W.
ТЕМ: получили микрофотографию, на которой видны ядра частиц размером 3-4 нм.
Эксперимент по деградации: экспоненциальное уменьшение поглощения по всему спектру (300-800 нм). Самое большее, поглощение уменьшалось на 22% за 4,3 часа (при 350 нм).
Электрофоретический эксперимент: движение частиц указывало на отрицательный заряд.
Пример 9: Получение и анализ покрытых полимером вольфрамовых наночастиц, содержащих мономер Е
Следуя методике из примера 7, в стеклянную колбу добавляли гексакарбонил вольфрама (2,3 г, 6,5 ммоль) и мономер Е (7,6 г, 32 ммоль). Через холодильник добавляли циклооктан (100 мл). Данный реакционный раствор перемешивали и затем нагревали до температуры дефлегмации в течение 60 часов.
Анализ:
Размер частиц определяли путем динамического светорассеяния. 99% от общего объема частиц принадлежало частицам, имеющим размер от 5,8 до 7,8 нм.
Пример 10: Получение и анализ покрытых полимером вольфрамовых наночастиц, содержащих мономеры А, С и F
В стеклянную колбу, снабженную холодильником и магнитной мешалкой, вносили гексакарбонил вольфрама (1,0 г, 2,8 ммоль), триглим (45 мл) и гептан (3 мл). Колбу и холодильник подвергали нескольким циклам вакуум/аргон, оставляя атмосферу аргона. Суспензию нагревали и перемешивали до растворения. Затем данный раствор нагревали до температуры 160°С, после чего шприцем через мембрану добавляли смесь мономера С (1,8 г, 14 ммоль), мономера А (280 мг, 1,3 ммоль) и мономера F (280 мг, 1,4 ммоль). Данный раствор перемешивали при температуре 165-170°С в течение 3 часов. После завершения реакции раствор охлаждали до комнатной температуры и вливали в пентан (50 мл). Полученную суспензию центрифугировали и осадок промывали пентаном и сушили под вакуумом. Выход: 800 мг темного порошка.
Анализ:
1H ЯМР: расширенные резонансы появлялись при (м.д.) 4,2, 3,5, 3,3, 2,3, 2,0-1,4.
ИК: 1921 w, 1825 w, 1727 vs, 1534 m.
XFS: 47% W.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОСТАВ ГЕЛЯ ДЛЯ ЛУЧЕВОЙ ТЕРАПИИ ПОД ВИЗУАЛЬНЫМ КОНТРОЛЕМ | 2014 |
|
RU2703303C2 |
| ТЕПЛОУСТОЙЧИВЫЕ ПРЕПАРАТЫ НАНОЧАСТИЦ И АССОЦИИРОВАННЫЕ С НИМИ СПОСОБЫ | 2013 |
|
RU2649765C2 |
| КОНТРАСТНЫЕ АГЕНТЫ НА ОСНОВЕ НАНОЧАСТИЦ ДЛЯ ДИАГНОСТИЧЕСКОЙ ВИЗУАЛИЗАЦИИ | 2009 |
|
RU2526181C2 |
| ВЕКТОРИЗОВАННЫЕ ВОДОСОВМЕСТИМЫЕ ПОЛИМЕРНЫЕ МИЦЕЛЛЯРНЫЕ ЧАСТИЦЫ ДЛЯ ДОСТАВКИ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР | 2020 |
|
RU2752177C1 |
| НАНОЧАСТИЦЫ, ЛЕГЧЕ ПРОНИКАЮЩИЕ В СЛИЗИСТУЮ ОБОЛОЧКУ ИЛИ ВЫЗЫВАЮЩИЕ МЕНЬШЕ ВОСПАЛЕНИЯ | 2012 |
|
RU2631599C2 |
| КОМПОЗИЦИОННЫЙ МАТЕРИАЛ ДЛЯ РЕНТГЕНКОНТРАСТНОЙ ВИЗУАЛИЗАЦИИ НЕРЕНТГЕНОКОНТРАСТНЫХ ИМПЛАНТАТОВ | 2015 |
|
RU2599510C1 |
| МАГНИТНО-РЕЗОНАНСНОЕ И РЕНТГЕНОВСКОЕ КОНТРАСТНОЕ СРЕДСТВО НА ОСНОВЕ СЛОЖНОГО ОКСИДА ЖЕЛЕЗА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2009 |
|
RU2419454C1 |
| ЧАСТИЦЫ, СОДЕРЖАЩИЕ ПРОИЗВОДНОЕ БИЛИРУБИНА И МЕТАЛЛ | 2018 |
|
RU2756753C2 |
| МАГНИТНО-РЕЗОНАНСНОЕ И РЕНТГЕНОВСКОЕ КОНТРАСТНОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2497546C1 |
| Поликомпонентная наноразмерная система для диагностики и терапии новообразований | 2020 |
|
RU2729617C1 |
Настоящее изобретение относится к частицам, полезным в рентгеновской визуализации, содержащим ядро из металлического элемента вольфрама, возможно, вместе с другими металлическими элементами, где содержание вольфрама в ядре частицы составляет от 20 до 100 мас.% металлического вольфрама, и где на указанное ядро нанесен заряженный слой покрытия для пассивации реакционноспособной поверхности ядер вольфрамовых частиц. Изобретение также касается фармацевтических препаратов, содержащих указанные частицы, способа получения указанных частиц и их применения в качестве рентгеноконтрастных веществ. 6 н. и 24 з.п. ф-лы, 3 табл.
1. Частица, полезная в рентгеновской визуализации, содержащая ядро из металлического элемента вольфрама, возможно, вместе с другими металлическими элементами, где содержание вольфрама в ядре частицы составляет от 20 до 100 мас.% металлического вольфрама, и где на указанное ядро нанесен заряженный слой покрытия для пассивации реакционноспособной поверхности ядер вольфрамовых частиц.
2. Частица по п.1, имеющая диаметр в диапазоне от 1,5 до 20 нм.
3. Частица по п.1, где ядро частицы содержит металлический вольфрам и один или более из элементов: рений, иридий, ниобий, тантал или молибден в металлической форме.
4. Частица по п.1, где заряженный слой покрытия обеспечивает результирующий отрицательный заряд кислотных групп, таких как группы карбоновых кислот, группы сульфоновых кислот, группы фосфорных кислот и кислотные гетероциклические группы.
5. Частица по п.1, где заряженный слой покрытия обеспечивает результирующий положительный заряд основных групп, таких как аминогруппа, амидиновая, гуанидиновая группы, группы четвертичных аммония и фосфония.
6. Частица по п.1, где заряженный слой покрытия содержит до 50 зарядов на частицу.
7. Частица по п.1, где слой покрытия включает полимерный слой с заряженными группами.
8. Частица по п.7, где полимерный слой содержит гидрофильный полимер.
9. Частица по п.8, где полимер содержит гомополимер или сополимер.
10. Частица по п.8, где полимер образован из мономеров акриловой кислоты.
11. Частица по п.8, где полимер образован по меньшей мере из одного мономера, содержащего заряженную группу.
12. Частица по п.8, где полимер образован по меньшей мере из одного нейтрального мономера.
13. Частица по п.11, где молярное отношение между нейтральным мономером и заряженным мономером составляет менее 20:1.
14. Частица по п.1, где слой покрытия включает мономерный слой.
15. Частица по п.14, где мономерный слой включает гидрофильный мономерный слой.
16. Частица по п.15, где указанный гидрофильный мономерный слой содержит по меньшей мере часть молекул, которые являются гидрофильными.
17. Частица по любому из пп.15 и 16, где указанный гидрофильный слой содержит молекулы, каждая из которых имеет по меньшей мере одну гидрофильную группу.
18. Частица по любому из пп.1-3 и 14-15, где на указанное ядро нанесено монослойное покрытие.
19. Частица по п.18, где указанное монослойное покрытие содержит соединения формулы An-Lo-Mp, где А представляет собой одну или более координационных групп вольфрама, L отсутствует или представляет собой одну или более связывающих групп и М представляет собой одну или более гидрофильных групп, n и р представляют собой положительные целые числа и о представляет собой ноль или положительное целое число.
20. Частица по п.14, где мономерный слой включает заряженный слой покрытия.
21. Частица по п.20, где заряженный слой покрытия содержит заряженные группы по любому из пп.4-6.
22. Фармацевтический препарат, полезный в рентгеновской визуализации, содержащий частицы по любому из пп.1-21, возможно, вместе с фармацевтически приемлемым растворителем или эксципиентом.
23. Рентгеноконтрастное вещество, содержащее частицу по любому из пп.1-21, возможно, вместе с растворителем или эксципиентом.
24. Применение частиц по любому из пп.1-21 в качестве рентгеноконтрастных веществ.
25. Способ рентгеновской визуализации, включающий введение частиц по любому из пп.1-21 в организм человека или животного, визуализацию организма устройством для визуализации, компиляцию данных этого исследования и, возможно, анализ этих данных.
26. Способ получения частиц по любому из пп.1-21, включающий разложение термолабильного комплекса вольфрама (0) в высококипящем, сухом и дезоксигенированном растворителе в присутствии одного или более мономеров и осуществление посредством этого термически индуцированной полимеризации данных мономеров.
27. Способ по п.26, где термолабильный комплекс вольфрама (0) представляет собой гексакарбонил вольфрама (W(CO)6).
28. Способ по п.26, где растворитель содержит ди- и триглим (диметиловый эфир диэтиленгликоля и диметиловый эфир триэтиленгликоля), дифениловый эфир, триалкилфосфиноксид и триалкилфосфин.
29. Способ по п.26, где высококипящий, сухой и дезоксигенированный растворитель дополнительно содержит фракцию низкокипящего растворителя.
30. Способ по любому из пп.26-29, дополнительно включающий обработку образовавшихся частиц низкокипящим алканом, в частности пентаном.
Приоритет по пунктам и признакам:
28.11.2003 по пп.1, 2 (в части, относящейся к диаметру в диапазоне от 1,5 до 10 нм), 3, 18-19, 22-24, 26-27 (в части, когда полимеризация конкретно не упомянута);
26.10.2004 по пп.2 (в части, относящейся к диаметру в диапазоне от 10 до 20 нм), 4-17, 20-21, 25, 26-27 (в части, относящейся к полимеризации), 28-30.
| WO 03075961 A, 18.09.2003 | |||
| LAURENT A | |||
| "Materials and biomaterials for interventional radiology", Biomed & Pharmacother, 1998, vol.52, №2, p.76-88 | |||
| СПОСОБ ВЫРАБОТКИ КОЖ | 1996 |
|
RU2096474C1 |
| РЕНТГЕНОПОГЛОЩАЮЩИЙ МАТЕРИАЛ | 1999 |
|
RU2172990C2 |
| СРЕДСТВО ДЛЯ КОНТРАСТИРОВАНИЯ ПРИ РЕНТГЕНОДИАГНОСТИКЕ (ВАРИАНТЫ) И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1999 |
|
RU2173173C2 |
Авторы
Даты
2009-07-20—Публикация
2004-11-26—Подача