Область изобретения
Настоящее изобретение обносится к соединениям, обладающим антагонистической активностью в отношении рецептора вазопрессина V1a, и к фармацевтическим композициям, включающим такие соединения. Настоящее изобретение также относится к применению антагонистов рецептора вазопрессина V1a для лечения некоторых физиологических расстройств, таких как болезнь Рэйно и дисменорея (первичная дисменорея и/или вторичная дисменорея).
Заявлен приоритет заявки на европейский патент ЕР номер 04104062 и заявки на патент США номер 60/603557, обе из которых поданы 24 августа 2004 года.
Предшествующий уровень техники
Нейрофизеальные гормоны вазопрессин (VP) и окситоцин (ОТ) представляют собой циклические нонапептиды, секретируемые задней долей гипофиза.
До настоящего времени охарактеризован только один рецептор ОТ, тогда как известны три рецептора VP. Они обозначены как рецепторы V1a, V1b и V2.
Вазопрессин действует на кровеносные сосуды, где он представляет собой сильный вазоконстриктор, и на почки, где он способствует реабсорбции воды, приводя к антидиуретическому эффекту.
V1a, V1b и V2, а также рецепторы ОТ представляют собой члены суперсемейства из семи трансмембранных рецепторов, известных как рецепторы, связанные с G-белком. Рецептор V1a опосредуют активацию фосфолипазы С и мобилизацию внутриклеточного кальция. Локализация рецепторов включает тромбоциты, кровеносные сосуды, гепатоциты, головной мозг и матку - шейку матки. Таким образом, антагонист рецептора V1a может оказывать действие на любую из этих тканей или все из них. Например, указывают на то, что избирательные антагонисты рецептора V1a обладают клинической полезностью при дисменорее, преждевременных родах, гипертензии, болезни Рэйно, отеке головного мозга, укачивании в транспорте, гиперлипидемии, мелкоклеточном раке легкого, депрессии, тревоге, гипонатриемии, циррозе печени и застойной сердечной недостаточности.
В отношении дисменореи предположили, что действие в отношении миометрия значительно усиливается у женщин, страдающих от дисменореи в течение менструации. Предположили, что миометриальная ишемия, вызванная увеличенной сокращаемостью матки, может объяснять менструальную боль. Кроме того, в первые сутки менструации у женщин, страдающих от дисменореи, измерены более высокие концентрации вазопрессина в плазме крови по сравнению с контрольными группами.
У здоровых женщин, не страдающих от дисменореи, внутривенная инфузия лизина-вазопрессина приводила в результате к маточному кровотечению, увеличенной сокращаемости матки и слабой-умеренной боли, подобной боли при дисменорее, причем эти эффекты ингибировались избирательным антагонистом человеческого рецептора V1a (Bossmar, Т. et al., BRITISH JOURNAL OF OBSTETRICS AND GYNAECOLOGY (1997 Apr), 104(4), 471-7). Кроме того известно, что вазопрессин в зависимости от дозы вызывает опосредованное V1a сокращение артерий матки человека.
Вышеприведенные данные свидетельствуют о том, что антагонист рецептора V1a представляет собой подходящее и эффективное средство лечения дисменореи (первичной дисменореи и/или вторичной дисменореи). Дополнительное доказательство получено в клиническом исследовании, проведенным с избирательным антагонистом рецептора V1a SR49059 ("Effect of SR49059, an orally active V1a vasopressin receptor antagonist, in the prevention of dysmenorrhea". Brouard, R. et al., BRITISH JOURNAL OF OBSTETRICS AND GYNAECOLOGY (2000), 107(5), 614-619). Обнаружено, что существует зависимое от дозы уменьшение боли и зависимое от дозы уменьшение количества дополнительного принимаемого обезболивающего средства по сравнению с пациентами, принимающими плацебо.
В международной заявке на патент WO 03/016316 А1, опубликованной 27 февраля 2003 года, раскрыто множество соединений, которые, как заявлено, представляют собой агониты окситоцина и применяются при лечении эректильной дисфункции у мужчин. Не сообщали ни о какой антагонистической активности в отношении рецептора V1a. В заявке на европейский патент ЕР 1449844 А1, опубликованной 25 авгута 2004 года, раскрыто множество соединений, которые, как заявлено, представляют собой антагонисты рецептора V1a и применяются при лечении первичной дисменореи.
Существует необходимость в лечении состояний, которые ассоциированы с рецепторами V1a. Также сохраняется потребность в альтернативных антагонистах V1a. Простой синтез и доступность при пероральном введении представляют собой дополнительные желаемые характеристики.
Описание изобретения
В соответствии с одним из аспектов настоящее изобретение относится к соединениям, предпочтительно антагонистам VP, и в частности, специфическим антагонистам рецептора V1a и их фармацевтически приемлемым солям.
В соответствии с еще одним аспектом настоящее изобретение относится к фармацевтическим композициям, включающим эти соединения, и такие композиции полезны для лечения, среди прочего, дисменореи (первичной дисменореи и/или вторичной дисменореи).
В соответствии с еще одним аспектом настоящее изобретение относится к применению соединений для приготовления фармацевтической композиции для лечения дисменореи.
В соответствии с другими аспектами настоящее изобретение относится к медицинскому применению и к применению вышеупомянутых соединений и композиций при лечении и к терапевтическим способам, при которых используют вышеупомянутые соединения и композиции.
Подробное описание изобретения
В соответствии с одним из аспектов изобретение относится к соединению общей формулы 1а или соединению, представляющему собой его таутомер или фармацевтически приемлемую соль,
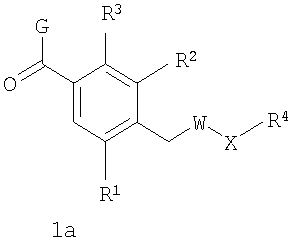
где G представляет собой группу, выбранную из общей формулы 2а, 3а, 4а, 5а и 6а,
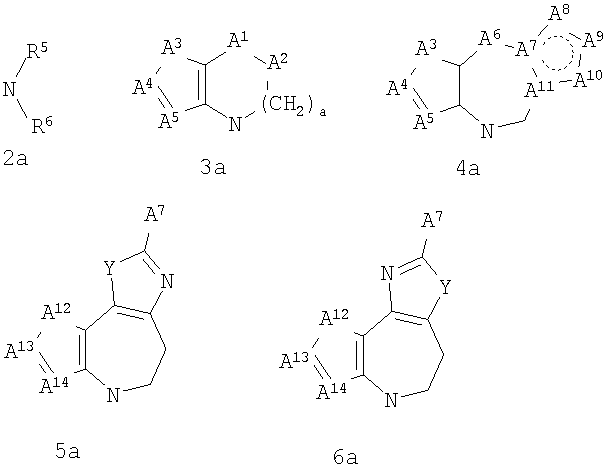
где:
А1 выбран из CH2, СН(ОН), NH, N-алкила, О и S;
А2 выбран из CH2, СН(ОН), С(=O) и NH;
А3 и А12 независимо выбраны из S, NH, N-алкила, -C(R8)=CH-, -C(R8)=N-, -N=C(R8)- и -CH=C(R8)-;
А4 и А13 независимо выбраны из C(R9) и N;
А5 и А14 независимо выбраны из C(R10) и N;
А6 выбран из СН2, NH, N-алкила и О;
А7 и А11 независимо выбраны из С и N;
А8 и А9 независимо выбраны из СН, N, NH, N(CH2)bR11 и S;
А10 выбран из -СН=СН-, СН, N, NH, N-(CH2)b-R11 и S;
где кольцо, образованное А7, А8, А9, А10 и А11, является ароматическим;
R1, R2 и R3 независимо выбраны из Н, алкила, O-алкила, NO2, F, Cl и Br;
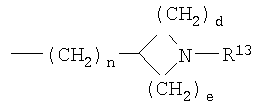
R4 выбран из Н, алкила, арила, гетероарила, -(CH2)c-R12 и
R5 и R6 независимо выбраны из алкила, арила, -(CH2)f-арила и -(CH2)f-гетероарила;
R7 выбран из Н, алкила, арила, гетероарила и -(CH2)g-R14;
R8, R9 и R10 независимо выбраны из Н, алкила, алкокси, F, Cl, Br, CN, NH2, NO2, групп NН(алкил), N(алкил)2; при условиях, что когда G представляет собой 3а, и R4 представляет собой Н, алкил, арил, гетероарил или -(CH2)c-R12, то кольцо, содержащее А3, А4 и А5, замещено по меньшей мере в одной позиции алкилом, алкокси, F, Cl, Br, CN, NH2, NO2, группами NH(алкил) или N(алкил)2; и
когда G представляет собой 4а, R4 представляет собой Н, алкил, арил, гетероарил или
-(CH2)c-R12 и А8 представляет собой NH, NCH3 или S, то кольцо, содержащее А3, А4 и А5, замещено по меньшей мере в одной позиции алкилом, алкокси, F, Cl, Br, CN, NH2, NO2, группами NH(алкил) или N(алкил)2;
R11 и R12 независимо выбраны из Н, алкила, арила, гетероарила, F, ОН, O-алкила, S-алкила, O-ацила, NH2, NH-алкила, группы N(алкил)2, NH-ацила, N(алкил)ацила, СO2Н, СO2-алкила, CONH2, CONH-алкила, группы СON(алкил)2, CN и СF3;
R13 выбран из Н, алкила, арила, гетероарила, -(CH2)h-R15 и Z-R16;
R14 и R15 независимо выбраны из Н, алкила, алкенила, арила, гетероарила, F, ОН, O-алкила, S-алкила, O-ацила, NH2, NH-алкила, группы N(алкил)2, NH-ацила, N(алкил)ацила, СO2Н, СO2-алкила, СО-алкила, СО-арила, CONH2, CONH-алкила, группы СON(алкил)2, алкенил-CO2-алкила, алкениларила, CN и СF3;
R16 выбран из Н, алкила, алкенила, арила, гетероарила, O-арила, -(CH2)i-R17, циклопропиларила и O-(CH2)i-R17;
R17 выбран из Н, алкила, арила, гетероарила, F, ОН, O-алкила, S-алкила, O-ацила, NH2, NH-алкила, группы N(алкил)2, NH-ацила, N(алкил)ацила, СO2Н, СO2-алкила, CONH2, CONH-алкила, группы СОN(алкил)2, CN и СF3;
W выбран из О и NH;
Х выбран из (CH2)m, C(=O) и S(=O)j;
Y выбран из О, S, NH и N-алкила;
Z выбран из -С(=O), -С(=O)-O и -S(=O)k;
а выбран из 1 и 2;
b и с независимо выбраны из 0, 1, 2 и 3;
d, e и f независимо выбраны из 1 и 2;
g, h и i независимо выбраны из 1, 2 и 3;
j и k независимо выбраны из 1 и 2; и
m и n независимо выбраны из 0, 1 и 2.
В соответствии с одним из аспектов R16 дополнительно может быть выбран из O-алкила и O-алкенила, и Z отличается от -С(=O)-O.
Соединения формулы 1а по п.1 подлежат следующим ограничениям. Когда G представляет собой 3а и R4 представляет собой Н, алкил, арил, гетероарил или -(CH2)c-R12, то кольцо, содержащее А3, А4 и А5, замещено по меньшей мере в одной позиции алкилом, алкокси, F, Cl, Br, CN, NH2, NO2, группами NH(алкил) или N(алкил)2. Когда G представляет собой 4а, R4 представляет собой Н, алкил, арил, гетероарил или -(CH2)c-R12 и А8 представляет собой NH, NCH3 или S, то кольцо, содержащее А3, А4 и А5, замещено по меньшей мере в одной позиции алкилом, алкокси, F, Cl, Br, CN, NH2, NO2, группами NH(алкил) или N(алкил)2. Кольцо, образованное А7, А8, А9, А10 и А11, является ароматическим, и соответственно группы должны удовлетворять некоторым требованиям. Когда А10 представляет собой -СН=СН-, кольцо представляет собой шестичленное кольцо. Само по себе оно может включать только атомы, имеющие тип -C(R)=и -N=. Следовательно, А7 и А11, оба, должны представлять собой С, а А8 и А9, оба, должны представлять собой СН или N. Когда А10 не представляет собой -СН=СН-, то кольцо представляет собой пятичленное кольцо. В этом случае один и только один из атомов в кольце должен представлять собой S или тригональный атом азота. В этом контексте "тригональный атом азота" представляет собой атом азота, ковалентно связанный с тремя различными атомами. Два из этих атомов представляют собой непосредственных соседей атома азота в пятичленном кольце. Третий атом представляет собой атом водорода, углерода или другой атом, связанный с пятичленным кольцом. Таким образом, когда А10 не представляет собой -СН=СН-, то один (и только один) из А7, А8, А9, А10 и А11 должен представлять собой S или тригональный атом азота. Следовательно, выбор А7, А8, А9, А10 и АН подлежит следующим ограничениям. Если А10 не представляет собой -СН=СН-, то один из А8, А9 и А10 представляет собой NH, N-(CH2)b-R11 или S или один из А7 и А11 представляет собой N. Не более чем один из А8, А9 и А10 может представлять собой NH, N-(CH2)b-R11 или S. А7 и А11 одновременно не могут представлять собой N. Ни А7, ни А11 не могут представлять собой N, если один из А8, А9 и А10 представляет собой NH, N-(CH2)b-R11 или S.
В соответствии с аспектами изобретения дополнительные и предпочтительные воплощения изобретения представлены ниже в описании и формуле изобретения.
Термин "алкил" включает насыщенные углеводородные остатки, включающие:
- линейные группы до 10 атомов (C1-С10). Примеры таких алкильных групп включают C1- метил, C2 - этил, С3 - пропил и C4 - н-бутил, но не ограничиваются ими;
- разветвленные группы из 3-10 атомов (С3-С10). Примеры таких алкильных групп включают С3 - изопропил, С4 - вторбутил, С4 - изобутил, С4 - трет-бутил и C5 - неопентил, но не ограничиваются ими;
- циклические группы из 3-8 атомов (С3-С8). Примеры таких алкильных групп включают С3 - циклопропил, С4 - циклобутил, C5 - циклопентил и С6 - циклогексил, но не ограничиваются ими;
- комбинации линейных, разветвленных и циклических групп. Примеры таких групп включают
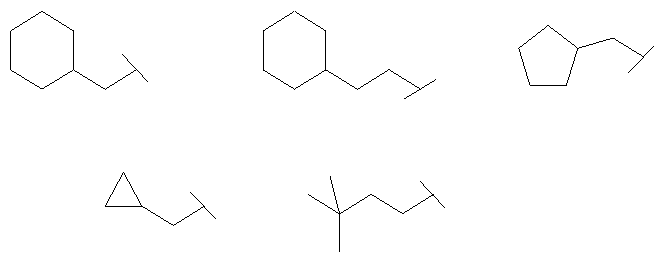
но не ограничиваются ими.
Термин "алкокси" используют для обозначения O-алкильных групп.
Термин "алкенил" включает мононенасыщенные углеводородные группировки, включающие
- линейные группы из двух-шести атомов (С2-С6). Примеры таких алкенильных групп включают C2 - винил, С3 - 1-пропенил, С3 - аллил и С4 - 2-бутенил, но не ограничиваются ими;
- разветвленные группы из 3-8 атомов (С3-С8). Примеры таких алкенильных групп включают С4 - 2-метил-2-пропенил и С6 - 2,3-диметил-2-бутенил, но не ограничиваются ими;
- циклические группы из 3-8 атомов (С3-С8). Примеры таких групп включают C5 - 3-циклопентенил и C6 - 1-циклогексенил, но не ограничиваются ими.
Термин "арил" включает, возможно, замещенный фенил и, возможно, замещенный нафтил. Примеры таких арильных групп включают фенил, 2-толил, 3-хлорфенил, 4-хлорфенил, 3-фторфенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 2,5-дифторфенил, 1-нафтил и 2-нафтил, но не ограничиваются ими.
Термин "гетероарил" включает, возможно, замещенные гетероциклы. Такие гетероарильные группы включают пиридил, 2-хлорпиридил, 4-метилпиридил, тиенил, 3-хлортиенил, 2,3-диметилтиофенил, фурил, 2-метилфурил, пиррол, N-метилпиррол, оксазол, имидазол, пиразол и триазол, но не ограничиваются ими.
Термин "ацил" обозначает группу R-C(=O), где R представляет собой Н, насыщенную или ненасыщенную углеводородную группировку, состоящую из 0-7 атомов углерода, или, возможно, замещенную фенильную, возможно, замещенную пиридильную или, возможно, замещенную тиенильную группу.
Примеры ацильных групп включают: формил, ацетил, пивалоил, бензоил и никотиноил, но не ограничиваются ими.
Некоторые соединения по настоящему изобретению способны образовывать соли с кислотами или основаниями. Например, соединения, содержащие один или более чем один основный атом азота, могут образовывать соли присоединения неорганических и органических кислот, таких как соляная кислота, серная кислота, ортофосфорная кислота, уксусная кислота, трифторуксусная кислота, метансульфоновая кислота, лимонная кислота и бензойная кислота. Соединения, содержащие кислые группы, могут образовывать соли с основаниями. Примеры таких солей включают соли натрия, калия, кальция, триэтиламмония и тетраэтиламмония. Кроме того, соединения, имеющие кислые и основные группы, могут образовывать внутренние соли (цвиттерионы). В той степени, в которой эти соли фармацевтически приемлемы, они включены в объем изобретения.
Некоторые соединения в объеме настоящего изобретения могут существовать в виде таутомеров. Например, где G1 имеет общую формулу 4а (4b, 4с, 4d), и X2 представляет собой NH, получающийся в результате имидазол может существовать в виде его таутомера, определенного G1 в виде общей формулы 5а (5b, 5с, 5d) и X2 в виде NH. Полагают, что все такие таутомеры находятся в объеме настоящего изобретения.
Соединения по настоящему изобретению могут иметь один или более чем один или стереогенный центр ("асимметричные атомы углерода") и, таким образом, могут демонстрировать оптическую изомерию. В объем настоящего изобретения включены все эпимеры, энантиомеры и диастереоизомеры соединений по настоящему изобретению, включающие единичные изомеры, смеси и рацематы.
В соответствии с одним из аспектов предпочтительно, чтобы G был выбран из:
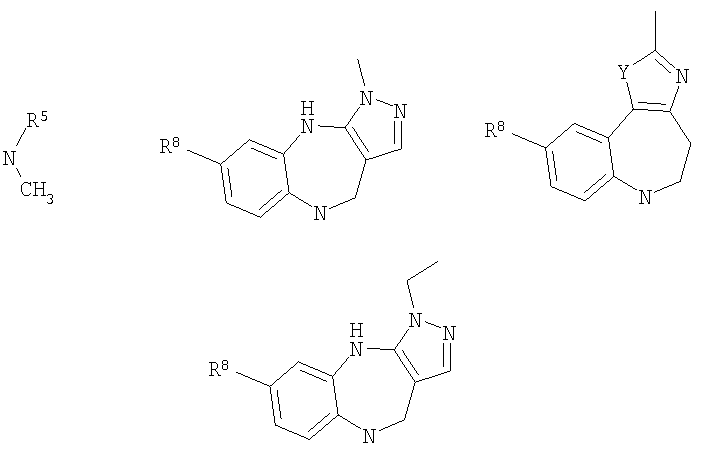
В соответствии с одним из аспектов также предочтительно, чтобы G был выбран из:
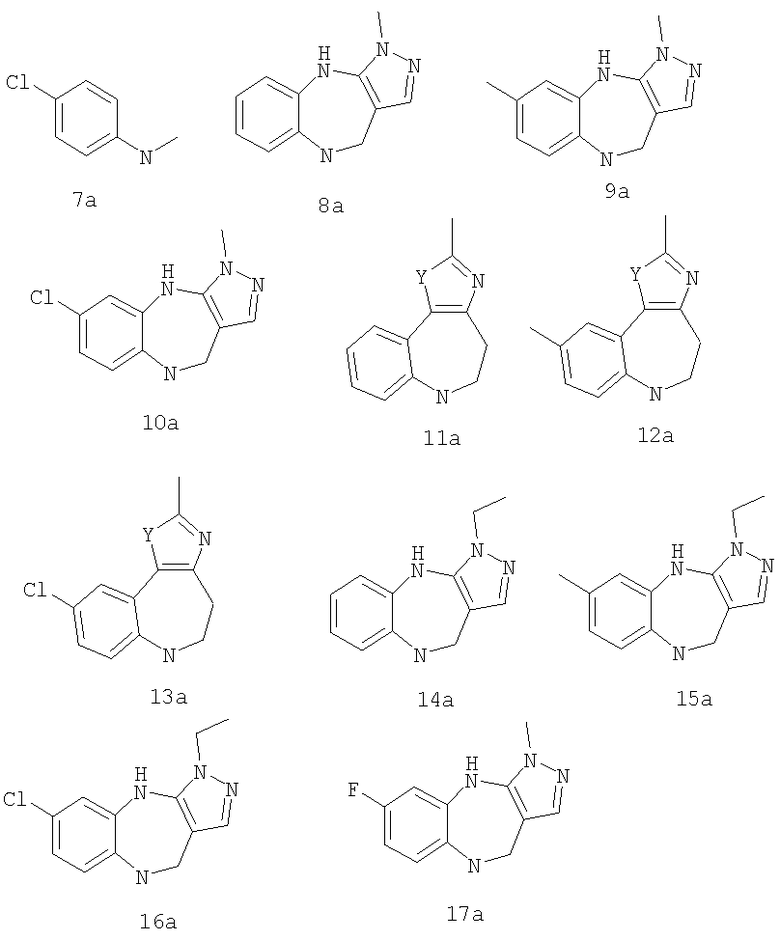
В соответствии с одним из аспектов предпочтительно, чтобы по меньшей мере один из R1, R2 и R3 являлся отличным от водорода; предпочтительно один из R1, R2 и R3 был выбран из метила, хлора и фтора, а другие представляют собой водород.
В соответствии с различными аспектами предпочтительно, чтобы W представлял собой NH; R4 представлял собой алкил; d представлял собой 2, и е представлял собой 2; R13 представлял собой алкил; и/или n представлял собой 0.
В соответствии с одним из аспектов предпочтительно, чтобы R2 представлял собой Н, R4 представлял собой пиперидин, где d представляет собой 2 и е представляет собой 2, W представляет собой NH, X представляет собой С(=O) и n представляет собой 0, как изображено в формуле 18а:
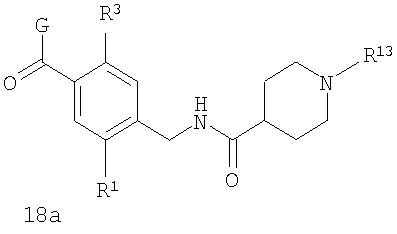
где R1 выбран из метила, хлора и фтора, и R3 представляет собой Н; или R1 представляет собой Н и R3 выбран из метила, хлора и фтора, и R13 представляет собой алкил.
В соответствии с одним из аспектов предпочтительно, чтобы Х представлял собой С(=O), n представлял собой 0 и R4 представлял собой пиперидин, где d представляет собой 2, и е представляет собой 2, как изображено в формуле 19а:
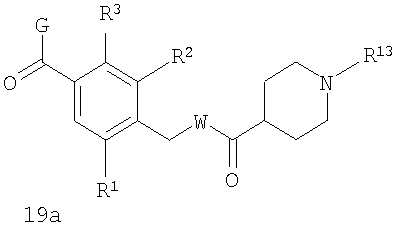
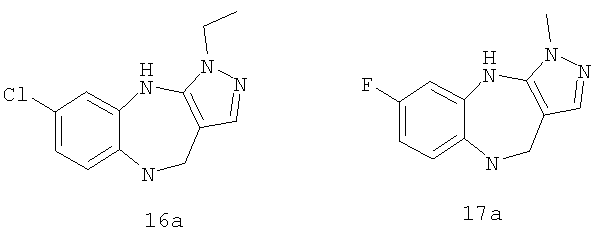
где G выбран из общих формул 7а-17а, и R13 представляет собой алкил.
В соответствии с одним из аспектов предпочтительно, чтобы R2 представлял собой Н и W представлял собой NH, как изображено в формуле 20а:
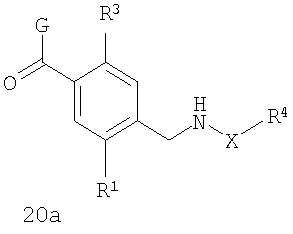
где R1 выбран из метила, хлора и фтора, и R3 представляет собой Н; или R1 представляет собой Н, и R3 выбран из метила, хлора и фтора; и G выбран из общих формул 7а-17а.
В соответствии с одним из аспектов предпочтительно, чтобы R2 представлял собой Н, W представлял собой NH и Х представлял собой С(=O), как изображено в формуле 21а:
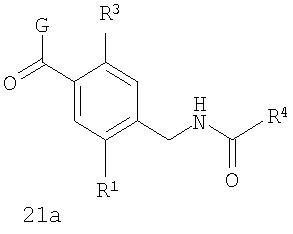
где R1 выбран из метила, хлора и фтора, и R3 представляет собой Н; или R1 представляет собой Н, и R3 выбран из метила, хлора и фтора; и R4 представляет собой алкил.
В соответствии с одним из аспектов предпочтительно, чтобы Х представлял собой С(=O), как изображено в формуле 22а:
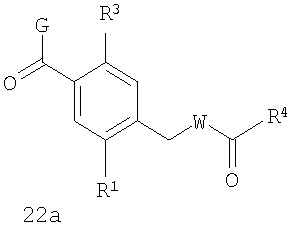
где G выбран из общих формул 7а-17а, и R4 представляет собой алкил. В соответствии с одним из аспектов предпочтительно, чтобы R2 и R3, оба, представляли собой Н, W представлял собой NH, и Х представлял собой С(=O), как изображено в формуле 23а:
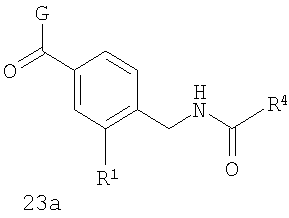
где G выбран из общих формул 9а, 10а, 15а, 16а и 17а, R1 выбран из метила, хлора и фтора и R4 представляет собой алкил.
В соответствии с одним из аспектов предпочтительно, чтобы R2 и R3, оба, представляли собой Н, R4 представлял собой пиперидин, где d представляет собой 2, и е представляет собой 2, W представляет собой NH, X представляет собой С(=O) и n представляет собой 0, как изображено в формуле 24а:
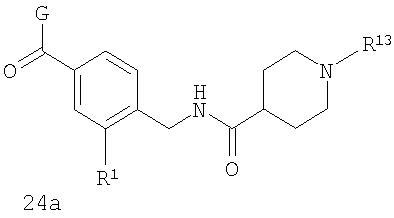
где G выбран из общих формул 9а, 10а, 15а, 16а и 17а, R1 выбран из метила, хлора и фтора и R13 представляет собой алкил.
В соответствии с одним из аспектов особенно предпочтительные соединения предложены в п.17.
В соответствии с одним из аспектов настоящее изобретение относится к соединениям по п.18. В соответствии с одним из аспектов кольцо, содержащее A3, А4 и А5 в соответствии с общими формулами 2b и 3b, замещено по меньшей мере в одной позиции алкилом, алкокси, F, Cl, Br, CN, NH2, NO2, NН(алкил) или N(алкил)2.
Соединения формулы 1b по п.18 подлежат следующим ограничениям. Когда кольцо, образованное А7, А8, А9, А10 и А11, является ароматическим, группы должны удовлетворять некоторым требованиям. Когда А10 представляет собой -СН=СН-, кольцо представляет собой шестичленное кольцо. Само по себе оно может включать только атомы, имеющие тип -C(R)= и -N=. Следовательно, А7 и А11, оба, должны представлять собой С, и А8 и А9 должны представлять собой СН или N. Когда А10 не представляет собой -СН=СН-, то кольцо представляет собой пятичленное кольцо. В этом случае один и только один из атомов в кольце должен представлять собой S или тригональный атом азота. В этом контексте "тригональный атом азота" представляет собой атом азота, ковалентно связанный с тремя различными атомами. Два из этих атомов представляют собой непосредственных соседей атома азота в пятичленном кольце. Третий представляет собой водород, углерод или другой атом, связанный с пятичленным кольцом. Таким образом, следует, что, когда А10 не представляет собой -СН=СН-, то один и только один из А7, А8, А9, А10 и А11 должен представлять собой S или тригональный атом азота. Следовательно, выбор А7, А8, А9, А10 и А11 подлежит следующим ограничениям. Если А10 не представляет собой -СН=СН-, то один из А8, А9 и А10 представляет собой NH, N-(CH2)d-R5 или S или один из А7 и А11 представляет собой N. Не более чем один из А8, А9 и А10 может представлять собой NH, N-(CH2)d-R5 или S. А7 и А11 одновременно не могут представлять собой N. Ни А7, ни А11 не может представлять собой N, если один из А8, А9 и А10 представляет собой NH, N-(CH2)d-R5 или S.
В соответствии с одним из аспектов особенно предпочтительные соединения предложены в п.30.
В соответствии с одним из аспектов настоящее изобретение относится к соединениям по п.31. Соединения формулы 1с по п.31 подлежат следующим ограничениям. Кольцо, образованное А7, А8, А9, А10 и А11, является ароматическим, и соответственно группы должны удовлетворять некоторым требованиям. Когда А10 представляет собой -СН=СН-, кольцо представляет собой шестичленное кольцо. Само по себе оно может включать только атомы, имеющие тип -C(R)=и -N=. Следовательно, А7 и А11, оба, должны представлять собой С, и А8 и А9 должны представлять собой СН или N. Когда А10 не представляет собой -СН=СН-, то кольцо представляет собой пятичленное кольцо. В этом случае один и только один из атомов в кольце должен представлять собой S или тригональный атом азота. В этом контексте "тригональный атом азота" представляет собой атом азота, ковалентно связанный с тремя различными атомами. Два из этих атомов представляют собой непосредственных соседей атома азота в пятичленном кольце. Третий представляет собой водород, углерод или другой атом, связанный с пятичленным кольцом. Таким образом, следует, что, когда А10 не представляет собой -СН=СН-, то один (и только один) из А7, А8, А9, А10 и А11 должен представлять собой S или тригональный атом азота. Следовательно, выбор А7, А8, А9, А10 и А11 подлежит следующим ограничениям. Если А10 не представляет собой -СН=СН-, то один из А8, А9 и А10 представляет собой NH, N-(CH2)c-R6 или S, или один из А7 и А11 представляет собой N. Не более чем один из А8, А9 и А10 может представлять собой NH, N-(CH2)c-R6 или S. А7 и А11 одновременно не могут представлять собой N. Ни А7, ни А11 не может представлять собой N, если один из А8, А9 и А10 представляет собой NH, N-(CH2)c-R6 или S.
В соответствии с одним из аспектов особенно предпочтительные соединения предложены в п.45.
В соответствии с одним из аспектов настоящее изобретение относится к соединениям по п.46. Соединения формулы 1d по п.46 подлежат следующим ограничениям. Кольцо, образованное А7, А8, А9, А10 и А11, является ароматическим, и соответственно группы должны удовлетворять некоторым требованиям. Когда А10 представляет собой -СН=СН-, кольцо представляет собой шестичленное кольцо. Само по себе оно может включать только атомы, имеющие тип -C(R)=и -N=. Следовательно, А7 и А11, оба, должны представлять собой С, и А8 и А9 должны представлять собой СН или N. Когда А10 не представляет собой -СН=СН-, то кольцо представляет собой пятичленное кольцо. В этом случае один и только один из атомов в кольце должен представлять собой S или тригональный атом азота. В этом контексте "тригональный атом азота" представляет собой атом азота, ковалентно связанный с тремя различными атомами. Два из этих атомов представляют собой непосредственных соседей атома азота в пятичленном кольце. Третий представляет собой водород, углерод или другой атом, связанный с пятичленным кольцом. Таким образом следует, что, когда А10 не представляет собой -СН=СН-, то один (и только один) из А7, А8, А9, А10 и А11 должен представлять собой S или тригональный атом азота. Следовательно, выбор А7, А8, А9, А10 и А11 подлежит следующим ограничениям. Если А10 не представляет собой -СН=СН-, то один из А8, А9 и А10 представляет собой NH, N-(CH2)c-R11 или S, или один из А7 и А11 представляет собой N. Не более чем один из А8, А9 и А10 может представлять собой NH, N-(CH2)c-R11 или S. А7 и А11 одновременно не могут представлять собой N. Ни А7, ни А11 не может представлять собой N, если один из А8, А9 и А10 представляет собой NH, N-(CH2)c-R11 или S.
В соответствии с одним из аспектов особенно предпочтительные соединения предложены в п.69.
Особенно предпочтительные соединения по изобретению представляют собой антагонисты рецептора V1a, обладающие высокой активностью.
В соответствии с одним из аспектов по меньшей мере одно из соединений, идентифицированных далее, не составляет часть настоящего изобретения: п.1 и пример 286 ([4-(4-Диметиламинобензилкарбамоил)-фенил]амид 3-пиридин-3-ил-4,5-дигидроизоксазол-5-карбоновой кислоты) в US 6583141; примеры 5 и 6 в WO 02/04403 (амид N-[4-(N-метил-N-фениламинокарбонил)фенилметил]-3-(4'-трифторметилбифенил-2-карбониламино)бензойной кислоты и амид N-[4-(N-метил-N-фениламинокарбонил)фенилметил]-3-(бифенил-2-карбониламино)бензойной кислоты); реферат, J. Org. Chem. USSR, vol.18, no.6, 1982, стр.1115-1119 (пара-(N,N-Диэтилкарбамоилокси)-N,N-диэтилбензамид); стр.3, 1. 16 - стр.4, 1. 11, примеры 1-4, 11 и 14-19 в WO 01/29005; стр.3, 1. 9 - стр.5, 1. 23, примеры 11, 28-31, 38 и 71-77 в WO 02/00626; и стр.3, 1. 1- стр.4, 1. 17, примеры 12-18 в WO 03/016316.
В соответствии с одним из аспектов изобретение относится к фармацевтической композиции, включающей соединение по изобретению в качестве активного агента.
Кроме того, изобретение относится к фармацевтическим композициям, включающим соединение по изобретению, которое применяют в качестве антагониста рецептора V1a, и такие композиции особенно полезны для медицинских показаний, таких как лечение дисменореи (первичной дисменореи и/или вторичной дисменореи), преждевременных родов, гипертензии, болезни Рэйно, отека головного мозга, болезни движения, гиперлипидемии, мелкоклеточного рака легкого, депрессии, тревоги, гипонатриемии, цирроза печени и застойной сердечной недостаточности.
Использование каких-либо эксципиентов будет зависеть от предполагаемой природы препарата, которая, в свою очередь, будет зависеть от предполагаемого пути введения. Введение может быть пероральным, в слизистые оболочки (таким как подъязычное, трансбуккальное, интраназальное, вагинальное и ректальное), трансдермальным или путем инъекции (такой как подкожная, внутримышечная и внутривенная). Как правило, предпочтительно пероральное введение. Для перорального введения препарат может представлять собой таблетку, капсулу или саше. Другие препараты включают сухие порошки, растворы, суспензии, суппозитории и т.п.
В соответствии с одним из аспектов изобретение относится к применению соединения по изобретению для приготовления лекарственного средства для лечения заболевания, выбранного из дисменореи (первичной дисменореи и/или вторичной дисменореи), преждевременных родов, гипертензии, болезни Рэйно, отека головного мозга, болезни движения, гиперлипидемии, мелкоклеточного рака легкого, депрессии, тревоги, гипонатриемии, цирроза печени и застойной сердечной недостаточности.
Соединения по настоящему изобретению могут быть полезны при лечении нескольких заболеваний, расстройств или состояний. Используемый здесь термин "лечение" относится к лечению для исцеления или облегчения симптомов заболевания, расстройства или состояния и к лечению для профилактики развития заболевания, расстройства или состояния. Лечение может быть проведено в остром или хроническом случае. Животное или человек, которых лечат, т.е. пациент, может представлять собой человека или любое млекопитающее, отличающееся от человека, нуждающееся в лечении по изобретению.
Введение композиций по настоящему изобретению, как правило, осуществляют под контролем лечащего врача. Лечащий врач определяет количество вводимой композиции и схему приема лекарственного средства, принимая во внимание физическое состояние пациента и терапевтические задачи.
Дополнительные аспекты изобретения относятся к способам лечения вышеупомянутых заболеваний, расстройств или состояний. В соответствии со способом по изобретению пациенту, нуждающемуся в таком лечении, вводят терапевтически эффективное количество соединения или описанной выше фармацевтической композиции. В соответствии с различными аспектами изобретение относится к способу лечения расстройства, выбранного из дисменореи (первичной дисменореи и/или вторичной дисменореи), преждевременных родов, гипертензии, болезни Рэйно, отека головного мозга, болезни движения, гиперлипидемии, мелкоклеточного рака легкого, депрессии, тревоги, гипонатриемии, цирроза печени и застойной сердечной недостаточности.
Термин "терапевтически эффективное количество" относится к количеству, которое приводит к желаемому терапевтическому эффекту. Терапевтически эффективное количество определяет лечащий врач с учетом всех соответствующих факторов. Как правило, разовая доза включает от 0,1 мг до 1000 мг, предпочтительно от 1 мг до 250 мг активного соединения по изобретению. Доза может быть введена разово или повторно. При повторном введении доза может быть введена с регулярными интервалами, такими как один раз, дважды или трижды в сутки, или по потребности в соответствии с состоянием, которое лечат.
Фармацевтическая композция по настоящему изобретению может быть представлена в любой форме, известной в области техники. Например, препарат может быть представлен в виде таблетки, капсулы, порошка, суппозитория, крема, раствора или суспензии, или в более сложной форме, такой как адгезионный пластырь. Препарат как правило включает один или более чем один эксципиент, такой как разбавитель, наполнитель, связывающий агент, диспергирующий агент, растворитель, консервант, корригент и т.п. Также препарат может включать одну или более чем одну дополнительную фармакологически активную частицу. Предпочтительно препарат не включает такие дополнительные активные агенты.
Когда композиции по настоящему изобретению применяют в качестве терапевтических агентов, они могут быть введены при помощи любого подходящего пути, известного в области техники. Например, они могут быть введены пероральным, трансбуккальным, подъязычным, ректальным, внутривагинальным, назальным, внутрилегочным или трансдермальным путем. Альтернативно они могут быть введены путем инъекции, включающей внутривенную, подкожную и внутримышечную инъекцию.
Соединения по настоящему изобретению могут быть получены с использованием стандартных химических манипуляций. Они описаны подробно в WO 03/016316 А1, стр.12-17. (Hudson, P.J. et al., "Diazacycloalkanes as Oxytocin Agonists").
Следующие примеры следует рассматривать в качестве дающих возможность, но не ограничивающих изобретение.
Примеры
Использованы следующие сокращения:
В Примерах Е1-Е125 описан синтез промежуточных соединений и соединений по настоящему изобретению. В Примере А описано, каким образом могут быть проанализированы соединения, основываясь на их способности ингибировать клеточные следствия стимуляции интактных клеток аргинин-вазопрессином (AVP). В Примере Б описаны таблетки для перорального введения, включающие соединение по изобретению.
Пример Е1
6-Хлор-3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен
Пример Е1.1
Этиловый эфир 5-(4-хлор-2-нитрофениламино)-1-метил-1Н-пиразол-4-карбоновой кислоты
Гидрид натрия (60% дисперсия в масле, 7,28 г, 180 ммоль) порциями при 0°С добавляли к раствору этил 5-амино-1-метилпиразол-4-карбоксилата (21,8 г, 148 ммоль) в безводном ТГФ. Смеси давали возможность нагреться до комнатной температуры и перемешивали в течение 1 ч. По каплям добавляли раствор 4-хлор-2-фторнитробензола (22,6 г, 129 ммоль) в безводном ТГФ (50 мл). Получающийся в результате темно-пурпурный раствор перемешивали при комнатной температуре в течение 18 ч, затем выливали в охлажденную на льду 1 н. соляную кислоту. Получающуюся в результате смесь экстрагировали дихлорметаном (200 мл × 2), и объединенные органические экстракты промывали рассолом и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 60% петролейный эфир:40% EtOAc) с получением указанного в заголовке соединения (27,5 г, 62%).
Пример Е1.2
Этиловый эфир 5-(2-амино-4-хлорфениламино)-1-метил-1Н-пиразол-4-карбоновой кислоты
Цинковый порошок (26,17 г, 400 ммоль) при комнатной температуре добавляли к суспензии этилового эфира 5-(4-хлор-2-нитрофениламино)-1-метил-1Н-пиразол-4-карбоновой кислоты из Примера Е1.1 (26,0 г, 80 ммоль) в метанол/уксусная кислота (10:1, 330 мл). После прохождения экзотермической реакции получающуюся в результате суспензию перемешивали при комнатной температуре в течение 18 ч перед фильтрацией через фильтрующий агент Celite®. Фильтрат концентрировали в вакууме. Остаток растворяли в EtOAc и раствор промывали насыщенным NaHCO3 и рассолом и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 65% EtOAc:35% петролейный эфир до 80% EtOAc:20% петролейный эфир) с получением указанного в заголовке соединения (18,41 г, 78,0%).
Пример Е1.3
6-Хлор-3-метил-4,9-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-10-он
(Метилсульфинил)метанид натрия (53,4 ммоль) получали из гидрида натрия (60% дисперсия в масле, 2,14 г, 53,4 ммоль) и безводного диметилсульфоксида (35 мл) путем нагревания при 65°С до появления раствора. К нему добавляли раствор этилового эфира 5-(2-амино-4-хлорфениламино)-1-метил-1H-пиразол-4-карбоновой кислоты из Примера Е1.2 (9,02 г, 30,5 ммоль) в безводном диметилсульфоксиде (20 мл) и перемешивание продолжали при 65°С в течение 30 мин. Смесь выливали в лед (200 мл) и получающееся в результате твердое вещество собирали и очищали путем перекристаллизации из метанол/EtOAc с получением указанного в заголовке соединения (5,56 г, 73,3%).
Пример Е1.4
6-Хлор-3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен
К суспензии 6-хлор-3-метил-4,9-дигидро-3Н-2,3,4,9-тетраазабензо-[f]азулен-10-она из Примера Е1.3 (5,56 г, 22,4 ммоль) в безводном ТГФ (200 мл) при 0°С добавляли алюмогидрид лития (4,24 г, 112 ммоль) и получающуюся в результате суспензию кипятили с обратным холодильником в течение 18 ч, затем давали возможность охладиться до комнатной температуры. Добавляли дополнительную порцию алюмогидрида лития (4,24 г, 112 ммоль) и смесь кипятили с обратным холодильником в течение 18 ч. Смесь охлаждали до 0°С, по каплям в течение 15 мин добавляли 35% раствор аммиака (10 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. Получающуюся в результате суспензию фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 0,5% 35% аммиак:5% метанол:дихлорметан) с получением указанного в заголовке соединения (3,88 г, 74%).
Пример Е2
3,6-Диметил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен
Пример Е2.1
Этиловый эфир 1-метил-5-(4-метил-2-нитросрениламино)-1H-пиразол-4-карбоновой кислоты
Гидрид натрия (60% дисперсия в масле, 7,28 г, 180 ммоль) порциями при 0°С добавляли к раствору этил 5-амино-1-метилпиразол-4-карбоксилата (21,8 г, 148 ммоль) в безводном ТГФ. Смеси давали возможность нагреться до комнатной температуры и перемешивали в течение 1 ч, затем по каплям добавляли раствор 3-фтор-4-нитротолуола (20 г, 129 ммоль) в безводном ТГФ (50 мл). Получающийся в результате темно-пурпурный раствор перемешивали при комнатной температуре в течение 18 ч, затем выливали в охлажденную на льду 1 н. соляную кислоту. Получающуюся в результате смесь экстрагировали дихлорметаном (200 мл × 2) и объединенные органические экстракты промывали рассолом и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 60% петролейный эфир:40% EtOAc) с получением указанного в заголовке соединения (28,00 г, 61%).
Пример Е2.2
Этиловый эфир 5-(2-амино-4-метилфениламино)-1-метил-1Н-пиразол-4-карбоновой кислоты
Хлорид олова (II) (86,65 г, 457,0 ммоль) добавляли к раствору этилового эфира 1-метил-5-(4-метил-2-нитрофениламино)-1H-пиразол-4-карбоновой кислоты из Примера Е2.1 (28,00 г, 91,4 ммоль) в метаноле и смесь кипятили с обратным холодильником в течение 3 дней. Растворитель удаляли в вакууме и остаток суспендировали в EtOAc (400 мл) и охлаждали до 0°С. 35% Раствор аммиака добавляли до рН 14 и смесь перемешивали в течение 15 мин перед фильтрацией через фильтрующий агент Celite®. Фильтрат промывали 2М NН3 и рассолом и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; от 6% метанол:94% дихлорметан до 10% метанол:90% дихлорметан) с получением указанного в заголовке соединения (12,8 г, 52%).
Пример Е2.3
3,6-Диметил-4,9-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-10-он
(Метилсульфинил)метанид натрия (22,7 ммоль) получали из гидрида натрия (60% дисперсия в масле, 912 мг, 22,7 ммоль) и безводного диметилсульфоксида (5,5 мл) путем нагревания при 65°С до появления раствора. К нему добавляли раствор этилового эфира 5-(2-амино-4-метилфениламино)-1-метил-1H-пиразол-4-карбоновой кислоты из Примера Е2.2 (3,56 г, 13,0 ммоль) в безводном диметилсульфоксиде (10 мл) и перемешивание продолжали при 65°С в течение 30 мин. Смесь затем выливали в лед (200 мл), получающееся в результате твердое вещество собирали и очищали путем флэш-хроматографии на силикагеле (элюент; 10% метанол:90% дихлорметан) с получением указанного в заголовке соединения (1,12 г, 38%).
Пример Е2.4
3,6-Диметил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен
К суспензии 3,6-диметил-4,9-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-10-она из Примера Е2.3 (2,35 г, 10,3 ммоль) в безводном ТГФ (100 мл) при 0°С добавляли алюмогидрид лития (1,56 г, 41,2 ммоль) и получающуюся в результате суспензию кипятили с обратным холодильником в течение 18 ч, затем давали возможность охладиться до комнатной температуры. Добавляли дополнительную порцию алюмогидрида лития (781 мг, 20,6 ммоль) и смесь кипятили с обратным холодильником в течение 3 ч. Смесь охлаждали до 0°С, по каплям в течение 15 мин добавляли 35% раствор аммиака (10 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. Получающуюся в результате суспензию фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 10% метанол:90% дихлорметан) с получением указанного в заголовке соединения (1,60 г, 72%).
Примеры Е2а-g описаны в WO 03/016316 A1, (Hudson, P. et al. "Diazacycloalkanes as Oxytocin Agonists"), стр.26-31.
Пример E2h
4-(трет-Бутоксикарбониламинометил)-3-метилбензойная кислота
Пример E2h.1
Метиловый эфир 4-циано-3-метилбензойной кислоты
Смесь 4-циано-3-метилбензойная кислоты из Примера E2d (1,5 г, 9,3 ммоль) и тионилхлорида (5 мл, 68,5 ммоль) в дихлорметане (20 мл) кипятили с обратным холодильником в течение 2 ч, затем растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток перерастворяли в дихлорметане (25 мл). Добавляли метанол (10 мл) и раствор перемешивали при комнатной температуре в течение 2 ч, затем концентрировали в вакууме. Остаток перерастворяли в EtOAc, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (1,6 г, 100%).
Пример Е2h.2
Метиловый эфир 4-аминометил-3-метилбензойной кислоты
Раствор метилового эфира 4-циано-3-метилбензойной кислоты из Примера E2h.1 (1,6 г, 9,3 ммоль) в метаноле (50 мл) до 0°С обрабатывали гексагидратом хлорида кобальта (II) (5,1 г, 18,6 ммоль). Смесь перемешивали в течение 15 мин при комнатной температуре, затем порциями добавляли боргидрид натрия (3,5 г, 93 ммоль). Реакционную смесь перемешивали в течение 90 мин, затем по каплям добавляли концентрированный NН3 (5 мл). Смесь нагревали до комнатной температуры в течение 30 мин, фильтровали через фильтрующий агент Celite®, промывали метанолом и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 1% 35% аммиак:10% метанол:89% дихлорметан) с получением указанного в заголовке соединения (670 мг, 37%).
Пример Е2h.3
Метиловый эфир 4-(трет-бутоксикарбониламинометил)-3-метилбензойной кислоты
Ди-трет-бутил дикарбонат (900 мг, 4,1 ммоль) при комнатной температуре добавляли к раствору метилового эфира 4-аминометил-3-метилбензойной кислоты из Примера Е2h.2 (670 мг, 3,7 ммоль) в дихлорметане (50 мл) и триэтиламине (до рН 9). Смесь перемешивали в течение 1 ч, затем концентрировали в вакууме. Остаток перерастворяли в EtOAc, промывали 0,3 н. KHSO4, затем рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (1,04 г, 100%).
Пример Е2h.4
4-(трет-Бутоксикарбониламинометил)-3-метилбензойная кислота
Метиловый эфир 4-(трет-бутоксикарбониламинометил)-3-метилбензойной кислоты из Примера Е2h.3 (1,04 г, 3,7 ммоль) растворяли в диоксане (20 мл). Добавляли 1 н. раствор NaOH (5,6 мл, 5,6 ммоль) и смесь перемешивали в течение 18 ч при комнатной температуре, затем концентрировали в вакууме. Остаток перерастворяли в EtOAc, промывали 1 н. КНSО4, затем рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (800 мг, 81%).
Пример Е3
4-(трет-Бутоксикарбониламинометил)-3-фторбензойная кислота
Пример Е3.1
Метиловый эфир 3-фтор-4-метилбензойной кислоты
Тионилхлорид (9,62 г, 81 ммоль) добавляли к раствору 3-фтор-4-метилбензойной кислоты (5,0 г, 32,4 ммоль) в толуоле (50 мл). Смесь перемешивали при комнатной температуре в течение 1,5 ч и кипятили с обратным холодильником в течение 3 ч. Растворитель удаляли в вакууме и остаток суспендировали в метаноле (30 мл) и CH2Cl2 (30 мл) и перемешивали в течение 18 ч. Смесь упаривали в вакууме и остаток суспендировали в EtOAc (50 мл), промывали насыщенным раствором NаНСО3 (3×75 мл), сушили и упаривали в вакууме с получением указанного в заголовке соединения (4,5 г, 83%).
Пример Е3.2
Метиловый эфир 4-бромметил-3-фторбензойной кислоты
Метиловый эфир 3-фтор-4-метилбензойной кислоты из Примера Е3.1 (4,5 г, 26,6 ммоль) растворяли в тетрахлориде углерода (150 мл). Добавляли AIBN (457 мг, 2,7 ммоль) и N-бромсукцинимид (5,2 г, 29,3 ммоль) и смесь кипятили с обратным холодильником в течение 18 ч. Смеси давали возможность охладиться и добавляли дополнительные порции AIBN (457 мг, 2,7 ммоль) и N-бромсукцинимида (5,2 г, 29,3 ммоль). Смесь кипятили с обратным холодильником в течение 56 ч. Смеси давали возможность охладиться и упаривали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 10% EtOAc:90% петролейный эфир) с получением указанного в заголовке соединения (2,7 г, 41%).
Пример Е3.3
Метиловый эфир 4-азидометил-3-фторбензойной кислоты
Азид натрия (609 мг) добавляли к раствору метилового эфира 4-бромметил-3-фторбензойной кислоты из Примера Е3.2 (2,1 г, 8,5 ммоль) в ДМФ (30 мл). Смесь перемешивали в течение 18 ч, разбавляли EtOAc, промывали водой и рассолом и концентрировали в вакууме с получением бесцветного масла, идентифицированного как указанное в заголовке соединение (1,8 г, 100%).
Пример Е3.4
Метиловый эфир 4-аминометил-3-фторбензойной кислоты
Водород в течение 2 ч пропускали через дегазированный раствор метилового эфира 4-азидометил-3-фторбензойной кислоты из Примера Е3.3 (2,11 г, 10 ммоль) в метаноле, содержащем 10% палладий на углероде. Реакционную смесь фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме с получением бесцветного масла, идентифицированного как указанное в заголовке соединение (1,51 г, 83%).
Пример Е3.5
Метиловый эфир 4-(трет-бутоксикарбониламинометил)-3-фторбензойной кислоты
К раствору метилового эфира 4-аминометил-3-фторбензойной кислоты из Примера Е3.4 (1,5 г, 8,2 ммоль) в дихлорметане (20 мл) добавляли ди-трет-бутилдикарбонат (2,3 г, 11 ммоль) и триэтиламин (1,4 мл, 10 ммоль). Смесь перемешивали в течение 18 ч, промывали 0,3М KHSO4 и рассолом и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 10% EtOAc:90% петролейный эфир) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (1,4 г, 60%).
Пример Е3.6
4-(трет-Бутоксикарбониламинометил)-3-фторбензойная кислота
К раствору метилового эфира 4-(трет-бутоксикарбониламинометил)-3-фторбензойной кислоты из Примера Е3.5 (640 мг, 2,25 ммоль) в диоксане (40 мл) добавляли 1 н. NaOH (4,5 мл, 4,5 ммоль). Смесь перемешивали в течение 18 ч, разбавляли EtOAc, промывали 1 н. КНSО4, водой и рассолом и концентрировали в вакууме с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (608 мг, 100%).
Пример Е4
Дигидрохлорид 1-(3,3-диметилбутил)пиперазина
Пример Е4.1
трет-Бутиловый эфир 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты
К раствору 1-бок-пиперазина (8,19 г, 43,9 ммоль) в метанол/уксусная кислота (99:1, об./об., 100 мл) добавляли 3,3-диметилмасляный альдегид (4,0 г, 40,0 ммоль) и получающуюся в результате смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли цианоборгидрид натрия (3,27 г, 51,9 ммоль) и получающуюся в результате смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали в вакууме. Остаток растворяли в EtOAc и получающуюся в результате раствор промывали насыщенным NаНСО3, водой и рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 5% метанол: 95% EtOAc) с получением указанного в заголовке соединения (9,1 г, 84%).
Пример Е4.2
Дигидрохлорид 1-(3,3-диметилбутил)пиперазина
Раствор трет-бутилового эфира 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты из Примера Е4.1 (9,1 г, 31,8 ммоль) в метаноле (100 мл) обрабатывали 4 н. HCl/диоксан (100 мл) и смесь перемешивали при комнатной температуре в течение 30 мин, затем концентрировали в вакууме. Остаток растирали с диэтиловым эфиром и получающееся в результате твердое вещество перекристаллизовывали из метанол/диэтиловый эфир с получением дигидрохлорида 1-(3,3-диметилбутил)пиперазина (7,4 г, 90%).
Пример Е5
2-Метил-1,4,5,6-тетрагидро-1,3,6-триазабензо[е]азулен
Пример Е5.1
Метиловый эфир 2-(толуол-4-сульфониламино)бензойной кислоты
Метилантранилат (110 г, 0,73 моль) при 0°С растворяли в дихлорметане (1 литр) и добавляли триэтиламин (115 мл, 0,8 моль). Порциями при 0°С добавляли тозилхлорид (133 г, 0,745 моль). Реакционную смесь перемешивали в течение 30 мин при 0°С и в течение 64 ч при комнатной температуре. Смесь концентрировали в вакууме. Остаток растворяли в EtOAc и органический слой промывали 5% раствором КНСО3 (водн.), 1 н. раствором HCl и рассолом, сушили, фильтровали и концентрировали в вакууме. Остаток кристаллизовали из EtOAc/гексан с получением указанного в заголовке соединения (181 г, 81%).
Пример Е5.2
Метиловый эфир 2-[(3-этоксикарбонилпропил)-(толуол-4-сульфонил)амино]бензойной кислоты
Метиловый эфир 2-(толуол-4-сульфониламино)бензойной кислоты из Примера Е5.1 (100 г) растворяли в ДМФ (250 мл). Добавляли карбонат калия (125 г) и этил 4-бромбутаноат (60 г) и смесь нагревали при 80°С в течение 18 ч. Смесь охлаждали до комнатной температуры, фильтровали и концентрировали в вакууме. Остаток распределялся между хлороформом и 1М раствором HCl. Водный слой экстрагировали хлороформом. Органический слои объединяли, промывали рассолом, сушили, фильтровали и концентрировали в вакууме. Вещество кристаллизовали из EtOAc/гексан и сушили в вакуумной печи при 60°С в течение 3 часов с получением указанного в заголовке соединения (98,6 г, 72%).
Пример Е5.3
Метиловый эфир 5-гидрокси-1-(толуол-4-сульфонил)-2,3-дигидро-1Н-бензо[b]азепин-4-карбоновой кислоты и этиловый эфир 5-гидрокси-1-(толуол-4-сульфонил)-2,3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты
Метиловый эфир 2-[3-этоксикарбонилпропил)-(толуол-4-сульфонил)амино]бензойной кислоты из Примера Е5.2 (98,6 г, 0,235 моль) суспендировали в теплом толуоле (600 мл) и добавляли по каплям к смеси трет-бутоксида калия (40 г) в толуоле (1 литр), дефлегмируя в условиях Дин-Старка. Смесь кипятили с обратным холодильником в условиях Дин-Старка в течение еще 1 ч и охлаждали до комнатной температуры. Ее разбавляли EtOAc (500 мл) и промывали 1М раствором HCl, насыщенным NаНСО3 (водн.) и рассолом. Органический слой сушили, фильтровали и концентрировали в вакууме. Остаток осаждали из EtOAc/гексан и сушили в вакуумной печи с получением смеси метилового эфира 5-гидрокси-1-(толуол-4-сульфонил)-2,3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты и этиловым эфиром 5-гидрокси-1-(толуол-4-сульфонил)-2,3-дигидро-1Н-бензо[b]азепин-4-карбоновой кислоты (53,5 г).
Пример Е5.4
1-(Толуол-4-сульфонил)-1,2,3,4-тетрагидробензо[b]азепин-5-он
Смесь метилового эфира 5-гидрокси-1-(толуол-4-сульфонил)-2,3-дигидро-1Н-бензо[b]азепин-4-карбоновой кислоты и этилового эфира 5-гидрокси-1-(толуол-4-сульфонил)-2,3-дигидро-1Н-бензо[b]азепин-4-карбоновой кислоты из Примера Е5.3 в течение 18 ч кипятили с обратным холодильником в смесь этанола (100 мл), уксусной кислоты (300 мл), концентрированной HCl (100 мл) и воды (50 мл). Смесь охлаждали до комнатной температуры, разбавляли водой (800 мл) и экстрагировали хлороформом. Объединенные органические экстракты сушили, фильтровали и концентрировали в вакууме. Остаток дважды кристаллизовали из метанола с получением указанного в заголовке соединения (44 г, 60% после двух стадий).
Пример Е5.5
1,2,3,4-Тетрагидробензо[b]азепин-5-он
Полифосфорную кислоту (25 г) нагревали при 100°С в атмосфере азота, до тех пор пока не стало возможным ее перемешивать. 1-(Толуол-4-сульфонил)-1,2,3,4-тетрагидробензо[b]азепин-5-он из Примера Е5.4 (2,6 г, 8,26 ммоль) добавляли порциями и реакционную смесь нагревали при 100°С в течение 1,5 ч. Ее выливали в лед и подкисляли 2М NaOH (водн.). Водный слой дважды экстрагировали дихлорметаном. Органические экстракты объединяли, промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 40% EtOAc: 60% гексан) с получением указанного в заголовке соединения (1,05 г, 79%).
Пример Е5.6
1-Бензоил-1,2,3,4-тетрагидробензо[b]азепин-5-он
1,2,3,4-Тетрагидробензо[b]азепин-5-он из Примера Е5.5 (480 мг, 2,98 ммоль) растворяли в смеси дихлорметана (30 мл) и триэтиламина (1,3 мл). Добавляли бензоилхлорид (0,46 г, 3,28 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 2 ч. Смесь охлаждали и концентрировали в вакууме. Остаток растворяли в EtOAc и промывали 1М KHSO4 (водн.), водой и рассолом. Органический слой сушили, фильтровали и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 50% EtOAc: 50% гексан) с получением указанного в заголовке соединения (440 мг, 56%).
Пример Е5.7
1-Бензоил-4-бром-1,2,3,4-тетрагидробензо[b]азепин-5-он
1-Бензоил-1,2,3,4-тетрагидробензо[b]азепин-5-он из Примера Е5.6 (54,2 г, 205 ммоль), N-бромсукцинимид (3,6 г, 20,4 ммоль) и бром (11,1 мл, 214,7 ммоль) растворяли в дихлорметане (1,0 литр). По каплям в течение 30 минут добавляли триэтиламин (30 мл, 215 ммоль), затем реакционную смесь кипятили с обратным холодильником в течение 4 часов. Добавляли дополнительное количество брома (1,1 мл, 21,5 ммоль) и триэтиламина (3,0 мл, 21,5 ммоль) и реакционную смесь кипятили с обратным холодильником в течение еще 4 часов. Вновь добавляли дополнительное количество брома (1,1 мл, 21,5 ммоль) и триэтиламина (3,0 мл, 21,5 ммоль) и реакционную смесь кипятили с обратным холодильником в течение еще 4 часов. После охлаждения до комнатной температуры реакционный раствор промывали 5% водным раствором метабисульфата натрия (150 мл) и водную фазу разбавляли водой (600 мл). Органическую фазу отделяли, промывали насыщенным NаНСО3 (водн.), сушили над сульфатом натрия и фильтровали. Фильтрат разбавляли EtOAc (100 мл), фильтровали через слой диоксида кремния (элюент; CH2Cl2) и концентрировали в вакууме с получением указанного в заголовке соединения (73,6 г), которое использовали без дополнительной очистки.
Пример Е5.8
6-Бензоил-2-метил-1,4,5,6-тетрагидро-1,3,6-триазабензо[e]азулен
1-Бензоил-4-бром-1,2,3,4-тетрагидробензо[b]азепин-5-он (67,5 г, 200 ммоль) из Примера Е5.7, гидрохлорид ацетамидина (92,7 г, 980 ммоль) и карбонат калия (136,0 г, 980 ммоль) суспендировали в ацетонитриле (2,0 литра) и кипятили с обратным холодильником в течение 17 ч в атмосфере азота. Добавляли дополнительное количество гидрохлорида ацетамидина (18,5 г, 200 ммоль) и карбоната калия (27,7 г, 200 ммоль) и реакционную смесь кипятили с обратным холодильником в течение еще 6 ч. Вновь добавляли дополнительное количество гидрохлорида ацетамидина (18,5 г, 200 ммоль) и карбоната калия (27,7 г, 200 ммоль) и реакционную смесь кипятили с обратным холодильником в течение еще 6 ч. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат концентрировали в вакууме. Остаток суспендировали в дихлорметане (1,4 литра), промывали водой (500 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенные продукты очищали путем флэш-хроматографии на силикагеле (элюент; 45% EtOAc: 45% ацетонитрил: 10% метанол) с получением указанного в заголовке соединения (26,7 г, 34%) и 6-бензоил-2-метил-5,6-дигидро-4Н-1-окса-3,6-диазабензо[е]азулена (3,3 г, 4%).
Пример Е5.9
2-Метил-1,4,5,6-тетрагидро-1,3,6-триазабензо[e]азулен
6-Бензоил-2-метил-1,4,5,6-тетрагидро-1,3,6-триазабензо[е]азулен из Примера Е5.8 (160 мг, 0,53 ммоль) растворяли в 6М растворе HCl/диоксан (50 мл) и кипятили с обратным холодильником в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Остаток распределялся между EtOAc и насыщенным NaHCO3 (водн.) и слои разделяли. Органический слой промывали рассолом, сушили, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения (69 мг, 66%).
Пример Е5а
1-Бензил-2-метил-1,4,5,6-тетрагидро-1,3,6-триазабензо[е]азулен
Пример Е5а.1
(1-Бензил-2-метил-4.5-дигидро-1Н-1,3,6-триазабензоГе]азулен-6-ил)фенилметанон
Гидрид натрия (60% дисперсия в масле, 905 мг, 22,5 ммоль) помещали в безводный ТГФ (200 мл) и охлаждали до 0°С. По каплям добавляли 6-бензоил-2-метил-1,4,5,6-тетрагидро-1,3,6-триазабензо[е]азулен из Примера Е5.8 (4,9 г, 16,1 ммоль) и смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли бензилбромид (2,31 мл, 19,3 ммоль) и йодид калия (1,34 г, 8,0 ммоль) и смесь перемешивали в течение 16 ч. Раствор разбавляли EtOAC, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc) с получением указанного в заголовке соединения (5,73 г, 90%).
Пример Е5а.2
1-Бензил-2-метил-1,4,5,6-тетрагидро-1,3,6-триазабензо[е]азулен
(1-Бензил-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-ил)фенилметанон из Примера Е5а.1 (5,73 г, 14,6 ммоль) помещали в метанол (50 мл) и добавляли 6М водный раствор HCl (200 мл). Реакционную смесь кипятили с обратным холодильником в течение 18 ч, затем концентрировали в вакууме. Остаток растворяли в дихлорметане, подкисляли насыщенным NаНСО3, затем промывали рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (3,30 г, 78%).
Пример Е6
2-Метил-5,6-дигидро-4Н-1-окса-3,6-диазабензо[е]азулен
6-Бензоил-2-метил-5,6-дигидро-4H-1-окса-3,6-диазабензо[е]азулен из Примера Е5.8 (1,0 г, 3,25 ммоль) приводили в реакцию с 6М раствором HCl/диоксан (100 мл) с использованием способа, аналогичного описанному для Примера Е5.9, с получением указанного в заголовке соединения (540 мг, 82%).
Пример Е7
2-Метил-5,6-дигидро-4H-3-тиа-1,6-диазабензо[е]азулен
Пример Е7.1
(2-Метил-4,5-дигидро-3-тиа-1,6-диазабензо[е]азулен-6-ил)фенилметанон
К раствору 1-бензоил-4-бром-1,2,3,4-тетрагидробензо[b]азепин-5-она (1,0 г, 2,9 ммоль) из Примера Е5.7 в этаноле (50 мл) добавляли тиоацетамид (0,75 г, 10 ммоль). Раствор перемешивали в течение 16 ч. Получающуюся в результате суспензию уменьшали в объеме путем упаривания и охлаждали. Осадок собирали путем фильтрации и твердое вещество промывали охлжденным этанолом и сушили с получением указанного в заголовке соединения в виде белого твердого вещества (0,65 г, 70%).
Пример Е7.2
2-Метил-5,6-дигидро-4H-3-тиа-1,6-диазабензо[е]азулен
Суспензию (2-метил-4,5-дигидро-3-тиа-1,6-диазабензо[е]азулен-6-ил)фенилметанона из Примера Е7.1 (0,42 г, 1,3 ммоль) в 6М соляной кислоте (45 мл) кипятили с обратным холодильником в течение 16 ч. Раствор охлаждали и обрабатывали насыщенным NаНСО3 (водн.) (100 мл). Добавляли дополнительное количество твердого NаНСО3 до тех пор, пока раствор не станет основным. Смесь экстрагировали дихлорметаном и органические экстракты сушили и концентрировали в вакууме с получением указанного в заголовке соединения в виде желтого масла (0,21 г, 76%).
Пример Е8
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламид 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты
Пример Е8.1
трет-Бутиловый эфир [4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]карбаминовой кислоты
Раствор 4-(трет-бутоксикарбониламинометил)-3-фторбензойной кислоты из Примера Е3.1 (538 мг, 2,0 ммоль) и DMAP (220 мг, 1,8 ммоль) в дихлорметане (20 мл) при комнатной температуре обрабатывали DIEA (0,93 мл, 5,4 ммоль) и WSCD (460 мг, 2,4 ммоль) и получающуюся в результате раствор перемешивали при комнатной температуре в течение 1 ч. Добавляли 3,6-диметил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен из Примера Е2 (385 мг, 1,8 ммоль) и получающийся в результате раствор кипятили с обратным холодильником в течение 20 ч и давали возможность охладиться до комнатной температуры. Раствор разбавляли дихлорметаном, промывали насыщенным NаНСО3 и рассолом и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент 10% метанол:90% дихлорметан) с получением указанного в заголовке соединения (265 мг, 32%).
Пример Е8.2
Гидрохлорид (4-аминометил-3-фторфенил)-(3,6-диметил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона
трет-Бутиловый эфир [4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]карбаминовой кислоты из Примера Е8.1 (237 мг, 0,51 ммоль) приводили в реакцию с 4 н. HCl/диоксан с использованием способа, аналогичного описанному для Примера Е4.2, с получением указанного в заголовке соединения (205 мг, 100%).
Пример Е8.3
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламид 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты
DIEA (0,10 мл, 0,60 ммоль) и 1,1'-карбонилдиимидазол (28 мг, 0,17 ммоль) добавляли к раствору гидрохлорида (4-аминометил-3-фторфенил)-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е8.2 (57 мг, 0,14 ммоль) в ДМФ (5,0 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. Добавляли дигидрохлорид 1-(3,3-диметилбутил)пиперазина из Примера Е4 (38 мг, 0,16 ммоль) и смесь перемешивали при комнатной температуре в течение 24 ч и концентрировали в вакууме. Остаток растворяли в EtOAc и получающуюся в результате раствор промывали рассолом и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 10% метанол:90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (45 мг, 56%).
Пример Е9
4-(трет-Бутоксикарбониламинометил)циклогексанкарбоновая кислота
К раствору 4-аминометилциклогексанкарбоновой кислоты (20,0 г, 127,39 ммоль) в диоксане (400 мл) добавляли 1 н. КНСО3 (300 мл, 300 ммоль) и ди-трет-бутил дикарбонат (33,3 г, 129,57 ммоль). Смесь перемешивали в течение 18 ч и концентрировали в вакууме. Водный остаток промывали простым эфиром, затем подкисляли 1 н. KHSO4 и экстрагировали EtOAc (×3). Объединенные органические экстракты промывали водой и рассолом и концентрировали в вакууме с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (31,9 г, 98%).
Пример Е10
[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амид циклопропанкарбоновой кислоты
Пример Е10.1
трет-Бутиловый эфир [4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]карбаминовой кислоты
Раствор 4-(трет-бутоксикарбониламинометил)циклогексанкарбоновой кислоты из Примера Е9 (510 мг, 2,0 ммоль) в дихлорметане (25 мл) при комнатной температуре обрабатывали DIEA (0,70 мл, 4,0 ммоль), бром-трис-пирролидинофосфоний гексафторфосфатом (РуВrор) (2,40 г, 5,1 ммоль) и 6-хлор-3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азуленом из Примера Е1 (422 мг, 1,8 ммоль) и получающийся в результате раствор кипятили с обратным холодильником в течение 20 ч и давали возможность охладиться до комнатной температуры. Раствор разбавляли дихлорметаном, промывали рассолом и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент EtOAc) с получением указанного в заголовке соединения (775 мг, 91%).
Пример Е10.2
Гидрохлорид (4-Аминометилциклогексил)-(6-хлор-3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона
Раствор трет-бутилового эфира [4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]карбаминовой кислоты из Примера Е10.1 (775 мг, 1,63 ммоль) приводили в реакцию с 4 н. HCl/диоксан с использованием способа, аналогичного описанному для Примера Е4.2, с получением указанного в заголовке соединения (655 мг, 100%).
Пример Е10.3
[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амид циклопропанкарбоновой кислоты
DIEA (0,50 мл, 2,90 ммоль) и циклопропанкарбонилхлорид (0,045 мл, 0,50 ммоль) добавляли к раствору гидрохлорида (4-аминометилциклогексил)-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е10.2 (220 мг, 0,53 ммоль) в дихлорметане (5 мл). Смесь перемешивали в течение 2 ч, затем разбавляли дихлорметаном, промывали водой и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак/10% метанол/90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (132 мг, 60%).
Пример Е11
3-Метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен
Пример Е11.1
Этиловый эфир 1-метил-5-(2-нитрофениламино)-1H-пиразол-4-карбоновой кислоты
Гидрид натрия (60% дисперсия в масле, 7,0 г, 170 ммоль) порциями при 0°С добавляли к суспензии этилового эфира 5-амино-1-метил-1H-пиразол-4-карбоновой кислоты (21,1 г, 125 ммоль) в безводном ТГФ (300 мл). Смеси давали возможность нагреться до комнатной температуры и перемешивали в течение 0,75 ч, затем охлаждали до 0°С.Добавляли 1-фтор-2-нитробензол (17,6 г, 125 ммоль) и получающююся в результате суспензия перемешивали при комнатной температуре в течение 18 ч. Добавляли EtOAc и 0,3М KHSO4 и разделяли. Водный слой экстрагировали EtOAc и объединенные органические слои промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент 50% гексаны/50% этилацетат) с получением указанного в заголовке соединения (20,8 г, 58%).
Пример Е11.2
Этиловый эфир 5-(2-аминофениламино)-1-метил-1Н-пиразол-4-карбоновой кислоты
Этиловый эфир 1-метил-5-(2-нитрофениламино)-1Н-пиразол-4-карбоновой кислоты (20,8 г, 72 ммоль) из Примера Е11.1 растворяли в метаноле (330 мл) и гидрировали над 10% Pd/C катализатором в течение 4 часов. Смесь фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (16,2 г, 87%).
Пример Е11.3
3-Метил-4,9-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-10-он
(Метилсульфинил)метанид натрия (29,7 ммоль) получали из гидрида натрия (60% дисперсия в масле, 1,19 г, 29,7 ммоль) и безводного диметилсульфоксида (7 мл) путем нагревания при 65°С до появления раствора. К нему добавляли раствор этилового эфира 5-(2-аминофениламино)-1-метил-1Н-пиразол-4-карбоновой кислоты из Примера Е11.2 (3,63 г, 16,9 ммоль) в безводном диметилсульфоксиде (10 мл) и перемешивание продолжали при 65°С в течение 2,5 ч. Смесь выливали в лед (100 мл) и получающееся в результате твердое вещество собирали и очищали путем перекристаллизации из метанол/EtOAc/60-80 петролейный эфир с получением указанного в заголовке соединения (1,46 г, 40%).
Пример Е11.4
3-Метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен
К суспензии 3-метил-4,9-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-10-она из Примера Е11.3 (3,01 г, 14,1 ммоль) в безводном ТГФ (100 мл) при 0°С добавляли алюмогидрид лития (2,13 г, 56,2 ммоль) и получающуюся в результате суспензию кипятили с обратным холодильником в течение 18 ч, затем давали возможность охладиться до комнатной температуры. Смесь охлаждали до 0°С, по каплям в течение 15 мин добавляли 35% раствор аммиака (10 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. Получающуюся в результате суспензию фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; от 2% метанол:хлороформ до 5% метанол:хлороформ) с получением указанного в заголовке соединения (1,60 г, 57%).
Пример Е12
[4-(Изобутиламинометил)циклогексил]-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанон
Раствор изомаслянного альдегида (0,36 мг, 0,005 ммоль) в 1,2-дихлопентане (0,05 мл) добавляли к раствору гидрохлорида (4-аминометилциклогексил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е10.2 (1,88 мг, 0,005 ммоль) в 1,2-дихлопентане (0,05 мл) и DIEA (0,0026 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем добавляли раствор триацетоксиборгидрида натрия (1,59 мг, 0,0075 ммоль) в ДМФ (0,05 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (Ионизация распылением электронов (ИРЭ))+: [М+Н]+=396,4.
Пример Е13
4-Нитробензиловый эфир [4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]карбаминовой кислоты
Раствор 4-нитробензилхлорформиата (1,08 мг, 0,005 ммоль) в дихлорметане (0,05 мл) добавляли к раствору гидрохлорида (4-аминометилциклогексил)-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона (Соединение номер 149) (1,95 мг, 0,005 ммоль) в дихлорметане (0,05 мл) и триэтиламине (0,0035 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=533,3
Пример Е14
(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-(4-гексиламинометилциклогексил)метанон
Раствор 1-бромгексана (0,83 мг, 0,005 ммоль) в ДМФ (0,05 мл) добавляли к раствору гидрохлорида (4-аминометилциклогексил)-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е10.2 (2,05 мг, 0,005 ммоль) в ДМФ (0,05 мл) и триэтиламине (0,0021 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=458,4.
Пример Е15
1-(3,3-Диметилбутил)пиперидин-4-карбоновая кислота
Пример Е15.1
Этиловый эфир 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты 3,3-Диметилмасляный альдегид (5,26 мл, 42,0 ммоль) добавляли к раствору этилизонипекотата (6,6 г, 42,0 ммоль) в метанол/уксусная кислота (99:1, об./об., 50 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли цианоборгидрид натрия (3,43 г, 54,6 ммоль) и смесь перемешивали при комнатной температуре в течение 4 дней, затем концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 25% EtOAc:75% циклогексан) с получением указанного в заголовке соединения (7,16 г, 71%).
Пример Е15.2
1-(3,3-Диметилбутил)пиперидин-4-карбоновая кислота
Моногидрат гидроксида лития (1,37 г, 32,6 ммоль) добавляли к раствору этилового эфира 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты из Примера Е15.1 (7,16 г, 29,7 ммоль) в ТГФ (50 мл) и воде (5 мл). Смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле через Isolute (элюент; 90% дихлорметан:9% метанол:1% уксусная кислота) с получением указанного в заголовке соединения (5,51 г, 87%).
Пример Е15а
1-Циклопропилметилпиперидин-4-карбоновая кислота
Указанное в заголовке соединение получали из циклопропанкарбоксальдегида и этилизонипекотата с использованием способов, похожих на способы, описанные для Примера Е15.
Пример Е16
[4-(3-Метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амид 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты
Пример Е16.1
[4-(3-Метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амид 4-(3,3-диметилбутил)пиперазин-4-карбоновой кислоты
2-(1Н-Бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат (HBTU) (84 мг, 0,22 ммоль) добавляли к раствору 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты из Примера Е15 (42 мг, 0,17 ммоль) в ДМФ (5 мл) и DIEA (до рН 9). Смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли гидрохлорид (4-аминометилциклогексил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона (Соединение номер 150) (42 мг, 0,11 ммоль) и смесь перемешивали при комнатной температуре в течение 18 ч. Растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток перерастворяли в EtOAc, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 10% метанол:90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (34 мг, 57%).
Пример Е17
Гидрохлорид N-[4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]-2-пиперидин-4-илацетамида
Раствор трет-бутилового эфира 4-({[4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]карбамоил}метил)пиперидин-1-карбоновой кислоты (Соединение номер 228) (259 мг, 0,45 ммоль) приводили в реакцию с 4 н. HCl/диоксан с использованием способа, аналогичного описанному для Примера Е4.2, с получением указанного в заголовке соединения (230 мг, 93%).
Пример Е18
N-[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]метансульфонамид
Раствор метансульфонилхлорида (0,57 мг, 0,005 ммоль) в дихлорметане (0,05 мл) добавляли к раствору (4-аминометилциклогексил)-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона (Соединение номер 149) (1,95 мг, 0,005 ммоль) в дихлорметане (0,05 мл) и триэтиламине (0,0035 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=432,1.
Пример Е19
N-[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]-2-(1-метансульфонилпиперидин-4-ил)ацетамид
Раствор метансульфонилхлорида (0,57 мг, 0,005 ммоль) в дихлорметане (0,05 мл) добавляли к раствору гидрохлорида N-[4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]-2-пиперидин-4-илацетамида из Примера Е17 (2,57 мг, 0,005 ммоль) в дихлорметане (0,05 мл) и триэтиламине (0,0035 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=557,4.
Пример Е20
2-(1-Ацетилпиперидин-4-ил)-N-[4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]ацетамид
Раствор ацетилхлорида (0,39 мг, 0,005 ммоль) в дихлорметане (0,05 мл) добавляли к раствору гидрохлорида N-[4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]-2-пиперидин-4-илацетамида из Примера Е17 (2,57 мг, 0,005 ммоль) в дихлорметане (0,05 мл) и триэтиламине (0,0035 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=521,5.
Пример Е21
[4-(3-Метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амид 1-изобутилпиперидин-4-карбоновой кислоты
Раствор изомасляного альдегида (0,36 мг, 0,005 ммоль) в 1,2-дихлопентане (0,05 мл) добавляли к раствору гидрохлорида [4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида пиперидин-4-карбоновой кислоты (Соединение номер 238) (2,43 мг, 0,005 ммоль) в 1,2-дихлопентане (0,05 мл) и DIEA (0,0026 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем добавляли раствор триацетоксиборгидрида натрия (1,59 мг, 0,0075 ммоль) в ДМФ (0,05 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=507,4.
Пример Е22
N-[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]-3-(1-гексилпиперидин-4-ил)пропионамид
Раствор 1-бромгексана (0,83 мг, 0,005 ммоль) в ДМФ (0,05 мл) добавляли к раствору гидрохлорида N-[4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]-3-пиперидин-4-илпропионамида (Соединение номер 237) (2,57 мг, 0,005 ммоль) в ДМФ (0,05 мл) и триэтиламине (0,0021 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=597,6/599,6.
Пример Е23
4-Нитробензиловый эфир 4-({[4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]карбамоил}метил)-пиперидин-1-карбоновой кислоты
Раствор 4-нитробензилхлорформиата (1,08 мг, 0,005 ммоль) в дихлорметане (0,05 мл) добавляли к раствору гидрохлорида N-[4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]-2-пиперидин-4-илацетамида из Примера Е17 (2,58 мг, 0,005 ммоль) в дихлорметане (0,05 мл) и триэтиламине (0,0035 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=658,5.
Пример Е24
[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амид 4-(3,3-диметилбутил)пиперазин-1-карбоновойкислоты
DIEA (0,30 мл, 1,7 ммоль) и 1,1'-карбонилдиимидазол (39 мг, 0,24 ммоль) добавляли к раствору гидрохлорида (4-аминометилциклогексил)-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона (Соединение номер 149) (78 мг, 0,20 ммоль) в ДМФ (4,0 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли дигидрохлорид 1-(3,3-диметилбутил)пиперазина из Примера Е4 (56 мг, 0,23 ммоль) и смесь перемешивали при комнатной температуре в течение 18 ч. Смесь разбавляли EtOAc, промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 10% метанол:90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (32 мг, 29%).
Пример Е25
3-Хлор-6,7,8,9-тетрагидро-5-окса-9-азабензоциклогептен
Пример Е25.1
N-(4-Хлор-2-гидроксифенил)бензамид
2-Амино-5-хлорфенол (1,45 г, 10 ммоль) растворяли в EtOAc (30 мл) и воде (20 мл). Добавляли бикарбонат натрия (1,25 г, 15 ммоль), затем бензоилхлорид (1,42 г, 10 ммоль) и смесь перемешивали при комнатной температуре в течение 1 ч. Слои распределялись и органический слой промывали рассолом, сушили и концентрировали в вакууме. Остаток растирали с диэтиловым эфиром с получением указанного в заголовке соединения (2,05 г, 82%).
Пример Е25.2
(3-Хлор-7,8-дигидро-6Н-5-окса-9-азабензоциклогептен-9-ил)фенил-метанон
N-(4-Хлор-2-гидроксифенил)бензамид из Примера Е25.1 (1,0 г, 4 ммоль) растворяли в ацетонитриле (10 мл) и дихлорметане (15 мл). Добавляли 1,3-дибромпропан (3,26 г, 16 ммоль), aliquat 336 (170 мг, 0,4 ммоль) и гидроксид натрия (750 мг, 16 ммоль) и смесь нагревали при 60°С в течение 3 ч. Твердое вещество отфильтровывали и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 30% EtOAc:70% гексан) с получением указанного в заголовке соединения (783 мг, 83%).
Пример Е25.3
3-Хлор-6,7,8,9-тетрагидро-5-окса-9-азабензоциклогептен (3-Хлор-7,8-дигидро-6Н-5-окса-9-азабензоциклогептен-9-ил)фенил-метанон из Примера Е25,2 (783 мг, 2,7 ммоль) растворяли в диоксане (10 мл) и добавляли 6М водный раствор HCl (50 мл). Смесь кипятили с обратным холодильником в течение 20 ч, затем концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток растворяли в диэтиловом эфире и воде, подкисляли NaHCO3, и слои распределялись. Органический слой промывали рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (280 мг, 47%).
Пример Е26
N-Циклогексил-N'-метилбензол-1,2-диамин
Пример Е26.1
Циклогексил-(2-нитрофенил)амин
Смесь 2-фторнитробензола (5,0 г, 35,4 ммоль), циклогексиламина (4,5 мл, 39,0 ммоль) и карбоната калия (17,1 г, 124 ммоль) в ацетонитриле (100 мл) кипятили с обратным холодильником в течение 2 дней. Смесь разбавляли EtOAC, промывали водой, затем рассолом, сушили и частично концентрировали в вакууме. Осажденное твердое вещество собирали и промывали гексаном с получением указанного в заголовке соединения (6,7 г, 86%).
Пример Е26.2
N-Циклогексилбензол-1,2-диамин
Циклогексил-(2-нитрофенил)амин из Примера Е26.1 (3,0 г, 13,6 ммоль) растворяли в метаноле (100 мл) и добавляли хлорид олова (II) (12,9 г, 68,1 ммоль). Смесь перемешивали в течение 20 ч при комнатной температуре, затем кипятили с обратным холодильником в течение 18 ч и концентрировали в вакууме. Остаток помещали в EtOAC (100 мл), охлаждали до 0°С и рН доводили до 14 конц. NH3. Осадок отфильтровывали и промывали EtOAc. Фильтрат промывали 2М NН3, водой, затем рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (2,25 г, 86%).
Пример Е26.3
N-Циклогексил-N'-метилбензол-1,2-диамин
Карбонат калия (2,45 г, 17,7 ммоль) и йодметан (0,81 мл, 13,0 ммоль) добавляли к раствору N-Циклогексилбензол-1,2-диамина из Примера Е26.2 (2,25 г, 11,8 ммоль) в ДМФ (10 мл). Смесь перемешивали в течение 6 ч при комнатной температуре, затем выливали в воду и экстрагировали EtOAc. Органический слой промывали водой, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 5% EtOAc:95% гексан) с получением указанного в заголовке соединения (950 мг, 39%).
Пример Е27
Этиловый эфир 3-фтор-4-гидроксибензойной кислоты
Раствор 3-фтор-4-гидроксибензойной кислоты (5,16 г, 33,1 ммоль) в этаноле (100 мл) обрабатывали конц. серной кислотой (5 мл) и смесь кипятили с обратным холодильником в течение 4 дней. Летучие вещества удаляли в вакууме и водный остаток подкисляли насыщенным NаНСО3 и дважды экстрагировали диэтиловым эфиром. Объединенные органические экстракты сушили и концентрировали в вакууме с получением указанного в заголовке соединения (5,16 г, 85%).
Пример Е28
Этиловый эфир 2-хлор-4-гидроксибензойной кислоты
Раствор 2-хлор-4-гидроксибензонитрила (5,0 г, 32,6 ммоль) в этаноле (125 мл) обрабатывали конц. серной кислотой (25 мл) и смесь кипятили с обратным холодильником в течение 3 дней. Добавляли конц. серную кислоту (25 мл) и смесь кипятили с обратным холодильником в течение еще 2 дней. Летучие вещества удаляли в вакууме и водный остаток подкисляли насыщенным NaHCО3 и 4 раза экстрагировали диэтиловым эфиром. Объединенные органические экстракты сушили и концентрировали в вакууме с получением указанного в заголовке соединения (2,5 г, 38%).
Пример Е29
Метиловый эфир 4-гидрокси-3-метилбензойной кислоты Метиловый эфир 4-амино-3-метилбензойной кислоты (5,25 г, 32,0 ммоль) обрабатывали 35% раствором серной кислоты (50 мл) и смесь перемешивали и нагревали до растворения, затем охлаждали до 0°С. По каплям добавляли нитрит натрия (2,82 г, 41,6 ммоль) в воду (50 мл) и смесь перемешивали в течение 5 мин при 0°С. Добавляли мочевину для разрушения избытка нитрита. Добавляли нитрат меди (121 г, 320 ммоль) в воду (1 л), затем оксид меди (4,25 г, 32,0 ммоль). Смесь нагревали до комнатной температуры в течение 30 мин и экстрагировали EtOAc (×3). Органические вещества объединяли, промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 30% EtOAc:70% гексан) с получением указанного в заголовке соединения (2,2 г, 42%).
Пример Е30
Метиловый эфир 4-(3-карбоксипропил)-3-метилбензойной кислоты
Пример Е30.1
Метиловый эфир 4-((Е)-2-трет-бутоксикарбонилвинил)-3-метил-бензойной кислоты
Тетракис(трифенилфосфин)палладий (0) (5,0 г, 4,33 ммоль) добавляли к перемешиваемому раствору метил 4-бром-3-метилбензоата (9,93 г, 43,3 ммоль), трет-бутилакрилата (50 мл, 341,3 ммоль) и ацетата натрия (35,8 г, 436,4 ммоль) в диметилацетамиде (DMA) (350 мл). Смесь нагревали при 140°С в течение 5 ч, фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме. Остаток перерастворяли в EtOAc, промывали 0,3М KHSO4, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 15% EtOAc:85% гексан до 20% EtOAc:80% гексан) с получением указанного в заголовке соединения (4,81 г, 40%).
Пример Е30.2
Метиловый эфир 4-(2-трет-бутоксикарбонилэтил)-3-метилбензойной кислоты
Метиловый эфир 4-((Е)-2-трет-бутоксикарбонилвинил)-3-метилбензойной кислоты из Примера Е30.1 (4,00 г, 14,5 ммоль) растворяли в метаноле (100 мл) и гидрировали над 10% Pd/C катализатором (480 мг) в течение 5 ч. Смесь фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме с получением указанного в заголовке соединения (3,41 г, 84%).
Пример Е30.3
Метиловый эфир 4-{2-карбоксиэтил)-3-метилбензойной кислоты
Трифторуксусную кислоту (40 мл) при комнатной температуре медленно добавляли к перемешиваемому раствору метилового эфира 4-(2-трет-бутоксикарбонилэтил)-3-метилбензойной кислоты из Примера Е30.2 (4,9 г, 17,6 ммоль) в дихлорметане (80 мл). Смесь перемешивали в течение 2 ч, затем концентрировали в вакууме и подвергали азеотропной перегонке дихлорметаном. Остаток перекристаллизовывали в EtOAc с получением указанного в заголовке соединения (2,77 г, 71%).
Пример Е30.4
Метиловый эфир 4-(3-карбоксипропил)-3-метилбензойной кислоты
Метиловый эфир 4-(2-карбоксиэтил)-3-метилбензойной кислоты из Примера Е30.3 (500 мг, 2,25 ммоль) растворяли в безводном дихлорметане (10 мл) и нескольких каплях ДМФ. По каплям добавляли оксалилхлорид (0,393 мл, 4,5 ммоль) и смесь перемешивали в течение 1 ч при комнатной температуре. Растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток перерастворяли в ацетонитриле (20 мл) и охлаждали до 0°С. По каплям добавляли раствор 2М (триметилсилил)диазометана в гексанах (2,25 мл, 4,5 ммоль) и реакционную смесь перемешивали в течение 5 ч при 0°С, затем 20 ч при комнатной температуре. Добавляли этилацетат, затем 10% раствор лимонной кислоты и слои распределялись. Органический слой промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 50% этилацетат:50% циклогексан). Полученный продукт растворяли в смеси ацетонитрила и воды. Постепенно добавляли раствор бензоата серебра (103 мг, 0,45 ммоль) в триэтиламине (1,25 мл, 9 ммоль), пока смесь подвергали ультразвуковой обработке в ультразвуковой бане. Через 30 мин при комнатной температуре растворители удаляли в вакууме. Добавляли этилацетат и 10% водный раствор лимонной кислоты, и слои распределялись. Органический слой промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 50% EtOAc:50% циклогексан) с получением указанного в заголовке соединения (378 мг, 71%).
Пример Е31
4-(4-Метоксикарбонилбутил)-3-метилбензойная кислота
Пример Е31.1
трет-Бутиловый эфир 4-бром-3-метилбензойной кислоты
4-Бром-3-метилбензойную кислоту (2,06 г, 9,6 ммоль) и тионилхлорид (2,2 мл, 30,2 ммоль) в толуоле (50 мл) кипятили с обратным холодильником в течение 2 ч, затем концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток растворяли в ТГФ (100 мл) и триэтиламине (2,8 мл, 20,1 ммоль), охлаждали до 0°С и порциями добавляли трет-бутоксид лития (1,24 г, 15,5 ммоль). Смесь перемешивали в течение 18 ч при комнатной температуре, затем концентрировали в вакууме. Остаток растворяли в EtOAc, промывали 1М HCl, насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 5% EtOAc;95% петролейный эфир) с получением указанного в заголовке соединения (1,86 г, 71%).
Пример Е31.2
трет-Бутиловый эфир 4-((1Е,3Е)-4-метоксикарбонилбута-1,3-диенил)-3-метилбензойной кислоты
Тетракис(трифенилфосфин)палладий (0) (852 мг, 0,7 моль) добавляли к перемешиваемому раствору трет-бутилового эфира 4-бром-3-метилбензойной кислоты из Примера Е31.1 (1,86 г, 6,8 ммоль), 1-ацетокси-1,3-бутадиена (7,5 мл, 64,5 ммоль) и ацетата натрия (5,69 г, 69,4 ммоль) в DMA (75 мл). Смесь нагревали при 140°С в течение 3 ч, фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 20% EtOAc:80% петролейный эфир) с получением указанного в заголовке соединения (1,54 г, 74%).
Пример Е31.3
трет-Бутиловый эфир 4-(4-метоксикарбонилбутил)-3-метилбензойной кислоты
трет-Бутиловый эфир 4-((1Е,3Е)-4-метоксикарбонилбута-1,3-диенил)-3-метилбензойной кислоты из Примера Е31.2 (1,54 г, 5,1 ммоль) растворяли в метаноле (40 мл) и гидрировали над 10% Pd/C катализатором (200 мг) в течение 5 ч. Смесь фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме с получением указанного в заголовке соединения (1,43 г, 92%).
Пример Е31.4
4-(4-Метоксикарбонилбутил)-3-метилбензойная кислота
Трифторуксусную кислоту (20 мл) добавляли к раствору трет-бутилового эфира 4-(4-метоксикарбонилбутил)-3-метилбензойной кислоты из Примера Е31.3 (1,43 г, 4,7 ммоль) в дихлорметане (40 мл) и смесь перемешивали в течение 2 ч при комнатной температуре. Растворители концентрировали в вакууме и подвергали азеотропной перегонке с дихлорметаном с получением указанного в заголовке соединения (1,07 г, 92%).
Пример Е32
Метиловый эфир 4-карбоксиметил-3-метилбензойной кислоты
Пример Е32.1
Метиловый эфир 4-трет-бутоксикарбонилметил-3-метилбензойной кислоты
Фторид меди (II) (4,08 г, 40,1 ммоль) и дихлорид бис-[три-(орто-толил)фосфин]палладия (473 мг, 0,6 ммоль) добавляли к раствору метил 4-бром-3-метил бензоата (4,60 г, 20,1 ммоль) в ТГФ (30 мл). Смесь кипятили с обратным холодильником перед добавлением ацеталя силилкетена (18,5 г, 80,3 ммоль). Смесь кипятили с обратным холодильником в течение 2 дней, затем разбавляли Et2O. Добавляли водный раствор NH4Cl (250 мл) и смесь перемешивали в течение 30 мин при комнатной температуре. Слои распределялись, и водный слой дважды экстрагировали Et2O. Органические фазы объединяли, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 5% EtOAc:95% гексан) с получением указанного в заголовке соединения (2,84 г, 53%).
Пример Е32.2
Метиловый эфир 4-карбоксиметил-3-метилбензойной кислоты
Трифторуксусную кислота (15 мл) добавляли к раствору метилового эфира 4-трет-бутоксикарбонилметил-3-метилбензойной кислоты из Примера Е32.1 (2,84 г, 10,7 ммоль) в дихлорметане (15 мл). Смесь перемешивали в течение 90 мин при комнатной температуре, концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток перекристаллизовывали из EtOAc и гексана с получением указанного в заголовке соединения (1,81 г, 81%).
Пример Е33
4-[1,3]Диоксолан-2-илпиперидин
Пример Е33.1
Бензиловый эфир 4-гидроксиметилпиперидин-1-карбоновой кислоты
4-Пиперидинметанол (5,0 г, 43 ммоль) растворяли в дихлорметане (100 мл) и триэтиламине (12 мл, 86 ммоль) при 0°С. Добавляли бензилхлорформиат (6,8 мл, 47,3 ммоль) и смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме. Остаток перерастворяли в EtOAc, промывали 1М KHSO4, водой, затем рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (8,33 г, 77%).
Пример Е33.2
Бензиловый эфир4-формилпиперидин-1-карбоновой кислоты
Реагент Десс-Мартина (17 г, 39,6 ммоль) порциями при комнатной температуре добавляли к раствору бензилового эфира 4-гидроксиметилпиперидин-1-карбоновой кислоты из Примера Е33.1 (8,33 г, 33 ммоль) в дихлорметане (100 мл). Смесь перемешивали в течение 3 ч в инертной атмосфере, затем разбавляли хлороформом и водой, и слои распределялись. Органический слой промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 40% EtOAc:60% гексан) с получением указанного в заголовке соединения (5,5 г, 66%).
Пример Е33.3
Бензиловый эфир 4-[1,3]диоксолан-2-илпиперидин-1-карбоновой кислоты
Этиленгликоль (5 мл) и каталитическое количество пара-толуолсульфоновой кислоты добавляли к бензиловомй эфиру 4-формилпиперидин-1-карбоновой кислоты из Примера Е33.2 (5,6 г, 22,6 ммоль) в толуоле (100 мл) и смесь кипятили с обратным холодильником в условиях Дина и Старка в течение 2,5 ч. Растворители удаляли в вакууме и остаток перерастворяли в EtOAc, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 50% EtOAc:50% петролейный эфир) с получением указанного в заголовке соединения (5,14 г, 78%).
Пример Е33.4
4-[1,3]Диоксолан-2-илпиперидин
Бензиловый эфир 4-[1,3]диоксолан-2-илпиперидин-1-карбоновой кислоты из Примера Е33.3 (5,14 г, 17,7 ммоль) растворяли в метаноле (100 мл) и гидрировали над 10% Pd/C катализатором (551 мг) в течение 4 часов. Смесь фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме с получением указанного в заголовке соединения (2,84 г, 100%).
Пример Е34
трет-Бутиловый эфир 4-(3-гидроксипропил)пиперазин-1-карбоновой кислоты
Раствор трет-бутилового эфира пиперазин-1-карбоновой кислоты (26,5 г, 142 ммоль) в ацетоне (300 мл) при комнатной температуре обрабатывали 3-бромпропан-1-олом (14,5 мл, 156,2 ммоль), карбонатом калия (50 г, 361,8 ммоль) и йодидом калия (2,4 г, 14,2 ммоль) и смесь кипятили с обратным холодильником в течение 18 ч, затем давали возможность охладиться до комнатной температуры. Суспензию фильтровали и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 5% метанол:95% дихлорметан) с получением указанного в заголовке соединения (27,7 г, 80%).
Пример Е35
Дитрифторацетат 1-циклопропилметилимидазолидина
Пример Е35.1
трет-Бутиловый эфир [2-(циклопропилметиламино)этил]карбаминовой кислоты
Гидрокарбонат калия (220 мг, 2,2 ммоль) и (бромэтил)циклопропан (270 мг, 2,0 ммоль) добавляли к раствору трет-бутил-N-(2-аминоэтил)карбамата (320 мг, 2,0 ммоль) в ТГФ (10 мл). Смесь нагревали при 66°С в течение 20 ч и растворители концентрировали в вакууме. Остаток растворяли в хлороформе, промывали водой, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 1% триэтиламин:4% метанол:95% хлороформ) с получением указанного в заголовке соединения (130 мг, 30%).
Пример Е35.2
Дитрифторацетат 1-циклопропилметилимидазолидина
Трифторуксусную кислоту (5 мл) добавляли к раствору трет-бутилового эфира [2-(циклопропилметиламино)этил]карбаминовой кислоты из Примера Е35.1 (180 мг, 0,84 ммоль) в дихлорметане (3 мл) и смесь перемешивали в течение 75 мин при комнатной температуре. Растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток помещали в воду (10 мл) и добавляли формальдегид (37% мас./мас. раствор, 0,10 мл, 1,36 ммоль). Смесь перемешивали в течение 6 дней при комнатной температуре, концентрировали в вакууме, подвергали азеотропной перегонке с толуолом, затем с петролейный эфир с получением указанного в заголовке соединения (255 мг, 86%).
Пример Е36
Дигидрохлорид 2-пиперазин-1-ил-1-пара-толилэтанона
Пример Е36.1
трет-Бутиловый эфир 4-(2-оксо-2-пара-толилэтил)пиперазин-1-карбоновой кислоты
2-Бром-4-метилацетофенон (572 мг, 2,68 ммоль) добавляли к раствору трет-бутилового эфира пиперазин-1-карбоновой кислоты (500 мг, 2,68 ммоль) в дихлорметане (5 мл) и триэтиламине (0,45 мл, 3,22 ммоль). Смесь перемешивали в течение 3 дней при комнатной температуре и растворители удаляли в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 40% гексан:60% EtOAc) с получением указанного в заголовке соединения (661 мг, 77%).
Пример Е36.2
Дигидрохлорид 2-пиперазин-1-ил-1-лара-толилэтанона
трет-Бутиловый эфир 4-(2-оксо-2-пара-толилэтил)пиперазин-1-карбоновой кислоты из Примера Е36.1 (661 мг, 2,08 ммоль) растворяли в 4М растворе HCl в диоксане (25 мл) при 0°С и смесь перемешивали в течение 45 мин при комнатной температуре. Растворители концентрировали в вакууме и подвергали азеотропной перегонке с диэтиловым эфиром с получением указанного в заголовке соединения (536 мг, 88%).
Пример Е37
2-Бром-1-[4-(3,3-диметилбутил)пиперазин-1-ил]этанон
Бромацетилбромид (0,52 мл, 6,0 ммоль) при 0°С добавляли к раствору гидрохлорида 1-(3,3-диметилбутил)пиперазина из Примера Е4 (1,5 г, 5,7 ммоль) в дихлорметана (20 мл) и триэтиламина (3,57 мл, 25,6 ммоль). Смесь перемешивали в течение 20 ч при комнатной температуре, промывали насыщенным NаНСО3, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 5% метанол:95% дихлорметан) с получением указанного в заголовке соединения (220 мг, 13%).
Пример Е38
трет-Бутиловый эфир циклопропилпиперидин-4-илметил-карбаминовой кислоты
Пример Е38.1
Бензиловый эфир 4-циклопропиламинометилпиперидин-1-карбоновой кислоты
Циклопропиламин (1,4 г, 24,4 ммоль) и уксусную кислоту (0,5 мл) добавляли к раствору бензилового эфира 4-формилпиперидин-1-карбоновой кислоты из Примера Е33.2 (5,5 г, 22,2 ммоль) в метаноле (49,5 мл) и смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли цианоборгидрид натрия (1,84 г, 28,9 ммоль) и смесь перемешивали в течение 20 ч при комнатной температуре в инертной атмосфере. Растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток растворяли в EtOAC, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 10% метанол:90% дихлорметан) с получением указанного в заголовке соединения (3,0 г, 47%).
Пример Е38.2
Бензиловый эфир 4-[(трет-бутоксикарбонилциклопропиламино)метил]-пиперидин-1-карбоновой кислоты
DMAP (127 мг, 1,04 ммоль) и ди-трет-бутил дикарбонат (3,4 г, 12,5 ммоль) добавляли к раствору бензилового эфира 4-циклопропиламинометилпиперидин-1-карбоновой кислоты из Примера Е38.1 (3,0 г, 10,4 ммоль) в дихлорметане (50 мл) и триэтиламине (до рН 9). Смесь перемешивали в течение 20 ч при комнатной температуре, затем концентрировали в вакууме. Остаток растворяли в EtOAC, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 40% EtOAc:60% гексан) с получением указанного в заголовке соединения (3,67 г, 92%).
Пример Е38.3
трет-Бутиловый эфир циклопропилпиперидин-4-илметилкарбаминовой кислоты
Бензиловый эфир 4-[(трет-бутоксикарбонилциклопропиламино)метил]-пиперидин-1-карбоновой кислоты из Примера Е38.2 (3,67 г, 9,4 ммоль) растворяли в метаноле (100 мл) и гидрировали над 10% Pd/C катализатором (3 г) в течение 1 ч. Смесь фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме с получением указанного в заголовке соединения (2,07 г, 87%).
Пример Е39
трет-Бутиловый эфир 4-[3-(4-карбокси-2-фторфенокси)пропил]-пиперазин-1-карбоновой кислоты
Пример Е39.1
трет-Бутиловый эфир 4-[3-(4-этоксикарбонил-2-фторфенокси)пропил]-пиперазин-1-карбоновой кислоты
Трифенилфосфинполистерол (загрузка 1,0 ммоль/г, 11 г, 11,0 ммоль) и диэтилазодикарбоксилат (DEAD) (2,45 г, 11,0 ммоль) при 0°С добавляли к раствору этилового эфира 3-фтор-4-гидроксибензойной кислоты из Примера Е27 (1,3 г, 7,4 ммоль) и трет-бутилового эфира 4-(3-гидроксипропил)пиперазин-1-карбоновой кислоты из Примера Е34 (1,8 г, 7,4 ммоль) в тетрагидрофуране (100 мл). Суспензии давали возможность нагреться до комнатной температуры и перемешивали в течение 18 ч. Смесь фильтровали и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAC) с получением указанного в заголовке соединения (1,7 г, 57%).
Пример Е39.2
трет-Бутиловый эфир 4-[3-(4-карбокси-2-фторфенокси)пропил1-пиперазин-1-карбоновой кислоты
Раствор трет-бутилового эфира 4-[3-(4-этоксикарбонил-2-фторфенокси)пропил]пиперазин-1-карбоновой кислоты из Примера Е39.1 (1,7 г, 4,1 ммоль) в диоксане (25 мл) обрабатывали 2 н. NaOH (3 мл) и смесь перемешивали при 50°С в течение 18 ч. Добавляли дополнительную аликвоту 2 н. NaOH (2 мл) и перемешивание продолжали при 50°С в течение 3 ч.
Растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 1% уксусная кислота:9% метанол:90% хлороформ) с получением указанного в заголовке соединения (1,45 г, 92%).
Пример Е40
4-{2-[4-(3,3-Диметилбутил)пиперазин-1-ил]этокси}-3-метилбензойная кислота
Пример Е40.1
трет-Бутиловый эфир 4-[2-(4-метоксикарбонил-2-метилфенокси)этил]-пиперазин-1-карбоновой кислоты
трет-Бутиловый эфир 4-(2-гидроксиэтил)пиперазин-1-карбоновой кислоты (500 мг, 2,2 ммоль) растворяли в ТГФ (30 мл) и охлаждали до 0°С. Добавляли трифенилфосфин на полимере (2,2 г, 2,2 ммоль), DEAD (378 мг, 2,2 ммоль) и метиловый эфир 4-гидрокси-3-метилбензойной кислоты из Примера Е29 (361 мг, 2,2 ммоль) и смесь перемешивали в течение 20 ч при комнатной температуре. Смолу отфильтровывали и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc) с получением указанного в заголовке соединения (495 мг, 60%).
Пример Е40.2
Дигидрохлорид метилового эфира 3-метил-4-(2-пиперазин-1-илэтокси)бензойной кислоты
трет-Бутиловый эфир 4-[2-(4-метоксикарбонил-2-метилфенокси)этил]пиперазин-1-карбоновой кислоты из Примера Е40.1 (200 мг, 0,53 ммоль) растворяли в 4М растворе HCl в диоксане (5 мл). Смесь перемешивали в течение 30 мин при комнатной температуре, концентрировали в вакууме и подвергали азеотропной перегонке с толуолом с получением указанного в заголовке соединения (185 мг, 100%).
Пример Е40.3
Метиловый эфир 4-{2-[4-(3,3-диметилбутил)пиперазин-1-ил]этокси}-3-метилбензойной кислоты
3,3-Диметилмасляный альдегид (54 мг, 0,53 ммоль) добавляли к раствору дигидрохлорида метилового эфира 3-метил-4-(2-пиперазин-1-илэтокси)бензойной кислоты из Примера Е40.2 (146 мг, 0,42 ммоль) в метанол/уксусная кислота (99:1, об./об., 10 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли цианоборгидрид натрия (42 мг, 0,69 ммоль) и смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали в вакууме. Остаток растворяли в EtOAc, промывали насыщенным NаНСО3, водой, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле через Isolute (элюент; EtOAc) с получением указанного в заголовке соединения (64 мг, 34%).
Пример Е40.4
4-(2-[4-(3,3-Диметилбутил)пиперазин-1-ил]этокси}-3-метилбензойная кислота
Метиловый эфир 4-{2-[4-(3,3-диметилбутил)пиперазин-1-ил]этокси}-3-метилбензойной кислоты из Примера Е40.3 (42 мг, 0,12 ммоль) растворяли в диоксане (5 мл) и добавляли 1М NaOH (1 мл). Смесь кипятили с обратным холодильником в течение 2 ч, затем растворители концентрировали в вакууме. Остаток растворяли в EtOAc, промывали насыщенным NаНСО3, водой, затем рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (40 мг, 100%).
Пример Е41
4-{2-[4-(3,3-Диметилбутил)пиперазин-1-ил]-2-оксоэтокси}-3-метилбензойная кислота
Пример Е41.1
Метиловый эфир 4-трет-бутоксикарбонилметокси-3-метилбензойной кислоты
Карбонат калия (4,6 г, 33 ммоль), йодид калия (0,25 г, 1,5 ммоль) и трет-бутилбромацетат (2,5 мл, 16,5 ммоль) добавляли к раствору метилового эфира 4-гидрокси-3-метилбензойной кислоты из Примера Е29 (2,5 г, 15 ммоль) в ацетоне (150 мл) и смесь кипятили с обратным холодильником в течение 20 ч. Твердое вещество отфильтровывали и фильтрат концентрировали в вакууме. Остаток растворяли в EtOAc, промывали 1 н. KHSO4, водой, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 15% EtOAc:85% гексан) с получением указанного в заголовке соединения (3,8 г, 90%).
Пример Е41.2
Метиловый эфир 4-карбоксиметокси-3-метилбензойной кислоты
Трифторуксусную кислоту (20 мл) добавляли к раствору метилового эфира 4-трет-бутоксикарбонилметокси-3-метилбензойной кислоты из Примера Е41.1 (3,8 г, 13,6 ммоль) в дихлорметане (40 мл) и смесь перемешивали в течение 1 ч при комнатной температуре. Летучие вещества удаляли в вакууме и подвергали азеотропной перегонке с дихлорметаном с получением указанного в заголовке соединения (3,04 г, 100%).
Пример Е41.3
Метиловый эфир 4-{2-[4-(3,3-диметилбутил)пиперазин-1-ил]-2-оксоэтокси}-3-метилбензойной кислоты
WSCD (5,14 г, 27,2 ммоль) и DMAP (1,64 г, 13,6 ммоль) добавляли к раствору метилового эфира 4-карбоксиметокси-3-метилбензойной кислоты из Примера Е41.2 (3,04 г, 13,6 ммоль) в дихлорметане (100 мл) и триэтиламине (5 мл). Смесь перемешивали в течение 1 ч при комнатной температуре, затем добавляли дигидрохлорид 1-(3,3-диметилбутил)пиперазина из Примера Е4 (3,67 г, 14,9 ммоль). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме. Остаток растворяли в EtOAc, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc) с получением указанного в заголовке соединения (2,8 г, 55%).
Пример Е41.4
4-{2-[4-(3,3-Диметилбутил)пиперазин-1-ил]-2-оксоэтокси}-3-метилбензойная кислота
1М Раствор трибромида бора (2,66 мл, 2,66 ммоль) при 0°С в инертной атмосфере добавляли по каплям к раствору метилового эфира 4-{2-[4-(3,3-диметилбутил)пиперазин-1-ил]-2-оксоэтокси}-3-метилбензойной кислоты из Примера Е41.3 (500 мг, 1,33 ммоль) в дихлорметане (20 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем охлаждали до 0°С. Добавляли 1М раствор трибромида бора (1,33 мл, 1,33 ммоль) и смесь перемешивали в течение 2 ч при комнатной температуре. Растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 1% уксусная кислота:5% метанол:94% хлороформ) с получением указанного в заголовке соединения (350 мг, 72%).
Пример Е41а
трет-Бутиловый эфир 4-(2-бромацетил)пиперазин-1-карбоновой кислоты
Раствор бромацетилбромида (8,5 мл, 97 ммоль) в ДХМ (250 мл) при 0°С обрабатывали по каплям раствором 1-бок-пиперазина (15,9, 85,3 ммоль) и триэтиламина (18,0 мл, 130 ммоль) в ДХМ (150 мл). После завершения добавления смесь перемешивали при комнатной температуре в течение 4 ч. Раствор промывали охлажденным на льду 1М HCl, насыщ. водн. NаНСО3, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 20% EtOAc:80% циклогексан to 50% EtOAc:50% циклогексан) с получением указанного в заголовке соединения (15,7 г, 60,0%).
Пример Е41b
Метиловый эфир 2-хлор-4-гидроксибензойной кислоты
Пример E41b.1
Метиловый эфир 4-амино-2-хлорбензойной кислоты
Раствор 4-амино-2-хлорбензойной кислоты (5,3 г, 31 ммоль) в метаноле (100 мл) обрабатывали ацетилхлоридом (5 мл) и затем кипятили с обратным холодильником в течение 16 часов. Растворители упаривали в вакууме. Остаток растворяли в EtOAc, промывали насыщенным гидрокарбонатом натрия, сушили и концентрировали в вакууме с получением указанного в заголовке соединения в виде пурпурного твердого вещества, 5,45 г, 95%.
Пример Е41b.2
2-Хлор-4-гидроксибензойная кислота
Метиловый эфир 4-амино-2-хлорбензойной кислоты из Примера Е41b.1 (5,45 г, 29,4 ммоль) обрабатывали 35% раствором серной кислоты (120 мл) и смесь перемешивали и нагревали до растворения, затем охлаждали до 0°С. По каплям добавляли нитрит натрия (4,30 г, 62,5 ммоль) в воде (25 мл) и смесь перемешивали в течение 15 мин при 0°С. Добавляли мочевину для разрушения избытка нитрита. Добавляли нитрат меди (200 мг, 0,83 ммоль) и нагревали до 90°С. Реакционную смесь охлаждали до комнатной температуры, экстрагировали этилацетатом х3, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 30% EtOAc: 70% гексан до 50% EtOAc: 49% гексан: 1% АсОН) с получением указанного в заголовке соединения (3,7 г, 73%).
Пример Е41b.3
Метиловый эфир 2-хлор-4-гидроксибензойной кислоты
Раствор 2-хлор-4-гидроксибензойной кислоты (3,70 г, 21,4 ммоль) в метаноле (50 мл) по каплям обрабатывали тионилхлоридом (2,4 мл, 32 ммоль) и перемешивали в течение 24 часов и растворители удаляли в вакууме. Остаток растворяли этилацетатом и промывали насыщ. гидрокарбонатом натрия, сушили и растворители удаляли в вакууме. Остаток очищали путем колоночной хроматографии на силикагеле (элюент 30% EtOAc: 70% циклогексан) с получением желаемого продукта в виде желтого твердого вещества, 3,68 г, 92%.
Пример Е41с
трет-Бутиловый эфир 4-[2-(4-карбокси-3-хлорфенокси)ацетил]-пиперазин-1-карбоновой кислоты
Пример Е41с.1
трет-Бутиловый эфир 4-[2-(3-хлор-4-метоксикарбонилфенокси)ацетил]-пиперазин-1-карбоновой кислоты
Метиловый эфир 2-хлор-4-гидроксибензойной кислоты из Примера Е41b (2,0 г, 10,9 ммоль) и трет-бутиловый эфир 4-(2-бромацетил)пиперазин-1-карбоновой кислоты из Примера Е41а (3,68 г, 12,0 ммоль) в ацетонитриле (30 мл) обрабатывали карбонатом калия (1,6 г, 11,5 ммоль) и смесь кипятили с обратным холодильником в течение 18 ч перед удалением растворителей в вакууме. Остаток адсорбировали на силикагеле и очищали путем флэш-хроматографии на силикагеле (элюент; 20% EtOAc:80% циклогексан до 50% EtOAc:50% циклогексан до 70% EtOAc:30% циклогексан) с получением указанного в заголовке соединения (4,5 г, 100%).
Пример Е41с.2
трет-Бутиловый эфир 4-[2-(4-карбокси-3-хлорфенокси)ацетил]-пиперазин-1-карбоновой кислоты
Раствор трет-бутилового эфира 4-[2-(3-хлор-4-метоксикарбонил-фенокси)ацетил]пиперазин-1-карбоновой кислоты из Примера Е41с.1 (4,5 г, 10.8 ммоль) в ТГФ при 0°С обрабатывали триметилсиланолятом калия (1,6 г, 10.9 ммоль) и смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли еще 1,6 г (10,9 ммоль) силанолята калия и перемешивание продолжали при комнатной температуре в течение 2 ч. Добавляли еще 1,6 г (10,9 ммоль) силанолята калия и смесь перемешивали при 45°С в течение 2 ч. Смесь затем разбавляли водой и ТГФ удаляли в вакууме. Остаток промывали простым эфиром, охлаждали в ледяной бане и доводили до рН 5 твердым KHSO4, после чего его экстрагировали СНСl3 и СНСl3/изопропанол (90:10 об./об.). Объединенные органические вещества сушили и растворители удаляли в вакууме с получением указанного в заголовке соединения (3,7 г, 85%).
Пример Е42
4-(3-трет-Бутоксикарбонилпропокси)-3-метилбензойная кислота
Пример Е42.1
трет-Бутиловый эфир 4-броммасляной кислоты
1М Трибромид бора (39 мл, 39 ммоль) добавляли к раствору бутиролактона (3 мл, 39 ммоль) в дихлорметане (30 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем гасили избытком трет-бутилового спирта. Смесь перемешивали в течение 2 ч при комнатной температуре, разбавляли дихлорметаном, промывали насыщенным NаНСО3, насыщенным Nа2S2O3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле через Isolute (элюент; 5% EtOAc:95% гексан) с получением указанного в заголовке соединения (3 г, 34%).
Пример Е42.2
Метиловый эфир 4-(3-трет-бутоксикарбонилпропокси)-3-метилбензойной кислоты
Карбонат калия (580 мг, 4,20 ммоль) и йодид калия (72 мг, 0,43 ммоль) добавляли к раствору метилового эфира 4-гидрокси-3-метилбензойной кислоты из Примера Е29 (293 мг, 1,76 ммоль) и трет-бутилового эфира 4-броммасляной кислоты из Примера Е42.1 (397 мг, 1,78 ммоль) в ацетоне (50 мл). Смесь кипятили с обратным холодильником в течение 18 ч, затем твердое вещество отфильтровывали и фильтрат концентрировали в вакууме. Остаток растворяли в EtOAc, промывали водой, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 20% EtOAc:80% петролейный эфир) с получением указанного в заголовке соединения (414 мг, 76%).
Пример Е42.3
4-(3-трет-Бутоксикарбонилпропокси)-3-метилбензойная кислота
Моногидрат гидроксида лития (137 мг, 3,26 ммоль) добавляли к раствору метилового эфира 4-(3-трет-бутоксикарбонилпропокси)-3-метилбензойной кислоты из Примера Е42.2 (414 мг, 1,34 ммоль) в ТГФ (10 мл) и воде (5 мл). Смесь перемешивали в течение 48 ч при комнатной температуре и концентрировали в вакууме. Остаток растворяли в хлороформе, подкисляли 1М HCl, затем промывали рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (275 мг, 70%).
Пример Е43
4-{4-[4-(3,3-Диметилбутил)пиперазин-1-ил]-4-оксобутил}-3-метилбензойная кислота
Пример Е43.1
Метиловый эфир 4-{4-[4-(3,3-диметилбутил)пиперазин-1-ил]-4-оксобутил}-3-метилбензойная кислота
2-(1Н-Бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат (HBTU) (910 мг, 2,4 ммоль) добавляли к раствору метилового эфира 4-(3-карбоксипропил)-3-метилбензойной кислоты из Примера Е30 (378 мг, 1,6 ммоль) и гидрохлорида 1-(3,3-диметилбутил)пиперазина из Примера Е4 (467 мг, 1,9 ммоль) в дихлорметане (15 мл) и DIEA (0,836 мл, 4,8 ммоль). Смесь перемешивали в течение 20 ч при комнатной температуре, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле через Isolute (элюент; 5% метанол:95% дихлорметан) с получением указанного в заголовке соединения (582 мг, 94%).
Пример Е43.2
4-{4-[4-(3,3-Диметилбутил)пиперазин-1-ил]-4-оксобутил}-3-метилбензойная кислота
Моногидрат гидроксида лития (108 мг, 2,6 ммоль) добавляли к раствору метилового эфира 4-{4-[4-(3,3-диметилбутил)пиперазин-1-ил]-4-оксобутил}-3-метилбензойной кислоты из Примера Е43.1 (500 мг, 1,3 ммоль) в ТГФ (12 мл) и воде (6 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 2% уксусная кислота:4% метанол:94% дихлорметан), затем перекристаллизовывали из хлороформа и петролейного эфира с получением указанного в заголовке соединения (439 мг, 91%).
Пример Е44
4-{3-[4-(3,3-Диметилбутил)пиперазин-1-ил]-3-оксопропил}-3-метилбензойная кислота
Пример Е44.1
Метиловый эфир 4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]-3-оксопропил}-3-метилбензойной кислоты
Оксалилхлорид (2,6 мл, 30 ммоль) медленно при 0°С добавляли к раствору метилового эфира 4-(2-карбоксиэтил)-3-метилбензойной кислоты из Примера Е30.3 (5,33 г, 24 ммоль) в дихлорметане (60 мл) и нескольких каплях ДМФ. Смесь перемешивали в течение 2 ч при комнатной температуре, затем концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток растворяли в дихлорметане (30 мл) и при 0°С добавляли к раствору гидрохлорида 1-(3,3-диметилбутил)пиперазина из Примера Е4 (6,3 г, 26 ммоль) в дихлорметане (45 мл) и DIEA (17 мл, 96 ммоль). Смесь перемешивали в течение 1 ч при комнатной температуре, затем концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 5% метанол:95% дихлорметан) с получением указанного в заголовке соединения (8,5 г, 96%).
Пример Е44.2
4-{3-[4-(3,3-Диметилбутил)пиперазин-1-ил]-3-оксопропил}-3-метилбензойная кислота
Моногидрат гидроксида лития (2,4 г, 56,7 ммоль) добавляли к раствору метилового эфира 4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]-3-оксопропил}-3-метилбензойной кислоты из Примера Е44.1 (8,5 г, 22,7 ммоль) в ТГФ (200 мл) и воде (100 мл). Смесь перемешивали в течение 24 ч при комнатной температуре, затем растворители удаляли в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 2% уксусная кислота:4% метанол:94% дихлорметан) с получением указанного в заголовке соединения (8,1 г, 99%).
Пример Е45
3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионовая кислота
Пример Е45.1
4-((Е)-2-трет-Бутоксикарбонилвинил)-3-метилбензойная кислота
Моногидрат гидроксида лития (384 мг, 9,2 ммоль) добавляли к раствору метилового эфира 4-((Е)-2-трет-бутоксикарбонилвинил)-3-метилбензойной кислоты из Примера Е30.1 (1,27 г, 4,6 ммоль) в ТГФ (50 мл) и воде (20 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме. Остаток растворяли в EtOAc, промывали 1М KHSO4, водой, затем рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (1,1 г, 92%).
Пример Е45.2
трет-Бутиловый эфир (Е)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]акриловой кислоты
4-((Е)-2-трет-Бутоксикарбонилвинил)-3-метилбензойную кислоту из Примера Е45.1 (1,1 г, 4,2 ммоль) и 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен из Примера Е11 (720 мг, 3,6 ммоль) растворяли в дихлорметане (50 мл) и триэтиламине (0,75 мл). Добавляли DMAP (4,45 г, 3,6 ммоль) и WSCD (1,36 г, 7,1 ммоль) и смесь кипятили с обратным холодильником в течение 2 дней. Раствор разбавляли дихлорметаном, промывали 0,3М КНSО4, насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc) с получением указанного в заголовке соединения (1,35 г, 82%).
Пример Е45.3
трет-Бутиловый эфир 3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионовой кислоты
трет-Бутиловый эфир (Е)-3-[2-метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]акриловой кислоты из Примера Е45.2 (436 мг, 0,99 ммоль) растворяли в метаноле (40 мл) и гидрировали над 10% Pd/C катализатором (91 мг) в течение 5 ч. Смесь фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме и подвергали азеотропной перегонке с дихлорметаном с получением указанного в заголовке соединения (426 мг, 96%).
Пример Е45.4
3-[2-Метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионовая кислота
Трифторуксусную кислоту (5 мл) добавляли к раствору трет-бутилового эфира 3-[2-метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионовой кислоты из Примера Е45.3 (413 мг, 0,92 ммоль) в дихлорметане (10 мл) и смесь перемешивали в течение 45 мин при комнатной температуре. Растворители удаляли в вакууме и подвергали азеотропной перегонке с дихлорметаном. Остаток кристаллизовали с MeOH/Et2O с получением указанного в заголовке соединения (322 мг, 90%).
Пример Е46
(Е)-3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]акриловая кислота
Трифторуксусную кислоту (5 мл) добавляли к раствору трет-бутилового эфира (Е)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо-[f]азулен-9-карбонил)фенил]акриловой кислоты из Примера Е45.2 (338 мг, 0,76 ммоль) в дихлорметане (10 мл) и смесь перемешивали в течение 45 мин при комнатной температуре. Растворители удаляли в вакууме и подвергали азеотропной перегонке с дихлорметаном с получением указанного в заголовке соединения (337 мг, 80%).
Пример Е47
3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-1-пиперазин-1-илпропан-1-он
Пример Е47.1
трет-Бутиловый эфир 4-{3-[2-метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)Фенил1пропионил}пиперазин-1-карбоновой кислоты
РуВrоР (1,54 г, 3,3 ммоль) добавляли к раствору 3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионовой кислоты из Примера Е45 (850 мг, 2,25 ммоль) и DMAP (275 мг, 2,25 ммоль) в дихлорметане (20 мл) и DIEA (0,90 мл, 5,2 ммоль). Смесь перемешивали в течение 15 минут при комнатной температуре, затем добавляли 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен из Примера Е11 (450 мг, 2,25 ммоль). Смесь кипятили с обратным холодильником в течение 18 ч, разбавляли дихлорметаном, промывали 0,3М раствором KHSO4, затем насыщенным NаНСО3, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 5% метанол:95% EtOAc) с получением указанного в заголовке соединения (1,09 г, 87%).
Пример Е47.2
3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-1-пиперазин-1-илпропан-1-он
трет-Бутиловый эфир 4-{3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионил}пиперазин-1-карбоновой кислоты из Примера Е47,1 (1,09 г, 1,95 ммоль) растворяли в метаноле (20 мл) и добавляли раствор 4М HCl/диоксан (20 мл). Смесь перемешивали в течение 3 ч при комнатной температуре, концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток растворяли в метаноле (30 мл) и аммиаке (5 мл), затем концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 0,5% 35% аммиак:4,5% метанол: 95% дихлорметан до 1% 35% аммиак: 9% метанол: 90% дихлорметан) с получением указанного в заголовке соединения (759 мг, 73%).
Пример Е48
{4-[3-(4-Циклопропилпиперазин-1-ил)пропокси]-3-фторфенил}-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанон
Пример Е48.1
Этиловый эфир 4-(3-бромпропокси)-3-Фторбензойной кислоты
1,3-Дибромпропан (2,2 г, 11,0 ммоль), карбонат калия (1,86 г, 13,6 ммоль) и йодид калия (90 мг, 0,5 ммоль) добавляли к этиловому эфиру 3-фтор-4-гидроксибензойной кислоты из Примера Е27 (1,0 г, 5,4 ммоль) в ацетоне (25 мл) и смесь кипятили с обратным холодильником в течение 20 ч. Твердое вещество отфильтровывали и промывали EtOAc. Фильтрат концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 20% EtOAc: 80% гексан) с получением указанного в заголовке соединения (1,18 г, 71%).
Пример Е48.2
Этиловый эфир 4-[3-(4-циклопропилпиперазин-1-ил)пропокси]-3-фторбензойной кислоты
Дигидрохлорид 1-циклопропилпиперазина (642 мг, 3,2 ммоль, в соответствии со способом, описанным G.S.Poindexter, M.A.Bruce, K.L.Le Boulluec, I.Monkovic, Tet. Lett, 35(44), 7331-7334, 1994), карбонат калия (2,1 г, 15,2 ммоль) и йодид калия (50 мг, 0,3 ммоль) добавляли к этиловому эфиру 4-(3-бромпропокси)-3-фторбензойной кислоты из Примера Е48.1 (1,2 г, 3,9 ммоль) в ацетоне (25 мл). Смесь кипятили с обратным холодильником в течение 20 ч. Твердое вещество отфильтровывали, промывали EtOAc и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc затем 1% 35% аммиак:9% метанол:90% дихлорметан) с получением указанного в заголовке соединения (1,0 г, 89%).
Пример Е48.3
4-[3-(4-Циклопропилпиперазин-1-ил)пропокси]-3-фторбензойная кислота
Этиловый эфир 4-[3-(4-циклопропилпиперазин-1-ил)пропокси]-3-фторбензойной кислоты из Примера Е48.2 (1,0 г, 2,9 ммоль) растворяли в диоксане (10 мл) и добавляли 2 н. раствор NaOH (3 мл, 6,0 ммоль). Смесь нагревали при 60°С в течение 18 ч, затем концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 1% 35% аммиак: 19% метанол: 80% дихлорметан) с получением указанного в заголовке соединения (920 мг, 100%).
Пример Е48.4
{4-[3-(4-Циклопропилпиперазин-1-ил)пропокси]-3-фторфенил}-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанон
HBTU (325 мг, 0,9 ммоль) и 4М НСl в диоксане (0,45 мл, 1,8 ммоль) добавляли к раствору 4-[3-(4-циклопропилпиперазин-1-ил)пропокси]-3-фторбензойной кислоты из Примера Е48.3 (230 мг, 0,7 ммоль) в ДМФ (5 мл). Смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен из Примера Е65 (186 мг, 0,9 ммоль) и DIEA (рН =9) и смесь перемешивали при комнатной температуре в течение 18 ч. Смесь нагревали при 60°С в течение 3 ч, затем добавляли HBTU (300 мг, 0,8 ммоль). Смесь нагревали при 60°С в течение 2 дней, затем растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток перерастворяли в EtOAc, промывали насыщенным NaHCOs, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением коричневого твердого вещества, идентифицированного как указанное в заголовке соединение (55 мг, 15%).
Пример Е49
Дигидрохлорид [3-фтор-4-(3-пиперазин-1-илпропокси)фенил]-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона
Пример Е49.1
трет-Бутиловый эфир 4-{3-[2-фтор-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенокси]пропил}пиперазин-1-карбоновой кислоты
Раствор трет-бутилового эфира 4-[3-(4-карбокси-2-фторфенокси)пропил]пиперазин-1-карбоновой кислоты из Примера Е39 (865 мг, 2,3 ммоль) в дихлорметане (50 мл) обрабатывали триэтиламином (до рН 9), WSCD (865 мг, 4,5 ммоль) и DMAP (276 мг, 2,3 ммоль) и смесь перемешивали при комнатной температуре в течение 10 мин. Добавляли 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен из Примера Е11 (541 мг, 2,7 ммоль). Смесь кипятили с обратным холодильником в течение 18 ч, затем концентрировали в вакууме. Остаток растворяли в EtOAc, промывали насыщенным NaHCO3, затем рассолом и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 10% метанол:90% дихлорметан) с получением указанного в заголовке соединения (615 мг, 48%).
Пример Е49.2
Дигидрохлорид [3-Фтор-4-(3-пиперазин-1-илпропокси)фенил]-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона
Раствор трет-бутилового эфира 4-{3-[2-фтор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенокси]пропил}пиперазин-1-карбоновой кислоты из Примера Е49.1 (615 мг, 1,09 ммоль) в метаноле (2 мл) при 0°С обрабатывали 4 н. HCl в диоксане (5 мл). Раствору давали возможность нагреться до комнатной температуры и перемешивали в течение 1 ч. Растворители удаляли в вакууме с получением белой пены, идентифицированной как указанное в заголовке соединение (585 мг, 100%).
Пример Е50
Бис(трифторацетат) (4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}-3-фторфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона
3,3-Диметилмасляный альдегид (120 мг, 1,20 ммоль) и триэтиламин (до рН 9) добавляли к раствору дигидрохлорида [3-фтор-4-(3-пиперазин-1-илпропокси)фенил]-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е49 (585 мг, 1,09 ммоль) в метанол/уксусная кислота (99:1, об./об., 20 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли цианоборгидрид натрия (103 мг, 1,30 ммоль) и смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 10% метанол:90% дихлорметан) с получением (4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}-3-фторфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона, который лиофилизировали из водной трифторуксусной кислоты с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (700 мг, 83%).
Пример Е51
(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-{4-[3-(1-изобутилпиперидин-4-ил)пропокси]-3-метилфенил}метанон
Раствор изомасляного альдегида (0,36 мг, 0,005 ммоль) в 1,2-дихлопентане (0,05 мл) добавляли к раствору гидрохлорида (3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-[3-метил-4-(3-пиперидин-4-илпропокси)фенил]метанона (2,6 мг, 0,005 ммоль) в 1,2-дихлопентане (0,05 мл) и DIEA (0,0026 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем добавляли раствор триацетоксиборгидрида натрия (1,59 мг, 0,0075 ммоль) в ДМФ (0,05 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=530,5.
Пример Е52
(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-{2-фтор-4-[3-(4-гексилпиперазин-1-ил)пропокси]фенил}метанон
Раствор 1-бромгексана (0,83 мг, 0,005 ммоль) в ДМФ (0,05 мл) добавляли к раствору дигидрохлорида (6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-[2-фтор-4-(3-пиперазин-1-илпропокси)фенил]метанона из Примера Е5а (2,85 мг, 0,005 ммоль) в ДМФ (0,05 мл) и триэтиламине (0,0021 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=583,6.
Пример Е53
1-(4-{3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенокси]пропил}пиперазин-1-ил)этанон
Раствор ацетилхлорида (0,39 мг, 0,005 ммоль) в дихлорметане (0,05 мл) добавляли к раствору дигидрохлорида (3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-[3-метил-4-(3-пиперазин-1-илпропокси)фенил]метаноа (Соединение номер 408) (2,67 мг, 0,005 ммоль) в дихлорметане (0,05 мл) и триэтиламине (0,0035 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=503,2.
Пример Е54
{4-[3-(4-Метансульфонилпиперазин-1-ил)пропокси]-3-метилфенил}-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанон
Раствор метансульфонилхлорида (0,57 мг, 0,005 ммоль) в дихлорметане (0,05 мл) добавляли к раствору дигидрохлорида (3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-[3-метил-4-(3-пиперазин-1-илпропокси)фенил]метанона (Соединение номер 408) (2,67 мг, 0,005 ммоль) в дихлорметане (0,05 мл) и триэтиламине (0,0035 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=539,2.
Пример Е55
1-(4-[1,3]Диоксолан-2-илпиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-он
HBTU (327 мг, 0,86 ммоль) добавляли к раствору 4-[1,3]диоксолан-2-илпиперидина из Примера Е33 (143 мг, 0,91 ммоль) и 3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионовой кислоте из Примера Е45 (320 мг, 0,82 ммоль) в дихлорметане (20 мл) и DIEA (0,7 мл, 4,02 ммоль) и смесь перемешивали в течение 20 ч при комнатной температуре. Добавляли дихлорметан и раствор промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 4% метанол:96% дихлорметан до 8% метанол:92% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (359 мг, 83%).
Пример Е56
1-[4-(Фуран-2-карбонил)пиперазин-1-ил]-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-он
Раствор HBTU (1,90 мг, 0,005 ммоль) в ДМФ (0,05 мл) добавляли к раствору 3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионовой кислоты из Примера Е45 (1,95 мг, 0,005 ммоль) в ДМФ (0,05 мл) и DIEA (0,0022 мл). Смесь перемешивали при комнатной температуре в течение 30 мин, затем добавляли раствор 1-(2-фуроил)пиперазина (0,90 мг, 0,005 ммоль) в ДМФ (0,05 мл). Смесь перемешивали в течение 18 ч при комнатной температуре, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=553,4.
Пример Е57
(Е)-3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо-[f]азулен-9-карбонил)фенил]-1-[4-(2-пиперидин-1-илэтил)-пиперазин-1-ил]пропенон
Раствор HBTU (1,90 мг, 0,005 ммоль) в ДМФ (0,05 мл) добавляли к раствору (Е)-3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]акриловой кислоты из Примера Е46 (1,95 мг, 0,005 ммоль) в ДМФ (0,05 мл) и DIEA (0,0022 мл). Смесь перемешивали при комнатной температуре в течение 30 мин, затем добавляли раствор 1-(2-пиперидин-1-илэтил)пиперазина (0,99 мг, 0,005 ммоль) в ДМФ (0,05 мл). Смесь перемешивали в течение 18 ч при комнатной температуре, затем растворители удаляли в вакууме с получением указанного в заголовке соединения.
Пример Е58
1-{4-[(Бутилметиламино)метил]пиперидин-1-ил}-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-он
Пример Е58.1
1-{3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионил}пиперидин-4-
карбальдегид
Пиридиний пара-толуолсульфонат (85 мг, 0,34 ммоль) добавляли к раствору 1-(4-[1,3]диоксолан-2-илпиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она из Примера Е55 (614 мг, 1,16 ммоль) в ацетоне (20 мл) и воде (20 мл). Смесь кипятили с обратным холодильником в течение 7 дней, затем растворители удаляли в вакууме. Остаток перерастворяли в EtOAc, промывали 0,3М KHSO4, затем рассолом, сушили, концентрировали в вакууме, затем кристаллизовали с хлороформом и петролейным эфиром с получением указанного в заголовке соединения (451 мг, 80%).
Пример Е58.2
1-{4-[(Бутилметиламино)метил]пиперидин-1-ил}-3-[2-метил-4-(3-метил-4,10-дигидpo-3H-2,3,4,9-тeтpaaзaбeнзo[f]aзyлeн-9-кapбoнил)фeнил]пpoпaн-1-oн
Раствор 1-{3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионил}пиперидин-4-карбальдегида из Примера Е58.1 (2,43 мг, 0,005 ммоль) в 1,2-дихлопентане (0,05 мл) добавляли к раствору бутилметиламина (0,43 мг, 0,005 ммоль) в 1,2-дихлопентане (0,05 мл) и смесь нагревали при 50°С в течение 3 ч, затем перемешивали при комнатной температуре в течение 2 дней. Добавляли раствор триацетоксиборгидрида натрия (1,59 мг, 0,0075 ммоль) в ДМФ (0,05 мл) и смесь перемешивали в течение 20 ч при комнатной температуре. Растворители удаляли в вакууме с получением указанного в заголовке соединения. Масс-спектр (МС): (ИРЭ)+:[М+Н]+=557,6.
Пример Е59
3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-1-[4-(2-морфолин-4-илэтиламино)пиперидин-1-ил]пропан-1-он
Раствор 1-{3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо-[f]азулен-9-карбонил)фенил]пропионил}пиперидин-4-она (Соединение номер 701) (2,36 мг, 0,005 ммоль) в 1,2-дихлопентане (0,05 мл) добавляли к раствору 2-морфолин-4-илэтиламина (0,65 мг, 0,005 ммоль) в 1,2-дихлопентане (0,05 мл) и смесь нагревали при 50°С в течение 3 ч, затем перемешивали при комнатной температуре в течение 2 дней. Добавляли раствор триацетоксиборгидрида натрия (1,59 мг, 0,0075 ммоль) в ДМФ (0,05 мл) и смесь перемешивали в течение 20 ч при комнатной температуре. Растворители удаляли в вакууме с получением указанного в заголовке соединения. МС: (ИРЭ)+: [М+Н]+=586,6.
Пример Е60
1-(4-Гексилпиперазин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-он
Раствор 1-бромгексана (0,83 мг, 0,005 ммоль) в ДМФ (0,05 мл) добавляли к раствору 3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо-[f]азулен-9-карбонил)фенил]-1-пиперазин-1-илпропан-1-она из Примера Е47 (2,29 мг, 0,005 ммоль) в ДМФ (0,05 мл) и триэтиламине (0,0021 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=543,4.
Пример Е61
3-[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилфенил]-1-(4-пропилпиперазин-1-ил)пропан-1-он
Раствор пропиональдегида (0,29 мг, 0,005 ммоль) в 1,2-дихлопентане (0,05 мл) добавляли к раствору 3-[4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилфенил]-1-пиперазин-1-илпропан-1-она (2,36 мг, 0,005 ммоль) в 1,2-дихлопентане (0,05 мл) и DIEA (0,0026 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем добавляли раствор триацетоксиборгидрида натрия (1,59 мг, 0,0075 ммоль) в ДМФ (0,05 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=515,5.
Пример Е62
1-(4-Ацетилпиперазин-1-ил)-3-[4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилфенил]пропан-1-он
Раствор ацетилхлорида (0,39 мг, 0,005 ммоль) в дихлорметане (0,05 мл) добавляли к раствору 3-[4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилфенил]-1-пиперазин-1-илпропан-1-она (2,47 мг, 0,005 ммоль) в дихлорметане (0,05 мл) и триэтиламине (0,0035 мл). Смесь перемешивали при комнатной температуре в течение 20 ч, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=535,5.
Пример Е63
3-[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилфенил]-1-(4-метансульфонилпиперазин-1-ил)пропан-1-он
Раствор метансульфонилхлорида (0,57 мг, 0,005 ммоль) в дихлорметане (0,05 мл) добавляли к раствору 3-[4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилфенил]-1-пиперазин-1-илпропан-1-она (2,36 мг, 0,005 ммоль) в дихлорметане (0,05 мл) и триэтиламине (0,0035 мл). Смесь перемешивали при комнатной температуре в течение 20 ч, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=551,3.
Пример Е64
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-4-[2-метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]бутан-1-он
4-{4-[4-(3,3-Диметилбутил)пиперазин-1-ил]-4-оксобутил}-3-метилбензойную кислоту из Примера Е43 (139 мг, 0,37 ммоль) и 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен из Примера Е11 (75 мг, 0,37 ммоль) растворяли в дихлорметане (5 мл) и DIEA (0,195 мл, 1,11 ммоль). Добавляли WSCD (93 мг, 0,48 ммоль) и DMAP (9 мг, 0,07 ммоль) и смесь кипятили с обратным холодильником в течение 3 дней, затем промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (11 мг, 5%).
Пример Е65
N-Бензил-3-[4-(2,3,4,5-тетрагидробензо[b]азепин-1-карбонил)фенил]-пропионамид
Пример Е65.1
4-((Е)-2-Метоксикарбонилвинил)бензойная кислота
Гидрид натрия (60% дисперсия в масле, 1,46 г, 36,6 ммоль) добавляли к раствору 4-формилбензойной кислоты (5,0 г, 33,3 ммоль) в толуоле (200 мл) и смесь перемешивали в течение 2 ч при комнатной температуре. Добавляли метил(трифенилфосфоранилиден)ацетат (11,69 г, 35,0 ммоль) и смесь кипятили с обратным холодильником в течение 20 ч. Растворители удаляли в вакууме и остаток перерастворяли в дихлорметане и 1М NаНСО3. Слои распределялись и водный слой подкисляли 1М раствором HCl, затем экстрагировали хлороформом. Органический слой сушили и концентрировали в вакууме с получением указанного в заголовке соединения (3,65 г, 53%).
Пример Е65.2
Метиловый эфир (Е)-3-[4-(2,3,4,5-тетрагидробензо[b]азепин-1-карбонил)фенил1акриловой кислоты
WSCD (1,17 г, 6,16 ммоль) добавляли к раствору 4-((Е)-2-метоксикарбонилвинил)бензойной кислоты из Примера Е65.1 (740 мг, 3,59 ммоль), 2,3,4,5-тетрагидро-1H-бензо[b]азепина (445 мг, 3,02 ммоль) и DMAP (370 мг, 3,02 ммоль) в дихлорметане (40 мл) и триэтиламине (0,7 мл, 5,02 ммоль). Смесь кипятили с обратным холодильником в течение 42 ч, затем растворители концентрировали в вакууме. Остаток растворяли в EtOAc, промывали 1М KHSO4, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 30% EtOAc:70% петролейный эфир) с получением указанного в заголовке соединения (484 мг, 48%).
Пример Е65.3
Метиловый эфир 3-[4-(2,3,4,5-тетрагидробензо[b]азепин-1-карбонил)фенил]пропионовой кислоты
Метиловый эфир (Е)-3-[4-(2,3,4,5-тетрагидробензо[b]азепин-1-карбонил)фенил]акриловой кислоты из Примера Е65.2 (485 мг, 1,44 ммоль) растворяли в метаноле (60 мл) и гидрировали над 10% Pd/C катализатором (214 мг) в течение 2 ч. Смесь фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме с получением указанного в заголовке соединения (415 мг, 85%).
Пример Е65.4
3-[4-(2,3,4,5-Тетрагидробензо[b]азепин-1-карбонил)фенил]пропионовая кислота
Моногидрат гидроксида лития (114 мг, 2,72 ммоль) добавляли к раствору метилового эфира 3-[4-(2,3,4,5-тетрагидробензо[b]азепин-1-карбонил)фенил]пропионовой кислоты из Примера Е65.3 (415 мг, 1,23 ммоль) в воде (5 мл) и диоксане (20 мл). Смесь перемешивали в течение 18 ч при комнатной температуре, затем концентрировали в вакууме. Остаток растворяли в хлороформе, промывали 1М раствором HCl, затем рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (241 мг, 61%).
Пример Е65.5
N-Бензил-3-[4-(2,3,4,5-тетрагидробензо[b]азепин-1-карбонил)фенил]пропионамид
Смесь 3-[4-(2,3,4,5-тетрагидробензо[b]азепин-1-карбонил)фенил]пропионовой кислоты из Примера Е65.4 (57 мг, 0,18 ммоль) и тионилхлорид (0,2 мл, 2,74 ммоль) в дихлорметане (6 мл) кипятили с обратным холодильником в течение 2 ч, затем летучие вещества удаляли в вакууме.
Остаток растворяли в дихлорметане (8 мл), затем добавляли бензиламин (0,022 мл, 0,20 ммоль) и триэтиламин (0,05 мл, 0,36 ммоль). Смесь перемешивали в течение 3 ч при комнатной температуре, затем концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 30% петролейный эфир: 70% EtOAc) с получением белого мягкого твердого вещества, идентифицированного как указанное в заголовке соединение (36,5 мг, 50%).
Пример Е66
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-3-[2-метил-4-(2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)фенил]пропан-1-он
Оксалилхлорид (0,049 мл, 0,55 ммоль) медленно добавляли к раствору 4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]-3-оксопропил}-3-метилбензойной кислоты из Примера Е44 (100 мг, 0,28 ммоль) в дихлорметане (10 мл) и нескольких каплях ДМФ. Смесь перемешивали в течение 1 ч при комнатной температуре, затем концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток перерастворяли в дихлорметане (10 мл) и добавляли DIEA (0,144 мл, 0,84 ммоль) затем 2-метил-1,4,5,6-тетрагидро-1,3,6-триазабензо[е]азулен из Примера Е5 (55 мг, 0,28 ммоль). Смесь перемешивали в течение 20 ч при комнатной температуре, затем промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением белого мягкого твердого вещества, идентифицированного как указанное в заголовке соединение (42 мг, 28%).
Пример Е67
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-3-[2-метил-4-(6-метил-3,4-дигидро-2Н-хинолин-1-карбонил)фенил]пропан-1-он
DMAP (51 мг, 0,42 ммоль) и WSCD (161 мг, 0,84 ммоль) добавляли к раствору 4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]-3-оксопропил}-3-метил-бензойной кислоты из Примера Е44 (150 мг, 0,42 ммоль) в дихлорметане (10 мл) и триэтиламине (0,176 мл, 1,26 ммоль) и смесь перемешивали в течение 30 мин при комнатной температуре. Добавляли 6-метил-1,2,3,4-тетрагидрохинолин (67 мг, 0,46 ммоль) и смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме. Остаток перерастворяли в EtOAC, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (12 мг, 6%).
Пример Е68
(4-{3-[1-(3,3-Диметилбутил)пиперидин-4-ил]пропокси}-3-метилфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанон
Пример Е68.1
трет-Бутиловый эфир 4-(3-гидроксипропил)пиперидин-1-карбоновой кислоты
трет-Бутиловый эфир 4-(2-карбоксиэтил)пиперидин-1-карбоновой кислоты (1,0 г, 3,9 ммоль, в соответствии со способом, описанным в J. Med. Chem., 41(14), 2492, 1998), растворяли в ТГФ (50 мл) и охлаждали до 0°С. Медленно добавляли 2М раствор бора в ТГФ (3,9 мл, 7,8 ммоль) и смесь перемешивали в течение 20 ч при комнатной температуре. Добавляли воду и растворители концентрировали в вакууме. Остаток растворяли в EtOAC, подкисляли NаНСО3, промывали рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (938 мг, 99%).
Пример Е68.2
трет-Бутиловый эфир 4-[3-(4-метоксикарбонил-2-метилфенокси)-пропил]пиперидин-1-карбоновой кислоты
трет-Бутиловый эфир 4-(3-гидроксипропил)пиперидин-1-карбоновой кислоты из Примера Е68.1 (400 мг, 1,64 ммоль) и метиловый эфир 4-гидрокси-3-метилбензойной кислоты из Примера Е29 (274 мг, 1,64 ммоль) растворяли в ТГФ (30 мл) и охлаждали до 0°С. Добавляли трифенилфосфин на полимере (1,7 г, 2,46 ммоль), затем DEAD (0,387
мл, 2,46 ммоль), и смесь кипятили с обратным холодильником в течение 20 ч. Смолу отфильтровывали, промывали EtOAc и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле через Isolute (элюент; 20% EtOAC:80% циклогексан) с получением указанного в заголовке соединения (340 мг, 53%).
Пример Е68.3
трет-Бутиловый эфир 4-[3-(4-карбокси-2-метилФенокси)пропил]-пиперидин-1-карбоновой кислоты
2М Раствор NaOH (1,25 мл, 2,5 ммоль) добавляли к трет-бутиловому эфиру 4-[3-(4-метоксикарбонил-2-метилфенокси)пропил]пиперидин-1-карбоновой кислоты из Примера Е68.2 (340 мг, 0,87 ммоль) в диоксане (10 мл) и смесь нагревали при 60°С в течение 20 ч. Добавляли 2М раствор NaOH (5 мл, 10 ммоль) и смесь нагревали при 60°С в течение 20 ч, затем концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле через Isolute (элюент; 1% уксусная кислота:9% метанол:90% дихлорметан) с получением указанного в заголовке соединения (303 мг, 92%).
Пример Е68.4
трет-Бутиловый эфир 4-{3-[2-метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенокси]пропил}пиперидин-1-карбоновой кислоты
РуВrоР (224 мг, 0,48 ммоль) и DMAP (39 мг, 0,32 ммоль) добавляли к раствору трет-бутилового эфира 4-[3-(4-карбокси-2-метилфенокси)пропил]пиперидин-1-карбоновой кислоты из Примера Е68.3 (120 мг, 0,32 ммоль) и 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулена из Примера Е11 (70 мг, 0,35 ммоль) в дихлорметане (5 мл) и DIEA (0,111 мл, 0,64 ммоль). Смесь кипятили с обратным холодильником в течение 2 дней, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением указанного в заголовке соединения (71 мг, 40%).
Пример Е68.5
Гидрохлорид (3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-[3-метил-4-(3-пиперидин-4-илпропокси)фенил]метанона
4М HCl раствор в диоксане (1 мл) добавляли к раствору трет-бутилового эфира 4-{3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенокси]пропил}пиперидин-1-карбоновой кислоты из Примера Е68.4 (71 мг, 0,13 ммоль) в метаноле (3 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители концентрировали в вакууме. Остаток растирали с диэтиловым эфиром с получением указанного в заголовке соединения (61 мг, 97%).
Пример Е68.6
(4-{3-[1-(3,3-Диметилбутил)пиперидин-4-ил]пропокси}-3-метилфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанон
Уксусная кислота (0,05 мл) и 3,3-диметилмасляный альдегид (0,024 мл, 0,19 ммоль) добавляли к раствору гидрохлорида (3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-[3-метил-4-(3-пиперидин-4-илпропокси)фенил]метанона из Примера Е68.5 (60 мг, 0,12 ммоль) в метаноле (2,45 мл) и триэтиламине (0,026 мл, 0,19 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч, затем добавляли триацетоксиборгидрид натрия (40 мг, 0,19 ммоль). Смесь перемешивали при комнатной температуре в течение 18 ч, разбавляли дихлорметаном, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением белого мягкого твердого вещества, идентифицированного как указанное в заголовке соединение (33 мг, 48%).
Пример Е69
(4-{3-[4-(3,3-Диметилбутил)пиперазин-1-ил]пропокси}-3-фторфенил)-(2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]азулен-6-ил)метанон
Пример Е69.1
трет-Бутиловый эфир 4-{3-[4-(1-бензил-2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]азулен-6-карбонил)-2-фторфенокси]пропил}пиперазин-1-карбоновой кислоты
трет-Бутиловый эфир 4-[3-(4-карбокси-2-фторфенокси)пропил]-пиперазин-1-карбоновой кислоты из Примера Е39 (130 мг, 0,34 ммоль) растворяли в дихлорметане (5 мл) и нескольких каплях ДМФ. Медленно добавляли оксалилхлорид (0,059 мл, 0,68 ммоль) и смесь перемешивали в течение 30 мин при комнатной температуре. Растворители концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток растворяли в дихлорметане (5 мл) и добавляли 1-бензил-2-метил-1,4,5,6-тетрагидро-1,3,6-триазабензо[е]азулене из Примера Е5а (100 мг, 0,34 ммоль), затем DIEA (0,176 мл, 1,02 ммоль). Смесь перемешивали в течение 2 ч при комнатной температуре, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением указанного в заголовке соединения (110 мг, 50%).
Пример Е69.2
Дигидрохлорид (1-бензил-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]-азулен-6-ил)-[3-фтор-4-(3-пиперазин-1-илпропокси)фенил]метанона
трет-Бутиловый эфир 4-{3-[4-(1-бензил-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)-2-фторфенокси]пропил}пиперазин-1-карбоновой кислоты из Примера Е69.1 (110 мг, 0,17 ммоль) растворяли в метаноле (5 мл) и добавляли 4М HCl в диоксане (2 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем концентрировали в вакууме с получением указанного в заголовке соединения (105 мг, 100%).
Пример Е69.3
(1-Бензил-2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]азулен-6-ил)-(4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}-3-фторфенил)метанон
Дигидрохлорид (1-бензил-2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]-азулен-6-ил)-[3-фтор-4-(3-пиперазин-1-илпропокси)фенил]метанона из Примера Е69.2 (105 мг, 0,17 ммоль) растворяли в метаноле (2,45 мл) и триэтиламине (0,07 мл, 0,50 ммоль). Добавляли уксусную кислоту (0,05 мл), затем 3,3-диметилмасляный альдегид (0,032 мл, 0,25 ммоль) и смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли цианоборгидрид натрия (16 мг, 0,25 ммоль) и смесь перемешивали в течение 3 ч при комнатной температуре, затем концентрировали в вакууме. Остаток растворяли в дихлорметане, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 5% метанол:95% дихлорметан) с получением указанного в заголовке соединения (102 мг, 95%).
Пример Е69.4
(4-{3-[4-(3,3-Диметилбутил)пиперазин-1-ил]пропокси}-3-фторфенил)-(2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-ил)метанон
(1-Бензил-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-ил)-(4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}-3-фторфенил)метанон из Примера Е69.3 (90 мг, 0,14 ммоль) растворяли в метаноле (5 мл) и уксусной кислоте (1 мл) и гидрировали над катализатором 20 мас.% гидроксидом палладия (90 мг) в течение 8 ч. Смесь фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме. Остаток растворяли в дихлорметане, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол;90% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (39 мг, 51%).
Пример Е70
(4-{3-[4-(3,3-Диметилбутил)пиперазин-1-ил]пропокси}-3-метилфенил)-(2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]азулен-6-ил)метанон
Пример Е70.1
трет-Бутиловый эфир 4-{3-[4-(1-бензил-2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]азулен-6-карбонил)-2-метилфенокси]пропил}пиперазин-1-карбоновой кислоты
трет-Бутиловый эфир 4-[3-(4-карбокси-2-метилфенокси)пропил]-пиперазин-1-карбоновой кислоты (350 мг, 0,92 ммоль) растворяли в дихлорметане (5 мл) и нескольких каплях ДМФ. Медленно добавляли оксалилхлорид (0,162 мл, 1,84 ммоль) и смесь перемешивали в течение 30 мин при комнатной температуре. Растворители концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток растворяли в дихлорметане (10 мл) и добавляли 1-бензил-2-метил-1,4,5,6-тетрагидро-1,3,6-триазабензо[е]азулен из Примера Е5а (268 мг, 0,92 ммоль) затем DIEA (0,48 мл, 2,77 ммоль). Смесь перемешивали в течение 2 дней при комнатной температуре, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением указанного в заголовке соединения (230 мг, 38%).
Пример Е70.2
Дигидрохлорид (1-бензил-2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]-азулен-6-ил)-[3-метил-4-(3-пиперазин-1-илпропокси)фенил]метанона
трет-Бутиловый эфир 4-{3-[4-(1-бензил-2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]азулен-6-карбонил)-2-метилфенокси]пропил}пиперазин-1-карбоновой кислоты из Примера Е70.1 (230 мг, 0,35 ммоль) растворяли в метаноле (5 мл) и добавляли 4М HCl в диоксане (2 мл). Смесь перемешивали в течение 2 ч при комнатной температуре, затем концентрировали в вакууме и растирали с диэтиловым эфиром с получением указанного в заголовке соединения (215 мг, 98%).
Пример Е70.3
(1-Бензил-2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]азулен-6-ил)-(4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси)-3-метилфенил)метанон
Дигидрохлорид (1-бензил-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]-азулен-6-ил)-[3-метил-4-(3-пиперазин-1-илпропокси)фенил]метанона из Примера Е70.2 (100 мг, 0,16 ммоль) растворяли в метаноле (2,45 мл) и триэтиламине (0,068 мл, 0,48 ммоль). Добавляли уксусную кислоту (0,05 мл), затем 3,3-диметилмасляный альдегид (0,031 мл, 0,24 ммоль) и смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли цианоборгидрид натрия (16 мг, 0,24 ммоль) и смесь перемешивали в течение 20 ч при комнатной температуре, затем концентрировали в вакууме. Остаток растворяли в дихлорметане, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (98 мг, 96%).
Пример Е70.4
(4-{3-[4-(3,3-Диметилбутил)пиперазин-1-ил]пропокси}-3-метилфенил)-(2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]азулен-6-ил)метанон
(1-Бензил-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-ил)-(4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}-3-метилфенил)метанон из Примера Е70.3 (98 мг, 0,15 ммоль) растворяли в метаноле (5 мл) и уксусной кислоте (1 мл) и гидрировали над катализатором 20 мас.% гидроксидом палладия (98 мг) в течение 8 ч. Смесь фильтровали через стекловолокнистую бумагу и фильтрат концентрировали в вакууме. Остаток растворяли в дихлорметане, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (17 мг, 20%).
Пример Е71
N-(4-Хлорфенил)-4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}-3-фтор-N-метилбензамид
Пример Е71.1
трет-Бутиловый эфир 4-(3-{4-[(4-хлорфенил)метилкарбамоил]-2-фторфенокси}пропил)пиперазин-1-карбоновой кислоты
РуВrоР (606 мг, 1,3 ммоль) добавляли к раствору трет-бутилового эфира 4-[3-(4-карбокси-2-фторфенокси)пропил]пиперазин-1-карбоновой кислоты из Примера Е39 (382 мг, 1,0 ммоль) в дихлорметане (20 мл) и DIEA (до рН 9). Смесь перемешивали в течение 1 ч при комнатной температуре, затем добавляли (4-хлорфенил)метиламин (156 мг, 1,1 ммоль). Смесь перемешивали в течение 2 дней при комнатной температуре, затем растворители концентрировали в вакууме. Остаток растворяли в EtOAC, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc) с получением указанного в заголовке соединения (210 мг, 41%).
Пример Е71.2
Дигидрохлорид N-(4-хлорфенил)-3-Фтор-N-метил-4-(3-пиперазин-1-илпропокси)бензамид
трет-Бутиловый эфир 4-(3-{4-[(4-хлорфенил)метилкарбамоил]-2-фторфенокси}пропил)пиперазин-1-карбоновой кислоты из Примера Е71.1 (210 мг, 0,4 ммоль) растворяли в 4М HCl в диоксане (5 мл) и перемешивали в течение 1 ч при комнатной температуре. Растворители концентрировали в вакууме и подвергали азеотропной перегонке с толуолом с получением указанного в заголовке соединения (184 мг, 100%).
Пример Е71.3
N-(4-Хлорфенил)-4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}-3-фтор-N-метилбензамид
Дигидрохлорид N-(4-хлорфенил)-3-фтор-N-метил-4-(3-пиперазин-1-илпропокси)бензамид из Примера Е71.2 (184 мг, 0,4 ммоль) растворяли в метаноле (4,95 мл) и триэтиламине (0,167 мл, 1,2 ммоль). Добавляли уксусную кислоту (0,05 мл), затем 3,3-диметилмасляный альдегид (46 мг, 0,44 ммоль) и смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли цианоборгидрид натрия (31 мг, 0,5 ммоль) и смесь перемешивали в течение 20 ч при комнатной температуре, затем концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 10% метанол:90% дихлорметан) с получением белой пены, идентифицированной как указанное в заголовке соединение (77 мг, 37%).
Пример Е72
(4-{4-[4-(3,3-Диметилбутил)пиперазин-1-ил]бутокси}-3-фторфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанон
Пример Е72.1
Этиловый эфир 4-(4-бромбутокси)-3-фторбензойной кислоты
1,4-Дибромбутан (2,34 г, 10,8 ммоль), карбонат калия (1,86 г, 13,5 ммоль) и йодид калия (90 мг, 0,5 ммоль) добавляли к раствору этилового эфира 3-фтор-4-гидроксибензойной кислоты из Примера Е27 (1,0 г, 5,4 ммоль) в ацетоне (25 мл) и смесь кипятили с обратным холодильником в течение 20 ч. Твердое вещество отфильтровывали, промывали EtOAc и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 15% EtOAc:85% гексан) с получением указанного в заголовке соединения (1,38 г, 80%).
Пример Е72.2
Этиловый эфир 4-{4-[4-(3,3-диметилбутил)пиперазин-1-ил]бутокси}-3-фторбензойной кислоты
Гидрохлорид 1-(3,3-диметилбутил)пиперазина из Примера Е4 (874 мг, 3,7 ммоль), карбонат калия (2,5 г, 18,0 ммоль) и йодид калия (60 мг, 0,4 ммоль) добавляли к раствору этилового эфира 4-(4-бромбутокси)-3-фторбензойной кислоты из Примера Е72.1 (1,4 г, 4,4 ммоль) в ацетоне (35 мл) и смесь кипятили с обратным холодильником в течение 20 ч. Твердое вещество отфильтровывали, промывали EtOAc и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc до 1% 35% аммиак: 10% метанол:89% EtOAc) с получением указанного в заголовке соединения (1,35 г, 90%).
Пример Е72.3
4-{4-[4-(3,3-Диметилбутил)пиперазин-1-ил]бутокси}-3-фторбензойная кислота
Гидроксид натрия (0,5 г, 13,2 ммоль) и воду (5 мл) добавляли к раствору этилового эфира 4-{4-[4-(3,3-диметилбутил)пиперазин-1-ил]бутокси}-3-фторбензойной кислоты из Примера Е72.2 (1,35 г, 3,3 ммоль) в диоксане (20 мл). Смесь перемешивали в течение 1 ч при комнатной температуре, затем нагревали при 60°С в течение 20 ч. Растворители концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 1% 35% аммиак:19% метанол:80% хлороформ) с получением указанного в заголовке соединения (0,85 г, 67%).
Пример Е72.4
(4-{4-[4-(3,3-Диметилбутил)пиперазин-1-ил]бутокси}-3-Фторфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензоГЛазулен-9-ил)метанон
Смесь 4-{4-[4-(3,3-диметилбутил)пиперазин-1-ил]бутокси}-3-фторбензойной кислоты из Примера Е72.3 (190 мг, 0,5 ммоль) и тионилхлорида (2 мл) в дихлорметане (5 мл) кипятили с обратным холодильником в течение 1 ч. Растворители концентрировали в вакууме и остаток растворяли в дихлорметане (10 мл). Добавляли 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен из Примера Е11 (110 мг, 0,55 ммоль) и DIEA (до рН 9). Смесь перемешивали при комнатной температуре в течение 2 дней и концентрировали в вакууме. Остаток растворяли в EtOAC, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением бесцветного масла, идентифицированного как указанное в заголовке соединение (48 мг, 17%).
Пример Е73
(4-{2-[4-(3,3-Диметилбутил)пиперазин-1-ил]этокси}-3-метилфенил)-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанон
WSCD (58 мг, 0,30 ммоль) и DMAP (20 мг, 0,15 ммоль) добавляли к раствору 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулена из Примера Е11 (37 мг, 0,20 ммоль) и 4-{2-[4-(3,3-диметилбутил)пиперазин-1-ил]этокси}-3-метилбензойной кислоты из Примера Е40 (53 мг, 0,15 ммоль) в дихлорметане (5 мл) и триэтиламине (до рН 9). Смесь кипятили с обратным холодильником в течение 2 дней, затем концентрировали в вакууме. Остаток растворяли в EtOAC, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 10% метанол: 90% хлороформ) с получением не совсем белого твердого вещества, идентифицированного как указанное в заголовке соединение (3,5 мг, 4%).
Пример Е74
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-2-[2-метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенокси]этанон
Оксалилхлорид (42 мг, 0,34 ммоль) и 2 капли ДМФ при 0°С добавляли к раствору 4-{2-[4-(3,3-диметилбутил)пиперазин-1-ил]-2-оксоэтокси}-3-метилбензойной кислоты из Примера Е41 (100 мг, 0,28 ммоль) в дихлорметане (5 мл). Смесь перемешивали в течение 1 ч при комнатной температуре, концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток растворяли в дихлорметане (5 мл) и добавляли раствор 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулена из Примера Е11 (61 мг, 0,31 ммоль) в дихлорметане (1 мл) и триэтиламине (до рН 9). Смесь перемешивали в течение 2 дней при комнатной температуре, затем концентрировали в вакууме. Остаток растворяли в EtOAC, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток дважды очищали путем флэш-хроматографии на силикагеле (элюент; 5% метанол: 95% хлороформ до 10% метанол: 90% хлороформ, затем 5% метанол: 95% EtOAc до 10% метанол: 90% EtOAc) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (25 мг, 17%).
Пример Е75
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-2-[4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенокси]этанон
Пример Е75.1
(4-Бензилоксифенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]-азулен-9-ил)метанон
Оксалилхлорид (0,41 мл, 4,7 ммоль) и несколько капель ДМФ добавляли к раствору 4-(бензилокси)бензойной кислоты (855 мг, 3,7 ммоль) в дихлорметане (15 мл). Смесь перемешивали в течение 2 ч при комнатной температуре, концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток растворяли в дихлорметане (10 мл) и добавляли раствор 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулена из Примера Е11 (500 мг, 2,5 ммоль) в дихлорметане (10 мл) и триэтиламине (0,87 мл, 6,2 ммоль). Смесь перемешивали в течение 20 ч при комнатной температуре и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc до 3% метанол:97% EtOAc) с получением указанного в заголовке соединения (820 мг, 80%).
Пример Е75.2
(4-Гидроксифенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]-азулен-9-ил)метанон
(4-Бензилоксифенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанон из Примера Е75.1 (800 мг, 1,95 ммоль) растворяли в метаноле (100 мл) и гидрировали над 10% Pd/C катализатором (400 мг) в течение 7 ч. Смесь фильтровали через фильтрующий агент Celite®, промывали хлороформом и метанолом и фильтрат концентрировали в вакууме с получением указанного в заголовке соединения (140 мг, 22%).
Пример Е75.3
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-2-[4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенокси]этанон
Карбонат калия (104 мг, 0,76 ммоль) добавляли к смеси 2-бром-1-[4-(3,3-диметилбутил)пиперазин-1-ил]этанона из Примера Е37 (110 мг, 0,38 ммоль) и (4-гидроксифенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е75.2 (90 мг, 0,28 ммоль) в ацетонитриле (5 мл). Смесь кипятили с обратным холодильником в течение 20 ч, затем концентрировали в вакууме. Остаток растворяли в дихлорметане, промывали 5% раствором КНСО3, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (21 мг, 11%).
Пример Е76
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-4-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенокси]бутан-1-он
Пример Е76.1
трет-Бутиловый эфир 4-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенокси]масляной кислоты
WSCD (391 мг, 2,06 ммоль) и DMAP (133 мг, 1,09 ммоль) добавляли к раствору 4-(3-трет-бутоксикарбонилпропокси)-3-метилбензойной кислоты из Примера Е42 (275 мг, 0,94 ммоль) и 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулена из Примера Е11 (191 мг, 0,95 ммоль) в дихлорметане (30 мл) и триэтиламине (0,28 мл, 2,01 ммоль). Смесь кипятили с обратным холодильником в течение 72 ч, промывали 0,3М KHSO4, насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc) с получением указанного в заголовке соединения (80 мг, 18%).
Пример Е76.2
4-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенокси]масляная кислота
Трифторуксусную кислоту (5 мл) добавляли к раствору трет-бутилового эфира 4-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[Лазулен-9-карбонил)фенокси]масляной кислоты из Примера Е76.1 (80 мг, 0,17 ммоль) в дихлорметане (10 мл). Смесь перемешивали в течение 2 ч при комнатной температуре, концентрировали в вакууме и подвергали азеотропной перегонке дихлорметаном с получением указанного в заголовке соединения (71 мг, 100%).
Пример Е76.3
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-4-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)Фенокси]бутан-1-он
HBTU (101 мг, 0,27 ммоль) добавляли к раствору 4-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенокси]масляной кислоты из Е76.2 (71 мг, 0,17 ммоль) и дигидрохлорида 1-(3,3-диметилбутил)пиперазина из Примера Е4 (54 мг, 0,22 ммоль) в дихлорметане (10 мл) и DIEA (0,15 мл, 0,86 ммоль). Смесь перемешивали в течение 20 ч при комнатной температуре, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 6% метанол:94% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (52 мг, 53%).
Пример Е77
Пиперидин-4-илметиловый эфир 3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионовой кислоты
Пример Е77.1
Бензиловый эфир 4-{3-[2-метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионилоксиметил}пиперидин-1-карбоновой кислоты
WSCD (107 мг, 0,54 ммоль) и DMAP (33 мг, 0,27 ммоль) добавляли к раствору 3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионовой кислоты из Примера Е45 (106 мг, 0,27 ммоль) и бензилового эфира 4-гидроксиметилпиперидин-1-карбоновой кислоты (81 мг, 0,32 ммоль) в дихлорметане (5 мл) и DIEA (0,095 мл, 0,54 ммоль). Смесь перемешивали в течение 3 ч при комнатной температуре, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле через Isolute (элюент; EtOAc) с получением указанного в заголовке соединения (44 мг, 26%).
Пример Е77.2
Пиперидин-4-илметиловый эфир 3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионовой кислоты
Бензиловый эфир 4-{3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионилоксиметил}пиперидин-1-карбоновой кислоты из Примера Е77.1 (44 мг, 0,07 ммоль) растворяли в метаноле (5 мл) и гидрировали над 10% Pd/C катализатором (5 мг) в течение 2 ч. Смесь фильтровали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме с получением белого порошка, идентифицированного как указанное в заголовке соединение (34 мг, 98%).
Пример Е78
Метил(3-хлор-4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо-[f]азулен-9-карбонил)фенокси)ацетат
Диизопропилэтиламин (2,1 мл, 12,0 ммоль), диметиламинопиридин (0,74 г, 6,0 ммоль), РуВrоР® (4,20 г, 9,0 ммоль) и 3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен из Примера Е2 (1,28 г, 6,0 ммоль) добавляли к раствору трет-бутил 4-(2-(4-карбокси-3-хлорфенокси)ацетил)пиперазин-1-карбоксилата из Примера Е41 с (2,39 г, 6,0 ммоль) в дихлорметане (50 мл) и смесь кипятили с обратным холодильником в течение 20 ч. Реакционную смесь охлаждали, разбавляли дихлорметаном (50 мл), промывали насыщенным водным гидрокарбонатом натрия, сушили и концентрировали в вакууме. Остаток растворяли в метаноле (150 мл) и обрабатывали 4М раствором гидрохлорида в диоксане (50 мл) с охлаждением в ледяной бане. Раствор перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь упаривали и остаток суспендировали в воде и промывали хлороформом. Водный раствор обрабатывали твердым гидрокарбонатом натрия до основного значения рН, экстрагировали хлороформом, сушили и упаривали. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc с последующим градиентом от 2% до 10% метанол:98% до 90% EtOAc) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (0,53 г, 20%).
Пример Е79
1-(4-Гидроксиметилпиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-он
Боргидрид натрия (12 мг, 0,32 ммоль) добавляли к раствору 1-{3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионил}пиперидин-4-карбальдегида из Примера Е58.1 (74 мг, 0,15 ммоль) в метаноле (6 мл). Смесь перемешивали в течение 1 ч при комнатной температуре, подкисляли 1М HCl и концентрировали в вакууме. Остаток растворяли в EtOAc, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток кристаллизовали из хлороформа и петролейного эфира с получением белого порошка, идентифицированного как указанное в заголовке соединение (28 мг, 38%).
Пример Е80
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-3-[4-(3,4-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилфенил]пропан-1-он
Пример Е80.1
трет-Бутиловый эфир 3-[4-(3,4-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилфенил]пропионовой кислоты
Гидрид натрия (14 мг, 0,34 ммоль) при 0°С добавляли к раствору трет-бутилового эфира 3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионовой кислоты из Примера Е45 (125 мг, 0,28 ммоль) в ДМФ (2 мл). Смесь перемешивали в течение 20 мин при комнатной температуре, затем охлаждали до 0°С. Добавляли метилйодид (0,09 мл, 1,4 ммоль) и смесь перемешивали в течение 20 ч при комнатной температуре. Добавляли EtOAc и смесь промывали 0,3М KHSO4, затем рассолом, сушили, концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток очищали путем флэш-хроматографии на силикагеле через Isolute (элюент; EtOAc) с получением указанного в заголовке соединения (46 мг, 36%).
Пример Е80.2
3-[4-(3,4-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилфенил]пропионовая кислота
К трет-бутиловому эфиру 3-[4-(3,4-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилфенил]пропионовой кислоты из Примера Е80.1 (46 мг, 0,10 ммоль) в дихлорметане (5 мл) добавляли трифторуксусную кислоту (2 мл). Смесь перемешивали в течение 2 ч при комнатной температуре, затем концентрировали в вакууме с получением указанного в заголовке соединения (40 мг, 100%).
Пример Е80.3
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-3-[4-(3,4-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилфенил]пропан-1-он
Оксалилхлорид (0,018 мл, 0,20 ммоль) добавляли к раствору 3-[4-(3,4-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилфенил]пропионовой кислоты из Примера Е80.2 (40 мг, 0,10 ммоль) в дихлорметане (5 мл) и нескольких каплях ДМФ. Смесь перемешивали в течение 1 ч при комнатной температуре, концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток растворяли в дихлорметане (5 мл) и добавляли 1-(3,3-диметилбутил)пиперазин дигидрохлорид из Примера Е4 (30 мг, 0,12 ммоль) и DIEA (0,052 мл, 0,30 ммоль). Смесь перемешивали в течение 20 ч при комнатной температуре, промывали насыщенным NaHCО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (36 мг, 65%).
Пример Е81
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-4-[2-метил-4-(2,3,4,5-тетрагидробензо[е][1,4]диазепин-1-карбонил)фенил]бутан-1-он
Пример Е81.1
трет-Бутиловый эфир 1-(4-{4-[4-(3,3-диметилбутил)пиперазин-1-ил]-4-оксобутил}-3-метилбензоил)-1,2,3,5-тетрагидробензо[е][1,4]диазепин-4-карбоновой кислоты
WSCD (58 мг, 0,30 ммоль) и DMAP (18 мг, 0,15 ммоль) добавляли к раствору 4-{4-[4-(3,3-диметилбутил)пиперазин-1-ил]-4-оксобутил}-3-метилбензойной кислоты из Примера Е43 (55 мг, 0,15 ммоль) и трет-бутиловому эфиру 1,2,3,5-тетрагидробензо[е][1,4]диазепин-4-карбоновой кислоты (73 мг, 0,30 ммоль) в дихлорметане (3 мл) и DIEA (0,052 мл, 0,30 ммоль). Смесь кипятили с обратным холодильником в течение 5 дней, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением указанного в заголовке соединения (25 мг, 28%).
Пример Е81.2
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-4-[2-метил-4-(2,3,4,5-тетрагидробензо[е][1,4]диазепин-1-карбонил)фенил]бутан-1-он
трет-Бутиловый эфир 1-(4-{4-[4-(3,3-диметилбутил)пиперазин-1-ил]-4-оксобутил}-3-метилбензоил)-1,2,3,5-тетрагидробензо[е][1,4]диазепин-4-карбоновой кислоты из Примера Е81.1 (25 мг, 0,04 ммоль) растворяли в метаноле (2 мл) и добавляли 4М HCl в диоксане (2 мл). Смесь перемешивали в течение 1 ч при комнатной температуре, затем концентрировали в вакууме с получением белого порошка, идентифицированного как указанное в заголовке соединение (6 мг, 28%). (ИРЭ)+: [М+Н]+=505,5.
Пример Е82
4-[4-(7,8-Дигидро-6Н-5-окса-9-азабензоциклогептен-9-карбонил)-2-метилфенил]-1-[4-(3,3-диметилбутил)пиперазин-1-ил]бутан-1-он
WSCD (58 мг, 0,30 ммоль) и DMAP (18 мг, 0,15 ммоль) добавляли к раствору 4-{4-[4-(3,3-диметилбутил)пиперазин-1-ил]-4-оксобутил}-3-метилбензойной кислоты из Примера Е43 (55 мг, 0,15 ммоль) и 6,7,8,9-тетрагидро-5-окса-9-азабензоциклогептена (44 мг, 0,30 ммоль) в дихлорметане (3 мл) и DIEA (0,052 мл, 0,30 ммоль). Смесь кипятили с обратным холодильником в течение 5 дней, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак;9,5% метанол:90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (6 мг, 10%).
Пример Е83
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-5-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пентан-1-он
Пример Е83.1
Метиловый эфир 5-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пентановой кислоты
WSCD (822 мг, 4,3 ммоль) и DMAP (273 мг, 2,2 ммоль) добавляли к раствору 4-(4-метоксикарбонилбутил)-3-метилбензойной кислоты из Примера Е31 (571 мг, 2,3 ммоль) и 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулена из Примера Е11 (424 мг, 2,1 ммоль) в дихлорметане (50 мл) и триэтиламине (0,6 мл, 4,3 ммоль). Смесь кипятили с обратным холодильником в течение 72 ч, разбавляли дихлорметаном, промывали 0,3М KHSO4, насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc до 5% триэтиламин;95% EtOAc) с получением указанного в заголовке соединения (424 мг, 46%).
Пример Е83.2
5-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пентановая кислота
Моногидрат гидроксида лития (120 мг, 2,86 ммоль) добавляли к раствору метилового эфира 5-[2-метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пентановой кислоты из Примера Е83.1 (410 мг, 0,95 ммоль) в ТГФ (10 мл) и воде (5 мл). Смесь перемешивали в течение 24 ч при комнатной температуре и концентрировали в вакууме. Остаток подкисляли 1М HCl и экстрагировали хлороформом. Органический слой промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 3% уксусной кислоты:7% метанол:90% хлороформ) с получением указанного в заголовке соединения (105 мг, 26%).
Пример Е83.3
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-5-[2-метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пентан-1-он
HBTU (104 мг, 0,27 ммоль) добавляли к раствору 5-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пентановой кислоты из Е83.2 (105 мг, 0,25 ммоль) и дигидрохлорида 1-(3,3-диметилбутил)пиперазина из Примера Е4 (69 мг, 0,28 ммоль) в ДМФ (10 мл) и DIEA (0,2 мл, 1,15 ммоль). Смесь перемешивали в течение 24 ч при комнатной температуре, затем концентрировали в вакууме. Остаток растворяли в дихлорметане, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 4% метанол:96% дихлорметан до 8% метанол:92% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (88 мг, 62%).
Пример Е84
1-(4-Гидроксипиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-он
Боргидрид натрия (4 мг, 0,1 ммоль) добавляли к раствору 1-{3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-пропионил}пиперидин-4-она (Соединение номер 701) (50 мг, 0,11 ммоль) в метанол/уксусная кислота (99:1, об./об., 100 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Вновь добавляли боргидрид натрия (4 мг, 0,11 ммоль) и смесь перемешивали в течение 1 ч при комнатной температуре, затем концентрировали в вакууме. Остаток растворяли в дихлорметане, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме с получением белого порошка, идентифицированного как указанное в заголовке соединение (28 мг, 56%).
Пример Е85
1-(4-Циклобутилметилпиперазин-1-ил)-2-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]этанон
Пример Е85.1
Метиловый эфир 4-[2-(4-циклобутилметилпиперазин-1-ил)-2-оксоэтил]-3-метилбензойной кислоты
Оксалилхлорид (0,36 мл, 3,3 ммоль) добавляли к раствору метилового эфира 4-карбоксиметил-3-метилбензойной кислоты из Примера Е32 (687 мг, 3,3 ммоль) в дихлорметане (20 мл) и нескольких каплях ДМФ. Смесь перемешивали в течение 3 ч при комнатной температуре, концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток растворяли в дихлорметане (10 мл) и при 0°С добавляли к раствору дигидрохлорида 1-циклобутилметилпиперазина (750 мг, 3,3 ммоль) в дихлорметане (10 мл) и DIEA (1,73 мл, 9,9 ммоль). Смесь перемешивали в течение 20 ч при комнатной температуре и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 3% метанол:97% дихлорметан) с получением указанного в заголовке соединения (528 мг, 46%).
Пример Е85.2
4-[2-(4-Циклобутилметилпиперазин-1-ил)-2-оксоэтил]-3-метилбензойная кислота
Моногидрат гидроксида лития (122 мг, 2,9 ммоль) добавляли к раствору метилового эфира 4-[2-(4-циклобутилметилпиперазин-1-ил)-2-оксоэтил]-3-метилбензойной кислоты из Примера Е85.1 (500 мг, 1,4 ммоль) в ТГФ (10 мл) и воде (5 мл). Смесь перемешивали в течение 20 ч при комнатной температуре и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 3% уксусной кислоты:7% метанол:90% хлороформ) с получением указанного в заголовке соединения (300 мг, 63%).
Пример Е85.3
1-(4-Циклобутилметилпиперазин-1-ил)-2-[2-метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]этанон
WSCD (76 мг, 0,39 ммоль) и DMAP (7 мг, 0,06 ммоль) добавляли к раствору 4-[2-(4-циклобутилметилпиперазин-1-ил)-2-оксоэтил]-3-метил-бензойной кислоты из Примера Е85.2 (100 мг, 0,30 ммоль) и 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[1]азулена из Примера Е11 (61 мг, 0,30 ммоль) в дихлорметане (20 мл) и DIEA (0,16 мл, 0,91 ммоль). Смесь кипятили с обратным холодильником в течение 20 ч и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 4% метанол: 96% дихлорметан до 6% метанол: 94% дихлорметан до 1% 35% аммиак: 7% метанол: 92% дихлорметан) с получением не совсем белого твердого вещества, идентифицированного как указанное в заголовке соединение (50 мг, 32%).
Пример Е86
1-(4-Циклопропиламинометилпиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-он
Пример Е86.1
Метиловый эфир 4-(3-{4-[(трет-бутоксикарбонилциклопропиламино)-метил]пиперидин-1-ил}-3-оксопропил)-3-метилбензойной кислоты
Оксалилхлорид (1,26 мл, 14,4 ммоль) добавляли к раствору метилового эфира 4-(2-карбоксиэтил)-3-метилбензойной кислоты из Примера Е30.3 (1,60 г, 7,2 ммоль) в дихлорметане (50 мл) и нескольких каплях ДМФ. Смесь перемешивали в течение 1 ч при комнатной температуре, концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток растворяли в дихлорметане (50 мл) и добавляли DIEA (2,5 мл, 14,4 ммоль) и трет-бутиловый эфир циклопропилпиперидин-4-илметилкарбаминовой кислоты из Примера Е38 (1,83 г, 7,2 ммоль) в дихлорметане (5 мл). Смесь перемешивали в течение 2 ч при комнатной температуре, разбавляли дихлорметаном, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 50% EtOAc:50% циклогексан) с получением указанного в заголовке соединения (1,42 г, 43%).
Пример Е86.2
4-(3-{4-[(трет-Бутоксикарбонилциклопропиламино)метил]пиперидин-1-ил}-3-оксопропил)-3-метилбензойная кислота
Моногидрат гидроксида лития (142 мг, 3,4 ммоль) добавляли к раствору метилового эфира 4-(3-{4-[(трет-бутоксикарбонилциклопропиламино)-метил]пиперидин-1-ил}-3-оксопропил)-3-метилбензойной кислоты из Примера Е86.1 (1,41 г, 3,1 ммоль) в ТГФ (20 мл) и воде (2 мл). Смесь перемешивали в течение 16 ч при комнатной температуре, затем добавляли 1М раствор NaOH (5 мл). Смесь нагревали при 60°С в течение 3 ч, затем концентрировали в вакууме. Остаток растворяли в EtOAc, промывали 1М HCl, затем рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (1,25 г, 91%).
Пример Е86.3
трет-Бутиловый эфир циклопропил-(1-{3-[2-метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионил}-пиперидин-4-илметил)карбаминовой кислоты
WSCD (1,08 г, 5,6 ммоль) и DMAP (343 мг, 2,8 ммоль) добавляли к раствору 4-(3-{4-[(трет-бутоксикарбонилциклопропиламино)метил]пиперидин-1-ил}-3-оксопропил)-3-метилбензойной кислоты из Примера Е86.2 (1,25 г, 2,8 ммоль) в дихлорметане (100 мл) и триэтиламине (0,783 мл, 5,6 ммоль). Смесь перемешивали в течение 1 ч при комнатной температуре, затем добавляли 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен из Примера Е11 (676 мг, 3,4 ммоль). Смесь кипятили с обратным холодильником в течение 2 дней, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 2% метанол:98% EtOAc до 5% метанол:95% EtOAc) с получением указанного в заголовке соединения (1,1 г, 62%).
Пример Е86.4
1-(4-Циклопропиламинометилпиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-он
трет-Бутиловый эфир циклопропил-(1-{3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионил}-пиперидин-4-илметил)карбаминовой кислоты из Примера Е86.3 (220 мг, 0,35 ммоль) растворяли в метаноле (5 мл) и добавляли 4М раствор HCl в диоксане (5 мл). Смесь перемешивали в течение 2 ч при комнатной температуре, затем концентрировали в вакууме с получением не совсем белого твердого вещества, идентифицированного как указанное в заголовке соединение (189 мг, 95%).
Пример Е87
Гидрохлорид N-циклопропил-3-[2-метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-N-пиперидин-4-илметилпропионамида
Пример Е87.1
трет-Бутиловый эфир 4-[(циклопропил-{3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионил}-амино)метил]пиперидин-1-карбоновой кислоты
РуВrоР (238 мг, 0,51 ммоль) добавляли к раствору 3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионовой кислоты из Примера Е45 (200 мг, 0,51 ммоль) и трет-бутилового эфира 4-циклопропиламинометилпиперидин-1-карбоновой кислоты (130 мг, 0,51 ммоль) в дихлорметане (10 мл) и DIEA (0,18 мл, 1,02 ммоль). Смесь перемешивали в течение 4 дней при комнатной температуре, разбавляли EtOAc, промывали 5% КНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 5% метанол:95% дихлорметан) с получением указанного в заголовке соединения (235 мг, 73%).
Пример Е87.2
Гидрохлорид N-циклопропил-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-N-пиперидин-4-илметилпропионамида
трет-Бутиловый эфир 4-[(циклопропил-{3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионил}-амино)метил]пиперидин-1-карбоновой кислоты из Примера Е87.1 (235 мг, 0,37 ммоль) растворяли в 4М раствор HCl в диоксане (5 мл). Смесь перемешивали в течение 1 ч при комнатной температуре, концентрировали в вакууме и подвергали азеотропной перегонке с толуолом. Остаток растворяли в 1М HCl, дважды промывали дихлорметаном и лиофилизировали с получением не совсем белого твердого вещества, идентифицированного как указанное в заголовке соединение (82 мг, 39%).
Пример Е88
Этиловый эфир 1-метил-5-(3-метил-2-нитрофениламино)-1H-пиразол-4-карбоновой кислоты
Карбонат цезия (35,2 г, 108 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,4 г, 0,7 ммоль) и трис(дибензилиденацетон)дипалладий(0) (0,2 г, 0,2 ммоль) добавляли к раствору этил 5-амино-1-метилпиразол-4-карбоксилата (15,3 г, 90 ммоль) в диоксане (50 мл) в инертной атмосфере. Добавляли раствор 3-бром-2-нитротолуол (16,2 г, 75 ммоль) в диоксане (10 мл) и смесь перемешивали в течение 30 мин при комнатной температуре, затем кипятили с обратным холодильником в течение 72 ч. Суспензию фильтровали через фильтрующий агент Celite®, промывали EtOAc и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 50% EtOAc: 50% петролейный эфир), затем перекристаллизовывали из EtOAc/петролейный эфир с получением указанного в заголовке соединения (12,5 г, 45%).
Пример Е89
Этиловый эфир 5-амино-1-этил-1Н-пиразол-4-карбоновой кислоты
Триэтиламин (19,6 мл, 144 ммоль) осторожно добавляли к раствору этил (этоксиметилен)цианоацетата (10,1 г, 60 ммоль) и оксалата этилгидразина (9,9 г, 66 ммоль) в этаноле (200 мл). Смесь кипятили с обратным холодильником в течение 24 ч, затем концентрировали в вакууме. Остаток перерастворяли в EtOAc, промывали 5% раствором КНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 25% петролейный эфир: 75% EtOAc) с получением указанного в заголовке соединения (8,8 г, 80%).
Пример Е90
3-Фтор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламид 1-циклопропилметилпиперидин-4-карбоновой кислоты
Пример Е90.1
трет-Бутиловый эфир [3-фтор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензил]карбаминовой кислоты
Смесь 4-(трет-бутоксикарбониламинометил)-2-фторбензойной кислоты из Примера Е2 (1,35 г, 5,0 ммоль), 3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулена из Примера Е11 (1,0 г, 5,0 ммоль) и РуВrоР (3,03 г, 6,5 ммоль) в дихлорметане (25 мл) и DIEA (1,31 мл, 7,5 ммоль) кипятили с обратным холодильником в течение 18 ч. После охлаждения до комнатной температуры смесь промывали 5% КНСО3, 1М HCl, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc) с получением указанного в заголовке соединения (1,25 г, 56%).
Пример Е90.2
Гидрохлорид (4-аминометил-2-фторфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона
трет-Бутиловый эфир [3-фтор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензил]карбаминовой кислоты из Примера Е90.1 (1,25 г, 2,8 ммоль) приводили в реакцию с 4 н. HCl/диоксан с использованием способа, аналогичного описанному для Примера Е4.2, с получением указанного в заголовке соединения (1,0 г, 97%).
Пример Е90.3
3-Фтор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламид 1-циклопропилметилпиперидин-4-карбоновой кислоты
HBTU (227 мг, 0,6 ммоль) добавляли к раствору 1-циклопропилметилпиперидин-4-карбоновой кислоты из Примера Е15а (99 мг, 0,45 ммоль) в ДМФ (5 мл) и DIEA (до рН 9). Смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли гидрохлорид (4-аминометил-2-фторфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е90.2 (116 мг, 0,3 ммоль) и смесь перемешивали при комнатной температуре в течение 18 ч. Растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток перерастворяли в EtOAc, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 1% 35% аммиак:19% метанол:80% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (71,5 мг, 46%).
Пример Е91
Гидрохлорид N-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензил]-2-пиперидин-4-илацетамида
Раствор трет-бутилового эфира 4-{[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензилкарбамоил]метил}пиперидин-1-карбоновой кислоты (Соединение номер 1067) (156 мг, 0,27 ммоль) приводили в реакцию с 4 н. HCl/диоксан с использованием способа, аналогичного описанному для Примера Е4.2, с получением указанного в заголовке соединения (135 мг, 97%).
Пример Е92
2-[1-(3,3-Диметилбутил)пиперидин-4-ил]-N-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензил]ацетамид
3,3-Диметилмасляный альдегид (0,048 мл, 0,38 ммоль) добавляли к раствору N-[2-метил-4-(3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензил]-2-пиперидин-4-илацетамида из Примера Е91 (130 мг, 0,25 ммоль) в метанол/уксусная кислота (49:1, об./об., 2,5 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли цианоборгидрид натрия (24 мг, 0,38 ммоль) и смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали в вакууме. Остаток растворяли в дихлорметане, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле через Isolute (элюент; 1,5% 35% аммиак: 15% метанол; 83,5% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (107 мг, 75%).
Пример Е93
2-Хлор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламид 1-пропилпиперидин-4-карбоновой кислоты
Раствор пропионового альдегида (0,29 мг, 0,005 ммоль) в 1,2-дихлопентане (0,05 мл) добавляли к раствору гидрохлорида 2-хлор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида пиперидин-4-карбоновой кислоты (Соединение номер 1109) (2,8 мг, 0,005 ммоль) в 1,2-дихлопентане (0,05 мл) и DIEA (0,0026 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем добавляли раствор триацетоксиборгидрида натрия (1,59 мг, 0,0075 ммоль) в ДМФ (0,05 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=521,4.
Пример Е94
N-[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]-2-(1-гексилпиперидин-4-ил)ацетамид
Раствор 1-бромгексана (0,83 мг, 0,005 ммоль) в ДМФ (0,05 мл) добавляли к раствору гидрохлорида N-[4-(3,6-диметил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]-2-пиперидин-4-илацетамида (Соединение номер 1110) (2,82 мг, 0,005 ммоль) в ДМФ (0,05 мл) и триэтиламина (0,0021 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=575,7.
Пример Е95
N-[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-метилбензил]-3-(1-пропионилпиперидин-4-ил)пропионамид
Раствор пропионилхлорида (0,46 мг, 0,005 ммоль) в дихлорметане (0,05 мл) добавляли к раствору гидрохлорида N-[4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-метилбензил]-3-пиперидин-4-илпропионамида (Соединение номер 1108) (2,97 мг, 0,005 ммоль) в дихлорметане (0,05 мл) и триэтиламине (0,0035 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=577,4.
Пример Е96
N-[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-метилбензил]-3-(1-этансульфонилпиперидин-4-ил)пропионамид
Раствор этансульфонилхлорида (0,64 мг, 0,005 ммоль) в дихлорметане (0,05 мл) добавляли к раствору гидрохлорида N-[4-(6-хлор-3-метил-4,10-дигидpo-3H-2,3,4,9-тeтpaaзaбeнзo[f]aзyлeн-9-кapбoнил)-3-мeтилбeнзил]-3-пиперидин-4-илпропионамида (Соединение номер 1108) (2,97 мг, 0,005 ммоль) в дихлорметане (0,05 мл) и триэтиламине (0,0035 мл). Смесь перемешивали при комнатной температуре в течение 1 ч затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=613,4.
Пример Е97
4-Нитробензиловый эфир 4-{2-[4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-метилбензилкарбамоил]-этил}пиперидин-1-карбоновой кислоты
Раствор 4-нитробензилхлорформиата (1,08 мг, 0,005 ммоль) в дихлорметане (0,05 мл) добавляли к раствору гидрохлорида N-[4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-метилбензил]-3-пиперидин-4-илпропионамида (Соединение номер 1108) (2,97 мг, 0,005 ммоль) в дихлорметане (0,05 мл) и триэтиламине (0,0035 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем растворители удаляли в вакууме с получением указанного в заголовке соединения. (ИРЭ)+: [М+Н]+=700,5, 702,5.
Пример Е98
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламид пропан-1-сульфоновой кислоты
Пример Е98.1
трет-Бутиловый эфир [4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]карбаминовой кислоты
Смесь 4-(трет-бутоксикарбониламинометил)-3-фторбензойной кислоты из Примера Е3 (1,38 г, 5,1 ммоль) и 3,6-диметил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулена из Примера Е2 (1,0 г, 4,7 ммоль) в дихлорметане (20 мл) при комнатной температуре обрабатывали DIEA (2,44 мл, 14,0 ммоль), DMAP (627 мг, 5,1 ммоль) и WSCD (1,16 г, 6,1 ммоль). Раствор кипятили с обратным холодильником в течение 2 дней, затем промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле через Isolute (элюент; EtOAc) с получением указанного в заголовке соединения (1,29 г, 59%).
Пример Е98.2
Гидрохлорид (4-аминометил-3-фторфенил)-(3,6-диметил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона
трет-Бутиловый эфир [4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]карбаминовой кислоты из Примера Е98.1 (1,29 г, 2,8 ммоль) приводили в реакцию с 4 н. HCl/диоксан с использованием способа, аналогичного описанному для Примера Е4.2, с получением указанного в заголовке соединения (1,1 г, 99%).
Пример Е98.3
4-(3,6-Диметил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламид пропан-1-сульфоновой кислоты
1-Пропансульфонилхлорид (0,016 мл, 0,14 ммоль) при комнатной температуре добавляли к раствору гидрохлорида (4-аминометил-3-фторфенил)-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е98.2 (50 мг, 0,12 ммоль) в дихлорметане (2 мл) и триэтиламине (0,038 мл, 0,27 ммоль). Смесь перемешивали в течение 1 ч затем концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (30 мг, 51%).
Пример Е99
N-[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]формамид
Муравьиную кислоту (0,85 мл, 22,5 ммоль) и уксусный ангидрид (1,4 мл, 13,5 ммоль) объединяли и перемешивали в течение 1 ч при комнатной температуре. Добавляли гидрохлорид (4-аминометил-3-фторфенил)-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е98.2 (113 мг, 0,3 ммоль) и смесь перемешивали в течение 1 ч. Добавляли воду (20 мл) и смесь перемешивали в течение 1 ч. Ее разбавляли хлороформом, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (48 мг, 40%).
Пример Е100
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f|зулен-9-карбонил)-2-фторбензиламид циклопропанкарбоновой кислоты
DIEA (0,08 мл, 0,46 ммоль) и циклопропанкарбонилхлорид (0,013 мл, 0,14 ммоль) при 0°С добавляли к раствору гидрохлорида (4-аминометил-3-фторфенил)-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е98.2 (57 мг, 0,14 ммоль) в дихлорметане (10 мл). Смесь перемешивали в течение 90 мин при комнатной температуре, затем разбавляли дихлорметаном, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (33 мг, 54%).
Пример Е101
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламид циклопропанкарбоновой кислоты
Пример Е101.1
4-(3,6-Диметил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензонитрил
Смесь 4-циано-3-метилбензойной кислоты из Примера Е6 (753 мг, 4,7 ммоль) и тионилхлорида (1,02 мл, 14,0 ммоль) в толуоле (50 мл) кипятили с обратным холодильником в течение 2 ч. После охлаждения при комнатной температуре растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток перерастворяли в дихлорметане (45 мл) и медленно добавляли раствор 3,6-диметил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен из Примера Е2 (1,0 г, 4,7 ммоль) в дихлорметане (5 мл) и триэтиламине (1,3 мл, 9,3 ммоль). Смесь перемешивали при комнатной температуре в течение 20 ч, промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле через Isolute (элюент; EtOAc) с получением указанного в заголовке соединения (1,42 г, 85%).
Пример Е101.2
(4-Аминометил-3-метилфенил)-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанон
Раствор 4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензонитрила из Примера Е101.1 (1,42 г, 4,0 ммоль) в метаноле (50 мл) при 0°С обрабатывали гексагидратом хлорида кобальта (II) (1,90 г, 8,0 ммоль). Смесь перемешивали в течение 15 мин при комнатной температуре, затем порциями добавляли боргидрид натрия (1,51 г, 40,0 ммоль). Реакционную смесь перемешивали в течение 2 ч, затем добавляли насыщенный NH4Cl. Смесь перемешивали в течение 30 мин, затем твердое вещество отфильтровывали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме. Остаток перерастворяли в EtOAc и насыщенном NаНСО3. Слои распределялись и водный слой экстрагировали дополнительным количеством хлороформа. Органические фазы объединяли, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле через Isolate (элюент; 1% 35% аммиак: 9% метанол: 90% дихлорметан) с получением указанного в заголовке соединения (511 мг, 35%).
Пример Е101.3
4-(3,6-Диметил-4.10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламид циклопропанкарбоновой кислоты
Триэтиламин (0,145 мл, 1,04 ммоль) и циклопропанкарбонилхлорид (0,041 мл, 0,45 ммоль) при комнатной температуре добавляли к раствору (4-аминометил-3-метилфенил)-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е101.2 (150 мг, 0,41 ммоль) в дихлорметане (10 мл). Смесь перемешивали в течение 20 ч, затем концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением не совсем белого твердого вещества, идентифицированного как указанное в заголовке соединение (91 мг, 51%).
Пример Е102
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламид циклопропанкарбоновой кислоты
Пример Е102.1
трет-Бутиловый эфир [4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]карбаминовой кислоты
Раствор 4-(трет-бутоксикарбониламинометил)-3-фторбензойной кислоты из Примера Е3 (568 мг, 2,1 ммоль) в дихлорметане (25 мл) при комнатной температуре обрабатывали DMAP (256 мг, 2,1 ммоль), DIEA (1,1 мл, 6,3 ммоль), затем WSCD (520 мг, 2,7 ммоль). Смесь перемешивали в течение 3 ч затем добавляли 6-хлор-3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен из Примера Е1 (450 мг, 1,9 ммоль). Смесь перемешивали в течение 4 дней, затем промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc) с получением указанного в заголовке соединения (503 мг, 54%).
Пример Е102.2
Гидрохлорид (4-аминометил-3-фторфенил)-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона
трет-Бутиловый эфир [4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]карбаминовой кислоты из Примера Е102.1 (503 мг, 1,03 ммоль) приводили в реакцию с 4 н. HCl/диоксан с использованием способа, аналогичного описанному для Примера Е4.2, с получением указанного в заголовке соединения (440 мг, 100%).
Пример Е102.3
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламид циклопропанкарбоновой кислоты
Циклопропанкарбонилхлорид (0,045 мл, 0,5 ммоль) при 0°С добавляли к раствору гидрохлорида (4-аминометил-3-фторфенил)-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е102.2 (210 мг, 0,5 ммоль) в дихлорметане (40 мл) и DIEA (0,30 мл, 1,7 ммоль). Смесь перемешивали в течение 1 ч при комнатной температуре, затем промывали насыщенным NаНСО3, рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (134 мг, 59%).
Пример Е103
N-[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]пропионамид
DIEA (0,27 мл, 1,56 ммоль) и пропионил хлорид (0,048 мл, 0,55 ммоль) при комнатной температуре добавляли к раствору гидрохлорида (4-аминометил-3-фторфенил)-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е102.2 (220 мг, 0,52 ммоль) в дихлорметане (6 мл). Смесь перемешивали в течение 2 ч, промывали насыщенным NaHCО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (129 мг, 56%).
Пример Е104
N-[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]бутирамид
DIEA (0,135 мл, 0,78 ммоль) и бутирилхлорид (0,027 мл, 0,27 ммоль) при комнатной температуре добавляли к раствору гидрохлорида (4-аминометил-3-фторфенил)-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е102.2 (110 мг, 0,26 ммоль) в дихлорметане (3 мл). Смесь перемешивали в течение 1 ч, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (77 мг, 65%).
Пример Е105
N-[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]изобутирамид
DIEA (0,135 мл, 0,78 ммоль) и изобутирилхлорид (0,029 мл, 0,27 ммоль) при комнатной температуре добавляли к раствору гидрохлорида (4-аминометил-3-фторфенил)-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е102.2 (110 мг, 0,26 ммоль) в дихлорметане (3 мл). Смесь перемешивали в течение 1 ч, промывали насыщенным NaHCО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (85 мг, 71%).
Пример Е106
2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламид циклопропанкарбоновой кислоты
Пример Е106.1
трет-Бутиловый эфир [2-хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензил]карбаминовой кислоты
Раствор 4-(трет-бутоксикарбониламинометил)-3-хлорбензойной кислоты из Примера Е2b (568 мг, 2,0 ммоль) в дихлорметане (25 мл) при комнатной температуре обрабатывали DMAP (244 мг, 2,0 ммоль), DIEA (1,0 мл, 6,0 ммоль), затем WSCD (500 мг, 2,6 ммоль). Смесь перемешивали в течение 3 ч, затем добавляли 6-хлор-3-метил-3,4,9,10-тетрагидро-2,3,4,9-тетраазабензо[f]азулен из Примера Е1 (430 мг, 1,8 ммоль). Смесь перемешивали в течение 4 дней, затем промывали насыщенным NаНСО3, рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc) с получением указанного в заголовке соединения (570 мг, 63%).
Пример Е106.2
Гидрохлорид (4-аминометил-3-хлорфенил)-(6-хлор-3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона
трет-Бутиловый эфир [2-хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензил]карбаминовой кислоты из Примера Е106.1 (570 мг, 1,13 ммоль) приводили в реакцию с 4 н. HCl/диоксан с использованием способа, аналогичного описанному для Примера Е4.2, с получением указанного в заголовке соединения (490 мг, 100%).
Пример Е106.3
2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламид циклопропанкарбоновой кислоты
Циклопропанкарбонилхлорид (0,045 мл, 0,5 ммоль) при 0°С добавляли к раствору гидрохлорида (4-аминометил-3-хлорфенил)-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е106.2 (220 мг, 0,5 ммоль) в дихлорметане (40 мл) и DIEA (0,30 мл, 1,7 ммоль). Смесь перемешивали в течение 1 ч при комнатной температуре, затем промывали насыщенным NаНСО3, рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (135 мг, 57%).
Пример Е107
N-[2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]-азулен-9-карбонил)бензил]бутирамид
Бутирилхлорид (46 мг, 0,4 ммоль) при комнатной температуре добавляли к раствору гидрохлорида (4-аминометил-3-хлорфенил)-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е106.2 (161 мг, 0,4 ммоль) в дихлорметане (10 мл) и триэтиламине (до рН 9). Смесь перемешивали в течение 20 ч, разбавляли EtOAc, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (110 мг, 58%).
Пример Е108
N-[2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]-азулен-9-карбонил)бензил]изобутирамид
Изобутирилхлорид (46 мг, 0,4 ммоль) при комнатной температуре добавляли к раствору гидрохлорида (4-аминометил-3-хлорфенил)-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е106.2 (161 мг, 0,4 ммоль) в дихлорметане (10 мл) и триэтиламине (до рН 9). Смесь перемешивали в течение 18 ч, разбавляли EtOAc, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (75 мг, 40%).
Пример Е109
{4-[(Циклопропилметиламино)метил]-3-метилфенил}(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанон
Циклопропанкарбоксальдегид (26 мг, 0,34 ммоль) добавляли к раствору (4-аминометил-3-метилфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона (131 мг, 0,38 ммоль) в МеОН/АсОН (99:1, 5 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли цианоборгидрид натрия (31 мг, 0,49 ммоль) и смесь перемешивали при комнатной температуре в течение 18 ч. Растворители удаляли в вакууме и остаток растворяли в EtOAc. Раствор промывали насыщ. водн. NаНСО3 и рассолом, затем сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (70 мг, 51%).
Пример Е110
Метиловый эфир [4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламино]уксусной кислоты
и
Пример Е111
Метиловый эфир {[4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]метоксикарбонил-метиламино}уксусной кислоты
Метилбромацетат (0,054 мл, 0,58 ммоль) добавляли к раствору гидрохлорида (4-аминометил-3-фторфенил)-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е102.2 (107 мг, 0,28 ммоль) и DIEA (0,26 мл, 1,53 ммоль) в ТГФ (25 мл), и смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли дополнительное количество метилбромацетата (0,10 мл, 1,11 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. Раствор гасили водой и разбавляли EtOAc. Органический слой промывали рассолом (×3), сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением двух продуктов. Более быстро элюируемый раствор изолировали в виде белого твердого вещества и идентифицировали как Е111 (68 мг, 46%).
Более медленно элюируемый продукт изолировали в виде белого твердого вещества и идентифицировали как Е110 (13 мг, 10%).
Пример Е112
(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-{3-фтор-4-[(2-гидроксиэтиламино)метил]фенил}метанон
Алюмогидрид лития (14,5 мг, 0,38 ммоль) добавляли к раствору метилового эфира [4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламино]уксусной кислоты из Примера Е110 (58,5 мг, 0,13 ммоль) в ТГФ (5 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. Гасили МеОН и экстрагировали EtOAc. Органический экстракт промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 10% метанол: 90% дихлорметан затем 20% метанол: 80% дихлорметан) с получением бледно-желтого твердого вещества, идентифицированного как указанное в заголовке соединение (15 мг, 28%).
Пример Е113
трет-Бутиловый эфир {[4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензилкарбамоил]метил}-карбаминовой кислоты
HBTU (165 мг, 0,44 ммоль) добавляли к раствору N-(трет-бутоксикарбонил)глицина (65 мг, 0,37 ммоль) в ДМФ (10 мл) и смесь перемешивали в течение 30 мин при комнатной температуре. Добавляли гидрохлорид (4-аминометил-3-фторфенил)-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона из Примера Е102.2 (100 мг, 0,22 ммоль) и DIEA (0,228 мл, 1,31 ммоль) и смесь перемешивали в течение 24 ч при комнатной температуре. Раствор разбавляли EtOAc, промывали водой, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 5% метанол:95% дихлорметан затем 10% метанол:90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (123 мг, 100%).
Пример Е114
Гидрохлорид 2-амино-N-[4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]ацетамид
трет-Бутиловый эфир {[4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензилкарбамоил]метил}-карбаминовой кислоты из Примера Е113 (120 мг, 0,22 ммоль) приводили в реакцию с 4 н. HCl/диоксан с использованием способа, аналогичного описанному для Примера Е4.2, с получением указанного в заголовке соединения (95 мг, 83%).
Пример Е115
4-[(3-Хлорбензоиламино)метил]-N-(4-хлорфенил)-3,N-диметил-бензамид
Пример Е115.1
N-(4-Хлорфенил)-4-циано-3,N-диметилбензамид
Смесь 4-циано-3-метилбензойной кислоты из Примера Е6 (3,4 г, 21 ммоль) и тионилхлорида (10 мл, 137 ммоль) в дихлорметане (50 мл) кипятили с обратным холодильником в течение 2 ч. После охлаждения при комнатной температуре растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток перерастворяли в дихлорметане (50 мл). Добавляли (4-хлорфенил)метиламин (3,0 г, 21 ммоль) и триэтиламин (до рН 9) и смесь перемешивали при комнатной температуре в течение 20 ч, затем концентрировали в вакууме. Остаток перерастворяли в EtOAc, промывали 1М KHSO4, водой, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 35% EtOAc;65% циклогексан) с получением указанного в заголовке соединения (5,1 г, 85%).
Пример Е115.2
4-Аминометил-N-(4-хлорфенил)-3,N-диметилбензамид
Раствор N-(4-хлорфенил)-4-циано-3,N-диметилбензамида из Примера Е115.1 (5,1 г, 17,9 ммоль) в метаноле (250 мл) обрабатывали гексагидратом хлорида кобальта (II) (8,4 г, 35,8 ммоль). Смесь перемешивали в течение 15 мин при комнатной температуре, затем охлаждали до 0°С и порциями добавляли боргидрид натрия (6,7 г, 179 ммоль). Смесь перемешивали в течение 1 ч при комнатной температуре, фильтровали через фильтрующий агент Celite®, промывали метанол и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 1% 35% аммиак: 10% метанол:89% дихлорметан) с получением указанного в заголовке соединения (3,6 г, 70%).
Пример Е115.3
4-[(3-Хлорбензоиламино)метил]-N-(4-хлорфенил)-3,N-диметилбензамид
3-Хлорбензоилхлорид (61 мг, 0,35 ммоль) и триэтиламин (до рН 9) при комнатной температуре добавляли к раствору 4-аминометил-N-(4-хлорфенил)-3,N-диметилбензамида из Примера Е115.2 (100 мг, 0,35 ммоль) в дихлорметане (5 мл). Смесь перемешивали в течение 1 ч, затем концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35%-ный аммиак:9,5% метанол:90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (101 мг, 69%).
Пример Е116
4-[(4-Хлорфенил)метилкарбамоил]-2-метилбензиламид 1-цикло-пропилметилпиперидин-4-карбоновой кислоты
РуВrоР (212 мг, 0,45 ммоль) и 1-циклопропилметилпиперидин-4-карбоновую кислоту из Примера Е15а (76 мг, 0,42 ммоль) добавляли к раствору 4-аминометил-N-(4-хлорфенил)-3,N-диметилбензамида из Примера Е115.2 (100 мг, 0,35 ммоль) в дихлорметане (5 мл) и ДМФ (1 мл). Смесь перемешивали при комнатной температуре в течение 18 ч, затем растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (34 мг, 22%).
Пример Е117
4-[(4-Хлорфенил)метилкарбамоил]-2-метилбензиламид 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты
HBTU (296 мг, 0,78 ммоль) добавляли к раствору 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты из Примера Е15 (182 мг, 0,73 ммоль) в ДМФ (5 мл) и DIEA (0,272 мл, 1,56 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч, затем добавляли 4-аминометил-N-(4-хлорфенил)-3,N-диметилбензамид из Примера Е115.2 (150 мг, 0,52 ммоль). Смесь перемешивали в течение 2 ч при комнатной температуре, затем разбавляли EtOAc, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (209 мг, 83%).
Пример Е118
2-Метил-4-[метил(4-трифторметилфенил)карбамоил]бензиламид 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты
Пример Е118.1
4-Циано-3-метил-N-(4-трифторметилфенил)бензамид
Смесь 4-циано-3-метилбензойной кислоты из Примера Е6 (750 мг, 4,6 ммоль) и тионилхлорида (1,02 мл, 14,0 ммоль) в толуоле (40 мл) кипятили с обратным холодильником в течение 2 ч. После охлаждения при комнатной температуре растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток перерастворяли в дихлорметане (25 мл), затем добавляли гидрохлорид 4-трифторметиланилина (1,11 г, 5,6 ммоль) в дихлорметане (5 мл) и триэтиламине (1,95 мл, 14,0 ммоль). Смесь перемешивали при комнатной температуре в течение 2 дней, промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле через Isolute (элюент; 20% EtOAc:80% циклогексан) с получением указанного в заголовке соединения (1,13 г, 80%).
Пример Е118.2
4-Циано-3,N-диметил-N-(4-трифторметилфенил)бензамид
4-Циано-3-метил-N-(4-трифторметилфенил)бензамид из Примера Е118.1 (1,10 г, 3,6 ммоль) растворяли в ДМФ (10 мл) и охлаждали до 0°С.Добавляли гидрид натрия (60% дисперсия в масле, 174 мг, 4,3 ммоль) и смесь перемешивали в течение 30 мин при комнатной температуре. Добавляли метилйодид (0,27 мл, 4,3 ммоль) и смесь перемешивали в течение 20 ч. Растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток перерастворяли в EtOAc, промывали рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (1,08 г, 94%).
Пример Е118.3
4-Аминометил-3,N-диметил-N-(4-трифторметилфенил)бензамид
Раствор 4-циано-3,N-диметил-N-(4-трифторметилфенил)бензамида из Примера Е118.2 (1,08 г, 3,4 ммоль) в метаноле (40 мл) при комнатной температуре обрабатывали гексагидратом хлорида кобальта (II) (1,61 г, 6,8 ммоль). Смесь перемешивали в течение 10 мин, затем порциями добавляли боргидрид натрия (1,28 г, 34 ммоль). Смесь перемешивали в течение 20 ч, затем добавляли насыщенный раствор NH4Cl (10 мл). Смесь перемешивали в течение 30 мин, фильтровали через стекловолокнистую бумагу и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 1% 35% аммиак:9% метанол:90% дихлорметан) с получением указанного в заголовке соединения (863 мг, 79%).
Пример Е118.4
2-Метил-4-[метил-(4-триФторметилфенил)карбамоил]бензиламид 1-(3.3-диметилбутил)пиперидин-4-карбоновой кислоты
РуВrоР (188 мг, 0,40 ммоль) и 1-(3,3-диметилбутил)пиперидин-4-карбоновую кислоту (82 мг, 0,38 ммоль) добавляли к раствору 4-аминометил-3,N-диметил-N-(4-трифторметилфенил)бензамида из Примера Е118.3 (100 мг, 0,31 ммоль) в дихлорметане (5 мл) и DIEA (0,081 мл, 0,46 ммоль). Смесь перемешивали при комнатной температуре в течение 2 дней, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением не совсем белого порошка, идентифицированного как указанное в заголовке соединение (22 мг, 14%).
Пример Е119
2-Метил-4-(2-метил-4,5-дигидро-1-окса-3,6-диазабензо[е]азулен-6-карбонил)бензиламид циклопропанкарбоновой кислоты
Пример Е119.1
трет-Бутиловый эфир [2-метил-4-(2-метил-4,5-дигидро-1-окса-3,6-диазабензо[е]азулен-6-карбонил)бензил]карбаминовой кислоты
Раствор 4-(трет-бутоксикарбониламинометил)-3-метилбензойной кислоты из Примера Е2h (400 мг, 1,5 ммоль) в дихлорметане (20 мл) и триэтиламине (до рН 9) обрабатывали WSCD (573 мг, 3,0 ммоль) и DMAP (183 мг, 1,5 ммоль). Раствор перемешивали в течение 30 мин при комнатной температуре, затем добавляли 2-метил-5,6-дигидро-4H-1-окса-3,6-диазабензо[е]азулен из Примера Е6 (300 мг, 1,5 ммоль) и смесь кипятили с обратным холодильником в течение 3 дней. Добавляли WSCD (287 мг, 1,5 ммоль) и смесь кипятили с обратным холодильником в течение еще 24 ч, затем концентрировали в вакууме. Остаток растворяли в EtOAc, промывали 1 н. KHSO4, водой, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; EtOAc) с получением указанного в заголовке соединения (62 мг, 9%).
Пример Е119.2
Гидрохлорид (4-аминометил-3-метилфенил)-(2-метил-4,5-дигидро-1-окса-3,6-диазабензо[е]азулен-6-ил)метанона
трет-Бутиловый эфир [2-метил-4-(2-метил-4,5-дигидро-1-окса-3,6-диазабензо[е]азулен-6-карбонил)бензил]карбаминовой кислоты из Примера Е119.1 (62 мг, 0,14 ммоль) в метаноле (0,5 мл) приводили в реакцию с 4 н. HCl/диоксан с использованием способа, аналогичного описанному для Примера Е4.2, с получением указанного в заголовке соединения (53 мг, 100%).
Пример Е119.3
2-Метил-4-(2-метил-4,5-дигидро-1-окса-3,6-диазабензо[е]азулен-6-карбонил)бензиламид циклопропанкарбоновой кислоты
Циклопропанкарбонилхлорид (26 мг, 0,25 ммоль) при комнатной температуре добавляли к раствору гидрохлорида (4-аминометил-3-метилфенил)-(2-метил-4,5-дигидро-1-окса-3,6-диазабензо[е]азулен-6-ил)метанона из Примера Е119.2 (85 мг, 0,22 ммоль) в дихлорметане (5 мл) и триэтиламине (до рН 9). Смесь перемешивали в течение 1 ч, затем очищали путем флэш-хроматографии на силикагеле (элюент; 10% метанол:90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (62 мг, 67%).
Пример Е120
2-Метил-4-(2-метил-4,5-дигидро-1-окса-3,6-диазабензо[е]азулен-6-карбонил)бензиламид 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты
Гидрохлорид (4-аминометил-3-метилфенил)-(2-метил-4,5-дигидро-1-окса-3,6-диазабензо[е]азулен-6-ил)метанона из Примера Е119.2 (89 мг, 0,225 ммоль) при комнатной температуре растворяли в дихлорметане (10 мл) и триэтиламине (до рН 9). Добавляли 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты (53 мг, 0,25 ммоль), DMAP (27 мг, 0,225 ммоль) и РуВrоР (165 мг, 0,36 ммоль) и смесь кипятили с обратным холодильником в течение 18 ч. Раствор разбавляли EtOAc, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем срлэш-хроматографии на силикагеле (элюент; 1% 35% аммиак: 9% метанол: 90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (84 мг, 69%).
Пример Е121
4-(1-Бензил-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)-2-метилбензиламид 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты
Пример Е121.1
4-(1-Бензил-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)-2-метилбензонитрил
Смесь 4-циано-3-метилбензойной кислоты из Примера Е6 (557 мг, 3,4 ммоль) и тионилхлорида (0,755 мл, 10,3 ммоль) в толуоле (100 мл) кипятили с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток перерастворяли в дихлорметане (100 мл) и триэтиламине (0,962 мл, 6,9 ммоль), затем добавляли 1-бензил-2-метил-1,4,5,6-тетрагидро-1,3,6-триазабензо[е]азулен из Примера Е5а (1,0 г, 3,4 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 50% EtOAc: 50% петролейный эфир затем EtOAc) с получением указанного в заголовке соединения (844 мг, 56%).
Пример Е121.2
(4-Аминометил-3-метилфенил)-(1-бензил-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-ил)метанон
Раствор 4-(1-бензил-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)-2-метилбензонитрила из Примера Е121.1 (830 мг, 1,9 ммоль) в метаноле (10 мл) при комнатной температуре обрабатывали гексагидратом хлорида кобальта (II) (913 мг, 3,8 ммоль). Смесь перемешивали в течение 15 мин, затем охлаждали до 0°С.Порциями добавляли боргидрид натрия (726 мг, 19 ммоль) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. По каплям добавляли 35% аммиак (5 мл) и смесь перемешивали в течение 30 мин, затем концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 1% 35% аммиак:9% метанол:90% дихлорметан) с получением указанного в заголовке соединения (680 мг, 81%).
Пример Е121.3
4-(1-Бензил-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)-2-метилбензиламид 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты
HBTU (175 мг, 0,46 ммоль) добавляли к раствору 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты (86 мг, 0,34 ммоль) в ДМФ (5 мл). Смесь перемешивали при комнатной температуре в течение 2 ч, затем добавляли (4-аминометил-3-метилфенил)-(1-бензил-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-ил)метанон из Примера Е121.2 (100 мг, 0,23 ммоль) и DIEA (0,12 мл, 0,69 ммоль). Смесь перемешивали при комнатной температуре в течение 18 ч, затем растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток очищали путем флэш-хроматографии на силикагеле через Isolute (элюент; 5% метанол:95% дихлорметан затем 10% метанол:90% дихлорметан) с получением желтой пены, идентифицированной как указанное в заголовке соединение (114 мг, 79%).
Пример Е122
2-Метил-4-(2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)бензиламид 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты
4-(1-Бензил-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)-2-метилбензиламид 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты из Примера Е121 (110 мг, 0,17 ммоль) растворяли в абсолютном этаноле (5 мл) и помещали в инертную атмосферу. Добавляли 10% палладий на углероде (110 мг) и циклогексен (0,176 мл, 1,7 ммоль) и смесь нагревали при 60°С в течение 3 ч. Катализатор отфильтровывали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак: 9,5% метанол: 90% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (45 мг, 48%).
Пример Е123
2-Метил-4-(2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)бензиламид циклопропанкарбоновой кислоты
Пример Е123.1
4-(1-Бензил-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)-2-метилбензиламид циклопропанкарбоновой кислоты
DIEA (0,176 мл, 1,02 ммоль) и циклопропанкарбонилхлорид (0,033 мл, 0,36 ммоль) при комнатной температуре добавляли к раствору (4-аминометил-3-метилфенил)-(1-бензил-2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]азулен-6-ил)метанона из Примера Е121.2 (150 мг, 0,34 ммоль) в дихлорметане (5 мл). Смесь перемешивали в течение 20 ч, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением указанного в заголовке соединения (155 мг, 90%).
Пример Е123.2
2-Метил-4-(2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)бензиламид циклопропанкарбоновой кислоты
4-(1-Бензил-2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]азулен-6-карбонил)-2-метилбензиламид циклопропанкарбоновой кислоты из Примера Е123.1 (155 мг, 0,31 ммоль) растворяли в абсолютном этаноле (10 мл) и помещали в инертную атмосферу. Добавляли 10% палладий на углероде (155 мг) и циклогексен (0,311 мл, 3,1 ммоль) и смесь нагревали при 60°С в течение 18 ч. Катализатор отфильтровывали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме. Остаток очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением белого твердого вещества, идентифицированного как указанное в заголовке соединение (67 мг, 53%).
Пример Е124
2-Метил-4-(2-метил-4,5-дигидро-3-тиа-1,6-диазабензо[е]азулен-6-карбонил)бензиламид циклопропанкарбоновой кислоты
Пример Е124.1
2-Метил-4-(2-метил-4,5-дигидро-3-тиа-1,6-диазабензо[е]азулен-6-карбонил)бензонитрил
Смесь 4-циано-3-метилбензойной кислоты из Примера Е6 (147 мг, 0,91 ммоль) растворяли в дихлорметане (25 мл) и 2 каплях ДМФ и охлаждали до 0°С. Медленно добавляли оксалилхлорид (0,1 мл) и смесь перемешивали в течение 2 ч при комнатной температуре. Растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток перерастворяли в дихлорметане (10 мл) и охлаждали до 0°С. Добавляли триэтиламин (0,5 мл) и 2-метил-5,6-дигидро-4H-3-тиа-1,6-диазабензо[е]азулен из Примера Е7 (165 мг, 0,76 ммоль) в дихлорметане (10 мл) и смесь перемешивали в течение 2 дней при комнатной температуре. Образовывались еще 0,91 ммоль кислотного хлорида, как ранее, и их добавляли к смеси. Раствор перемешивали в течение 20 ч при комнатной температуре, промывали насыщенным NaHCO3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 10% EtOAc:90% циклогексан затем 20% EtOAc: 80% циклогексан) с получением указанного в заголовке соединения (220 мг, 80%).
Пример Е124.2
(4-Аминометил-3-метилфенил)-(2-метил-4,5-дигидро-3-тиа-1,6-диазабензо[е]азулен-6-ил)метанон
Раствор 2-метил-4-(2-метил-4,5-дигидро-3-тиа-1,б-диазабензо[е]азулен-6-карбонил)бензонитрила из Примера Е124.1 (190 мг, 0,53 ммоль) в метаноле (15 мл) при комнатной температуре обрабатывали гексагидратом хлорида кобальта (II) (275 мг, 1,15 ммоль). Смесь перемешивали в течение 20 мин, затем охлаждали до 0°С. Порциями добавляли боргидрид натрия (200 мг, 5,3 ммоль) и смесь перемешивали в течение 20 ч при комнатной температуре. По каплям добавляли насыщенный NH4Cl (2 мл) и смесь перемешивали в течение 30 мин, затем концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 1% 35% аммиак:9% метанол:90% дихлорметан) с получением указанного в заголовке соединения (100 мг, 52%).
Пример Е124.3
2-Метил-4-(2-метил-4,5-дигидро-3-тиа-1,6-диазабензо[е]азулен-6-карбонил)бензиламид циклопропанкарбоновой кислоты
DIEA (0,02 мл, 0,115 ммоль) и циклопропанкарбонилхлорид (0,008 мл, 0,088 ммоль) при 0°С добавляли к раствору (4-аминометил-3-метилфенил)-(2-метил-4,5-дигидро-3-тиа-1,6-диазабензо[е]азулен-6-ил)метанона из Е124.2 (20 мг, 0,055 ммоль) в дихлорметане (5 мл). Смесь перемешивали в течение 20 ч при комнатной температуре, затем концентрировали в вакууме и очищали путем препаративной ВЭЖХ (элюент; 0,5% 35% аммиак:9,5% метанол:90% дихлорметан) с получением белого порошка, идентифицированного как указанное в заголовке соединение (11 мг, 46%).
Пример Е125
N-[4-(9-Хлор-2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]азулен-6-карбонил)-2-метилбензил]изобутирамид
Пример Е125.1
4-[1-(4-Циано-3-метилбензоил)-9-хлор-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил]-2-метилбензонитрил
Смесь 4-циано-3-метилбензойной кислоты из Примера Е6 (262 мг, 1,6 ммоль) растворяли в дихлорметане (20 мл) и 2 каплях ДМФ и охлаждали до 0°С. Добавляли оксалилхлорид (0,6 мл) и смесь перемешивали в течение 0,5 ч при комнатной температуре. Растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток перерастворяли в дихлорметане (10 мл) и добавляли к раствору 9-хлор-2-метил-1,4,5,6-тетрагидро-1,3,6-триазабензо[е]азулена из Примера Е7 (190 мг, 0,8 ммоль) и DIEA (0,5 мл) в дихлорметане (10 мл) и смесь перемешивали в течение 20 ч при комнатной температуре. Растворители удаляли в вакууме и остаток суспендировали в EtOAc, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 40% EtOAc:60% циклогексан) с получением указанного в заголовке соединения (124 мг, 30%).
Пример Е125.2
4-(9-Хлор-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)-2-метилбензонитрил
4-[1-(4-Циано-3-метилбензоил)-9-хлор-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил]-2-метилбензонитрил из Е125.1 (124 мг, 0,24 ммоль) растворяли в МеОН (5 мл). Добавляли 2М NaOH (2 мл) и смесь перемешивали в течение 1 ч при комнатной температуре. Растворители удаляли в вакууме и подвергали азеотропной перегонке с толуолом. Остаток суспендировали в EtOAc, промывали насыщенным NаНСО3, затем рассолом, сушили и концентрировали в вакууме с получением указанного в заголовке соединения (80 мг, 89%).
Пример Е125.3
(4-Аминометил-3-метилфенил)-(9-хлор-2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]азулен-6-ил)метанон
Раствор 4-(9-хлор-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)-2-метилбензонитрила из Е125.2 (80 мг, 0,2 ммоль) в метаноле (5 мл) при комнатной температуре обрабатывали гексагидратом хлорида кобальта (II) (101 мг, 0,4 ммоль). Смесь охлаждали до 0°С, затем порциями добавляли боргидрид натрия (80 мг, 2,1 ммоль). Реакционную смесь перемешивали при 0°С в течение 30 мин, затем в течение 2 ч при комнатной температуре, затем добавляли насыщенный NH4Cl. Смесь перемешивали в течение 10 мин, затем твердое вещество отфильтровывали через фильтрующий агент Celite® и фильтрат концентрировали в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 1% 35% аммиак:9% метанол:90% дихлорметан) с получением указанного в заголовке соединения (24 мг, 30%).
Пример Е125.4
N-[4-(9-Хлор-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)-2-метилбензил]изобутирамид
Изобутирилхлорид (0,07 мл, 0,07 ммоль) при 0°С добавляли к раствору (4-аминометил-3-метилфенил)-(9-хлор-2-метил-4,5-дигидро-1Н-1,3,6-триазабензо[е]азулен-6-ил)метанона из Примера Е125.3 (24 мг, 0,07 ммоль) в дихлорметане (3 мл) и DIEA (0,10 мл, 0,57 ммоль). Смесь перемешивали в течение 20 ч при комнатной температуре, затем растворители удаляли в вакууме. Остаток очищали путем флэш-хроматографии на силикагеле (элюент; 5% метанол:95% дихлорметан до 10% метанол:90% дихлорметан) с получением бесцветного масла, идентифицированного как указанное в заголовке соединение 24 мг, 85%).
Пример А
Тестирование in vitro
Соединения анализировали в отношении их способности ингибировать клеточные следствия стимуляции интактных клеток аргинин-вазопрессином (AVP). В анализе соединения по изобретению вызывают значительное ингибирование клеточной активации при концентрациях 30 мкМ или меньше. Предпочтительные соединения вызывают значительное ингибирование в концентрациях 300 нМ.
Пример Б
Таблетка для перорального введения
Таблетки, содержащие 100 мг соединения Примера Е8 в виде активного агента, могут быть приготовлены из следующего:
Материалы смешивают и затем прессуют с получением 2000 таблеток массой 250 мг, каждая из которых содержит 100 мг соединения Примера Е8.
Все цитированные источники включены здесь путем ссылки.
СХЕМЫ И СТРУКТУРЫ
Пример Е1
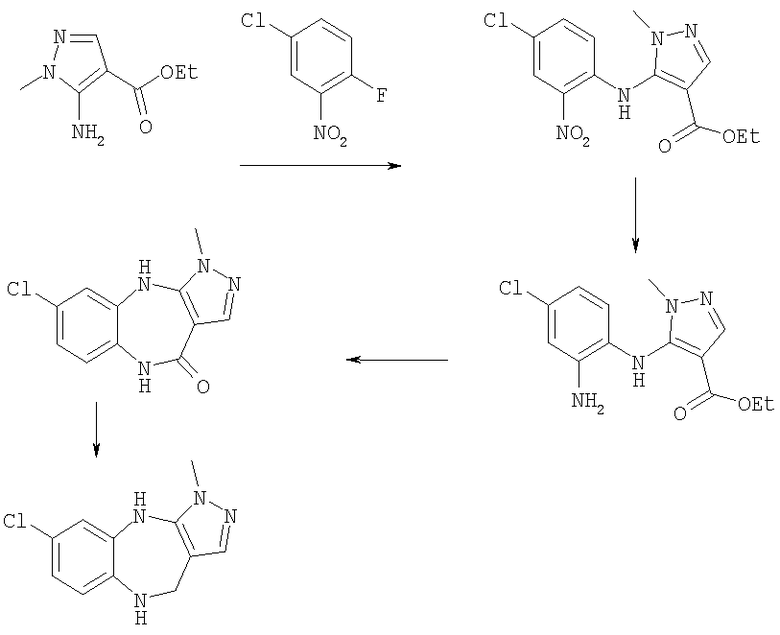
Пример Е2
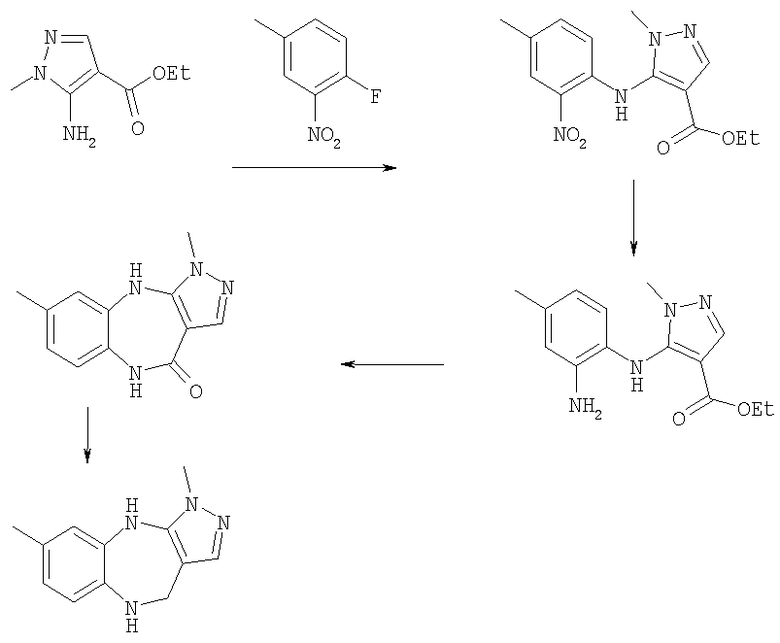
Примеры Е2а-g
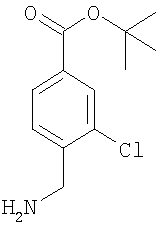
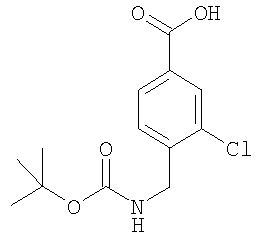
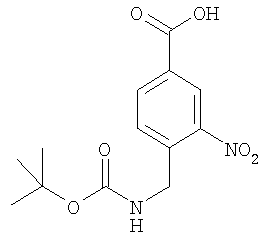
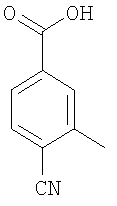
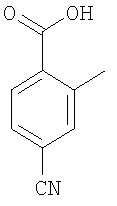
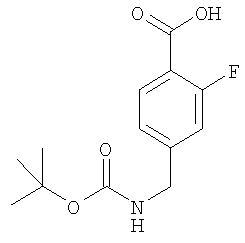
Пример E2h
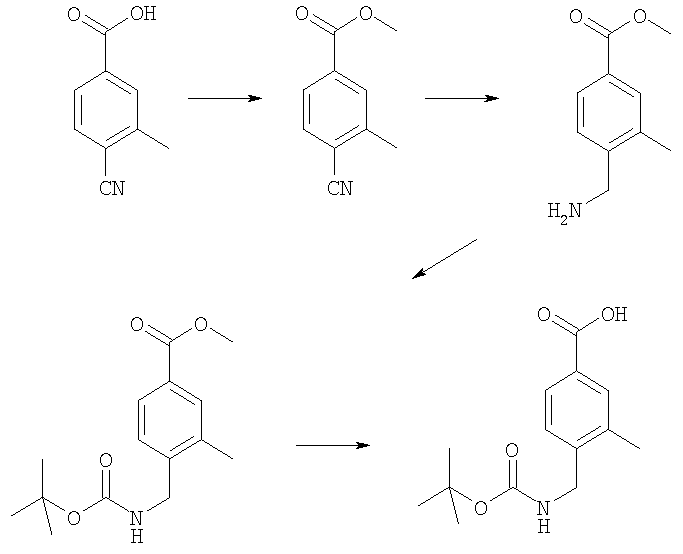
Пример Е3
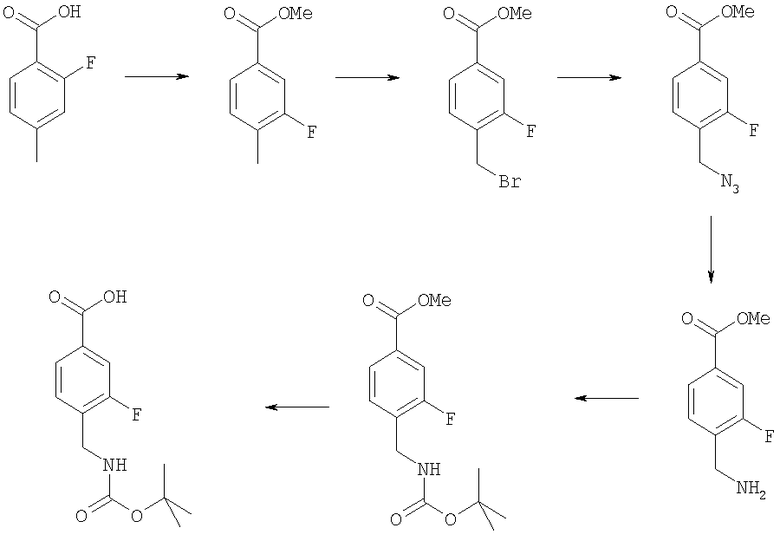
Пример Е4
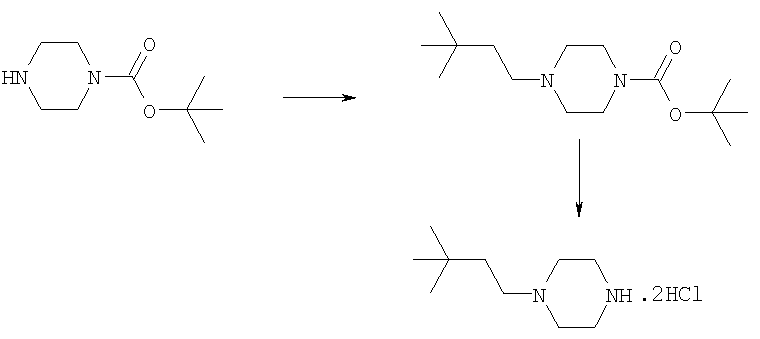
Пример Е5
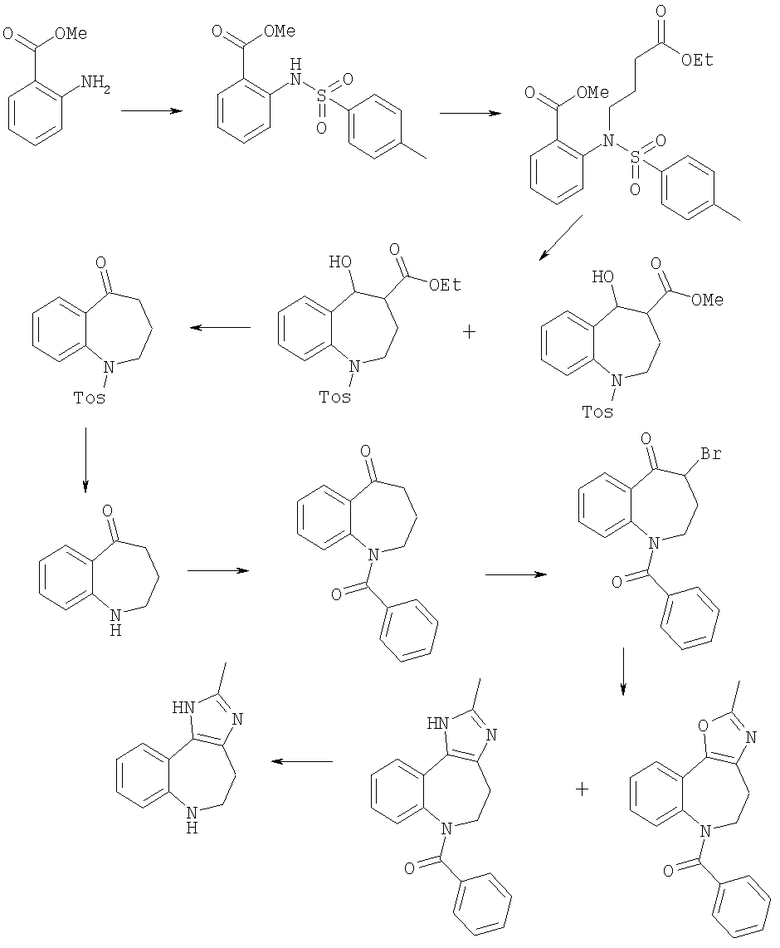
Пример Е5а
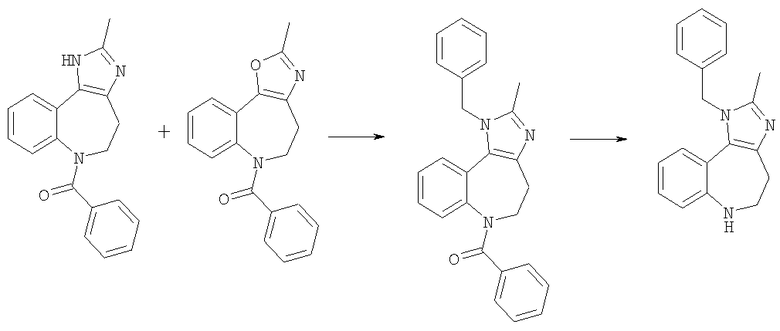
Пример Е6
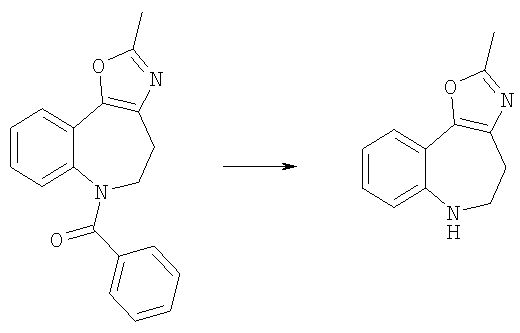
Пример Е7
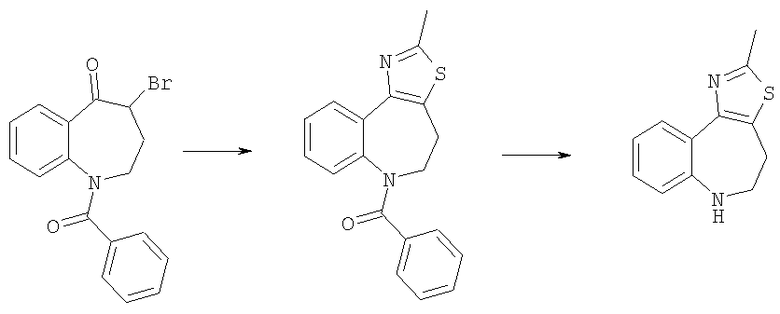
Пример Е8
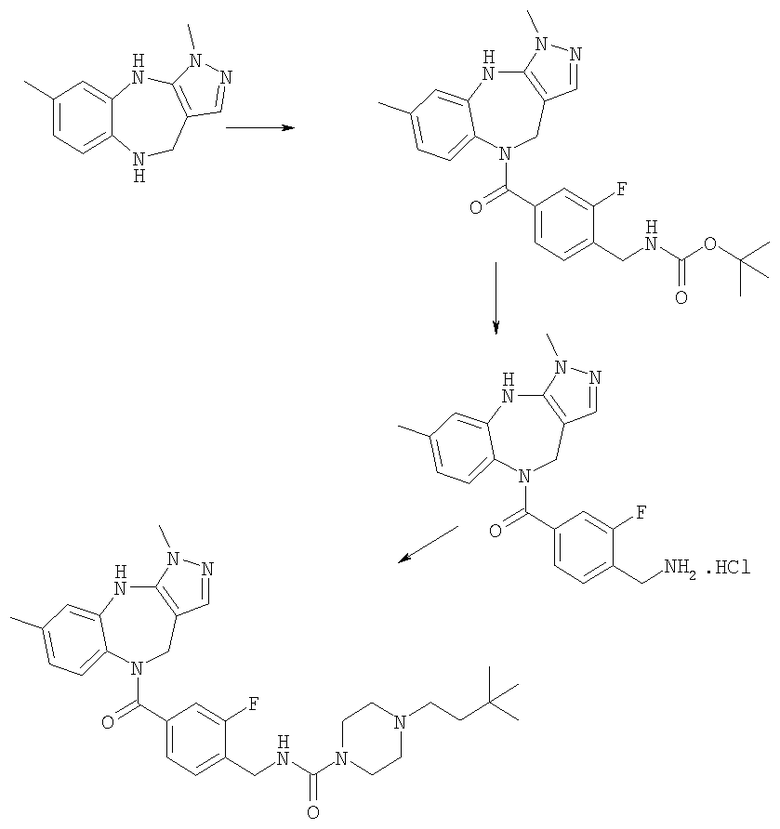
Пример Е9
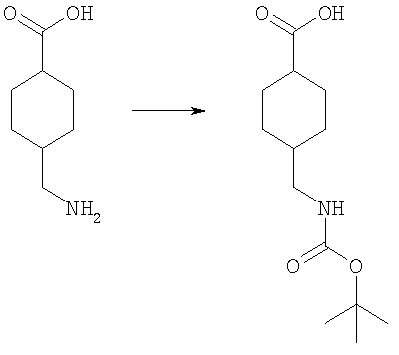
Пример Е10
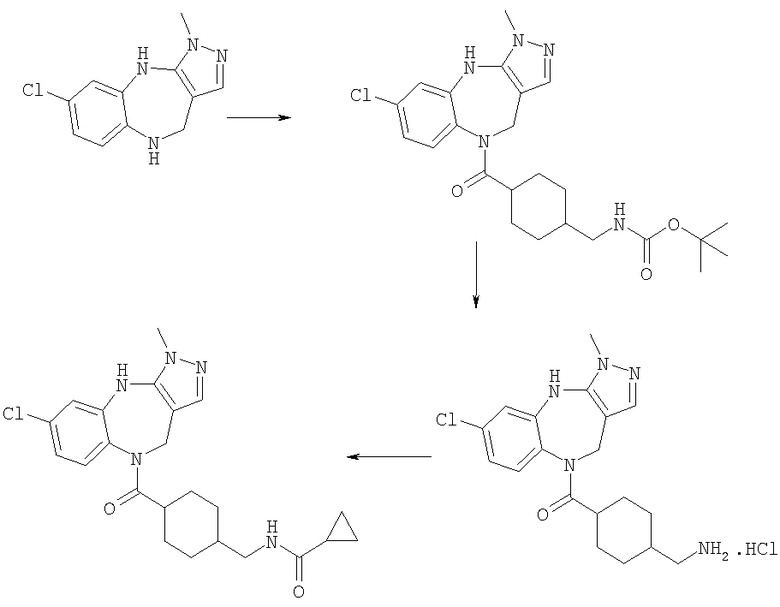
Пример Е11
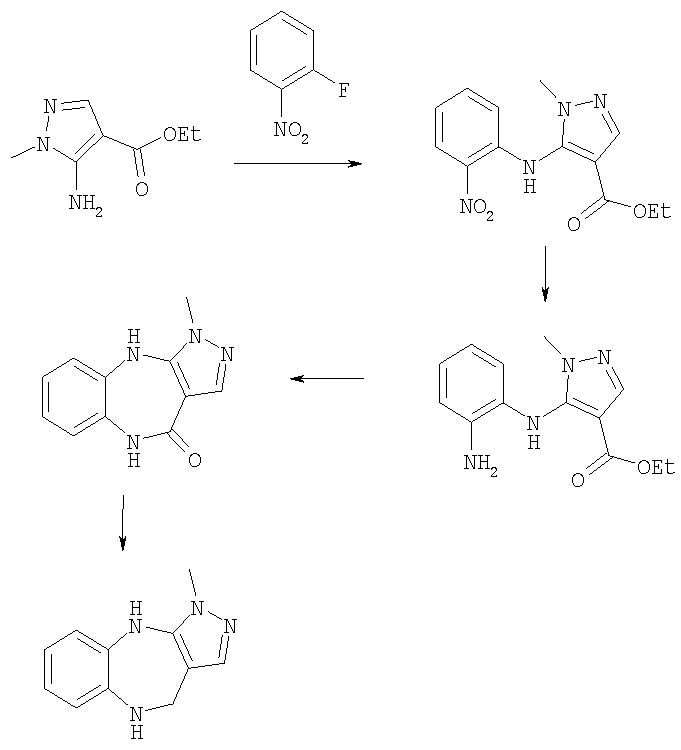
Пример Е12
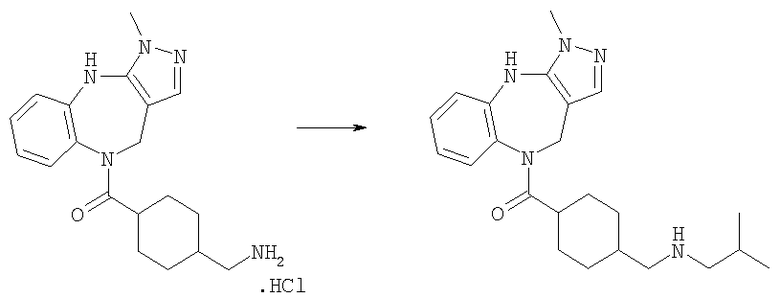
Пример Е13
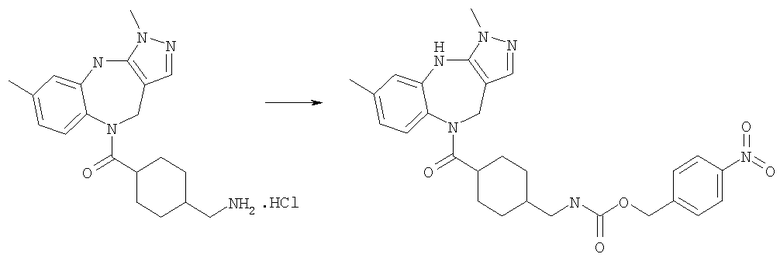
Пример Е14
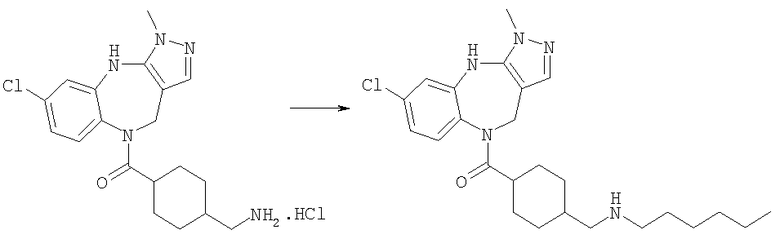
Пример Е15
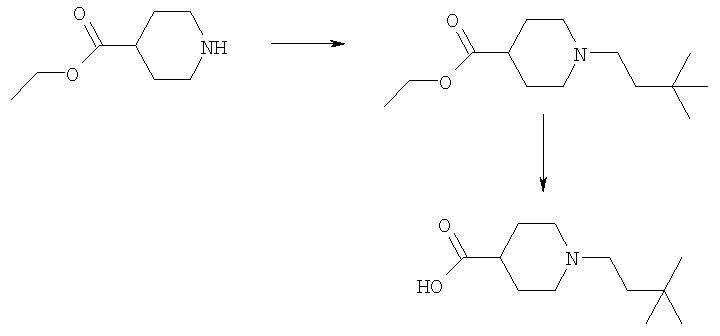
Пример Е15а
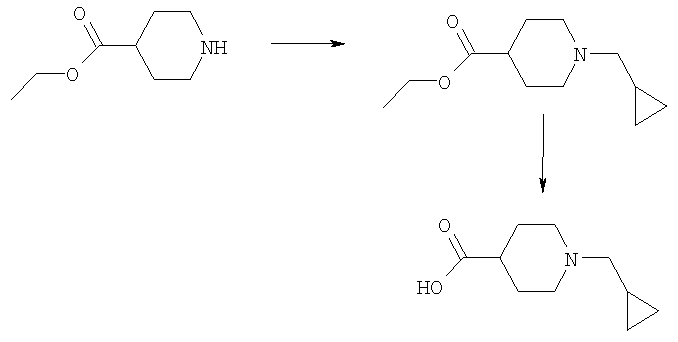
Пример Е16
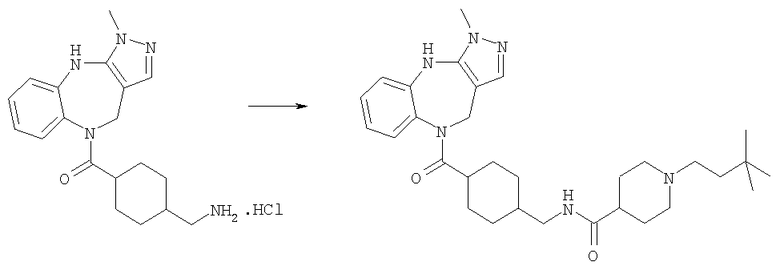
Пример Е17
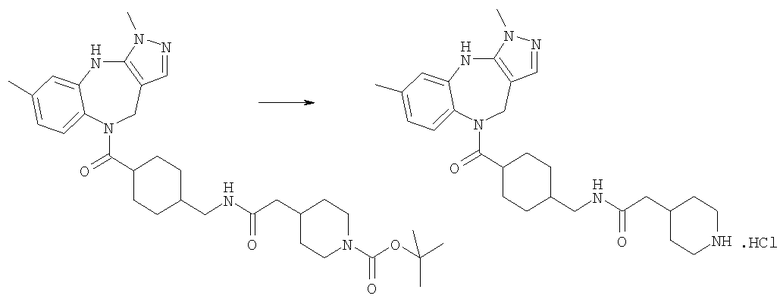
Пример Е18
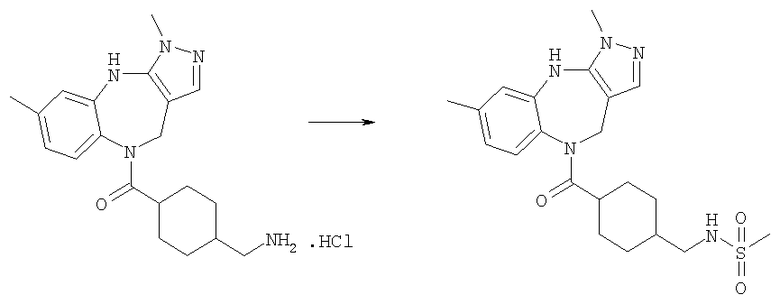
Пример Е19
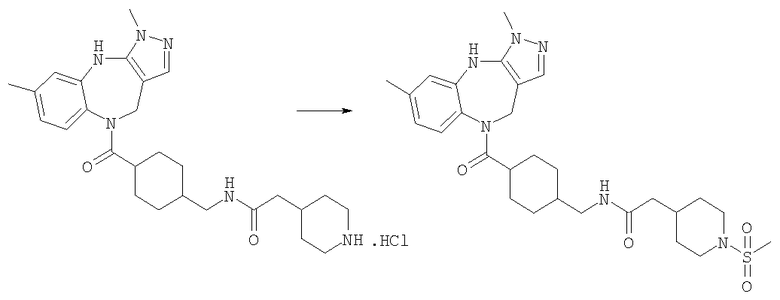
Пример Е20
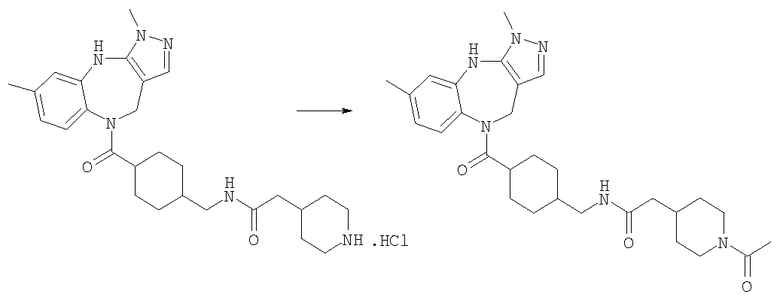
Пример Е21
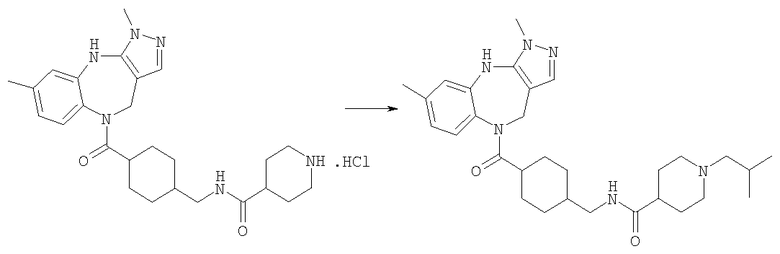
Пример Е22
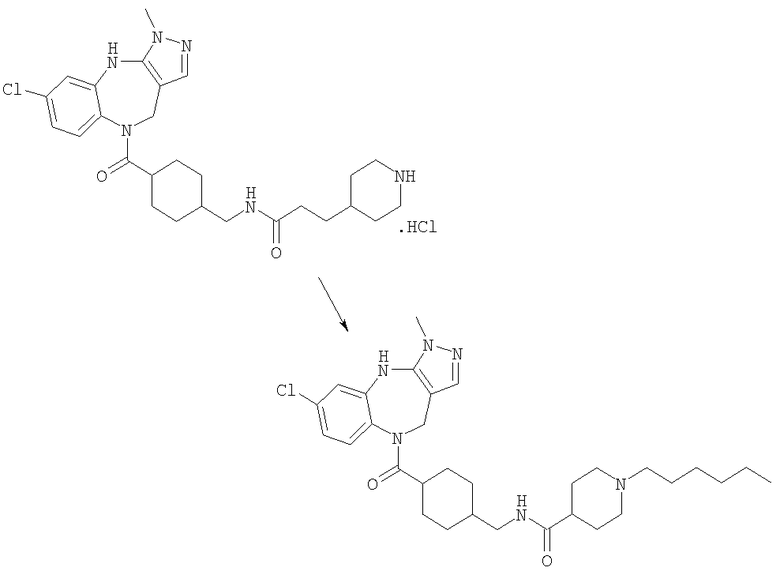
Пример Е23
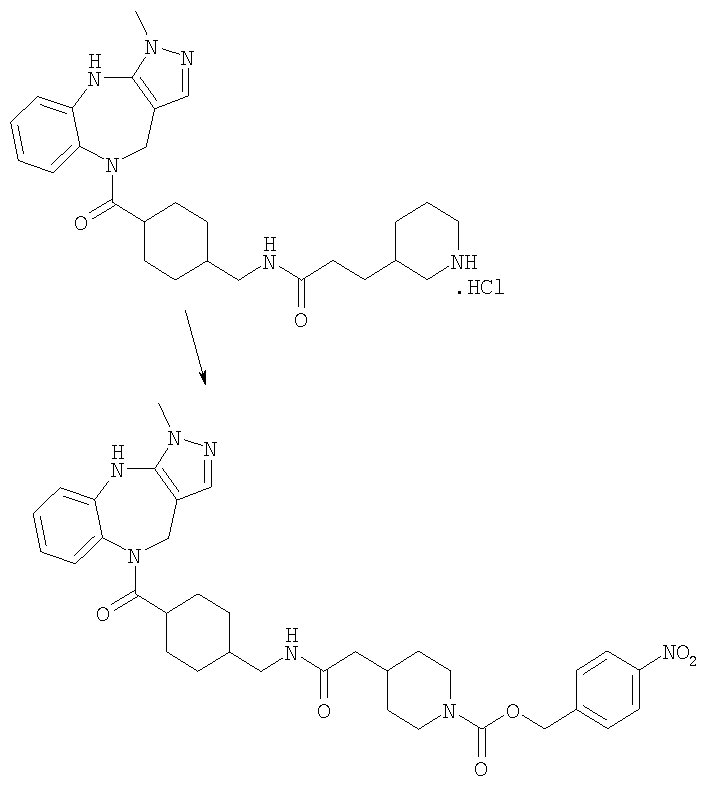
Пример Е24
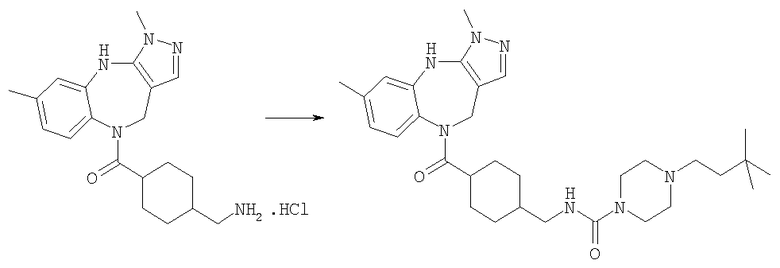
Пример Е25
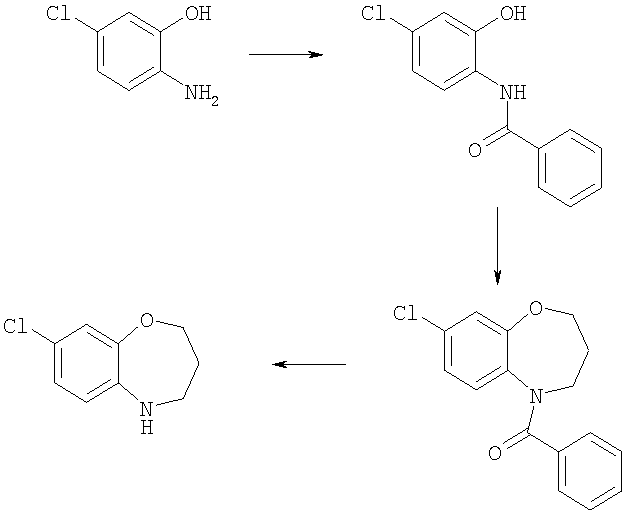
Пример Е26
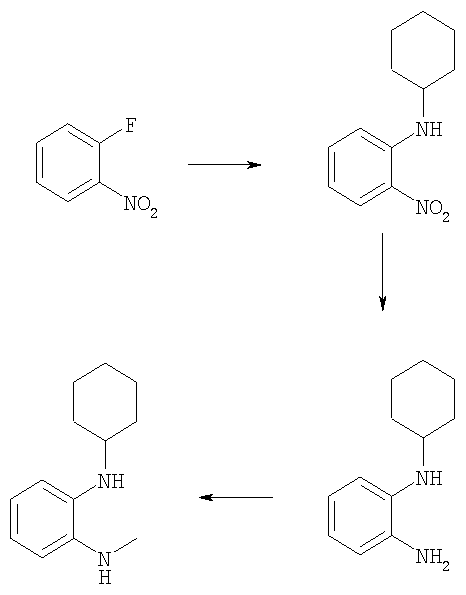
Пример Е27
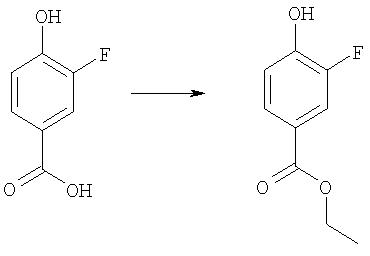
Пример Е28
Пример Е29
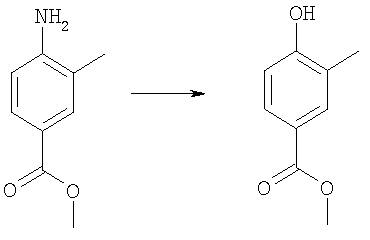
Пример Е30
Пример Е31
Пример Е32
Пример Е33
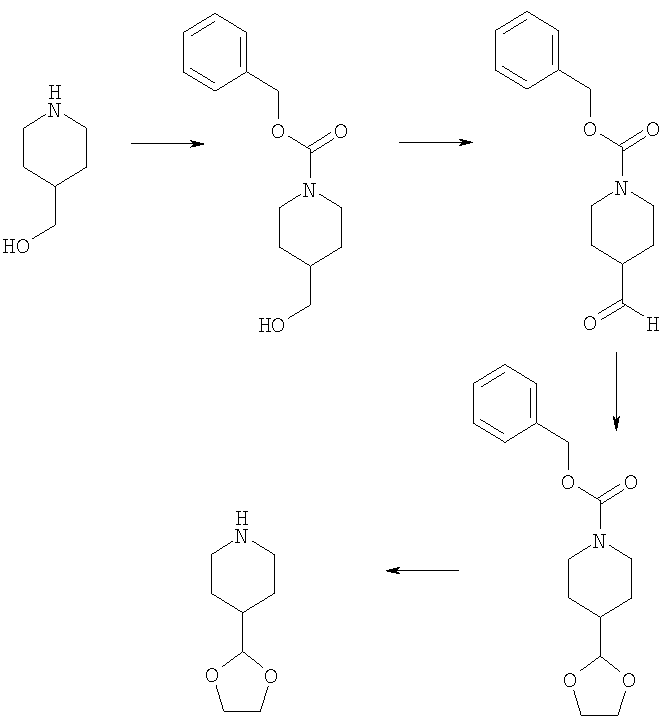
Пример Е34
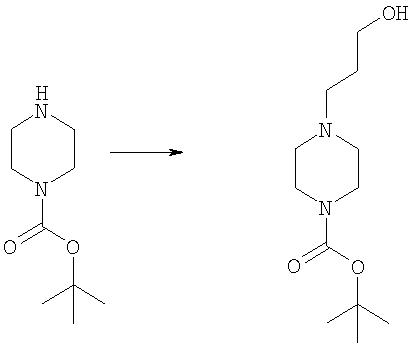
Пример Е35
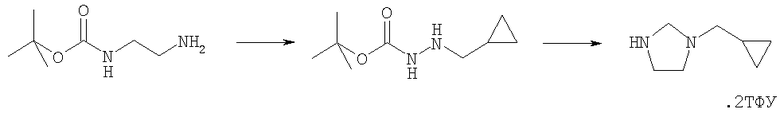
Пример Е36
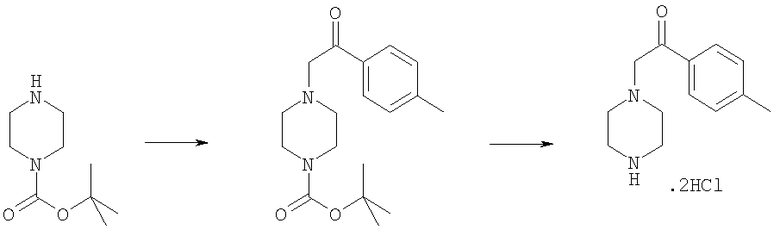
Пример Е37

Пример Е38
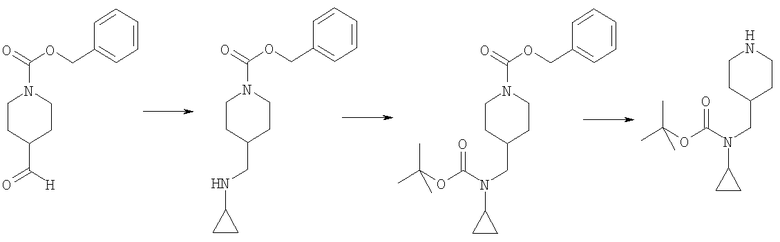
Пример Е39
Пример Е40
Пример Е41
Пример Е41а
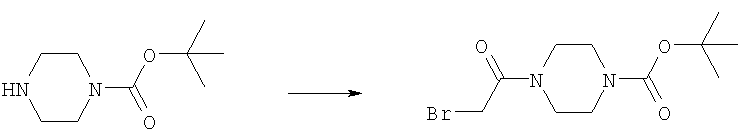
Пример Е41b
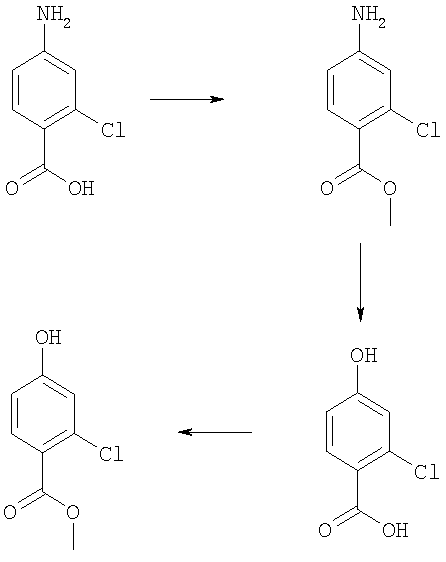
Пример Е41с
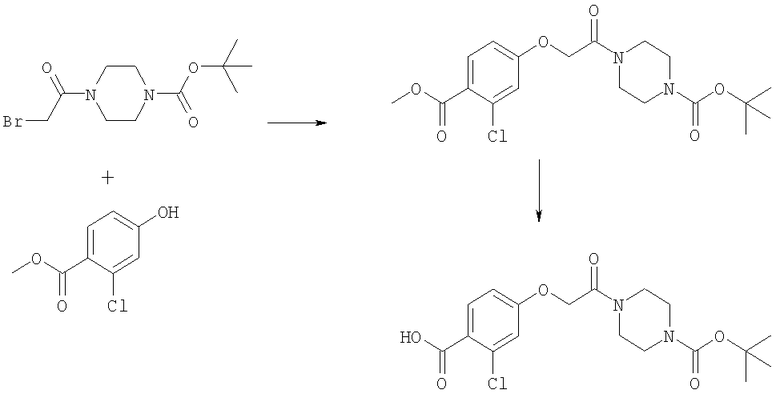
Пример Е42
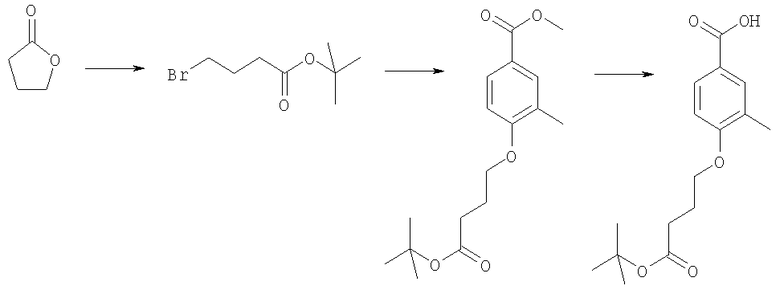
Пример Е43
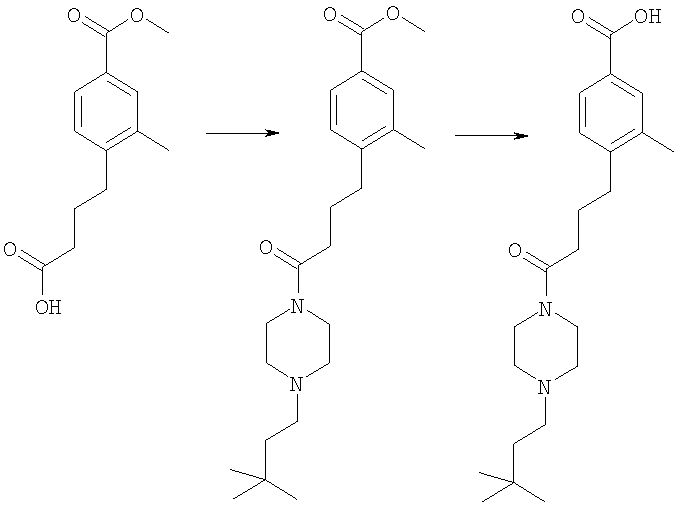
Пример Е44
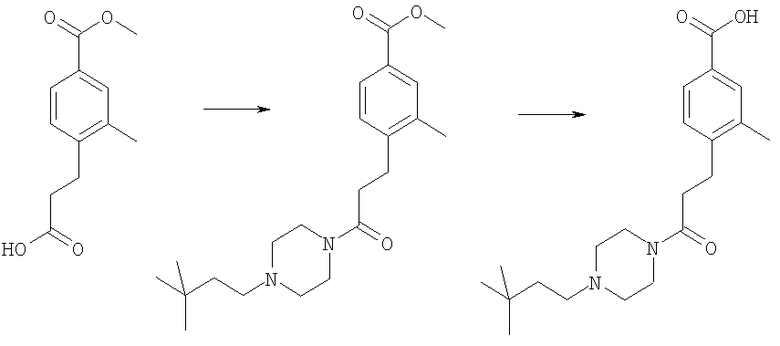
Пример Е45
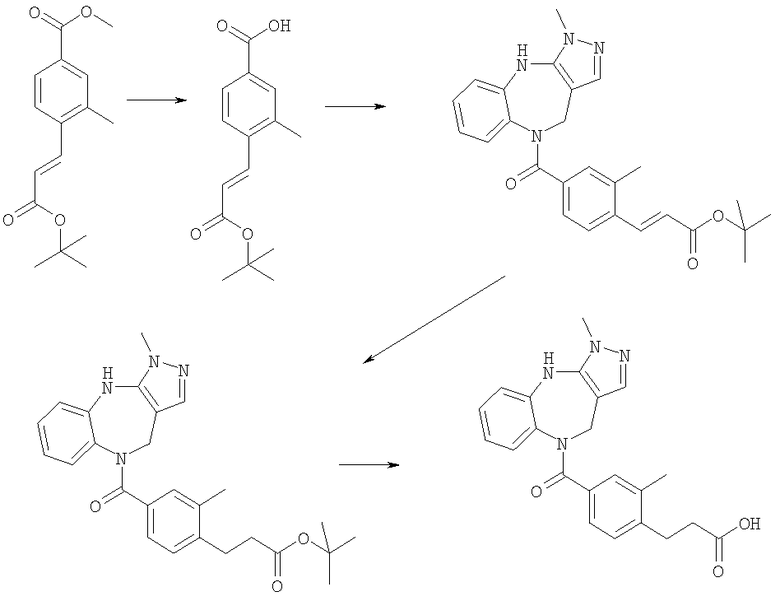
Пример Е46

Пример Е47
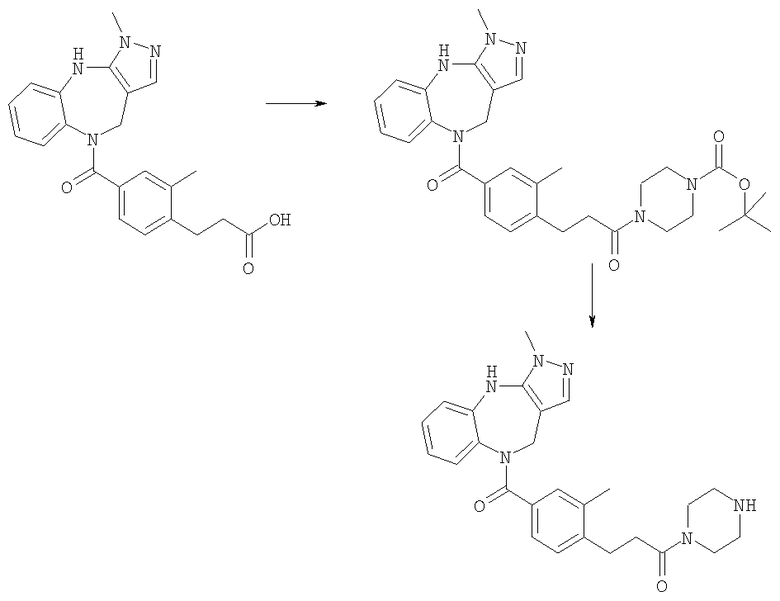
Пример Е48
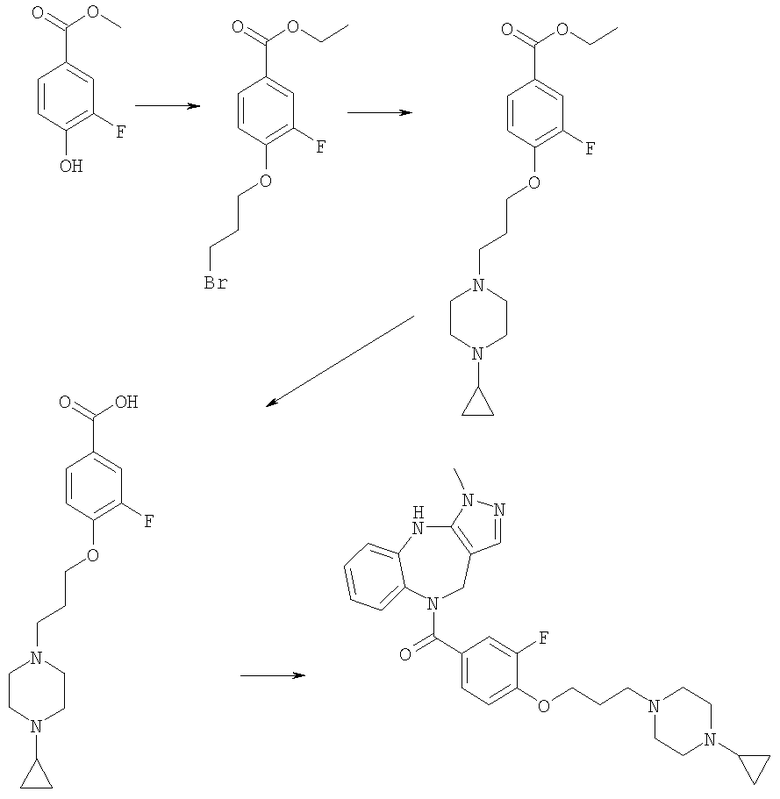
Пример Е49
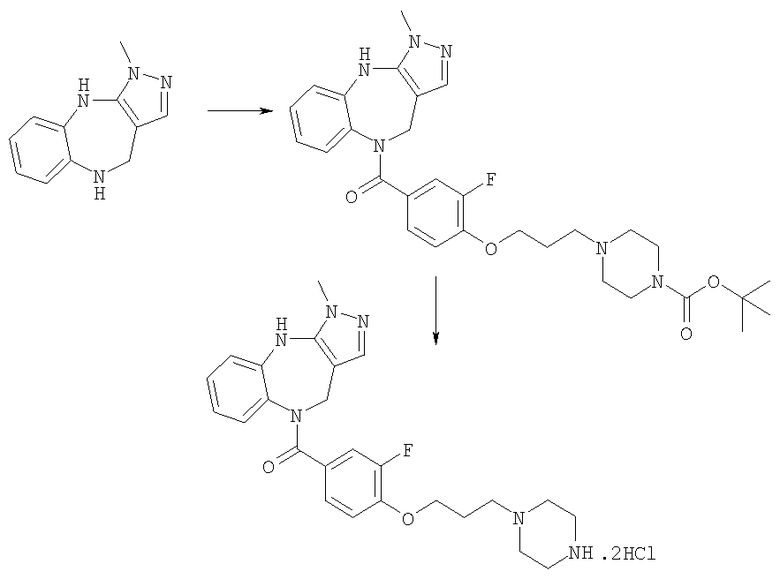
Пример Е50
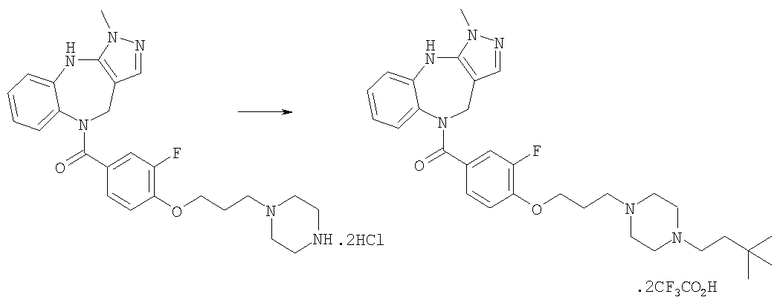
Пример Е51
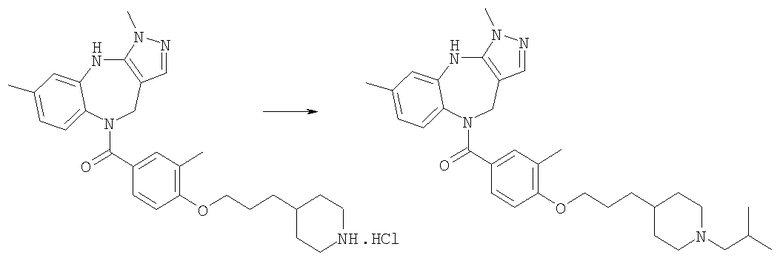
Пример Е52
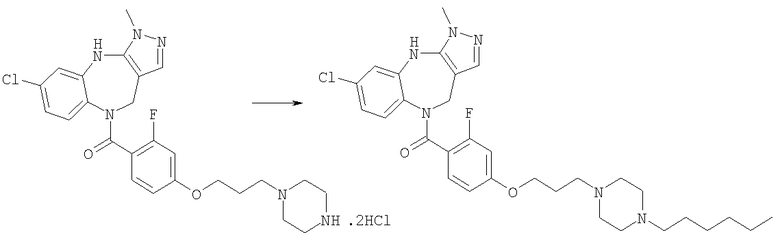
Пример Е53
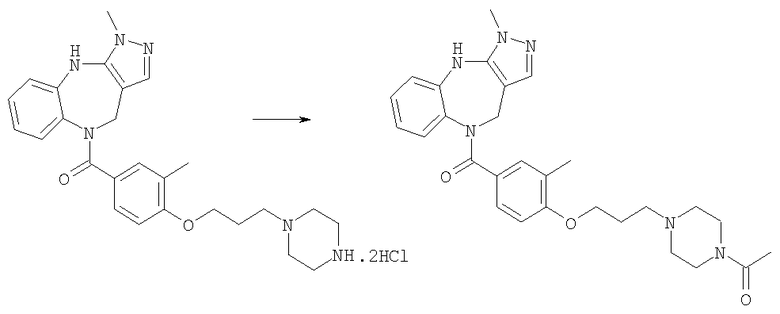
Пример Е54
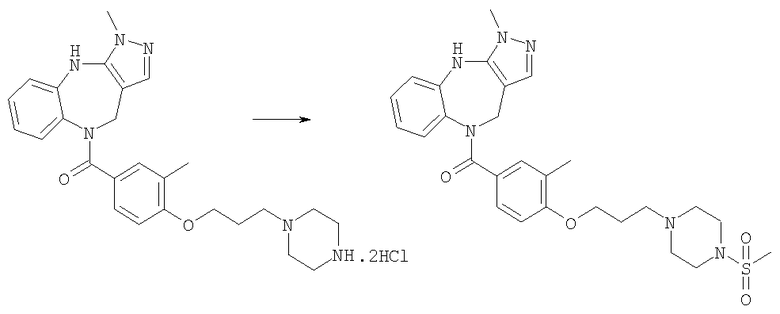
Пример Е55
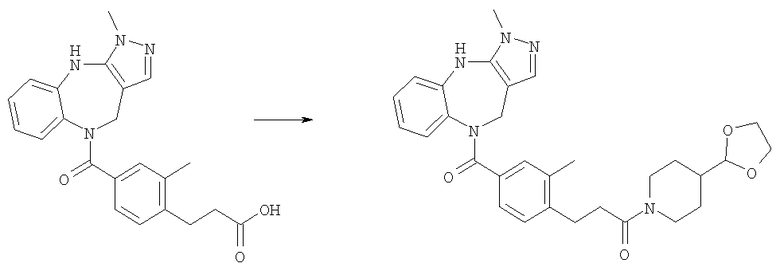
Пример Е56
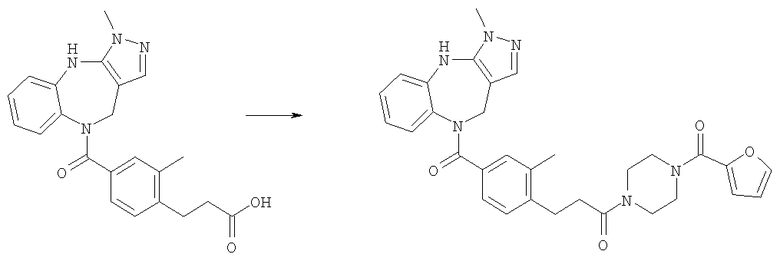
Пример Е57
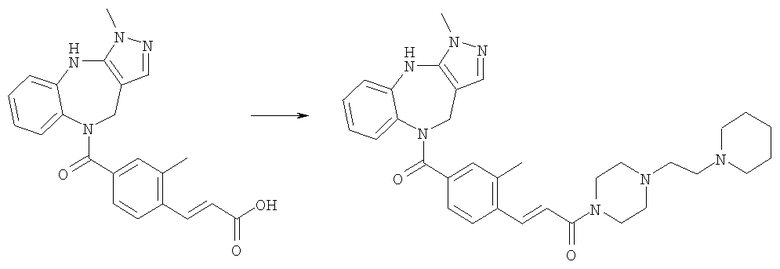
Пример Е58
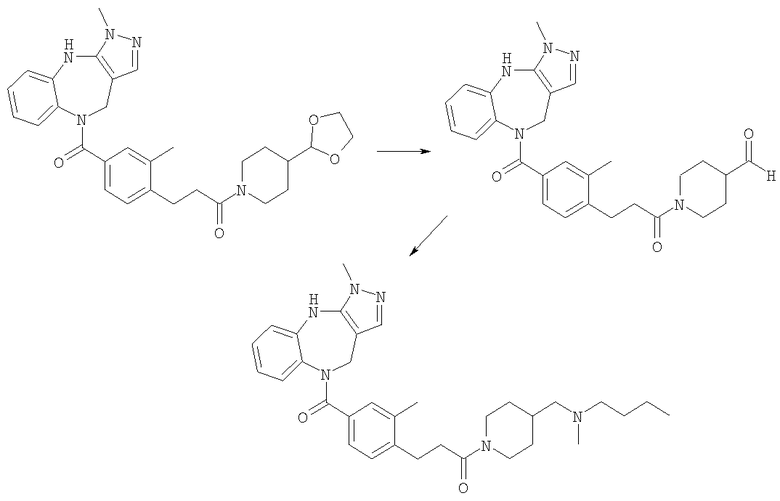
Пример Е59
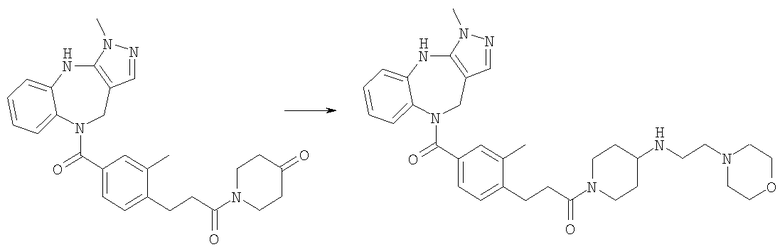
Пример Е60
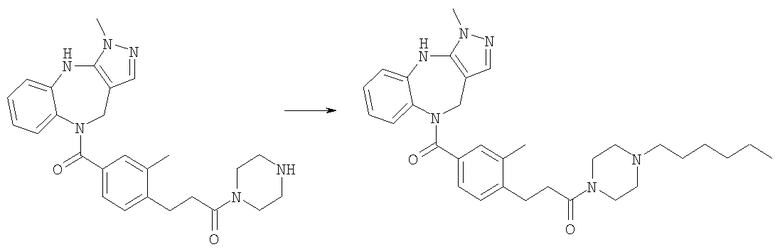
Пример Е61
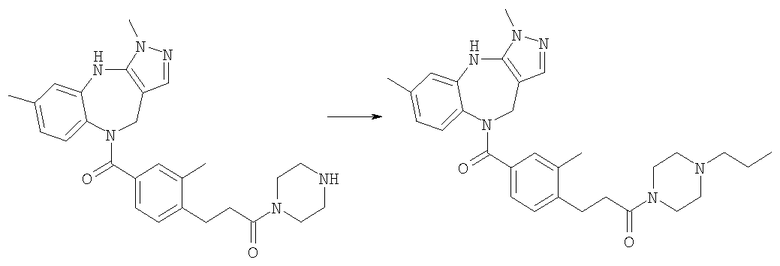
Пример Е62
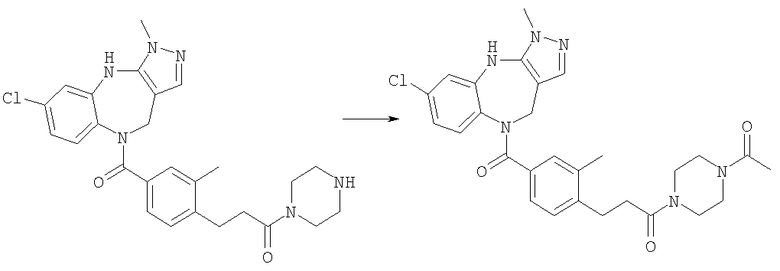
Пример Е63
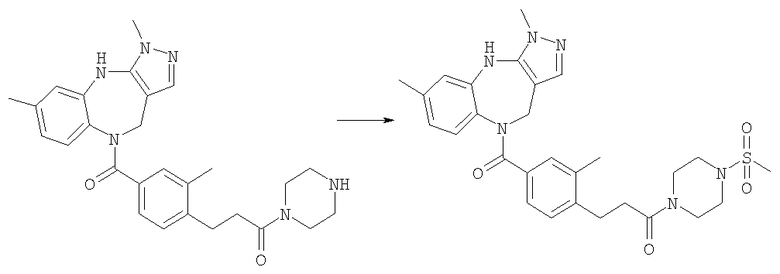
Пример Е64
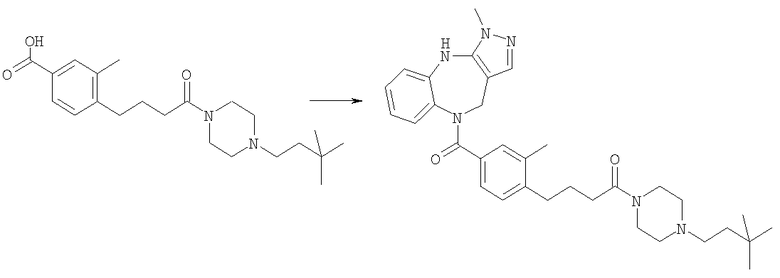
Пример Е65
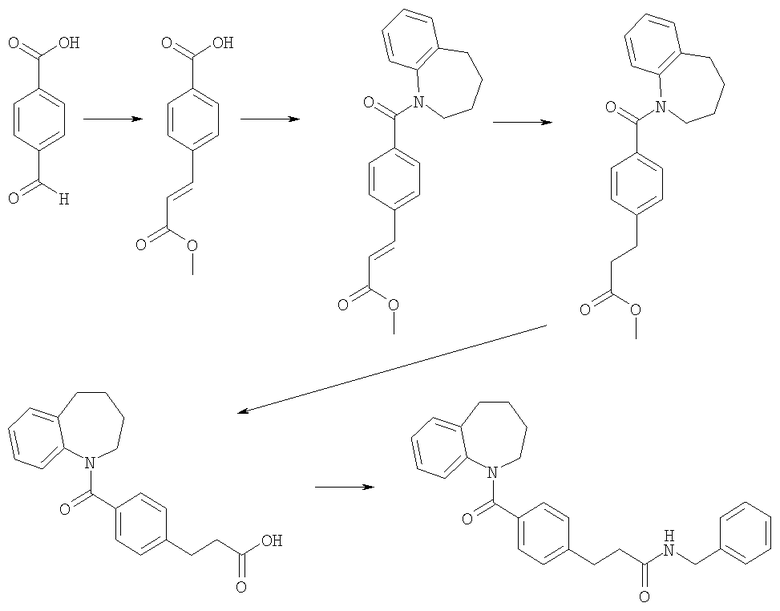
Пример Е66
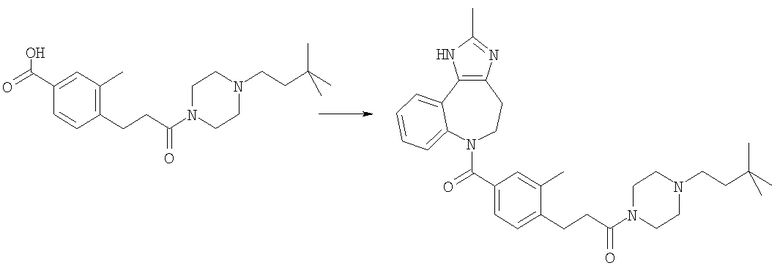
Пример Е67
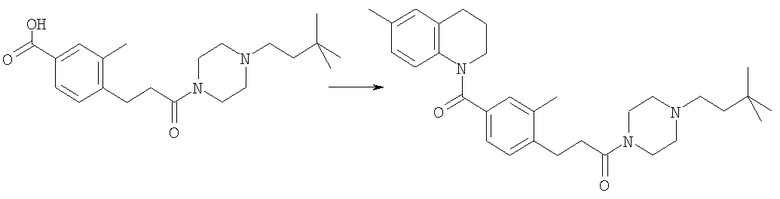
Пример Е68
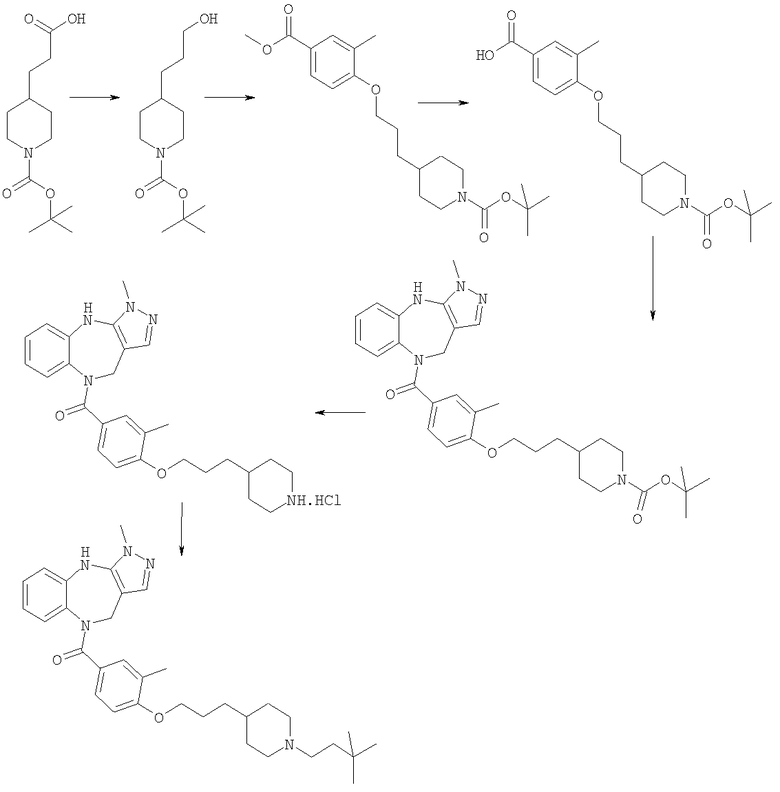
Пример Е69
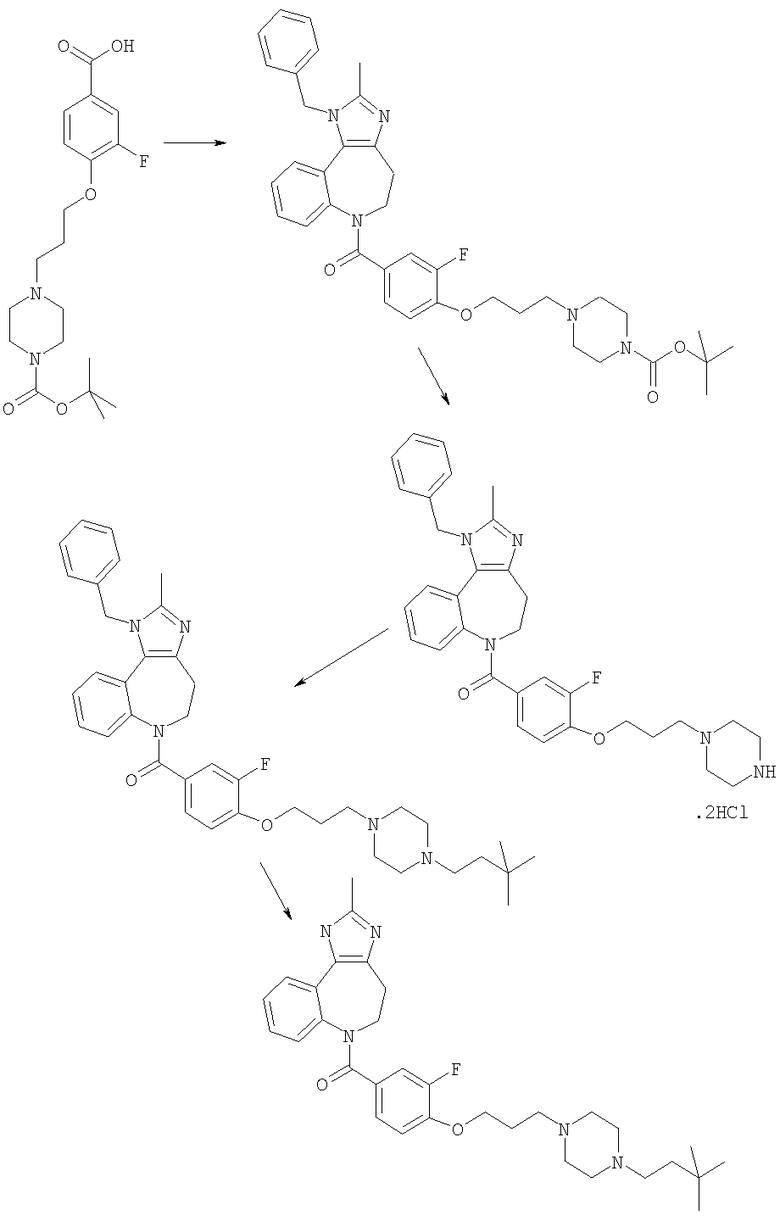
Пример Е70
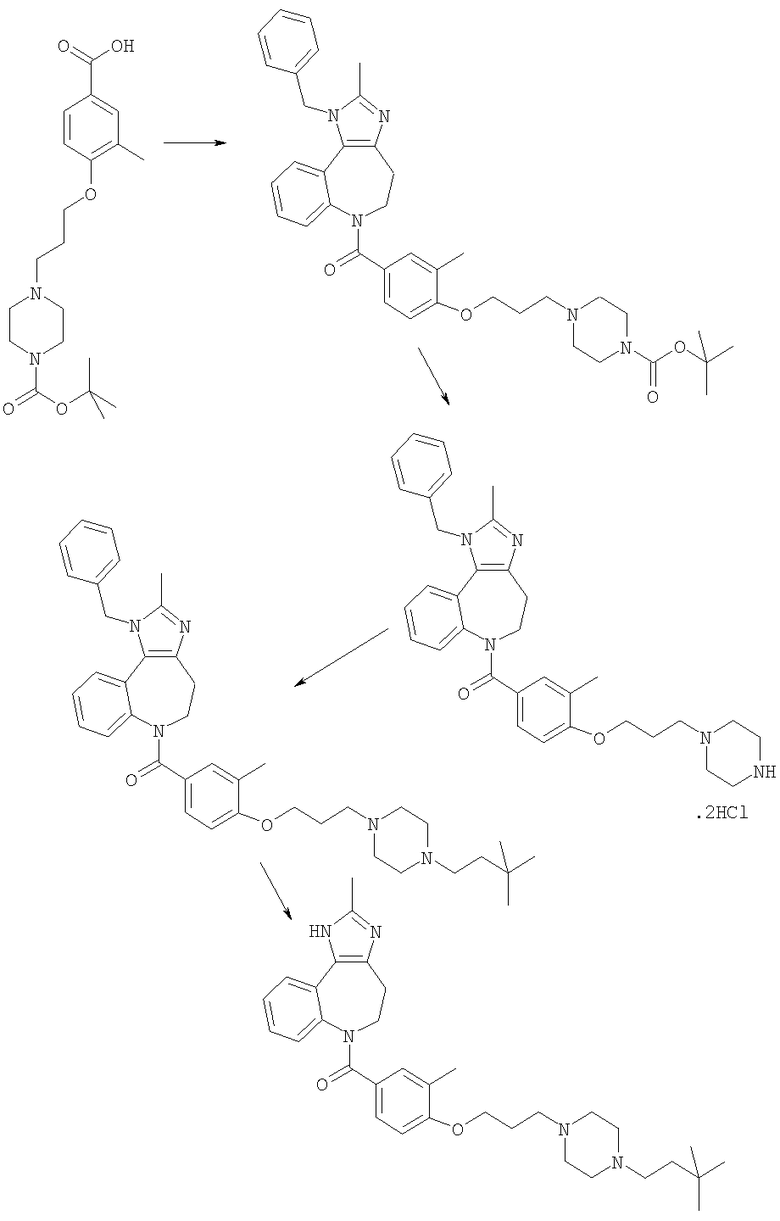
Пример Е71
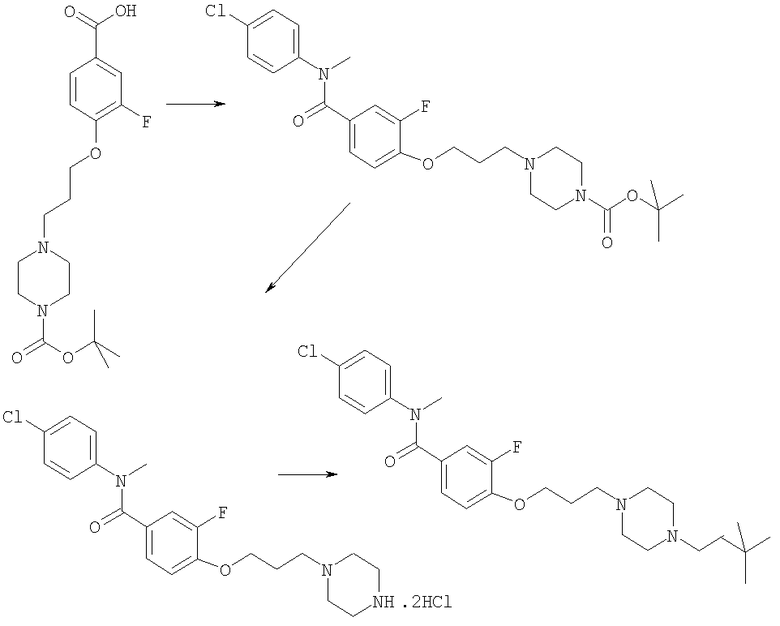
Пример Е72
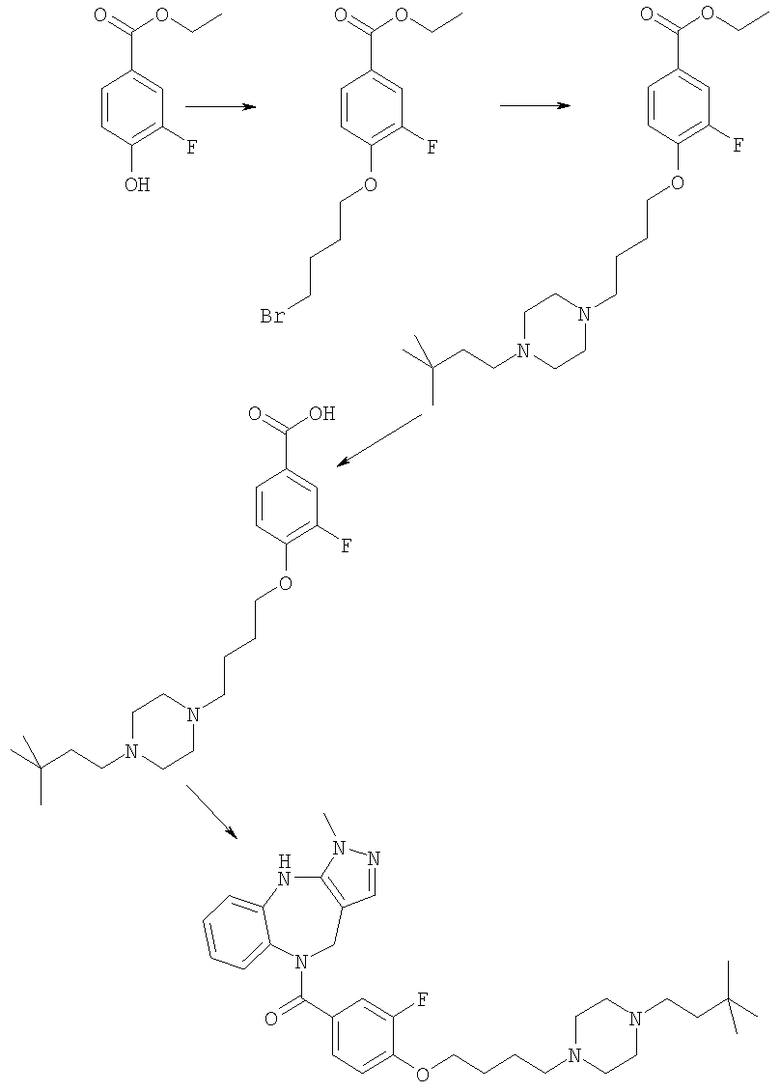
Пример Е73
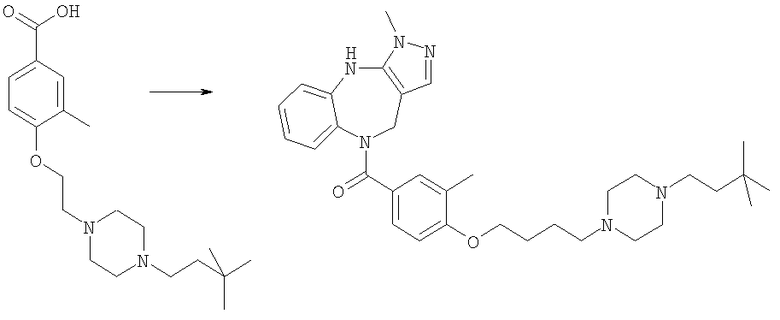
Пример Е74
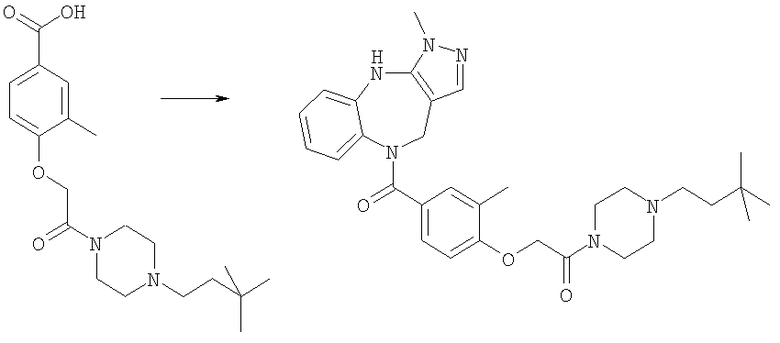
Пример Е75
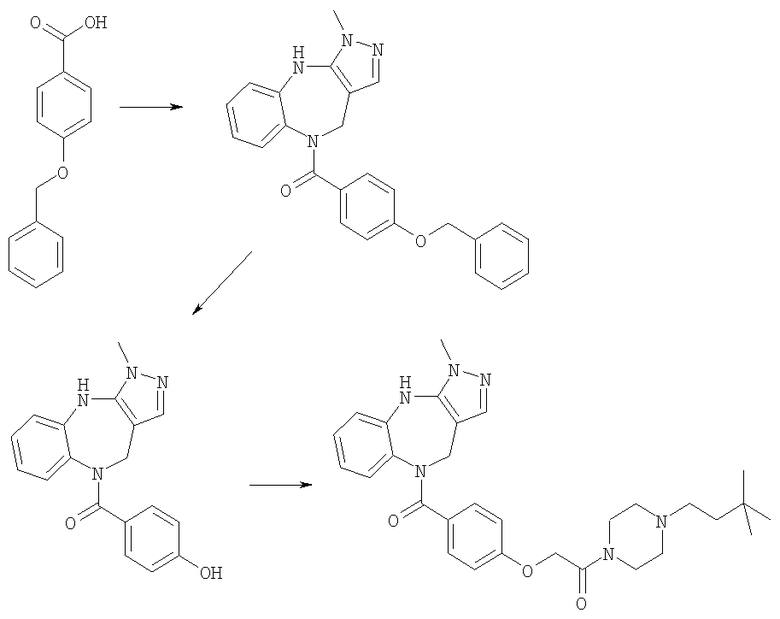
Пример Е76
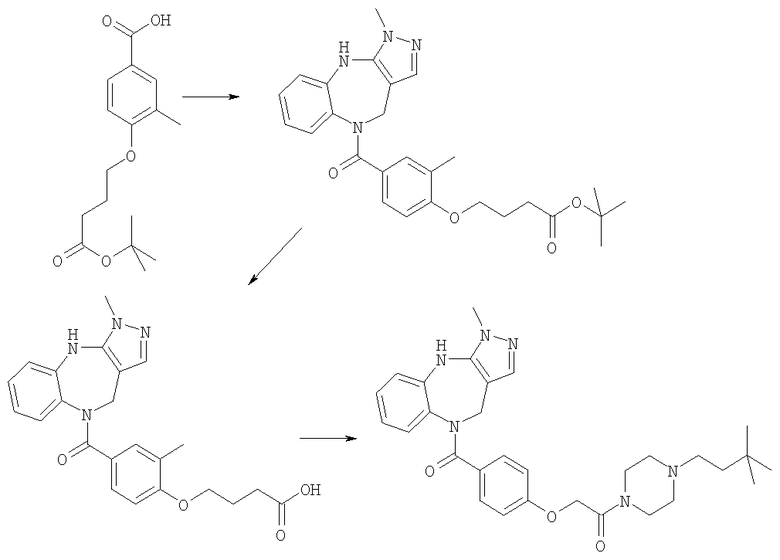
Пример Е77
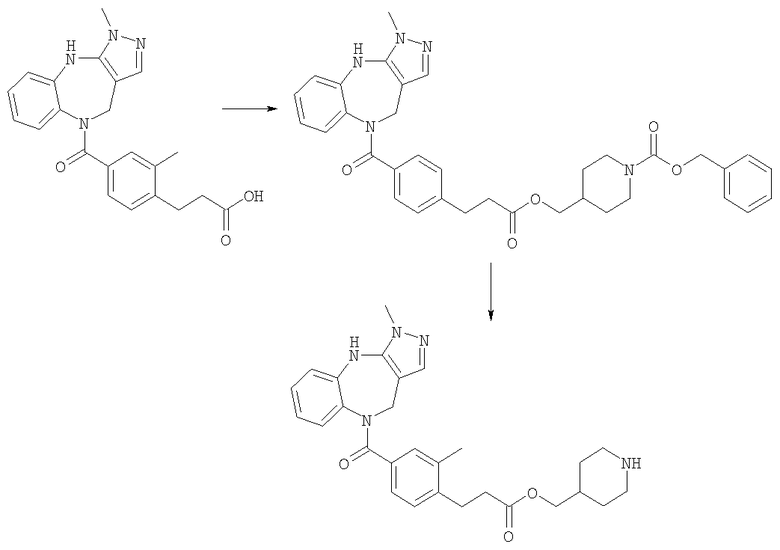
Пример Е78
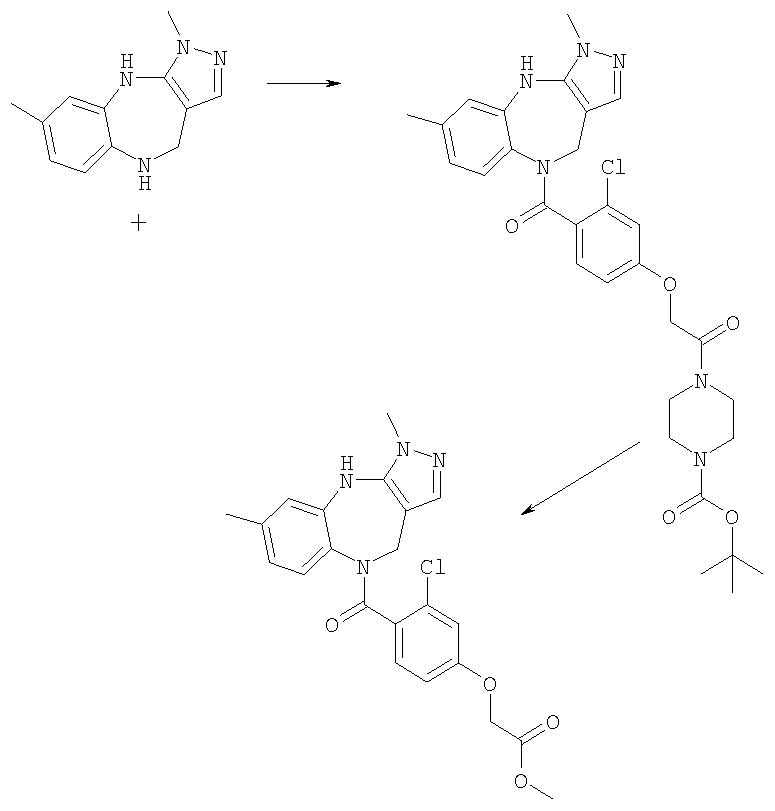
Пример Е79
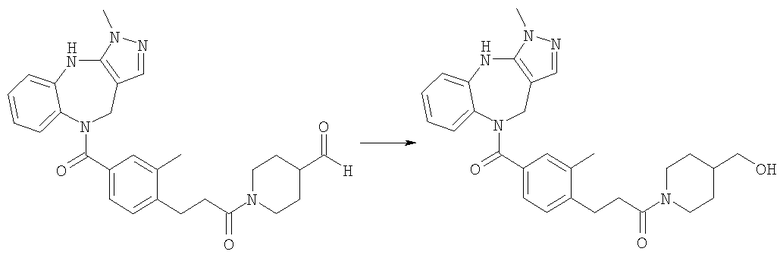
Пример Е80
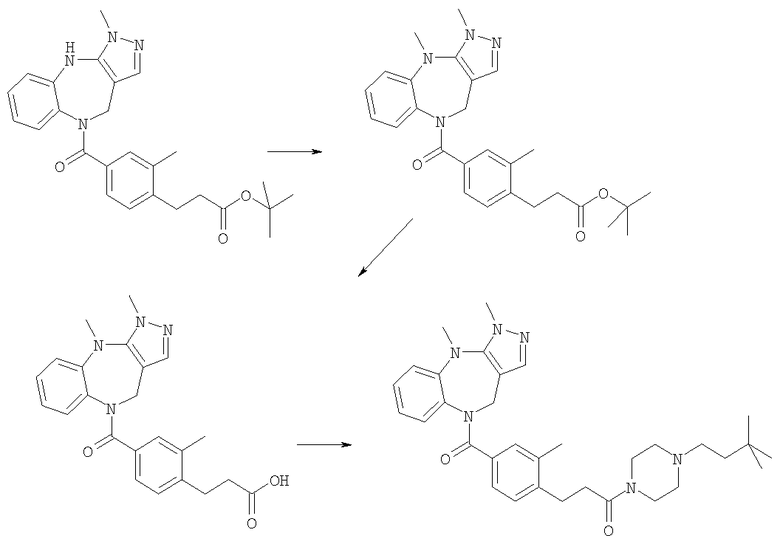
Пример Е81
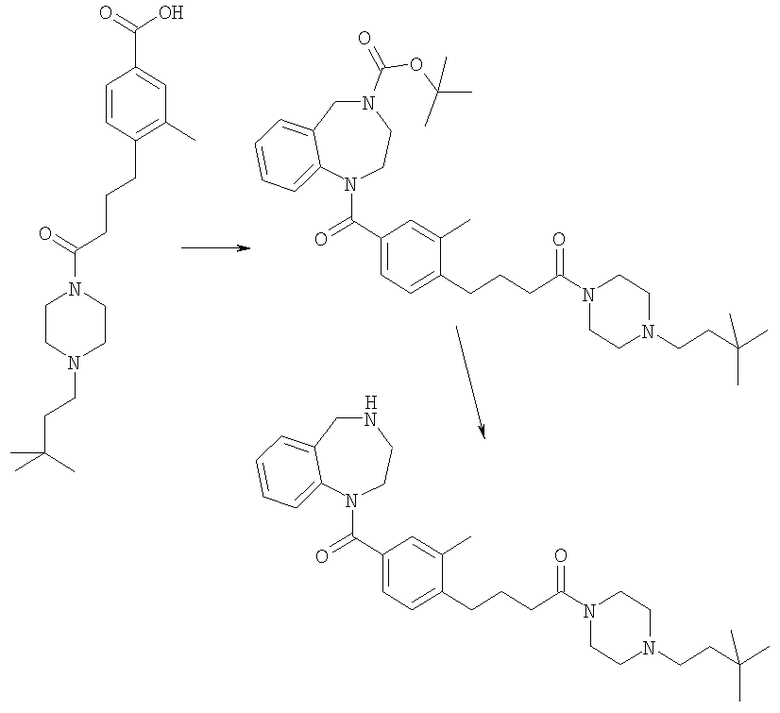
Пример Е82
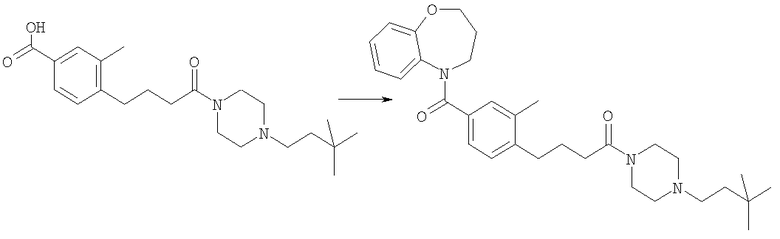
Пример Е83
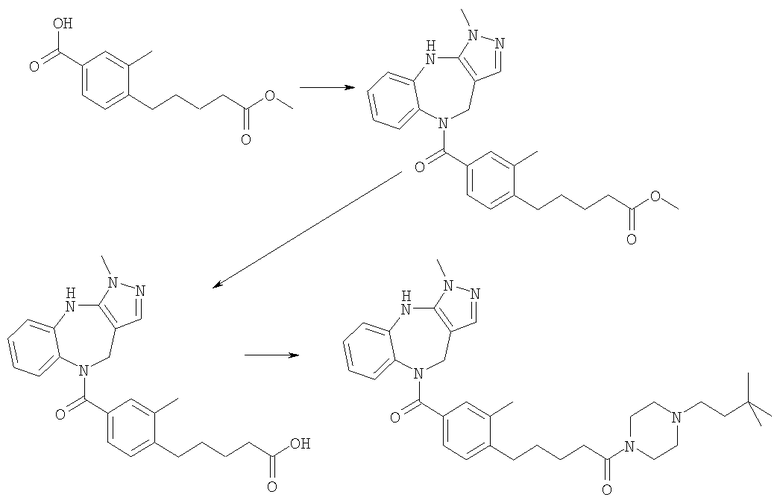
Пример Е84
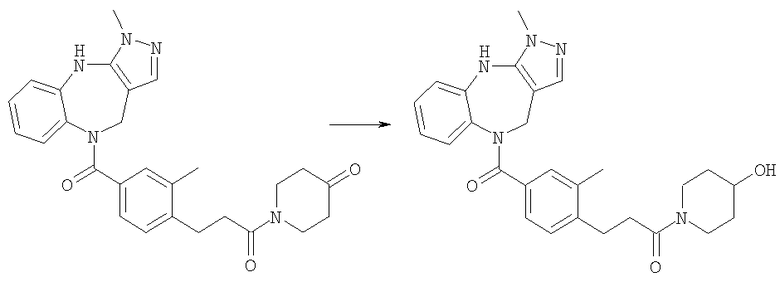
Пример Е85
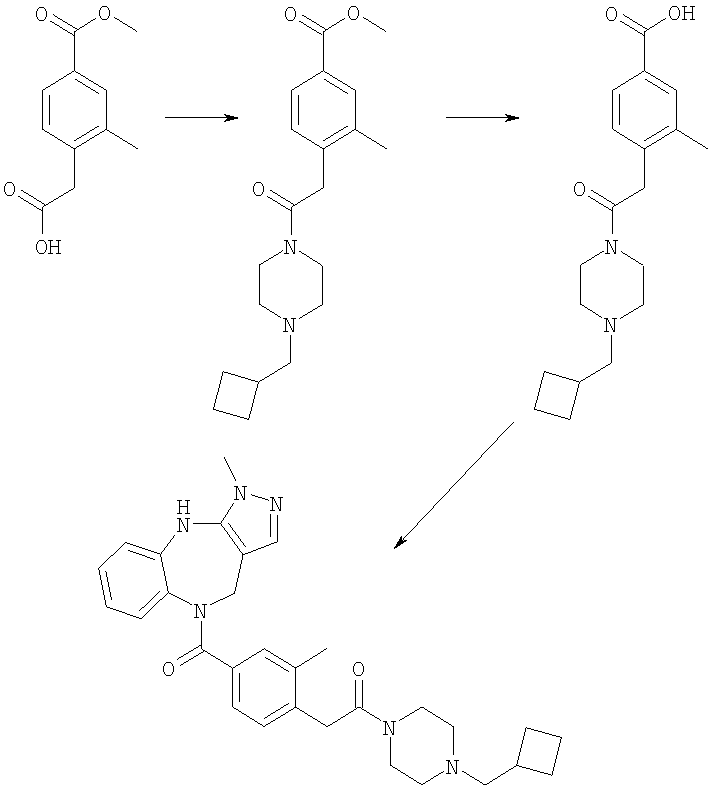
Пример Е86
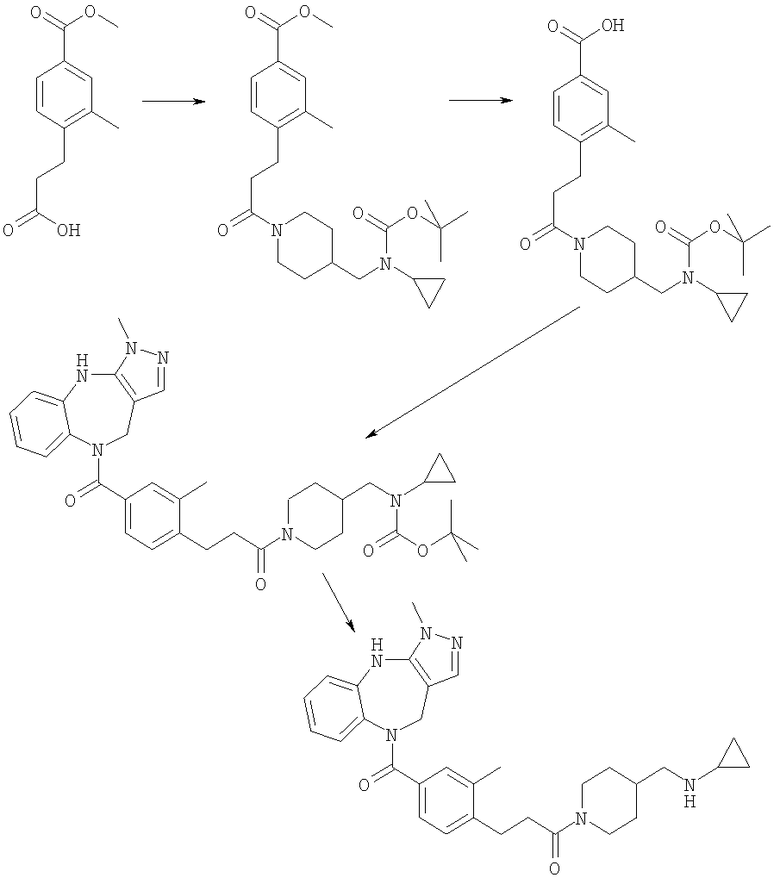
Пример Е87
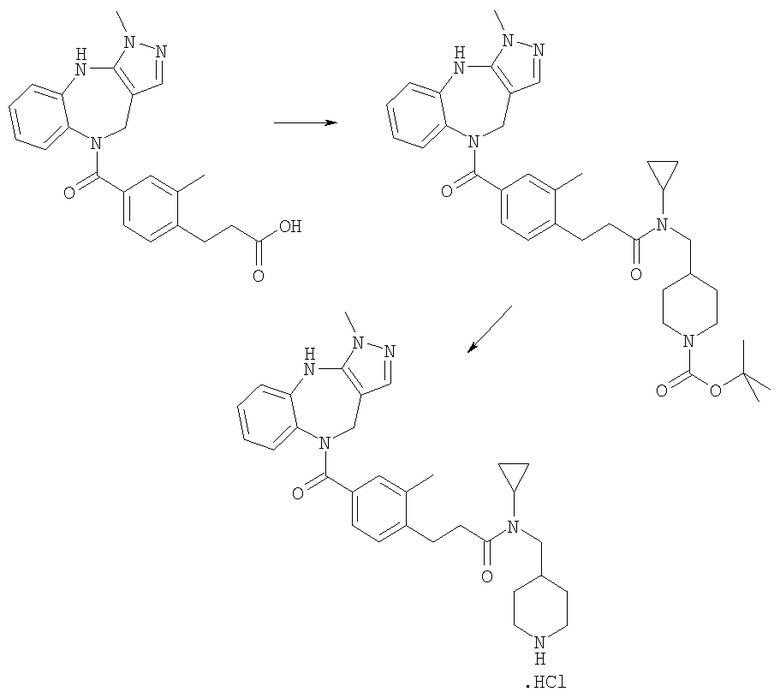
Пример Е88
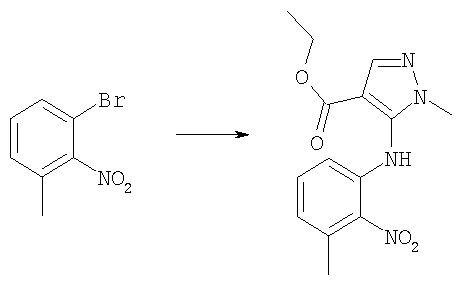
Пример Е89
Пример Е90
Пример Е91
Пример Е92
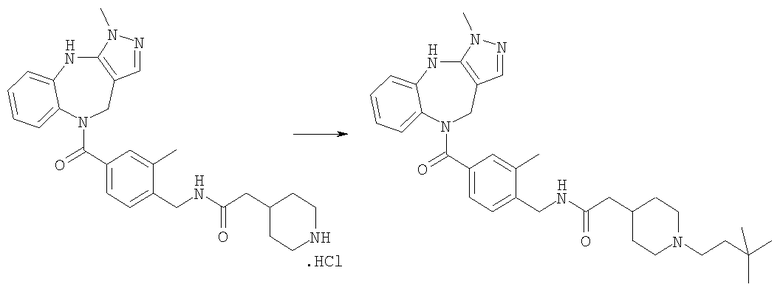
Пример Е93
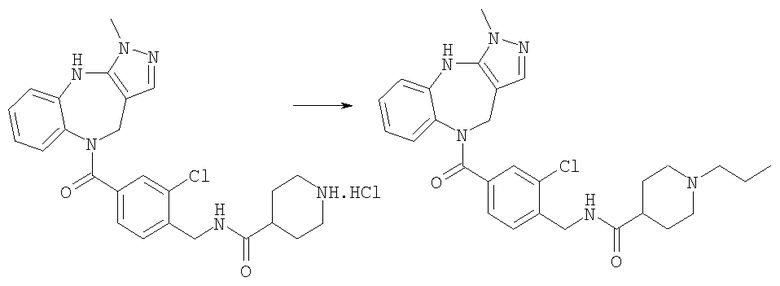
Пример Е94
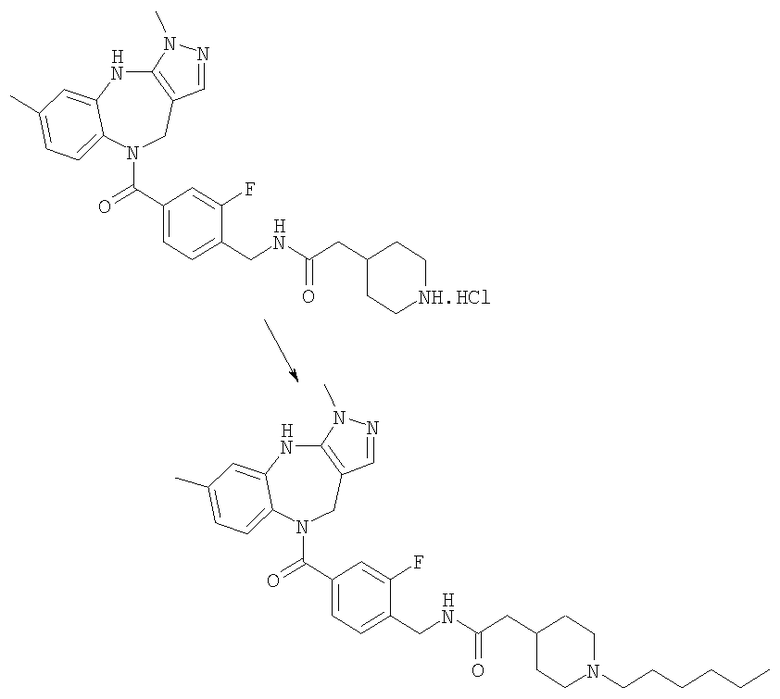
Пример Е95
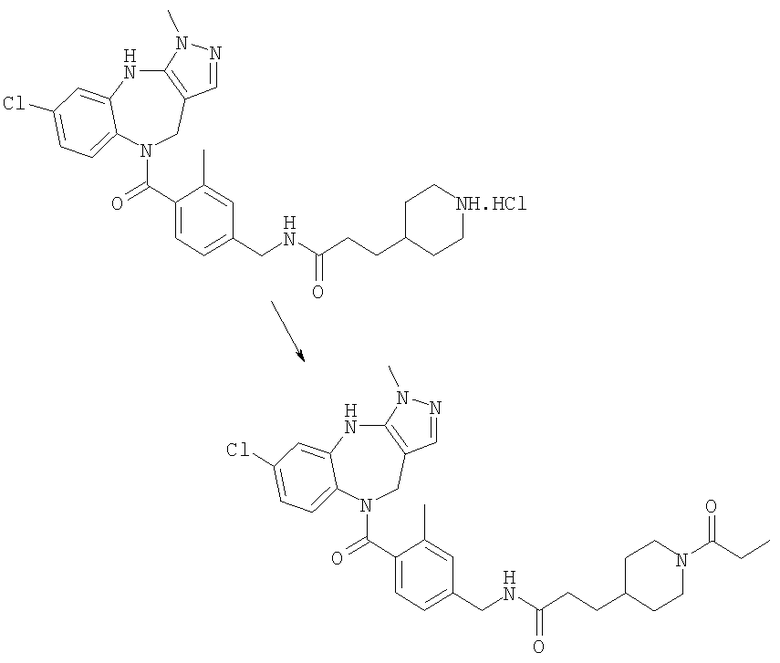
Пример Е96
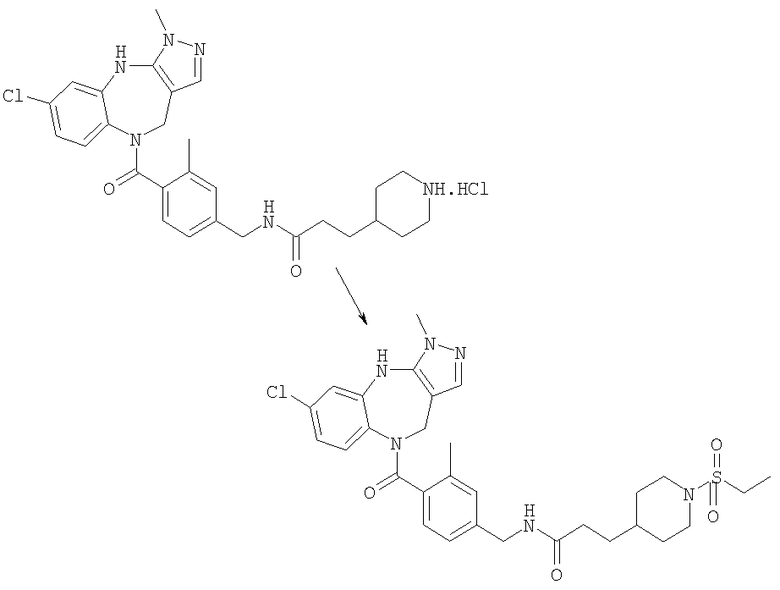
Пример Е97
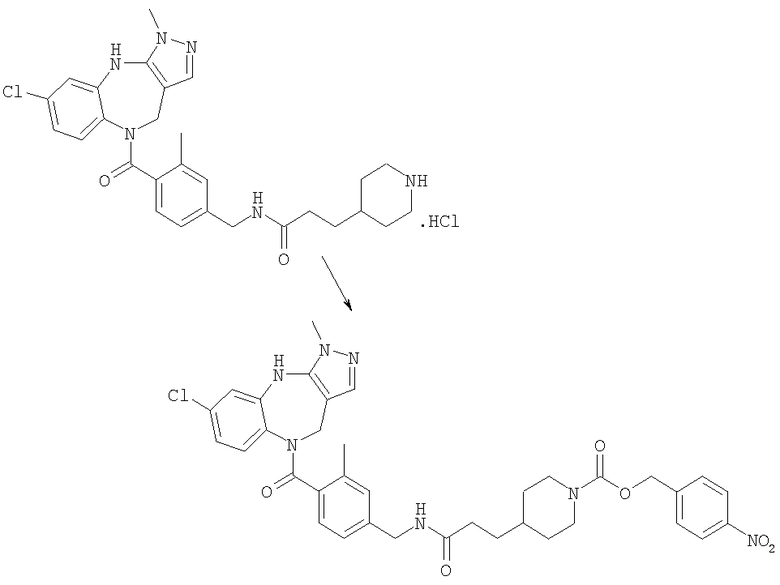
Пример Е98
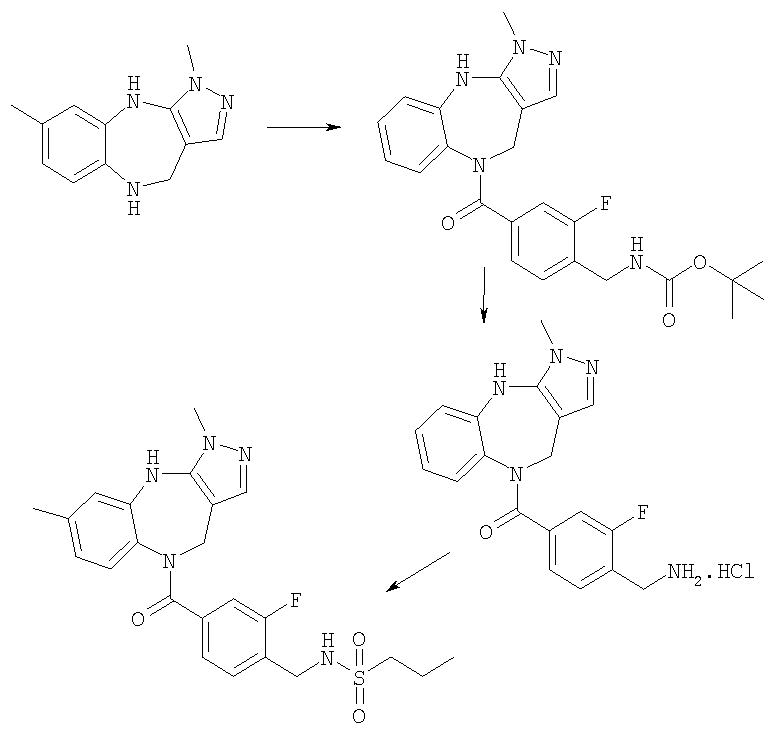
Пример Е99
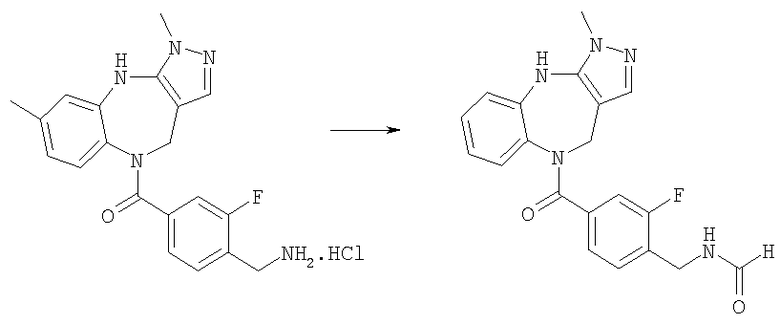
Пример Е100
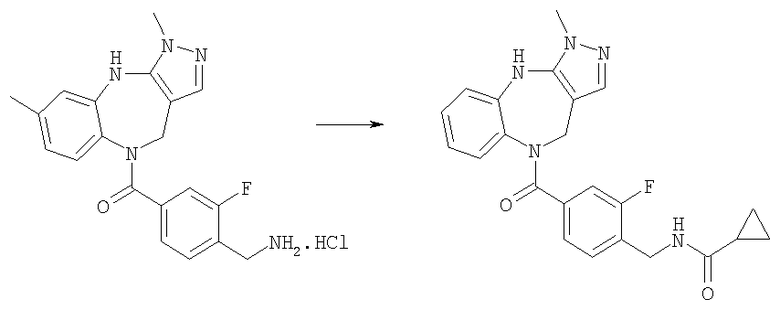
Пример Е101
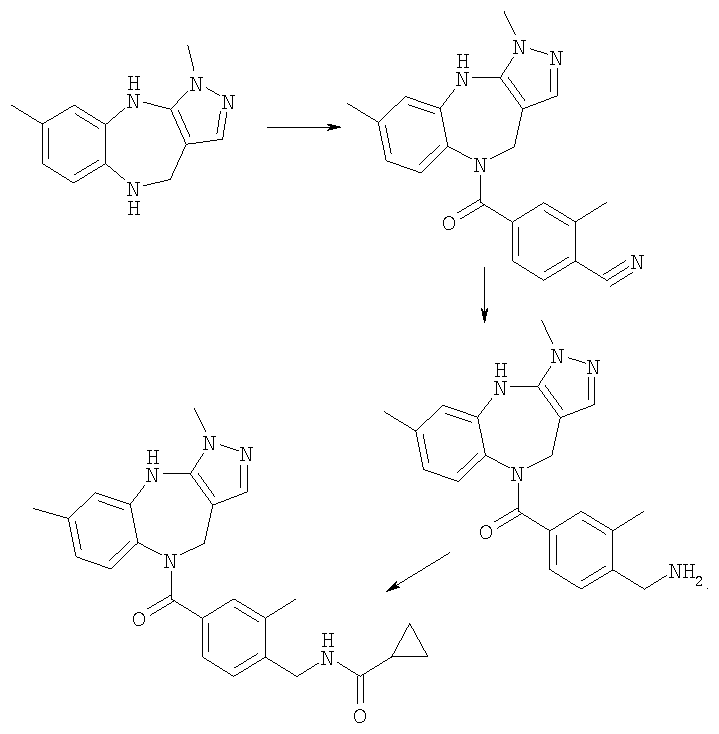
Пример Е102
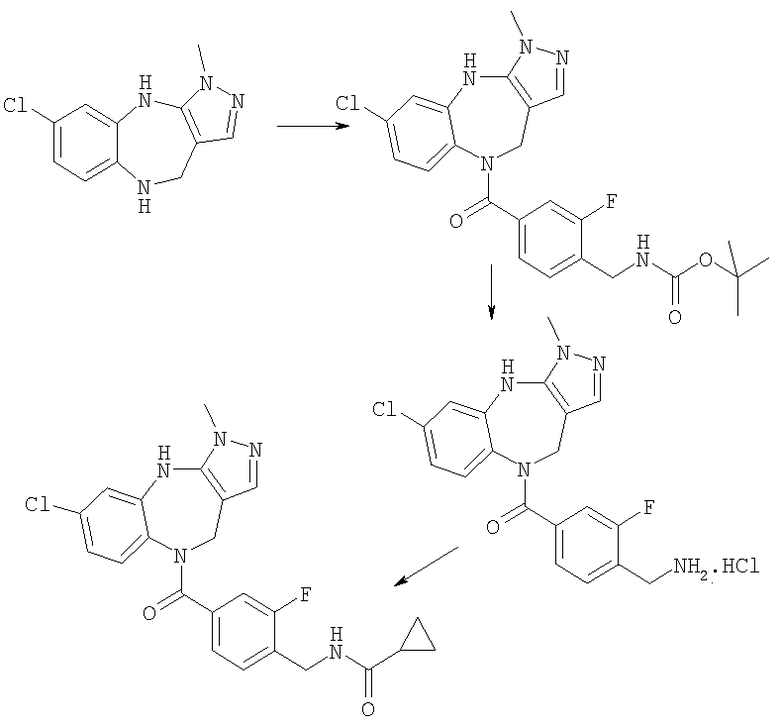
Пример Е103
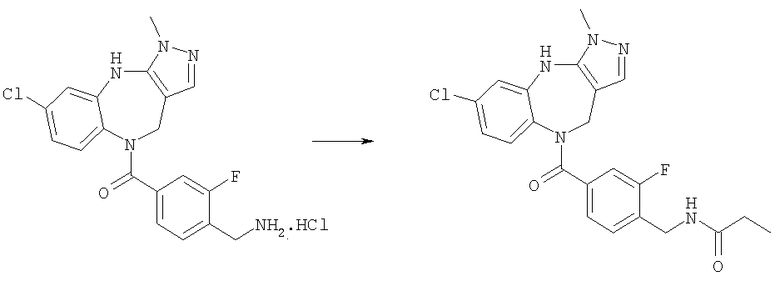
Пример Е104
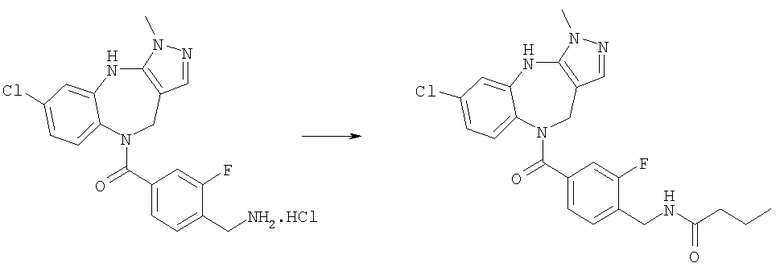
Пример Е105
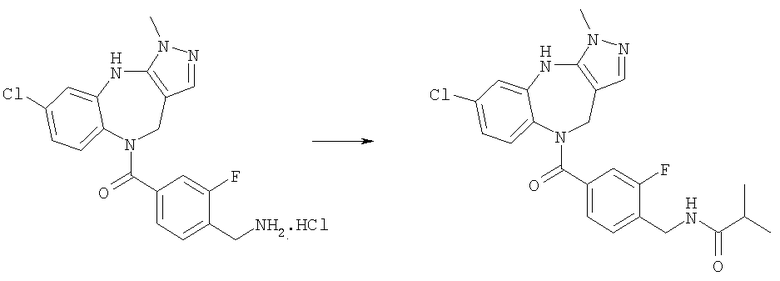
Пример Е106
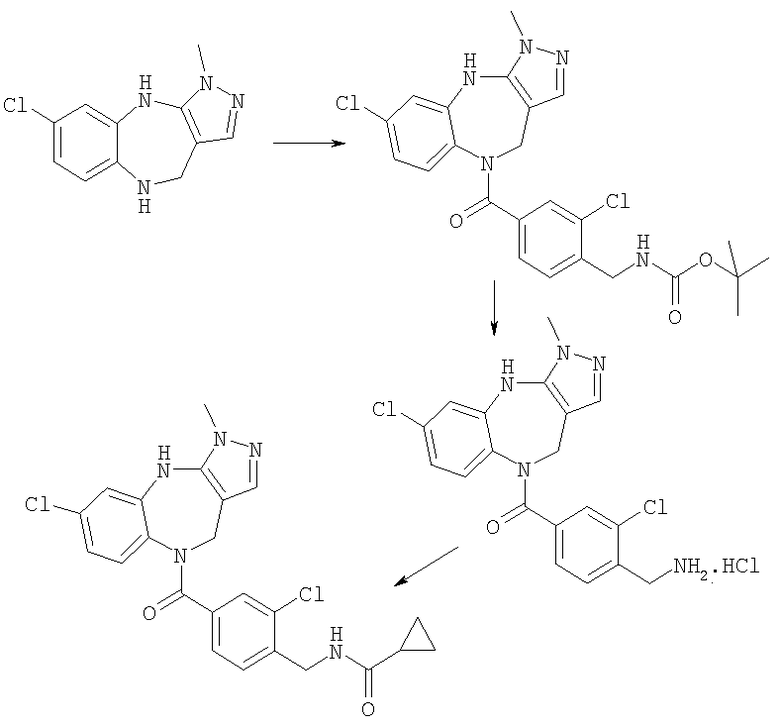
Пример Е107
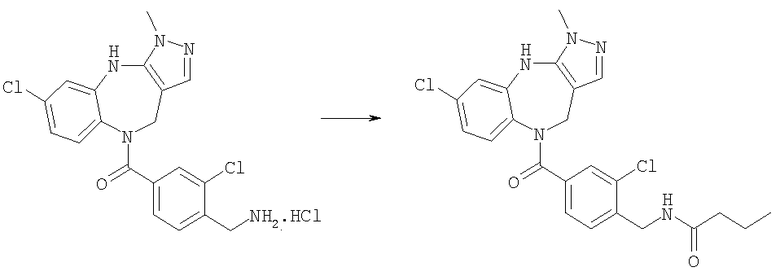
Пример Е108
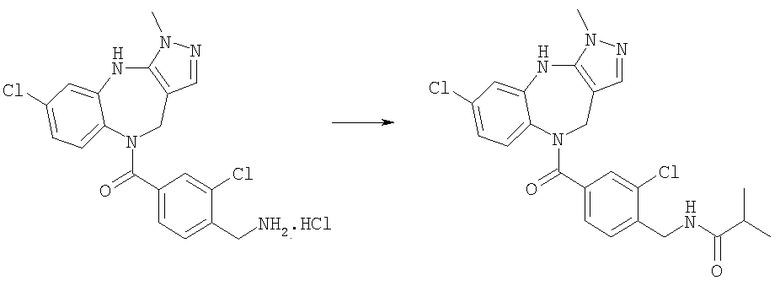
Пример Е109
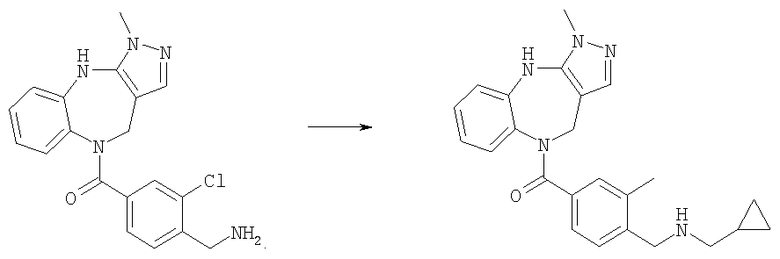
Пример Е110 и Пример Е111
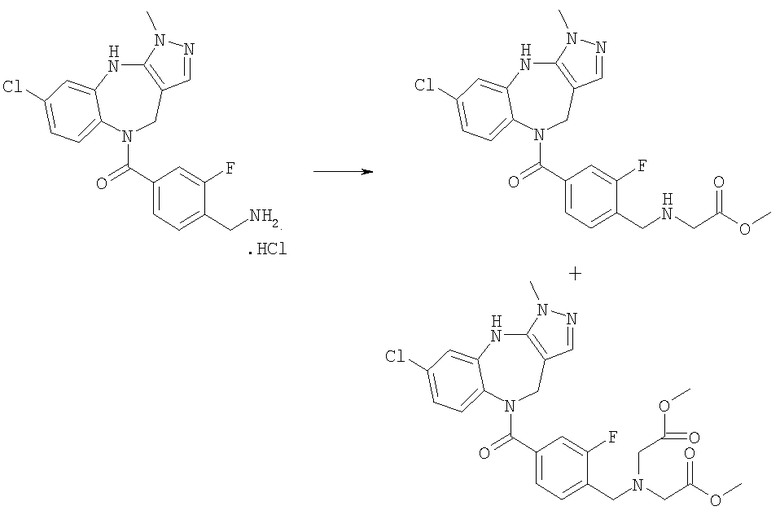
Пример Е112
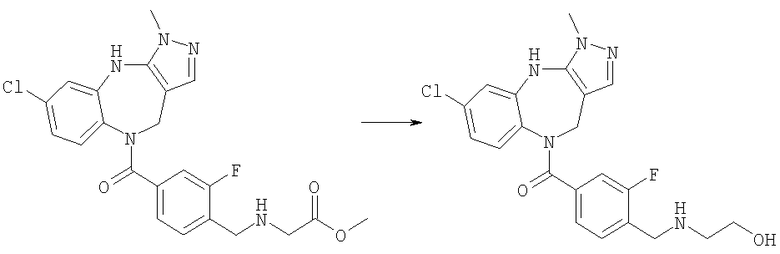
Пример Е113
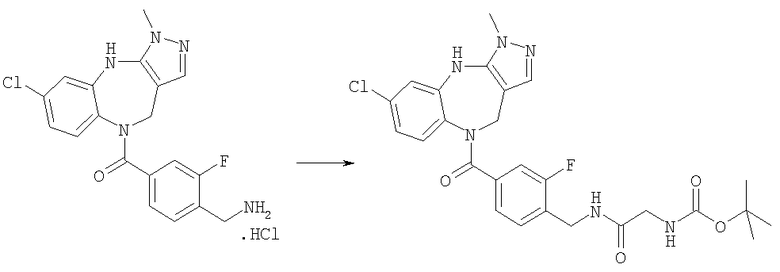
Пример Е114
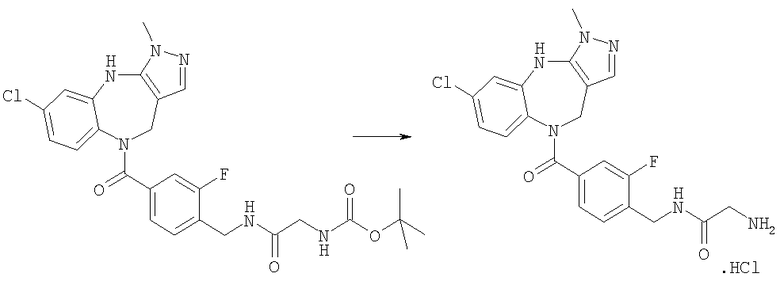
Пример Е115
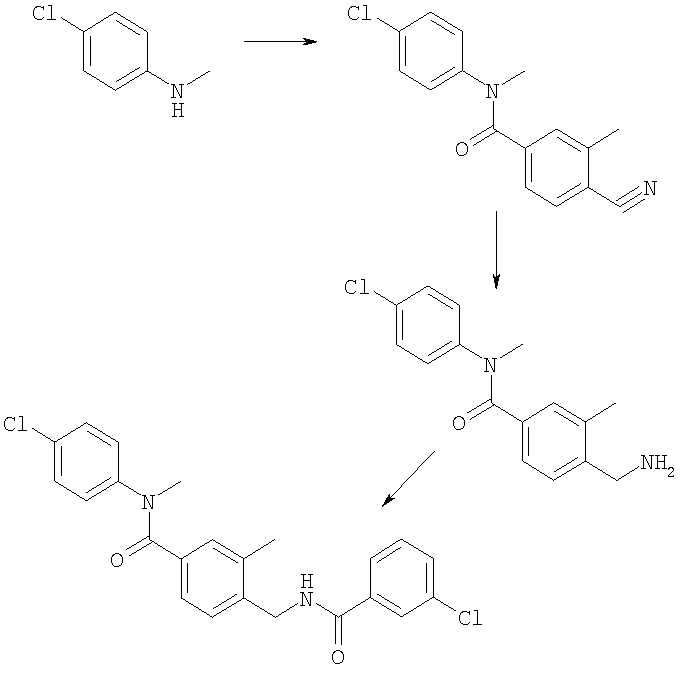
Пример Е116
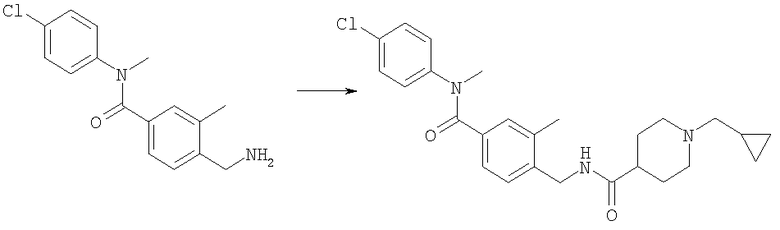
Пример Е117
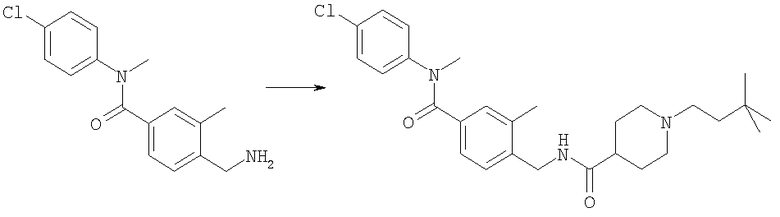
Пример Е118
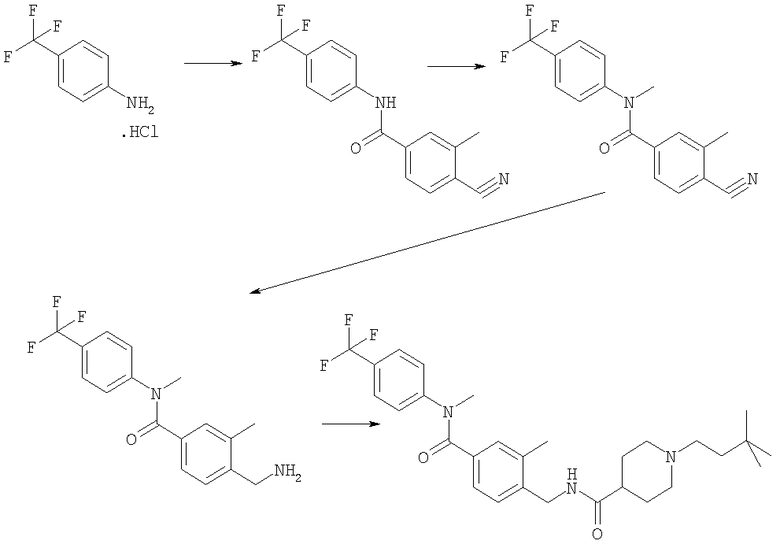
Пример Е119
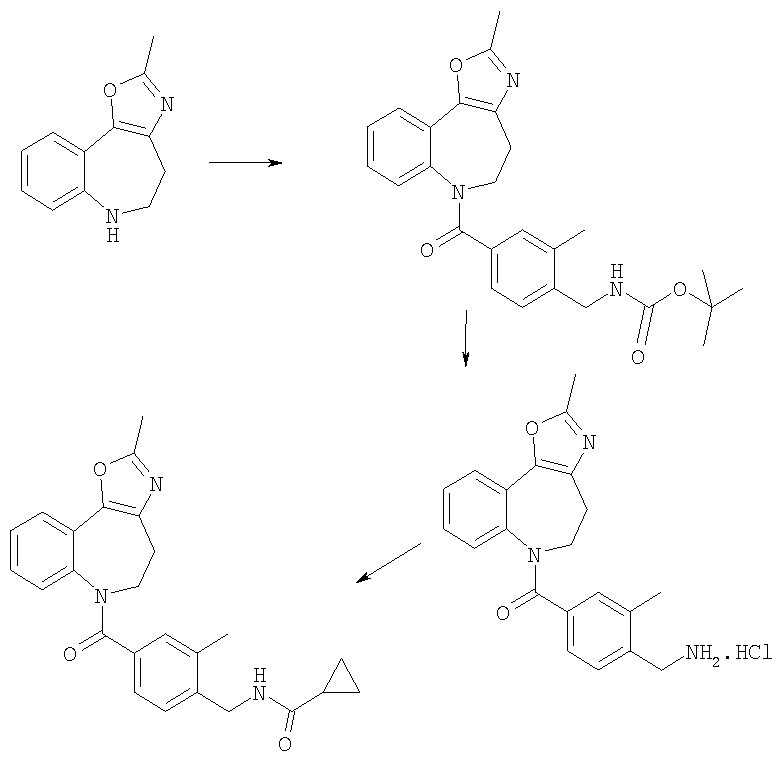
Пример Е120
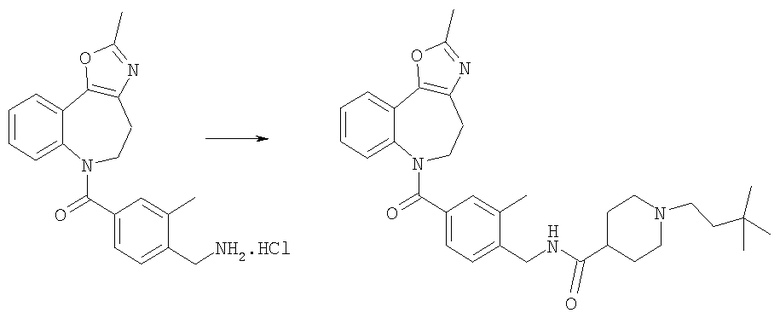
Пример Е121
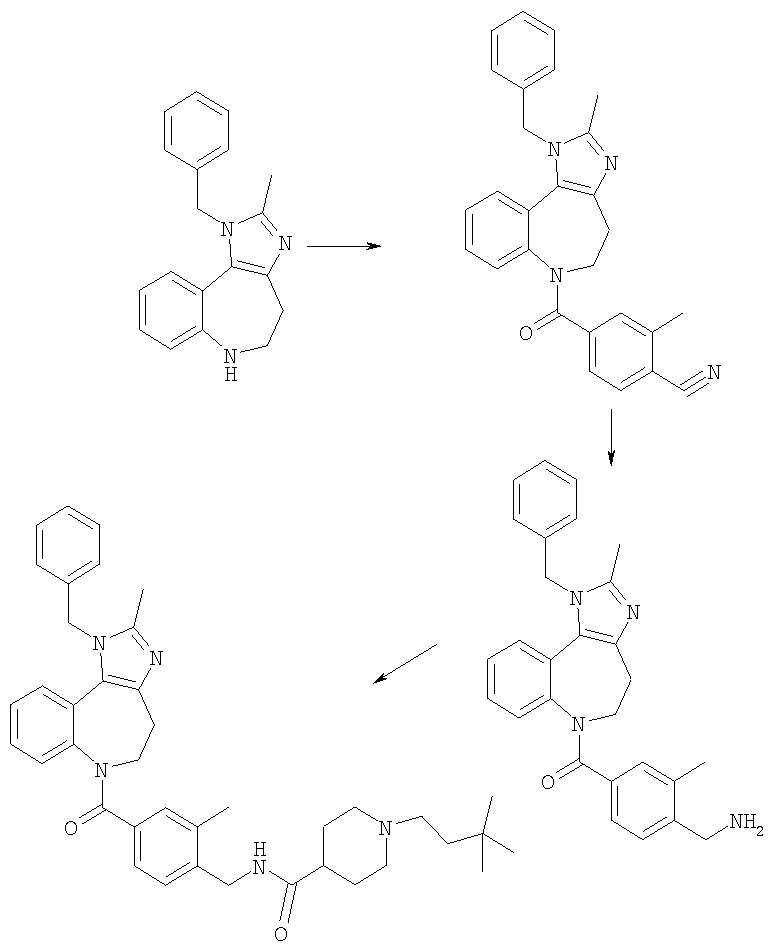
Пример Е122
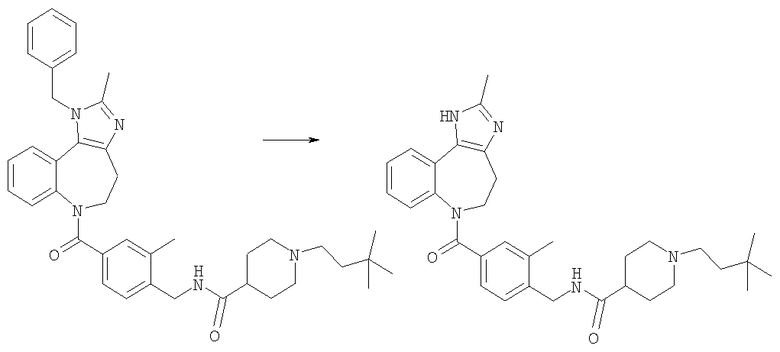
Пример Е123
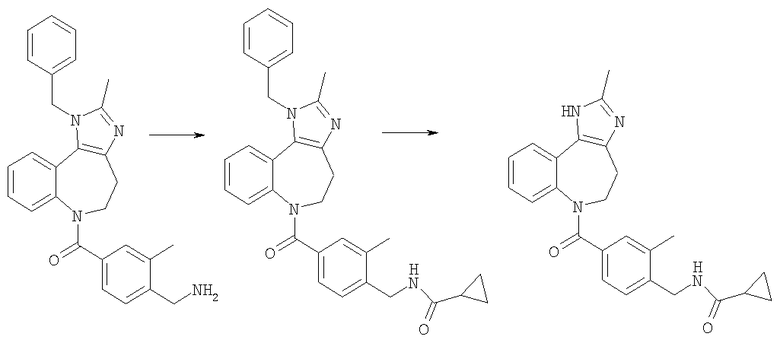
Пример Е124
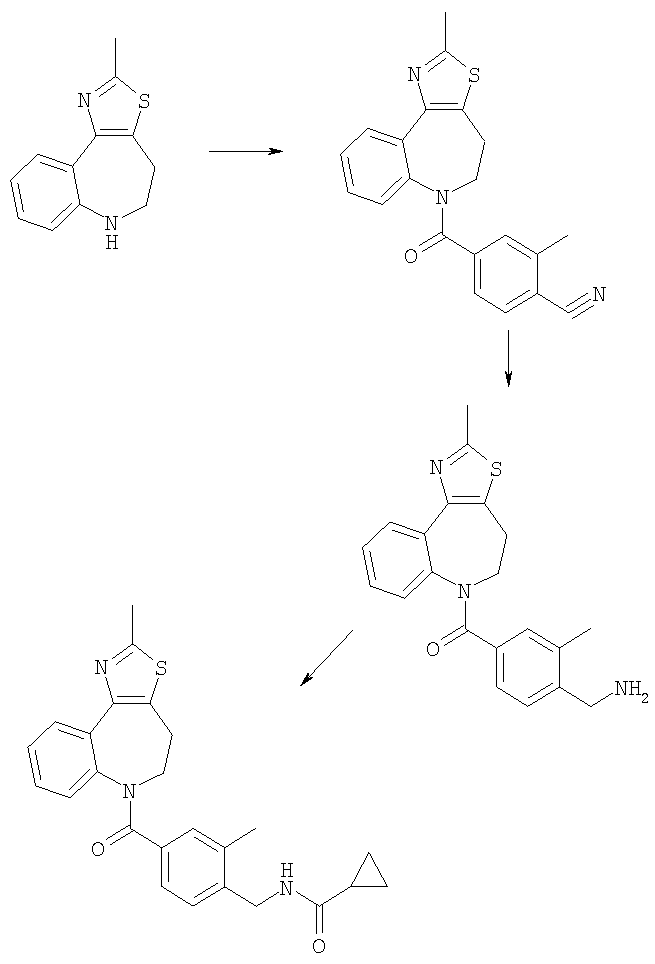
Пример Е125
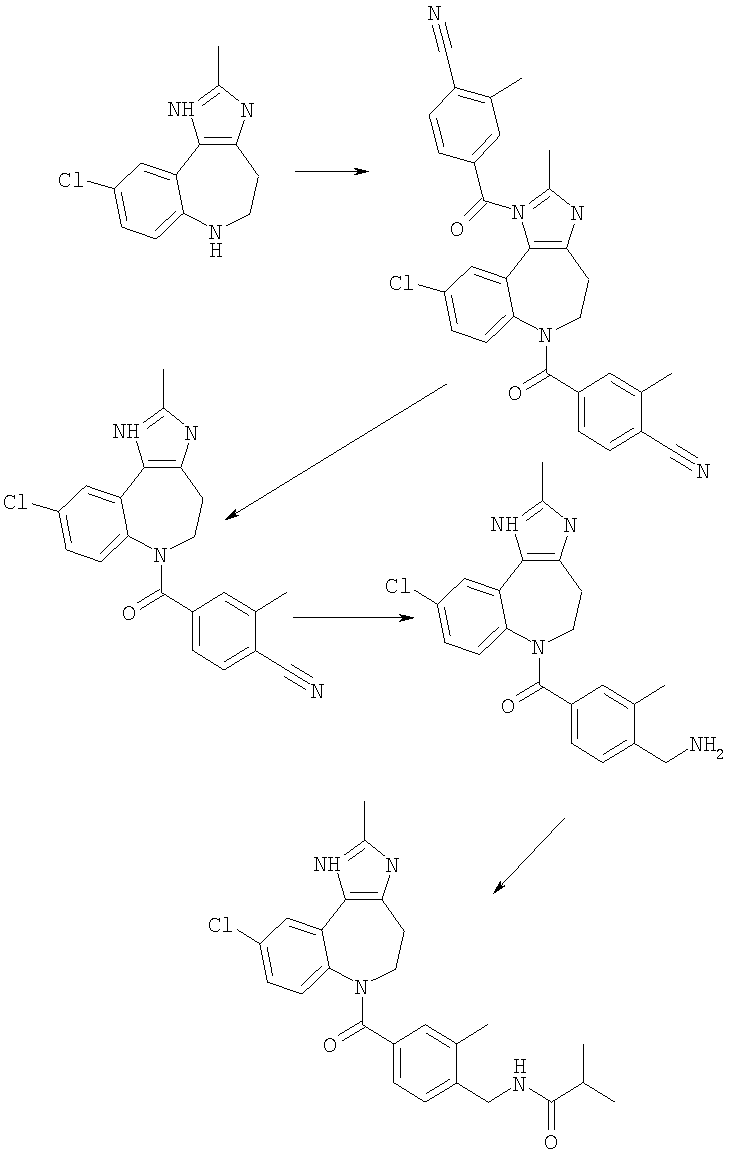
ТАБЛИЦЫ С ПРИМЕРАМИ
Следующие соединения получали с использованием способов, аналогичных описанным выше.
Пример Е5 и Соединение номер 2 имеют особенную полезность в качестве промежуточных соединений.
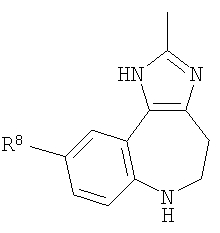
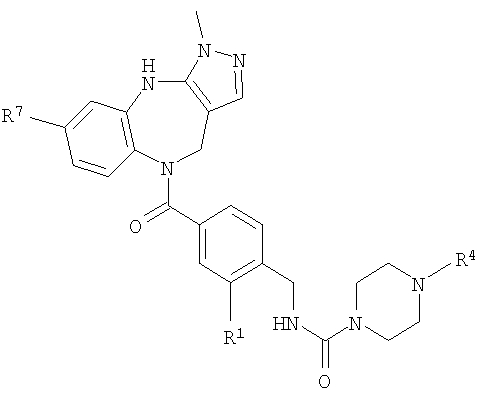












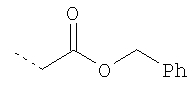

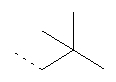


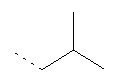




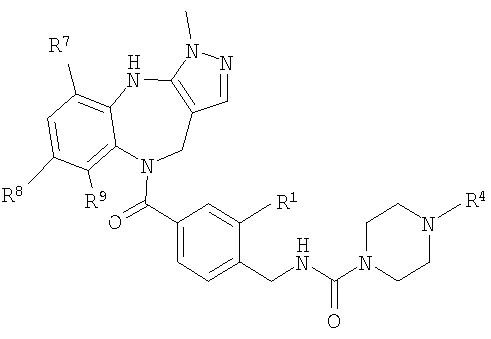


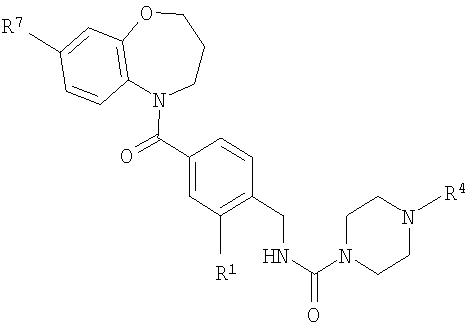


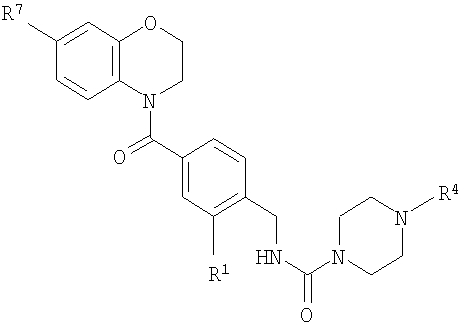


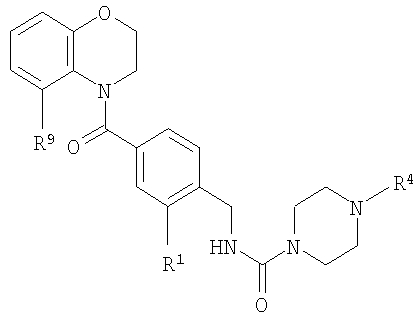

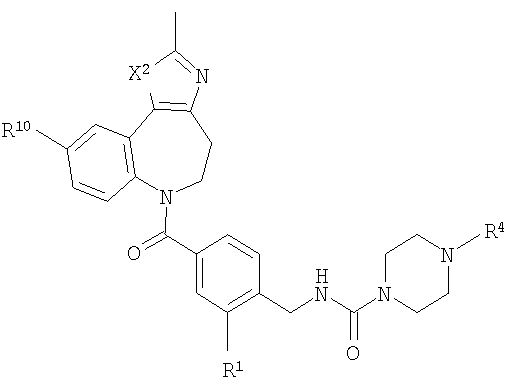




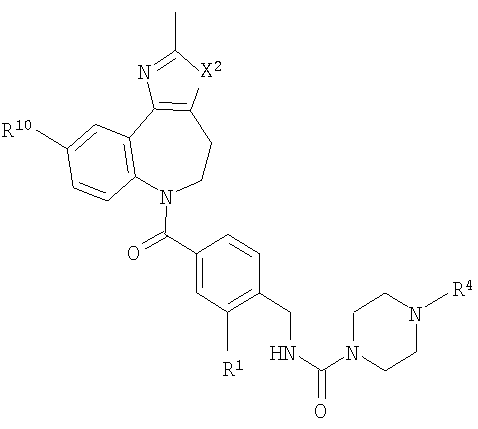



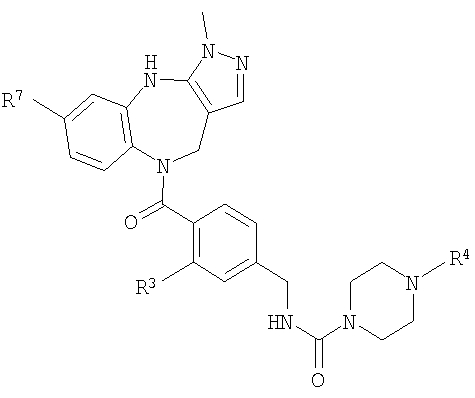












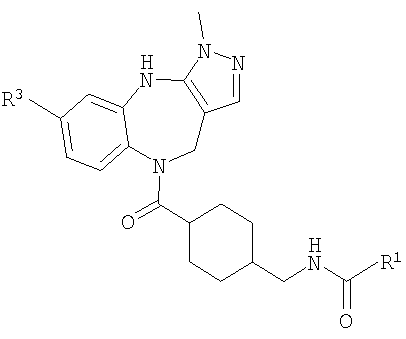


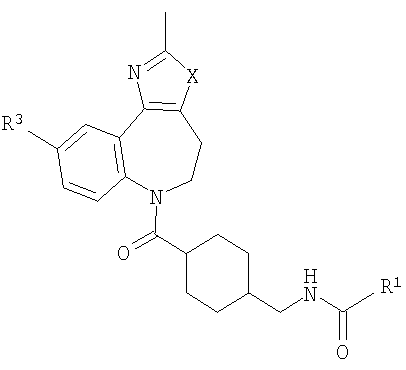


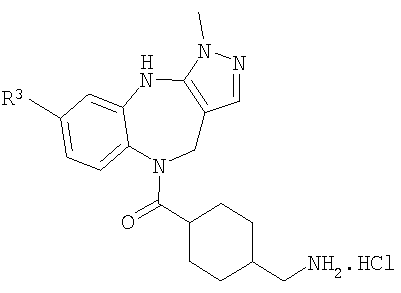
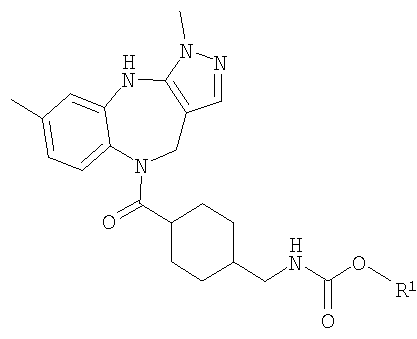



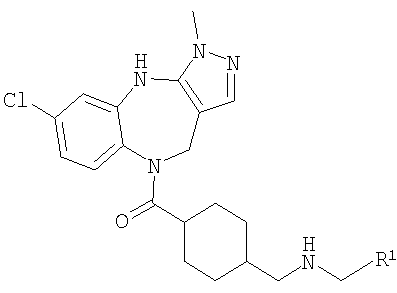
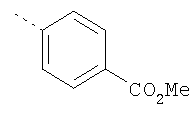
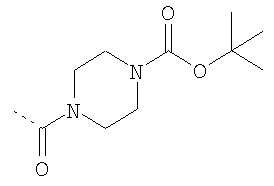


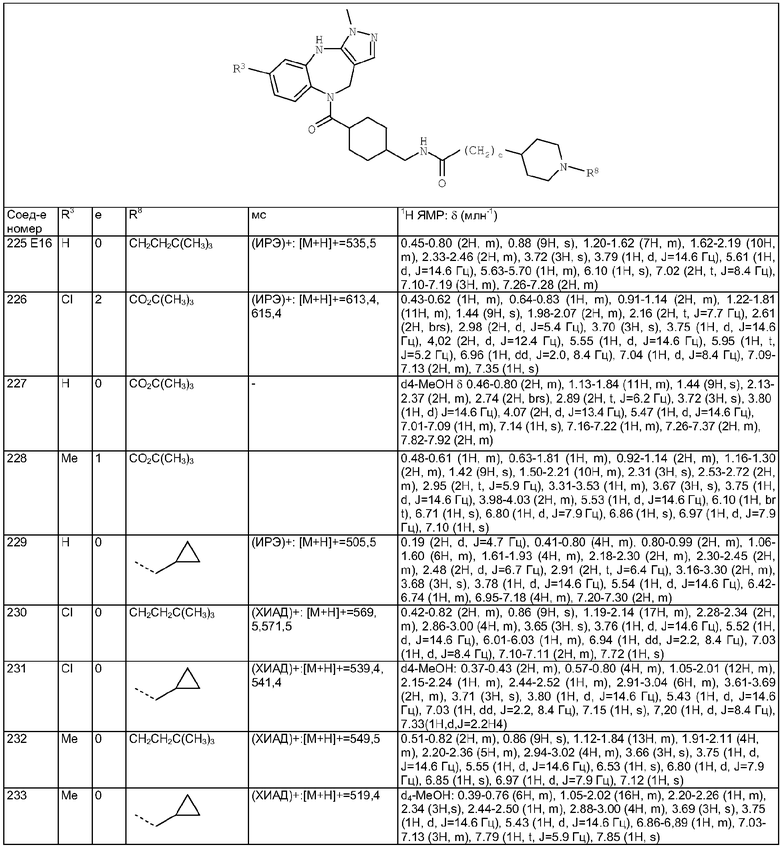
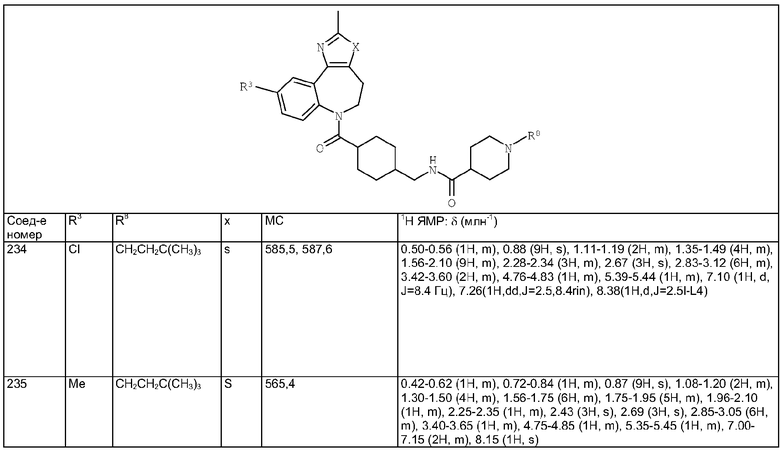
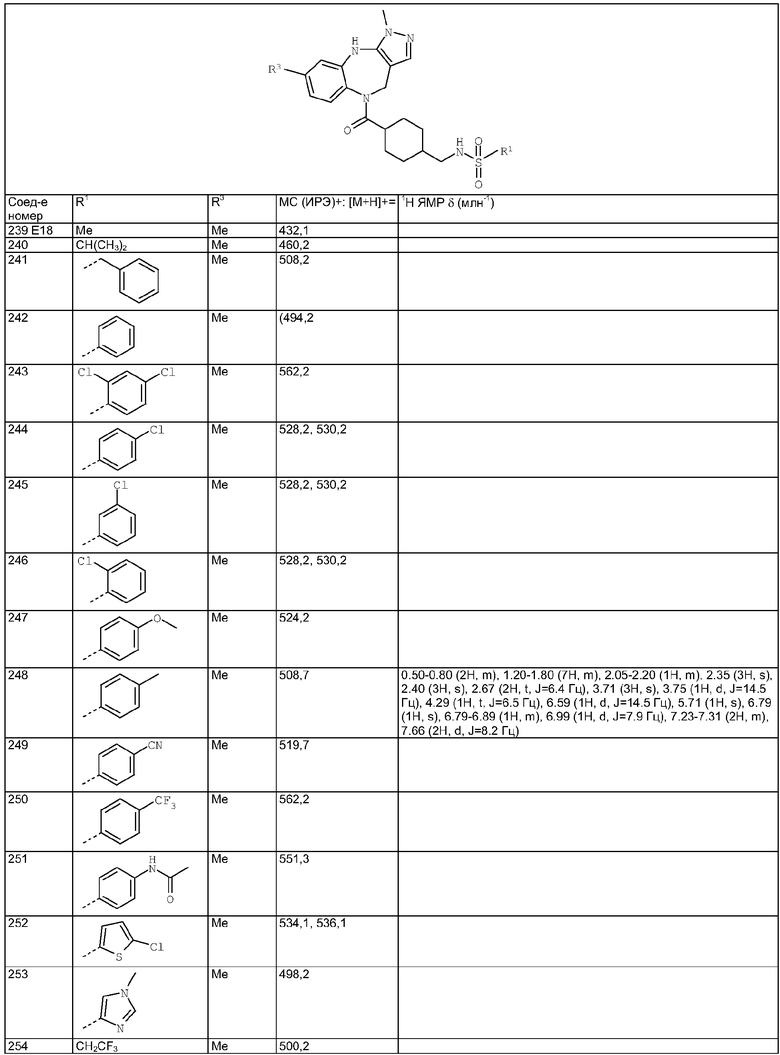
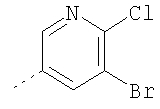
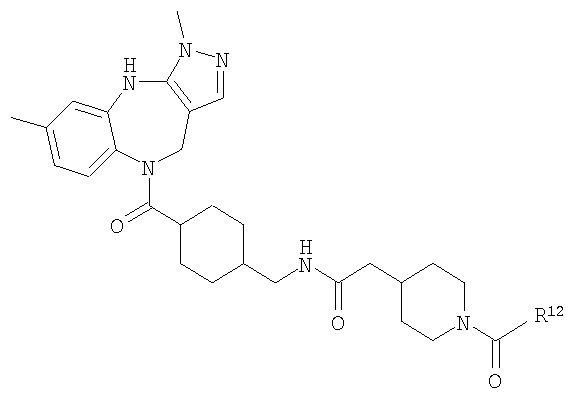




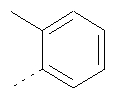
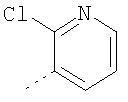
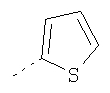
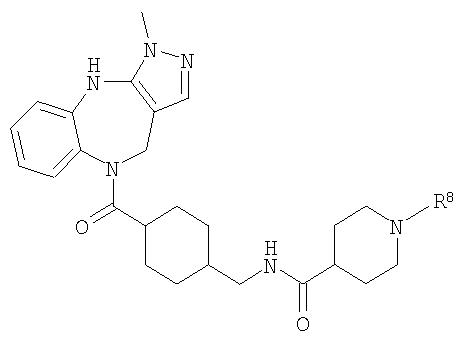

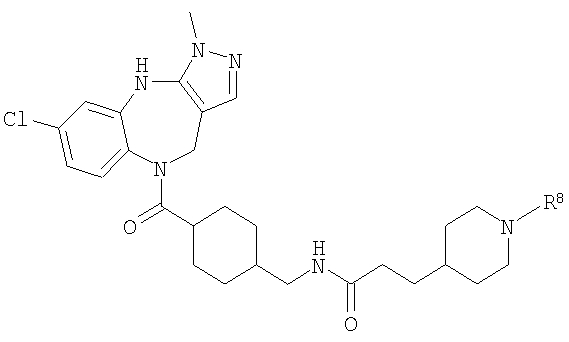

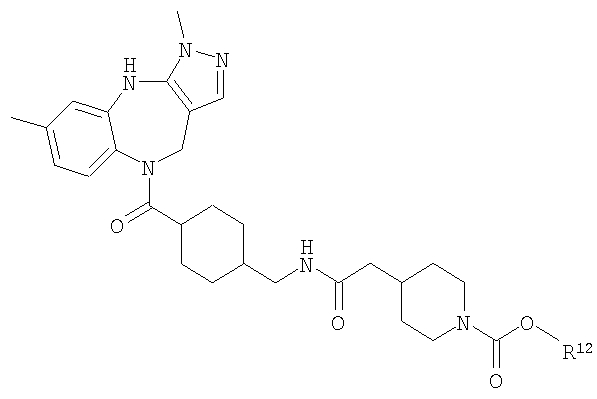




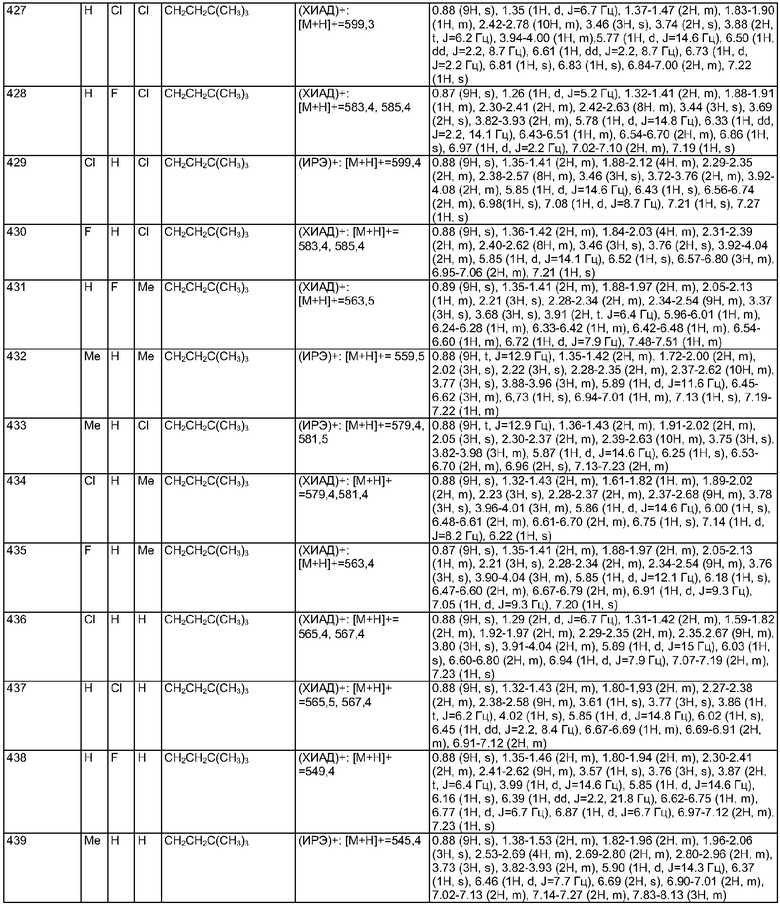






















































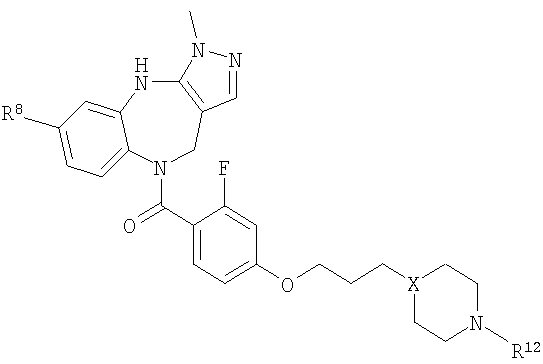





















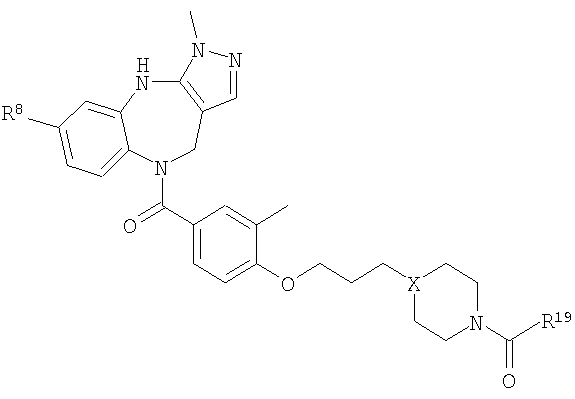




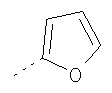
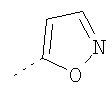
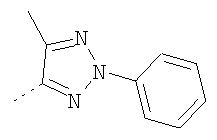





























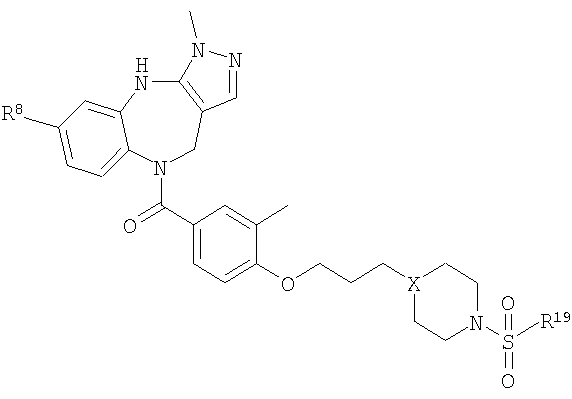




















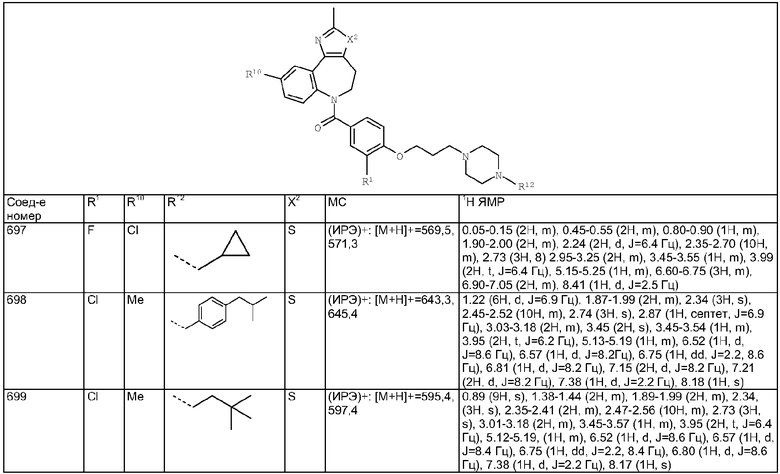
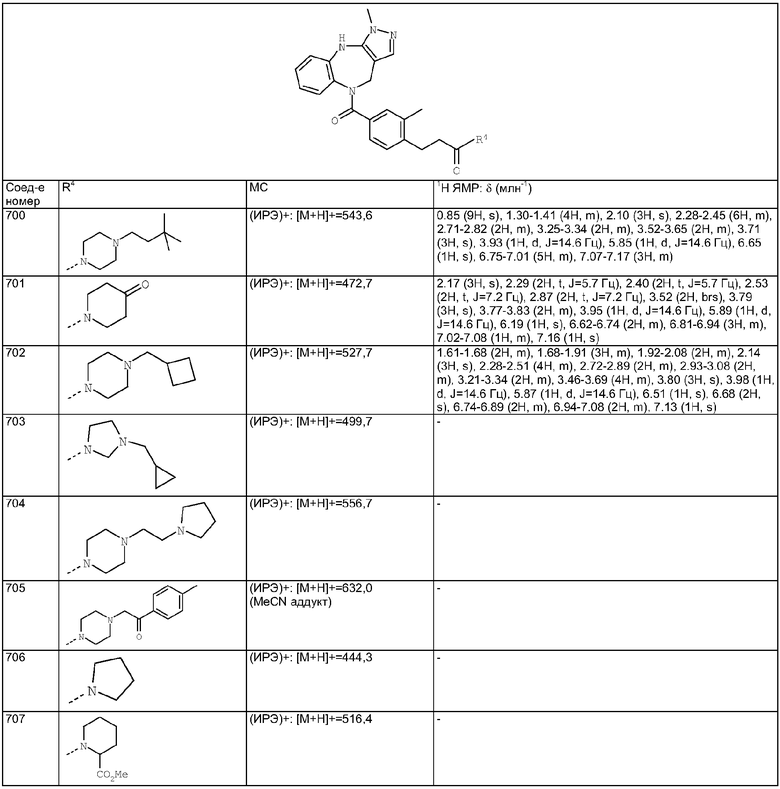
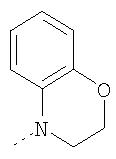
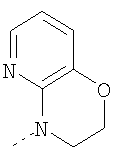
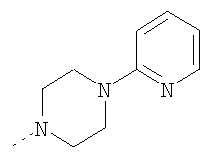
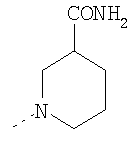
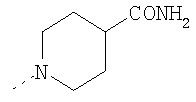
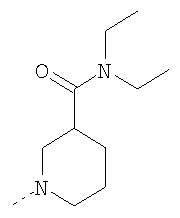
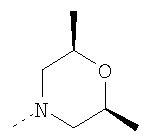
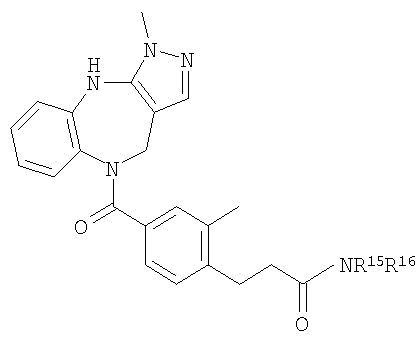
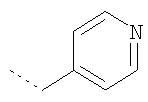
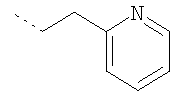
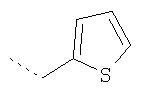
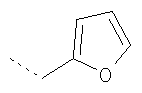





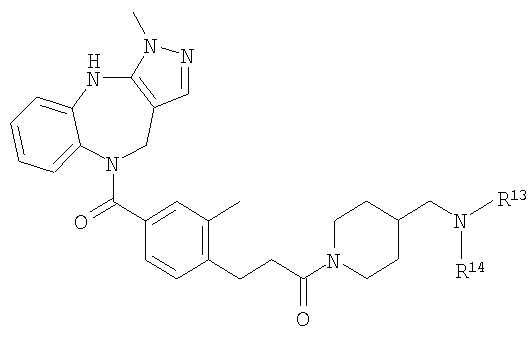
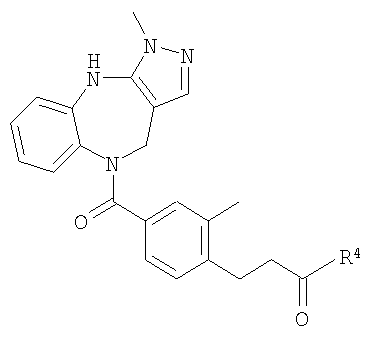

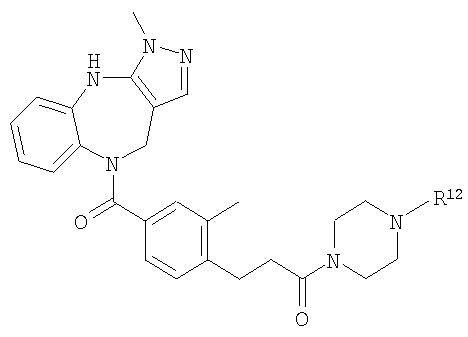







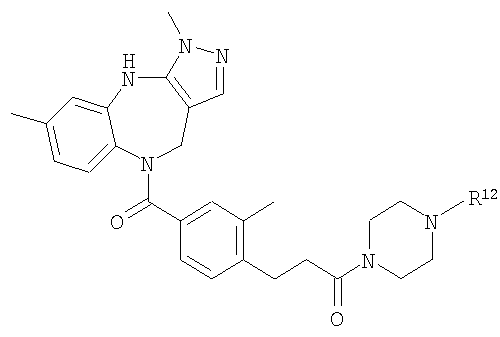
























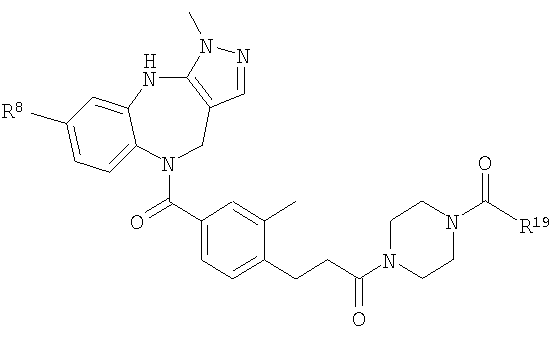
















































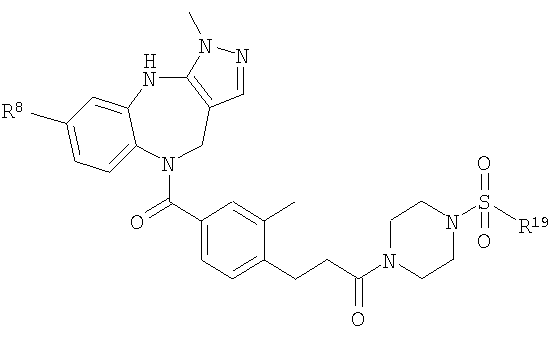














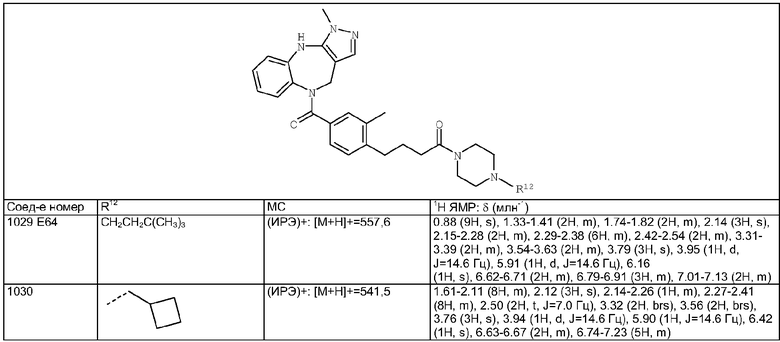
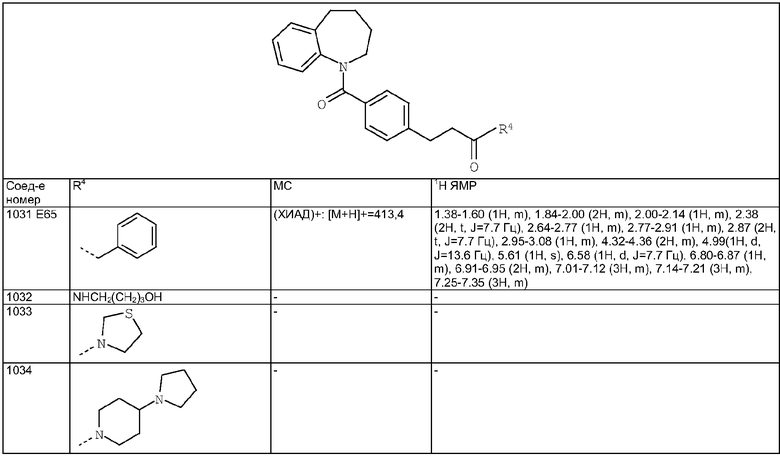
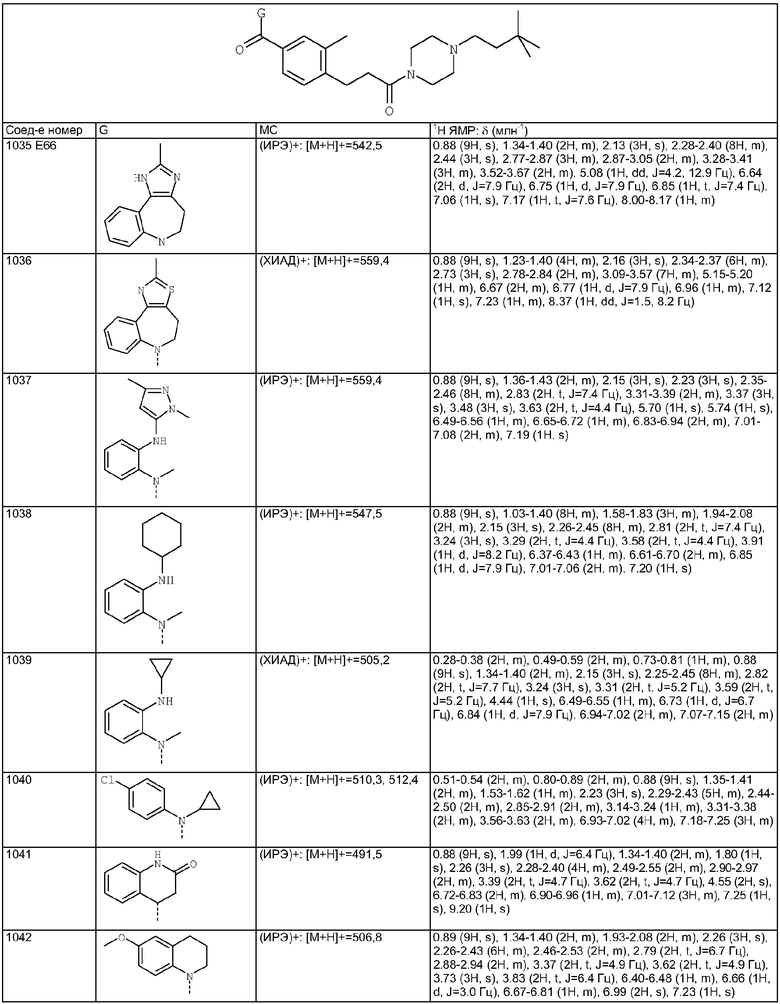
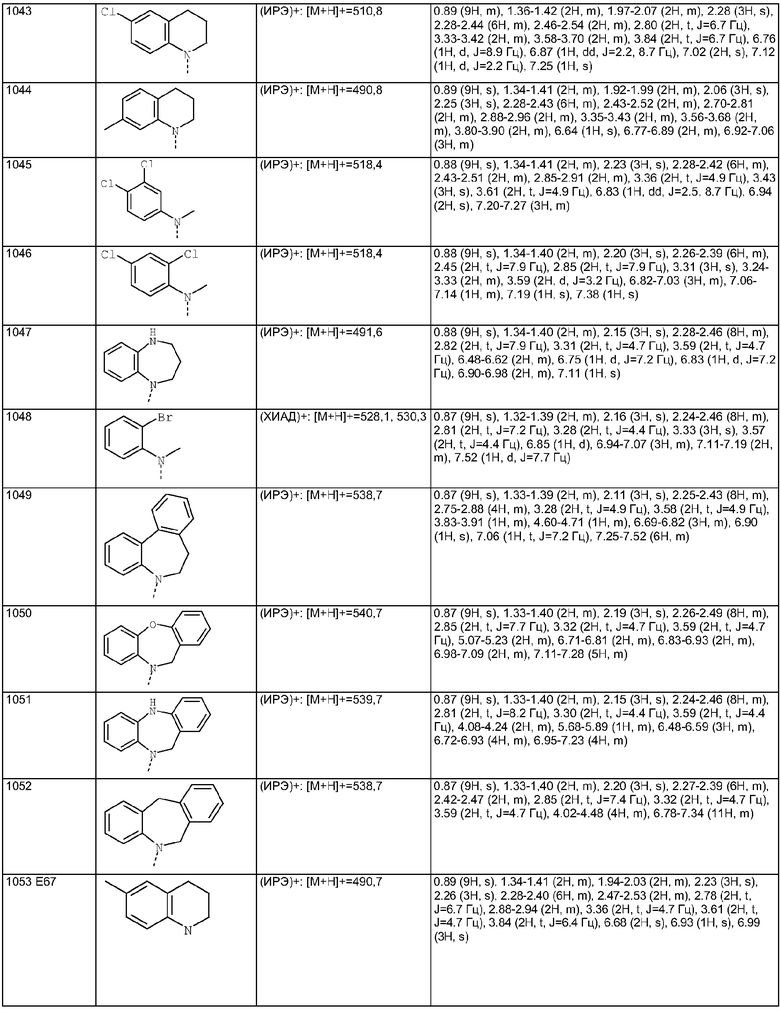

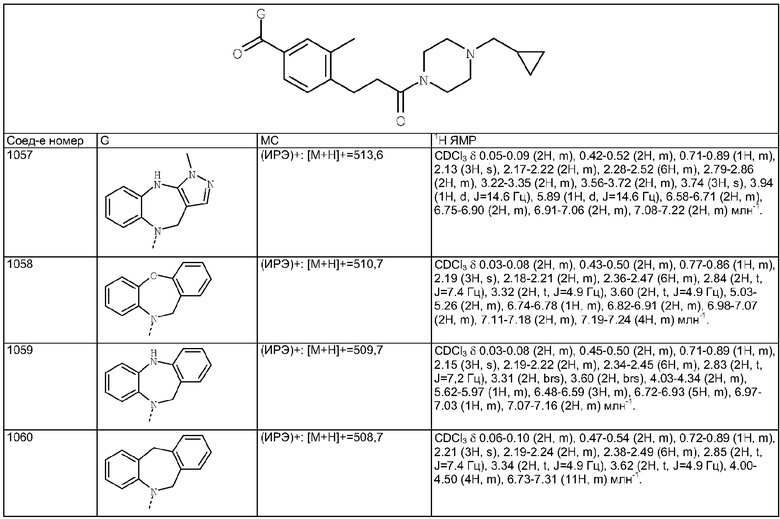
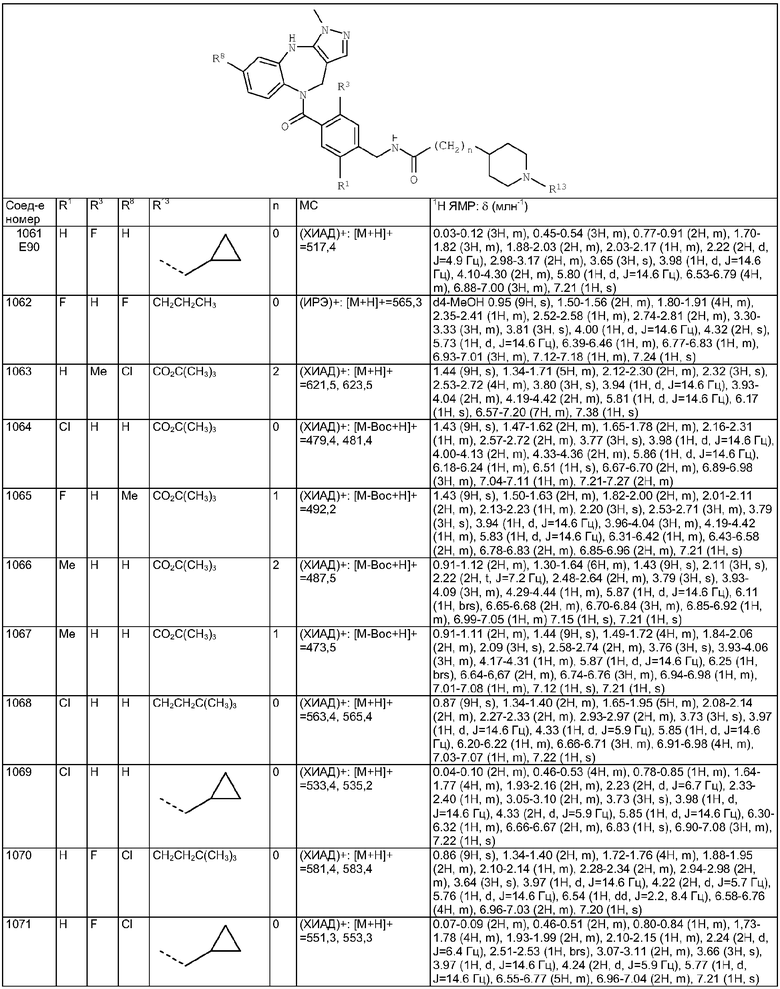
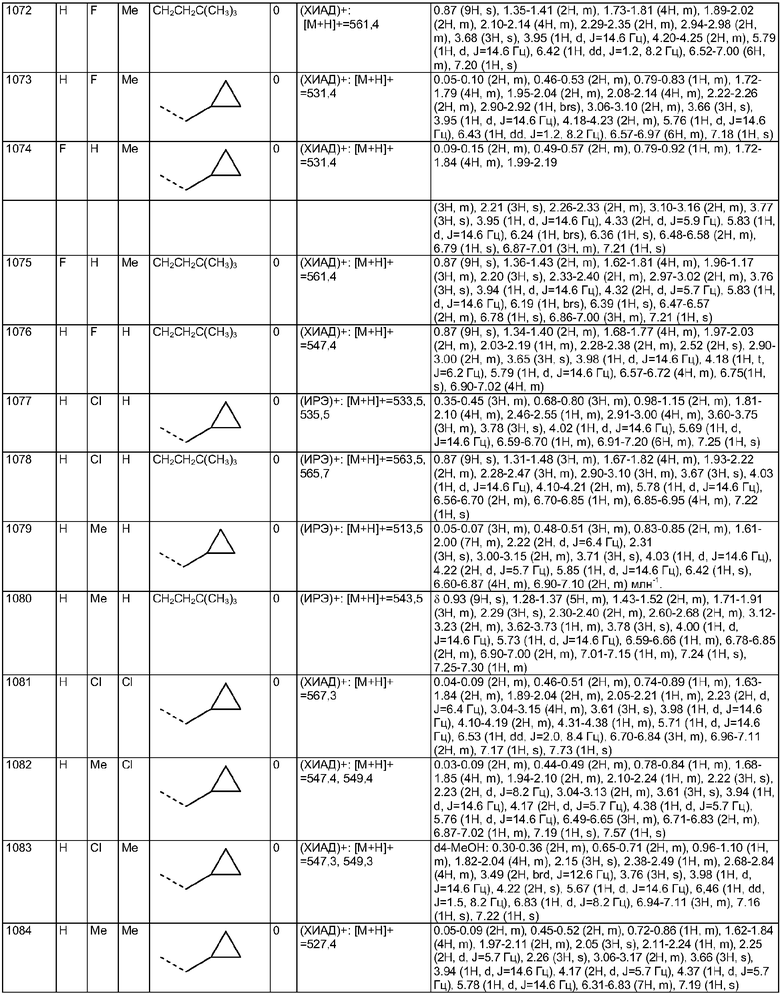
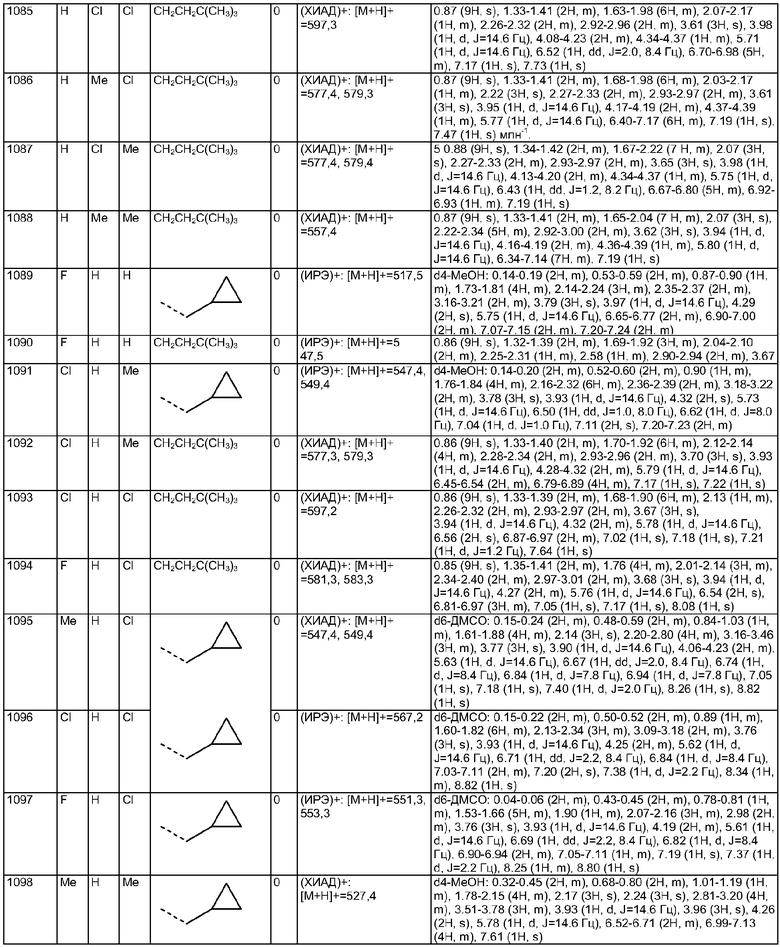
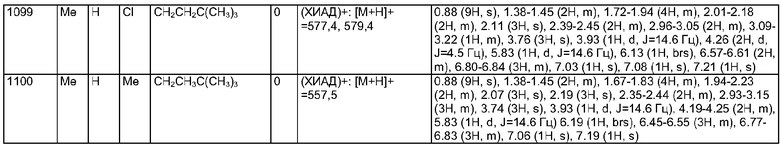
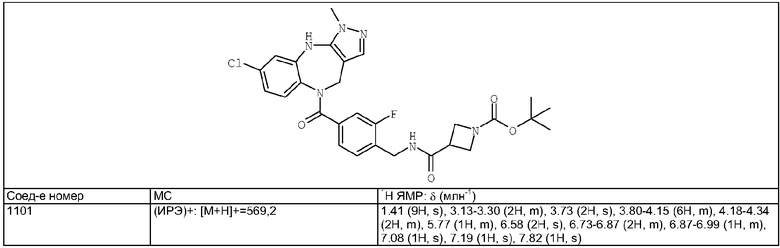
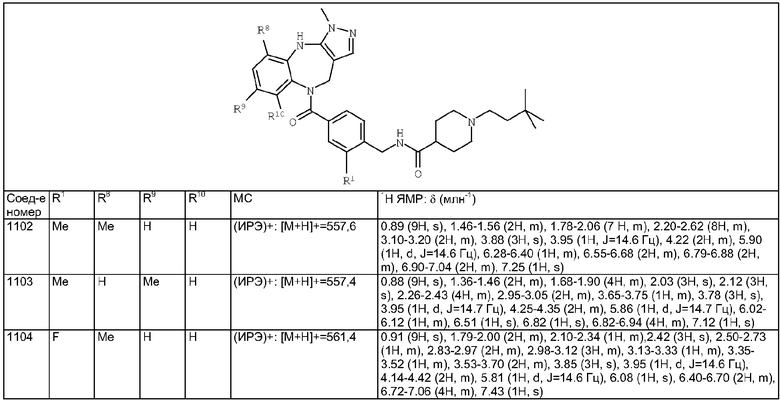
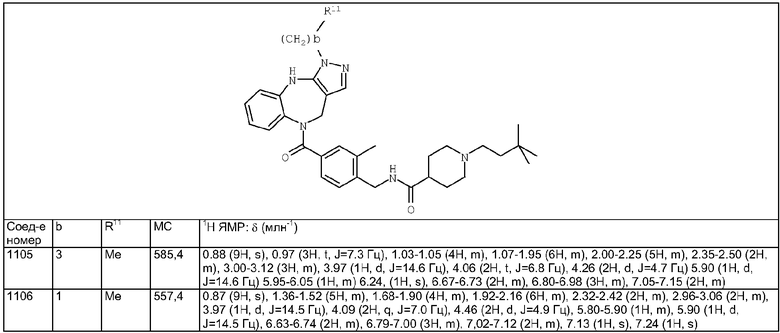
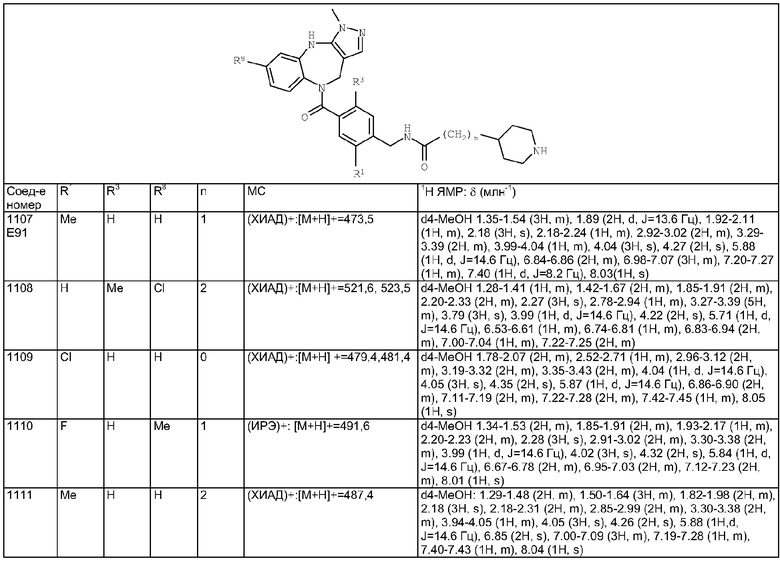
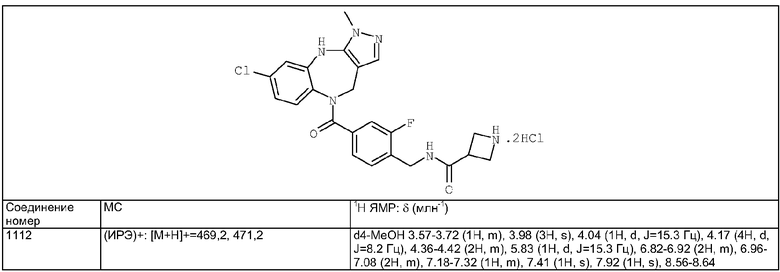
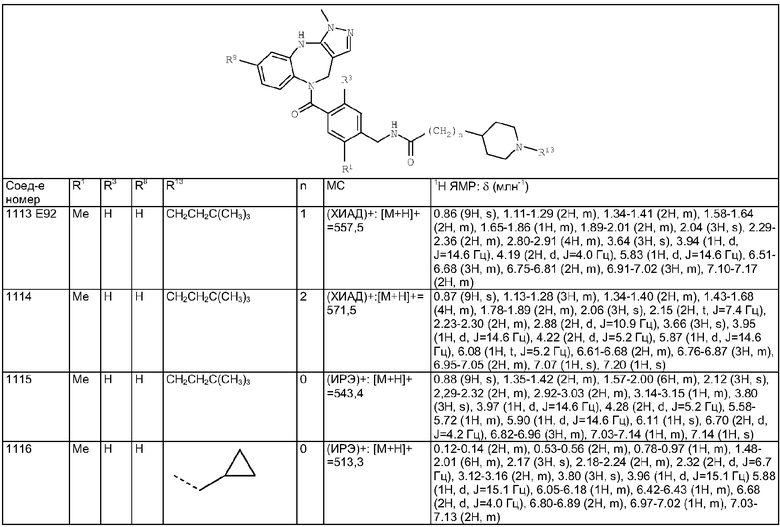
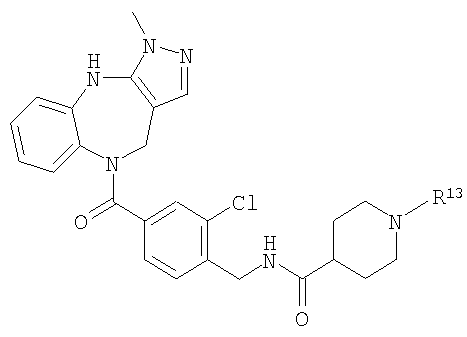
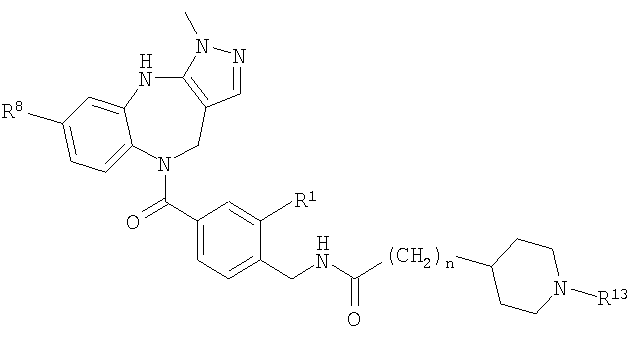













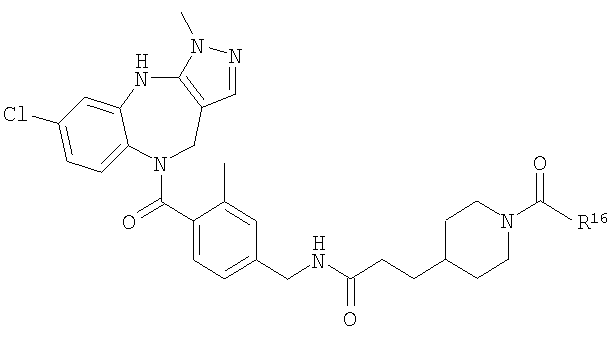
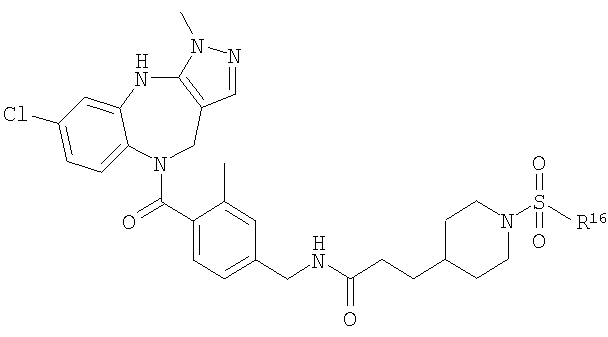
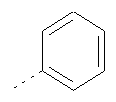
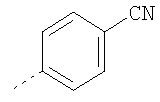
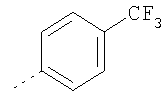
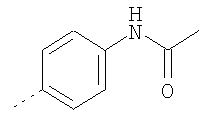
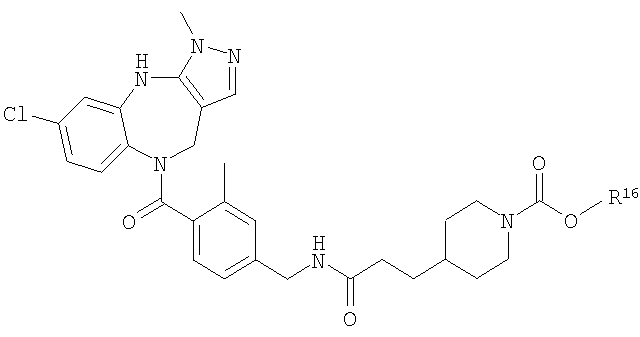



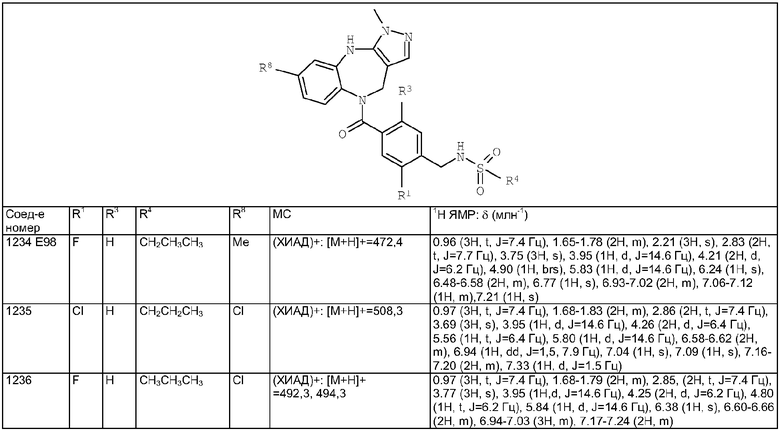
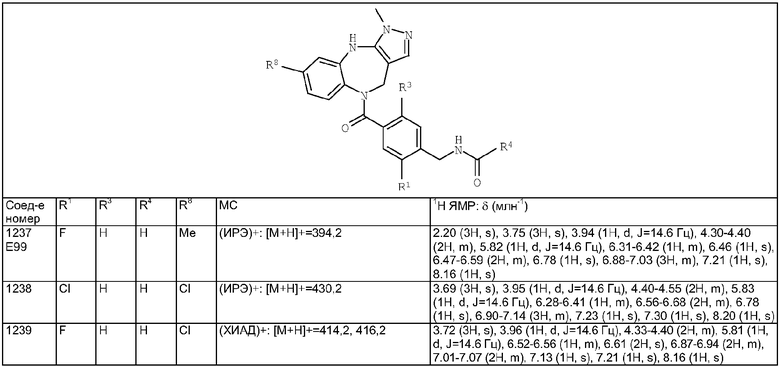
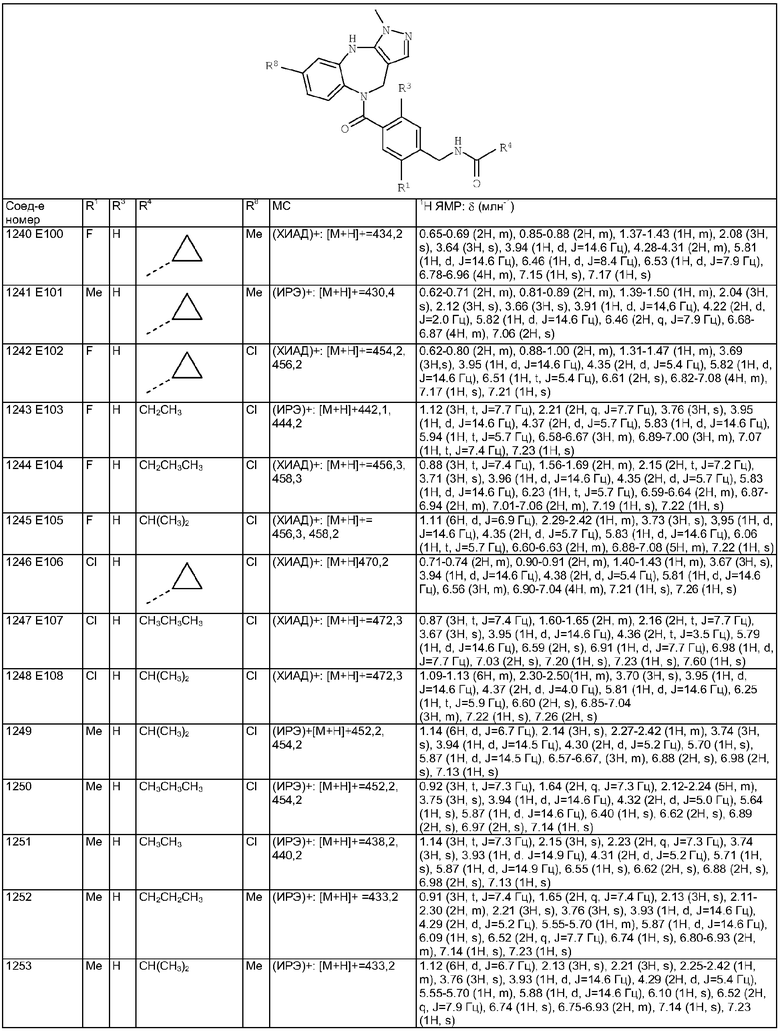
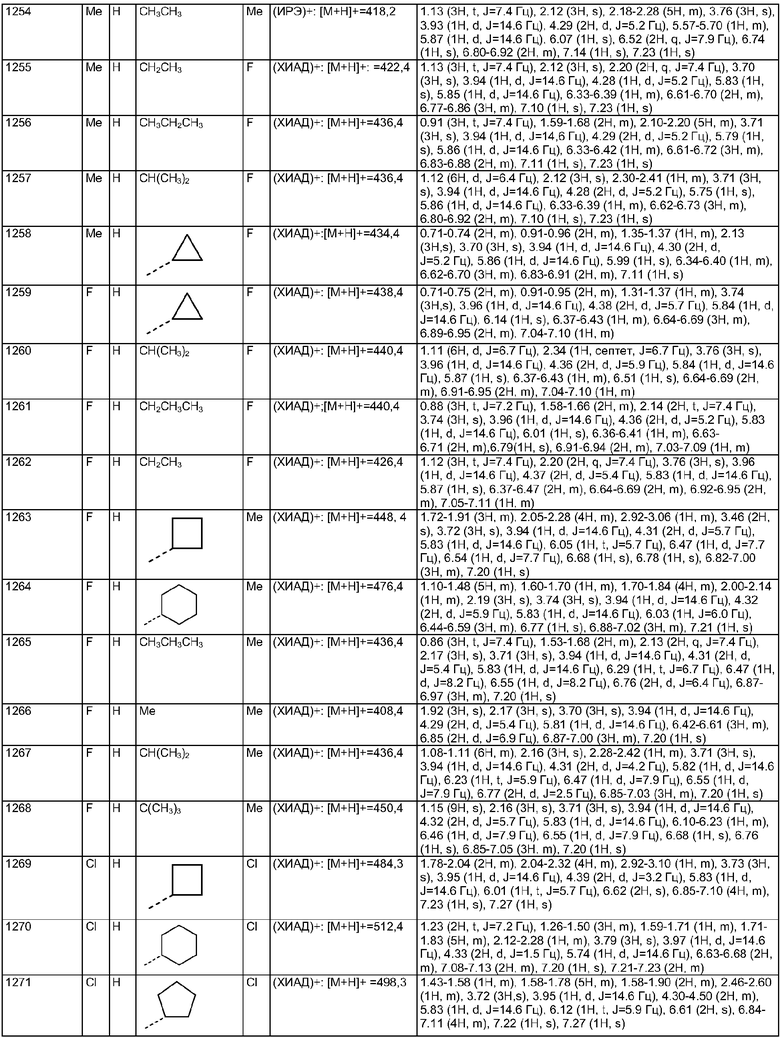
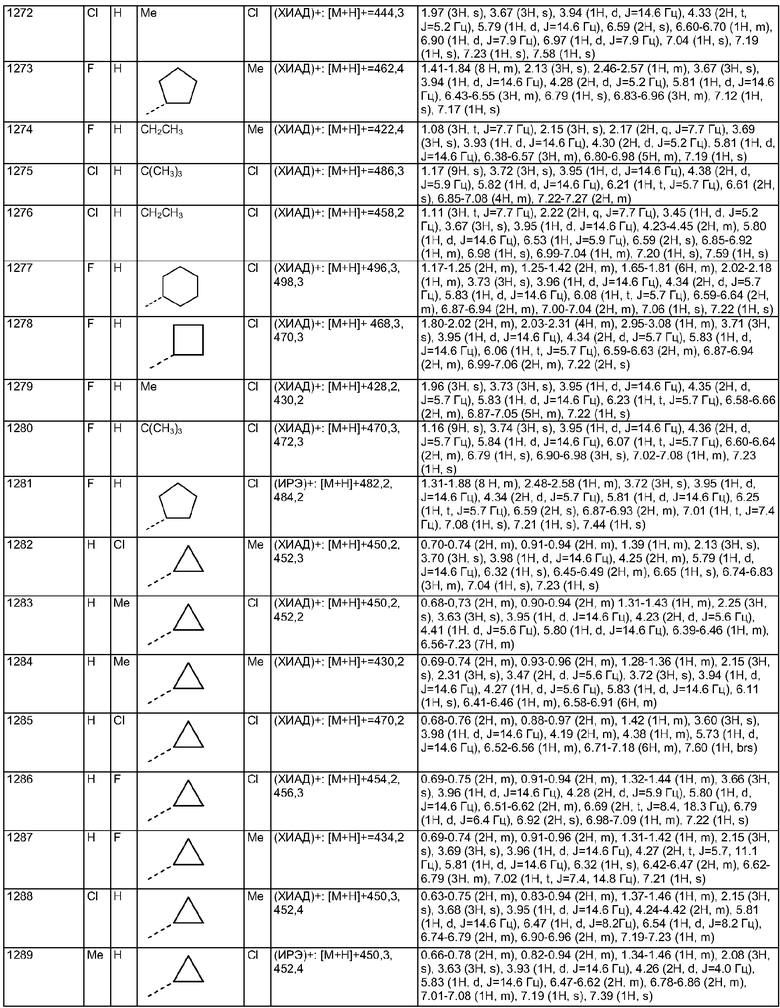
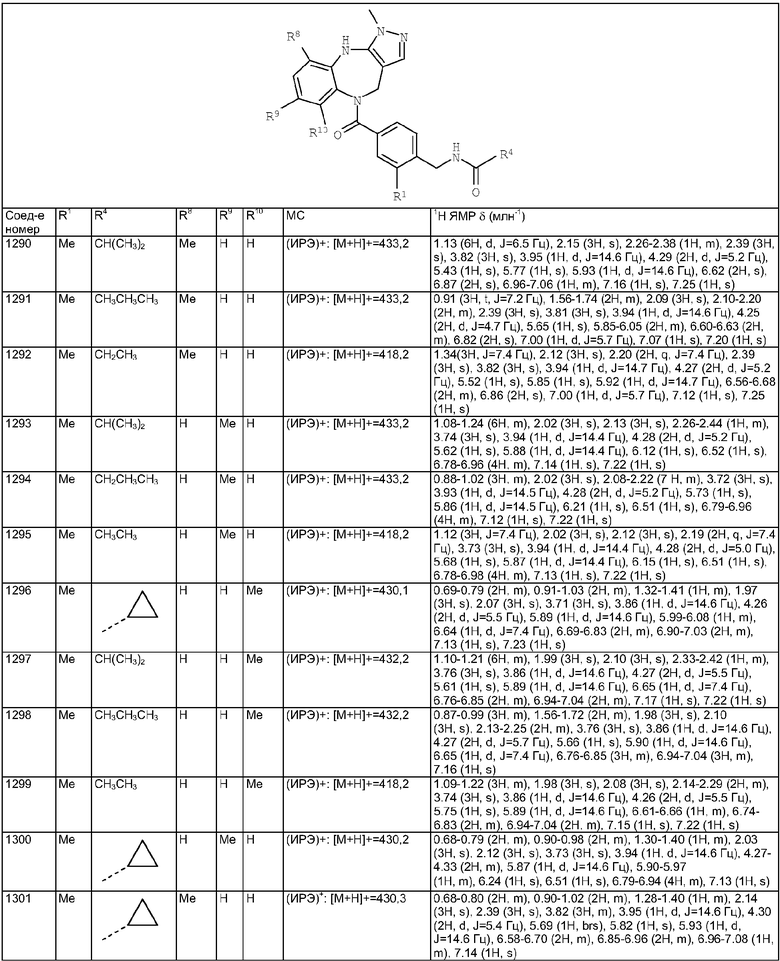
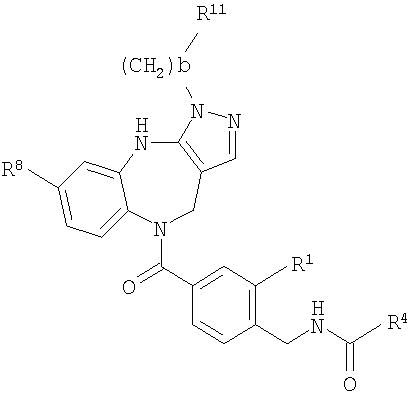




































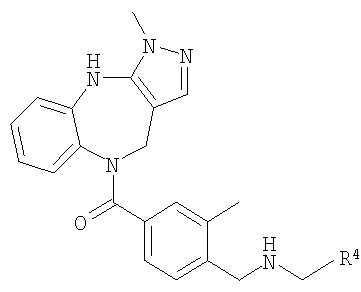

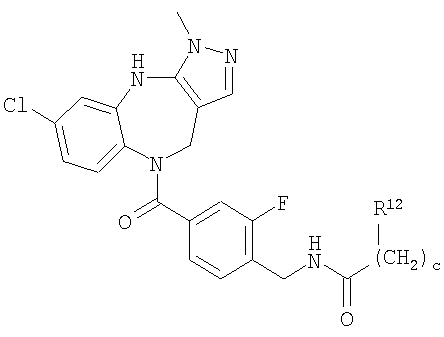
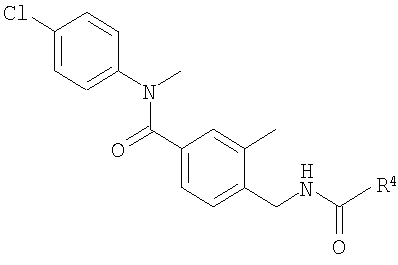

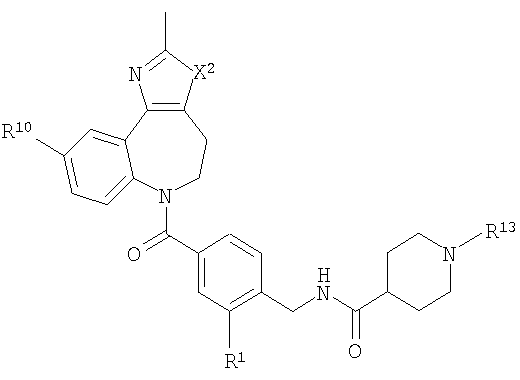
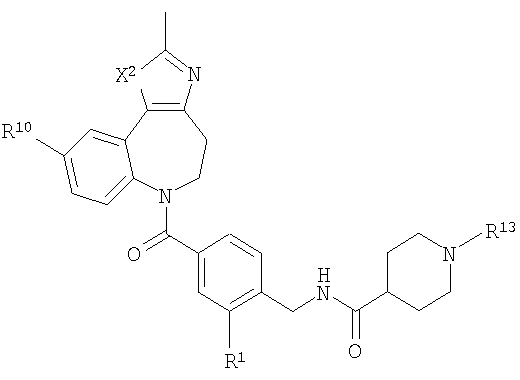



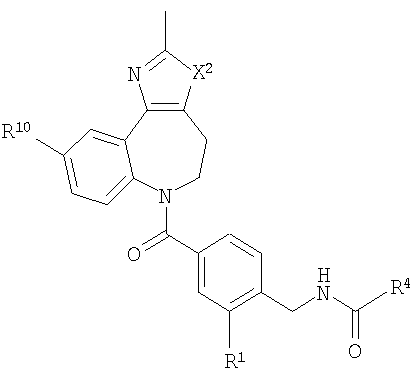


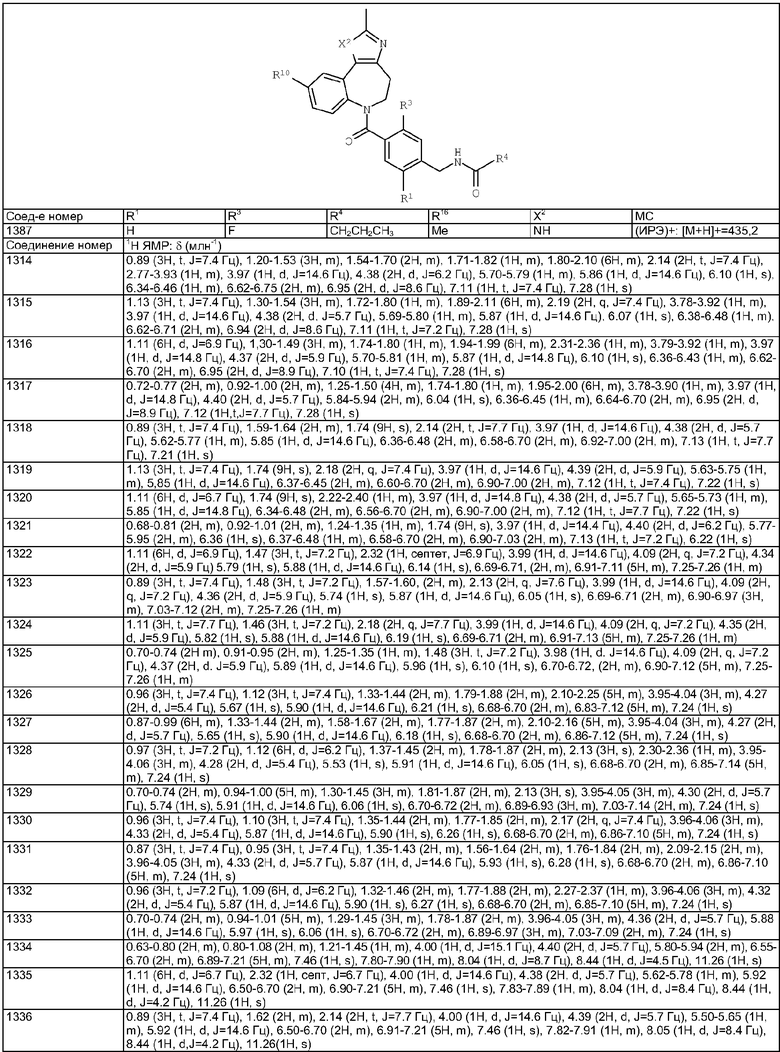






Данные по антагонистической активности соединений по изобретению в отношении рецепторов VIa, полученные в анализе из Примера А.
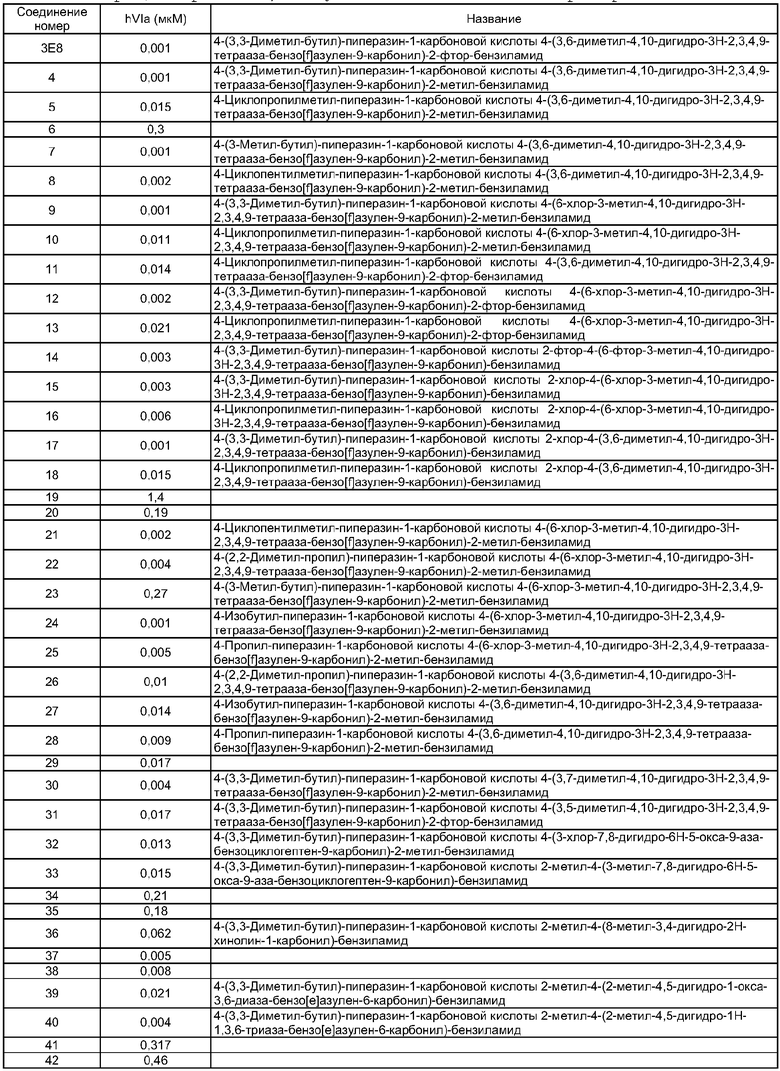
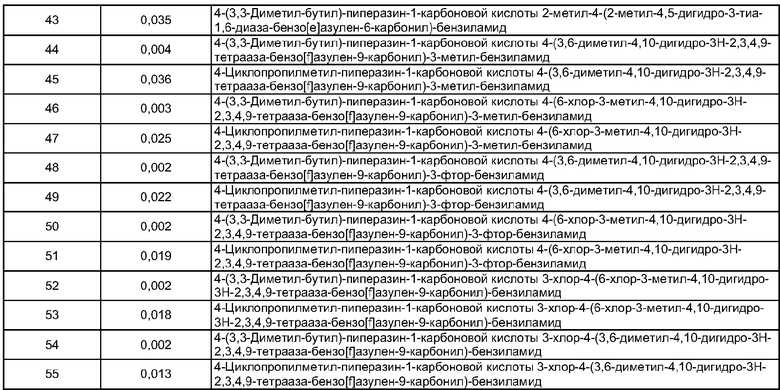
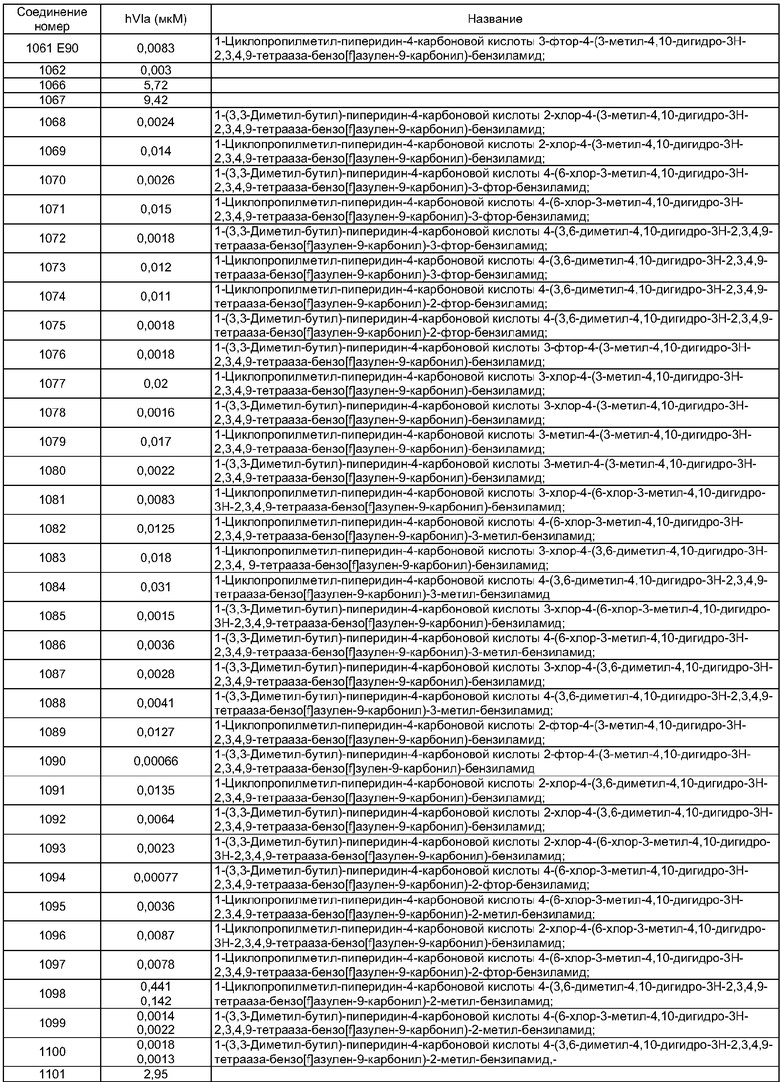
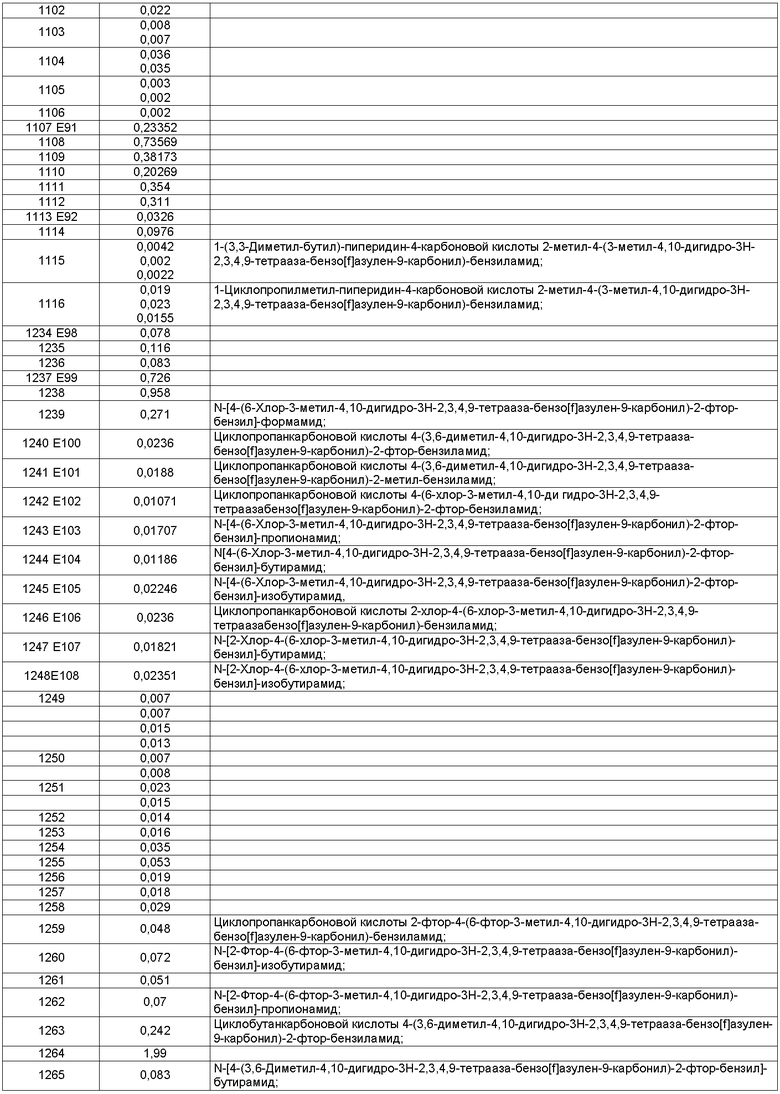
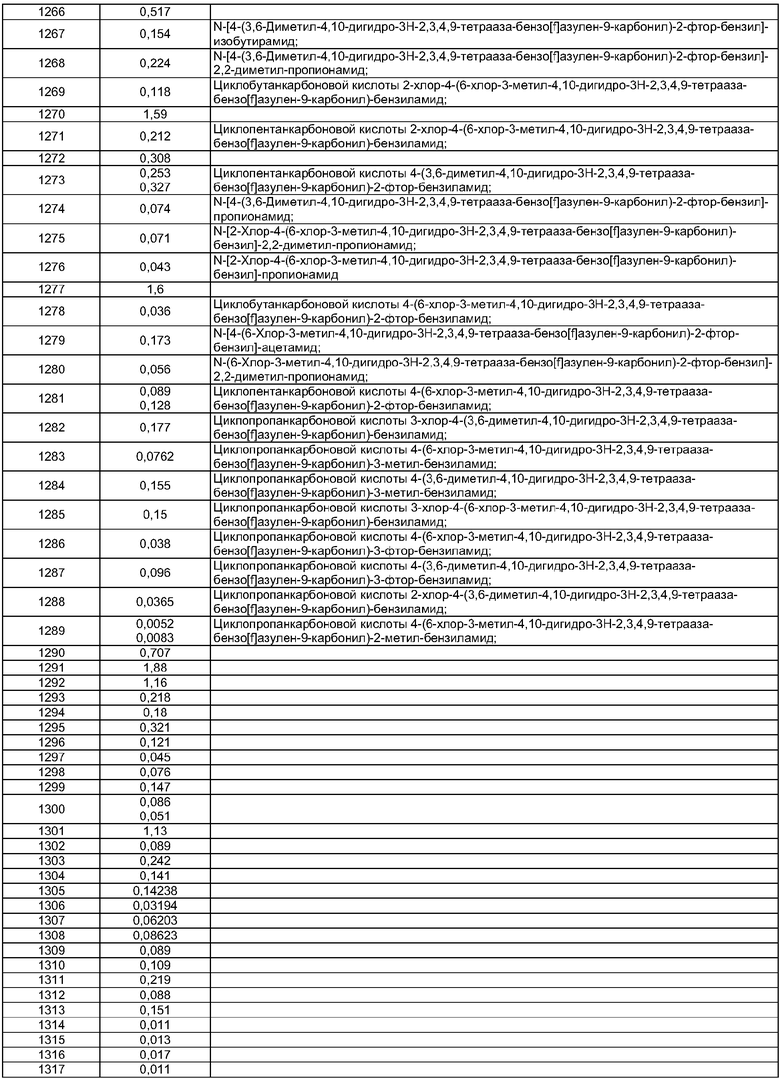
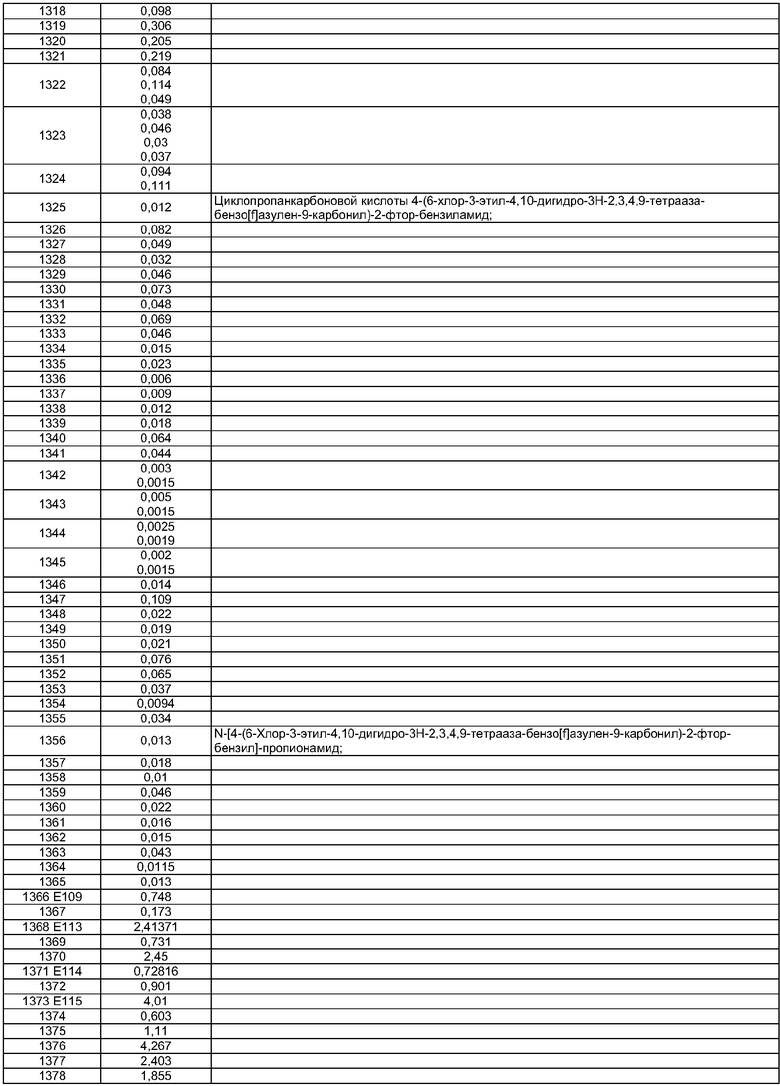
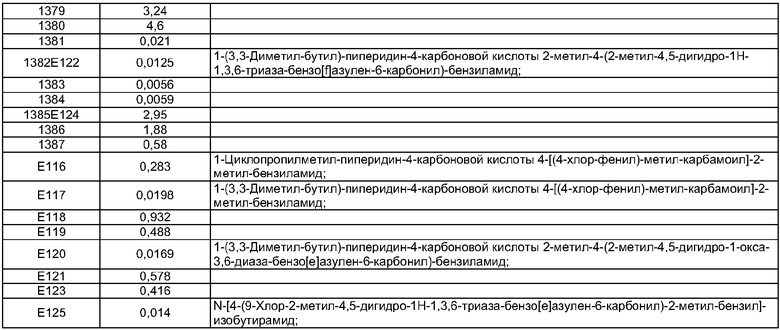
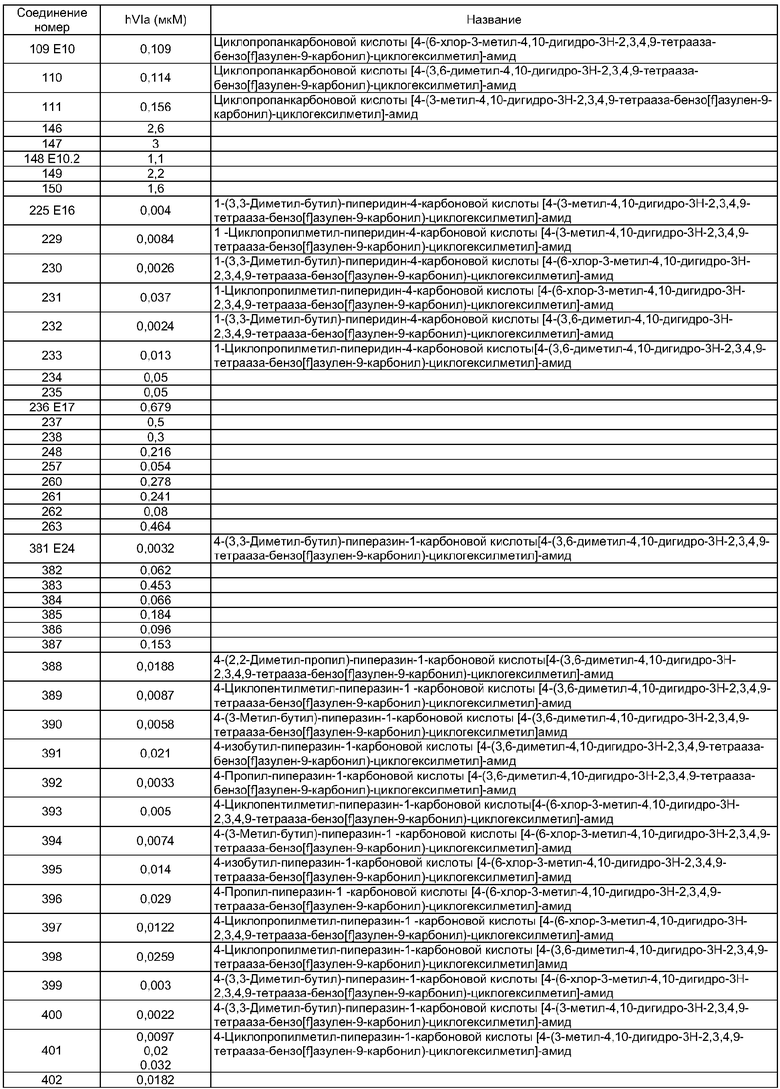

| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ ПИРАЗОЛОПИРИМИДИНА | 2007 |
|
RU2420530C2 |
| ПРОИЗВОДНЫЕ БЕНЗАМИДА В КАЧЕСТВЕ АГОНИСТОВ ОКСИТОЦИНА И АНТАГОНИСТОВ ВАЗОПРЕССИНА | 2004 |
|
RU2340617C2 |
| ПРОИЗВОДНОЕ ПИПЕРИДИНА | 2008 |
|
RU2475485C2 |
| БЕНЗОКСЕПИНОВЫЕ ИНГИБИТОРЫ PI3 И СПОСОБЫ ПРИМЕНЕНИЯ | 2010 |
|
RU2557658C2 |
| НОВОЕ ПРОИЗВОДНОЕ ЦИКЛИЧЕСКОГО ДИНУКЛЕОТИДА И ЕГО КОНЪЮГАТ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2019 |
|
RU2809547C2 |
| АМИНОПРОПИЛИДЕНОВОЕ ПРОИЗВОДНОЕ | 2009 |
|
RU2483063C2 |
| ИМИДАЗОПИРИМИДИНЫ КАК ИНГИБИТОРЫ EED И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2836176C2 |
| Бициклические гетероциклические соединения и их применения в терапии | 2012 |
|
RU2662827C2 |
| ЭТИНИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2016 |
|
RU2722014C2 |
| БЕНЗОКСАЗЕПИНОВЫЕ ИНГИБИТОРЫ PI3 И СПОСОБЫ ПРИМЕНЕНИЯ | 2010 |
|
RU2654068C1 |
Настоящее изобретение относится к новым соединениям формулы (1а), формулы (1b), формулы (1c) и формулы (1d), обладающим антагонистической активностью в отношении рецептора вазопрессина VIA, а также к фармацевтической композиции на их основе и к их применению для приготовления лекарственного средства.
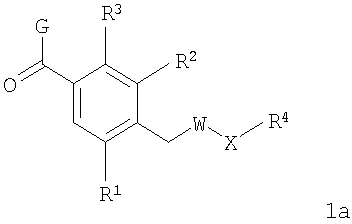
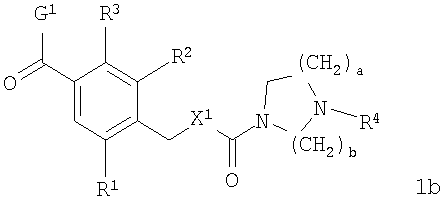
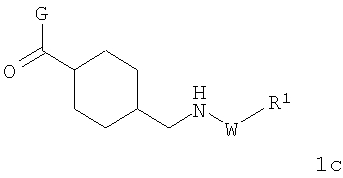
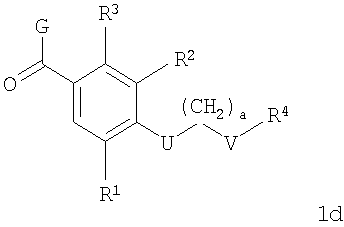
Значения R1-R4, G, W, X, X1, U, V, a, b приведены в формуле изобретения. 6 н. и 67 з.п. ф-лы.
1. Соединение общей формулы 1a или соединение, представляющее собой его таутомер или фармацевтически приемлемую соль

где G представляет собой группу, выбранную из общих формул 2а, 3а, 4а, 5а и 6а,
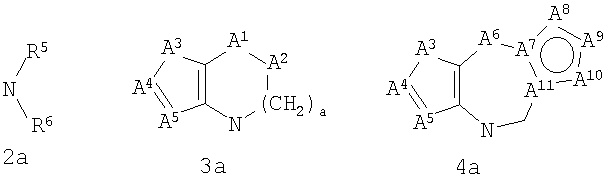
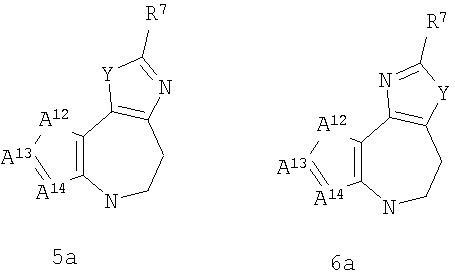
где А1 выбран из СН2, NH, О;
А2 выбран из СН2, С(=O);
А3 и А12 независимо выбраны из -C(R8)=CH- и -CH=C(R8)-;
А4 и А13 независимо выбраны из C(R9);
А5 и А14 независимо выбраны из C(R10);
А6 выбран из СН2, NH и О;
А7 и А11представляют собой С;
А8 и А9 независимо выбраны из СН, N, NH, N(CH2)bR11и S;
А10 выбран из -СН=СН-, СН, N, NH, N-(CH2)b-R11 и S;
где кольцо, образованное А7, А8, А9, А10 и А11, является ароматическим;
R1, R2 и R3 независимо выбраны из Н, C1-10алкила, F, Cl и Вr;
R4 выбран из Н, С1-10алкила, С3-8циклоалкила, возможно замещенного арила и возможно замещенного гетероарила, -(CH2)c-R12 и

R5 и R6 независимо выбраны из C1-10алкила, фенила,-(СH2)f-фенила, возможно замещенных Cl, Вr;
R7 выбран из С1-10алкила;
R8, R9 и R10 независимо выбраны из Н, С1-10алкила, С1-10алкокси, F, Cl, Вr;
при условиях, что когда G представляет собой 3а и R4 представляет собой Н, C1-10алкил, С3-8циклоалкил, арил, гетероарил или-(СН2)c-R12, то кольцо, содержащее
А3, А4 и А5, замещено, по меньшей мере, в одном положении C1-10алкилом, C1-10алкокси, F, Cl, Вr, и
когда G представляет собой 4а, R4 представляет собой Н, С1-10алкил, С3-8циклоалкил, арил, гетероарил или -(СН2)c-R12 и А8 представляет собой NH, NСН3 или S, то кольцо, содержащее А3, А4 и А5, замещено, по меньшей мере, в одном положении C1-10алкилом, C1-10алкокси, F, Cl, Вr;
R11 и R12 независимо выбраны из Н, C1-10алкила, С3-8циклоалкила, возможно замещенного арила, возможно замещенного гетероарила, NH2, NH-C1-10алкила, группы N(С1-10алкил)2, группы СО2-С1-10алкил;
причем в R4, R11 и R12 арил представляет собой фенил или нафтил, гетероарил представляет собой фурил, пиридил, тиенил, имидазолил, изоксазолил, бензофуразанил или триазолил, и арил и гетероарил в R4, R11 и R12 возможно замещены F, Cl, Вr, C1-10алкилом, CN, О-С1-10алкилом, O-СF3, СF3, СООСН3, NO2, NНСОСН3, фенилом, ОН;
R13 выбран из Н, C1-10алкила, С3-8алкенила, арила, гетероарила,-(CH2)h-R15 и Z-R16;
R15 независимо выбран из Н, С1-10алкила, С3-8циклоалкила, С2-6алкенила, циклического С3-8алкенила, арила, гетероарила, F, ОН, S-C1-10алкила, групп СO2-С1-10алкил, CO-C1-10алкил, СО-арил, CONH2, CONH-С1-10алкил, С2-6алкенил-СO2-C1-10алкил, С2-6алкениларил, CN и СF3;
R16 выбран из Н, C1-10алкила, С3-8циклоалкила, возможно замещенного C1-10алкилом, С2-6алкенила, арила, гетероарила, O-арила, циклопропиларила,
-(CH2)i-R17;
R17 выбран из Н, С1-10алкила, С3-8циклоалкила, возможно замещенного C1-10алкилом, арила, гетероарила, F, ОН, O-C1-10алкила, S-С1-10алкила, групп N(C1-10алкил)2, NН-СОС1-10алкил, СO2Н, СO2-C1-10алкил, CONH2, CN и СF3;
причем в R13, R15-R17 арил представляет собой фенил или нафтил, гетероарил представляет собой фурил, пиридил, тиенил или бензофуразанил, и арил и гетероарил в R13, R15-R17 возможно замещены F, Cl, Вr, С1-10алкилом, CN, O-С1-10алкилом, O-СF3, СF3, СООСН3, NO2, CH2OH, NНСОСН3, фенилом;
W выбран из О и NH;
Х выбран из (СН2)m, С(=O) и S(=O)j;
Y выбран из О, S, NH;
Z выбран из-С(=O), -С(=O)-O и -S(=O)k;
а выбран из 1 и 2;
b и с независимо выбраны из 0, 1, 2 и 3;
d, e и f независимо выбраны из 1 и 2;
h и i независимо выбраны из 1, 2 и 3;
j и k равны 2 и
m и n независимо выбраны из 0, 1 и 2.
2. Соединение по п.1, где G выбран из:

3. Соединение по п.1, где G выбран из:
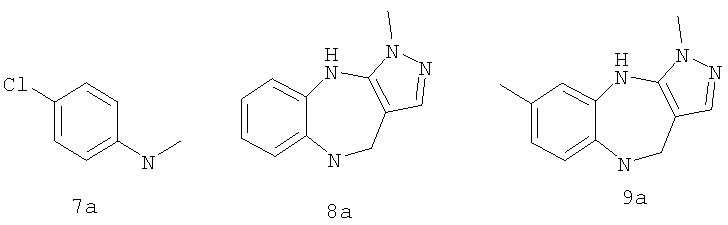
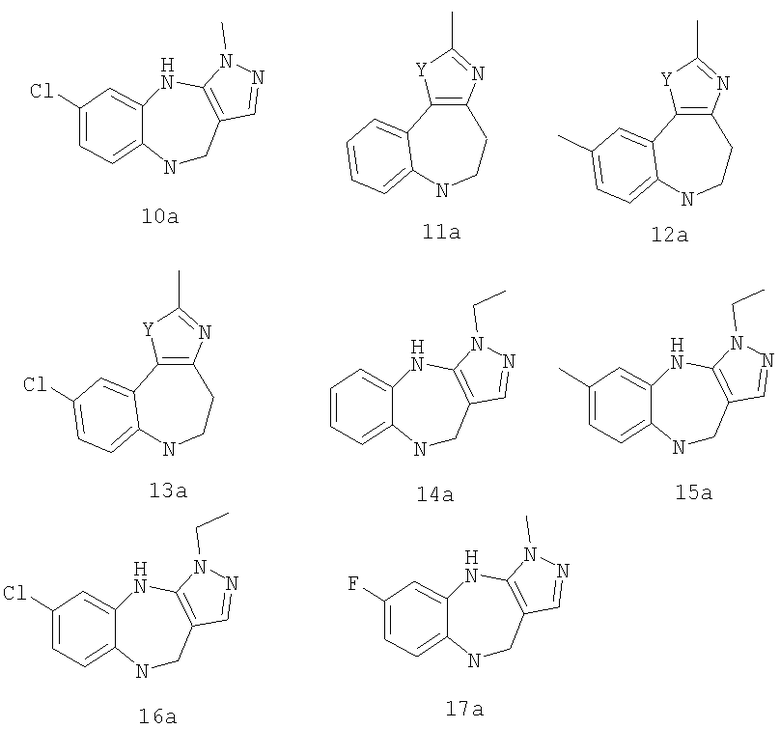
4. Соединение по п.1, где, по меньшей мере, один из R1, R2 и R3 является отличным от водорода; предпочтительно один из R1, R2 и R3 выбран из метила, хлора и фтора, а другие представляют собой водород.
5. Соединение по п.1, где W представляет собой NH.
6. Соединение по п.1, где R4 представляет собой C1-10алкил.
7. Соединение по п.1, где d представляет собой 2 и е представляет собой 2.
8. Соединение по п.1, где R13 представляет собой С1-10алкил.
9. Соединение по п.1, где n представляет собой 0.
10. Соединение по п.1, где R2 представляет собой Н, R4 представляет собой пиперидин, где d представляет собой 2 и е представляет собой 2, W представляет собой NH, Х представляет собой С(=O) и n представляет собой 0, как изображено в формуле 18а
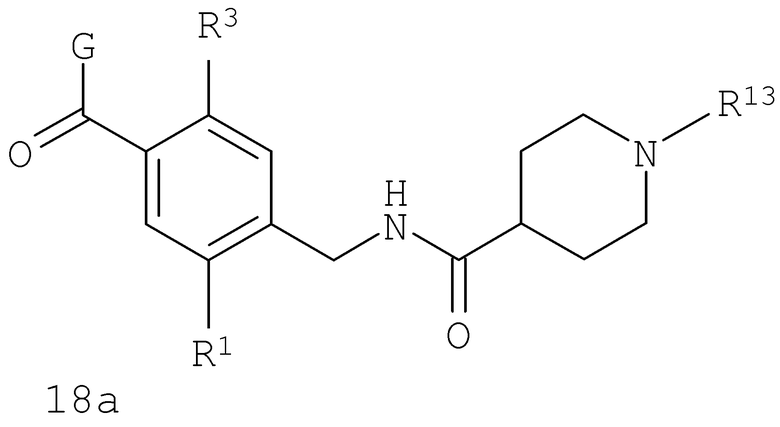
где R1 выбран из метила, хлора и фтора и R3 представляет собой Н или R1 представляет собой Н и R3 выбран из метила, хлора и фтора, а R13 представляет собой С1-10алкил.
11. Соединение по п.1, где Х представляет собой С(=O), n представляет собой 0 и R4 представляет собой пиперидин, где d представляет собой 2 и е представляет собой 2, как изображено в формуле 19а

где G выбран из общих формул 7а-17а и R13 представляет собой C1-10алкил.
12. Соединение по п.1, где R2 представляет собой Н и W представляет собой NH, как изображено в формуле 20а

где R1 выбран из метила, хлора и фтора и R3 представляет собой Н или R1 представляет собой Н и R3 выбран из метила, хлора и фтора; и G выбран из общих формул 7а-17а.
13. Соединение по п.1, где R2 представляет собой Н, W представляет собой NH и Х представляет собой С(=O), как изображено в формуле 21а

где R1 выбран из метила, хлора и фтора и R3 представляет собой Н или R1 представляет собой Н и R3 выбран из метила, хлора и фтора; и R4 представляет собой С1-10алкил.
14. Соединение по п.1, где Х представляет собой С(=O), как изображено в формуле 22а
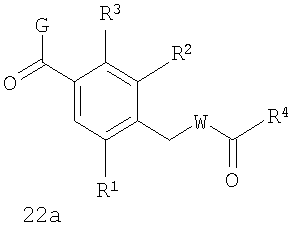
где G выбран из общих формул 7а-17а и R4 представляет собой C1-10алкил.
15. Соединение по п.1, где R2 и R3 оба представляют собой Н, W представляет собой NH и Х представляет собой С(=O), как изображено в формуле 23а

где G выбран из общих формул 9а, 10а, 15а, 16а и 17а, R1 выбран из метила, хлора и фтора и R4 представляет собой С1-10алкил.
16. Соединение по п.1, где R2 и R3 оба представляют собой Н, R4 представляет собой пиперидин, где d представляет собой 2 и е представляет собой 2, W представляет собой NH, Х представляет собой С(=O) и n представляет собой 0, как изображено в формуле 24а

где G выбран из общих формул 9а, 10а, 15а, 16а и 17а, R1 выбран из метила, хлора и фтора и R13 представляет собой C1-10алкил.
17. Соединение по п.1, выбранное из группы, состоящей из:
2-Хлор-4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
2-Хлор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо-[f]азулен-9-карбонил)бензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
2-Фтор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
2-Метил-4-(2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)бензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
2-Метил-4-(2-метил-4,5-дигидро-1-окса-3,6-диазабензо[е]азулен-6-карбонил)бензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
3-Хлор-4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
3-Хлор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
3-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]-азулен-9-карбонил)бензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
3-Фтор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
3-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
4-(3,6-Димeтил-4,10-дигидpo-3H-2,3,4,9-тeтpaaзaбeнзo[f]aзyлeн-9-карбонил)-2-метилбензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-метилбензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-фторбензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-метилбензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-фторбензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
4-[(4-Хлорфенил)метилкарбамоил]-2-метилбензиламида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
2-Хлор-4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
2-Хлор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]-азулен-9-карбонил)бензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
2-Фтор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
2-Meтил-4-(3-мeтил-4,10-дигидpo-3H-2,3,4,9-тeтpaaзaбeнзo[f]aзyлeн-9-карбонил)бензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
3-Хлор-4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
3-Хлор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
3-Xлop-4-(6-xлop-3-мeтил-4,10-дигидpo-3H-2,3,4,9-тeтpaaзaбeнзo[f]-азулен-9-карбонил)бензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
3-Фтор-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
3-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-метилбензиламид 1-циклопропилметилпиперидин-4-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-фторбензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-метилбензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-фторбензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
4-[(4-Хлорфенил)метилкарбамоил]-2-метилбензиламида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида циклобутанкарбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламида циклобутанкарбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламида циклобутанкарбоновой кислоты;
2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида циклопентанкарбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламида циклопентанкарбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламида циклопентанкарбоновой кислоты;
2-Хлор-4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида циклопропанкарбоновой кислоты;
2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида циклопропанкарбоновой кислоты;
3-Хлор-4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида циклопропанкарбоновой кислоты;
3-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо [f]-азулен-9-карбонил)бензиламида циклопропанкарбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида циклопропанкарбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламида циклопропанкарбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-фторбензиламида циклопропанкарбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-метилбензиламида циклопропанкарбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида циклопропанкарбоновой кислоты;
4-(6-Xлop-3-мeтил-4,10-дигидpo-3H-2,3,4,9-тeтpaaзaбeнзo[f]aзулeн-9-карбонил)-3-фторбензиламида циклопропанкарбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо [f]азулен-9-карбонил)-2-фторбензиламида циклопропанкарбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-метилбензиламида циклопропанкарбоновой кислоты;
N-[2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензил]пропионамида;
N-[2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензил]-2,2-диметилпропионамида;
N-[2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензил]изобутирамида;
N-[2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензил]бутирамида;
N-[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]пропионамида;
N-[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]-2,2-диметилпропионамида;
N-[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]изобутирамида;
N-[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]бутирамида;
N-[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]пропионамида;
N-[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]-2,2-диметилпропионамида;
N-[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]изобутирамида;
N-[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]ацетамида;
N-[4-(6-Xлop-3-мeтил-4,10-дигидpo-3H-2,3,4,9-тeтpaaзaбeнзo[f]aзyлeн-9-карбонил)-2-фторбензил]бутирамида;
N-[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]формамида;
N-[4-(6-Хлор-3-этил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензил]пропионамида;
4-(6-Хлор-3-этил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламида циклопропанкарбоновой кислоты;
N-[2-Фтор-4-(6-фтор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензил]пропионамида;
N-[2-Фтор-4-(6-фтор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензил]изобутирамида;
2-Фтор-4-(6-фтор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида циклопропанкарбоновой кислоты и
N-[4-(9-Хлор-2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)-2-метилбензил]изобутирамида.
18. Соединение общей формулы 1b или соединение, представляющее собой его таутомер или фармацевтически приемлемую соль
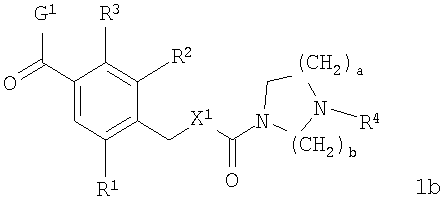
где G1представляет собой бициклическое или трициклическое конденсированное пиперидиновое или азепиновое производное, выбранное из общих формул 2b, 3b, 4b и 5b
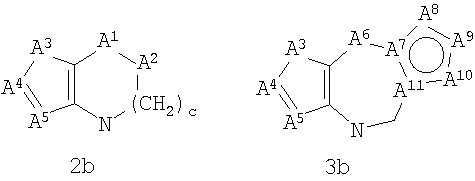
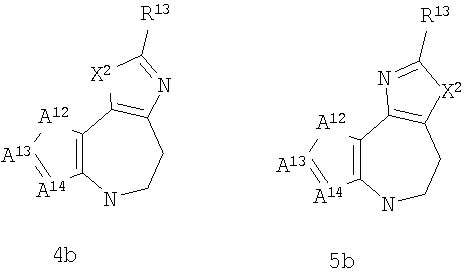
А1 выбран из СН2, NH и O;
А2 выбран из СН2, С(=O);
А3 выбран из -C(R7)=CH- и -CH=C(R7)-;
А4 выбран из C(R8);
А5 выбран из C(R9);
А6 выбран из СН2, NH и О;
А7 и А11 представляют собой С;
А8 и А9 независимо выбраны из СН, N, N(СН2)dR5;
А10 выбран из -СН=СН-, СН, N, N-(СН2)d-R5;
А12 выбран из -С(R10)=CH- и -CH=C(R10)-;
А13 выбран из C(R11);
А14 выбран из C(R12);
X1 выбран из О и NH;
X2 выбран из О, S, NH;
R1, R2 и R3 независимо выбраны из Н, С1-10алкила, F, Cl и Вr;
R4 выбран из Н, С1-10алкила, -(CH2)e-R6 и Y-R15;
R13 и R15 независимо выбраны из С1-10алкила, арила, гетероарила и -(СН2)f-R14;
R5, R6 и R14 независимо выбраны из Н, С1-10алкила, С3-8циклоалкила, арила, гетероарила, F, ОН, СO2Н, СО2-С1-10алкила, CONH2, CN;
R7, R8 и R9 независимо выбраны из Н, С1-10алкила, С1-10алкокси, F, Cl, Вr;
R10, R11 и R12 независимо выбраны из Н, С1-10алкила, С1-10алкокси, F, Cl, Вr;
причем в R5, R6 и R13-R15 арил представляет собой фенил или нафтил, гетероарил представляет собой фурил, пиридил, тиенил или бензофуразанил, и арил и гетероарил в R5, R6 и R13-R15 возможно замещены F, Cl, Вr, С1-10алкилом, CN, O-С1-10алкилом, O-СF3, СF3, СООСН3, NO2, СН2ОН, NНСОСН3, фенилом;
Y выбран из С=O и S(=O)g;
а выбран из 1 и 2;
b выбран из 1, 2 и 3;
с выбран из 1 и 2;
d выбран из 0, 1, 2 и 3;
е выбран из 1, 2 и 3;
f выбран из 1, 2 и 3;
g равен 2; и
при условии, что кольцо, содержащее А3, А4 и А5 в соответствии с общими формулами 2b и 3b, замещено, по меньшей мере, в одном положении C1-10алкилом, C1-10алкокси, F, Cl, Вr;
и при условии, что кольцо, образованное А7, А8, А9, А10 и А11, является ароматическим.
19. Соединение по п.18, где G1 выбран из:
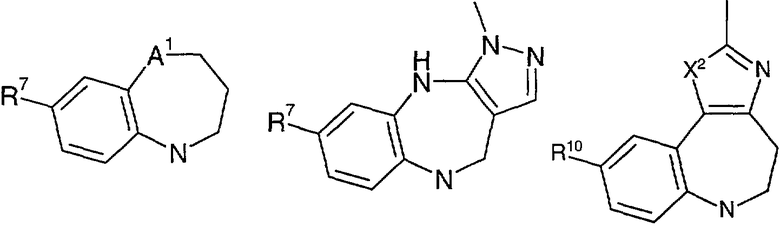
20. Соединение по п.19, где G1 выбран из общих формул 6b, 7b, 8b, 9b, 10b, 11b, 12b, 13b, 14b, 15b, 16b и 17b:
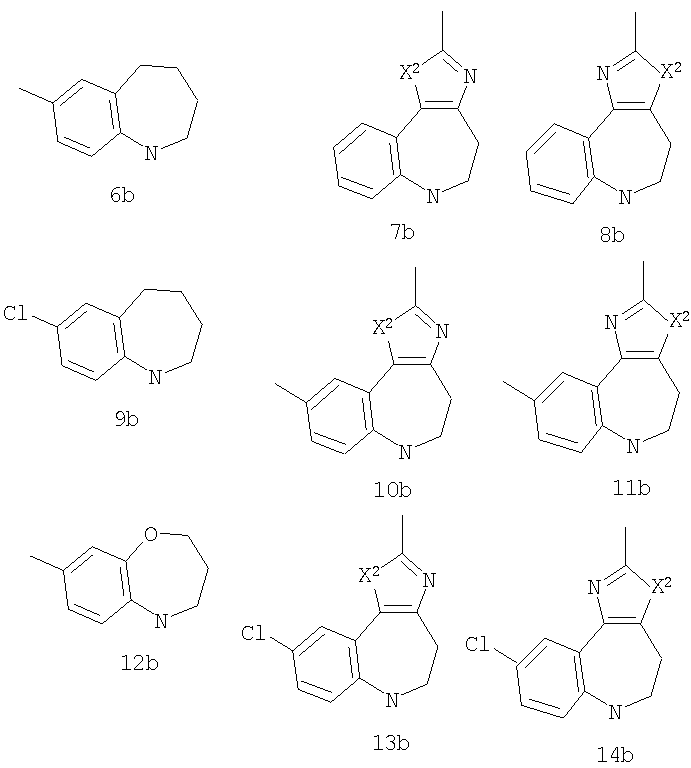
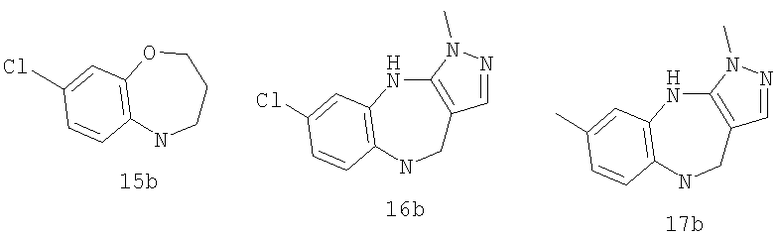
21. Соединение по любому из пп.18, 19 или 20, где, по меньшей мере, один из R1, R2 и R3 является отличным от водорода.
22. Соединение по п.21, где один из R1, R2 и R3 выбран из метила, хлора и фтора, а другие представляют собой водород.
23. Соединение по любому из пп.18-20, где X1 представляет собой NH.
24. Соединение по любому из пп.18-20, где а представляет собой 1 и b представляет собой 2.
25. Соединение по любому из пп.18-20, где R4 представляет собой C1-10алкил.
26. Соединение по п.18, имеющее общую формулу 18b, где R1 выбран из метила, хлора и фтора и R4 представляет собой С1-10алкил
27. Соединение по п.20, имеющее общую формулу 19b, где R1 выбран из метила, хлора и фтора:
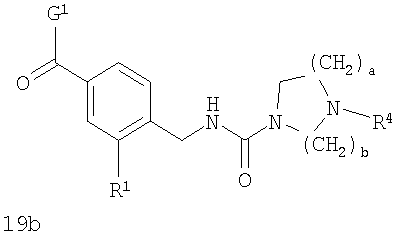
28. Соединение по п.20, имеющее общую формулу 20b, где R4 представляет собой C1-10алкил:
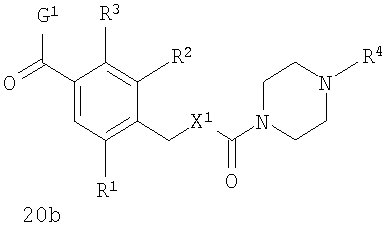
29. Соединение по п.20, имеющее общую формулу 21b, где R1 выбран из метила, хлора и фтора; и R4 представляет собой C1-10алкил:
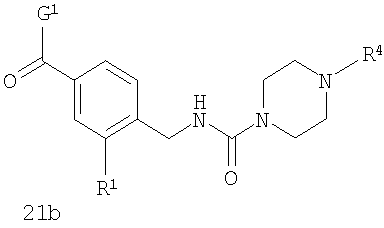
30. Соединение по п.18, выбранное из
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-(2,2-диметилпропил)пиперазин-1-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-(2,2-диметилпропил)пиперазин-1-карбоновой кислоты;
2-Хлор-4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]-азулен-9-карбонил)бензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
2-Метил-4-(2-метил-4,5-дигидро-1H-1,3,6-триазабензо[е]азулен-6-карбонил)бензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
2-Метил-4-(2-метил-4,5-дигидро-1-окса-3,6-диазабензо[е]азулен-6-карбонил)бензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
2-Метил-4-(3-метил-7,8-дигидро-6H-5-окса-9-азабензоциклогептен-9-карбонил)бензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
2-Метил-4-(8-метил-3,4-дигидро-2H-хинолин-1-карбонил)бензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
3-Хлор-4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
3-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]-азулен-9-карбонил)бензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-фторбензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
4-(3,6-Димeтил-4,10-дигидpo-3H-2,3,4,9-тeтpaaзaбeнзo[f]aзyлeн-9-карбонил)-3-метилбензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
4-(3-Xлop-7,8-дигидpo-6H-5-oкca-9-aзaбeнзoциклoгeптeн-9-кapбoнил)-2-метилбензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-фторбензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-метилбензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-(3-метилбутил)пиперазин-1-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-(3-метилбутил)пиперазин-1-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-циклопентилметилпиперазин-1-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-циклопентилметилпиперазин-1-карбоновой кислоты;
2-Хлор-4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 4-циклопропилметилпиперазин-1-карбоновой кислоты;
2-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 4-циклопропилметилпиперазин-1-карбоновой кислоты;
3-Хлор-4-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)бензиламида 4-циклопропилметилпиперазин-1-карбоновой кислоты;
3-Хлор-4-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]-азулен-9-карбонил)бензиламида 4-циклопропилметил-пиперазин-1-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламида 4-циклопропилметилпиперазин-1-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-циклопропилметилпиперазин-1-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-фторбензиламида 4-циклопропилметилпиперазин-1-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-метилбензиламида 4-циклопропилметилпиперазин-1-карбоновой кислоты;
4-(6-Xлop-3-мeтил-4,10-дигидpo-3H-2,3,4,9-тeтpaaзaбeнзo[f]aзулeн-9-карбонил)-2-фторбензиламида 4-циклопропилметилпиперазин-1-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-циклопропилметилпиперазин-1-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-фторбензиламида 4-циклопропилметилпиперазин-1-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-3-метилбензиламида 4-циклопропилметилпиперазин-1-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-изобутилпиперазин-1-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-изобутилпиперазин-1-карбоновой кислоты;
4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-пропилпиперазин-1-карбоновой кислоты;
4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-пропилпиперазин-1-карбоновой кислоты;
2-Метил-4-(2-метил-4,5-дигидро-3-тиа-1,6-диазабензо[е]азулен-6-карбонил)бензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
2-Фтор-4-(6-фтор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]-азулен-9-карбонил)бензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
4-(3,7-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-метилбензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты; и
4-(3,5-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)-2-фторбензиламида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты.
31. Соединение общей формулы 1с или соединение, представляющее собой его таутомер или фармацевтически приемлемую соль
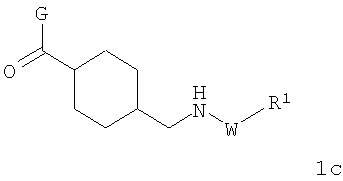
где G представляет собой группу, выбранную из общих формул 2с, 3с, 4с и 5с,
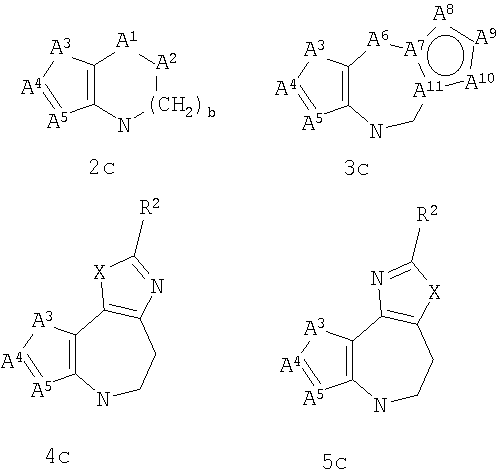
А1 выбран из СН2, NH, О;
А2 выбран из СН2, С(=О);
А3 выбран из -С(R3)=СН- и -CH=C(R3)-;
А4 выбран из C(R4);
А5 выбран из C(R5);
А6 выбран из СН2, NH и О;
А7 и А11 представляют собой С;
А8 и А9 независимо выбраны из СН, N, NH, N(CH2)c-R6;
А10 выбран из -СН=СН-, СН, N, NH, N-(CH2)c-R6;
где кольцо, образованное А7, А8, А9, А10 и А11, является ароматическим; и
R1 выбран из Н, C1-10алкила, С3-8циклоалкила, возможно замещенного C1-10алкилом, С2-6алкенила, циклического С3-8алкенила, C1-10алкиларила, С2-6алкениларила, С3-8циклоалкиларила, арила, гетероарила, -(CH2)d-R7,
 и
и 
R2 выбран из C1-10алкила;
R3, R4 и R5 независимо выбраны из Н, С1-10алкила, С1-10алкокси, F, Cl, Вr;
R6 и R7 независимо выбраны из Н, C1-10алкила, арила, гетероарила, F, ОН, O-C1-10алкила, O-арила, O-C1-10алкиларила, NH2, NH-C1-10алкила, группы N(C1-10алкил)2, СO2-С1-10алкила, CONH2, CN и СF3;
причем в R1, R6 и R7 арил представляет собой фенил или нафтил, гетероарил представляет собой фурил, пиридил, тиенил, имидазолил, изоксазолил, бензофуразанил или триазолил, и арил и гетероарил в R1, R6 и R7 возможно замещены F, Cl, Вr, C1-10алкилом, CN, группой O-C1-10алкил, O-СF3, СF3, СООСН3, NO2, NHCOCH3, фенилом, ОН;
R8 и R9 независимо выбраны из Н, С1-10алкила, С3-8алкенила, арила, гетероарила, -(CH2)k-R11 и Y-R12;
R11 независимо выбран из Н, C1-10алкила, С3-8циклоалкила, С2-6алкенила, циклического С3-8алкенила, арила, гетероарила, F, ОН, О-С1-10алкила, S-C1-10алкила, группы N(C1-10алкил)2, СО-С1-10алкила, СО-арила, СО2-С1-10алкила, CONH2, СОNН-С1-10алкила, С2-6алкенил-СO2-С1-10алкила, С2-6алкениларила, CN и СF3;
R12 выбран из Н, С1-10алкила, С3-8циклоалкила, возможно замещенного C1-10алкилом, С2-6алкенила, циклопропиларила, арила, гетероарила и (CH2)1-R13;
R13 выбран из Н, C1-10алкила, С3-8циклоалкила, арила, гетероарила, F, ОН, О-С1-10алкила, S-C1-10алкила, NH-COC1-10алкила, СО2Н, СO2-C1-10алкила;
причем в R8, R9 и R11-R13 арил представляет собой фенил или нафтил, гетероарил представляет собой фурил, пиридил, тиенил или бензофуразанил, и арил и гетероарил в R8, R9 и R11-R13 возможно замещены F, Сl, Вr, С1-10алкилом, CN, группой О-С1-10алкил, O-СF3, СF3, СООСН3, NO2, СН2ОН, NНСОСН3, фенилом;
W выбран из СН2, С(=O), С(=O)-O и S(=O)m;
Х выбран из О, S, NH;
Y выбран из С(=O), С(=O)-O и -S(=O)n;
b выбран из 1 и 2;
c и d независимо выбраны из 0, 1, 2 и 3;
е выбран из 0, 1 и 2;
f, g, h и i независимо выбраны из 1 и 2;
k и l независимо выбраны из 1, 2 и 3;
m и n независимо выбраны из 1 и 2.
32. Соединение по п.31, где G выбран из:
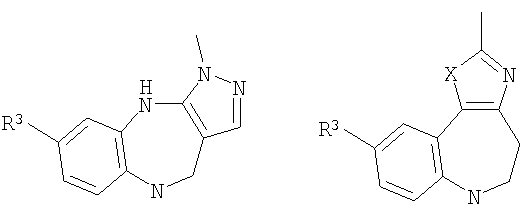
33. Соединение по п.31, где G выбран из:
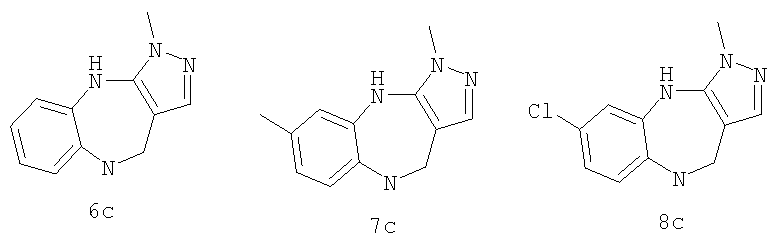
34. Соединение по п.31, где R8 представляет собой С1-10алкил.
35. Соединение по п.31, где R9 представляет собой С1-10алкил.
36. Соединение по п.31, где R1 выбран из:

37. Соединение по п.36, где R1 выбран из:
38. Соединение по п.31, где W представляет собой С(=O).
39. Соединение по п.31, как изображено в формуле 18с:
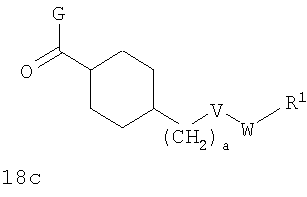
где G выбран из общих формул 6с-11с и R1 выбран из общих формул 12с-15с; предпочтительно R1 выбран из 14с и 15с.
40. Соединение по п.39, где V представляет собой NH.
41. Соединение по п.39, где а представляет собой 1.
42. Соединение по п.39, где V представляет собой NH, W представляет собой С(=O), и а представляет собой 1; как изображено в формуле 16с
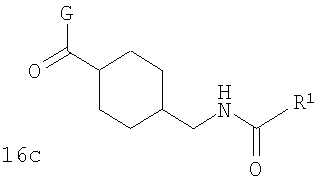
где R1 выбран из общих формул 12с-15с, предпочтительно R1 выбран из 14с и 15с.
43. Соединение по п.39, где V представляет собой NH, W представляет собой С(=O) и а представляет собой 1, как изображено в формуле 17с
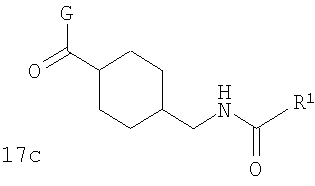
где G выбран из общих формул 6с-11с.
44. Соединение по п.39, как изображено в формуле 19с, где V представляет собой NH, W представляет собой С(=O) и а представляет собой 1:
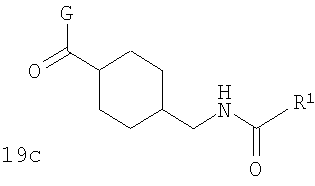
и где G выбран из общих формул 6с-11с и R1 выбран из общих формул 12с-15с; предпочтительно R1 выбран из 14с и 15с.
45. Соединение по п.31, выбранное из группы, состоящей из:
[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
[4-(3-Метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 1-(3,3-диметилбутил)пиперидин-4-карбоновой кислоты;
[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
[4-(3-Метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
[4-(6-Хлор-3-метил-4,10-дигидpo-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 1-циклопропилметилпиперидин-4-карбоновой кислоты;
[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 4-(2,2-диметилпропил)пиперазин-1-карбоновой кислоты;
[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
[4-(3-Метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 4-(3,3-диметилбутил)пиперазин-1-карбоновой кислоты;
[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 4-(3-метилбутил)пиперазин-1-карбоновой кислоты;
[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо [f] азулен-9-карбонил)циклогексилметил]амида 4-(3-метилбутил)пиперазин-1-карбоновой кислоты;
[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 4-циклопентилметилпиперазин-1-карбоновой кислоты;
[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 4-циклопентилметилпиперазин-1-карбоновой кислоты;
[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 4-циклопропилметилпиперазин-1-карбоновой кислоты;
[4-(3-Метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 4-циклопропилметилпиперазин-1-карбоновой кислоты;
[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 4-циклопропилметилпиперазин-1-карбоновой кислоты;
[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 4-изобутилпиперазин-1-карбоновой кислоты;
[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 4-изобутилпиперазин-1-карбоновой кислоты;
[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 4-пропилпиперазин-1-карбоновой кислоты;
[4-(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида 4-пропилпиперазин-1-карбоновой кислоты;
[4-(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида циклопропанкарбоновой кислоты;
[4-(3-Метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида циклопропанкарбоновой кислоты; и
[4-(6-Хлор-3-метил-4,10-дигидро-3Н-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)циклогексилметил]амида циклопропанкарбоновой кислоты.
46. Соединение общей формулы 1d или соединение, представляющее собой его таутомер или фармацевтически приемлемую соль
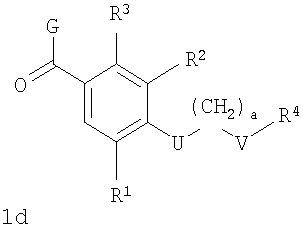
где G представляет собой группу, выбранную из общих формул 2d, 3d, 4d, 5d и 6d
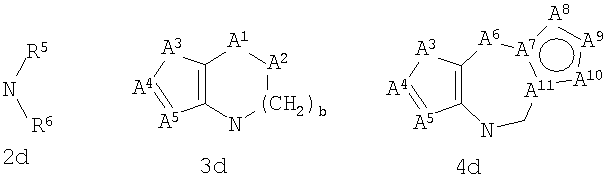
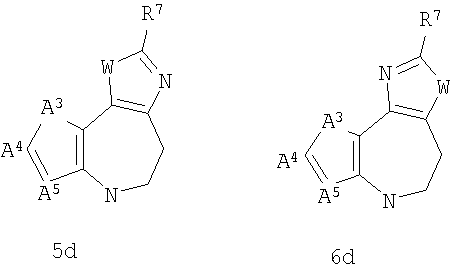
где А1 выбран из СН2, NH, О;
А2 выбран из CH2, С(=O);
А3 выбран из -C(R8)=CH- и -CH=C(R8)-;
А4 выбран из C(R9);
А5 выбран из C(R10);
А6 выбран из СН2, NH и О;
А7 и А11 представляет собой С;
А8 и А9 независимо выбраны из СН, N, NH, N(CH2)cR11;
А10 выбран из -СН=СН-, СН, N, NH, N-(СН2)c-R11;
где кольцо, образованное А7, А8, А9, А10 и А11, является ароматическим, R1, R2 и R3 независимо выбраны из Н, С1-10-алкила, F, Cl и Вr, причем, по меньшей мере, один из
R1, R2 и R3 является отличным от водорода;
R4 выбран из
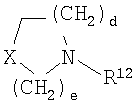
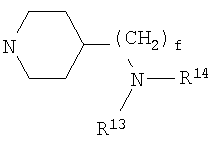
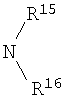
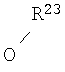
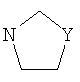 и
и 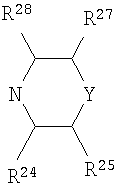
R5 и R6 независимо выбраны из C1-10алкила, фенила,-(СН2)f-фенила, возможно замещенных Сl, Вr;
R7 выбран из C1-10алкила;
R8, R9 и R10 независимо выбраны из Н, С1-10алкила, С1-10алкокси, F, Сl, Вr;
R11 выбран из С1-10алкила;
R12 выбран из Н, С1-10алкила, С2-6алкенила, С3-8циклоалкенила, арила, гетероарила, -(CH2)i-R18 и Z-R19;
R13 и R14 независимо выбраны из Н, С1-10алкила, С3-8циклоалкила, арила, гетероарила и -(CH2)j-R20;
R15, R16 независимо выбраны из Н, C1-10алкила, С3-8циклоалкила, арила, гетероарила, CH(СН2OH)(СН2)k-R21, СН(C1-10алкил)(СН2)k-R21, СН(C1-10алкил)СО-арила, СН(СO2-C1-10алкил)(СН2)k-R21, (СН2)k-СН(арил)-R21, возможно замещенного пиперидина, индана и -(СН2)k-R21;
R23 выбран из Н, С1-10алкила и -(CH2)k-R21;
R18 независимо выбран из Н, С1-10алкила, С3-8циклоалкила, С2-6алкенила, циклического С3-8алкенила, арила, гетероарила, F, ОН, О-С1-10алкила, S-C1-10алкила, группы N(С1-10алкил)2, СO2-C1-10алкила, CO-C1-10алкила, СО-арила, CONH2,
CONH-C1-10алкила, С2-6алкенил-СO2-С1-10алкила, С2-6алкениларила, CN и СF3;
R19 выбран из Н, С1-10алкила, С3-8циклоалкила, арила, гетероарила, O-арила, -(CH2)l-R22, циклопропиларила;
R20, R21 и R22 независимо выбраны из Н, С1-10алкила, С3-8циклоалкила, арила, гетероарила, F, ОН, O-C1-10алкила, S-С1-10алкила, группы N(С1-10алкил)2,
NH-СОС1-10алкила, СO2Н, СO2-С1-10алкила, CONH2, CN и СF3;
R24, R25 и R26 независимо выбраны из Н, С1-10алкила, гидрокси-С1-10алкила,
СO2-C1-10алкила, CONH2, CONH-C1-10алкила, группы СОN(С1-10алкил)2, СН2-фенил и 
или R24 и R25 вместе образуют конденсированное фенильное кольцо, возможно замещенное O-C1-10алкилом, или вместе образуют конденсированное циклогексильное кольцо,
или R25 и R26 вместе образуют конденсированное фенильное кольцо или вместе образуют конденсированное циклогексильное кольцо;
причем в R12-R16, R18-R22 арил представляет собой фенил или нафтил, гетероарил представляет собой диазолил, имидазолил, изоксазолил, пирролил, тиадиазолил, тиазолил, фурил, пиридил, тиенил или бензофуразанил, и арил, гетероарил, пиперидин в R12-R16, R18-R22 возможно замещены F, Cl, Br, C1-10алкилом, CN, O-C1-10алкилом, О-СF3, СН(СН3)ОН, СF3, СООС1-4алкил, N(СН3)2, СООСН3, NO2, СН2ОН, NHCOCH3, фенилом, СH2фенилом, ОН;
R27 и R28 независимо выбраны из Н и С1-10алкила;
U выбран из СН=СН, О и СН2;
V выбран из СН2, С(=O);
W выбран из O, S, NH;
Х выбран из N и СН;
Y выбран из CH-R26, (СН2)n, С=O, О и S;
Z выбран из С=O и S(=O)p;
а выбран из 0, 1, 2 и 3;
b выбран из 1 и 2;
с выбран из 0,1, 2 и 3;
d и e независимо выбраны из 1 и 2;
f выбран из 0 и 1;
i, j, k и 1 независимо выбраны из 1, 2 и 3;
n выбран из 0, 1 и 2;
р выбран из 1 и 2.
47. Соединение по п.46, где G выбран из:
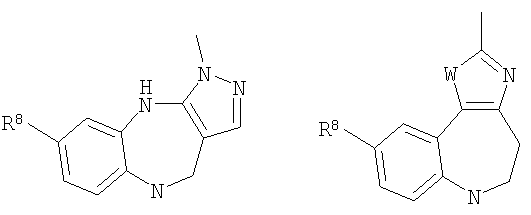
48. Соединение по п.46, выбранное из:
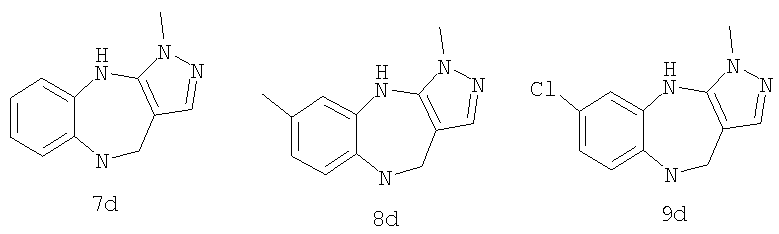
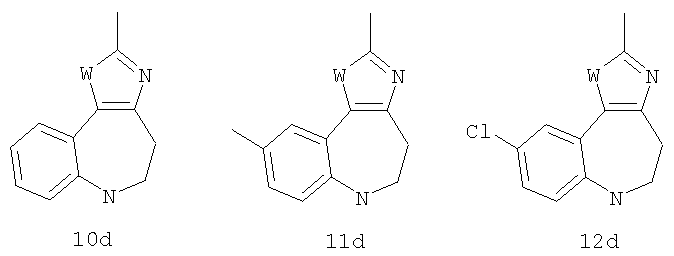
49. Соединение по п.46, где один из R1, R2 и R3 представляет собой метил, хлор или фтор, а другие представляют собой водород.
50. Соединение по п.46, где R12 представляет собой C1-10алкил.
51. Соединение по п.46, где R4 выбран из:
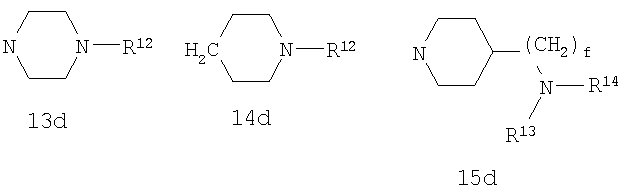
52. Соединение по п.46, где R4 выбран из:
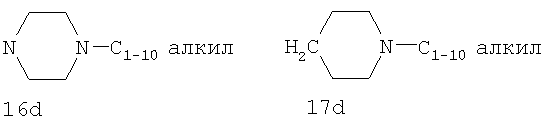
53. Соединение по п.46, где U представляет собой О, V представляет собой С(=O) и а представляет собой 1.
54. Соединение по п.46, где U представляет собой СН2, V представляет собой С(=O) и а выбран из 1 и 2.
55. Соединение по п.46, где U представляет собой О, V представляет собой СН2 и а выбран из 1 и 2.
56. Соединение по п.46, где R2 и R3 оба представляют собой Н, U представляет собой О, V представляет собой С(=O) и а представляет собой 1, как изображено в формуле 18d
где R1 выбран из метила, хлора и фтора и R4 выбран из общих формул 13d, 15d и 16d; предпочтительно R4 представляет собой 16d.
57. Соединение по п.46, где R2 и R3 оба представляют собой Н, U представляет собой СН2, V представляет собой С(=O) и а представляет собой 1, как изображено в формуле 19d:
где R1 выбран из метила, хлора и фтора; предпочтительно R1 представляет собой метил; R4 выбран из общих формул 13d, 15d и 16d; предпочтительно R4 представляет собой 16d.
58. Соединение по п.46, где R2 и R3 оба представляют собой Н, U представляет собой О и V представляет собой СН2, как изображено в формуле 20d
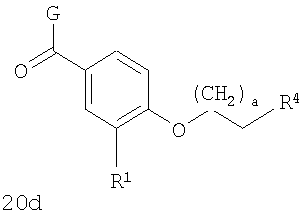
где R1 выбран из метила, хлора и фтора, и R4 выбран из общих формул 13d-17d; предпочтительно R4 выбран из общих формул 16d и 17d.
59. Соединение по п.46, где R2 и R3 оба представляют собой Н, U представляет собой О, V представляет собой СН2 и а представляет собой 2, как изображено в формуле 21d
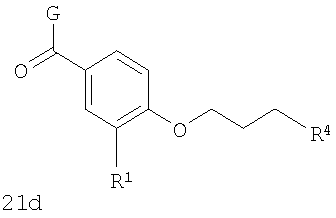
где R1 выбран из метила, хлора и фтора и R4 выбран из общих формул 13d-17d; предпочтительно R4 выбран из 16d и 17d.
60. Соединение по п.46, где U представляет собой О и V представляет собой СН2, как изображено в формуле 22d
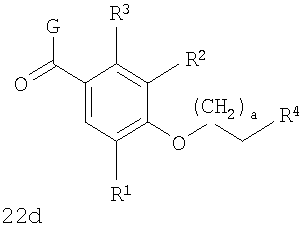
где G выбран из общих формул 7d-12d; предпочтительно R4 выбран из общих формул 13d-17d, более предпочтительно R4 выбран из 16d и 17d.
61. Соединение по п.46, где U представляет собой О, V представляет собой СН2 и а представляет собой 2, как изображено в формуле 23d
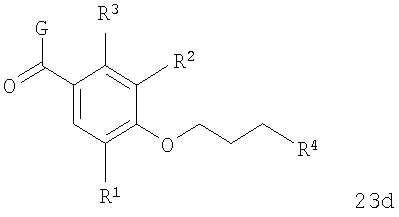
где G выбран из общих формул 7d-12d; предпочтительно R4 выбран из общих формул 13d-17d, более предпочтительно R4 выбран из 16d-17d.
62. Соединение по п.46, где U представляет собой СН2, V представляет собой С(=O) и а представляет собой 1, как изображено в формуле 24d
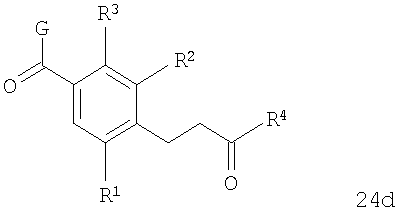
где G выбран из общих формул 7d-12d; предпочтительно R4 выбран из общих формул 13d, 15d и 16d; более предпочтительно R4 представляет собой 16d.
63. Соединение по п.46, где U представляет собой О, V представляет собой С(=O) и а представляет собой 1, как изображено в формуле 25d
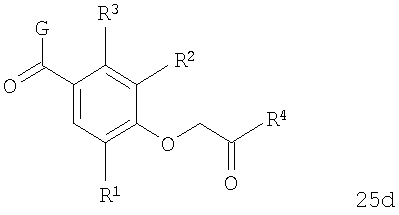
где G выбран из общих формул 7d-12d; предпочтительно R4 выбран из общих формул 13d, 15d и 16d; более предпочтительно R4 представляет собой 16d.
64. Соединение по п.46, где R2 и R3 оба представляют собой Н, как изображено в формуле 26d
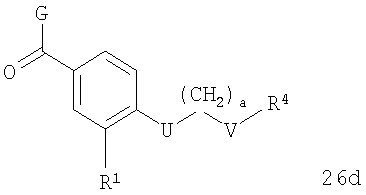
где R1 выбран из метила, хлора и фтора, и G выбран из общих формул 7d-12d.
65. Соединение по п.46, где R2 и R3 оба представляют собой Н, U представляет собой О и V представляет собой CH2, как изображено в формуле 27d
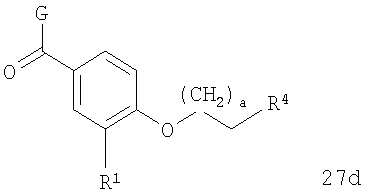
где R1 выбран из метила, хлора и фтора и G выбран из общих формул 7d-12d; предпочтительно R4 выбран из общих формул 13d-17d; более предпочтительно R4 выбран из 16d и 17d.
66. Соединение по п.46, где R2 и R3 оба представляют собой Н, U представляет собой О, V представляет собой СН2 и а представляет собой 2, как изображено в формуле 28d
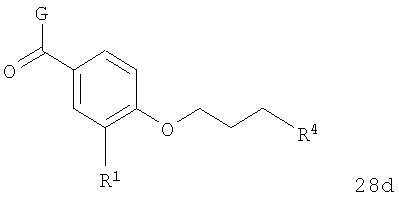
где R1 выбран из метила, хлора и фтора и G выбран из общих формул 7d-12d; предпочтительно R4 выбран из общих формул 13d-17d, более предпочтительно R4 выбран из 16d и 17d.
67. Соединение по п.46, где R2 и R3 оба представляют собой Н, U представляет собой СН2, V представляет собой С(=O) и а представляет собой 1, как изображено в формуле 29d
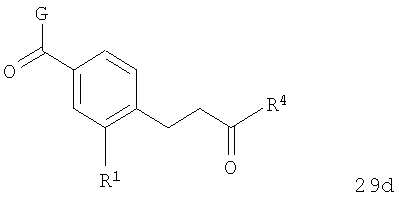
где R1выбран из метила, хлора и фтора; предпочтительно R1 представляет собой метил; G выбран из общих формул 7d-12d; предпочтительно R4 выбран из общих формул 13d, 15d и 16d; более предпочтительно R4 представляет собой 16d.
68. Соединение по п.46, где R2 и R3 оба представляют собой Н, U представляет собой О, V представляет собой С(=O) и а представляет собой 1, как изображено в формуле 30d
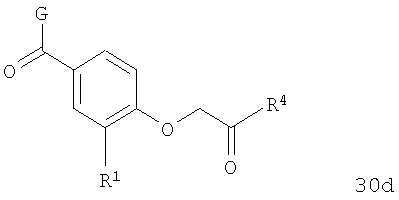
где R1 выбран из метила, хлора и фтора и G выбран из общих формул 7d-12d; предпочтительно R4 выбран из общих формул 13d, 15d и 16d; более предпочтительно
R4 представляет собой 16d.
69. Соединение по п.46, выбранное из группы, состоящей из:
(2-Хлор-4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}фенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(2-Хлор-4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}фенил)-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(2-Хлор-4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}фенил)-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-{3-метил-4-[3-(4-пропилпиперазин-1-ил)пропокси]фенил}метанона;
(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-{4-[3-(4-изобутилпиперазин-1-ил)пропокси]-3-метилфенил}метанона;
(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-(3-метил-4-{3-[4-(3-метилбутил)пиперазин-1-ил]пропокси}фенил)метанона;
(3,6-Диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-(4-{3-[4-(2,2-диметилпропил)пиперазин-1-ил]пропокси}-3-метилфенил)метанона;
(3-Хлор-4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}фенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(3-Хлор-4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}фенил)-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(3-Хлор-4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}фенил)-(6-хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(3-Фтор-4-{3-[4-(3-метилбутил)пиперазин-1-ил]пропокси}фенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(4-{2-[4-(3,3-Диметилбутил)пиперазин-1-ил]этокси}-3-метилфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(4-{3-[4-(2,2-Диметилпропил)пиперазин-1-ил]пропокси}-3-фторфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(4-{3-[4-(2-Этилбутил)пиперазин-1-ил]пропокси}-3-фторфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(4-{3-[4-(3,3-Диметилбутил)пиперазин-1-ил]пропокси}-2-фторфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(4-{3-[4-(3,3-Диметилбутил)пиперазин-1-ил]пропокси)-2-фторфенил)-(3,6-димeтил-4,10-дигидpo-3H-2,3,4,9-тeтpaaзaбeнзo[f]aзyлeн-9-ил)мeтaнoнa;
(4-{3-[4-(3,3-Диметилбутил)пиперазин-1-ил]пропокси}-3-фторфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(4-{3-[4-(3,3-Диметилбутил)пиперазин-1-ил]пропокси}-3-фторфенил)-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(4-{3-[4-(3,3-Диметилбутил)пиперазин-1-ил]пропокси}-3-метилфенил)-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(4-{3-[4-(3,3-Диметилбутил)пиперазин-1-ил]пропокси}-3-метилфенил)-(3,6-диметил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-(4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}-3-метилфенил)метанона;
(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-(4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}-3-фторфенил)метанона;
(6-Хлор-3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)-(4-{3-[4-(3,3-диметилбутил)пиперазин-1-ил]пропокси}-2-фторфенил)метанона;
{2-Хлор-4-[3-(4-изобутилпиперазин-1-ил)пропокси]фенил}-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
{2-Хлор-4-[3-(4-пропилпиперазин-1-ил)пропокси]фенил}-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
{3-Фтор-4-[3-(4-изобутилпиперазин-1-ил)пропокси]фенил}-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
{3-Фтор-4-[3-(4-пропилпиперазин-1-ил)пропокси]фенил}-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
{4-[3-(4-Циклопентилметилпиперазин-1-ил)пропокси]-3-фторфенил}-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
{4-[3-(4-Циклопропилметилпиперазин-1-ил)пропокси]-3-фторфенил}-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
{4-[3-(4-Циклопропилметилпиперазин-1-ил)пропокси]-3-метилфенил}-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
{4-[3-(4-Циклопропилпиперазин-1-ил)пропокси]-3-фторфенил}-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-ил)метанона;
1-(4-Бензиламинопиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-(4-Циклобутиламинопиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-(4-Циклобутилметилпиперазин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-(4-Циклобутилметилпиперазин-1-ил)-4-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]бутан-1-она;
1-(4-Циклогексиламинопиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-(4-Циклопентиламинометилпиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-(4-Циклопентиламинометилпиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-(4-Циклопентиламинопиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-(4-Циклопропиламинометилпиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-(4-Циклопропилметилпиперазин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-(4-Гексиламинопиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-(4-Изобутиламинопиперидин-1-ил)-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-[4-(1-Бензилпиперидин-4-иламино)пиперидин-1-ил]-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил] пропан-1-она;
1-[4-(2-Гидроксиэтиламино)пиперидин-1-ил]-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-2-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенокси]этанона;
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-2-[4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенокси]этанона;
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-4-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]бутан-1-она;
1-[4-(3,3-Диметилбутил)пиперазин-1-ил]-5-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пентан-1-она;
1-[4-(3,4-Дигидро-1H-изохинолин-2-илметил)пиперидин-1-ил]-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-пропан-1-она;
1-[4-(3-Гидроксипропиламино)пиперидин-1-ил]-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-[4-(3-Имидазол-1-илпропиламино)пиперидин-1-ил]-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-пропан-1-она;
1-[4-(Бензилбутиламино)пиперидин-1-ил]-3-[2-метил-4-(3-метил-4,10-дигидpo-3H-2,3,4,9-тeтpaaзaбeнзo[f]aзулeн-9-кapбoнил)фeнил]пpoпaн-1-oнa;
1-[4-(Циклогексилметиламино)пиперидин-1-ил]-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-[4-(Изобутиламинометил)пиперидин-1-ил]-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-{4-[(1-Бензилпиперидин-4-иламино)метил]пиперидин-1-ил}-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-пропан-1-она;
1-{4-[(Бутилметиламино)метил]пиперидин-1-ил}-3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропан-1-она;
1-{4-[Бензил-(2-диметиламиноэтил)амино]пиперидин-1-ил}-3-[2-метил-4-(3-мeтил-4,10-дигидpo-3H-2,3,4,9-тeтpaaзaбeнзo[f]aзулeн-9-кapбoнил)фeнил]-пропан-1-она;
3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-1-[4-(2-оксо-2-пара-толилэтил)пиперазин-1-ил]пропан-1-она;
3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-1-[4-(2-пирролидин-1-илэтил)пиперазин-1-ил]пропан-1-она;
3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-1-[4-(2-морфолин-4-илэтиламино)пиперидин-1-ил]пропан-1-она;
3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-1-(4-фенэтиламинопиперидин-1-ил)пропан-1-она;
3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-1-{4-[2-(1-метилпирролидин-2-ил)этиламино]пиперидин-1-ил}пропан-1-она;
3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-1-[4-(2-пирролидин-1-илэтиламино)пиперидин-1-ил]пропан-1-она;
3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-1-[4-(фенэтиламинометил)пиперидин-1-ил]пропан-1-она;
3-[2-Метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]-1-(4-тиоморфолин-4-илметилпиперидин-1-ил)пропан-1-она; и
Пиперидин-4-илметилового эфира 3-[2-метил-4-(3-метил-4,10-дигидро-3H-2,3,4,9-тетраазабензо[f]азулен-9-карбонил)фенил]пропионовой кислоты.
70. Фармацевтическая композиция, обладающая антагонистической активностью в отношении рецептора V1a, включающая эффективное количество соединения по любому из пп.1-69 и фармакологически приемлемый эксципиент.
71. Фармацевтическая композиция по п.70, приготовленная в виде препарата для перорального введения, предпочтительно в виде таблетки, капсулы или саше.
72. Фармацевтическая композиция по п.70 или 71 для лечения состояния, выбранного из дисменореи, преждевременных родов, гипертензии, болезни Рэйно, отека головного мозга, болезни движения, гиперлипидемии, мелкоклеточного рака легкого, депрессии, тревоги, гипонатриемии и застойной сердечной недостаточности.
73. Применение соединения по любому из пп.1-69 для приготовления лекарственного средства для лечения состояния, выбранного из дисменореи, преждевременных родов, гипертензии, болезни Рэйно, отека головного мозга, болезни движения, гиперлипидемии, мелкоклеточного рака легкого, депрессии, тревоги, гипонатриемии и застойной сердечной недостаточности.
| АВТОМАТИЧЕСКИЙ КЛАПАН ДЛЯ ПОЛИВНЫХ ТРУБОПРОВОДОВ | 0 |
|
SU186817A1 |
| POCIECHA D | |||
| et al | |||
| New mesogenic compounds having fork-like or cyclic amide terminal groups | |||
| Liquid Crystals, 2002, том 29, №5, стр.663-667 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| US 5843952 A, 01.12.1998 | |||
| US 5968930 A, 19.10.1999 | |||
| US 5760031 A, 02.06.1998 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1998 |
|
RU2213094C2 |
| КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ БЕНЗАЗЕПИНА, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ ДЛЯ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2129123C1 |
Авторы
Даты
2009-10-20—Публикация
2005-08-24—Подача