ОПИСАНИЕ
Настоящее изобретение относится к новому типу триазолзамещенных аминобензофенонов и к их применению в терапии.
Аминобензофеноны известны как из научной, так и из патентной литературы. Например, все патенты WO 98/32730, WO 01/05746, WO 01/05749, WO 01/05751, WO 01/05744 и WO 01/05745 раскрывают соединения с общей базовой структурой
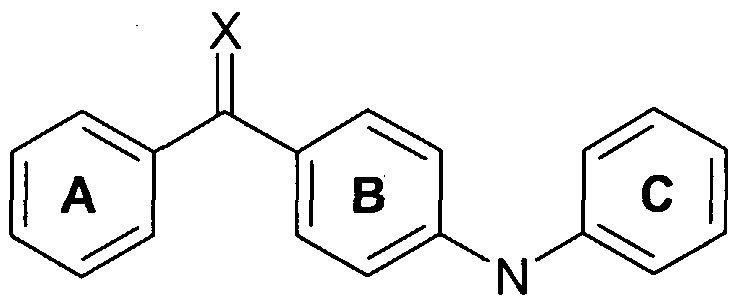
в которой фенильное кольцо С замещено аминопроизводными. Кроме того, патенты WO 01/42189 и WO 02/076447 раскрывают соединения с похожей структурой, но без азотсодержащего заместителя в фенильном кольце С. И, наконец, патенты WO 01/90074 и WO 02/083622 раскрывают соединения, у которых фенильные кольца А и С соответственно заменены гетероциклами. Соединения, раскрытые в этой заявке на патент, обозначены как ингибиторы секреции интерлейкина 1β (IL-1β) и фактора некроза опухоли α (TNF-α) in vitro, что делает соединения потенциально пригодными для лечения воспалительных заболеваний, в которых образование цитокинов включено в патогенез. Предположительно, аминобензофеноны проявляют свое воздействие путем ингибирования р38 МАР киназы, которая, в свою очередь, ингибирует образование IL-1β и TNF-α.
Получение структурно родственных аминобензофенонов, применяемых, когда окрашивают ткани, раскрыто в Man-Made Text. India (1987), 30(6), 275-6, Man-Made Text. India (1986), 29(5), 224-30, и в Man-Made Text. India (1985), 28(11), 425, 427-9, 431.
Было обнаружено, что новые производные триазолзамещенных аминобензофенонов являются активными ингибиторами секреции интерлейкина 1β (IL-1β) и фактора некроза опухоли α (TNF-α) in vitro и in vivo, что позволяет предположить их пригодность для лечения и/или профилактики воспалительных заболеваний и других патологических состояний, при которых секреция и модуляция предвоспалительных цитокинов включена в патогенез. Было установлено, что производные триазолзамещенных аминобензофенонов настоящего изобретения проявляют свое противовоспалительное воздействие путем ингибирования или подавления MAP акиназ, более специфично р38 МАР киназы, активируемого стрессом белка, который является важным элементом пути передачи сигнала, приводящего к выработке противовоспалительных цитокинов.
Производные триазолзамещенных аминобензофенонов настоящего изобретения, кроме того, могут быть пригодны для лечения раковой опухоли, офтальмологических заболеваний или состояний.
Таким образом, настоящее изобретение относится к соединению общей формулы Iа или Ib
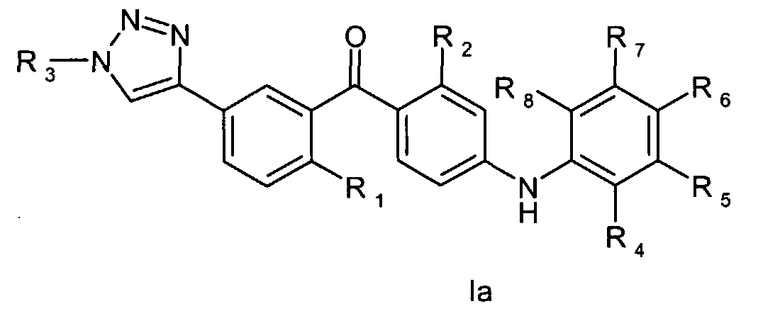
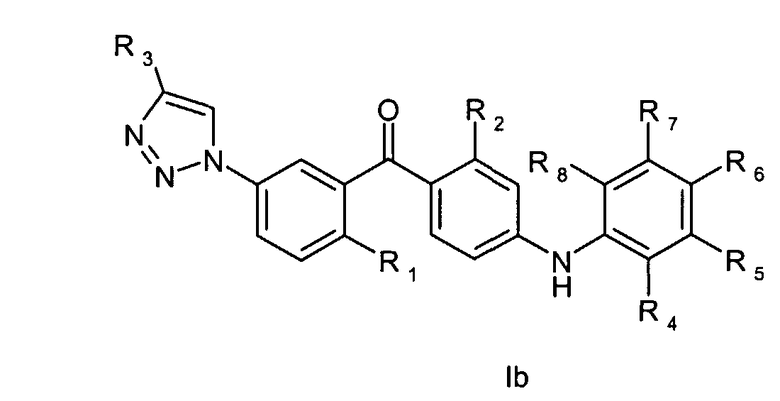
где
R1 - это метил, хлор, бром или метокси;
R2 - это хлор или метил;
R3 представляет собой С1-6алкил, С2-6алкенил, С2-6алкинил, С1-6гидроксиалкил, С1-6галогеналкил, С1-6алкокси, С1-6алкоксикарбонил, С1-6амино, уреидо, тиоуреидо, С1-6алкилкарбонилокси, С1-6алкилкарбонил, С1-6алкоксикарбонилокси, С1-6алкоксисульфонилокси, С1-6алкоксикарбамоил или С1-6аминокарбонил,
каждый из которых необязательно замещен одним или более, одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, гидрокси, меркапто, трифторметила, циано, карбокси, СОNН2, нитро, оксо, -S(O)2NH2, С1-4алкила, С2-4алкенила, С2-4алкинила, С1-4гидроксиалкила, С1-6галогеналкила, С1-4алкокси, С1-4алкоксикарбонила, уреидо, тиоуреидо, С1-4алкилкарбонилокси, С1-4алкоксикарбонилокси, С1-4алкоксисульфонилокси, С1-4алкоксикарбамоила, С1-4аминокарбонила, С1-4алкилтио, С3-6циклоалкила, С3-6циклоалкенила, амино, имино, С1-4аминосульфонила, С1-4аминокарбонилокси, С1-4алкилсульфониламино, С1-4алкоксиимино, С1-4алкилкарбониламино, С1-4алкилсульфонила, С1-6гетероарила, С1-6гетероциклоалкила или С2-6гетероциклоалкенила,
где упомянутые С1-4алкил, С2-4алкенил, С2-4алкинил, С1-4гидроксиалкил, С1-6галогеналкил, С1-4алкокси, С1-4алкоксикарбонил, уреидо, тиоуреидо, С1-4алкилкарбонилокси, С1-4алкоксикарбонилокси, С1-4алкоксисульфонилокси, С1-4алкоксикарбамоил, С1-4аминокарбонил, С1-4алкилтио, С3-6циклоалкил, С3-6циклоалкенил, амино, имино, С1-4аминосульфонил, С1-4аминокарбонилокси, С1-4алкилсульфониламино, С1-4алкоксиимино, С1-4алкилкарбониламино, С1-4алкилсульфонил, С1-6гетероарил, С1-6гетероциклоалкил или С2-6гетероциклоалкенил, необязательно дополнительно замещены одним или более, одинаковыми или различными заместителями, выбираемыми из группы, состоящей из галогена, гидрокси, -NH2, меркапто, трифторметила, циано, карбокси, СОNH2, нитро, оксо, -S(O)2NH2, С1-4алкила или С1-4гидроксиалкила,
или R3 представляет собой водород, гидрокси или карбокси;
R4, R5, R6, R7 и R8 независимо друг от друга представляют собой водород, галоген, -NH2, гидрокси, трифторметил, метокси, этокси, циано, ацетил, ацетамидо, метил или этил;
при условии, что соединение не является [4-(2-аминофенил)амино)-2-хлорфенил]-[2-метил-5-[1-[2-[(тетрагидро-2Н-пиран-2-ил)окси]этил]-1Н-1,2,3-триазол-4-ил]фенил]метаноном или [4-[(2-аминофенил)амино]-2-хлорфенил]-[5-[1-(2-гидроксиэтил)-1Н-1,2,3-триазол-4-ил]-2-метилфенил]метаноном;
или его фармацевтически приемлемая соль, сольват или сложный эфир.
В другом аспекте изобретение относится к фармацевтической композиции, включающей соединение формулы Iа или Ib или фармацевтически приемлемую соль, сольват или сложный эфир их вместе с фармацевтически приемлемым носителем или наполнителем.
В дополнительном аспекте изобретение относится к способу профилактики, лечения или улучшения состояния в случае воспалительных заболеваний или состояний, или в случае офтальмологических заболеваний или состояний, способ включает введение нуждающемуся в этом пациенту эффективного количества соединения формулы Iа или Ib.
В дополнительном аспекте изобретение относится к способу лечения или улучшения состояния в случае раковых опухолей, способ включает введение нуждающемуся в этом пациенту эффективного количества соединения формулы Iа или Ib.
Еще в дополнительном аспекте изобретение относится к применению соединения формулы Iа или Ib для изготовления лекарственных препаратов для профилактики, лечения или улучшения состояния в случае воспалительных заболеваний или состояний, или офтальмологических заболеваний или состояний.
Еще в дополнительном аспекте изобретение относится к применению соединения формулы Iа или Ib для изготовления лекарственных препаратов для лечения или улучшения состояния в случае раковых опухолей.
Подробное описание изобретения
В настоящем контексте термин «алкил» предназначен для обозначения радикала, полученного, если один атом водорода удален из углеводорода. Упомянутый алкил включает 1-6, предпочтительно 1-4, а также 2-3 атома углерода. Термин включает подклассы: нормальный алкил (н-алкил), вторичный и третичный алкил, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил и изогексил.
Термин «циклоалкил» предназначен для обозначения насыщенного циклоалканового радикала, включающего 3-6 атомов углерода, а также 4-5 атомов углерода, например циклопропил, циклобутил, циклопентил и циклогексил.
Термин «циклоалкенил» предназначен для обозначения моно- или диненасыщенных неароматических циклических углеводородных радикалов, включающих 3-6 атомов углерода, а также 4-5 атомов углерода, например циклопропенил, циклобутенил, циклопентенил или циклогексенил.
Термин «гетероарил» предназначен для обозначения радикалов гетероциклических ароматических колец, включающих 1-4 гетероатома (выбранных из O, S и N) и 1-6 атомов углерода, таких как 1-3 гетероатома и 1-6 атомов углерода, таких как 1-2 гетероатома и 1-5 атомов углерода, таких как 1-2 гетероатома и 2-4 атома углерода, в частности, 5- или 6-членных колец с 1-4 гетероатомами или 1-2 гетероатомами, выбранными из из O, S и N, например, пиридил, тетразолил, тиазолил, имидазолил, пиразолил, оксазолил, оксадиазолил, тиофенил, 1,2,4-триазолил, изоксазолил, пирролидинил, тиенил, пиразинил, пиримидинил, [1,2,3]триазолил или изотиазолил.
Термин «гетероциклоалкил» предназначен для обозначения циклоалкильного радикала, как определено выше, в частности, 5- или 6-членных колец, включая полициклические радикалы, включающие 1-4 гетероатома, предпочтительно, 1-3 гетероатома, выбранных из O, N или S, например, тетрагидропиранил, морфолин, имидазолидинил, диоксоланил или пиперидинил.
Термин «гетероциклоалкенил» предназначен для обозначения циклоалкенильного радикала, как определено выше, включая полициклические радикалы, включающие 1-4 гетероатома, предпочтительно, 1-3 гетероатома, выбранных из O, N или S, например, 1,6-дигидропиридинил, 4,5-дигидро-1Н-[1,2,4]триазолил, 4,5-дигидрооксазолил, 1-Н-пиразолил или 4,5-дигидроизоксазолил.
Термин «алкенил» предназначен для обозначения моно-, ди- или триненасыщенных углеводородных радикалов, включающих 2-6 атомов углерода, в частности, 2-4 атома углерода, а также 2-3 атома углерода, например, этенил, аллил, пропенил, бутенил, пентенил или гексенил.
Термин «алкинил» предназначен для обозначения углеводородного радикала, включающего 1-5 углерод-углеродных тройных связей, например, 2 или 3 тройные связи и 2-6 атомов углерода, алкановая цепочка обычно включает 2-5 атомов углерода, в частности, 2-4 атома углерода, а также 2-3 атома углерода, например, этинил, пропинил, бутинил, пентинил или гексинил.
Термин «галоген» предназначен для обозначения заместителя из 7-й основной группы периодической таблицы, предпочтительно, фтор, хлор и бром.
Термин «гидроксиалкил» предназначен для обозначения алкильного радикала, как определено выше, в котором один или несколько водородных атомов заменены на гидроксил.
Термин «галогеналкил» предназначен для обозначения алкильного радикала, как определено выше, в котором один или несколько водородных атомов заменены на галоген, одинаковый или различный, такой как бром, йод, хлор и/или фтор.
Термин «амино» предназначен для обозначения радикала формулы -NR2, в котором каждый R независимо друг от друга представляет собой водород, алкил, алкенил или циклоалкил, как указано выше, например, -NН2, метиламино, диэтиламино, циклогексиламино, трет-бутиламино или этиламино.
Термин «имино» предназначен для обозначения радикала формулы =N-R, в котором R представляет собой водород или алкил, как указано выше.
Термин «алкокси» предназначен для обозначения радикала формулы -ОR, в котором R является алкилом или алкенилом, как указано выше, например, метокси, этокси, н-пропокси, изопропокси, бутокси, и др.
Термин «алкилтио» предназначен для обозначения радикала формулы -S-R, в котором R является алкилом, как указано выше.
Термин «алкоксикарбонил» предназначен для обозначения радикала формулы -С(О)-О-R, в котором R является алкилом, как указано выше, например, метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил и др.
Термин «алкилкарбонилокси» предназначен для обозначения радикала формулы -О-С(О)-R, в котором R является алкилом, как указано выше, например, метилкарбонилокси или этилкарбонилокси.
Термин «алкоксикарбонилокси» предназначен для обозначения радикала формулы -О-С(О)-О-R, в котором R является алкилом, как указано выше.
Термин «алкилкарбонил» предназначен для обозначения радикала формулы -С(О)-R, в котором R является алкилом, как указано выше, например ацетил.
Термин «уреидо» предназначен для обозначения радикала формулы -NR′-С(О)-NН-R, в котором R′ является водородом или алкилом, как указано выше, и R является водородом, алкилом, алкенилом, алкинилом или циклоалкилом, как указано выше, например, -NН-С(О)-NН2, метилуреидо, этилуреидо, трет-бутилуреидо, циклогексилуреидо, метилтиоуреидо, изопропилуреидо или н-пропилуреидо.
Термин «тиоуреидо» предназначен для обозначения радикала формулы -NR′-С(S)-NН-R, в котором R′ является водородом или алкилом, как указано выше, и R является водородом, алкилом или циклоалкилом, как указано выше, например, -NН-С(S)-NН2.
Термин «алкоксисульфонилокси» предназначен для обозначения радикала формулы -О-S(О)2-О-R, в котором R является алкилом, как указано выше.
Термин «аминосульфонил» предназначен для обозначения радикала формулы -S(О)2-NR2, в котором R независимо друг от друга представляют собой водород или алкил, как указано выше.
Термин «аминокарбонилокси» предназначен для обозначения радикала формулы -NR′-С(О)-О-R, в котором R′ является водородом или алкилом, как указано выше, и R является алкилом, как указано выше, например, аминокарбонил-трет-бутокси.
Термин «алкилсульфониламино» предназначен для обозначения радикала формулы -NR′-S(О)2-R, в котором R является алкилом, как указано выше, и R′ является водородом или алкилом, как указано выше, например, метилсульфониламино.
Термин «алкоксиимино» предназначен для обозначения радикала формулы =N-О-R, в котором R является водородом или алкилом, как указано выше, например, метоксиимино.
Термин «алкоксикарбамоил» предназначен для обозначения радикала формулы -С(О)NR′-О-R, в котором R′ является водородом или алкилом, как указано выше, и R является алкилом, как указано выше.
Термин «аминокарбонил» предназначен для обозначения радикала формулы -С(О)NR′2, в котором каждый R′, независимо друг от друга, является водородом, алкилом или алкенилом, как указано выше, например, карбамоил, метиламинокарбонил, этиламинокарбонил, пропиламинокарбонил или бутиламинокарбонил.
Термин «алкилкарбониламино» предназначен для обозначения радикала формулы -NR′-С(О)-R, в котором R′ является водородом или алкилом, как указано выше, и R является алкилом, как указано выше, например, ацетиламино.
Термин «фармацевтически приемлемая соль» предназначен для обозначения солей, полученных реакцией соединения формулы I с подходящей неорганической или органической кислотой, такой как хлористоводородная, бромистоводородная, йодистоводородная, серная, азотная, фосфорная, муравьиная, уксусная, 2,2-дихлоруксусная, адипиновая, аскорбиновая, L-аспарагиновая, L-глутаминовая, галактаровая, молочная, малеиновая, L-оксиянтарная, фталевая, лимонная, пропионовая, бензойная, глутаровая, глюконовая, D-глюкуроновая, метансульфоновая, салициловая, янтарная, малоновая, виноградная, бензолсульфоновая, этан-1,2-дисульфоновая, 2-гидроксиэтансульфоновая, толуолсульфоновая, сульфамовая или фумаровая кислота. Фармацевтически приемлемые соли соединения формулы I также могут быть получены реакцией с подходящим основание, таким как гидроксид натрия, гидроксид калия, гидроксид магния, гидроксид кальция, аммиак или подходящие нетоксичные амины, такие как низшие алкиламины, например, триэтиламин, гидроксинизшие алкиламины, например, 2-гидроксиэтиламин, бис-(2-гидроксиэтил)амин, циклоалкиламины, например, дициклогексиламин, или бензиламины, например, N,N′-дибензилэтилендиамин и дибензиламин, или L-аргинин, или L-лизин.
Термин «сольват» предназначен для обозначения продукта, образованного взаимодействием между соединением, например, соединением формулы I, и растворителем, например, спиртом, глицерином или водой, где упомянутый продукт находится в твердой форме. В том случае, когда вода является растворителем, упомянутый продукт относится к гидрату.
Термин «фармацевтически приемлемый сложный эфир» предназначен для обозначения легко гидролизуемых сложных эфиров, таких как алканоилоксиалкил, аралканоилоксиалкил, арилоилоксиалкил, например, ацетоксиметиловые, пивалоилоксиметиловые, бензоилоксиметиловые сложные эфиры и соответствующие 1′-оксиэтиловые производные, или сложные эфиры молочной кислоты, например, фталидиловые сложные эфиры или диалкиламиноалкиловые сложные эфиры, например, диметиламиноэтиловые сложные эфиры. Легко гидролизуемые сложные эфиры включают in vivo гидролизуемые сложные эфиры соединений формулы I. Такие сложные эфиры могут быть получены стандартными способами, известными специалисту, такими как способ, раскрытый в патенте Великобритании № 1490852, включенном в описание как ссылка.
Термин «соединение I» или «соединение формулы I» включает как соединение Iа, так и соединение Ib.
«р38 МАР киназа» является активируемой стрессом белковой киназой, существующей в нескольких изоформах (р38α, р38β, р38β2, р38γ и р38δ). Р38 МАР киназа активируется различными стимулирующими воздействиями, включая тепловые, химические, обонятельные, рН и окислительный стресс, удаление фактора роста, высокий или низкий уровень глюкозы и ультрафиолетовое излучение. Р38 также стимулируется агентами, которые являются посредниками инициации физиологического ответа на рану, инфекцию и воспаление, такими как LPS и провоспалительными цитокинами IL-1β, TNF-α, FasL, CD40L и TGF-β. Как и другие МАР киназы, р38 фосфорилируется киназами, включая МКК3, МЕК6 и МКК6, по треонину и тирозину в активационной петле (Thr-Xaa-Tyr), сближенной с АТР и участком связывания субстрата. В свою очередь, р38 фосфорилирует и активирует серин-треонин белковые киназы МАРКАР киназа-2, МАРКАР киназа-3 МАРКАР киназа-5, MNK-1 и MSK-1. Было установлено, что активация биосинтеза цитокинов, регулируемого р38, в клетках различных типов либо непосредственно связана путем фосфорилирования и активации факторов транскрипции с экспрессией цитокинов, либо опосредованно, например, путем фосфорилирования MSK-1, которая, будучи активированной, активирует фактор транскрипции CREB. Также было показано, что определенные пиридинилимидазолы, например, SB203580, которые ингибируют р38, ингибируют образование IL-1β и TNF-α из LPS-обработанных человеческих моноцитов. Поэтому был сделан вывод, что р38 представляет собой потенциально очень интересную мишень для разработки противовоспалительных соединений (ср. J.C. Lee et al., Immunopharmacology 47, 2000, pp. 185-201 и ссылки, обзор которых дается там; P.R. Young, “Specific Inhibitors of p38 MAP kinase” in Signaling Networks and Cell Cycle Control: The Molecular Basis of Cancer and Other Diseases, J.S. Gutkind (Ed.), Humana Press, Inc., Totowa, N.J. и ссылки, обзор которых дается там).
Существует несколько сообщений о р38 МАР киназе и воспалительных цитокинах в связи с клеточным ростом и апоптозом, а именно пролиферацией опухоли и метастаз. Несмотря на то что точный механизм опосредованной регуляции р38 МАР киназой клеточного роста неизвестен, полагают, что р38МАР киназа представляет собой потенциально очень интересную мишень для разработки противораковых лекарственных препаратов (S. Nakada et al., Anticancer Research 21(1A), 2001, pp. 167-171 и ссылки, цитированные там; C. Denkert et al., Cancer Letters 195(1), 2003, pp. 101-109 и ссылки, цитированные там).
Соединения формулы Ia и Ib могут содержать асимметрично замещенные (хиральные) атомы углерода и углерод=углерод двойные связи, что увеличивает возможность существования изомерных форм, например, энантиомеры, диастереомеры и геометрические изомеры. Настоящее изобретение относится ко всем таким изомерам, как в чистой форме, так и в их смеси. Чистые стереоизомерные формы соединений и промежуточных продуктов этого изобретения могут быть получены применением методик, известных из уровня техники. Диастереомеры могут быть разделены физическими методами сепарации, такими как селективная кристаллизация и хроматографические методы, например, жидкостная хроматография с использованием хиральной стационарной фазы. Энантиомеры могут быть разделены друг от друга селективной кристаллизацией их диастереомерных солей с оптически активными кислотами. В качестве альтернативы энантиомеры могут быть разделены хроматографическими методами с использованием хиральных стационарных фаз. Упомянутые чистые стереоизомерные формы могут также быть получены из соответствующих чистых стереоизомерных форм подходящих исходных веществ при условии, что реакция протекает стереоселективно или стереоспецифично. Предпочтительно, если требуется специфичный стереоизомер, упомянутое соединение следует синтезировать стереоселективными или стереоспецифическими способами получения. В этих способах будут успешно применяться хирально чистые исходные вещества. Подобным образом, чистые геометрические изомеры могут быть получены из соответствующих чистых геометрических изомеров подходящих исходных веществ. Смесь геометрических изомеров обычно будет проявлять различные физические свойства, и поэтому они могут быть разделены стандартными хроматографическими методами, хорошо известными из уровня техники.
Триазольный фрагмент может рассматриваться в качестве изостеры амида, но не поддающийся гидролитическому расщеплению амидазоподобными ферментами. Соединения формулы Ia или Ib таким образом считаются более метаболически стабильными, чем их соответствующие амидные производные.
Предпочтительные примеры соединения формулы Ia и Ib
В настоящем предпочтительном примере соединения формулы Ia или Ib
R3 представляет собой
С1-6алкил, С2-6алкенил, С2-6алкинил, С1-6гидроксиалкил, С1-6алкоксикарбонил, С1-6алкилкарбонил, уреидо или С1-6аминокарбонил, каждый из которых необязательно может быть замещен одним или более, одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, гидрокси, меркапто, трифторметила, циано, карбокси, СОNН2, нитро, оксо, -S(O)2NH2, С1-4алкила, С2-4алкенила, С2-4алкинила, С1-4гидроксиалкила, С1-4алкокси, С1-4алкоксикарбонила, уреидо, тиоуреидо, С1-4алкилкарбонилокси, С1-4алкоксикарбонилокси, С1-4алкоксисульфонилокси, С1-4алкоксикарбамоила, С1-4аминокарбонила, С1-4алкилтио, С3-6циклоалкила, С3-6циклоалкенила, амино, имино, С1-4аминосульфонила, С1-4аминокарбонилокси, С1-4алкилсульфониламино, С1-4алкоксиимино, С1-4алкилкарбониламино, С1-4алкилсульфонила, С1-6гетероарила, С1-6гетероциклоалкила или С2-6гетероциклоалкенила,
последние 27 из которых, кроме того, необязательно дополнительно замещены одним или более, одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, гидрокси, -NH2, меркапто, трифторметила, циано, карбокси, СОNH2, нитро, оксо, -S(O)2NH2, С1-4алкила или С1-4гидроксиалкила,
или R3 представляет собой водород, гидрокси или карбокси;
при условии, что соединение не является [4-(2-аминофениламино)-2-хлорфенил]-(2-метил-5-{1-[2-[(тетрагидропиран-2-илокси)этил]-1Н-[1,2,3]триазол-4-ил}фенил]метаноном или [4-[(2-аминофениламино)-2-хлорфенил]-{5-[1-(2-гидроксиэтил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метаноном.
В следующем предпочтительном примере соединений формулы Ia или Ib R4, R5, R6, R7 и R8 независимо друг от друга представляют собой водород, галоген, гидрокси, трифторметил, метокси, этокси, метил или этил.
В другом примере настоящего изобретения R5, R6 и R7 независимо друг от друга представляют собой водород, галоген, -NH2, гидрокси, трифторметил, метокси, этокси, циано, ацетил, ацетамидо, метил или этил, и R4 и R8 независимо друг от друга представляют собой водород, галоген, гидрокси, трифторметил, метокси, этокси, циано, ацетил, ацетамидо, метил или этил.
В еще одном примере соединений формулы Ia или Ib R4, R5, R6, R7 и R8 независимо друг от друга представляют собой водород, фтор или хлор.
В еще одном примере соединений формулы Ia или Ib, по крайней мере три из R4, R5, R6, R7 или R8 представляют собой водород.
В следующем представляемом предпочтительном примере соединений формулы Ia или Ib R5, R7 и R8 представляют собой водород.
В следующем представляемом предпочтительном примере соединений формулы Ia или Ib R5, R6, R7 и R8 представляют собой водород.
В следующем представляемом предпочтительном примере соединений формулы Ia или Ib R4, R5, R7 и R8 представляют собой водород.
В еще одном примере соединений формулы Ia или Ib R4, R7 и R8 или R6, R7 и R8, или R4, R6, R7 и R8, или R4, R6 и R8, или R4, R6 и R7 представляют собой водород.
В следующем представляемом предпочтительном примере соединений формулы Ia или Ib R1 представляет собой метил и R2 представляет собой хлор.
В следующем представляемом предпочтительном примере соединений формулы Ia или Ib R3 представляет собой С1-4алкил, С1-4алкенил или С1-4гидроксиалкил, каждый из которых необязательно может быть замещен одним или более, одинаковыми или различными заместителями, выбираемыми из группы, состоящей из галогена, гидрокси, меркапто, -NH2, карбокси, СОNН2, нитро, оксо, -S(O)2NH2, С1-2гидроксиалкила, С1-2алкокси, С1-2алкоксикарбонила, С1-2уреидо, С1-2тиоуреидо, С1-2алкилкарбонилокси, С1-2алкоксикарбонилокси, С1-2алкоксисульфонилокси, С1-2алкоксикарбамоила, С1-2аминокарбонила, С1-2алкилтио, С1-2амино, С1-2имино, С1-2аминосульфонила, С1-2аминокарбонилокси, С1-2алкилсульфониламино, С1-2алкоксиимино, С1-2алкилкарбониламино, С1-2алкилсульфонила, С2-5гетероарила, С2-5гетероциклоалкила, С3-5гетероциклоалкенила,
последние 22 из которых необязательно дополнительно могут быть, кроме того, замещены одним или более, одинаковыми или различными заместителями, выбранными из группы, состоящей из гидрокси, -NH2, карбокси, СОNH2, оксо или С1-3алкила,
при условии, что соединение не является [4-(2-аминофениламино)-2-хлорфенил]-[2-метил-5-{1-[2-(тетрагидропиран-2-илокси)этил]-1Н-[1,2,3]триазол-4-ил}фенил]метаноном или [4-(2-аминофениламино)-2-хлорфенил]-{5-[1-(2-гидроксиэтил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метаноном.
В следующем предпочтительном примере соединений формулы Ia или Ib R3 представляет собой С1-3алкил, С1-3алкенил или С1-3гидроксиалкил, каждый из которых необязательно замещен одним или более, одинаковыми или различными заместителями, выбранными из группы, состоящей из гидрокси, -NH2, карбокси, хлора, СОNН2, оксо, -S(O)2NH2, С1-2гидроксиалкила, С1-2алкокси, С1-2алкоксикарбонила, С0-2уреидо, С1-2аминокарбонила, С1-2амино, С1-2алкилсульфониламино, С2-5гетероциклоалкила, последние 8 из которых дополнитеольно могут быть, кроме того, замещены одним или более, одинаковыми или различными заместителями, выбираемыми из группы, состоящей из гидрокси или С1-2алкила,
при условии, что соединение не является [4-(2-аминофениламино)-2-хлорфенил]-(2-метил-5-{1-[2-(тетрагидропиран-2-илокси)этил]-1Н-[1,2,3]триазол-4-ил}фенил]метаноном или [4-(2-аминофениламино)-2-хлорфенил]-{5-[1-(2-гидроксиэтил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метаноном.
В следующем предпочтительном примере соединений формулы Ia или Ib R3 представляет собой метил, этил, пропил, пропенил, все они замещены одним, двумя, тремя или четырьмя одинаковыми или различными заместителями, выбранными из группы, состоящей из гидрокси, CONH2, оксо, диэтиламино, этиламинокарбонила, метила, гидроксиметила, пирролидинила, морфолинила, хлора, H2N-C(О)-NH-, метоксикарбонила, метокси, -NHz, этоксикарбонила, этокси, метилсульфониламино, -S(O)2NH2, тетрагидропиранила, [1,3]диоксоланила, этиламино, пиперазинила, последние четыре дополнительно замещены одним, двумя, тремя или четырьмя одинаковыми или различными заместителями, выбранными из группы, состоящей из метила или этила.
В следующем предпочтительном примере соединений формулы 1а или Ib R3 представляет собой 2-гидроксиэтил, 3-гидроксипропил, карбамоилметил, 2,3-дигидроксипропил,
2-(метилсульфониламино)этил, сульфониламинопропил, 2,2-диметил-[1,3]диоксолан-4-илметил, 2-(тетрагидропиран-2-илокси)этил,
3-(тетрагидропиран-2-илокси)пропил, этоксикарбонилметил, карбоксиметил, этиламинокарбонилметил, (2-гидрокси-1,1-диметилэтил)аминокарбонилметил, 1-пирролидин-1-илэтанон, 1-морфолин-4-илэтанон, 2-хлорэтил, 1-гидрокси-1-метилэтил, ацетил, 1-амино-1-метилэтил, метоксикарбонил, карбокси, гидроксиметил, 3-гидроксипропенил, 2-аминоэтил, метилмочевина, 2-морфолин-4-илэтил, (4-метилпиперазин-1-ил)этил, 2-диэтиламиноэтил, 2-(2-гидроксиэтиламино)этил, пропиламиноэтил или диэтиламин.
Конкретные примеры соединений формулы I могут быть выбраны из группы, состоящей из
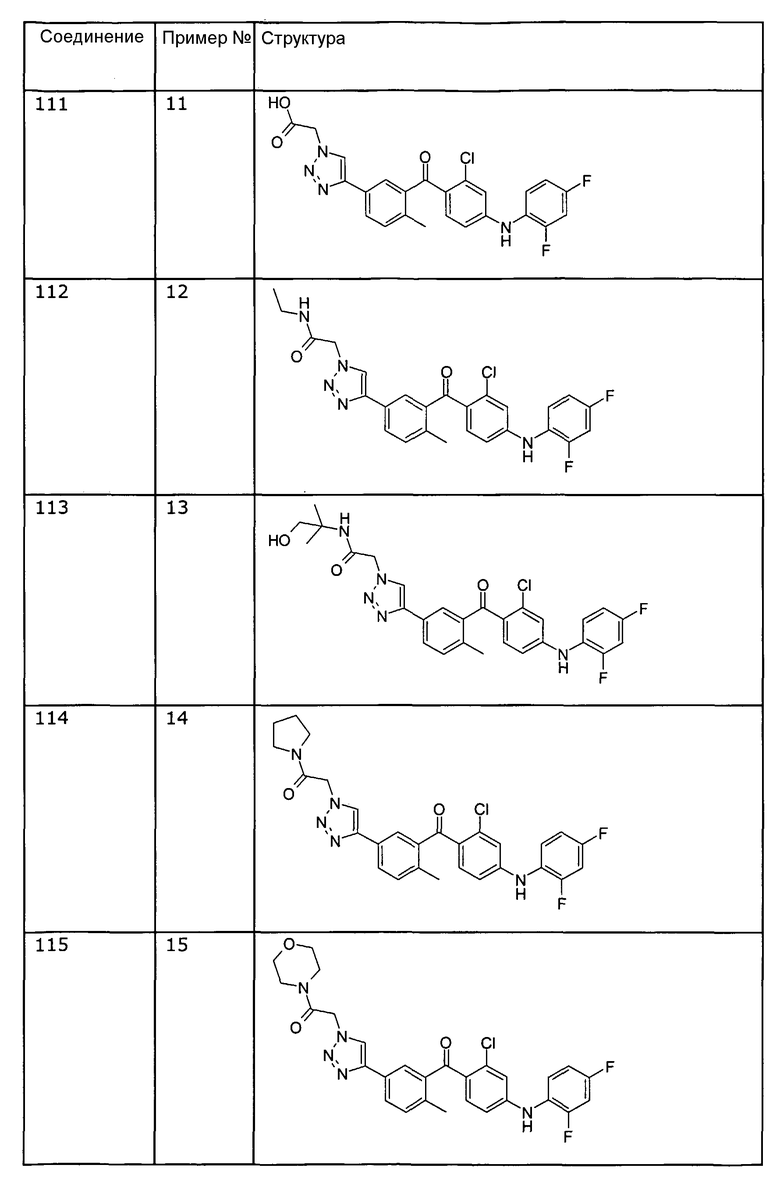
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(2-гидроксиэтил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанона (соединение 102),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(3-гидроксипропил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанона (соединение 104),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(2,2-диметил-[1,3]диоксолан-4-илметил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанона (соединение 105),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(2,3-дигидроксипропил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанона (соединение 106),
2-(4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)ацетамида (соединение 107),
амида 3-(4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)пропан-1-сульфоновой кислоты (соединение 108),
N-[2-(4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)этил]метансульфонамида (соединение 109),
этилового эфира (4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)уксусной кислоты (соединение 110),
2-(4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)-N-этилацетамида (соединение 112),
2-(4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)-N-(2-гидрокси-1,1-диметилэтил)ацетамида (соединение 113),
2-(4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)-1-пирролидин-1-илэтанона соединение 114),
2-(4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)-1-морфолин-4-илэтанона (соединение 115),
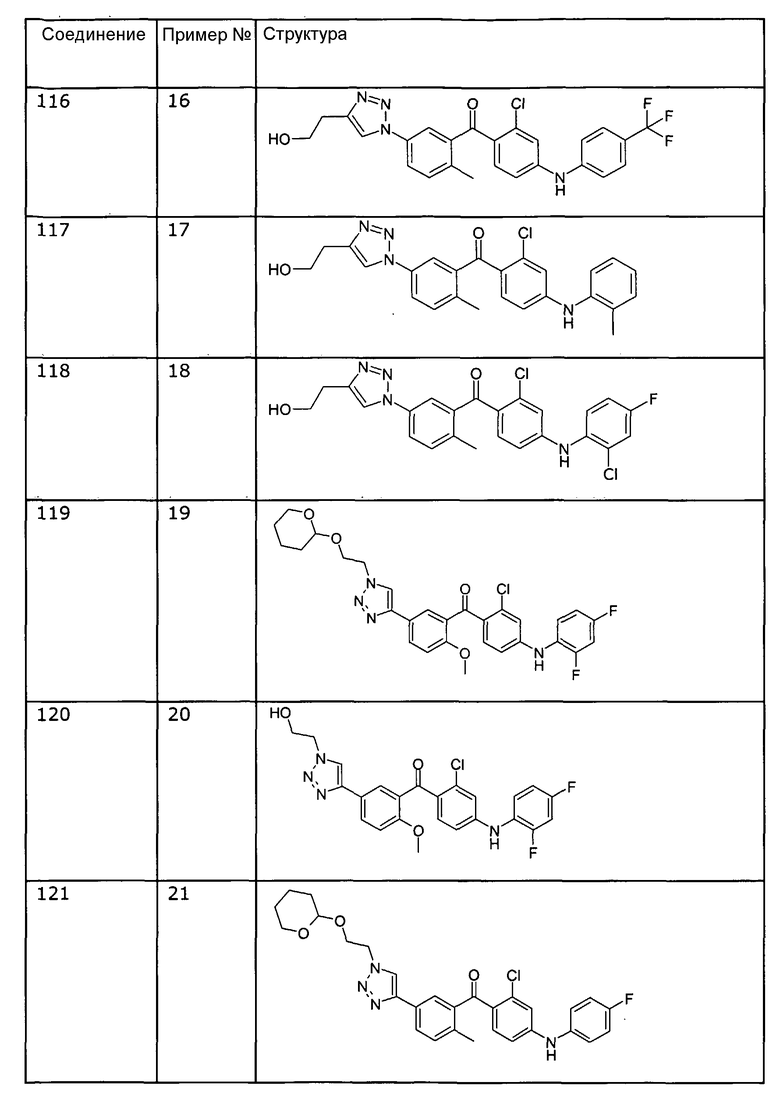
[2-хлор-4-о-толиламинофенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 117),
[2-хлор-4-(2-хлор-4-фторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 118),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(2-гидроксиэтил)-1Н-[1,2,3]триазол-4-ил]-2-метоксифенил}метанона (соединение 120),
[2-хлор-4-(4-фторфениламино)фенил]-{5-[1-(2-гидроксиэтил)1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанона (соединение 122),
[2-хлор-4-(4-фторфениламино)фенил]-{5-[1-(2,3-дигидроксипропил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанона (соединение 124),
2-(4-{3-[2-хлор-4-(4-фторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)ацетамида (соединение 125),
[2-хлор-4-(4-фторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 127),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 128),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[4-(1-гидрокси-1-метилэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 129),
1-(1-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-1Н-[1,2,3]триазол-4-ил)этанон (соединение 130),
{5-[4-(1-амино-1-метилэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}-[2-хлор-4-(2,4-дифторфениламино)фенил]метанона (соединение 131),
1-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-1Н-[1,2,3]триазол-4-карбоксикислоты (соединение 133),
[2-хлор-4-(2,4-дифторфениламино)фенил]-[5-(4-гидроксиметил-[1,2,3]триазол-1-ил)-2-метилфенил]метанона (соединение 134),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[4-(3-гидроксипропенил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 135),
{5-[4-(2-аминоэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}-[2-хлор-4-(2,4-дифторфениламино)фенил]метанона (соединение 136),
(1-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил-lH-[1,2,3]триазол-4-илметил)мочевины (соединение 137),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{2-метил-5-[4-(2-морфолин-4-илэтил)-[1,2,3]триазол-1-ил]фенил}метанона (соединение 138),
[2-хлор-4-(2,4-дифторфениламино)фенил]-(2-метил-5-{4-[2-(4-метилпиперазин-1-ил)этил]-[1,2,3]триазол-1-ил}фенил}метанона (соединение 139),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[4-(2-диэтиламиноэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 140),
[2-хлор-4-(2,4-дифторфениламино)фенил]-(5-{4-[2-(2-гидроксиэтиламино)этил]-[1,2,3]триазол-1-ил}-2-метилфенил)метанона (соединение 141),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{2-метил-5-[4-(2-пропиламиноэтил)-[1,2,3]триазол-1-ил]фенил}метанона (соединение 142),
[2-хлор-4-(4-фтор-2-метилфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 143),
[2-хлор-4-(2-метоксифениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 144),
[2-хлор-4-(4-хлор-2-метилфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 145),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[4-(2-этиламиноэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 147),
[4-(2,4-дифторфениламино)-2-метилфенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 148),
[4-(3-хлор-4-фторфениламино)-2-метилфенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 149),
{5-[4-(2-гидрокси-этил)-[1,2,3]триазол-1-ил]-2-метилфенил}-(2-метил-4-фениламинофенил)метанона (соединение 150),
[4-(3,4-дифторфениламино)-2-метилфенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 154),
[4-(3-хлор-2-метилфениламино)-2-метилфенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 156),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{2-хлор-5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]фенил}метанона (соединение 159),
[2-хлор-4-(3-фторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 160),
[2-хлор-4-(3-хлорфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 161),
[2-хлор-4-(2,3-дихлорфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 164),
[2-хлор-4-(2,5-дифторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 166) и
[2-хлор-4-(3,5-дифторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 167).
В еще одном примере настоящего изобретения соединений формулы Iа, по крайней мере, один из R5, R6, R7, или R8 не является водородом в том случае, когда R4 представляет собой NH2, или, по крайней мере, один из R4, R5, R6, или R7 не является водородом в том случае, когда R8 представляет собой NH2.
Способы получения
Соединения настоящего изобретения могут быть получены несколькими путями, хорошо известными специалисту в области техники, связанной с органическим синтезом. Соединения настоящего изобретения могут быть синтезированы с использованием способов, изложенных ниже, в совокупности со способами, известными в области техники синтетической органической химии, или вариаций их, которые принимаются во внимание специалистами в данной области техники. Предпочтительные методы включают те, которые описаны ниже, но ими не ограничиваются.
Соединения формулы Ia и Ib могут быть получены с использованием реакций и технологического оборудования, описанного в этом разделе. Реакции осуществляются в растворителях, которые являются подходящими для применяемых реагентов и материалов и которые пригодны для того, чтобы превращения были осуществлены. Также в описанных ниже синтетических методах следует понимать, что все предложенные реакционные условия, включая выбор растворителя, окружающая газообразная среда реакции, реакционная температура, продолжительность эксперимента и процедуры обработки, выбраны как стандартные условия реакции, которые должны быть полностью признаны каждым специалистом в этой области техники. Каждому специалисту в области техники органического синтеза понятно, что функциональные возможности, существующие для различных положений молекул, используемых как исходные соединения или как промежуточные соединения в синтезе, должны сочетаться с предложенными реагентами и реакциями. Не все соединения формулы I, попадающие под данный класс, могут сочетаться с некоторыми условиями реакции, необходимыми в некоторых описанных способах. Такие ограничения в заместителях или в функциональных группах, которые сочетаются с условиями реакции, должны быть вполне очевидными каждому специалисту в этой области техники и могут применяться альтернативные способы.
Соединения в соответствии с настоящим изобретением могут быть получены в процессе, включающем соединение алкина, имеющего концевую алкинильную группу, формулы IIa с азидом формулы IIIa, с образованием соединения формулы Ia, как это показано на схеме 1; или подобным образом в процессе, включающем соединение азида формулы IIb с алкином, имеющим концевую алкинильную группу, формулы IIIb, с образованием соединения формулы Ib, как это показано на схеме 1: где R1, R2, R3, R4, R5, R6, R7 и R8 таковы, как это определено выше, за исключением тех случаев, когда какие-либо заместители или функциональные группы, которые потенциально реакционоспособны в реакции соединения, могут быть защищены до осуществления реакции соединения, и защитные группы удаляются впоследствии.


FGI: взаимопревращение функциональных групп
R'1, R'2, R'3, R'4, R'5, R'6, R'7 и R'8 замещаются на R1, R2, R3, R4, R5, R6, R7 и R8 соответственно или на какую-либо подходящую FG (функциональную группу), которая может быть превращена в R1, R2, R3, R4, R5, R6, R7 и R8
Схема 1
Вышеупомянутая реакция соединения осуществляется путем использования способа образования 1,4-дизамещенных триазолов, хорошо известного любому специалисту в области техники органического синтеза (см., например, WO 03/101972, Angew. Chem. Int. Ed. 2002, 41, No.14, JOC 2002, 67, 3057-3064, и ссылки, там помещенные). Предпочтительным способом является катализируемый медью(I) способ, который включает соединение азида с алкином, имеющим концевую алкинильную группу, при комнатной температуре или более высокой температуре (например, до 80°С).
Различные источники меди могут быть использованы в процессе, примерами которых, не ограничивающими объем изобретения, являются Cu(I)I, Cu(I)Br, Cu(I)Cl, Cu(I)OAc и Cu(0). В настоящее время предпочтительным источником является Сu(II)SO4·5H2O в присутствии подходящего восстанавливающего агента типа аскорбата натрия. Количество источника меди, используемого в этом каталитическом процессе, обычно находится в пределах от 0,1 до 10% по молям относительно количества используемого алкина или азида.
Реакция обычно осуществляется при невысоких температурах (например, 25°С) в таких растворителях, как метанол, этанол, трет-бутанол, 1,4-диоксан, ацетонитрил, диметилсульфоксид (DMSO), ацетон, N,N-диметилформамид (DMF), N-метилпирролидон (NMP) или тетрагидрофуран (THF). Когда в качестве каталитической системы используется Cu(II)SO4·5H2O в присутствии восстанавливающего агента, тогда в реакцию обычно добавляются минорные количества воды (2-40%, об./об.).
Вышеупомянутое взаимодействие также может быть осуществлено некаталитически (без Cu), но термически, просто путем нагревания. Однако процесс также может приводить к 1,5-дизамещенным триазолам.
Соединения в соответствии с настоящим изобретением общей формулы IIa могут быть приготовлены несколькими способами, известными специалисту в области техники органического синтеза. Одна из удобных последовательностей превращений показана на схеме 2. Ключевая стадия включает соединение иодида общей формулы IV с этинилтриметилсиланом, обеспечивающее образование соединения общей формулы III. Соединение обычно осуществляется в присутствии каталитических количеств источника палладия (0), например, pd2(dba)3; каталитических количеств соли меди(I), например, иодид меди(I); и лиганда, например, трифенилфосфина для стабилизации каталитической системы. Реакция хорошо описана в литературе, также называется реакцией Соногашира (Sonogashira) (см., например,: Sonogashira, K. In Metal-Catalyzed Reactions, Diederich, F., Stang, P.J., Eds.; Wiley-VCH: New York, 1998). Защищенное соединение III затем может быть подвергнуто снятию защитных групп и превращению в соответствующее соединение с концевой ацетиленовой группой общей формулы IIa посредством обработки, например, K2CO3 в метаноле, при комнатной температуре.
Иодид общей формулы IV может быть получен стандартным диазотированием амина общей формулы V, за которым следует обработка образовавшейся диазониевой соли иодидом калия (см. получение 5 как не ограничивающий объема изобретения пример для общих применяемых подробностей проведения эксперимента). Амин общей формулы V может быть образован путем восстановления нитросоединения общей формулы VI с использованием стандартных восстанавливающих агентов. Примеры таких восстанавливающих агентов в настоящее время включают, но не ограничиваются ими, дигидрат хлорида олова, водород, формиат аммония или гидразингидрат и каталитическое количество палладия-на-угле. Азид общей формулы IIb может быть получен из амина общей формулы V путем обработки трифторметансульфонилазидом в присутствии каталитических количеств соли меди, например, пентагидрата сульфата меди(II), как это описано в литературе, например, Liu, Q.; Yitzhak, T.; Org. Lett. 2003, 5, 2571-2572.


FGI: взаимопревращение функциональных групп
R'1, R'2, R'3, R'4, R'5, R'6, R'7 и R'8 замещаются на R1, R2, R3, R4, R5, R6, R7 и R8 соответственно или на какую-либо подходящую FG (функциональную группу), которая может быть превращена в R1, R2, R3, R4, R5, R6, R7 и R8.
Схема 2
Соединения в соответствии с настоящим изобретением общей формулы VI могут быть получены несколькими способами, известными специалисту в области техники органического синтеза. Одна из удобных последовательностей превращений показана на схеме 3.
Первая ключевая стадия включает соединение йодида общей формулы IX с эфиром (активированной кислотой) общей формулы X с образованием бензофенона общей формулы VII, например, путем использования способа, описанного для получения других кетонов в J. Am. Chem. Soc. 1973, 95: 14, 4763-4765. Реакция соединения может быть активирована путем превращения йодида IX в реакционоспособный металлоорганический интермедиат, таким образом, как обработка изопропилмагнийхлоридом с образованием соответствующего магнийпроизводного. Смешивание реакционоспособного магнийпроизводного с эфиром общей формулы X дает продукт общей формулы VII.
Альтернативно реакционоспособное магнийпроизводное может быть трансметаллировано в производное, содержащее цинк, путем обработки цинковой солью, например, хлоридом цинка или ZnBr2 или ZnI2 и затем соединено с галогенидом кислоты, таким как хлорид кислоты для кислоты общей формулы XI, в присутствии каталитического количества системы Pd(0)/лиганд. Примеры таких палладиевых катализаторов включают, но не ограничиваются ими, тетракис(трифенилфосфин)палладий(0), тетракис(трифениларсин)палладий(0), дихлорбис(трифенилфосфин)палладий(II) или бензилхлорбис(трифенилфосфин)палладий(II). Альтернативно цинкорганическое соединение соединяется с галогенидом кислоты, таким как хлорид кислоты, в присутствии или при посредничестве эквимолярного или субстехиометрического, или каталитического количества соли меди (I) или (II), такой как ацетат меди(II) или растворимый комплекс СuCN·2LiCl или CuCN·2LiBr. Реакция сочетания обычно может быть проведена при комнатной температуре в инертных растворителях, таких как 1,4-диоксан, толуол, бензол и тетрагидрофуран, в инертной атмосфере, например, под аргоном или азотом.
Вторая ключевая стадия включает реакцию взаимодействия бромида общей формулы VII с амином общей формулы VIII с образованием аминобензофенона общей формулы VI. Реакция сочетания осуществляется путем использования способа образования дифениламинов, хорошо известного любому специалисту в области техники органического синтеза. Предпочтительным способом является катализируемый палладием способ аминирования, который включает соединение амина с арилгалогенидом (или арилтрифталатом) в присутствии основания, подходящего источника Pd и подходящего фосфинового лиганда в инертном растворителе.
Различные палладиевые соединения могут использоваться в процессе, не ограничивающими их примерами являются ацетат палладия(II), хлорид палладия(II), бромид палладия(II), дихлорбис(трифенилфосфин)палладия(II), тетракис(трифенилфосфин)палладия(0), трис(дибензилиденацетон)дипалладий(0). Предпочтительные фосфиновые лиганды включают, но не ограничиваются ими, рацемический или нерацемический 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (здесь и далее упоминается как BINAP), три-о-толилфосфин, три-трет-бутилфосфин, 1,1'-бис(дифенилфосфино)ферроцен, бис[(2-дифенилфосфино)фенил]эфир (DPEphos), 2-дициклогенсилфосфанил-2'-диметиламинобифенил, 2-(ди-трет-бутилфосфино)дифенил и 9,9-диметил-4,6-бис(дифенилфосфино)ксантен (Xantphos). Количество палладия и лиганда, применяемое в каталитическом процессе, обычно может быть в пределах от 0,1 до 10% по молям относительно количества используемого ароматического галогенида (или трифлата). Особенно предпочтительными апробированными основаниями в этом процессе являются натрий-трет-бутоксид (NaOt-Bu) и карбонат цезия (Cs2CO3), но другие основания также могут применяться. Реакция обычно осуществляется при повышенных температурах (80-120°С) в инертных растворителях, таких как 1,4-диоксан, толуол, бензол и тетрагидрофуран, в инертной атмосфере, например, аргона или азота.
Тиоэфиры общей формулы X, например, могут быть получены из кислот общей формулы XI путем обработки 2,2΄-дитиопиридином в присутствии трифенилфосфина (см., например, получение 1 для общих соответствующих неосвещенных экспериментальных подробностей), как это описано в Tetrahedron Letters Vol. 22, No. 46, pp.4647-4650, 1981. Другие общие методы для получения тиоэфиров общей формулы Х могут быть найдены, например, в Tetrahedron Letters No. 31, pp.2875-2878, 1979 и Org. Letters 2003, Vol. 5, No. 10, pp.1633-1635 и в помещенных там ссылках.

FGI: взаимопревращение функциональных групп
R'1, R'2, R'3, R'4, R'5, R'6, R'7 и R'8 замещаются на R1, R2, R3, R4, R5, R6, R7 и R8 соответственно или на какую-либо подходящую FG (функциональную группу), которая может быть превращена в R1, R2, R3, R4, R5, R6, R7 и R8.
Схема 3
Соединения в соответствии с настоящим изобретением в специальных случаях могут быть получены простым взаимопревращением функциональных групп (FGI), означающим стандартный процесс, известный специалисту в области техники органического синтеза, где функциональная группа в соединениях общей формулы I или I′ трансформируются в другую функциональную группу за одну или несколько синтетических стадий, что приводит к новому соединению общей формулы I. Примеры таких процессов включают, но не ограничиваются ими, гидролиз сложного эфира в основных условиях, приводящий к образованию кислоты, снятие метилэфирной защитной группы, приводящее к образованию фенола, путем обработки, например, бортрибромидом (BBr3) и, например, каталитическое гидрирование олефина с образованием насыщенного углеводорода. Не ограничивающимися только ими примерами таких трансформаций являются описанные в “Comprehensive Organic Transformations” R.C. Larock, VCH 1989 и помещенные там ссылки, которые таким образом включены в качестве ссылок в общие методики. В частности, применение обычных защитных групп в одной или в нескольких синтетических стадиях может оказаться целесообразным в синтезах соединений общей формулы I. Примеры таких общих защитных групп включают, но не ограничиваются ими, метиловые, этиловые, трет-бутиловые или бензиловые эфиры как защитные группы для гидроксильной группы; тетрагидропиранильные или силильные эфиры как защитные группы гидроксильной группы или концевой алкиновой.
Как показано на схеме 1, 2 или 3, каждое промежуточное соединение может быть трансформировано посредством FGI процесса, как описано выше, с образованием новых соединений с такой же общей формулой (например, гидроксигруппа может быть зщащищена трет-бутилдиметилсилиловым эфиром). Это только для иллюстрации универсальности в синтезах, и, в общем, описанная последовательность процессов является одной из нескольких возможных стратегий синтезов соединений настоящего изобретения. Это означает, что может быть более предпочтительно в некоторых случаях изменить последовательность процессов, описанных выше. Описанные последовательности процессов не должны рассматриваться как ограничения процессов получения соединений настоящего изобретения общей формулы Ia или Ib, и изменение реакционной последовательности может быть альтернативой для специалистов в области техники органического синтеза. Легко доступные интермедиаты могут быть исходной единицей для синтеза различных серий соединений, относящихся к общей формуле Ia и Ib.
Синтезы различных аминобензофенонов и общие способы, применимые в синтезах интермедиатов и бензофенонов настоящего изобретения, могут быть найдены, например, в патентах WO 98/32730, WO 01/05744, WO 01/05746, WO 01/05749, WO 01/05751, WO 01/05745, WO 01/42189, WO 01/90074, WO 02/083622, WO 03/018535, WO 02/076447 и WO 04/056762, и помещенные там ссылки, каждая из которых, таким образом, включена в данное описание в качестве ссылки.
Фармацевтические композиции
В другом аспекте изобретение относится к фармацевтической композиции, включающей в качестве активного компонента соединение формулы Ia или Ib вместе с фармацевтически приемлемыми вспомогательным формообразующим веществом, носителем или наполнителем. Кроме того, изобретение относится к применению соединения формулы Ia или Ib для приготовления лекарственных средств для профилактики, лечения или улучшения состояния при воспалительных заболеваниях или патологических состояниях.
Фармацевтические композиции изобретения могут быть в виде стандартных лекарственных форм, таких как таблетки, пилюли, капсулы, порошки, гранулы, эликсиры, сиропы, эмульсии, ампулы, суппозитории или парентеральные растворы, или суспензии для перорального, парентерального, офтальмического, трансдермального, интраартикулярного, локального, пульмонального, назального, буккального или ректального введения, или для какого-либо другого метода, предназначенного для технологии приготовления лекарственных средств на основе противовоспалительных соединений и в соответствии с приемлемой врачебной практикой, как это раскрыто в Remington: The Science and Practice of Pharmacy. 19th Ed., Mack Publishing Company, 1995. В композиции изобретениея активный компонент может присутствовать в количествах от приблизительно 0,01 до приблизительно 99%, а также от 0,1 до приблизительно 10% от массы композиции.
Для перорольного введения в форме таблеток или капсулы соединение формулы I целесообразно комбинировать с пероральным, нетоксичным, фармацевтически приемлемым носителем, таким как этанол, глицерин, вода или им подобные. Кроме того, к смеси могут быть добавлены подходящие связующие вещества, смазывающие вещества, дезинтегрирующие вещества, ароматизаторы и красители, поскольку это целесообразно. Подходящие связующие вещества включают, например, лактозу, глюкозу, крахмал, желатин, аравийскую камедь, трагакантовую камедь, альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль, воски или им подобные. Смазывающие вещества включают, например, олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат антрия, хлорид натрия или т.п. Дезинтегрирующие агенты включают, например, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь или им подобные. Дополнительные вспомогательные вещества для капсул включают макроголы или липиды.
Для приготовления твердых композиций, таких как таблетки, активное соединение формулы I смешивается с одним или более вспомогательными веществами, такими как описанные выше, и другими фармацевтическими разбавителями, такими как вода, чтобы сделать предварительную приготовленную композицию твердого лекарственного средства, содержащую гомогенную смесь, в которой соединение формулы I равномерно диспергировано по всей композиции, так, что композиция легко может быть разделена на равно эффективные стандартные лекарственные формы, такие как таблетки и капсулы. Предварительно приготовленная композиция затем может быть разделена на стандартные лекарственные формы, содержащие от приблизительно 0,05 до приблизительно 1000 мг, в частности, от приблизительно 0,1 до приблизительно 500 мг активного соединения изобретения.
Жидкие лекарственные формы как для перорального, так и для перентерального введения соединения изобретения включают, например, водные растворы, сиропы, водные или масляные суспензии и эмульсии с пищевыми маслами, такими как хлопковое масло, кунжутное масло, кокосовое или арахисовое масло. Подходящие диспергирующие или суспендирующие вещества для водных суспензий включают синтетические или натуральные камеди, такие как трагакант, альгинат, аравийская камедь, декстран, натрий-карбоксиметилцеллюлоза, желатин, метилцеллюлоза или поливинилпиролидон.
Для парентерального введения, например, внутримышечной, внутрибрюшинной, подкожной или внутривенной инъекции или инфузии фармацевтическая композиция предпочтительно включает соединение формулы I, растворенное или солюбилизированное в подходящем фармацевтически приемлемом растворителе. Для парентерального введения композиция изобретения может включать стерильный водный или неводный растворитель, в частности, воду, изотонический солевой раствор, изотонический раствор глюкозы, буферный раствор или другой растворитель, стандартно используемый для парентерального введения терапевтически активных веществ. Композиция может быть стерилизована, например, путем фильтрации через задерживающий бактерии фильтр путем добавления стерилизующего вещества к композиции, облучения композиции или нагревания композиции. Альтернативно для соединения изобретения может быть предусмотрено стерильное твердое приготовление, например, лиофилизованный порошок, который растворяют в стерильном растворителе непосредственно перед использованием.
Композиция, предназначенная для парентерального введения, может дополнительно включать в свой состав стандартные добавки, такие как стабилизаторы, буферы или консерванты, например, антиоксиданты, такие как метилгидроксибензоат или ему подобные.
Композиции для ректального введения могут быть в форме суппозиториев, включающих активный ингредиент и носитель, такой как какао-масло, или в форме клизмы.
Композиции, пригодные для интраартикулярного введения, могут быть в форме стерильных водных препаратов активного ингредиента, который может быть в микрокристаллической форме, например, в форме водной микрокристаллической суспензии. Липосомальные лекарственные формы или системы с биодеградируемым полимером также могут применяться для настоящего активного ингредиента как для интраактикулярного, так и для офтальмического введения.
Композиции, пригодные для топического введения, включая офтальмологическое лечение, включают жидкие или полужидкие препараты, такие как линименты, лосьоны, гели, аппликанты, эмульсии типа масло-в-воде или вода-в-масле, такие как кремы, мази и пасты; или растворы или суспензии, такие как капли. Для топического введения соединение формулы I обычно может присутствовать в количествах от 0,01 до 20% от массы композиции, так, от 0,1 до приблизительно 10%, но также может присутствовать и в количествах вплоть до приблизительно 50% от композиции.
Композиции для офтальмологического лечения предпочтительно могут дополнительно содержать циклодекстрин.
Композиции, пригодные для введения в носовую или ротовую полость или для ингаляции, включают порошок, саморазбрызгивающиеся или распыляемые лекарственные формы, такие как аэрозоли и пульверизаторы. Такие композиции могут включать соединение формулы I в количествах 0,01-20%, например 2% от массы композиции.
Композиция может дополнительно содержать один или несколько других активных компонентов, обычно применяемых в лечении различных инфекционных заболеваний и патологических состояний. Примерами таких дополнительных активных компонентов могут быть следующие, выбранные из группы, состоящей из глюкокортикоидов, витамина D и аналогов витамина D, антигистаминов, антагонистов фактора активации тромбоцитов (PAF), антихолинергических агентов, метилксантинов, β-адренергических агентов, ингибиторов COX-2, салицилатов, индометацина, флюфенаматов, напроксена, тимегадина, золото-хлористоводородного натрия, пеницилламина, веществ, понижающих содержание сывороточного холестерина, ретиноидов, солей цинка и салицилазосульфапиридина.
В дополнительном аспекте изобретение связано со способом лечения воспалительных заболеваний и патологических состояний, или офтальмологических заболеваний и патологических состояний, или рака, способ заключается во введении нуждающемуся в этом пациенту эффективных количеств соединения формулы I.
Приемлемые дозы соединения изобретения будут зависеть, между прочим, от возраста и состояния пациента, от серьезности заболевания, которое надо вылечить, и от других факторов, хорошо известных практикующему врачу. Соединение может вводиться либо перорально, парентерально, либо топически в соответствии с различными схемами применения, например, с ежедневной или еженедельной периодичностью. Обычно однократная доза выбирается в пределах от 0,01 до 400 мг/кг массы тела. Соединение может вводиться как болюс (т.е. полная дневная доза вводится однократно) или дробными дозами два или несколько раз в день.
Воспалительные заболевания или патологические состояния, лечение которых предусмотрено настоящими соединениями, - это воспалительные заболевания, при которых модуляция экспрессии и секреции цитокинов может быть опосредована МАР киназами, такими как р38 МАР киназа, как это обсуждалось выше. Примеры воспалительных заболеваний и патологических состояний, для которых предполагается опосредованное действие р38 МАР киназы, выбираются из группы, состоящей из астмы, артрита, включая ревматоидный артрит и спондилоартрит, подагры, атеросклероза, воспалительного заболевания пищеварительного тракта, болезни Крона, неврологических воспалений, воспалительных заболеваний глаз, пролиферативных и воспалительных кожных нарушений, таких как псориаз, атопический дерматит и обыкновенные угри, увеит, сепсис, септический шок и остеопороз.
Лечение дополнительно может включать введение одного или нескольких противовоспалительных активных компонентов, таких как глюкокортикоиды, витамин D и аналоги витамина D, антигистамины, антагонисты фактора активации тромбоцитов (PAF), антихолинергические вещества, метилксантины, β-адренергические вещества, ингибиторы COX-2, салицилаты, индометацин, флюфенаматы, напроксен, тимегадин, золото-хлористоводородный натрий, пеницилламин, вещества, понижающие содержание сывороточного холестерина, ретиноиды, соли цинка и салицилазосульфапиридин. Введение соединения настоящего изобретения и другого противовоспалительного компонента может быть либо одновременным, либо последовательным.
Предполагается лечение настоящими соединениями офтальмологических заболеваний и паталогических состояний, включая офтальмологические заболевания и патологические состояния неинфекционные (например, аллергические) конъюнктивит, ирит, кератит, увеит, склерит, эписклерит, симпатический офтальмит, блефарит или сухой кератоконъюнктивит.
Фармакологические способы
Для изучения воздействия соединений настоящего изобретения in vitro ингибирование секреции IL-1β и TNF-α определяли с использованием следующей методики:
Продуцирование цитокинов измеряли в среде стимулированных липополисахаридом (LPS) периферических кровяных моноядерных клеток. Моноядерные клетки были изолированы из человеческой периферической крови путем фракционирования с использованием Lymphoprep® (Nycomed, Norway) и суспендирования в RPMI 1649 (среда для культивирования) с сывороткой зародыша теленка (FCS, 2%) в концентрации 5×105 клеток/мл. Клетки инкубировали на планшетах с 24 ячейками в виде тканевой культуры, в 1-мл аликвотах. Тестируемые соединения растворяли в диметилсульфоксиде (DMSO, 10 мМ) и разбавляли средой. Соединения добавляли к клеткам за 30 мин, затем добавляли LPS (1 мг/мл конечная концентрация). Планшеты инкубировали 18 час и определяли концентрацию IL-1β и TNF-α в среде путем ферментсвязанного иммуносорбентного анализа. Половинные ингибирующие концентрации (IC50) соединений были подсчитаны. Результаты показаны в таблице 1.
соединениями настоящего изобретения
Ссылка на соединение а: (4-(2-аминофениламино)-2-хлор-2′-метилбензофенон, соединение 156, раскрытое в патенте WO 98/32730.
Ссылка на соединение b: 2′-[3-хлор-4-(2-метилбензоил)фениламино]октананилид, соединение 102, раскрытое в патенте WO 01/05746.
Ссылка на соединение c: 1-ацетоксиметил N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат, соединение 109, раскрытое в патенте WO 01/05749.
Ссылка на соединение d: 1-этил-3-[2-[3-хлор-4-(2-метилбензоил)фениламино]-5-фторфенил]мочевина, соединение 114, раскрытое в патенте WO 01/05751.
Ссылка на соединение e: 2,2,2-трифтор-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]-5-фторфенил]ацетамид, соединение 102, раскрытое в патенте WO 01/05745.
Ссылка на соединение f: 2-хлор-4-(3-фтор-2-метилфениламино)-2′-метилбензофенон, соединение 131, раскрытое в патенте WO 01/42189.
Эти результаты показывают, что соединения настоящего изобретения являются сильнодействующими ингибиторами продуцирования IL-1β и TNF-α и проявляют неожиданно более высокую активность в ингибировании цитокинов, чем соединения, на которые ссылаются, это делает их потенциально применимыми в лечении воспалительных заболеваний.
Кроме того, новые производные аминобензофенона могут иметь неожиданно полезные фармакокинетические свойства, такие как абсорбция и метаболическая стабильность.
Анализ р38α МАР киназы
Клеточная культура
COS-1 клетки (полученные из фибробластоподобных клеток почек африканской зеленой обезьяны, содержащих Т антиген дикого типа под контролем SV40 промотора) получены от АТСС (ATCC № CRL-1650) и выращены на среде для культивирования (DMEM без фенолового красного, 10% FCS, 2 мМ L-глутамина, 100U пенициллина и 100 мкг стрептомицина/мл) при 37°С с 5% СО2. Клетки дважды в неделю пересевали с трипсинацией (0,25% трипсина, 1 мМ EDTA в PBS) и распределяли 1:10. Среду меняли каждые два или три дня. Клеточная линия регулярно тестировалась с помощью включения PCR праймера микоплазмы (Stratagene) и обнаружения отсутствия содержания Mycoplasma. Среда тканевой клеточной культуры, FCS, L-глутамин и пенициллин, и стрептомицин получены от Bribco BRL Gaithersburg, MD, USA.
Транзиторная экспрессия СОS-1 клеток
В течение дня одинаковые СОS-1 клетки высевали в 143 см2 чашки Петри с плотностью 2×104клеток/см2 среды культивирования. На день 2 клетки были подвергнуты котрансфекции с 5 мкг (общее количество) экспериментальной плазмидной ДНК, экспрессирующей FLAG-p38α и FLAG-MKK6 (EE). Плазмиды были введены в СОS-1 клетки в бессывороточной среде с использованием DOTAP™ (Boehringer-Mannheim, Mannheim, Germany). Плазмидная ДНК была приготовлена и очищена с использованием набора QIAGEN EndoToxin-free Maxiprep-500 (Hilden, Germany). Вкратце ДНК и DOTAP™ перемешивали ровно 15 мин при 37°С в среде СО2 в инкубаторе. Трансфекционную смесь затем переносили в пробирки объемом 15 мл и добавляли к трансфекционной смеси трансфекционную среду (DMEM с L-глутамином и пен./стреп., но без сыворотки), с последующим добавлением клеточного монослоя. После 4 час инкубации с DOTAP™ и плазмидами к клеткам добавляли среду с удвоенным содержанием сыворотки, доводя конечную концентрацию сыворотки до 10%. Клетки затем инкубировали 24 час до проведения реакции с киназой.
Иммунопреципитация
После 24 инкубации реакцию останавливали, помещая чашки Петри в баню со льдом. Среду удаляли с помощью аспиратора и клеточный монослой промывали однократно охлажденным во льду PBS (137 мМ NaCl, 1,5 мМ KH2PO4, 2,7 мМ KCl, 8,1 мМ Na2HPO4·2H2O) и затем солюбилизировали в течение 10 мин в 1,5 мл добавленного лизирующего буфера (50 мМ HEPES, pH 7,5, 150 мМ NaCl, 10 мМ EDTA, 10 мМ Na4P2O7, 100 мМ NaF, 2 мМ Na3VO4, 1% Тритон-X-100, Пефаблок 500 мкМ, Лейпептин 10 мкг/мкл, Апротинин 10 мкг/мкл). Клеточный монослой соскабливали резиновым скребком и переносили в пробирку Эппендорф. Солюбилизированные клетки отделяли от примесей центрифугированием при 10000×g 10 мин при 4°С. Супернатант переносили в 50 мкл гранул промытой протеин G сефарозы в HNT-буфере (30 мМ HEPES, pH 7,5, 30 мМ NaCl, 0,1% Тритон X-100) и инкубировали с 2 мкг/образец моноклональных антител анти-FLAG™ M2 (индуцированных против FLAG-эпитопа, NH2-Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys-COOH) 1 час при комнатной температуре. Моноклональные антитела анти-FLAG™ M2 были получены от Sigma (cat.№ F-3165). Приблизительно 60 мкг белка из очищенного клеточного лизата добавляли для предварительной абсорбции антител анти-FLAG™ на гранулах протеин G сефарозы и инкубировали 90 мин при 4°С в смесителе пробы крови. После периода иммунопреципитации гранулы сефарозы дважды промывали лизирующим буфером и дважды - буфером для киназной реакции (25 мМ НЕРЕS рН 7,5, 10 мМ ацетата магния, 50 мкМ АТФ).
Инкубация соединений с очищенной р38α киназой
Предварительно промытые иммунопреципитированные анти-FLAG-р38, абсорбированные на гранулах протеин G сефарозы, дважды промывали в 1×киназном буфере (25 мМ НЕРЕS рН 7,5, 10 мМ ацетата магния, 50 мкМ АТФ) и супернатант удаляли с помощью аспиратора. Соединения разбавляли 1×киназным буфером до целесообразной концентрации. Соединения добавляли к промытым иммунопреципитированным и активированным FLAG-р38, абсорбированным на гранулах протеин G сефарозы, на 30 мин при 30°С в объеме 100 мкл. Каждые 10 мин пробирки Эппиндорф проверялись, чтобы убедиться, что гранулы и соединения находятся в растворе. После 30 мин инкубации гранулы осаждали и супернатант удаляли аспиратором.
р38α МАР киназная реакция
Киназная реакция начиналась добавлением 1 мкг GST-ATF-2 (Santa Cruz, LaJolla, CA USA, cat.№ sc-4114) вместе с 2 мкКюри γ-32P-ATP в 1×киназном буфере на каждый образец. Реакцию проводили 30 мин при 30°С и ее останавливали добавлением 40 мкл 2×SDS-образца буфера к киназной реакции. Образцы кипятили, встряхивали и разделяли на 15% SDS-PAGE. Высушенный SDS-PAGE гель экспонировали на экране визуализации фосфора и радиоактивные PNAS-1 полосы количественно анализировали с помощью STORM860 Phospho-Imager (Molecular Dynamics, Sunnyvale, CA, USA) c использованием ImageQuaNT программного обеспечения.
По данным этого количественного анализа было установлено, что соединение 102 является сильным ингибитором р38 МАР киназы.
In vivо cкрининговая модель LPS-индуцированного образования TNF-α у мышей
Изучение воздействия соединений настоящего изобретения in vivо, in vivо cкрининговая модель LPS-индуцированной выработки TNF-α у мышей были организованы следующим образом: группы из 6 мышей (С3Н/НеN, самки, 8 недель (20 г), Bomholtgaard) получали дозы тестируемых соединений в суспензионной среде за 1 час до введения LPS (LPS из E.coli 055:B5, L-4005, Sigma). В момент времени 0 мыши получали инициирующую продуцирование дозу 1,0 мг LPS/кг. После анестезии с Hypnorm/Dormicum у мышей отбирали кровь из периорбитального венозного сплетения спустя 80-90 мин после введения LPS. Образцы крови отбирались в стабилизированные EDTA пробирки и центрифугировались при 4000 об/мин в течение 10 мин при 4°С. Уровень TNF-α в плазме анализировали посредством метода твердофазного иммуноферментного анализа ELISA. В качестве вещества сравнения использовали cоединение 156 патента WO 98/32730. Уровень TNF-α в плазме определяли с использованием многослойного метода ELISA. Титрационные микропланшеты покрывали моноклональными антителами против мышиного TNF-α, промывали и блокировали казеиновым буфером. Образцы стандартного рекомбинантного TNF-α добавляли в ячейки титрационных микропланшет и инкубировали. Все стандарты тестировали в трех экземплярах, все образцы плазмы - в одном. После инкубации образца и стандарта планшеты промывали и инкубировали с биотинилированными поликлональными вторичными антителами против мышиного TNF-α и промывали. Ферментный конъюгат добавляли во все ячейки и инкубировали. Добавляли субстрат и ферментативно/субстратную реакцию останавливали через 15 мин при комнатной температуре с помощью 1М H2SO4. Проявление цвета (оптическую плотность OD) измеряли при 450 нм методом ELISA планшет-ридер и базовое фоновое значение OD при 620 нм вычитали. Эксперименты считались апробированными, если группа, обработанная упомянутым соединением, показывала существенное ингибирование (р<0,05) образования TNF-α в сравнении с LРS обработанной контрольной группой. Полученные результаты для тестированных соединений указаны как процент ингибирования в сравнении с LРS обработанной контрольной группой. Соединения тестировали в количестве 1 мг/кг (п.о.). Применяли тест Манна-Уитни (Mann-Whitney) для сравнения группы, обработанной лекарством, с LРS обработанной контрольной группой (р<0,05). Результаты представлены в таблице 3.
Ссылка на соединение а: (4-(2-аминофениламино)-2-хлор-2′-метилбензофенон, соединение 156, раскрытое в патенте WO 98/32730 (тестировали в количестве 10 мг/кг интраперитониально).
Результаты демонстрируют, что соединения настоящего изобретения неожиданно показывают улучшенную биологическую активность in vivо из-за ингибирования LPS-индуцированной выработки TNF-α у мышей в сравнении с соединением, на которое ссылаются, что делает их потенциально применимыми в лечении воспалительных заболеваний.
Изобретение описывается дополнительно в нижеследующих ранее не описанных в литературе примерах, которые никоим образом не предназначены для ограничения объема изобретения, как описано в формуле изобретения.
ПРИМЕРЫ
Общий
Все температуры плавления нескорректированы. Для спектров 1Н ядерного магнитного резонанса (ЯМР) (300 МГц) и 13С ЯМР (75,6 МГц) приведены величины химических сдвигов (δ) (в м.д.) за исключением иных специальных случаев; в растворах дейтерохлороформа относительно внутреннего стандарта тетраметилсилана (δ = 0,00), или хлороформа (δ = 7,26), или дейтерохлороформа (δ = 76,81 для 13С ЯМР). Величины для мультиплетов, либо разрешенных (дублет (d), триплет (t), квартет (q)), либо - нет (m) при приблизительно срединной точке приведены без указания интервала. Все использованные органические растворители были безводными. Хроматографию проводили на силикагеле с использованием флэш-метода. Целесообразные смеси этилацетата, дихлорметана, метанола и петролейного эфира (40-60) применяли в качестве элюентов, без указания иных случаев.
Использованы нижеследующие сокращения:
Таблица 4
Представленные примеры соединений общей формулы I



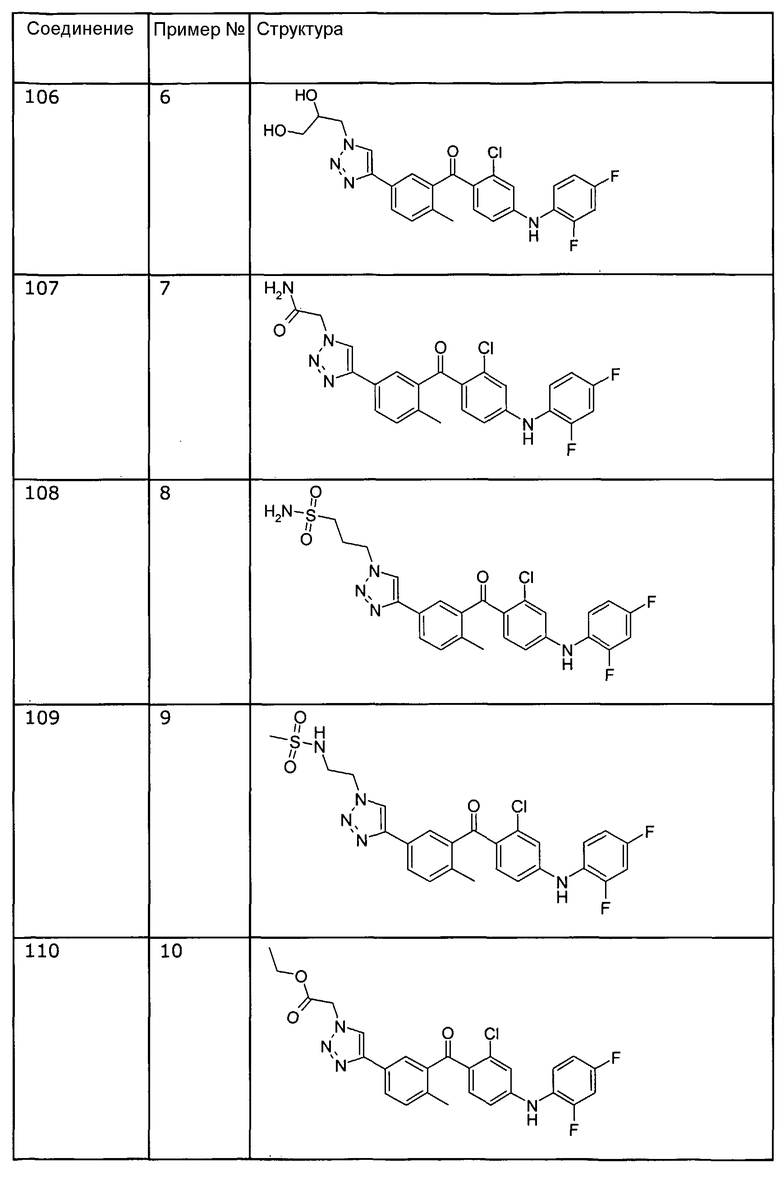






Получение 1:
S-пиридин-2-иловый эфир 2-метил-5-нитротиобензойной кислоты (соединение 401)
2-Метил-5-нитробензойная кислота (22,5 г, 124 ммоль), 2,2'-дитиопиридин (27,5 г, 124 ммоль) и трифенилфосфин (32,6 г, 124 ммоль) растворяли в CH3CN (650 мл). Раствор перемешивали при комнатной температуре в течение 18 час. Реакционную смесь фильтровали и твердый остаток промывали небольшим количеством CH3CN. Это дает указанное в заголовке соединение в виде бесцветного и твердого вещества.
Получение 2:
(4-бром-2-хлорфенил)-(2-метил-5-нитрофенил)метанон (соединение 402)
Реакция протекала в атмосфере аргона с использованием сухой стеклянной посуды.
4-Бром-2-хлорйодбензен (25,5 г, 80,9 ммоль) растворяли в сухом ТГФ (400 мл) и охлаждали до -60°С. Изопропилмагнийхлорид (2 М в ТГФ, 40,4 мл, 80,9 ммоль) добавляли при перемешивании в течение 30 мин. Реакционную смесь оставляли для нагревания до температуры -40°С и смесь перемешивали при -40°С в течение 4 час. Соединение 401 (22,2 г, 80,9 ммоль) добавляли к смеси и перемешивали при -40˚С в течение 3 час, после чего оставляли для нагревания до комнатной температуры и перемешивали в течение 17 час. Насыщенный водный раствор NH4Cl (200 мл) добавляли и смесь перемешивали в течение 1 час. Фазы разделяли и водную фазу экстрагировали Et2O (4×100 мл). Объединенные органические фазы промывали солевым раствором, сушили (MgSO4), фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией, используя CH2Cl2/петролейный эфир (40-60) 2:3 в качестве элюента для выделения указанного в заголовке соединения в виде кристаллического соединения желтого цвета.
Получение 3:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-(2-метил-5-нитрофенил)метанон (соединение 403)
Соединение 402 (5,4 г, 15,2 ммоль) растворяли в сухом 1,4-диоксане (150 мл) в 200-мл сосуде с завинчивающейся пробкой. 2,4-Дифторанилин (1,7 мл, 16,7 ммоль) добавляли и аргон продували через смесь. CsCO2 (14,9 г, 45,7 ммоль), BINAP (0,38 г, 0,6 ммоль) и Pd(OAc)2 (0,14 г, 0,6 ммоль) добавляли, смесь продували аргоном и сосуд с завинчивающейся крышкой закрывали. Смесь перемешивали при 100°С в течение 7 час. Реакционную смесь выливали в воду (100 мл) и EtOAc (200 мл). Водную фазу экстрагировали EtOAc (×3) и объединенные органические фазы промывали солевым раствором, сушили(MgSO4), фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией, используя CH2Cl2/петролейный эфир (40-60) 2:3->1:1->1:0, с последующим использованием EtOAc в качестве элюента для выделения указанного в заголовке соединения в виде кристаллического соединения желтого цвета.
Получение 4:
(5-Амино-2-метилфенил)-[2-хлор-4-(2,4-дифторфениламино)фенил]метанон (соединение 404)
Соединение 403 (6,0 г, 14,9 ммоль) растворяли в МеОН (350 мл). Добавляли цинковую пыль (12,69 г, 194 ммоль) и NH4Cl (5,59 г, 104 ммоль). Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 1 час. Смесь фильтровали и промывали МеОН. Фильтрат концентрировали и твердый остаток растворяли в EtOAc (150 мл) и насыщенном водном растворе Na2CO3 (100 мл). Водную фазу экстрагировали EtOAc и объединенные органические фазы сушили (MgSO4), фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией, используя CH2Cl2/петролейный эфир (40-60) 1:2 в качестве элюента для выделения указанного в заголовке соединения в виде слегка окрашенного кристаллического соединения.
Получение 5:
[2-Хлор-4-(2,4-дифтор-фениламино)-фенил]-(5-йод-2-метилфенил)метанон (соединение 405)
Соединение 404 (0,62 г, 1,66 ммоль) растворяли в ацетоне (14 мл). Концентрированную HCl (37%, 0,69 мл, 8,3 ммоль) добавляли и раствор охлаждали на бане со льдом. NaNO2 (0,14 г, 1,99 ммоль) растворяли в H2O (1 мл) и добавляли к вышеупомянутому раствору в течение 15 мин. Внутренняя температура поддерживалась при 0-2°С в процессе добавления. Суспензию перемешивали на ледяной бане в течение 0,5 час, после чего добавляли по каплям раствор КI (0,41 г, 2,45 ммоль) и I2 (0,31 г, 1,22 ммоль) в H2O (4 мл) в течение 5 мин. Смесь перемешивали при 0°С в течение 2 час. H2O (20 мл) и EtOAc (20 мл) добавляли и перемешивали, и фазы разделяли. Органические фазы промывали водным NaHSO3, затем водным Na2СO3, сушили (MgSO4), фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией, используя CH2Cl2/петролейный эфир (40-60) 1:5 для выделения указанного в заголовке соединения в виде слегка окрашенного кристаллического соединения.
Получение 6:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-(2-метил-5-триметилсиланилэтинилфенил)метанон (соединение 405)
Соединение 405 (400 мг, 0,83 ммоль) и этинилтриметилсилан (115 мл, 0,83 ммоль) растворяли в дегазированном триэтиламине (11 мл). Трифенилфосфин (21,7 мг, 0,083 ммоль), pd2(dba)3 (15 мг, 0,017 ммоль) и иодид меди (I) (3 мг, 0,017 ммоль) добавляли затем к раствору. Колбу закрывали, наполнив аргоном, и затем перемешивали при 90°С в течение 18 час. Реакционную смесь фильтровали через декалин и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 25:75 в качестве элюента для выделения указанного в заголовке соединения в виде сиропа.
Получение 7:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-(5-этинил-2-метилфенил)метанон (соединение 407)
Раствор соединения 406 (426 мг, 0,94 ммоль) и К2CO3 (195 мг, 1,41 ммоль) в метаноле (4,0 мл) перемешивали при комнатной температуре в течение 5 час. Реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного указанного в заголовке соединения. Продукт использовали без дальнейшей очистки.
2-(2-Азидоэтокси)тетрагидропиран (соединение 108)
Смесь 2-(2-бромэтокси)тетрагидропирана (1,00 мл, 6,62 ммоль), NaN3 (4,34 г, 66 ммоль) и тетрабутиламмонийиодида (245 мг, 0,66 ммоль) в DMF (7,0 мл) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 20:80 в качестве элюента для выделения указанного в заголовке соединения в виде бесцветного масла.
Пример 1:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-(2-метил-5-{1-[2-(тетрагидропиран-2-илокси)этил]-1Н-[1,2,3]триазол-4-ил}фенил)метанон (соединение 101)
Соединение 407 (300 мг, 0,79 ммоль) и соединение 408 (135 мг, 0,79 ммоль) растворяли в этаноле (6,0 мл). Свежеприготовленный раствор пентагидрата сульфата меди(II) (7,8 мг, 0,031 ммоль) и аскорбата натрия (31 мг, 0,16 ммоль) в воде (0,9 мл) добавляли к реакционной смеси. Колбу закрывали и перемешивали в течение 48 час при комнатной температуре. Реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 50:50 в качестве элюента для выделения указанного в заголовке соединения в виде сиропа светло-коричневого цвета.
13C ЯМР (CDCl3) δ 196,1, 159,1 (дд), 155,5 (дд), 147,8, 146,9, 139,8, 137,7, 135,3, 133,7, 131,9, 129,4, 128,3, 127,9, 126,5, 124,4 (дд), 124,3 (дд), 120,8, 116,3, 112,8, 111,6 (дд), 104,9 (дд), 99,1, 65,8, 62,4, 50,5, 30,4, 25,2, 20,2, 19,4.
Пример 2:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(2-гидроксиэтил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанон (соединение 102)
Раствор соединения 101 (350 мг, 0,63 ммоль) в метаноле (4,0 мл) добавляли к толуол-4-сульфоновой кислоте (60 мг, 0,32 ммоль) и смесь перемешивали в течение 7 час при комнатной температуре. Реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали NaOH (водным, 2М), водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 25:75 в качестве элюента для выделения указанного в заголовке соединения в виде пены желтого цвета.
13C ЯМР (CDCl3) δ 196,2, 159,2 (дд), 155,6 (дд), 148,1, 146,7, 139,9, 137,6, 135,2, 133,8, 131,8, 128,9, 127,8, 126,2, 124,6 (дд), 124,3 (дд), 121,1, 116,2, 112,7, 111,6 (дд), 104,9 (дд), 61,1, 52,8, 20,1.
Получение 9:
2-(3-Азидопропокси)тетрагидропиран (соединение 409)
Смесь 2-(3-хлорпропокси)тетрагидропирана (6,28 г, 35,2 ммоль), NaN3 (11,4 г, 176 ммоль) и иодида калия (584 мг, 3,52 ммоль) в DMF (50 мл) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 15:85 в качестве элюента для выделения указанного в заголовке соединения в виде бесцветного масла.
Пример 3:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-(2-метил-5-{1-[3-(тетрагидропиран-2-илокси)пропил]-1Н-[1,2,3]триазол-4-ил}фенил)метанон (соединение 103)
Реакцию осуществляли подобно тому, как описано в получении соединения 101, используя соединение 407 (0,44 ммоль) и соединение 409 (0,44 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 10:90 до 50:50 в качестве элюента для выделения указанного в заголовке соединения в виде бесцветной пены.
13C ЯМР (CDCl3) δ 196,1, 147,8, 146,9, 139,8, 137,6, 135,3, 133,7, 131,9, 129,4, 128,2, 127,9, 126,4, 124,4 (дд), 124,3 (дд), 120,2, 116,3, 112,8, 111,6 (дд), 104,9 (дд), 99,4, 63,8, 62,9, 47,5, 30,7, 30,5, 25,4, 20,2, 19,9.
Пример 4:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(3-гидроксипропил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанон (соединение 104)
Реакцию осуществляли подобно тому, как описано в получении соединения 102, используя соединение 103 (0,2 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 50:50 до 100:0 в качестве элюента с получением указанного в заголовке соединения в виде бесцветной пены.
13C ЯМР (CDCl3) δ 196,1, 159,2 (дд), 155,6 (дд), 148,0, 146,9, 139,9, 137,7, 135,3, 133,8, 131,9, 129,1, 128,0, 127,9, 126,4, 124,5 (дд), 124,3 (дд), 120,3, 116,3, 112,8, 111,6 (дд), 104,9 (дд), 58,8, 47,0, 32,6, 20,2.
Получение 10:
4-Азидометил-2,2-диметил-[1,3]диоксолан (соединение 410)
Реакцию осуществляли подобно тому, как описано в получении соединения 408, используя 2,2-диметил-[1,3]диоксолан-4-илметиловый эфир толуол-4-сульфоновой кислоты (37,8 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 20:80 в качестве элюента с получением указанного в заголовке соединения в виде бесцветной пены.
Пример 5:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(2,2-диметил-[1,3]диоксолан-4-илметил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанон (соединение 105)
Реакцию осуществляли подобно тому, как описано в получении соединения 101, используя соединение 407 (1,37 ммоль) и соединение 410 (1,62 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 20:80 до 35:65 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
13C ЯМР (ДМСО-d6) δ 194,9, 158,7 (дд), 155,7 (дд), 149,4, 145,2, 139,8, 135,9, 133,7, 133,7, 131,7, 128,2, 127,1, 126,5, 126,5 (дд), 125,0, 124,2 (дд), 122,3, 114,8, 111,9 (дд), 111,8, 109,0, 105,0 (дд), 73,7, 65,8, 52,0, 26,4, 25,1, 19,4.
Пример 6:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(2,3-дигидроксипропил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанон (соединение 106)
Раствор соединения 105 (535 мг, 1,16 ммоль) в ТГФ (6,0 мл) добавляли к водной НСl (1М, 6 мл) и смесь перемешивали в течение 24 час при комнатной температуре. Реакционную смесь выливали в смесь EtOAc/насыщенный NaHCO3. Водную фазу промывали дополнительным количеством EtOAc. Объединенную органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя МеОН/DCM от 2:98 до 10:90 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
13C ЯМР (ДМСО-d6) δ 194,9, 158,7 (дд), 155,7 (дд), 149,3, 145,0, 139,8, 135,7, 133,7, 133,7, 131,6, 128,4, 127,1, 126,6, 126,5 (дд), 124,9, 124,2 (дд), 122,3, 114,8, 112,0 (дд), 111,8, 105,0 (дд), 70,3, 63,2, 53,0, 19,4.
Получение 11:
2-Азидоацетамид (соединение 411)
Смесь 2-хлорацетамида (2,00 г, 21,4 ммоль), NaN3 (6,95 г, 107 ммоль) и тетрабутиламмонийиодида (790 мг, 2,14 ммоль) в DMF (30,0 мл) перемешивали при 50°С в течение 48 час. Реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт использовали без дальнейшей очистки. Неочищенный продукт содержал значительные количества DMF (приблизительно 6 экв.).
Пример 7:
2-(4-{3-[2-Хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил]ацетамид (соединение 107)
Реакцию осуществляли подобно тому, как описано в получении соединения 101, используя соединение 407 (0,44 ммоль) и соединение 411. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя МеОН/DCM от 0:100 до 10:90 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
13C ЯМР (ДМСО-d6) δ 194,9, 167,1, 158,7 (дд), 155,7 (дд), 149,3, 145,2, 139,8, 135,9, 133,7, 133,7, 131,7, 128,2, 127,1, 126,6, 126,4 (дд), 125,0, 124,2 (дд), 123,0, 114,9, 112,0 (дд), 111,8, 105,0 (дд), 51,5, 19,4.
Получение 12:
3-Азидопропан-1-сульфоновой кислоты амид (соединение 412)
Реакцию осуществляли подобно тому, как описано в получении соединения 411, используя амид 3-хлорпропан-1-сульфоновой кислоты (19,0 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 35:65 до 65:35 в качестве элюента с получением указанного в заголовке соединения в виде бесцветного масла.
Пример 8:
3-(4-{3-[2-Хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил]пропан-1-сульфоновой кислоты амид (соединение 108)
Реакцию осуществляли подобно тому, как описано в получении соединения 101, используя соединение 407 (1,37 ммоль) и соединение 412 (2,79 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 65:35 до 85:15 в качестве элюента с получением указанного в заголовке соединения в виде почти белого твердого вещества.
13C ЯМР (ДМСО-d6) δ 194,9, 158,8 (дд), 155,7 (дд), 149,4, 145,5, 139,9, 135,9, 133,7, 133,7, 131,7, 128,2, 127,1, 126,5, 126,4 (дд), 124,9, 124,1 (дд), 121,6, 114,8, 111,9 (дд), 111,8, 105,0 (дд), 51,4, 47,9, 24,6, 19,4.
Получение 13:
N-(2-Азидоэтил)метансульфонамид (соединение 413)
В 100-мл колбу помещали гидрохлорид 2-хлорэтиламина (5,0 г, 43,1 ммоль) и дихлорметан (50 мл). К суспензии добавляли N-метилморфолин (10 мл, 91 ммоль), при этом поддерживая температуру от -3 до 5°С. Метансульфонилхлорид (4,0 мл, 51,7 ммоль) медленно добавляли к реакционной смеси. Через 2 час реакционную смесь промывали водой, 4N HCl и водой. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный сульфонамид (3,1 г) перерастворяли в DMF (8,0 мл). NaI (327 мг, 1,97 ммоль) и NaN3 (1,92 г, 29,5 ммоль) добавляли к раствору. Реакционную смесь перемешивали в течение 48 час при 50°С и затем выливали в смесь EtOAc/вода. Органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт использовали без дальнейшей очистки.
Пример 9:
N-[2-(4-{3-[2-Хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил]этил]метансульфонамид (соединение 109)
Реакцию осуществляли подобно тому, как описано в получении соединения 101, используя соединение 407 (0,87 ммоль) и соединение 413 (1,3 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 65:35 до 85:15 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества почти белого цвета.
13C ЯМР (ДМСО-d6) δ 194,9, 158,7 (дд), 155,7 (дд), 149,4, 145,3, 139,8, 135,9, 133,7, 133,7, 131,7, 128,2, 127,1, 126,5, 126,4 (дд), 124,9, 124,1 (дд), 121,9, 114,8, 111,9 (дд), 111,8, 105,0 (дд), 49,8, 42,2, 39,5, 19,4.
Пример 10:
Этиловый эфир (4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил]уксусной кислоты (соединение 110)
Соединение 407 (243 мг, 0,64 ммоль) и раствор этилового эфира азидоуксусной кислоты (0,7 ммоль) в толуоле (0,60 мл) растворяли в ацетоне (3,5 мл). Свежеприготовленный раствор пентагидрата сульфата меди(II) (7,0 мг, 0,026 ммоль) и аскорбата натрия (25 мг, 0,13 ммоль) в воде (0,5 мл) добавляли к реакционной смеси. Колбу закрывали и перемешивали в течение 24 час при комнатной температуре в атмосфере аргона.
Реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 5:95 до 60:40 в качестве элюента с получением указанного в заголовке соединения в виде пены светло-желтого цвета.
13C ЯМР (CDCl3) δ 196,0, 166,3, 159,1 (дд), 155,5 (дд), 147,8, 147,5, 139,9, 137,9, 135,3, 133,7, 131,9, 129,3, 128,0, 127,9, 126,6, 124,4 (дд), 124,3 (дд), 121,0, 116,4, 112,9, 111,6 (дд), 104,9 (дд), 62,5, 51,0, 20,2, 14,1.
Пример 11:
(4-{3-[2-Хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил]уксусная кислота (соединение 111)
Раствор соединения 110 (236 мг, 0,46 ммоль) в МеОН (3,0 мл) добавляли к LiOH (55 мг, 2,31 ммоль) и воде (0,3 мл). Реакционную смесь перемешивали в течение 2 час с обратным холодильником. Реакционную смесь выливали в смесь EtOAc/насыщенный раствор NaCl. Добавляли водную HCl (1N, 0,5 мл). Водную фазу промывали дополнительным количеством EtOAc. Объединенную органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией, используя смесь МеОН/DCM/уксусная кислота 400:2:1 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
13C ЯМР (ДМСО-d6) δ 194,9, 168,4, 158,7 (дд), 155,7 (дд), 149,3, 145,3, 139,8, 136,0, 133,7, 133,7, 131,7, 128,1, 127,1, 126,5, 126,4 (дд), 125,0, 124,2 (дд), 122,8, 114,8, 112,0 (дд), 111,8, 105,0 (дд), 50,9, 19,4.
Пример 12:
2-(4-{3-[2-Хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил]-N-этилацетамид (соединение 112)
К раствору соединения 111 (39 мг, 0,08 ммоль) в DMF (1,0 мл) добавляли этиламингидрохлорид (20 мг, 0,08 ммоль), FDPP (43 мг, 0,11 ммоль) и DIEA (68 мкл, 0,4 ммоль). Колбу продували аргоном и реакционную смесь перемешивали при комнатной температуре в течение 72 час и затем выливали в смесь воды (4 мл), HCl (4N, 2 мл) и EtOAc. Фазы разделяли. Органическую фазу концентрировали на силикагеле в вакууме. Неочищенный продукт очищали флэш-хроматографией, элюируя EtOAc/петролейный эфир (40-60) от 50:50 до 100:0 в качестве элюента с получением указанного в заголовке соединения в виде пены белого цвета.
13C ЯМР (ДМСО-d6) δ 194,9, 164,8, 149,3, 145,2, 139,8, 135,9, 133,7, 133,7, 131,7, 128,2, 127,1, 126,6, 126,4 (дд), 125,0, 124,2 (дд), 123,0, 114,8, 111,9 (дд), 111,8, 105,0 (дд), 51,7, 33,6, 19,4, 14,4.
Пример 13:
2-(4-{3-[2-Хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил]-N-(2-гидрокси-1,1-диметилэтил)ацетамид (соединение 113)
Реакцию осуществляли подобно тому, как описано в получении соединения 112, используя соединение 111 (0,08 ммоль) и 2-амино-2-метил-1-пропанол (0,08 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 50:50 до 100:0 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества почти желтого цвета.
13C ЯМР (ДМСO-d6) δ 8,74 (с, 1Н), 8,50 (с, 1Н), 7,90 (дд, 1H), 7,85 (ушир.с, 1H), 7,75 (д, 1Н), 7,50-7,33 (м, 4H), 7,11 (м, 1Н), 6,83 (м, 1Н), 6,78 (м, 1Н), 5,07 (с, 2H), 4,80 (т, 1Н), 3,40 (д, 2H), 2,33 (с, 3H), 1,21 (с, 6H).
Пример 14:
2-(4-{3-[2-Хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил]-1-пирролидин-1-илэтанон (соединение 114)
Реакцию осуществляли подобно тому, как описано в получении соединения 112, используя соединение 111 (0,12 ммоль) и пиролидин (0,12 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя МеОН/EtOAc от 0:100 до 5:95 в качестве элюента с получением указанного в заголовке соединения в виде сиропа почти желтого цвета.
13C ЯМР (CDCl3) δ 196,0, 163,1, 159,0 (дд), 155,4 (дд), 147,8, 147,1, 139,7, 137,9, 135,2, 133,7, 131,9, 129,3, 128,0, 127,8, 126,6, 124,5 (дд), 124,2 (дд), 121,5, 116,4, 112,9, 111,5 (дд), 104,9 (дд), 51,9, 46,4, 46,4, 26,1, 24,1, 20,2.
Пример 15:
2-(4-{3-[2-Хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил]-1-морфолин-4-илэтанон (соединение 115)
Реакцию осуществляли подобно тому, как описано в получении соединения 112, используя соединение 111 (0,12 ммоль) и гидрохлорид морфолина (0,12 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя МеОН/EtOAc от 0:100 до 5:95 в качестве элюента с получением указанного в заголовке соединения в виде сиропа почти желтого цвета.
13C ЯМР (CDCl3) δ 196,0, 163,5, 147,9, 147,3, 139,8, 138,0, 135,3, 133,7, 131,9, 129,2, 128,0, 127,7, 126,5, 124,4 (дд), 124,2 (дд), 121,4, 116,3, 112,8, 111,6 (дд), 104,9 (дд), 66,6, 66,4, 50,9, 45,9, 42,6, 20,2.
Получение 14
[2-Хлор-4-(4-трифторметилфениламино)фенил]-(2-метил-5-нитрофенил)метанон (соединение 414)
Соединение 402 (100 мг, 0,28 ммоль) растворяли в сухом 1,4-диоксане (2 мл) в 8-мл пробирке с завинчивающейся крышкой. 4-Трифторметилфениламин (35 мкл, 0,28 ммоль), Cs2CO3 (276 мг, 0,85 ммоль), BINAP (7 мг, 0,011 ммоль) и Pd(OAc)2 (3 мг, 0,011 ммоль) добавляли и продували аргон через реакционную смесь, закрывали завинчивающейся пробкой реакционный сосуд. Смесь перемешивали при 100°С в течение 18 час. Реакционную смесь фильтровали через Decalite и концентрировали на силикагеле. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 25:75 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
Получение 15
(5-Амино-2-метилфенил)-[2-хлор-4-(4-трифторметилфениламино)фенил]метанон (соединение 415)
Соединение 414 (134 мг, 0,31 ммоль) растворяли в МеОН (4 мл). Добавляли цинковый порошок (203 мг, 3,1 ммоль) и NH4Cl (84 мг, 1,57 ммоль). Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 3 час. Смесь фильтровали через Decalite и промывали МеОН. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения в виде пены.
Получение 16
(5-Азидо-2-метилфенил)-[2-хлор-4-(4-трифторметилфениламино)фенил]метанон (соединение 416)
Соединение 415 (134 мг, 0,31 ммоль) растворяли в ацетоне (2 мл). Концентрированную НСl (37%, 0,113 мл, 1,36 ммоль) добавляли и раствор охлаждали на ледяной бане. NaNO2 (22 мг, 0,32 ммоль) растворяли в Н2О (0,18 мл) и добавляли к вышеуказанному раствору в течение 5 мин. Внутреннюю температуру поддерживали равной 0-2°С при добавлении. Суспензию перемешивали на ледяной бане в течение 1 час, после чего добавляли раствор NaN3 (27 мг, 0,41 ммоль) в Н2О (0,56 мл) по каплям в течение 5 мин. Смесь перемешивали при 0°С в течение 4 час. Н2О (5 мл) и EtOAc (10 мл) добавляли и перемешивали, и фазы разделяли. Органическую фазу концентрировали в вакууме с получением указанного в заголовке соединения. Неочищенный продукт использовали без дальнейшей очистки.
Пример 16:
[2-Хлор-4-(4-трифторметилфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 116)
Бут-3-ин-1-ол (23 мкл, 0,30 ммоль) и соединение 416 (116 мг, 0,27 ммоль) растворяли в ацетоне (2,6 мл) в пробирке. Свежеприготовленный раствор пентагидрата сульфата меди(II) (7,0 мг, 0,028 ммоль) и аскорбата натрия (27 мг, 0,14 ммоль) в воде (0,135 мл) добавляли к реакционной смеси. Пробирку закрывали и перемешивали в течение 24 час при комнатной температуре в атмосфере аргона. Реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали водой, солевым раствором, фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 20:80 до 0:100 в качестве элюента с получением указанного в заголовке соединения в виде пены светло-желтого цвета.
13C ЯМР (ДМСО-d6) δ 194,1, 147,1, 145,8, 144,6, 140,4, 136,5, 134,6, 134,0, 133,8, 132,6, 127,8, 126,7 (кв), 121,7, 120,8, 119,4, 118,2, 117,3, 114,2, 60,2, 29,2, 19,3.
Получение 17
(2-Хлор-4-о-толиламинофенил)-(2-метил-5-нитрофенил)метанон (соединение 417)
Реакцию осуществляли подобно тому, как описано в получении соединения 414, используя соединение 402 (0,28 ммоль) и 2-метиланилин (0,28 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя МеОН/EtOAc от 0:100 до 25:75 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
Получение 18
(5-Амино-2-метилфенил)-(2-хлор-4-о-толиламинофенил)метанон (соединение 418)
Реакцию осуществляли подобно тому, как описано в получении соединения 415, используя соединение 417 (0,39 ммоль). Неочищенный продукт использовался без дальнейшей очистки.
Получение 19
(5-Азидо-2-метилфенил)-(2-хлор-4-о-толиламинофенил)метанон (соединение 419)
Реакцию осуществляли подобно тому, как описано в получении соединения 416, используя соединение 418 (0,39 ммоль). Неочищенный продукт использовался без дальнейшей очистки.
Пример 17:
(2-Хлор-4-о-толиламинофенил)-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 117)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 419 (0,40 ммоль) и бут-3-ин-1-ол (0,40 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 20:80 до 0:100 в качестве элюента с получением указанного в заголовке соединения в виде пены светло-желтого цвета.
13C ЯМР (CDCl3) δ 194,7, 149,9, 146,2, 141,2, 138,0, 137,7, 135,7, 134,7, 134,2, 132,8, 132,5, 131,4, 127,1, 126,9, 125,8, 124,4, 122,1, 120,6, 120,0, 115,7, 112,3, 61,5, 28,7, 19,9, 17,9.
Получение 20
[2-Хлор-4-(2-хлор-4-фторфениламино)фенил]-(2-метил-5-нитрофенил)метанон (соединение 420)
Реакцию осуществляли подобно тому, как описано в получении соединения 414, используя соединение 402 (0,28 ммоль) и 2-хлор-4-фторанилин (0,28 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя МеОН/EtOAc от 0:100 до 25:75 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
Получение 21
(5-Амино-2-метилфенил)-[2-хлор-4-(2-хлор-4-фторфениламино)фенил]метанон (соединение 421)
Реакцию осуществляли подобно тому, как описано в получении соединения 415, используя соединение 420 (0,21 ммоль). Неочищенный продукт использовался без дальнейшей очистки.
Получение 22
(5-Азидо-2-метилфенил)-[2-хлор-4-(2-хлор-4-фторфениламино)фенил]метанон (соединение 422)
Реакцию осуществляли подобно тому, как описано в получении соединения 416, используя соединение 421 (0,21 ммоль). Неочищенный продукт использовался без дальнейшей очистки.
Пример 18:
[2-Хлор-4-(2-хлор-4-фторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 118)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 422 (0,21 ммоль) и бут-3-ин-1-ол (0,21 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 30:70 до 100:0 в качестве элюента с получением указанного в заголовке соединения в виде пены светло-желтого цвета.
13C ЯМР (CDCl3) δ 194,8, 158,7 (д), 147,9, 146,3, 140,7, 138,4, 135,4, 134,8, 133,8, 133,3 (д), 132,6, 128,8, 127,5 (д), 123,4 (д), 122,4, 120,9, 120,0, 117,6 (д), 116,9, 114,9 (д), 113,5, 61,5, 28,7, 20,0.
Получение 23
(5-Бром-2-метоксифенил)-(2-хлор-4-нитрофенил)метанон (соединение 423)
Смесь 1-бром-4-метоксибензола (7,48 г, 40 ммоль), 2-хлор-4-нитробензоилхлорида (8,79 г, 40 ммоль) и трифлата висмута (1,31 г, 2,0 ммоль) в атмосфере аргона перемешивали при комнатной температуре в течение 20 мин. Температуру поднимали до 80°С и перемешивание продолжали в течение 90 мин. DCM добавляли к реакционной смеси и органическую фазу промывали водной HCl (1N, 0,5 мл) и NaHCO3 (водным). Органическую фазу сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт кристаллизовали из смеси DCM и пентана с получением указанного в заголовке соединения в виде кристаллов желтого цвета.
Получение 24
(4-Амино-2-хлорфенил)-(5-бром-2-метоксифенил)метанон (соединение 424)
Реакцию осуществляли подобно тому, как описано в получении соединения 404, используя соединение 423 (16,1 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 20:80 до 45:55 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
Получение 25
(5-Бром-2-метоксифенил)-[2-хлор-4-(2,4-дифторфениламино)фенил]метанон (соединение 425)
Соединение 424 (4,39 г, 12,9 ммоль) суспендировали в сухом толуоле (100 мл) в 200-мл сосуде с завинчивающейся пробкой. 1-бром-2,4-дифторбензол (1,75 мл, 15,5 ммоль) добавляли и аргон продували через смесь. Cs2CO3 (5,88 г, 18,1 ммоль), 4,5-бис-дифенилфосфанил-9,9-диметил-9Н-ксантен (0,22 г, 0,39 ммоль) и Pd(OAc)2 (58 мг, 0,26 ммоль) добавляли, аргон продували через смесь и сосуд с завинчивающейся пробкой закрывали. Смесь перемешивали при 120°С в течение 72 чаc. Реакционную смесь фильтровали через Decalite и затем концентрировали на силикагеле в вакууме. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 5:95 до 30:70 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
Получение 26
[2-Хлор-4-(2,4-дифторфениламино)фенил]-(2-метокси-5-триметилсиланилэтинилфенил)метанон (соединение 426)
Реакцию осуществляли подобно тому, как описано в получении соединения 406, используя соединение 425 (0,99 ммоль) и этинилтриметилсилан (0,99 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 10:90 в качестве элюента с получением указанного в заголовке соединения в виде сиропа светло-оранжевого цвета.
Получение 27
[2-Хлор-4-(2,4-дифторфениламино)фенил]-(5-этинил-2-метоксифенил)метанон (соединение 427)
Реакцию осуществляли подобно тому, как описано в получении соединения 407, используя соединение 426 (0,44 ммоль). Неочищенный продукт немедленно использовали в следующей реакции без дальнейшей очистки.
Пример 19:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-(2-метокси-5-{1-[2-(тетрагидропиран-2-илокси)этил]-1Н-[1,2,3]триазол-4-ил}фенил)метанон (соединение 119)
Реакцию осуществляли подобно тому, как описано в получении соединения 101, используя соединение 427 (0,42 ммоль) и соединение 408 (0,42 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 20:80 до 60:40 в качестве элюента с получением указанного в заголовке соединения в виде пены светло-оранжевого цвета.
13C ЯМР (CDCl3) δ 193,2, 159,0 (дд), 158,1, 155,4 (дд), 147,3, 146,9, 134,8, 133,3, 130,2, 127,7, 124,8 (дд), 123,9 (дд), 123,8, 120,3, 116,2, 113,0, 112,3, 111,5 (дд), 104,9 (дд), 99,2, 65,8, 62,5, 56,1, 50,6, 30,5, 25,3, 19,4.
Пример 20:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(2-гидроксиэтил)-1Н-[1,2,3]триазол-4-ил]-2-метоксифенил}метанон (соединение 120)
Реакцию осуществляли подобно тому, как описано в получении соединения 101, используя соединение 119 (0,11 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 20:80 до 100:0 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
13C ЯМР (CDCl3) δ 193,3, 158,1, 147,4, 146,7, 134,8, 133,4, 130,1, 127,6, 124,6 (дд), 123,9 (м), 123,7, 123,3, 120,5, 116,1, 112,1, 111,5 (дд), 104,9 (дд), 61,3, 56,0, 52,8.
Получение 28
[2-Хлор-4-(4-фторфениламино)фенил]-(2-метил-5-нитрофенил)метанон (соединение 428)
Реакцию осуществляли подобно тому, как описано в получении соединения 403, используя соединение 402 (22,6 ммоль) и 4-фтораналин (24,8 ммоль), за исключением того, что время реакции составляло 16 чаc. Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 1:5 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
Получение 29
(5-Амино-2-метилфенил)-[2-хлор-4-(4-фторфениламино)фенил]метанон (соединение 429)
Реакцию осуществляли подобно тому, как описано в получении соединения 404, используя соединение 428 (19,2 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 1:2, затем 2:3 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества.
Получение 30
[2-Хлор-4-(4-фторфениламино)фенил]-(5-йод-2-метилфенил)метанон (соединение 430)
Реакцию осуществляли подобно тому, как описано в получении соединения 405, используя соединение 429 (8,46 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 2:8, затем 3:7 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества.
Получение 31
[2-Хлор-4-(4-фторфениламино)фенил]-(2-метил-5-триметилсиланилэтинилфенил)метанон (соединение 431)
Реакцию осуществляли подобно тому, как описано в получении соединения 406, используя соединение 430 (7,17 ммоль) и этинилтриметилсилан (7,17 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 1:8 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества.
Получение 32
[2-Хлор-4-(4-фторфениламино)фенил]-(5-этинил-2-метилфенил)метанон (соединение 432)
Реакцию осуществляли подобно тому, как описано в получении соединения 407, используя соединение 431 (5,95 ммоль). Неочищенный продукт использовали без дальнейшей очистки.
Пример 21:
[2-Хлор-4-(4-фторфениламино)фенил]-(2-метил-5-{1-[2-(тетрагидропиран-2-илокси)этил]-1Н-[1,2,3]триазол-4-ил}фенил)метанон (соединение 121)
Реакцию осуществляли подобно тому, как описано в получении соединения 101, используя соединение 432 (2,06 ммоль) и соединение 408 (2,06 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 50:50 до 50:50 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (CDCl3) δ 196,1, 159,6 (д), 148,8, 147,0, 140,0, 137,5, 135,9 (д), 135,4, 134,0, 131,8, 128,4, 128,2, 127,8, 126,4, 124,2 (д), 120,8, 116,4 (д), 115,8, 112,3, 99,1, 65,8, 62,4, 50,6, 30,4, 25,2, 20,2, 19,4.
Пример 22:
[2-Хлор-4-(4-фторфениламино)фенил]-{5-[1-(2-гидроксиэтил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанон (соединение 122)
Реакцию осуществляли подобно тому, как описано в получении соединения 102, используя соединение 121 (1,63 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 50:50 до 100:0 в качестве элюента с получением указанного в заголовке соединения в виде сиропа желтого цвета.
13C ЯМР (ДМСО-d6) δ 194,8, 158,1 (д), 149,1, 145,2, 139,9, 136,6 (д), 135,7, 134,0, 133,9, 131,6, 128,4, 127,0, 126,3, 124,8, 122,7 (д), 121,9, 116,1 (д), 114,9, 111,8, 59,7, 52,3, 19,4.
Пример 23:
[2-Хлор-4-(4-фторфениламино)фенил]-{5-[1-(2,2-диметил-[1,3]диоксолан-4-илметил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанон (соединение 123)
Реакцию осуществляли подобно тому, как описано в получении соединения 101, используя соединение 432 (2,75 ммоль) и соединение 410 (2,75 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 20:80 до 65:35 в качестве элюента с получением указанного в заголовке соединения в виде пены.
13C ЯМР (CDCl3) δ 196,1, 159,7 (д), 148,9, 147,1, 140,1, 137,6, 135,9 (д), 135,5, 134,0, 131,8, 128,4, 128,0, 127,8, 126,4, 124,2 (д), 121,0, 116,4 (д), 115,8, 112,3, 110,3, 74,1, 66,5, 52,4, 26,7, 25,2, 20,2.
Пример 24:
[2-Хлор-4-(4-фторфениламино)фенил]-{5-[1-(2,3-дигидроксипропил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанон (соединение 124)
Раствор соединения 123 (1,05 г, 2,02 ммоль) в ТГФ (10 мл) добавляли к HCl (10 мл, водной, 1N) и смесь перемешивали в течение 16 час при комнатной температуре. Реакционную смесь выливали в смесь EtOAc/вода/NaHCO3. Органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM от 0:100 до 10:90 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества белого цвета.
13C ЯМР (ДМСО-d6) δ 194,8, 158,1 (д), 149,1, 145,1, 139,9, 136,6 (д), 135,7, 134,0, 133,9, 131,6, 128,4, 127,0, 126,3, 124,8, 122,7 (д), 122,3, 116,0 (д), 114,9, 111,8, 70,3, 63,2, 53,0, 19,4.
Пример 25:
2-(4-{3-[2-Хлор-4-(4-фторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)ацетамид (соединение 125)
Реакцию осуществляли подобно тому, как описано в получении соединения 101, используя соединение 432 (1,04 ммоль) и соединение 411 (1,5 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/DCM/петролейный эфир (40-60) от 0:80:20, 0:100:0 и 10:90:0 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
13C ЯМР (ДМСО-d6) δ 194,8, 167,1, 158,0 (д), 149,1, 145,2, 139,9, 136,6 (д), 135,8, 134,0, 133,9, 131,6, 128,2, 127,0, 126,3, 124,9, 123,0, 122,7 (д), 116,0 (д), 114,8, 111,8, 51,5, 19,4.
Пример 26:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(2-хлорэтил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанон (соединение 126)
В колбу, содержащую перемешиваемую смесь трифенилфосфина (39 мг, 0,15 ммоль) и 4,5-дихлор-3,6-диоксоциклогекса-1,4-диен-1,2-дикарбонитрила (44,5 мг, 0,20 ммоль) в сухом DCM (3,0 мл), добавляли тетра-N-бутиламмонийазид (56 мг, 0,20 ммоль) при комнатной температуре. Соединение 102 (46 мг, 0,10 ммоль) затем добавляли и реакционную смесь перемешивали в течение 1 час. Реакционную смесь концентрировали в вакууме и очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 50:50 в качестве элюента с получением указанного в заголовке соединения в виде пены.
13C ЯМР (CDCl3) δ 196,1, 159,2 (дд), 155,6 (дд), 148,0, 147,0, 139,9, 137,8, 135,3, 133,8, 131,9, 129,0, 127,9, 127,8, 126,4, 124,5 (дд), 124,3 (дд), 120,8, 116,3, 112,7, 111,6 (дд), 104,9 (дд), 51,8, 42,4, 20,2.
Получение 33
(5-Азидо-2-метилфенил)-[2-хлор-4-(4-фторфениламино)фенил]метанон (соединение 433)
Смесь NaN3 (3,3 г), H2O (8 мл) и DCM (2,8 мл) охлаждали до 0°С при перемешивании. Трифторметансульфоновый ангидрид (1,34 мл, 8,46 ммоль) медленно добавляли, поддерживая температуру в интервале от -2 до 1°С. Спустя 2 час реакционную смесь разделяли в делительной воронке. Водную фазу примывали EtOAc. Органическую фазу промывали насыщенным NaHCO3 и концентрировали в вакууме с получением неочищенного трифторметансульфоназида, который использовали в дальнейшем.
К суспензии соединения 429 (1,00 г, 2,82 ммоль) в DCM (5,0 мл) добавляли раствор пентагидрата сульфата меди(II) (35,2 мг, 0,14 ммоль) в H2O (4,0 мл) и ТЕА (1,18 мл, 8,45 ммоль). Неочищенный трифторметансульфоназид добавляли медленно при перемешивании к реакционной смеси с последующим добавлением МеОН (5 мл). Через 18 час при комнатной температуре реакционную смесь выливали в смесь EtOAc/NaHCO3 (водную). Органическую фазу промывали водой, солевым раствором, фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 25:75 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
Пример 27:
[2-Хлор-4-(4-фторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил)-2-метилфенил}метанон(соединение 127)
Реакцию осуществляли подобно тому, как описано в получении соединения 101, используя соединение 433 (1,10 ммоль) и 3-бутин-1-ол (1,10 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 50:50 до 100:0 в качестве элюента с получением указанного в заголовке соединения в виде пены.
13C ЯМР (CDCl3) δ 194,8, 159,8 (д), 149,5, 146,3, 141,1, 138,1, 135,7 (д), 135,6, 134,8, 134,0, 132,5, 127,6, 124,5 (д), 122,2, 120,8, 119,9, 116,5 (д), 115,8, 112,4, 61,6, 28,8, 19,9.
Получение 34
(5-Азидо-2-метилфенил)-[2-хлор-4-(2,4-дифторфениламино)фенил]-метанон (соединение 434)
Соединение 404 (5,40 г, 14,5 ммоль) растворяли в ацетоне (100 мл). Концентрированную НСl (37%, 6,04 мл, 72 ммоль) добавляли и раствор охлаждали на ледяной бане. NaNO2 (1,20 г, 17,4 ммоль) растворяли в Н2О (9 мл) и добавляли к вышеуказанному раствору в течение 20 мин. Внутренюю температуру поддерживали равной 0-2°С во время добавления. Суспензию перемешивали на ледяной бане в течение 1 час, после чего добавляли раствор NaN3 (1,20 г, 17,4 ммоль) в Н2О (12 мл) по каплям в течение 5 мин. Смесь перемешивали при 0°С в течение 2 час. Н2О (50 мл) и EtOAc (100 мл) добавляли и перемешивали, и фазы разделяли. Органическую фазу концентрировали в вакууме с получением указанного в заголовке соединения. Неочищенный продукт использовали без дальнейшей очистки. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 50:50 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества коричневого цвета.
Пример 28:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 128)
Реакцию осуществляли подобно тому, как описано в получении соединения 110, используя соединение 434 (6,87 ммоль) и 3-бутин-1-ол (8,24 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 50:50 до 100:0 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
13C ЯМР (CDCl3) δ 194,8, 159,4 (дд), 155,7 (дд), 148,4, 146,3, 140,8, 138,3, 135,5, 134,8, 133,8, 132,6, 128,4, 124,8 (дд), 124,1 (дд), 122,3, 120,9, 119,9, 116,2, 112,8, 111,7 (дд), 105,0 (дд), 61,6, 28,7, 20,0.
Пример 29:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-{5-[4-(1-гидрокси-1-метилэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 129)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 434 (0,125 ммоль) и 2-метилбут-3-ин-2-ол (0,125 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 30:70 до 70:30 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (CDCl3) δ 194,9, 159,4 (дд), 156,4, 155,8 (дд), 148,6, 140,8, 138,2, 135,5, 134,8, 133,8, 132,6, 128,2, 125,0 (дд), 124,1 (дд), 122,4, 120,9, 117,6, 116,1, 112,7, 111,7 (дд), 105,0 (дд), 68,7, 30,5, 19,9.
Пример 30:
1-(1-{3-[2-Хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-1Н-[1,2,3]триазол-4-ил]этанон (соединение 130)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 434 (0,125 ммоль) и бут-3-ин-2-ол (0,125 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 50:50 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (ДМСО-d6) δ 193,6, 191,2, 159,0 (дд), 155,8 (дд), 149,9, 147,6, 140,9, 137,3, 134,3, 134,2, 133,8, 132,5, 126,7 (дд), 125,6, 125,5, 124,0 (дд), 122,0, 119,8, 115,0, 112,0 (дд), 111,8, 105,1 (дд), 27,3, 19,1.
Пример 31:
{5-[4-(1-Амино-1-метилэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}-[2-хлор-4-(2,4-дифторфениламино)фенил]метанон (соединение 131)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 434 (0,125 ммоль) и 1,1-диметилпроп-2-иниламин (0,125 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя МеОН/DCM от 0:100 до 5:95 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (CDCl3) δ 194,9, 159,4 (дд), 155,8 (дд), 148,5, 140,8, 138,1, 135,4, 134,9, 133,8, 132,6, 128,3, 124,9 (дд), 124,1 (дд), 122,4, 120,8, 117,1, 116,1, 112,8, 111,7 (дд), 105,0 (дд), 31,2 (ушир.с), 20,0.
Пример 32:
Метиловый эфир 1-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил-4-метилфенил}-1Н-[1,2,3]триазол-4-карбоновой кислоты (соединение 132)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 434 (0,50 ммоль) и метиловый эфир пропиновой кислоты (0,50 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 50:50 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (CDCl3) δ 194,4, 161,0, 159,5 (дд), 155,8 (дд), 148,6, 141,1, 140,6, 139,3, 135,5, 134,0, 133,9, 132,8, 128,1, 125,6, 124,9 (дд), 124,0 (дд), 122,6, 121,0, 116,1, 112,9, 111,7 (дд), 105,0 (дд), 52,4, 20,0.
Пример 33:
1-{3-[2-Хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-1Н-[1,2,3]триазол-4-карбоновая кислота (соединение 133)
Суспензию соединения 132 (100 мг, 0,21 ммоль) в МеОН (5,0 мл) добавляли к H2O (0,6 мл) и LiOH (25 мг, 1,0 ммоль) и полученную реакционную смесь кипятили с обратным холодильником в течение 1 час. EtOAc добавляли к реакции и рН доводили до 1-2 концентрированной HCl (37%, 6 капель). Органическую фазу отделяли и водный слой экстрагировали дополнительным количеством EtOAc. Органические фазы объединяли и промывали водой, солевым раствором, сушили (MgSO4), фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого вещества белого цвета.
13C ЯМР (ДМСО-d6) δ 193,6, 161,3, 159,0 (дд), 155,7 (дд), 149,8, 140,8, 140,7, 137,1, 134,3, 134,1, 133,8, 132,4, 127,0, 126,7 (дд), 125,5, 124,0 (дд), 121,9, 119,7, 114,9, 112,0 (дд), 111,8, 105,0 (дд), 19,1.
Пример 34:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-4-метилфенил]-[5-(4-гидроксиметил-[1,2,3]триазол-1-ил)-2-метилфенил]метанон (соединение 134)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 434 (0,125 ммоль) и проп-2-ин-1-ол (0,125 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 60:40 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (CDCl3) δ 194,8, 159,4 (дд), 155,8 (дд), 148,5, 148,4, 140,8, 138,5, 135,5, 134,7, 133,8, 132,7, 128,2, 124,8 (дд), 124,0 (дд), 121,0, 120,1, 116,1, 112,8, 111,8, 111,7 (дд), 105,0 (дд), 56,6, 20,0.
Пример 35:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-{5-[4-(3-гидроксипропенил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 135)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 434 (0,15 ммоль) и пент-2-ен-4-ин-1-ол (0,30 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 30:70 до 50:50 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
13C ЯМР (ДМСО-d6) δ 193,7, 158,9, 155,8, 149,8, 145,9, 140,8, 136,3, 134,3, 134,0, 133,2, 132,4, 126,6 (дд), 125,6, 124,0 (дд), 121,3, 119,3, 119,0, 116,8, 114,9, 112,0 (дд), 111,8, 105,0 (дд), 60,9, 19,1.
Получение 35:
2-(1-{3-[2-[Хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-1Н-[1,2,3]триазол-4-ил)этиловый эфир толуол-4-сульфоновой кислоты (соединение 435)
Раствор соединения 128 (250 мг, 0,53 ммоль) в сухом пиридине (2,0 мл) продували аргоном и охлаждали до 0°С. 4-Метилбензолсульфонилхлорид (102 мг, 0,53 ммоль) добавляли и реакцию оставляли нагреваться до комнатной температуры в течение ночи при перемешивании. Реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали водой, рассолом, фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 25:75 до 50:50 в качестве элюента с получением указанного в заголовке соединения.
Получение 36:
{5-[4-(2-Азидоэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}-2-хлор-4-(2,4-дифторфениламино)фенил (соединение 436)
Смесь соединения 435 (167 мг, 0,27 ммоль), NaN3 (26 мг, 0,40 ммоль) и иодида калия (4,4 мг, 0,027 ммоль) в DMF (5 мл) перемешивали при 50°С в течение 18 час в атмосфере аргона. Реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали солевым раствором, сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 50:50 в качестве элюента с получением указанного в заголовке соединения в виде масла желтого цвета.
Пример 36:
{5-[4-(2-Аминоэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}-[2-хлор-4-(2,4-дифторфениламино)фенил]метанон (соединение 136)
К раствору соединения 436 (96 мг, 0,20 ммоль) в ТГФ (2,5 мл) добавляли 3 капли воды и трифенилфосфин (102 мг, 0,39 ммоль) и затем перемешивали в течение 18 час при комнатной температуре. Реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали водой, солевым раствором, фильтровали, концентрировали в вакууме с образованием неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией, используя МеОН в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (CDCl3) δ 194,8, 159,4 (дд), 155,8 (дд), 148,4, 146,8, 140,8, 138,1, 135,5, 134,9, 133,8, 132,6, 128,4, 124,8 (дд), 124,1 (дд), 122,3, 120,8, 119,6, 116,2, 112,8, 111,7 (дд), 105,0 (дд), 41,6, 29,7, 20,0.
Пример 37:
(1-{3-[2-Хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-1Н-[1,2,3]триазол-4-илметил)мочевина (соединение 137)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 434 (0,15 ммоль) и проп-2-инилмочевину (0,30 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc в качестве элюента, для выделения твердого вещества. Тритурированием в МеОН и осаждением получали указанное в заголовке соединение в виде твердого вещества белого цвета.
13C ЯМР (ДМСО-d6) δ 193,7, 158,9 (дд), 158,3, 155,8 (дд), 149,7, 147,2, 140,7, 136,3, 134,3, 134,2, 134,0, 132,4, 126,6 (дд), 125,6, 124,0 (дд), 121,4, 120,7, 119,2, 114,9, 112,0 (дд), 111,8, 105,0 (дд), 34,7, 19,1.
Пример 38:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-{2-метил-5-[4-(2-морфолин-4-ил-этил)-[1,2,3]триазол-1-ил]фенил}метанон (соединение 138)
Соединение 435 (150 мг, 0,24 ммоль), К2СО3 (50 мг, 0,36 ммоль) и морфолин (0,5 мл) помещали в пробирку (8 мл). DMF (0,5 мл) добавляли и полученную реакционную смесь перемешивали при 50°С в течение 18 час. К реакционной смеси добавляли НСl (4 мл, 0,5 N) и затем дважды экстрагировали EtOAc (2 мл). Органические фазы концентрировали на силикагеле и очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM от 0:100 до 10:90 в качестве элюента с получением указанного в заголовке соединения в виде пены белого цвета.
13C ЯМР (CDCl3) δ 194,8, 159,4 (дд), 155,8 (дд), 148,4, 146,7, 140,7, 138,1, 135,4, 134,9, 133,8, 132,6, 128,4, 124,8 (дд), 124,1 (дд), 122,3, 120,9, 119,6, 116,2, 112,8, 111,7 (дд), 105,0 (дд), 66,8, 57,9, 53,5, 23,0, 20,0.
Пример 39:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-(2-метил-5-{4-[2-(4-метилпиперазин-1-ил)этил]-[1,2,3]триазол-1-ил}фенил)метанон (соединение 139)
Реакцию осуществляли подобно тому, как описано в получении соединения 138, используя соединение 435 (0,24 ммоль) и 1-метилпиперазин (0,5 мл). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM от 0:100 до 15:85 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
13C ЯМР (CDCl3) δ 194,8, 148,4, 146,9, 140,8, 138,1, 135,5, 134,9, 133,8, 132,6, 128,4, 124,8 (дд), 124,1 (дд), 122,3, 120,9, 119,5, 116,2, 112,8, 111,7 (дд), 105,0 (дд), 57,5, 55,0, 52,7, 45,8, 23,4, 20,0.
Пример 40:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-{5-[4-(2-диэтиламиноэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 140)
Реакцию осуществляли подобно тому, как описано в получении соединения 138, используя соединение 435 (0,24 ммоль) и диэтиламин (0,5 мл). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM от 0:100 до 15:85 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
13C ЯМР (CDCl3) δ 194,9, 159,4 (дд), 155,8 (дд), 148,5, 147,0, 140,8, 138,0, 135,4, 134,9, 133,8, 132,5, 128,3, 124,9 (дд), 124,1 (дд), 122,3, 120,8, 119,6, 116,2, 112,8, 111,7 (дд), 105,0 (дд), 52,2, 46,9, 23,4, 20,0, 11,5.
Пример 41:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-(5-{4-[2-(2-гидроксиэтиламино)этил]-[1,2,3]триазол-1-ил}-2-метилфенил)метанон (соединение 141)
Реакцию осуществляли подобно тому, как описано в получении соединения 138, используя соединение 435 (0,24 ммоль) и 2-аминоэтанол (0,5 мл). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM от 0:100 до 15:85 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
13C ЯМР (CDCl3) δ 194,8, 148,6, 146,1, 140,8, 138,2, 135,4, 134,7, 133,9, 132,6, 128,2, 124,9 (дд), 124,1 (дд), 122,2, 120,8, 119,9, 116,1, 112,8, 111,8 (дд), 105,0 (дд), 60,0, 50,7, 48,1, 25,3, 19,9.
Пример 42:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-{2-метил-5-[4-(2-пропиламиноэтил)-[1,2,3]триазол-1-ил]фенил}метанон (соединение 142)
Реакцию осуществляли подобно тому, как описано в получении соединения 138, используя соединение 435 (0,24 ммоль) и пропиламин (0,5 мл). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM от 0:100 до 15:85 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
13C ЯМР (CDCl3) δ 194,8, 159,4 (дд), 155,8 (дд), 148,5, 146,3, 140,8, 138,2, 135,4, 134,8, 133,8, 132,6, 128,3, 124,8 (дд), 124,1 (дд), 122,3, 120,8, 119,8, 116,2, 112,8, 111,7 (дд), 105,0 (дд), 51,1, 48,3, 25,2, 22,2, 20,0, 11,6.
Получение 37:
[2-Хлор-4-(4-фтор-2-метилфениламино)фенил]-(2-метил-5-нитрофенил)метанон (соединение 437)
Реакцию осуществляли подобно тому, как описано в получении соединения 414, используя соединение 402 (0,56 ммоль) и 4-фтор-2-метилфениламин (0,56 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 25:75 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
Получение 38:
(5-Амино-2-метилфенил)-[2-хлор-4-(4-фтор-2-метилфениламино)фенил]метанон (соединение 438)
Реакцию осуществляли подобно тому, как описано в получении соединения 415, используя соединение 437 (0,41 ммоль). Неочищенный продукт использовали без дальнейшей очистки.
Получение 39:
(5-Азидо-2-метилфенил)-[2-хлор-4-(4-фтор-2-метилфениламино)фенил]метанон (соединение 439)
Реакцию осуществляли подобно тому, как описано в получении соединения 416, используя соединение 438 (0,29 ммоль). Неочищенный продукт использовали без дальнейшей очистки.
Пример 43:
[2-Хлор-4-(4-фтор-2-метилфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил}-2-метилфенил}метанон (соединение 143)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 439 (0,29 ммоль) и бут-3-ин-1-ол (0,40 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM от 0:100 до 5:95 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (ДМСО-d6) δ 193,5, 159,5 (д), 151,2, 145,7, 141,1, 136,3 (д), 135,9, 134,6, 134,4, 134,2 (д), 132,3, 127,1 (д), 124,3, 121,0, 120,6, 118,8, 117,4 (д), 114,2, 113,5 (д), 111,1, 60,1, 29,1, 19,0, 17,6.
Получение 40:
[2-Хлор-4-(2-метоксифениламино)фенил]-(2-метил-5-нитрофенил)метанон (соединение 440)
Реакцию осуществляли подобно тому, как описано в получении соединения 414, используя соединение 402 (0,56 ммоль) и 2-метоксифениламин (0,56 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 25:75 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
Получение 41:
(5-Амино-2-метилфенил)-[2-хлор-4-(2-метоксифениламино)фенил]метанон (соединение 441)
Реакцию осуществляли подобно тому, как описано в получении соединения 415, используя соединение 440 (0,28 ммоль). Неочищенный продукт использовали без дальнейшей очистки.
Получение 42:
(5-Азидо-2-метилфенил)-[2-хлор-4-(2-метоксифениламино)фенил]метанон (соединение 442)
Реакцию осуществляли подобно тому, как описано в получении соединения 416, используя соединение 441 (0,27 ммоль). Неочищенный продукт использовали без дальнейшей очистки.
Пример 44:
[2-Хлор-4-(2-метоксифениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил}-2-метилфенил}метанон (соединение 144)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 442 (0,27 ммоль) и бут-3-ин-1-ол (0,30 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 20:80 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (ДМСО-d6) δ 193,6, 152,4, 150,2, 145,6, 141,1, 135,9, 134,4, 134,2, 134,0, 132,3, 128,2, 125,3, 124,6, 123,4, 121,0, 120,6, 118,8, 115,1, 112,2, 111,7, 60,1, 55,4, 29,1, 19,0.
Получение 43:
[2-Хлор-4-(4-хлор-2-метилфениламино)фенил]-(2-метил-5-нитрофенил)метанон (соединение 443)
Реакцию осуществляли подобно тому, как описано в получении соединения 414, используя соединение 402 (0,56 ммоль) и 4-хлор-2-метилфениламин (0,56 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 25:75 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
Получение 44:
(5-Амино-2-метилфенил)-[2-хлор-4-(4-хлор-2-метилфениламино)фенил]метанон (соединение 444)
Реакцию осуществляли подобно тому, как описано в получении соединения 415, используя соединение 443 (0,24 ммоль). Неочищенный продукт использовали без дальнейшей очистки.
Получение 45:
(5-Азидо-2-метилфенил)-[2-хлор-4-(4-хлор-2-метилфениламино)фенил]метанон (соединение 445)
Реакцию осуществляли подобно тому, как описано в получении соединения 416, используя соединение 444 (0,09 ммоль). Неочищенный продукт использовали без дальнейшей очистки.
Пример 45:
[2-Хлор-4-(4-хлор-2-метилфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил}-2-метилфенил}метанон (соединение 145)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 445 (0,03 ммоль) и бут-3-ин-1-ол (0,06 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 30:70 до 100:0 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (CDCl3) δ 194,7, 149,5, 146,2, 141,1, 138,2, 136,4, 135,7, 134,7, 134,1, 132,6, 131,2, 130,8, 127,4, 127,2, 125,6, 122,1, 120,7, 120,1, 115,8, 112,4, 61,5, 28,6, 19,9, 17,9.
Получение 46:
[2-Хлор-4-(4-метоксифениламино)фенил]-(2-метил-5-нитрофенил)метанон (соединение 446)
Реакцию осуществляли подобно тому, как описано в получении соединения 414, используя соединение 402 (0,56 ммоль) и 4-метоксифениламин (0,56 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 35:65 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
Получение 47:
(5-Амино-2-метилфенил)-[2-хлор-4-(4-метоксифениламино)фенил]метанон (соединение 447)
Реакцию осуществляли подобно тому, как описано в получении соединения 415, используя соединение 446 (0,31 ммоль). Неочищенный продукт использовали без дальнейшей очистки.
Получение 48:
(5-Азидо-2-метилфенил)-[2-хлор-4-(4-метоксифениламино)фенил]метанон (соединение 448)
Реакцию осуществляли подобно тому, как описано в получении соединения 416, используя соединение 447 (0,08 ммоль). Неочищенный продукт использовали без дальнейшей очистки.
Пример 46:
[2-Хлор-4-(4-метоксифениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил}-2-метилфенил}метанон (соединение 146)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 448 (0,03 ммоль) и бут-3-ин-1-ол (0,06 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 30:70 до 100:0 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (CDCl3) δ 194,7, 157,3, 150,5, 146,2, 141,4, 138,1, 135,8, 134,6, 134,2, 132,5, 132,2, 126,5, 125,3, 122,1, 120,6, 120,1, 115,2, 115,0, 111,8, 61,5, 55,6, 28,6, 19,9.
Пример 47:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-{5-[4-(2-этиламиноэтил)-[1,2,3]триазол-1-ил}-2-метилфенил}метанон (соединение 147)
Реакцию осуществляли подобно тому, как описано в получении соединения 138, используя соединение 435 (0,24 ммоль) и гидрохлорид этиламина (0,55 мг). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM от 0:100 до 15:85 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (CDCl3) δ 194,8, 159,4 (дд), 155,8 (дд), 148,6, 144,7, 140,8, 138,3, 135,4, 134,6, 133,9, 132,6, 128,2, 124,9 (дд), 124,1 (дд), 122,2, 120,8, 120,4, 116,1, 112,7, 111,7 (дд), 105,0 (дд), 46,5, 42,8, 23,2, 19,9, 12,1.
Получение 49:
(4-Бром-2-метилфенил)-(2-метил-5-нитрофенил)метанон (соединение 449)
Реакция проводилась в атмосфере аргона с использованием сухой стеклянной посуды.
4-Бром-2-метилйодбензол (2,40 мл, 16,8 ммоль) растворяли в сухом ТГФ (15 мл) и охлаждали до -60°С. Изопропилмагнийхлорид (2 М в ТГФ, 8,4 мл, 16,8 ммоль) добавляли при перемешивании в течение 30 мин. Реакционную смесь оставляли для нагревания до -40°С и смесь перемешивали при -40°С в течение 4 час. Добавляли соединение 401 (4,62 г, 16,8 ммоль) и смесь перемешивали при -40°С в течение 3 час, после чего ее оставляли нагреваться до комнатной температуры и перемешивали в течение 17 час. Добавляли насыщенный водный раствор NH4Cl (100 мл) и смесь перемешивали в течение 1 час. Фазы разделяли и водную фазу экстрагировали EtOAc (2×100 мл). Объединенные органические фазы промывали солевым раствором, сушили (MgSO4), фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя CH2Cl2/петролейный эфир (40-60) 1:6, 1:4, 1:2 в качестве элюента с получением указанного в заголовке соединения в виде желтого цвета.
Получение 50:
(4-Амино-2-метилфенил)-(4-бром-2-метилфенил)метанон (соединение 450)
Соединение 449 (1,85 г, 5,54 ммоль) растворяли в МеОН (75 мл). Добавляли цинковую пыль (3,62 г, 55,4 ммоль) и NH4Cl (1,48 г, 27,7 ммоль). Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 2 час. Смесь фильтровали через Decalite и промывали МеОН. Фильтрат концентрировали на силикагеле. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 30:70 в качестве элюента с получением указанного в заголовке соединения в виде сиропа желтого цвета.
Получение 51:
(4-Азидо-2-метилфенил)-(4-бром-2-метилфенил)метанон (соединение 451)
Соединение 450 (1,91 г, 6,28 ммоль) растворяли в ацетоне (45 мл). Добавляли концентрированную HCl (37%, 2,61 мл, 31 ммоль) и раствор охлаждали на ледяной бане. NaNO2 (520 мг, 7,54 ммоль) растворяли в H2O (4,5 мл) и добавляли к вышеупомянутому раствору в течение 20 мин. Внутренняя температура поддерживалась от 0°С до 2°С в процессе добавления. Суспензию перемешивали на ледяной бане в течение 30 мин, после чего раствор NaN3 (618 мг, 9,42 ммоль) в H2O (13 мл) добавляли по каплям в течение 30 мин. Смесь перемешивали при 0°С в течение 2 час. Добавляли H2O (50 мл) и EtOAc (2Ч75 мл) и перемешивали, и фазы разделяли. Органическую фазу промывали солевым раствором и концентрировали в вакууме с получением указанного в заголовке соединения. Неочищенный продукт использовали без дополнительной очистки.
Получение 52:
(4-Бром-2-метилфенил)-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 452)
К раствору соединения 451 (170 мг, 0,51 ммоль) в этаноле (2 мл) добавляли бут-3-ин-1-ол (39 мкл, 0,51 ммоль). Свежеприготовленный раствор пентагидрата сульфата меди(II) (5,0 мг, 0,020 ммоль) и аскорбата натрия (20 мг, 0,10 ммоль) в воде (0,5 мл) добавляли к реакционной смеси. Пробирку закрывали и перемешивали в течение 24 час при комнатной температуре в атмосфере аргона. Реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 40:60 до 95:5 в качестве элюента с получением указанного в заголовке соединения в виде сиропа белого цвета.
Пример 48:
[4-(2,4-Дифторфениламино)-2-метилфенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 148)
Соединение 452 (78 мг, 0,19 ммоль) растворяли в сухом 1,4-диоксане (1 мл) в 8-мл сосуде с завинчивающейся пробкой. 2,4-Дифторанилин (20 мкл, 0,19 ммоль) добавляли и аргон продували через смесь. Cs2CO3 (186 мг, 0,57 ммоль), BINAP (5 мг, 0,008 ммоль) и Pd(OAc)2 (2 мг, 0,008 ммоль) добавляли и аргон продували через смесь и сосуд с завинчивающейся пробкой закрывали. Смесь перемешивали при 90°С в течение 18 час. Реакционную смесь фильтровали через Decalite и фильтрат концентрировали в вакууме на силикагеле. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 40:60 до 100:0 в качестве элюента с получением указанного в заголовке соединения в виде пены светло-желтого цвета.
13C ЯМР (CDCl3) δ 197,1, 158,9 (дд), 155,4 (дд), 147,6, 146,3, 143,3, 142,3, 137,1, 135,3, 134,7, 132,2, 128,2, 124,7 (дд), 124,0 (дд), 121,5, 120,0, 119,9, 118,0, 111,4 (дд), 111,2, 104,8 (дд), 61,6, 28,7, 22,2, 19,6.
Пример 49:
[4-(3-Хлор-4-фторфениламино)-2-метилфенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 149)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 452 (0,13 ммоль) и 3-хлор-4-фторфениламин (0,13 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM/петролейный эфир (40-60) 0:50:50, 0:100:0 и 5:95:0 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
13C ЯМР (ДМСО-d6) δ 196,4, 152,6 (д), 147,6, 145,8, 142,3, 142,3, 138,6 (д), 135,3 (д), 134,4, 132,2, 126,9, 121,1, 120,7, 120,5, 120,0 (д), 119,9 (д), 118,4, 117,7, 117,5 (д), 111,3, 60,2, 29,2, 22,0, 18,9.
Пример 50:
{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}-(2-метил-4-фениламинофенил)метанон (соединение 150)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 452 (0,13 ммоль) и анилин (0,13 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM/петролейный эфир (40-60) 0:50:50, 0:100:0 и 5:95:0 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
13C ЯМР (CDCl3) δ 197,0, 147,9, 146,3, 143,4, 142,5, 140,4, 137,0, 135,5, 134,6, 132,2, 129,5, 127,6, 123,5, 121,4, 121,0, 119,9, 118,1, 111,4, 61,6, 28,7, 22,3, 19,5.
Пример 51:
1-[3-(4-{5-[4-(2-Гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилбензоил}-3-метилфениламино)фенил]этанон (соединение 151)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 452 (0,13 ммоль) и 1-(3-аминофенил)этанон (0,13 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM/петролейный эфир (40-60) 0:50:50, 0:100:0 и 5:95:0 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
13C ЯМР (CDCl3) δ 197,8, 197,1, 147,1, 146,3, 143,3, 142,3, 141,2, 138,5, 137,1, 135,3, 134,7, 132,3, 129,8, 128,5, 124,8, 123,2, 121,5, 120,0, 119,9, 119,6, 118,7, 111,8, 61,6, 28,7, 26,7, 22,2, 19,6.
Пример 52:
3-(4-{5-[4-(2-Гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилбензоил}-3-метилфениламино)бензонитрил (соединение 152)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 452 (0,13 ммоль) и 3-аминобензонитрил (0,13 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM/петролейный эфир (40-60) 0:50:50, 0:100:0 и 5:95:0 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
13C ЯМР (ДМСО-d6) δ 196,5, 146,5, 145,7, 142,4, 142,1, 142,1, 135,4, 135,0, 134,5, 132,2, 130,7, 127,7, 124,9, 123,3, 121,1, 120,7, 120,6, 118,8, 118,6, 118,5, 112,2, 60,2, 29,2, 21,9, 18,9.
Пример 53:
{5-[4-(2-Гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}-[2-метил-4-(3-трифторметилфениламино)фенил]метанон (соединение 153)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 452 (0,13 ммоль) и 3-трифторметилфениламин (0,13 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM/петролейный эфир (40-60) 0:50:50, 0:100:0 и 5:95:0 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
13C ЯМР (ДМСО-d6) δ 196,5, 146,8, 145,7, 142,3, 142,2, 142,1, 135,3, 135,1, 134,4, 132,2, 130,6, 130,2 (кв), 127,6, 124,1 (кв), 122,0, 120,7, 120,5, 118,5, 117,7 (кв), 114,9 (кв), 112,0, 60,2, 29,2, 21,9, 18,9.
Пример 54:
[4-(3,4-Дифторфениламино)-2-метилфенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 154)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 452 (0,13 ммоль) и 3,4-дифторфениламин (0,13 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM/петролейный эфир (40-60) 0:50:50, 0:100:0 и 5:95:0 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
13C ЯМР (ДМСО-d6) δ 196,4, 149,6 (дд), 147,5, 145,7, 144,7 (дд), 142,3, 142,2, 138,4 (дд), 135,3, 135,2, 134,4, 132,1, 127,0, 120,7, 120,5, 118,4, 117,9 (д), 117,7, 116,0 (дд), 111,4, 108,5 (д), 60,2, 29,2, 22,0, 18,9.
Пример 55:
[4-(3,4-Диметилфениламино)-2-метилфенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 155)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 452 (0,13 ммоль) и 3,4-диметилфениламин (0,13 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM/петролейный эфир (40-60) 0:50:50, 0:100:0 и 5:95:0 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
13C ЯМР (ДМСО-d6) δ 196,0, 148,9, 145,7, 142,7, 142,3, 138,4, 137,1, 135,5, 135,1, 134,4, 132,0, 130,5, 130,2, 125,4, 121,9, 120,7, 120,2, 118,2, 118,0, 117,0, 110,4, 60,2, 29,2, 22,2, 19,5, 18,8, 18,7.
Пример 56:
[4-(3-Хлор-2-метилфениламино)-2-метилфенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 156)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 452 (0,13 ммоль) и 3-хлор-2-метилфениламин (0,13 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM/петролейный эфир (40-60) 0:50:50, 0:100:0 и 5:95:0 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
13C ЯМР (CDCl3) δ 197,0, 148,6, 146,3, 143,5, 142,5, 139,9, 137,0, 135,7, 135,5, 134,6, 132,2, 130,9, 127,5, 127,1, 126,0, 122,4, 121,3, 119,9, 119,9, 117,8, 111,1, 61,6, 28,7, 22,3, 19,5, 15,0.
Пример 57:
[4-(3,4-Дихлорфениламино)-2-метилфенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 157)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 452 (0,13 ммоль) и 3,4-дихлорфениламин (0,13 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM/петролейный эфир (40-60) 0:50:50, 0:100:0 и 5:95:0 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
13C ЯМР (ДМСО-d6) δ 196,4, 146,4, 145,6, 142,0, 141,9, 141,6, 135,3, 134,9, 134,3, 132,1, 131,5, 131,0, 127,6, 122,5, 120,6, 120,5, 119,7, 118,6, 118,4, 112,2, 60,1, 29,1, 21,8, 18,8.
Пример 58:
N-[3-(4-{5-[4-(2-Гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилбензоил}-3-метилфениламино)фенил]ацетамид (соединение 158)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 452 (0,13 ммоль) и N-(3-аминофенил)ацетамид (0,13 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя NН3(водный)/MeOH/DCM 0:0:100, 0:9:90 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
13C ЯМР (ДМСО-d6) δ 196,1, 168,2, 147,9, 145,6, 142,4, 142,0, 141,2, 140,1, 135,1, 135,0, 134,3, 131,9, 129,3, 126,0, 120,6, 120,2, 118,2, 117,6, 114,2, 112,7, 111,1, 110,0, 60,1, 29,1, 24,0, 22,1, 18,7.
Получение 53:
(4-Бром-2-хлорфенил)-(2-хлор-5-нитрофенил)метанон (соединение 453)
Реакция проводилась в атмосфере аргона с использованием сухой стеклянной посуды.
4-Бром-2-хлорйодбензол (5,00 г, 15,8 ммоль) растворяли в сухом ТГФ (25 мл) и охлаждали до -35°С. Изопропилмагнийхлорид (2 М в ТГФ, 8,27 мл, 16,5 ммоль) добавляли при перемешивании в течение 90 мин. Раствор ZnCl2 (2,17 г, 15,9 ммоль) в сухом ТГФ (35 мл) медленно добавляли к реакционной смеси при -35°С. Спустя час реакционную смесь оставляли для достижения комнатной температуры и добавляли раствор 2-хлор-5-нитробензоилхлоида (3,64 г, 16,5 ммоль) в ТГФ (45 мл), с последующим добавлением Cu(OAc)2·H2O (63 мг, 0,32 ммоль). Полученную в результате реакционную смесь перемешивали при комнатной температуре в течение 18 час. Реакционную смесь выливали в смесь EtOAc/вода/HCl (1 N). Органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией, используя DCM/петролейный эфир (40-60) 1:6, 1:4, 1:2 в качестве элюента с получением указанного в заголовке в виде соединения желтого цвета.
Получение 54:
(5-Амино-2-хлорфенил)-(4-бром-2-хлорфенил)метанон (соединение 454)
Соединение 453 (2,17 г, 5,79 ммоль) суспендировали в МеОН (50 мл). Добавляли SnCl2·H2O (5,49 г, 28,9 ммоль). Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 1 час. Реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя DCM/петролейный эфир (40-60) от 50:50 до 100:0 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
Получение 55:
(4-Азидо-2-хлорфенил)-(4-бром-2-хлорфенил)метанон (соединение 455)
Соединение 454 (1,21 г, 3,51 ммоль) растворяли в ацетоне (25 мл). Добавляли концентрированную HCl (37%, 1,46 мл, 17,5 ммоль) и раствор охлаждали на ледяной бане. NaNO2 (291 мг, 4,21 ммоль) растворяли в H2O (2,5 мл) и добавляли к вышеупомянутому раствору в течение 20 мин. Внутренняя температура поддерживалась от 0°С до 2°С в процессе добавления. Суспензию перемешивали на ледяной бане в течение 30 мин, после чего раствор NaN3 (348 мг, 5,31 ммоль) в H2O (7,5 мл) добавляли по каплям в течение 30 мин. Добавляли H2O (50 мл) и EtOAc (2Ч75 мл) при перемешивании и фазы разделяли. Органическую фазу промывали солевым раствором и концентрировали в вакууме с получением указанного в заголовке соединения. Неочищенный продукт использовали без дополнительной очистки.
Получение 56:
(4-Бром-2-хлорфенил)-{2-хлор-5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]фенил}метанон (соединение 456)
К раствору соединения 455 (1,32 г, 3,56 ммоль) в этаноле (20 мл) добавляли бут-3-ин-1-ол (0,3 мл, 3,91 ммоль). Свежеприготовленный раствор пентагидрата сульфата меди(II) (36 мг, 0,14 ммоль) и аскорбата натрия (141 мг, 0,71 ммоль) в воде (3,2 мл) добавляли к реакционной смеси. Пробирку закрывали и перемешивали в течение 24 час при комнатной температуре в атмосфере аргона. Реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 40:60 до 95:5 в качестве элюента с получением указанного в заголовке соединения в виде сиропа белого цвета.
Пример 59:
[2-Хлор-4-(2,4-дифторфениламино)фенил]-{2-хлор-5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]фенил}метанон (соединение 159)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 456 (0,91 ммоль) и 2,4-дифторфениламин (0,91 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя MeOH/DCM от 0:100 до 10:90 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
13C ЯМР (CDCl3) δ 191,1, 159,6 (дд), 155,9 (дд), 149,1, 146,7, 141,1, 136,1, 135,7, 134,5, 131,7, 131,6, 126,9, 125,1 (дд), 123,8 (дд), 122,8, 121,0, 119,9, 116,1, 112,8, 111,7 (дд), 105,1 (дд), 61,5, 28,7.
Получение 57:
[2-Хлор-4-(3-фторфениламино)фенил]-(2-метил-5-нитрофенил)метанон (соединение 457)
Реакцию осуществляли подобно тому, как описано в получении соединения 414, используя соединение 402 (2,82 ммоль) и 3-фторфениламин (2,82 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 30:70 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
Получение 58:
(5-Амино-2-метилфенил)-[2-хлор-4-(3-фторфениламино)фенил]метанон (соединение 458)
Реакцию осуществляли подобно тому, как описано в получении соединения 415, используя соединение 457 (2,25 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 1:2 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
Получение 59:
(5-Азидо-2-метилфенил)-[2-хлор-4-(3-фторфениламино)фенил]метанон (соединение 459)
Реакцию осуществляли подобно тому, как описано в получении соединения 416, используя соединение 458 (1,83 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 1:9 и 1:6 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
Пример 60:
[2-Хлор-4-(3-фторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 160)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 459 (0,26 ммоль) и бут-3-ин-1-ол (0,29 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 6:1 в качестве элюента с получением указанного в заголовке соединения в виде пены светло-желтого цвета.
13C ЯМР (CDCl3) δ 194,9, 163,6 (д), 147,6, 146,3, 141,8 (д), 140,7, 138,3, 135,4, 134,8, 133,8, 132,6, 130,9 (д), 128,7, 122,4, 120,9, 120,0, 117,1, 116,1 (д), 113,7, 110,5 (д), 107,6 (д), 61,6, 28,7, 20,0.
Получение 60:
[2-Хлор-4-(3-хлорфениламино)фенил]-(2-метил-5-нитрофенил)метанон (соединение 460)
Реакцию осуществляли подобно тому, как описано в получении соединения 414, используя соединение 402 (2,82 ммоль) и 3-хлорфениламин (3,10 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 30:70 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
Получение 61:
(5-Амино-2-метилфенил)-[2-хлор-4-(3-хлорфениламино)фенил]метанон (соединение 461)
Реакцию осуществляли подобно тому, как описано в получении соединения 415, используя соединение 460 (2,13 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 1:2 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
Получение 62:
(5-Азидо-2-метилфенил)-[2-хлор-4-(3-хлорфениламино)фенил]метанон (соединение 462)
Реакцию осуществляли подобно тому, как описано в получении соединения 416, используя соединение 461 (1,40 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 1:6 в качестве элюента с получением указанного в заголовке соединения в виде сиропа желтого цвета.
Пример 61:
[2-Хлор-4-(3-хлорфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 161)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 462 (0,23 ммоль) и бут-3-ин-1-ол (0,28 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 6:1 в качестве элюента с получением указанного в заголовке соединения в виде пены светло-желтого цвета.
13C ЯМР (CDCl3) δ 194,9, 147,7, 146,3, 141,4, 140,7, 138,3, 135,4, 135,3, 134,8, 133,8, 132,6, 130,7, 128,7, 123,8, 122,4, 120,9, 120,7, 120,0, 118,8, 117,1, 113,6, 61,6, 28,7, 20,0.
Получение 63:
(2-Хлор-4-m-толиламинофенил)-(2-метил-5-нитрофенил)метанон (соединение 463)
Реакцию осуществляли подобно тому, как описано в получении соединения 414, используя соединение 402 (2,82 ммоль) и 3-метилфениламин (3,10 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 5:95 до 30:70 в качестве элюента с получением указанного в заголовке соединения.
Получение 64:
(5-Амино-2-метилфенил)-(2-хлор-4-m-толиламинофенил)метанон (соединение 464)
Реакцию осуществляли подобно тому, как описано в получении соединения 415, используя соединение 463 (1,78 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 1:2 в качестве элюента с получением указанного в заголовке соединения в виде сиропа желтого цвета.
Получение 65:
(5-Азидо-2-метилфенил)-(2-хлор-4-m-толиламинофенил)метанон (соединение 465)
Реакцию осуществляли подобно тому, как описано в получении соединения 416, используя соединение 464 (1,17 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 1:9 и 1:6 в качестве элюента с получением указанного в заголовке соединения в виде сиропа желтого цвета.
Пример 62:
(2-Хлор-4-m-толиламинофенил)-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 162)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 465 (0,25 ммоль) и бут-3-ин-1-ол (0,30 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 6:1 в качестве элюента с получением указанного в заголовке соединения в виде пены светло-желтого цвета.
13C ЯМР (CDCl3) δ 194,8, 148,9, 146,3, 141,1, 139,7, 139,6, 138,1, 135,6, 134,8, 134,0, 132,5, 129,5, 127,5, 125,2, 122,3, 122,2, 120,7, 119,9, 118,7, 116,3, 112,8, 61,6, 28,7, 21,5, 19,9.
Получение 66:
[2-Хлор-4-(3-метоксифениламино)фенил]-(2-метил-5-нитрофенил)метанон (соединение 466)
Реакцию осуществляли подобно тому, как описано в получении соединения 414, используя соединение 402 (2,82 ммоль) и 3-метоксифениламин (3,10 ммоль). Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 30:70 в качестве элюента с получением указанного в заголовке соединения.
Получение 67:
(5-Амино-2-метилфенил)-[2-хлор-4-(3-метоксифениламино)фенил]метанон (соединение 467)
Реакцию осуществляли подобно тому, как описано в получении соединения 415, используя соединение 466 (2,32 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 1:2 в качестве элюента с получением указанного в заголовке соединения в виде пены желтого цвета.
Получение 68:
(5-Азидо-2-метилфенил)-[2-Хлор-4-(3-метоксифениламино)фенил]метанон (соединение 468)
Реакцию осуществляли подобно тому, как описано в получении соединения 416, используя соединение 467 (1,17 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 1:9 и 1:6 в качестве элюента с получением указанного в заголовке соединения.
Пример 63:
[2-Хлор-4-(3-метоксифениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 163)
Реакцию осуществляли подобно тому, как описано в получении соединения 116, используя соединение 468 (0,22 ммоль) и бут-3-ин-1-ол (0,28 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 6:1 в качестве элюента с получением указанного в заголовке соединения в виде пены светло-желтого цвета.
13C ЯМР (CDCl3) δ 194,8, 160,8, 148,5, 141,1, 141,0, 138,1, 135,5, 134,8, 133,9, 132,6, 130,4, 127,8, 122,2, 120,7, 119,9, 116,6, 113,6, 113,2, 109,4, 107,3, 61,6, 55,4, 28,7, 19,9.
Получение 69
(4-Амино-2-метилфенил)-(4-бром-2-хлорфенил)метанон (соединение 469)
Соединение 402 (5,09 г, 14,4 ммоль) растворяли в МеОН (200 мл). Добавляли цинковую пыль (9,38 г, 144 ммоль) и NH4Cl (3,84 г, 71,8 ммоль). Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 2 час. Смесь фильтровали через Decalite и промывали МеОН. Фильтрат концентрировали на силикагеле. Неочищенный продукт очищали флэш-хроматографией в постоянном градиенте, используя EtOAc/петролейный эфир (40-60) от 0:100 до 20:80 в качестве элюента с получением указанного в заголовке соединения в виде сиропа желтого цвета.
Получение 70:
(4-Азидо-2-метилфенил)-(4-бром-2-хлорфенил)метанон (соединение 470)
Соединение 469 (1,00 г, 3,08 ммоль) растворяли в ацетоне (23 мл). Добавляли концентрированную HCl (37%, 1,30 мл, 15 ммоль) и раствор охлаждали на ледяной бане. NaNO2 (225 мг, 3,70 ммоль) растворяли в H2O (2,3 мл) и добавляли к вышеупомянутому раствору в течение 20 мин. Внутренняя температура поддерживалась от 0°С до 2°С в процессе добавления. Суспензию перемешивали на ледяной бане в течение 30 мин, после чего раствор NaN3 (303 мг, 4,60 ммоль) в H2O (7 мл) добавляли по каплям в течение 30 мин. Смесь перемешивали при 0єС в течение 1 час. Добавляли H2O (50 мл) и EtOAc (2×50 мл) и перемешивали, и фазы разделяли. Органическую фазу промывали солевым раствором, сушили (MgSO4), фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения. Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) от 1:20 в качестве элюента с получением указанного в заголовке соединения в виде сиропа желтого цвета.
Получение 71:
(4-Бром-2-хлорфенил)-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 471)
К раствору соединения 470 (1,04 г, 2,97 ммоль) в этаноле (18 мл) добавляли бут-3-ин-1-ол (225 мкл, 2,97 ммоль), пентагидрат сульфата меди(II) (30 мг, 0,12 ммоль) и раствор аскорбата натрия (119 мг, 0,6 ммоль) в воде (3,0 мл). Пробирку закрывали и перемешивали в течение 24 час при комнатной температуре в атмосфере аргона. Через 18 час добавляли бут-3-ин-1-ол (225 мкл, 2,97 ммоль), пентагидрат сульфата меди(II) (30 мг, 0,12 ммоль) и раствор аскорбата натрия (119 мг, 0,6 ммоль) в воде (3,0 мл). Через 2 час реакционную смесь выливали в смесь EtOAc/вода. Органическую фазу промывали водой, солевым раствором и затем сушили (MgSO4), фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией, используя EtOAc/петролейный эфир (40-60) 3:1 в качестве элюента с получением указанного в заголовке соединения в виде не совсем белого твердого вещества.
Пример 64:
[2-Хлор-4-(2,3-дихлорфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 164)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 471 (0,13 ммоль) и 2,3-дихлорфениламин (0,13 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя MeOH/DCM 1:20 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (CDCl3) δ 194,9, 146,4, 140,4, 139,1, 138,5, 135,1, 134,8, 134,0, 133,5, 132,7, 130,0, 127,6, 124,3, 123,2, 122,5, 121,0, 119,9, 118,6, 117,4, 115,2, 61,5, 28,7, 20,1.
Пример 65:
[2-Хлор-4-(3,5-диметилфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 165)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 471 (0,13 ммоль) и 3,5-диметилфениламин (0,13 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя MeOH/DCM 1:20 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (CDCl3) δ 194,8, 149,2, 146,3, 141,2, 139,6, 139,4, 137,9, 135,6, 134,7, 134,1, 132,5, 126,9, 126,0, 122,1, 120,5, 120,0, 119,3, 116,3, 112,7, 67,1, 61,5, 28,8, 21,3, 19,8.
Пример 66:
[2-Хлор-4-(2,5-дифторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 166)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 471 (0,13 ммоль) и 2,5-дифторфениламин (0,13 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя MeOH/DCM 1:20 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (CDCl3) δ 194,9, 158,8 (д), 150,2 (д), 146,3 (д), 140,4, 138,4, 135,2, 134,8, 133,5, 132,7, 129,9, 122,5, 121,0, 119,9, 117,9, 116,6 (дд), 114,5, 109,5 (дд), 107,1 (д), 61,6, 28,7, 20,1.
Пример 67:
[2-Хлор-4-(3,5-дифторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанон (соединение 167)
Реакцию осуществляли подобно тому, как описано в получении соединения 148, используя соединение 471 (0,13 ммоль) и 3,5-дифторфениламин (0,13 ммоль). Неочищенный продукт очищали флэш-хроматографией, используя MeOH/DCM 1:20 в качестве элюента с получением указанного в заголовке соединения.
13C ЯМР (CDCl3) δ 195,0, 163,8 (дд), 146,6, 146,4, 143,1 (т), 140,5, 138,4, 135,2, 134,8, 133,6, 132,7, 132,6, 132,3, 129,4, 122,5, 121,0, 120,1, 118,1, 114,5, 102,2 (м), 98,2 (т), 61,5, 28,8, 20,0.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПРОИЗВОДНЫЕ АМИНОБЕНЗОФЕНОНА | 2004 |
|
RU2396250C2 |
| АМИНОБЕНЗОФЕНОНЫ | 2002 |
|
RU2361855C2 |
| АНТАГОНИСТЫ РЕЦЕПТОРА ВАЗОПРЕССИНА V | 2005 |
|
RU2370497C2 |
| КОНДЕНСИРОВАННЫЕ N-ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРОВ CRF | 2004 |
|
RU2382785C2 |
| БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ И СПОСОБ ЛЕЧЕНИЯ МЛЕКОПИТАЮЩИХ С ИХ ИСПОЛЬЗОВАНИЕМ | 2002 |
|
RU2310655C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА И ИМИДАЗО[4,5-с]ПИРИДИНА, В КАЧЕСТВЕ АНТАГОНИСТА ПУТИ HEDGEHOG | 2010 |
|
RU2533825C2 |
| ИНГИБИТОРЫ ЦИТОЗОЛЬНОЙ ФОСФОЛИПАЗЫ А2 | 2002 |
|
RU2337906C2 |
| ПРОИЗВОДНЫЕ ГИДРОКСИБЕНЗАМИДА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ Hsp90 | 2006 |
|
RU2458919C2 |
| ИНГИБИТОРЫ РЕЦЕПТОРА ФАКТОРА РОСТА ФИБРОБЛАСТОВ | 2013 |
|
RU2679130C2 |
| ТРИАЗОЛОПИРИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ ДЛЯ ЛЕЧЕНИЯ КОЖНЫХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2544011C2 |
Описываются новые триазолзамещенные аминобензофеноновые соединения формулы (Iа) или (Ib) (значения радикалов приведены в формуле изобретения), фармацевтическая композиция, их содержащая, и применение

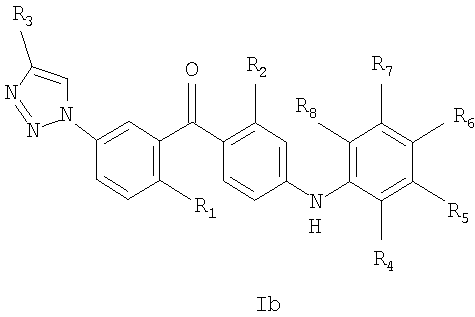
данных соединений, например, в лечении воспалительных, офтальмологических заболеваний или раковой опухоли. 5 н. и 15 з.п. ф-лы, 4 табл.
1. Соединение общей формулы Ia или Ib
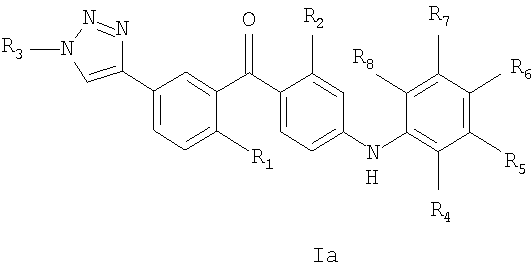

где R1 представляет собой метил, хлор или метокси;
R2 представляет собой хлор или метил;
R3 представляет собой С1-6алкил или С2-6алкенил, каждый из которых необязательно замещен одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из гидрокси, CONH2, оксо,
-S(O)2NH2, C1-4алкоксикарбонила, -NH-C(О)-NH2-, метиламинокарбонила, этиламинокарбонила, пропиламинокарбонила, бутиламинокарбонила, -NH2, С1-4алкилсульфониламино или 5- или 6-членного насыщенного циклоалкильного радикала, содержащего 1-2 гетероатома, выбранного из О или N, где указанные этиламинокарбонил, -NH2 или 5- или 6-членный насыщенный циклоалкильный -радикал, содержащий 1-2 гетероатома, выбранных из О или N, необязательно дополнительно замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из гидрокси, С1-4алкила или С1-4гидроксиалкила;
R5, R6 и R7 независимо друг от друга представляют собой водород или галоген, и где R4 и R8 независимо друг от друга представляют собой водород, галоген или метил;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором R4, R5, R6, R7 и R8 независимо друг от друга представляют собой водород, фтор или хлор.
3. Соединение по любому из пп.1-5, в котором, по крайней мере, три из R4, R5, R6, R7 и R8 представляют собой водород;
4. Соединение по п.3, в котором R5, R7 и R8 представляют собой водород, или в котором R5, R6, R7 и R8 представляют собой водород, или в котором R4, R5, R7 и R8 представляют собой водород.
5. Соединение по п.3, в котором R4, R7 и R8, или R6, R7 и R8, или R4, R6, R7 и R8, или R4, R6 и R8, или R4, R6 и R7 представляют собой водород.
6. Соединение по любому из пп.1-5, в котором R1 представляет собой метил и R2 представляет собой хлор.
7. Соединение по любому из пп.1-2, в котором R3 представляет собой C1-4алкил или С2-4алкенил, каждый из которых необязательно замещен одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из гидрокси, -NH2, -CONH2, оксо, -S(O)2NH2, C1-4алкоксикарбонила, -NH-C(O)-NH2-, метиламинокарбонила, этиламинокарбонила, С1-2алкилсульфониламино или 5- или 6-членного насыщенного циклоалкильного радикала, содержащего 1-2 гетероатома, выбранного из О или N, где указанные этиламинокарбонил, -NН2 или 5- или 6-членный насыщенный циклоалкильный радикал, содержащий 1-2 гетероатома, выбранных из О или N, необязательно дополнительно замещены одним или более одинаковыми или различными заместителями, выбранными из группы, включающей гидрокси или C1-3алкил.
8. Соединение по любому из пп.1 и 2, в котором R3 представляет собой метил, этил, пропил, пропенил, и все они замещены одним, двумя, тремя или четырьмя одинаковыми или различными заместителями, выбранными из группы, состоящей из гидрокси, CONH2, оксо, этиламинокарбонила, метила, пирролидинила, морфолинила, H2N-C(O)-NH-, метоксикарбонила, -NН2, этоксикарбонила, метилсульфониламино, -S(O)2NH2, [1,3]-диоксоланила, этиламино, пиперазинила, последние три дополнительно замещены одним, двумя, тремя или четырьмя одинаковыми или различными заместителями, выбранными из группы, состоящей из метила или этила.
9. Соединение по любому из пп.1 и 2, в котором R3 представляет собой 2-гидроксиэтил, 3-гидроксипропил, карбамоилметил, 2,3-дигидроксипропил, 2-(метилсульфониламино)этил, сульфониламинопропил, 2,2-диметил-[1,3]диоксолан-4-илметил, этоксикарбонилметил, этиламинокарбонилметил, (2-гидрокси-1,1-диметилэтил)аминокарбонилметил, 1-пирролидин-1-илэтанон, 1-морфолин-4-илэтанон, 1-гидрокси-1-метилэтил, ацетил, 1-амино-1-метилэтил, гидроксиметил, 3-гидроксипропенил, 2-аминоэтил, метилмочевина, 2-морфолин-4-илэтил, (4-метилпиперазин-1-ил)этил, 2-диэтиламиноэтил, 2-(2-гидроксиэтиламино)этил, пропиламиноэтил или диэтиламин.
10. Соединение по п.6 общей формулы Iа.
11. Соединение по п.6 общей формулы Ib.
12. Соединение по любому из пп.1-11, выбранное из группы, состоящей из
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(2-гидроксиэтил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанона (соединение 102),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(3-гидроксипропил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанона (соединение 104), [2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(2,2-диметил-[1,3]диоксолан-4-илметил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанона (соединение 105),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(2,3-дигидроксипропил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанона (соединение 106),
2-(4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)ацетамида (соединение 107),
амида 3-(4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)пропан-1-сульфоновой кислоты (соединение 108),
N-[2-(4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)этил]метансульфонамида (соединение 109),
этилового эфира (4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)уксусной кислоты (соединение 110),
2-(4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)-N-этилацетамида (соединение 112),
2-(4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)-N-(2-гидрокси-1,1-диметилэтил)ацетамида (соединение 113),
2-(4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)-1-пирролидин-1-илэтанона (соединение 114),
2-(4-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)-1-морфолин-4-илэтанона (соединение 115),
[2-хлор-4-о-толиламинофенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 117),
[2-хлор-4-(2-хлор-4-фторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 118),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[1-(2-гидроксиэтил)-1Н-[1,2,3]триазол-4-ил]-2-метоксифенил}метанона (соединение 120),
[2-хлор-4-(4-фторфениламино)фенил]-{5-[1-(2-гидроксиэтил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанона (соединение 122),
[2-хлор-4-(4-фторфениламино)фенил]-{5-[1-(2,3-дигидроксипропил)-1Н-[1,2,3]триазол-4-ил]-2-метилфенил}метанона (соединение 124),
2-(4-{3-[2-хлор-4-(4-фторфениламино)бензоил]-4-метилфенил}-[1,2,3]триазол-1-ил)-ацетамида (соединение 125),
[2-хлор-4-(4-фторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 127),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 128),
[2-хлор-4-(2,4-дифтор-фениламино)фенил]-{5-[4-(1-гидрокси-1-метилэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 129),
1-(1-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-1Н-[1,2,3]триазол-1-ил)этанона (соединение 130),
{5-[4-(1-амино-1-метилэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}-[2-хлор-4-(2,4-дифторфениламино)фенил]метанона (соединение 131),
1-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил}-1Н-[1,2,3]триазол-4-карбоксикислоты (соединение 133),
[2-хлор-4-(2,4-дифторфениламино)фенил]-[5-(4-гидроксиметил-[1,2,3]триазол-1-ил)-2-метилфенил]метанона (соединение 134),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[4-(3-гидроксипропенил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 135),
{5-[4-(2-аминоэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}-[2-хлор-4-(2,4-дифторфениламино)фенил]метанона (соединение 136),
(1-{3-[2-хлор-4-(2,4-дифторфениламино)бензоил]-4-метилфенил-1Н-[1,2,3]триазол-4-илметил)мочевины (соединение 137),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{2-метил-5-[4-(2-морфолин-4-илэтил)-[1,2,3]триазол-1-ил]фенил}метанона (соединение 138),
[2-хлор-4-(2,4-дифторфениламино)фенил]-(2-метил-5-{4-[2-(4-метилпиперазин-1-ил)этил]-[1,2,3]триазол-1-ил}фенил}метанона (соединение 139),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[4-(2-диэтиламиноэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 140),
[2-хлор-4-(2,4-дифторфениламино)фенил]-(5-{4-[2-(2-гидроксиэтиламино)этил]-[1,2,3]триазол-1-ил}-2-метилфенил)метанона (соединение 141),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{2-метил-5-[4-(2-пропиламиноэтил)-[1,2,3]триазол-1-ил]фенил}метанона(соединение 142),
[2-хлор-4-(4-фтор-2-метилфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 143),
[2-хлор-4-(2-метоксифениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона(соединение 144),
[2-хлор-4-(4-хлор-2-метилфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона(соединение 145),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{5-[4-(2-этиламиноэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона(соединение 147),
[4-(2,4-дифторфениламино)-2-метилфенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 148),
[4-(3-хлор-4-фторфениламино)-2-метилфенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 149),
{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}-(2-метил-4-фениламинофенил)метанона (соединение 150),
[4-(3,4-дифторфениламино)-2-метилфенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 154),
[4-(3-хлор-2-метилфениламино)-2-метилфенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 156),
[2-хлор-4-(2,4-дифторфениламино)фенил]-{2-хлор-5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]фенил}метанона (соединение 159),
[2-хлор-4-(3-фторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 160),
[2-хлор-4-(3-хлорфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 161),
[2-хлор-4-(2,3-дихлорфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 164),
[2-хлор-4-(2,5-дифторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 166) и [2-хлор-4-(3,5-дифторфениламино)фенил]-{5-[4-(2-гидроксиэтил)-[1,2,3]триазол-1-ил]-2-метилфенил}метанона (соединение 167).
13. Фармацевтическая композиция, обладающая свойствами ингибировать или подавлять активность р38 MAP киназы, включающая соединение по любому из пп.1-12, или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым носителем или наполнителем.
14. Соединение по п.1, обладающее свойствами ингибировать или подавлять активность р38 MAP киназы, для применения в качестве лекарственного средства.
15. Соединение по п.1 обладающее свойствами ингибировать или подавлять активность р38 MAP киназы, для применения в качестве противовоспалительного средства или противоопухолевого средства.
16. Применение соединения по любому из п.п.1-12 для приготовления лекарственного средства для профилактики, лечения или улучшения воспалительных заболеваний или состояний, таких как астма, аллергия, артрит, ревматоидный артрит и спондилоартрит, подагра, атеросклероз, воспалительное заболевание пищеварительного тракта, болезнь Крона, неврологические воспаления, воспалительные заболевания глаз, пролиферативные и воспалительные кожные нарушения, псориаз, атопический дерматит, угри, увеит, сепсис, септический шок, остеопороз, или офтальмологических заболеваний или состояний.
17. Применение соединения по любому из пп.1-12 для приготовления лекарственного средства для лечения или улучшения состояния в случае раковых опухолей.
18. Применение по п.16, в котором офтальмологическое заболевание предусматривает собой острую дегенерацию желтого пятна или возрастную дегенерацию желтого пятна.
19. Способ предотвращения, лечения или улучшения состояния в случае воспалительных заболеваний или состояний таких, как астма, аллергия, артрит, ревматоидный артрит и спондилоартрит, подагра, атеросклероз, воспалительное заболевание пищеварительного тракта, болезнь Крона, неврологические воспаления, воспалительные заболевания глаз, пролиферативные и воспалительные кожные нарушения, псориаз, атопический дерматит, угри, увеит, сепсис, септический шок, остеопороз, или офтальмологических заболеваний или состояний, включающий введение нуждающемуся в этом пациенту эффективного количества соединения по любому из пп.1-12.
20. Способ по п.19, в котором офтальмологическое заболевание представляет собой острую дегенерацию желтого пятна или возрастную дегенерацию желтого пятна.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| US 6313174 B1, 06.11.2001 | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| ЗАМЕЩЕННЫЕ 1,2,3-ТРИАЗОЛЫ | 1992 |
|
RU2076102C1 |
Авторы
Даты
2010-07-20—Публикация
2005-11-28—Подача