ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка является частичным продолжением заявки на патент США No. 10/825060, зарегистрированной 15 апреля 2004 года, в которой заявляется преимущество временной заявки на патент США No. 60/464061, зарегистрированной 18 апреля 2003 года, которые включены в настоящее описание во всей полноте в качестве ссылок для всех целей.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится в основном к сочетанию технологий моноклонального антитела и рекомбинантной ДНК для разработки новых биологически активных соединений и, более конкретно, например, к получению моноклональных антител, которые связываются с фактором роста гепатоцитов и нейтрализуют его.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Гепатоцитарный фактор роста человека (HGF) представляет собой многофункциональный гетеродимерный полипептид, продуцируемый клетками мезенхимы. Было показано, что HGF стимулирует ангиогенез, морфогенез и мотогенез, а также рост и распространение клеток различных типов (Bussolino et al., J. Cell Biol. 119: 629, 1992; Zarnegar and Michalopoulos, J. Cell Biol. 129: 1177, 1995; Matsumoto et al., Ciba, Found. Symp. 212: 198, 1997; Birchmeier and Gherardi, Trends Cell. Biol. 8: 404, 1998; Xin et al., Am. J. Pathol. 158: 1111, 2001). Плейотропный характер активности HGF опосредован его рецептором, трансмембранной тирозинкиназой, кодируемой протоонкогеном cMet. Было показано, что в дополнение к регуляции большого числа нормальных клеточных функций HGF и его рецептор c-Met вовлекаются в инициацию, инвазию и метастазирование опухолей (Jeffers et al., J. Mol. Med. 74: 505, 1996; Comoglio and Trusolino, J. Clin. Invest. 109: 857, 2002). HGF/cMet подвергаются совместной экспрессии, часто - сверхэкспрессии, на разных твердых опухолях человека, включающих опухоли, возникшие из легкого, ободочной кишки, прямой кишки, желудка, почки, яичника, кожи, множественной миеломы и тканей щитовидной железы (Prat et al., Int. J. Cancer 49: 323, 1991; Chan et al., Oncogene 2: 593, 1988; Weidner et al., Am. J. Respir. Cell. Mol. Biol. 8: 229, 1993; Dercksen et al., Blood 99: 1405, 2002). HGF действует как аутокринный (Rong et al., Proc. Natl. Acad. Sci. USA 91: 4371, 1994; Koochekpour et al., Cancer Res. 57: 5391, 1997) и паракринный фактор роста (Weidner et al., Am. J. Respir. Cell. Mol. Biol. 8: 229, 1993) и антиапоптозный регулятор (Gao et al., J. Biol. Chem. 276: 47257, 2001) для этих опухолей.
HGF представляет собой белок размером 102 кДа, обладающий сходством по последовательности и структуре с плазминогеном и другими ферментами системы свертывания крови (Nakamura et al., Nature 342: 440, 1989; Weidner et al., Am. J. Respir. Cell. Mol. Biol. 8: 229, 1993; каждая из работ полностью включена в настоящее описание в качестве ссылки) (фиг.1). Человеческий HGF синтезируется в виде предшественника из 728 аминокислот (preproHGF), который подвергается расщеплению внутри клетки до неактивной одноцепочечной формы (proHGF) (Nakamura et al., Nature 342: 440, 1989; Rosen et al., J. Cell Biol. 127: 1783, 1994). При внеклеточной секреции proHGF расщепляется с образованием активной гетеродимерной молекулы с дисульфидной связью, состоящей из α-субъединицы и β-субъединицы (Nakamura et al., Nature 342: 440, 1989; Naldini et al., EMBO J. 11: 4825, 1992). α-субъединица содержит 440 остатков (размером 69 кДа, с гликозилированием) и состоит из N-концевого шпилечного домена и 4 крингл («kringle») доменов. β-субъединица содержит 234 остатков (34 кДа) и включает домен, подобный домену сериновой протеазы, который утратил протеолитическую активность. Расщепление HGF требуется для активации рецептора, но не для связывания рецептора (Hartmann et al., Proc. Natl. Acad. Sci. USA 89: 11574, 1992; Lokker et al., J. Biol. Chem. 268: 17145, 1992). HGF содержит 4 предположительных сайта N-гликозилирования, 1 - в α-субъединице и 3 - в β-субъединице. HGF имеет 2 уникальных сайта связывания со специфичными клетками: сайт связывания с высокой аффинностью (Kd=2×10-10 M) для cMet рецептора и сайт связывания с низкой аффинностью (Kd=2×10-9 M) для гепаринсульфатных протеогликанов (HSPG), которые присутствуют на поверхности клетки и во внеклеточном матриксе (Naldini et al., Oncogene 6: 501, 1991; Bardelli et al., J. Biotechnol. 37: 109, 1994; Sakata et al., J. Biol. Chem., 272; 9457, 1997). NK2 (белок, включающий N-конец и два первых крингл домена α-субъединицы) достаточен для осуществления связывания с cMet и активации сигнального каскада для переноса, однако для митогенного ответа требуется белок полной длины (Weidner et al., Am. J. Respir. Cell. Mol. Biol. 8: 229, 1993). HSPG связывается с HGF за счет взаимодействия с N-концом HGF (Aoyama, et al., Biochem. 36: 10268, 1997; Sakata et al., J. Biol. Chem. 272: 9457, 1997). Предложенная роль для взаимодействия HSPG-HGF включает повышение биологической доступности HGF, его биологической активности и олигомеризацию HGF (Bardelli et al., J. Biotechnol. 37: 109, 1994; Zioncheck et al., J. Biol. Chem. 270: 16871, 1995).
cMet относится к классу IV семейства рецепторов белка тирозинкиназы. Ген cMet полной длины был клонирован и идентифицирован как cMet протоонкоген (Cooper et al., Nature 311: 29; Park et al., Proc. Natl. Acad. Sci. USA 84: 6379, 1987). Рецептор cMet вначале синтезируется в виде одной цепи, частично гликозированного предшественника, p170(MET) (фиг.1) (Park et al., Proc. Natl. Acad. Sci. USA 84: 6379, 1987; Giordano et al., Nature 339: 155, 1989; Giordano et al., Oncogene 4: 1383, 1989; Bardelli et al., J. Biotechnol. 37: 109, 1994). Впоследствии в ходе гликозилирования белок подвергается протеолитическому расщеплению с образованием гетеродимерного зрелого белка размером 190 кДа (1385 аминокислот), состоящего из α-субъединицы размером 50 кДа (остатки 1-307) и β-субъединицы размером 145 кДа. Цитоплазматический домен тирозинкиназы в β-субъединице вовлекается в сигнальную передачу.
Было использовано несколько стратегий для получения молекулы, оказывающей антагонистический эффект на взаимодействие HGF/cMet, которые включали использование: усеченных HGF белков, таких как NK1 (N-концевой домен плюс крингл-домен 1; Lokker et al., J. Biol. Chem. 268: 1745, 1993), NK2 (N-концевой домен плюс крингл-домены 1 и 2; Chan et al., Science 254: 1382, 1991) и NK4 (N-концевой домен плюс четыре крингл-домена; Kuba et al., Cancer Res. 60: 6737, 2000), анти-cMet мАт (Dodge, Master's Thesis, San Francisco State University, 1998) и анти-HGF мАт (Сао et al., Proc. Natl. Acad. Sci. USA 98: 7443, 2001, данная работа полностью включена в настоящее описание в качестве ссылки).
NK1 и NK2 могут эффективно конкурировать с HGF за связывание с его рецептором, но, как было показано, демонстрируют частичную агонистскую активность in vitro (Cioce et al., J. Biol. Chem. 271: 13110; Schwall et al., J. Cell. Biol. 133: 709, 1996), а не желательную чисто антагонистскую активность. Недавно Куба с соавт. (Kuba et al., Cancer Res. 60: 6737, 2000) показали, что NK4 может частично ингибировать первичный рост (фиг.2) и метастазирование мышиной опухоли легкого LLC на модели «голых» мышей («nude») при проведении непрерывной инфузии NK4. Тот факт, что NK4 нужно вводить непрерывно для достижения частичного ингибирования роста первичных опухолей указывает на предположительно короткий период полувыведения молекулы NK4 и/или на потерю активности. В сравнении с использованием NK4 стратегия, основанная на применении антител, обладает рядом преимуществ, определяемых благоприятной фармакокинетикой и возможностью получения антител с более высокой активностью.
В рамках другого подхода Додж (Dodge, Master's Thesis, San Francisco State University, 1998) получал моноклональные анти-cMet антитела с антагонистской активностью (мАт). Одно моноклональное антитело, 5D5, демонстрировало мощную антагонистскую активность, по данным анализа ELISA, но индуцировало пролиферативный ответ в cMet-экспрессирующих BAF-3 клетках, преимущественно за счет димеризации мембранных рецепторов. Прат с соавт. (Prat et al., J. Cell Sci. 111: 237, 1998) также сообщили о наличии такой агонистской активности у анти-cMet мАт. Закколо с соавт. (Zaccolo et al., Eur. J. Immunol. 27: 618, 1997) использовали методы фагового дисплея для получения человеческих Fab фрагментов против мышиного и человеческого гепатоцитарного фактора роста. Указанные Fab фрагменты не оказывали эффекта на активность HGF при использовании по отдельности. Однако, когда один из Fab фрагментов против человеческого HGF объединяли с антителом, которое само по себе связывается с Fab фрагментом, происходило повышение активности HGF, по результатам биотеста.
Као с соавт. (Cao et al., Proc. Natl. Acad. Sci. USA 98: 7443, 2001) показали, что введение смеси трех анти-HGF мАт, которые были отобраны по их способности ингибировать рассеивающую активность HGF in vitro, приводит к ингибированию роста опухолей человека на модели «голых» мышей с ксенотрансплантатом (фиг.3). Они сделали вывод, что три мАт, распознающие три разных сайта связывания на HGF, необходимы для ингибирования биологической активности HGF in vivo: два мАт ингибируют связывание HGF с cMet и один мАт ингибирует связывание HGF с гепарином. Однако для коммерческого применения и с целью регуляции непрактично создавать препарат, объединяющий три новых мАт, в частности, в связи с тем, что должна быть доказана клиническая активность независимо каждого антитела.
Таким образом, существует необходимость в одном моноклональном антителе, способном блокировать биологическую активность HGF in vitro и in vivo. Настоящее изобретение отвечает на эту и другие потребности.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном варианте настоящее изобретение относится к нейтрализующему мАт против гепатоцитарного фактора роста человека (HGF). Указанное антитело ингибирует по меньшей мере одну и предпочтительно несколько или все виды биологической активности HGF, включая связывание с его рецептором cMet, индуцирование рассеивания клеток, таких как клетки почки собаки Madin-Darby, индукцию пролиферации эпителиальных клеток обезьяны 4MRr-5 и/или гепатоцитов и/или HUVEC и индукцию ангиогенеза. Анти-HGF мАт может ингибировать такую активность, если его используют в качестве единственного агента. Предпочтительно анти-HGF антитело ингибирует, наиболее предпочтительно полностью ингибирует рост ксенотрансплантата опухоли человека у мыши. Предпочтительно мАт по настоящему изобретению представляет собой химерное, гуманизированное, подобное человеческому или человеческое антитело. Примеры таких антител включают L2G7 и его химерные и гуманизированные формы. Изобретение также относится к клеточным линиям, продуцирующим такие антитела. В другом варианте описывается фармацевтическая композиция, содержащая нейтрализующее анти-HGF антитело, например химерное или гуманизированное антитело L2G7. В третьем варианте фармацевтическую композицию вводят пациенту для лечения рака или другого заболевания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1. Схематическое изображение структуры HGF и cMet.
Фиг.2. График, показывающий, что NK4 частично ингибирует первичный рост мышиной опухоли легкого LLC у «голых» мышей (см. Kuba et al., Cancer Res. 60: 6737, 2000). NK4 вводят непрерывной инфузией в течение 14 дней, начиная с 4-го дня после подкожной (п/к) имплантации опухоли «голым» мышам.
Фиг.3. График, показывающий, что смесь трех анти-HGF мАт требуется для ингибирования роста клеток опухоли мозга человека U-118 у «голых» мышей (см. Cao et al., Proc. Natl. Acad. Sci. USA 98: 7443, 2001). Опухолевые клетки U-118 инъецируют п/к «голым» мышам. Начиная с первого дня анти-HGF мАт А-1, -5 и -7 или мАт 7-2 и -3 вводят в дозе 200 мкг/инъекцию два раза в неделю в течение 10 недель.
Фиг.4. Определение связывающих эпитопов mat L1H4, L2C7, L2G7 с использованием механизма конкурентного связывания в рамках методики ELISA. На планшеты наслаивают рекомбинантный HGF (rHGF), блокируют сепарированным молоком и инкубируют с субоптимальными концентрациями биотинилированных мАт в присутствии 100-кратного избытка немеченых мАт. Связывание биотинилированных мАт выявляют при добавлении HRP-стрептавидина.
Фиг.5. Связывание анти-HGF мАт с rHGF, определяемое при непосредственном связывании HGF по методу ELISA. На планшеты наслаивают H1-F11 супернатант, содержащий rHGF, блокируют 2% сепарированным молоком и инкубируют с мАт, после чего добавляют HRP-GoMIgG (как описано в разделе примеров).
Фиг.6. Способность анти-HGF мАт улавливать rHGF-Flag в растворе. Анти-HGF мАт улавливают на планшетах для ELISA, покрытых козьим антимышиным IgG. Далее планшеты блокируют 2% сепарированным молоком и инкубируют с rHGF-Flag, после чего добавляют HRP-M2 анти-Flag мАт (как описано в разделе примеров).
Фиг.7. Ингибирование связывания rHGF-Flag с cMet-Fc с помощью анти-HGF мАт в методе ELISA с захватом. cMet-Fc, включенный в планшет для ELISA, покрытый козьим антимышиным IgG, инкубируют с HGF-Flag, который был предварительно проинкубирован с/без мАт. Связанный rHGF-Flag выявляют при добавлении HRP-M2 анти-Flag мАт (как описано в разделе примеров).
Фиг.8. Нейтрализация HGF - индуцированного рассеивания MDCK анти-HGF мАт L2G7. (А) Контроль без какой-либо обработки. (В) rHGF+IgG. (С) rHGF+мАт L2G7. MDCK клетки инкубируют с культуральным супернатантом H1-F11 в разбавлении 1:20 (≈3 мкг/мл HGF) в присутствии 10 мкг/мл мАт. Фотографии сделаны при 100-кратном увеличении.
Фиг.9. Ингибирование HGF-индуцированной пролиферации Mv I LU клеток моноклональным антителом L2G7. Кратный молярный избыток мАт относительно HGF показан на горизонтальной оси, тогда как на вертикальной оси показан уровень включения в имп/мин ×10-2. Представленные данные получены в результате анализа в тройном повторе.
Фиг.10. Ингибирование HGF-индуцированной пролиферации HUVEC моноклональным антителом L2G7 и контрольным мышиным антителом (mIgG). Представленные данные получены в результате анализа в тройном повторе.
Фиг.11. Эффект на HGF-индуцированную пролиферацию опухолевых клеток ободочной кишки НСТ 116 антител L2G7 и L1H4. Представленные данные получены в результате анализа в тройном повторе.
Фиг.12. Эффект обработки мАт L2G7 или PBS (контроль) на рост опухолей U-118 в группах мышей NIH III Beige/Nude (n=6). Стрелки указывают время начала инъекций. (А) Размер опухоли относительно дня имплантации опухоли. (В) Масса опухоли к концу эксперимента.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретении относится к нейтрализующим анти-HGF моноклональным антителам, к содержащим их фармацевтическим композициям и к способам их использования для лечения заболевания.
1. Антитела
Антитела представляют собой крупные, сложные молекулы (с молекулярной массой ≈150000 или включающие примерно 1320 аминокислот) со сложной внутренней структурой. Молекула природного антитела содержит две идентичных пары полипептидных цепей, где каждая из пар содержит одну легкую цепь и одну тяжелую цепь. Каждая легкая и каждая тяжелая цепь, в свою очередь, состоит из двух участков: вариабельного ("V") участка, вовлекаемого в связывание с антигеном-мишенью, и константного ("С") участка, который взаимодействует с другими компонентами иммунной системы. Вариабельные участки легкой и тяжелой цепи складываются вместе в пространственную трехмерную структуру с образованием вариабельного участка, который связывается с антигеном (например, с рецептором на поверхности клетки). Внутри каждого вариабельного участка легкой и тяжелой цепи имеется три коротких сегмента (включающие в среднем 10 аминокислот в длину), называемые гипервариабельными участками (CDR). Шесть CDR в вариабельном домене антитела (три из легкой цепи и три из тяжелой цепи) складываются вместе в трехмерную пространственную структуру с образованием фактического связывающего сайта антитела, который захватывает антиген-мишень. Положение и длина CDR точно определены (Kabat, E. et al., Sequences of Proteins of Immunological Interest, US Department of Health and Human Services, 1983, 1987). Часть вариабельного участка, не содержащегося в CDR, называется каркасной областью, которая формирует окружающую среду для CDR.
Моноклональное антитело представляет собой один молекулярный вид антител и в этой связи не включает поликлональные антитела, образуемые при инъекции животному (такому как грызун, кролик или коза) антигена с последующим отбором сыворотки от животного. Гуманизированное антитело представляет собой антитело, полученное в результате генетической манипуляции с антителом (моноклональным), в котором CDR из мышиного антитела («донорного антитела», которое может быть также взято от крысы, хомяка или другого аналогичного вида животного) приживляют на человеческое антитело («акцепторное антитело»). Гуманизированные антитела могут быть также получены на основе CDR из мышиного антитела, которые имеют меньший размер, чем полные CDR (см., например, Pascalis et al., J. Immunol. 169: 3076, 2002). Таким образом, гуманизированное антитело представляет собой антитело, содержащее CDR из донорного антитела, а каркасную область вариабельного участка и константные участки из человеческого антитела. Так, в типичном случае гуманизированное антитело содержит (i) легкую цепь, содержащую три CDR из мышиного антитела, например, L2G7, каркасную область вариабельного участка из человеческого антитела и константный участок из человеческого антитела, и (ii) тяжелую цепь, содержащую три CDR из мышиного антитела, например, L2G7, каркасную область вариабельного участка из человеческого антитела и константный участок из человеческого антитела. Кроме того, для сохранения высокой аффинной активности может использоваться по меньшей мере один из двух дополнительных структурных элементов. См. патенты США NoNo. 5530101 и 5585089, включенные в настоящее описание в качестве ссылки, в которых даны подробные инструкции для конструирования гуманизированных антител.
В случае первого структурного элемента каркасную область вариабельного участка тяжелой цепи гуманизированного антитела выбирают таким образом, чтобы достигалась максимальная идентичность по последовательности (от 65% до 95%) с каркасной областью вариабельного участка тяжелой цепи донорного антитела путем соответствующего выбора акцепторного антитела среди множества известных человеческих антител. Идентичность по последовательности определяют в процессе сопоставления сравниваемых последовательностей в соответствии с нумерацией Кабата (Kabat). В случае второго структурного элемента, применяемого при конструировании гуманизированного антитела, выбранные аминокислоты в каркасной области акцепторного человеческого антитела (за пределами CDR), замещаются соответствующими аминокислотами из донорного антитела в соответствии с установленными правилами. Конкретно, аминокислоты, подлежащие замещению в каркасной области, выбирают на основе их способности взаимодействовать с CDR. Например, замещенные аминокислоты могут примыкать к CDR в последовательности донорного антитела или находиться на расстоянии 4-6 ангстрем от CDR в гуманизированном антителе по результатам измерения в 3-мерном пространстве.
Химерное антитело представляет собой антитело, в котором вариабельный участок мышиного антитела (или антитела из другого грызуна) объединен с константным участком человеческого антитела; конструирование таких антител методами генетической инженерии хорошо известно в данной области. Такие антитела сохраняют связывающую специфичность, характерную для мышиного антитела, тогда как примерно на 2/3 они являются человеческими антителами. Доля не человеческой последовательности, имеющаяся в мышином, химерном или гуманизированном антителе, позволяет полагать, что иммуногенность химерных антител будет характеризоваться средним значением между значениями для мышиных и гуманизированных антител. Другие типы генетически сконструированных антител, которые могут обладать сниженной иммуногенностью относительно мышиных антител, включают человеческие антитела, полученные с использованием методов фагового дисплея (Dower et al., WO 91/17271; McCafferty et al., WO 92/001047; Winter, WO 92/20791; and Winter, FEBS Lett. 23:92, 1998, каждая из указанных работ включена в настоящее описание в качестве ссылки) или с использованием трансгенных животных (Lonberg et al., WO 93/12227; Kucherlapati WO 91/10741, каждая из указанных работ включена в настоящее описание в качестве ссылки).
В контексте настоящего описания термин «подобное человеческому» применительно к антителу относится к мАт, в котором существенная часть аминокислотной последовательности в одной или обеих цепях (в частности, примерно 50% или более) происходит из человеческих генов иммуноглобулина. В этой связи подобные человеческому антитела включают, без ограничения, химерные, гуманизированные и человеческие антитела. В контексте настоящего описания термин «сниженная иммуногенность» применительно к антителу рассматривается как ожидаемая значительно меньшая иммуногенность, чем у мышиного антитела, при введении такого антитела людям. Такие антитела охватывают химерные, гуманизированные и человеческие антитела, а также антитела, полученные при замещении специфических аминокислот в мышиных антителах, которые могут вовлекаться в В- или Т-клеточные эпитопы, например, экспонированных остатков (Padlan, Mol. Immunol. 28: 489, 1991). В контексте настоящего описания термин «генетически сконструированное» применительно к антителу относится к такому антителу, для которого гены были сконструированы или введены в неприродную среду (например, человеческие гены в мыши или бактериофаге) с помощью методик рекомбинатной ДНК и которое не будет включать мышиное мАт, полученное с использованием традиционных гибридомных методов.
Эпитоп мАт представляет собой участок того антигена, с которым мАт связывается. Два антитела связываются с одним эпитопом или перекрывающимися эпитопами, если каждый из них конкурентно ингибирует (блокирует) связывание другого антитела из этой пары антител с антигеном. Так, 1-кратный, 5-кратный, 10-кратный, 20-кратный или 100-кратный избыток одного антитела ингибирует связывание другого антитела по меньшей мере на 50%, но предпочтительно на 75%, 90% или даже на 99% по результатам измерения в тесте на конкурентное ингибирование в сравнении с контрольным, не конкурирующим антителом (см., например, Junghans et al., Cancer Res. 50:1495, 1990, данная работа включена в настоящее описание в качестве ссылки). Альтернативно, два антитела имеют один и тот же эпитоп, если по существу все аминокислотные мутации в антигене, которые снижают или устраняют связывание одного антитела, снижают или устраняют связывание другого антитела. Два антитела имеют перекрывающиеся эпитопы, если некоторые аминокислотные мутации, которые снижают или устраняют связывание одного антитела, снижают или устраняют связывание другого антитела.
2. Нейтрализующие анти-HGF антитела
Считается, что моноклональное антитело (мАт), которое связывается с HGF, нейтрализует HGF или может его нейтрализовать, если связывание частично или полностью ингибирует одну или несколько биологических активностей HGF (например, когда HGF используется в качестве единственного агента). В число тех биологических свойств HGF, которые может ингибировать нейтрализующее антитело, входят способность HGF связываться с cMet рецептором, вызывая распространение некоторых клеточных линий, таких как клетки почки собаки Madin-Darby (MDCK); стимулировать пролиферацию некоторых клеток (т.е. быть для них митогенными), включая гепатоциты, эпителиальные клетки обезьяны 4MBr-5и клеток различных опухолей человека; или стимулировать ангиогенез, например, по результатам измерения пролиферации эпителиальных клеток сосудов человека (HUVEC), или формирования трубки, или индукции кровеносных сосудов, при нанесении на хориоаллантоическую мембрану эмбриона цыпленка (САМ). Антитела согласно настоящему изобретению предпочтительно связываются с человеческим HGF, например с белком, кодируемым последовательностью, депонированной в Genbank под номером D90334 (соответствующая информация включена в настоящее описание в качестве ссылки).
Нейтрализующее мАт по настоящему изобретению в концентрации, например, 0,01, 0,1, 0,5, 1, 2, 5, 10, 20 или 50 мкг/мл будет ингибировать биологическую функцию HGF (например, стимуляцию пролиферации или рассеивания) примерно на 50%, но предпочтительно на 75%, более предпочтительно на 90%, 95% или даже на 99% и наиболее предпочтительно на 100% (по существу полностью), при оценке по методам анализа, описанным в примерах или известным в данной области. Ингибирование рассматривается как полное, если уровень активности находится в пределах ошибки для отрицательного контроля без HGF. В типичном случае степень ингибирования измеряют при использовании количества HGF, достаточного для полной стимуляции биологической активности или составляющего 0,05, 0,1, 0,5, 1, 3 или 10 мкг/мл. Предпочтительно достигается по меньшей мере 50%, 75%, 90% или 95% или по существу полное ингибирование при наличии молярного соотношения антитела к HGF в 0,5-кратном, 1-кратном, 2-кратном, 3-кратном, 5-кратном или 10-кратном количестве. Предпочтительно мАт будет нейтрализовывать, например ингибировать, биологическую активность, в случае его использования в качестве единственного агента, но возможно необходимо совместное действие 2 мАт для ингибирования. Наиболее предпочтительно мАт будет нейтрализовывать только одну из нескольких биологических активностей, перечисленных выше; в контексте настоящего описания анти-HGF мАт, который, используемый в качестве единственного агента, нейтрализует все виды биологической активности HGF, называется «полностью нейтрализующим», и такие мАт являются наиболее предпочтительными. МАт согласно настоящему изобретению предпочтительно являются специфичными для HGF, что означает, что они не связываются или связываются в существенно меньшей степени (например, со значением Ка, меньшим по крайней мере в 10 раз) с белками, близкими к HGF, такими как фактор роста фибробластов (FGF) и фактор роста эндотелиальных клеток сосудов (VEGF). Предпочтительные антитела не имеют агонистской активности в отношении HGF. Это означает, что антитела блокируют взаимодействие HGF с cMet без стимуляции непосредственно клеток, содержащих HGF. МАт согласно настоящему изобретению в типичном случае имеют аффинность по связыванию (Ка) для HGF, равную по меньшей мере 107 М-1, но предпочтительно 108 М-1 или выше и наиболее предпочтительно 109 М-1 или выше или даже 1010 М-1 или выше.
МАт согласно настоящему изобретению включают анти-HGF антитела в их природной тетрамерной форме (2 легких цепи и 2 тяжелых цепи) и могут относиться к любому из известных изотипов IgG, IgA, IgM, IgD и IgE и их подтипам, например к человеческому IgG1, IgG2, IgG3, IgG4 и к мышиному IgG1, IgG2a, IgG2b и IgG3. Следует также понимать, что мАт согласно настоящему изобретению включают фрагменты антител, такие как Fv, Fab и F(ab')2; бифункциональные гибридные антитела (см., например, Lanzavecchia et al., Eur. J. Immunol. 17: 105, 1987), одноцепочечные антитела (Huston et al., Proc. Natl. Acad. Sci. USA 85: 5879, 1988; Bird et al. Science 242: 423, 1988) и антитела с измененными константными участками (см., например, патент США No. 5 624 821). МАт могут также иметь животное происхождение (например, могут быть получены от мыши, хомяка или курицы), или они могут быть созданы генно-инженерными методами. МАт грызунов могут быть получены стандартными методами, известными в данной области, которые включают множественную иммунизацию HGF в соответствующем адъюванте в/б или в/в или в подушечки лап с последующим отбором клеток из селезенки или лимфатических узлов и слиянием их с подходящей иммортализованной клеточной линией, после чего проводят селекцию гибридом, которые продуцируют антитело, связывающееся с HGF, в частности, как описано в приведенных примерах. Химерные и гуманизированные антитела, получаемые по известным методикам, указанным выше, представляют собой предпочтительный аспект настоящего изобретения. Человеческие антитела, получаемые, например, с использованием фагового дисплея или трансгенных мышей, являются также предпочтительными (см., например. Dower et al., McCafferty et al., Winter, Londberg et al., Kucherpalati, supra). В более широком аспекте антитела, подобные человеческому, обладающие сниженной иммуногенностью, и антитела, полученные генетическими методами, в соответствии с данным в описании определением, все, рассматриваются как предпочтительные.
Нейтрализующие анти-HGF мАт L1H4, L2C7 и L2G7, описанные ниже, представляют примеры осуществления настоящего изобретения, где L2G7 является предпочтительным примером. Нейтрализующие мАт с одинаковыми или перекрывающимися эпитопами, как любое из указанных мАт, например, как L2G7, относятся к другому варианту осуществления изобретения. МАт (включая химерные, гуманизированные и человеческие антитела), которые конкурируют с L2G7 за связывание с HGF и нейтрализуют HGF, по результатам одного и предпочтительно всех тестов in vitro или in vivo, приведенных в настоящем описании, являются также предпочтительными. МАт, которые на 90%, 95%, 99% или 100% идентичны (при определении путем сопоставления последовательностей антител, в соответствии с правилом Кабата), с L2G7 по аминокислотной последовательности, по меньшей мере в CDR, включены в настоящее изобретение. Предпочтительно такие антитела отличаются от L2G7 по небольшому числу функционально не последовательных аминокислотных замещений (например, консервативных замещений), делеций или вставок. Предпочтительно такие антитела сохраняют функциональные свойства L2G7, т.е. такие антитела нейтрализуют HGF, по результатам одного и предпочтительно всех тестов in vitro или in vivo, приведенных в настоящем описании. Для целей классификации аминокислотных замещений как консервативных или неконсервативных аминокислоты могут быть сгруппированы следующим образом: Группа I (с гидрофобными боковыми цепями): норлейцин, met, ala, val, leu, ile; Группа II (с нейтральными гидрофильными боковыми цепями): cys, ser, thr; Группа III (с кислыми боковыми цепями): asp, glu; Группа IV (основные боковые цепи): asn, gln, his, lys, arg; Группа V (остатки, влияющие на ориентацию цепи): gly, pro; и Группа VI (ароматические боковые цепи): trp, tyr, phe. Консервативные замещения включают замещения между аминокислотами в пределах одного класса. Неконсервативные замещения представляют собой замену представителя одного класса на представителя другого класса.
Нативные мАт согласно настоящему изобретению могут быть получены из гибридом. МАт, полученные в результате генетических манипуляций, могут быть экспрессированы при использовании многих известных в данной области методик. Например, гены, кодирующие V участки их легкой и тяжелой цепи, могут быть синтезированы на основе перекрывающихся олигонуклеотидов и далее встроены вместе в С участки векторов экспрессии (например, коммерчески доступных от компании Invitrogen), которые обеспечивают необходимые регуляторные участки, например промоторы, энхансеры, поли-А сайты и т.п. Предпочтительно при этом использование промотора-энхансера из CMV. Векторы экспрессии могут быть трансфицированы с использованием различных известных методов, таких как метод, основанный на применении липофектина, и электропорация, во множество клеточных линий млекопитающих, таких как СНО или непродуцирующие миеломы, включающие Sp2/0 и NSO, и далее клетки, экспрессирующие антитела, отбирают путем селекции с использованием соответствующего антибиотика. См., например, патент США No. 5530101. Большие количества антитела могут быть получены при выращивании клеток в коммерчески доступных биореакторах.
После экспрессии мАт или другие антибиотики согласно настоящему изобретению могут быть очищены в соответствии с известными стандартными процедурами, такими как микрофильтрация, ультрафильтрация, аффинная хроматография с белком А или G, гель-хроматография, анионообменная хроматография, катионообменная хроматография и/или другие формы аффинной хроматографии, основанные на органических красителях или т.п. Предпочтительны по существу чистые антитела, которые на 90 или 95% являются гомогенными, и наиболее предпочтительны антитела с гомогенностью 98% или 99% для их фармацевтического применения.
3. Терапевтические методы
В предпочтительном варианте настоящее изобретение относится к фармацевтической композиции, содержащей антитела, приведенные в настоящем описании. Так, антитела могут использоваться при производстве лекарственного средства для лечения заболевания. Фармацевтические композиции (например, лекарственные препараты) антител содержат мАт в физиологически приемлемом носителе, необязательно при наличии наполнителей или стабилизаторов, в форме лиофилизированного или водного растворов. Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают буферы, такие как фосфатный, цитратный или ацетатный, при рН в типичном случае от 5,0 до 8,0 и чаще всего - при рН от 6,0 до 7,0; соли, такие как хлорид натрия, хлорид калия и т.п., для поддержания изотоничности; антиоксиданты, консерванты, низкомолекулярные полипептиды, белки, гидрофильные полимеры, такие как полисорбат 80, аминокислоты, углеводы, хелатирующие агенты, сахара и другие стандартные ингредиенты, известные специалистам в данной области (Remington's Pharmaceutical Science 16th edition, Osol, A. Ed. 1980). МАт в типичном случае присутствует в концентрации от 1 до 100 мг/мл, например 10 мг/мл.
Антитела согласно настоящему изобретению являются по существу чистыми, свободными от нежелательного загрязнения. Это означает, что антитело является в типичном случае чистым по меньшей мере на 50 вес.% (вес./вес.), а также по существу свободным от мешающих белков и загрязнителей. Предпочтительно антитела являются чистыми по меньшей мере на 90, 95 вес.% или 99 вес.%. Фармацевтические композиции для парентерального введения обычно являются стерильными, по существу изотоничными и полученными в соответствии с требованиями, предъявляемыми к производственным процессам FDA или аналогичного учреждения.
В другом предпочтительном варианте настоящее изобретение относится к способу лечения пациента с использованием анти-HGF в составе фармацевтической композиции. МАт, приготовленное в составе фармацевтической композиции, может быть введено пациенту любым приемлемым способом, в особенности парентерально, путем инфузии или инъекции болюсом, внутримышечно или подкожно. Внутривенная инфузия может проводиться в течение 15 минут, но чаще - в течение 30 минут или в течение 1, 2 или даже 3 часов. МАт могут быть также инъецированы непосредственно в пораженный заболеванием участок (например, в опухоль) или могут быть инкапсулированы внутрь агентов-носителей, таких как липосомы. Вводимая доза должна быть достаточной для облегчения состояния, подлежащего лечению («терапевтически эффективная доза»), и может составлять от 0,1 до 5 мг/кг веса тела, например 1, 2, 3 или 4 мг/кг, например 50, 100, 200, 500 или 1000 мг/кг. Может вводиться также фиксированная стандартная доза, например 50, 100, 200, 500 или 1000 мг/кг, или вводимая доза может подбираться с учетом площади тела пациента, например, 100 мг/м2. Обычно для лечения рака вводят от 1 до 8 доз (например, 1, 2, 3, 4, 5, 6, 7 или 8), но может вводиться 10, 20 или более доз. МАт могут вводиться ежедневно, раз в две недели, еженедельно, через неделю, ежемесячно или с некоторым другим интервалом, в зависимости, например, от периода полувыведения мАт, в течение 1 недели, 2 недель, 4 недель, 8 недель, 3-6 месяцев или дольше. Возможны также повторные курсы лечения, как, например, в случае хронического введения. Режим дозирования и интервалы между введениями, позволяющие облегчить или по меньшей мере частично остановить проявление симптомов заболевания (биохимических, гистологических и/или клинических), включая его осложнения и промежуточные фенотипы в развитии заболевания, рассматривается как терапевтически эффективный режим.
Фармацевтические композиции согласно настоящему изобретению могут также использоваться для профилактики в случае пациента с риском развития рака. Такие пациенты включают людей, имеющих генетическую предрасположенность к раку, пациентов, подвергающихся воздействию канцерогенных агентов, таких как радиация или токсины, а также пациентов, которые ранее подвергались лечению по поводу рака или имеют риск его рецидива. Профилактическая доза представляет собой такое количество, которого достаточно для устранения или снижения риска развития, снижения тяжести или задержки проявления заболевания, включая биохимические, гистологические и/или клинические симптомы заболевания, его осложнения и промежуточные фенотипы, проявляемые в развитии заболевания. Введение фармацевтической композиции в количестве и с интервалами, эффективными для достижения одного или нескольких указанных эффектов, рассматривается как профилактически эффективный режим.
Заболевания, которые характеризуются особой чувствительностью к лечению анти-HGF мАт по настоящему изобретению, включают солидные опухоли, в отношении которых известно или предполагается потребность в ангиогенезе или наличие ассоциации с повышенными уровнями HGF, например рак яичника, рак молочной железы, рак легкого (мелкоклеточный или не мелкоклеточный), рак ободочной кишки, рак предстательной железы, рак поджелудочной железы, рак почки, рак желудка, рак печени, рак головы и шеи, меланома, саркомы и опухоли мозга (например, глиобластомы) у взрослых и детей. Данное лечение может проводиться также в случае пациентов с лейкозом и лимфомами. В предпочтительном варианте анти-HGF мАт могут вводиться вместе с другими противораковыми средствами (например, до, во время или после такой терапии). Например, анти-HGF мАт могут вводиться вместе с одним или несколькими химиотерапевтическими препаратами, известными специалистам в области онкологии, такими как, например, таксол (паклитаксел) или его производные, соединения платины, такие как карбоплатина или цисплатина, антроциклины, такие как доксорубицин, алкилирующие агенты, такие как циклофосфамид, антиметаболиты, такие как 5-фторурацил, или этопозид. Анти-HGF мАт могут вводиться в сочетании с двумя или более агентами в стандартном режиме химиотерапии, таком как, например, таксол и карбоплатина, например, при раке молочной железы и раке яичников. Другие агенты, с которыми анти-HGF мАт могут вводиться, включают биологические активные соединения, такие как моноклональные антитела, включающие Герцептин™ (Herceptin™) против антигена HER2, Авастин™ (Avastin™) против VEGF, или антитела против рецептора EGF, а также малые молекулы препаратов с антиангиогенной активностью или с антагонистской активностью против рецептора EGF. Кроме того, анти-HGF мАт могут использоваться вместе с лучевой терапией или с хирургическими методами.
Лечение (например, в курсе стандартной химиотерапии), включающее анти-HGF моноклональное антитело, может повышать средний показатель времени выживания без прогрессирования или общее время выживания пациентов с указанными опухолями (например, яичников, молочной железы, легкого, поджелудочной железы, мозга и ободочной кишки, в особенности в случае рецидивирующей или рефракторной опухоли) по меньшей мере на 30% или 40%, но предпочтительно на 50%, 60%-70% или даже на 100% или больше, в сравнении с аналогичным лечением (например, в курсе химиотерапии), но без анти-HGF мАт. В дополнение или в альтернативном варианте, лечение (например, в курсе химиотерапии), включающее анти-HGF мАт, может повышать скорость полного ответа, частичного ответа или скорость объективного (полного + частичного) у пациентов с указанными опухолями (например, яичников, молочной железы, легкого, поджелудочной железы, мозга и ободочной кишки, в особенности в случае рецидивирующей или рефракторной опухоли) по меньшей мере на 30% или 40%, но предпочтительно на 50%, 60%-70% или даже на 100% или больше, в сравнении с аналогичным лечением (например, в курсе химиотерапии), но без анти-HGF мАт. Необязательно данное лечение может ингибировать инвазию опухолей или их метастазирование.
В типичном случае в клиническом испытании (например, на фазе II, фазе II/III или фазе III испытания) указанный средний показатель времени выживания без прогрессирования болезни и/или скорость ответа пациентов, подвергающихся химиотерапии плюс анти-HGF мАт, относительно контрольной группы пациентов, подвергающихся только химиотерапии (или плюс плацебо), будут статистически значимыми, например, на уровне р=0,05, или 0,01, или даже 0,001. Для каждого специалиста в данной области очевидно, что скорости полного и частичного ответа определяются по объективным критериям, используемым в клинических испытаниях рака, например в соответствии с критериями, перечисленными или утвержденными Национальным Институтом рака (National Cancer Institute) и/или Управлением США, регламентирующим употребление пищевых и лекарственных продуктов (Food and Drug Administration).
4. Другие методы
Анти-HGF мАт согласно настоящему изобретению могут также найти применение в методах диагностики, прогнозирования и в лабораторных методах. Они могут использоваться для определения уровня HGF в опухоли или в кровотоке пациента с опухолью и в этой связи могут использоваться при проведении и выборе направления лечения опухоли. Например, опухоль, ассоциированная с высоким уровнем HGF, будет особенно чувствительной к лечению с применением анти-HGF мАт. В конкретных вариантах осуществления настоящего изобретения мАт могут использоваться при анализе по методу ELISA или в радиоиммунологическом тесте для определения уровня HGF, например в биопсийных образцах опухоли, или в сыворотке, или в супернатанте от среды, или в HGF-секретирующих клетках в культуре. Использование двух анти-HGF мАт, связывающихся с разными эпитопами (т.е. не конкурирующих за связывание), будет особенно полезным при разработке чувствительного варианта ELISA по «сэндвич»-методу для выявления HGF. Для осуществления разного рода тестов HGF могут быть помечены флуоресцентными молекулами, спин-мечеными молекулами, ферментами или радиоактивными изотопами и могут предлагаться в виде набора, включающего все необходимые реактивы для проведения теста на HGF. В других вариантах анти-HGF мАт в основном используют для очистки HGF, например, путем аффинной хроматографии.
ПРИМЕРЫ
1. Получение анти-HGF мАт
Для получения мАт, которые будут связываться с человеческим HGF и блокировать его активность, вначале использовали систему экспрессии млекопитающего для продукции рекомбинантного человеческого HGF (rHGF). кДНК, кодирующие рекомбинантный человеческий HGF (rHGF) или rHGF-FLAG пептид (в котором 8 аминокислотных остатков присоединено к С-концу HGF), вводили в pIND-индуцибельный вектор экспрессии (No et al., Proc. Natl. Acad. Sci. USA, 93:3346, 1996). Указанные кДНК трансфицировали в клетки фибробластов почки человека EcR-293 (Invitrogen) с использованием реагента трансфекции Fugene (Roche). Стабильные клеточные линии, H1-F11 и 24.1, секретирующие HGF и HGF-Flag соответственно, отбирали в присутствии 600 мкг/мл G418 и 400 мкг/мл Зеоцина (Zeocin) (Invitrogen). У клеток H1-F11 и 24.1 индуцировали секрецию HGF и HGF-Flag путем обработки 4 мкМ понастерона A (Ponasteron A) (Invitrogen) в течение 4-5 дней в сыворотке без DMEM, содержащей глютамин и антибиотики. После удаления агрегатов центрифугированием при 15000 об/мин в течение 30 минут при температуре 4°С HGF, секретированный в культуральный супернатант, концентрировали примерно в 100 раз с использованием мембранного картриджа для ультрафильтрации с фильтром, отсекающим М.в. 50000 [amicon Centriprep YM-50 и затем фильтр microcon YM-50 (Millipore)]. Такой концентрированный культуральный супернатант H1F11 содержит примерно 100 мкг/мл HGF и примерно 120 мкг/мл бычьего сывороточного альбумина.
Balb/c мышей иммунизировали в подушечку каждой задней лапы >10 раз с интервалами одна неделя по 1-2 мкг очищенного rHGF (Pepto Tech) или 1-2 мкг rHGF плюс 1-2 мкг БСА (концентрированный супернатант H1-F11), ресуспендированных в MDL-TDM (Ribi Immunochem. Research). Через три дня после последней бустинг-инъекции клетки подколенного лимфатического узла сливали с миеломными клетками мышей, P3X63AgU.1 (ATCC CRL1597) с использованием 35% полиэтиленгликоля. Гибридомы отбирали в среде HAT по описанной в литературе методике (Chuntharapai and Kim, J. Immunol. 163:766, 1997, данная работа включена в настоящее описание в качестве ссылки). Через десять дней после слияния супернатанты гибридомной культуры фракционировали путем прямого связывания HGF в рамках ELISA, а также по методу ELISA захвата HGF-Flag. Последний тест может использоваться для дополнительного подтверждения специфичности выбранных анти-HGF мАт с использованием прямого связывания HGF по методу ELISA и для отбора мАт, которые могут связываться с HGF в фазе раствора. Затем определяли блокирующую активность выбранных мАт путем выявления связывания HGF-Flag/cMet-Fc в методе ELISA и в тесте на рассеивание. MDCK по описанной в литературе методике (Jeffers et al., Proc. Natl. Acad. Sci. USA 95:14417, 1998). Выбранные гибридомы два раза клонировали с использованием метода предельных разбавлений. Изотип мАт определяли с использованием набора для изотипирования (Zymed). На основе выбранных мАт получали асциты и очищали их с использованием набора для очистки ImmunoPure (A/G) IgG (Pierce). Получали также биотинилированные мАт с использованием EZ-сульфо-NHS-LC-биотина, в соответствии с рекомендациями Pierce. Каждый из указанных тестов далее будет описан более подробно. Для проведения прямого связывания HGF в рамках ELISA на микротитрационные планшеты (Maxisorb; Nunk) наслаивали по 50 мкг/лунку культуральных супернатантов H1-F11, содержащих rHGF, разбавленный PBS в соотношении HGF:PBS, равном 1:2, и выдерживали в течение ночи при температуре 4°С. После промывания планшета сайты неспецифического связывания блокировали PBS, содержащим 2% сепарированного молока, в течение 1 часа при комнатной температуре (КТ). После промывания планшетов в каждую лунку добавляли на 1 час по 50 мкг/лунку очищенных мАт или культуральных супернатантов гибридом. Далее планшеты после промывания инкубировали с вносимым по 50 мкл/лунку 1 мкг/мл козьим антимышиным IgG, конъюгированным с пероксидазой хрена (HRP-GαMIgG, Cappel) в течение 1 часа. Связанный HRP-GαMIgG выявляли при добавлении субстрата тетраметилбензидина (Sigma). Реакцию останавливали добавлением 1N H2SO4 и затем в планшетах определяли поглощение при 450 нм с использованием устройства для анализа ELISA планшетов. Промывку проводили 3 раза в промывочном буфере (PBS, содержащий 0,05% Твин 20).
При проведении анализа по методу захвата HGF-Flag по методу ELISA на микротитрационные планшеты наслаивали по 50 мкг/лунку 2 мкг/мл козьих антител, специфичных к Fc части мышиного IgG (GαMIgG-Fc) в PBS в течение ночи при температуре 4°С и блокировали 2% сепарированным молоком в течение 1 часа при КТ. После промывания планшеты инкубировали с очищенными мАт или культуральными супернатантами гибридом, вносимыми по 50 мкг/лунку, в течение 1 часа. Затем планшеты после промывания инкубировали с 50 мкл/лунку культурального супернатанта 24/1 клеток, содержащих rHGF-Flag. После промывания планшеты инкубировали с 50 мкг/мл HRP-M2 анти-Flag мАт (Invitrogen) в присутствии 15 мкг/мл мышиного IgG. Связанные HRP-анти-Flag М2 выявляли при добавлении субстрата, как было описано выше. Промывку проводили 3 раза с использованием промывочного буфера.
По меньшей мере три мАт, обозначенных как L1H4, L2C7 и L2G7, полученные из гибридом, созданных путем иммунизации мышей Balb/c в концентрированном культуральном супернатанте H1-F11, как было описано выше, демонстрировали связывание как в прямом связывании rHGF по методу ELISA, так и при анализе захвата HGF-Flag по методу ELISA, которые были отобраны для дальнейших исследований. Указанные гибридомы два раза клонировали, получали у мышей асциты по стандартным методикам и очищали мАт с использованием колонки с белком G/A. Изотипы определяли с использованием набора для изотипирования (Zymed Lab). Гибридома L2G7 была депонирована 29 апреля 2003 года в Американской Коллекции типовых культур (American Type Culture Collection, P.O. Box 1549 Manassas, VA 20108), под номером хранения в АТСС РТА-5162, в соответствии с Будапештским Договором. Указанный депозит будет храниться в персональной коллекции и будет заменяться по мере появления нежизнеспособных или деструктивных мутаций в течение периода времени, равного по меньшей пяти годам после последнего запроса на выдачу образца, полученного в коллекции, в течение по меньшей мере тридцати лет с момента депонирования или в течение срока действия родственного патента, в соответствии с наиболее длинным из таких периодов. Все ограничения по доступности для общего использования будут необратимо отменены при выдаче патента.
После выделения одного архетипного антитела против человеческого HGF, например, L2G7, которое имеет желательные свойства согласно настоящему описанию по нейтрализации HGF in vitro и/или ингибированию (например, полному) роста опухоли in vivo, далее приступали непосредственно к продукции других мАт с аналогичными свойствами при использовании для этого известных методов. Например, мыши могут быть иммунизированы HGF по описанной выше методике, далее могут быть получены гибридомы и образованные мАт подвергнуты скринингу для анализа их способности конкурировать с архетипными мАт по связыванию с HGF. Альтернативно, метод Джесперса с соавт. (Jespers et al., Biotechnology 12:899, 1994), который включен в настоящее описание в качестве ссылки, может использоваться для селекции мАт, имеющих один и тот же эпитоп и в этой связи одинаковые свойства со свойствами архетипных мАт, например L2G7. С использованием фагового метода первую тяжелую цепь архетипного антитела спаривают с репертуаром легких цепей (предпочтительно человеческих) для отбора HGF-связывающих мАт и затем новую легкую цепь спаривают с репертуаром тяжелых цепей (предпочтительно человеческих) для отбора HGF-связывающих мАт, имеющих тот же эпитоп, что и архетипное мАт.
2. Характеристика анти-HGF мАт in vitro
Связывающие эпитопы антител вначале исследовали в методе конкурентного связывания в рамках ELISA, в котором использовали 100-кратный избыток мАт для достижения конкуренции по связыванию с тем же самым или другим биотинилированным мАт в ELISA методе связывания HGF. На Фиг.4 показано, что связывание анти-HGF мАт, L1H4 и L2G7 ингибировалось только ими самими, что указывает на то, что они распознают уникальный эпитоп. Связывание L2C7 ингибировалось L2G7, но не L1H4. Это позволяет полагать, что L2C7 эпитоп перекрывается с эпитопом L2G7, но не с L1H4. Однако L2C7 не демонстрировал ингибирующей способности в отношении L2G7, что указывает на то, что L2C7 и L2G7 эпитопы перекрываются, но имеют четкие различия, и/или аффинность L2C7 намного ниже, чем аффинность L2G7. Эпитопы L1H4, L2C7 и L2G7 обозначены как А, В и С соответственно.
Относительные способности по связыванию трех анти-HGF мАт определяли с использованием очищенных антител в прямом ELISA методе связывания HGF, в котором rHGF вначале связывают с планшетом. В данном тесте L2C7 и L2G7 связывались лучше, чем L1H4 (фиг.5). Определяли также способность мАт связываться с rHGF-Flag в растворе с использованием метода ELISA с захватом HGF-Flag. Все три мАт оказались способны захватывать rHGF-Flag в фазе раствора, но мАт L2G7 был более эффективным, чем другие (Фиг.6). Приведенные результаты позволяют полагать, что мАт L2G7 обладает наивысшей связывающей аффинностью к HGF среди трех мАт.
Один из видов биологической активности HGF включает его способность связываться со своим рецептором cMet, так что анализировали способность анти-HGF мАт ингибировать связывание HGF с cMet. Для этой цели вначале получали cMet-Fc путем трансфекции фибробластных клеток человека 293 с использованием кДНК, кодирующей остатки 1-929 ECD в cMet, связанном с Fc частью человеческого IgGI (остатки 216-446), как описано в работе Марка с соавт. (Mark et al., J. Biol. Chem. 267: 26166, 1992), в векторе экспрессии pDisplay (Invitrogen). На микротитрационные планшеты наслаивали по 50 мкг/лунку 2 мкг/мл козьих антител, специфичных к Fc части человеческого IgG (GαHIgG-Fc), в PBS, инкубировали в течение ночи при температуре 4°С и блокировали 2% БСА в течение 1 часа при КТ. После промывания планшетов в каждую лунку добавляли на 1 час при КТ по 50 мкл культурального супернатанта 293 клеток, трансфицированных кДНК cMet-Fc. После промывания планшетов в каждую лунку на 1 час добавляли по 50 мкг/мл культурального супернатанта 24.1 клеток, содержащих rHGF-Flag, после предварительной инкубации с разными концентрациями мАт. После промывания планшеты инкубировали с 50 мкг/лунку HRP-М2 анти-Flag мАт (Invitrogen). Связанный HRP-анти-Flag М2 выявляли при добавлении субстрата, как было описано выше. Промывание проводили 3 раза промывочным буфером.
В указанном тесте на ингибирование связывания HGF-Flag/cMet-Fc все три антитела продемонстрировали некоторый уровень ингибирования, тогда как контрольное Ig антитело не проявило такой активности (фиг.7). МАт L2G7 в концентрации ≥1 мкг/мл и мАт L1H4 в концентрации 50 мкг/мл полностью устраняют связывание rHGF-Flag с cMet-Fc; мАт L2C7 даже в концентрации 50 мкг/мл дает лишь 85% ингибирование. Исходя из этого, мАт L2G7 намного более эффективен в плане ингибирования взаимодействия rHGF-Flag с cMet-Fc (и в этой связи преимущественно HGF с его рецептором cMet), чем другие антитела, что согласуется с его предположительно более высокой аффинностью для HGF.
Поскольку белок рецептора, используемый в ELISA методе связывания cMet-Fc/HGF-Flag, представляет собой растворимый белок рецептора, его конформация может отличаться от конформации природного рецептора, связанного с мембраной. Кроме того, в дополнение к связыванию с cMet HGF связывается с HSPG и известно, что взаимодействие HSPG-HGF повышает разные виды активности HGF. Так, мАт, блокирующие взаимодействие HGF с растворимым cMet, необязательно будут обладать способностью нейтрализовать биологические активности HGF в клетках. Таким образом, важно дополнительно подтвердить блокирующие активности мАт в выбранных биологических системах. Известно, что HGF является мощным, рассеивающим фактором. Так, нейтрализующую активность анти-HGF мАт также определяли с использованием клеток почки собаки Madin-Darby (MDCK клетки, полученные из АТСС) в тесте на рассеяние (Jeffers et al., Proc. Natl. Acad. Sci. USA 95: 14417, 1998). MDCK клетки, выращенные в DMEM с добавкой 5% PBS, помещали на планшеты по 103 клеток/лунку в присутствии заданных концентраций rGHF, при наличии или в отсутствие мАт в DMEM с 5% PBS. После 2 дней инкубации при температуре 37°С и при наличии 5% CO2 клетки промывали в PBS и фиксировали в 2% формальдегиде в течение 10 минут при КТ. После промывания в PBS клетки окрашивали 0,5% кристаллическим фиолетовым красителем в 50% об. этаноле в течение 10 минут при КТ. Рассеивающую активность определяли при исследовании под микроскопом.
Культуральные супернатанты H1-F11 клона, секретирующего HGF, описанные выше, использовали в качестве источника HGF в тесте на рассеивающую способность. Уже в разбавлении 1:80 культуральный супернатант H1-F11 индуцировал рассеивание и рост MDCK клеток. Однако тесты на рассеивание проводили с использованием разбавления 1:20 культурального супернатанта. H1-F11 (примерно 3 мкг/мл). МАт L2G7 даже при молярном соотношении HGF/мАт, равном 1:5, ингибировал HGF-индуцированное рассеивание MDCK за счет собственного воздействия (фиг.8), что в итоге демонстрирует, что мАт является действительно нейтрализующим мАт. МАт L2C7 даже в концентрации 20 мкг/мл демонстрировал лишь частичную нейтрализующую активность (данные не приведены).
Различные характеристики трех анти-HGF антител, определенных в указанных выше тестах, показаны в таблице 1.
HGF является представителем семейства гепарин-связывающих факторов роста, включающего фактор роста фибробластов (FGF) и фактор роста эндотелия сосудов (VEGF). HGF обладает также примерно 40% сходством в целом по последовательности с плазминогеном (Nakamura et al., Nature, 342: 440, 1989) и имеет структуру домена, аналогичную таковой у макрофагального стимулирующего белка (MSF, Wang et al., Scand. J. Immunol. 56: 545, 2002). Таким образом, должна быть определена связывающая специфичность анти-HGF. Связывание анти-HGF мАт с указанными HGF-родственными белками (доступными от компании R&D) анализируют с использованием теста ELISA на прямое связывание аналогично тесту для анализа HGF, описанного выше. МАт L2G7, мАт L2C7 и мАт L1H4 будут незначительно связываться с указанными белками, демонстрируя свою специфичность для HGF.
3. Способность анти-HGF мАт ингибировать опухолевую биологическую активность HGF
HGF имеет множество видов биологической активности, которые позволяют ему играть определенную роль в росте и инвазии некоторых опухолей человека. Одной такой известной активностью HGF является его способность действовать в качестве мощного митогена для гепатоцитов и других эпителиальных клеток (Rubin et al., Proc. Natl. Acad. Sci. USA, 88: 415, 1991). Таким образом, для дополнительного подтверждения нейтрализующей активности анти-HGF мАт определяли эффекты мАт на HGF-индуцированную пролиферацию эпителиальных клеток 4МВг-5 обезьяны (АТСС) или гепатоцитов крысы. Гепатоциты выделяли по методу Гаррисона и Хайнеса (Harrison and Haynes, J. Biol. Chem. 269: 4262, 1985). Клетки ресуспендировали в количестве 5×104 клеток/лунку в среде DMEM, содержащей 5% PBS, и стимулировали заданной концентрацией HGF с разными концентрациями мАт. После инкубации в течение 2,5 дней при температуре 37°С с 5% CO2 определяли уровень клеточной пролиферации при добавлении 3H-тимидина на 4 часа. Далее клетки собирали с использованием автоматического коллектора для сбора клеток и определяли уровень включенного 3H-тимидина в сцинтилляционном счетчике. При наличии достаточных концентраций мАт L2G7 может в значительной мере или полностью ингибировать HGF-индуцированную пролиферацию клеток и мАт L2C7 и L1H4 может, по меньшей мере частично, ингибировать пролиферацию. Указанные антитела могут также ингибировать HGF-индуцированную пролиферацию других линий эпителиальных клеток.
Например, определяли ингибирующую активность L2G7 в отношении HGF-индуцированной пролиферации клеток легкого норки Mv I Lu (Borset et al., J. Immunol. Methods 189: 59, 1996). Клетки, растущие в среде DMEM, содержащей 10% PBS, собирали при обработке ЭДТА/трипсином. После промывания клетки ресуспендировали в количестве 5×104 клеток/мл в бессывороточной среде DMEM с заданной концентрацией HGF (50 нг/мл) +/- разные концентрации мАт. После инкубации в течение 1 дня при температуре 37°С с 5% CO2 определяли уровень пролиферации при добавлении 1 мкCI 3H-тимидина еще на 24 часа. Далее клетки собирали на стекловолокнистых фильтрах с использованием автоматического коллектора для сбора клеток и определяли уровень включенного 3H-тимидина в сцинтилляционном счетчике. На Фиг.9 показано, что добавление 100-кратной молярной концентрации мАт L2G7 полностью ингибировали пролиферативный ответ Mv I Lu клеток. Фактически, L2G7 даже при 3-кратном молярном соотношении мАт к HGF демонстрировало полное ингибирование, тогда как контрольный IgG не демонстрировал ингибирования даже при 100-кратном молярном избытке.
Сообщалось также, что HGF является мощным фактором ангиогенеза (Bussolino et al., J Cell Biol. 119: 629, 1992; Cherrington et al., Adv. Cancer Res. 79: 1, 2000), и считается, что ангиогенез, т.е. образование новых кровеносных сосудов, является обязательным условием для роста опухолей. В этой связи способность анти-HGF мАт ингибировать ангиогенные свойства HGF была показана в трех тестах: (i) пролиферация эндотелиальных клеток сосудов человека (HUVEC), (ii) образование трубки для HUVEC; и (iii) развитие новых сосудов на хориоаллантоической мембране эмбриона цыпленка (САМ). Поскольку было показано, что HGF действует синергически вместе с VEGF в ангиогенезе (Xin et al., Am. J. Pathol. 158: 1111, 2001), данные тесты были проведены при наличии и в отсутствие VEGF.
Тест на пролиферацию HUVEC проводили по известной процедуре с модификацией (Conn et al., Proc. Natl. Acad. Sci. USA 87: 1323, 1991). Клетки HUVEC, полученные от компании Cloneties, выращивали в ростовой среде для эндотелиальных клеток (ЕВМ-2), содержащей 10% PBS плюс добавки для роста эндотелиальных клеток, поставляемых компанией Clonetics. Предпочтительно клетки, используемые в данном исследовании, подвергали от 4 до 7 пассажей. Клетки ресуспендировали с достижением концентрации 105 клеток/мл в среде-199, содержащей антибиотики, 10 мМ HEPES и 10% PBS (среда для тестирования). Клетки HUVEC (50 мкл/лунку) добавляли в лунки микротитрационного планшета, содержащие подходящую концентрацию HGF с различными концентрациями анти-HGF мАт, в течение 1 часа при температуре 37°С. По завершении инкубации клеток в течение 72 часов при температуре 37°С в среде, содержащей 5% CO2, определяли уровень пролиферации клеток по количеству включенного 3H-тимидина в течение 4 часов. При наличии достаточных концентраций мАт L2G7 и мАт L1H4 могут по меньшей мере частично ингибировать пролиферацию.
Альтернативно, уровень клеточной пролиферации может быть определен по известному колориметрическому тесту с использованием реактива МТТ. Клетки HUVEC (104 клеток/100 мкл/лунку) растили в бессывороточной среде в течение 24 часов и затем инкубировали со 100 мкл 50 нг/мл HGF (т.е. с количеством, предварительно определенным как субоптимальное количество), с различными концентрациями мАт L2G7 в течение 72 часов. Добавляли к каждой лунке МТТ (20 мкл/200 мкл среды) на 4 часа. Затем отбирали 100 мкл среды/лунку и смешивали с 100 мкл/лунку подкисленного изопропилового спирта (0,04 N HCl в изопропиловом спирте). Поглощение в лунках планшета определяли на устройстве для анализа по методу ELISA при длине волны 560 нм. % от максимального уровня реакции вычисляли следующим образом: [ОП для HGF + мАт-обработанных клеток - ОП для необработанных клеток]/[ОП для HGF-обработанных клеток - ОП для необработанных клеток]×100. На Фиг.10 показано, что даже 2-кратный молярный избыток мАт L2G7 в значительной мере блокировал пролиферацию HUVEC в ответ на воздействие HGF.
Тест на образованием трубок эндотелиальных клеток проводили по описанной в литературе методике (Matsumura et al., J. Immunol. 158: 3408, 2001; Xin et al., Am. J. Pathol. 158:1111, 2001). Клетки HUVEC (Clonetics) после 4-7 пассажей растили в среде Clonetics EGM с добавкой 10% PBS и с добавками, необходимыми для роста эндотелиальных клеток. На планшеты наслаивали Matrigel (BD Bioscience) в соответствии с инструкцией производителя при температуре 37°С в течение 30 минут и затем высевали клетки с плотностью 3×106 клеток/мл в основной среде с HGF при наличии различных концентраций анти-HGF мАт. Образование трубки оценивали под микроскопом при слабом (10×) увеличении. При наличии достаточных концентраций мАт L2G7 в значительной мере или полностью ингибировал HGF-индуцированное образование трубки эндотелиальных клеток, а мАт L2C7 и L1H4 могут по меньшей мере частично ингибировать его.
Тест с использованием хориоаллантоической мембраны эмбриона цыпленка (САМ) проводили по описанной в литературе методике (Kim et al., Nature 362: 841, 1992). Трехдневных эмбрионов цыплят отбирали из скорлупы и растили в чашках Петри при температуре 37°С и при наличии в среде 5% CO2. Через семь дней наслаивали на САМ высушенные метилцеллюлозные диски, содержащие HGF с различными концентрациями анти-HGF мАт. Метилцеллюлозные диски готовили путем смешивания 5 мкл 1,5% метилцеллюлозы в PBS с 5 мкл HGF после его инкубирования с мАт.Через три дня осматривали метилцеллюлозные диски для выявления развития кровеносных сосудов вокруг дисков. При наличии достаточных концентраций мАт L2G7 в значительной мере или полностью ингибировал образование кровеносного сосуда, а мАт L2C7 и L1H4 могут по меньшей мере частично ингибировать его.
Сообщалось также, что HGF способствует росту опухоли (Comoglio and Trusolino, J. Clin Invest. 109: 857, 2002). Способность анти-HGF антител ингибировать указанную активность была продемонстрирована в два этапа. Вначале осматривали множество линий опухолевых клеток на наличие у них способности секретировать HGF и пролиферировать в ответ на воздействие HGF, поскольку HGF может представлять собой аутокринный фактор роста для некоторых таких клеток. Указанные клеточные линии включают ряд линий клеток опухоли человека, в отношении которых известно, что они экспрессируют HGF и cMet (Koochekpour et al., Cancer Res. 57: 5391, 1997; Wang et al., J. Cell. Biol. 153: 1023, 2001). Специфические клеточные линии, подлежащие тестированию, включают U-118 глиому, карциному ободочной кишки НСТ116, карциному легкого А549 и клетки эпидермоидной карциномы А431, получаемые, все, от АТСС. После идентификации таких клеточных линий определяли эффект анти-HGF мАт на пролиферативный ответ данных клеток на HGF с использованием способов, аналогичных описанным выше. При наличии достаточных концентраций мАт L2G7 в значительной мере или полностью ингибировал HGF-индуцированную пролиферацию многих из указанных клеточных линий, а мАт L2C7 и L1H4 могут по меньшей мере частично ингибировать пролиферацию.
Например, клетки опухоли человека НСТ116 высевали на 96-луночные микротитрационные планшеты с плотностью 5×103 клеток/лунку в 200 мкл DMEM плюс 5% PBS. После инкубации в течение 24 часов при температуре 37°С и при содержании 5% CO2 клетки промывали в PBS и инкубировали с бессывороточной средой DMEM в течение 48 часов. Затем клетки инкубировали со 100 нг/мл HGF +/- 20 мкг/мл мАт в DMEM еще в течение 20 часов. В качестве контролей в эксперимент включали клетки, растущие в одной среде DMEM или в среде DMEM плюс 10% PBS. В конце инкубации определяли уровень клеточной пролиферации по включению 3H-тимидина в течение 4 часов. На Фиг.11 показаны результаты, полученные в рамках указанного эксперимента, проведенного в тройном повторе. HGF индуцирует умеренную пролиферацию НСТ116 клеток, которая полностью устранялась добавлением антитела L2G7 (но с меньшей эффективностью, чем антитело L1H4).
Во всех тестах, описанных выше, каждое анти-HGF антитело нейтрализует или ингибирует активность, при использовании их самих по себе, без добавления антагонистов HGF, то есть при использовании каждого из них в качестве единственного агента, но аддитивный или синергический эффекты могут быть достигнуты при введении антитела в сочетании с другими анти-HGF антителами или с другими активными агентами.
4. Способность анти-HGF мАт ингибировать рост опухоли in vivo
Способность анти-HGF мАт ингибировать рост опухоли человека продемонстрирована на моделях ксенотрансплантатов у иммунодефицитных мышей или других грызунов, таких как крыса. В качестве репрезентативных, но не ограничивающих примеров иммунодефицитных штаммов мышей, которые могут использоваться, можно назвать «голых» мышей, таких как CD-1 nude, Nu/Nu, Balb/c nude, NIH-III (NIH-bg-nu-xid BR); scid мышей, таких как Fox Chase SCID (C.B-17 SCID), аутбредных Fox Chase SCID мышей и SCID Beige; мышей, дефицитных по ферменту РАГ, а также "голых" крыс. Эксперименты проводили по процедуре, описанной ранее в литературе (Kim et al.. Nature 362: 841, 1992, данная работа включена в настоящее описание в качестве ссылки). Клетки опухоли человека, выращенные в полной среде DMEM, собирали в HBSS. Иммунодефицитным самкам мышей, например «голым» мышам без вилочковой железы (4-6 недельного возраста), в дорсальные зоны инъецировали п/к 5×106 клеток в 0,2 мл HBSS. Когда размер опухоли достигал 50-100 мм3, мышей группировали случайным образом и вводили в/б соответствующие количества мАт (в типичном случае от 0,1 до 1,0 мг, например 0,5 мг) один, два или три раза в неделю, в соответствующем объеме, например, в 0,1 мл, в течение, например, 1, 2, 3 или 4 недель или в течение периода времени эксперимента. Размеры опухолей определяли в типичном случае два раза в неделю путем измерения в двух измерениях [длина (а) и ширина (b)]. Объем опухоли вычисляли по уравнению V=ab2/2 и выражали в виде среднего значения объема опухоли ± СКО. Количество мышей в каждой исследуемой группе составляло по меньшей мере 3, но чаще от 5 до 10, например 7. Статистический анализ может быть проведен с использованием, например, теста Стьюдента. В одном варианте указанного эксперимента введение антитела начинали одновременно с инъекцией опухолевых клеток или в скором времени после такой инъекции. Эффект антитела может быть охарактеризован по пролонгированию срока выживания мышей или по повышению процента выживших мышей.
Различные опухолевые клетки, в отношении которых известно, что они секретируют или отвечают на введенный HGF, использовали в отдельных экспериментах, например клетки глиобластомы человека U118 и/или опухоли клеток ободочной кишки человека НСТ116. Предпочтительные антитела согласно настоящему изобретению, такие как подобные человеческому антитела и антитела со сниженной иммуногенностью, а также антитело L2G7 и его химерные и гуманизированные формы и антитела с тем же самым эпитопом, что и L2G7, в случае использования каждого из них в качестве единственного агента ингибировали рост опухолей по меньшей мере на 25%, но возможно по меньшей мере на 40% или 50% и вплоть до 75% или 90% или еще выше или даже полностью ингибировали рост опухоли после некоторого периода времени или вызывали регрессию или исчезновение опухоли. Указанное ингибирование имеет место по меньшей мере в одной линии опухолевых клеток, такой как U118, по меньшей мере в одном штамме мышей, таком как NIH III Beige/Nude, но предпочтительно имеет место в 2, 3, нескольких, многих или даже по существу во всех HGF-экспрессирующих линиях опухолевых клеток конкретного типа (например, глиомы) или любого другого типа, при тестировании в одном или большем числе штаммов иммунодефицитных мышей, которые не образуют в ответ на инъецированное антитело нейтрализующего антитела. Лечение с использованием некоторых предпочтительных антител на одной или нескольких моделях с ксенотрансплантатом приводит к не охарактеризованному выживанию у 50%, 75%, 90% или даже по существу у всех мышей, которые бы в ином случае умерли или которых нужно было бы умертвить из-за роста у них опухоли.
Например, такой эксперимент проводили с использованием клеток глиобластомы U-118, растущих в среде DMEM с PBS и собранных в HBSS. Самкам мышей NIH III Beige/Nude (4-6-недельного возраста) в дорсальные зоны инъецировали п/к 106 клеток в 0,2 мл HBSS. Когда размер опухоли достигал примерно 50 мм3, мышей группировали случайным образом по 6 мышей в каждой группе и вводили в/б 200 мкг мАт (опытная группа) или PBS (контрольная группа) два раза в неделю в объеме 0,1 мл. Размеры опухолей определяли в типичном случае два раза в неделю по описанной выше процедуре. В конце эксперимента опухоли вырезали и взвешивали. На Фиг.12 показано, что введение L2G7 полностью ингибировало рост опухоли.
Аналогичные эксперименты по ингибированию опухоли проводят с использованием анти-HGF антитела, вводимого в сочетании с одним или более химиотерапевтическими агентами, такими как 5-ФУ (5-фторурацил) или СРТ-11 (Camptostar), на которые, как ожидается, опухоль данного типа должна отзываться, в соответствии с данными Ашкенайна с соавт. (Ashkenize et al., J. Clin Invest. 104: 155, 1999). Сочетание антитела и химиотерапевтического агента может демонстрировать более сильное ингибирование роста опухоли, чем каждый из агентов по отдельности. Указанный эффект может быть аддитивным или синергическим и может приводить к мощному ингибированию роста, например на 80% или 90% или более, или даже может вызывать регрессию или исчезновение опухоли. Анти-HGF антитело может также вводиться в сочетании с антителом против другого фактора роста или ангиогенного фактора, например анти-VEGF, и при этом ожидается аддитивное или синергическое ингибирование и/или регрессия или исчезновение опухоли.
Несмотря на то, что настоящее изобретение было описано со ссылкой на некоторые предпочтительные варианты его осуществления, следует понимать, что могут быть введены различные модификации, без отступления от сути изобретения. Если иное не вытекает из контекста, любая стадия, любой элемент, вариант, особенность или аспект настоящего изобретения может использоваться в сочетании с любым другим.
Все цитированные в описании публикации, патенты и заявки на патент включены в настоящее изобретение полностью в той степени, в какой каждая отдельная публикация/ патент и заявка на патент конкретно и индивидуально показаны для полного включения в качестве ссылки для всех целей.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННЫЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К ФАКТОРУ РОСТА ГЕПАТОЦИТОВ | 2007 |
|
RU2461570C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К РЕЦЕПТОРУ 2 ФАКТОРА РОСТА ФИБРОБЛАСТОВ | 2009 |
|
RU2546254C9 |
| НОВЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ ДИМЕРИЗАЦИЮ С-МЕТ, И ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2552161C2 |
| AXL-АНТИТЕЛА | 2008 |
|
RU2506276C2 |
| АНТИТЕЛО ПРОТИВ c-Met | 2009 |
|
RU2560257C2 |
| Гуманизированные антитела к антигену Томсена-Фриденрайха | 2015 |
|
RU2699717C2 |
| ИНГИБИТОРЫ АНГИОПОЭТИНПОДОБНОГО БЕЛКА 4, ИХ КОМБИНАЦИИ И ПРИМЕНЕНИЕ | 2005 |
|
RU2392966C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИ-ТФР-БЕТА-АНТИТЕЛА | 2005 |
|
RU2386638C2 |
| АНТИТЕЛА, РАСПОЗНАЮЩИЕ СОДЕРЖАЩИЙ УГЛЕВОДЫ ЭПИТОП НА CD-43 И СЕА, ЭКСПРЕССИРУЕМЫХ НА ЗЛОКАЧЕСТВЕННЫХ КЛЕТКАХ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2461572C2 |
| АНТИТЕЛА ПРОТИВ ОХ40 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2562874C1 |
Настоящее изобретение относится к области биотехнологии и иммунологии. Предложено химерное или гуманизированное моноклональное антитело против фактора роста гепатоцитов, полученное из антитела L2G7. Раскрыто мышиное антитело L2G7, продуцируемое гибридомой АТСС РТА-5162, и указанная гибридома. Описана клеточная линия, продуцирующая химерное или гуманизированное моноклональное антитело против фактора роста гепатоцитов. Предложена фармацевтическая композиция и способ лечения опухолей на основе антитела. Использование изобретения обеспечивает нейтрализующее антитело против фактора роста гепатоцитов, что может найти применение в лечении рака человека. 6 н. и 1 з.п. ф-лы, 12 ил., 1 табл.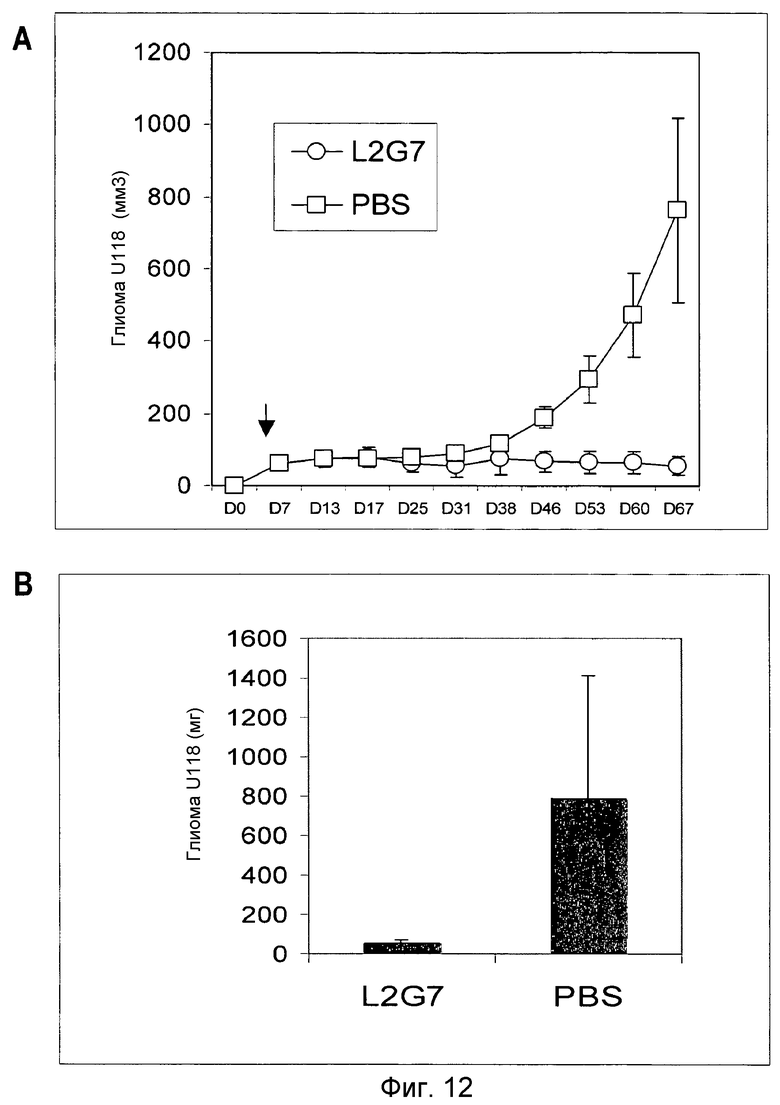
1. Химерное или гуманизированное моноклональное антитело L2G7 против фактора роста гепатоцитов, где L2G7 представляет собой мышиное антитело, продуцируемое гибридомой АТСС РТА-5162.
2. Клеточная линия, продуцирующая моноклональное антитело по п.1.
3. Гибридома, депонированная под номером АТСС РТА-5162, которая продуцирует антитело L2G7.
4. Антитело L2G7 против фактора роста гепатоцитов, продуцируемое гибридомой по п.3.
5. Фармацевтическая композиция для лечения заболеваний, опосредованных фактором роста гепатоцитов, содержащая терапевтически эффективное количество антитела по п.1.
6. Способ лечения рака у пациента, предусматривающий введение пациенту антитела по п.1.
7. Способ по п.6, отличающийся тем, что указанный рак представляет собой глиобластому.
| Di Nicola et al., «Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli», Blood, 15.05.2002, vol.99, n.10, с.3838-3843 | |||
| Burr et al., «Anti-hepatocyte growth factor antibody inhibits hepatocyte proliferation during liver regeneration», J | |||
| Pathology, 1998, 185 (3), |
Авторы
Даты
2009-07-20—Публикация
2004-08-13—Подача