Область техники, к которой относится изобретение
Настоящее изобретение относится к антителам, в частности к моноклональным антителам, которые прикрепляются к внеклеточному домену рецепторной тирозинкиназы AXL и которые, по меньшей мере, частично ингибируют активность AXL.
Предшествующий уровень техники
AXL (Ark, UFO, Tyro-7) рецепторная тирозинкиназа является членом семейства киназ Tyro-3 вместе с другими членами, которыми являются Mer (Eyk, Nyk, Tyro-12) и Sky (Rse, Tyro-3, Dtk, Etk, Brt, Tif). Она активируется посредством присоединения гетерофильного лиганда Gas6, 70-кДа протеинового гомолога, к антикоагуляционному фактору протеину S. В отличие от других рецепторных тирозинкиназ, AXL-тирозиновое фосфорилирование также может быть вызвано посредством гомофильного присоединения. Активация AXL приводит к сигнальному через PI-3-киназа/Akt (Franke et al., Oncogene 22:8983-8998, 2003) и другим путям, типа Ras/Erk и β-катенин/TCF (Goruppi et al., Mol. Cell Biol. 21:902-915, 2001).
AXL слабо экспрессируется во многих нормальных тканях, включая мозг, сердце, скелетные мышцы, органные капсулы и соединительные ткани некоторых других органов, и в моноцитах, но не лимфоцитах. Akt-фосфорилирование, индуцированное AXL, описано для популяции фибробластов (Goruppi et al., Mol Cell Biol 17:4442-4453 1997), эндотелиальных клеток (Hasanbasic et al., Am J Physiol Heart Circ Physiol, 2004), сосудистых гладкомышечных клеток (Melaragno et al., J. Mol. Cell Cardiol. 37:881-887, 2004) и нейронов (Alien et al., Mol. Endocrinol. 13:191-201 1999). Кроме того, AXL участвует в клеточной адгезии и хемотаксисе. Нокауты по AXL приводят к замедлению стабилизации агрегации тромбоцитов и образованию тромбов, результатом чего является снижение активации тромбоцитарного интегрина Ilb3.
Сверхэкспрессия AXL наблюдается во многих типах раковых опухолей, напр., в опухоли молочной железы (Meric et al., Clin. Cancer Res. 8:361-367, 2002; Berclaz et al., Ann. Oncol. 12:819-824, 2001), толстой кишки (Chen et al., Int. J. Cancer 83:579-584, 1999; Craven et al., Int. J. Cancer 60:791-797, 1995), предстательной железы (Jacob et al., Cancer Detect. Prev. 23:325-332, 1999), легких (Wimmel et al., Eur J Cancer 37:2264-2274, 2001), желудка (Wu et al., Anticancer Res 22:1071-1078, 2002), яичников (Sun et al., Oncology 66:450-457, 2004), эндометрия (Sun et al., Ann. Oncol. 14:898-906, 2003), почек (Chung et al., DNA Cell Biol. 22:533-540, 2003), гепатоцеллюлярной (Tsou et al., Genomics 50:331-340, 1998), щитовидной железы (Ito et al., Thyroid 12:971-975, 2002; Ito et al., Thyroid 9:563-567, 1999) и карциноме пищевода (Nemoto et al., 1997), а также при хроническом миелолейкозе - CML (Janssen et al., A novel putative tyrosine kinase receptor with oncogenic potential. Oncogene, 6:2113-2120, 1991; Braunger et al., Oncogene 14:2619-2631 1997; O'Bryan et al., Mol Cell Biol 11:5016-5031, 1991), остром миелоцитарном лейкозе - AML (Rochlitz et al., Leukemia 13:1352-1358, 1999), остеосаркоме (Nakano et al., J. Biol. Chem. 270:5702-5705, 2003), меланоме (van Ginkel et al., Cancer Res 64:128-134, 2004) и в плоскоклеточном раке головы и шеи (Green et al., Br J Cancer. 2006 94:1446-5, 2006).
Кроме того, AXL идентифицирован как ассоциированный с метастазами ген, который активируется в клеточных линиях агрессивной формы рака молочной железы, по сравнению с неинвазивными клетками. In vitro, было обнаружено, что для миграции и инвазии необходима AXL-активность, и эту активность можно ингибировать путем обработки антителами (WO04008147). Аналогично, нейтрализация AXL-активности in vivo, либо через экспрессию доминантного негативного варианта AXL (Vajkoczy, P., et al., Proc. Natl. Acad. Science U.S.A. 103:5799-5804. 2005), либо путем миРНК-опосредованной деактивации AXL (Holland et al., Cancer Res. 65:9294-9303, 2005), предотвращала подкожный и ортотопический клеточный рост в экспериментах на мышах с ксенотрансплантатами.
До сих пор описаны два антитела, которые связываются с AXL и обладают биологической активностью. Одно антитело способно снижать AXL-опосредованную инвазию клеток (WO04008147), тогда как другое антитело, как сообщается, снижает взаимодействие AXL/Лиганд. Однако оба антитела являются поликлональными, что делает их непригодными для терапевтического применения.
Таким образом, ввиду терапевтического потенциала AXL существует острая необходимость получения моноклональных AXL-антител, фрагментов антител или их производных, которые эффективно и специфично блокировали бы AXL-опосредованную сигнальную трансдукцию и которые были бы пригодны для лечения.
Раскрытие изобретения
Соответственно, первый аспект настоящего изобретения относится к моноклональному антителу, включая его фрагмент и производное, которое связывается с внеклеточным доменом AXL, особенно AXL человека, и, по меньшей мере, частично ингибирует активность AXL.
Предпочтительно антитело настоящего изобретения дополнительно обладает, по меньшей мере, одним или более из следующих свойств: способностью снижать или блокировать AXL-опосредованную сигнальную трансдукцию, способностью снижать или блокировать AXL-фосфорилирование, способностью снижать или блокировать пролиферацию клеток, способностью снижать или блокировать ангиогенез, способностью снижать или блокировать миграцию клеток, способностью снижать или блокировать метастазирование опухоли, способностью снижать или блокировать AXL-опосредованную PI3K-сигнальный путь и способностью снижать или блокировать AXL-опосредованный антиапоптоз, вследствие чего повышая, например, чувствительность клеток на лечение антинеопластическим агентом. Кроме того, антитела настоящего изобретения могут проявлять высокую специфичность к AXL, особенно AXL человека, и в большей степени не распознают других членов семейства Tyro-3, напр., MER, и/или SKY, и/или AXL млекопитающих, не относящихся к приматам, таких как AXL мышей. Специфичность антител может быть определена путем измерения перекрестной реактивности, как описано в Примерах.
Термин "активность" относится к биологической функции AXL, которая влияет на фенотип клетки, в частности, но не ограничиваясь, раковые фенотипы, как, например, избежание апоптоза, автономность в сигналах роста, клеточной пролиферации, тканевой инвазии и/или метастазирования, интенсивность сигналов антироста (антиапоптоз) и/или постоянный ангиогенез.
Термин "AXL-опосредованная сигнальная трансдукция" означает активацию вторичных информационных путей, запускаемых посредством прямого или непрямого взаимодействия AXL со вторичной молекулой-мессенджером.
Термин "AXL-фосфорилирование" относится к фосфорилированию аминокислотных остатков, предпочтительно тирозиновых остатков, либо с помощью второго AXL-белка (трансфосфорилирование), или с помощью другого белка, имеющего активность протеинкиназы.
Термин "пролиферация клеток" относится ко всем AXL-включающим процессам, лежащим в основе репродукции клеток человека, в частности, но не ограничиваясь, раковых клеток человека. Они участвуют в или приводят к репликации клеточной ДНК, сепарации дуплицированной ДНК в двух эквивалентных по размеру группах хромосом и физическому делению (называемому цитокинезом) целостных клеток и должны стимулироваться или опосредоваться некаталитическими или каталитическими активностями AXL, предпочтительно включая AXL-фосфорилирование и/или AXL-опосредованную сигнальную трансдукцию.
Термин "ангиогенез" относится ко всем AXL-включающим процессам, которые способствуют росту новых кровеносных сосудов из уже существующих сосудов, в частности, но не ограничиваясь, новых питающих опухоль кровеносных сосудов. Эти процессы включают множество клеточных событий, таких как пролиферация, выживаемость, миграция и спрутинг (прорастание) эндотелиоцитов сосудистой стенки, притяжение и миграцию перицитов, а также образование базальной мембраны для стабилизации сосудов, перфузии сосудов или секреции ангиогенных факторов посредством стромальных или неопластических клеток, и должны быть стимулированными или опосредованными некаталитической или каталитической активностью AXL, предпочтительно включая AXL-фосфорилирование и/или AXL-опосредованную сигнальную трансдукцию.
Термин "метастаз" относится ко всем AXL-включающим процессам, которые способствуют распределению раковых клеток из первичной опухоли, проникновению в лимфатические и/или кровеносные сосуды, циркуляции по кровотоку и росту в отдаленном очаге (метастаз) в нормальных тканях по всему организму. В частности, это относится к клеточным процессам в опухолевых клетках, таким как пролиферация, миграция, безъякорный рост, уклонение от апоптоза или секреция ангиогенных факторов, которые указывают на метастаз и стимулируются или опосредуются некаталитическими или каталитическими активностями AXL, предпочтительно включая AXL-фосфорилирование и/или AXL-опосредованную сигнальную трансдукцию.
Термин "AXL-опосредованный антиапоптоз" относится ко всем AXL-включающим процессам, которые предохраняют человеческие клетки, предпочтительно но не ограничиваясь, раковые клетки человека от запрограммированной гибели клеток (апоптоза). В частности, это относится к процессам, которые предохраняют человеческие клетки, предпочтительно, но не ограничиваясь, раковые клетки человека, от индукции апоптоза через прекращение действия фактора роста, гипоксию, воздействие химиотерапевтических агентов или облучение или инициирования Fas/Apo-1 рецептор-опосредованной передачи сигнала и стимулируются или опосредуются некаталитическими или каталитическими активностями AXL, предпочтительно включая AXL-фосфорилирование и/или AXL-опосредованную сигнальную трансдукцию.
В дополнение, настоящее изобретение включает антитела, чьи связывающие активности с AXL составляют KD=10-5 М или менее, предпочтительно KD=10-7 М или менее и наиболее предпочтительно KD=10-9 М или менее. Составляет ли связывающая активность AXL-антитела настоящего изобретения KD=10-5 М или менее, можно определить с помощью способов, известных из уровня техники. Например, активность можно определить, используя метод поверхностного плазменного резонанса Biacore и/или с помощью ELISA (твердофазного иммуноферментного анализа), EIA (иммуноферментного анализа), RIA (радиоиммунного анализа) или метода флуоресцирующих антител, напр., FACS.
Во втором аспекте антитело может иметь, по меньшей мере, один антигенсвязывающий сайт, напр., один или два антигенсвязывающих сайта. Дополнительно, антитело предпочтительно содержит, по меньшей мере, одну тяжелую цепь иммуноглобулина и, по меньшей мере, одну легкую цепь иммуноглобулина. Иммуноглобулиновая цепь содержит вариабельный домен и, при необходимости, константный домен. Вариабельный домен может содержать определяющие комплементарность участки (CDR), напр. CDR1, CDR2 и/или CDR3 участок, и каркасные участки. Термин "определяющий комплементарность участок" (CDR) четко определен в уровне технике (см., например, Harlow and Lane "Antibodies, a Laboratory Manual", CSH Press, Cold Spring Harbour, 1988) и относится к удлинениям аминокислот в вариабельном участке антитела, который непосредственно контактирует с антигеном.
Дополнительный аспект настоящего изобретения относится к антителу, включая его фрагмент или его производное, которое связывается с внеклеточным доменом AXL, который содержит, по меньшей мере, одну аминокислотную последовательность тяжелой цепи, включающую, по меньшей мере, один CDR, который выбирают из группы, состоящей из:
(a) CDRH1, как показано в SEQ ID NO:16, 22, 28, или CDRH1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(b) CDRH2, как показано в SEQ ID NO:17, 23, 29, или CDRH2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(c) CDRH3, как показано в SEQ ID NO:18, 24, 30, или CDRH3, последовательность которого отличается на 1 или 2 аминокислотных остатков,
и/или, по меньшей мере:
одну аминокислотную последовательность легкой цепи, включающую, по меньшей мере, один CDR, который выбирают из группы, состоящей из:
(d) CDRL1, как показано в SEQ ID NO:13, 19, 25 или CDRL1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(e) CDRL2, как показано в SEQ ID NO:14, 20, 26 или CDRL2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(f) CDRL3, как показано в SEQ ID NO:15, 21, 27 или CDRL3, последовательность которого отличается на 1 или 2 аминокислотных остатков,
или моноклонального антитела, распознающего тот же эпитоп на внеклеточном домене AXL.
В предпочтительном воплощении антитело содержит тяжелую цепь, содержащую, по меньшей мере, один CDR, выбранный из группы, состоящей из:
(a) CDRH1, как показано в SEQ ID NO:16, или CDRH1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(b) CDRH2, как показано в SEQ ID NO:17, или CDRH2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(c) CDRH3, как показано в SEQ ID NO:18, или CDRH3, последовательность которого отличается на 1 или 2 аминокислотных остатков,
и/или легкую цепь, содержащую, по меньшей мере, один CDR, выбранный из группы, состоящей из:
(d) CDRL1, как показано в SEQ ID NO:13, или CDRL1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(e) CDRL2, как показано в SEQ ID NO:14, или CDRL2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(f) CDRL3, как показано в SEQ ID NO:15, или CDRL3, последовательность которого отличается на 1 или 2 аминокислотных остатков,
или моноклональное антитело, распознающее тот же эпитоп на внеклеточном домене AXL.
В дополнительном предпочтительном воплощении, антитело содержит тяжелую цепь, содержащую, по меньшей мере, один CDR, выбранный из группы, состоящей из:
(a) CDRH1, как показано в SEQ ID NO:22, или CDRH1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(b) CDRH2, как показано в SEQ ID NO:23, или CDRH2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(c) CDRH3, как показано в SEQ ID NO:24, или CDRH3, последовательность которого отличается на 1 или 2 аминокислотных остатков,
и/или легкую цепь, содержащую, по меньшей мере, один CDR, выбранный из группы, состоящей из
(d) CDRL1, как показано в SEQ ID NO:19, или CDRL1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(e) CDRL2, как показано в SEQ ID NO:20, или CDRL2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(f) CDRL3, как показано в SEQ ID NO:21, или CDRL3, последовательность которого отличается на 1 или 2 аминокислотных остатков,
или моноклональное антитело, распознающее тот же эпитоп на внеклеточном домене AXL.
В еще дополнительном предпочтительном воплощении антитело содержит тяжелую цепь, содержащую, по меньшей мере, один CDR, выбранный из группы, состоящей из:
(a) CDRH1, как показано в SEQ ID NO:28, или CDRH1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(b) CDRH2, как показано в SEQ ID NO:29, или CDRH2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(c) CDRH3, как показано в SEQ ID NO:30, или CDRH3, последовательность которого отличается на 1 или 2 аминокислотных остатков, и/или легкую цепь, содержащую, по меньшей мере, один CDR, выбранный из группы, состоящей из:
(d) CDRL1, как показано в SEQ ID NO:25, или CDRL1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(e) CDRL2, как показано в SEQ ID NO:26, или CDRL2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(f) CDRL3, как показано в SEQ ID NO:27, или CDRL3, последовательность которого отличается на 1 или 2 аминокислотных остатков,
или моноклональное антитело, распознающее тот же эпитоп на внеклеточном домене AXL.
В другом воплощении настоящее изобретение относится к антителу, содержащему аминокислотную последовательность тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:8, 10, 12, или, по меньшей мере, ее вариабельный домен или аминокислотную последовательность, имеющую с ней идентичность последовательности, по меньшей мере, 90%, и/или аминокислотную последовательность легкой цепи, выбранную из группы, состоящей из SEQ ID NO:7, 9, 11, или, по меньшей мере, ее вариабельный домен или аминокислотную последовательность, имеющую с ней идентичность последовательности, по меньшей мере, 90%, или изобретение относится к антителу, распознающему тот же эпитоп на внеклеточном домене AXL.
В используемом здесь значении "идентичность последовательности" между двумя полипептидными последовательностями показывает процент аминокислот, которые идентичны между последовательностями. Предпочтительные полипептидные последовательности изобретения имеют идентичность последовательности, составляющую, по меньшей мере, 90%.
В особенно предпочтительном воплощении антитело выбирают из группы, состоящей из 11В7, 11D5, 10D12, или антитела, распознающего аналогичный эпитоп на внеклеточном домене AXL.
Антитело может быть любым антителом естественного и/или синтетического происхождения, напр. антитело млекопитающего. Предпочтительно, константный домен - если таковой присутствует - представляет собой константный домен человека. Константный домен предпочтительно является константным доменом млекопитающего, напр. гуманизированным, или константным доменом человека. Более предпочтительно, антитело является химерным, гуманизированным или антителом человека.
Антитело изобретения может быть IgA-, IgD-, IgE-, IgG- или IgM-типом, предпочтительно IgG- или IgM-типом, включая, но не ограничиваясь, IgG1-, IgG2-, IgG3-, IgG4-, IgM1- и IgM2-типом. В наиболее предпочтительных воплощениях антитело представляет собой IgG1-, IgG2- или IgG4-тип.
Как обсуждалось выше, существует множество изотипов антител. Необходимо понимать, что антитела, которые образуются, сначала не имеют такой изотип, но иногда антитело, как образовано, может обладать любым изотипом, и что антитело может быть антителом с переключенным изотипом при использовании молекулярно клонированных генов V-областей или клонированных генов константных участков или кДНК в соответствующих экспрессирующих векторах, используя общепринятые биомолекулярные технологии, которые хорошо известны из уровня техники, а затем экспрессируются антитела в клетках-хозяевах, используя техники, известные из уровня техники.
Термин антитело включает "фрагменты" или "производные", которые имеют, по меньшей мере, один антигенсвязывающий участок антитела. Фрагменты антител включают Fab фрагменты, Fab' фрагменты F(ab')2 фрагменты, а также Fv фрагменты. Производные антитела включают одноцепочечные антитела, нанотела и диатела. Производные антитела должны также включать каркасные белки, обладающие антитело-подобной связывающей активностью, которые связываются с AXL.
В контексте настоящего изобретения термин "каркасный белок" в используемом здесь значении означает полипептид или белок с экспонированными площадями поверхности, в которых с высокой степенью допустимы аминокислотные вставки, замены или делеции. Примерами каркасных белков, которые могут применяться в соответствии с настоящим изобретением, являются белок А из Staphylococcus aureus, билин-связывающий белок из Pieris brassicae или другие липокалины, белок с анкириновым повтором и фибронектин человека (приведено в Binz and Pluckthun, Curr Opin Biotechnol, 16:459-69, 2005). Создание каркасного белка может рассматриваться как трансплантирование или интегрирование аффинной функции на или в структурный каркас прочно упакованного белка. Аффинная функция означает аффинность к связывающим белкам в соответствии с настоящим изобретением. Каркас может быть структурно отделен от аминокислотных последовательностей, придавая связывающую специфичность. В целом, белки, которые предположительно подходят для разработки таких синтетических аффинных реагентов, могут быть получены с помощью рациональных, или наиболее распространенных, комбинационных методов белковой инженерии, таких как пэннинг против AXL, либо очищенного белка, либо белка, имеющегося на клеточной поверхности, для связывающих агентов в синтетической библиотеке каркасных белков, представленных in vitro, при этом белки могут быть получены специалистом в данной области техники (Skerra, J. Mol. Recog., Biochim Biophys Acta, 1482:337-350, 2000; Binz and Pluckthun, Curr Opin Biotechnol, 16:459-69, 2005). В дополнении, каркасный белок, обладающий антителоподобной связывающей активностью, может быть получен из акцепторного полипептида, содержащего каркасный домен, который может быть соединен со связывающими доменами донорского полипептида для придания связывающей специфичности донорского полипептида каркасному домену, содержащему акцепторный полипептид. Введенные связывающие домены могут включать, например, по меньшей мере, один CDR анти-AXL-антитела, предпочтительно, по меньшей мере, такой, который выбирают из группы SEQ ID NO:13-30. Вставки могут выполняться различными способами, известными специалистам в данной области техники, включая, например, с помощью полипептидного синтеза, синтеза нуклеиновых кислот кодируемой аминокислоты, а также с помощью различных вариантов рекомбинантных методов, хорошо известных специалистам из уровня техники.
Как было определено выше, специфичность антитела, фрагмента антитела или его производного заключается в аминоксилотной последовательности CDR. Константный домен (тяжелая цепь VH и легкая цепь VL) антитела предпочтительно содержит три определяющих комплементарность участка, иногда называемых гипервариабельные участки, фланкированные четырьмя относительно консервативными каркасными участками или "FR". Часто специфичность антитела определяется или в большей степени определяется посредством CDR, таких как CDR из VH-цепи, или ряда CDR. Специалист в данной области без труда оценит, какой константный домен антитела, фрагмента антитела или его производного, имеющий вышеописанные CDR, может быть использован для конструирования антител с дополнительно улучшенной специфичностью и биологической функцией. В связи с чем настоящее изобретение охватывает антитела, фрагменты антител или их производные, содержащие, по меньшей мере, один CDR вышеописанных константных доменов и которые преимущественно имеют практически такие же, аналогичные или улучшенные свойства, что и антитело, описанное в прилагаемых примерах. Начиная с антитела, которое содержит, по меньшей мере, один CDR, который указан в прилагаемом перечне последовательностей и предусмотрен воплощениями изобретения, специалист может комбинировать дополнительные CDR из первоначально идентифицированных моноклональных антител или различных антител для повышения специфичности и/или аффинности. CDR-пересадка хорошо известна из уровня техники и также может использоваться для точного настраивания специфичной аффинности и других свойств антитела, фрагмента или его производного изобретения, поскольку остается природная специфичность. Преимущественно, что антитело, фрагмент или производное содержит, по меньшей мере, два, более предпочтительно, по меньшей мере, три, даже более предпочтительно, по меньшей мере, четыре или, по меньшей мере, пять и в особенности предпочтительно все шесть CDR от природного донорского антитела. В дополнительных альтернативах изобретения CDR из различных природных моноклональных антител могут комбинироваться в новую единицу антитела. В этом случае предпочтительно, чтобы три CDR тяжелой цепи происходили из того же антитела, тогда как три CDR легкой цепи происходили из другого (но не все из одного) антитела. Антитела настоящего изобретения или их соответствующая иммуноглобулиновая цепь(и) могут быть дополнительно модифицированы, используя общепринятые техники, известные из уровня техники, например, путем использования аминокислотной делеции(ий), вставки(ок), замены(н), дополнения(ий), и/или рекомбинации(ий), и/или любой другой модификации(ий), известной из уровня техники, либо в отдельности, либо в комбинации. Способы введения таких модификаций в ДНК-последовательность, лежащую в основе аминокислотной последовательности иммуноглобулиновой цепи, хорошо известны специалисту в данной области техники; см., напр., Sambrook, Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory (1989) N.Y.
Антитела, фрагменты антител или их производные, при необходимости, деиммунизируют для терапевтических целей. Деиммунизированное антитело является белком, лишенным или с небольшим количеством эпитопов, которые могут быть распознаны Т-хелперными лимфоцитами. Пример того, как идентифицировать указанные эпитопы, показан в Tangri et al. (J Immunol. 174:3187-96, 2005). Изготовление фрагментов деиммунизированных антител или их производных можно осуществлять, как описано в патентах США №6054297, 5886152 и 5877293.
В одном воплощении антитела специфично включают "химерные" антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из определенных видов или принадлежащих к определенному классу или подклассу антител, между тем как остаток цепи(ей) идентичен или гомологичен соответствующим последовательностям в антителах, полученных из других видов или принадлежащих к другому классу или подклассу антител, а также фрагментов таких антител, поскольку они проявляют желаемую биологическую активность (патент США №4816567; Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). Получение химерных антител описано, например, в WO 89/09622.
Предпочтительно, настоящее изобретение относится к химеризированному антителу, содержащему аминокислотную последовательность тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:38, 39, 41, 42, или, по меньшей мере, ее константный домен или аминокислотную последовательность, имеющую с ней идентичность последовательность, по меньшей мере, 90%, и/или аминокислотную последовательность легкой цепи, которую выбирают из группы, состоящей из SEQ ID NO:37, 40, или, по меньшей мере, ее константный домен или аминокислотную последовательность, имеющую с ней идентичность последовательность, по меньшей мере, 90%, или изобретение относится к антителу, распознающему тот же эпитоп на внеклеточном домене AXL.
В дополнительном воплощении антитела настоящего изобретения являются гуманизированными или полностью человеческими антителами. Гуманизированные формы антител могут создаваться в соответствии с методами, известными из уровня техники, такими как химеризация или пересадка CDR. Альтернативные способы получения гуманизированных антител хорошо известны из уровня техники и описаны, напр., в ЕР-А1 0239400 и W090/07861. Обычно гуманизированное антитело имеет один или более аминокислотных остатков, введенных в него из источника, который не является человеком. Эти нечеловеческие аминокислотные остатки часто называют "импортные" остатки, которые типично взяты из "импортного" константного домена. Гуманизирование может, например, быть выполнено с помощью метода, описанного Winter и его соавторами (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), путем замещения CDR или CDR-последовательностей нечеловеческого происхождения на соответствующие последовательности антитела человека. Следовательно, такие "гуманизированные" антитела являются химерными антителами (патент США №4816567), в которых практически менее чем интактный человеческий константный домен замещен соответствующей последовательностью из видов, не относящихся к человеку. В практике гуманизированные антитела обычно являются человеческими антителами, в которых некоторые CDR-остатки и, возможно, некоторые FR-остатки замещены остатками аналогичных сайтов из нечеловеческих антител.
Предпочтительно, настоящее изобретение относится к гуманизированному антителу, содержащему аминокислотную последовательность тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:44, 46, или, по меньшей мере, ее константный домен или аминокислотную последовательность, имеющую с ней идентичность последовательность, по меньшей мере, 90%, и/или аминокислотную последовательность легкой цепи, которую выбирают из группы, состоящей из SEQ ID NO:43, 45, или, по меньшей мере, ее константный домен или аминокислотную последовательность, имеющую с ней идентичность последовательность, по меньшей мере, 90%, или изобретение относится к антителу, распознающему тот же эпитоп на внеклеточном домене AXL.
Один из способов создания полностью человеческих антител включает использование мышиных штаммов XenoMouse®, которые содержат фрагменты эмбрионального типа локуса тяжелой цепи человека и локуса легкой каппа-цепи размером не менее 1000 кб. См., Mendez et al. (Nature Genetics 15:146-156 1997), и Green and Jakobovits (J. Exp. Med. 188:483-495, 1998). Штаммы XenoMouse® доступны от AMGEN, Inc. (ранее ABGENIX, Fremont, CA).
Получение штаммов мышей XenoMouse® обсуждено и определено в патентных заявках США №07/466,008, поданной 12.01.1990; №07/610,515, поданной 08.11.1990; №07/919,297, поданной 24.07.1992; №07/922,649, поданной 30.07.1992; №08/031,801, поданной 15.03.1993; №08/112,848, поданной 27.08.1993; №08/234,145, поданной 28.04.1994; №08/376,279, поданной 20.01.1995; №08/430, 938, поданной 27.04.1995, №08/464,584, поданной 05.06.1995, №08/464,582, поданной 05.06.1995, №08/463,191, поданной 05. 06.1995, №08/462,837, поданной 05.06.1995, №08/486,853, поданной 05.06.1995, №08/486,857, поданной 05.06.1995. №08/486,859, поданной 05.06.1995, №08/462,513, поданной 05.06.1995, №08/724,752, поданной 02.10.1996, №08/759,620, поданной 03.12.1996; в публикации США 2003/0093820, поданной 30.11.2001, и в патентах США №6162963, 6150584, 6114598, 6075181 и 5939598 и японских патентах №3068180 В2, 3068506 В2 и 3068507 В2. См. также европейский патент ЕР 0463151 B1, опубликованный 12.06.1996, международную заявку на патент WO 9402602, опубликованную 03.02.1994, международные заявки на патент WO 9634096, опубликованную 31.10.1996, WO 9824893, опубликованную 11.06.1998, WO 0076310, опубликованную 21.12.2000. Описания каждого из цитируемых выше патентов, заявок и ссылок приведено здесь в полном объеме в виде ссылок.
В альтернативном методе другие исследователи, включая исследователей GenPharm International, Inc., использовали "мини-локусы". Этот подход с использованием мини-локусов заключается в том, что был имитирован локус экзогенного Ig путем включения фрагментов (отдельных генов) из локуса Ig. Таким образом, из одного или нескольких генов VH, одного или нескольких генов DH, одного или нескольких генов JH, константной мю-области и второй константной области (предпочтительно константной гамма-области) создавали конструкцию для введения животному. Этот способ описан в патенте США №5545807, Surani et al., и в патентах США №№5545806, 5625825, 5625126, 5633425, 5661,016, 5770429, 5789650, 5814318, 5877397, 5874299 и 6255458, Lonberg, и в патентах США №№5591669 и 6023010, Krimpenfort & Berns, в патентах США №№5612205, 5721367 и 5789215, Bems et al., и в патенте США №5643763, Choi & Dunn, и в Международных заявках на патент США; GenPharm: рег. №07/574748, поданной 29 августа 1990 г., 07/575962, поданной 31 августа 1990 г., 07/810279, поданной 17 декабря 1991 г., 07/853408, поданной 18 марта 1992 г., 07/904068, поданной 23 июня 1992 г., 07/990860, поданной 16 декабря 1992 г., 08/053131, поданной 26 апреля 1993 г., 08/096762, поданной 22 июля 1993, 08/155301, поданной 18 ноября 1993 г., 08/161739, поданной 3 декабря 1993 г., 08/165699, поданной 10 декабря 1993 г., и 08/209741, поданной 9 марта 1994 г., описания которых включены сюда путем ссылки. См. также Европатент №546073 В1, Международные патентные заявки №№ WO 92/03918, WO 92/22645, WO 92/22647, WO 92/22670, WO 93/12227, WO 94/00569, WO 94/25585, WO 96/14436, WO 97/13852 и WO 98/24884, и патент США №5981175, описания которых включены сюда путем ссылки в полном объеме.
Kirin также продемонстрировал генерирование человеческих антител у мышей, которым путем слияния микроклеток вводили большие фрагменты хромосом или целые хромосомы. См. Европейские патентные заявки №№773288 и 843961, описания которых включены сюда путем ссылки. Дополнительно, были генерированы KMTM-мыши, которые являются результатом кроссбридинга мышей Те (Kirin) и мышей с минилокусами (Medarex) (Humab). Эти мыши имеют человеческие трансхромосомы IgH мышей Kirin и трансген каппа-цепи мышей Genpharm (Ishida et al.,, Cloning Stem Cells 4:91-102, 2002).
Человеческие антитела также могут быть получены способами in vitro. Подходящие примеры включают, но не ограничиваются, фаговое отображение (CAT, Morphosys, Dyax, Biosite/Medarex, Xoma, Symphogen, Alexion (бывший Proliferon), (Affimed) рибосомное отображение (CAT), дрожжевое отображение и им подобные.
Для терапевтических целей антитело можно конъюгировать с терапевтически эффекторной группой, напр. радиоактивной группой или цитотоксичной группой.
Для диагностических целей антитело можно пометить. Подходящие метки включают радиоактивные метки, флуоресцентные метки или ферментативные метки.
Дополнительно используемые в соответствие с настоящим изобретением антитела являются так называемыми ксеногенными антителами. Общий принцип получения ксеногенных антител, таких как человеческие антитела, у мышей описан, напр., в WO 9110741, WO 9402602, WO 9634096 и WO 9633735.
Как обсуждалось выше, антитело изобретения может существовать в различных формах, кроме полных антител, включая, например, Fv, Fab' и F(ab')2, а также с одинарными цепями, см., напр., WO 8809344.
При необходимости, антитела изобретения могут быть мутированы в константных доменах тяжелой и/или легких цепей для изменения связывающего свойства антитела. Например, мутацию можно выполнить в одном или более CDR-участках для повышения или снижения Kd антитела для AXL или для изменения связывающей специфичности антитела. Техники сайт направленного мутагенеза хорошо известны из уровня техники. См, напр., Sambrook et al. and Ausubel et al., supra. Кроме того, мутация может быть выполнена в аминокислотном остатке, который известно, что изменен по сравнению с эмбриональным в вариабельном участке AXL-антитела. В другом аспекте мутации могут вводиться в один или более каркасных участков. Мутация может быть выполнена в каркасном участке или константном домене для повышения периода полураспада AXL-антитела. См., напр., WO 0009560. Мутация в каркасном участке или константном домене может также быть выполнена для изменения иммуногенности антитела с обеспечением сайта для ковалентного или нековалентного связывания с другой молекулой или для изменения таких свойств, как связывание комплемента. Мутации можно выполнять в каждом из каркасных участков, константном домене и вариабельных участках в одном мутированном антителе. Альтернативно, мутации можно выполнить только в одном из каркасных участков, вариабельных участков или константном домене в одном мутированном антителе.
В дополнительном аспекте антитело может иметь константный домен с эффекторными функциями, на основании чего экспрессирующие AXL клетки, которые связывают антитело, фрагмент антитела или его производное на клеточной поверхности, могут подвергаться воздействию иммунной системы. Например, антитело может быть способно фиксировать комплемент и участвовать в комплементзависимой цитотоксичности (CDC). Кроме того, антитело может быть способно связывать рецепторы Fc на эффекторных клетках, таких как моноциты и натуральные киллеры (NK), и участвовать в антителозависимой клеточной цитотоксичности (ADCC).
В еще дополнительном аспекте антитела изобретения пригодны для терапевтического лечения, предпочтительно для лечения гиперпролиферативных заболеваний, сердечнососудистых заболеваний, в частности атеросклероза и тромбоза, связанных с диабетом заболеваний, в частности гломерулярной гипертрофии или диабетической нефропатии, и в особенности нарушений, связанных с, сопровождающихся или вызванных экспрессией, сверхэкспрессией или гиперактивностью AXL. Гиперпролиферативные заболевания предпочтительно выбирают из нарушений связанных с, сопровождающихся или вызванных экспрессией, сверхэкспрессией или гиперактивностью AXL, таких как рак, напр., рак молочной железы, рак толстой кишки, рак легких, рак почки, фолликулярная лимфома, миелолейкоз, рак кожи/меланома, глиобластома, рак яичников, рак предстательной железы, рак поджелудочной железы, пищевод Барретта и рак пищевода, рак желудка, рак мочевого пузыря, рак шейки матки, рак печени, рак щитовидной железы и рак головы и шеи, или гиперпластические и неопластические заболевания или другие гиперпролиферативные заболевания, ассоциированные с экспрессией или сверхэкспрессией AXL.
В другом аспекте антитела настоящего изобретения могут использоваться для введения совместно с антибластомным агентом для лечения одного из вышеуказанных нарушений.
Совместное введение в используемом здесь значении включает введение антитела настоящего изобретения вместе с антинеопластическим агентом, предпочтительно антинеопластическим агентом, индуцирующим апоптоз. Термин совместное введение дополнительно включает введение антитела настоящего изобретения и антинеопластического агента, предпочтительно антинеопластического агента, индуцирующего апоптоз, в виде одной композиции или в виде двух или более раздельных композиций. Совместное введение включает введение антитела настоящего изобретения вместе с антинеопластическим агентом, предпочтительно антибластомный агент, индуцирующим апоптоз, одновременно (т.е. в одно время) или последовательно (т.е. с интервалами).
Изобретение дополнительно относится к молекуле нуклеиновой кислоты, кодирующей антитело, фрагмент антитела или его производное изобретения. Молекулой нуклеиновой кислоты изобретения, кодирующей вышеописанное антитело, фрагмент антитела или его производное, может быть, напр., ДНК, кДНК, РНК, или синтетически полученная ДНК или РНК, или рекомбинантно полученная химерная молекула нуклеиновой кислоты, содержащая любую из этих молекул нуклеиновой кислоты либо в отдельности, либо в комбинации. Молекула нуклеиновой кислоты может быть также геномной ДНК, относящейся к полному гену или большей его части или к фрагментам и его производным. Нуклеотидная последовательность может относиться к природной нуклеотидной последовательности или может содержать единичные или множественные нуклеотидные замены, делеции или дополнения. В особенно предпочтительном воплощении настоящего изобретения молекула нуклеиновой кислоты является молекулой кДНК.
Предпочтительно, изобретение относится к изолированной молекуле нуклеиновой кислоты, выбранной из группы, состоящей из:
(a) последовательности нуклеиновой кислоты, кодирующей полипептид SEQ ID NO:7-12, 13-30, 37-42, 43-46;
(b) последовательности нуклеиновой кислоты, как показано в SEQ ID NO:1-6, 31-36;
(c) нуклеиновой кислоты, комплементарной любым последовательностям в (а) или (b); и
(d) последовательности нуклеиновой кислоты, способной к гибридизации с (а), (b) или (с) при строгих условиях.
Термин "гибридизация при строгих условиях" означает, что два фрагмента нуклеиновой кислоты гибридизируются друг с другом при стандартных условиях гибридизации, как описано, например, в Sambrook et al., "Expression of cloned genes in E.coli" в Molecular Cloning: A laboratory manual (1989), Cold Spring Harbor Laboratory Press, New York, USA. Такими условиями являются, например, гибридизация в 6,0×SSC при около 45°C с последующей стадией промывания с 2,0×SSC при 50°С, предпочтительно 2,0×SSC при 65°С, или 0,2×SSC при 50°С, предпочтительно 0,2×SSC при 65°С.
Изобретение также относится к вектору, содержащему молекулу нуклеиновой кислоты изобретения. Указанным вектором может быть, например, фаг, плазмида, вирусный или ретровирусный вектор. Ретровирусные векторы могут быть репликационно компетентными или репликационно дефектными. В последнем случае репродукция вируса обычно может происходить только в комплементарных клетках-хозяевах.
Молекулы нуклеиновых кислот изобретения можно объединять с вектором, содержащим селектируемые маркеры для репродукции в хозяине. Обычно плазмидный вектор вводится в преципитат, такой как преципитат фосфата кальция или преципитат хлорида рубидия, или в комплекс с заряженным липидом, или в кластеры с углеродной основой, такие как фуллерены. Если вектор представляет собой вирус, то его можно комплектовать in vitro, используя соответствующие клеточные линии с дефектом упаковки, перед введением в клетку-хозяина.
Предпочтительно, вектор изобретения представляет собой экспрессирующий вектор, в котором молекула нуклеиновой кислоты функционально связана с одной или более контрольными последовательностями, обеспечивая транскрипцию и, при необходимости, экспрессию в прокариотических и/или эукариотических клетках-хозяевах. Экспрессия указанной молекулы нуклеиновой кислоты включает транскрипцию молекулы нуклеиновой кислоты, предпочтительно в транслируемую мРНК. Регуляторные элементы, обеспечивающие экспрессию в эукариотических клетках, предпочтительно клетках млекопитающих, хорошо известны для специалиста в данной области техники. Они обычно содержат регуляторные последовательности, обеспечивающие инициирование транскрипции и, при необходимости, поли-А-сигналы, обеспечивающие завершение транскрипции и стабилизацию транскрипта. Дополнительные регуляторные элементы включают транскрипционные, а также трансляционные энхансеры. Возможные регуляторные элементы, обеспечивающие экспрессию в прокариотических клетках-хозяевах, содержат, напр., lac, trp или tac-промотор в Е.coli, и примерами регуляторных элементов, обеспечивающих экспрессию в эукариотических клетках-хозяевах, являются промотор AOXI или GAL1 в дрожжах или CMV-, SV40-, RSV-промотор (вирус саркомы Рауса), CMV-энхансер, SV40-энхансер или интрон гена глобина в клетках млекопитающих или других животных. Среди элементов, которые ответственны за инициирование транскрипции, такие регуляторные элементы могут также содержать сигналы терминации транскрипции, такие как сайт SV40-поли-А или сайт tk-поли-А, вниз от полинуклеотида. В этом случае пригодные экспрессирующие векторы известны из уровня техники, такие как кДНК экспрессирующий вектор pcDV1 Okayama-Berg (Pharmacia), pCDM8, pRc/CMV, pcDNAI, pcDNA3 (Invitrogen) или pSPORTI (GIBCO BRL). Предпочтительно, указанный вектор является экспрессирующим вектором и/или вектором для переноса генов или прицельным вектором. Экспрессирующий вектор, который получен из вирусов, таких как ретровирусы, вирус вакцины, аденовирус, герпес-вирус или вирус папилломы крупного рогатого скота, может использоваться для доставки полинуклеотидов или вектора изобретения в мишеневую клеточную популяцию. Способы, которые хорошо известны специалистам, могут применяться для конструирования рекомбинантных вирусных векторов; см., например, техники, описанные в Sambrook, Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory (2001, Third Edition) N.Y. и в Ausubel, Current Protocols in Molecular Biology, Green Publishing Associates and Wiley Interscience, N.Y. (1994). Альтернативно, молекулы нуклеиновых кислот изобретения можно растворять в липосомах для доставки в клетки-мишени.
Изобретение дополнительно относится к хозяину, содержащему вектор изобретения. Указанный хозяин может быть прокариотической или эукариотической клеткой или трансгенным животным, не относящимся к человеку. Полинуклеотид или вектор изобретения, который присутствует в хозяине, может либо быть интегрирован в геном хозяина, либо может поддерживаться экстрахромосомно. В связи с этим необходимо понимать, что молекула нуклеиновой кислоты изобретения может использоваться для "направленного воздействия на ген(ы)" и/или "замещения гена(ов)", для восстановления мутантного гена или для создания мутантного гена посредством гомологичной рекомбинации; см., например Mouellic, Proc. Natl. Acad. Sci. USA, 87 (1990), 4712-4716; Joyner, Gene Targeting, A Practical Approach, Oxford University Press.
Хозяин может быть любой прокариотической или эукариотической клеткой, такой как клетка бактерии, гриба, растения, животного, млекопитающего или, предпочтительно, человека. Предпочтительными грибковыми клетками являются, например, клетки рода дрожжевых грибов (Saccharomyces), в частности видов S. cerevisiae. Термин "прокариотическая" включает все бактерии, которые можно трансформировать или трансфицировать полинуклеотидом для экспрессии варианта полипептида изобретения. Прокариотические хозяева могут включать грамотрицательные, а также грамположительные бактерии, такие как, например, Е.coli, S. typhimurium, Serratia marcescens и Bacillus subtilis. Полинуклеотид, кодирующий мутантную форму вариантных полипептидов изобретения, может быть трансформирован или трансфицирован в хозяина, используя любые методы, общеизвестные для специалиста в данной области техники. Способы приготовления слитых, функционально связанных генов и экспрессии их в бактериальных или животных клетках хорошо известны из уровня техники (Sambrook, Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory (2001, Third Edition)). Генетические конструкции и способы, описанные здесь, могут применяться для экспрессии вариантных антител, фрагментов антител изобретения или их производных, напр., в прокариотических хозяевах. В целом, экспрессирующие векторы, содержащие промоторные последовательности, которые способствуют эффективной транскрипции введенной молекулы нуклеиновой кислоты, применяются в сочетании с хозяином. Экспрессирующий вектор обычно содержит ориджин-репликации, промотор и терминатор, а также специфичные гены, которые способны обеспечивать выбор по фенотипу трансформированных клеток. Трансформированные прокариотические клетки можно выращивать в ферментаторах и культивировать в соответствии с методами, известными из уровня техники, для достижения оптимального роста клеток. Антитела изобретения, фрагменты антител или их производные могут затем быть изолированы из питательной среды, клеточных лизатов или фракций мембран клеток. Изолирование и очистка антител изобретения, экспрессированных в бактериях или других видах, фрагментов антител или их производных могут быть выполнены с помощью любых общепринятых способов, таких, например, как подготовительные хроматографические разделения и иммунологические разделения, которые включают применение моноклональных или поликлональных антител.
В предпочтительном воплощении изобретения хозяином является клетка бактерии, гриба, растения, амфибии или животного. Предпочтительные клетки животных включают, но не ограничиваются, клетки яичника китайского хомячка (СНО), клетки почки карликового хомячка (BHK), клетки почек обезьян (COS), 3Т3-клетки, NSO-клетки и другие клеточные линии, включая клетки человека, например Per.С6. В другом предпочтительном воплощении указанная клетка животного является клеткой насекомого. Предпочтительные клетки насекомых включают, но не ограничиваются, клетки клеточных линий SF9.
В более предпочтительном воплощении изобретения указанный хозяин представляет собой клетку человека или клеточную линию человека. Указанные клетки человека включают, но не ограничиваются, клетки эмбриональной почки человека (HEK293, 293Т, 293 freestyle). Кроме того, указанные клеточные линии человека включают, но не ограничиваются, HeLa-клетки, клетки гепатокарциномы человека (напр., Hep G2), А549-клетки.
Изобретение также обеспечивает трансгенных животных, не относящихся к человеку, содержащих одну или более молекул нуклеиновых кислот изобретения, которые могут быть использованы для получения антител изобретения. Антитела могут быть получены или извлечены из ткани или биологических жидкостей, таких как молоко, кровь или моча, от коз, коров, лошадей, свиней, крыс, мышей, кроликов, хомяков или других млекопитающих. См., напр., патенты США №№5827690; 5756687; 5750172 и 5741957. Как описывается выше, трансгенные животные, не относящиеся к человеку и которые содержат локусы иммуноглобулинов человека, могут быть получены путем иммунизации AXL или ее частью.
Изобретение дополнительно относится к способу приготовления антитела, включающему культивирование хозяина изобретения при условиях, которые позволяют синтезировать указанное антитело, и извлечение указанного антитела из указанной культуры.
Трансформированные хозяева можно выращивать в ферментаторах и культивировать в соответствии с методами, известными из уровня техники, для достижения оптимального роста клеток. Как только экспрессировались, все антитела, их димеры, отдельные легкие и тяжелые цепи или другие формы иммуноглобулинов настоящего изобретения могут быть очищены в соответствии со стандартными процедурами, известными из уровня техники, включая фракционирование сульфатом аммония, аффинные колонки, колоночную хроматографию, гель-электрофорез и им подобные; см. Scopes, "Protein Purification", Springer-Verlag, N.Y. (1982). Антитело или его соответствующую иммуноглобулиновую цепь(и) изобретения можно потом изолировать из питательной среды, клеточных лизатов или фракций клеточных мембран. Изолирование и очистка, напр., антител, экспрессируемых в бактериях, или иммуноглобулиновых цепей изобретения могут выполняться любыми общепринятыми способами, такими как, например, подготовительные хроматографические разделения и иммунологические разделения, которые включают применение моноклональных или поликлональных антител, направленных, напр., против константного участка антитела изобретения.
Для специалиста в данной области техники понятно, что антитела изобретения могут дополнительно связываться с другими агентами, напр., для нацеливания лекарственного средства и визуализации изображения. Такое соединение может быть проведено химически после экспрессии антитела или антигена на участке прикрепления, или продукт присоединения может быть сконструирован в антителе или антигене изобретения на уровне ДНК. ДНК затем экспрессируется в подходящей системе-хозяине, и экспрессируемые белки собирают и денатурируют, при необходимости.
В предпочтительном воплощении настоящего изобретения антитело соединено с эффектором, таким как радиоизотоп или токсичный химиотерапевтический агент. Предпочтительно, эти конъюгаты антител можно использовать в клетках-мишенях, напр. раковых клетках, экспрессирующих AXL, для элиминации. Соединение антител/фрагментов антиген изобретения с радиоизотопами, напр., обеспечивает преимущества для лечения опухолей. В отличие от химиотерапии и других форм лечения рака, радиоиммунотерапия или введение комбинации радиоизотоп-антитело непосредственно воздействует на раковые клетки с минимальными повреждением окружающих нормальных, здоровых тканей. Предпочтительные радиоизотопы включают, напр., 3H, 14С, 15N, 35S, 90Y, 99Tc, 111In, 1251, 131I.
Кроме того, антитела изобретения могут использоваться для лечения рака, если их конъюгировать с токсическими химиотерапевтическими лекарственными средствами, таким как гелданамицин (Mandler et al., J. Natl. Cancer Inst., 92(19), 1549-51, 2000) и майтансин, например майтансиновое лекарственное средство, DM1 (Liu et al., Proc. Natl. Acad. Sci. U.S.A. 93:8618-8623, 1996) и ауристатин-Е, или монометилауристатин-Е (Doronina et al., Nat. Biotechnol. 21:778-784, 2003), или калихимицин. Различные линкеры, которые высвобождают лекарства при кислых или восстановительных условиях или под действием специфичных протеаз, используются с этими технологиями. Антитела изобретения можно конъюгировать, как описано в уровне техники.
Изобретение дополнительно относится к фармацевтической композиции, содержащей антитело, молекулу нуклеиновой кислоты, вектор, хозяин изобретения или антитело, полученное с помощью способа изобретения.
Термин "композиция" в используемом здесь значении содержит, по меньшей мере, одно соединение изобретения. Предпочтительно, такая композиция является фармацевтической или диагностической композицией.
Предпочтительно, чтобы указанная фармацевтическая композиция содержала фармацевтически подходящий носитель и/или разбавитель. Описанная здесь фармацевтическая композиция может быть частично пригодной для лечения нарушений, сопровождающихся или вызванных экспрессией, связанных с сверхэкспрессией или гиперактивностью AXL, напр., гиперпролиферативных заболеваний, сердечнососудистых заболеваний, в частности атеросклероза и тромбоза, связанных с диабетом заболеваний, в частности гломерулярной гипертрофии или диабетической нефропатии. Указанные нарушения включают, но не ограничиваются, рак, напр. рак молочной железы, рак толстой кишки, рак легких, рак почки, фолликулярную лимфому, миелолейкоз, рак кожи/меланому, глиобластому, рак яичников, рак предстательной железы, рак поджелудочной железы, пищевод Барретта и рак пищевода, рак желудка, рак мочевого пузыря, рак шейки матки, рак печени, рак щитовидной железы и рак головы и шеи, или другие гиперпластические или неопластические заболевания, или другие заболевания, связанные с экспрессией или сверхэкспрессией AXL.
Термин "гиперактивность" в данном изобретении относится к неконтролируемой AXL-активации, которая может быть вызвана недостатком и/или дисфункцией негативной регуляции. В качестве примера, негативная регуляция включает дефосфорилирование белков, деградацию и/или эндоцитоз. Кроме того, неконтролируемая AXL-активация может являться результатом генетических изменений, или соматических, или зародышевых, которые приводят к изменениям аминокислотной последовательности AXL.
Примеры пригодных фармацевтических носителей, эксципиентов и/или разбавителей хорошо известны из уровня техники и включают фосфатно-солевые буферные растворы, воду, эмульсии, такие как «масло-в-воде» эмульсии, различные типы увлажнителей, стерильные растворы и др. Композиции, содержащие такие носители, могут быть составлены с помощью хорошо известных общепринятых методов. Эти фармацевтические композиции можно вводить субъекту в подходящей дозировке. Введение подходящих композиций может осуществляться различными путями, напр. внутривенно, интраперитонеально, подкожно, внутримышечно, местно, внутрикожно, интраназально или интрабронхиально. Композиции изобретения можно также вводить непосредственно в нужный участок, напр., путем биолистической доставки во внешний или внутренний участок-мишень, например в мозг. Режим приема лекарственного средства будет определяться лечащим врачом и в зависимости от клинических факторов. Как известно, дозировки для каждого конкретного пациента зависят от множества факторов, включая размер пациента, площадь поверхности тела, возраст, вводимое конкретное соединение, пол, время и путь введения, состояние общего здоровья и другие лекарства, которые пациент принимает одновременно. Белковоподобное фармацевтически активное вещество может присутствовать в количестве от 1 мкг до 100 мг/кг массы тела на дозу; однако, дозы ниже или выше указанного примерного диапазона также предусмотрены, в особенности принимая во внимание вышеприведенные факторы. Если режим представляет собой непрерывную инфузию, то активное вещество должно присутствовать в диапазоне от 1 пг до 100 мг на килограмм массы тела в минуту.
Динамику можно проверять посредством периодической оценки. Композиции изобретения можно вводить местно или системно. Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, включая солевые и буферные среды. Парентеральные наполнители включают раствор хлорида натрия, декстрозу Рингера, декстрозу и натрия хлорид, лактат Рингера или жирные масла. Внутривенные наполнители включают жидкие и питательные наполнители, электролитные наполнители (такие, которые основаны на декстрозе Рингера) и им подобные. Консерванты и другие добавки также могут входить в состав, например, такие как противомикробные средства, антиоксиданты, хелатообразующие агенты и инертные газы и им подобные. Кроме того, фармацевтическая композиция изобретения может содержать дополнительные агенты в зависимости от предназначения фармацевтической композиции. В особенности предпочтительно то, что фармацевтическая композиция дополнительно содержит активные агенты, такие как, напр., дополнительный антибластомный агент, низкомолекулярный ингибитор, противоопухолевый агент или химиотерапевтический агент.
Изобретение также относится к фармацевтической композиции, содержащей анти-AXL-антитело, которое является предпочтительно антителом изобретения в комбинации, по меньшей мере, с одним дополнительным антибластомным агентом. Указанная комбинация является эффективной, например, для ингибирования патологического роста клеток.
Многие антибластомные агенты известны в настоящее время из уровня техники. В общем, термин включает все агенты, которые способны предотвращать, уменьшать и/или излечивать гиперпролиферативные заболевания. В одном воплощении антибластомный агент выбирают из группы терапевтических белков, включая, но не ограничиваясь, антитела или иммуномодуляторные белки. В другом воплощении антибластомный агент выбирают из группы низкомолекулярных ингибиторов или химиотерапевтических агентов, состоящей из ингибиторов митоза, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, ингибиторов гистондеацетилазы, агентов «антивыживания», модификаторов биологического отклика, антигормонов, напр. антиандрогенов, и агентов антиангиогенеза.
Специфичные примеры антибластомных агентов, которые можно использовать в комбинации с антителами, которые обеспечены здесь, включают, например, гефинитиб, лапатиниб, сунитиниб, пеметрексед, бевацизумаб, цетуксимаб, иматиниб, трастузумаб, алемтузумаб, ритуксимаб, эрлотиниб, бортезомиб и им подобные. Другие специфичные антибластомные агенты для применения в композиции, описываемой и заявленной здесь, включают, например, химиотерапевтические агенты, такие как капецитабин, даунорубицин, дауномицин, дактиномицин, доксорубицин, эпирубицин, идарубицин, эзорубицин, блеомицин, мафосфамид, ифосфамид, цитозина арабинозид, бис-хлорэтилнитрозомочевина, бисульфан, митомицин С, актиномицин D, митрамицин, преднизон, гидроксипрогестерон, тестостерон, тамоксифен, дакарбазин, прокарбазин, алтретамин, пентаметилмеламин, митоксантрон, амсакрин, хлорамбуцил, метилциклогексилнитрозомочевина, азотистый иприт, мелфалан, циклофосфамид, 6-меркаптопурин, 6-тиогуанин, цитарабин (СА), 5-азацитидин, гидроксимочевина, дезоксикоформицин, 4-гидроксипероксициклофосфорамид, 5-фторурацил (5-FU), 5-фтордезоксиуридин (5-FUdR), метотрексат (МТХ), колхицин, таксол, винкристин, винбластин, этопозид, триметрексад, тенипозид, цисплатин и диэтилстилбестрол (DES). См., в основном, The Merck Manual of Diagnosis and Therapy, 15th Ed. 1987, p.1206-1228, Berkow et al., eds., Rahway, N.J. В особенности предпочтительными являются такие антибластомные агенты, которые индуцируют апоптоз.
При использовании вместе с описываемыми AXL-антителами такие антибластомные агенты могут использоваться по отдельности (напр., 5-FU и антитело), последовательно (напр., 5-FU и антитело за период времени с последующим использованием МТХ и антитела) или в комбинации с одним или более антибластомными агентами (напр., 5-FU, МТХ и антитело или 5-FU, радиотерапия и антитело).
Термин антибластомный агент может также включать терапевтические процедуры, как, например, облучение или радиотерапию.
Фармацевтическая композиция изобретения может применяться в клинической медицине и также может применяться в ветеринарных целях.
Дополнительно, изобретение относится к применению антитела изобретения, молекулы нуклеиновой кислоты, вектора, хозяина изобретения или антитела, полученного способом изобретения для приготовления фармацевтической композиции для диагностики, профилактики или лечения гиперпролиферативных заболеваний, сердечнососудистых заболеваний, в частности атеросклероза и тромбоза, связанных с диабетом заболеваний, в частности гломерулярной гипертрофии или диабетической нефропатии, и в особенности заболеваний, сопровождающихся или вызванных экспрессией, связанных с сверхэкспрессией или гиперактивностью AXL.
Гиперпролиферативное заболевание, которое указано выше, включает неоплазию, т.е. любое патологичное и/или неконтролируемое новообразование ткани. Термин "неконтролируемое новообразование ткани" в используемом здесь значении может зависеть от дисфункции и/или нарушения регуляции роста. Гиперпролиферативное заболевание включает опухолевые заболевания и/или рак, такой как метастатические или инвазивные злокачественные опухоли.
В предпочтительном воплощении применения изобретения указанное гиперпролиферативное заболевание представляет собой, в частности, рак молочной железы, рак толстой кишки, рак легких, рак почки, фолликулярную лимфому, миелолейкоз, рак кожи/меланому, глиобластому, рак яичников, рак предстательной железы, рак поджелудочной железы, пищевод Барретта и рак пищевода, рак желудка, рак мочевого пузыря, рак шейки матки, рак печени, рак щитовидной железы и рак головы и шеи, или гиперпластические или неопластические заболевания, или другие гиперпролиферативные заболевания, связанные с экспрессированием или сверхэкспрессированием AXL.
В еще другом воплощении настоящее изобретение относится к применению анти-AXL-антитела, предпочтительно антитела настоящего изобретения для изготовления лекарственного средства для совместного введения с антибластомным агентом для лечения одного из вышеприведенных нарушений.
В соответствии со следующим предпочтительным воплощением настоящее изобретение относится к применению анти-AXL-антитела для изготовления фармацевтической композиции для лечения рака, устойчивого к лекарственным препаратам. В особенно предпочтительном воплощении анти-AXL-антитело представляет собой моноклональное антитело, как указано в пп.1-22 формулы изобретения.
Дополнительно настоящее изобретение относится к композиции для диагностики, содержащей антитело изобретения, молекулу нуклеиновой кислоты, вектор, хозяина изобретения или антитело, полученное с помощью способа изобретения, и, при необходимости, фармацевтически подходящий носитель.
Диагностическая композиция изобретения является пригодной в обнаружении нежелательной экспрессии, сверхэкспрессии или гиперактивности AXL млекопитающих в различных клетках, тканях или другом подходящем образце, причем способ обнаружения включает контактирование образца с антителом изобретения и определение присутствия AXL в образце. Таким образом, диагностическую композицию изобретения можно использовать для оценки начала или состояния гиперпролиферативного заболевания.
Кроме того, злокачественные клетки, такие как раковые клетки, экспрессирующие AXL, могут быть нацелены на антитело изобретения. Клетки, которые связывают антитело изобретения, могут быть атакованы комплексами иммунной системой, например системой комплементам, или посредством клеточно-опосредованной цитотоксичности, за счет чего снижается число или происходит эрадикация раковых клеток. Эти принципы равнозначно применяются в лечении метастазов и рецидивирующих опухолей.
В другом аспекте настоящего изобретения антитело изобретения соединено с мечеными группами. Такие антитела в особенности подходят для диагностического применения. В используемом здесь значении, термин "меченая группа" относится к детектируемому маркеру, напр. радиомеченой аминокислоте, или биотинилированным агентам, которые могут быть обнаружены с помощью меченого авидина. Различные способы мечения полипептидов и гликопротеинов, таких как антител, известны из уровня техники и могут применяться в осуществлении настоящего изобретения. Примеры подходящих меченых групп включают, но не ограничиваются, следующие: радиоизотопы или радионуклиды (напр., 3H, 14С, 15N, 35S, 90Y, 99Tc, 11In, 125I, 131I), флуоресцентные группы (напр., FITC, родамин, лантаноидные люминесцирующие вещества), ферментативные группы (напр., пероксидазу хрена, β-галактозидазу, люциферазу, щелочную фосфатазу), хемилюминесцентные группы, биотинилированные группы или предварительно определенные полипептидные эпитопы, узнаваемые вторичными репортерными группами (напр., парные последовательности лейциновые «молнии», связывающие сайты для вторичных антител, домены связывания металлов, эпитопные метки).
В некоторых аспектах может быть желательным, что меченые группы прикреплены посредством спейсерных групп различной длины для снижения возможного стерического несоответствия.
В другом воплощении настоящее изобретение относится к способу оценки присутствия AXL-экспрессирующих клеток, включающему контактирование антитела изобретения с клетками или тканями, потенциально содержащих AXL на их поверхности. Подходящими способами обнаружения экспрессии AXL в образце могут быть иммуноферментный твердофазный анализ (ELISA) или иммуногистохимическое исследование (IHC).
Анализ ELISA может выполняться в титрационных микропланшетах, где, напр., в лунках микропланшет адсорбировано AXL-антитело. Лунки промывают и обрабатывают блокирующим агентом, таким как молочный белок или альбумин, для предотвращения неспецифической адсорбции аналита. Затем лунки обрабатывают тестируемым образцом. После промывки тестируемого образца или стандарта лунки обрабатывают вторым AXL-антителом, которое является меченым, напр., посредством связывания с биотином. После отмывки избытка вторичного антитела метка обнаруживается, напр., вместе с авидин-конъюгированной пероксидазой хрена (HRP) и подходящим хромогенным субстратом. Концентрацию AXL-антигена в тестируемых образцах определяют путем сравнения со стандартной кривой, разработанной на основе стандартных образцов.
Для IHC можно использовать залитые в парафин ткани, при этом ткани, напр., сначала депарафинизируют в ксилоле и затем дегидратируют, напр., этанолом и промывают в дистиллированной воде. Антигенные эпитопы, скрытые путем фиксации в формалине и заливки в парафин, могут быть доступны посредством открытия эпитопов, ферментативного расщепления или сапонина. Для открытия эпитопов парафиновые срезы можно нагревать в паровой камере, водяной бане или микроволновой печи в течение 20-40 мин в растворе для восстановления эпитопов, как, например, 2N растворе HCl (рН 1,0). В случае ферментативного расщепления срезы ткани можно инкубировать при 37°С в течение 10-30 минут в разных ферментных растворах, таких как протеиназа K, трипсин, проназа, пепсин и др.
После промывки от раствора для восстановления эпитопов или избытка ферментов, срезы ткани обрабатывают блокирующим буфером для предотвращения неспецифических взаимодействий. Добавляют первичное AXL-антитело в соответствующих концентрациях. Избыток первичного антитела отмывают и срезы инкубируют в блокирующем пероксидазу растворе в течение 10 мин при комнатной температуре. После другого этапа промывки срезы ткани инкубируют со вторым меченым антителом, напр. меченым группой, которая может служить в качестве «якоря» для фермента. Следовательно, примерами являются биотин-меченые вторичные антитела, которые распознаются пероксидазой хрена, конъюгированной со стрептавидином. Обнаружение комплекса антитело/фермент достигается путем инкубации вместе с подходящим хромогенным субстратом.
В дополнительном воплощении настоящее изобретение относится к способу блокирования функции AXL, включающему контактирование антитела изобретения с клетками или тканью, потенциально содержащими(ей) AXL на их/ее поверхности при условиях, при которых антитело способно блокировать функцию AXL. Контактирование может выполняться in vitro или in vivo.
Изобретение также относится к способу лечения гиперпролиферативного заболевания, сердечнососудистых заболеваний, в частности атеросклероза и тромбоза, связанных с диабетом заболеваний, в частности гломерулярной гипертрофии или диабетической нефропатии, при этом способ включает введение пациенту, нуждающемуся в лечении, подходящей дозы антитела, или фрагмента антитела, или его производного настоящего изобретения. Гиперпролиферативное заболевание предпочтительно выбирают из нарушений, сопровождающихся или вызванных экспрессией, связанных с сверхэкспрессией или гиперактивностью AXL, таких как рак, напр. рак молочной железы, рак толстой кишки, рак легких, рак почки, фолликулярная лимфома, миелолейкоз, рак кожи/меланома, глиобластома, рак яичников, рак предстательной железы, рак поджелудочной железы, пищевод Барретта и рак пищевода, рак желудка, рак мочевого пузыря, рак шейки матки, рак печени, рак щитовидной железы и рак головы и шеи, или гиперпластические и неопластические заболевания или другие гиперпролиферативные заболевания, связанные с экспрессией или сверхэкспрессией AXL.
В соответствии с другим предпочтительным воплощением изобретения рак, который подвергают лечению, является устойчивым к лекарственным средствам раком.
Изобретение дополнительно относится к способу лечения заболевания, в котором антитело изобретения вводят млекопитающему и в котором указанное заболевание непосредственно или косвенно связано с патологичным уровнем экспрессии или активности AXL.
В итоге изобретение относится к набору, содержащему анти-AXL-антитело, предпочтительно антитело, фрагмент антитела или его производное изобретения, молекулу нуклеиновой кислоты, кодирующую указанные компоненты и/или вектор изобретения.
Все воплощения, охватывающие соединения, здесь описываемые, могут использоваться как отдельные соединения, так и в комбинации для приготовления лекарственного средства.
Краткое описание фигур
Фигура 1. Анализ проточной цитометрии AXL на клеточной поверхности в фибробластах Ratl-Mock и Ratl-AXL cl.2. Поликлональные клетки Ratl-Mock и клональные клетки Ratl-AXL cl.2, полученные путем инфицирования Ratl-фибробластов экотропным вирусом pLXSN и pLXSN-hAXL, соответственно, собирали и помечали мышиным контрольным антителом 72А1 (левая панель) или мышиным первичным антителом анти-AXL МАВ154 (правая панель) в концентрации 3 мкг/мл и РЕ-конъюгированным антимышиным вторичным антителом. Подробнее см. текст. Мечение Ratl-AXL cl-2-клеток привело к сдвигу на три порядка и демонстрирует AXL-сверхэкспрессию на поверхности этих клеток.
Фигура 2. Анализ проточной цитометрии AXL на клеточной поверхности в фибробластах NIH3T3-Mock и NIH3T3-AXL cl.7. Поликлональные клетки NIH3T3-Моск и клональные клетки NIH3T3-AXL cl.7, полученные путем инфицирования NIH3T3-фибробластов экотропным вирусом pLXSN и pLXSN-AXL, соответственно, собирали и помечали мышиным контрольным антителом 72А1 (левая панель) или мышиным первичным антителом анти-AXL МАВ154 (правая панель) в концентрации 3 мкг/мл и РЕ-конъюгированным антимышиным вторичным антителом. Подробнее см. текст. Мечение NIH3T3-AXL cl.7-клеток привело к сдвигу на два порядка и демонстрирует AXL-сверхэкспрессию на поверхности этих клеток.
Фигура 3. Анализ проточной цитометрии перекрестной отвечаемости крысиных анти-AXL-антител с AXL мышей и макак-крабоедов, а также человеческих Mer и Sky. HEK293T-фибробласты случайным образом трансфицировали pcDNA3, pcDNA3-hAXL, pcDNA3mAXL, pcDNA3-cyAXL, pcDNA3-hMer или pcDNA3- hSky. Клетки собирали и метили 10 мкг/мл анти-AXL-первичным антителом 1D5, 11D5, 11В7, 10D12, 6Е7, 2А1, 11D7 или 12В7 и/или РЕ-конъюгированным ослиным антикрысиным вторичным антителом, или РЕ-конъюгированным ослиным антимышиным вторичным антителом только для контроля. Подробнее см. текст. Except 12B7, который показал среднюю перекрестную отвечаемость с мышиными AXL, а также человеческих Mer and Sky, никакие анти-AXL антитела не давали перекрестную реакцию с этими молекулами. В отличие от этого все тестируемые анти-AXL-антитела давали перекрестную реакцию с AXL макак-крабоедов.
Фигура 4. ELISA-эксперименты для изучения эффектов крысиных анти-AXL-антител на AXL-рецепторное фосфорилирование. NIH3T3-AXL cl.7 фибробласты (А) и NCI-H292 клетки рака легких (В) обедняли, предварительно инкубировали с 10 мкг/мл мышиным контрольным антителом 72А1, а также с крысиными анти-AXL антителами 2А1, 11D7, 11D5, 11В7, 6Е7 или 10D12, обрабатывали или не обрабатывали 400 нг/мл mGas6 и лизировали. Лизаты переносили в лунки планшета MAXL-Sorp 96, покрытых анти-фосфо-тирозин антителом 4G10, которые затем промывали и инкубировали вместе с 0,5 мкг/мл биотинилированным крысиным анти-AXL-антителом 12B7, АР-конъюгированным стрептавидином и субстратным раствором AttoPhos с тем, чтобы уловить интенсивность флуоресценции. Подробнее см. текст. Крысиные анти-AXL-антитела 11В7, 11D5, 6Е7 и 10D12 обеспечивали блокирование или снижение лиганд-опосредованной AXL-активации, что показано снижением фосфорилирования, и, следовательно, рассматривались как антагонистические анти-AXL-антитела. В отличие от этого крысиные анти-AXL-антитела 2А1 и 11D7 стимулировали базальную активацию AXL, что видно по увеличению фосфорилирования, при этом незначительно снижали лиганд-опосредованную активацию AXL и вследствие чего рассматривались как агонистические анти-AXL-антитела.
Фигура 5. ELISA-эксперименты для изучения эффектов крысиных анти-AXL-антител на фосфорилирование р42/р44 МАР-Киназы. Клетки рака шейки матки CaSki обедняли, предварительно инкубировали с 10 мкг/мл изотипическим контрольным антителом 1D5, а также с крысиными анти-AXL-антителами 11D5, 11В7 или 2А1, обрабатывали или не обрабатывали 400 нг/мл mGas6 и фиксировали формальдегидом. Клетки промывали, блокировали и инкубировали с первичным антителом анти-фосфо-р44/р42 МАР-Киназа (Thr202/Tyr204), HRP-конъюгированным антикроличьим вторичным антителом и раствором тетраметилбензидин для измерения интенсивности абсорбции. Подробнее см. текст. Крысиные анти-AXL-антитела 11В7 и 11D5 обеспечивали снижение лиганд-опосредованной активации р42/р44 МАР-Киназы, что видно по снижению фосфорилирования, и вследствие чего рассматривались как антагонистические анти-AXL-антитела. В отличие от этого крысиное анти-AXL-антитело 2А1 стимулировало базальную активацию р42/р44 МАР-Киназы, что показано повышением фосфорилирования, при этом не снижало лиганд-опосредованную активацию р42/р44 МАР-Киназы и тем самым рассматривалось как агонистическое анти-AXL-антитело.
Фигура 6. ELISA-эксперименты для изучения эффектов крысиных анти-AXL-антител на фосфорилирование Akt-Киназы. NIH3T3-AXL cl.7 фибробласты (А) и CaLu-1 клетки рака легких (В) обедняли, предварительно инкубировали с 10 мкг/мл изотипическим контрольным антителом 1D5, а также с крысиными анти-AXL-антителами 11D5, 11В7 или 2А1, обрабатывали или не обрабатывали 400 нг/мл mGas6 и фиксировали формальдегидом. Клетки промывали, блокировали и инкубировали с анти-фосфо-Akt (Ser473) первичным антителом, HRP-конъюгированным антикроличьим вторичным антителом и раствором тетраметилбензидин для измерения интенсивности абсорбции. Подробнее см. текст. Крысиные анти-AXL-антитела 11В7 и 11D5 обеспечивали блокирование и снижение лиганд-опосредованной активации Akt-Киназы, что видно по сниженному фосфорилированию, и, тем самым, рассматривались как антагонистические анти-AXL-антитела. В отличие от этого крысиное анти-AXL-антитело 2А1 стимулировало базальную активацию Akt-Киназы, что показано повышенным фосфорилированием, при этом не снижало лиганд-опосредованную активацию Akt-Киназы и вследствие чего рассматривалось как агонистическое анти-AXL-антитело.
Фигура 7. ELISA-эксперименты по сравнению эффектов крысиных и химерных анти-AXL-антител на фосфорилирование Akt-Киназы. Фибробласты NIH3T3-AXL cl.7 обедняли, предварительно инкубировали вместе с 50 нг/мл, 100 нг/мл, 300 нг/мл, 500 нг/мл и 1 мкг/мл мышиным анти-AXL-антителом 11 В7 или химерным анти-AXL-антителом ch11B7, а также вместе с 50 нг/мл, 100 нг/мл, 300 нг/мл, 500 нг/мл, 1 мкг/мл, 5 мкг/мл и 10 мкг/мл крысиным анти-AXL-антителом 11D5 или химерным анти-AXL-антителом ch11D5, обрабатывали или не обрабатывали 400 нг/мл mGas6 и фиксировали формалином. Клетки промывали, блокировали и инкубировали с первичным антителом анти-фосфо-Akt (Ser473), HRP-конъюгированным антикроличьим вторичным антителом и раствором тетраметилбензидина для измерения интенсивности абсорбции. Подробнее см. текст. Крысиное анти-AXL-антитело 11В7 и химерное анти-AXL-антитело ch11B7, а также крысиное анти-AXL-антитело 11D5 или химерное анти-AXL-антитело ch11D5 обеспечивали ингибирование лиганд-опосредованной активации Akt-Киназы до аналогичного уровня, что видно по сниженному фосфорилированию. Таким образом, по сравнению с их крысиными аналогами химерные анти-AXL-антитела ch11B7 и ch11D5 поддерживали активность.
Фигура 8. Конкурентные эксперименты ELISA для изучения свойств связывания крысиных анти-AXL-антител. 96-луночные планшеты MAXL-Sorp покрывали 1 мкг/мл AXL-ECD человека и предварительно инкубировали вместе с 10 мкг/мл небиотинилированным изотипическим контрольным антителом 1D5 или крысиными анти-AXL-антителами 11В7, 11D5, 6Е7, 10D12, 11D7 или 2А1. После инкубации с 0,5 мкг/мл биотинилированным изотипическим контрольным антителом 1D5 или биотинилированными крысиными анти-AXL-антителами 11В7, 11D5, 6Е7, 10D12, 11D7 или 2А1 и добавлением АР-конъюгированного стрептавидина и субстратного раствора AttoPhos, собирали сигнал флуоресценции для определения связанных биотинилированных антител. Подробнее см. текст. Контрольное антитело 1D5 не присоединилось к AXL-ECD. Антагонистические анти-AXL-антитела 11В7, 11D5, 6Е7 и 10D12 конкурировали друг с другом за одинаковые или структурно смежные эпитопы. Агонистические антитела 11D7 и 2А1 распознавали разные эпитопы и не конкурировали с антагонистическими антителами для присоединения к AXL-ECD.
Фигура 9. Анализ заживления ран/царапин для изучения эффектов крысиных и химерных анти-AXL-антител на клеточную миграцию и пролиферацию. До достижения клетками конфлюэнтности клетки рака легких NCI-H292 обедняли и наносили на рану с помощью наконечника для пипетки. В присутствии 10 мкг/мл изотипического контрольного антитела 1D5, антагонистических крысиных анти-AXL-антител 11D5, 11В7, 6Е7 или 10D12, химерных анти-AXL-антител chn11D5 lgG2 и chn11B7 lgG2, агонистических крысиных анти-AXL-антител 2А1 и 11D7, а также 10 мкг/мл Erbitux или 5 мкМ Sutent клеткам обеспечивали возможность вторичного заселения свободного участка. Через 24 ч клетки фиксировали и окрашивали и фотографировали рану. Подробнее см. текст. По сравнению с изотипическим контрольным антителом 1D5 антагонистические крысиные анти-AXL-антитела 11D5, 11В7, 6Е7 и 10D12, а также химерные анти-AXL-антитела chn11D5 lgG2 и chn11B7 lgG2 уменьшали вторичное заселение свободного участка, тогда как агонистические крысиные анти-AXL-антитела 2А1 и 11D7 приводили к полному закрытию раны.
Фигура 10. Анализ с использованием камер Бойдена/камер с мембраной «transwell» для изучения эффектов крысиных анти-AXL-антител на направленную миграцию клеток. В бессывороточной среде фибробласты NIH3T3-AXL cl.7 предварительно инкубировали вместе с 10 мкг/мл крысиными анти-AXL-антителами 4А6, 11В7 или 2А1, высеивали сверху покрытых коллагеном 1 вкладышей FluoreBlock и подвергали воздействию бессывороточной среды с или без Gas6 в нижней камере. Через 7 ч мигрировавшие клетки окрашивали кальцеином-АМ и измеряли флуоресценцию каждой клетки. Подробнее см. Текст. Антагонистическое анти-AXL-антитело 11В7 снижало обе, базальную и Gas6-индуцированную, миграции фибробластов NIH3T3-AXL cl.7, тогда как агонистическое крысиное анти-AXL-антитело 2А1 повышало лиганд-индуцированную и, в особенности, базальную миграцию клеток NIH3T3-AXL cl.7. Антитело 4А6 не оказывало действия на направленную миграцию клеток.
Фигура 11. Анализ с использованием AlamarBlue™ для изучения действия крысиных анти-AXL-антител на Са$6-индуцированную клеточную пролиферацию. В бессывороточной среде фибробласты NIH3T3-AXL cl.7 предварительно инкубировали вместе с 20 мкг/мл мышиным контрольным антителом 72А1, крысиными антагонистическими анти-AXL-антителами 11D5 и 11В7, а также агонистическим анти-AXL-антителом 2А1 и выращивали в отсутствие или в присутствии 400 нг/мл Gas6. Через 4 дня, К клеткам добавляли AlamarBlue™ и измеряли адсорбцию. Подробнее см. текст. Антагонистические анти-AXL-антитела 11D5 и 11В7 ингибировали Gas6-индуцированную пролиферацию фибробластов NIH3T3-AXL cl.7, тогда как агонистическое крысиное анти-AXL-антитело 2А1 повышало лиганд-индуцированную и, в особенности, базальную пролиферацию клеток NIH3T3-AXL cl.7.
Фигура 12. Анализ определения Каспазы-3/7 для изучения действия крысиных анти-AXL-антител на Cas6-опосредованный антиапоптоз. В бессывороточной среде фибробласты NIH3T3-AXL cl.7 предварительно инкубировали вместе с 10 мкг/мл изотипическим контрольным антителом 1D5, антагонистическими крысиными анти-AXL-антителами 11В7 и 11D5 или агонистическими крысиными анти-AXL-антителами 11D7 и 2А1 и обрабатывали или не обрабатывали Gas6. Добавляли субстратный раствор Apo-ONE и собирали сигнал флуоресценции для измерения активности каспазы-3/7. Подробнее см. текст. По сравнению с изотопическим контрольным антителом антагонистические крысиные анти-AXL-антитела 11В7 и 11D5 снижали Cas6-опосредованный антиапоптоз фибробластов NIH3T3-AXL cl.7 в бессывороточной среде и, следовательно, индуцировали апоптоз. В отличие от этого агонистические крысиные анти-AXL-антитела 2А1 и 11D7 индуцировали антиапоптоз клеток NIH3T3-AXL cl.7 в бессывороточной среде независимо от отсутствия или наличия Gas6 и, следовательно, ингибировали апоптоз.
Фигура 13. Анализ клеточного ангиогенеза, основанного на образовании сфероидов, для изучения действия крысиных анти-AXL-антител на VEGF-A-индуцированный эндотелиоцитарный спрутинг. HUVEC-сфероиды погружали в коллагеновый гель 3D, стимулировали 25 нг/мл VEGF-A и обрабатывали указанными концентрациями антагонистических крысиных анти-AXL-антител 11В7 (А) и 11D5 (В) в течение 24 ч. Анализировали среднее значение ± SEM суммарной длины отростков от 10 случайно выбранных сфероидов на точке на графике (левая панель) и определяли соответствующее ингибирование посредством антитела (правая панель). Приближение изображение кривых IC50 и подсчет значений IC50 осуществляли с помощью GraphPad Prism 4.03. Подробнее см. текст. Антагонистические крысиные анти-AXL-антитела 11В7 и 11D5 ингибировали VEGF-A-стимулирвоанный HUVEC-спрутинг в анализе сфероид-основанного ангиогенеза дозозависимым образом. Тогда как обработка более высокими концентрациями 11В7 снижала HUVEC-спрутинг до базальных уровней, при этом ингибирование более высокими концентрациями 11D5 не было эффективным (левая панель). HUVEC-спрутинг был ингибирован значениями IC50 9,8×10-8 М и 7,0×10-7 М для 11В7 и 11D5 соответственно (правая панель).
Фигура 14. Модель ортотопического ксенотрансплантата для изучения действия крысиных анти-AXL-антител на рост рака предстательной железы человека у бестимусных мышей. Клетки карциномы предстательной железы PC-3-LN ортотопически имплантировали в простату мышей NMRI-nu/nu. Животных случайным образом отбирали на 4 группы и им давали 25 мг/кг изотипического контрольного антитела 1D5 или антагонистического крысиного анти-AXL-антитела 11В7, а также 40 мг/кг Sutent или 12,5 мг/кг Taxotere. Во время периода лечения рост ортотопично растущих опухолей PC-3-LN, а также периферийных метастазов контролировали один раз в неделю по изображению биолюминесценции in vivo на 15 день, 23 день, 29 день и 34 день. Подробнее см. текст. По сравнению с изотипическим контрольным антителом 1D5 антагонистическое крысиное анти-AXL-антитело 11В7 снижало общий рост опухолей простаты PC-3-LN у бестимусных мышей.
Фигура 15. Модель ортотопического ксенотрансплантата для изучения действия крысиных анти-AXL-антител на метастазы карциномы предстательной железы человека у бестимусных мышей. Клетки карциномы предстательной железы PC-3-LN ортотопически имплантировали в простату мышей NMRI-nu/nu. Животных случайным образом отбирали на 4 группы и им давали 25 мг/кг изотипического контрольного антитела 1D5 или антагонистического крысиного анти-AXL-антитела 11В7, а также 40 мг/кг Sutent или 12,5 мг/кг Taxotere. После некропсии извлекали выбранные органы (печень, селезенка, легкие, бедро и часть поясничного отдела) и анализировали на наличие метастазов по изображению биолюминесценции. Подробнее см. текст. По сравнению с изотипическим контрольным антителом 1D5 антагонистическое крысиное анти-AXL-антитело 11В7 изобретения снижало возникновение метастазов селезенки. Примечательно, антиметастатический эффект 11В7 в этом эксперименте был сильнее, чем от Sutent.
Фигура 16. Иммуногистохимический анализ экспрессии AXL в различных злокачественных опухолях человека. 17 типов солидных опухолей человека, каждый из которых представлен попарно - опухолевая ткань и соответствующая незлокачественная ткань, анализировали относительно экспрессии AXL с помощью иммуногистохимического анализа. Подробнее см. текст. Результаты суммировали (А), в результате чего значение интенсивности «1» относилось к слабому окрашиванию у более чем 25% проверенных клеток. Примеры наиболее интенсивного окрашивания, которое наблюдается в опухоли молочных желез и перстневидно-клеточном раке желудка, показаны в (В).
Фигура 17. ELISA эксперименты для сравнения действия крысиных и химерных анти-AXL-антител на AXL-фосфорилирование. Клетки рака шейки матки CaSki обедняли, предварительно инкубировали вместе с 50 нг/мл, 100 нг/мл, 300 нг/мл, 750 нг/мл, 1 мкг/мл и 10 мкг/мл крысиным анти-AXL-антителом 11 В7 (А) или химерным анти-AXL-антителом ch11B7 (В), обрабатывали или не обрабатывали 400 нг/мл mGas6 и лизировали. Лизаты переносили в 96-луночные планшеты MAXL-Sorp, покрытые анти-фосфо-тирозин антителом и 4G10. После этого планшеты промывали и инкубировали с 0,5 мкг/мл биотинилированным крысиным анти-AXL-антителом 12В7, АР-конъюгированным стрептавидином и субстратным раствором AttoPhos для сбора сигнала флуоресценции. Подробнее см. текст. Как продемонстрировано посредством зависимого от концентрации снижения относительного AXL-фосфорилирования в клеточной линии рака шейки матки CaSki, крысиное анти-AXL-антитело 11В7 (А) и химерное анти-AXL-антитело ch11B7 (В) изобретения обеспечивали блокирование лиганд-индуцированной активации рецепторной тирозинкиназы AXL в сходной степени.
Фигура 18. ELISA-эксперименты для сравнения эффектов крысиного и химерного анти-AXL-антител на AXL-фосфорилирование. Клетки рак шейки матки CaSki обедняли, предварительно инкубировав вместе с 50 нг/мл, 100 нг/мл, 300 нг/мл, 750 нг/мл, 1 мкг/мл и 10 мкг/мл крысиным анти-AXL-антителом 11 В7 (А) или химерным анти-AXL-антителом ch11B7 (В), обрабатывали или не обрабатывали 400 нг/мл mGas6 и фиксировали формалином. Клетки промывали, блокировали и инкубировали с анти-фосфо-р44/р42 MAP Киназа (Thr202/Tyr204) первичным антителом, HRP-конъюгированным антикроличьим вторичным антителом и раствором тетраметилбензидином для измерения интенсивности абсорбции. Подробнее см. текст. Крысиное анти-AXL-антитело 11В7 (А) и химерное анти-AXL-антитело ch11B7 (В) изобретения обеспечивали блокирование Gas6-индуцированной активации р42/р44 МАР-Киназы в клетках рака шейки матки CaSki в сходной степени, что показано зависимым от концентрации снижением относительного р42/р44 МАР-Киназа-фосфорилирования.
Фигура 19. TUNEL-окрашивание для изучения комбинаторного действия крысиных анти-AXL-антител и химиотерапевтических агентов с преодолением лекарственной устойчивости в клетках рак яичников человека. Клетки рака яичников человека NCI/ADR-RES предварительно инкубировали вместе с 10 мкг/мл контрольным антителом или антагонистическим анти-AXL-антителом 11В7 и инкубировали вместе с доксорубицином в конечных концентрациях 100 мкМ, 150 мкМ или 200 мкМ. Применяя коммерчески доступный набор, выполняли окрашивание TUNEL для визуализации и определения апоптоза. Подробнее см. текст. Не наблюдали TUNEL-окрашивание, а следовательно, и апоптоз в клетках рака яичников NCI/ADR-RES, которые были обработаны 100 мкМ доксорубицина, независимо от того, инкубировали ли клетки вместе с контрольным антителом или антагонистическим анти-AXL-антителом 11В7 (верхняя). Однако при концентрации 150 мкМ доксорубицина был зафиксирован очень слабый апоптоз в клетках, обработанных совместно с контрольным антителом, тогда как инкубация вместе с антагонистическим анти-AXL-антителом 11В7 привела к стойкой индукции апоптоза (средняя). Также в присутствии 200 мкМ доксорубицина инкубирование клеток совместно с 11В7 значительно повышало степень апоптоза по сравнению с клетками, инкубированными с контрольным IgG-антителом (нижняя), показывая, что совместная обработка опухолевых клеток, даже мультирезистентных к лекарственным средствам, обоими химиотерапевтическими агентами и антагонистическими анти-AXL-антителами изобретения может подходить для преодоления лекарственной устойчивости.
Фигура 20. Анализ на мягком агаре для изучения комбинаторного действия крысиных анти-AXL-антител и химиотерапевтических агентов на безъякорный рост клеток меланомы человека. Клетки меланомы человека С-8161 либо оставляли необработанными, либо инкубировали с крысиным антагонистическим анти-AXL-антителом 11В7 в конечной концентрации 2,5 мкг/мл. Комбинируя с цисплатином при указанных концентрациях, погруженные в агар клетки выращивали сверху 0,7% основного слоя агара в течение 5 дней. Окрашивали с МТТ и затем измеряли площадь колоний. Подробнее см. текст. Представлены абсолютное количество, отражающее общую площадь колоний (А), и относительное ингибирование роста (В), рассчитанное на основании этих данных. По сравнению с необработанными контрольными клетками инкубация с цисплатином привела к замедлению роста колоний дозозависимым образом. В соответствии с ингибиторным эффектом одного 11В7 в пределах 30% комбинация с антагонистическим анти-AXL-антителом 11В7 привела к значительному потенцированному ингибиторному эффекту цисплатина на рост клеток меланомы С-8161 на мягком агаре, в особенности при низких концентрациях цисплатина.
Дополнительно, настоящее изобретение поясняется следующими примерами и сопровождаемыми фигурами.
Сведения, подтверждающие возможность осуществления изобретения
Следующие примеры, включая проведенные эксперименты и полученные результаты, приведены только для иллюстрации и не ограничивают объем настоящего изобретения.
Пример 1. Образование AXL-сверхэкспрессирующих Ratl-фибробластов как иммуногена и AXL-сверхэкспрессирующих NIH3T3-фибробластов как экспериментальной модельной системы
Полноразмерная кодирующая последовательность для AXL-транскриптного варианта 1 рецепторной тирозинкиназы человека в соответствии с National Center for Biotechnology Information (NCBI), контрольная последовательность (NM_021913), была субклонирована в pLXSN посредством фланкирующих распознающих элементов для рестрикционных эндонуклеаз EcoR1 и SamHI, что привело к получению ретровирусного экспрессирующего вектора pLXSN-hAXL.
Для образования антител, которые специфично прикрепляются к AXL-рецепторной тирозинкиназы человека, Ratl-фибробласты, постоянно сверхэкспрессирующие человеческий AXL, были образованы путем ретровирусного переноса генов. Вкратце, 3×105 Phoenix-E-клетки высеивали на 60 мм чашки Петри и трансфицировали 2 мкг/мл вектора pLXSN или pLXSN-hAXL, используя метод кальций-фосфатного осаждения. Через 24 ч среду заменяли свежей средой, в которой Phoenix-E-клетки инкубировали в течение 4 ч. Супернатанты Phoenix-E-клеток, высвобождающих pLXSN или pLXSN-hAXL-экотропный вирус, собирали и использовали для инкубации субконфлюэнтных Ratl-клеток (2×105 клеток на 6 см чашки) в течение 3 ч в присутствии Полибрена (Polybrene, 4 мг/мл; Aldrich). Одновременно Phoenix-E-клетки повторно инкубировали со свежей средой и через следующие 3 ч использовали для второго инфицирования Ratl-фибробластов в присутствии Polybrene (4 мг/мл; Aldrich). Аналогично этому осуществляли третий цикл инфицирования. После смены среды, начинали селекцию Ratl-клеток с использованием G418. Обычно стойкие клоны выбирали через селекционный период 21 день.
Панель стойких клонов размножили и подсчитали относительно экспрессии локализованного в мембране AXL человека с помощью FACS-анализа. Подробнее, 1×105 клетки собирали с 10 мМ EDTA в PBS, один раз промывали с помощью FACS-буфера (PBS, 13% FCS, 0,4% азид) и высеивали на 96-луночную планшету с круглым дном. Клетки прокручивали в течение 3 мин при 1000 rpm для удаления супернатанта и повторно суспендировали с мышиным анти-AXL первичным антителом МАВ154 (R&D Systems, 3 мкг/мл). Клеточные суспензии инкубировали во льду в течение 1 часа, промывали дважды FACS-буфером и ресуспендировали в 100 мкл/лунку РЕ-конъюгированном ослином антимышином вторичном антителе (Jackson), разведенном в соотношении 1:50 в FACS-буфере. Клеткочные суспензии инкубировали во льду и в темноте в течение 30 мин, дважды промывали FACS-буфером и анализировали, используя проточный цитометр Epics XL-MCL (Beckman Coulter).
Фигура 1 показывает FACS-анализ поликлональной популяции Ratl-Mock, стойко инфицированной пустым вирусом pLXSN, и Ratl-AXL cl.2, стойко инфицированной pLXSN-hAXL, и показывает AXL-сверхэкспрессию на клеточной поверхности этого his репрезентативного клона.
Дополнительно, для получения подходящей клеточной модельной системы в экспериментальных целях NIH3T3-фибробласты, стойко сверхэкспрессирующие AXL, получали аналогичным образом, как описано для Ratl. Вкратце, 3×105 Phoenix-E-клеток высеивали на 60 мм чашки Петри и трансфицировали 2 мкг/мл вектора pLXSN или pLXSN-AXL cDNA, используя метод кальций-фосфатного осаждения. Через 24 ч среду заменяли свежей средой, в которой Phoenix-E-клетки ингкубировали в течение 4 ч. Супернатанты Phoenix-E-клеток, высвобождающих pLXSN или pLXSN-hAXL экотропный вирус, собирали и использовали для инкубации субконфлюэнтных NIH3T3-клеток (2×105 клеток на 6 см чашки) в течение 3 ч в присутствии Полибрена (4 мг/мл; Aldrich). Одновременно Phoenix-E-клетки повторно инкубировали со свежей средой, которые через 3 ч использовали для вторичного инфицирования NIH3Т3-фибробластов в присутствии Полибрена (4 мг/мл; Aldrich). Аналогично этому выполняли третий цикл инфицирования. После смены среды начинали процесс селекции NIH3T3-клеток с использованием G418. Обычно стойкие клоны собирали через период селекции 21 день.
Панель стойких клонов размножили и подсчитали относительно экспрессии локализованного в мембране AXL человека с помощью FACS-анализа. Подробнее, 1×105 клетки собирали с 10 мМ EDTA в PBS, один раз промывали с помощью FACS-буфера (PBS, 13% FCS, 0,4% азид) и высеивали на 96-луночную планшету с круглым дном. Клетки прокручивали в течение 3 мин при 1000 rpm для удаления супернатанта и повторно суспендировали с мышиным анти-AXL первичным антителом МАВ154 (R&D Systems, 3 мкг/мл). Клеточные суспензии инкубировали во льду в течение 1 часа, промывали дважды FACS-буфером и ресуспендировали в 100 мкл/лунку РЕ-конъюгированном ослином антимышином вторичном антителе (Jackson), разведенном в соотношении 1:50 в FACS-буфере. Клеткочные суспензии инкубировали во льду и в темноте в течение 30 мин, дважды промывали FACS-буфером и анализировали, используя проточный цитометр Epics XL-MCL (Beckman Coulter).
Фигура 2 показывает FACS-анализ поликлональной NIH3T3-Mock-популяции, стойко инфицированной пустым вирусом pLXSN, и NIH3T3-AXL cl.7, стойко инфицированной pLXSN-hAXL, и показывает AXL-сверхэкспрессию на клеточной поверхности этого репрезентативного клона.
Пример 2. Получение крысиных моноклональных анти-AXL-антител
Моноклональные крысиные анти-AXL-антитела индуцировали путем введения примерно 10×106 замороженных клеток Ratl-AXL cl.2 обоими интраперитонеальным (и.п.) и подкожным путями крысам Lou/C или Long Evans. Через 8-недельный интервал делали конечную инъекцию и.п. и подкожно за 3 дня до слияния. Слияние миеломной клеточной линии Р3Х63- Ag8.653 с крысиными иммуннокомпетентными спленоцитами осуществляли в соответствии со стандартными методами и получили 105 гибридом. Через 2 недели первый супернатант от гибридом собирали и тестировали первичным FACS-скринингом относительно связывания с NIH3T3-AXL cl.7 фибробластами в отличие от NIH3T3-Mock контрольных клеток. Клоны, позитивные по AXL-связыванию, дополнительно культивировали. Из 50 мл супернатанта этих клонов антитела очищали и повторно анализировали на специфическое связывание с AXL в NIH3T3-AXL cl.7 фибробластах в отличие от NIH3T3-Mock контрольных клеток. Очищенные антитела, специфически связанные с NIH3T3-AXL cl.7 фибробластами, но не с NIH3T3-Mock контрольными клетками, дополнительно тестировали с помощью Akt-Киназа-фосфорилирование-ELISA и выполняли анализы ELISA для определения изотипа. Для очистки крысиных антител супернатанты прокручивали в течение 20 минут при 5000g и затем фильтровали в стерильных условиях. Добавляли 500 мкл белка G, конъюгированного с сефарозой FF, и инкубировали при 4°С в течение, по меньшей мере, 1 ч на вращающемся колесе. Сефарозу прокручивали, удаляли супернатант и матрикс из белка G дважды промывали PBS перед элюированием белка, используя цитратный буфер (100 мМ) рН 2,1. Элюированные фракции сразу повторно буферизировали до нейтрального рН путем добавления 1 М Tris pH 8,0 и проводили диализ против PBS.
Из протестированных олигоклональных антител 91 специфически соединялись с NIH3T3-AXL cl.7 фибробластами, но не с NIH3T3-Mock контрольными клетками, 9 ингибировали Gas6-индуцированное Akt-фосфорилирование в тех же клетках, тогда как 71 стимулировали Akt-фосфорилирование. Четыре антагонистических антитела (I11B7, I10D12, I6E7 и III11D5, в следующих примерах обозначенные как 11В7, 10D12, 6Е7 и 11D5 соответственно), два агонистических антитела (I11D7 и III2A1; в следующих примерах обозначенные как 11D7 и 2А1) и одно контрольное антитело (III1D5; в следующих примерах обозначенное как 1D5) были заморожены и субклонированы.
Пример 3. Крысиные анти-AXL-антитела изобретения не дают перекрестную реакцию с мышиной AXL или другими членами семейства AXL человека, Mer и Sky.
Этот пример рассматривает перекрестную реакцию крысиных анти-AXL-антител изобретения с AXL мышей и макак-крабоедов, а также с другими членами AXL-семейства человека, человеческими Mer и человеческими Sky. После субклонирования мышиной и обезьяньей AXL-кодирующей последовательности, а также человеческих Mer и Sky, в pcDNA3, каждую экспрессирующую конструкцию трансфицировали в НЕК293Т фибробласты. Способность крысиных анти-AXL-антител изобретения связывать эти белки была протестирована с помощью анализа FACS.
3А. Клонирование мышиных AXL
В настоящем исследовании была получена мышиная AXL-экспрессирующая конструкция pcDNA3-mAXL. Полноразмерная кодирующая последовательность мышиных AXL была амплифицирована с помощью полимеразной цепной реакции (PCR) с использованием мышиной сердечной кДНК (Ambion) в качестве темплата и соответствующих праймеров в соответствии с National Center for Biotechnology Information (NCBI) контрольной последовательностью (NM_009465) мышиных AXL. Полноразмерная последовательность, кодирующая мышиные AXL, была покрыта двумя перекрывающимися фрагментами PCR, 5'-фрагментом и 3'-фрагментом. Использовали следующие праймеры для амплификации этих фрагментов.
Прямой праймер MOUSE 1 для 5'-фрагмента, несущего последовательность распознавания EcoRl:
5'-GCGAATTCGCCACCATGGGCAGGGTCCCGCTGGCCTG-3'
Обратный праймер MOUSE 2 для 5'-фрагмента:
5'-CAGCCGAGGTATAGGCTGTCACAGACACAGTCAG-3'
Прямой праймер MOUSE 3 для 3'-фрагмента:
5'-GCACCCTGTTAGGGTACCGGCTGGCATATC-3'
Обратный праймер MOUSE 4 для 3'-фрагмента, несущего последовательность распознавания Notl:
5'-ATAAGAATGCGGCCGCTCAGGCTCCGTCCTCCTGCCCTG-3'
5'-фрагмент был расщеплен EcoRl и BstEII, 3'-фрагмента был расщеплен BstEII и NotI, и pcDNA3 был расщеплен EcoRI и NotI. Выполняли трехфакторное лидирование изолированных и очищенных фрагментов и их трансформировали в DH5α бактериальные клетки. Отбирали колонию клеток одной линии и выращивали в присутствии ампициллина. Используя коммерчески доступный набор для очистки плазмид (Qiagen), очищали мышиный AXL-экспрессирующий вектор pcDNA3-mAXL и проверяли последовательность для последующей транзиторной трансфекции в HEK293T-клетки.
3В. Клонирование AXL макак-крабоедов
В данном исследовании была получена экспрессирующая AXL макак-крабоедов конструкция pcDNA3-cyAXL. Полноразмерная кодирующая последовательность AXL макак-крабоедов была амплифицирована с помощью PCR, используя кДНК, полученную из ткани мозга макак-крабоедов в качестве матрицы. Поскольку нуклеотидная последовательность AXL макак-крабоедов не была доступна, то соответствующие праймеры были сконструированы, предполагая значительную гомологию с AXL человека. Полноразмерная последовательность, кодирующая AXL макак-крабоедов, была покрыта двумя перекрывающимися фрагментами PCR, 5'-фрагментом и 3'-фрагментом. Праймеры для амплификации этих фрагментов были следующие:
Прямой праймер CYNO1 для 5'-фрагмента, несущего последовательность распознавания EcoRl:
5'-CGGAATTCGCCACCATGGCGTGGCGGTGCCCCAG-3'
Обратный праймер CYNO2 для 5'-фрагмента:
5'-CTCTGACCTCGTGCAGATGGCAATCTTCATC-3'
Прямой праймер CYNO3 для 3'-фрагмента:
5'-GTGGCCGGTGCCTGTGTCCTCATC-3'
Обратный праймер CYNO4 для 3'-фрагмента, несущего последовательность распознавания Notl:
5'-ATAAGAATGCGGCCGCTCAGGCACCATCCTCCTGCCCTG-3'
5'-фрагмент был расщеплен EcoRl и Dralll, 3'-фрагмента был расщеплен Dralll и Notl, и pcDNA3 был расщеплен EcoRl и Notl. Выполняли трехфакторное лигирование изолированных и очищенных фрагментов и их трансформировали в DH5α бактериальные клетки. Отбирали колонию клеток одной линии и выращивали в присутствии ампициллина. Используя коммерчески доступный набор для очистки плазмид (Qiagen), очищали вектор pcDNA3-cyAXL, экспрессирующий AXL макак-крабоедов, и проверяли последовательность для последующей транзиторной трансфекции в HEK293T-клетки. Нуклеотидными и аминокислотными последовательностями макак-крабоедов являются следующие:
Нуклеотидная последовательность:


Аминокислотная последовательность:

3С. Блокирование Mer человека
В данном исследовании была получена конструкция pcDNA3-hMer, экспрессирующая Mer человека. Полноразмерная кодирующая последовательность Mer человека была получена посредством расщепления вектора pCMV6-XL4-Mer человека (Origene #ТС116132) посредством EcoRl и Xbal. После расщепления pcDNA3 теми же рестрикционными эндонуклезами оба фрагмента были лигированы с получением pcDNA3-hMer. Для введения консенсусной последовательности Козака 5'-участок кодирующей последовательности Mer человека в pcDNA3-hMer был амплифицирован с помощью PCR, используя соответствующие праймеры в соответствии с NCBI контрольной последовательностью (NM_006343) Mer человека. Праймеры для амплификации этого фрагмента были следующие:
Прямой праймер MER1, несущий последовательность распознавания EcoRl и консенсусную последовательность Козака:
5'-CGGAATTCGCCACCATGGGGCCGGCCCCGCTGCCGC-3'
Обратный праймер MER2 для 5'-фрагмента:
5'-TCGGCTGCCATTCTGGCCAACTTCC-3'
PCR-продукт и pcDNA3-hMer были расщеплены с помощью EcoRl и EcoRV и лигированы с получением pcDNA3-Kozak-hMer, в котором полноразмерная кодирующая последовательность Mer человека предшествовала консенсусной последовательности Козака.
Трансформировав в DH5α бактериальные клетки, брали колонию клеток одной линии и выращивали в присутствии амипициллина. Используя коммерчески доступный набор для очистки плазмид (Qiagen), очищали pcDNA3-Kozak-hMer экспрессирующий вектор и проверяли последовательность для последующей транзиторной трансфекции в HEK293T-клетки.
3D. Клонирование Sky человека
В данном исследовании была получена конструкция pcDNA3-hSky, экспрессирующая Sky человека. Полноразмерная кодирующая последовательность Sky человека была амплифицирована с помощью PCR, используя вектор pCMV6-XL4-Sky человека (Origene #MG1044_A02) в качестве матрицы и соответствующие праймеры в соответствии с NCBI контрольной последовательностью (NM_006293) Sky человека.
Праймерами для амплификации были следующие:
Прямой праймер SKY1, несущий последовательность распознавания EcoRl:
5'-CGGAATTCGCCACCATGGCGCTGAGGCGGAGC-3'
Обратный праймер SKY2, несущий последовательность распознавания Xhol:
5'-GCCCTCGAGCTAACAGCTACTGTGTGGCAGTAG-3'
Продукт PCR и pcDNA3 расщепляли с помощью EcoRl и Xhol и лигировали с получением экспрессирующего вектора pcDNA3-hSky. Трансформировав в DH5α бактериальные клетки, брали колонию клеток одной линии и выращивали в присутствии амипициллина. Используя коммерчески доступный набор для очистки плазмид (Qiagen), очищали экспрессирующий вектор pcDNA3-hSky и проверяли последовательность для последующей транзиторной трансфекции в HEK293T-клетки.
3Е. Трансфицирование и экспрессия AXL мышей, AXL макак-крабоедов, Mer человека и Sky человека
Для транзиторной экспрессии AXL мышей, AXL макак-крабоедов, Mer человека или Sky человека HEK293T клетки случайным образом трансфицировали либо пустым вектором pcDNA3, pcDNA3-hAXL, pcDNA3mAXL, pcDNA3-cyAXL, pcDNA3-hMer, либо pcDNA3-hSky, применяя метод кальций-фосфатного осаждения. Вкратце, до трансфекции 3×106 клеток HEK293T в 16 мл среды высеивали на 15 см слой клеток чашки Петри и выращивали при 7% CO2 и 37°С в течение 30 ч. 32 мкг ДНК соответствующей экспрессирующей конструкции или пустого вектора в 720 мкл дважды дистиллированной Н2О перемешивали с 2,5 М CaCl2 и 2xBBS (pH 6,96) и хранили при комнатной температуре в течение 10 мин. Растворы аккуратно добавляли к клеточным культурам и инкубировали при 3% CO2 и 37°С в течение 8 ч. Затем среду заменяли свежей питательной средой и клетки культивировали при 7% CO2 и 37°С в течение 24 ч.
3F. FACS-анализ для исследования крысиных анти-AXL-антител на перекрестную реакцию
Для FACS-анализа 2×105 клеток собирали вместе с10 мМ EDTA в PBS один раз промывали FACS-буфером (PBS, 3% FCS, 0,4% азид) и высеивали на 96-луночную планшету с круглым дном. Для удаления супернатанта планшеты прокручивали в течение 3 мин при 1000 rpm и клетки ресуспендировали в 10 мкг/мл изотипическом контрольном антителе 1D5, а также в растворах анти-AXL 11D5, 11В7, 10D12, 6Е7, 2А1, 11D7 и 12В7-первичных антител (100 мкл/лунку). После инкубации во льду в течение 1 ч клетки промывали дважды охлажденным FACS-буфером и ресуспендировали с РЕ-конъюгированным ослиным антикрысиным (Jackson) вторичным антителом, разведенным в соотношении 1:50 в FACS-буфере (100 мкл/лунку) или РЕ-конъюгированным ослиным антимышиным вторичным антителом для контроля. Защищая от света, клетки инкубировали во льду в течение 30 мин, дважды промывали FACS-буфером и анализировали, используя проточный цитометр Epics XL-MCL (Beckman Coulter).
Фигура 3 показывает репрезентативные результаты этого эксперимента. За исключением 12В7, который показывал среднюю перекрестную реактивность с AXL мышей, а также Mer и Sky человека ни один из других анти-AXL-антител изобретения не давал перекрестной реакции с этими молекулами. В отличие от этого все тестируемые крысиные анти-AXL-антитела изобретения давали перекрестную реакцию с AXL макак-крабоедов.
Пример 4. Крысиные анти-AXL-антитела изобретения ингибировали лиганд-индуцированное AXL-фосфорилирование in vitro
Выполняли ELISA эксперименты для изучения, способны ли крысиные анти-AXL-антитела изобретения блокировать активацию AXL, опосредованную лигандом Gas6. Gas6-опосредованную активацию. AXL обнаруживали за счет усиления фосфорилирования рецепторной тирозинкиназы. Вкратце, на 1 день 3×104 клеток на лунку высеивали в нормальную питательную среду в 96-луночные планшеты с круглым дном. На следующий день питательную среду заменяли бессывороточной средой и обедняли клетки с вечера в течение 24 ч. Также на ночь, черные 96-луночные планшеты MAXL-Sorp (Nunc) покрывали мышиным анти-фосфо-тирозин-антителом 4G10 при 2 мкг/мл PBS и 4°С. На 3 день раствор 4G10-антитела удаляли и лунки MAXL-Sorp блокировали PBS, 0,5% BSA в течение, по меньшей мере, 4 ч при комнатной температуре. Параллельно клетки предварительно инкубировали вместе с 10 мкг/мл мышиным контрольным антителом 72А1, а также крысиными анти-AXL-антителами 2А1, 11D7, 11D5, 11В7, 6Е7 и 10D12 в течение 1 ч при 37°С и затем обрабатывали или не обрабатывали 400 нг/мл Gas6 (R&D Systems) в течение 10 мин при 37°С. Среду затем выливали и клетки лизировали в лизирующем буфере (50 мМ HEPES, рН 7,5, 150 мМ NaCl, 1 мМ EDTA, 10% глицерин и 1% Triton X-100), дополненном ингибиторами фософтазы и протеазы (10 мМ Na4P2O7, 1 мМ фенилметилсульфонилфторида, 1 мМ ортованадата, 1 мМ NaF и 0,5% апротинина) в течение 30 мин во льду. При этом, перед тем как лизаты переносили и инкубировали всю ночь при 4°С, блокирующий буфер удаляли и планшеты MAXL-Sorp промывали 6 раз отмывочным буфером (PBS, 0,05% Tween 20). После того как планшеты промывали 6 раз отмывочным буфером на 4 день, лунки инкубировали с биотинилированным крысиным анти-AXL-антителом 12 В7 в 0,5 мкг/мл PBS в течение 2 ч при комнатной температуре. Планшеты промывали 6 раз отмывочным буфером и к каждой лунке добавляли АР-конъюгированный стрептавидин (Chemicon #SA110), разведенный в соотношении 1:4000 в PBS, и инкубировали в течение 30 мин при комнатной температуре. Затем лунки промывали 6 раз отмывочным буфером и добавляли субстратный раствор AttoPhos (Roche #11681982). Используя планшет-ридер Victor (Perkin Elmer), собирали сигнал флуоресценции от каждой лунки при длине волны возбуждения 430 нм и длине волны излучения 580 нм.
Фигура 4 представляет репрезентативные результаты этого эксперимента для фибробластов NIH3T3-AXL cl.7 (А) и NC1-Н292-клеток рака легких (В). Крысиные анти-AXL-антитела 11В7, 11D5, 6Е7 и 10D12 изобретения обеспечивали блокирование или снижение лиганд-опосредованной активации AXL, что показано ослаблением фосфорилирования, и они, тем самым, рассматривались как антагонистические анти-AXL-антитела. В отличие от этого крысиные анти-AXL-антитела 2А1 и 11D7 изобретения стимулировали базальную активацию AXL, что показано усилением фосфорилирования, при этом незначительно снижали лиганд-опосредованную активацию AXL и вследствие чего рассматривались как агонистические анти-AXL-антитела. Аналогичные действия с той же панелью антител наблюдались для клеточных линий рака легких CaLu-1 и CaLu-6, клеточных линий рака молочной железы Hs578T и MDA-MB-231, клеточной линии рака предстательной железы PC-3, клеточной линии рака поджелудочной железы PANC-1, клеточной линии меланомы С-8161, клеточных линий рака яичников SkOV-3 и SkOV-8, клеточной линии глиобластомы SF-126, клеточной линии рака шейки матки CaSki, a также клеточных линий рака желудка Hs746T и MKN-1.
Пример 5. Крысиные анти-AXL-антитела изобретения ингибировали лиганд-индуцированное фосфорилирование р42/р44 МАР-Киназа in vitro
Затем выполняли ELISA эксперименты для изучения, способны ли крысиные анти-AXL-антитела изобретения блокировать активацию р42/р44 МАР-Киназа, опосредованную лигандом Gas6. Gas6-опосредованную активацию р42/р44 МАР-Киназа обнаруживали посредством усиленного фосфорилирования белка (Thr202/Tyr204). Вкратце, на первый день 2×104 клеток на лунку высеивали в 96-луночные планшеты с круглым дном. На следующий день нормальную питательную среду заменяли бессывороточной средой для обеднения клеток на 36 ч. После этого клетки предварительно инкубировали вместе с 10 мкг/мл изотипическим контрольным антителом 1D5, а также с крысиными анти-AXL-антителами 11D5, 11В7 и 2А1 в течение 1 ч при 37°С и затем обрабатывали или не обрабатывали 400 нг/мл Gas6 (R&D Systems) в течение 10 мин при 37°С. Среду выливали и клетки фиксировали с 4% формальдегидом в PBS (рН 7,5) в течение 30 мин при комнатной температуре. Раствор формальдегида удаляли и клетки промывали дважды отмывочным буфером (PBS, 0,1% Tween 20). Клетки блокировали 1% H2O2, 0,1% NaN3 в отмывочном буфере и инкубировали в течение 20 мин при комнатной температуре. Затем блокирующий раствор удаляли и клетки промывали дважды отмывочным буфером и блокировали PBS, 0,5% BSA в течение 4 ч при 4°С. Добавляли анти-фосфо-р42/р44 MAP Киназа (Thr202/Tyr204) первичное антитело (поликлональное кроличье; Cell Signaling #9101), разведенное в соотношении 1:500 в PBS, 0,5% BSA, 5 мМ EDTA, оставляли на всю ночь при 4°С. На 4 день раствор антитела удаляли и планшету промывали 3 раза отмывочным раствором. Затем к каждой лунке добавляли HRP-конъюгированное антикроличье вторичное антитело (Dianova #111-036-045), разведенное в соотношении 1:2500 в PBS, 0,5% BSA, и инкубировали в течение 1,5 ч при комнатной температуре. Планшету промывали 3 раза отмывочным буфером и дважды PBS в течение 5 мин каждым. Добавляли тетраметилбензидин (ТМВ, Calbiochem) и измеряли при длине волны 620 нм. Реакцию останавливали добавлением 100 мкл 250 нМ HCl и измеряли оптическую плотность при длине волны 450 нм с опорной длиной волны 620 нм, используя планшет-ридер Vmax (Thermo Lab Systems).
Фигура 5 показывает репрезентативные результаты этого эксперимента для клеточной линии рака шейки матки CaSki. Крысиные анти-AXL-антитела 11В7 и 11D5 изобретения обеспечивали снижение лиганд-опосредованной активации р42/р44 МАР-Киназа, что показано ослаблением фосфорилирования, и вследствие чего рассматривались как антагонистические анти-AXL-антитела. В отличие от этого крысиное анти-AXL-антитело 2А1 изобретения стимулировало базальную активацию р42/р44 МАР-Киназа, что показано усилением фосфорилирования, при этом не снижало лиганд-опосредованной активации р42/р44 МАР-Киназа и вследствие чего рассматривалось как агонистическое анти-AXL-антитело. Аналогичные эффекты той же панели антител наблюдались в клеточной линии рака молочной железы Hs578T и клеточной линии рака легких NCI-H292.
Пример 6. Крысиные анти-AXL-антитела изобретения ингибировали лиганд-индуцированное Akt-фосфорилирование in vitro
Кроме того, выполняли ELISA-эксперименты для изучения, способны ли крысиные анти-AXL-антитела изобретения блокировать активацию Akt-Киназа, опосредованную лигандом Gas6. Gas6-опосредованную активацию Akt-Киназа определяли по усилению фосфорилирования белка (Ser473). Вкратце, на 1 день 2×104 клеток на лунку высеивали в 96-луночные планшеты с круглым дном. На следующий день нормальную питательную среду заменяли средой с низким содержанием сыворотки (DMEM, 0,5% FCS для фибробластов NIH3T3-AXL cl.7) или бессывороточной (для раковых клеточных линий) средой для обеднения клеток в течение 36 ч. После этого клетки предварительно инкубировали с 10 мкг/мл изотипическим контрольным антителом 1D5, а также крысиными анти-AXL-антителами 11D5, 11В7 и 2А1 в течение 1 ч при 37°С и затем обрабатывали или не обрабатывали 400 нг/мл Gas6 (R&D Systems) в течение 10 мин при 37°С. Среду выливали и клетки фиксировали 4% формальдегидом в PBS (рН 7,5) в течение 30 мин при комнатной температуре. Раствор формальдегида удаляли и клетки промывали дважды отмывочным буфером (PBS, 0,1% Tween 20). Клетки блокировали 1% H2O2, 0,1% NaN3 в отмывочном буфере и инкубировали в течение 20 мин при комнатной температуре. Затем блокирующий раствор удаляли и клетки промывали дважды отмывочным буфером и блокировали PBS, 0,5% BSA в течение 4 ч при 4°С. Добавляли анти-фосфо-Akt (Ser473) первичное антитело (поликлональное кроличье; Cell Signaling #9271), разведенное в соотношении 1:500 в PBS, 0,5% BSA, 5 мМ EDTA, и оставляли на всю ночь при 4°С. На 4 день раствор антитела удаляли и планшету промывали 3 раза отмывочным раствором. Затем к каждой лунке добавляли HRP-конъюгированное антикроличье вторичное антитело (Dianova #111-036-045), разведенное в соотношении 1:2,500 в PBS, 0,5% BSA, и инкубировали в течение 1,5 ч при комнатной температуре. Планшету промывали 3 раза отмывочным буфером и дважды PBS в течение 5 мин каждым. Добавляли тетраметилбензидин (ТМВ, Calbiochem) и измеряли при длине волны 620 нм. Реакцию останавливали добавлением 100 мкл 250 нМ HCl и измеряли оптическую плотность при длине волны 450 нм с опорной длиной волны 620 нм, используя планшет-ридер Vmax (Thermo Lab Systems).
Фигура 6 показывает репрезентативные результаты этого эксперимента для фибробластов NIH3T3-AXL cl.7 (А) и клеток рака легких CaLa-1 (В). Крысиные анти-AXL-антитела 11В7 и 11D5 изобретения обеспечивали блокирование или снижение лиганд-опосредованной активации Akt-Киназа, что показано ослаблением фосфорилирования, и вследствие чего рассматривались как антагонистические анти-AXL-антитела. В отличие от этого крысиное анти-AXL-антитело 2А1 изобретения стимулировало базальную активацию Akt-Киназа, что показано усилением фосфорилирования, при этом не снижало лиганд-опосредованной активации Akt-Киназа, и, вследствие чего, рассматривалось как агонистическое анти-AXL-антитело. Аналогичные эффекты с той же панелью антител наблюдались в клеточной линии рака легких NCI-H292, клеточных линиях рака молочной железы Hs578T и MDA-MB-231, клеточной линии рака предстательной железы РС-3, клеточной линии рака поджелудочной железы PANC-1, клеточной линии меланомы С-8161, клеточных линиях рака яичников SkOV-3 и SkOV-8, клеточной линии рака мочевого пузыря TCC-Sup, a также в клеточной линии фибросаркомы НТ1080.
Пример 7. Крысиные и химерные анти-AXL-антитела изобретения ингибировали лиганд-индуцированное Akt-фосфорилирование in vitro в сходной степени
Химерные производные крысиных анти-AXL-антител 11В7 и 11D5 были получены как часть данного изобретения (см. ниже). Для изучения, обеспечивают ли крысиные анти-AXL-антитела изобретения и соответствующие химерные анти-AXL-антитела изобретения блокирование лиганд Gas6-опосредованной активации Akt-Киназа в фибробластах NIH3T3-AXL cl.7 в сходной степени, проводили ELISA-эксперименты. Антитело-опосредованное ингибирование Akt-Киназа определяли по ослаблению фосфорилирования белка (Ser473). Вкратце, на 1 день 2×104 клеток на лунку высеивали в 96-луночные планшеты с круглым дном. На следующий день нормальную питательную среду заменяли средой с низким содержанием сыворотки (DMEM, 0,5% FCS) для обеднения клеток на 36 ч. После этого клетки предварительно инкубировали вместе с 50 нг/мл, 100 нг/мл, 300 нг/мл, 500 нг/мл и 1 мкг/мл крысиным анти-AXL-антителом 11В7 или химерным анти-AXL-антителом ch11B7, а также 50 нг/мл, 100 нг/мл, 300 нг/мл, 500 нг/мл, 1 мкг/мл, 5 мкг/мл и 10 мкг/мл крысиным анти-AXL-антителом 11D5 или химерным анти-AXL-антителом ch11D5 в течение 1 ч при 37°С и затем обрабатывали или не обрабатывали 400 нг/мл Gas6 (R&D Systems) в течение 10 мин при 37°С. Среду выливали и клетки фиксировали 4% формальдегидом в PBS (рН 7,5) в течение 30 мин при комнатной температуре. Раствор формальдегида удаляли и клетки промывали дважды отмывочным буфером (PBS, 0,1% Tween 20). Клетки блокировали 1% H2O2, 0,1% NaN3 отмывочным буфером и инкубировали в течение 20 мин при комнатной температуре. Затем блокирующий раствор удаляли и клетки дважды промывали отмывочным буфером и блокировали PBS, 0,5% BSA в течение 4 ч при 4°С. Добавляли анти-фосфо-Akt (Ser473) первичное антитело (поликлональное кроличье; Cell Signaling #9271), разведенное в соотношении 1:500 в PBS, 0,5% BSA, 5 мМ EDTA, на всю ночь при 4°С. На 4 день раствор антитела удаляли и планшету промывали 3 раза отмывочным раствором. Затем к каждой лунке добавляли HRP-конъюгированное антикроличье вторичное антитело (Dianova #111-036-045), разведенное в соотношении 1:2500 в PBS, 0,5% BSA и инкубировали в течение 1,5 ч при комнатной температуре. Планшету промывали 3 раза отмывочным буфером и дважды PBS в течение 5 мин каждым. Добавляли тетраметилбензидин (ТМВ, Calbiochem) и измеряли при длине волны 620 нм. Реакцию останавливали добавлением 100 мкл 250 нМ HCl и измеряли оптическую плотность при 450 нм с опорной длиной волны 620 нм, используя планшет-ридер Vmax (Thermo Lab Systems).
Фигура 7 демонстрирует, что крысиное анти-AXL-антитело 11В7 и химерное анти-AXL-антитело ch11B7 изобретения, а также крысиное анти-AXL-антитело 11D5 и химерное анти-AXL-антитело ch11D5 изобретения, обеспечивали ингибирование лиганд-опосредованной активации Akt-Киназа в сходной степени, что показано ослаблением фосфорилирования. Вследствие чего, по сравнению с их соответствующими крысиными вариантами, химерные анти-AXL-антитела ch11B7 и ch11D5 сохраняли активность.
Пример 8. Антагонистические крысиные анти-AXL-антитела изобретения конкурируют друг с другом за одинаковые или структурно связанные эпитопы и не разделяют сайты связывания с агонистическими крысиными анти-AXL-антителами изобретения
Анти-AXL-антитела изобретения были исследованы, конкурируют ли они друг с другом за одинаковые связывающие эпитопы на домене AXL-ECD. В связи с чем связывание биотинилированных анти-AXL-антител с покрытыми доменом AXL-ECD планшетами, предварительно инкубированными с анти-AXL-антителами, определяли в конкурентном ELISA. Вкратце, 30 мкг изотипического контрольного антитела 1D5, а также крысиных анти-AXL-антител 11В7, 11D5, 6Е7, 10D12, 11D7 и 2А1 биотинилировали с Sulfo-NHS-Biotin (Pierce #21217) в соответствии с инструкциями производителя и очищали, применяя колонки SSC Micro-BioSpin P6 (BIO-RAD #732-6200). На 1 день черные 96-луночные планшеты MAXL-Sorp (Nunc) покрывали 100 мкл/лунку 1 мкг/мл AXL-ECD человека (R&D Systems #154-AL) в PBS на всю ночь при 4°С. На 2 день покрытые планшеты MAXL-Sorp блокировали блокирующим буфером (PBS, 1% BSA, 0,05% TWEEN-20) в течение 2 ч при комнатной температуре (250 мкл/лунку) и затем инкубировали с PBS или небиотинилированным изотипическим контрольным антителом 1D5, а также небиотинилированными крысиными анти-AXL-антителами 11В7, 11D5, 6Е7, 10D12, 11D7 или 2А1 при 10 мкг/мл в блокирующем буфере (100 мкл/лунку) в течение 1 ч при комнатной температуре. Растворы антител выливали без промывания и добавляли 100 мкл/лунку PBS или биотинилированного изотопического контрольного антитела 1D5, а также биотинилированных крысиных анти-AXL-антител 11В7, 11D5, 6Е7, 10D12, 11D7 или 2А1 в концентрации 0,5 мкг/мл в блокирующем буфере и инкубировали в течение 15 мин при комнатной температуре. Через 6 промываний отмывочным буфером (PBS, 0,1% TWEEN-20), добавляли 80 мкл/лунку АР-конъюгированного стрептавидина (Chemicon #SA110), разведенного в соотношении 1:4000 в блокирующем буфере, инкубировали в течение 20 мин при комнатной температуре, снова промывали 6 раз отмывочным буфером и последний раз промывали PBS. Для обнаружения добавляли 100 мкл/лунку субстратного раствора Attophos (Roche # 11681982). Используя планшет-ридер Victor (Perkin Elmer), измеряли сигнал флуоресценции от каждой лунки при длине волны возбуждения 430 нм и длине волны излучения 580 нм.
Фигура 8 показывает репрезентативные результаты этого анализа. Антагонистические анти-АХЕ-антитела 11В7, 11D5, 6Е7 и 10D12 изобретения конкурируют друг с другом за одинаковые или структурно связанные эпитопы. Два агонистических антитела 11D7 и 2А1 изобретения распознают совершенно разные эпитопы и, следовательно, не являются несовместимыми. Кроме того, 11D7 и 2А1 не конкурируют с антагонистическими антителами за связывание с AXL-ECD. Контрольное антитело 1D5 не связывалось с AXL-ECD.
Пример 9. Крысиные и химерные анти-AXL-антитела изобретения ингибировали миграцию и пролиферацию клеток рака легких in vitro
Для изучения скорости миграции и пролиферации различных клеток и условий культивирования в течение многих лет выполняли анализы заживления ран/царапин in vitro. Эти анализы обычно включают выращивание монослоя конфлюэнтных клеток в первую очередь. Затем небольшой участок разрывают и группа клеток разрушается или смещается, что происходит путем процарапывания линии через слой, например, наконечником для пипетки. Открытый разрыв затем изучают под микроскопом в динамике по времени относительно того, как клетки заселяют и заполняют поврежденный участок ("заживление"). Вкратце, 1,5×106 NCI-H292 клеток рака легких высеивали на лунку 12-луночной чашки и культивировали в нормальной питательной среде (RPMI, 10% FCS). Через 8 ч клетки промывали PBS и обедняли в среде с низким содержанием сыворотки (RPMI, 0,5% FCS) всю ночь в течение 24 ч. Используя стерильные 200 мкл наконечники для пипетки, процарапывали через конфлюэнтные NCI-Н292-клеточные монослои три отдельные одинаковые раны на лунку. Клетки аккуратно промывали PBS и инкубировали со средой с низким содержанием сыворотки (RPMI, 0,5% FCS), не содержащей добавок, 10 мкг/мл изотипическим контрольным антителом 1D5, антагонистическими крысиными анти-AXL-антителами 11D5, 11В7, 6Е7 или 10D12, химерными анти-AXL-антителами chn11D5 lgG2 и chn11B7 lgG2, агонистическими крысиными анти-AXL-антителами 2А1 и 11D7, а также 10 мкг/мл Erbitux или 5 мкМ Sutent для сравнения. Оставляли на 24 ч для миграции клеток в свободные участки, один раз промывали PBS и фиксировали ледяным Метанолом (100%) при -20°С. Потом клетки окрашивали кристаллическим фиолетовым (0,5% в 20% Метанола), промывали водой и высушивали всю ночь, фотографировали раны.
Фигура 9 показывает репрезентативные результаты этого эксперимента для NCI-Н292-клеток рака легких. По сравнению с изотипическим контрольным антителом антагонистические крысиные анти-AXL-антитела 11D5, 11В7, 6Е7 и 10D12 изобретения, а также химерные анти-AXL-антитела chn11D5 lgG2 и chn11B7 lgG2 изобретения снижали вторичное заселение свободного участка, тогда как агонистические крысиные анти-AXL-антитела 2А1 и 11D7 изобретения приводили к полному закрытию раны. Аналогичные результаты с той же панелью антител наблюдали для клеточной линии рака яичников SkOv-3 или клеточной линии рака желудка MKN-1.
Пример 10. Крысиные анти-AXL-антитела изобретения ингибировали лиганд-индуцированную миграцию фибробластов NIH3T3-AXL cl.7 in vitro
Трансмиграционные эксперименты выполняли для изучения, блокируют ли антитела изобретения миграцию клеток. Для этого утром первого дня клетки NIH3T3-AXL cl.7 высеивали на 15 см чашки в нормальную питательную среду, которую вечером заменяли средой с низким содержанием сыворотки (DMEM, 0,5% FCS) для обеднения клеток на 36 ч. На следующий день 96-луночную планшету FluoroBlock (Becton Dickinson #351164, 8 мкм размер пор) покрывали 10 мкг коллагена 1/мл 0,1 М уксусной кислоты на всю ночь при 37°С. На день 3, среду с низким содержанием сыворотки (DMEM, 0,5% FCS) заменяли бессывороточной средой (DMEM, 0% FCS, 0,1% BSA) и оставляли на следующие 4 ч. Клетки собирали с 10 мМ EDTA вPBS и предварительно инкубировали вместе с крысиными анти-AXL-антителами 4А6, 11В7 или 2А1 при плотности клеток 4×105 клеток/мл и концентрации антител 10 мкг/мл в течение 45 мин. 50 мкл клеточной суспензии (20000 клеток) на лунку затем помещали в верхнюю камеру 96-луночной планшеты FluoroBlock, при этом использовали 225 мкл среды (DMEM1 0%FCS, 0,1%BSA) с или без 400 нг/мл мышиного Gas6 (R&D Systems) на лунку в нижней камере. Клетки оставляли для миграции на 7 ч при 37°С и затем окрашивали 4,2 мкМ Кальцеин-АМ (Molecular Probes #С3099) в PBS, 1 мМ CaCl2, 1 мМ MgCl2 в течение 1 ч при 37°С. Используя планшет-ридер Victor (Perkin Elmer), флуоресценцию каждой лунки измеряли при длине волны 530 нм.
Фигура 10 показывает, что антагонистическое анти-AXL-антитело 11В7 изобретения снижало обе, базальную и Gas6-индуцированную, миграции фибробластов NIH3T3-AXL cl.7, тогда как агонистическое крысиное анти-AXL-антитело 2А1 изобретения усиливало лиганд-индуцированную и, в особенности, базальную миграцию клеток NIH3T3-AXL с1.7. Антитело 4А6 не оказывало никакого действия на миграцию клеток.
Пример 11. Крысиные анти-AXL-антитела изобретения ингибировали лиганд-индуцированную пролиферацию фибробластов NIH3T3-AXL с1.7 in vitro
In vitro эксперименты выполняли для определения способности крысиных анти-AXL-антител изобретения ингибировать Gas6-индуцированную клеточную пролиферацию. Для этого 2500 фибробластов NIH3T3-AXL cl.7 на лунку высеивали в FCS-содержащую среду на 96-луночные планшеты на всю ночь. На следующий день клетки обедняли в среде с низким содержанием сыворотки (DMEM, 0,5% FCS) в течение 10 ч и затем предварительно инкубировали вместе с 20 мкг/мл мышиным контрольным антителом 72А1, антагонистическими крысиными анти-AXL-антителами 11D5 и 11В7, а также агонистическим антителом 2А1 в DMEM, 0,5% FCS в течение 1 ч при 37°С. Клетки обрабатывали или не обрабатывали 400 нг/мл мышиным Gas6 (R&D Systems) путем добавления лиганда непосредственно к раствору антитела и там их оставляли для роста на 96 ч. Добавляли AlamarBlue™ (BIOSOURCE #DAL1100) и инкубировали при 37°С в темноте. Оптическую плотность измеряли при 590 нм каждые 30 мин. Данные собирали через 4 ч после добавления AlamarBlue™.
Фигура 11 показывает репрезентативные результаты этого эксперимента. Антагонистические анти-AXL-антитела 11D5 и 11В7 изобретения блокировали Gas6-индуцированную пролиферацию фибробластов NIH3T3-AXL с1.7, тогда как агонистическое крысиное анти-AXL-антитело 2А1 изобретения усиливало лиганд-индуцированную и, в особенности, базальную пролиферацию клеток NIH3T3-AXL cl.7.
Пример 12. Крысиные анти-AXL-антитела изобретения ингибировали лиганд-опосредованный антиапоптоз бессывороточных фибробластов NIH3T3-AXL cl.7 in vitro
Запуск апоптоза и активация каспазы могут произойти вследствие разных стимулов, включая отказ факторов роста, воздействие химиотерапевтических агентов или радиации или запуск процесса клеточной гибели, опосредованного рецепторами Fas/Apo-1. Показано, что взаимодействие Gas6-AXL вовлечено в процесс защиты разных типов клеток от апоптоза, включая бессывороточные фибробласты NIH3T3 (Goruppi et al., 1996, Oncogene 12, 471-480) или легочные эндотелиоциты (Healy et al., 2001, Am. J. Physiol., 280, 1273-1281). В данном примере мы изучали, оказывают ли крысиные анти-AXL-антитела изобретения влияние на Gas6-опосредованный антиапоптоз бессывороточных NIH3T3-AXL cl-7-фибробластов и вследствие чего индуцируют ли апоптоз. Степень апоптоза определяли измерением активности каспазы-3/7 в клетках. Для этого NIH3T3-AXL cl.7 клетки высеивали с плотностью 1,5×103 клеток на лунку в черные 96-луночные планшеты с круглым дном (100 мкл/лунку). Через день нормальную питательную среду заменяли средой с низким содержанием сыворотки (DMEM, 0,5% FCS) для обеднения клеток на всю ночь в течение 24 ч. На следующий день приготавливали растворы изотипического контрольного антитела 1D5, антагонистических крысиных анти-AXL-антител 11В7 и 11D5, а также агонистических крысиных анти-AXL-антител 11D7 и 2А1 при 80 мкг/мл в DMEM, 0% FCS, 0,01% BSA. Клетки промывали PBS, накрывали 60 мкл DMEM, 0% FCS, 0,01% BSA и добавляли 10 мкл соответствующего раствора антител. Через 1 ч инкубации при 37°С, добавляли 10 мкл DMEM, 0% FCS, 0,01% BSA с или без 3,2 мкг/мл мышиным Gas6 (R&D Systems) (конечные концентрации антитела и Gas6 составляли 10 мкг/мл и 400 нг/мл соответственно) и клетки инкубировали при 37°С в течение следующих 5 ч. Следующие стадии относятся к техническому бюллетеню для анализа Apo-ONE Homogenwous Caspase-3/7 (Promega, G7791). Вкратце, культуральные планшеты вынимали из инкубатора и обедняли при комнатной температуре в течение 20 мин. Размораживали 60 мкл субстрата Apo-ONE и 6 мл буфера, смешивали и добавляли к образцам (75 мкл/лунку). Содержимое лунок аккуратно встряхивали в течение 30 сек и, защищая от света, инкубировали при комнатной температуре в течение 1 ч. Используя планшет-ридер Victor (Perkin Elmer), измеряли флуоресценцию каждой лунки при длине волны возбуждения 485 нм и длине волны излучения 530 нм.
Фигура 12 показывает репрезентативные результаты этого эксперимента. По сравнению с изотипическим контрольным антителом антагонистические крысиные анти-AXL-антитела 11В7 и 11D5 изобретения снижали Gas6-опосредованный антиапоптоз бессывороточных NIH3T3-AXL cl.7 фибробластов и вследствие чего индуцировали апоптоз. В отличие от этого агонистические крысиные анти-AXL-антитела 2А1 и 11D7 изобретения строго индуцировали антиапоптоз бессывороточных NIH3T3-AXL cl.7 клеток независимо от отсутствия или присутствия Gas6 и тем самым ингибировали апоптоз.
Пример 13. Крысиные анти-AXL-антитела изобретения ингибировали ангиогенез клеток, основанный на образовании сфероидов, in vitro
AXL является ключевым регулятором многочисленных ангиогенных процессов, включая эндотелиальную миграцию клеток, пролиферацию и образование трубочек in vitro (Holland et al., Cancer Res: 65, 9294-9303, 2005). Вследствие чего крысиные анти-AXL моноклональные антитела 11В7 и 11D5 изобретения тестировали относительно ингибирующего действия на VEGF-A-индуцированный сосудистый спрутинг (разрастание) HUVEC-сфероидов. Эксперименты были выполнены с модификацией первоначально опубликованного протокола (Korff and 08.in: J Cell Sci 112:3249-58, 1999). Вкратце, сфероиды получали, как описано (Korff and 08.in: J Cell Biol 143:1341-52, 1998), путем пипетирования 500 эндотелиальных клеток пупочной вены человека (HUVEC) в висячей капле на пластиковые чашки и оставляли на всю ночь для агрегации сфероидов. 50 HUVEC-сфероидов, затем высеивали в 0,9 мл коллагенового раствора (2 мг/мл) и пипетировали в отдельные лунки 24-луночной планшеты для полимеризации. Уменьшая концентрации, крысиные анти-AXL-антитела 11В7 и 11D5 (1×10-6 М, 1×10-7 М, 1×10-8 М, 1×10-9 М, 1×10-10 М) смешивали непосредственно в растворе коллагена пред полимеризацией, тогда как фактор роста VEGF-A (итоговая концентрация 25 нг/мл) добавляли через 30 мин путем пипетирования 100 мкл 10-кратно концентрированного рабочего раствора сверху полимеризованного геля. Планшеты инкубировали при 37°С в течение 24 часов и фиксировали путем добавления 4% параформальдегида. Интенсивность спрутинга HUVEC-сфероидов определяли с помощью системы анализа изображений, которая определяет суммарную длину «отростков» на сфероид, используя инвертированный микроскоп и программное обеспечение для цифрового изображения Analysis 3.2 (Soft imaging system, Munster, Germany). Анализировали среднюю суммарную длину «отростков» из 10 случайно выбранных сфероидов в качестве индивидуальной точки отсчета.
Фигура 13 показывает результаты этого эксперимента. Антагонистические крысиные анти-AXL-антитела 11В7 (А) и 1D5 (В) изобретения ингибировали VEGF-A-стимулированный HUVEC-спрутинг в анализе ангиогенеза, основанном на сфероидах, в зависимости от дозы. Тогда как обработка более высокими концентрациями 11В7 снижала HUVEC-спрутинг до базальных уровней, ингибирование с более высокими концентрациями 11D5 было неэффективным (левая панель). HUVEC-спрутинг был ингибирован при значениях IC50 9,8×10-8 М и 7,0×10-7 М для 11В7 и 11D5 соответственно (правая панель).
Пример 14. Крысиные анти-AXL-антитела изобретения снижали рост карциномы простаты человека у бестимусных мышей
Антиопухолевая эффективность терапевтических антител часто оценивается в исследованиях на ксенотрансплантатах опухолей человека. В этих экспериментальных моделях опухоли человека растут как ксенотрансплантаты у мышей с иммунной недостаточностью и терапевтическую эффективность измеряют по степени ингибирования роста опухоли. Цель этого исследования заключалась в оценке, препятствуют ли антагонистическое крысиное анти-AXL-антитело 11В7 изобретения опухолевому росту клеток рака предстательной железы человека у бестимусных мышей. Вкратце, на 0 день 7-8 недельных мышей-самцов NMRI-nu/nu (приблизительный вес: 30 г после акклиматизации) анестезировали с 1,5-2,0 об.% изофлураном при скорости расхода кислорода 2 л/мин и 1×106 РС-3-LN-клеток в 25 мкл PBS ортотопически имплантировали в простату. РС-3-LN-клетки получали из клеточной линии карциномы простаты РС-3, которую инфицировали ретровирусом, кодируемым слитым белком люцифераза-неомицин. Начало опухолевого роста и прогрессирования опухолевого роста измеряли посредством биолюминесцентного отображения in vivo. Для этого люциферин инъецировали интраперитонеально (и.п.) в мышей и оптическое излучение измеряли через 10 минут после инъецирования на системе биолюминесцентного отображения NightOWL LB 981 (Berthold Technologies, Germany). Перед первой обработкой мышей рандомизировали и выполняли статистические тесты для обеспечения единообразия начальных опухолевых параметров (вероятное, среднее и стандартное отклонение) среди групп, состоящих из 10 животных каждая. На день 8 начинали все обработки и продолжали до 34 дня с последующей некропсией на 35 день. 25 мг/кг изотипического контрольного антитела 1D5 и антагонистического крысиного анти-AXL-антитела 11В7 вводили животным из групп 1 и 2 интраперитонеально (и.п.) 3 раза в неделю (Пон, Ср, Пят) соответственно. Животные из группы 3 перорально (п.о.) получали 40 мг/кг Sutent один раз в день. Животные из группы 4 получали три внутривенные (в.в.) инъекции 12,5 мг/кг Taxotere в течение 4 дней независимо друг от друга. Обзор групп обработки представлен ниже.
Фигура 14 показывает результаты этого эксперимента. По сравнению с изотипическим контрольным антителом 1D5 антагонистическое крысиное анти-AXL-антитело 11В7 изобретения снижало всеобщий рост опухолей простаты PC-3-LN у бестимусных мышей.
Пример 15. Крысиные анти-AXL-антитела изобретения ингибировали метастазирование карциномы простаты человека
В аналогичном эксперименте, который описан под названием "Крысиные анти-AXL-антитела изобретения снижали рост карциномы простаты человека у бестимусных мышей", перемещение опухолевых клеток PC-3-LN в другие органы (метастазирование) анализировали после аутопсии для оценки антиметастатических эффектов крысиного анти-AXL-антитела 11В7 изобретения. Для этого выбранные органы (печень, селезенка, легкие, бедренная часть, часть люмбарного отдела позвоночника) после аутопсии извлекали, гомогенизировали и добавляли люциферин. Затем измеряли оптическое излучение, используя биолюминесцентную систему NightOWL LB 981 (Berthold Technologies, Germany).
Фигура 15 показывает результаты этого эксперимента для анализа селезенок. По сравнению с изотипическим контрольным антителом 1D5 антагонистическое крысиное анти-AXL-антитело 11В7 изобретения снижало возникновение метастазов селезенки. Примечательно, антиметастатический эффект 11В7 в этом эксперименте был сильнее, чем от применения Sutent. Аналогичные наблюдения были получены для метастазов печени, легких и люмбарного отдела позвоночника.
Пример 16. AXL экспрессируется преимущественно в опухоли, чем в прилегающей нормальной ткани
В этом исследовании AXL, экспрессирующуюся в 17 различных злокачественных опухолях человека, иммуногистохимически анализировали в фиксированнной в формалине и залитой в парафин ткани в формате тканевой микропанели. Для каждого типа опухоли исследовали пары опухолевая ткань и соответствующая незлокачественная ткань. Вкратце, ткань фиксировали на 16-20 ч в 4% буферном формалине и заливали в парафин. Для конструирования 60-ядерной тканевой матрицы (ТМА), патологоанатом выбирал один массив здоровой ткани и один массив соответствующей опухолевой ткани. 96-ядерная ТМА с массивов нормальных контрольных тканей (три от каждого типа ткани) была получена в соответствии с рекомендациями FDA. Каждый массив составлял 1,5 мм в диаметре.
С помощью микротома делали 2-4 мкм срезы блоков выбранных тканей, закрепляли на силанизированных предметных стеклах (Sigma) и высушивали при 60°С в течение 30 мин и при 38°С в течение ночи. Срезы депарафинизировали путем инкубации в ксилоловой бане в течение 5 мин дважды, в ацетоновой в течение 5 мин дважды и в итоге в дистиллированной воде в течение 5 мин. Предварительное нагревание срезов осуществляли в 10 мМ цитратном буфере, рН 6,0, в паровой камере в течение 30 мин с последующим промыванием в дистиллированной воде. Эндогенную пероксидазу блокировали путем инкубации со свежеприготовленным раствором 0,3% H2O2 в метаноле в течение 20 мин при комнатной температуре с последующим промыванием дистиллированной водой и PBS в течение 5 мин каждым. Срезы инкубировали с поликлональным козлиным античеловеческим AXL-антителом (Santa Cruz SC-1096) в течение 60 мин (1:20 разведение в TBST) при комнатной температуре. Через три промывания в TBST срезы инкубировали с биотинилированным кроличьим антикозлиным вторичным антителом (Dianova, 1:200 разведение в TBST) в течение 45 мин при комнатной температуре. После промывания, как и ранее, срезы инкубировали с стрептавидин/HRP (DAKO, 1:300 разведение в TBST) в течение 30 мин при комнатной температуре с последующим промыванием, как и ранее. Окрашивание выполняли с помощью раствором DAB (DAKO; 1:50 разведение в субстратном буфере) в течение 10 мин при комнатной температуре. В итоге стекла промывали водой, докрашивали гематокислином Харриса и накрывали предметным стеклом. Контрольные срезы инкубировали с козлиным IgG-контрольным антителом (R&D) вместо анти-AXL первичного антитела.
Фигура 16 объединяет результаты этого анализа относительно экспрессии AXL в 17 различных солидных опухолях человека и в соответствующих незлокачественных тканях (А). Среди всех обследованных случаев для каждого измерения не обнаружили значимой экспрессии в фолликулярной лимфоме, раке предстательной железы (исключая единичные клетки) и в раке почки. Меланома и опухоль клеток Меркеля показали очень низкую экспрессию AXL. Слабая экспрессия наблюдалась в некоторых опухолях легких, главным образом аденокарциномах. Опухоли пищевода и Берета, опухоли яичников, толстой кишки и поджелудочной железы, а также опухоли печени (гепатоцеллюлярная карцинома) показали слабое окрашивание в около 30% случаев. Опухоли головы и шеи показали от слабого до среднего окрашивания в 40% опухолей. От слабого до среднего окрашивания обнаружили в от 60% до 100% анализируемых опухолях молочной железы, шейки матки, мочевого пузыря, щитовидной железы и желудка. Наиболее интенсивное окрашивание наблюдали в опухолях молочной железы и в перстневидно-клеточном раке желудка (В). Незлокачественные ткани не показали специфичного окрашивания, исключая почечные канальцы, которые в некоторых случаях показывали слабое окрашивание на общем фоне.
Пример 17: Структура и характеристики анти-AXL-антител
17А. Нуклеотидные последовательности константных доменов крысиного антитела
Константные домены крысиного анти-AXL-антитела клонировали из гибридомных клеток. РНК получали, применяя набор для экстрагирования РНК RNeasy (RNeasy midi-kit, Qiagen). кДНК, кодирующая гены антител, была приготовлена с использованием набора 5'RACE (Invitrogen) в соответствии с инструкциями производителя.
Коротко, первая цепь кДНК была синтезирована из общей или РНК, используя ген-специфические GSP1-праймеры и обратную транскриптазу Superscript™ II. После синтеза первой цепи кДНК исходную матрицу мРНК удаляли путем обработки с помощью RNase Mix. Затем к 3'-концу кДНК добавляли гомополимерный "хвост". PCR-амплификацию осуществляли, используя ДНК-полимеразу Taq, вложенный, ген-специфический праймер (GSP2), который соединяется с сайтом, расположенным в молекуле кДНК, и якорный праймер, содержащийся в наборе. Вслед за амплификацией клонировали продукты 5' RACE в вектор pLXSN-ESK для секвенирования. Для облегчения клонирования Якорный Праймер (АР) включал распознающую последовательность для Sal I, GSP2-праймеры содержали сайт Xhol.
GSP1 праймер:
kappa_GSP1: GATGGATGCATTGGTGCAGC
new_kappa_GSP1: ATAGATACAGTTGGTGCAGC
heavy_GSP1: CAGGGTCACCATGGAGTTA
GSP2 праймер:
Xhol-hGSP2: CCGCTCGAGCGGGCCAGTGGATAGACAGATGG
Xhol-kGSP2: CCGCTCGAGCGGCCGTTTCAGCTCCAGCTTGG
Применение GSP-праймеров для клонирования крысиных анти-AXL Mab:
11В7: kappa GSP1; Xhol-kGSP2
heavy GSP1; Xhol-hGSP2
10D12: kappa_GSP1, new_kappa_GSP1; Xhol-kGSP2
heavy GSP1; Xhol-hGSP2
11D5: new_kappa_GSP1; Xhol-kGSP2
heavy GSP1; Xhol-hGSP2
17В. Аминокислотная последовательность константных доменов крысиного анти-AXL-антитела
Последовательности константных доменов крысиного анти-AXL-антитела были транслированы из секвенированных генов, клонированных в векторы pLXSN-ESK. Данные аминокислотные последовательности начинались в положении одного из константного домена. Определяющие комплементарность участки (CDR), требуемые для специфического связывания антитела с его мишенью, определяли в соответствии с Kabat (Kabat et al. Sequences of Proteins of Immunological Interest, Fifth Edition. NIH Publication No. 91-3242, 1991). Kabat-определение основано на изменчивости последовательностей в константных доменах. Анти-AXL специфичные CDR-участки антител перечислены в SEQ ID NO:13-30. Конкретные CDR включают следующие положения:
CDR-L1: 24-34
CDR-L2: 50-56
CDR-L3: 89-97
CDR-H1:31-35b
CDR-H2: 50-65
CDR-H3: 95-102
17С. Экспрессия и очистка крысиных антител:
Гибридомы культивировали в биореакторах Celline CL 1000 (Integra Biosciences) при 37°C, 5-7% СО2, используя среду DMEM, включающую 4,5 г/л глюкозы; 1% глутамина, 1% пируват, 1% Pen/Strep. FCS-добавка составила 1% FCS для питательной камеры и 5% FCS IgG для клеточной камеры. Сбор и замену среды осуществляли дважды в неделю. Расщепление клеток 1/1->1/3 в зависимости от клеточного роста. Продуктивность тестировали один раз в день посредством анализа электрофореза в полиакриламидном геле (SDS-PAGE). Супернатанты замораживали при -20°С до очистки. Тест на микоплазму распространяющихся культур проводили один раз в неделю.
Антитела очищали, используя Белок А или G Сефарозу FF (GE-Healthcare), с помощью системы Akta Explorer 100 (GE-Healthcare). Колонки по отдельности упаковывали для каждого процесса очистки. Размер колонки регулировали под ожидаемый выход продукта и размер каждой партии (обычно 50-500 мг). Содержащие белки растворы хранили во льду или при 4°С по возможности. Стерильные буферы и дважды дистиллированную воду использовали для полного процесса.
Супернатанты размораживали, буферизовали с 50 мМ TRIS рН 8,5, центрифугировали, фильтровали через 0,22 мкм мембрану и загружали в колонку. После промывания с 8 объемами колонки (CV) 50 мМ PO4, рН 8,5, антитело элюировали в 10 CV 100 мМ Глицина, рН 3,3. Фракции элюатов ребуферизировали непосредственно до нейтрального рН путем добавления 1/5 1М Tris рН 8,0 (1 мл Tris на 4 мл фракции элюата) и затем анализировали с использованием rSDS-PAG. Фракции, содержащие чистое антитело, объединяли, проводили диализ против PBS при 4°С и стерильно фильтровали.
Условия буферной системы настраивали в соответствии с индивидуальными свойствами каждого антител. В частности, антитело 11D5 RatlgG2a связывали с матриксом ProteinG 4 FF (GE-Healthcare) и промывали в высокосолевых условиях (2М NaCI). Крысиное антитело IgG1 11B7 очищали посредством rProteinA (GE-Healthcare) в высокосолевых условиях согласно 11D5. Элюцию антитела осуществляли при рН 5,5. Скорость потока очистки крысиного антитела удерживали на низком уровне для усиления эффективности связывания.
В качестве второй стадии очистки можно выполнять либо ионообменную хроматографию (при индивидуальных, подходящих условиях), либо гель-хроматографию.
Стандартный протокол для контроля качества очищенных антител включает:
- анализ rSDS-PAGE гелей; Окрашивание кумаси или серебром
- ВСА-тест (Pierce #23227 - набор реактивов ВСА для анализа на белок; образец крысиного IgG #31233)
- Аналитическая гель-хроматография (Superdex 200 Tricom 10/300 GL, ~250 мг в 250 мкл; 0,5 мл/мин, Akta Explorer 100)
- Эндотоксиновый тест (LAL, Cambrex QCL-1000® хромогенный анализ LAL # US50-648U)
- Анализы клеточной активности (FACS-связывание; pAkt; pAXL)
Очищенные антитела хранили в PBS, рН 7,4 в стерильных условиях при 4°С или -20°С в зависимости от их стабильности.
17D. Определение аффинности антител с помощью Scatchard-анализа FACS
NIH3T3-клетки, сверхэкспрессирующие AXL человека, собирали путем инкубации с 10 мМ EDTA в PBS и ресуспендировали в количестве 6 миллион клеток на мл в FACS-буфере (PBS рН 7,4, 3% FCS, 0,1% NaN3), в микротитровальной планшете с круглым дном, добавляли 100 мкл клеточной суспензии к 100 мкл раствора антител, содержащему антитела 11В7, 11D5, ch11B7-lgG2 или ch11D5-lgG2 в концентрациях между 40 и 0,002 мкг/мл (266 и 0,01 нМ) в FACS-буфере. Связывание антител протекало 2 часа во льду. Затем клетки промывали дважды с использованием 250 мкл FACS-буфера на лунку и ресуспендировали в 200 мкл вторичного антитела (анти-крысиное-РЕ; Jackson), разведенного в соотношении 1:50 в FACS-буфере. Через 45 минут инкубации клетки снова дважды промывали в FACS-буфере и ресуспендировали в 500 мл PBS для FACS-анализа. Анализ проводили на Beckman-Coulter FACS FC500. Для определения константы кажущегося сродства KDapp значение средней флуоресценции наносили против соотношения средней флуоресценции и концентрации соответствующего антитела ([М]). Рассчитанные KDapp, полученные из обратного угла наклона прямой линии, приведены ниже:
18. Химеризация крысиных анти-AXL-антител:
Человеческие гены легкой каппа-цепи и тяжелой цепи lgG1/2 клонировали из мононуклеарных клеток периферической крови (РВМС) добровольцев, как описывается ниже:
РВМС приготавливали из цельной крови. Кровь разводили в соотношении 1/2,5 в PBS/2 мМ EDTA с 10 Ед./мл гепарина при RT, наложенном над 15 мл раствора Biocoll, покрытого диафрагмой (35 мл/пробирку) [Biocoll от Biochrom # L6115]. Образцы центрифугировали при RT в течение 30 мин при 400 g и сыворотку сливали (-15 мл). Поверхность раздела фаз, содержащую РВМС, аккуратно извлекали, используя пипетку Пастера. РВМС промывали дважды в PBS/2 мМ EDTA (первая промывка 100 мл, вторая промывка 50 мл) и прокручивали при 300 g в течение 10 мин. Клеточную пеллету ресуспендировали в RPMI/10% FCS (25 мл) и получали 5,5×107 РВМС.
РНК приготавливали из РВМС, используя набор RNeasy от Qiagen (# 75142) в соответствии с инструкциями производителя. Очищенную РНК (30 мкг) замораживали по аликвотам при -80°С.
кДНК для антител класса IgG-гамма 1 и 2, а также каппа-цепей приготавливали из изолированной РНК с помощью RT-PCR, используя обратную транскриптазу Superskript III (invitrogen # 18080-93) в соответствии с инструкциями производителя, используя следующие праймеры:
1) RT-гамма: GCGTGTAGTGGTTGTGCAGAG
2) RT-гамма2: GGGCTTGCCGGCCGTG
3) RT-каппа: TGGAACTGAGGAGCAGGTGG
4) 5'BIp: AGATAAGCTTTGCTCAGCGTCCACCAAGGGCCCATCGGT
5) 3'Bam(GAG): AGATGGATCCTCATTTACCCGGAGACAGGGAGAG
6) 5'Bsi: AGATAAGCTTCGTACGGTGGCTGCACCATCTGTCTTCAT
7) 3'Bam(CTT): AGATGGATCCCTAACACTCTCCCCTGTTGAAGCTCT
Праймеры растворяли при 100 мкМ. Реакции RT-PCR выполняли, используя 2 пмоль олиго RTγ и PTK соответственно, добавляя 1 мкг РНК, смешивали с 10 мМ dNTP и нагревали в течение 5 мин до 65°С. Добавляли 4 мкл буфера для синтеза первой цепи, 1 мкл 0,1 М DTT, 1 мкл ингибитора RNase (40 Ед./мкл Fermentas # E00311) и 2 мкл Superscript III RT, перемешивали и инкубировали при 50°С в течение 1 ч с последующим этапом тепловой инактивации в течение 15 мин при 70°С.
2 мкл буфера для синтеза первой цепи использовали для проведения второй стадии PCR, используя Taq-полимеразу (Eurochrom # EME010001) с получением двухцепочечной ДНК константных доменов антител. Праймер 5'BIp и 3'Bam(GAG) использовали для амплификации γ-цепи и 5'Bsi и 3'Bam(СТТ) использовали для амплификации константных участков κ-цепи, используя следующие настройки PCR:
Амплификация κ-цепи:
94°С 120 сек
94°С 30 сек
55°С 30 сек
72°С 45 сек цикл 35 раз
72°С 10 мин
Амплификация γ-цепи:
94°С 120 сек
94°С 30 сек
45°С 30 сек
72°С 60 сек цикл 5 раз
94°с 30 сек
50°С 30 сек
72°С 60 сек цикл 35 раз
72°С 10 мин
Продукты PCR анализировали на ТАЕ-буферизированном 2% агарозном геле. Обнаружили единичную полосу ~350 п.н. для легкой каппа-цепи и единичную полосу ~1000 п.н. для тяжелых цепей γ1 и γ2. Продукты PCR очищали с помощью набора для экстракции из геля Qiagen (QIAGEN1 #28784) в соответствии с инструкциями производителя. Для клонирования PCR-фрагментов во множественные сайты клонирования вектора NA3 (Invitrogen), pcDNA3-вектор и PCR-фрагменты расщепляли с помощью рестрикционных эндонуклеаз HindIII (5') и BamHI (3'). Рестрикционные сайты кодировали PCR-праймерами. Расщепленные фрагменты очищали, используя набор для очистки продуктов PCR Qiagen (QIAGEN, 28104), и ДНК, кодирующую γ1, γ2 и κ-цепи, лигировали в вектор pcDNA3, облегчая Т4 ДНК-лигазу, при 16°С DNA в течение всей ночи. Лигазу инактивировали в течение 10 мин при 65°С. Лигированные ДНК-плазмиды сразу же трансформировали в CaCl2-компетентные клетки E.coli, используя стандартный протокол, и наносили на содержащие ампициллин LB-планшеты. После инкубации при 37°С в течение ночи отбирали единичные колонии, суспендировали в 10 мкл Н2О и защищали от наличия соответствующей плазмиды, несущей цепи антитела, с помощью проведения PCR (5 мкл суспендированных клеток, Taq-полимераза, праймер 5BIp и 3Bam(GAG) γ1/γ2 и 5Bsi и 3Bam(СТТ) для κ-колоний:
94°С 120 сек
94°С 30 сек
55°С 30 сек
72°С 60 сек цикл 35 раз
72°С 10 мин
Образцы анализировали в 1,5% агарозном геле на наличие PCR-продуктов. Колонии, содержащие гены антител, были выбраны для инокулирования 5 мл среды LB/Ампициллин. После инкубации при 37°С в течение ночи E.coli собирали и ДНК приготавливали, используя набор Qiagen miniprep (QIAGEN, # 12123). Контрольное расщепление (HindIII, BamHI) показало, что все гены κ- и γ-цепей вставлены при ожидаемом размере; последовательности подтверждали путем секвенирования ДНК на Medigenomix.
Крысиные константные домены амплифицировали с помощью PCR из вектора pLXSN-ESK и клонировали в векторы g1/g2 и k pcDNA3 с получением химерных полноразмерных антител. Вариабельные домены VL амплифицировали со следующими праймерами, содержащими HindIII и BsmI сайт на 5'-конце и BsiWI сайт на 3'-конце:
VL-11B7-5': AGATAAGCTTGTGCATTCCGACATCCAGATGACCCAGGCTCC
VL-11B7-3': AGATCGTACGTTTCAGCTCCAGCTTGGTGCCTC
VL-11D5-5': AGATAAGCTTGTGCATTCCGACATCCAGATGACCCAGTCTCCATC
VL-11D5-3': AGATCGTACGTTTCAGCTTGGTCCCAG
Вариабельные домены VH амплифицировали со следующими праймерами, содержащими HindIII и BsmI сайт на 5'-конце и BIpI сайт на 3'-конце:
VH-11B7/11D5-5': AGATAAGCTTGTGCATTCCGAGGTGCAGCTTCAGGAGTCAGG
VH-11B7/11D5-3': AGATGCTGAGCTGACAGTGACCATGACTCCTTGGCC
BsiWI для легкой цепи и BIpI для тяжелой цепи являются единичными сайтами на 5' конце константных участков, обеспечивающими непосредственное слияние с 3' концом генов с константными доменами,
Слитые с лидерной последовательностью SEQ ID No: 69, полученной из вектора pLNOH2 (Norderhaug et. al. J. Immunol. Methods 204, 1997; Neuberger EMBO J. 1983; 2 (8): 1373-8,1983), гены, кодирующие цепи химерного антитела были клонированы в векторную систему рСЕР для рекомбинантной экспрессии. Гены легкой цепи Nhel (5') и Xhol (3') клонировали в рСЕР4 (Invitrogen), гены тяжелой цепи Kpnl (5') и Xhol (3') в pCEP-Pu (Kohfeld FEBS Vol 414; (3) 557ff, 1997).
HEK 293-клетки, которые высеивали на 20×20 см планшеты, трансфицировали вместе с 1 мкг/мл каждой плазмиды, кодирующей гены легкой и тяжелой цепи, используя стандартный способ CaPO4-трансфицирования для транзиторной экспрессии. Условия культивирования включали 37°С, 5% CO2 в среде с высоким содержанием глюкозы DMEM/F12, содержащей 5% низко-IgG FCS, 1% пируват, 1% глутамин, 1% пенициллин/стрептомицин. Через 24 ч трансфекции среду заменяли свежей средой. Супернатанты собирали каждые 2-3 дня в течение приблизительно 3 недель. Химерные антитела очищали из приблизительно 600 мл супернатанта, применяя 1 мл колонки Hitrap rProtein A (GE-Healthcare) при условиях со стандартным буфером (загрузка: 50 мМ Tris; рН 8,5, промывка: 50 мМ PO4; рН 8,5, элюция: 100 мМ Glycin; pH 3,3), как описано для очистки крысиных антител.
Пример 19. Гуманизация константных доменов крысиных анти-AXL-антител
Крысиные вариабельные участки химерных антител сравнивали с последовательностями человеческих антител эмбрионального типа на уровне белка путем проведения поиска BLAST для доменов иммуноглобулинов. Идентифицировали наиболее близкий человеческий аналог в V-генах, который в дополнении имел идентичные длины петлей CDR. Связанные D и J сегменты были выбраны из базы данных V-BASE (http://vbase.mrc-cpe.cam.ac.uk/) в соответствии с их гомологией к крысиным последовательностям аналогичным образом.
Для крысиных константных доменов 11В7 и 11D5 антител были найдены следующие наиболее оптимальные человеческие эмбриональные последовательности (V, D и J сегменты) и определены как человеческие каркасные:
VL11B7hum: Vκ1-O12+Jk1
VH11B7hum: VH4-59+D4-4 (рамка считывания 3) + JH4
VL11D5hum: Vκ1-L1+Jκ4
VH11D5hum: VH4-59+D4-4 (рамка считывания 3) + JH4
Лидерные последовательности для гуманизированных константных доменов выбирали из связанных эмбриональных V-генных последовательностей, как выбрано. CDR-остатки крысиных анти-AXL-антител, определенные в соответствии с Kabat (Rabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition. NIH Publication № 91-3242, 1991) пересаживали в человеческие эмбриональные каркасные последовательности для анти-AXL-специфичности с получением итоговых гуманизированных версий анти-AXL-антител hum11B7 и hum11D5.
Белковые последовательности гуманизированных анти-AXL-антител hum11B7 и hum11D5 являлись следующими.
Белковые последовательности обратно транслировали в ДНК последовательности. ДНК-последовательности КОДОН-оптимизировали для рекомбинантной экспрессии в клетках млекопитающих, используя базу данных Kazusa-Codon-Usage. Результирующие ДНК последовательности для гуманизированных анти-AXL-антител являлись следующими.
Оптимизированные ДНК последовательности, кодирующие гуманизированные анти-AXL-антитела, синтезировали с помощью метода PCR, основанного на перекрывании олигонуклеотидов.
VL-гены клонировали в вектор рСЕР4, применяя плазмиду конструкции химерного антитела pCEP4_ch11B7k1. Участками клонирвоания были Nhel (5') и BsiWI (3'), которые уже были включены в синтезированные гены гуманизированных антител. VH гены клонировали в соответствующую тяжелую цепь химерного вектора pCEP-PU_ch11B7g1, используя Kpnl (5') и BIpI (3') в качестве сайтов рестрикции. ДНК оптимизация, синтез генов, клонирование и подтверждение последовательностей осуществляли на Eurofins Medigenomix GmbH, Martinsried, Germany.
Пример 20. Крысиные и химерные анти-AXL-антитела изобретения ингибировали лиганд-индуцированное AXL-фосфорилирование in vitro в сходной степени
Химерные производные крысиных анти-AXL-антител 11В7 и 11D5 были получены как часть данного изобретения (см. ниже). Для изучения, обеспечивают ли крысиные анти-AXL-антитела изобретения и соответствующие химерные анти-AXL-антитела изобретения ингибирование лиганд Gas6-опосредованной AXL-активации in vitro в сходной степени, проводили эксперименты ELISA на клетках рака шейки матки CaSki. Gas6-опосредованную AXL-активацию вследствие чего обнаруживали по усилению фосфорилирования тирозина. Кратко, на 1 день высеивали 3×104 клеток на лунку в нормальную питательную среду в 96-луночные планшеты с круглым дном. На следующий день питательную среду заменяли бессывороточной средой для обеднения клеток и оставляли на всю ночь в течение 24 ч. На следующий день черные 96-луночные планшеты MAXL-Sorp (Nunc) покрывали мышиным анти-фосфо-тирозин-антителом 4G10 при 2 мкг/мл PBS и 4°С. На 3 день раствор антитела 4G105 удаляли и лунки MAXL-Sorp блокировали PBS, 0,5% BSA в течение, по меньшей мере, 4 ч при комнатной температуре. Параллельно клетки предварительно инкубировали с 50 нг/мл, 100 нг/мл, 300 нг/мл, 750 нг/мл, 1 мкг/мл и 10 мкг/мл крысиным анти-AXL-антителом 11 В7 или с химерным анти-AXL-антителом ch11B7 в течение 1 ч при 37°С и затем обрабатывали или не обрабатывали 400 нг/мл Gas6 (R&DO Systems) в течение 10 мин при 37°С. Среду затем выливали и клетки лизировали в лизирующем буфере (50 мМ HEPES, рН 7,5, 150 мМ NaCl, 1 мМ EDTA, 10% глицерин и 1% Triton X-100), дополненном ингибиторами фосфатазы и протеазы (10 мМ Na4P2O7, 1 мМ фенилметилсульфонилфторид, 1 мМ ортованадат, 1 мМ NaF и 0,5% апротинин) в течение 30 мин во льду. Между тем, блокирующий буфер удаляли и планшеты MAXL-Sorp промывали 6 раз отмывочным буфером (PBS, 0,05% Tween 20), перед тем как лизаты переносили и инкубировали всю ночь при 4°С. Затем планшеты промывали 6 раз отмывочным буфером. На 4 день лунки инкубировали с биотинилированным крысиным анти-AXL-антителом 12В7 при 0,5 мкг/мл PBS в течение 2 ч при комнатной температуре. Планшеты промывали 6 раз отмывочным буфером и АР-конъюгированный стрептавидин (Chemicon #SA110), разведенный в соотношении 1:4000 в PBS, добавляли к каждой лунке и инкубировали в течение 30 мин при комнатной температуре. Затем лунки промывали 6х отмывочным буфером и добавляли субстратный раствор AttoPhos (Roche #11681982). Используя планшет-ридер Victor (Perkin Elmer), собирали сигнал флуоресценции от каждой лунки при длине волны возбуждения 430 нм и длине волны излучения 580 нм.
Фигура 17 показывает репрезентативные результаты этого эксперимента для клеточной линии рака шейки матки CaSki. Как продемонстрировано по снижению в зависмости от концентрации соответствующего AXL-фосфорилирования, крысиное анти-AXL-антитело 11В7 (А) и химерное анти-AXL-антитело ch11B7 (В) изобретения обеспечивали блокирование лиганд-индуцированной активации рецепторной тирозинкиназы AXL в сходной степени. Сравнимые эффекты применяемых аналогичных экспериментальных условий наблюдали для клеточной линии меланомы С-8161.
Пример 21. Крысиные и химерные анти-AXL-антитела изобретения ингибировали лиганд-индуцированное р42/р44 МАР-Киназа-фосфорилирование in vitro в сходной степени
Для дополнительного подтверждения, способны ли крысиные анти-AXL-антитела изобретения и соответствующие химерные анти-AXL-антитела изобретения ингибировать Gas6-индуцированную активацию р42/р44 МАР-Киназа в CaSki-клетках рака шейки матки в сходной степени, проводили ELISA-эксперименты. Здесь, Gas6-индуцированную р42/р44 МАР-Киназа-активацию определяли по усилению белкового (Thr202/Tyr204) фосфорилирования. Вкратце, на первый день в 96-луночные планшеты с круглым дном высеивали 2×104 клеток на лунку. На следующий день нормальную питательную среду заменяли бессывороточной средой для обеднения клеток в течение 24 ч. После этого клетки предварительно инкубировали вместе с 50 нг/мл, 100 нг/мл, 300 нг/мл, 750 нг/мл, 1 мкг/мл и 10 мкг/мл крысиным анти-AXL-антителом 11 В7 или химерным анти-AXL-антителом ch11B7 в течение 1 ч при 37°С и затем обрабатывали или не обрабатывали 400 нг/мл Gas6 (R&D Systems) в течение 10 мин при 37°С. Среду выливали и клетки фиксировали 4% формальдегидом в PBS (рН 7,5) в течение 30 мин при комнатной температуре. Раствор формальдегида удаляли и клетки промывали дважды отмывочным буфером (PBS, 0,1% Tween 20). Клетки блокировали 1% H2O2, 0,1% NaN3 в отмывочном буфере и инкубировали в течение 20 мин при комнатной температуре. Затем блокирующий раствор удаляли и клетки промывали дважды отмывочным буфером и блокировали PBS, 0,5% BSA в течение 4 ч при комнатной температуре. Анти-фосфо-р42/р44 MAP Киназа (Thr202/Tyr204) первичное антитело (поликлональное кроличье; Cell Signaling #9101) разводили в соотношении 1:1000 в PBS, 0,5% BSA, 0,05% Tween 20, добавляли 5 мМ EDTA и оставляли на всю ночь при 4°С. На 4 день раствор антитела удаляли и планшету промывали 3x отмывочным раствором. HRP-конъюгированное антикроличье вторичное антитело (Dianova #111-036-045) разводили в соотношении 1:2500 в PBS, 0,5% BSA, 0,05% Tween 20, затем к каждой лунке добавляли 5 мМ EDTA и инкубировали в течение 1,5 ч при комнатной температуре. Планшету промывали 3x отмывочным буфером в течение 5 мин каждое. Добавляли тетраметилбензидин (ТМВ, Calbiochem) и измеряли при длине волны 620 нм. Реакцию останавливали добавлением 100 мкл 250 нМ HCL и измеряли оптическую плотность при 450 нм с опорной длиной волны 620 нм, используя планшет-ридер Vmax (Thermo Lab Systems).
Фигура 18 показывает репрезентативные результаты этого эксперимента. Крысиное анти-AXL-антитело 11В7 (А) и химерное анти-AXL-антитело ch11B7 (В) изобретения обеспечивали блокирование Gas6-индуцированной активации of p42/p44 МАР-Киназа в клетках CaSki рака шейки матки в сходной степени, что показано снижением в зависимости от концентрации соответствующего p42/p44 МАР-Киназа-фосфорилирования.
Пример 22. Крысиные анти-AXL-антитела изобретения синергичны с химиотерапевтическими агентами для устранения устойчивости к лекарственным средствам in vitro
Как только выяснилось, что крысиные анти-AXL-антитела изобретения мешают Gas6-опосредованному антиапоптозу бессывороточных фибробластов NIH3T3-Axl cl.7, возник вопрос, синергичны ли антагонистические анти-AXL-антитела с химиотерапевтическими агентами в индуцировании апоптоза, что способствует устранению лекарственной резистентности. В этом примере, NCI/ADR-RES (исходно называемые MCF-7/AdrR) клетки - клеточная линия рака яичников (Liscovitch and Ravid, 2007, Cancer Letters, 245, 350-352), демонстрирующие высокую устойчивость к некоторым агентам, включая доксорубицин (Fairchild et al., 1987, Cancer Research, 47, 5141-5148; Xu et al., 2002, The Journal of Pharmacology and Experimantal Therapeutics, 302, 963-971), - инкубировали с антагонистическим анти-AXL-антителом 11В7 и/или доксорубицином и уровень апоптоза определяли с помощью TUNEL-окрашивания. Вкратце, 3×104 NCI/ADR-RES-клеток высеивали на лунку в нормальную питательную среду на 8-камерное предметное стекло для культур (BD Falcon, cat# 354118), которые предварительно инкубировали вместе с этой же средой в течение 1 ч при 37°С. На следующее утро нормальную питательную среду удаляли и клетки промывали и культивировали в среде с низким содержанием сыворотки (0,5% FCS). Вечером добавляли изотипическое контрольное антитело 1D5 или антагонистическое анти-AXL-антитело 11В7 в конечной концентрации 10 мкг/мл каждое. На утро 3 дня добавляли доксорубицин в конечных концентрациях 100 мкМ, 150 мкМ или 200 мкМ и клетки инкубировали при 37°С. Через 24 ч клетки промывали один раз в PBS, фиксировали 4% формальдегидом в PBS (рН 7,5) в течение 20 мин при комнатной температуре, высушивали на воздухе в течение 5 мин и хранили при -20°С. Используя коммерчески доступный набор Fluorescein-FragEL(TM) (Oncogene, cat# QIA39, ранее поставляемый через Merck-Calbiochem), выполняли TUNEL-окрашивание в соответствии с инструкциями производителя (глава «Fluorescein-FragEL™ of cell preparations fixed on slides», c.10). Применяя флуоресцентный микроскоп, клетки анализировали и фотографировали.
Фигура 19 показывает репрезентативные результаты этого эксперимента. Не наблюдали TUNEL-окрашивания и, следовательно, апоптоза в клетках NCI/ADR-RES рака яичников, которые обрабатывали 100 мкМ доксорубицина, независимо от того, инкубировали клетки с контрольным антителом или антагонистическим анти-AXL-антителом 11В7 (верхняя). Однако в концентрации 150 мкМ доксорубицина обнаруживался слабый апоптоз в клетках, обрабатанных совместно с контрольным антителом, тогда как инкубация с антагонистическим анти-AXL-антителом 11В7 привела к устойчивой индукции апоптоза (средняя). Также в присутствии 200 мкМ доксорубицина, инкубация клеток с 11В7 значительно усилила уровень апоптоза по сравнению с клетками, которые инкубировали с контрольным IgG-антителом (нижняя), показывая, что совместная обработка даже мультиустойчивых к лекарственным средствам клеток обоими химиотерапевтическими агентами и антагонистическими анти-AXL-антителами изобретения может подходить для устранения лекарственной резистентности.
Пример 23. Крысиные анти-AXL-антитела изобретения синергичны с химиотерапевтическими агентами в снижении якорьзависимого роста колоний in vitro
Анализы в мягком агаре проводили для изучения способности анти-AXL-антитела изобретения ингибировать якорьзависимый клеточный рост либо самого по себе либо в комбинации с химиотерапевтическими агентами. Анализ образования колоний на мягком агаре является стандартным анализом in vitro для тестирования трансформированных клеток, если только трансформированные клетки способны расти на мягком агаре. Вкратце, клетки меланомы 750 С-8161 либо оставляли необработанными, либо предварительно инкубировали с антагонистическим крысиным анти-AXL-антителом 11В7 в концентрации 15 мкг/мл в среде IMDM (Gibco) в течение 30 мин при 37°С. Затем клетки комбинировали с раствором очищенного агара Difco, что привело к образованию 50 мкл клеточной суспензии сверху агара в соотношении Агар, FCS и 11В7 0,35%, 0,2% и 7,5 мкг/мл соответственно. Эту клеточную суспензию помещали сверху 50 мкл 0,7% агарозного нижнего слоя, содержащего 20% FCS, и в конце покрывали другим питательным раствором в количестве 50 мкл, который содержит 0,2% FCS, а также цисплатин в соответствующих концентрациях. В целом на 150 мкл на образец конечные концентрации 11В7 и цисплатина составляли 2,5 мкг/мл и 1,5 мкМ, 1,0 мкМ, 0,75 мкМ, 0,5 мкМ или 0,25 мкМ соответственно. Оставляли для образования колоний в течение 5 дней и затем окрашивали с 50 мкл МТТ (Sigma, 1 мг/мл в PBS) в течение 3 часов при 37°С. Используя систему отображения Scanalyzer HTS в сочетании с программным обеспечением для определения образования колоний HTS Bonit (Lemnatec, Wuerselen), анализировали трехкратно эффект антагонистического крысиного анти-AXL-антитела 11В7 в отсутствие или присутствии цисплатина.
Фигура 20 показывает репрезентативные результаты этого эксперимента. Представленные данные относятся ко всей площади колоний и отражают оба абсолютное измеренное количество (А) и относительное ингибирование роста (В), вызываемое цисплатином и/или антагонистическим крысиным анти-AXL-антителом 11В7. По сравнению с необработанными контрольными клетками инкубация с цисплатином привела к замедлению роста колоний в зависимости от дозы цисплатина. В отличие от ингибирующего действия 11В7 самого по себе на уровне 30% комбинация с антагонистическим анти-AXL-антителом 11В7 привела к значительному потенцированию ингибирующего эффекта цисплатина на рост в мягком агаре клеток меланомы С-8161, в особенности при низких концентрациях цисплатина.
Пример 24. Крысиные анти-AXL-антитела изобретения синергичны с антинеопластическими агентами в облегчении симптомов, связанных с опухолью
В предыдущих примерах синергетические эффекты антагонистических анти-AXL-антител изобретения, введенных совместно с доксорубицином, наблюдались по отношению к индуцированию апоптоза и преодоления проблем, связанных с устойчивостью к лекарственным средствам, в мультирезистентных к лекарствам раковых клетках, таких как клеточная линия рака яичников NCI/ADR-RES. Кроме того, комбинационные эффекты антагонистических анти-AXL-антител изобретения и цисплатина в снижении якорьзависимого роста колоний определялись в отношении клеточной линии меланомы С-8161. Следовательно, если раковые клетки или пациентов, страдающих раковыми заболеваниями, обрабатывают антагонистическими анти-AXL-антителами в комбинации с облучением и/или одним или более дополнительным антинеопластическим агентом, ожидаются следующие синергетические эффекты: индуцирование апоптоза в опухолевых клетках и/или преодоление устойчивости к лекарственным средствам опухолевых клеток, подавление выживаемости опухолевых клеток, ингибировании роста опухолевых клеток и/или пролиферации, снижение миграции опухолевых клеток, распространения и метастазирования или ослабление опухолевого ангиогенеза. В особенности, синергетические эффекты в индуцировании апоптоза в опухолевых клетках и/или преодолении устойчивости к лекарственным средствам опухолевых. клеток, подавлении выживаемости опухолевых клеток, ингибирование роста опухолевых клеток и/или пролиферации, снижении миграции опухолевых клеток, распространения и метастазирования или ослаблении опухолевого ангиогенеза ожидаются, если клетки меланомы или пациентов, страдающих меланомой, обрабатывают антагонистическими анти-AXL-антителами в комбинации с облучением и/или любым дополнительным антинеопластическим агентом, который представляет собой предпочтительно, но не ограничиваясь, цисплатин, дакарбазин, темозоломид/темодал, муфоран/фотемустин, паклитаксел или доцетаксел. Кроме того, синергетические эффекты в индуцировании апоптоза в опухолевых клетках и/или преодолении устойчивости к лекарственным средствам опухолевых клеток, подавлении выживаемости опухолевых клеток, ингибировании роста опухолевых клеток и/или пролиферации, снижении миграции опухолевых клеток, распространения и метастазирования или ослаблении опухолевого ангиогенеза ожидаются, если клетки рака яичников или пациентов, страдающих раком яичников, обрабатывают антагонистическими анти-AXL-антителами в комбинации с облучение и/или любым дополнительным антинеопластическим агентом, который предпочтительно представляет собой, но не ограничиваясь, доксорубицин, цисплатин, карбоплатин, паклитаксел, доцетаксел, мелфалан, алтретамин, топотекан, ифосфамид, этопозид или 5-фторурацил. Дополнительно, синергетические эффекты в индуцировании апоптоза в опухолевых клетках и/или преодолении устойчивости к лекарственным средствам опухолевых клеток, подавлении выживаемости опухолевых клеток, ингибировании роста опухолевых клеток и/или пролиферации, снижении миграции опухолевых клеток, распространения и метастазирования или ослаблении опухолевого ангиогенеза ожидаются, если клетки рака предстательной железы или пациентов, страдающих раком предстательной железы, обрабатывают антагонистическими анти-AXL-антителами в комбинации с облучением и/или любым дополнительным антинеопластическим агентом, который представляет собой предпочтительно, но не ограничиваясь, митозантрон, доксорубицин, паклитаксел, доцетаксел или винбластин. Также синергетические эффекты в индуцировании апоптоза в опухолевых клетках и/или преодолении устойчивости к лекарственным средствам опухолевых клеток, подавлении выживаемости опухолевых клеток, ингибировании роста опухолевых клеток и/или пролиферации, снижении миграции опухолевых клеток, распространении и метастазирования или ослаблении опухолевого ангиогенеза ожидаются, если клетки рака желудка или пациентов, страдающих раком желудка, обрабатывают антагонистическими анти-AXL-антителами в комбинации с облучением и/или любым дополнительным антинеопластическим агентом, который представляет собой предпочтительно, но не ограничиваясь, 5-фторурацил, митомицин С, цисплатин, доксорубицин, метотрексат, этопозид, лейковарин, эпирубицин, паклитаксел, доцетаксел или иринотекан. Также синергетические эффекты в индуцировании апоптоза в опухолевых клетках и/или преодолении устойчивости к лекарственным средствам опухолевых клеток, подавлении выживаемости опухолевых клеток, ингибировании роста опухолевых клеток и/или пролиферации, снижении миграции опухолевых клеток, распространения и метастазирования или ослаблении опухолевого ангиогенеза ожидаются, если клетки рака молочной железы или пациентов, страдающих от рака молочной железы, обрабатывают антагонистическими анти-AXL-антителами в комбинации с облучением и/или любым дополнительным антинеопластическим агентом, который представляет собой предпочтительно, но не ограничиваясь, доксорубицин, эпирубицин, паклитаксел, доцетаксел, циклофосфамид, 5-фторурацил, гемцитабин, капецитабин, винорелбин или трастузумаб. Кроме того, синергетические эффекты в индуцировании апоптоза в опухолевых клетках и/или преодолении устойчивости к лекарственным средствам опухолевых клеток, подавлении выживаемости опухолевых клеток, ингибировании роста опухолевых клеток и/или пролиферации, снижении миграции опухолевых клеток, распространения и метастазирования или ослаблении опухолевого ангиогенеза ожидаются, если клетки рака шейки матки или пациентов, страдающих раком шейки матки, антагонистическими анти-AXL-антителами в комбинации с облучением и/или любым дополнительным антинеопластическим агентом, который представляет собой предпочтительно, но не ограничиваясь, цисплатин, ифосфамид, иринотекан, 5-фторурацил, паклитаксел, доцетаксел, гемцитабин или топотекан. Кроме того, синергетические эффекты в индуцировании апоптоза в опухолевых клетках и/или преодолении устойчивости к лекарственным средствам опухолевых клеток, подавлении выживаемости опухолевых клеток, ингибировании роста опухолевых клеток и/или пролиферации, снижении миграции опухолевых клеток, распространения и метастазирования или ослаблении опухолевого ангиогенеза ожидаются, если клетки рака поджелудочной железы или пациентов, страдающих раком поджелудочной железы, антагонистическими анти-AXL-антителами в комбинации с облучением и/или любым дополнительным антинеопластическим агентом, который представляет собой предпочтительно, но не ограничиваясь, гемцитабин, капецитабин или 5-фторурацил. И наконец, но не исключая другие виды раковых опухолей, синергетические эффекты в индуцировании апоптоза в опухолевых клетках и/или преодолении устойчивости к лекарственным средствам опухолевых клеток, подавлении выживаемости опухолевых клеток, ингибировании роста опухолевых клеток и/или пролиферации, снижении миграции опухолевых клеток, распространения и метастазирования или ослаблении опухолевого ангиогенеза ожидаются, если клетки рака легких или пациентов, страдающих раком легких, антагонистическими анти-AXL-антителами в комбинации с облучением и/или любым дополнительным антинеопластическим агентом, который представляет собой предпочтительно, но не ограничиваясь, цисплатин, карбоплатин, доксорубицин, паклитаксел, доцетаксел, этопозид, винорелбин, винкристин, ифосфамид, гемцитабин, метотрексат, циклофосфамид, ломустин или топотекан.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ AXL | 2010 |
|
RU2571224C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, СПОСОБНЫЕ СВЯЗЫВАТЬСЯ С БЕЛКОМ AXL, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2559530C2 |
| АНТИГЕН-СВЯЗЫВАЮЩИЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОДУКТА ДЛЯ АДРЕСНОЙ ДОСТАВКИ ПРИ ЛЕЧЕНИИ РАКА | 2012 |
|
RU2650771C1 |
| ИНГИБИРОВАНИЕ AXL СИГНАЛИЗАЦИИ В АНТИМЕТАСТАТИЧЕСКОЙ ТЕРАПИИ | 2011 |
|
RU2556822C2 |
| АНТИГЕНСВЯЗЫВАЮЩИЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОДУКТА ДЛЯ АДРЕСНОЙ ДОСТАВКИ ПРИ ЛЕЧЕНИИ РАКА | 2012 |
|
RU2659094C2 |
| СВЯЗЫВАЮЩИЕ ПРОТЕИНЫ, СПЕЦИФИЧНЫЕ ПО ОТНОШЕНИЮ К ИНСУЛИН-ПОДОБНЫМ ФАКТОРАМ РОСТА, И ИХ ИСПОЛЬЗОВАНИЕ | 2013 |
|
RU2549703C2 |
| АНТИТЕЛА ПРОТИВ AXL И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2577986C2 |
| АНТИТЕЛА К CXCR4 И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКА | 2009 |
|
RU2573897C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CXCR4 ДЛЯ ЛЕЧЕНИЯ РАКА | 2011 |
|
RU2595394C2 |
| Антитела к PD-1 и способы их применения | 2015 |
|
RU2701797C2 |





































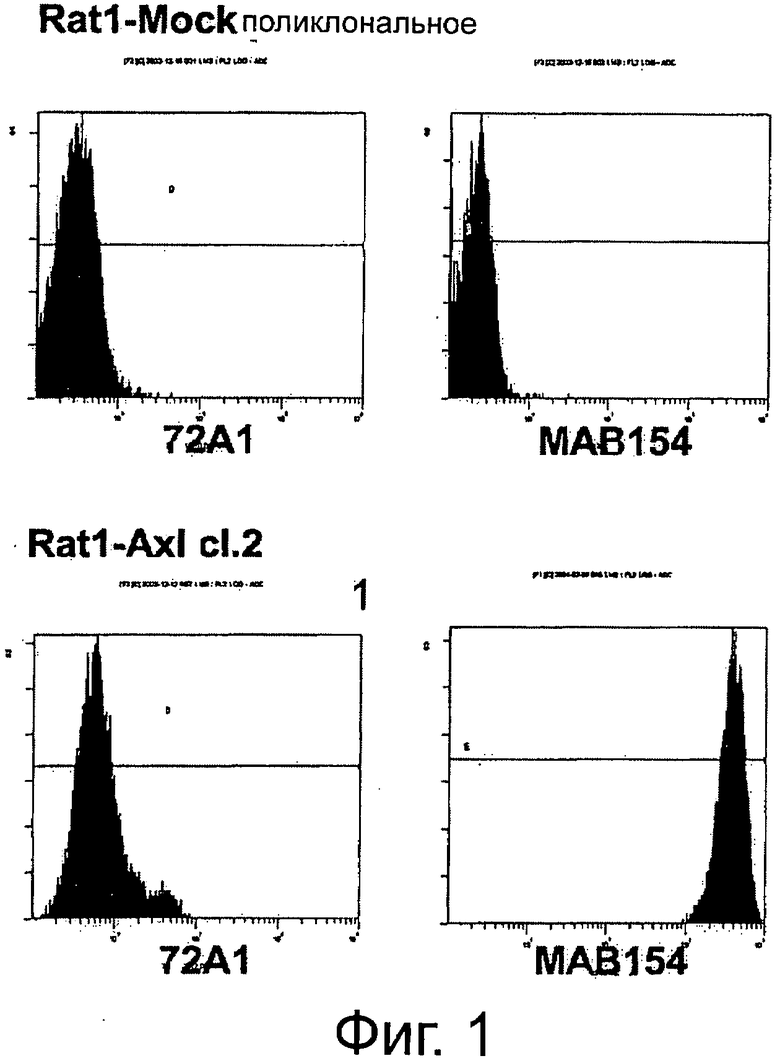
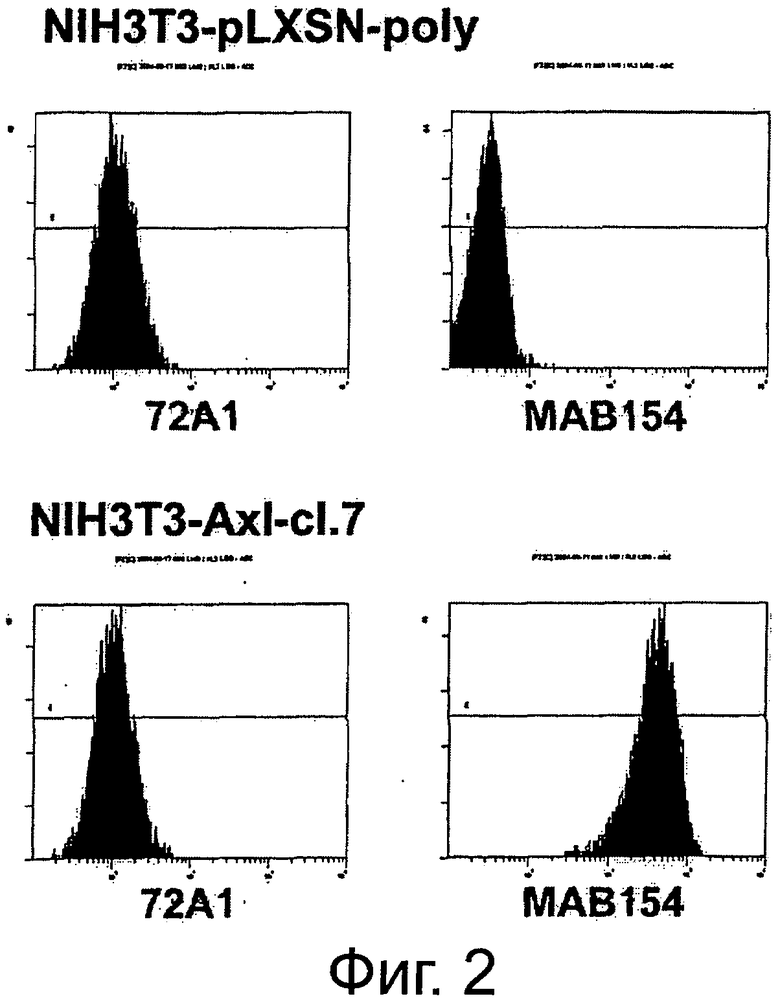
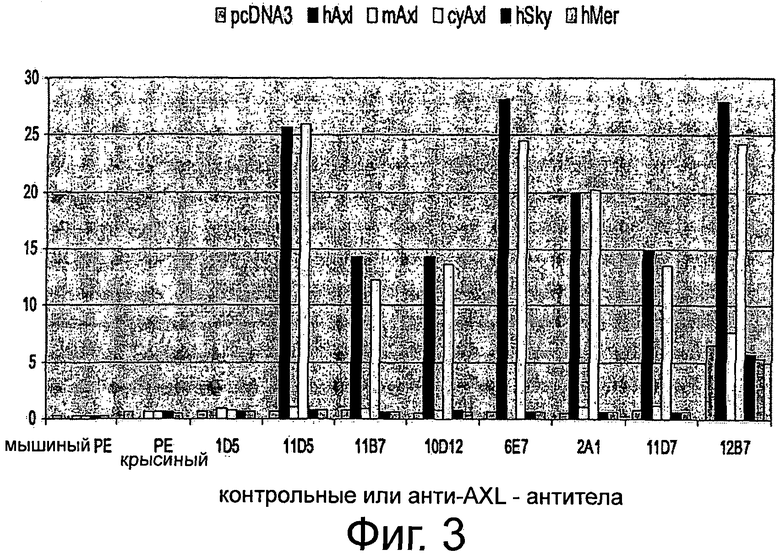
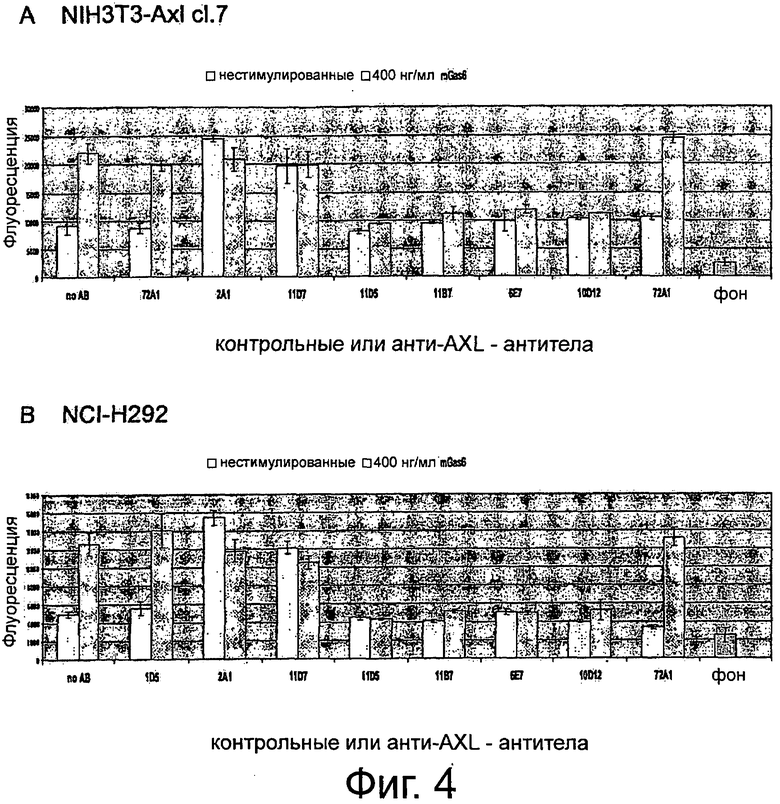
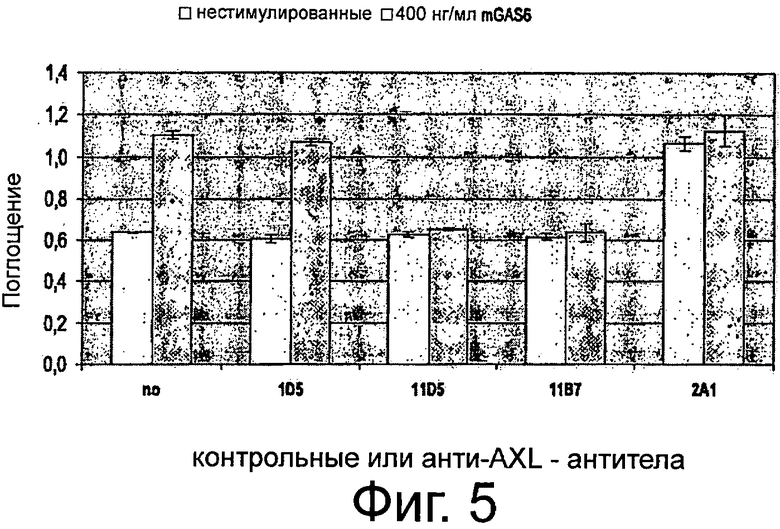
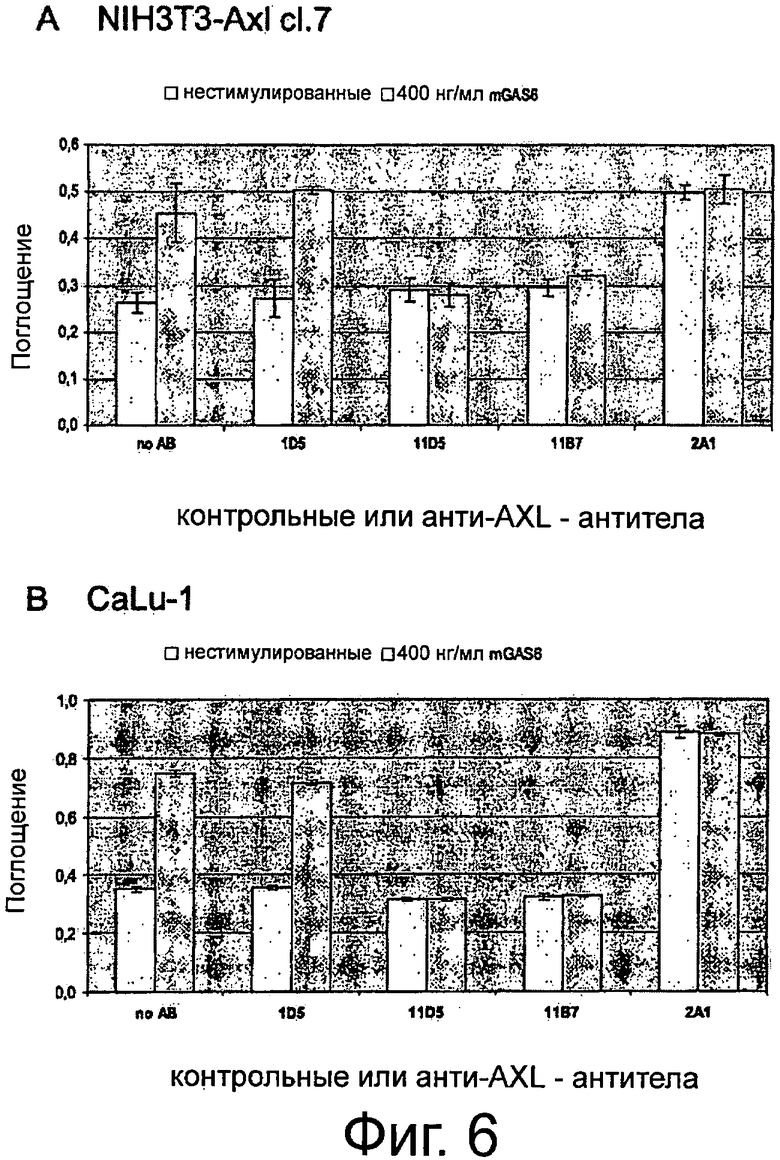
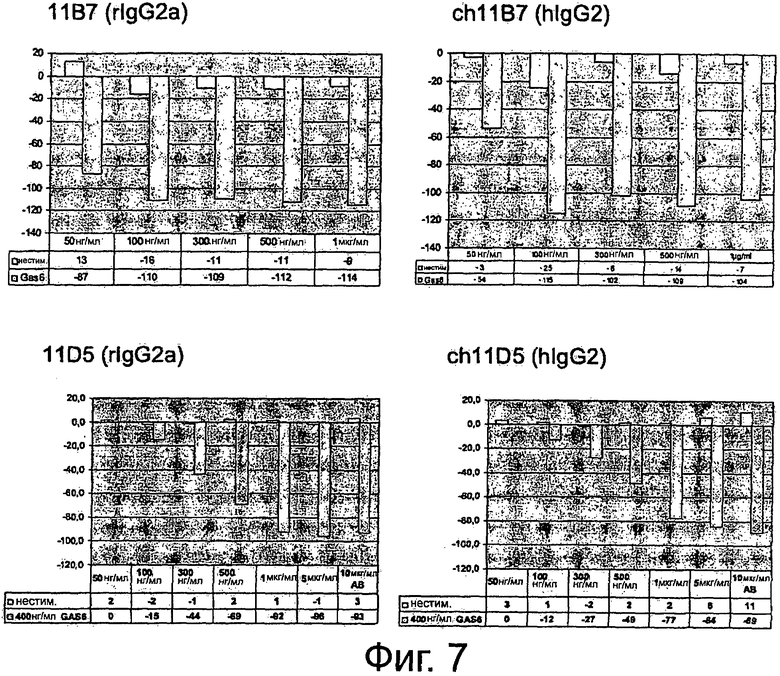
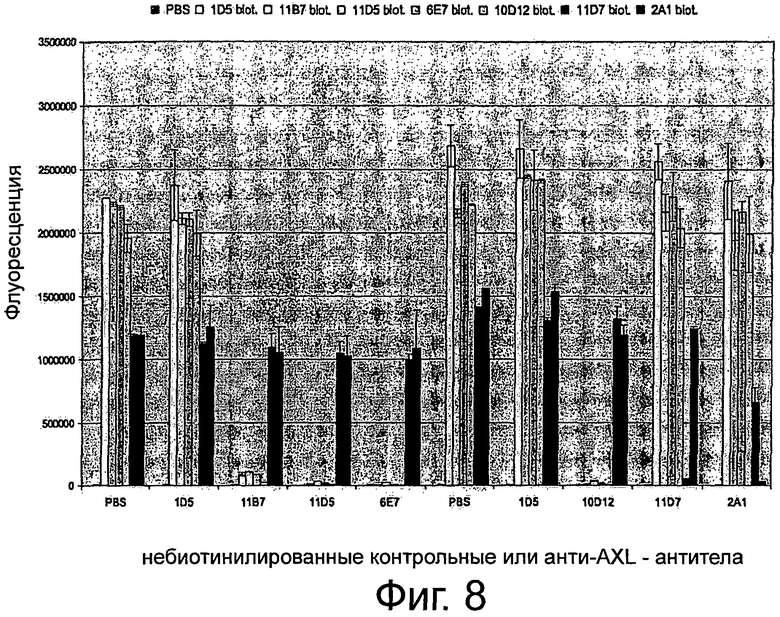
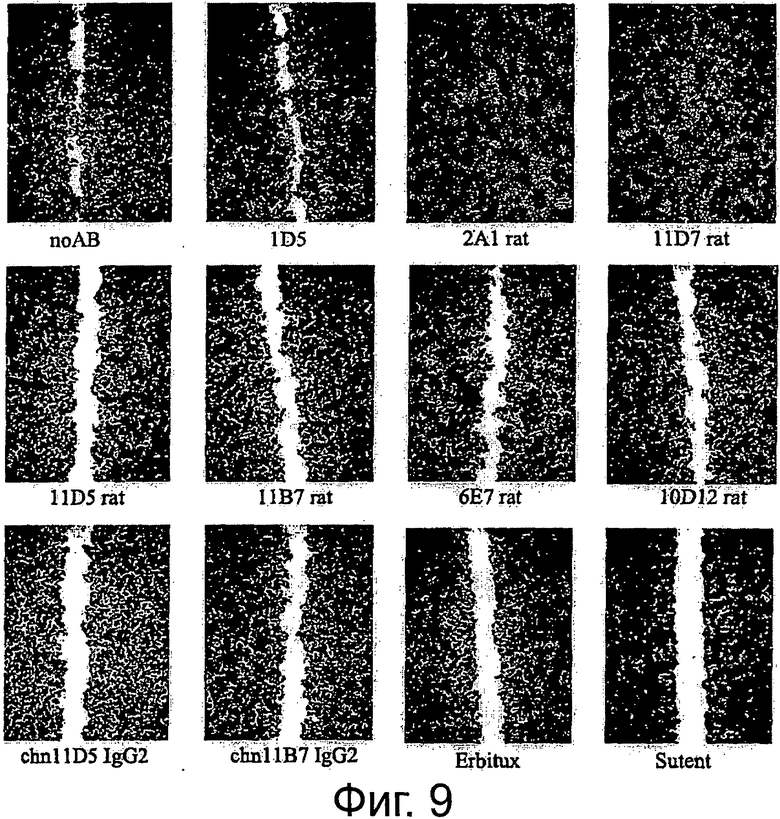
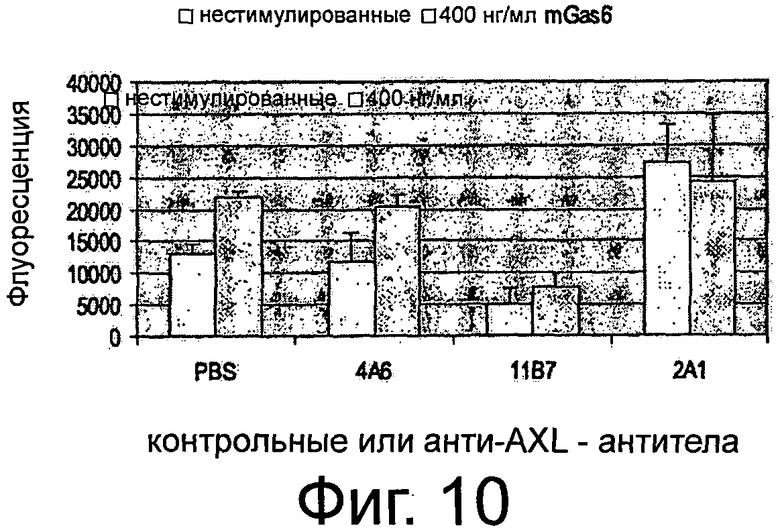
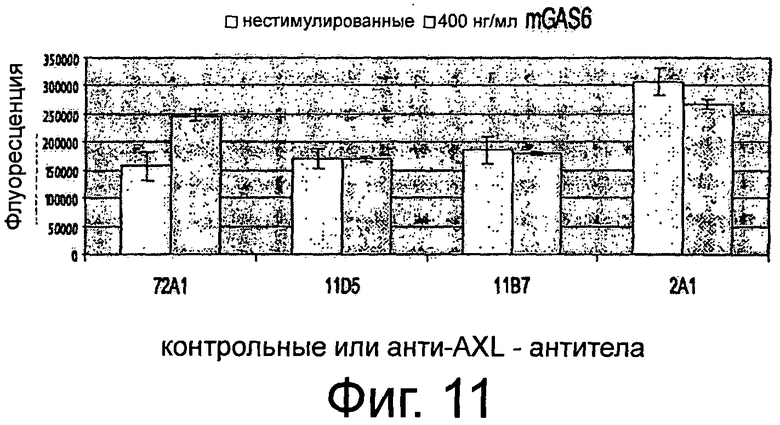
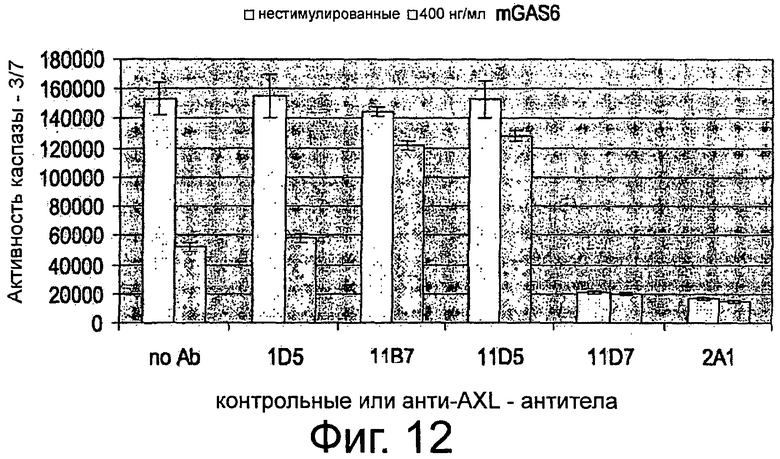
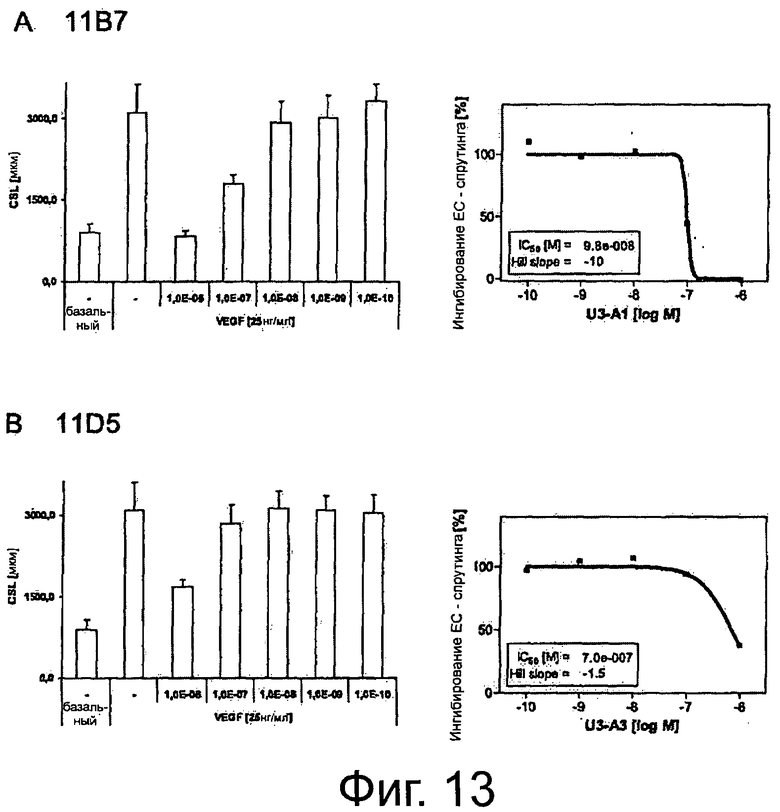
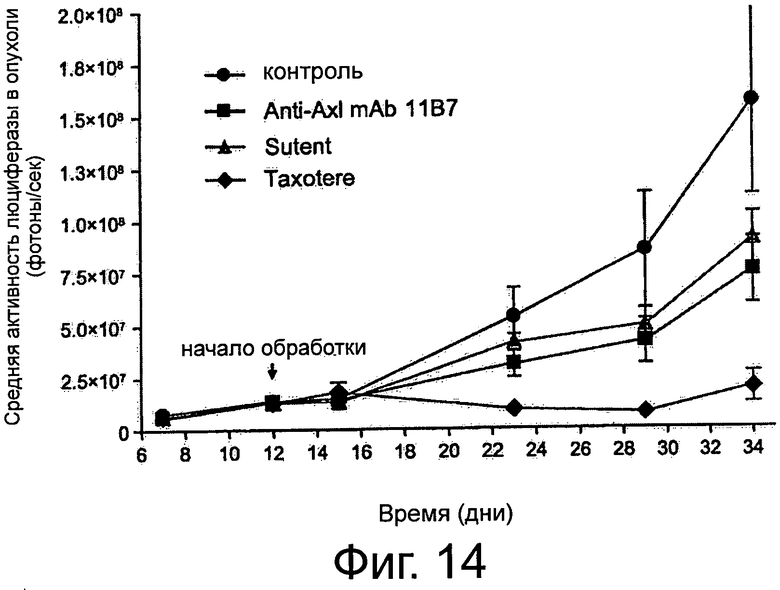
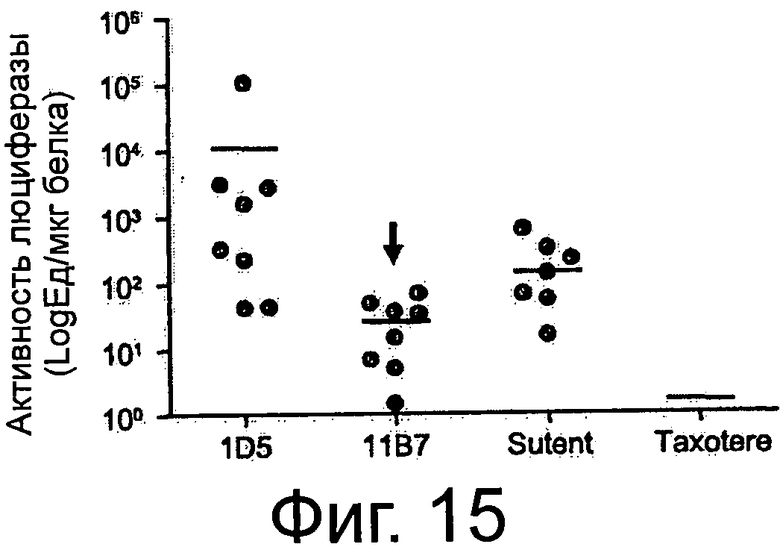

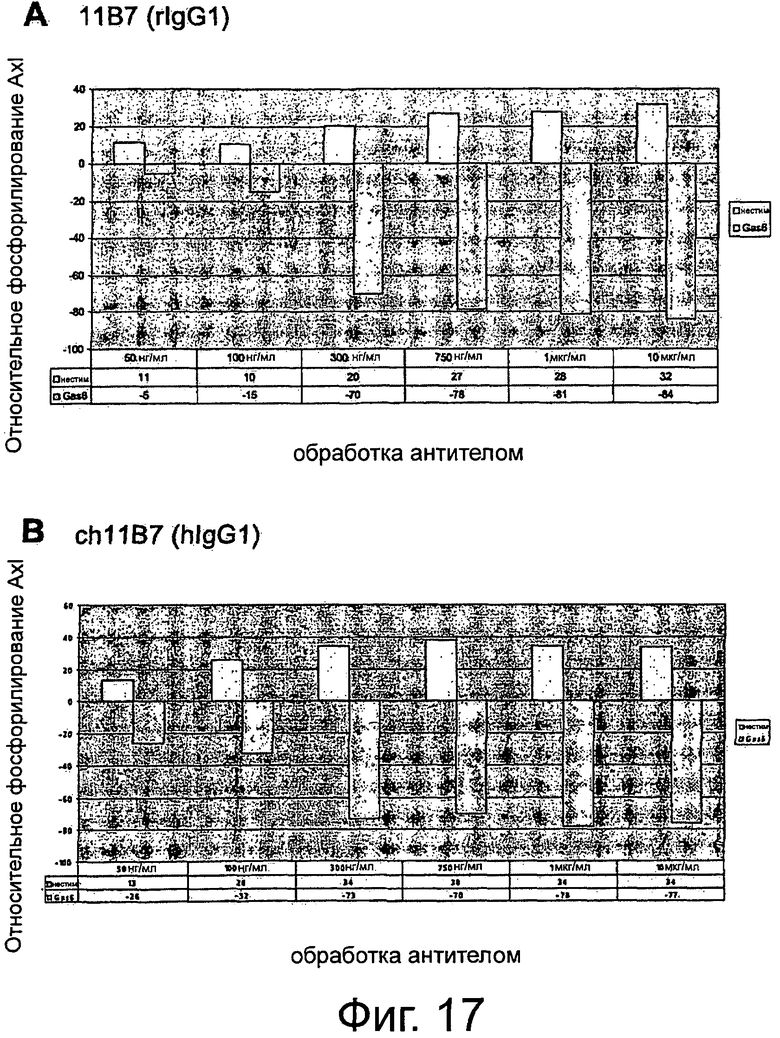
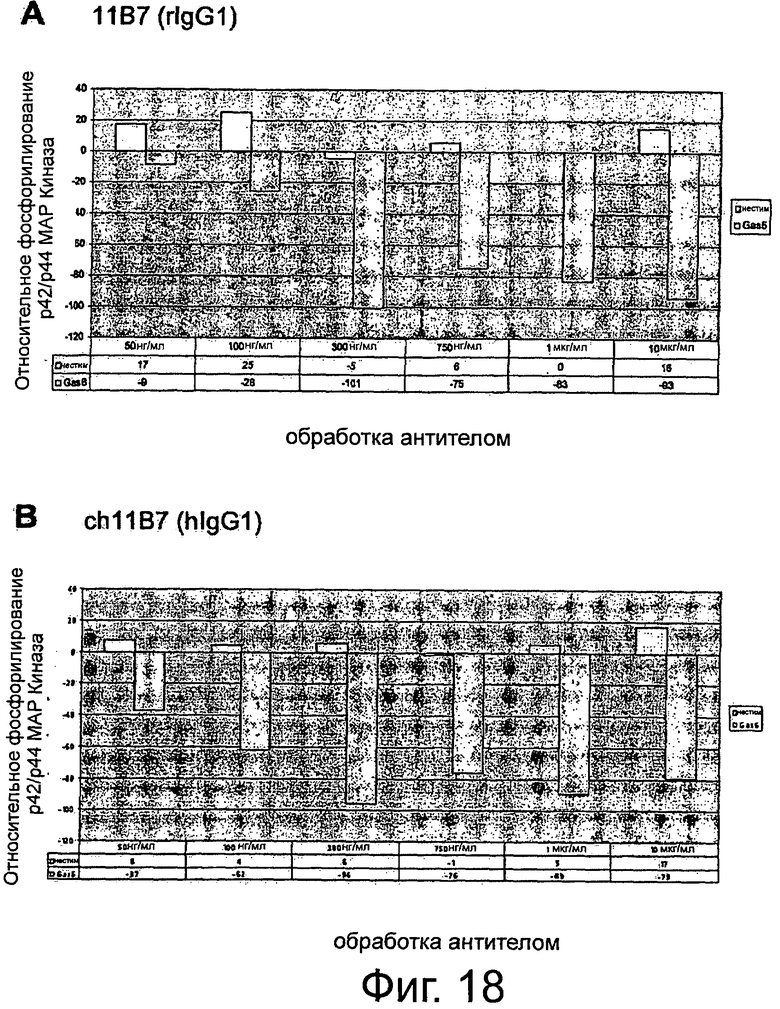

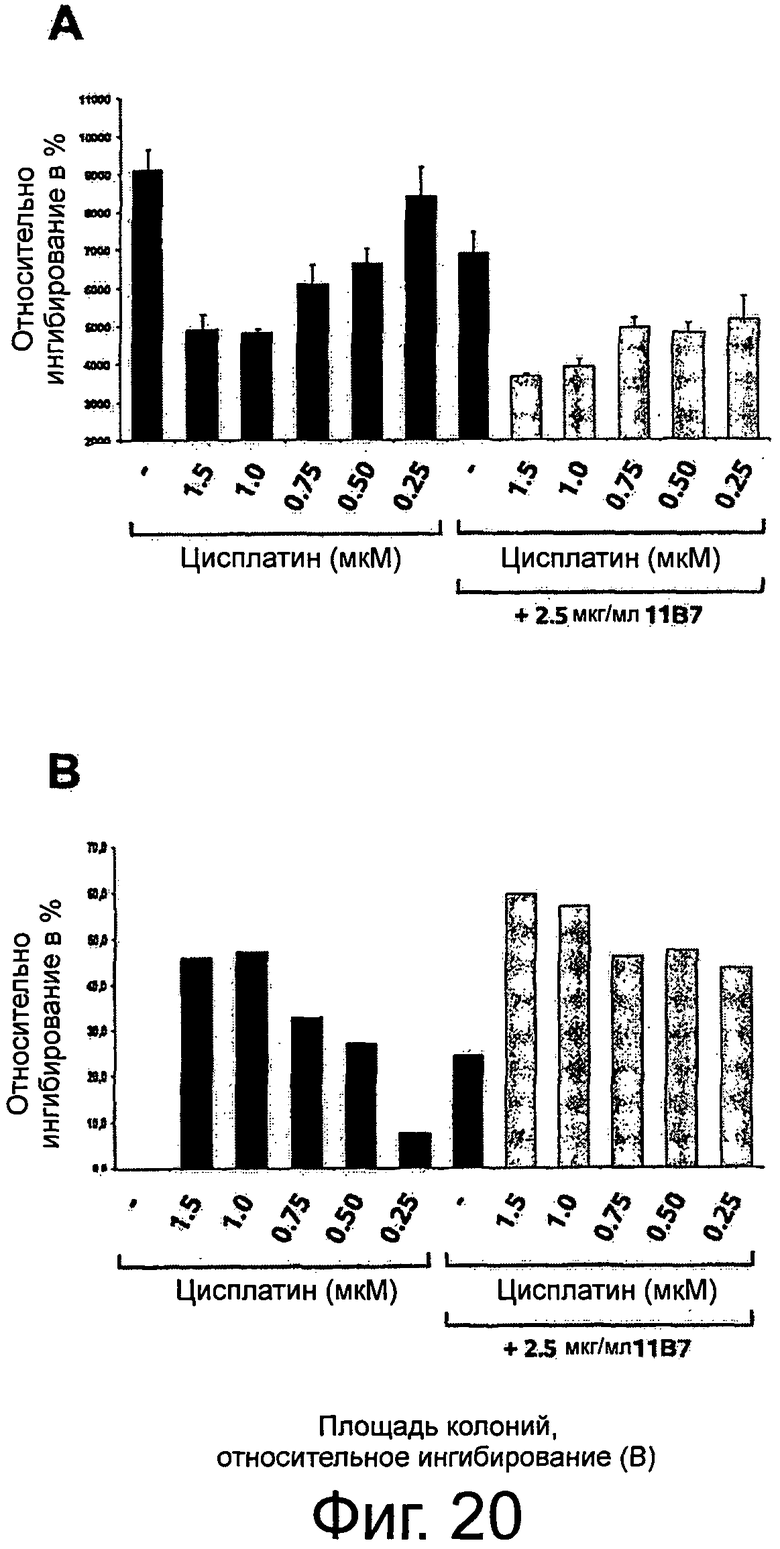
Настоящее изобретение относится к области иммунологии. Предложены моноклональные антитела, которые связываются с внеклеточным доменом рецепторной тирозинкиназы AXL и которые, по меньшей мере, частично ингибируют активность AXL, а также их антигенсвязывающие фрагменты. Также рассмотрена выделенная молекула нуклеиновой кислоты, клетка-хозяин и способ получения моноклонального антитела и его антигенсвязывающего фрагмента, а также применение моноклонального антитела или его антигенсвязывающего фрагмента для изготовления лекарственного средства, фармацевтические композиции, способ диагностики и способ профилактики или лечения состояния, связанного с экспрессией, сверхэкспрессией и/или гиперактивностью AXL. Настоящее изобретение может найти дальнейшее применение в терапии и диагностике заболеваний, связанных с AXL. 11 н. и 12 з.п. ф-лы, 20 ил., 24 пр., 3 табл.
1. Моноклональное антитело или его антигенсвязывающий фрагмент, которое связывается с внеклеточным доменом AXL и, по меньшей мере, частично ингибирует активность AXL, в котором тяжелая цепь содержит
(a) CDRH1, представленный в SEQ ID NO: 16, 22 или 28,
(b) CDRH2, представленный в SEQ ID NO: 17, 23 или 29, и
(c) CDRH3, представленный в SEQ ID NO: 18, 24 или 30,
и в котором легкая цепь содержит
(d) CDRL1, представленный в SEQ ID NO: 13, 19 или 25,
(e) CDRL2, представленный в SEQ ID NO: 14, 20 или 26, и
(f) CDRL3, представленный в SEQ ID NO: 15, 21 или 27.
2. Моноклональное антитело или его антигенсвязывающий фрагмент по п.1, которое снижает и/или блокирует AXL-опосредованную передачу сигнала, снижает и/или блокирует фосфорилирование AXL, снижает и/или блокирует клеточную пролиферацию, снижает и/или блокирует ангиогенез, снижает и/или блокирует миграцию клеток, снижает и/или блокирует метастазирование опухоли, снижает и/или блокирует AXL-опосредованный антиапоптоз, снижает и/или блокирует AXL-опосредованную передачу сигналов через PI3К.
3. Моноклональное антитело или его антигенсвязывающий фрагмент по п.1, которое является рекомбинантным антителом, гуманизированным антителом, химерным антителом, мультиспецифичным антителом или его антигенсвязывающим фрагментом.
4. Моноклональное антитело или его антигенсвязывающий фрагмент по п.1, которое является химерным антителом и содержит аминокислотную последовательность тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: 38, 39, 41, 42, или, по меньшей мере, ее вариабельный домен или аминокислотную последовательность, идентичную ей по последовательности, по меньшей мере, на 90%, и/или аминокислотную последовательность легкой цепи, выбранную из группы, состоящей из SEQ ID NO: 37, 40, или, по меньшей мере, ее константный домен или аминокислотную последовательность, идентичную ей по последовательности, по меньшей мере, на 90%.
5. Моноклональное антитело или его антигенсвязывающий фрагмент по п.1, которое является гуманизированным антителом и содержит аминокислотную последовательность тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: 44, 45, или, по меньшей мере, ее вариабельный домен или аминокислотную последовательность, идентичную ей по последовательности, по меньшей мере, на 90%, и/или аминокислотную последовательность легкой цепи, выбранную из группы, состоящей из SEQ ID NO: 43, 46, или, по меньшей мере, ее вариабельный домен или аминокислотную последовательность, идентичную ей по последовательности, по меньшей мере, на 90%.
6. Моноклональное антитело или его антигенсвязывающий фрагмент по п.1, которое представляет собой Fab-фрагмент, Fab'-фрагмент, F(аb')-фрагмент, Fv-фрагмент, диатело или одноцепочечную молекулу антитела.
7. Моноклональное антитело по п.1, которое соединено с детектируемым маркером, радиоактивной группой или цитотоксической группой.
8. Моноклональное антитело или его антигенсвязывающий фрагмент по п.1, которое содержит тяжелую цепь, содержащую:
(a) CDRH1, представленный в SEQ ID NO: 16,
(b) CDRH2, представленный в SEQ ID NO: 17, и
(c) CDRH3, представленный в SEQ ID NO: 18,
и легкую цепь, содержащую
(d) CDRL1, представленный в SEQ ID NO: 13,
(e) CDRL2, представленный в SEQ ID NO: 14, и
(f) CDRL3, представленный в SEQ ID NO: 15.
9. Моноклональное антитело или его антигенсвязывающий фрагмент по п.1, которое содержит тяжелую цепь, содержащую:
(a) CDRH1, представленный в SEQ ID NO: 22,
(b) CDRH2, представленный в SEQ ID NO: 23, и
(c) CDRH3, представленный в SEQ ID NO: 24,
и легкую цепь, содержащую
(d) CDRL1, представленный в SEQ ID NO: 19,
(e) CDRL2, представленный в SEQ ID NO: 20, и
(f) CDRL3, представленный в SEQ ID NO: 21.
10. Моноклональное антитело или его антигенсвязывающий фрагмент по п.1, которое содержит тяжелую цепь, содержащую:
(a) CDRH1, представленный в SEQ ID NO: 28,
(b) CDRH2, представленный в SEQ ID NO: 29, и
(c) CDRH3, представленный в SEQ ID NO: 30,
и легкую цепь, содержащую
(d) CDRL1, представленный в SEQ ID NO: 25,
(e) CDRL2, представленный в SEQ ID NO: 26, и
(f) CDRL3, представленный в SEQ ID NO: 27.
11. Моноклональное антитело или его антигенсвязывающий фрагмент по п.1, которое содержит аминокислотную последовательность тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: 8, 10, 12, или, по меньшей мере, ее вариабельный домен или аминокислотную последовательность, идентичную ей по последовательности, по меньшей мере, на 90%, и/или аминокислотную последовательность легкой цепи, выбранную из группы, состоящей из SEQ ID NO: 7, 9, 11, или, по меньшей мере, ее вариабельный домен или аминокислотную последовательность, идентичную ей по последовательности, по меньшей мере, на 90%.
12. Выделенная молекула нуклеиновой кислоты, кодирующая моноклональное антитело или его антигенсвязывающий фрагмент по п.1.
13. Экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты по п.12.
14. Клетка-хозяин, экспрессирующая моноклональное антитело или его антигенсвязывающий фрагмент по п.1, содержащая вектор по п.13, которая является клеткой человека, бактерии, животного, гриба, амфибии или растений.
15. Моноклональное антитело или его антигенсвязывающий фрагмент по п.1 для диагностики, профилактики или лечения гиперпролиферативного заболевания, связанного с экспрессией, сверхэкспрессией и/или гиперактивностью AXL.
16. Способ получения моноклонального антитела или его антигенсвязывающего фрагмента по п.1, включающий стадию выделения моноклонального антитела или его антигенсвязывающего фрагмента из клетки-хозяина по п.14.
17. Способ диагностики гиперпролиферативного заболевания, связанного с экспрессией, сверхэкспрессией и/или гиперактивностью AXL, включающий контакт образца с моноклональным антителом или его антигенсвязывающим фрагментом по п.1, и обнаружение наличия AXL.
18. Способ профилактики или лечения состояния, связанного с экспрессией, сверхэкспрессией и/или гиперактивностью AXL, у пациента, включающий введение пациенту, нуждающемуся в таком введении, эффективного количества, по меньшей мере, моноклонального антитела или его антигенсвязывающего фрагмента по п.1.
19. Применение моноклонального антитела или его антигенсвязывающего фрагмента по п.1 для изготовления фармацевтической композиции для лечения устойчивого к лекарственным средствам злокачественного новообразования, связанного с экспрессией, сверхэкспрессией и/или гиперактивностью AXL.
20. Применение моноклонального антитела или его антигенсвязывающего фрагмента по п.1 для изготовления лекарственного средства для совместного введения с антинеопластическим агентом для лечения гиперпролиферативного заболевания, связанного с экспрессией, сверхэкспрессией и/или гиперактивностью AXL.
21. Фармацевтическая композиция для диагностики гиперпролиферативного заболевания, связанного с экспрессией, сверхэкспрессией и/или гиперактивностью AXL, содержащая эффективное количество моноклонального антитела или его антигенсвязывающего фрагмента по п.1.
22. Фармацевтическая композиция для профилактики или лечения гиперпролиферативного заболевания, связанного с экспрессией, сверхэкспрессией и/или гиперактивностью AXL, содержащая эффективное количество моноклонального антитела или его антигенсвязывающего фрагмента по п.1.
23. Фармацевтическая композиция по п.21 или 22, где указанное заболевание выбирают из группы, состоящей из рака молочной железы, рака легких и других злокачественных новообразований, связанных с экспрессией или сверхэкспрессией AXL, и образования опухолевых метастазов, дополнительно содержащая активный агент.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| LAY J.-D | |||
| et al., "Sulfasalazine Suppresses Drug Resistance and Invasiveness of Lung Adenocarcinoma Cells Expressing AXL", Cancer Res (апрель 2007); 67(8):3878-3887 | |||
| O′BRYAN J.P | |||
| et al., "The transforming receptor tyrosine kinase, Axl, is post-translationally regulated by proteolytic | |||
Авторы
Даты
2014-02-10—Публикация
2008-11-12—Подача