Изобретение относится к медицине, биологии, микробиологии, именно к исследованию микорбосодержащих материалов и продуктов их жизнедеятельности путем определения их физических и химических свойств, и может быть использовано в промышленных, пищевых и медицинских биотехнологиях.
Возможность определения видов микробов и их концентраций в суспензии на основе лазерного спектрально-флуоресцентного анализа представляет практический и теоретический интерес, поскольку может стать основой диагностики заболеваний микробной этиологии.
Известен способ диагностики микробов и сложных аминокислот, заключающийся в том, что в нем используют в качестве диагностической информации спектральные интегральные интенсивности индуцированной лазером флуоресценции микробов, на основе которых констатируют наличие микробов и их концентрацию. Суспензия микробов представляет собой смесь люминесцирующих и нелюменисцирующих молекул. При специфических условиях возбуждения удается в способе реализовать преимущественное возбуждение макромолекул биологических контаминантов, по чему судят о наличии живых и полуживых микробов. Используя спектральное разложение и интегрирование по отдельным участкам можно делать вывод об аэробном или анаэробном характере микробной популяции (Александров М., Воробьев А., Полянский Е., Филатов М., Мищенко И., Багрянова Г. Лазерная флуоресцентная диагностика в медицине, пищевой промышленности, индустрии, экологии. 2003. // Электроника: НТБ 3/03) [1].
Способ позволяет предсказать распространение патологического процесса микробной природы уже на стадии его начального развития на основе флуоресцентной индикации возбудителей болезни, обладает высокой чувствительностью и позволяет определять преимущественную аэробность или анаэробность возбудителей, а также обладает экспрессностью проведения диагностики.
Однако этот способ обладает следующими недостатками: не предоставляет достаточной информации о видовой специфике микробов и сложных аминокислот и не позволяет вычислить концентрацию конкретного вида микроба, особенно в микробных ассоциациях, что не обеспечивает дифференциальную диагностику микробов и сложных аминокислот.
Известен также способ, являющийся стандартным методом количественного и качественного спектрально-эмиссионного анализа биологических объектов химического состава их вещества и который состоит в обнаружении и оценке характерных узкополосных особенностей в спектрах флуоресценции. Концентрацию выбранного исследуемого химического субстрата в этом методе оценивают с помощью измерения интенсивности конкретных полос флуоресценции, используя градуировочные кривые, получаемые на этапе градуировки. Эти процедуры проводят на приспособленном для этого диагностическом комплексе, включающем в себя тракт лазерного возбуждения образца, измерительный тракт, спектранализатор и ЭВМ, содержащем программное обеспечение обработки спектров и базу данных градуировочных кривых. Градуировочные кривые получают на этапе обучения на спектрах флуоресценции образцов с известным химическим содержимым (Э.А.Свириденков. Люминесцентный анализ, М., 1961). [2]
Этот метод позволяет проводить количественный и качественный анализ газообразных веществ, а также некоторых минеральных веществ в конденсированной фазе.
Однако этот метод обладает следующими недостатками: трудно применять этот метод для аналитической оценки флуоресцирующих органических суспензий и с помощью него нельзя определить микробиологический состав суспензии. Определение параметров микробов по данным спектрального анализа этим методом, учитывающим выделенные значения на отдельных длинах волн, невозможно из-за сильного перекрытия спектральных полос отдельных молекул. Эти недостатки обусловлены особенностью микробосодержащего вещества, выражающиеся в том, что флуоресценция входящих в них органических веществ имеет специфику, вследствие которой подобные спектрально-аналитические методы малопригодны для идентификации, так как флуоресцентные спектры таких объектов имеют контуры, не имеющие каких-либо ярко выраженных, узкополосных характерных особенностей. Помимо многокомпонентности биологического субстрата, спектры флуоресценции неспецифичны вследствие однородного и неоднородного уширения линий, присущих конденсированной фазе вещества.
Наиболее близким по технической сущности к предлагаемому изобретению является способ лазерно-флуоресцентной диагностики, заключающийся в том, что лазерно-флуоресцентная диагностика (ЛФД) суспензий микробов была дополнена процедурой обработки спектров при помощи искусственных нейронных сетей. Для нужд дистанционного мониторинга и мониторинга в режиме реального времени образцов из приповерхностных слоев водоемов используется техника измерения спектров флуоресцентного отклика небольшого объема воды в приповерхностном слое при дистанционном облучении лазером. Излучение собирают при помощи телескопической системы и направляют на спектроанализатор. Полученные спектры обрабатываются предварительно обученной искусственной нейронной сетью с целью получения информации о видах живых микроорганизмов в этой воде (И.В.Гердова, С.А.Доленко, Т.А.Доленко, И.Г.Персиянцев, В.В.Фадеев, И.В.Чурина. Новые возможности в решении обратных задач лазерной спектроскопии с применение искусственных нейронных сетей. 2002. // Известия Российской Академии Наук, Серия физическая, 2002, т.66, 8, с.1116-1124) [3].
Способ позволяет экспрессно измерять специфическую населенность суспензии микробами и микроорганизмами.
Однако предлагаемый способ обладает следующими недостатками: вычисление концентраций происходит с ошибками и обладает плохой воспроизводимостью. Это происходит по причине переопределенности моделирования концентраций бактерий искусственными нейронными сетями, вследствие которой результаты обработки будут содержать большую долю статистически необоснованных компонент и ошибок, из-за чего происходит часто неверное вычисление концентраций видов организмов (О.Е.Родионова, А.Л.Померанцев. Хемометрика в аналитической химии) [6].
Техническим результатом предлагаемого изобретения является устранение видовой неспецифичности и повышение аналитической специфичности лазерной флуоресцентной диагностики микробов и сложных аминокислот, а также повышение точности и скрининговой информативности способа как местных, так и удаленных биологических объектов, экспрессности и систематичности, определение видов микробов, концентрации в суспензии каждого из них как в чистых культурах, так и в микробных смесях.
Указанный технический результат достигается тем, что в способе дифференциальной диагностики микробов и сложных аминокислот для определения ведущего микроба, конкурирующих ассоциантов и сложных аминокислот по спектру их флуоресценции с помощью специального программного обеспечения диагностического комплекса, сравнивающего хранящиеся в базе данных комплекса спектры известных образцов суспензий с микробами и спектр микроба для анализа микробосодержащих субстратов и продуктов их жизнедеятельности, используют значения спектральной интенсивности во всем спектральном диапазоне аппаратуры оптического диапазона, при этом производимую на этапе наладки комплекса процедуру обучения модели концентраций микробов проводят программно реализуя получение статистической модели концентраций микробов, формулируя ее в виде произведения специального вида градуировочной матрицы на вектор спектральных характеристик флуоресценции исследуемого образца, при этом градуировочную матрицу модели находят экспериментально с помощью хранящихся в базе данных комплекса спектров микробов и аминокислот через регрессию референтной информации о концентрациях микробов в образцах из базы данных на факторы главных компонент их спектральных характеристик, градуировочную матрицу приравнивают произведению матрицы коэффициентов регрессии на матрицу нагрузок главных компонент, затем на основе модели с помощью программного обеспечения производят вычисление концентраций микробов или аминокислот в диагностируемых образцах, на основе вычисленных концентраций в дальнейшем производят определение ведущего микроба по характеристическому концентрационному и видовому критерию, что определение концентраций специфических микробов и/или аминокислот производят на различных этапах диагностического процесса, связанного с микробами или аминокислотами, применительно к биотехнологиям с применением стандартных техник флуоресцентных спектроскопических измерений и что в глобальном варианте реализации дифференциальной диагностики с помощью дистанционных методов по спектрам лазерно-индуцированной флуоресценции определяют обсемененность микробами близких или удаленных проб, при этом диагностический комплекс стоит из единого блока анализа информации, обрабатывающего спектры флуоресценции сразу нескольких блоков, измеряющих эти спектры и передающих свою информацию для обработки блоку анализа по локальным или глобальным сетям связи с использованием стандартных протоколов, в том числе и протоколов шифрования.
Описание способа
В предполагаемом изобретении способ лазерной флуоресцентной спектроскопии, используемый для получения спектральных зависимостей флуоресценции микробов и сложных аминокислот в условиях возбуждения, учитывающих физико-химическую специфику биомолекулы и ее окружения, объединен с математико-статистическим аппаратом линейного анализа главных компонент в качестве основы экспресс-диагностики в области медико-биологических приложений. При этом достигнуты преимущества: повышенная экспрессность, повышенная специфичность и улучшенное качество информации. Диагностика микробов по предлагаемому методу производится следующим образом. Берется проба микробов и/или сложных аминокислот и помещается в стандартную пробирку или на стандартную контактную поверхность; далее у содержимого этой пробирки с помощью диагностической установки измеряется спектр флуоресценции с последующей регистрацией характеристик рассеяния и поглощения и с помощью программы вычисляется концентрация известных видов бактерий. Полученные данные применяются для целей, усмотренных надобностью подобной диагностики для клинических целей (фиг.7, 8). В зависимости от вида сред и метода съема программное обеспечение использует соответствующие им эмпирические градуировочные матрицы, хранящиеся в базе данных ЭВМ. Получение градуировочных матриц в методе происходит на этапе обучения модели распознавания микробов и сложных аминокислот в заданном типе исследуемого субстрата с реализацией процедуры регрессии на главные компоненты, которую проводят до практического применения налаженного диагностического комплекса. Для упрощения понимания принципа применения способа и следования потока данных до окончательной постановки диагностики на фиг.1 приведена его блок-схема.
Идея распознавания неизвестного образца по результатам вычислительного сравнения с известными образцами лежит в основе другого подхода к реализации дифференциальной диагностики, основанного на программировании искусственных нейронных сетей. Принцип предлагаемого способа отличен от такового при использовании программного продукта в виде нейросетей. При прогнозировании вместо схемы устойчивых связей, полученных в обучении в случае нейросети в способе модель руководствуется вектором уровней статистической значимости детектируемых физических характеристик исследуемого образца. Данный способ имеет преимущество перед упомянутым по устойчивости, успешности распознавания, воспроизводимости и точности.
Специфическая спектрально-флуоресцентная диагностика без применения маркирующих добавок, к которой применяется способ, является видом флуоресцентной диагностики. Ее применение сопряжено с использованием спектроснимающей аппаратуры. Диагностические установки для ЛФД снабжены автоматическим интерфейсом для ЭВМ. Это реализуется применением многоканальных светочувствительных элементов и аналогово-цифровых преобразователей, передающих спектральный сигнал с каждого канала, являющийся аналогом спектральной интенсивности на определенном участке спектра, на входной канал компьютера в понятной ему форме. Таким образом, применение метода происходит при участи соответствующе подобранного аппаратного и написанного к нему программного обеспечения специальной установки (фиг.2) для лазерно-флуоресцентной диагностики, представляющей собой лазер L с соответствующе подобранной длиной волы генерации, раздвоенный оптический кабель с волокнами для подвода возбуждающего излучения Fa к анализируемому образцу и снятия флуоресцентного отклика и подвода его к спектроанализатору Flif, спектроанализатора М, сотоящего из оптического фильтра на длину волны накачки F, диспергирующего элемента, и многоканального полупроводникового детектора FD, усилителя электрического сигнала, АЦП (DT) и ЭВМ (PC), имеющего программное обеспечение для обработки и хранения спектральной информации. Программное обеспечение написано по алгоритму, позволяющему на основе базы данных и снятого спектра оценивать видовой и количественный состав микробов в виде концентрации специфического вида микроорганизма. Этот алгоритм позволяет проводить количественный специфический анализ микробосодержащего биологического субстрата (МБС) или аминокислот по их спектральной информации посредством реализации линейной регрессии на главные компоненты (ГК) спектральных характеристик. ГК и коэффициенты регрессии хранятся в базе данных и являются статической невычисляемой в ходе процедуры диагноза информацией.
Имеется много задач, схожих решаемой в данном способе задаче. Их общей концептуально-методологической направленностью является распознавание неизвестного образца по его некоторым диагностическим характеристикам на основе данных, полученных из образцов с известными диагностическими досье. Диагностическими характеристиками могут являться различные физические свойства, измеряемые при помощи диагностической аппаратуры. В дальнейшем они будут обозначаться как признаки. Последовательные этапы применения метода для диагностического комплекса построены и упорядочены в согласии с логикой идеи задачи распознавания.
Задача распознавания ставится следующим образом. Исходной информацией для задачи распознавания являются описания объектов Sj (j=1, …, n), в виде признаков хi, (i=1, …, k), характеризующих различные стороны-свойства объекта Sj. Набор признаков образует вектор
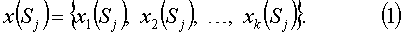
У каждого из объектов Sj, принадлежащих множеству объектов S, существует "основное свойство" y(Sj), которое для части объектов S':

предполагается известным. Значение переменной, описывающей данное свойство, принимает известное численное либо логическое значение. Для остальной части объектов S/S' из S:
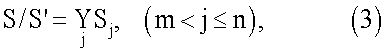
основное свойство является неизвестным. Процедура распознавания предполагает наличие обучающей или эталонной выборки, включающей в себя множество S' и совокупность соответствующих значений признаков y(S1), y(S2), …, y(Sm). Задача распознавания состоит в том, чтобы, используя информацию, содержащуюся в эталонной или обучающей выборке, определить значения свойства y(Sj) для выбранного объекта Sj из S/S' с максимальным уровнем статистической значимости.
В данном случае в качестве распознаваемых параметров выступают концентрации некоторых нужных для диагностики видов микробов и/или сложных аминокислот по спектрам флуоресценции микробосодержащего биологического субстрата.
Этапы способа и их содержательные описания
1. Обучение комплекса (тренировка модели концентрации микробов)
Спектроскопическую информацию об образце можно представить в виде векторной величины большой размерности, равной числу каналов спектроскопического датчика. Каждая координата в пронумерованном порядке равна значению сигнала на соответствующем канале. Если данную операцию проделать для большого количества спектров, то получается набор векторов, которые можно собрать в матрицу - матрицу данных. В силу схожести и различия в химическом составе образцов, их спектры будут иметь корреляции в определенных спектральных диапазонах. Эту корреляцию можно использовать для уменьшения количества значимых единиц информации, описывающей данные спектры, т.е. уменьшения размерности пространства векторов спектральных характеристик через замену исходной совокупности, разложенной по каналам датчика спектральной информации совокупностью меньшего числа конечных параметров, выражающих первые по выявленным и зафиксированным закономерностям. Эта процедура производится с помощью известного метода главных компонент (МГК). До применения МГК часто приходится корректировать спектральные данные с учетом поглощающих и рассеивающих свет свойств субстрата. Тогда спектр флуоресценции образца программно восстанавливается с учетом дополнительно снятого спектра поглощения и рассеивания по закону, подобранному для конкретной геометрии возбуждения и снятия данных.
МГК в применении к измерениям флуоресценции микробов состоит в следующем. Исследуется достаточно большое количество образцов микробов и полученные спектры собираются с матрицу через трансформацию дискретных спектров в векторное представление (вектор признаков).
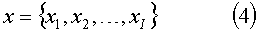
где x1, x2, …, xI - значения спектральных мощностей на длинах волн, соответствующих 1, 2, …, I каналам спектроанализатора.
Матрица данных собирается по строкам, где каждая строка есть вектор признаков отдельного образца. Таким образом матрица (матрица данных) будет иметь размер по столбцам, равный количеству каналов в спектрах (размерности пространства векторов признаков) и по строкам - количеству образцов. Матрица данных далее центрируется, поскольку преобразование матрицы данных в этом методе не содержит свободных членов. Это имеет важное практическое значение, позволяя, избавится от постоянной составляющей показаний спектрометра как от систематической ошибки. Далее матрица данных раскладывается на три матрицы согласно формуле:

F - матрица факторов главных компонент, Q - матрица нагрузок главных компонент, Е-матрица остатков. Матрица факторов, представляющая набор конечных параметров, имеет размер по столбцам меньший, чем у матрицы данных. Этот размер определяет количество главных компонент (ГК), принимаемых для расчета. Считается, что матрица остатков имеет р-нормальное распределение элементов, отличающихся от нуля на незначительное значение по сравнению с матрицей F. Количество ГК выбирается достаточным для обеспечения максимально низкой величины дисперсии остатков Е и не слишком большим для избегания переоценки модели и неустойчивости диагноза, для этого хорошо подходит критерий Кэттеля [4].
Матрица факторов главных компонент представляет собой набор значимых параметров спектральных данных от заданного типа суспензий. С помощью нее можно перейти от изначальных спектров со многими схожими между собой чертами к представлению спектральных особенностей каждого образца в виде факторов. Таким образом, для каждого образца вычисляется индивидуальный набор определенного общего количества значимых параметров. Представление в виде факторов спектральной информации образцов эквивалентно начальному представлению в виде спектров, поскольку в соотношении (5) они явно выражают начальную совокупность данных за вычетом несущественной бесструктурной информации, выражающей априори ошибки зашумленности спектров фотонными флуктуациями и небольшими случайными вариациями оптических свойств образца. При этом оно имеет преимущество в отсутствии сингулярности матрицы факторов. Это преимущество позволяет с хорошей точностью вычислять градуировочные коэффициенты для спектральных компонент посредством определения коэффициентов регрессии референтной обучающей информации на факторы главных компонент, что невозможно для имеющей сильную интеркорреляцию матрицы спектральных данных. Коэффициенты регрессии связаны с коэффициентами градуировки через матрицу нагрузок главных компонент, определяющую соотношения между факторами и спектральными признаками. Размер матрицы нагрузок подобран таким образом, что число столбцов равно числу главных факторов, а число строк равно числу спектральных признаков. Факторы имеют нумерацию по убыванию уровня их статистической значимости.
Процедура анализа главных компонент, состоящая в разложении матрицы данных по выраженной в (5) форме, может быть реализована любым из имеющихся стандартных алгоритмов такого анализа. Например, это алгоритм NIPALS (Martens H., Naes Т. Multivariative calibration. 1998, Willey) [5].
Чтобы с помощью факторов главных компонент вычислять концентрации неизвестных образцов, производят регрессию референтной информации о концентрациях микробов или сложных аминокислот в образцах обучающей выборки на главные компоненты матрицы данных спектральных признаков образцов обучающей выборки.
В представленной модели считается, что концентрации микробов по флуоресцентным данным численно равны линейной суперпозиции факторов главных компонент. Коэффициенты суммирования факторов определяются при помощи аппроксимации искомой зависимости референтных данных обучающей выборки от факторов их линейной функцией с добавлением дополнительного члена в состав аргументов линейной функции, численно равного единице, методом наименьших квадратов. При этом для определения каждого вида микробов определяется своя совокупность коэффициентов регрессии.
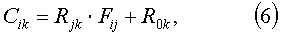
где Cik - референтная информация (элемент матрицы концентраций) о k-й компоненте микробов или сложных аминокислот в i-м образце обучающей выборки, Rjk - коэффициенты регрессии j-й ГК на концентрационную шкалу k-й компоненты микробов или сложных аминокислот, R0k - постоянное смещение для шкалы концентрации k-й компоненты микробов или сложных аминокислот, Fij - фактор j-й ГК для i-го образца, являющийся информацией, получаемой в результате анализа ГК спектров ансамбля образцов микробов или сложных аминокислот.
Эта процедура производится по стандартному алгоритму метода наименьших квадратов (МНК) [5].
Градуровочная матрица равна произведению матрицы коэффициентов регрессии на матрицу нагрузок главных компонент, дополненную вектором единиц.
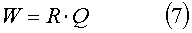
2. Определение концентраций микробов или сложных аминокислот в неизвестном образце
Диагностика неизвестного образца микробов или сложных аминокислот производится следующим образом. Берется проба из микробов или сложных аминокислот и помещается в стандартную пробирку, далее, у этой пробирки с помощью диагностической установки измеряется спектр индуцированной лазерным излучением флуоресценции и с помощью программы вычисляются наличие и концентрация известных видов микробов. Для оптически не чистых образцов спектр флуоресценции образца программно восстанавливается с учетом дополнительно снятого спектра поглощения и рассеивания по закону подобранному для конкретной геометрии возбуждения и снятия данных. Для этого неизвестного образца программа вычисляет концентрации проекцией центрированного вектора его признаков (спектр) на градуировочную матрицу W (7) и определяет по критерию наличие микроба.
Полученные данные применяются для целей, усмотренных надобностью подобной диагностики (фиг. 6, 7).
3. Определение вида микроба по концентрационному или нозологическому критерию.
По референтным диагностическим данным эталонного набора образцов и результатам пункта 2 находятся динамические пределы изменения вычисляемой концентрации микроба или в альтернативном варианте, специфические для диагностируемой болезни пределы изменений факторов главных компонент. При диагностике новых образцов по принадлежности их указанных концентрационных или статистических параметров данным динамическим пределам делается вывод о положительном диагнозе и при выходе параметров за эти пределы ставится отрицательный диагноз болезни вызываемой данным микробом.
4. Наблюдение за производственным процессом
Данная реализация получается при использовании специальных стандартизованных емкостей как замкнутого, так и проточного типа. В первом варианте продукт, на какой-либо стадии производства исследуется пробой пробы и заключается в стандартную емкость. Эту емкость помещают в крепление для снятия спектра, где с помощью лазера возбуждают флуоресценцию образца и снимают ее спектр, занося на ЭВМ. Далее с помощью программного обеспечения и соответствующей базы данных определяют концентрацию различных видов микробов в смеси. Во втором варианте емкость непосредственно встроена в технологический тракт и имеет окно для возбуждения и наблюдения флуоресценции. Далее последовательность шагов как в первом варианте.
5. Рекомендации по лечению пациента, проба которого исследуется этим методом, и определение более точных критериев для дальнейшего использования комплекса.
Проба, взятая у пациента, исследуется на наличие ведущего микроба с помощью метода в пунктах 2-3. По результатам наблюдения назначаются антибиотики и антисептики для лечения пациента от обнаруженного вида болезни. По результатам некоторого количества актов лечения определяется неточность постановки диагноза и корректируются динамические пределы изменений концентрационных и статистических параметров. Делаются более точные рекомендации по использованию лекарственных препаратов. Тем самым производится двухэтапное замыкание так называемой триады Паскаля. Также с помощью данной процедуры определяются наиболее эффективные из имеющихся лекарственных препаратов.
6. Диагностика нужна для контроля зараженности пищевых продуктов специфическими видами микробов.
Модель для вычисления концентраций в пункте 1 обучается на образцах, приготовленных на исследуемом типе пищевых продуктов в качестве субстрата, и по пункту 2 определяется концентрация специфических видов микробов в образцах, взятых из диагностируемых продуктов выбранного типа. Определяется свежесть или заряженность продуктов холерой, тифом, ботулизмом и прочими микробами, что позволяет в режиме реального времени контролировать свежесть продуктов и предотвращать заболевания, связанные с патогенными микробами в пище.
7. Удаленная диагностика объектов с целью определения их микробной обсемененности (фиг.8).
Для диагностики образцов микробов или сложных аминокислот, измерение спектров индуцированной лазерным излучением флуоресценции которых производится на расположенных на удаленных географических территориях диагностических установках, используются локальные и глобальные сети, при котором снятие диагностических данных производится на дистанционно расположенной диагностической установке, далее эти данные передаются по локальным и глобальным сетям связи с использованием стандартных протоколов, в том числе и протоколов шифрования, расположенному на головном ЭВМ серверу. Программа, находящаяся на головном ЭВМ и реализующая по пунктам 1-2, с использованием имеющейся на головном ЭВМ базы данных градуировочных матриц и спектров, вычисление наличия и концентрации микробов и сложных аминокислот, использует полученные от удаленного диагностического комплекса диагностические данные для определения микробов или сложных аминокислот в диагностируемом удаленном образце и по пунктам 3-6 выдает обработанную нужную информацию по сети связи соответствующему диагностическому комплексу. Эта информация используется для целей диагностики микробов или сложных аминокислот, лечения пациента, контроля пищевых и промышленных объектов на удаленной географической территории.
Производится также удаленное зондирование с помощью известных способов дистанционного съема лазерно-индуцированной флуоресцентной спектроскопической информации и пунктов 1-2. Для оптического возбуждения удаленного объекта применяют оптическую систему наведения луча лазера на объект. Для снятия спектральной информации флуоресценции объекта применяют телескопическую систему сбора и фокусировки света флуоресценции объекта на входную щель спектроанализатора. Полученные спектры обрабатываются согласно способу.
8. Повышение точности и надежности диагностики микробов и сложных аминокислот при использовании флуоресцентного микроскопа.
В предлагаемом способе предполагается дополнительно повысить точность и надежность идентификации бактерий по спектрам их флуоресценции за счет анализа спектров единичных бактерий. Можно предложить следующую схему установки (фиг.3).
Здесь поляризованное излучение эксимерного лазера направляют в кювету с исследуемым образцом. Излучение флуоресценции единичной бактерии через поляризатор и спектральный фильтр попадает в микроскоп, снабженный CCD-камерой. RGB-сигнал камеры служит своеобразной хэш-таблицей исследуемого образца, фильтра и длины волны возбуждения. Компьютер сравнивает этот сигнал с имеющейся библиотекой и определяет вид бактерии. Зная объем кюветы и посчитав «поштучно» бактерии, вычисляют их концентрацию. В некоторых случаях степень деполяризации может уточнить и дополнить сигнал.
Пусть ультрафиолетовый лазер освещает поле микроскопа размером 1х1 мм и суммарная энергия излучения здесь 1 мДж. Пусть в этом поле находится одна бактерия размером 10 мкм и в эмиссию флуоресценции преобразуется примерно 10% падающей энергии (у многих органических веществ эта эффективность более 90% и в расчете приводятся заведомо худшие условия для флуоресценции). Если волна излучения эксимерного лазера 248 нм (KrF), то из общего числа фотонов в поле микроскопа 1015 на бактерию «упадет» примерно 1011 и даже если объектив и оптическая система микроскопа передадут на камеру только 1% сигнала флуоресценции, то примерно 108 фотонов попадут на детектор (камеру). Это очень большой сигнал, особенно с учетом того, что квантовая эффективность современных научных CCD камер достигает 30% и они способны регистрировать отдельные фотоны. Даже при минимальном размере бактерии 1 мкм примерно 106 фотонов попадут на детектор.
Таким образом, сигнала оказывается достаточно не только для регистрации спектра отдельной бактерии, но и для применения дополнительных методов спектрального или поляризационного разделения сигналов и спектров флуоресценции. При этом теоретически возможно получить всю информацию за один импульс лазера без накопления сигнала. Кроме того, эксимерные лазерные обладают дополнительным преимуществом в виде нескольких длин волн излучения на одном приборе, поскольку просто смена состава газовой смеси позволяет получать на одном устройстве излучение с длиной волны 193 нм (ArF), 222 нм (KrCl), 248 нм (KrF), 308 (XeCl) и 353 (XeF). Изменение длины волны возбуждения изменит спектр флуоресценции без существенного изменения энергетических параметров лазера. То есть появляется дополнительная возможность идентификации бактерий.
Примеры выполнения способа.
1. Обнаружение ведущего микроба по спектрам флуоресценции образцов определенного типа микробов.
С целью специфической диагностики микробов в отношении ведущего микроба, имеющего наибольшую концентрацию в исследуемом субстрате, провели измерение спектров 5 видов микробов в отдельности и в смеси. Полученные спектры использовали для определения градуировочных матриц модели концентраций микробов в среде способом дифференциальной диагностики микробов. Применение способа включает в себя вычисление главных компонент спектральных характеристик флуоресценции и последующую регрессию матрицы концентраций на главные компоненты. Полученную в результате анализа градуировочную матрицу использовали для нахождения концентраций микробов в образцах из проверочной выборки и определения ведущего микроба. Результаты исследований свидетельствуют о приемлемой частоте правильного диагноза.
Образцы из проверочной выборки имели известный видовой состав. Этот видовой состав нужен для сравнения результата применения метода по спектрам флуоресценции. Для этого спектры флуоресценции перемножаются на градуировочную матрицу и полученная в результате перемножения матрица распознанных концентраций сравнивается по структуре с матрицей известных концентраций микробов в этих образцах. Они представлены на фиг.4, где были анализированы концентрации этих пяти видов микробов и рядом с таблицей приведены известные концентрации по микробиологическим данным. Результат такого сравнения дает удовлетворительные совпадения для образцов, содержащих ведущий патоген в концентрации >108 и посредственный в концентрации <108. Однако дальнейшее развитие точности способа позволит определять специфичность с более низким концентрационным порогом обнаружения.
Приложение к примеру:
Микробные смеси и чистые культуры микробов приготовляли из высевов на питательных средах, которые содержали одинаковую основу. Часть образцов содержала микробы только одного вида (обучающая выборка), а часть образцов содержала различные виды микробов в смеси (проверочная выборка). У всех образцов измеряли спектры флуоресценции при возбуждении излучением лазера с длиной волны 633 нм. Спектры образцов из обучающей выборки собрали в специальную матрицу, содержащую спектры, имеющие определенное количество дискретных позиций спектральной мощности по длине волны, в качестве строк. С применением процедуры анализа главных компонент выявили факторы и нагрузки главных компонент матрицы данных в виде отдельных матриц. Для этой группы образцов была информация о количественном и видовом составе населенности микробов, которую удобно для последующего анализа собрать в матрицу концентраций, которая определялась по строкам номерами образцов а по столбцам - номерами анализируемых видов микробов. Эта матрица с помощью процедуры регрессии связывалась в линейный закон зависимости с матрицей факторов методом наименьших квадратов. Полученная матрица связи, определяющая закон нахождения концентраций по факторам, умножается на матрицу нагрузок главных компонент. Результат этой операции дает градуировочную матрицу концентраций для спектров флуоресценции.
2. Определение наличия и концентрации микобактерий разных видов в чистом виде и в смеси.
С целью определения конкретного вида микобактерий в суспензии, состоящей из пяти видов, произвели процедуру обучения модели на образцах с чистыми культурами в физрастворе. Далее составили две смеси с различными видами микобактерий и сняли спектры флуоресценции этих суспензий. С помощью программы, использующей градуировочную матрицу модели, на компьютере вычислили концентрации пяти видов бактерий микобактерий.
Образцы с чистыми культурами бактерий приготовляли из посевов на питательных средах. Эти пять видов микобактерий имеют номенклатурные обозначения следующие: М.Avium, М.Vaccae, Tuberculosis(H37), М.Intracellulare и М.Kansasii. Смыв со сред растворяли в физрастворе и помещали в стандартные пробирки. Эти пробирки ставились в измерительный тракт диагностической установки и, возбуждая образцы излучением He-Ne лазера на длине волны 633 нм, подводимого к образцу по оптоволокну, снимали спектры их флуоресценции. Спектры некоторых из них приведены на фиг.5. Однако модель, построенная по предлагаемому способу, способна определить принадлежность этих спектров определенным видам микробов и определить их долю в смесях.
Для получения градуировочной матрицы провели процедуру регрессии на главные компоненты согласно способу. В использовавшейся референтной информации о концентрациях предполагали, что в образцах с наиболее густыми суспензиями концентрации составляли 1000 единиц. Это связано с тем, что отсутствует стандарт мутности для микобактерий в этих концентрациях, по которой обычно определяется концентрация разведении чистых культур для других видов микробов.
По пяти образцам с чистыми культурами и двумя образцами со смесями микобактерий определяли способность модели определять концентрации бактерий по их спектрам флуоресценции. Спектры флуоресценции этих образцов снимались в аналогичных условиях, что и для образцов обучающей выборки. Далее на компьютере, следуя модели, вычислили концентрации микобактерий в этих образцах. Результаты вычисления приведены на фиг.6. Здесь по горизонтали отложены определяемые виды бактерий а по вертикали - конкретные образцы. В двух последних образцах, обозначенных Mix1 и Mix2, присутствовали соответственно М.Vaccae, М.Intracellulare и М.Avium, M.Intacellulare, М.Kansasii. Как видно из таблицы, вычисленные концентрации довольно хорошо показывают качественный состав и в пределах ошибки измерений - количественный.
На первый взгляд, как уже отмечалось, спектры флуоресценции микробов обладают малой специфичностью. Для модели эта специфичность достаточна, для того чтобы определить наличие в образцах разных видов микобактерий. Это демонстрирует приведенная на фиг.6 таблица, а также составляющие градуировочную матрицу весовые функции, служащие законом линейного отображения центрированных спектральных характеристик образца на нормированные шкалы концентраций, принадлежащих конкретным видам микробов. На фиг.7 приведены две весовые функции для микобактерий М.Tuberculosis H37 и М.Avium. Сильное отличие их друг от друга, а также таковых для всех микобактерий, обусловлено тем, что имеется ощутимое отличие в спектрах флуоресценции чистых культур. Эти функции также показывают на каких спектральных диапазонах имеются характерные особенности в спектрах, отличающие бактерии друг от друга. Для большей точности вычислительная модель использует по алгоритму максимальное количество этих особенностей.
Концентрации разных видов микробов вычисляли с ошибкой, содержащейся в измерениях. Это неизбежно, так как используются для измерения аппаратурные узлы, имеющие собственные шумовые искажения, а также из-за того, что регистрируемое спектроанализатором фотонное поле содержит квантовые флуктуации. Все это в совокупности искажает снимаемые данные, и основанные на них вычисления будут давать тоже отличающиеся от действительности результаты. Ситуация усугубляется при малом структурном составляющем данных, обусловленным малым сигналом от микробного объекта. Для улучшения сигнала от образцов с суспензиями микробов провели дополнительные измерения с добавлением в приготовляемые образцы детергента, разрушающего защитную оболочку микробов и растворяющего их содержимое в окружающем субстрате. Этот процесс высвобождает флуоресцирующие молекулы, которые ранее не проявляли флуоресценцию из-за тушения флуоресценции внутри цитоплазмы. В результате вычислений по таким данным получились следующие концентрации, показанные на фиг.8. Здесь определение концентрации микобактерий туберкулеза дает неточное совпадение, что связано с некоторыми химическими изменениями при воздействии детергента на этот вид бактерий. Однако для отдельных других видов это определение удовлетворительно.
3. Специфическая диагностика туберкулеза по лазерно-флуоресцентному анализу плазмы крови пациентов.
С целью разработки экспресс-метода диагностики туберкулеза были проведены исследования на поиск информативных критериев инфицированности пациентов микобактериями туберкулеза по спектральным характеристикам флуоресценции. В результате найдены динамические поля величин, имеющих закон вычисления, определяемый эмпирической градуировочной матрицей.
В данной работе множество объектов S представлено определенным количеством пациентов клиники, плазма крови которых была протестирована методом ЛФД (один человек - один тест). Общая численность группы составляла 130 человек. Для каждого из лиц этой группы было установлено независимыми медико-биологическими исследованиями нозологическое досье, использовавшееся для нахождения основного свойства объектов по спектрам флуоресценции. Группа была разбита на две подгруппы: S' - обучающая подгруппа (60 человек) и контрольно-тестовая подгруппа (70 человек). После проведения анализа главных компонент на обучающей подгруппе были выявлены главные факторы модели и проведена привязка областей локализации полученных данных к заранее известному из досье типу заболевания. Данная привязка приводила к соответствующим регрессионным соотношениям. На контрольной подгруппе S/S' оценивалась эффективность распознавания заболеваний путем сопоставления данных модели факторного анализа, настроенной по S', и фактических данных, взятых у пациентов этой группы из их истории болезни.
В число испытуемых входили пациенты категории "практически здоровые", пациенты больные туберкулезом и пациенты с другими заболеваниями, включающими воспаление легких и гнойные процессы. Последняя группа именуется далее - "пациенты с другими легочными заболеваниями".
В случае спектрально-флуоресцентного анализа многомерный признак представляет собой спектр люминесцентного сигнала, оцифрованный в каждом спектральном канале ПЗС матрицы полихроматора. Полихроматор был включен в состав диагностического комплекса, имеющего лазер на длине волны генерации 532 нм для возбуждения образцов.
По завершении цикла тестирования оцифрованные спектры флуоресценции использовались в качестве исходных массивов для проведения анализа главных компонент и диагностики заболеваний в тестируемой группе. Типичные спектры лазерно-индуцированной флуоресценции проб, полученные при длине волны возбуждающего излучения 532 нм, приведены на фиг.9.
Как видно на фиг.9, измеренные спектры флуоресценции на вид практически лишены характерных спектральных особенностей и малопригодны для диагностики, непосредственно опирающейся на обнаружение флуоресцирующих ферментных центров, вырабатываемых патогенными бактериями. Вместе с тем, использование для анализа массива таких спектров метода главных компонент позволяет определить соответствующие классам диагностируемых заболеваний динамические поля значений параметров, которые описывают характерные пределы изменений этих параметров.
Процедура анализа главных компонент данных, накопленных в обучающей выборке, выявила наличие в пространстве признаков трех главных компонент (р=3) и соответствующих общих факторов, обуславливающих особенности измеренных спектров. Значение р=3, соответствует критерию Кэттеля [4], фиксирующего номер итерации, приводящей к максимальному замедлению убыли остаточной дисперсии.
В подпространстве общих факторов точки локализуются в областях, отвечающих определенному, известному из досье обучающей группы, диагностируемому заболеванию. При проведении предварительной компьютерной 3D-визуализации распределения, имитирующего локализацию экспериментальных точек в факторном подпространстве, эти области оказались вытянутыми и приближенно ориентированными вдоль одного направления. Следовательно, информация, существенная в отношении дискриминации объектов по классам диагностируемых заболеваний, содержится в координатах проекций этих точек на некоторую плоскость S, ортогональную найденному ориентационному направлению. Таким образом, задача распознавания сводится к определению и разделению 2D-областей локализации координат точек в S-плоскости для обучающей выборки с последующим отнесением объекта из контрольно-тестовой выборки к одной из этих областей.
На фиг.10 представлены диаграммы распределения экспериментальных точек в S-плоскости для обучающей выборки (4а) и для контрольно-тестовой выборки (4б). Начало 2D-системы координат в S-плоскости взято в точке пересечения с ориентационной осью. Ось Х для удобства представления выбрана параллельной плоскости первых двух ортов факторного пространства: связь Х-проекции и координат образца f1, f2 в факторном базисе задана соотношением
 .
.
Десятикратное "растяжение" значений f2 имеет целью компенсацию убыли собственного значения второго фактора по сравнению с первым и, соответственно, предотвращение сжатия области локализации точек в одном из направлений. С учетом сделанных замечаний связь Y-проекции в S-плоскости и координат образца f1, f2, f3 выражается соотношением
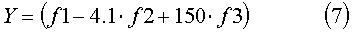 .
.
Данные, отображенные на фиг.10, представляют две группы испытуемых: практически здоровые пациенты и пациенты, больные туберкулезом. Видно, что области сгущения точек или динамические поля, найденные по обучающей выборке, имеют хорошее разделение в данном пространстве. По точкам контрольно-тестовой группы можно заметить, что доминирующая их часть лежит в определенных для своих групп полях. Это свидетельствует о приемлемой эффективности дискриминации пациентов по этим группам.
Вследствие большого разнообразия заболеваний, связанных с патогенной микрофлорой, в задачу диагностики входит не только дискриминация больных и здоровых, но и отделение больных одной нозологической группы от других. В соответствии с целями данного исследования, а именно создания экспресс-методики выявления больных зараженных туберкулезом, проведено сравнение спектральных параметров флуоресценции проб, взятых у туберкулезных больных, и группы больных с другими легочными заболеваниями. На фиг.11 представлены диаграммы распределения экспериментальных точек для группы больных туберкулезом и группы больных с другими легочными заболеваниями. Как и на фиг.10 здесь, соответственно, представлены результаты для обучающей (5а) и контрольно-тестовой (5б) группы. Как видно из представленной диаграммы, динамические поля туберкулеза и группы других легочных заболеваний также хорошо разделяются.
Подсчет количества точек в динамических полях S-плоскости позволил оценить статистическую значимость диагностической процедуры, вычисленную как относительная частота правильного заключения при постановке диагноза в полном наборе проб контрольно-тестовой группы. Уровень выявления заболевания туберкулезом по результатам мониторинга с однократным отбором проб в контрольно-тестовой группе составил 80%.
4. Сетевая мультитерминальная компьютеризированная система индивидуальной экспресс-диагностики и экспертной оценки эффективности лечения заболеваний и процессов микробной природы
Для проведения диагностики заболеваний микробной этиологии применяется методика получения физико-химической информации проб с помощью явления лазерно-индуцированной флуоресценции, основанная на прямой обработке снимаемой информации в режиме реального времени и без применения сложной аппаратуры, что позволяет применять ее для многих случаев, где это не было достижимо по многим критериям обычными методами. Например, для обнаружения патогенных микроорганизмов в среде с необходимой скоростью этот способ подходит больше всех, что дает его основное преимущество и ряд других преимуществ.
В лазерно-флуоресцентной диагностике спектральные исследования в основном варианте проводят на экспериментальном лазерном волоконном многоканальном спектроанализаторе, который в результате измерений дает спектр индуцированной лазером флуоресценции в определенном спектральном диапазоне. С помощью специального ПО компьютера полученные данные обрабатываются и отображаются на его мониторе в виде спектра. Спектры флуоресценции являются источником диагностической информации. Процесс экспресс-диагностики занимает не более минуты, и даже секунды.
Результат дифференциальной диагностики достигается тем, что в способе лазерной флуоресцентной диагностики микробов для определения ведущего микроба, конкурирующих ассоциантов и сложных аминокислот по спектру их флуоресценции с помощью специального программного обеспечения диагностического комплекса, с целью повышения чувствительности, точности, специфичности, информативности, применяют решения, заключающиеся в том, что для анализа используются значения спектральной интенсивности во всем спектральном диапазоне аппаратуры оптического диапазона. При этом производится на этапе наладки комплекса процедура обучения получение статистической модели концентраций микробов, формулируемой в виде произведения специального вида градуировочной матрицы на вектор спектральных характеристик флуоресценции исследуемого образца. На основе модели с помощью программного обеспечения производится вычисление концентраций микробов или аминокислот в диагностируемых образцах. На основе вычисленных концентраций в дальнейшем производят определение ведущего микроба по характеристическому концентрационному и видовому критерию. Все этапы процедуры диагностики реализуются программно на ЭВМ диагностического комплекса с участием пользовательского интерфейса.
Этот метод позволяет обеспечивать экспрессность, точность, информативность и экономическую целесообразность диагностики микробов и соответствующих нозологий.
Проводили экспериментальные измерения и проверку результатов программного обеспечения. Все измерения поведены по измерениям флуоресценции в спектральном диапазоне 650-800 нм при возбуждении флуоресценции гелий-неоновым лазером. Объектом исследования являлись 5 видов микобактерий, которые обозначены на приведенных иллюстрациях следующим образом: Мb.а - М. Avium, Mb.b - М. Vaccae, Mb.h -Tuberculosis(H37), Mb.i - М. Intracellulare, Mb.k - М. Kansasii. Сначала были приготовлены суспензии, состоящие из пяти видов указанных микробов, на основе которых произвели процедуру обучения модели на образцах с чистыми культурами в физрастворе. Далее составили образцы смесей с различными видами микобактерий и сняли спектры флуоресценции этих суспензий. С помощью программы, использующей градуировочную матрицу модели, на компьютере вычислили концентрации пяти видов бактерий микобактерий.
Образцы с чистыми культурами бактерий приготовляли из посевов на питательных средах. Смыв со сред растворяли в физрастворе и помещали в стандартные пробирки. Спектры некоторых из них приведены справа на фиг.12. На первый взгляд эти спектры отличаются лишь по величине общего сигнала, но не имеют качественных отличий. Однако модель, построенная по предлагаемому способу, способна определить принадлежность этих спектров определенным видам микробов и определить их долю в смесях. Это демонстрируют составляющие градуировочную матрицу весовые функции, служащие законом линейного отображения спектральных характеристик образца на нормированные шкалы концентраций, принадлежащих конкретным видам микробов. На фиг.12 слева приведены две весовые функции для микобактерий М.Tuberculosis H37 и М.Avium.
Результаты вычисления приведены на фиг.13. Здесь по горизонтали отложены определяемые виды бактерий а по вертикали конкретные образцы. В двух последних образцах, обозначенных Mix1 и Mix2, присутствовали соответственно М. Vaccae+М. Intracellulare и М. Avium+М. Intacellulare, + М. Kansasii. Как видно из таблицы (см. фиг. 14), вычисленные концентрации довольно хорошо показывают качественный состав и в пределах ошибки измерений количественный (концентрации условные, нормированные на 1000 единиц).
Для повышения чувствительности измерений были проведены измерения спектров лазерно-индуцированной флуоресценции образцов микобактерий, смешанных с детергентом, разрушающим клеточную стенку микробов и высвобождающих молекулы содержимого цитоплазмы (концентрации условные, нормированные на 10 единиц).
В образцах смеси присутствовали следующие микобактерий:
Mix1:Mb.b + Mb.I
Mix2: Mb.a + Mb.h. + Mb.I.
Mix3: Mb.a + Mb.h. + Mb.k.
Mix3: Mb.a + Mb.h. + Mb.k. + Mb.b.
В результате этих исследований была получена 60-70% эффективность определения микробов в смесях.
Для получения более достоверных данных об исследуемом объекте необходимо иметь четкое представление о его характеристиках поглощения, рассеяния, а также о вероятной концентрации в нем тех или иных флуоресцирующих веществ. Для повышения точности определения микробов и их концентраций в смесях по данному методу провели дополнительные измерения спектров пропускания образцов, с помощью которых восстанавливали спектры лазерно-индуцированной флуоресценции образцов. На основе восстановленных спектров вычислили концентрацию в образцах, обработанных детергентом, и сравнили с их содержимым, что демонстрирует таблица на фиг.15 (концентрации условные, нормированные на 1000 единиц).
В образцах смеси присутствовали следующие микобактерий:
Mix1: Mb.a. + Mb.h. + Mb.I.
Mix2: Mb.a + Mb.b. + Mb.I.
В результате этих исследований была получена 80-100% эффективность определения микробов в смесях, что доказывает увеличение эффективности при учете оптических характеристик среды.
Предлагаемый способ дифференциальной диагностики позволяет реализовать систему индивидуальной экспресс-диагностики и экспертной оценки эффективности лечения заболеваний микробных, когда с помощью дистанционных методов по спектрам лазерно-индуцированной флуоресценции определяют обсемененность микробами близких или удаленных проб, при этом диагностический комплекс стоит из единого блока анализа информации, обрабатывающего спектры флуоресценции сразу нескольких блоков измеряющих эти спектры и передающих свою информацию для обработки блоку анализа по локальным или глобальным сетям связи с использованием стандартных протоколов, в том числе и протоколов шифрования. См. схему сетевой мультитерминальной компьютеризированной системы индивидуальной экспресс-диагностики и экспертной оценки эффективности лечения заболеваний и процессов микробной природы (фиг.16). Данный способ обладает следующими преимуществами:
- практическое отсутствие расходных материалов,
- скрининг - при экспресс-оценке инфекционных заболеваний (туберкулез, СПИД, сифилис, холера и др.),
- диспансеризация населения с целью выявления заболеваний и процессов микробной природы и регистрации фоновых (контрольных) показателей различных биологических жидкостей (моча, слюна, кровь и др.) для создания паспорта здоровья населения,
- население получает современную высокоэффективную, экологически чистую технологию без применения расходных материалов и экономическую выгоду (стоимость одного анализа в 10-100 раз дешевле стандартных применяемых аналогов),
- экспресс-диагностика и оценка эффективности лечения дисбактериоза (страдает 90% населения),
- самообучаемость системы с достижением новых информативных возможностей, учитывающих изменения видов микроорганизмов в медицинских учреждениях, находящихся в разных климатических и географических условиях,
- слежение за ареалом распространения инфекции,
- экономическая целесообразность и существенное сокращение расходов на диагностику вследствие централизованности системы.
Система состоит из единого сервера и удаленных клиентов. Сервер содержит систематизированную библиотеки микробов как музейных, так и клинических штаммов и специальное программное обеспечение, проводящее диагностику и делающее рекомендации по лечению. Клиентами являются диагностические комплексы на удаленных локальных клинических объектах.
Часть клиентов выступает как в качестве потребителя информационных возможностей сервера, так и поставщика дополнительной уточняющей информации по изменчивым видам микроорганизмов.
Предлагаемый способ дифференциальной диагностики микробов и сложных аминокислот обеспечивает экспрессность диагностики: время диагностики определяется скоростью взятия пробы, а также временем снятия спектра флуоресценции и временем вычисления концентраций микробов, и определение ведущего микроба. Также он обеспечивает специфичность: позволяет в реальном времени на принципе обратной связи определять концентрации и наличие различных видов микробов в микс-системах (ассоциации), превышающих порог определения по концентрации, и улучшенное качество информации: использует все значения спектральных интенсивностей флуоресценции и определяет максимально структурную часть информации в спектральных данных, что повышает успешность диагностики.
Дешевизна: не требует применения дополнительных расходных материалов в качестве реактивов и маркеров.
На основе диагностики ведущего микроба дают рекомендации по лечению пациента, проба которого исследуется, затем проводят определение новых лечебных и диагностических критериев по отзывам о результатах процесса лечения, используя человека в качестве биологической модели; для экспрессного определения заболевания человека, связанного с микробной этиологией, применяют динамические пределы вариаций главных факторов для диагностики; определяют концентрации специфических видов микробов в определенном типе пищевых продуктов.
Литература
1. Александров М., Воробьев А., Полянский Е., Филатов М., Мищенко И., Багрянова Г. Лазерная флуоресцентная диагностика в медицине, пищевой промышленности, индустрии, экологии. // Электроника: НТБ 3/03
2. И.В.Гердова, С.А.Доленко, Т.А.Доленко, И.Г.Персиянцев, В.В.Фадеев, И.В.Чурина. Новые возможности в решении обратных задач лазерной спектроскопии с применение искусственных нейронных сетей. Известия Российской Академии Наук, Серия физическая, 2002, т.66,8, с.1116-1124.
3. Э.А.Свириденков. Люминесцентный анализ, М., 1961.
4. Cattell, R.В. The screen test for the number of factors. 1966, Multivariate Behavioral Research, 1, 629-637.
5. Martens H., Naes Т. Multivariative calibration. 1998, Willey.
6. O.E.Родионова, А.Л.Померанцев. Хемометрика в аналитической химии.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ БИОЛОГИЧЕСКИХ МИКРООБЪЕКТОВ И ИХ НАНОКОМПОНЕНТОВ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2406078C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СКОРОСТИ ГИБЕЛИ ЖИВЫХ МИКРОБОВ | 2007 |
|
RU2396352C2 |
| Способ лечения опухолевых и воспалительных заболеваний с применением фотодинамической терапии | 2018 |
|
RU2700407C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ НИЗКОМОЛЕКУЛЯРНЫХ МАРКЕРОВ НЕЙРОМЕДИАТОРНОГО ОБМЕНА В ОБРАЗЦАХ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ОПРЕДЕЛЕНИЯ КАТЕХОЛАМИНОВ И ИХ МЕТАБОЛИТОВ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2017 |
|
RU2708917C2 |
| СПОСОБ МОНИТОРИНГА ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, ВКЛЮЧАЮЩИЙ ФЛУОРЕСЦЕНТНУЮ ДИАГНОСТИКУ ЗАБОЛЕВАНИЯ, И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2511262C2 |
| СПОСОБ ПРИМЕНЕНИЯ ФИКОБИЛИПРОТЕИНОВ В КАЧЕСТВЕ ОПТИЧЕСКИХ СЕНСОРОВ ЛОКАЛЬНОЙ ТЕМПЕРАТУРЫ В ЖИВЫХ КЛЕТКАХ И ТКАНЯХ | 2021 |
|
RU2780954C1 |
| СПОСОБ И АВТОМАТИЗИРОВАННОЕ УСТРОЙСТВО ДЛЯ ДИАГНОСТИКИ СЕПСИСА, ВЫЗВАННОГО БАКТЕРИЯМИ, СОДЕРЖАЩИМИ ГЕН NDM-1 | 2012 |
|
RU2524615C2 |
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ВЫЯВЛЕНИЯ ДНК ВОЗБУДИТЕЛЯ ЧЕЛОВЕЧЕСКОГО МОНОЦИТАРНОГО ЭРЛИХИОЗА Ehrlichia spp. МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ "В РЕАЛЬНОМ ВРЕМЕНИ" | 2009 |
|
RU2415947C1 |
| Способ дифференциальной и ранней диагностики заболеваний ЛОР-органов воспалительной и опухолевой этиологии с использованием раман-флюоресцентной спектрометрии | 2018 |
|
RU2726062C2 |
| Способ дифференциальной диагностики форм хронического тонзиллита с использованием раман-флюоресцентной спектроскопии | 2018 |
|
RU2723139C2 |
Изобретение относится к исследованию физических и химических свойств микробосодержащих материалов. Способ заключается в том, что для определения ведущего микроба, конкурирующих ассоциантов и сложных аминокислот по спектру их флуоресценции используют значения спектральной интенсивности во всем спектральном диапазоне аппаратуры оптического диапазона, при этом получают статистическую модель концентраций микробов, формулируя ее в виде произведения градуировочной матрицы на вектор спектральных характеристик флуоресценции исследуемого образца, затем на основе модели с помощью программного обеспечения производят вычисление концентраций микробов или аминокислот в диагностируемых образцах. Техническим результатом является повышение точности и информативности диагностики. 3 з.п. ф-лы, 16 ил.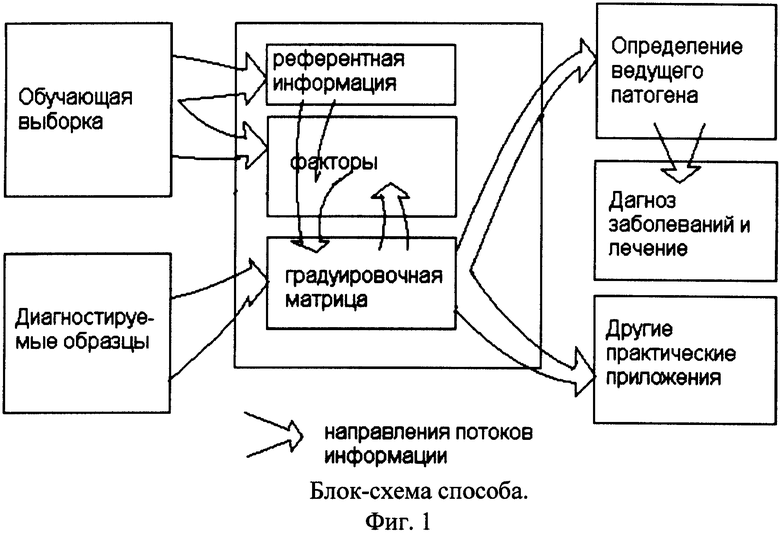
1. Способ дифференциальной диагностики микробов, заключающийся в определении ведущего микроба и конкурирующих ассоциантов по спектру их флуоресценции с помощью программного обеспечения диагностического комплекса, сравнивающего спектры, хранящиеся в базе данных комплекса, с полученной в ходе диагностики образца спектральной информацией, отличающийся тем, что для анализа микробов используют значения спектральной интенсивности во всем спектральном диапазоне аппаратуры оптического диапазона с последующей регистрацией характеристик рассеивания и поглощения исследуемого объекта в диапазоне его флуоресценции; при этом производят для этого на этапе наладки комплекса процедуру обучения программного обеспечения, получая статистическую модель зависимости спектра флуоресценции от концентраций микробов, формулируемой в виде произведения градуировочной матрицы на вектор восстановленных с учетом коэффициентов рассеивания и поглощения спектральных характеристик флуоресценции исследуемого образца, а с помощью градуировочной матрицы определяют концентрацию микробов и их специфичность на основе использования программного обеспечения.
2. Способ по п.1, отличающийся тем, что определение ведущего микроба производят по характеристическому концентрационному и видовому критерию.
3. Способ по п.1, отличающийся тем, что дополнительное определение концентраций специфических микробов или аминокислот производят на различных этапах диагностического процесса, связанного с микробами или аминокислотами, применительно к биотехнологиям с применением стандартных техник флуоресцентных спектроскопических измерений.
4. Способ по п.1, отличающийся тем, что с помощью дистанционных методов по спектрам лазерно-индуцированной флуоресценции дополнительно определяют наличие аминокислот и/или обсемененность микробами близких или удаленных проб, при этом диагностический комплекс состоит из единого блока анализа информации, обрабатывающего спектры флуоресценции сразу нескольких блоков, измеряющих эти спектры и передающих свою информацию для обработки блоку анализа по локальным или глобальным сетям связи с использованием стандартных протоколов, в том числе и протоколов шифрования, а процесс мониторинга лечения, оценки его эффективности и коррекцию лечения осуществляют путем повторного диагностического процесса на принципе обратной связи в экспресс-режиме, и так до завершения процесса реабилитации больного.
| СПОСОБ КОНТРОЛЯ ПРИКРЕПЛЕННОЙ И ПЛАНКТОННОЙ МИКРОБИОЛОГИЧЕСКИХ ПОПУЛЯЦИЙ В ПРОМЫШЛЕННОЙ ВОДНОЙ СИСТЕМЕ (2 ВАРИАНТА) | 2000 |
|
RU2280692C2 |
| Способ определения концентрации микроорганизмов в суспензиях | 1986 |
|
SU1382848A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Пакер для гидроразрыва пласта | 1982 |
|
SU1067199A1 |
Авторы
Даты
2009-07-20—Публикация
2007-04-05—Подача