Настоящее изобретение относится к производным фосфиновой кислоты в качестве антагонистов GАВАB, к их получению, их применению в качестве фармацевтических препаратов и фармацевтических композиций, содержащих указанные производные.
Прежде всего, изобретение относится к соединению формулы I
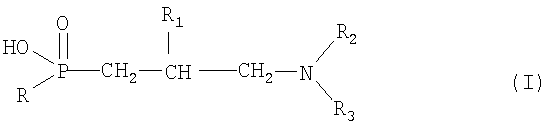
где R означает С3-С5алкил, ди(С1-С4)алкоксиметил, С3-С6циклоалкил(С1-С4)алкил или бензил, необязательно замещенный в ароматическом кольце от одного до трех заместителями, выбранными из группы, включающей С1-С4алкил, С1-С4алкокси и галоген,
R1 означает водород или гидрокси,
R2 означает группу формулы
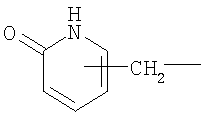 или
или 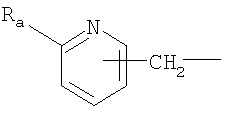
где
Ra означает С1-С4алкокси, а
R3 означает водород, или С1-С4алкил, или к его соли.
В связи с их амфотерной природой соединения формулы I образуют как кислотно-аддитивные соли, так и соли с основаниями.
В зависимости от присутствия асимметрического атома углерода (например, R1 означает гидрокси) соединения формулы I и их соли могут существовать в форме смеси изомеров, прежде всего рацематов, или в форме чистых изомеров, прежде всего оптических антиподов.
Термин «галоген» означает фтор, хлор, бром или иод.
Другой объект изобретения относится к способу получения соединений формулы I и их солей, который включает высвобождение гидроксигруппы в соединении формулы II или его соли
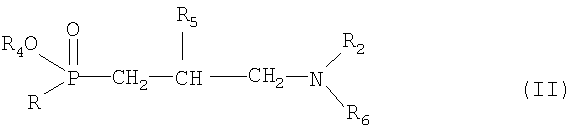
где R и R2 имеют значения, определенные выше, R4 означает гидроксизащитную группу, R5 означает водород или защищенный гидрокси, a R6 означает R3, определенный выше, или аминозащитную группу, причем указанное высвобождение проводят заменой гидроксизащитной группы R4 водородом и при необходимости высвобождение гидроксигруппы R1 из защищенной гидроксигруппы R5, удаление аминозащитной группы R6 и при необходимости превращение полученного соединения в другое соединение формулы I с последующим разделением смеси изомеров на компоненты и/или превращением соли в соответствующее свободное соединение или наоборот.
Пригодные гидроксизащитные и аминозащитные группы описаны в литературе. Удаление указанных защитных групп с образованием свободных гидрокси- и аминогрупп осуществляют по стандартным методикам.
Последующие стадии превращения соединения проводят последовательно или одновременно по известным методикам.
Все гидрокси- и аминозащитные группы предпочтительно удаляют при замене на водород в одну стадию при обработке три(низш.)алкилсилилгалогенидом, таким как триметилбромсилан, или кислотой, предпочтительно галогенводородной кислотой, например хлористоводородной кислотой, в условиях гидролиза.
Исходный материал формулы II получают, например, при взаимодействии соединения формулы III по известной методике
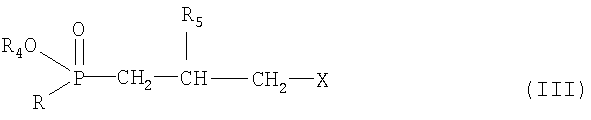
где R, R4 и R5 определены выше, а Х означает галоген, предпочтительно хлор, бором или иод, с соединением формулы IV

где R2 и R6 определены выше.
Соединения формул III и IV известны или их можно получить по известным методикам.
Новые соединения формулы I и их фармацевтически приемлемые соли, названные в настоящем описании агентами по изобретению, обладают ценными свойствами антагонистов GАВАB. Прежде всего, они эффективно связываются с рецептором GАВАB и являются антагонистами в отношении этого рецептора GАВАB (γ-аминомасляной кислоты).
Агенты по изобретению взаимодействуют с рецептором GАВАB в составе мембранной фракции из коры головного мозга крысы, при этом величина IC50 составляет приблизительно 10-8 М (моль/л) и выше. В отличие от агонистов GАВАB, таких как баклофен, они не потенциируют стимуляцию аденилатциклазы норадреналином в отделах коры головного мозга крысы, а действуют как антагонисты действию баклофена. Антагонизм к баклофену проявляется также in vitro при использовании электорофизиологических моделей, например препарата «эпилептических» участков гиппокампа, индуцированного пенициллином, в которых баклофен в концентрации 6 мкм подавляет «эпилептическиподобные» разряды пирамидальных клеток. Агенты по изобретению действуют в качестве антагонистов баклофена при концентрации от приблизительно 10 до приблизительно 100 мкм. Антагонизм проявляется также in vivo при ионофорезе баклофена в коре головного мозга крысы и при системном введении антагонистов в дозе от 10 до 100 мг/кг. При введении приблизительно 30 мг/кг наблюдается антагонизм действию баклофена в качестве мышечного релаксанта, которое оценивают в модели Ротарода (Rotarod).
Агенты по изобретению проявляют не только антагонизм к баклофену, но и независимо действуют в качестве антагонистов эндогенной GABA. В связи с этим антагонисты проявляют активность в стандартных поведенческих моделях и характеризуются антидепрессивными, анксиолитическими и/или ноотропными свойствами. Установлено, что соединения формулы I проявляют активность при пероральном введении в ходе испытаний типа «блужданий» по методике Порсолта (Porsolt), при испытаниях Геллера, при испытаниях по замедленному пассивному уклонению (модификация одной попытки) в ситуациях до и после испытаний, при испытаниях двухкамерным методом и в сложном лабиринте. Более того, при испытаниях на резус макаках наблюдается повышенный игровой интеллект, любознательность, способность по уходу за другими особями и снижение симптомов тревоги.
Таким образом, агенты по изобретению можно использовать в качестве ноотропных средств, антидепрессантов и анксиолитиков для лечения симптомов мозговой недостаточности, нарушений познавательной способности, депрессии, прежде всего эмоциональной депрессии, болезни Альцгеймера, легкой степени нарушения познавательной способности, шизофрении или недостаточности когнитивной функции, например пациентов, страдающих от болезни Альцгеймера, легкой степени нарушения познавательной способности и шизофрении.
Более того, было установлено, что агенты по изобретению характеризуются высокой эффективностью для предотвращения кратковременных приступов потери сознания (абсанс) in vivo.
Такие свойства можно продемонстрировать на модели специальной породы крыс на примере значительного подавления припадков эпилептического абсанса после самопроизвольных разрядов «комплекса медленной и быстрой волны», как описано в статье Vergnes и др. Neurosci. Lett. 33, 97-101 (1982). Следовательно, агенты по изобретению можно использовать в качестве активных ингредиентов для получения противоэпилептических лекарственных средств, предназначенных для лечения малых припадков эпилепсии, непроизвольных припадков абсанса при эпилепсии, таких как непроизвольные припадки эпилептического абсанса у детей и подростков, а также атипичных абсансов, таких как абсансы при синдроме Ленокса и абсансы, проявляющиеся в результате побочных действий при лечении больших эпилептических припадков противоэпилептическими средствами, такими как фенитоин, карбамазепин или вигабатрин, и противоэпилептическими средствами аналогичного или родственного типа.
Соответствующая дозировка для указанных выше показаний может изменяться и зависит, например, от используемого соединения, организма-хозяина, способа введения и природы и тяжести заболевания, которое необходимо вылечить. Однако в основном удовлетворительные результаты при лечении животных можно получить при введении суточной дозы от приблизительно 0,1 до приблизительно 100 мг/кг массы тела животного. Для лечения более крупных животных, например человека, суточная доза находится в интервале от приблизительно 5 до приблизительно 500 мг агента по изобретению, который обычно вводят, например, в виде разделенных доз вплоть до 4 раз в сутки или в форме с замедленным высвобождением.
Агенты по изобретению можно вводить обычным способом, прежде всего энтеральным способом, предпочтительно пероральным способом, например в форме таблеток или капсул, или парентеральным способом, например в форме инъекционных растворов или суспензий.
В связи с указанным выше в настоящем изобретении предлагается также агент по изобретению для применения в качестве фармацевтического препарата, например, для лечения мозговой недостаточности, депрессии, тревоги и эпилепсии.
В настоящем изобретении предлагается также фармацевтическая композиция, включающая агент по изобретению в сочетании по крайней мере с одним фармацевтическим носителем или разбавителем. Такие композиции получают известным способом. Стандартная лекарственная форма содержит, например, от приблизительно 0,25 до приблизительно 150, предпочтительно от 0,25 до приблизительно 25 мг, соединения по изобретению.
Более того, настоящее изобретение относится к применению агента по изобретению для получения лекарственного средства, предназначенного для лечения упомянутого выше состояния, например эпилепсии, мозговой недостаточности, депрессии и тревоги.
Еще одним объектом настоящего изобретения является способ лечения любого из перечисленных выше состояний, например малого эпилептического припадка, мозговой недостаточности, депрессии и тревоги, у субъекта, нуждающегося в таком лечении, причем способ включает введение такому субъекту терапевтически эффективного количества агента по изобретению.
Следующие примеры иллюстрируют изобретение.
Пример 1
{3-[(6-метокси-3-пиридилметил)амино]-2-(S)-гидроксипропил}(циклогексилметил)фосфиновая кислота
Раствор этилового эфира
{3-[(6-метокси-3-пиридилметил)амино]-2-
(S)-гидроксипропил}(циклогексилметил)фосфиновой кислоты (15,5 г, 40,3 ммоль) в 1 л этанола обрабатывали 0,1н. водным раствором гидроксида натрия (806 мл) и нагревали с обратным холодильником в течение 5 ч. После охлаждения до комнатной температуры этанол упаривали в вакууме. После добавления 800 мл 0,1н. водного раствора соляной кислоты смесь экстрагировали один раз 250 мл дихлорметана и два раза по 250 мл диэтилового эфира. Водный раствор упаривали досуха в вакууме и остаток растворяли в горячем н-пропаноле. Хлорид натрия отделяли фильтрованием и раствор снова упаривали, остаток растворяли в метаноле и обрабатывали раствором газообразного хлористого водорода в диэтиловом эфире до рН 1. После упаривания растворителя полученный моногидрохлорид {3-[(6-метокси-3-пиридилметил)амино]-2-(S)-гидроксипропил}(циклогексилметил)фосфиновой кислоты перекристаллизовывали из изопропанола при добавлении по каплям ацетона, tпл. 189-191°С.
Полученный гидрохлорид 7,9 (20 ммоль) растворяли в 60 мл метанола и медленно добавляли при интенсивном перемешивании 300 мл пропиленоксида. Суспензию перемешивали при комнатной температуре в течение 24 ч, продукт отделяли фильтрованием и после высушивания получали {3-[(6-метокси-3-пиридилметил)амино]-2-(S)-гидроксипропил}(циклогексилметил)фосфиновую кислоту, tпл. 192-195°С.
[α]D=-9,8° (с 1,045, МеОН), [α]365=-27,8° (с 1,045, МеОН).
Элементный анализ: рассч. для C17H29N2O4P: С 57,29, Н 8,20, N 7,86, Р 8,69%,
найд. С 57,1, Н 8,3, N 7,7, Р 8,7%.
1Н ЯМР (360 МГц, D2О): δ 8,18 (d, J 2 Гц, 1Н), 7,84 (dd, J 7 и 2 Гц, 1Н), 6,93 (d, J 7 Гц, 1Н), 4,31 (s, 2H), 4,30-4,13 (m, 1Н), 3,89 (s, 3H), 3,25 и 3,4 (АВХ, J 15, 12 и 6 Гц, 2H), 1,90-1,67 (m, 4H, Р-СН3), 1,67-1,50 (m, 4H), 1,50-1,37 (m, 2H), 1,29-0,90 (m, 5H).
Исходный материал получали по следующей методике.
Раствор этилового эфира (3-хлор-2-(R)-гидроксипропил)(циклогексилметил)фосфиновой кислоты (15,5 г, 40,3 ммоль), полученного, как описано в статье W.Froestl и др. J. Med. Chem. 38, 3313 (1995), в 90 мл безводного этанола в атмосфере аргона обрабатывали раствором 6-метоксипиридил-3-метанамина (9 г, 65 ммоль), полученного, как описано в статье Н.S.Forrest и J.Walter. J. Chem. Soc. 1948, 1939, в 90 мл безводного этанола. Затем по каплям при перемешивании добавляли этилдиизопропиламин (8,4 г, 65 ммоль), раствор нагревали с обратным холодильником в течение 10 сут, охлаждали до комнатной температуры и растворитель упаривали. Масляный остаток распределяли между дихлорметаном и водой, органический слой отделяли, сушили над сульфатом натрия и фильтровали. Растворитель удаляли в вакууме и получали масло светло-желтого цвета. После хроматографии на 1 кг силикагеля при элюции дихлорметаном, а затем последовательно смесью дихлорметан/метанол, 49:1, 19:1 и 9:1, получали этиловый эфир {3-[(6-метокси-3-пиридилметил)амино]-2-
(S)-гидроксипропил}(циклогексилметил)фосфиновой кислоты в виде масла, содержащего смесь диастереоизомеров, 1:1. МС: m/е 385 (М+Н)+, рассч. для
C19H34N2O4P, найд. 385,44.
1H ЯМР (500 МГц, CDCl3): δ 8,05 (d, J 2 Гц, 2×1Н), 7,54 (dd, J 7 и 2 Гц, 2×1Н), 6,70 (d, J 7 Гц, 2×1Н), 4,19-4,10 (m, 1Н, один из СНОН диастереоизомера), 4,10-3,99 (m, 1Н, один из СНОН диастереоизомера и 2×2Н, ArCH2N), 3,92 (s, 2×3H), 3,72 (q, J 7 Гц, 2×2Н), 2,73-2,66 (m, 2×1Н), 2,63-2,55 (m, 2×1Н), 1,98-1,79 (m, 2×4H), 1,79-1,57 (m, 2×5H), 1,30 (t, J 7 Гц, 2×3H), 1,28-1,21 (m, 2×2Н), 1,17-1,07 (m, 2×1Н), 1,07-0,95 (m, 2×2Н).
Следующие соединения получали аналогично тому, как описано в примере 1.
Пример 2
{3-[(2-метокси-4-пиридилметил)амино]-2-(S)-гидроксипропил}(циклогексилметил)фосфиновая кислота
tпл. 188-191°С (перекристаллизация из метанола), гидрохлорид tпл. 159-160°С (перекристаллизация из изопропанола).
[α]D=-9,2° (с 1,025, МеОН), [α]365=-25,8° (с 1,025, МеОН).
Элементный анализ: рассч. для C17H29N2O4P: С 57,29, Н 8,20, N 7,86, Р 8,69%,
найд. С 57,4, Н 8,1, N 8,1, Р 8,8%.
1H ЯМР (360 МГц, D2O): δ 8,15 (d, J 7 Гц, 1Н), 7,08 (dd, J 7 и 1 Гц, 1Н), 6,93 (d, J 1 Гц, 1Н), 4,27-4,16 (m, 1Н), 4,23 (s, 2H), 3,90 (s, 3Н), 3,23 и 3,03 (ABX, J 15, 12 и 6 Гц, 2H), 1,90-1,68 (m, 4H, Р-СН2), 1,65-1,50 (m, 4H), 1,48-1,38 (m, 2H), 1,28-0,90 (m, 5H).
Пример 3
{3-[(6-метокси-3-пиридилметил)амино]-2-(S)-гидроксипропил}(бензил)фосфиновая кислота
tпл. 211-213 °С (перекристаллизация из метанола/диэтилового эфира).
[α]D=-10,1° (с 1,015, МеОН), [α]365=-29,6° (с 1,015, МеОН).
Элементный анализ: рассч. для C17H23N2O4P·0,31 Н2О: С 57,37, Н 6,69, N 7,87, Р 8,70, Н2O 1,57,
найд. С 56,9, Н 6,5, N 7,7, Р 8,7, H2O 1,55%.
1H ЯМР (360 МГц, D2O): δ 8,12 (d, J 2 Гц, 1Н), 7,84 (dd, J 7 и 2 Гц, 1Н), 7,40-7,22 (m, 5H), 6,96 (d, J 7 Гц, 1Н), 4,18 (s, 2H), 4,18-4,08 (m, 1Н), 3,92 (s, 3Н), 3,20 и 2,99 (ABX, J 15, 12 и 6 Гц, 2H), 2,99 (d, J 18 Гц, 2H, P-CH2Ph), 1,92-1,67 (m, 2H, Р-СН2).
Пример 4
{3-[(2-метокси-4-пиридилметил)амино]-2-(S)-гидроксипропил}(бензил)фосфиновая кислота
tпл. 192-195°С (перекристаллизация из метанола/диэтилового эфира).
[α]D=-8,5° (с 1,005, МеОН), [α]365=-26,4° (с 1,005, МеОН).
Элементный анализ: рассч. для C17H23N2O4P: С 58,28, Н 6,62, N 8,00, Р 8,84%.
найд. С 58,4, Н 6,7, N 7,8, Р 8,7%.
1Н ЯМР (360 МГц, D2O): δ 8,18 (d, J 7 Гц, 1Н), 7,38-7,23 (m, 5H), 7,08 (dd, J 7 и 2 Гц, 1Н), 6,94 (d, J 2 Гц, 1Н), 4,23-4,10 (m, 1Н), 4,21 (s, 2H), 3,93 (s, 3Н), 3,21 и 3,06 (ABX, J 15, 12 и 6 Гц, 2H), 3,02 (d, J 18 Гц, 2H, PCH2Ph), 1,92-1,67 (m, 2H, Р-СН2).
Пример 5
{3-[(6-метокси-3-пиридилметил)амино]-2-(S)-гидроксипропил}(диэтоксиметил)фосфиновая кислота
Пена белого цвета,
[α]D=-10,3° (с 1,05, МеОН), [α]436=-18,8° (с 1,05, МеОН).
Элементный анализ: рассч. для C15H27N2O6P·1,49 H2O: С 46,29, Н 7,76, N 7,20, Р 7,96, H2O 6,90%,
найд. С 46,1, Н 7,6, N 7,0, Р 8,7, H2O 6,9%.
1Н ЯМР (360 МГц, D2O): δ 8,18 (d, J 2 Гц, 1Н), 7,84 (dd, J 7 и 2 Гц, 1Н), 6,93 (d, J 7 Гц, 1Н), 4,46 (d, J 2 Гц, 1Н), 4,33-4,20 (m, 1Н), 4,21 (s, 2H), 3,90 (s, 3Н), 3,85-3,73 (m, 2H), 3,73-3,61 (m, 2H), 3,29 и 3,03 (dAB, J 12 и 2 Гц, 2H), 1,98-1,72 (m, 2H), 1,17 (t, J 7 Гц, 3Н), 1,16 (t, J 7 Гц, 3Н).
Пример 6
{3-[(2-метокси-4-пиридилметил)амино]-2-(S)-гидроксипропил}(диэтоксиметил)фосфиновая кислота
Пена белого цвета, МС: m/е 363 (М+Н)+, рассч. для C15H29N2O6P, найд. 363,36.
[α]D=-10,5° (с 0,96, МеОН), [α]436=-20,4° (с 0,96, МеОН).
Элементный анализ: рассч. для C15H27N2O6P·0,81 Н2О: С 47,79, Н 7,65, N 7,43, Р 8,22, Н2O 3,87%,
найд. С 48,2, Н 7,5, N 7,8, Р 8,4, H2O 3,88%.
1H ЯМР (360 МГц, MeOD): δ 8,18 (d, J 7 Гц, 1Н), 7,11 (dd, J 7 и 1 Гц, 1Н), 6,97 (d, J 1 Гц, 1Н), 4,38 (d, J 2 Гц, 1Н), 4,38-4,26 (m, 1Н), 4,26 (s, 2H), 3,92 (s, 3Н), 3,88-3,76 (m, 2H), 3,76-3,63 (m, 2H), 3,32 и 3,08 (dAB, J 12 и 2 Гц, 2H), 2,02-1,73 (m, 2H), 1,20 (t, J 7 Гц, 3Н), 1,19 (t, J 7 Гц, 3Н).
Пример 7
{2-(S)-гидрокси-3-[6-оксо-1,6-дигидропиридин-3-илметил)амино]пропил}(циклогексилметил)фосфиновая кислота
Раствор соединения, полученного, как описано в примере 1 (4,6 г, 12,9 ммоль), в 200 мл 2н. соляной кислоты нагревали с обратным холодильником при перемешивании в течение 20 ч. После охлаждения до комнатной температуры раствор экстрагировали два раза по 100 мл диэтилового эфира, один раз 100 мл дихлорметана и упаривали досуха в вакууме. После перекристаллизации из метанола при добавлении по каплям диэтилового эфира продукт перекристаллизовывали второй раз из метанола и получали гидрохлорид {2-(S)-гидрокси-3-
[6-оксо-1,6-дигидропиридин-3-илметил)амино]пропил}(циклогексилметил)фосфиновой кислоты, tпл. 224-225°.
МС: m/e 341,3 (M-H)+, рассч. для С16Н36N2O4Р, найд. 341,37.
[α]D=-10,6° (с 0,385. МеОН), [α]365=-29,1° (с 0,385, МеОН).
Элементный анализ: рассч. для C16H27N2O4P·HCl·0,27 H2O: С 50,08, Н 7,50, Cl 9,24, N 7,30, Р 8,07, Н2O 1,27%,
найд. С 50,3, Н 7,5, Cl 9,2, N 7,6, Р 8,2, Н2O 1,28%.
1Н ЯМР (500 МГц, D2O): δ 7,77 (dd, J 7 и 2 Гц, 1Н), 7,72 (d, J 2 Гц, 1Н), 6,68 (d, J 7 Гц, 1Н), 4,33-4,25 (m, 1Н), 4,16 (s, 2H), 3,27 и 3,08 (АВХ, J 15, 12 и 6 Гц, 2Н), 2,06-1,97 (m, 1H, P-CH2), 1,95-1,86 (m, 1H, P-CH2), 1,81-1,73 (m, 2H), 1,73-1,54 (m, 6H), 1,30-1,18 (m, 2H), 1,18-1,17 (m, 1H), 1,07-0,96 (m, 2H).
Следующие соединения получали аналогично тому, как описано в примере 7.
Пример 8
{2-(S)-гидрокси-3-[2-оксо-1,2-дигидропиридин-4-илметил)амино]пропил}(циклогексилметил)фосфиновая кислота
Гидрохлорид tпл. 212-215° (перекристаллизация из метанола).
[α]D=-9,7° (с 0,205, МеОН), [α]365=-27,8° (с 0,205, МеОН).
Элементный анализ: рассч. для C16H27N2O4P·HCl·0,38 Н2О: С 49,83, Н 7,52, Cl 9,19, N 7,26, Р 8,03, Н2О 1,77%,
найд. С 50,2, Н 7,6, Сl 9,1, N 7,4, Р 8,0, H2O 1,78%.
1H ЯМР (360 МГц, D2O): δ 7,60 (d, J 7 Гц, 1H), 6,70 (d, J 2 Гц, 1H), 6,60 (dd, J 7 и 2 Гц, 1H), 4,33-4,22 (m, 1H), 4,22 (s, 2H), 3,33 и 3,12 (АВХ, J 15, 12 и 6 Гц, 2H), 1,95-1,70 (m, 4H, P-CH2), 1,70-1,53 (m, 4H), 1,53-1,43 (m, 2H), 1,32-1,08 (m, 3Н), 1,08-0,93 (m, 2H).
Пример 9
{2-(S)-гидрокси-3-[6-оксо-1,6-дигидропиридин-3-илметил)амино]пропил}(бензил)фосфиновая кислота
Гидрохлорид tпл. 219-224° (перекристаллизация из метанола).
[α]D=-13,1° (с 0,275, МеОН), [α]365=-40,4° (с 0,275, МеОН).
Элементный анализ: рассч. для С16Н21N2O4P·НСl·0,44H2O: С 50,48, Н 6,06, Сl 9,31, N 7,36, Р 8,14, Н2О 2,08%,
найд. С 49,8, Н 6,2, Сl 10,4, N 7,4, Р 8,2, Н2О 2,08%.
1H ЯМР (360 МГц, D2O): d 7,75 (dd, J 7 Гц и 2 Гц, 1H), 7,70 (d, J 2 Гц, 1H), 7,41-7,25 (m, 5H), 6,68 (d, J 7 Гц, 1H), 4,27-4,15 (m, 1H), 4,10 (s, 2H), 3,20 и 3,00 (АВХ, J 15, 12 и 6 Гц, 2H), 3,14 (d, J 18 Гц, 2H, PCH2Ph), 2,05-1,81 (m, 2H, P-CH2).
Пример 10
{2-(S)-гидрокси-3-[2-оксо-1,2-дигидропиридин-4-илметил)амино]пропил}(бензил)фосфиновая кислота
Гидрохлорид tпл. 226-228° (перекристаллизация из метанола/ацетона/диэтилового эфира).
МС: m/е 337 (М+Н)+, рассч. для C16H22N2O4P, найд. 337,32.
[α]D=-13,6° (с 0,205, МеОН), [α]365=-36,6° (с 0,205, МеОН).
Элементный анализ: рассч. для C16H21N2O4P·HCl: С 51,55, Н 5,95, Сl 9,51, N 7,51, Р 8,31,
найд. С 51,1, Н 6,1, Сl 9,4, N 7,3, Р 8,3%.
1H ЯМР (360 МГц, D2O): δ 7,61 (d, J 7 Гц, 1Н), 7,42-7,27 (m, 5H), 6,68 (d, J 2 Гц, 1Н), 6,58 (dd, J7 Гц и 2 Гц, 1Н), 4,32-4,20 (m, 1Н), 4,18 (s, 2H), 3,25 и 3,08 (ABX, J 15, 12 и 6 Гц, 2H), 3,16 (d, J 18 Гц, 2H, РСН2Рh), 2,05-1,82 (m, 2H, Р-СН2).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ОКСАДИАЗОЛА, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВЫМ ДЕЙСТВИЕМ, ЛЕКАРСТВЕННОЕ СРЕДСТВО, ИХ СОДЕРЖАЩЕЕ, И СПОСОБ ЛЕЧЕНИЯ | 2001 |
|
RU2275371C2 |
| ФЕНОКСИПИРИДИНИЛАМИДНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ PDE4-ОПОСРЕДОВАННЫХ БОЛЕЗНЕННЫХ СОСТОЯНИЙ | 2009 |
|
RU2509077C2 |
| ПРОИЗВОДНЫЕ 3-ЗАМЕЩЕННОГО 4-АРИЛХИНОЛИН-2-ОНА В КАЧЕСТВЕ МОДУЛЯТОРОВ КАЛИЕВЫХ КАНАЛОВ | 1999 |
|
RU2240998C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2004 |
|
RU2346938C2 |
| СОЕДИНЕНИЯ БЕНЗАЗЕПИНА ДИКАРБОКСАМИДА | 2016 |
|
RU2712248C2 |
| ПРОИЗВОДНЫЕ АМИНА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ОФТАЛЬМОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И РАССТРОЙСТВ | 2008 |
|
RU2536040C2 |
| ИНГИБИТОРЫ ДЕАЦЕТИЛАЗ ГИСТОНОВ (HDACS) | 2013 |
|
RU2629947C2 |
| НОВЫЕ АМИНОПРОПИЛФОСФИНОВЫЕ КИСЛОТЫ | 2000 |
|
RU2260595C2 |
| НОВЫЕ СОЕДИНЕНИЯ КОНДЕНСИРОВАННОГО ИМИДАЗОЛА, ОБЛАДАЮЩИЕ СВОЙСТВАМИ АГОНИСТОВ РЕЦЕПТОРА СВ2 | 2002 |
|
RU2312864C2 |
| 3,6-ДИАМИНОПИРИДАЗИН-3-ИЛЬНЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОАПОПТОТИЧЕСКИХ СРЕДСТВ | 2020 |
|
RU2830186C2 |
Настоящее изобретение относится к {2-(S)-гидрокси-3-[6-оксо-1,6-дигидропиридин-3-илметил)амино]
пропил}(циклогексилметил)фосфиновой кислоте, обладающей антагонистическим действием в отношении GАВАB, которая может быть использована в качестве фармацевтического препарата. Технический результат - получение нового биологически активного вещества. 2 н. 1 з.п. ф-лы.
1. {2-(S)-гидрокси-3-[6-оксо-1,6-дигидропиридин-3-илметил)амино]пропил}(циклогексилметил)фосфиновая кислота в форме свободного основания или соли.
2. Соединение по п.1 в форме свободного основания или фармацевтически приемлемой соли, обладающее антагонистическим действием в отношении GАВАB, пригодное для применения в качестве фармацевтического препарата.
3. Фармацевтическая композиция, обладающая антагонистическим действием в отношении GАВАB, включающая соединение по п.1 в форме свободного основания или фармацевтически приемлемой соли в смеси с фармацевтическим носителем или разбавителем.
| Струйный регулируемый насос | 1975 |
|
SU543780A1 |
| Устройство для крепления оборудования в изотермическом кузове транспортного средства | 1970 |
|
SU463560A1 |
| УСТРОЙСТВО для ГРУППОВОЙ ОКОРКИ БРЕВЕН | 0 |
|
SU356128A1 |
| RU 99107969, 20.02.2001. | |||
Авторы
Даты
2009-09-27—Публикация
2004-11-19—Подача