Изобретение относится к биотехнологии, в частности к производству противоопухолевых соединений, и может быть использовано при получении противоопухолевого препарата нуклеозидной природы - 9-(β-D-арабинофуранозил)-2-фтораденина (флударабина).
Флударабин является предшественником фармацевтического препарата 5'-фосфата флударабина, широко используемого в медицине противоопухолевого препарата, применяющегося в терапии В-клеточного хронического лимфолейкоза и неходжкинских лимфом низкой степени злокачественности (Fludarabine-induced apoptosis in CD19+/CD5+B-CLL cells is a direct and nurse-like-cell independent effect. Martinez-Lostao L., Briones J., Martinez-Gallo M. et al. Leukemia & lymphoma. 2004, V.45, no 11, p.2307-14).
По химической структуре флударабин представляет собой модифицированный нуклеозид - фторированный аналог 9-β-D-арабинофуранозиладенина (фиг.1).
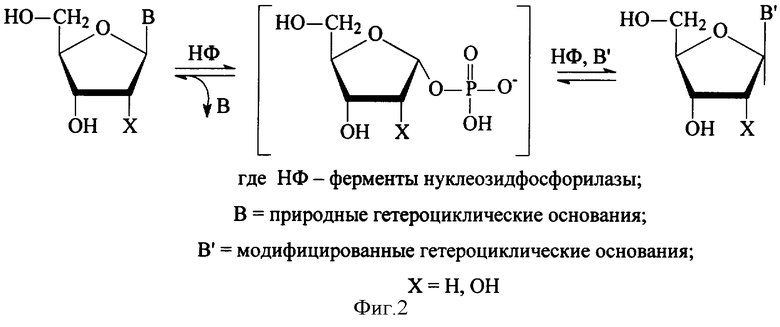
Наиболее эффективным в настоящее время признан биотехнологический способ получения модифицированных нуклеозидов с использованием генно-инженерных ферментов нуклеозидфосфорилаз (НФ) - реакция ферментативного трансгликозилирования, - в процессе которой происходит перенос сахарного остатка от природного пуринового или пиримидинового нуклеозида на модифицированное гетероциклическое основание (Purine nucleoside phosphorylases: properties, functions, and clinical aspects. Bzowska A., Kulikowska E., Shugar D. Pharmacology & Therapeutics. - 2000. - V.88. P. - 349-425). Принципиальная схема процесса представлена на фиг.2.
Известен способ ферментативного синтеза флударабина по реакции трансгликозилирования исходного гетероциклического основания 2-фтораденина 1-β-D-арабинофуранозилурацилом при температуре 60°С в присутствии суспензии клеток Enterobacter aerogenes при 60°С (патент ЕР № 1464708, МПК7 кл. С12Р 19/32, опублик. 03.04.2003). К недостаткам этого метода, можно отнести следующие:
1) процесс проводят в буферных растворах с добавлением в реакционную смесь диметилсульфоксида (до 40% об), что сказывается на частичной потере активности ферментных препаратов и затрудняет выделение продукта из реакционной смеси,
2) флударабин продуцируется в культуральной среде, содержащей пролиферирующие микроорганизмы в процессе роста микроорганизмов,
3) ферменты клетки продуцируют не только флударабин, но и весь спектр природных нуклеозидов, их метаболитов, что усложняет процесс выделения целевого продукта.
Известен наиболее близкий к заявленному способ получения флударабина по реакции трансгликозилирования исходного основания 2-фтораденина 1-β-D-арабинофуранозилурацилом с использованием ферментов пуриннуклеозидфосфорилазы (КФ 2.4.2.1.) и уридинфосфорилазы (КФ 2.4.2.3.) из суспензии клеток Enterobacter aerogenes, предварительно выделенных и иммобилизованных на полимерных носителях (патент ЕР № 1439220, МПК7 кл. C12N 19/10, опублик. 16.01.2003). К недостаткам данного метода можно отнести следующее:
1) исходный 2-фтораденин плохо растворим в воде, вследствие чего процесс проводят в буферных растворах с добавлением в реакционную смесь диметилсульфоксида (до 40% об.) или этилового спирта (10% объемн.), что сказывается на частичной потере активности ферментных препаратов,
2) по окончании процесса продукт кристаллизуется совместно с исходным основанием в силу его низкой растворимости, что приводит к необходимости дополнительной перекристаллизации флударабина.
Изобретение решает задачу упрощения технологии получения флударабина и повышения его выхода.
Поставленная задача решается за счет того, что флударабин получают путем взаимодействия 2-фтораденозина и 1-β-D-арабинофуранозилурацила при их мольном соотношении - 1:2 соответственно, в калий-фосфатном буфере при нейтральном значении рН, температуре 48-52°С в присутствии пуриннуклеозидфосфорилазы в количестве 62.5 ед. акт. на 1 ммоль 2-фтораденозина и уридинфосфорилазы в количестве 62.5 ед. акт. на 1 ммоль 1-β-D-арабинофуранозилурацила.
Использование 2-фтораденозина позволяет проводить процесс получения флударабина при высоких концентрациях исходных нуклеозидов без добавления в реакционную смесь диметилсульфоксида, что упрощает процесс выделения целевого продукта из реакционной смеси и приводит к значительному увеличению его выхода.
Изобретение осуществляют следующим образом.
Исходный 2-фтораденозин получают обработкой аммиаком в метаноле 2',3',5'-три-О-ацетил-2-фтораденозина (патент РФ № 2325395, 05.02.2007). Схема синтеза представлена на фиг.3.
Параллельно осуществляют синтез второго исходного нуклеозида 1-β-D-арабинофуранозилурацила (соединение VI, фиг.4), способ получения которого основан на реакции кислотно-катализируемого ацетилирования уридина с образованием 2,2'-ангидро-1-(3',5'-ди-О-ацетил-β-D-арабинофуранозил)урацила (Kondo К. and Inoue I.J.Org. Chem. 1977. V.42. N.17. P.2809-2812), омыление которого водной щелочью при комнатной температуре и приводит к образованию 1-β-D-арабинофуранозилурацила.
В качестве генно-инженерных ферментов используют пуриннуклеозидфосфорилазу (ПНФ, КФ 2.4.2.1) и уридинфосфорилазу (УФ, КФ 2.4.2.3).
Синтез флударабина (I, фиг.5) из 2-фтораденозина проводят по реакции трансгликозилирования при мольном соотношении 2-фтораденозина к 1-β-D-арабинофуранозилурацилу - 1:2 при 48-52°С до содержания исходного 2-фтораденозина 0,5-1%. При данной температуре флударабин постепенно кристаллизуется, смещая равновесие ферментативной реакции в сторону образования продукта. Контроль процесса осуществляют с помощью ВЭЖХ. По окончании реакции смесь выдерживают при 8-15°С в течение 20-24 ч, выпавший в осадок флударабин отфильтровывают. Проведение процесса получения флударабина описанным способом позволяет получить продукт с выходом 92% и чистотой не менее 99%. Данные, подтверждающие достижение технического результата, представлены в таблице.
Изобретение иллюстрируют чертежи:
Фиг.1. - структурная формула флударабина (9-(β-D-арабинофуранозил)-2-фтораденина).
Фиг.2 - принципиальная схема реакции трансгликозилирования.
Фиг.3 - схема синтеза 2-фтораденозина.
Фиг.4 - схема синтеза 1-β-D-арабинофуранозилурацила.
Фиг.5. - схема ферментативного синтеза 9-(β-D-арабинофуранозил)-2-фтораденина (флударабина).
Изобретение иллюстрируют примеры.
Пример 1.
Получение 2-фтораденозина (соединение III, фиг.3).
Суспензию 33.35 г (117 ммоль) 2',3',5'-три-О-ацетил-2-фтораденозина в 1.25 л метанола перемешивают и насыщают осушенным аммиаком при 0-2°С в течение 6 ч, образовавшийся раствор выдерживают в закрытой колбе при указанной температуре 5 суток, а затем 4 ч при 20°С. Выпавший осадок отфильтровывают и получают 11.96 г 2-фтораденозина т. пл. 249-251°С. Масс-спектр: m/z 308(M+Na)+, 286(М+Н)+, 154(В+Н)+, м.в. 285.237. Спектр 1Н-ЯМР (DMSO-d6), (δ м.д.): 8.38 (с, 1Н, 8-Н), 7.9 (с, 2Н, NH2), 5.81(д, 1Н, J1=5.1 Hz, 1'-H), 4.54 (м, 1Н, 2'-Н), 4.15 (м, 1Н, 3'-Н), 3.96 (м, 1Н, 4'-Н), 3.50-3.75 (м, 2Н, 5'-Н2).
Маточный раствор концентрируют в вакууме (15 мм рт.ст.), остаток кипятят 15 мин в 300 мл метанола, содержащего 5% аммиака, реакционную смесь охлаждают до 20°С и выдерживают при этой температуре 2 ч, выпавший осадок отфильтровывают и получают дополнительно 9.21 г 2-фтораденозина (соединение III, фиг.3), 98%-ной чистоты, т. пл. 244-246°С. Общий выход 2-фтораденозина составляет 21.17 г (91.56%).
Пример 2.
Получение 1-β-D-арабинофуранозилурацила (соединение VI, фиг.4). Раствор уксусного ангидрида (210 г, 200 мл) добавляют по каплям к перемешиваемой кипящей суспензии уридина (соединение IV, рисунок 4) (100 г, 0.4 моль) с эфиратом трехфтористого бора (160 мл, 1.28 моль) в 1 л смеси толуол-ацетонитрил, 1:1. Через 2 часа реакционную смесь охлаждают льдом и нейтрализуют карбонатом натрия
(Na2СО3) до рН 8-8.5. Осадок удаляют, промывают ацетонитрилом. Супернатант концентрируют в вакууме. Остаток уксусной кислоты удаляют соупариванием с толуолом. Остаток растворяют в этаноле, продукт высаживают из раствора добавлением толуола. Выпавшие кристаллы отфильтровывают, промывают этанолом (2×100 мл), сушат в вакууме (15 мм рт.ст.). Выход 2-2'-ангидро-1-(3',5'-ди-О-ацетил-β-D-арабинофуранозил)урацила (соединение V, фиг.4) 72.8 г. (58.5%); т. пл. 185°С; λmax, нм: 246.2; m/z: 311.3 [М]+, 333.4 [M+Na]+.
2-2'-Ангидро-1-(3',5'-ди-О-ацетил-β-D-арабинофуранозил)урацил (соединение V, фиг.4) (72.8 г) растворяют в 1 л Н2О, добавляют 140 мл 5М КОН до рН 12. Через 5 ч реакционную смесь нейтрализуют катионитом Dowex 50 (Н+) до рН 7. Смолу отфильтровывают, промывают водой (3×100 мл). Растворитель удаляют в вакууме (15 мм рт.ст.). Целевой продукт кристаллизуют из 600 мл этанола, промывают охлажденным этанолом (2×100 мл). Выход 30.4 г (30%); т. пл. 238°С; λmax, нм: 262.6; m/z: 245.3 [М+Н]+, 267.2 [M+Na]+. 1Н-ЯМР (D2О) (δ, ppm): 7.83 (1Н, д, J6,5 8.09, Н6), 6.15 (1Н, д, J1',2' 4.98, Н1'), 5.85 (1Н, д, J5,6 8.09, Н5), 4.43 (1Н, т, J2', 1'. 4.8, Н2),4.11 (1Н, т, J3', 2' 5.14, Н3'), 3.97 (1Н, м, Н4'), 3.9 (1Н, дд, J5'a, 5'b 12.45, J5'а, 4' 3.11, Н5'а), 3.81 (1Н, дд, J5'b, 5'a 12.45, J5'b, 4' 5.61, H5'b).
Пример 3.
Получение флударабина (соединение I, фиг.5).
Смесь 17.116 г (0.06 моль) 2-фтораденозина (соединение III, фиг.5) и 29.3 г (0.12 моль) 1-β-D-арабинофуранозилурацила (соединение VI, фиг.5) в 2 л 60 мМ калий-фосфатного буфера (рН 7.0) термостатируют в течение 120 часов при 50±2°С в присутствии 15 мл ферментного препарата ПНФ (10 мг/мл, 25 ед. акт./мг белка или 62.5 ед. акт. на 1 ммоль 2-фтораденозина) и 15 мл ферментного препарата УФ (10 мг/мл, 50 ед. акт./мг белка или 62.5 ед. акт. на 1 ммоль 1-β-D-арабинофуранозилурацила). Контроль полноты процесса осуществляют с помощью ВЭЖХ. Процесс считается законченным, если содержание исходного 2-фтораденозина (соединение III, фиг.5) в реакционной смеси составляет 1%.
Реакционную смесь охлаждают до температуры 8°С. Выпавший в осадок целевой продукт отфильтровывают, промывают водой (3×20 мл) и этиловым спиртом (1×20 мл), затем высушивают в эксикаторе до постоянного веса. Выход: 15.75 г (92%). Чистота продукта по данным ВЭЖХ 99-99.4%. Т. пл. 260-262°С. λmax, нм (ε, М-1 см-1): 262(14800). Спектр 1Н-ЯМР (DMSO-d6), (δ м. д.): 8.17 (с, 1Н, Н-8), 7.76 (с, 2Н, NH2), 6.11 (д, 1Н, Н1'), 5.61(д, ОН2′), 5.51 (д, ОН5'), 5.05 (т, ОН3'), 4.14 (м, 1Н, Н2'), 3.77 (м, 1Н, Н3'), 3.65 (м, 1Н, Н4'), 3.35 (с, 2Н, Н5')
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения пуриновых нуклеозидов ряда β-D-арабинофуранозы | 2015 |
|
RU2624023C2 |
| СПОСОБ ПОЛУЧЕНИЯ 9-(БЕТА-D-АРАБИНОФУРАНОЗИЛ)-6-(N-L-СЕРИЛАМИДО)-2-ХЛОРПУРИНА | 2014 |
|
RU2563257C1 |
| Гидройодная соль 7-метил-2'-дезоксигуанозина в качестве субстрата для получения 2'-дезоксинуклеозидов методом ферментативного трансгликозилирования | 2017 |
|
RU2664472C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-β-D-РИБОФУРАНОЗИЛ-1,2,4-ТРИАЗОЛ-3-КАРБОКСАМИДА | 2011 |
|
RU2480218C1 |
| 3-Бутилтио-1-(бета-D-2-дезоксирибофуранозил)-5-фенил-(4Н)-1,2,4-триазол, синтез, противогерпесвирусное действие | 2023 |
|
RU2815137C1 |
| 2-Амино-5,6-дифтор-1-(бета-D-рибофуранозил)-бензимидазол, способ получения и противовирусная активность его в отношении вируса герпеса простого 1-го типа | 2016 |
|
RU2629670C2 |
| Способ получения соли α-D-рибофуранозо-1-фосфата или α-D-2-дезоксирибофуранозо-1-фосфата | 2018 |
|
RU2708971C1 |
| Способ получения кладрибина методом ферментативного трансгликозилирования 2-хлор-6-азидопурина с последовательной двухстадийной конверсией азидогруппы | 2023 |
|
RU2836333C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2',3',5'-ТРИ-О-АЦЕТИЛ-2-ФТОРАДЕНОЗИНА | 2007 |
|
RU2325395C1 |
| КОМБИНАЦИЯ ТЕРМОСТАБИЛЬНЫХ БИОКАТАЛИЗАТОРОВ ДЛЯ СИНТЕЗА НУКЛЕОЗИДОВ | 2010 |
|
RU2569110C2 |




Изобретение относится к способу получения 9-(β-D-арабинофуранозил)-2-фтораденина (флударабина), включающему взаимодействие 2-фтораденозина и 1-β-D-арабинофуранозилурацила при их мольном соотношении - 1:2 соответственно, в калий-фосфатном буфере при нейтральном значении рН, температуре 48-52°С в присутствии пуриннуклеозидфосфорилазы в количестве 62.5 ед. акт. на 1 ммоль 2-фтораденозина и уридинфосфорилазы в количестве 62.5 ед. акт. на 1 ммоль 1-β-D-арабинофуранозилурацила. Флударабин является предшественником фармацевтического препарата 5'-фосфата флударабина, широко используемого в медицине в качестве противоопухолевого препарата. 1 табл., 5 ил.
Способ получения 9-(β-D-арабинофуранозил)-2-фтораденина, включающий взаимодействие 2-фтораденозина и 1-β-D-арабинофуранозилурацила при их мольном соотношении 1:2 соответственно в калий-фосфатном буфере при нейтральном значении рН, температуре 48-52°С в присутствии пуриннуклеозидфосфорилазы в количестве 62.5 ед. акт. на 1 ммоль 2-фтораденозина и уридинфосфорилазы в количестве 62.5 ед. акт. на 1 ммоль 1-β-D-арабинофуранозилурацила.
| Способ контроля качества обработки призабойной зоны пласта | 1987 |
|
SU1439220A1 |
| EP 1464708 A1, 06.10.2004 | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-6-АЗИДО-9-(2,3,5-ТРИ-O-АЦЕТИЛ-БЕТА-D-РИБОФУРАНОЗИЛ)ПУРИНА | 2007 |
|
RU2326124C1 |
Авторы
Даты
2009-09-27—Публикация
2008-06-27—Подача