Область техники, к которой относится изобретение
Настоящее изобретение относится к протеолитическому гидролизу пептидов или полипептидов.
Уровень техники
Известно, что обогащенные пролином белки, входящие в состав пищи, такие как казеины коровьего молока или глютены зерновых культур, с трудом поддаются протеолитическому расщеплению в желудочно-кишечном тракте человека. В результате может происходить накопление пептидов с высоким содержанием пролина, что может приводить к нежелательным последствиям у определенных групп людей. Некоторые из этих последствий были отнесены на счет того факта, что пептиды с высоким содержанием пролина действуют как опиоиды, которые связываются с рецепторами в периферических тканях и центральной нервной системе. Например, синдромы, наблюдаемые у пациентов, страдающих аутизмом и шизофренией, были связаны с потреблением пищевых белков с высоким содержанием пролина. Другие последствия являются результатом непереносимости пептидов с высоким содержанием пролина. Например, конкретные последовательности, обогащенные пролином, несут ответственность за наблюдаемую токсичность глютена при целиакии (глютеновой болезни). Целиакия является широко распространенным аутоиммунным заболеванием тонкого кишечника, которое может быть вылечено только пожизненной диетой, исключающей глютен. Кроме этого целиакия иногда сопровождается психиатрическими и неврологическими симптомами, показывающими, насколько далеко идущие последствия может иметь нарушение метаболизма пептидов с высоким содержанием пролина.
Белки коровьего молока связаны с ростом и здоровьем и являются важным ингредиентом рациона человека. Казеины составляют приблизительно 80% общего количества белка в коровьем молоке, являясь важным источником аминокислот, кальция и фосфатов. Казеин ориентировочно состоит из 50% альфа-казеинов, 35% бета-казеинов, 13% каппа-казеинов и 3% гамма-казеинов. В человеческом молоке фракция альфа-казеина в основном отсутствует.
Известно, что при метаболизме казеина образуется ряд новых биологически активных пептидов. Из альфа и бета-казеиновых фракций были выделены и идентифицированы опиоидные пептиды, названные, соответственно, альфа-казоморфины и бета-казоморфины. Фармакологические эффекты, в особенности, бета-казоморфинов широко изучены. Бета-казоморфин с последовательностью Tyr-Pro-Phe-Pro-Gly-Pro-Ile является основным опиоидным пептидом коровьего молока, который называют BCM-7 (бета-казоморфин (1-7); Chang et al. (1985) Journal of Biological Chemistry, 260, 9706-9712). В отдалении от фрагмента BCM-7, в положениях 60-66 аминокислотной последовательности молекулы бета-казеина меньшие фрагменты, подобные BCM-7, такие как Tyr-Pro-Phe-Pro (бета-казоморфин (1-4)) и Tyr-Pro-Phe-Pro-Gly (бета-казоморфин (1-5)) в положениях 60-63 и 60-64 соответственно, а также все более крупные пептиды, родственные BCM-7, вплоть до длины цепи в 11 аминокислотных остатков (в положениях 60-70), проявляют по крайней мере определенную степень опиоидной активности. N-концевой трипептид BCM-7, т.е. последовательность Tyr-Pro-Phe в положениях 60-62 не обладает опиоидной активностью. Утверждалось, что генетический вариант бета-казеина, именуемый A1 (имеющий гистидиновый, а не пролиновый, как у A2 бета-казеина, остаток в положении 67) приводит к образованию меньшего количества молекул BCM-7.
Основная причина образования различных бета-казоморфинов заключается в том, что их аминокислотная последовательность относительно богата пролиновыми остатками. Поскольку пептидные связи, включающие пролиновые остатки, с трудом подвергаются протеолитическому расщеплению, бета-казоморфиновые последовательности имеет тенденцию сохраняться после воздействия желудочно-кишечных протеаз в желудке и кишечном проходе. По той же причине можно предположить, что указанные бета-казоморфиновые последовательности имеют тенденцию сохраняться после инкубирования с другими протеазами, например протеазами, которые, как правило, используются в промышленном производстве белковых гидролизатов. Это предположение подразумевает, что все широко доступные белковые гидролизаты или продукты, содержащие эти белковые гидролизаты, содержат BCM-7 или близкородственные пептиды. Поскольку пептидный фрагмент BCM-7 и родственные ему молекулы связаны с определенными заболеваниями, наличие таких молекул в белковых гидролизатах, которые достаточно часто используются в рационе питания таких групп риска как дети младшего возраста, престарелые и больные, является нежелательным. Результаты анализов связывания опиатного рецептора с человеческими и коровьими бета-казоморфинами показывают, что фрагменты, обладающие опиоидной активностью, связываются с опиатными рецепторами в мембране мозга крысы. Было показано, что бета-казеины более селективны по отношению к мю-лигандам, с небольшим сродством к дельта- и каппа- подтипам рецепторов. В соответствии с этими и другими исследованиями, утверждается, что бета-казоморфины обладают разнообразными желудочно-кишечными, болеутоляющими, респираторными, сердечно-сосудистыми, эндокринными и иммуномодулирующими воздействиями. Общая структурная особенность опиоидных пептидов, включающих остаток пролина, состоит в наличии фрагмента Tyr-Pro-Phe/Trp (Okada et al., Vitamins and Hormones 2002, 65, 257-279).
Хотя у нормальных индивидуумов пептидазы в кишечном эпителиальном слое и в крови способны справиться с расщеплением бета-казоморфинов, полагают, что это не всегда имеет место у пациентов, страдающих шизофренией, аутизмом, ADHD (синдромом дефицита внимания и гиперактивности) или другими аффективными расстройствами. Например, с появлением таких расстройств были связаны генетические изменения в ферментной активности дипептидилпептидазы плазмы IV (DPP IV), ведущие к неполному расщеплению пептидов с высоким содержанием пролина. Кроме того, постоянно обнаруживается гиперпептидурия, т.е. повышенная концентрация в моче пептидов, являющихся производными казеина или глютена (Reichelt, W.H. et al; (1997) Dev. Brain Dysfunct; 10:44-55). В настоящее время научная литература предоставляет неопровержимые доказательства того, что неполное расщепление пептидов с высоким содержанием пролина может вносить определенный вклад в развитие и тяжелое протекание подобных заболеваний. Помимо имеющегося в казеине фрагмента BCM-7, в этой связи также упоминались устойчивые к протеазам пептиды, являющиеся производными глютена. Уже в 1979 Panksepp (Trends in Neuroscience 1979; 2:174-177) предложил теорию избытка опиоидов, в которой он предположил, что нарушение метаболизма опиоидов является частью патогенеза при аутизме. В настоящее время мы понимаем, что многие пептиды с высоким содержанием пролина весьма устойчивы к расщеплению такими пептидазами желудка и поджелудочной железы, как пепсин, трипсин, химотрипсин и т.п., и что только определенные ферменты, как, например, присутствующие в числе прочих на границе ворсинок эпителиального слоя желудочно-кишечного тракта, способны гидролизовать пептидные связи, образованные пролином.
Глютен представляет собой нерастворимую фракцию белка таких зерновых культур, как пшеница, рожь, овес, ячмень, кукуруза и рис, которая остается после промывания с целью удаления крахмала и водорастворимых компонентов. Глютен может быть подразделен по растворимости на 4 основные фракции, т.е. альбумин, глобулин, проламин и глютелин. Среди перечисленных фракций проламиновые и глютелиновые фракции пшеницы, кукурузы, ячменя и овса особенно отличаются относительно высоким содержанием аминокислот пролина и глутамина. Современные данные подразумевают, что обогащенные пролином последовательности являются главным фактором в развитии целиакии. Целиакия, известная так же как глютеновая энтеропатия, представляет собой аутоиммунное заболевание тонкого кишечника, вызванное употреблением в пищу глютеновых белков. Она проявляется, как правило, в раннем детстве тяжелыми симптомами, такими как хроническая диарея и вздутие живота; в более поздний период жизни симптомы включают усталость, потерю веса из-за нарушения всасывания в пищеварительном тракте и неврологические симптомы. Среди обогащенных пролином фракций различных зерновых культур наиболее токсичными, по-видимому, являются альфа-глиадин пшеницы, гордеин ячменя, секалин ржи и авенин овса (Schuppan, D.; Gastroenterology 2000; 119:234-242). Единственным эффективным лечением пациентов с целиакией является пожизненная диета, исключающая глютен. У больных целиакией часто наблюдаются различные аутоиммунные расстройства, в особенности диабет типа 1, герпетиформный дерматит, аутоиммунный тиреоидит, расстройства, связанные с коллагеном, аутоиммунная потеря волос и аутоиммунный гепатит. Это показывает, что за счет неизвестных механизмов, не леченная целиакия вызывает предрасположенность к аутоиммунным заболеваниям других органов (Schuppan, D.; Gastroenterology 2000; 119:234-242). Более того, существуют указания на то, что легкая форма целиакии имеется у группы людей, страдающих синдромом раздраженного кишечника (IBS). IBS представляет собой расстройство, которое мешает нормальной работе толстой кишки и характеризуется спастической болью в животе, запором и диареей. IBS, как правило, начинается в возрасте около 20 лет и причиняет большое количество дискомфорта и страданий. Употребление в пищу пшеницы, ячменя, риса или молочных продуктов связано с усилением симптомов IBS.
Недавно Shan и сотрудники (Science; vol.297, 27 September 2002:2275-2279) идентифицировали пептид с высоким содержанием пролина, состоящий из 33 аминокислотных остатков и являющийся производным глиадина, который, как полагают, является источником набора основных T-клеточных эпитопов, специфичных для больных целиакией. В то время как экстракт ферментов, полученный из малых пограничных клеток кишечных ворсинок, неспособен гидролизовать этот 33-мерный пептид, добавление бактериальной пролилолигопептидазы из Flavobacterium meningosepticum ведет к быстрому расщеплению с сопутствующим сильным понижением стимуляции соответствующих T-клеточных клонов. В подражание более ранним работам по пероральному введению папаина (Messer, M. и Baume, P.E.; Lancet 1976; 2:1022) статья показывает потенциал пролилолигопептидазы в качестве пищевого фермента при детоксикации глютена ферментной терапией.
Пролилолигопептидазы (EC 3.4.21.26) обладают уникальной возможностью предпочтительного расщепления пептидов с карбоксильной стороны пролиновых остатков. В пролилолигопептидазах, выделенных из млекопитающих, а также в пролилолигопептидазах, выделенных из Flavobacterium meningosepticum, был идентифицирован специфический пептидазный домен, который не позволяет крупным структурированным белкам приблизиться к активному сайту фермента. Фактически, эти ферменты не способны расщеплять белки, содержащие более чем приблизительно 30 аминокислотных остатков, поэтому такие ферменты в настоящее время носят название «пролил олигопептидазы» (Fulop et al: Cell, Vol.94, 161-170, July 24, 1998). Все известные пролилолигопептидазы являются цитозольными ферментами, оптимальное значение pH которых находится вблизи нейтрального, причем они характеризуются тем фактом, что они неспособны эффективно расщеплять молекулы, содержащие более чем приблизительно, 30 аминокислотных остатков. Тот факт, что данные ферменты демонстрируют оптимальное значение pH, которое соответствует величинам pH, преобладающим в наиболее удаленной части желудочно-кишечного тракта, делает их идеально пригодными в качестве пищевых добавок, поддерживающих процесс переваривания поступающего с пищей глютена в кишечнике.
Другим ферментом, который может оказаться полезным для инактивации токсичных пептидов, обогащенных пролином, является фермент дипептидилпептидаза IV (US2002/0041871A). Дипептидилпептидаза IV, также именуемая Xaa-Pro-дипептидиламинопептидазой (EC 3.4.14.5), катализирует отделение N-концевого дипептида Xaa-Xbb от пептида с N-концевой последовательностью Xaa-Xbb-Xcc-, в случае если Xbb предпочтительно является пролином, при условии, что Xcc не является пролином. Дипептидилпептидаза IV была выделена из большого количества источников млекопитающих, например, богатым источником этого фермента являются пограничные мембраны кишечных ворсинок. Кроме того, фермент был выделен из таких микробных источников, как пищевые микроорганизмы Saccharomyces, Lactococcus и Aspergillus. Как и пролилолигопептидазы, все известные дипептидилпептидазы IV представляют собой ферменты с почти нейтральным оптимальным значением pH и, таким образом, они подходят для поддержания процесса расщепления в кишечнике.
Благодаря возможным применениям пролин-специфичной олигопептидазы и дипептидилпептидазы IV в лечении целиакии или шизофрении, аутизма, или других аффективных расстройств, было подано несколько заявок на патенты, относящиеся к различным аспектам данной темы. Например, патенты США 6447772 и WO 01/24816 описывают композиции, содержащие дипептидилпептидазу IV, WO 03/068170 описывает композиции, содержащие пролин-специфичные олигопептидазы, необязательно объединенные с дипептидилпептидазой IV, WO 02/45523 описывает низкоаллергенные гидролизаты белков, полученные с применением пролин-специфичных эндопротеаз, и WO 03/028745 описывает композиции, содержащие бактериальные штаммы, которые способны понижать концентрацию токсичных для кишечника пептидов с высоким содержанием пролина. WO 96/36239 описывает преимущества продуктов, полученных от крупного рогатого скота, в основном, свободного от аллели бета-казеина A1.
Сущность изобретения
Настоящее изобретение относится к способу протеолитического гидролиза пептидов или полипептидов, причем упомянутые пептиды или полипептиды содержат от 4 до 40, предпочтительно от 5 до 35, аминокислотных остатков, и упомянутые пептиды или полипептиды не подвергаются гидролизу под действием субтилизина, согласно которому упомянутые пептиды или полипептиды подвергаются гидролизу под действием пролин-специфичной эндопротеазы при pH 6,5 или ниже, предпочтительно, 5,5 или ниже и более предпочтительно 5,0 или ниже, с целью гидролиза упомянутых пептидов или полипептидов. Предпочтительно, в данном способе гидролизу подвергается не менее 70%, более предпочтительно не менее 80% и, наиболее предпочтительно, не менее 90% пептида или полипептида.
В соответствии с другим вариантом осуществления, способ по настоящему изобретению относится к способам протеолитического гидролиза пептидов или полипептидов, причем указанные пептиды или полипептиды содержат от 4 до 40, предпочтительно от 5 до 35 аминокислотных остатков и включают трипептидный фрагмент Glu-Xxx-Pro, Gln-Xxx-Pro, Tyr-Pro-Phe или Tyr-Pro-Trp, согласно которому упомянутые пептиды или полипептиды подвергаются гидролизу под действием пролин-специфичной эндопротеазы при pH 6,5 или ниже, предпочтительно, 5,5 или ниже и более предпочтительно 5,0 или ниже, с целью гидролиза упомянутых пептидов или полипептидов. Предпочтительно, в данном способе гидролизу подвергается не менее 70%, более предпочтительно не менее 80% и наиболее предпочтительно не менее 90% пептида или полипептида.
Кроме того, в настоящем изобретении разработан способ протеолитического гидролиза пептидов или полипептидов, причем указанные пептиды или полипептиды содержат от 4 до 40, предпочтительно от 5 до 35 аминокислотных остатков, и аминокислотные остатки пептидов или полипептидов включают не менее 30%, предпочтительно не менее 40%, остатков пролина и/или глутамина, согласно которому упомянутые пептиды или полипептиды подвергаются гидролизу под действием пролин-специфичной эндопротеазы при pH 6,5 или ниже, предпочтительно, 5,5 или ниже и более предпочтительно 5,0 или ниже, с целью гидролиза упомянутых пептидов или полипептидов, при условии, что пептиды или полипептиды содержат не менее 10% остатков пролина. Предпочтительно, в данном способе гидролизу подвергается не менее 70%, более предпочтительно не менее 80% и наиболее предпочтительно не менее 90% пептида или полипептида.
Пептиды или полипептиды в способе по настоящему изобретению предпочтительно включают фрагмент Gln-Xxx-Pro или Glu-Xxx-Pro и содержат 9 или более аминокислотных остатков. Эти пептиды или полипептиды преимущественно гидролизуются до пептидов, содержащих 8 или менее аминокислотных остатков. В случае, если пептиды или полипептиды включают фрагмент Tyr-Pro-Phe или Tyr-Pro-Trp, предпочтительно подвергается гидролизу связь между Pro и Phe или Pro и Trp.
Предпочтительная эндопролин-специфичная эндопротеаза, применяемая в способе по настоящему изобретению, предпочтительно представляет собой пролин-специфичную эндопротеазу, полученную из Aspergillus или принадлежащую к семейству серинпротеаз S28. Данный фермент предпочтительно имеет оптимальное значение pH ниже 6,5, предпочтительно ниже 5,5, более предпочтительно ниже 5,0, для гидролиза пептидов или полипептидов, включающих от 4 до 40, предпочтительно от 5 до 35 аминокислотных остатков, которые не подвергаются гидролизу под действием субтилизина.
Пролин-специфичные эндопротеазы могут применяться при значениях pH ниже 5,5 для гидролиза пептидов с высоким содержанием пролина, которые имеют отношение к психиатрическим расстройствам, включая аутизм, шизофрению, ADHD, биполярное аффективное расстройство и депрессию, а также расстройства, связанные с целиакией, такие как аутоиммунные расстройства, в особенности, диабет 1 типа, герпетиформный дерматит, аутоиммунный тиреоидит, заболевания, связанные с коллагеном, аутоиммунную потерю волос, а также аутоиммунный гепатит и IBS.
Этот фермент преимущественно применяется для производства пищевых продуктов, например, пива или хлеба, которые не содержат связанных с целиакией эпитопов, предпочтительно глютеновых эпитопов, более предпочтительно, эпитопов пшеницы или ячменя.
Настоящее изобретение также относится к применению пролин-специфичной эндопротеазы, которая, предпочтительно, представляет собой фермент Aspergillus, более предпочтительно Aspergillus niger, в качестве лекарственного средства или к применению в производстве лекарственных средств.
В соответствии с другим вариантом осуществления настоящего изобретения, пролин-специфичную эндопротеазу применяют для производства пищевых добавок или лекарственных средств для лечения или профилактики психиатрических расстройств, включая аутизм, шизофрению, ADHD, биполярное аффективное расстройство и депрессию, а также расстройств, связанных с целиакией, как, например, аутоиммунных расстройств, в особенности диабета 1 типа, герпетиформного дерматита, аутоиммунного тиреоидита, заболеваний, связанных с коллагеном, аутоиммунной потери волос, а также аутоиммунного гепатита и IBS.
Пролин-специфичная эндопротеаза преимущественно применяется для производства пищевых добавок или медикаментов для индивидуумов, не достигших 25-летнего возраста.
В соответствии с настоящим изобретением пролин-специфичная эндопротеаза также применяется для получения пищевых добавок или лекарственных средств, предназначенных для лечения или профилактики психиатрических расстройств, включая аутизм, шизофрению, ADHD, биполярное аффективное расстройство и депрессию, а также расстройств, связанных с целиакией, как, например, аутоиммунных расстройств, в особенности диабета 1 типа, герпетиформного дерматита, аутоиммунного тиреоидита, заболеваний, связанных с коллагеном, аутоиммунной потери волос, а также аутоиммунного гепатита и IBS.
Кроме того, настоящее изобретение относится к применению пролин-специфичной эндопротеазы для гидролиза белков или пептидов, включающих более 30 аминокислотных остатков. В целях, соответствующих настоящему изобретению, предпочтительно применяется пролин-специфичная эндопротеаза Aspergillus, более предпочтительно A. niger.
Настоящее изобретение также относится к применению пролин-специфичной протеазы, которая активна при pH 5 или ниже 5 в присутствии пепсина.
Настоящее изобретение преимущественно относится к способу протеолитического гидролиза указанных пептидов или белков, присутствующих в числе молочных белков, полученных от крупного рогатого скота, несущего аллели бета-казеина A1 или бета-казеина A2.
Кроме этого в способе по настоящему изобретению могут быть использованы белки. Во-первых, белок должен подвергаться гидролизу до пептидов, включающих от 4 до 40 аминокислотных остатков. Гидролиз белка должен быть осуществлен до процесса гидролиза по настоящему изобретению или одновременно с ним.
Помимо этого настоящее изобретение относится к применению пролин-специфичной эндопротеазы, имеющей оптимальное значение pH ниже 6,5, предпочтительно, ниже 5,5, более предпочтительно ниже 5,0, в качестве пищевой добавки, в качестве лекарственного средства, для производства пищевых добавок, для производства лекарственных средств или для производства корма, включая корм домашних животных, предназначенного для животных, предпочтительно млекопитающих, не являющихся человеком.
Подробное описание изобретения
Цели предыдущего уровня техники, в основном, заключались либо в удалении из пищи токсичных пептидов с высоким содержанием пролина до ее употребления, либо в пероральном введении корректирующих ферментов для компенсации неправильного процесса пищеварения в кишечнике. Подразумевается, что в нормальном процессе желудочно-кишечного пищеварения, первой стадией расщепления поступающих с пищей белков является протеолиз в желудке под действием фермента пепсина. Вторая стадия осуществляется в тонком кишечнике, т.е. двенадцатиперстной кишке и тощей кишке, расположенных непосредственно вслед за желудком. В двенадцатиперстной кишке происходит увеличение кислотного pH содержимого желудка за счет добавления соков поджелудочной железы, содержащих также большое количество эндо- и карбоксипептидаз. Катализируемое этими ферментами дальнейшее расщепление разрушенных пепсином пищевых белков осуществляется в полости двенадцатиперстной кишки и тощей кишки при значениях pH более 5. Перед транспортом через стенку кишечника происходит третья стадия, которая включает дальнейший гидролиз пептидов в пограничной поверхностной мембране ворсинок кишечного эпителия. Данная стадия осуществляется целым рядом протеаз, включающим DPP IV, которые локализованы в мембранах этих эпителиальных клеток. В предыдущем уровне техники предполагалось, что в кишечнике индивидуумов, страдающих некоторыми заболеваниями, на которые нацелено настоящее изобретение, некоторые из этих эпителиальных ферментов и, в особенности, DPP IV являются частично неактивными или даже вообще отсутствуют. У пациентов с целиакией уровни этих эпителиальных ферментов, вероятно, являются нормальными, но у этой группы индивидуумов даже небольшие количества определенных пептидов с высоким содержанием пролина могут спровоцировать сильный воспалительный T-клеточный ответ. Имевшееся в предшествующем уровне техники решение заключалось в том, что для минимизации уровней токсичных пептидов с высоким содержанием пролина, присутствующих в полости кишечника, в полость кишечника человека вводились корректирующие энзимы, предназначенные для перорального приема. В рамках этого подхода, в предшествующем уровне техники выбирались ферменты, как можно более близкие к природным ферментам человека, т.е. ферменты, которые активны в кишечнике при pH превышающем 5. Эти ферменты известного уровня техники неактивны в кислой среде, или же лекарственные формы для перорального введения, содержащие эти ферменты известного уровня техники, снабжены соответствующим покрытием, чтобы предотвратить их активность в кислой среде.
Авторы настоящего изобретения обнаружили, что ферменты, развивающие основную активность в условиях кислой среды желудка, предлагают лучшее решение проблемы неэффективного расщепления пептидов с высоким содержанием пролина. Данный подход является новым и открывает возможность применения для решения данной проблемы других ферментов, помимо известных в литературе.
Как обсуждалось выше, несколько публикаций были направлены на возможности применения для профилактики нарушенного метаболизма опиоидов таких ферментов, как дипептидилпептидаза IV и пролилолигопептидаза. Для этого выбраны ферменты дипептидилпептидаза IV и пролилолигопептидаза, которые, как правило, активны при значениях pH, близких к нейтральным. Смысл этого заключается в том, что указанные ферменты будут эффективно гидролизовать обогащенные пролином белки только при значениях pH выше 5. Принимая во внимание pH-профиль желудочно-кишечного тракта человека, эти ферменты известного уровня техники не станут активными до достижения дистальной части двенадцатиперстной кишки, т.е. далеко за пределами желудка. Однако дистальная часть двенадцатиперстной кишки является основным участком абсорбции белков и, как также известно, она подвергается поражению у пациентов с целиакией. Таким образом, фактически ферменты известного уровня техники начнут работать там, где уже нанесена часть ущерба.
Кроме того, ферменты известного уровня техники становятся активными только после значительного предварительного разрушения белков с высоким содержанием пролина. Время, требуемое для достижения этого предварительного разрушения под действием ферментов поджелудочной железы, еще больше ограничивает период времени, который имеется у перорально применяемых ферментов для полного гидролиза последовательностей с высоким содержанием пролина. В соответствии с настоящим изобретением применяется фермент, который способен расщеплять большинство белковых последовательностей с высоким содержанием пролина и/или глутамина до того, как пища поступает в тонкий кишечник. Обычное время пребывания пищи в желудке обеспечивает период времени, необходимый для достаточного гидролиза белков с высоким содержанием пролина или глутамина. Более того, в соответствии с настоящим изобретением предпочтительно применяется фермент, который способен расщеплять пептиды с карбоксильной стороны пролиновых остатков и, кроме того, способен расщеплять интактные белки с карбоксильной стороны пролиновых остатков, даже в присутствии пепсина. Ферменты известного уровня техники будут гидролизованы в условиях низкого pH желудка и под действием протеолитического фермента пепсина, который секретируется в желудке. Однако вплоть до настоящего момента в рамках описываемого способа неизвестно применение подобных ферментов, устойчивых к кислоте/пепсину. Подход, примененный в настоящем изобретении, приведет к значительному расщеплению пептидов, полипептидов и белков с высоким содержанием пролина еще до достижения кишечника, вместо подхода известного уровня техники, который предлагает имитировать естественный процесс гидролиза пептидов с высоким содержанием пролина в кишечнике. Предпочтительный фермент, применяемый в способе по настоящему изобретению, представляет собой фермент, который проявляет активность при значениях pH ниже 5 в присутствии пепсина, и который способен расщеплять пищевые белки или полипептиды, а также пептиды. Решения известного уровня техники во всех случаях нуждаются в коферменте, который осуществляет предварительный гидролиз пищевого белка до пептидов, и только после этого дополнительные пролин-специфичные ферменты могут начать проявление своей активности.
Термины «пептид» или «олигопептид» в рамках настоящей заявки определены как цепи, содержащие от двух до тридцати аминокислотных остатков, связанных пептидными связями. Термины «пептид» и «олигопептид» считаются синонимами (что соответствует общепринятому толкованию), и каждый из этих терминов может применяться вместо другого в зависимости от контекста. В рамках настоящей заявки «полипептид» определен как цепь, содержащая более 30 аминокислотных остатков.
Подразумевается, что пептиды или полипептиды, включающие от четырех до сорока аминокислотных остатков, которые не подвергаются гидролизу под действием субтилизина (EC 3.4.21.62), предпочтительно субтилизина Carlsberg, являются пептидами или полипептидами, которые остаются интактными после инкубирования в течение 2 часов при pH 8,0 и 60°C в суспензии или растворе, содержащем 20 г/л белка, причем соотношение фермента к субстрату составляет 0,12 AU-A (Алкалазных единиц по Anson) протеазных единиц на грамм белка. AU-A протеазная единица определена, в соответствии с указанным в Analytical Method LUNA #2003-32153-01, выпущенным Novozymes (Denmark). Интактный означает, что после инкубирования исходный пептид или полипептид образует более 80%, предпочтительно, более 90%, более предпочтительно, более 95% итоговых продуктов ферментной реакции. Практически ферментное расщепление выполняют при указанных условиях, используя 40 микролитров алкалазы на грамм имеющегося белкового субстрата. Примером такого не подвергающегося гидролизу пептида является пептид VYPFPGPIPN, образующийся при гидролизе бета-казеина, который описан в примере 4. Другим примером подобного, не подвергающегося гидролизу полипептида, является 33-мерный продукт, описанный в примере 6.
Олигопептидаза представляет собой фермент, классифицируемый как EC 3.4.21.26 и принадлежащий к семейству серинпротеаз род SC, семейство S9.
Все формулы или последовательности (олиго)пептидов и полипептидов записаны в настоящей заявке слева направо в направлении от амино-конца к карбокси-концу, в соответствии с общепринятой практикой. Буквенные коды аминокислот, используемые в заявке, общеизвестны в технике и могут быть найдены в Sambrook, et al. (Molecular Cloning: A Laborotary Manual, 2nd ed. Cold Spring Harbor Laborotary, Cold Spring Harbor Laborotary Press, Cold Spring Harbor, NY, 1989). Подразумевается, что аминокислоты Xxx, Xaa, Xbb или Xcc могут являться любыми аминокислотами. Под термином «фрагмент» подразумевается последовательность аминокислот, которая является частью пептида, полипептида или белка. В настоящей заявке имеется в виду, что глутамин (Q или Gln) является глутамином или глутаматом (E или Glu). Например, в химически дезамидированном глютене значительная часть имевшихся природных глутаминовых остатков превращена в форму глутамата. Следовательно, фрагмент Gln-Xxx-Pro также включает фрагмент Glu-Xxx-Pro. Кроме этого, в других пептидах, полипептидах или белках глутамин может быть превращен в глутамат, например, благодаря значению pH среды, температуре или с помощью ферментной реакции, например, под действием трансглутаминазы.
Под пептидом или полипептидом с высоким содержанием пролина (обогащенным пролином) имеется в виду пептид или полипептид, содержащий от 4 до 40 аминокислотных остатков, причем аминокислотные остатки пептида или полипептида включают не менее 30%, предпочтительно не менее 40%, пролиновых и/или глутаминовых остатков, при условии, что пептид или полипептид содержит не менее 10% пролиновых остатков. «Пищевая добавка», согласно адаптированному определению DSHEA, представляет собой продукт (не являющийся табаком), который предназначен для дополнения рациона питания, который несет в себе или содержит один или несколько из следующих ингредиентов рациона питания: белки, включая ферменты, полипептиды, пептиды, витамины, минералы, травы или другие растительные компоненты, аминокислоты, питательные вещества, предназначенные для использования человеком с целью дополнить рацион питания путем увеличения общего потребления, или же концентрат, метаболит, составная часть экстракт или комбинации указанных ингредиентов.
Кроме того, пищевые добавки:
- предназначены для приема внутрь в пилюлях, капсулах, таблетках или в виде жидкости;
- не предназначены для использования в качестве обычной пищи или в качестве единственной принимаемой пищи или диеты;
- в основном имеют маркировку «пищевая добавка»;
- включают такие продукты, как утвержденные новые лекарства, сертифицированные антибиотики или лицензированные биологические продукты, которые имелись на рынке в качестве пищевых добавок или пищевых продуктов до их утверждения, сертификации или лицензирования (если министр здравоохранения и социальных служб не отказал в подобном утверждении).
Токсичные пептиды или полипептиды с высоким содержанием пролина представляют собой пептиды или полипептиды, вовлеченные в связывание с опиоидными рецепторами или же в развитие или увеличение тяжести психиатрических расстройств или целиакии.
Психиатрические расстройства включают аутизм, шизофрению, ADHD, биполярное аффективное расстройство, а также депрессию.
Расстройства, связанные с целиакией, представляют собой аутоиммунные расстройства, в особенности диабет 1 типа, герпетиформный дерматит, аутоиммунный тиреоидит, заболевания, связанные с коллагеном, аутоиммунную потерю волос и аутоиммунный гепатит.
Международно-признанные схемы классификации и номенклатура всех ферментов, утвержденная IUMB, включает протеазы. Регулярно обновляемый текст IUMB с указанием номеров EC протеаз может быть найден на Интернет сайте. В данной системе ферменты определены тем фактом, что они катализируют единственную реакцию. Система подразделяет протеазы на эндо- и экзопротеазы. К эндопротеазам относят те ферменты, которые осуществляют гидролиз внутренних пептидных связей, экзопротеазы гидролизуют пептидные связи, расположенные рядом с концевой α-аминогруппой («аминопептидазы») или пептидные связи между концевой карбоксильной группой и предпоследней аминокислотой («карбоксипептидазы»). Эндопротеазы подразделены на под-подклассы на основании каталитического механизма. Существуют под-подклассы серинэндопротеаз (EC 3.4.21), цистеинэндопротеаз (EC 3.4.22), аспарагиновых эндопротеаз (EC 3.4.23), металлоэндопротеаз (EC 3.4.24) и треонинэндопротеаз (EC 3.4.25).
В WO 02/45524 описаны пролин-специфичные эндопротеазы, полученные из Aspergillus niger. Авторы настоящего изобретения неожиданно обнаружили, что эти ферменты Aspergillus успешно применимы в способе по настоящему изобретению в условиях кислой среды в желудке и могут гидролизовать в этих условиях поступающие с пищей интактные белки, полипептиды, а также меньшие пептидные молекулы. Помимо этого, данный фермент не разрушается в присутствии фермента пепсина в кислой среде и, вероятно, продолжает свою деятельность на протяжении всей двенадцатиперстной кишки. Авторы показали, что пролин-специфичная эндопротеаза, выделенная из A. niger, полностью отличается от известных пролин-специфичных протеаз, а также от глютеназ, описанных в WO 03/068170, с точки зрения активности, а также с эволюционной точки зрения. Последняя особенность в достаточной степени демонстрируется тем фактом, что гомология аминокислотных последовательностей между глютеназой, описанной в WO 03/068170, и ферментом, выделенным из A. niger, составляет, как правило, менее 20% при использовании общего алгоритма анализа совпадения последовательностей. Данный результат согласуется с современной точкой зрения, что пролилолигопептидазы не встречаются в таких грибках, как Aspergillus niger, из которых в соответствии с настоящим изобретением выделена пролин-специфичная эндопротеаза (Venäläinen, J.I. et al, Eur J Biochem 271, 2705-2715 (2004)).
Под пролин-специфичной эндопротеазой по настоящему изобретению или примененной по настоящему изобретению подразумевается, например, полипептид, упомянутый в пп.1-5, 11 и 13 формулы изобретения заявки WO 02/45524, которая включена в настоящую заявку в качестве ссылки. Следовательно, эта пролин-специфичная эндопротеаза представляет собой полипептид, который обладает пролин-специфичной эндопротеолитической активностью, выбранный из группы, состоящей из:
(a) полипептида, обладающего аминокислотной последовательностью, которая, по крайней мере, на 40% идентична аминокислотной последовательности, включающей аминокислоты с 1 по 526 из SEQ ID NO:2, или ее фрагменту;
(b) полипептида, кодируемого полинуклеотидом, который гибридизуется в условиях пониженной жесткости с (i) последовательностью нуклеиновых кислот SEQ ID NO:1 или ее фрагментом, который идентичен не менее чем на 80% или 90% на участке более 60, предпочтительно, более 100 нуклеотидов, более предпочтительно, идентичен не менее чем на 90% на участке более 200 нуклеотидов, или (ii) последовательностью нуклеиновых кислот, комплементарной последовательности нуклеиновых кислот SEQ ID NO:1. Последовательности SEQ ID NO:1 и SEQ ID NO:2 соответствуют приведенным в WO 02/45524. Полипептид предпочтительно присутствует в изолированной форме.
Предпочтительный полипептид имеет аминокислотную последовательность, которая не менее чем на 50%, предпочтительно, не менее чем на 60%, предпочтительно, не менее чем на 65%, предпочтительно, не менее чем на 70%, более предпочтительно, не менее чем на 80%, еще более предпочтительно, не менее чем на 90%, наиболее предпочтительно, не менее чем на 95% и даже еще более предпочтительно, не менее чем на, приблизительно, 97% идентична аминокислотам с 1 по 526 из SEQ ID NO:2 или содержащей аминокислотную последовательность SEQ ID NO:2.
Полипептид предпочтительно кодируется полинуклеотидом, который гибридизуется в условиях пониженной жесткости, более предпочтительно, в условиях средней жесткости и наиболее предпочтительно в жестких условиях с (i) последовательностью нуклеиновых кислот SEQ ID NO:1 или ее фрагментом или (ii) последовательностью нуклеиновых кислот, которая комплементарна последовательности нуклеиновых кислот SEQ ID NO:1.
Термин «способный гибридизоваться» означает, что целевой полинуклеотид по настоящему изобретению может гибридизоваться с нуклеиновой кислотой, используемой в качестве зонда (например, с последовательностью нуклеотидов, приведенной в SEQ ID NO:1 или ее фрагментом или комплементом SEQ ID NO:1) на уровне, значительно превосходящем фоновый. Изобретение также включает полинуклеотиды, которые кодируют пролин-специфичную эндопротеазу по настоящему изобретению, а также нуклеотидную последовательность, ей комплементарную. Нуклеотидная последовательность может представлять собой РНК или ДНК, включая геномную ДНК, синтетическую ДНК или кДНК. Предпочтительно, нуклеотидная последовательность представляет собой ДНК и, наиболее предпочтительно, последовательность геномной ДНК. Как правило, полинуклеотид по настоящему изобретению содержит непрерывную последовательность нуклеотидов, которая способна селективно гибридизоваться с кодирующей последовательностью или комплементом кодирующей последовательности SEQ ID NO:1. Такие нуклеотиды могут быть синтезированы хорошо известными в технике способами.
Полинуклеотид по настоящему изобретению может гибридизоваться с кодирующей последовательностью или комплементом кодирующей последовательности SEQ ID NO:1 на уровне значительно выше фонового. Фоновая гибридизация может иметь место, например, из-за того, что другая кДНК представлена в библиотеке кДНК. Уровень сигнала, генерируемого взаимодействием между полинуклеотидом по настоящему изобретению и кодирующей последовательностью или комплементом кодирующей последовательности SEQ ID NO:1, как правило, не менее чем в 10 раз, предпочтительно, не менее чем в 20 раз, более предпочтительно, не менее чем в 50 раз, и еще более предпочтительно не менее чем в 100 раз превосходит по интенсивности уровень взаимодействия между другими полинуклеотидами и кодирующей последовательностью SEQ ID NO:1. Интенсивность взаимодействия может быть измерена, например, внесением в зонд радиоактивной метки, например 32P. Селективная гибридизация, как правило, может быть достигнута при использовании условий пониженной жесткости (0,3 М хлорид натрия и 0,03 М цитрат натрия при температуре около 40°C), условий средней жесткости (например, 0,3 М хлорид натрия и 0,03 М цитрат натрия при температуре около 50°C) и жестких условий (например, 0,3 М хлорид натрия и 0,03 М цитрат натрия при температуре около 60°C).
Пакет UWGCG предоставляет программу BESTFIT, которую можно применять для вычисления идентичности (например, используя ее установки по умолчанию).
Алгоритмы PILEUP и BLAST N также могут быть использованы для вычисления идентичности последовательностей или для сравнения последовательностей (как, например, для идентификации эквивалентных или аналогичных последовательностей, например при установках по умолчанию).
Программное обеспечение для осуществления анализа BLAST доступно всем желающим через Национальный Центр Биотехнологической Информации (http://www.ncbi.nlm.nih.gov/). Этот алгоритм включает, во-первых, идентификацию пар последовательностей с высокой степенью соответствия (HSPs) путем идентификации коротких наборов символов длины W в запрашиваемой последовательности, которые либо совпадают, либо удовлетворяют определенному положительному пороговому значению T при сравнении с набором символов той же длины в базе данных последовательностей. T называют пороговым значением близости набора символов. Эти первоначальные совпадения близких наборов символов действуют в качестве отправной точки для инициирования поиска с целью обнаружения содержащих их HSPs. Совпадения наборов символов расширяются в обоих направлениях вдоль каждой последовательности до тех пор, пока может быть увеличено общее количество соответствий. Расширение в каждом из направлений для поиска совпадения набора символов прекращается, в случае если: общее количество соответствий уменьшается на число X по сравнению с максимальным достигнутым значением; общий счет соответствий доходит до нуля или ниже за счет накопления одной или нескольких групп остатков, вносящих отрицательный счет; или если достигнут конец любой из последовательностей. Параметры алгоритма BLAST W,T и X определяют чувствительность и скорость сверки. В программе BLAST по умолчанию используется длина набора символов (W), равная 11, матрица подсчета соответствий BLOSUM62 (B), равная 50, ожидание (E), равное 10, M=5, N=4, и сравнение обeих цепей.
Алгоритм BLAST осуществляет статистический анализ подобия между двумя последовательностями. Одной из мер подобия, предоставляемых алгоритмом BLAST, является наименьшая суммарная вероятность (P(N)), показывающая вероятность, с которой совпадение между двумя последовательностями нуклеотидов или аминокислот может появиться случайно. Например, считается, что последовательность подобна другой последовательности, если наименьшая суммарная вероятность при сравнении первой последовательности со второй последовательностью менее чем, приблизительно, 1, предпочтительно менее чем, приблизительно, 0,1, более предпочтительно менее чем, приблизительно, 0,01 и наиболее предпочтительно, менее чем, приблизительно 0,001.
Фермент по настоящему изобретению предпочтительно получают из грибков, предпочтительно Aspergillus, более предпочтительно из Aspergillus niger. Таким образом, было найдено, что фермент, выделенный из Aspergillus, действительно является эндопротеазой, стабильной к действию кислот, и, предпочтительно, не подвергающийся воздействию пепсина при преобладающих в желудке значениях pH. Пролин-специфичные олигопептидазы, включающие в основном ферменты, которые могут быть получены из Flavobacterium meningosepticum, почти не проявляют активности при значениях pH, равных 5 или ниже, и инактивируются сочетанием низких значений pH и наличия фермента пепсина. Кроме того, пролин-специфичные протеазы, как правило, не способны разрушать интактные белки, и было найдено, что они эффективно гидролизуют только пептиды меньшего размера, т.е. пептиды длиной вплоть до, приблизительно, 30 аминокислотных остатков.
В настоящем изобретении разработаны экономичные, пригодные для использования в пищу композиции, предназначенные для задержки или минимизации явлений, связанных с токсичными пептидами с высоким содержанием пролина или нарушенным метаболизмом опиоидов. Эти композиции включают пероральные ферментные составы, пригодные для пищевого, фармацевтического и ветеринарного применения, а также ферментные составы, предназначенные для получения гидролизатов белков и пищевых продуктов со значительно сниженными уровнями опиоидов или токсичных пептидов с высоким содержанием пролина.
В настоящем изобретении раскрыты способы гидролиза пептидов или полипептидов с высоким содержанием пролина, которые связаны с развитием психиатрических расстройств или целиакии, или с нарушением метаболизма опиоидов. В настоящем изобретении также раскрыты способы получения продуктов питания, которые способны предотвратить или замедлить развитие таких расстройств у детей младшего возраста или, в целом, у людей в возрасте до 25 лет. Такими способами также могут быть получены продукты питания, которые лучше переносятся людьми, страдающими целиакией и брюшными симптомами, связанными с IBS. Вариант осуществления настоящего изобретения связан с расщеплением этих пептидов или полипептидов с высоким содержанием пролина перед их употреблением, что предотвращает или минимизирует воздействие токсичных пептидов с высоким содержанием пролина на организм. У детей младшего возраста это позволит избежать воздействия опиоидов, причем незрелая иммунная система не приобретет повышенную чувствительность из-за воздействия подобных токсичных пептидов с высоким содержанием пролина. Помимо этого, рацион питания, содержащий пониженное количество токсичных пептидов с высоким содержанием пролина, будет полезным с профилактической точки зрения для подростков и взрослых, например, для людей, страдающих не выявленной целиакией или IBS. Настоящее изобретение также относится к добавлению подходящих ферментов для расщепления указанных токсичных пептидов с высоким содержанием пролина в организме (человека или животного) или пептидов в желудке, т.е. при значениях pH, соответствующих кислой среде, предпочтительно, при значениях pH ниже 5. В соответствии с последним вариантом осуществления изобретения люди, страдающие целиакией, заболеваниями, связанными с целиакией, или заболеваниями, вызванными пониженным уровнем пролин-специфичных протеаз в организме, и нуждающиеся в расщеплении этих пептидов или полипептидов, приобретают способность расщеплять соответствующие пептиды или полипептиды с высоким содержанием пролина в желудке и в проксимальной части двенадцатиперстной кишки. Кроме того, ферменты по настоящему изобретению не нуждаются в защитных покрытиях.
Предпочтительно, не менее 80% пептидов или полипептидов с высоким содержанием пролина, которые образуются при инкубировании пептидов, полипептидов или белков с субтилизином (EC 3.4.21.62), предпочтительно субтилизином Bacillus licheniformis (или субтилизином Carlsberg) в среде с нейтральным значением pH, гидролизуются пролин-специфичными эндопротеазами по настоящему изобретению. Образование подобных устойчивых к субтилизину пептидов иллюстрируется примером 4 настоящей заявки. Такие устойчивые к субтилизину пептиды с высоким содержанием пролина часто связаны с упомянутыми выше заболеваниями. Примерами таких пептидов являются BCM-7 и родственные BCM-7 пептиды, т.е. пептиды, содержащие последовательность аминокислот YPFP, которая занимает положения с 60 по 63 в молекуле бета-казеина. Кроме того, примерами таких пептидов служат пептиды, являющиеся производными глиадина, которые содержат фрагмент Gln-Xxx-Pro (Q-X-P), например, эпитоп PYPQPQLPY, а также другие устойчивые к субтилизину молекулы, которые могут быть получены из глиадина, гордеина, секалина или авенина, и содержащие тот же самый фрагмент Q-X-P или E-X-P. Более предпочтительно, не менее 90%, еще более предпочтительно, не менее 95% и наиболее предпочтительно, не менее 99% пептидов с высоким содержанием пролина, которые образуются при гидролизе под действием субтилизина, расщепляются или не образуются при применении пролин-специфичной эндопротеазы по настоящему изобретению. Более предпочтительно, эти пептиды с высоким содержанием пролина могут быть разрушены по способу настоящего изобретения при значениях pH ниже 5,5.
Один из путей получения требуемых ферментов мог бы заключаться в употреблении их в форме средств для содействия пищеварению, например, в виде стабилизированных ферментных составов, которые принимаются совместно с пищей, для того чтобы помочь желудочно-кишечному усвоению пищевых пептидов или полипептидов с высоким содержанием пролина. Другой путь мог бы заключаться в предотвращении или ограничении поступления проблемных токсичных последовательностей с высоким содержанием пролина, например, путем употребления белковой пищи, «предварительно переваренной» под действием фермента Aspergillus. Такая белковая пища могла бы употребляться в форме гидролизата, например, гидролизата глютена или молочного белка, и включать гидролизаты, белки которых в значительной степени разрушены действием эндо- и экзопротеаз для высвобождения значительных количеств свободных аминокислот. Типовым примером последнего применения могло бы являться получение гидролизатов глютена с высоким содержанием глутамата для получения пищевых приправ. Гидролизат мог бы употребляться сам по себе, или мог бы служить ингредиентом пищи. В другом аспекте изобретение относится к применению композиции для улучшения переносимости продуктов питания, которое отличается тем, что композиция содержит устойчивую к действию кислот пролин-специфичную эндопротеазу по настоящему изобретению. В еще одном аспекте изобретение относится к способу получения продуктов питания, содержащих добавки устойчивой к действию кислот пролин-специфичной эндопротеазы, для улучшения переносимости продуктов питания. Во всех подобных применениях пролин-специфичный фермент применялся бы в качестве т.н. технологической добавки.
Штаммы рода Aspergillus имеют статус пригодных для употребления в пищу, причем известно, что ферменты, выделенные из этих микроорганизмов, получены из источника, несомненно пригодного для употребления в пищу. В соответствии с другим предпочтительным вариантом осуществления изобретения, фермент секретируется продуцирующей его клеткой, а не является не секретируемым, т.н. цитозольным или периплазматическим ферментом. Таким образом, ферменты могут быть повторно получены из клеточного бульона в основном в чистом состоянии, без дорогостоящих стадий очистки. Фермент предпочтительно имеет высокое сродство к своему субстрату при широко распространенных значениях pH и температурных условиях. Предпочтительно, фермент не подвергается инактивации такими желудочно-кишечными протеолитическими ферментами, как пепсин или трипсин, эластаза и химотрипсин при значениях pH, характерных для соответствующей части желудочно-кишечного тракта. Более предпочтительно, фермент остается активным в желудке, а также в двенадцатиперстной кишке и не нуждается в защитном покрытии.
Пищеварительный тракт человека представляет собой последовательность различных отделов. Пища проглатывается и после проглатывания достигает желудка, где она смешивается с кислотой и эндопротеазой пепсином. Обычное время пребывания твердой пищи в желудке находится в пределах от одного до нескольких часов. Происходящее время от времени открытие пилоруса позволяет пище, которая смешана с кислотой и частично гидролизована, поступать в тонкий кишечник. В первой части тонкого кишечника, т.е. в двенадцатиперстной кишке к пище добавляется желчь, а также сок поджелудочной железы. Сок поджелудочной железы содержит бикарбонаты, для частичной нейтрализации содержимого желудка. Кроме этого, сок поджелудочной железы содержит дополнительный набор протеаз, т.е. эндопротеазы трипсин, химотрипсин и эластазу, а также карбоксипептидазы A и B для дальнейшего расщепления пептидов и полипептидов, образовавшихся в желудке под действием пепсина. После двенадцатиперстной кишки перевариваемая пища достигает тощей кишки. Двенадцатиперстная кишка и тощая кишка являются основными местами усвоения белков в желудочно-кишечном тракте. Процесс усвоения включает дальнейшее протеолитическое расщепление пищевых белков различными протеазами, закрепленными на пограничных клетках ворсинок кишечного эпителия. Последняя из упомянутых стадий гидролиза сопровождается облегчением транспорта небольших пептидов, а также свободных аминокислот через стенку кишечника. Заключительная часть тонкого кишечника образована подвздошной кишкой, после которой перевариваемая пища поступает в толстую кишку (ободочную кишку). В ободочной кишке имеет место интенсивная ферментация, но отсутствует заметное поглощение аминокислот или пептидов.
Употребление в пищу глютена пациентами с целиакией, ведет к поражениям проксимальной области тонкого кишечника. Атрофия кишечных ворсинок является одной из наиболее характерных особенностей таких поражений. Атрофия ворсинок не ограничена тощей кишкой, но также может проявляться в дистальной части двенадцатиперстной кишки (Meijer, J.W.R. et al; Virchows Arch. 2003 Feb; 442:124-128). Наблюдения показывают, что у пациентов с целиакией повреждающее воздействие токсичных пептидов с высоким содержанием пролина заметно уже в области, находящейся непосредственно за желудком по ходу движения пищи. Авторы изобретения обнаружили, что ферментная терапия, цель которой заключается в профилактике симптомов целиакии, должна быть направлена на гидролиз соответствующих пептидов с высоким содержанием пролина в желудке, а не в более удаленной части желудочно-кишечного тракта. Активность фермента, применяемого в ферментной терапии, преимущественно такова, что он начинает работать в желудке и продолжает оставаться активным в двенадцатиперстной кишке. Авторы изобретения обнаружили, что опиоидные пептиды, которые играют определенную роль в развитии психиатрических, респираторных и сердечно-сосудистых расстройств, также лучше разрушать в желудке. Поскольку двенадцатиперстная кишка и тощая кишка являются основными местами усвоения белков, содержание токсичных пептидов в этой части тонкого кишечника должно быть как можно более низким, для минимизации симптомов, связанных с присутствием этих токсичных пептидов.
При использовании в качестве средств для содействия пищеварению, корректирующие ферменты должны обладать существенной активностью при температуре 37°С и, предпочтительно, должны иметь низкое оптимальное значение pH, чтобы не подвергнуться разрушению в условиях кислой среды желудка. В соответствии с опубликованными данными кислотность поступившей в желудок пищи снижается от исходного значения pH 5 до pH 3,5 в течение тридцати минут после приема пищи, с последующим дальнейшим понижением до pH 2 в течение 60 минут после приема (тезисы Mans Minkus; Uiversity of Utrecht, the Netherlands; ISBN: 90-393-1666-X). Поэтому, идеальные ферменты, предназначенные для ферментной терапии, должны проявлять активность при таком низком значении pH как 2. Исследования по опорожнению желудка показывают, что через 45 минут после поступления, почти 90% твердой пищи все еще находится в желудке (R.Notivol et al., 1984. Scand J.Gastroenterol. 19:1107-1113). За желудком значение pH перевариваемой пищи медленно возрастает, достигая pH 5 в дистальной части двенадцатиперстной кишки, т.е. приблизительно в 50 см после желудка (Handbook of Physiology, American Phisiologcal Society, Washington, D.C., 1968, Ed. Werner Heidel; Section 6: Alimentary Canal, Vol.111, pp.1457-1490). В WO 03/068170 описаны различные «глютеназы», которые могут снизить уровни токсичных глютеновых олигопептидов в продуктах питания либо до, либо после приема в пищу пациентом. Термин «глютеназа» относится к протеазам или пептидазам, более конкретно пролил-специфичным протеазам, которые способны расщеплять токсичные олигопептиды глютеновых белков на нетоксичные фрагменты. Поскольку все упомянутые глютеназы, как правило, предназначены для проявления активности в кишечнике, они имеют оптимальную активность при почти нейтральных значениях pH. В WO 03/068170 предложено разложение токсичных пептидов с высоким содержанием пролина в двенадцатиперстной кишке или за ней, а не в желудке или проксимальной части двенадцатиперстной кишки. Кроме того, WO 03/068170 нацелена на получение ферментов, защищенных т.н. кишечными покрытиями, которые не дают проявляться ферментной активности при низких значениях pH, так что имеющиеся ферменты будут проходить через желудок и становиться активными только в кишечнике в условиях нейтральной среды.
При применении в качестве технологической добавки в производстве гидролизатов белков, фермент должен демонстрировать значительную активность при условиях, которые допускают инкубирование, безопасное с точки зрения присутствия микробов в не стерильных условиях промышленного производства. Адекватная ферментная активность при температуре переработки 50°C и значении pH существенно ниже 5,5 удовлетворяет этим требованиям.
Было показано, что и базидиомицеты Agaricus bisporus (Sattar et al; J.Biochem. 107, 256-261 (1990)), и не родственные им аскомицеты Aspergillus niger (WO 02/45524) вырабатывают внеклеточные пролилэндопептидазы. Однако фермент, выделенный из базидиомицетов, не выдерживает значений pH ниже 5 и, следовательно, является менее привлекательным. Предпочтительно применяется пролилэндопептидаза A. niger, которая имеет оптимальное значение pH в кислотной области.
В настоящем изобретении разработаны ферментные препараты, которые сочетают низкую стоимость и приемлемость с точки зрения законодательства с доказанной эффективностью в отношении пептидных последовательностей с высоким содержанием пролина в условиях кислой среды. Предпочтительно, те же ферменты могут применяться для разрушения не только бета-казоморфинов типов A1 и A2, но и различных глютеновых эпитопов.
Было обнаружено, что эти пролин-специфичные эндопротеазы, выделенные из Aspergillus, проявляют значительную активность при расщеплении пептидов, полипептидов или даже белков с высоким содержанием пролина. Данный фермент преимущественно секретируется вырабатывающим его микроорганизмом в ферментативный бульон, имеет оптимальное значение pH в кислотной области и может быть получен пригодным для употребления в пищу экономичным путем. Соответствующие пептиды бета-казоморфина содержат до четырех остатков пролина в молекуле и, кроме того, бета-казоморфины A1 и A2 имеют различные аминокислотные последовательности. Совершенно неожиданно авторы обнаружили, что фермент Aspergillus способен гидролизовать бета-казоморфины с C-концевой стороны пролинового остатка в положении 61 и, таким образом, эффективно инактивировать BCM-7 и родственные BCM-7 пептиды как для бета-казеина A1, так и для A2. Этот факт является весьма примечательным, поскольку авторы обнаружили, что такая широко применяемая и высоко агрессивная эндопротеаза, обладающая специфичностью к большому кругу субстратов, как субтилизин (EC 3.4.21.64), коммерчески доступный как, например, Алкалаза, не способен разрушить BCM-7. Подобным же образом, другие промышленно доступные протеазы не способны расщепить BCM-7. Фактически, выделенная из Aspergillus пролин-специфичная эндопротеаза может гидролизовать бета-казоморфин, но, что полностью неожиданно, только по одному из четырех пролиновых остатков, имеющихся в BCM-7. Тем не менее, благодаря специфичности данного конкретного фермента Aspergillus к данному конкретному остатку пролина, BCM-7, также как все родственные BCM-7 молекулы эффективно разрушаются при инкубировании с данным ферментом, т.к. фермент расщепляет фрагмент Tyr-Pro-Phe. Кроме того, молекулы BCM-7, полученные из бета-казеинов A1 и A2, инактивируются при инкубировании с пролин-специфичной эндопротеазой Aspergillus.
Преимущество этой пролин-специфичной эндопротеазы заключается в том, что пролин-специфичная эндопротеаза может начать гидролиз последовательностей с высоким содержанием пролина непосредственно в момент вступления в контакт фермента с белком. Пролилолигопептидазы могут стать активными лишь после значительного предварительного расщепления молекул глютена или казеина под действием других, например, желудочно-кишечных эндопротеаз. Ввиду необходимости глубокого распада и ограниченного количества времени до попадания пищи в тонкий кишечник, применение настоящей пролин-специфичной эндопротеазы обладает значительными преимуществами перед известными олигопептидазами. Другое преимущество настоящей пролин-специфичной эндопротеазы состоит в том, что она может применяться в промышленности для уменьшения уровня токсичных пептидов с высоким содержанием пролина в глютене без полного разрушения структуры глютена. Например, экструдирование глютеновой пшеничной пасты вместе с выделенным из Aspergillus ферментом приведет к продукту с некоторыми остаточными структурными свойствами, но с сильно пониженным уровнем токсичных пептидов с высоким содержанием пролина. Для достижения того же самого снижения токсичных обогащенных пролином пептидов с помощью пролилолигопептидазы потребовался бы почти полный предварительный гидролиз другими протеазами, чтобы достичь желаемой длины пептидов менее 30 аминокислотных остатков. Не приходится и говорить, что это приведет к полной потере всех значимых физико-химических свойств глютена, т.е. к потере консистенции теста и будет исключена возможность выпечки хлебных изделий приемлемой формы и объема. Di Cango и соавторы (Appl. Environ. Microbiol., Vol.70(2)1088-1096, 2004) описывают изготовление хлеба из теста на закваске, который хорошо переносится пациентами с глютеновой энтеропатией. В их способе уровень токсичных эпитопов с высоким содержанием пролина минимизирован за счет использования теста, приготовленного с использованием значительной части нетоксичной муки, и брожения смеси с отобранными молочнокислыми бактериями в течение 24 часов. Хотя их результаты, безусловно, представляют научный интерес, очевидно, что столь длительный период ферментации среды, как 24 часа, неосуществим в промышленности. Кроме того, использованная ими значительная часть нетоксичной муки подразумевает, что будет иметься недостаток «нормального» глютена, из-за чего объем полученных хлебных изделий будет ограничен. Следовательно, было бы выгодно воспользоваться экономичным способом, который делает возможным изготовление 100% пшеничного хлеба с применением существующих промышленных методик, но с ограниченными уровнями токсичных пептидов с высоким содержанием пролина. Такие разновидности хлеба могут стать важным компонентом диет, нацеленных на уменьшение ежедневного поступления токсичных пептидов. Группы потребителей, для которых такая диета может оказаться особенно подходящей, включают детей младшего возраста, подростков, страдающих IBS, пожилых людей и индивидуумов, страдающих описанными выше заболеваниями и симптомами. Хотя для пациентов с целиакией дневное поступление глютена менее 50 миллиграмм считается безопасным, любая диета, включающая значительно меньше токсичных пептидов с высоким содержанием пролина, чем 13 г глютена в день, как это в среднем имеет место в западных странах, вероятно, является полезной для упомянутых выше групп потребителей.
Все эти соображения вместе взятые, показывают новые и значительные преимущества ферментов, выделенных из A. niger над ферментами, известными из уровня техники. Композиции, содержащие ферменты по настоящему изобретению, успешно применяются для уменьшения или замедления повышения чувствительности к глютену, явлений нарушенного метаболизма опиоидов или явлений IBS. Такие композиции могут применяться в качестве средств для содействия пищеварению с целью достижения in situ понижения уровней токсичных пептидов с высоким содержанием пролина в желудочно-кишечном тракте. С другой стороны, такие композиции могут применяться в качестве технологических добавок для получения гидролизатов белков, не содержащих упомянутых токсичных пептидов, обогащенных пролином. Среди прочих гидролизатов белков особым случаем является изготовление пива, в котором применение полученной из A. niger пролин-специфичной эндопротеазы с низким оптимумом pH предлагает неожиданно большое количество преимуществ. Согласно WO 02/046381 применение пролин-специфичных эндопротеаз либо во время стадии приготовления сусла, либо перед фильтрацией пива, либо перед выдерживанием пива, снижает количество мути в пиве. Имеющиеся у авторов настоящего изобретения данные показывают, что проведенное соответствующим образом инкубирование с ферментом, имеющим низкий оптимум pH, также понижает уровень токсичных пептидов с высоким содержанием пролина, образующихся из зерновых культур. Неожиданно мы обнаружили, что обработка пива или других напитков, содержащих зерновые белки, пролин-специфичной эндопротеазой не только приводит к понижению количества мути, но кроме этого позволяет получить продукты, которые будут безопасными для людей, страдающих целиакией.
Пример 1 настоящей заявки показывает кислотный оптимум pH и идеальный температурный оптимум пролин-специфичной протеазы, полученной из Aspergillus. В примерах 2 и 3 авторы показали, что пролин-специфичная эндопротеаза, вырабатываемая Aspergillus niger, действительно представляет собой пролин-специфичную эндопротеазу, которая может расщеплять большие интактные белки столь же эффективно, как и меньшие по размеру пептиды или полипептиды. Фактически данные авторов изобретения показали, что фермент Aspergillus является новым членом семейства S28, а не семейства S9, к которому принадлежат известные олигопептидазы (N.D. Rawlings и A.J.Barret, Biochimica & Biophisica Acta 1298(1996)1-3). Авторы обнаружили, что в противоположность известным олигопептидазам, пролилэндопротеаза Aspergillus niger активна в условиях кислой среды в желудке и демонстрирует высокую эффективность в отношении гидролиза крупных фрагментов и полипептидов с высоким содержанием пролина. Эта высокая эффективность проиллюстрирована в примерах 4, 5 и 6. В примере 4 авторы показали, что в процессе получения гидролизатов молочного белка с помощью алкалазы, т.е. агрессивной протеазы широкого спектра действия, часто применяемой при получении гидролизатов белков, несколько пептидов, включая последовательности BCM-7, сохраняли свою целостность в результате гидролиза. Однако эти пептиды быстро исчезали при инкубировании в кислой среде с пролилэндопротеазой, выделенной из Aspergillus. Данные, представленные в примере 5, выявили неожиданный факт, что фермент Aspergillus отщепляет только один из четырех пролиновых остатков, имеющихся в молекуле BCM-7, полученной из бета-казеина A2. Это показывает, что инкубирование субстрата с высоким содержанием пролина с пролин-специфичной протеазой не подразумевает автоматического расщепления всех пептидных связей, включающих пролиновые остатки, даже в условиях резко увеличенного соотношения фермент/субстрат. В примере 6 авторы продемонстрировали эффективность пролилэндопротеазы, полученной из Aspergillus в отношении 33-мерного производного глиадина, которое, как утверждалось, является основным эпитопом для пациентов с целиакией. Хотя алкалаза широкого спектра действия вновь не смогла расщепить эту молекулу, ни в кислой, ни в щелочной среде, фермент, выделенный из Aspergillus, быстро расщеплял данную молекулу в кислой среде, образуя 99,5% пептидов с максимальной длиной в 6 аминокислотных остатков. Таким образом, несмотря на высокую эффективность в отношении пептидов с высоким содержанием пролина в кислой среде, даже фермент Aspergillus оставлял нетронутыми, по крайней мере, 0,5% гептамера с аминокислотной последовательностью YPQPQLP. Поскольку последовательность YPQPQLP представляет собой известный специфичный для пациентов с целиакией T-клеточный эпитоп, полученные данные показывают, что в случае не самых оптимальных пролин-специфичных ферментов, как, например, известных пролин-специфичных олигопептидаз, включая ферменты Flavobacterium meningosepticum, практическое применение in vivo с целью предотвратить образование токсичных пептидов из молекул глютена будет, скорее всего, невозможно. Этот вывод подтверждается экспериментами, описанными в примерах 7 и 8. В примере 7 авторы сравнили кривые активности пролин-специфичной эндопротеазы A. niger и пролин-специфичной олигопептидазы F. meningosepticum в диапазоне значений pH 2-12. В то время как фермент A. niger демонстрирует активность в диапазоне pH 2,5-7, ферменту F. meningosepticum, чтобы стать активным, требуются значения pH свыше 5,0. В примере 8 авторы имитировали ситуацию в желудке, поместив оба пролин-специфичных фермента в среду с низким значением pH в отсутствие и в присутствии желудочного фермента пепсина. Последующее измерение активности при оптимальных для каждого из ферментов значениях pH среды показало, что фермент F. meningosepticum не способен сохранять устойчивость при значениях pH 2 или pH 3. В противоположность этому, фермент A. niger перенес столь низкую кислотность среды, как pH 2, и даже в присутствии пепсина, что подчеркивает его ценность для гидролиза токсичных пептидов в желудке. В примере 9 авторы показали, что фермент, выделенный из A. niger, способен расщеплять большое количество известных эпитопов глютена HLA-DQ2. Интересно, что положения наблюдаемых сайтов расщеплений позволяют предсказать разрушение всех известных в литературе T-клеточных эпитопов. В примере 10 авторы выделяли глютеновые эпитопы из 100% солодового пива и 100% пшеничного хлеба и показывали, что имеется возможность обнаружения этих эпитопов в анализе с использованием антител. В примере 11 авторы показали, что пиво, полученное при включении в процесс производства ферментов A. niger, содержит значительно меньшее количество глютеновых эпитопов. В примере 12 авторы показали, что подобный результат может быть получен при включении фермента в состав пшеничного теста для выпечки голландского формового хлеба с пониженным содержанием глютеновых эпитопов.
Глютен представляет собой нерастворимое в воде вещество со сложной трехмерной структурой. Эти свойства глютена в сочетании с его аминокислотным составом, обогащенным пролином, делают молекулы глютена устойчивыми к протеолизу в желудке и кишечнике. Поскольку ни одно из секретируемых в желудочно-кишечный тракт природных веществ, обладающих протеолитической активностью, не способно к расщеплению пептидных связей, образованных пролином, имеет смысл применение синергического экзогенного пролин-специфичного фермента. Однако люди, страдающие целиакией, могут быть крайне чувствительны ко многим эпитопам, имеющимся в глютене. По настоящему изобретению действие природных пищеварительных протеаз может быть улучшено пролилэндопротеазой, выделенной из Aspergillus, причем в настоящей заявке раскрыто дополнительное улучшение гидролитической способности данной протеолитической смеси.
Хорошо известно, что пептидные связи, образованные отрицательно заряженными остатками, такими, как Glu (E) и Asp (D), представляют собой плохие субстраты для протеаз. Кроме того, природные желудочно-кишечные протеолитические ферменты не могут справиться с этими остатками, что доказано выделением из глиадина пептида WQIPEQSR, устойчивого к действию протеаз желудка и поджелудочной железы (ср. Shan et al). Последняя публикация также делает очевидным тот факт, что повсеместно присутствующие глутаминовые остатки (Q) в глютене могут быть деамидированы до глутаматных остатков (E) под действием трансглутаминазы. К сожалению, это региоспецифичное деамидирование глиадиновых пептидов дополнительно увеличивает их иммуногенный потенциал. В ответ на эти предпосылки авторы разработали эффективную комбинацию ферментов, состоящую из пролин-специфичной эндопротеазы, полученной из Aspergillus, и вспомогательной эндопротеазы, предотвращающей образование токсичных пептидов с высоким содержанием пролина. В соответствии с настоящим изобретением могут быть применены глутамат-специфичные эндопротеазы (EC3.4.21.19), сверхсекреция которых осуществляется целым рядом микроорганизмов пищевой кондиции, например, Bacillus и Streptomyces. Эти ферменты могут быть получены экономичным способом, пригодным для получения продуктов питания. Ферменты, которые могут проходить через желудок неповрежденными с учетом их ферментной активности, являются предпочтительными. В основном такие ферменты будут иметь кислотный или нейтральный оптимум pH. В сочетании с пролилэндопротеазой Aspergillus, эта категория глутамат-специфичных эндопротеаз оказывается применимой при получении гидролизатов белков с низким содержанием обогащенных пролином пептидов.
Полностью неожиданно настоящее исследование демонстрирует, что помимо глутамат-специфичных эндопротеаз существуют другие эндопротеазы, которые обладают синергическим эффектом при инкубировании с пролин-специфичной эндопротеазой, выделенной из Aspergillus. Авторы пришли к выводу, что эндопротеазы (EC 3.4.21-99) способны к расщеплению связи между аминокислотными остатками Q (глутамин) и L (лейцин) и хорошо сочетаются с пролин-специфичной эндопротеазой из Aspergillus. Особенно успешно применимы эндопротеазы, которые имеют оптимальное значение pH ниже 5,0, и предпочитают либо глутаминовый, либо лейциновые остатки в положениях P1 или P1' субстратов, такие как аспарагиновые протеазы аспергиллов (EC 3.4.23.18 и 19) и мукоропепсины (EC 3.4.23.23).
Одно из применений ферментов по настоящему изобретению заключается в использовании их в качестве средств для содействия пищеварению. В этом применении композиции по настоящему изобретению предпочтительно вводятся перорально, но могут вводиться также другими прямыми путями. Композиции, как правило, вводят людям, но их можно также вводить и животным, предпочтительно млекопитающим, с целью облегчения симптомов, характерных для повышенной чувствительности к глютену, или при нарушениях метаболизма казеина или глютена, или при IBS. При применении в качестве средств для содействия пищеварению, ферменты по настоящему изобретению могут входить в состав сухих рецептур в форме, например, пилюль, таблеток, гранул, саше или капсул. С другой стороны ферменты по настоящему изобретению могут включаться в состав жидких рецептур, например, сиропа или капсулы, или же они могут быть включены в пищевые продукты с активностью воды (Aw) ниже 0,85. Композиции, применяемые в различных составах и содержащие ферменты по настоящему изобретению, могут также включать, по крайней мере, одно соединение из группы, состоящей из физиологически приемлемого носителя, вспомогательного вещества, наполнителя, стабилизатора, буфера и разбавителя, причем перечисленные термины используются в их обычном смысле, для обозначения веществ, которые содействуют упаковке, доставке, абсорбции, стабилизации или, в случае вспомогательных веществ, улучшению физиологического результата действия ферментов. Соответствующие данные по различным соединениям, которые могут применяться в сочетании с ферментами по настоящему изобретению в порошкообразной форме, могут быть найдены в “Pharmaceutical Dosage Forms”, second edition, Volumes 1,2 и 3, ISBN 0-8247-8044-2 Marcel Dekker, Inc. Хотя ферменты по настоящему изобретению, включенные в состав сухих порошков, могут храниться в течение относительно продолжительного периода, следует избегать их соприкосновения с влагой или влажным воздухом, за счет выбора подходящих упаковок, таких как, например, блистерная упаковка. В случае включения в состав жидкостей, важную роль играют соединения, используемые для стабилизации ферментной активности и предохранения от микробов. Стабилизация ферментной активности может потребовать понижения активности воды, что может быть достигнуто применением полиолов, таких как глицерин, или различных сахаров. Кроме того, своим стабилизирующим действием известны двухвалентные катионы, такие как Ca2+ или Mg2+, а также восстанавливающие агенты, как, например серосодержащие аминокислоты или фенольные соединения, такие как BHT или пропилгаллат. Предохранение от микробов, соответствующее пищевой кондиции, может быть достигнуто за счет применения хорошо известного сочетания среды с низким pH и низкой активности воды, с помощью сорбатов, бензоатов или парабенов. Кроме того, могут потребоваться пищевые загустители, такие как гидроколлоид. Относительно новой формой перорального применения является использование желатиновой капсулы, содержащей жидкость. В данном применении жидкость, как правило, представляет собой масло или полиэтиленгликоль, или лецитин, в котором могут быть суспендированы высушенные ферменты по настоящему изобретению. Примеры составов таблеток с улучшенной стабильностью ферментов приведены в US 2002/0136800.
Описание чертежей
Фиг.1: Графическое представление оптимального значения pH пролин-специфичной эндопротеазы, выделенной из A. niger, полученное при использовании в качестве субстрата синтетического пептида Z-Gly-Pro-pNA (ср. пример 1).
Фиг.2: SDS-PAGE интактного овальбумина и синтетического 27-мерного пептида после инкубирования с очищенной хроматографией пролин-специфичной эндопротеазой, выделенной из A. niger (ср. пример 3).
Фиг.3: Графическое представление оптимального значения pH пролин-специфичных эндопротеаз, выделенных из A. niger и F. meningosepticum (ср. пример 7).
Материалы и методики
Материалы
У фирмы Sigma были получены следующие ферменты: амилоглюкозидаза из Aspergillus niger, 300 Ед/мл, Sigma A-7095; пепсин из слизистой оболочки желудка свиньи, 2331 Ед/мг, Sigma-P-7012; трансглутаминаза морской свинки, Sigma T-5398. 2,5% раствор трипсина был получен у Gibco (BRL 25090-028) и картриджи Sep-Pak Plus tC18, Walters № 036810 у фирмы Walters. Alcalase® AF 2,4L, обладающая активностью 2,6 AU(A) (алкалазных единиц Anson) единиц/грамм продукта была получена у Novozymes A/S (Bagsvaerd, Denmark). Согласно Novozymes, подробности данного измерения активности могут быть найдены в Novozymes Analitical Method (LUNA#2003-32153-01/SOP №:EB-SM-0218.02/02).
Синтетические пептиды были получены у Pepscan Systems B.V. (Lelystad, The Netherlands). Хромогенные пептидные субстраты были получены либо у Pepscan Systems, либо у Bachem, Switserland.
Пролин-специфичная эндопротеаза из A. niger
Сверхсинтез и хроматографическую очистку пролин-специфичной эндопротеазы из Aspergillus niger проводили, как описано в WO 02/45524. Активность фермента (1 ед/10 мг белка) испытывали на синтетическом пептиде Z-Glu-Pro-pNA при 37°C в буфере цитрат/динатрийфосфат pH 4,6. За продуктом реакции наблюдали спектрофотометрически при 405 нм. Активность коммерчески доступного фермента пролилолигопептидазы (приобретенного у ICN Biomedicals/MP Biomedicals, Aurora, Ohio, US) составляла 35 единиц на мг продукта, причем ее испытывали на Z-Glu-Pro-pNA при 30°C в буфере с pH 7. За продуктом реакции наблюдали спектрофотометрически при 405 нм. Для обоих ферментов единица определена как количество фермента, которое способствует выделению 1 мкмоль п-анилида в минуту при указанных выше условиях.
Анализ ЖХ/МС
Для характеристики продуктов ферментного гидролиза белков, полученных при действии смеси ферментов по настоящему изобретению, применяли ВЭЖХ, использующую масс-спектрометр с ионной ловушкой (Thermo Electron®, Breda, the Netherlands), соединенный с насосом P4000 (Thermoquest®, Breda, the Netherlands). Пептиды разделяли, используя колонку PEPMAP C18 300A (MIC-15-03-C18-PM, LC Packing, Amsterdam, The Netherlands), в сочетании с градиентом 0,1% муравьиной кислоты в Milli Q water (Millipore, Bedford, MA, USA; раствор A) и 0,1% муравьиной кислоты в ацетонитриле (раствор B) для элюирования. Градиент начинали с 95% раствора A, в течение 140 минут увеличивали содержание раствора B до 40% и сохраняли последнее соотношение в течение еще 5 минут. Вводимый объем составлял 50 микролитров, скорость потока равнялась 50 микролитров в минуту, и температуру колонки поддерживали на уровне 30°C. Концентрация белка во вводимом образце составляла, приблизительно, 50 микрограмм/миллилитр.
Подробную информацию об отдельных пептидах получали, применяя «скан-зависимый» МС/МС алгоритм, который представляет собой типовой алгоритм для масс-спектрометров с ионной ловушкой.
За полным сканирующим анализом следовал более детальный сканирующий анализ для определения заряда наиболее интенсивного иона в полном диапазоне сканированных масс. Следующий затем МС/МС анализ этого иона приводил к частичной информации о пептидной последовательности, которая могла бы быть использована для поиска в базе данных с применением приложения SEQUEST из Xcalibur Bioworks (Thermoquest®, Breda, the Netherlands). Используемые банки данных извлекали из OWL.fasta databank, который доступен в NCBI (National Centre for Biotechnology informatics) и содержит белки, представляющие интерес для использованного приложения. В этих экспериментах, когда измерению подвергались хорошо охарактеризованные белковые субстраты, как, например, белки сыворотки или казеины, точность аналитической методики увеличивалась за счет исключения из рассмотрения МС/МС спектров с соответствием последовательностей менее 50%.
Ангиотензин (M=1295,6) применяли для настройки оптимальной чувствительности в режиме МС и для оптимальной фрагментации в режиме МС/МС, осуществляя непрерывное введение 60 микрограмм/мл, приводившее, в основном, к частицам с двойным и тройным зарядом в режиме МС и оптимальной энергии столкновения приблизительно 35% в режиме МС/МС.
MALDI-TOF
Анализ спектроскопией MALDI-TOF проводили с применением масс-спектрометра Voyager De-Pro (Applied Biosystems). После смешивания с подходящей матрицей, образцы пептидов измеряли в линейном режиме. Массы, определенные с помощью программного обеспечения MassLynx, выстраивали в последовательность с помощью распада после источника ионов (PSD) для подтверждения предполагаемой аминокислотной последовательности пептидов.
Количественное определение глютеновых пептидов в образцах пищевых продуктов.
Моноклональные антитела, специфичные для стимулирующих T-клетки альфа-глиадина, гамма-глиадина и LMW-глютениновых пептидов, являются доступными и их вводили в конкурентный анализ для определения указанных пептидов в образцах пищевых продуктов (E.H/A/ Spaenij-Dekking et al., GUT, 53:1267-1273 (2004))
Анализы на основе антител
Для осуществления анализа на основе антител в мышах Balb C вырабатывались моноклональные антитела против известных стимулирующих T-клетки альфа-, гамма-глиадиновых и LMW-глютениновых пептидов. После слияния клеток селезенки мышей с клеточной линией мышиной миеломы, получали гибридомы, вырабатывающие антитела. Их клонировали ограниченным разбавлением, и моноклональные антитела, секретируемые этими клетками, испытывали с целью применения их в конкурентном анализе моноклональных антител. Для каждой из специфичностей выбирали одно или два подходящих моноклональных антитела и определяли эпитопы, распознаваемые различными моноклональными антителами (см. таблицу ниже).
ПРИМЕРЫ
Пример 1
Оптимальные значения pH и температуры пролин-специфичной эндопротеазы, полученной из A. niger
Полученную из A. niger пролин-специфичную эндопротеазу сверхэкспрессировали в хозяине A. niger, выделяли и подвергали хроматографической очистке, применяя материалы и методики, описанные в WO 02/45524. Для установления оптимального значения pH полученного таким образом фермента приготавливали буферные растворы с различными значениями pH. Буферные растворы с pH 4,0-4,5-4,8-5,0-5,5 и 6,0 получали, используя 0,05 моль/л ацетата Na и 0,02М CaCl2; буферные растворы с pH 7,0 и 8,0 получали, используя 0,05 М буферы Tris/HCl, содержащие 0,02 М CaCl2. Значения pH регулировали, используя уксусную кислоту и HCl соответственно. В качестве субстрата использовали хромогенный синтетический пептид Z-Glu-Pro-pNA. Буферный раствор, раствор субстрата и предварительно разбавленную эндопротеазу (с активностью 0,1 Ед/мл) нагревали точно до температуры 37,0°C на водяной бане. После перемешивания за протеканием реакции наблюдали спектрофотометрически при длине волны 405 нм и температуре 37,0°C в течение 3,5 мин, осуществляя измерения каждые 0,5 мин. Из результатов, показанных на фиг.1, ясно, что пролин-специфичная эндопротеаза, вырабатываемая A. niger, имеет оптимальное значение pH около 4.
Кроме этого, устанавливали температурный оптимум пролилэндопротеазы. С этой целью, очищенные препараты фермента инкубировали в 0,1 моль/л ацетате Na, содержащем 0,02 моль/л CaCl2 при pH 5,0 в течение 2 часов при различных температурах, используя казеин резоруфин (Roche version 3) в качестве субстрата и количественно определяя ферментную активность измерением при 574 нм. Согласно полученным результатам пролин-специфичная эндопротеаза из A. niger имеет температурный оптимум около 50°C.
Оптимум pH, лежащий в cильно кислой области, очевидно наводит на мысль, что вырабатываемая A. niger пролин-специфичная эндопротеаза обладает идеальными свойствами для промышленного применения, а также для перорального употребления, поскольку она будет проявлять оптимальную активность в условиях кислой среды, предпочтительных для промышленного применения, а также преобладающих в желудке и начальной части тонкого кишечника. Кроме того, температурный оптимум фермента делает данный фермент в высшей степени подходящим для обоих применений.
Пример 2
Фермент, полученный из A. niger, является представителем нового класса пролин-специфичных ферментов
Из всей кодирующей последовательности пролин-специфичной эндопротеазы, получаемой из A. niger, которая описана в WO 02/45524, может быть определена белковая последовательность из 526 аминокислот. Новизна фермента подтверждена поиском с помощью BLAST в таких базах данных, как SwissProt, PIR и trEMBL. К удивлению авторов не удалось обнаружить явной гомологии между ферментом A. niger и известными пролилолигопептидазами. Более тщательное исследование аминокислотной последовательности выявило, однако, низкую, но значимую степень гомологии с карбоксипептидазами Pro-X (EC3.4.16.2), дипептидиламинопептидазами I (EC3.4.14.2) и специфичной для тимуса серинпротеазой. Все эти ферменты отнесены к семейству серинпептидаз S28. Также, у всех этих ферментов и эндопротеазы A. niger сохранена конфигурация GxSYxG вокруг активного сайта серина. Кроме того, члены семейства S28 имеют кислотный оптимум pH, обладают специфичностью в отношении расщепления с карбокси-концевой стороны пролиновых остатков и синтезируются с сигнальной последовательностью и пропептидом, точно так же как пролин-специфичная эндопротеаза, вырабатываемая A. niger. Наконец, фермент A. niger имеет размер, сходный с размером членов семейства S28. Следовательно, пролин-специфичная эндопротеаза A. niger, по-видимому, является членом семейства серинпротеаз S28, а не семейства S9, в котором сгруппировано большинство цитозольных пролилолигопептидаз, включая фермент, выделенный из Flavobacterium meningosepticum. На основе перечисленных структурных и физиологических особенностей мы пришли к выводу, что фермент A. niger принадлежит к семейству S28, а не к семейству серинпротеаз S9. Еще одной особенностью, которая отличает фермент A. niger от пролилолигопептидаз, принадлежащих к семейству S9, является тот факт, что в отличие от цитозольных пролилэндопротеаз, принадлежащих к последнему семейству, недавно идентифицированный фермент A. niger секретируется в ростовую среду. К настоящему времени было показано, что только базидиомицеты Agaricus bisporus (Sattar et al; J.Biochem. 107, 256-261 (1990)) и не родственные им аскомицеты Aspergillus niger (WO 02/45524) вырабатывают внеклеточную пролилэндопротеазу. Однако фермент, полученный из базидиомицетов, не переносит значения pH ниже 5 и, следовательно, является намного менее подходящим для промышленного применения, а также для перорального употребления.
Настоящая заявка является первым сообщением о выделении члена семейства S28 из низших эукариотов и описанием его характеристик.
Пример 3
Пролин-специфичная эндопротеаза, полученная из A. niger, способна гидролизовать крупные белки, а также небольшие пептиды и, таким образом, является настоящей эндопротеазой
Благодаря характерной особенности структуры пролилолигопептидазы, принадлежащие к семейству S9, не могут разлагать пептиды размером свыше 30 аминокислотных остатков. Это ограничение представляет собой очевидный недостаток для фермента, который, как подразумевается, должен гидролизовать все потенциально токсичные пептиды с высоким содержанием пролина так быстро и эффективно, как только возможно. Для того чтобы выяснить, характерны ли эти ограничения, относящиеся к молекуле субстрата, для пролин-специфичной эндопротеазы, полученной из A. niger, авторы инкубировали хроматографически очищенную пролилэндопротеазу из A. niger с небольшим синтетическим пептидом, а также с крупной молекулой овальбумина и подвергли образовавшиеся продукты гидролиза анализу с помощью SDC-PAGE. Использованный синтетический пептид представлял собой 27-мер, включающий последовательность NH2-FRASDNDRVIDPGKVETLTIRRLHIPR-COOH, подаренный компанией Perscan (Lelystad, The Netherlands). Как видно из его аминокислотной последовательности, этот пептид содержит 2 пролиновых остатка, один в середине и один возле самого конца пептида. Интактная молекула овальбумина (Pierce Imject, пузырьки, содержащие 20 мг замороженного высушенного вещества) состоит из 385 аминокислот и имеет молекулярную массу 42 750 Да. Эта молекула содержит 14 пролиновых остатков, один из которых расположен в самой С-концевой части молекулы, и его нельзя расщепить пролин-специфичной эндопротеазой.
Овальбумин и олигопептид по отдельности инкубировали при 50°C с очищенной пролин-специфичной эндопротеазой, полученной из A. niger. Через определенные отрезки времени отбирали несколько образцов, которые анализировали, применяя SDS-PAGE.
Хроматографически очищенную пролин-специфичную эндопротеазу, полученную из A. niger, с активностью 4,5 Ед/мл разбавляли в 100 раз 0,1М ацетатным буфером с pH 4, содержащим 20 мМ CaCl2. Овальбумин растворяли в ацетатном буфере с pH 4 до концентрации 1 мг/мл (22 мкМ). 27-мерный пептид растворяли в таком же буфере до достижения концентрации 0,48 мг/мл (152 мкм). Молярности растворов овальбумина и 27-мера выбирали таким образом, чтобы оба раствора имели одинаковую молярность по отношению к расщепляемым пролиновым остаткам. Овальбумин содержит 13 потенциальных сайта расщепления пролина, тогда как 27-мерный пептид имеет только два. 0,5 мл растворов обоих субстратов инкубировали с 10 мкл (0,45 милиЕд) раствора фермента в термомиксере Эппендорфа при 50°C. Несколько раз через определенные интервалы времени отбирали 10 мкл образцы инкубируемых смесей и до проведения SDS-PAGE хранили при 20°C. Все материалы, использованные для SDS-PAGE и окрашивания, приобретены у Invitrogen. Образцы получали, используя буфер LDS в соответствии с инструкциями производителя, и разделяли на 12% бис-трис гелях, используя буферную систему MES-SDS согласно инструкциям производителя. Окрашивание выполняли, используя краситель Simply Blue Safe Stain (Collodial Coomassie G250).
Как можно видеть на фиг.2, овальбумин расщепляется ферментом, полученным из Aspergillus на дискретную линию, приблизительно 35-36 КДа в первые 4,75 часа инкубирования (полоса 3). Увеличение продолжительности инкубирования приводит к дальнейшему распаду на более мелкие продукты различной молекулярной массы (полоса 7).
27-мерный пептид также расщепляется, как можно судить по более слабым линиям в полосах 4, 6 и 8 по сравнению с полосой 2. Сдвиг, соответствующий очень малой молекулярной массе продукта (ср. полосы 9 и 8), вероятнее всего, вызван отщеплением аргининового остатка от карбоксильного конца пептида. Разница составляет приблизительно 200 Да (измерена с использованием программного обеспечения Alphalmager 3.3d на системе Alphalmager 2000), и аргинин обладает молекулярной массой 174. Этот сдвиг, соответствующий малой молекулярной массе, вероятно, соответствует первой стадии в расщеплении пептида.
Дальнейший распад продукта может быть виден только за счет уменьшения интенсивности линии на геле SDS. Продукты дальнейшего распада невидимы, т.к. в геле невозможно окрашивание компонентов с молекулярной массой около 1000 красителем кумасси бриллиантовый голубой.
Из этого эксперимента можно сделать вывод, что в отличие от известных пролилолигопептидаз, принадлежащих к семейству S9, выделенная из A. niger пролин-специфичная эндопротеаза не имеет конкретного предпочтения в отношении расщепления пептидов небольшого размера по сравнению со значительно более крупными белками. В силу этого, выделенный из A. niger фермент представляет собой настоящую эндопротеазу и является предпочтительным ферментом для расщепления потенциально токсичных пептидов с высоким содержанием пролина.
Пример 4
Бета-казоморфины в гидролизатах, полученных после инкубирования с алкалазой и комбинацией алкалазы с пролин-специфичной эндопротеазой из A. niger
По аналогии с образованием устойчивых к протеазам бета-казоморфинов в ходе желудочно-кишечного протеолиза, авторов изобретения заинтересовало, не наблюдается ли подобное накопление родственных BCM-7 пептидных фрагментов в процессе промышленного производства гидролизатов молочного белка. С этой целью авторы инкубировали бета-казеин A2 из коровьего молока с часто используемым в промышленности субтилизином алкалазой, а также с алкалазой в сочетании с пролин-специфичной эндопротеазой из A. niger. Полученные таким образом пептиды подвергали анализу с использованием ЖХ/МС/МС.
Коровье молоко содержит почти 10 г бета-казеина на килограмм молока, что составляет 28% всего имеющегося белка. Для облегчения анализа родственных BCM-7 аминокислотных последовательностей, авторы использовали в данном эксперименте концентрированный препарат (фирмы Sigma), содержащий минимум 90% бета-казеина (A2). Этот продукт растворяли в воде в концентрации 20 г на литр, после чего, используя NaOH, доводили значение pH до 8 и добавляли алкалазу в количестве 800 мкл концентрата фермента на литр раствора казеина. Инкубировали в течение 2 часов при 60°C. Затем понижали pH раствора до 4,5, используя лимонную кислоту. Затем раствор разделяли на две части: одну часть нагревали в течение 5 минут при 90°C для инактивации алкалазы и к другой части добавляли пролин-специфичную эндопротеазу из A. niger до достижения концентрации фермента 1 ед/г присутствующего казеина (определение единицы см. в разделе «Материалы и методики»). Инкубирование с пролин-специфичной эндопротеазой из A. niger продолжали в течение 16 часов при 55°C и затем осуществляли еще одну тепловую обработку для инактивации пролин-специфичной эндопротеазы. В заключение два образца с измеренной концентрацией бета-казеина 20 мг/мл отправили на ЖХ/МС/МС анализ. Эти образцы центрифугировали в течение 10 минут при 13000 об/мин и перед анализом ЖХ/МС/МС разбавили в 20 раз в Milli Q. Анализ ЖХ/МС/МС выполняли в соответствии с описанием из раздела «Материалы и методики».
На удалении от последовательности BCM-7 Tyr-Pro-Phe-Pro-Gly-Pro-Ile в аминокислотных положениях 60-66 молекулы бета-казеина, меньшие фрагменты, такие как Tyr-Pro-Phe-Pro (бета-казоморфин(1-4)) и Tyr-Pro-Phe-Pro-Gly (бета-казоморфин(1-5)) в аминокислотных положениях 60-63 и 60-64 соответственно, а также пептиды более крупного размера вплоть до длины 11 аминокислотных остатков (в аминокислотных положениях 60-70) показывают, по крайней мере, некоторую степень опиоидной активности. Сообщалось, что трипептид Tyr-Pro-Phe в положениях 60-62 не обладает опиоидной активностью. Для идентификации пептидов применяли прямой ЖХ/МС/МС протонированных молекул. Массы возможно подходящих протонированных пептидов приведены в таблице 1. Все спектры получали с амплитудой столкновения 35% и шириной пика 3 Да. Все экспериментальные данные сравнивали с моделями теоретической фрагментации, основанными на т.н. B и Y ионах. Этот процессом, как правило, осуществляли с применением автоматической обработки данных.

Аминокислотная последовательность бета-казоморфина начинается с тирозина (Y; остаток номер 60 пептидной цепи бета-казеина), причем в таблице он выделен жирным шрифтом. Значения m/z представлены для протонированных молекул других возможно подходящих пептидов. Обнаружение пролинового остатка в положении 67 показывает, что использованный субстрат представляет собой бета-казеин A2.
Результаты, полученные при ЖХ/МС/МС анализе гидролизатов бета-казеина, которые образовались после инкубирования либо с алкалазой, либо с комбинацией алкалазы и пролин-специфичной эндопротеазы, представлены в таблице 2 и могут быть резюмированы следующим образом:
- сами по себе казоморфиновые последовательности, т.е. YPFPGPI, и производные отсутствуют в бета-казеине A2, обработанном либо алкалазой, либо комбинацией алкалазы и пролин-специфичной эндопротеазы из A. niger;
- однако в образце, обработанном алкалазой, присутствуют два пептида, содержащие бета-казоморфиновую последовательность, т.е. LVYPFPGPIPN и VYPFPGPIPN;
- интенсивность сигнала этих содержащих бета-казоморфин последовательностей резко снижается при обработке пролин-специфичной эндопротеазой из A. niger.
ЖХ/МС/МС идентификация пептидов, содержащих бета-казоморфиновую (1-7) аминокислотную последовательность
Полученные результаты ясно показывают, что комбинация алкалазы с пролин-специфичной эндопротеазой из A. niger с высокой эффективностью разрушает все потенциальные бета-казоморфиновые последовательности, тем самым, предоставляя возможность получения гидролизатов без потенциально токсичных последовательностей с высоким содержанием пролина.
После более тщательного поиска среди образовавшихся пептидов, авторы смогли обнаружить наличие пептида VYP в гидролизате, полученном при воздействии комбинации двух ферментов. Поскольку данный пептид не удалось обнаружить в гидролизате, который образовался при использовании только алкалазы, эти данные предполагают расщепление у C-конца пролинового остатка в положении 61 молекулы бета-казеина под действием фермента, полученного из Aspergillus.
Пример 5
Пептиды, полученные при инкубировании пептида VYPFPGPIPN, образовавшегося под действием алкалазы, с пролин-специфичной эндопротеазой из A. niger
Как показано в примере 4, гидролиз бета-казеина A2 с комбинацией алкалазы и пролин-специфичной эндопротеазы из A. niger, эффективно удаляет все потенциальные казоморфиновые последовательности. Однако сложность образующихся пептидов не позволила авторам установить, по какому положению полученный из Aspergillus фермент расщепляет образовавшийся под действием алкалазы пептид VYPFPGPIPN. С этой целью пептид с данной конкретной последовательностью был синтезирован и инкубирован с пролин-специфичной эндопротеазой при двух концентрациях последней. Последующий анализ образовавшихся пептидов с помощью ЖХ/МС/МС выявил точный сайт расщепления ферментом.
Лиофилизованный 10-мерный пептид (Pepscan Systems; Lelystad, The Netherlands) растворяли в цитратно-фосфатном буфере pH 4,5 с концентрацией 2 мг/мл. К раствору добавляли пролин-специфичную эндопротеазу в концентрациях 1 и 10 ед/г пептида. Инкубацию проводили в течение 4 часов при 55°C, и затем использовали тепловую обработку в течение 5 минут при 90°C для инактивации фермента. После этого два образца центрифугировали в течение 10 минут при 13000 об/мин и перед анализом ЖХ/МС и ЖХ/МС/МС разбавляли в 20 раз в Milli Q water. Вначале образцы анализировали в режиме ЖХ/МС для наблюдения уменьшения интенсивности сигнала 10-мера, используя различные количества фермента, а также наблюдая, сигналы каких пептидов появятся на ЖХ/МС ионной хроматограмме после ферментного расщепления.
Затем осуществляли непосредственный анализ ЖХ/МС/МС протонированных молекул пептидов, найденных в прогонах ЖХ/МС. Все спектры получали с амплитудой столкновения 35% и шириной пика 3 Да. Все экспериментальные данные сравнивали с теоретической моделью фрагментации, основанной на т.н. B и Y ионах. Этот процесс, как правило, осуществляли с применением автоматической обработки данных для идентификации пептидов, полипептидов и белков.
Обработка 10-мера VYPFPGPIPN (M=1099,5) 1 ед/г фермента уже приводит к полному расщеплению 10-мера на несколько пептидов. Интенсивность сигнала протонированной молекулы при m/z 1100,5 сокращается на 3 порядка величины. Обработка 10-мера 10 ед/г не приводит к дальнейшему уменьшению интенсивности сигнала протонированной молекулы и, кроме этого, не найдено сигналов каких-либо дополнительных пептидов. При обработке ферментом в концентрации 1 ед/г образовывались 4 пептида, причем в наибольшем количестве (почти 98%, см. таблицу 3) пептид VYP (M=377,2), характеризующийся соотношением m/z 378,2. Все четыре пептида были проанализированы в режиме ЖХ/МС/МС и признаны правильными на основе описанных выше критериев. В таблице 3 приведены массы протонированных пептидов 10-мера VYPFPGPIPN M=1099,5, проанализированных в режимах ЖХ/МС и ЖХ/МС/МС. Во второй колонке представлены величины m/z протонированных молекул, в третьей колонке интенсивности сигналов протонированных молекул, наблюдаемые в режиме ЖХ/МС, в четвертой колонке процентные соотношения на основании площади пиков протонированных молекул и в пятой колонке положения обнаруженных пептидов в общей аминокислотной последовательности 10-мера. Следует подчеркнуть, что использование площадей пиков протонированных молекул пептидов не учитывает влияния различий в эффективности ионизации.
Пептиды, полученные при инкубировании родственного ВСМ-7 10-мера VYPFPGPIPN c пролин-специфичной эндопротеазой А. niger
аминокислотной последовательности
Однако можно сделать вывод, что пролин-специфичная эндопротеаза из A. niger осуществляет расщепление почти исключительно с C-концевой стороны пролина в положении 61 (положение 3 для данного конкретного декапептида). Увеличение соотношений фермент/субстрат не оказывает влияния на осуществление расщепления.
Поскольку все известные молекулы бета-казоморфинов с опиоидной активностью обладают одной и той же N-концевой последовательностью YPF, очевидно, что эффективное расщепление этой последовательности между P и F (т.е. со стороны карбокси-конца пролинового остатка в положении 61) под действием пролин-специфичной эндопротеазы будет эффективно инактивировать все BCM-7 и родственные BCM-7 пептиды, независимо от того, образуются они из генетического варианта бета-казеина A1 или A2.
Ключевая роль пролинового остатка в положении 61 во взаимодействии с мю-рецептором была также подтверждена в современной интернет-публикации («Синтез и сродство к опиоидным рецепторам аналогов бета-казоморфинов, содержащих бета-замещенные аминокислоты» опубликовано Dipartamento di Scenza degli Alimenti Universita di Napoli “Frederico II” Facolta di Agraria).
Пример 6
Пептиды, полученные при инкубировании 33-мерного производного глиадина LQLQPFPQPQLPYPQPQLPYPQPQLPYPQPQPF с пролин-специфичной эндопротеазой из A. niger
По сообщениям Shan и сотрудников (Science, Vol.297, 27 September 2002) обработка устойчивого к сокам желудка и поджелудочной железы 33-мерного производного глиадина LQLQPFPQPQLPYPQPQLPYPQPQLPYPQPQPF (М=3911) алкалазой при pH 8 или pH 5 не привела к какому-либо расщеплению молекулы. Тем не менее, так же как и в случае 10-мерного производного бета-казеина, инкубирование с 1 единицей пролин-специфичной эндопротеазы из A. niger при pH 5 привело к полному расщеплению молекулы на несколько пептидов. Интенсивность сигнала трехкратно протонированного 33-мера при m/z 1304,4 снизилась на 3 порядка по амплитуде. При обработке 33-мера 10 единицами фермента на грамм белка не наблюдалось дальнейшего уменьшения интенсивности сигнала протонированной молекулы, а также сигналов других пептидов.
После обработки ферментом образовалось около 6 основных пептидов и еще несколько минорных пептидов, причем в наибольшем количестве образовался пептид, характеризующийся m/z 565,2. Все 6 пептидов были проанализированы в режиме ЖХ/МС/МС, причем было найдено, что все они содержат пролин на C-конце, что подтверждает специфичность фермента. Основной образовавшийся пептид характеризуется соотношением m/z 565,2 (последовательность …QPL в таблице 4). Хотя наличие C-концевой последовательности “LP” для этого пептида не может быть продемонстрировано однозначно, идентифицированная масса теоретически не может образоваться при эндопротеолитическом распаде 33-мера, так что сохраняется некоторая неопределенность в отношении точной N-концевой структуры пептида. Наиболее вероятно, что m/z 565,2 представляет собой N-пироглутамиловый вариант структуры QPQLP (М=581,3), хотя это не было исследовано более подробно.
Появление QPQLP: LQLQPFPQPQLPYPQPQLPYPQPQLPYPQPQPF
Появление QPQLPYP: LQLQPFPQPQLPYPQPQLPYPQPQLPYPQPQPF.
Спектр ЖХ/МС/МС пептида с m/z 679 мог бы быть истолкован как PQPQLP. Несмотря на то, что природа пептида с m/z 565,2 не была полностью понята, полученные данные ясно продемонстрировали предпочтительное отщепление под действием пролин-специфичной эндопротеазы из Aspergillus с C-концевой стороны пролиновых остатков в положениях 12, 19 и 26 (т.е. исключительно между пролиновым и тирозиновым остатками) данного конкретного 33-мера. На данную модель расщепления не оказывает влияние использование более высоких соотношений фермент/субстрат. Вся соответствующая информация суммирована в таблице 4.
В первом столбце указаны полученные пептидные последовательности, причем точки использованы (как и в столбце 5) для того, чтобы показать, что не может быть приведено точное исходное положение пептида из-за необъясненного несоответствия масс. Во втором столбце приведены величины m/z протонированных молекул, в третьем интенсивности сигналов пептидов, наблюдаемые в режиме ЖХ/МС, в четвертом процентные соотношения, основанные на площади пиков протонированных молекул, и в пятом столбце указаны положения идентифицированных пептидов в общей аминокислотной последовательности.
Пептиды, образовавшиеся при инкубировании 33-мерного производного глиадина LQLQPFPQPQLPYPQPQLPYPQPQLPYPQPQPF с пролин-специфичной эндопротеазой из A. niger
последовательности
Расщепление 33-мера, который, как указывалось, является основным эпитопом у пациентов с целиакией, не может быть осуществлено соками желудка и поджелудочной железы или инкубированием с агрессивной протеазой широкого спектра действия алкалазой, ни в щелочной, ни в кислой среде. Тем не менее, полученные авторами результаты показали эффективное расщепление пролин-специфичной эндопротеазой, выделенной из A. niger, в условиях кислой среды. Это расщепление осуществляется исключительно между пролиновыми и тирозиновыми остатками молекулы и приводит к образованию 99,5% пептидов, длина которых не превышает 6 аминокислотных остатков. Таким образом, несмотря на высокую эффективность по отношению к пептидам с высоким содержанием пролина в кислой среде, даже фермент Aspergillus оставляет 0,5% гептамера с аминокислотной последовательностью YPQPQLP. Поскольку последовательность PYPQPQLPY является известным T-клеточным эпитопом, специфичным для больных целиакией, полученные данные еще раз подчеркивают, что, очевидно, невозможно практическое применение in vivo для предотвращения образования токсичных пептидов из молекул глютена не совсем оптимальных пролин-специфичных ферментов с близким к нейтральному оптимумом pH, таких как известные пролин-специфичные олигопептидазы и фермент, полученный из Flavobacterium meningosepticum.
Пример 7
pH-спектр активности пролин-специфичной эндопротеазы A. niger и пролин-специфичной олигопептидазы из F.meningosepticum
Как показано в примере 1, оптимум pH пролин-специфичной эндопротеазы, выделенной из A. niger, находится около 4,2. В этом первом тесте не рассматривались значения pH в очень кислой области, так что не вполне ясно поведение фермента при экстремальных значениях pH, которые могут существовать в желудке. В заявке WO 03/068170 указано, что пролин-специфичные протеазы, такие как пролилолигопептидаза из Flavobacterium meningosepticum или DPP IV из Aspergillusfumigatus или пептидил дипептидазы видов Streptomyces являются предпочтительными кандидатами для разрушения in situ токсичных пептидов с высоким содержанием пролина. Как правило, все упомянутые протеазы характеризуются оптимальным значением pH, близким к нейтральному, что, по-видимому, исключает любую гидролитическую активность в желудке. Чтобы показать различия в оптимальных значениях pH, которые существуют между пролин-специфичной эндопротеазой по настоящему изобретению и ферментами известного уровня техники, авторы сравнили pH-спектр активностей эндопротеазы, полученной из Aspergillus и олигопептидазы, выделенной из Flavobacterium. Эндопротеазу Aspergillus получали, как описано в примере 1. Олигопептидазу из Flavobacterium приобретали у ICN Biomedicals (35 Ед/мг; № по каталогу 32082; Ohio, US).
Для определения pH-спектра активности двух рассматриваемых ферментов, приготовляли буферные растворы с различными значениями pH. Буферы в диапазоне pH от 2,0 до 7,0 получали, используя 0,1 моль/л раствор цитрата, буферы в диапазоне pH от 6,0 до 9,0 получали, используя 0,1 моль/л трис, и буферы в диапазоне pH от 8,0 до 12,0 получали, используя 0,2 моль/л раствор глицина. Нужные значения pH получали, используя HCl либо NaOH. В качестве субстрата для обоих ферментов применяли хромогенные синтетические пептиды Z-Gly-Pro-AMC (Bachem, Swizerland). В каждую ячейку (планшеты Costar № 3631) вводили 85 мкл буфера, 10 мкл раствора фермента и 5 мкл субстрата (4 мМ Z-Gly-Pro-AMC в 60% метаноле). Итоговая концентрация фермента A. niger составляла 32 мкг/мл (3,2 мили Ед/мл), итоговая концентрация фермента F. meningosepticum составляла 0,21 мкг/мл (7,4 мили Ед/мл). После перемешивания реакционную смесь оставляли на 30 минут для протекания реакции при 37,0°C, после чего измеряли флуоресценцию на мультипланшетном считывателе CytoFluor производства PerSeptive Biosciences. Полученные сравнительные данные показаны на фиг.3. Данные, полученные в этих, слегка отличающихся условиях тестирования, подтверждают установленный в примере 1 кислотный оптимум pH пролин-специфичной эндопротеазы A. niger. Данные показывают, что фермент A.niger обладает приблизительно 20% остаточной активностью при pH 2,2 и 7,5. Кроме этого, данные, показанные на фиг.3, подтверждают опубликованный ранее оптимум pH фермента F. meningosepticum в районе pH 7,0. В контексте настоящей заявки на патент более важно, что при pH ниже 5,0 фермент F. meningosepticum не обладает активностью.
Полученные данные показывают, что в противоположность ферменту F. meningosepticum, свойства пролин-специфичной эндопротеазы из A. niger идеально подходят для проявления полной активности фермента в условиях кислой среды, которая преобладает в желудке и части двенадцатиперстной кишки.
Пример 8
Стабильность пролин-специфичной эндопротеазы A. niger и пролин-специфичной олигопептидазы F. meningosepticum в условиях, имеющихся в желудке
Необходимым условием успешной ферментной терапии является эффективное расщепление токсичных пептидов с высоким содержанием пролина в желудке и кишечнике до того, как эти пептиды достигнут дистальной части двенадцатиперстной кишки. Для этого необходимо, чтобы экзогенный фермент, который планируется применить для ферментной терапии, представлял собой пролин-специфичную протеазу, которая активна во время пребывания пищевых белков в желудке и, необязательно, за желудком. Чтобы сравнить активности пролин-специфичных протеаз, выделенных из A. niger и F. meningosepticum в подобных условиях, напоминающих условия в желудке, мы проанализировали их остаточные активности после инкубирования при 37°C в течение различных периодов времени при различных значениях pH, а также в присутствии и отсутствие желудочной протеазы пепсина. Остаточные активности ферментов измеряли при оптимальных значениях pH и с использованием хромогенного пептида, оптимального для соответствующего фермента, т.е. pH 7,0 и субстрата Z-Gly-Pro-pNA для фермента F. meningosepticum и pH 4,0 и субстрата Ala-Ala-Pro-pNA для фермента A. niger. В таких условиях фермент A. niger демонстрирует высокую активность на субстрате Ala-Ala-Pro-pNA и определенную активность (менее 10% активности на Ala-Ala-Pro-pNA) на субстрате Ala-Ala-Ala-pNA. В этих же условиях фермент A. niger не проявляет заметной активности на других субстратах Ala-Ala-X-pNA.
Для создания требуемой кислой среды использовали буферы цитрат/HCl 0,2 моль/л. Количество фермента A. niger составляло 1,5 Ед/мл, количество фермента F. meningosepticum (MP Biochemicals, Ohio, US) 3,3 Ед/мл (определения единицы приведены в разделе «Материалы и методики»). Пепсин (Sigma) добавляли в концентрации 180 мкг/мл. После отбора проб добавляли пепстатин (Sigma) в концентрации 1,67 мкг/мл для инактивации пепсина. В этих условиях пепстатин не оказывает ингибиторного влияния на обе пролин-специфичные протеазы. Остаточные активности двух пролин-специфичных протеаз измеряли кинетически при 405 нм, используя синтетические субстраты Ala-Ala-Pro-pNA и Z-Gly-Pro-pNA соответственно. Для этого в ячейках микротитровального планшета смешивали 200 мкл раствора субстрата (2 ммоль/л Z-Gly-Pro-pNA в 0,05 моль/л фосфатном буфере pH 7,0 или 1,5 ммоль/л Ala-Ala-Pro-pNA в 0,05 моль/л уксуснокислом буфере pH 4,0) с 50 мкл (предварительно разбавленного от 10 до 100х) образца, обработанного кислотой/пепсином. Для исследования кинетики измеряли поглощение в течение 10 минут при 405 нм и 30°C, используя считыватель планшетов TECAN Genios (Salzburg, Vienna).
Отображенные в таблице 5 результаты показывают, что pH 4 представляет собой нижний предел, при котором возможно сохранение фермента F. meningosepticum. Необходимо отметить, что согласно данным, описанным в примере 7, данный фермент не обладает активностью при таком pH среды. Через 2 часа при pH 4,0 фермент демонстрирует приблизительно 25% остаточную активность при испытании в оптимальных условиях. Однако в присутствии пепсина данный фермент полностью инактивируется при указанном значении pH в течение 15 минут. Противоположностью этим результатам являются данные, полученные для фермента A. niger. Этот фермент полностью сохраняет свою активность при таких низких значениях pH, как 2, и даже в присутствии пепсина. Эти результаты в сильной степени наводят на мысль, что только ферменты с оптимальным значением pH ниже 5,5, вероятно, являются активными в желудке, так что известные пролин-специфичные протеазы, принадлежащие к классам ферментов EC 3.4.21.26 (пролилолигопептидазы), EC 3.4.14.5 (дипептидилпептидаза IV) и EC 3.4.15.1 (пептидилдипептидаза A), не попадают в число ферментов, разрушающих пептиды с высоким содержанием пролина в желудке.
Остаточная ферментная активность олигопептидазы F. meningosepticum и эндопротеазы A. niger после инкубирования в течение различных периодов времени в условиях, подобных условиям желудка
F. meningosepticum после:
- Означает отсутствие остаточной активности при тестировании в условиях, оптимальных для данного фермента.
Пример 9
Активность пролин-специфичной эндопротеазы по отношению к различным глютеновым эпитопам
В ряде публикаций указаны пептиды, являющиеся производными глютена пшеницы, которые распознаются T-клетками тонкого кишечника пациентов с целиакией. В этом контексте особый интерес представляет связывание пептидов с молекулами HLA-DQ2, т.к. люди, несущие только гаплотип HLA-DQ2, имеют намного более высокие шансы развития целиакии (Maki et al.; N. Engl.J. Med. 2003 Jun 19; 348 (25): 2517-24). Все исследованные взрослые HLA-DQ2 пациенты реагируют на последовательности альфа-глиадина, т.е. Glia-alpha2 и Glia-alpha9 (Arentz-Hansen et al, J.Exp.Med. 2000; 6:337-342). Дети, у которых в данный момент начинается целиакия, реагируют на пептиды Glia-alpha 20, Glia-gamma 30, Glt-17, Glt-156 и Glu-21 (Vader et al, Gastroenterology 2002; 122:1729-1737). В примере 6, авторами изобретения уже продемонстрировано успешное расщепление пептида Glia-alpha2 (PQPQLPYPQPQLPY) под действием фермента, полученного из A. niger. В настоящем примере авторы проводили испытание фермента A. niger на способность расщеплять также и другие значимые пептиды, являющиеся производными глютена, а также гомологи этих пептидов, полученные из других зерновых культур.
С этой целью синтезировали соответствующие пептиды, после чего их чистоту подтверждали ВЭЖХ и масс-спектроскопией (MALDI-TOF) в соответствии с методикой, описанной в разделе «Материалы и методики». Расщепление пептидов осуществляли смешиванием 50 мкл раствора пептида (1 мг/мл) с 50 мкл раствора фермента A. niger, содержащего 0,43 мкг/мл (0,043 мили Ед) фермента в 50 ммоль/л буферном растворе ацетата аммония с pH 4,5. После инкубирования в течение различных периодов времени при комнатной температуре отбирали образцы 0,5 мкл и добавляли к 9,5 мкл матричного раствора (1:1 H2O и CH3CN, содержащего 0,2% ТФУ). После обессоливания с использованием гранул ионообменной смолы Dowex, жидкость наносили на пластину МАLDI совместно с некоторыми количествами подходящих эталонных пептидов, после чего все пептиды подвергали анализу. Из полученных данных можно было бы установить сайты расщепления, как показано в таблице 6. Пептиды Glt 156 и Glia gamma-2 являются 10-мерами; Glt-17 является 8-мером, но для оптимального связывания требует C-концевого расширения остатками P и L. Однозначно определенные сайты расщепления показаны двойными вертикальными линиями, сайты расщепления, которые являются не столь очевидными, показаны одинарными вертикальными линиями. Известные минимальные T-клеточные эпитопы на каждом пептиде показаны подчеркиванием. Символы “U”, использованные в Glu-5, отображают либо лейциновый, либо изолейциновый остаток.
Из полученных данных ясно, что не только Glia-alpha2, но, фактически, все глютеновые эпитопы, значимые для молодых, а также для взрослых HLA-DQ2 пациентов, эффективно гидролизуются выделенной из A. niger пролин-специфичной протеазой. Поскольку большинство сайтов расщепления может быть точно отнесено к известным минимальным сайтам связывания T-клеточных эпитопов, вероятно, что воздействие фермента на глютеновые эпитопы отменит распознавание и, таким образом, эффективно предотвратит последующую T-клеточную пролиферацию, которая, в конечном счете, ведет к симптомам, характерным для пациентов с целиакией.
Сайты расщепления в различных известных глютеновых эпитопах пшеницы под действием эндопротеазы, выделенной из A. niger
С помощью подобного подхода были установлены сайты расщепления под действием фермента, полученного из A. niger, у целого ряда гомологов глютеновых эпитопов пшеницы, выделенных из овса, ячменя и ржи (Vader, W et al, Gastroenterology 2003; 125:1105-1113). Полученные результаты (см. таблицу 7) показывают, что фермент A. niger способен расщеплять не только ответственные за целиакию глютеновые эпитопы пшеницы, но также гомологи этих пептидов, которые имеются в овсе, ячмене и ржи. Как и в таблице 6, сайты расщепления, не вызывающие сомнения, показаны двойными линиями.
Сайты расщепления в различных известных не пшеничных глютеновых эпитопах под действием эндопротеазы, выделенной из A. niger
Glia-gamma2
Пример 10
Исследование выделения глютеновых эпитопов из 100% солодового пива и 100% пшеничного хлеба.
Как и было задумано (см. раздел «Материалы и методики»), методику извлечения испытывали в сочетании с анализом на основе антител, на образце обработанного PVPP 100% солодового пива (см. пример 11) и на образце 100% пшеничного хлеба (см. пример 12). В соответствии с полученными результатами (см. таблицу 8), методика извлечения в сочетании с анализом на основе антител способна обнаружить анти-альфа глиадиновые, анти-гамма глиадиновые, а также анти-глютениновые эпитопы в пиве и в хлебе. Полученные данные в совокупности наводят на мысль, что примененная методика извлечения подходит для обнаружения глютена в образцах, как пива, так и хлеба. Исходя из этих результатов, в примерах 11 и 12 были более подробно исследованы образцы пива и хлеба, которые в ходе изготовления были подвергнуты воздействию различных концентраций пролин-специфичной эндопротеазы A. niger.
Результаты анализа с использованием антител. Измерению подвергали образцы при двух разбавлениях: 1/16 и 1/64. Результаты выражены в виде мкг/мл исходного образца
Пример 11
Производство пива с применением пролин-специфичной протеазы из A. niger ведет к более низкому содержанию глютеновых эпитопов
Пивная муть формируется за счет объединения образующихся из глютена обогащенных пролином белков, полипептидов и пептидов с полифенолами, которые выделяются из зерновых (в основном ячменя), используемых для производства пива. Как показано в WO 02/046381, образование пивной мути может быть уменьшено или предотвращено, благодаря введению в процесс производства пива устойчивой к кислотам пролин-специфичной эндопротеазы при получении сусла, ферментации или на стадии выдержки. В общепринятом процессе пивоварения образование мути предотвращают обработкой PVPP, т.е. соединением, которое связывает различные имеющиеся полифенолы, но оказывает только небольшое воздействие на уровни пептидов с высоким содержанием пролина, которые участвуют в образовании мути. Поскольку общепринятый способ пивоварения не позволяет устранить токсичные пептиды с высоким содержанием пролина, пациентам с целиакией не разрешают пить пиво.
Цель настоящего исследования заключается в том, чтобы установить, приведет ли добавление пролин-специфичной эндопротеазы из A. niger в процессе изготовления пива к снижению уровней токсичных пептидов с высоким содержанием пролина в конечном продукте. Если это действительно так, пациенты с целиакией могли бы употреблять такое пиво.
Изготовление пива осуществляли на 20 гл экспериментальном заводе IFBM (Nancy, France). Используемый образец пролин-специфичной эндопротеазы, полученной из A. niger, был стабилизирован в 50% (по массе) глицерине и имел итоговую активность 5 ед/г жидкости (определение единицы см. в разделе «Материалы и методики»).
В ходе выполнения независимых процедур пивоварения, было сварено пять порций 100% солодового пива с использованием либо PVPP (эталон), либо различных количеств пролин-специфичной эндопротеазы для предотвращения образования мути. Во всех экспериментах методика приготовления сусла была в точности одинаковой. В разных экспериментах пролин-специфичную протеазу добавляли либо в начале процесса образования сусла, либо после образования сусла, непосредственно перед ферментацией пива. В процессе образования сусла испытывали три различные дозировки фермента, а именно 2,5, 5,0 и 7,5 единиц фермента на кг используемого солода. При ферментации испытывали только одну дозировку фермента, а именно 0,75 единиц фермента на кг добавленного солода. Эталонный образец пива был стабилизирован 30 г/гл PVPP, который добавляли перед фильтрацией пива.
Каждую варку осуществляли из 300 кг ячменного солода и гранул хмеля. При образовании сусла использовали соотношение жидкость/солод 3:1 (объем/масса) и pH 5,6. Диаграмма получения сусла включала первый этап продолжительностью 20 минут при 45°C, второй этап продолжительностью 15 мин при 64°C, третий этап продолжительностью 25 минут при 76°C и, наконец, нагревание до 78°C. Между этапами скорость нагревания составляла 1°C в минуту. Сусло кипятили 90 мин. Хорошего отделения осадка достигали с помощью гидроциклонного сепаратора. Ферментацию выполняли с помощью штамма дрожжей низового брожения, при норме добавления 17×106 клеток/мл сусла и выживаемости при добавлении 97%. За периодом ферментации в течение 10 дней при 12°C +/- 1°C следовало холодное созревание в течение 5 дней при -1°C +/- 1°C. Пиво насыщали углекислым газом при давлении 5,2 г/дюйм и, после розлива по бутылкам, пастеризовали при 60°C в течение 20 минут.
Различные образцы пива и содержание в них глютена по результатам анализов с использованием антител
Разбавление 1/16
Разбавление 1/16
Разбавление 1/16
В соответствии с полученными результатами анти-альфа глиадиновые и анти-гамма глиадиновые антитела образуются в сопоставимых количествах. Результаты, относящиеся к анти-глютениновому антителу, в данном анализе не являются решающими. Очевидно, что применение фермента, в особенности после стадии получения сусла, приводит к очень низким уровням содержания в пиве токсичных пептидов, обогащенных пролином. То соображение, что сайты распознавания антител имеют минимальную длину 5 аминокислотных остатков, но сайт распознавания T-клеток требует, по крайней мере, 9 аминокислотных остатков, делает еще менее вероятным распознание T-клетками коротких пептидов, образующихся при ферментной обработке. Фактически полученные данные уверенно указывают на то, что, используя упомянутую выше ферментную обработку, можно сварить пиво, которое является безопасным для больных целиакией.
Пример 12
Производство хлеба при включении в состав теста пролин-специфичной эндопротеазы из A. niger ведет к снижению количества глютеновых эпитопов
Тесто для выпечки хлеба приготовляли из 3500 г пшеничной муки (80% KolibriTM и 20% IbisTM), 1990 мл воды (56%), 77 г прессованных дрожжей (2,2%), 70 г соли (2%), 140 мг аскорбиновой кислоты (40 мд) и различных количеств фермента, выделенного из A. niger, как показано в таблице 10. Количество добавленного фермента компенсировали уменьшением количества добавленной в тесто воды.
Для получения теста смешивали ингредиенты, используя спиральный миксер Diosnar®, в течение 2 минут на скорости 1 и затем 6 минут на скорости 2. Кускам теста массой 875 г придавали шарообразную форму, выдерживали в течение 35 минут при 34°C и 85% относительной влажности, обминали, формовали, укладывали в формы, выдерживали в течение 75 минут при 38°C и 87% относительной влажности и выпекали в течение 20 минут при 220°C. Оценку теста и полученного хлеба выполняли профессиональные пекари. Из результатов, приведенных в таблице 10, ясно, что добавление пролин-специфичной эндопротеазы очевидным образом не влияет на пространственную структуру глютена и способность теста удерживать газы, поскольку значения объема и упругости хлебных изделий не подверглись влиянию фермента в концентрации 225 ед/кг муки или ниже. Фактически, только добавление большего количества фермента оказало отрицательное влияние на тесто и полученные хлебные изделия, которые показались бы неприемлемыми большинству потребителей. Из-за этого наблюдения не фиксировали данные анализа с использованием антител для хлеба, полученного при больших концентрациях фермента.
Данные, отображенные в таблице 10, показывают явное уменьшение количества токсичных пептидов с высоким содержанием пролина, имеющихся в хлебе, полученном при концентрации фермента около 200 ед/кг муки. Весьма вероятно, что это уменьшение окажется недостаточным для того, чтобы разрешить употребление такого хлеба больным целиакией. Однако такое уменьшение могло бы быть вполне достаточным для получения продуктов питания с профилактической пользой для людей, страдающих не выявленной целиакией или IBS, или даже для детей младшего возраста с незрелой иммунной системой.
Различные образцы 100% пшеничного хлеба и количества имеющегося в них глютена по данным анализа с использованием антител
Разбавление 1/16
Разбавление 1/64
2347
2212
124
Разбавление 1/16
Разбавление 1/64
3979
2895
888
Разбавление 1/16
Разбавление 1/64
232
232
121
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИЩЕВОЙ ПРОДУКТ, СОДЕРЖАЩИЙ СПЕЦИФИЧНУЮ К ПРОЛИНУ ПРОТЕАЗУ, СПОСОБ ЕГО ПРОИЗВОДСТВА И ЕГО ПРИМЕНЕНИЕ ДЛЯ РАСЩЕПЛЕНИЯ ТОКСИЧНЫХ ИЛИ АЛЛЕРГЕННЫХ ПЕПТИДОВ ГЛЮТЕНА | 2007 |
|
RU2446210C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ НАРУШЕНИЙ ВРОЖДЕННОГО ИММУННОГО ОТВЕТА | 2014 |
|
RU2671832C1 |
| НОВЫЕ ГЕНЫ, КОДИРУЮЩИЕ НОВЫЕ ПРОТЕОЛИТИЧЕСКИЕ ФЕРМЕНТЫ | 2002 |
|
RU2423525C2 |
| НОВЫЙ РЕКОМБИНАНТНЫЙ ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM CANESCENS PEP3 И ПОЛУЧЕНИЕ НА ЕГО ОСНОВЕ КОМПЛЕКСНОГО ФЕРМЕНТНОГО ПРЕПАРАТА ПРОТЕАЗ ЭНДО- И ЭКЗОДЕЙСТВИЯ | 2015 |
|
RU2616275C1 |
| НОВЫЕ ГЕНЫ, КОДИРУЮЩИЕ НОВЫЕ ПРОТЕОЛИТИЧЕСКИЕ ФЕРМЕНТЫ | 2002 |
|
RU2296160C2 |
| СПОСОБ ГИДРОЛИЗА МОЛОЧНЫХ БЕЛКОВ | 2002 |
|
RU2292155C2 |
| ТРИПЕПТИДИЛПЕПТИДАЗЫ, СПОСОБНЫЕ ВОЗДЕЙСТВОВАТЬ НА СВЯЗИ С УЧАСТИЕМ ПРОЛИНА, И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2741080C2 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ ПРОТЕАЗНОЙ АКТИВНОСТЬЮ, И НУКЛЕИНОВЫЕ КИСЛОТЫ, КОДИРУЮЩИЕ УКАЗАННЫЕ ПОЛИПЕПТИДЫ | 2002 |
|
RU2318018C2 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ ЭНДОПЕПТИДАЗНОЙ АКТИВНОСТЬЮ, И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ | 2011 |
|
RU2583293C2 |
| АНАЛИЗ БЕТА-КАЗЕИНА МОЛОКА И МОЛОЧНЫХ ПРОДУКТОВ | 2019 |
|
RU2830136C2 |
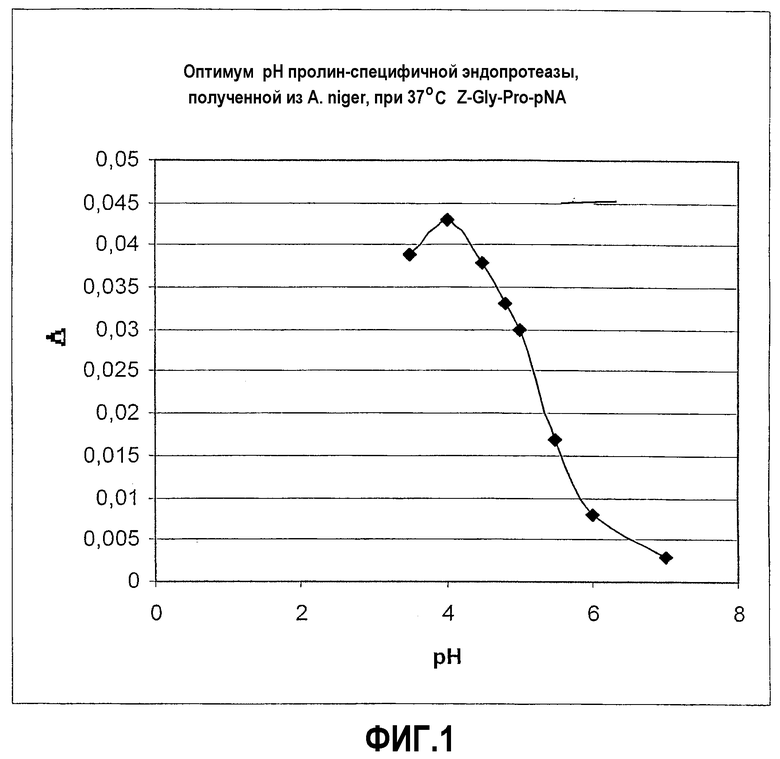
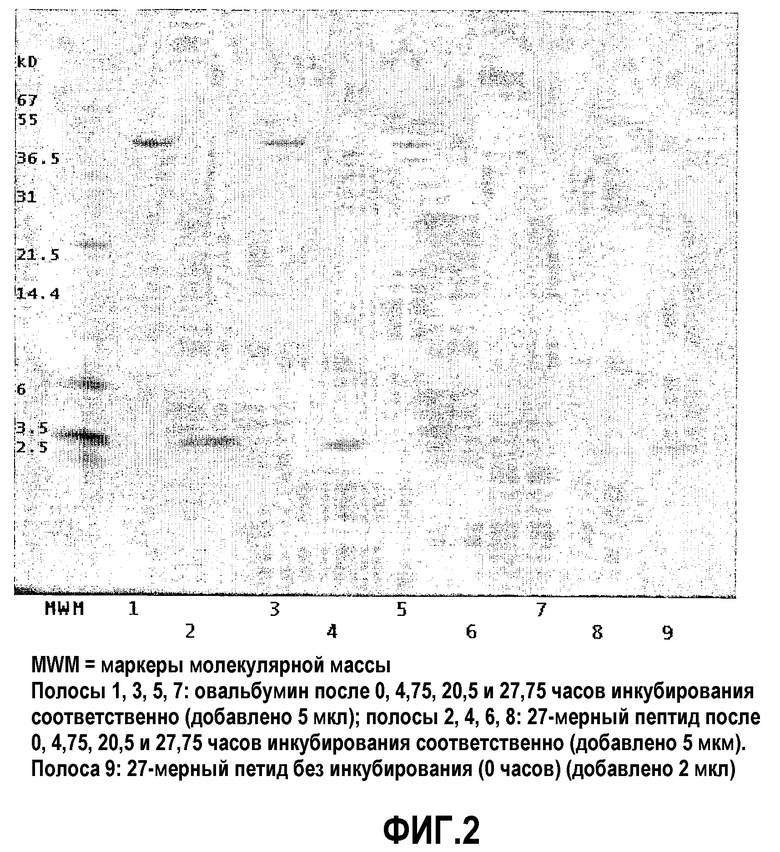
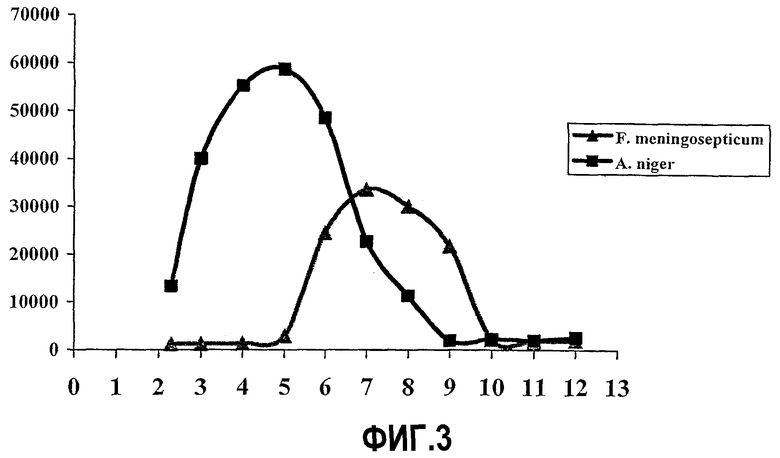
Изобретение относится к области медицины и касается применения пролинспецифичных эндопротеаз для гидролиза пептидов и белков. Сущность изобретения включает применение пролинспецифической эндопротеазы, имеющей рН оптимум ниже 5,5 для изготовления диетической добавки или лекарственного средства для in vivo лечения целиакии, или заболеваний, связанных с присутствием богатых пролином пептидов в потребляемой пище, а также в качестве диетической добавки или лекарственного средства для предотвращения целиакии. Преимущество изобретения заключается в усилении гидролиза пищевых белков с высоким содержанием пролина. 4 н. и 9 з.п. ф-лы, 10 табл., 3 ил.
1. Применение пролинспецифичной эндопротеазы, имеющей рН оптимум ниже 5.5, для изготовления диетической добавки для предотвращения целиакии, заболеваний, связанных с целиакией, заболеваний связанных с присутствием богатых пролином пептидов в потребляемой пище или вызванных снижением уровня пролинспецифичной протеазы.
2. Применение пролинспецифичной эндопротеазы, имеющей рН оптимум ниже 5.5, для изготовления лекарственного средства для in vivo лечения целиакии, заболеваний, связанных с целиакией, заболеваний связанных с присутствием богатых пролином пептидов в потребляемой пище или вызванных снижением уровня пролинспецифичной протеазы.
3. Применение пролинспецифической эндопротеазы, имеющей рН оптимум ниже 5.5, в качестве диетической добавки для предотвращения целиакии, расстройств, связанных с целиакией, заболеваний связанных с присутствием богатых пролином пептидов в потребляемой пище или вызванных снижением уровня пролин-специфичной протеазы.
4. Применение пролинспецифической эндопротеазы, имеющей рН оптимум ниже 5.5, в качестве лекарственного средства для лечения целиакии, расстройств, связанных с целиакией, заболеваний связанных с присутствием богатых пролином пептидов в потребляемой пище или вызванных снижением уровня пролинспецифичной протеазы.
5. Применение по любому из пп.1-4, при котором рН ниже 5,0.
6. Применение по любому из пп.1-4, при котором расстройство или заболевание локализовано в желудке.
7. Применение по любому из пп.1-4, при котором пролинспецифичной эндопротеазой является фермент Aspergillus, предпочтительно Aspergillus niger.
8. Применение по п.1 или 3, при котором пролинспецифичную эндопротеазу используют для производства пищевых добавок, предназначенных для индивидуумов, не достигших возраста 25 лет.
9. Применение по п.1 или 3, при котором пролинспецифичную эндопротеазу используют для производства лекарственных средств, предназначенных для индивидуумов, не достигших возраста 25 лет.
10. Применение по п.1 или 3, при котором пролинспецифичную эндопротеазу используют в качестве пищевой добавки, для производства пищевой добавки, или для производства корма, включая корм для животных, не являющихся людьми, предпочтительно млекопитающих.
11. Применение по п.2 или 4, при котором пролинспецифичную эндопротеазу используют в качестве лекарственного средства, для производства лекарственного средства для животных, не являющихся людьми, предпочтительно млекопитающих.
12. Применение по любому из пп.1-4, при котором пролинспецифичная эндопротеаза способна гидролизовать белки или пептиды, имеющие более 30 аминокислотных остатков.
13. Применение по любому из пп.1-4, при котором богатый пролином полипептид представляет собой клейковину.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2009-10-20—Публикация
2004-09-23—Подача