Изобретение относится к биологии, медицине и ветеринарии, и может быть использовано для блокирования хронических интеграционных инфекций, вызываемых вирусом иммунодефицита человека (ВИЧ), вирусом лейкоза крупного рогатого скота (BLV), вирусом иммунодефицита крупного рогатого скота (BIV), вирусом инфекционной анемии лошадей (EIAV), вирусом мышиной лейкемии (MuLV), а также вирусом гепатита В.
Известен способ блокирования ВИЧ-инфекции более чем 20 различными химиотерапевтическими препаратами (Покровский В.В., Ермак Т.Н., Беляева В.В., Юрин О.Г., 2000, ВИЧ-инфекция).
Однако все эти препараты вызывают быстрое развитие резистентности у вируса из-за возникающих множественных мутаций компонентов вириона ВИЧ, нарастающей токсичности, коротком периоде ремиссии болезни и невысокой специфичности ингибирования этапов вирусной репликации-репродукции, в результате чего ДНК-провирус полностью не удаляется из генома хронически инфицированной клетки, а только на какое-то время снижается уровень вирусной нагрузки.
Известно блокирование хронической интеграционной инфекции, вызванной BLV в перевиваемых клетках овцы (FLK), которые были контаминированы микоплазмой M.argini (Миллер Г.Г., Раковская И.В. Вопросы вирусологии, 1983, №5).
Целью изобретения является повышение специфичности и эффективности процесса освобождения клетки от вируса за счет удаления ДНК-провируса ВИЧ, интегрированного с геномом Т-лимфоцита, независимости от вирусных мутаций, отсутствия токсичности и сохранения жизнеспособности клетки.
Сущность способа заключается в специфическом взаимодействии вируса иммунодефицита человека (ВИЧ) с непатогенным микроорганизмом микоплазмой M.arginini, обусловленным действием аргинин дезаминазы в составе M.arginini, модифицирующей нуклеотидные последовательности ДНК-провируса ВИЧ, а также связывающим эффектом холестерина, присутствующего в составе Т-лимфоцита, вируса и микоплазмы. Эти события приводят к поэтапному удалению генома вируса из генома клетки, а также циркулирующего внеклеточного вируса.
Пример 1. Берут культуры первичных Т-лимфоцитов периферической крови доноров (PBL) или перевиваемые Т-лимфобластоидные клетки человека МТ4 в среде культивирования RPMI 1640 с 0,1 mg/ml L-глутамином и 10% сыворотки эмбрионов коров (FCS), без добавления антибиотиков. Преинфицируют клетки высокопатогенным Т-лимфотропным вариантом вируса иммунодефицита человека типа 1 (ВИЧ-1), штамм R5/X4 MVP-889 (Marchang P et al, 1984) на 48 час. Добавляют живые клетки микоплазмы M.arginini, выращенные на селективной питательной среде на 48-72 часа. Исходная концентрация клеток составляла 107 КОЕ. На 4-5 сутки культуры обрабатывают любым из фторхинолоновых аналогов антимиколазменных антибиотиков. Этим достигается удаление микоплазмы вместе со связанным ею циркулирующим внеклеточным вирусом. В результате вирусная нагрузка (р24АГ) в образцах вируссодержащей культуральной жидкости (КВЖ) после смешанного культивирования ВИЧ с M.arginini снижается на 50% по сравнению с контрольными цифрами для моно-инфекции одним вирусом (фиг.1).
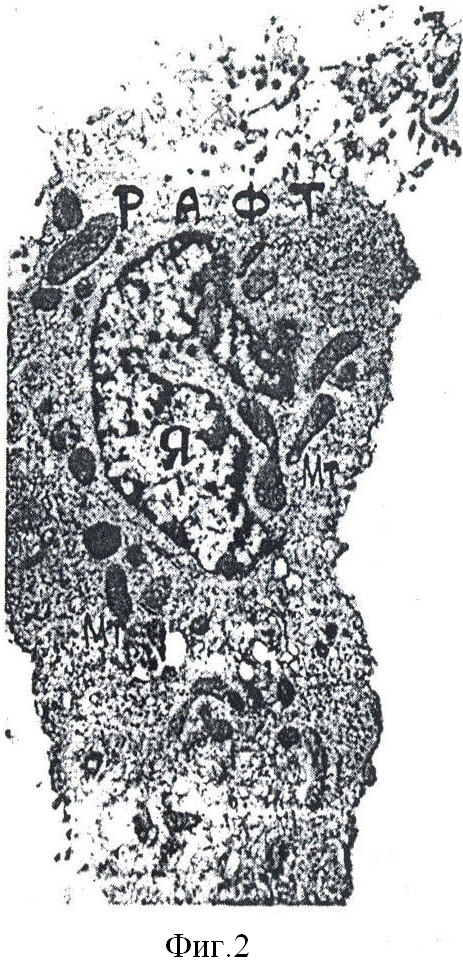
Пример 2. Определение эффективности колонизации микоплазмы M.arginini на Т-лимфоцитах в клетках МТ4 проводят в присутствии и в отсутствии ВИЧ. Из опытных и контрольных образцов клеток готовят мазки. Фиксируют 96° спиртом, окрашивают флуоресцентным красителем по Hoechst на ДНК. Количество изумрудных зерен на клетках учитывают в люминесцентном микроскопе ЛЮМАМ-2 с масляной иммерсией при увеличении 600х. Колонизация M.arginini не превышает 1,0% на 100 просчитанных клеток в контрольных образцах и незначительно больше, но статистически достоверно (до 1,5%) в пробах, смешанно инфицированных ВИЧ и M.arginini. При этом гранулы располагаются неизменно в одном определенном участке цитоплазмы над ядром или слегка эксцентрично. На обзорной электронограмме (фиг.2) и фрагменте при большем увеличении (фиг.3) показан этот участок клетки. Он соответствует биосинтетически наиболее активной зоне, богатой холестерином и известной как рафт. Из этого следует, что колонизация микоплазмы и формирование вируса топографически совмещены в одном и том же участке клетки - рафте.
Пример 3. Измеряют влияние митогенного эффекта на пролиферацию Т-лимфоцитов периферической крови доноров (PBL), индуцированного живыми клетками или бесклеточными фильтратами (БФ) 7 различных видов микоплазм в сравнении с растительным митогеном фитогемагглютинином (ФГА). Пролиферативный индекс определяют по включению в ДНК клеток тимидин-трифосфата, меченного тритием (3H-ТТР), в концентрации 1-2 µCi/ml в течение 16-18 час. Уровень радиоактивности подсчитывают в β-сцинцилляторе Mark 2000. Индекс пролиферации (CD50) выражают как процент от включения метки в опытные и контрольные образцы (диаграмма 1).
Уровень пролиферации M.arginini занимает среди других 7 видов микоплазм и (РВL) ФГА промежуточное положение. Митогенный эффект выражен значительно интенсивнее при воздействии живыми клетками, нежели БФ. Это означает, что митогенного эффекта от живых клеток M.arginini достаточно для активации в Т-клетках ядерного транскрипционного фактора NF-kβ и следующего за этим запуска экспрессии ранних генов деления.
Таким образом, M.arginini поддерживает клеточное деление и экспрессию проинфломаторных цитокинов, ответственных за синтез, в том числе иммуноглобулинов класса G и других компонентов вторичного иммунного ответа. Кроме того, живые клетки M.arginini не вызывают в Т-клетках спонтанного апоптоза (в противоположность препаратам очищенной аргинин дезаминазы), удерживают пролиферацию клеток при провокативном стауроспорин-индуцированном апоптозе и перекрывают про-апоптозную активность, проявляемую ВИЧ, в условиях смешанной микоплазма-вирусной инфекции. Тем не менее, в случае смешанной инфекции количество апоптозных клеток все же превышает таковое в культурах, инфицированных только одной микоплазмой. Такой эффект может быть отражением количественной зависимости между активностью слабо колонизируемой микоплазмы и высоким уровнем патогенности вируса (таблица 1).
Стауроспорин - индуцированный апоптоз в клетках МТ4 в условиях моно - и смешанной инфекции (по данным РИФ, окраска на ДНК по Hoechst)
Следовательно, живые клетки M.arginini не оказывают какого-либо патогенного действия или токсического эффекта на Т-лимфоциты периферической крови человека. Среди пяти из двухсот известных видов микоплазм, которые могут вызывать различные патологии у людей, M.arginini не значится (Molecular Biology and Pathogenicity of Mycoplasmas (ed. S.Razin, R.Herrman), Plenum Publishers, N-Y., 2002).
Пример 4. Оценку экспрессии цитокинов в клетках, раздельно и смешанно инфицированных ВИЧ и M.arginini, проводят с использованием коммерческой тест-системы для иммуноферментного анализа (ИФА) (Prokont, С.-Петербург). Определяют уровень синтеза провоспалительных цитокинов IL-1, IL-2, IL-6, IFN-α, IFN-γ, TNF-α в контрольных и опытных образцах через 16, 24 и 48 час от начала эксперимента. Уровень синтеза определяют в культуральной жидкости на спектрофотометре Multiscan Plus (Финляндия) при ОП 450 nm. В результате совместного культивирования ВИЧ и M.arginini происходит изменение конфигурации цитокинового профиля в сторону увеличения синтеза IL-1 и 2, а также IFN-α, γ и TNF-α, что отражает превалирование в популяции клеток пролиферативных процессов над цитодеструктивными (таблица 2).
Цитокиновый ответ ВИЧ-инфицированных Т-лимфоцитов, коинфицированных микоплазмой М. arginini (по данным ИФА в пг/мл)
Пример 5. При электронно-микроскопическом исследовании различных вариантов смешанных инфекций ВИЧ и M.arginini обнаруживают общие для этих агентов картины взаимодействия с Т-лимфоцитом, а также прямые взаимодействия между вирионами ВИЧ и клетками микоплазмы. Участок рафта при ув.×250000 показан на фиг.4. Демонстрируются как начальные, так и заключительные этапы инфекционного процесса. Имеется топографическое совмещение процессов адгезии клеток M.arginini и вирионов ВИЧ, а также места сортинга белков в эндосомальных вакуолях (ESM), сборки и почкования нового поколения вируса на одних и тех же участках клеточной периферии и поверхностной мембраны клетки. Более того, происходит активная адгезия внеклеточных вирионов ВИЧ на поверхности клеток самой микоплазмы с последующим формированием единого смешанного комплекса микоплазма-вирус. Такое связывание продиктовано конкуренцией за холестерин, а также взаимодействием внеклеточных вирионов ВИЧ и M.arginini при участии аргинин дезаминазы микоплазмы. Взаимодействие способствует «выведению из игры» вирионов, которые могли бы адсорбироваться на других Т-клетках и участвовать в дальнейшем распространении инфекции в клеточной популяции. Смешанный комплекс микоплазма-вирус может быть эффективно удален из культивируемых клеток с помощью антимикоплазменных антибиотиков.
Таким образом, комплекс молекулярных механизмов взаимодействия ВИЧ с определенным видом прокариота, а именно с M.arginini, приводит: а) к нарушению внутриклеточных процессов обратной транскрипции вирусной РНК под воздействием аргинин дезаминазы (АД) M.arginini; б) к образованию мутаций в синтезированной провирусной ДНК в результате модифицирующего действия АД микоплазмы, с последующим постепенным разрушением провирусных нуклеотидных последовательностей; в) к невозможности осуществления по этой причине процессов трансляции и сборки функционально активных вирусных белков; г) к нейтрализации внеклеточного вируса из-за конкуренции между вирусом и микоплазмой за холестерин в рафтах в результате топографического совмещения процессов колонизации микоплазмы, сортировки вирусных белков и формирования вирусных частиц. Все перечисленное приводит к блокированию инфекционного процесса в клетках.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСЛОВНО РЕПЛИЦИРУЮЩИЙСЯ РЕТРОВИРУСНЫЙ ВЕКТОР (ВАРИАНТЫ), СПОСОБ ЕГО ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ (ВАРИАНТЫ), ВЫДЕЛЕННАЯ И ОЧИЩЕННАЯ МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ | 1996 |
|
RU2270250C2 |
| СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ ВИЧ И ЦМВ-ИНФЕКЦИЙ И СПОСОБ ИХ ИНГИБИРОВАНИЯ | 2002 |
|
RU2196602C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ РНК ИНТЕРФЕРОНА λ, ИНТЕРЛЕЙКИНА IL23 И ПРОТИВОВИРУСНОГО БЕЛКА MxA | 2016 |
|
RU2627179C1 |
| СПОСОБ КОМПЛЕКСНО-ИНДИВИДУАЛИЗИРОВАННОГО ВОЗДЕЙСТВИЯ НА ОРГАНИЗМ ПРИ МЕДЛЕННОЙ ВИРУСНОЙ ИНФЕКЦИИ И СПОСОБ ПОДГОТОВКИ ЛАБОРАТОРНОГО ЖИВОТНОГО ДЛЯ ИСПЫТАНИЯ СПОСОБА ТАКОГО ВОЗДЕЙСТВИЯ | 2001 |
|
RU2207876C1 |
| СПОСОБ ИНГИБИРОВАНИЯ РЕПЛИКАЦИИ ВИЧ В КЛЕТКАХ МЛЕКОПИТАЮЩИХ И У ЛЮДЕЙ | 2011 |
|
RU2593948C2 |
| КОМПОЗИЦИИ И СПОСОБЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ОЦЕНКИ ЦИТОТОКСИЧНОСТИ ОТДЕЛЬНЫХ КЛЕТОК | 2009 |
|
RU2532228C2 |
| Иммунобиологическое средство для повышения клеточного ответа против вируса гепатита С | 2023 |
|
RU2811136C1 |
| СПОСОБ ВОЗДЕЙСТВИЯ НА ВИРУСЫ ПУТЕМ ИСПОЛЬЗОВАНИЯ ВЕЩЕСТВА НА ОСНОВЕ 2,8-ДИТИОКСО-1H-ПИРАНО[2,3-d; 6,5-d`] ДИПИРИМИДИНА И ИХ 10-АЗА-АНАЛОГОВ (ВАРИАНТЫ) | 2005 |
|
RU2294367C2 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЙ ЛОР-ОРГАНОВ ВИРУСНОЙ, БАКТЕРИАЛЬНОЙ И СМЕШАННОЙ ВИРУСНО-БАКТЕРИАЛЬНОЙ ЭТИОЛОГИИ У ВИЧ-ИНФИЦИРОВАННЫХ ДЕТЕЙ И ПОДРОСТКОВ | 2004 |
|
RU2305558C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ЦИТОМЕГАЛОВИРУСНОЙ ИНФЕКЦИИ ЧЕЛОВЕКА ДЛЯ ИЗУЧЕНИЯ И ТЕСТИРОВАНИЯ ПРОТИВОВИРУСНЫХ СОЕДИНЕНИЙ И ТРАНСПЛАНТАТ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2013 |
|
RU2544287C2 |



Изобретение относится к биотехнологии и может быть использовано для блокирования хронических интеграционных инфекций, вызываемых вирусом иммунодефицита человека (ВИЧ), вирусом лейкоза крупного рогатого скота (BLV), вирусом иммунодефицита крупного рогатого скота (BIV), вирусом лейкоза мышей (MuLV), вирусом инфекционной анемии лошадей (EIA) и вирусом гепатита В. Эффект достигается применением живых клеток непатогенного для человека микроорганизма микоплазмы M.arginini, используемой для суперинфекции Т-лимфоцита, инфицированного ВИЧ. Способ позволяет повысить специфичность и эффективность процесса поэтапного удаления интегрированного ДНК-провируса из генома клетки при сохранении ее жизнеспособности, независимо от любых вирусных мутаций. 5 ил., 2 табл.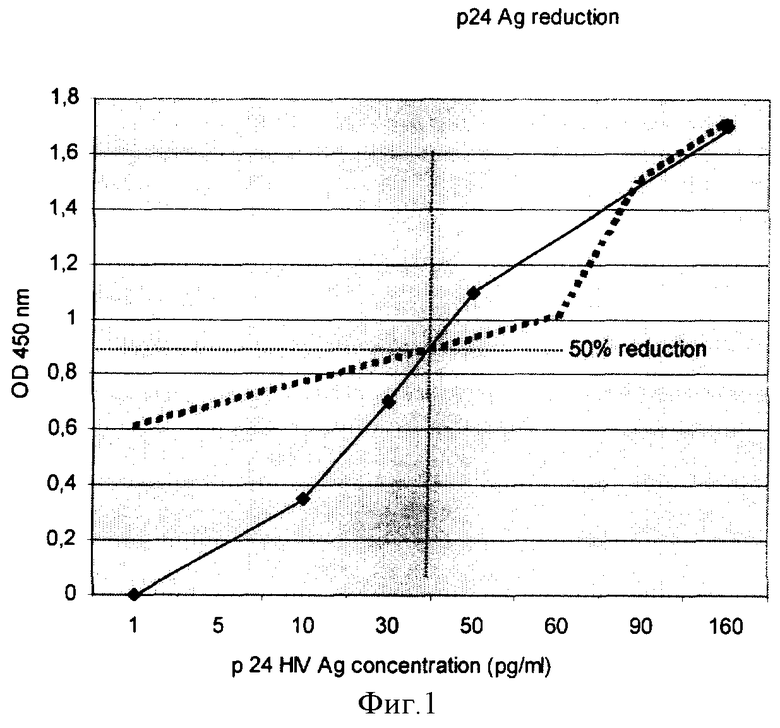
Способ блокирования хронической интеграционной инфекции, вызванной вирусом иммунодефицита человека, заключающийся в суперинфекции зараженной клетки in vitro непатогенной для человека микоплазмой M.arginini с последующим специфическим взаимодействием вируса с микоплазмой.
| МИЛЛЕР Г.Г., РАКОВСКАЯ И.В | |||
| Электронно-микроскопическое изучение ассоциации микоплазмы и бычьего лейкозного вируса в культуре ткани | |||
| Вопросы вирусологии | |||
| Гребенчатая передача | 1916 |
|
SU1983A1 |
| RUUTH E | |||
| et al | |||
| Interactions between mycoplasmas and the immune system, Immunol Rev, 1989, dec, реферат. | |||
Авторы
Даты
2009-10-20—Публикация
2008-04-07—Подача