Область, к которой относится изобретение
Настоящее изобретение относится к способу анализа взаимодействий между парами «мишень-эффекторные клетки», используемыми в способах крупномасштабного скрининга для определения профиля большого числа отдельных клеток в микромассивах.
Предшествующий уровень техники
Несмотря на то что исследования по контактированию человека с вирусом иммунодефицита человека типа 1 (ВИЧ-1), проводятся уже более двадцати пяти лет, остается признать, что ВИЧ/СПИД являются одной из главных причин заболеваний, представляющих угрозу для здоровья людей во всем мире. В настоящее время специалистами было высказано предположение, что в следующие двадцать лет ВИЧ/СПИД будет занимать третье место после рака и сердечно-сосудистых заболеваний среди причин смертности людей во всем мире. Вакцина, которая позволяла бы предупреждать инфицирование или индуцировать действие природных механизмов против указанного заболевания, пока еще не найдена. Существующие несложные способы анализов не позволяют определить критические признаки, связанные с клетками иммунной системы, которые обеспечивают выработку иммунитета против данного вируса. Методы, такие как проточная цитометрия, и иммуноферментные анализы (ELISpot, ELISA) позволяют выявить определенные популяции клеток, но они обладают недостаточной чувствительностью для оценки редких событий. Другие важные функции, такие как цитотоксичность и пролиферация, в настоящее время могут быть определены лишь в совокупности. Эти ограничения в целом затрудняют или вообще не позволяют оценивать выработку у человека иммунитета на ВИЧ с достаточной степенью точности и тем самым определить факторы корреляции иммунитета. А поэтому необходимость в разработке новых стратегий для анализа защитного иммунного ответа против вируса, такого как ВИЧ, остается крайне актуальной.
Описание сущности изобретения
Настоящее изобретение относится к способам идентификации CD8+-клеток, способных лизировать CD4+-ВИЧ-инфицированные клетки у индивидуума, путем получения суспензии эффекторных CD8+-клеток и клеток-мишеней, взятых у индивидуума и нанесенных на сформованную пластину, содержащую по меньшей мере одну микролунку в микролуночном массиве, где указанная по меньшей мере одна микролунка в микролуночном массиве имеет отдельную эффекторную клетку; культивирования указанной суспензии в условиях, позволяющих осуществлять лизис клетки-мишени под действием CD8+-клеток; детектирования лизиса клетки-мишени эффекторными клетками; и идентификации CD8+-клеток, способных лизировать CD4+-ВИЧ-инфицированные клетки. Эффекторные клетки, которые лизируют клетку-мишень, могут быть, но необязательно, выделены. Предпочтительно выделенные эффекторные клетки, которые лизируют клетку-мишень, культивируют. В одном из аспектов эффекторные клетки и клетки-мишени смешивают, а затем эти клетки помещают в микролунку. Альтернативно, эффекторные клетки и клетки-мишени смешивают после помещения клеток в микролунку. Лизис детектируют путем мониторинга изменения интенсивности флуоресценции меченых клеток. Альтернативно, лизис детектируют путем мониторинга изменений уровней внутриклеточного кальция в клетках-мишенях. Кальций детектируют с использованием флуоресцентного красителя, чувствительного к кальцию. Предпочтительно флуоресцентным красителем, чувствительным к кальцию, является Fura 2AM (Invitrogen).
В одном из аспектов микролуночный массив приводят в контакт с субстратом, где указанный субстрат предварительно обрабатывают по меньшей мере одним средством, которое позволяет специфически детектировать продукт эффекторных клеток с последующим детектированием указанного средства. Такими средствами являются антитело, цитокин или растворимый медиатор лизиса. Предпочтительным цитокином является TNF-α или IFN-γ. Необязательным растворимым медиатором лизиса является гранзим B (GzB) или перфорин. Способ по изобретению также предусматривает, но необязательно, мечение эффекторных клеток антигеном CD69.
Настоящее изобретение также относится к способам характеристики гуморального ответа у индивидуума путем получения суспензии В-клеток, взятых у индивидуума и нанесенных на сформованную пластину, содержащую по меньшей мере одну микролунку в микролуночном массиве, где указанный индивидуум инфицирован или, предположительно, инфицирован ВИЧ, и где по меньшей мере одна микролунка в микролуночном массиве имеет отдельную клетку; приведение в контакт указанного микролуночного массива с субстратом, где указанный субстрат предварительно обрабатывают по меньшей мере одним средством для детектирования В-клеток; и детектирования указанного средства с последующей характеристикой гуморального ответа. Предпочтительным средством для детектирования В-клеток является антитело, специфичное к эпитопу в gp120.
В одном из аспектов способ по изобретению также предусматривает приведение в контакт микролуночного массива со вторым субстратом, где указанный субстрат предварительно обрабатывают по меньшей мере одним первым средством для детектирования В-клеток. Необязательным первым средством для детектирования В-клеток является антитело против gp120 ВИЧ. Предпочтительным средством является антитело против С-концевого gp120 ВИЧ. В одном из аспектов определяют изотип антитела, продуцируемого В-клеткой в микролуночном массиве. Затем выделяют, но необязательно, В-клетки, экспрессирующие антитело, реагирующее с ВИЧ. В другом аспекте выделяют и амплифицируют вариабельные области легкой цепи и тяжелой цепи антитела. В-клетки обрабатывают, но необязательно, средством, которое стимулирует продуцирование антител в клетке. Предпочтительными средствами являются CD40L или анти-BCR антитело. В другом аспекте B-клетки обрабатывают CD40L и анти-BCR антителом.
Настоящее изобретение также относится к способам характеристики перекрестной реактивности B-клеток с множеством ВИЧ-изолятов путем получения суспензии В-клеток, взятых у индивидуума и нанесенных на сформованную пластину, содержащую по меньшей мере одну микролунку в микролуночном массиве, где указанный индивидуум инфицирован или, предположительно, инфицирован ВИЧ и где по меньшей мере одна микролунка в микролуночном массиве имеет отдельную клетку; приведения в контакт указанного микролуночного массива с первым субстратом, где указанный субстрат предварительно обрабатывают антителом, продуцируемым В-клетками, по меньшей мере в одной микролунке; приведения в контакт указанного субстрата с первым меченым вирионом ВИЧ и со вторым меченым вирионом ВИЧ; и определения наличия связывания первого меченого вириона и второго меченого вириона с антителами, продуцируемыми той же самой клеткой в указанной микролунке. B-клетки, продуцирующие антитела, которые специфически связываются с первым меченым вирионом и со вторым меченым вирионом, могут быть, но необязательно, выделены. В одном из аспектов выделенные В-клетки культивируют. Предпочтительно, по меньшей мере один из вирионов подвергают мечению. Альтернативно, первый вирион и второй вирион метят различными средствами, то есть различными детектируемыми маркерами.
Настоящее изобретение также относится к способам создания функционального профиля для эффекторных клеток, чувствительных к ВИЧ-инфекциям у индивидуума, путем получения популяции эффекторных клеток, выбранных из группы, состоящей из клеток CTL (CD8+), NK-клеток (CD16+), NK-T-клеток (CD1d+,Vα24+) или γδ-T-клеток (Vγ9+,Vδ2+), где указанные эффекторные клетки, взятые у индивидуума, были нанесены на сформованную пластину, содержащую по меньшей мере одну микролунку в микролуночном массиве, где по меньшей мере одна микролунка в микролуночном массиве имеет отдельную эффекторную клетку; и где популяция эффекторных клеток нагружена совместно с популяцией когнатных клеток-мишеней; визуализации эффекторных клеток; оценки цитотоксичности эффекторных клеток; приведения в контакт микролуночного массива с первым субстратом, где указанный субстрат предварительно обрабатывают средством, которое позволяет специфически детектировать один или более из IL-2, IL-4, IL-10, TNF-α и IFN-γ; и определения связывания эффекторных клеток, находящихся в микролунках, с одним или несколькими средствами. В одном из аспектов цитотоксичность оценивают путем детектирования высвобождения кальцеина AM. Указанные клетки метят, но необязательно, одним или несколькими поверхность-специфическими маркерными белками. Предпочтительными поверхностными маркерными белками являются CD62L, CXCR3, CCR4 или CCR7. В другом аспекте эффекторную клетку выделяют из одной или нескольких микролунок. Затем выделенную клетку культивируют, но необязательно, до достижения клональной амплификации выделенных клеток. Затем охарактеризовывают, но необязательно, экспрессию одного или нескольких генов в выделенной клетке. Выделенными клетками предпочтительно являются CD8+-цитотоксические T-клетки (CTL), природные киллеры (NK), NK-T-клетки или γδ-T-клетки. В другом аспекте указанным индивидуумом является индивидуум с инфекцией в острой стадии, индивидуум, подвергаемый высокоинтенсивной антиретровирусной терапии (HAART), или индивидуум, являющийся «элит-контроллером».
Настоящее изобретение также относится к способам оценки природного иммунитета у индивидуума с ВИЧ-инфекцией путем получения суспензии NK-клеток, взятых у индивидуума и нанесенных на сформованную пластину, содержащую по меньшей мере одну микролунку в микролуночном массиве, где указанный индивидуум инфицирован или, вероятно, инфицирован ВИЧ, а указанная по меньшей мере одна микролунка в микролуночном массиве имеет отдельную клетку; приведения в контакт указанного микролуночного массива с субстратом, где указанный субстрат предварительно обрабатывают по меньшей мере одним средством для детектирования NK-клеток, и детектирования указанного средства с последующей идентификацией NK-клеток и оценкой природного иммунного ответа. В одном из аспектов NK-клетки детектируют с использованием NKp46-Cy3, CD107a-Alexa647 и/или CD69-Alexa488. Средство для детектирования NK-клеток позволяет детектировать NK-клетки. Эти клетки совместно культивируют, но необязательно, перед их нанесением на сформованную пластину. Предпочтительно указанные клетки совместно культивируют с IL-12 и IL-18.
Настоящее изобретение также относится к способам оценки клонального разнообразия популяции NK-клеток путем получения суспензии NK-клеток и клеток-мишеней, взятых у индивидуума и нанесенных на сформованную пластину, содержащую по меньшей мере одну микролунку в микролуночном массиве, где указанная по меньшей мере одна микролунка в микролуночном массиве имеет отдельную эффекторную клетку; культивирования указанной суспензии в условиях, позволяющих осуществлять лизис клетки-мишени NK-клетками; детектирования лизиса клеток-мишеней эффекторными клетками; и идентификации эффекторных клеток с последующей оценкой клонального разнообразия популяции NK-клеток. В одном из аспектов эффекторные клетки, которые лизируют клетки-мишени выделяют и, необязательно, культивируют. В другом аспекте выделяют NK-клетки, которые лизируют клетки-мишени. NK-клетки и клетки-мишени смешивают, но необязательно, перед тем как их помещают в микролунку. Альтернативно, NK-клетки и клетки-мишени смешивают после того, как их помещают в микролунку. В одном из аспектов лизис клеток-мишеней определяют путем мониторинга изменения интенсивности флуоресценции меченых клеток. В еще одном аспекте NK-клетки, которые лизируют клетки-мишени, выделяют и детектируют ген иммуноглобулин-подобного рецептора клеток-киллеров (KIR) на NK-клетках. Микролуночный массив приводят в контакт, но необязательно, с субстратом, где указанный субстрат предварительно обрабатывают по меньшей мере одним средством, которое позволяет специфически детектировать продукт NK-клеток, и осуществляют детектирование указанного средства. Указанными средствами являются антитело, цитокин или растворимый медиатор лизиса. Предпочтительным цитокином является TNF-α или IFN-γ.
Настоящее изобретение также относится к способам оценки разнообразия популяции NK-клеток и В-клеток путем получения суспензии клеток, содержащих повышенное количество ВИЧ-инфицированных CD4+-Т-клеток, активированных NK-клеток, В-клеток и клеток-мишеней, где указанную суспензию наносят на сформованную пластину, содержащую по меньшей мере одну микролунку в микролуночном массиве, где указанная по меньшей мере одна микролунка в микролуночном массиве имеет отдельную Т-клетку; культивирования клеток в условиях, позволяющих антителам, продуцируемым В-клетками, связываться с поверхностью Т-клеток; идентификации лунок, содержащих В-клетки, NK-клетки и лизированные Т-клетки, и идентификации В-клеток или NK-клеток. В одном из аспектов NK-клетки активируют цитокином IL-2. В другом аспекте В-клетки активируют CD40L или анти-BCR антителом. В еще одном аспекте В-клетки активируют CD40L и анти-BCR антителом. NK-клетки активируют IL-2. В-клетки активируют анти-BCR антителом CD40L. B-клетки или NK-клетки выделяют, но необязательно, из лунок и охарактеризовывают одно или несколько свойств В-клеток. В другом аспекте охарактеризовывают гены антител в В-клетках. Затем анализируют, но необязательно, область VDJ генов, кодирующих антитела в B-клетках. Микролуночный массив приводят в контакт, но необязательно, с субстратом в условиях, стимулирующих связывание антител, продуцируемых В-клетками, с субстратом. В другом аспекте субстрат приводят в контакт с лизатами, выделенными из ВИЧ-инфицированных клеток и идентифицируют лунки с В-клетками, продуцирующими антитела, которые связываются с ВИЧ-лизатом, или анти-IgG3 антитело. Предпочтительно идентифицируют лунки с B-клетками, продуцирующими антитела, которые связываются с ВИЧ-лизатом, или анти-IgG3 антитело.
Другие признаки и преимущества настоящего изобретения будут очевидны из нижеследующего описания предпочтительных вариантов изобретения и из прилагаемой формулы изобретения. Если это не оговорено особо, все используемые здесь технические и научные термины имеют значения, в основном понятные среднему специалисту в области, к которой относится настоящее изобретение. Хотя для осуществления настоящего изобретения и для проведения тестов в соответствии с настоящим изобретением могут быть применены методы и материалы, аналогичные или эквивалентные описанным здесь методам и материалам, однако предпочтительными являются методы и материалы, описанные ниже. Все публикации, патентные заявки, патенты и другие упомянутые там работы во всей своей полноте приведены в настоящем описании в качестве ссылки. В случае возникновения противоречий они должны быть истолкованы так, как они трактуются в описании, включая определения терминов. Кроме того, такие материалы, методы и примеры носят лишь иллюстративный характер и не ограничивают настоящего изобретения.
Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания и формулы изобретения.
Краткое описание графического материала
На фигуре 1 представлена схема анализа. Клетки, флуоресцентно меченные мишени (окрашенные кальцеином, зеленым) и эффекторы (окрашенные α-CD8 APC, розовым) загружают на ~30 мкм микролуночный массив и визуализируют на флуоресцентном микроскопе. Затем микролуночный массив покрывают предметным стеклом, предварительно функционализированным антителами для захвата, и инкубируют при 37°C, 5% CO2 в течение 2-6 часов. После инкубирования секретированные цитокины детектируют на предметном стекле с использованием специфических флуоресцентных антител, и мишени, лизированные под действием специфических эффекторов, визуализируют по потере интенсивности флуоресценции (лунка 1). В микролунках, содержащих только клетки-мишени (лунка 2), и в микролунках, содержащих эффекторы, которые неспособны лизировать мишень (лунка 3), должно наблюдаться очень незначительное изменение интенсивности флуоресценции мишени.
На фигуре 2 представлена серия репрезентативных флуоресцентных изображений меченых мишеней и эффекторов до и после инкубирования (0 и 4 ч.). (A) Окрашенные кальцеином (зеленый) и нагруженные пептидом (KK10) мишени (могут наблюдаться 3 отдельных клетки); (B) эффекторы, меченные (розовые) α-CD8-APC; (C) совместное инкубирование эффекторов (розовых) и ненагруженных мишеней (без добавления пептида KK10) (зеленых); (D) совместное инкубирование эффекторов (показано розовым) и мишеней (зеленых), нагруженных пептидом KK10. Лизис мишеней происходил только в том случае, когда эффекторы распознавали нагруженные пептидом мишени (показано в D).
На фигуре 3 представлена панель флуоресцентных изображений CD4-T-клеток, инфицированных GFP-экспрессирующим вирусом NL4-3. Наличие зеленых клеток указывает на инфекцию.
На фигуре 4 представлена серия флуоресцентных изображений, иллюстрирующих совместное культивирование ВИЧ-специфических CD8+-Т-клеточных клонов с В-клетками, меченными кальцеином AM и нагруженными ВИЧ-пептидом. CTL-опосредуемый лизиз определяют по отсутствию флуоресцентного сигнала.
На фигуре 5 представлена панель флуоресцентных изображений, иллюстрирующих совместное культивирование APC-меченных CTL (красным) и В-клеток, меченных кальцеином AM (зеленым). Гашение флуоресценции кальцеина AM указывает на CTL-опосредуемый лизиз.
На фигуре 6 схематически представлена серия анализов отдельных клеток, которые были разработаны с использованием массива микролунок. Измерения проводили последовательно или одновременно. Квадраты на каждом изображении имеют размер 50 мкм.
На фигуре 7 схематически представлен анализ методом захвата, проводимый для идентификации клеток, распознающих CD4-связывающую область gp120. Один массив В-клеток был использован для отпечатывания (а) на поверхности иммобилизованного gp120, а затем (b) на второй поверхности иммобилизованного gp120 после блокирования растворимым CD4.
На фигуре 8 схематически представлена экспериментальная модель для идентификации антител человека, продуцируемых B-клетками и связывающихся с множеством штаммов ВИЧ. Каждый кластер иммобилизованных антител (окрашенных) представляет один элемент микромассива, который соответствует клеткам, присутствующим в соответствующих микролуночных массивах.
На фигуре 9 проиллюстрировано создание функционального профиля исходя из данных для отдельных клеток. Были отобраны популяции клеток, а затем были оценены их цитотоксические свойства, цитокиновые профили и поверхностные маркеры. На этих картах показан характер изменения частоты встречаемости субпопуляций в процессе инфицирования. Аналогичные профили для CD4+-T-клеток дают базисные точки, указывающие на статус данной системы.
На фигуре 10 показан гель, иллюстрирующий результаты проведения ОТ-ПЦР с использованием вырожденных праймеров для отдельных B-лимфоцитов, выбранных из микролунок. B-клетки выделяли из пробы крови (в результате негативного отбора МКПК посредством сортинга на магнитных сферах) и загружали в микролунки. Клетки произвольно отбирали из двенадцати микролунок, помещали в буфер для лизиса и амплифицировали с помощью ОТ-ПЦР с использованием серии вырожденных праймеров для тяжелых и легких цепей. Было отобрано семь последовательностей белка, которые указаны внизу за гелем.
Подробное описание изобретения
Исчерпывающие знания механизмов, которые позволяют вирусу иммунодефицита человека (ВИЧ) уклоняться от «надзора» иммунной системы, крайне необходимы для разработки эффективных вакцин и методов терапии. На прогрессирование заболевания у индивидуумов, не подвергаемых лечению, указывает непрерывная репликация вируса и потеря CD4+-T-клеток (Kahn J.O., Walker BD (1998) Acute human immunodeficiency virus type I infection. N. Engl. J. Med. 339, 33; Hecht FM et al. (2002) Use of laboratory tests and clinical symptoms for identification of primary HIV infection. AIDS 16, 1119). Вирус-специфические CTL играют значительную роль в регуляции непрерывной репликации, и было показано, что первое появление ВИЧ-1-специфических CD8+-Т-клеток приводит к снижению вирусной нагрузки (Altfeld M et al. (2006) HLA Alleles Associated with delayed progression to AIDS contribute strongly to the initial CD8 + T cell response against HIV-I PLoS. Med. 3(10), 1851). Однако такое снижение репликации вируса у большинства индивидуумов («прогрессоров») является временным. И лишь у очень небольшой подгруппы индивидуумов, называемых LTΝP («элит-контроллерами»), поддерживаются низкие вирусные пороговые уровни на протяжении длительного периода времени, и было показано, что вирус-специфические CD8+-Т-клетки, обнаруженные у этих индивидуумов, обладают более высокой пролиферирующей способностью по сравнению с теми же самыми клетками, выделенными у «прогрессоров» (Migueles S.A. et al. (2002) HIV-specific CD8+ T cell proliferation is coupled to perforin expression and is maintained in nonprogessors Nat. Immun. 3(11), 1061).
До появления настоящего изобретения исследователи, изучающие взаимодействия между патогеном и иммунной системой человека, сталкивались с двумя проблемами, связанными с тем, что: 1) число клеток, присутствующих в большинстве клинических образцов, часто очень ограничено; и 2) уникальные клоны, такие как патоген-специфические B-клетки или Т-клетки, встречаются редко.
Существующие в настоящее время аналитические средства недостаточны для одновременной оценки одной и той же отдельной клетки на множество свойств (линии дифференцировки, функции, генотипа). Так, например, проточная цитометрия представляет собой общеизвестный метод, используемый для анализа популяций отдельных клеток на фенотипические маркеры, экспрессируемые на поверхности, а анализ профилей цитокинов, который позволяет определить некоторые функциональные фенотипы, требует фиксации клеток и придания им проницаемости. Такая потеря жизнеспособности клетки означает, что дополнительные функциональные свойства, такие как цитотоксичность, не могут быть оценены прямым методом, при этом также часто затрудняется и генетический анализ. Таким образом, до появления настоящего изобретения было невозможно однозначно и точно определить гетерогенность клеток в субпопуляциях исходя из природной и адаптивной иммунных систем, отвечающих на конкретный инфекционный агент. Также трудно было создать представление о статусе иммунной системы. Такое представление облегчило бы идентификацию механизмов, которые сообщают иммунитет против некоторых патогенов и являются диагностическими индикаторами устойчивых ответов. Поэтому настоящее изобретение относится к новым технологиям измерения и установления корреляции линий дифференцировки, функций и генотипов для многих отдельных клеток, разработанных в целях повышения эффективности исследований взаимодействий между иммунной системой человека и представляющими интерес патогенами, а в частности ВИЧ (Fauci, A.S., Johnston, M.I., Dieffenbach, C.W., Burton, D.R., Hammer, S.M., Hoxie, J.A., Martin, M., Overbaugh, J., Watkins, D.I., Mahmoud, A. & Greene, W.C. Perspective -HIV vaccine research: The way forward. Science 321, 530-532 (2008)).
Настоящее изобретение относится к способам и композициям, используемым для характеристики иммунного ответа индивидуума на инфекции, включая инфекции, вызываемые вирусом иммунодефицита человека. Микромассивы и пластины могут быть сконструированы способами, известными специалистам, включая способы, описанные в заявке PCT/US 2006/036282 (опубликованной как WO 2007/035633) и в заявке США рег. № 61/057371. Содержание обеих заявок во всей своей полноте приведено в настоящем описании в качестве ссылки. Используемый в настоящем описании термин «сформованная пластина» означает устройство, которое может быть гибким, подвижным или может деформироваться по меньшей мере в одном направлении при его приведении в контакт с субстратом. Так, например, в некоторых конфигурациях сформованная пластина может быть получена, например, из эластомерного материала, так, чтобы при контакте этой сформованной пластины с субстратом они образовывали плотное, в основном водонепроницаемое, соединение, позволяющее задерживать или предотвращать утечку любой жидкости из сформованной пластины.
Противовирусная функция цитотоксических T-лимфоцитов (CTL) в ингибировании ВИЧ
Цитотоксические CD8+-Т-клетки (CTL) играют важную роль в подавлении острых вирусных инфекций и в регуляции резервуаров инфекции, вызываемой персистирующим вирусом. Истощение CD8+-лимфоцитов у SIV-инфицированных макак приводит к быстрому и заметному повышению виремии. Тем не менее, хронические ВИЧ-1-инфекции связаны с избыточным количеством ВИЧ-специфических CD8+-Т-клеток в отсутствие клиренса вируса или регуляции его уровня. Эти данные позволяют предположить, что именно функции, а не число CD8+-Т-клеток играет важную роль в эффективной регуляции уровня репликации вируса. До настоящего времени активность ВИЧ-специфических CD8+-Т-клеток определяли либо путем оценки частоты встречаемости ВИЧ-специфических CD8+-Т-клеток посредством мечения этих клеток тетрамерами комплексов «пептид-HLA класса I», либо по способности этих клеток секретировать IFN-γ после антигенной стимуляции. Однако недавно проведенные исследования показали, что частота встречаемости CD8+-Т-клеток и секреция IFN-γ под действием этих клеток не коррелирует с регуляцией виремии при хронических инфекциях, вызываемых вирусом ВИЧ-1.
Способность CTL подавлять репликацию ВИЧ измеряют путем совместного культивирования ВИЧ-инфицированных CD4+-Т-клеток и массы аутологичных CD8+-Т-клеток. Эти эксперименты давали неоднородные результаты в отношении способности индивидуумов к ингибированию ВИЧ. Недавно полученные результаты позволяют предположить, что CD8+-Т-клеточные ответы ex vivo не коррелируют со способностью этих клеток ингибировать репликацию ВИЧ-1 in vitro. Скорее всего CD8+-Т-клетки, которые могут пролифирировать в количествах, достаточных для борьбы с вирусом, способны осуществлять регуляцию уровня вируса, однако фенотип, функциональные свойства и генетический транскрипционный профиль (созревание/истощение) этих клеток пока неизвестны.
Хотя важная роль ВИЧ-специфических CD8+-Т-клеток в предотвращении прогрессирования заболевания не вызывает сомнений, однако их характеристика и выделение представляют значительные трудности. Для выделения CTL были применены различные методы, каждый из которых имеет свои достоинства и преимущества. Для выделения антиген-специфических клонов может быть проведен анализ методом лимитирующего разведения, однако результаты такого анализа зависят от способности этих клонов к размножению в тканевой культуре. Анализ ELISPOT позволяет определять способность активированных CTL секретировать отдельный цитокин, но не дает какой-либо информации относительно их литических свойств. Было также продемонстрировано, что антигенпрезентирующие клетки (АПК), обнаруживающие низкую плотность нагруженных пептидом MHC (pMHC), могут обладать цитотоксической функцией без одновременной секреции цитокинов (Valitutti S et al. (1996) Different responses are elicited in cytotoxic T lymphocytes by different levels of T cell receptor occupancy. J. Exp. Med. 183, 1917). Это ограничение оказалось особенно эффективным при попытке выделения ВИЧ-специфических CTL, поскольку вирусная инфекция ингибирует MHC класса I (Mangasarian A et al. (1999) Nef-Induced CD4 and Major Histocompatibility Complex Class I (MHC-I) Down-Regulation Are Governed by Distinct Determinants: N-Terminal Alpha Helix and Proline Repeat of Nef Selectively Regulate MHC-I Trafficking J. Virol. 73(3), 1964). Для выделения ангигенспецифических CTL использовали окрашивание нагруженным пептидом и флуоресцентно помеченным тетрамером HLA класса I в комбинации с проточной цитометрией, однако это также не дало какой-либо информации о литической способности этих клеток. Кроме того, было показано, что CTL, выделенные методом окрашивания тетрамером, не всегда распознают инфицированные вирусом клетки (Appay V et al. (2000) HIV-specific CD8+ T cells produce antiviral cytokines but are impaired in cytolytic function. J. Exp. Med. 192(1), 63). В литературе описан анализ лизиса методом проточной цитометрии, проводимый с использованием субстратов каспазы, однако такой анализ непригоден для скрининга большого числа эффекторных клеток (Liu L et al. (2002) Visualization and quantification of T cell-mediated cytotoxicity using cell-permeable fluorogenic caspase substrates Nat. Med. 8, 185). Таким образом, до появления настоящего изобретения не существовало какого-либо конкретного крупномасштабного метода, который позволял бы определять способность отдельных CTL к лизису отдельных инфицированных первичных клеток-мишеней и измерять число цитокинов и цитотоксических молекул, секретируемых этими клетками, а значит, и отобрать «живую» клетку в целях определения клональных линий для последующей функциональной характеристики и генетического анализа.
Сохранение высоких уровней CD8+-Т-клеток, которые способны распознавать и лизировать инфицированные CD4+-Т-клетки, непосредственно коррелирует с уровнем ингибирования репликации вируса у пациента. Определение уникального фенотипа, функции и профиля экспрессии генов в цитолитических и нецитолитических CTL на уровне отдельных клеток позволяет обнаруживать корреляты сообщаемого CD8+-Т-клетками противовирусного иммунитета, необходимого для разработки эффективной вакцины против ВИЧ. Настоящее изобретение относится к анализу на элиминацию отдельных CTL в комбинации с фенотипированием и генетическими анализами, позволяющими определять иммунологические и генетические корреляты эффективного опосредуемого CD8+-Т-клетками противовирусного иммунного ответа. Определение таких свойств на уровне отдельных клеток позволит определить прототипический ответ, который будет вырабатываться посредством иммунизации вакциной, сконструированной в целях увеличения числа CD8+-Т-клеток, способных эффективно подавлять репликацию вируса.
Разнообразие антител у ВИЧ-инфицированных пациентов
Первичным рецептором, экспрессируемым на поверхности ВИЧ, является gp120. Рецептор, презентируемый на поверхности некоторых Т-клеток, необходим для инфицирования и связывается с CD4. Было предпринято множество попыток разработки вакцин против ВИЧ в целях блокирования инфекции посредством вырабатывания NAb-ответа против gp120, однако в настоящее время все эти попытки оказались безуспешными, что обусловлено, главным образом, вариабельностью рецепторов у различных штаммов и предрасположенностью этих рецепторов к мутации в их хозяине. Однако в настоящее время имеются примеры инфицирования людей, у которых в естественных условиях образуются NAb, обладающие способностью нейтрализовать многие варианты вируса широкого ряда. Разнообразие этих антител трудно оценить стандартными методами, поскольку уникальные антитела присутствуют в сыворотке в ограниченном количестве, трудно поддаются очистке и не могут быть рекомбинантно продуцированы без соответствующих генов. Проблема заключается в том, что bNAb соответствуют клональной линии В-клеток, из которых они продуцируются. До настоящего времени наиболее успешной попыткой идентифицировать гены, кодирующие NAb, было применение пэннинга библиотек антител, продуцируемых рекомбинантными методами из большого числа В-клеток, присутствующих в кровотоке ВИЧ-положительных индивидуумов (Koefoed, K., Farnaes, L., Wang, M., Svejgaard, A., Burton, D.R. & Ditzel, H.J. Molecular characterization of the circulating anti-HIV-1 gp120-specific B cell repertoire using antibody phage display libraries generated from pre-selected HIV-I gp120 binding PBLs. J. Immunol Methods 297, 187-201 (2005)). Однако эти подходы не дают возможности точно определить природный репертуар антител у индивидуумов, поскольку такой способ приводит к нарушению уникальных клональных комбинаций тяжелых и легких цепей. Как описано ниже в примерах, необходимо решить две проблемы, а именно определить: (1) клональное разнообразие bNAb-продуцирующих В-клеток у индивидуума; и (2) свойства bNAb, которое связывается с первичными изолятами широкого ряда.
Клеточные иммунные ответы против ВИЧ
Есть надежда, что вакцина против ВИЧ будет эффективной для тех индивидуумов, у которых наблюдается естественное заметное подавление прогрессирования заболевания, у так называемых «элит-контроллеров», и у приматов, не являющихся человеком и обладающих иммунитетом к обезьяньему вирусу иммунодефицита (SIV), который был сообщен им путем вакцинации; однако решающие факторы, которые в данном случае коррелируют с иммунитетом, пока еще не ясны (Saez-Cirion, A., Pancino, G., Sinet, M., Venet, A., Lambotte, O. & Gr, A.E.H.C.S. HIV controllers: how do they tame the virus? Trends Immunol 28, 532-540 (2007); Deeks, S.G. & Walker, B.D. Human immunodeficiency virus controllers: Mechanisms of durable virus control in the absence of antiretroviral therapy. Immunity 27, 406-416 (2007); Koff, W.C., Johnson, P.R., Watkins, D.I., Burton, D.R., Lifson, J.D., Hasenkrug, K.J., McDermott, A.B., Schultz, A., Zamb, T.J., Boyle, R. & Desrosiers, R.C. HIV vaccine design: insights from live attenuated SIV vaccines. Nat Immunol 7, 19-23 (2006)). Особенно большого внимания заслуживает адаптивный иммунный ответ, и недавно проведенные исследования природной иммунной системы показали его важность в формировании адаптивного ответа (Pulendran, B. & Ahmed, R. Translating innate immunity into immunological memory: Implications for vaccine development. Cell 124, 849-863 (2006)). Имеющиеся в настоящее время анализы, проводимые путем мониторинга эффективной элиминации инфицированных клеток иммунными клетками, не позволяют в достаточной степени охарактеризовать гетерогенность в отношении их функций (Fauci, A. S., Johnston, M.I., Dieffenbach, C. W., Burton, D.R., Hammer, S. M., Hoxie, J.A., Martin, M., Overbaugh, J., Watkins, D.I., Mahmoud, A. & Greene, W.C. Perspective - HIV vaccine research: The way forward. Science 321, 530-532 (2008); Walker, B.D. & Burton, D.R. Toward an AIDS vaccine. Science 320, 760-764 (2008)). Настоящее изобретение относится к способам характеристики и корреляции множества иммунных функций отдельных клеток различных линий дифференцировки для анализа субпопуляций эффекторных клеток у пациентов различных групп, например у пациентов с острыми инфекциями, у пациентов с хроническим прогрессирующим заболеванием, у пациентов, подвергаемых интенсивной антиретровирусной терапии (HAART), и у «элит-контроллеров». Как описано в настоящей заявке, количественные анализы клеток позволяют идентифицировать клетки, имеющие специфические комбинации функций, необходимых для регуляции репликации вирусов.
Другим средством защиты от вирусных инфекций является природный иммунный ответ. NK-клетки представляют собой центральный компонент такого ответа (Alter, G., Teigen, N., Ahem, R., Streeck, H., Meier, A., Rosenberg, E.S. & Altfeld, M. Evolution of innate and adaptive effector cell functions during acute HIV-1 infection. J. Infect Dis 195, 1452-1460 (2007)). Такими клетками являются цитотоксические эффекторные клетки, которые также индуцируют адаптивные иммунные ответы посредством высвобождения цитокинов, таких как IFN-γ, MIP-1β, TNF-α и GM-CSF. В случае ВИЧ-1-инфекции данные эпидемиологических исследований со всей очевидностью продемонстрировали, что у индивидуумов, у которых имеются конкретные NK-клеточные рецепторы (рецептор цитотоксического иммуноглобулина 3DS1 (KIR3DS1) и некоторые аллели KIR3DL1) и их предполагаемые лиганды (аллели HLA-B с изолейцином в положении 80), СПИД прогрессирует более медленно, чем у пациентов, у которых имеется только один или из этих аллелей или вообще отсутствуют эти аллели (Martin, M.P., Qi, Y., Gao, X.J., Yamada, E., Martin, J.N., Pereyra, F., Colombo, S., Brown, E.E., Shupert, W.L., Phair, J., Goedert, J.J., Buchbinder, S., Kirk, G.D., Telenti, A., Connors, M., O'Brien, S.J., Walker, B.D., Parham, P., Deeks, S. G., McVicar, D. W. & Carrington, M. Innate partnership of HLA-B and KIR3DL1 subtypes against HIV-1. Nat Genet 39, 733-740 (2007)). Аналогичным образом, повышенная активность NK-клеток и повышенная экспрессия транскриптов KIR3DS1 в массе NK-клеток коррелирует с иммунитетом к инфекции даже после повторного инфицирования (Alter, G., Martin, M.P., Teigen, N., Carr, W.H., Suscovich, T.J., Schneidewind, A., Streeck, H., Waring, M., Meier, A., Brander, C, Lifson, J.D., Allen, T.M., Carrington, M. & Altfeld, M. Differential natural killer cell-mediated inhibition of HIV-I replication based on distinct KIR/HLA subtypes. The Journal of experimental medicine 204, 3027-3036 (2007); Long, B.R., Ndhlovu, L.C., Oksenberg, J.R., Lanier, L.L., Hecht, F.M., Nixon, D.F. & Barbour, J.D. Conferral of enhanced natural killer cell function by KIR3DS1 in early human immunodeficiency virus type 1 infection. J. Virol 82, 4785-4792 (2008)). Эти данные позволяют предположить, что конкретные популяции NK-клеток играют защитную роль в предупреждении и подавлении инфекции, однако точные фенотипы этих клеток пока не были определены.
Одним из механизмов, используемых NK-клетками для элиминации ВИЧ-инфицированных клеток, является прямой цитолиз после межклеточного контакта. Некоторые формы KIR, экспрессируемые на поверхности NK-клеток, посылают ингибирующие сигналы клетке, которая подавляет цитолитическую функцию при лигировании с HLA класса I, экспрессируемом на поверхности клетки-мишени (Moretta, A., Bottino, C, Mingari, M.C., Biassoni, R. & Moretta, L. What is a natural killer cell? Nat Immunol 3, 6-8 (2002)). В отсутствие таких взаимодействий NK-клетки активируют и лизируют клетку-мишень. ВИЧ-инфицированные клетки часто ингибируют экспрессию аллелей HLA-A и -B, что делает их более восприимчивыми к цитолизу под действием активированных NK-клеток (Fogli, M., Mavilio, D., Brunetta, E., Varchetta, S., Ata, K., Roby, G., Kovacs, C, Follmann, D., Pende, D., Ward, J., Barker, E., Marcenaro, E., Moretta, A. & Fauci, A.S. Lysis of endogenously infected CD4+ T cell blasts by rIL-2 activated autologous natural killer cells from HIV-infected viremic individuals. Plos Pathogens 4, 1-13 (2008)). Вторым механизмом, посредством которого субпопуляция NK-клеток, экспрессирующих CD16 (Fcγ-рецептор III), разрушает ВИЧ-инфицированные клетки, является ADCC (Cooper, M.A., Fehniger, T.A. & Caligiuri, M.A. The biology of human natural killer-cell subsets. Trends Immunol 22, 633-640 (2001)). Эти рецепторы связываются с Fc-областью антител, связанных с мишенями на поверхности инфицированных клеток, и активируют лизис под действием NK-клеток. Такой механизм защиты требует объединения гуморального иммунного ответа, опосредуемого В-клетками, и природного ответа NK-клеток. Этот ответ может иметь важное значение для замедления прогрессирования ВИЧ-инфекции, а в некоторых случаях для защиты от инфекции ВИЧ-1 у индивидуумов, которым внутривенно было введено лекарственное средство, и от SIV-инфекции у макак (Stratov, L, Chung, A. & Kent, S.J. Robust NK cell-mediated human immunodeficiency virus (HΙV)-specific antibody-dependent responses in HIV-infected subjects. J. Virol 82, 5450-5459 (2008)). Однако до появления настоящего изобретения специалисты, изучающие этот механизм, сталкивались с ограничениями, заключающимися в отсутствие количественных анализов для измерения ADCC.
Настоящее изобретение более подробно проиллюстрировано на нижеследующих неограничивающих примерах.
Пример 1. Разработка высокоэффективного анализа для оценки цитолитической активности отдельных клеток
В ранее проводимых исследованиях был описан высокоэффективный анализ для функциональной характеристики большого числа первичных клеток путем загрузки отдельных клеток в пиколитровые микролунки (~2×105 на микромассив, каждая лунка имела диаметр ~30 мкм) (Bradshaw EM et al. (2008) Concurrent detection of secreted products from human lymphocytes by microengraving: cytokines and antigen-reactive antibodies. Clin. Immunol. 129(1), 10; Love J.C. et al. (2006) A microengraving method for rapid selection of single cells producing antigen-specific antibodies. Nat. Biotech. 24(6), 703). Загруженные микролунки поддерживали в физическом контакте с предметными стеклами, предварительно функционализированными соответствующими реагентами (например, анти-IL-2 антителом для захвата, нанесенным на предметные стекла с полилизином) и инкубировали в течение 2 часов для захвата секретированных цитокинов. Затем предметные стекла обрабатывали и метили соответствующими детектирующими антителами для выявления флуоресцентных пятен на предметных стеклах, которые могут быть картированы на клетках, секретирующих эти антитела. Затем эти клетки могут быть отобраны с применением роботизированных микроманипуляторов для клонального размножения.
Настоящее изобретение относится к применению массивов микролунок для исследования межклеточных взаимодействий. В частности, настоящее изобретение относится к способу мониторинга лизиса инфицированных клеток-мишеней отдельными CTL при одновременном определении профиля маркеров активации/секретированных растворимых медиаторов. Другим преимуществом этой аналитической системы является скорость получения результатов (или завершения анализа). Так, например, результаты получают (или анализ завершают) менее чем через 24 часа, менее чем через 12 часов или менее чем через 10 часов. Так, например, результаты получают (или анализ завершают) менее чем через 4 часа.
Изготовление штампов микромассивов
Микролуночные массивы изготавливают из полидиметилсилоксана (PDMS) с применением фотолитографии и формования реплик. Глубина и размер лунок предпочтительно составляют менее чем 100 мкм, например менее чем 50 мкм. По усмотрению специалиста глубина и размер лунок могут быть доведены до ~30 мкм. Для стерилизации микромассивов и сообщения им гидрофильных свойств проводят обработку O2-плазмой. Обработанный плазмой массив погружают в PBS-BSA в целях сохранения гидрофильных свойств и для последующего применения.
Клеточные материалы
В описанных ниже методах использовали ВИЧ-инфицированные CD4-клетки и аутологичные CD8-клетки. В описанных ниже методах также использовали МКПК, взятые у индивидуумов с прогрессирующим заболеванием, и у LTNP- и ВИЧ-отрицательных индивидуумов. Кроме того, выделенные CTL-клоны, которые специфически распознают HLA-B27-рестриктированный пептид gag ВИЧ (KK10), служили в качестве позитивного контроля для оценки достоверности анализа и уточнения экспериментальных условий.
Разработка анализа
В целях создания точного протокола выделения мишень-специфических CTL ранее упомянутый KKl0-специфический клон (эффектор) использовали в качестве эффекторов, а HLA B27-экспрессирующие EBV-трансформированные B-клетки использовали в качестве мишеней. Общий протокол анализа схематически проиллюстрирован на фигуре 1. Нагруженные пептидом В-клетки (мишени) окрашивали кальцеином AM (Invitrogen, Carlsabad, CA), то есть неспецифическим флуоресцентным субстратом для внутриклеточных эстераз и липаз, и эти клетки служили в качестве маркера целостности клеток. Интактные клетки с нормальным иммунитетом оставались флуоресцентными в отсутствие эффекторных клеток на протяжении всего анализа на цитолиз (4 часа), как показано на фигуре 2A.
Поскольку снижение интенсивности флуоресценции мишени также, вероятно, обусловлено фотоотбеливанием/деградацией флуорофора после длительного инкубирования, то мишени метили красителем Sytox красным (Invitrogen, Carlsabad, CA). Семейство мембрано-непроницаемых красителей Sytox давало значительное увеличение интенсивности флуоресценции (>500 раз) при их интеркаляции нуклеиновыми кислотами, а поэтому такие красители могут быть использованы в качестве специфических маркеров для лизированных клеток с поврежденными мембранами. Поскольку красители Sytox и кальцеин метят клетки по ортогональному механизму, то они могут быть использованы одновременно для мониторинга кинетики лизиса мишеней путем детектирования увеличения/снижения интенсивности флуоресценции в независимых каналах флуоресцентного микроскопа.
Эффекторы были помечены флуоресцентными анти-CD8 антителами (APC/Alexa647/тихоокеанский голубой). Может быть использован краситель, который дает наиболее репродуцируемый сигнал и наименьшее фотоотбеливание/наименьшую деградацию в аналитических условиях (4 часа, 37°C). Эффекторы, помеченные α-CD8-APC, представлены на фигуре 2B.
Предварительные исследования (Bradshaw EM et al. (2008) Concurrent detection of secreted products from human lymphocytes by microengraving: cytokines and antigen-reactive antibodies. Clin. Immunol. 129(1), 10; Love J.C. et al. (2006) A microengraving method for rapid selection of single cells producing antigen-specific antibodies. Nat. Biotech. 24(6), 703) и предварительные эксперименты (фигуры 2A и 2B) подтвердили, что клетки не подвергаются апоптозу при их инкапсулировании в микролунках. Затем были определены оптимальные пути загрузки микролуночных массивов мишенями и эффекторами в определенных отношениях. Были оценены два различных подхода, а именно предварительное смешивание мишеней и эффекторов в среде перед загрузкой, или последовательная загрузка эффекторов и мишеней. Поскольку сначала осуществляли последовательную загрузку эффекторов, а затем мишеней, то это давало лучший эффект, чем изменение отношения «эффектор:мишень» в микролунках, а поэтому этот подход был принят за стандартный. Для исследования целесообразности применения данного анализа ненагруженные мишени (мишени с несвязанным пептидом, отрицательный контроль) и KK10-нагруженные мишени (положительный контроль) инкубировали с эффекторами. Поскольку T-клеточный рецептор (TCR) на эффекторе может распознавать только pMHC на мишени, то лизис в отсутствие пептида не наблюдался (фигура 2C). При предварительной нагрузке мишеней пептидом KK10 и их инкубировании с эффекторами наблюдался лизис мишеней, на что указывала потеря флуоресцентного излучения в зеленом диапазоне спектра (фигура 2D). Данные, приведенные на фигуре 2, представляют собой репрезентативные данные, полученные для одной отдельной микролунки. Для оценки числа микролунок, которые имеют отдельную мишень, инкубированную с отдельным эффектором, и для определения числа субпопуляции эффекторов, которые специфически лизировали мишени, необходимо провести автоматизированный анализ генерируемых флуоресцентных изображений (два различных канала) и фазово-контрастного изображения (проходящий свет, третий канал). В экспериментах, включающих контроли и проводимых с использованием клонов-мишеней и эффекторных клонов, описанных выше, для оценки достоверности данного анализа достаточно провести лишь мануальную оценку небольшого числа клеток (~102), однако в целях рутинного скрининга необходимо разработать алгоритмы для получения большого набора данных и их анализа.
Идентификация клеток с низкой частотой встречаемости
Важным условием для успешного осуществления рутинного скрининг-анализа CTL является возможность детектировать и выделять позитивные клетки с низкой частотой встречаемости. Для этой цели эффекторы предварительно смешивали так, чтобы эффекторы, нагруженные HLA-B27 KK10 (меченные кальцеиновым синим), и эффекторы, нагруженные несоответствующим эпитопом (немеченые), имели различные отношения (1/5000-1/25000), а затем смесь клеток метили α-CD8-APC и инкубировали с KK10-нагруженными мишенями (меченными кальцеиновым зеленым) в микролуночных массивах. Позитивные эффекторы с низкой частотой встречаемости идентифицировали в микролунках по потере интенсивности флуоресценции мишени в зеленом диапазоне спектра под действием KK10-специфических эффекторов, и возможность их картирования может быть независимо оценена путем идентификации локализации KK10-специфических эффекторов посредством флуоресцентных изображений, полученных в синем канале микроскопа.
Определение фенотипа противовирусной активности CTL
Для теоретического исследования биологии эффективного CTL-опосредуемого цитолиза применяли планшет микролуночного массива. ВИЧ-инфицированные клетки-мишени (T), а также эффекторные клетки (E) метили двумя различными флуоресцентными репортерными красителями и смешивали в различных отношениях E:T, а затем загружали на массив микролунок так, чтобы в каждой лунке в среднем находилась одна отдельная эффекторная клетка. Эти клетки подвергали совместному культивированию в течение 4 часов, а затем измеряли уровень цитолиза путем детектирования потери интенсивности флуоресценции клеток-мишеней в течение определенного периода времени. И наконец, идентифицировали клетки, которые опосредовали цитолиз, а затем эти клетки отбирали с использованием автоматизированного микроманипулятора и переносили непосредственно в буфер для экстракции РНК. Параллельно для сравнения также отбирали промежуточные клетки-киллеры и клетки, не являющиеся киллерами. В субсерии экспериментов клетки-киллеры и клетки, не являющиеся киллерами, собирали и использовали для клонирования отдельных клеток в целях сбора полной информации о всех указанных клетках на клональном уровне. Этот анализ позволяет более детально охарактеризовать CTL, а также позволяет проводить анализы на немодифицированных Т-клетках для получения точного представления об ex vivo коррелятах для защитных CD8+-Т-клеточных ответов. Эти анализы могут быть подвергнуты различным экспериментальным модификациям, что позволяет определить различие между фенотипами эффекторных CTL, взятых у «контроллеров» и у «прогрессоров» или у пациентов с «защитными» и «незащитными» HLA-аллелями.
Разработка анализа с использованием микролунок для оценки цитолитического действия отдельных клеток
Настоящее изобретение также относится к идентификации клеточно-опосредуемого цитолиза в различных условиях с высокой репродуцируемостью. Необходимо определить множество деталей, связанных с анализами, проводимыми на вышеупомянутых микролуночных планшетах, включая протоколы биологического эксперимента, реагенты, кинетику, клеточные препараты, выбор клеток-мишеней и анализ данных. Этот анализ осуществляли с использованием цитолитических T-клеточных клонов в качестве эффекторов и В-клеток, подвергнутых импульсному мечению пептидом, в качестве мишеней. В предварительном эксперименте HLA B27-экспрессирующие В-клетки подвергали импульсному мечению пептидом gag ВИЧ (KK10), а затем метили кальцеином AM. Клетки-мишени совместно культивировали с CTL-клоном, распознающим эпитоп B27-KK10 (E:T = 1:1), и после инкубирования в течение 4 часов детектировали лизис по потере интенсивности флуоресцентного излучения, испускаемого клеткой-мишенью (фигура 4). Различные способы мечения оценивали с использованием ряда красителей для идентификации эффекторов и клеток-мишеней, а затем отношения E:T на лунку корректировали в целях улучшения качества визуализации цитолитической активности. В другом предварительном эксперименте эффекторные клетки метили анти-CD8-APC антителом, а B-клетки метили кальцеином AM. На фигуре 5 проиллюстрирована прогрессирующая потеря клеток-мишеней в течение 4-часового совместного культивирования. Эффекторные клетки (красные) заметно отличались от клеток-мишеней (зеленые).
Разработка компьютерных алгоритмов для идентификации представляющих интерес клеток
Уточнение разработанного протокола позволило осуществлять рутинный скрининг 105-106 клеток на эксперимент. Данные, полученные с одного массива, содержат 24*72*3 изображений (~5 Гб). Оптимизация данного анализа может быть осуществлена путем мануальной оценки небольшого числа клеток (102-103), однако для рутинного скрининга с применением данного метода предпочтительно разработать алгоритмы для получения большого набора данных и их анализа. Был разработан компьютерный алгоритм для применения в биоинформатике. Был специально разработан пакет программ в целях проведения анализа изображений для обработки и сохранения большого объема данных, которые будут накапливаться при анализе каждого массива. Эта компьютерная программа позволит распознавать лунки, в которых осуществляется цитолиз, и размещать эти лунки в микроманипуляторе.
Пример 2. Идентификация и выделение CTL, специфичных к ВИЧ-инфицированным CD4 + -T-клеткам, по их способности лизировать клетки-мишени и детектировать секретированные медиаторы этих CTL
После определения оптимальных условий идентификации клеток с низкой частотой встречаемости для идентификации CTL, обладающих способностью лизировать ВИЧ-инфицированные аутологичные CD4+-T-клетки, проводили анализ с использованием микролунок. В качестве предварительной стратегии использовали CD4+-T-клетки, инфицированные GFP-экспрессирующими рекомбинантными вирусами для специфической визуализации предпочтительного цитолиза. Сортинг на проточном цитометре по GFP-флуоресценции также позволяет получить гомогенную вирус-инфицированную популяцию CD4+-мишеней. В недавно проведенных исследованиях были выявлены происходящие от GFP+NL4-3 ВИЧ-варианты, которые давали обещающие результаты с точки зрения их инфекционности, способности к репликации и интенсивности GFP-сигнала. CD4+-T-клетки продуцировали четкий зеленый флуоресцентный сигнал при инфицировании этими GFP-экспрессирующими штаммами (фигура 3). Очистка инфицированных CD4-клеток методом клеточного сортинга давала гомогенную полуляцию мишеней.
Детектирование секретированных медиаторов мишень-специфических литических CTL
Для мультиплексного детектирования секретированных цитокинов была разработана технология получения микроизображений (Bradshaw EM et al. (2008) Concurrent detection of secreted products from human lymphocytes by microengraving: cytokines and antigen-reactive antibodies. Clin. Immunol. 129(1), 10). Как показано на фигуре 1, предметные стекла, предварительно функционализированные иммобилизованными антителами против цитокинов, приводили в контакт с микролуночным массивом. После инкубирования предметные стекла промывали и анализировали с использованием детектирующих антител, конъюгированных с флуорофором. Пятна картировали на отдельных лунках в микролуночном массиве для идентификации и сбора клеток, содержащихся в микролунке. В случае CTL-опосредуемого цитолиза детектировали секрецию TNF-α, IFN-γ и растворимых медиаторов лизиса, а именно гранзима B (GzB) и перфорина. Детектирование GzB и перфорина может быть затруднено, поскольку их секреция поляризуется в направлении иммунологического синапса (IS) (Faroudi et al. (2003) Lytic versus stimulatory synapse in cytotoxic T lymphocyte/target cell interaction: manifestation of a dual activation threshold. Proc. Natl. Acad. Sci USA 100, 14145) и поскольку количество секретируемых молекул обычно невелико. В случае если количество секретируемых факторов слишком мало для детектирования в данном анализе, то мониторинг активации CTL осуществляют путем регистрации уровней внутриклеточного кальция. Активация TCR комплексами pMHC приводит к дозозависимому увеличению концентрации ионов кальция в цитозоле T-клеток (Kim H. et al. (2006) Live lymphocyte arrays for biosensing Adv. Funct. Mater. 16, 1313). Проникающие через мембраны и чувствительные к кальцию флуоресцентные красители, такие как Fura 2AM (Invitrogen), могут функционировать как стандартные репортеры уровней внутриклеточного кальция, а значит, и активации Т-клеток. Если оба этих варианта окажутся неприемлемыми, то эффекторные клетки могут быть помечены маркером активации, CD69.
После характеристики CTL по способности к лизису, секретированным факторам и условиям активации клетки отбирали с использованием микроманипулятора для выявления клональных линий и для получения генетической информации. Если возникает проблема, связанная с потерей клеток в процессе принтинга цитокинов, то могут быть разработаны альтернативные пути для захвата и сохранения клеток в микролуночных массивах с использованием фибронектина/анти-CD44 антитела (маркер B/T-клеточной поверхности), которые не связаны с такими серьезными проблемами.
Пример 3. Различия в CTL у пацентов с прогрессирующим заболеванием («прогрессоров») и пацентов с длительным отсуствием прогрессирования заболевания («непрогрессоров») (LTNPS) с точки зрения способности этих CTL секретировать растворимые медиаторы и осуществлять лизис
Целями данного исследования являются количественная оценка и сравнение цитотоксических Т-лимфоцитарных (CTL) ответов на ВИЧ-инфицированные CD4+-T-клетки, где указанные оценки и сравнение проводят по способности CTL лизировать мишени и секретировать цитокины. Этот подход основан на недавно разработанной методике высокоэффективного скрининга для определения профиля большого числа отдельных клеток в микромассивах и для анализа взаимодействий между парами мишеней и эффекторых клеток.
Сравнение и количественная оценка различий в CTL
Настоящее изобретение относится к способу количественной оценки различий между отдельными мишень-специфическими CTL у больших группах индивидуумов-«прогрессоров», LTNP, индивидуумов, инфицированных после HAART, и индивидуумов с хронической инфекцией. Так, например, хотя у LTNP и у пациентов-«прогрессоров» наблюдалось значительное различие в уровнях экспрессии перфорина и в пролиферации ВИЧ-специфических CTL, однако анализ, проведенный на популяциях CTL, не дал какой-либо информации, прямо указывающей на литические свойства этих клеток (Migueles S.A. et al. (2002) HIV-specific CD8+ T cell proliferation is coupled to perform expression and is maintained in non-progressors Nat. Immun. 3(11), 1061). В этой связи возникает важный вопрос, существуют ли субпопуляции CTL, которые подвергаются активации посредством связывания с TCR, но имеют пониженный секреторный ответ, заключающийся в вырабатывании либо цитокинов, либо цитотоксических агентов. Высокоэффективный анализ позволяет идентифицировать эти и другие субпопуляции CTL и облегчает поиск клеток для последующего получения клональных линий и генетической модификации.
В результате этого был разработан надежный количественный анализ, позволяющий идентифицировать и отбирать CTL, способные лизировать ВИЧ-инфицированные клетки на уровне отдельных клеток. Такой подход позволяет не только количественно оценить степень лизиса, но также получить подробную информацию о иммунологических и генетических коррелятах эффективных противовирусных функций CTL после их отбора методом микроманипуляции. Такая технология позволяет точно определить многие биологические свойства CTL и быстро обследовать большие группы пациентов, которые включают пациентов с острой инфекцией, пациентов, прошедших HAART, «элит-контроллеров» и пациентов с хронической инфекцией для оценки различий в CTL у пациентов этих групп. Кроме того, такой анализ может быть легко адаптирован для проведения исследования по цитолизу с использованием различных клеточных субпопуляций, включая цитолитические клетки (то есть природные клетки-киллеры, макрофаги и т.п.).
Пример 4. Оценка разнообразия антител у ВИЧ-инфицированных индивидуумов
В настоящем изобретении рассматривается ряд новых способов, проводимых с использованием изготовленных микросистем для одновременной оценки множества свойств многих отдельных первичных лимфоцитов. Такие методы позволяют идентифицировать клетки, секретирующие антитело, реагирующее с антигеном (Love, J.C., Ronan, J.L., Grotenbreg, G.M., van der Veen, A.G. & Ploegh, H.L. A microengraving method for rapid selection of single cells producing antigen-specific antibodies. Nat Biotechnol 24, 703-707 (2006); Ronan, J.L., Story, CM., Papa, E. & Love, J.C. Optimization of the surfaces used to capture antibodies from single hybridomas reduces the time required for microengraving. J. Immunol. Methods (в печати); Story, CM., Papa, E., Hu, C-C.A., Ronan, J.L., Herlihy, K., Ploegh, H.L. & Love, J.C. Profiling antibody responses by multiparametric analysis of single B cells. Proc. Natl. Acad. Sci. 105, 17902-17907 (2008)), определять профиль секретированных цитокинов (Bradshaw, E.M., Kent, S.C, Tripuraneni, V., Orban, T., Ploegh, H. L., Hafler, D. A. & Love, J.C. Concurrent detection of secreted products from human lymphocytes by microengraving: antigen-reactive antibodies and cytokines. Clin. Immunol 129, 10-18 (2008)), амплифицировать мРНК-транскрипты и оценить цитотоксическую функцию с разрешением на уровне отдельных клеток (фигура 6). Общим элементом, используемым в этих методах, является плотный массив из субнанолитровых микролунок, сформованных на поверхности полимерного чипа (~105-106 лунок на чип). Клетки осаждали из суспензии при плотности ~1 клетка на лунку (например, 1, 2, 3, 4 или 5 клеток/лунку, а предпочтительно 1 клетка на лунку). Массив клеток может быть использован как штамп для отпечатывания белковых микромассивов секретированных молекул (антител или цитокинов) или как набор контейнеров для проведения определенных анализов отдельных клеток (анализов на экспрессию генов, цитотоксичность или пролиферацию). После проведения всех анализов за исключением анализа на экспрессию генов клетки остаются жизнеспособными, при этом экспрессируемые на поверхности маркеры могут быть визуализированы для определения иммунофенотипов, а представляющие интерес клетки могут быть отобраны посредством микроманипуляции для клонального размножения или генетического анализа. Последующее применение этих анализов позволяет установить корреляцию функции, иммунофенотипа и генотипа одного и того же набора отдельных клеток. Вместе с этим, такие измерения позволили получить данные, аналогичные данным, полученным в анализах групп пациентов на функцию (ELISA, ELISpot, анализ на пролиферацию), фенотип (FACS, иммунофлуоресцентный анализ) и генотип (ОТ-ПЦР), но с разрешением на уровне отдельных клеток.
Клональное разнообразие bNAb-продуцирующих B-клеток у индивидуума
Получение микроизображений представляет собой способ, который был разработан для отпечатывания микромассивов антител, продуцируемых отдельными клетками, в целях осуществления количественной оценки частоты встречаемости B-клеток, реагирующих с gp120 в кровотоке, распределения изотипов этих антител и их нейтрализующих свойств. Скрининг-анализ был разработан так, что он позволяет идентифицировать реагирующие с gp120 антитела сначала посредством иммобилизации антитела, специфичного к С-концу gp120 (D73-324) на поверхности предметного стекла, а затем путем осаждения рекомбинантного gp120 (Progenics). B-клетки, полученные от ВИЧ+-индивидуумов, имеющих высокие титры bNAb в сыворотке, стимулировали CD40L/анти-BCR антителом для индуцирования продуцирования антител. Эти клетки наносили на массив микролунок и использовали для отпечатывания двух реплик микромассивов антител на gp120-покрытых предметных стеклах. Перед отпечатыванием второго массива растворимый CD4 или b12 (моноклональное антитело с известными нейтрализующими свойствами) добавляли к субстрату, используемому для захвата антител из клеток. Антитела, связывающиеся с gp120 на первом микромассиве, но не связывающиеся с CD4-блокированным gp120 на втором массиве, вероятно, будут нейтрализовать ВИЧ (фигура 7). Для оценки разнообразия присутствующих изотипов, микромассивы метили смесью флуоресцентных изотип-специфических «вторых» антител (IgG1, IgG3, IgG4, IgA, IgM). Представляющие интерес антитела на микромассивах картировали для соответствующей микролунки, и клетки отбирали с применением автоматизированной микроманипуляции (Aviso CellCelector). Вариабельные области генов, кодирующих тяжелые и легкие цепи, амплифицировали и секвенировали с помощью ОТ-ПЦР отдельных клеток (Wang, X. W. & Stollar, B.D. Human immunoglobulin variable region gene analysis by single cell RT-PCR. J. Immunol Methods 244, 217-225 (2000)). Сравнение последовательностей позволило установить взаимосвязь близкородственных клонов с доминантными генами зародышевой линии и соматическими мутациями. Эти антитела рекомбинантно экспрессировали, и их нейтрализующую активность подтверждали путем проведения стандартных анализов (Monogram Biosciences).
Свойства bNAb, связывающихся с различными первичными изолятами
Одна из проблем, возникающих при разработке вакцин для вырабатывания Nab, заключается в том, что иммуногены должны вырабатывать антитела, которые будут перекрестно реагировать с другими вариантами вируса широкого ряда. Выявление механизмов специфичности антител, нейтрализующих различные первичные изоляты, должно послужить руководством для конструирования новых иммуногенов, и в настоящее время является одним из приоритетных факторов при исследовании ВИЧ (Fauci, A. S., Johnston, M.I., Dieffenbach, C.W., Burton, D. R., Hammer, S.M., Hoxie, J.A., Martin, M., Overbaugh, J., Watkins, D.I., Mahmoud, A. & Greene, W.C. Perspective - HIV vaccine research: The way forward. Science 321, 530-532 (2008)). Скрининг-анализ был модифицирован для иммобилизации антител, секретированных из отдельных В-клеток, путем создания микроизображений с последующим пэннингом массива с различными изолятами ВИЧ, каждый из которых был окрашен различными липофильными флуоресцентными красителями (фигура 8). Представляющие интерес клетки отбирали, и их антитела рекомбинантно экспрессировали и охарактеризовывали на специфичность к эпитопу и на нейтрализующую активность.
Частота встречаемости нужных В-клеток в кровотоке может быть низкой. Хотя существующий в настоящее время предел детектирования (0,01-0,001%) превышает предел, типичный для FACS (0,1%), (Bradshaw, E.M., Kent, S. C, Tripuraneni, V., Orban, T., Ploegh, H.L., Hafler, D.A. & Love, J.C. Concurrent detection of secreted products from human lymphocytes by microengraving: antigen-reactive antibodies and cytokines. Clin Immunol 129, 10-18 (2008)), однако может оказаться необходимым обогащение реагирующими с gp120 B-клетками с использованием gp120-покрытых магнитных сфер. Два альтернативных подхода для проведения скрининг-анализа включают: i) использование клеточных линий или вирусоподобных частиц, экспрессирующих тримерный gp120, в целях идентификации тример-специфических антител, и ii) проведение анализов на конкурентное связывание с другими bNAb, такими как 2Gl2. Предлагаемые здесь подходы позволяют осуществлять ряд простых анализов с мониторингом способности сконструированных иммуногенов вырабатывать антитела, которые связываются с различными первичными изолятами, непосредственно из циркулирующих В-клеток.
Наиболее часто применяемым анализом для оценки ответа эффекторных клеток является детектирование интерферона-γ (IFN-γ) методом ELISpot, однако такое однопараметрическое измерение не коррелирует с регуляцией виремии (Walker, B.D. & Burton, D.R. Toward an AIDS vaccine. Science 320, 760-764 (2008)). Также необходимо провести оценку других функциональных ответов, например пролиферации, широких профилей цитокинов, маркеров рекрутинга в слизистую и цитолитической активности (Fauci, A.S., Johnston, M.I., Dieffenbach, C. W., Burton, D.R., Hammer, S.M., Hoxie, J.A., Martin, M., Overbaugh, J., Watkins, D.I., Mahmoud, A. & Greene, W.C. Perspective - HIV vaccine research: The way forward. Science 321, 530-532 (2008)). Для различных субпопуляций эффекторных клеток (CD8+-цитотоксических Т-клеток (CTL), природных киллеров (NK), NK-T-клеток или γδ-T-клеток), которые продуцируют ответ на ВИЧ-инфицированные клетки, определяли мультипараметрический функциональный профиль с использованием микроанализов. МКПК отсортировывали с помощью FACS на CTL (CD8+), NK-клетки (CD16+), NK-T-клетки (CD1d+,Vα24+), и γδ-T-клетки (Vγ9+,Vδ2+). Каждая субпопуляция эффекторных клеток, а именно HLA-совместимых, EBV-трансформированных B-клеток, нагруженных перекрывающимися пулами пептидов, происходящих от ВИЧ и окрашенных кальцеином AM, может быть загружена в микролунки вместе с клетками-мишенями. Эти совместно нагруженные массивы визуализировали под микроскопом с живыми клетками для определения лунок с двойной нагрузкой. После инкубирования массивы снова визуализировали для оценки цитотоксичности (оцениваемой по высвобождению кальцеина AM) (фигура 6c, внизу справа). Профиль цитокинов, высвобождаемых клетками, которые оставались в лунках, оценивали путем получения микроизображений (IL-2, IL-4, IL-10, TNF-α и IFN-γ). С использованием этой исходной панели можно оценить приблизительно 10-15 Th1- и Th2-цитокинов, а также регуляторных цитокинов в одном анализе. Эти клетки также метили на присутствие 3 специфических поверхностных маркеров, указывающих на их «хоминг»-паттерны (например, CD62L, CXCR3, CCR4, CCR7), и визуализировали под микроскопом. Клетки, представляющие интерес в этом эксперименте, экстрагировали посредством микроманипуляции для клонального размножения или определения профиля экспрессии гена. Эти эксперименты повторяли 3-5 раз для 5 индивидуумов на стадии острой инфекции. Для сравнения эти измерения также проводили у HAART-пациентов и у «элит-контроллеров». Полученные данные указывали на разброс полифункциональных ответов у этих клеточных популяций во время инфекционного поражения и на фенотипические признаки, которые коррелировали с эффективной цитотоксичностью.
Профиль уровня системного иммунного ответа на ВИЧ у «элит-контроллеров», сравниваемых с пациентами с острыми инфекциями и с HAART-пациентами.
Из-за сложности иммунной системы наряду с отсутствием средств для мониторинга небольших функциональных и фенотипических различий между субполуляциями клеток широкого класса (например, CD4+-T-клеток) большинство исследований заболеваний у человека ограничивается характеристикой одной популяции клеток, выделенных из части сетчатой структуры. Могут быть проведены количественные анализы на системные уровни и прогностическое моделирование сложных биологических сетчатых структур, но эти анализы требуют достаточного количества многомерных данных для разрешения тонкой структуры системы. Карты, полученные на основе патологического состояния, создавали исходя из данных для отдельных клеток, которые описывают функциональные профили для субпопуляций эффекторных клеток, полученных от «элит-контроллеров», пациентов с острой инфекцией и HAART-пациентов (фигура 4). Для оценки вариаций среди групп каждого класса были проведены статистические анализы, такие как иерархическая группировка и анализ главных компонентов. Полученные данные использовали в первой части данного проекта для создания таких профилей. Этот подход аналогичен подходу, применяемому в интеграционном геномном анализе, за исключением того, что в данном подходе для определения профилей используется детальные характеристики отдельных клеток (Bradshaw, E.M., Kent, S. C., Tripuraneni, V., Orban, T., Ploegh, H.L., Hafler, D.A. & Love, J.C. Concurrent detection of secreted products from human lymphocytes by microengraving: antigen-reactive antibodies and cytokines. Clin. Immunol. 129, 10-18 (2008)).
Одно из преимуществ описанных здесь способов заключается в том, что в этих анализах может быть использовано небольшое число клеток (103-105). Использование пептидных пулов для нагрузки клеток-мишеней может искажать измеренные функциональные профили. В качестве альтернативного подхода в этих анализах исследовали аутологичные ВИЧ-инфицированные CD4+-T-клетки, при этом во избежание обратной конволюции этих профилей цитотоксическими клетками сначала необходимо проводить оценку профилей цитокинов. В настоящее время эффективность клонирования нецитолитических человеческих T-клеток составляет ~75-90%. Эта эффективность может снижаться, поскольку некоторые цитолитические клетки могут подвергаться запрограммированной клеточной гибели и эти клетки размножают так, чтобы их было достаточно для проведения анализов на каждом клоне. Определение тонких функциональных различий, коррелирующих с эффективными противовирусными ответами для клеток природной иммунной системы и эффекторных клеток памяти, позволит установить эталонный критерий для разработки вакцин или других методов терапии.
Пример 5. Корреляция между фенотипическими маркерами и функциональным поведением NK-клеток во время острых стадий ВИЧ-инфекции
Вышеописанные анализы могут быть применены для мультиплексного детектирования цитокинов, секретированных отдельными клетками, в целях получения детальных фенотипических, функциональных и генотипических профилей NK-клеток у пациентов с острыми ВИЧ-инфекциями и у пациентов с длительным непрогрессирующим заболеванием (непрогрессоров). Как указывалось выше, эти подходы являются неприемлемыми для выявления участия этих клеток в продуцировании иммунного ответа у хозяина, но позволяют идентифицировать свойства редких клеток, которые трудно поддаются анализу существующими методами, такими как проточная цитометрия и ELISpot. Отдельные субпопуляции NK-клеток присутствуют на различных стадиях инфекции, и их функциональное поведение (или потеря функции) позволяют понять механизм снижения действия этих клеток после острой стадии инфекции.
Клетками, необходимыми для такого исследования, являются NK-клетки, присутствующие в кровотоке ВИЧ+-пациентов. При этом использовали продольные образцы, взятые у пациентов с острыми инфекциями и у пациентов с длительным непрогрессирующим заболеванием/«элит-контроллеров».
Существуют две важных субпопуляции NK-клеток, обнаруживаемых у человека (Cooper, M. A., Fehniger, T. A. & Caligiuri, M. A. The biology of human natural killer-cell subsets. Trends Immunol 22, 633-640 (2001)). Цитолитические NK-клетки (NKp46posCD3negCD56posCD16pos/neg) секретируют большие количества IFN-γ, TNF-α, MIP-1β, GM-CSF. В противоположность этому иммунорегуляторные NK-клетки (NKp46posCD3negCD56pos/negCD16pos) продуцируют большие количества IL-10 и IL-17. У здоровых индивидуумов обычно присутствуют большие количества цитолитических NK-клеток и низкие уровни иммунорегуляторных NK-клеток. Однако во время беременности и локализации распространения инфекций слизистых оболочек, популяции иммунорегуляторных NK-клеток увеличиваются. При этом неясно, происходит ли изменение баланса между этими двумя популяциями NK-клеток во время инфицирования вирусом ВИЧ-1, и способны ли конкретные клоны NK-клеток продуцировать паттерны цитокинов, связанных с множеством Т-хелперных ответов.
Описанный выше метод создания микроизображений может быть применен для детектирования пяти цитокинов в одном анализе (IFN-γ, TNF-α, MIP-1β, IL-10 и IL-17). Для оптимизации анализа NK-клетки экстрагировали из периферической крови здоровых контрольных индивидуумов путем негативного отбора (Stem Cell Technologies). Эти NK-клетки разделяли на две фракции и либо совместно культивировали с IL-12 и IL-18 (сильными стимуляторами всех NK-клеточных функций), либо оставляли нестимулированными. После стимуляции в течение 4 часов NK-клетки помещали на микролуночный массив (~105, диаметр лунок 30 мкм). Для оценки оптимального времени инкубирования проводили кинетические исследования в целях измерения максимума NK-клеточной функции. После иммобилизации цитокинов на предметном стекле клетки в лунках окрашивали на прототипические маркеры активации NK-клеток (Hoescht 33324 (ядерных), NKp46-Cy3, CD107a-Alexa647 и CD69-Alexa488), и визуализировали на специально сконструированной установке для высокоскоростной визуализации. Детектированные профили цитокинов от каждой клетки коррелировали с этими данными и эти данные группировали с помощью анализа основных компонентов для идентификации наиболее распространенных клеточных субпопуляций (8 параметров на клетку). NK-клетки выделяли у 10 пациентов с острой ВИЧ-инфекцией, а также у 10 пациентов с длительным непрогрессирующим заболеванием («непрогрессоров»). Затем анализы повторяли для того, чтобы определить характер изменения субпопуляций клеток у этих групп по сравнению друг с другом и с контрольной группой. И наконец, оценивали различия субпопуляций клеток, присутствующих у пациентов с острой инфекцией в течение длительного периода времени, для того чтобы определить характер изменения субпопуляций клеток у групп с прогрессирующим заболеванием.
Пример 6. Оценка клонального разнообразия цитолитических NK-клеток
В отличие от T- и B-клеток, которые экспрессируют один антиген-специфический рецептор, NK-клетки экспрессируют множество различных рецепторов в рандомизированных комбинациях. Комбинация рецепторов на отдельных NK-клеточных клонах позволяет этим клонам дифференцированно распознавать инфицированные вирусом клетки или злокачественные клетки. Экспрессия рецепторов NK-клеток и распределение субпопуляций NK-клеток при ВИЧ-инфекции резко изменяется. У индивидуумов с острой ВИЧ-1-инфекцией наблюдается значительное увеличение NK-клеток, а именно примерно до 50% циркулирующих мононуклеарных клеток периферической крови (МКПК) представляют собой NK-клетки, образующиеся в первые несколько недель после инфицирования. По сравнению с этим прогрессирующую инфекцию определяют по аккумуляции анергических CD56neg-NK-клеток. Механизм изменения ряда рецепторов на клональном уровне и характер его корреляции с функцией NK-клеток, способных осуществлять антивирусный контроль, плохо изучен, особенно для тех клонов, которые обладают явно выраженной цитолитической активностью.
Профили иммуноглобулин-подобных рецепторов клеток-киллеров (KIR), экспрессируемых отдельными цитолитическими NK-клетками на различных стадиях ВИЧ-1-инфекции, определяли на стадии острой инфекции. Для определения цитолитической функции проводили анализ с использованием микролуночных массивов. Отдельные цитотоксические NK-клетки отбирали методом микроманипуляции для последующей количественной оценки репертуара их рецепторов с помощью количественной ОТ-ПЦР. При проведении цитолитического анализа отдельных клеток NK-клетки, меченные CD56-Alexa 647 или цитозольным красителем (CellTracker красным), совместно нагружали не содержащими МНС клетками-мишенями (K562 или 221), меченными кальцеином AM. Эти массивы инкубировали в течение 5-6 часов и периодически проводили визуализацию для оценки лизиса (по потере кальцеина клетками-мишенями). Для гарантии также обеспечивалась активация CD107a на поверхности NK-клеток.
Предварительные результаты анализов такого типа, проводимых с использованием CTL и B-клеточной линии-мишени, представлены на фигуре 5. Альтернативно, в этом анализе в качестве мишеней были использованы ВИЧ-инфицированные CD4+-T-клетки. После определения локализации лунок в массиве, содержащих отдельные литические клетки, эти клетки отбирали автоматизированным методом микроманипуляции (Aviso CellCelector) и клонально размножали в 96-луночных планшетах с использованием рекомбинантного IL-2. После размножения для количественной оценки репертуара рецепторов NK-клеток на каждом клоне с помощью количественной ОТ-ПЦР использовали панель праймеров, специфичных для 12 KIR.
Прямой анализ отдельных клеток без их размножения осуществляли путем помещения этих клеток в маточную смесь для ОТ-ПЦР SuperScript-3 (Invitrogen), содержащую набор олиго-dt-праймеров со встроенными амплифицирующими связывающими последовательностями для гнездовых праймеров, с последующим проведением реакции в термоячейке. Кол.ПЦР осуществляли на кДНК с использованием серии из 12 KIR-праймеров. Разнообразие в репертуарах KIR выделенных NK-клеток может быть определено у 10 здоровых контрольных индивидуумов, у 10 индивидуумов с острой ВИЧ-инфекцией, у 10 индивидуумов со спонтанной длительной непрогрессирующей ВИЧ+-инфекцией (с вирусной нагрузкой ниже 2000 копий/мл) и у 10 индивидуумов с хронической ВИЧ+-инфекцией, не подвергавшихся лечению (с вирусной нагрузкой >10000 копий/мл).
Пример 7. Определение способности NK-клеток к изменению антитело-зависимой клеточной цитотоксичности (ADCC) при прогрессировании инфекции
До настоящего времени было предпринято множество попыток получить вакцины - кандидаты для борьбы с ВИЧ, которые вырабатывали бы широкий спектр нейтрализующих антител против данного вируса (Barouch, D.H. Challenges in the development of an HIV-1 vaccine. Nature 455, 613-619 (2008)). Альтернативной стратегией, применяемой для вырабатывания гуморального ответа в целях опосредования защиты, является ADCC. Исследования, проводимые с забором сыворотки у пациентов с острой инфекцией, позволяют предположить, что может наблюдаться активация NK-клеток, однако в настоящее время не существует каких-либо анализов, позволяющих идентифицировать В-клеточные клоны, которые могли бы продуцировать антитела, эффективно индуцирующие ADCC, опосредуемую NK-клетками. Продуцирование рекомбинантных антител клонами, описанными ниже, облегчает проведение новых исследований по созданию подходящих иммуногенов для вакцинации (Walker, B.D. & Burton, D.R. Toward an AIDS vaccine. Science 320, 760-764 (2008)).
У пациентов с острой инфекцией и у пациентов с длительной непрогрессирующей инфекцией («непрогрессоров») выделяли три популяции клеток - CD56lowCD16+-NK-клетки, CD4+-T-клетки и CD20+-B-клетки. CD4+-T-клетки размножали путем культивирования с фитогемаглютинином (PHA) и IL-2, и экзогенно инфицировали ВИЧ. NK-клетки активировали IL-2, а В-клетки активировали CD40L и анти-BCR антителом. B-клетки (меченные CellTracker красным) совместно нагружали ВИЧ-инфицированными Т-клетками (меченными кальцеином AM) и помещали в микролуночный массив. Этот массив герметично закрывали предметным стеклом и оставляли на один час. В это время в отдельных реакторах В-клетки продуцировали антитела, которые могут связываться с поверхностью инфицированных Т-клеток. Затем массив удаляли с предметного стекла и промывали.
Активированные NK-клетки (меченные Celltracker синим) добавляли в лунки и инкубировали в течение 4-6 часов. Массив визуализировали до и после инкубирования для оценки лунок, содержащих: 1) B-клетки, 2) NK-клетки и 3) лизированные Т-клетки после инкубирования. Клетки выделяли из этих лунок и проводили ОТ-ПЦР с использованием серии вырожденных праймеров для областей VDJ генов, кодирующих антитело. Внутренним контролем на массиве являются лунки, которые не содержат либо В-клеток, либо NK-клеток. Также оценивали массивы только с NK-клетками и только с Т-клетками. Рекомбинантная экспрессия выбранных антител позволяет картировать связанные эпитопы на инфицированных клетках и оценивать клональное разнообразие В-клеток, которое коррелирует с эффективной ADCC.
Альтернативный подход заключается в разделении анализа на две части. Сначала продуцировали обогащенную популяцию В-клеток с применением метода получения микроизображений, а затем эту популяцию использовали для создания микромассивов антител. Эти массивы окрашивали лизатами ВИЧ-инфицированных клеток и анти-IgG3 антителом. B-клетки, которые картировали в би-позитивных лунках, отбирали для генетического анализа. Рекомбинантные антитела, продуцируемые этими клетками, наносили на инфицированные клетки и смешивали с NK-клетками в цитолитическом анализе, подобном анализу, описанному выше.
Описанные здесь способы позволяют охарактеризовывать взаимодействия «хозяин-патоген» непосредственно в клетках, выделенных из клинических человеческих образцов, и облегчить разработку вакцин и проведение иммунотерапии инфекционных заболеваний путем количественной оценки иммунологического профиля обнаружения, анализа и мониторинга инфекций. Этот способ помимо ВИЧ может быть применен и к другим инфекционным заболеваниям, включая патогены, которые являются основными возбудителями инфекций у индивидуумов с ослабленным иммунитетом независимо от того, является ли такое ослабление иммунитета следствием заражения ВИЧ или его искусственного подавления в целях лечения. Такие инфекции вызываются, например, бактериями Cryptococcus neoformans, Clostridium difficile, Streptococcus pneumoniae и Mycobacterium tuberculosis.
Дополнительные варианты осуществления изобретения приводятся в формуле изобретения.
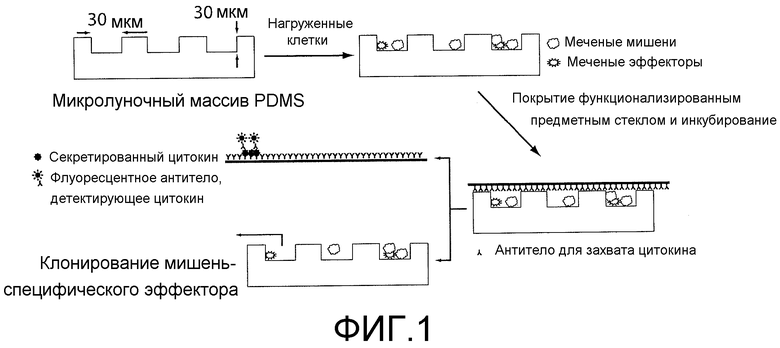
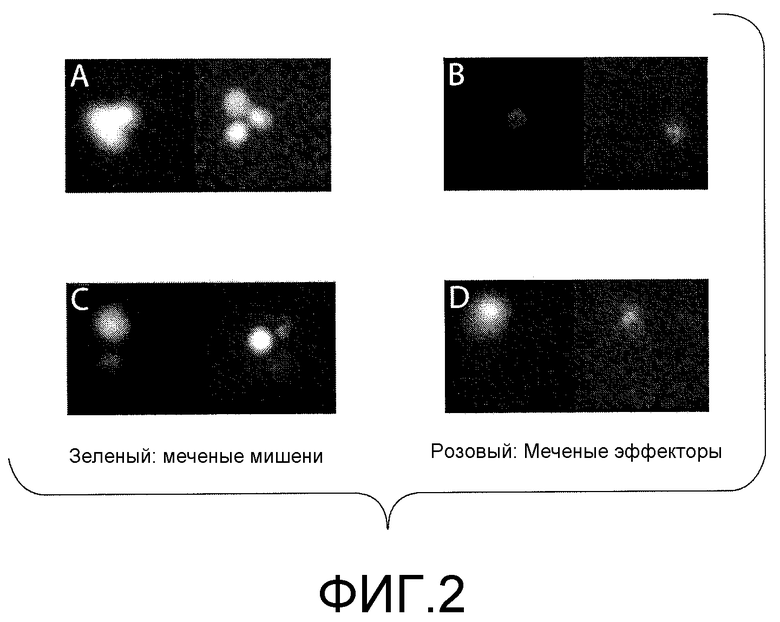

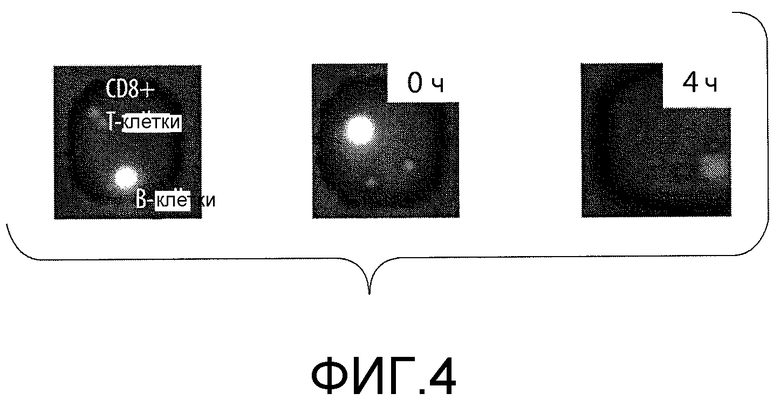

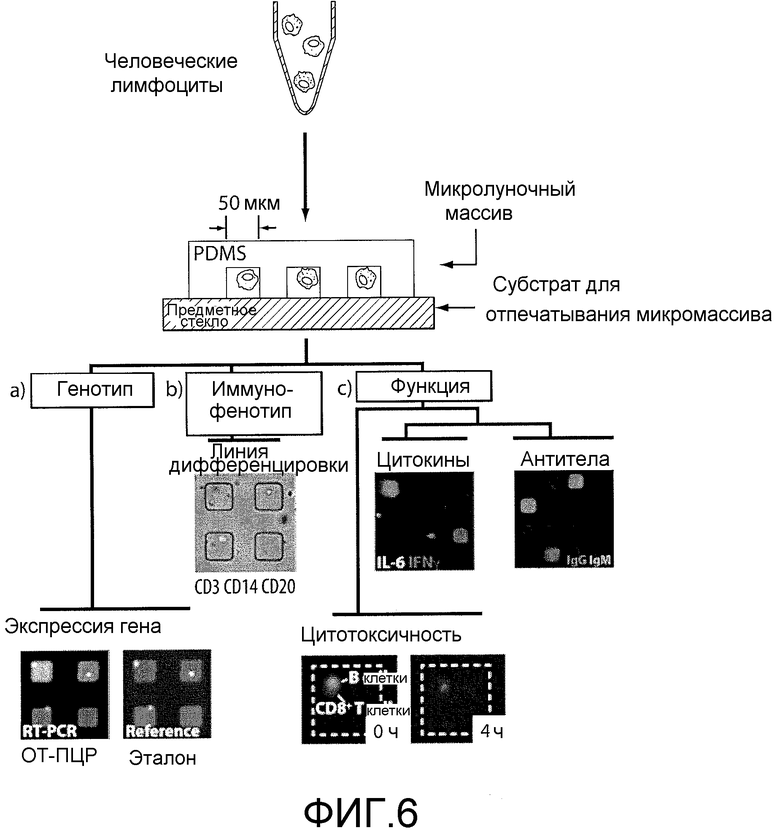

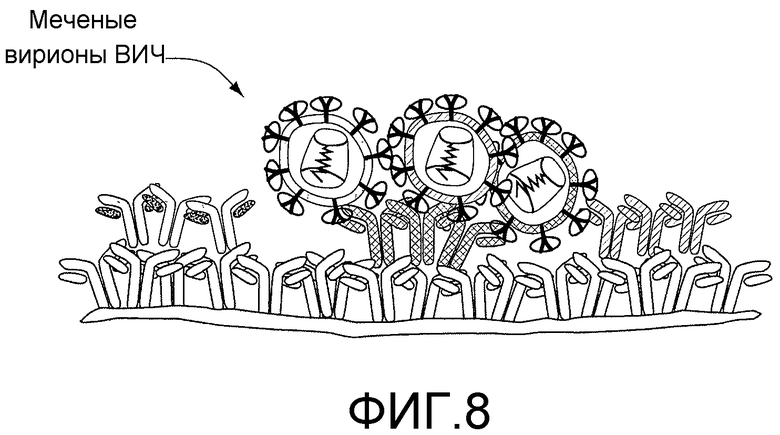
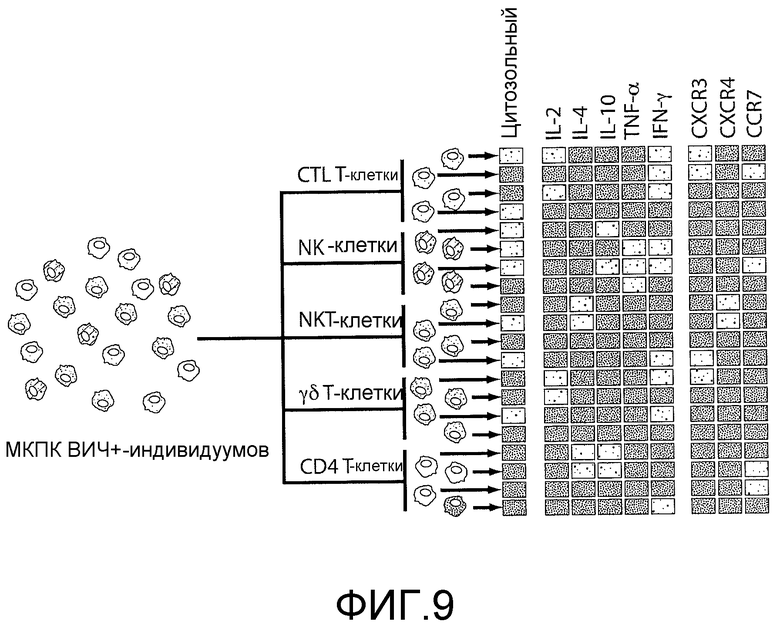
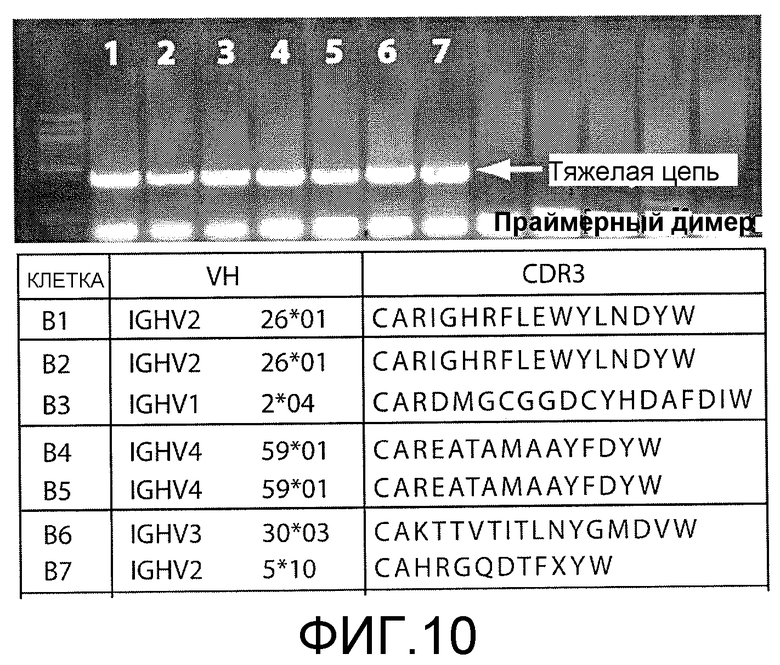
Изобретение относится к области молекулярной биологии, генной инженерии и медицины. Способ оценки цитолитической активности единичных эффекторных клеток, при этом определяя профиль секретированного продукта, используя матрицы микролунок, включает мониторинг лизиса инфицированных клеток-мишеней с помощью эффекторных клеток в микролунках, где микролунки содержат в среднем одну эффекторную клетку и по меньшей мере одну инфицированную клетку-мишень на микролунку; где мониторинг включает стадию детекции лизиса указанных инфицированных клеток-мишеней с помощью эффекторных клеток, используя флуоресцентный индикатор, при этом определяя профиль одного или более секретированных продуктов. Способ может быть использован в медицине для крупномасштабного скрининга для определения профиля большого числа отдельных клеток в микромассивах. 19 з.п. ф-лы, 10 ил.,7 пр.
1. Способ оценки цитолитической активности единичных эффекторных клеток, при этом определяя профиль секретированного продукта, используя матрицы микролунок, включающий:
мониторинг лизиса инфицированных клеток-мишеней с помощью эффекторных клеток в микролунках, где микролунки содержат в среднем одну эффекторную клетку и по меньшей мере одну инфицированную клетку-мишень на микролунку; где мониторинг включает стадию детекции лизиса указанных инфицированных клеток-мишеней с помощью эффекторных клеток, используя флуоресцентный индикатор;
при этом определяя профиль одного или более секретированных продуктов.
2. Способ по п.1, где мониторинг включает стадию культивирования клеток-мишеней и эффекторных клеток в микролунках при условиях, приводящих к лизису клетки-мишени.
3. Способ по п.2, дополнительно включающий выделение эффекторной клетки из одной из микролунок, где стадия культивирования приводит к лизису клетки-мишени.
4. Способ по п.1, дополнительно включающий, перед указанной стадией мониторинга, стадию помещения суспензии эффекторных клеток в микролунки.
5. Способ по п.4, где суспензия эффекторных клеток и клеток-мишеней объединены друг с другом перед стадией помещения.
6. Способ по п.2, где клетки-мишени мечены флуоресцентным индикатором, а стадия детекции лизиса с использованием флуоресцентного индикатора включает детекцию ослабевания флуоресценции клеток-мишеней в течение времени.
7. Способ по п.2, где стадия детекции лизиса с использованием флуоресцентного индикатора, включает детекцию изменений проницаемости ядра клеток-мишеней с помощью детектируемой флуоресценции красителя Sytox.
8. Способ по п.1, где один или более секретируемых продуктов содержат гранзим В (GzB) или перфорин.
9. Способ по п.3, дополнительно включающий культивирование выделенной эффекторной клетки с получением клональной амплификации выделенной эффекторной клетки.
10. Способ по п.3, дополнительно включающий характеристику последовательности или экспрессии одного или более генов в выделенной эффекторной клетке.
11. Способ по п.1, где эффекторные клетки и клетки-мишени являются клетками человека.
12. Способ по п.1, где указанное определение профиля предусматривает стадии:
приведение микролунок в контакт с субстратом, где на поверхности субстрата содержится один или несколько агентов, которые соответствующим образом связываются с указанным одним или несколькими секретированными продуктами; и
определение на поверхности субстрата расположения агента, связывающегося с секретированным продуктом.
13. Способ по п.1, где эффекторные клетки представляют собой цитотоксические Т-лимфоциты (CTL).
14. Способ по п.1, где эффекторные клетки представляют собой природные киллеры (NK).
15. Способ по п.1, где один или несколько секретированных продуктов содержат один или несколько цитокинов.
16. Способ по п.15, где один или несколько секретированных продуктов содержат одно или несколько следующих веществ: IL-2, IL-4, IL-10, TNF-α и IFN-γ.
17. Способ по п.16, где один или несколько секретированных продуктов содержат IFN-γ.
18. Способ по п.12, где один или несколько агентов содержат антитело.
19. Способ по любому из пп.1, 2, 3 и 12, где инфицированные клетки являются клетками, инфицированными ВИЧ.
20. Способ по п.1, где
эффекторными клетками являются CTL;
один или несколько секретированных продуктов содержат IFN-γ; и
эффекторные клетки и мишеневые клетки являются клетками человека.
| Сальник для электродов электропечей | 1937 |
|
SU61629A1 |
| Термос-холодильник | 1948 |
|
SU77026A1 |
| Термос-холодильник | 1948 |
|
SU77026A1 |
| Способ диагностики протяженности активного воспаления в толстой кишке при неспецифическом язвенном колите | 1987 |
|
SU1650094A1 |
| RENAT SHAYKHIEV and ROBERT BALS | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Journal of Leukocyte Biology | |||
| vol | |||
| Машина для разделения сыпучих материалов и размещения их в приемники | 0 |
|
SU82A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2014-10-27—Публикация
2009-07-13—Подача