Техническое обоснование
Настоящее изобретение касается соединения имидазопиридина, полезного в качестве ингибитора секреции кислоты желудочного сока, либо соли или гидрата указанного соединения.
Настоящее изобретение также касается соединения имидазопиридина, полезного в качестве терапевтического или профилактического средства в отношении вызываемых кислотой заболеваний (в особенности таких, как гастроэзофагеальный рефлюкс, симптоматический гастроэзофагеальный рефлюкс, язва желудка или язва двенадцатиперстной кишки), либо соли или гидрата указанного соединения.
Известный уровень техники
Считается, что пептическая язва, такая как язва желудка и язва двенадцатиперстной кишки, развивается в результате аутолиза, вызываемого дисбалансом между агрессивными факторами, такими как кислота и пепсин, и защитными факторами, такими как слизь и кровь.
В принципе, лечение пептической язвы относится к области медицины внутренних болезней, с этой целью были предприняты попытки использования разнообразных медикаментозных лечений. В частности, за последнее время были разработаны и использованы клинически лекарственные средства, специфически ингибирующие H+-, K+-АТФазу, фермент, присутствующий в париетальных клетках желудка и отвечающий за конечную стадию секреции кислоты желудочного сока, подавляющие секрецию кислоты и тем самым препятствующие аутолизу, например омепразол, эзомепразол, пантопразол, ланзопразол, рабепразол и пр.
Хотя эти лекарственные средства обладают превосходным терапевтическим действием, все же требуются лекарственные средства с более продолжительным ингибирующим действием на секрецию кислоты желудочного сока, более безопасные и с большей физико-химической устойчивостью.
Соединения, в особенности близкие к предмету настоящего изобретения, описаны в патентных документах 1-3, но конкретные соединения, описанные в этих патентных документах, и специфические соединения по настоящему изобретению различны по химической структуре.
Патентный документ 1 JP-A-62-207271
Патентный документ 2 EP-A-0254588
Патентный документ 3 EP-A-0187977
Описание изобретения
Задачи, решаемые изобретением
Задача, на решение которой направлено настоящее изобретение, состоит в получении нового соединения, обладающего улучшенным ингибирующим действием на секрецию кислоты желудочного сока, полезного в качестве терапевтического или профилактического средства для лечения вызываемых кислотой заболеваний.
Степень разрешения проблем
Настоящими заявителями проведены интенсивные исследования в целях разрешения вышеуказанных проблем, и в результате обнаружено, что соединение имидазопиридина с новой химической структурой оказывает улучшенное ингибирующее действие на секрецию кислоты желудочного сока и полезно в качестве терапевтического или профилактического средства, в особенности от таких заболеваний, как гастроэзофагеальный рефлюкс, симптоматический гастроэзофагеальный рефлюкс, язва желудка или язва двенадцатиперстной кишки, что, таким образом, позволило завершить настоящее изобретение.
Таким образом, настоящее изобретение охватывает соединения, имеющие следующую общую формулу (1), либо соли или гидраты указанного соединения.
[Формула 1]
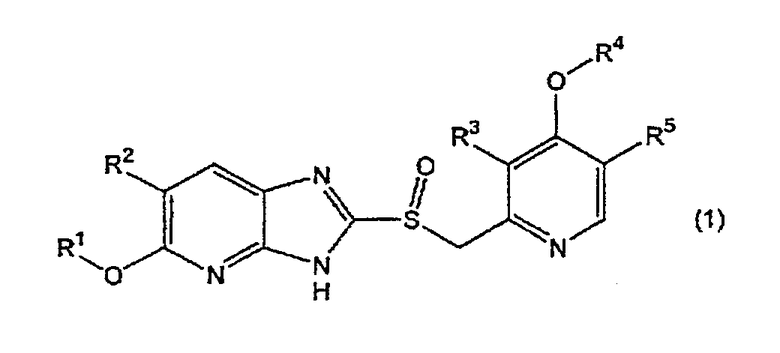
Настоящее изобретение также касается лекарственного средства, включающего соединение вышеуказанной общей формулы (1), либо соль или гидрат указанного соединения, и фармацевтически приемлемый носитель.
Далее настоящее изобретение касается ингибитора секреции кислоты желудочного сока, включающего соединение вышеуказанной общей формулы (1), либо соль или гидрат указанного соединения.
Кроме того, настоящее изобретение касается применения соединения формулы (1) в качестве терапевтического или профилактического средства, включающего соединение вышеуказанной общей формулы (1), либо соль или гидрат указанного соединения, от заболеваний, вызванных кислотой желудочного сока, в особенности таких, как язва желудка, язва двенадцатиперстной кишки, пептическая язва анастомоза, гастроэзофагеальный рефлюкс, синдром Золлингера-Эллисона, симптоматический гастроэзофагеальный рефлюкс, эндоскопически-негативный гастроэзофагеальный рефлюкс, гастроэзофагеальная регургитация, глоточно-гортанная парестезия, пищевод Барретта, язва, вызванная приемом нестероидного противовоспалительного лекарственного средства (NSAID), гастрит, желудочное кровотечение, желудочно-кишечное кровотечение, пептическая язва, кровоточащая язва, стрессовая язва, желудочная гиперхлоргидрия, диспепсия, гастрапарез, сенильная язва, неустранимая язва, изжога, бруксизм, боль в желудке, тяжесть в желудке, артроз височно-нижнечелюстного сустава или эрозивный гастрит. Способ включает введение эффективного количества соединения или композиции нуждающемуся в этом пациенту.
Подходящие примеры "вызываемых кислотой заболеваний" включают, например, такие заболевания, как язва желудка, язва двенадцатиперстной кишки, пептическая язва анастомоза, гастроэзофагеальный рефлюкс, синдром Золлингера-Эллисона или симптоматический гастроэзофагеальный рефлюкс, и более уместные примеры включают такие заболевания, как гастроэзофагеальный рефлюкс, симптоматический гастроэзофагеальный рефлюкс, язва желудка или язва двенадцатиперстной кишки, еще более подходящие примеры включают такие заболевания, как (1) гастроэзофагеальный рефлюкс или симптоматический гастроэзофагеальный рефлюкс, или (2) язва желудка, или язва двенадцатиперстной кишки.
В то же время настоящее изобретение касается монотерапевтического или комбинированного терапевтического средства для уничтожения Helicobacter Pylori, включающего соединение вышеуказанной общей формулы (1), либо соль или гидрат указанного соединения.
Здесь вышеупомянутое "профилактическое средство" включает средство, вводимое до начала заболевания, а также поддерживающее терапевтическое средство или предупреждающее рецидив средство после излечивания заболевания.
Далее вышеупомянутое "комбинированное терапевтическое средство для уничтожения Helicobacter Pylori" означает лекарственное средство с соответствующим регулированием окружающей среды, так что средство для уничтожения, эффективность которого трудно обеспечить в кислотных условиях, способно проявлять свою активность.
В вышеуказанной формуле (1)
R1 означает C1-C6-алкильную группу, которая может иметь, по меньшей мере, один заместитель, выбираемый из приведенной ниже α группы, C2-C6-алкенильную группу, C2-C6-алкинильную группу, C3-C6-циклоалкильную группу или фенильную группу, которая может иметь заместитель, выбираемый из приведенной ниже β группы;
R2 означает атом водорода или C1-C3-алкильную группу;
R3 означает метильную или этильную группу;
R4 означает C1-C6-алкильную группу;
R5 означает атом водорода;
α группа означает группу, включающую атом галогена, C3-C6-циклоалкильную группу, фенильную группу, которая может иметь, по меньшей мере, один заместитель, выбираемый из приведенной ниже β группы, и фенилоксигруппу, которая может иметь заместитель, выбираемый из приведенной ниже β группы;
β группа означает группу, включающую атом галогена и C1-C6-алкоксигруппу;
при условии, что соединение, где R1 означает C1-C6-алкильную группу, незамещенную или замещенную атомом галогена, и R2 означает атом водорода, либо соль или гидрат указанного соединения, исключены из рамок объема настоящего изобретения.
"C1-C6-алкильная группа", как использовано, для удобства, в данном описании, означает линейную или разветвленную алкильную группу с 1-6 атомами углерода, такую как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, 2-метилбутил, неопентил, 1-этилпропил, гексил, изогексил, 4-метилпентил, 3-метилпентил, 2-метилпентил, 1-метилпентил, 3,3-диметилбутил, 2,2-диметилбутил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 1-этилбутил или 2-этилбутил.
"C1-C3-алкильная группа", как использовано, для удобства, в данном описании, означает линейную или разветвленную алкильную группу с 1-3 атомами углерода, такую как метил, этил, н-пропил или изопропил.
"C2-C6-алкенильная группа", как использовано, для удобства, в данном описании, означает такую группу, как винильная группа, аллильная группа, 1-пропенильная группа, изопропенильная группа, 1-бутенильная группа, 2-бутенильная группа, 3-бутенильная группа, 1,3-пентадиенильная группа или 1,4-гексадиенильная группа.
"C2-C6-алкинильная группа", как использовано, для удобства, в данном описании, означает алкинильную группу с 2-6 атомами углерода и 1-2 тройными связями, такую как этинильная группа, 1-пропинильная группа, 2-пропинильная группа, 2-бутинильная группа, 3-бутинильная группа, 1,3-пентадиинильная группа, 1,4-гексадиинильная группа, пентинильная группа или гексинильная группа.
"C3-С6-циклоалкильная группа, как использовано, для удобства, в данном описании, означает такую группу, как циклопропильная группа, циклобутильная группа, циклопентильная группа или циклогексильная группа.
"Атом галогена" как использовано, для удобства, в данном описании, означает атом фтора, атом хлора, атом брома или атом иода.
"C1-C6-алкоксигруппа" как использовано, для удобства, в данном описании, означает линейную или разветвленную алкоксигруппу с 1-6 атомами углерода, такую как метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентокси, изопентокси, 2-метилбутокси, неопентокси, гексилокси, 4-метилпентокси, 3-метилпентокси, 2-метилпентокси, 3,3-диметилбутокси, 2,2-диметилбутокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси или 2,3-диметилбутокси.
Выражения "которая может быть замещена" или "которая может иметь, по меньшей мере, один заместитель", как использовано, для удобства, в данном описании, означает "которая может иметь один-три заместителя по пригодной для замещения позиции (позициям), в любой комбинации", если число заместителей не указано конкретно.
Выражение "которая замещена (которые замещены)", как использовано, для удобства, в данном описании, означает "которая имеет (которые имеют)" один-три заместителя по пригодной для замещения позиции (позициям), в любой комбинации", если число заместителей не указано конкретно.
Предпочтительно, вышеупомянутый R1 означает такую группу, как незамещенная C1-C6-алкильная группа, C2-C6-алкинильная группа или C1-C6-алкильная группа, которая может быть замещена галогеном, или фенильная группа, которая может иметь заместитель, выбираемый из вышеуказанной β группы, и, более предпочтительно, означает такую группу, как метильная группа, 2,2,2-трифторэтильная группа, 2,2-дифторэтильная группа, 2-(фенил)пропильная группа, 2-(фенилокси)этильная группа, 2-бутинильная группа, 3-фторфенильная группа, 4-фторфенильная группа или 4-метоксифенильная группа, и, более предпочтительно, метильная группа, 2,2,2-трифторэтильная группа или 2,2-дифторэтильная группа, и, наиболее предпочтительно, метильная группа.
Предпочтительно, вышеупомянутый R2 означает атом водорода, метильную группу, этильную группу или пропильную группу, и, более предпочтительно, атом водорода или метильную группу.
Вышеупомянутый R3 предпочтительно означает метильную группу.
Вышеупомянутый R4 предпочтительно означает метильную группу.
Хотя структурная формула соединения, для удобства, в данном описании может представлять конкретный изомер, настоящее изобретение охватывает все изомеры, включая геометрические изомеры, оптические изомеры, стереоизомеры и таутомер, и смеси изомеров, отвечающих структуре соединения, и соединение не ограничивается конкретной формулой, приведенной для удобства, и может представлять собой либо один из изомеров, либо смеси изомеров. Кроме того, соединение по настоящему изобретению, которое может быть в виде оптически активного соединения или рацемата, не ограничивается одной конкретной формой, а может включать как ту, так и другую.
Аналогичным образом, возможный кристаллический полиморфизм не имеет ограничений, и кристаллическое вещество может включать отдельную кристаллическую форму или может являться смесью, и соединение по настоящему изобретению может включать как ангидрид (негидратированную форму), так и гидрат. Кроме того, так называемый метаболит, который образуется при разложении соединения (1) по настоящему изобретению в живом организме, также входит в рамки объема настоящего изобретения. Далее, соединение (так называемое, пролекарство), которое приводит к соединению (1) по настоящему изобретению в ходе химического обмена веществ, такого как окисление, восстановление, гидролиз и сочетание в живом организме, также входит в рамки объема настоящего изобретения.
Соединение по настоящему изобретению образует соль, согласно вышеуказанной формуле (1), по NH группе в 1- или 3-положении в структуре имидазопиридина.
"Соль" не имеет особых ограничений, если не оговаривается обработка, является фармакологически приемлемой, и включает, например, соль с неорганическим основанием или соль с органическим основанием.
Предпочтительные примеры соли с неорганическим основанием включают соли щелочного металла, такие как натриевая соль и калиевая соль, соли щелочноземельных металлов, такие как соль кальция или соль магния, соль алюминия или соль аммония, и предпочтительные примеры соли с органическим основанием включают соль диэтиламина, соль диэтаноламина, соль меглумина или соль N,N'-дибензилэтилендиамина, и т.д.
Предпочтительные соединения общей формулы (1) по настоящему изобретению включают:
(2) соединения, в которых R1 означает незамещенную C1-C6-алкильную группу, либо соответствующие соль или гидрат,
(3) соединения, в которых R1 означает C2-C6-алкинильную группу, либо соответствующие соль или гидрат,
(4) соединения, в которых R1 означает C1-C6-алкильную группу, которая может быть замещена галогеном, либо соответствующие соль или гидрат,
(5) соединения, в которых R1 означает фенильную группу, которая может иметь заместитель, выбираемый из вышеуказанной β группы, либо соответствующие соль или гидрат,
(6) соединения, в которых R1 означает такую группу, как метильная группа, 2,2,2-трифторэтильная группа, 2,2-дифторэтильная группа, 2-(фенил)пропильная группа, 2-(фенилокси)этильная группа, 2-бутинильная группа, 3-фторфенильная группа, 4-фторфенильная группа или 4-метоксифенильная группа, либо соответствующие соль или гидрат,
(7) соединения, в которых R1 означает такую группу, как метильная группа, 2,2,2-трифторэтильная группа или 2,2-дифторэтильная группа, либо соответствующие соль или гидрат,
(8) соединения, в которых R2 означает атом водорода, метильную группу, этильную группу или пропильную группу, либо соответствующие соль или гидрат,
(9) соединения, в которых R2 означает метильную группу, либо соответствующие соль или гидрат,
(10) соединения, в которых R2 означает атом водорода, либо соответствующие соль или гидрат,
(11) соединения, в которых R3 означает метильную группу, либо соответствующие соль или гидрат, или
(12) соединения, в которых R4 означает метильную группу, либо соответствующие соль или гидрат.
Кроме того, также предпочтительны соединения, полученные при выборе: R1 из вышеуказанных пп.(2), (3), (4), (5), (6) или (7), R2 из вышеуказанных пп.(8), (9) или (10), R3 из вышеуказанного п.(11) или R4 из вышеуказанного п.(12), в любой комбинации, либо соответствующие соль или гидрат.
Предпочтительными соединениями, из числа конкретных соединений по настоящему изобретению, либо соответствующих солей или гидратов, являются 5-метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридин, 2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил]-6-метил-5-(2,2,2-трифторэтокси)-3H-имидазо[4,5-b]пиридин или 5-(2,2-дифторэтокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридин.
Эффект изобретения
Поскольку соединение по настоящему изобретению обладает превосходной, ингибирующей секрецию кислоты желудочного сока активностью, более продолжительной ингибирующей секрецию кислоты желудочного сока активностью, большей безопасностью (например, вызывая меньшую индукцию цитохрома P450) и более подходящей физико-химической устойчивостью, указанное соединение полезно в качестве фармацевтического средства, в особенности терапевтического или профилактического средства от вызываемых кислотой заболеваний, и монотерапевтического или комбинированного терапевтического средства для уничтожения Helicobacter Pylori.
Наилучший способ осуществления изобретения
Соединение по настоящему изобретению может быть получено указанным ниже способом. Однако способ получения соединения по настоящему изобретению не ограничивается приведенным способом.
Соединение (1) по настоящему изобретению может быть получено следующим способом A.
[Формула 2]
Способ A
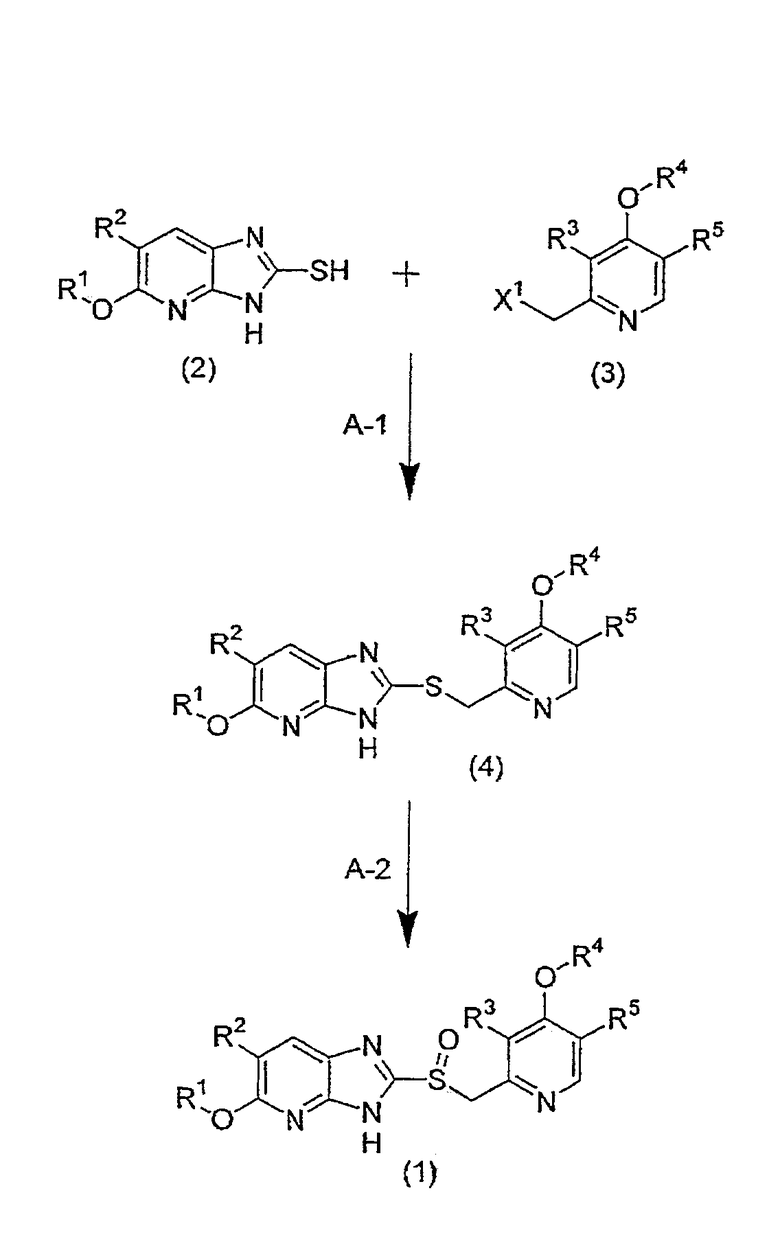
На приведенной выше схеме R1, R2, R3, R4 и R5 имеют вышеуказанные значения, X1 означает уходящую группу и, предпочтительно, представляет собой алкилсульфонилоксигруппу, которая может быть замещенной, или бензолсульфонилоксигруппу, которая может быть замещенной (например, такую группу, как метансульфонилокси, этансульфонилокси, бензолсульфонилокси, п-толуолсульфонилокси и т.д.), или атом хлора, атом брома или атом иода, и, более предпочтительно, атом хлора и метансульфонилоксигруппу.
Далее поясняется каждая стадия способа A.
(Стадия A-1) Тиоэтерификация
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие соединения (2) и соединения (3), либо соли соединения (3) (в особенности хлористоводородной соли), в присутствии или в отсутствие основания, в отсутствие растворителя или в инертном растворителе, получая соединение (4).
В качестве соединения (4a) может быть использовано промышленно выпускаемое соединение или соединение, синтезированное на основании известного из публикации способа.
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; N,N-диметилформамид; диметилсульфоксид; воду или смеси этих растворителей, и, преимущественно, представляет собой спирты, наиболее предпочтительно, метанол.
Приемлемое для использования основание включает, например, неорганические основания, такие как гидрид натрия, гидрид калия, карбонат лития, карбонат натрия, карбонат калия, гидроксид лития, гидроксид натрия, гидроксид калия; и органические основания, такие как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нона-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO), 1,8-диазабицикло[5.4.0]ундека-7-ен (DBU), и, предпочтительно, представляет собой неорганические основания, такие как гидрид натрия, гидрид калия, гидроксид лития, гидроксид натрия, гидроксид калия, и, наиболее предпочтительно, гидроксид натрия.
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя и основного катализатора, как правило, температура составляет от 0 до 100°C и, предпочтительно, от 10 до 40°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, основного катализатора и реакционной температуры, как правило, указанное время составляет от 30 минут до 20 часов и, предпочтительно, от 1 до 8 часов.
(Стадия A-2) Реакция окисления.
Данная стадия представляет собой стадию, на которой окисляющий реагент подвергают взаимодействию с соединением (4) в отсутствие растворителя или в инертном растворителе, получая соединение (1) по настоящему изобретению.
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; ароматические углеводороды, такие как бензол, толуол; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, гексаметилфосфорный триамид, и, преимущественно, представляет собой ароматический углеводород, спирт или смеси указанных растворителей, наиболее предпочтительно, смесь толуола и метанола или дихлорметан.
Приемлемый для использования окисляющий реагент включает, например, такой реагент, как водный раствор пероксида водорода, третбутилгидропероксид, периодат натрия, перуксусная кислота, пербензойная кислота, метахлорпербензойная кислота, аддукт мочевина-пероксид водорода ((NH2)2CO·H2O2) и т.д., и, предпочтительно, представляет собой метахлорпербензойную кислоту. При осуществлении асимметрического окисления может быть использован обычно применяемый асимметрический окисляющий агент.
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя и окисляющих реагентов, как правило, температура составляет от -100 до 100°C и, предпочтительно, от -70 до 70°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, окисляющего реагента и реакционной температуры, как правило, указанное время составляет от 30 минут до 24 часов и, предпочтительно, от 1 до 5 часов.
Соединение, полученное, как указано выше, может быть превращено в соль общепринятым способом. Например, основание подвергают взаимодействию с соединением (1) в отсутствие растворителя или в инертном растворителе. В качестве растворителя используют спирт, такой как метанол или этанол, воду или смесь указанных растворителей, предпочтительно, смесь этанола и воды, и гидроксид щелочного металла, такой как гидроксид натрия и гидроксид калия, гидроксид щелочноземельных металлов, такой как гидроксид магния, алкоксид, такой как метилат натрия, трет-бутилат натрия и метилат магния, предпочтительно, гидроксид натрия, используют в качестве основания в водном растворе.
Температура реакции, в основном, составляет от -50 до 50°C и, предпочтительно, от 10 до 40°C. Время взаимодействия, в основном, составляет от 5 минут до 2 часов и, предпочтительно, от 10 до 30 минут.
Соединение (2) и соединение (3), являющиеся промежуточными соединениями в вышеуказанном способе A, могут представлять собой промышленные продукты либо могут быть легко получены из промышленных продуктов способом, обычно применяемым специалистами в данной области, а также могут быть получены способами B, C, D или E, описанными ниже.
Соединение (2) может быть получено следующим способом B.
[Формула 3]
Способ B
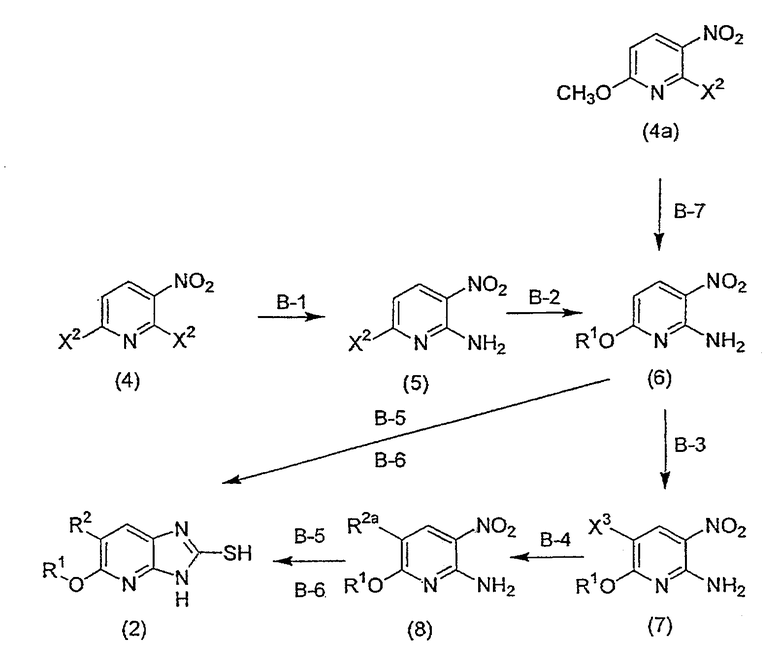
На приведенной выше схеме R1 и R2 имеют вышеуказанные значения, R2a означает метильную группу, винильную группу или аллильную группу и X2 означает уходящую группу, предпочтительно, атом хлора, атом брома или атом иода, и, более предпочтительно, атом хлора. X3 означает уходящую группу, предпочтительно, атом хлора, атом брома или атом иода, и, более предпочтительно, атом иода.
Далее поясняется каждая стадия способа B.
(Стадия B-1) Реакция аминирования
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие аммиака с соединением (4) в присутствии или в отсутствие карбоната щелочного металла, в отсутствие растворителя или в инертном растворителе, приводящее к получению соединения (5).
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, алифатические углеводороды, такие как гексан, гептан, лигроин, петролейный эфир; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан, четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, гексаметилфосфорный триамид; трет-бутиловый спирт, воду и т.д., и, преимущественно, представляет собой смесь трет-бутилового спирта и воды или смесь N,N-диметилформамида и воды.
Приемлемый для использования карбонат щелочного металла включает, например, карбонат натрия, карбонат калия, бикарбонат натрия, бикарбонат калия и т.д., и, преимущественно, представляет собой карбонат калия.
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя и карбоната щелочного металла, как правило, температура составляет от 0 до 100°C и, предпочтительно, от 40 до 80°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, карбоната щелочного металла и реакционной температуры, как правило, указанное время составляет от 6 до 36 часов и, предпочтительно, от 12 до 36 часов.
В качестве соединения (4) может быть использовано промышленно выпускаемое соединение или соединение, синтезированное известным из публикации способом.
(Стадия B-2) Реакция введения R1-O группы
Реакционные условия могут изменяться в зависимости от типа R1-OH.
a) В случае, когда R1-OH означает спирт
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие соединения (5) и спирта R1-OH (где R1 имеет вышеуказанные значения) в присутствии основания, в отсутствие растворителя или в инертном растворителе, приводящее к получению соединения (6).
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, спирты, дающие требуемый R1-O-, такие как метанол и этанол; алифатические углеводороды, такие как гексан, гептан, лигроин, петролейный эфир; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан, четыреххлористый углерод; ароматические углеводороды, такие как бензол, толуол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, гексаметилфосфорный триамид, N-метилпирролидон; диметилсульфоксид, воду или смесь указанных растворителей, и, преимущественно, представляет собой диметилсульфоксид, простой эфир или амид, наиболее предпочтительно, тетрагидрофуран, когда R1-OH означает первичный спирт, и диметилсульфоксид или N-метилпирролидон в случае вторичного спирта.
Приемлемое для использования основание включает, например, карбонаты щелочного металла, такие как карбонат лития, карбонат натрия, карбонат калия; гидроксиды щелочного металла, такие как гидроксид лития, гидроксид натрия, гидроксид калия; алкоксиды металлов, такие как метилат лития, метилат натрия, этилат натрия, третбутилат калия; гидриды щелочного металла, такие как гидрид натрия, гидрид калия; алкоксиды щелочных металлов, полученные из щелочных металлов; н-бутиллитий, литийдиизопропиламид и т.д., и, преимущественно, представляет собой гидрид щелочного металла и, наиболее предпочтительно, гидрид натрия.
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя и оснований, как правило, температура составляет от 0 до 100°C и, когда R1-OH означает первичный спирт, предпочтительно, от 10 до 40°C, а в случае вторичного спирта от 50 до 100°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, основания и реакционной температуры, как правило, указанное время составляет от 6 до 48 часов и, предпочтительно, от 12 до 24 часов.
b) В случае, когда R1-OH означает фенол
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие соединения (5) и фенола R1-OH (где R1 имеет вышеуказанные значения) в присутствии палладиевого катализатора, лиганда и фосфата щелочного металла, в отсутствие растворителя или в инертном растворителе, приводящее к получению соединения (6).
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; алифатические углеводороды, такие как гексан, гептан, лигроин, петролейный эфир; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; ароматические углеводороды, такие как бензол, толуол; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, гексаметилфосфорный триамид; органические кислоты, такие как уксусная кислота и т.д., и, преимущественно, представляет собой ароматический углеводород и, наиболее предпочтительно, толуол.
Приемлемый для использования палладиевый катализатор включает, например, такой палладиевый катализатор, как тетракис(трифенилфосфин)палладий(0), трис(дибензилиденацетон)дипалладий(0), бис(дибензилиденацетон)палладий(0), бис(три-трет-бутилфосфин)палладий(0), палладиевая чернь; предшественник палладиевого катализатора (генерирующий палладиевый катализатор внутри системы), такой как дихлорбис(трифенилфосфин)палладий(II), палладий(II)ацетат, 1,1'-бис(дифенилфосфино)ферроцендихлорпалладий(II), дихлорбис(три-o-толилфосфин)палладий(II), дихлорбис(трициклогексилфосфин)палладий(II) и пр., и, преимущественно, представляет собой палладий(II)ацетат.
Приемлемый для использования лиганд включает, например, трифенилфосфин, тритретбутилфосфин, три(4-метилфенил)фосфин, 2-(дитрет-бутилфосфино)бифенил, 2-(дициклогексилфосфино)бифенил, трициклогексилфосфин, 1,1'-бис(дифенилфосфино)ферроцен, ди-трет-бутилфосфонийтетрафторборат и т.д., и, преимущественно, представляет собой 2-(ди-трет-бутилфосфино)бифенил.
Приемлемый для использования фосфат щелочного металла включает, например, фосфат натрия, фосфат калия и пр., и, преимущественно, представляет собой фосфат калия.
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя, палладиевого катализатора и пр., как правило, температура составляет от 50 до 200°C и, предпочтительно, от 120 до 180°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, палладиевого катализатора, реакционной температуры и пр., как правило, указанное время составляет от 6 до 48 часов и, предпочтительно, от 12 до 24 часов.
(Стадия B-3) Реакция галогенирования (представленная реакцией бромирования и иодирования)
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие бромирующего агента или иодирующего агента с соединением (6) в отсутствие растворителя или в инертном растворителе, приводящее к получению соединения (7).
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол, метилцеллозольв; алифатические углеводороды, такие как гексан, гептан, лигроин, петролейный эфир; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; нитрил, такой как ацетонитрил; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и гексаметилфосфорный триамид; органические кислоты, такие как уксусная кислота и т.д., и, преимущественно, представляет собой ацетонитрил, спирт (в особенности, метанол) или органическую кислоту и, наиболее предпочтительно, уксусную кислоту или ацетонитрил.
Приемлемый для использования бромирующий или иодирующий агент включает, например, бром (Br2), иод (I2), N-бромсукцинимид, N-иодсукцинимид и т.д., и, преимущественно, представляет собой N-иодсукцинимид или N-бромсукцинимид.
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя, бромирующего или иодирующего агента, как правило, температура составляет от 0 до 60°C и, предпочтительно, от 10 до 40°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, бромирующего агента или иодирующего агента, реакционной температуры и пр., как правило, указанное время составляет от 2 до 24 часов и, предпочтительно, от 5 до 24 часов.
(Стадия B-4) Реакция алкилирования или алкенилирования
(1) В случае, когда R2a означает метильную группу
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие соединения (7) и заданного триалкилбороксина в присутствии палладиевого катализатора и основания, в отсутствие растворителя или в инертном растворителе, приводящее к получению соединения (8).
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, ароматические углеводороды, такие как бензол, толуол, ксилол; простые эфиры, такие как диоксан, диметоксиэтан, тетрагидрофуран; амиды, такие как N,N-диметилформамид, и, преимущественно, представляет собой тетрагидрофуран или N,N-диметилформамид.
Приемлемый для использования палладиевый катализатор включает, например, такой палладиевый катализатор, как
дихлорбис(трифенилфосфин)палладий(II),
тетракис(трифенилфосфин)палладий(0),
трис(дибензилиденацетон)дипалладий(0),
бис(дибензилиденацетон)палладий(0),
бис(три-трет-бутилфосфин)палладий(0),
палладиевая чернь и пр., и, преимущественно, представляет собой дихлорбис(трифенилфосфин)палладий(II) или тетракис(трифенилфосфин)палладий(0).
Приемлемое для использования основание включает, например, такие основания, как третбутилат калия, третбутилат натрия, карбонат цезия и, предпочтительно, карбонат цезия.
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя, палладиевых катализаторов и пр., как правило, температура составляет от 50 до 200°C и, предпочтительно, от 70 до 150°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, палладиевого катализатора, реакционной температуры и пр., как правило, указанное время составляет от 30 минут до 48 часов и, предпочтительно, от 5 до 12 часов.
(2) В случае, когда R2a означает винильную или аллильную группу
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие соединения (7) и трибутил(винил)олова или аллилтрибутилолова в присутствии палладиевого катализатора, в отсутствие растворителя или в инертном растворителе, приводящее к получению соединения (8).
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, ароматические углеводороды, такие как бензол, толуол, ксилол; простые эфиры, такие как диоксан, диметоксиэтан, тетрагидрофуран; амиды, такие как N,N-диметилформамид, и, преимущественно, представляет собой тетрагидрофуран или N,N-диметилформамид.
Приемлемый для использования палладиевый катализатор включает, например, такой палладиевый катализатор, как
дихлорбис(трифенилфосфин)палладий(II),
тетракис(трифенилфосфин)палладий(0),
трис(дибензилиденацетон)дипалладий(0),
бис(дибензилиденацетон)палладий(0),
бис(три-трет-бутилфосфин)палладий(0),
палладиевая чернь и пр., и, преимущественно, представляет собой дихлорбис(трифенилфосфин)палладий(II) или тетракис(трифенилфосфин)палладий(0).
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя, палладиевых катализаторов и пр., как правило, температура составляет от 50 до 200°C и, предпочтительно, от 70 до 150°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, палладиевого катализатора, реакционной температуры и пр., как правило, указанное время составляет от 30 минут до 48 часов и, предпочтительно, от 5 до 12 часов.
(Стадия B-5) Реакция восстановления
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие водорода с соединением (8) в отсутствие растворителя или в инертном растворителе, в присутствии катализатора восстановления, либо подвергают взаимодействию восстанавливающий агент с соединением (8) в отсутствие растворителя или в инертном растворителе, и нитрогруппу и алкенильную группу превращают в аминогруппу и алкильную группу.
Также в данную стадию включена стадия, где, когда R1 означает C2-C6-алкинильную группу, восстанавливается только нитрогруппа, без восстановления тройной связи.
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол, метилцеллозольв; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; алифатические углеводороды, такие как гексан, гептан, лигроин, петролейный эфир; эфиры органических кислот, такие как этилацетат, и, преимущественно, представляет собой простые эфиры, алифатические углеводороды, спирты, эфиры органических кислот или смеси указанных соединений и, наиболее предпочтительно, метанол или тетрагидрофуран.
Приемлемый для использования катализатор включает, например, палладий-уголь, Никель Ренея, никель(II)хлорид, оксид платины, платиновую чернь, оксид родия-алюминия, хлорид трифенилфосфинродия, сульфат палладия-бария и пр., и, преимущественно, представляет собой палладий/уголь или хлорид никеля(II). В случае медленного протекания реакции катализатор восстановления может также быть использован в массовом соотношении по отношению к материалам приблизительно 1/2.
Хотя температура реакции в случае применения катализатора восстановления может изменяться в зависимости от исходных материалов и растворителей, как правило, температура составляет от 0 до 60°C и, предпочтительно, от 10 до 40°C.
Хотя время взаимодействия в случае применения катализатора восстановления может изменяться в зависимости от исходных материалов, растворителя и реакционной температуры, как правило, указанное время составляет от 1 до 60 часов и, предпочтительно, от 5 до 24 часов.
Обычно давление водорода во время взаимодействия, в случае применения катализатора восстановления, составляет от 0,5 до 5 атм и, предпочтительно, от 1 до 2 атм.
В случае, когда алкенильную группу восстанавливают одновременно с нитрогруппой, в качестве катализатора используют хлорид никеля(II), и взаимодействие может быть выполнено с натрийборгидридом и пр. при температуре от -30 до 40°C (предпочтительно, от -15 до 25°C) за период от 30 минут до 1 часа.
Кроме того, когда R1 означает C2-C6-алкинильную группу, и в случае, когда только нитрогруппу восстанавливают, без восстановления тройной связи, взаимодействие может быть выполнено с применением смесей железохлористоводородная кислота, цинк-уксусная кислота, железо-хлорид аммония и пр. при температуре от 0 до 30°C за период от 10 до 50 часов.
Обычно соединение, полученное на B-5 стадии, может быть использовано на следующей B-6 стадии просто при отделении катализатора фильтрованием.
(Стадия B-6) Реакция циклизации
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие бисульфида углерода с соединением, полученным на вышеуказанной B-5 стадии, в отсутствие растворителя или в инертном растворителе, приводящее к соединению (2), являющемуся промежуточным для вышеуказанного способа A.
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол, метилцеллозольв; алифатические углеводороды, такие как гексан, гептан, лигроин, петролейный эфир; ароматические углеводороды, такие как бензол, толуол, простые эфиры, такие как диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан, четыреххлористый углерод; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, гексаметилфосфорный триамид; органическую кислоту, такую как уксусная кислота и пр., предпочтительно, спирт и, наиболее предпочтительно, метанол или N,N-диметилформамид.
Хотя температура реакции может изменяться в зависимости от исходных материалов и растворителя, как правило, температура составляет от 0 до 60°C и, предпочтительно, от 10 до 40°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя и реакционной температуры, как правило, указанное время составляет от 12 до 60 часов и, предпочтительно, от 24 до 48 часов.
(Стадия B-7)
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие аммиака с соединением (4a) в присутствии или в отсутствие карбоната щелочного металла, в отсутствие растворителя или в инертном растворителе, приводящее к получению соединения (6). Указанная стадия может быть проведена согласно B-1 стадии.
В качестве соединения (4a) может быть использовано промышленно выпускаемое соединение или соединение, синтезированное на основании известного из публикации способа.
Соединение (2a), где R2 соединения (2) означает метильную группу, может быть получено следующим способом C.
[Формула 4]
Способ C
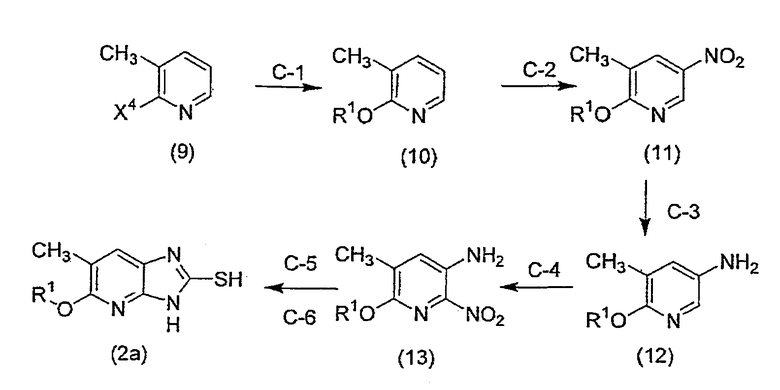
На приведенной выше схеме R1 имеет вышеуказанные значения, X4 означает уходящую группу, предпочтительно, атом фтора, атом хлора, атом брома или атом иода и, более предпочтительно, атом фтора.
(Стадия C-1) Реакция введения R1-O группы
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие соединения (9) и спирта или фенола R1-OH (где R1 имеет вышеуказанные значения), приводящее к получению соединения (10).
В качестве соединения (9) может быть использовано промышленно выпускаемое соединение или соединение, синтезированное на основании известного из публикации способа.
Данный процесс может быть осуществлен согласно B-2 стадии.
(Стадия C-2) Реакция нитрования
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие дымящейся азотной кислоты с соединением (10) в присутствии или в отсутствие концентрированной серной кислоты, в отсутствие растворителя, приводящее к получению соединения (11).
Хотя температура реакции может изменяться в зависимости от исходных материалов и растворителя, как правило, температура составляет от -20 до 100°C и, предпочтительно, от 0 до 80°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя и реакционной температуры, как правило, указанное время составляет от 6 до 48 часов и, предпочтительно, от 7 до 36 часов.
(Стадия C-3) Реакция восстановления
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие водорода с соединением (11) в присутствии катализатора восстановления, в отсутствие растворителя или в инертном растворителе, приводящее к получению соединения (12). Данная стадия может быть осуществлена согласно описанной выше стадии B-5.
(Стадия C-4) Реакция введения нитрогруппы
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие соединения (12) в безводной уксусной кислоте при 0-40°C в течение 1-10 часов, получая соединение, превращенное в N-ацетильную форму (стадия C-4-1), после чего осуществляют взаимодействия дымящейся азотной кислоты с соединением (12) в присутствии или в отсутствие концентрированной серной кислоты, в отсутствие растворителя, при 0-40°C в течение 1-10 часов, приводящее к получению соединения (13) (стадия C-4-2), и далее полученное на предшествующей стадии соединение подвергают взаимодействию с гидроксидом щелочного металла, таким как гидроксид натрия, в спирте, таком как метанол и этанол, или смеси спирта и воды при 0-40°C в течение 5-30 минут, получая соединение (13).
(Стадия C-5) Реакция восстановления
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие газообразного водорода с соединением (13) в присутствии восстанавливающего катализатора, в отсутствие растворителя или в инертном растворителе, в целях превращения нитрогруппы в аминогруппу. Данный процесс может быть осуществлен согласно описанной выше стадии B-5.
(Стадия C-6) Реакция циклизации
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие бисульфида углерода с соединением, полученным на вышеуказанной стадии C-5, в отсутствие растворителя или в инертном растворителе, что приводит к получению соединения (2a), в котором R2 означает метильную группу, из числа промежуточных соединения вышеуказанного способа A. Данный процесс может быть осуществлен согласно описанной выше стадии B-6.
Соединение (3a), где R3 соединения (3) означает этильную группу, может быть получено следующим способом D.
[Формула 5]
Способ D
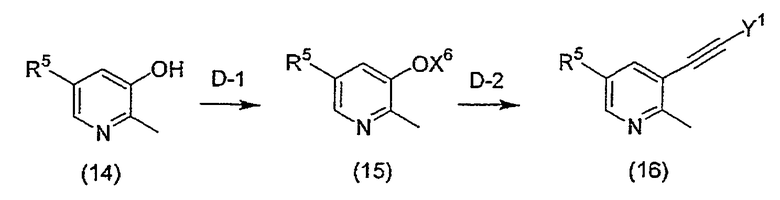
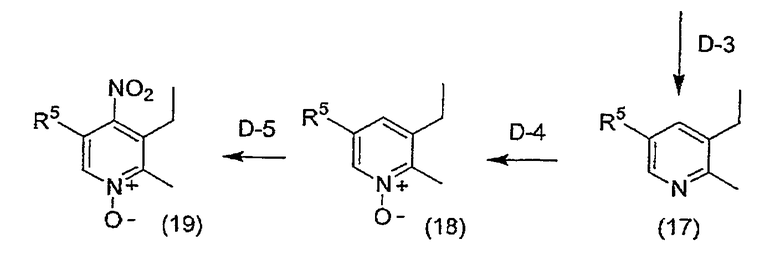
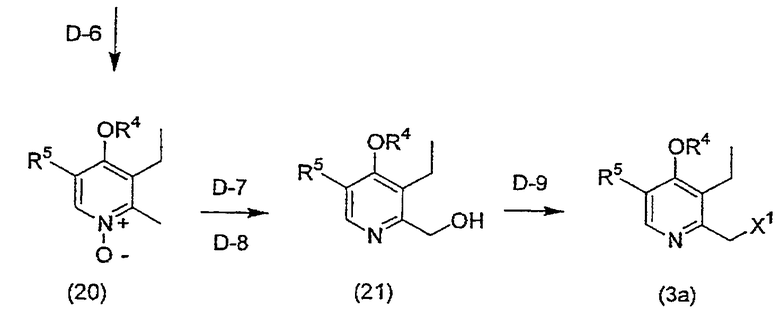
На приведенной выше схеме R4, R5 и X1 имеют вышеуказанные значения, Y1 означает триалкилсилильную группу, предпочтительно, триметилсилильную группу, и X6 означает алкилсульфонильную группу, которая может быть замещена атомом галогена, или бензолсульфонильную группу, которая может быть замещенной (например, такой группой, как трифторметансульфонил, метансульфонил, этансульфонил, бензолсульфонил, п-толуолсульфонил и т.д.).
(Стадия D-1) реакция введения уходящей группы
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие соединения (14) и агента введения уходящей группы в присутствии основания, в отсутствие растворителя или в инертном растворителе, что приводит к получению соединения (15)
В качестве соединения (14) может быть использовано промышленно выпускаемое соединение или соединение, синтезированное на основании известного из публикации способа.
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан, четыреххлористый углерод; ароматический углеводород, такой как бензол, толуол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, гексаметилфосфорный триамид, пиридин и т.д., и, предпочтительно, галогенированный углеводород, наиболее предпочтительно, дихлорметан.
Приемлемый для использования агент введения уходящей группы включает, например, сульфонилгалогениды, такие как метансульфонилхлорид, п-толуолсульфонилхлорид, трифторметансульфонилхлорид, N-фенилбис(трифторметансульфонимид) и, предпочтительно, N-фенилбис(трифторметансульфонимид).
Приемлемое для использования основание включает, например, третичные алкиламины, такие как триметиламин и триэтиламин, пиридины и пр., и, предпочтительно, представляет собой триэтиламин.
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя, агента введения уходящей группы и оснований, как правило, температура составляет от 0 до 100°C и, предпочтительно, от 0 до 40°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, агента введения уходящей группы, основания и реакционной температуры, как правило, указанное время составляет от 6 до 48 часов и, предпочтительно, от 12 до 30 часов.
(Стадия D-2) Реакция введения алкина
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие соединения (15) и (триалкилсилил)ацетилена в присутствии палладиевого катализатора, медного катализатора и основания, в отсутствие растворителя или в инертном растворителе и в атмосфере азота, что приводит к получению соединения (16).
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, гексаметилфосфорный триамид, пиридин и пр., и, предпочтительно, амид, а, наиболее предпочтительно, N,N-диметилформамид.
Приемлемый для использования палладиевый катализатор включает, например,
дихлорбис(трифенилфосфин)палладий(0),
тетракис(трифенилфосфин)палладий(0),
трис(дибензилиденацетон)дипалладий(0),
бис(дибензилиденацетон)палладий(0),
бис(три-трет-бутилфосфин)палладий (0),
палладиевую чернь и т.д., и, предпочтительно, дихлорбис(трифенилфосфин)палладий(0).
Приемлемый для использования медный катализатор включает, например, медь (порошок), хлорид меди(I), хлорид меди(II), иодид меди(I), оксид меди(I), оксид меди(II), ацетат меди(II), пентагидрат сульфата меди(II), ацетилацетонат меди(II), тиоцианат меди(I) и т.д., и, предпочтительно, иодид меди(I).
Приемлемое для использования основание включает, например, N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нона-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO), 1,8-диазабицикло[5.4.0]ундека-7-ен (DBU) и т.д., и, предпочтительно, представляет собой триэтиламин.
Приемлемый для использования (триалкилсилил)ацетилен включает, например, (триметилсилил)ацетилен, (триэтилсилил)ацетилен и т.д., и, предпочтительно, представляет собой (триметилсилил)ацетилен.
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя, палладиевого катализатора, медного катализатора, основания и (триалкилсилил)ацетилена, как правило, температура составляет от 10 до 100°C и, предпочтительно, от 30 до 80°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, палладиевого катализатора, медного катализатора, основания, (триалкилсилил)ацетилена и реакционной температуры, как правило, указанное время составляет от 10 минут до 4 часов и, предпочтительно, от 30 минут до 3 часов.
(Стадия D-3) Реакция десилилирования, реакция восстановления
Данный способ включает следующие 2 реакционные стадии.
(1) Реакция десилилирования
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие десилилирующего агента с соединением (16) в отсутствие растворителя или в инертном растворителе, что приводит к получению десилилированного соединения.
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; алифатические углеводороды, такие как гексан, гептан, лигроин, петролейный эфир; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, гексаметилфосфорный триамид, и, предпочтительно, представляет собой простой эфир и, наиболее предпочтительно, тетрагидрофуран.
Приемлемый для использования десилилирующий агент включает, например, фторид водорода, тетрабутиламмонийфторид и т.д., и, предпочтительно, представляет собой тетрабутиламмонийфторид.
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя и десилилирующего агента, как правило, температура составляет от 0 до 100°C и, предпочтительно, от 10 до 40°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя и десилилирующего агента, как правило, указанное время составляет от 30 минут до 6 часов и, предпочтительно, от 2 до 3 часов.
Поскольку соединение, получаемое на данной стадии, может быть низкокипящим соединением, то в этом случае раствор обычно используют для последующей переработки без какой-либо обработки после взаимодействия посредством концентрации, экстракции, колоночной хроматографии и пр.
(2) Реакция восстановления
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие газообразного водорода с соединением, полученным на вышеуказанной стадии (1), в присутствии катализатора восстановления, в инертном растворителе, что приводит к получению соединения (17).
Данный процесс может быть осуществлен согласно описанной выше стадии B-2. Однако катализатор восстановления обычно используют в массовом соотношении порядка 5-10% по отношению к соединению, полученному на вышеуказанной стадии (1).
(Стадия D-4) Реакция окисления
Данная стадия представляет собой стадию, на которой окисляющий реагент подвергают взаимодействию с соединением (17) в отсутствие растворителя или в инертном растворителе, что приводит к получению соединения (18).
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, алифатические углеводороды, такие как гексан, гептан, лигроин, петролейный эфир; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан, четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, гексаметилфосфорный триамид; органические кислоты, такие как уксусная кислота и пр., и, предпочтительно, представляет собой органическую кислоту, наиболее предпочтительно, уксусную кислоту.
Приемлемый для использования окисляющий реагент включает, например, такие реагенты, как пероксид водорода, трет-бутилгидропероксид, периодат натрия, перуксусная кислота, пербензойная кислота, метахлорпербензойная кислота, аддукт мочевина-пероксид водорода и пр., и, предпочтительно, представляет собой пероксид водорода или аддукт мочевина-пероксид водорода. Кроме того, при использовании аддукта мочевина-пероксид водорода обычно целесообразно использовать соединение вместе с безводной трифторуксусной кислотой и тому подобным.
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя и окисляющего реагента, как правило, температура составляет от 30 до 150°C и, предпочтительно, от 50 до 100°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, окисляющего реагента и реакционной температуры, как правило, указанное время составляет от 12 до 60 часов и, предпочтительно, от 24 до 36 часов.
(Стадия D-5) Реакция нитрования
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие дымящейся азотной кислоты с соединением (18) в отсутствие или присутствии концентрированной серной кислоты, в отсутствие растворителя или в инертном растворителе, что приводит к получению соединения (19).
Эта стадия может быть осуществлена согласно описанной выше стадии C-2.
(Стадия D-6) реакция образования R4-O
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие спиртового соединения R4-OH (где R4 имеет вышеуказанные значения) с соединением (19), в присутствии основания, в отсутствие растворителя или в инертном растворителе, что приводит к получению соединения (20).
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; алифатические углеводороды, такие как гексан, гептан, лигроин, петролейный эфир; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и гексаметилфосфорный триамид; органическую кислоту, такую уксусная кислота и т.д., и, предпочтительно, представляет собой спирт (R4-OH).
Приемлемое для использования основание включает, например, алкоксид щелочного металла, такой как метилат натрия и этилат натрия, и, предпочтительно, представляет собой алкоксид натрия (требуемый R4-ONa).
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя и основания, как правило, температура составляет от 0 до 100°C и, предпочтительно, от 10 до 60°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, основания и реакционной температуры, как правило, указанное время составляет от 5 до 24 часов и, предпочтительно, от 8 до 14 часов.
(Стадия D-7) Реакция этерификации под действием уксусной кислоты
Данная стадия представляет собой стадию, на которой безводную уксусную кислоту подвергают взаимодействию с соединением (20), в отсутствие растворителя, что приводит к получению эфира уксусной кислоты, соединения (21).
Хотя температура реакции может изменяться в зависимости от исходных материалов и растворителя, как правило, температура составляет от 20 до 150°C и, предпочтительно, от 50 до 100°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя и реакционной температуры, как правило, указанное время составляет от 10 минут до 3 часов и, предпочтительно, от 1 до 2 часов.
Остаток, полученный после взаимодействия путем выпаривания безводной уксусной кислоты, обычно используют на последующей стадии без какой-либо обработки.
(Стадия D-8) Реакция гидролиза
Данная стадия представляет собой стадию, на которой основание подвергают взаимодействию с соединением, полученным на вышеуказанной стадии D-7, в отсутствие растворителя или в инертном растворителе, что приводит к получению соединения (21).
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, воду; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; алифатические углеводороды, такие как гексан, гептан, лигроин, петролейный эфир; простые эфиры, такие как диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, гексаметилфосфорный триамид, и, предпочтительно, представляет собой спирт или смесь спирта и воды, и, наиболее предпочтительно, смесь метанола и воды.
Приемлемое для использования основание включает, например, карбонаты щелочного металла, такие как карбонат лития, карбонат натрия, карбонат калия; гидроксид щелочного металла, такой как гидроксид лития, гидроксид натрия, гидроксид калия; алкоксид металла, такой как метилат лития, метилат натрия, этилат натрия, трет-бутилат калия; аммиак, такой как водный раствор аммиака, смесь концентрированный аммиак-метанол и пр., и, предпочтительно, представляет собой гидроксид щелочного металла и, наиболее предпочтительно, гидроксид натрия.
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя и основания, как правило, температура составляет от 0 до 60°C и, предпочтительно, от 10 до 40°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, основания и реакционной температуры, как правило, указанное время составляет от 10 минут до 2 часов и, предпочтительно, от 30 минут до 1 часа.
(Стадия D-9) (1) Реакция галогенирования (иллюстрируемая реакцией хлорирования в качестве характерного примера реакции)
Данная стадия представляет собой стадию, на которой хлорирующий агент подвергают взаимодействию с соединением (21), в отсутствие растворителя или в инертном растворителе, что приводит к получению соединения (3a), в котором R3 означает этильную группу, из числа промежуточных соединений для вышеуказанного способа A.
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан, четыреххлористый углерод, и, предпочтительно, представляет собой галогенированный углеводород, и, наиболее предпочтительно, дихлорметан.
Приемлемый для использования хлорирующий агент включает, например, хлор, оксалилхлорид, тионилхлорид, оксихлорид фосфора, трихлорид фосфора, пентахлорид фосфора и пр., и, предпочтительно, представляет собой тионилхлорид.
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя и хлорирующих агентов, как правило, температура составляет от -20 до 30°C и, предпочтительно, от 0 до 10°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, хлорирующего агента, основания и реакционной температуры, как правило, указанное время составляет от 30 минут до 6 часов и, предпочтительно, от 1 до 2 часов.
Соединение (3a) на данной стадии может быть получено в виде хлористоводородной соли и может также быть использовано без какой-либо обработки.
(2) Реакция введения уходящей группы
Данная стадия представляет собой стадию, на которой подвергают взаимодействию соединение (21) и агент введения уходящей группы в присутствии основания, в отсутствие растворителя или в инертном растворителе, что приводит к получению соединения (3a), в котором R3 означает метильную группу. Эта стадия может быть осуществлена согласно описанной выше стадии D-1.
Соединение (2b), в котором R2 соединения (2) означает метильную группу, также может быть получено следующим способом E.
[Формула 6]
Способ E
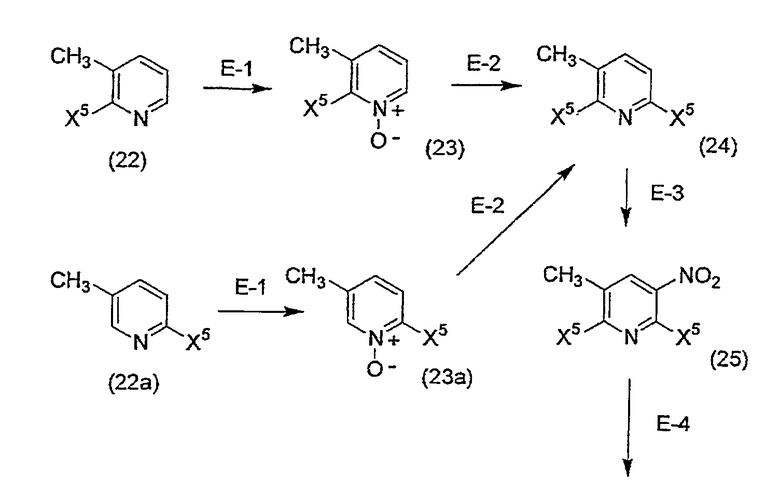
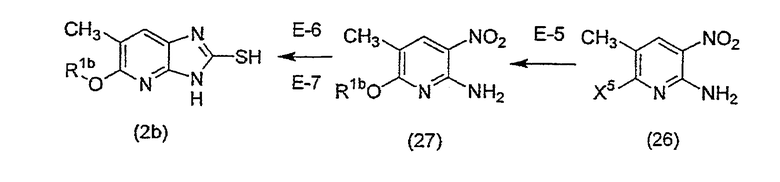
На приведенной выше схеме R1b имеет вышеуказанное значение, X5 означает уходящую группу, представляющую собой атом хлора, атом брома или атом иода, и, предпочтительно, означает атом хлора.
(Стадия E-1) Реакция окисления
Данная стадия представляет собой стадию, на которой окисляющий реагент подвергают взаимодействию с соединением (22) или соединением (22a), в отсутствие растворителя или в инертном растворителе, что приводит к получению соединения (23) или соединения (23a).
В качестве соединений (22) и (22a) могут быть использованы промышленно выпускаемые соединения или соединения, синтезированные на основании известного из публикации способа.
Эта стадия может быть осуществлена согласно описанной выше стадии D-4.
(Стадия E-2) Реакция введения уходящей группы (иллюстрируемая реакцией хлорирования в качестве характерного примера реакции)
Данная стадия представляет собой стадию, на которой хлорирующий агент подвергают взаимодействию с соединением (23) или соединением (23a) в присутствии основания, в отсутствие растворителя или в инертном растворителе, что приводит к получению соединения (24).
Приемлемый для использования растворитель не имеет особых ограничений до тех пор, пока способен растворять исходные материалы, до известной степени, и не ингибирует взаимодействие, и включает, например, галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан, четыреххлористый углерод, и, предпочтительно, представляет собой галогенированный углеводород и, наиболее предпочтительно, дихлорметан.
Приемлемое для использования основание включает, например, N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нона-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO), 1,8-диазабицикло[5.4.0]ундека-7-ен (DBU) и пр., и, предпочтительно, представляет собой триэтиламин.
Приемлемый для использования хлорирующий агент включает, например, хлор, оксалилхлорид, тионилхлорид, оксихлорид фосфора, трихлорид фосфора, пентахлорид фосфора и пр., и, предпочтительно, представляет собой тионилхлорид.
Хотя температура реакции может изменяться в зависимости от исходных материалов, растворителя и хлорирующих агентов, как правило, температура составляет от -20 до 30°C и, предпочтительно, от 0 до 10°C.
Хотя время взаимодействия может изменяться в зависимости от исходных материалов, растворителя, хлорирующего агента и реакционной температуры, как правило, указанное время составляет от 30 минут до 6 часов и, предпочтительно, от 1 до 2 часов.
(Стадия E-3) Реакция нитрования
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие дымящейся азотной кислоты с соединением (24) в отсутствие или присутствии концентрированной серной кислоты, в отсутствие растворителя, приводящее к получению соединения (25).
Эта стадия может быть осуществлена согласно описанной выше стадии C-2.
(Стадия E-4) Реакция аминирования
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие водного раствора аммиака с соединением (25) в присутствии карбоната щелочного металла, в отсутствие растворителя или в инертном растворителе, приводящее к получению соединения (26). Эта стадия может быть осуществлена согласно описанной выше стадии B-1.
(Стадия E-5) Реакция введения R1-O группы
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие соединения (26) и спирта или фенола R1-OH (где R1 имеет вышеуказанные значения), приводящее к получению соединения (27).
Эта стадия может быть осуществлена согласно описанной выше стадии B-2.
(Стадия E-6) Реакция восстановления
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие водорода с соединением (27) в присутствии катализатора восстановления, в отсутствие растворителя или в инертном растворителе, и нитрогруппу превращают в аминогруппу. Эта стадия может быть осуществлена согласно описанной выше стадии B-5.
(Стадия E-7) Реакция циклизации.
Данная стадия представляет собой стадию, на которой осуществляют взаимодействие бисульфида углерода с соединением, полученным на вышеуказанной B-5 стадии, в отсутствие растворителя или в инертном растворителе, приводящее к соединению (2b), в котором R2 означает метильную группу, из числа промежуточных соединений описанного выше способа A. Эта стадия может быть осуществлена согласно описанной выше стадии B-6.
Целевое соединение каждой стадии может быть экстрагировано из реакционной смеси общепринятым способом после окончания каждой стадии вышеуказанных способов.
Например, когда суммарная реакционная смесь является жидкой, реакционную смесь, необязательно, оставляют охлаждаться до комнатной температуры или охлаждают льдом, кислоту, щелочь, окисляющий реагент или восстанавливающий агент соответственно нейтрализуют и добавляют органический растворитель, который является несмешивающимся, наподобие воды и этилацетата, и не взаимодействующим с целевым соединением, и слой, содержащий целевое соединение, отделяют. Далее, добавляют растворитель, который не смешивается с полученным слоем и не взаимодействует с целевым соединением, слой, содержащий целевое соединение, промывают, и отделяют интересующий слой. Вдобавок, если интересующий слой является органическим слоем, этот слой может быть высушен с применением осушителя, такого как безводный сульфат магния или безводный сульфат натрия, и целевое соединение может быть получено выпариванием растворителя.
Если интересующий слой является водным слоем, после обессоливания указанного слоя с использованием электрического поля промышленной частоты целевое соединение может быть получено лиофильной сушкой.
Кроме того, в случае, когда суммарная реакционная смесь является жидкой, и, если возможно, целевое соединение может быть получено просто выпариванием веществ, отличных от целевого соединения (например, растворителя, реагентов и пр.) при обычном или пониженном давлении.
Далее, когда только целевое соединение осаждается в виде твердого вещества или когда вышеуказанная суммарная реакционная смесь является жидкой и только целевое соединение осаждается в виде твердого вещества в процессе получения соединения, сначала целевое соединение получают методом фильтрования и полученное целевое соединение промывают подходящим органическим или неорганическим растворителем, а затем сушат, и маточник обрабатывают точно так же, как описано выше для случая, когда суммарная реакционная смесь является жидкой, получая дополнительное количество целевого соединения.
Кроме того, когда только реагент или катализатор существует в виде твердого вещества или когда вышеуказанная суммарная реакционная смесь является жидкой и только реагент или катализатор осаждаются в виде твердого вещества в процессе экстракции, а целевое соединение растворяется в растворе, реагент или катализатор сначала отделяют методом фильтрования и целевое соединение промывают подходящим органическим или неорганическим растворителем, а полученные промывные воды объединяют с маточником, и полученный смешанный раствор обрабатывают точно так же, как описано выше для случая, когда суммарная реакционная смесь является жидкой, получая целевое соединение.
В частности, когда другие содержащиеся в реакционной смеси вещества, отличные от целевого соединения, не ингибируют взаимодействие на последующей стадии, реакционная смесь может быть использована без какой-либо обработки на последующей стадии без специального выделения целевого соединения.
С целью повышения чистоты целевого соединения, экстрагированного вышеуказанным способом, целесообразно применять метод перекристаллизации, разнообразные хроматографические методики и метод перегонки.
Когда экстрагированное целевое соединение является твердым, чистота целевого соединения обычно может быть повышена методом перекристаллизации. В способе перекристаллизации могут быть использованы отдельный растворитель или смеси двух или более растворителей, которые не взаимодействуют с целевым соединением. В частности, целевое соединение сначала растворяют в отдельном растворителе или многокомпонентных растворителях, которые не взаимодействуют с целевым соединением при комнатной температуре или при нагревании. Полученный смешанный раствор охлаждают льдом с водой или позволяют указанному раствору достичь комнатной температуры и дают возможность целевому соединению кристаллизоваться из смешанного раствора.
Когда экстрагированное целевое соединение является жидким, чистота целевого соединения обычно может быть повышена разнообразными хроматографическими методами. Обычно могут быть использованы слабокислые силикагели, такие как Silica Gel 60, выпускаемый Merck Co. (70-230 меш или 340-400 меш) или BW-300, выпускаемый Fuji Silysia Chemical Co., Ltd. (300 меш). Когда целевое соединение обладает основными свойствами и вышеуказанные силикагели являются избыточно адсорбционными, может также быть использован содержащий пропиламин силикагель (200-350 меш) от Fuji Silysia Chemical Co., Ltd. etc. Когда целевое соединение обладает биполярностью или в случае необходимости элюирования высокополярным растворителем, таким как метанол, могут также быть использованы NAM-200H или NAM-300H, выпускаемые NAMU Research Institute. Целевое соединение, чистоту которого повышают, может быть получено путем применения этих силикагелей, элюированием целевого соединения отдельным или многокомпонентным растворителями, не взаимодействующими с целевым соединением и выпариванием растворителя.
Когда экстрагированное целевое соединение является жидким, чистота целевого соединения может быть повышена также методом перегонки. При использовании способа перегонки целевое соединение может быть подвергнуто перегонке при пониженном давлении, при комнатной температуре или при нагревании.
Вышесказанное служит иллюстрацией характерных примеров способов получения соединения (1) по настоящему изобретению, реальные соединения и разнообразные реагенты при обработке согласно настоящему изобретению могут образовывать соль, гидрат или сольват, и каждая из указанных форм может изменяться в зависимости от используемых исходных материалов, растворителей и т.д. и не имеет особых ограничений, при условии, что не оказывает ингибирующего действия на взаимодействие. Приемлемые для использования растворители могут изменяться в зависимости от исходных материалов, реагентов и т.д., и следует отметить, что указанные растворители не имеют особых ограничений до тех пор, пока способны растворять исходные материалы, до известной степени, и не ингибируют взаимодействие. Когда рассматриваемое соединение (1) по изобретению получают в свободной форме, указанное соединение может быть переведено общепринятым способом в состояние соли или гидрата, которые может образовывать вышеуказанное соединение (1).
Когда соединение (1) по настоящему изобретению получают в форме соли или гидрата соединения (1), указанная форма может быть переведена общепринятым способом в свободную форму вышеуказанного соединения (1).
Кроме того, различные изомеры (например, геометрический изомер, оптический изомер, поворотный изомер, стереоизомер, таутомер и т.д.), доступные для соединения (1) по настоящему изобретению, могут быть очищены и выделены с применением общепринятых приемов разделения, например, таких как перекристаллизация, метод диастереомерной соли, ферментативный способ разделения и разнообразные хроматографии (например, тонкослойная хроматография, колоночная хроматография, газовая хроматография и т.д.).
Когда соединение по настоящему изобретению используют в качестве лекарственного средства, обычно для получения препарата подходящие вспомогательные средства смешивают с соединением по настоящему изобретению. Однако это не мешает использованию соединения по настоящему изобретению без какой-либо обработки в качестве лекарственного средства.
В качестве вышеуказанных вспомогательных средств, обычно используемых для лекарственных препаратов, могут быть упомянуты наполнитель, связующее вещество, смазывающее вещество, дезинтегрирующее средство, краситель, корригент, эмульгатор, поверхностно-активное вещество, способствующее растворению средство, суспендирующее средство, изотонизирующее средство, буферное вещество, антисептик, антиоксидант, стабилизирующее средство, улучшитель всасывания и пр., и указанные вспомогательные средства могут также быть использованы в подходящей комбинации.
Примеры вышеуказанного наполнителя включают такие вещества, как лактоза, сахароза, глюкоза, кукурузный крахмал, маннит, сорбит, крахмал, желатинизированный крахмал, декстрин, кристаллическая целлюлоза, легкая безводная кремниевая кислота, силикат алюминия, силикат кальция, магнийалюмометасиликат, гидрофосфат кальция и т.д.
Примеры вышеуказанного связующего вещества включают такие вещества, как поливиниловый спирт, метилцеллюлоза, этилцеллюлоза, гуммиарабик, трагакантовая камедь, желатин, шеллак, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, натрийкарбоксиметилцеллюлоза, поливинилпирролидон, макрогол и пр.
Примеры вышеуказанного смазывающего вещества включают такие вещества, как магния стеарат, кальция стеарат, стеарилфумарат натрия, тальк, полиэтилен гликоль, коллоидный диоксид кремния и т.д.
Примеры вышеуказанного дезинтегрирующего средства включают такие вещества, как кристаллическая целлюлоза, агар, желатин, кальция карбонат, натрия бикарбонат, кальция цитрат, декстрин, пектин, низкозамещенная гидроксипропилцеллюлоза, карбоксиметилцеллюлоза, кальцийкарбоксиметилцеллюлоза, натрийкроскармеллоза, карбоксиметилкрахмал, натрийкарбоксиметилкрахмал и пр.
Примеры вышеуказанного красителя включают такие разрешенные для добавки к лекарственным средствам красители, как сесквиоксид железа, желтый сесквиоксид железа, кармин, карамель, бета-каротин, оксид титана, тальк, рибофлавиннатрийфосфат, желтый алюминий и тому подобное.
Примеры вышеуказанного корригента включают такие вещества, как какао-порошок, мята перечная, ароматический порошок, мятное масло, камфора, корица-порошок и т.д.
Примеры вышеуказанного эмульгатора или поверхностно-активного вещества включают такие вещества, как стеарилтриэтаноламин, натрийлаурилсульфат, лауриламинопропионат, лецитин, глицерилмоностеарат, эфир сахарозы и жирной кислоты, эфир глицерина и жирной кислоты и т.д.
Примеры вышеуказанного, способствующего растворению средства включают такие вещества, как полиэтиленгликоль, пропиленгликоль, бензиловый эфир бензойной кислоты, этанол, холестерин, триэтаноламин, карбонат натрия, цитрат натрия, полисорбат 80, никотинамид и пр.
Примеры вышеуказанного суспендирующего средства включают, помимо вышеуказанного поверхностно-активного вещества, такие вещества как гидрофильные полимеры, такие как поливиниловый спирт, поливинилпирролидон, метилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза.
Примеры вышеуказанного изотонизирующего средства включают такие вещества, как глюкоза, хлорид натрия, маннит, сорбит и пр.
Примеры вышеуказанного буферного вещества включают буферный раствор, такой как фосфатный, ацетатный, карбонатный, цитратный и пр.
Примеры вышеуказанного антисептика включают такие вещества, как метилпарабен, пропилпарабен, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидроацетовая кислота, сорбиновая кислота и пр.
Примеры вышеуказанного антиоксиданта включают такие вещества, как соль сернистой кислоты, аскорбиновая кислота, альфа-токоферол и пр.
Примеры вышеуказанного стабилизирующего средства включают те вещества, которые обычно используются для лекарственных средств.
Примеры вышеуказанного улучшителя всасывания включают те вещества, которые обычно используются для лекарственных средств.
Примеры вышеуказанного препарата включают препарат для перорального приема, такой как таблетка, порошок, гранула, капсула, сироп, пастилка и препарат для ингаляции; препараты для наружного применения, такие как суппозиторий, мазь, глазная мазь, пластырь, глазные капли, капли для носа, ушные капли, паста, лосьон или препарат для инъекции.
Вышеуказанный препарат для перорального приема получают соответствующим комбинированием вышеуказанных вспомогательных веществ. Поверхность такого препарата, по необходимости, может быть покрыта оболочкой.
Вышеуказанные препараты для наружного применения получают соответствующим комбинированием вышеуказанных вспомогательных веществ, в особенности, таких как наполнитель, связующее вещество, корригент, эмульгатор, поверхностно-активное вещество, способствующее растворению средство, суспендирующее средство, изотонизирующее средство, антисептик, антиоксидант, стабилизирующее средство или улучшитель всасывания.
Вышеуказанный препарат для инъекции получают соответствующим комбинированием вышеуказанных вспомогательных веществ, в особенности, таких как эмульгатор, поверхностно-активное вещество, способствующее растворению средство, суспендирующее средство, изотонизирующее средство, буферное вещество, антисептик, антиоксидант, стабилизирующее средство или улучшитель всасывания.
При использовании соединения по настоящему изобретению в качестве лекарственного средства дозировка изменяется в зависимости от состояния или возраста и обычно составляет от 0,15 до 5000 мг (предпочтительно, от 0,5 до 1500 мг) в случае препарата для перорального приема, от 0,5 до 1500 мг (предпочтительно, от 1,5 до 500 мг) в случае препарата для наружного применения, от 0,3 до 5000 мг (предпочтительно, от 1 до 500 мг) для однократного приема или подразделенного на 2-6-кратный прием в день в случае препарата для инъекции. Вышеуказанные величины соответствуют фактически введенным величинам в случае препарата для перорального приема и препарата для инъекции и фактически поглощенной живым организмом величине в случае препарата для наружного применения.
Соединение (1) по настоящему изобретению может быть получено, например, способом, приведенным в следующих примерах, и эффективность соединения может быть оценена способом, приведенным в следующих примерах испытаний. Однако указанные примеры являются иллюстративными, и настоящее изобретение, в любом случае, не ограничивается этими приведенными ниже конкретными примерами.
Промышленно выпускаемые исходные материалы, реагенты, используемые в примерах, и соответствующие поставщики указаны ниже. Когда поставщик указан по названию издания, это означает, что соединение получают по приведенной ссылке.
2-Фтор-3-метилпиридин (FLUOROCHEM)
10% порошкообразный Pd-на-угле (50% содержание воды в продукте) (N. E. CHEMCAT)
Бисульфид углерода (Wako Pure Chemical Industries)
Хлористоводородная соль 2-хлорметил-4-метокси-3-метилпиридина (J. Med. Chem., 1992; 35, 1049-1057)
Метахлорпербензойная кислота (Tokyo Kasei Kogyo)
1 н. Раствор гидроксида натрия (Wako Pure Chemical Industries)
2-Хлор-3-метилпиридин (Aldrich)
Аддукт мочевина-пероксид водорода (Aldrich)
Безводная трифторуксусная кислота (Tokyo Kasei Kogyo)
2-Хлор-5-метилпиридин (Aldrich)
Оксихлорид фосфора (Wako Pure Chemical Industries)
Безводная трифторметансульфоновая кислота (Tokyo Kasei Kogyo)
Азотная кислота-тетраметиламмоний (Aldrich)
2,2,2-трифторэтанол (Tokyo Kasei Kogyo)
2,2-дифторэтанол (Lancaster)
2-Хлор-6-метокси-3-нитропиридин (Tokyo Kasei Kogyo)
Концентрированный раствор аммиака (Kanto chemistry)
N-иодсукцинимид (Lancaster)
Уксусная кислота (Wako Pure Chemical Industries)
Триметилбороксин (Aldrich)
Тетракис(трифенилфосфин)палладий(0) (Kanto chemistry)
ПРИМЕРЫ
Пример 1
Натриевая соль 5-метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридина
[Формула 7]
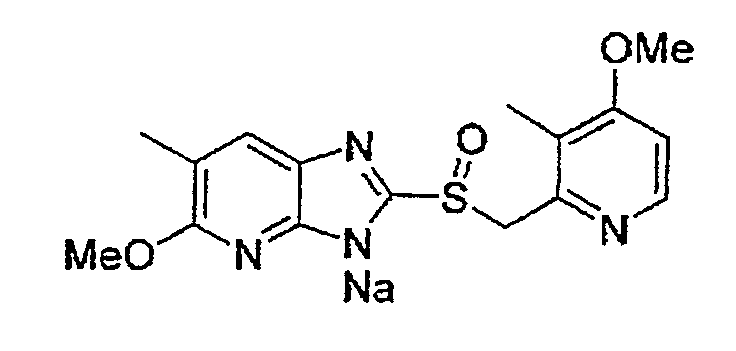
(1a) 2-Метокси-3-метилпиридин
[Формула 8]
Смесь 2-фтор-3-метилпиридина (2,34 г, 21,1 ммоль) и 28% метанольного раствора метилата натрия (7,72 г, 40 ммоль) перемешивают 15 минут при нагревании до температуры кипения с обратным холодильником. По завершению взаимодействия в реакционную смесь наливают воду и, после нейтрализации, реакционную смесь экстрагируют этилацетатом, сушат над сульфатом магния и растворитель выпаривают, тем самым получая указанное в заголовке соединение (1,62 г, 13,1 ммоль, 62%) в виде бесцветной жидкости.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,13 (3H, с), 3,86 (3H, с), 6,87-6,90 (1H, м), 7,49-7,55 (1H, м), 7,96-8,02 (1H, м).
(1b) 2-Метокси-3-метил-5-нитропиридин
[Формула 9]
Концентрированную серную кислоту (5 мл) и дымящуюся азотную кислоту (5 мл) добавляют к 2-метокси-3-метилпиридину (1,61 г, 13,1 ммоль), при охлаждении льдом, и перемешивают при 0°C 1 час, после чего перемешивают при комнатной температуре в течение ночи. Реакционную смесь выливают на лед, нейтрализуют водным раствором аммиака, экстрагируют этилацетатом, сушат над сульфатом магния, растворитель выпаривают, тем самым получая указанное в заголовке соединение (1,63 г, 9,71 ммоль и 74%).
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,25 (3H, с), 4,04 (3H, с), 8,37-8,40 (1H, м), 8,92-8,95 (1H, м).
(1c) 6-Метокси-5-метил-3-пиридинамин
[Формула 10]
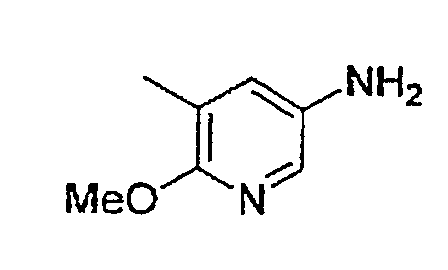
2-Метокси-3-метил-5-нитропиридин (1,63 г, 9,71 ммоль) растворяют в метаноле (50 мл), добавляют 10% порошкообразный Pd-на-угле (содержание воды в продукте 50%) (800 мг) и перемешивают в атмосфере водорода 2 часа и 10 минут. После завершения взаимодействия фильтруют через целит, растворитель выпаривают, тем самым получая указанное в заголовке соединение (1,25 г, 0,90 ммоль, 93%) в виде голубого маслянистого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,03 (3H, с), 3,73 (3H, с), 4,62 (2H, ушир.с), 6,83-6,86 (1H, м), 7,31-7,34 (1H, м).
(1d) N-(6-метокси-5-метил-2-нитро-3-пиридинил)ацетамид
[Формула 11]
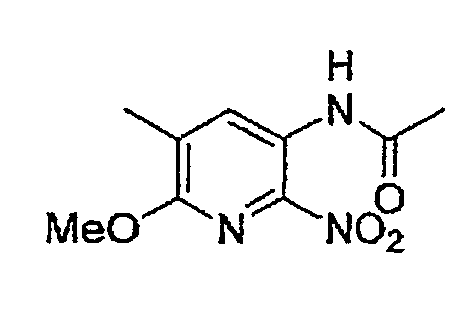
Безводную уксусную кислоту (20 мл) добавляют к 6-метокси-5-метил-3-пиридинамину (1,18 г, 8,54 ммоль), при охлаждении льдом, и перемешивают при 0°C 20 минут и при комнатной температуре еще 1 час. Реакционную смесь вновь охлаждают до 0°C, добавляют по каплям дымящуюся азотную кислоту (2 мл) и смесь перемешивают при 0°C 1 час и 55 минут и при комнатной температуре еще 1 час и 45 минут. Реакционную смесь выливают на лед и доводят pH до 9 с помощью 5 н. раствора гидроксида натрия, экстрагируют этилацетатом и затем растворитель выпаривают, тем самым получая указанное в заголовке соединение (1,94 г) желтого, твердого, сырого продукта.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,05 (3H, с), 2,23 (3H, с), 3,91 (3H, с), 7,89 (1H, с), 10,10 (1H, ушир.с).
(1e) 6-Метокси-5-метил-2-нитро-3-пиридинамин
[Формула 12]
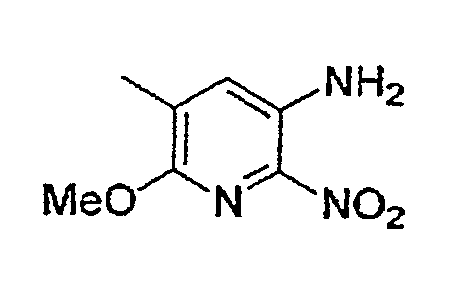
Сырой продукт (1,93 г), N-(6-метокси-5-метил-2-нитро-3-пиридинил)ацетамид растворяют в метаноле (36 мл), добавляют 5 н. раствор гидроксида натрия (6 мл) и реакционную смесь перемешивают 15 минут при комнатной температуре. После добавления воды к реакционному раствору полученный раствор экстрагируют этилацетатом и сушат над сульфатом магния, растворитель выпаривают, тем самым получая указанное в заголовке соединение (1,06 г, 5,79 ммоль) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,15 (3H, с), 3,84 (3H, с), 7,25 (2H, ушир.с), 7,34 (1H, с).
(1f) 5-Метокси-6-метил-3H-имидазо[4,5-b]пиридин-2-тиол
[Формула 13]
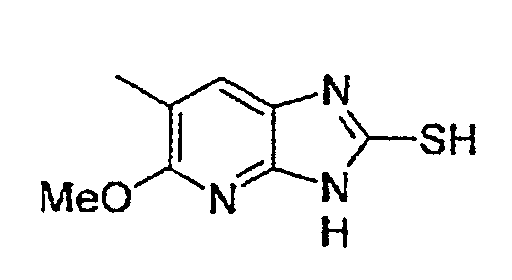
6-Метокси-5-метил-2-нитро-3-пиридинамин (5,40 г, 29,5 ммоль) растворяют в метаноле (300 мл), добавляют 10% порошкообразный Pd-на-угле (50% содержание воды в продукте) (2,73 г) и реакционную смесь перемешивают в атмосфере водорода 5 часов и 25 минут. После завершения взаимодействия реакционную смесь фильтруют, добавляют бисульфид углерода (110 мл) и перемешивают при комнатной температуре 65 часов и 40 минут в атмосфере азота, растворитель выпаривают, тем самым получая указанное в заголовке соединение (5,59 г, 28,6 ммоль, 97,1%) в виде коричневого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,16 (3H, с), 3,86 (3H, с), 7,35 (1H, с), 12,46 (1H, ушир.с), 12,88 (1H, ушир.с).
(1g) 5-Метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)тио)-6-метил-3H-имидазо[4,5-b]пиридин
[Формула 14]
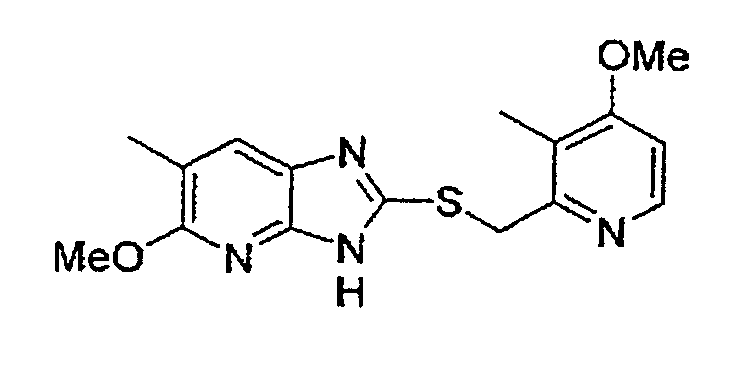
Смесь 5-метокси-6-метил-3H-имидазо[4,5-b]пиридин-2-тиола (971 мг, 5,0 ммоль), хлористоводородной соли 2-хлорметил-4-метокси-3-метилпиридина (1,35 г, 6,5 ммоль), гидроксида натрия (822 мг) и метанола (40 мл) перемешивают в течение ночи при комнатной температуре в атмосфере азота. После завершения взаимодействия растворитель выпаривают наполовину, добавляют раствор хлорида аммония и реакционную смесь экстрагируют хлороформом (300 мл), сушат над сульфатом магния и растворитель выпаривают, тем самым получая сырой продукт, который затем осаждают в виде твердого вещества из смеси хлороформа и диэтилового эфира, и указанное в заголовке соединение (1,06 г, 3,22 ммоль, 64%) получают в виде красновато-серого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,19 (3H, с), 2,21 (3H, с), 3,86 (3H, с), 3,90 (3H, с), 4,66 (2H, ушир.с), 6,97 (1H, д, J=6 Гц), 7,63 (1H, ушир.с), 8,25 (1H, д, J=6 Гц).
(1h) 5-Метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридин
[Формула 15]
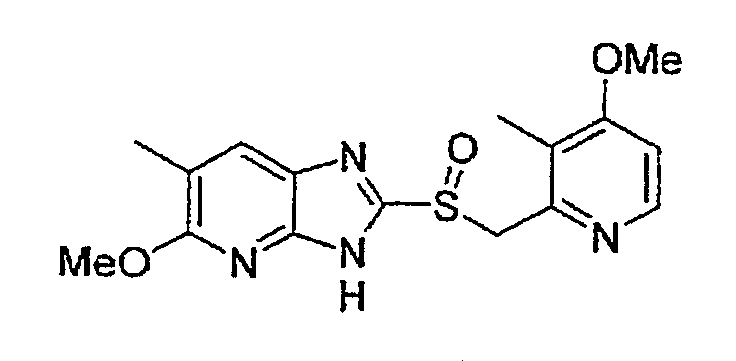
5-Метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)тио)-6-метил-3H-имидазо[4,5-b]пиридин (784 мг, 2,37 ммоль) растворяют в смеси метанола (6 мл) и толуола (54 мл). Добавляют метахлорпербензойную кислоту (566 мг) в смешанном растворе из метанола (3 мл) и толуола (3 мл), при -40°C, в токе азота, и реакционную смесь перемешивают при -20 - -40°C в течение 2 часов. После завершения взаимодействия добавляют раствор бикарбоната натрия и отделяют органический слой. Водный слой экстрагируют хлороформом (40 мл), объединяют с органическим слоем и сушат над сульфатом натрия, растворитель выпаривают и получают остаток, который затем осаждают в виде твердого вещества из смеси хлороформа и диэтилового эфира, тем самым получая указанное в заголовке соединение (654 мг, 1,89 ммоль, 80%) в виде красновато-серого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,14 (3Н, с), 2,25 (3Н, с), 3,85 (3Н, с), 3,94 (3Н, с), 4,72 (1Н, д, J=14 Гц), 4,81 (1Н, ушир.д, J=14 Гц), 6,96 (1Н, д, J=6 Гц), 7,83 (1Н, ушир.с), 8,22 (1Н, д, J=6 Гц).
(1i) Натриевая соль 5-метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридина
[Формула 16]
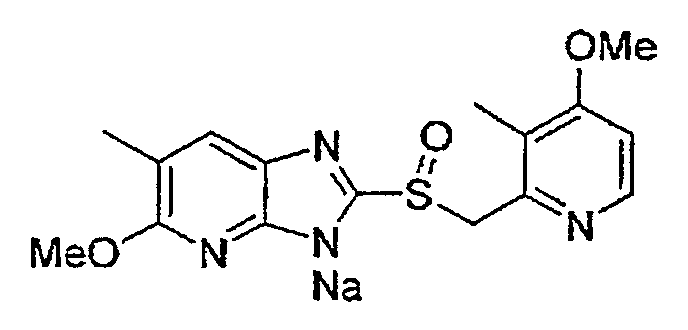
5-Метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридин (654 мг, 1,89 ммоль) растворяют в этаноле (30 мл), добавляют 1 н. раствор гидроксида натрия (1,89 мл, 1,89 ммоль) и реакционную смесь перемешивают 30 минут при комнатной температуре. Остаток, полученный выпариванием растворителя, растворяют в этаноле и растворитель вновь выпаривают. Полученный остаток суспендируют в диэтиловом эфире, растворитель выпаривают, вновь добавляют диэтиловый эфир до получения суспензии, растворитель выпаривают, тем самым получая указанное в заголовке соединение (690 мг, 1,87 ммоль, 99%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,16 (3H, с), 2,19 (3H, с), 3,85 (3H, с), 3,86 (3H, с), 4,39 (1H, д, J=13 Гц), 4,75 (1H, д, J=13 Гц), 6,94 (1H, д, J=6 Гц), 7,54 (1H, с), 8,30 (1H, д, J=6 Гц).
Пример 2
Натриевая соль 2-(((4-метокси-3-метил-2-пиридинил)метил]сульфинил)-6-метил-5-(2,2,2-трифторэтокси)-3H-имидазо[4,5-b]пиридина
[Формула 17]
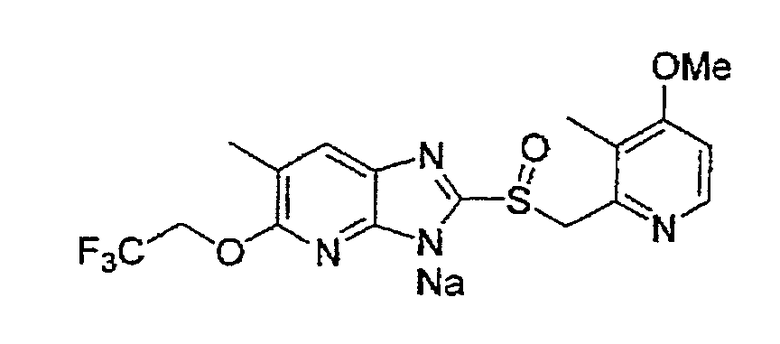
(2a) 2-Хлор-3-метилпиридин-1-оксид
[Формула 18]
В смесь 2-хлор-3-метилпиридина (12,8 г, 100 ммоль), аддукта мочевина-пероксид водорода ((NH2)2CO·H2O2, 19,8 г, 210 ммоль) и дихлорметана (130 мл) добавляют по каплям безводную трифторуксусную кислоту (28,2 мл, 200 ммоль) при 0°C в токе азота и реакционную смесь перемешивают при 0°C в течение 1 часа. Затем, после перемешивания в течение 30 минут и повышения реакционной температуры до комнатной температуры, добавляют водный раствор (200 мл) гидросульфита натрия (20 г) и реакционную смесь перемешивают 15 минут. Добавляют 2 н. хлористоводородную кислоту (50 мл) и смесь экстрагируют дихлорметаном (120 мл), и, после промывки раствором бикарбоната натрия, смесь сушат над сульфатом магния и растворитель выпаривают, тем самым получая указанное в заголовке соединение (9,00 г, 62,7 ммоль, 63%) в виде светло-желтого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,38 (3H, с), 7,29-7,37 (2H, м), 8,30-8,38 (1H, м).
(2b) 2-Хлор-5-метилпиридин-1-оксид
[Формула 19]
В смесь 2-хлор-5-метилпиридина (27,4 г, 215 ммоль), аддукта мочевина-пероксид водорода (42,5 г, 452 ммоль), дихлорметана (250 мл) добавляют по каплям безводную трифторуксусную кислоту (60,7 мл и 430 ммоль) при 0°C и реакционную смесь перемешивают при 0°C в течение 1 часа. Затем, после перемешивания в течение 45 минут во время повышения реакционной температуры до комнатной температуры, добавляют водный раствор (450 мл) гидросульфита натрия (45 г) и реакционную смесь перемешивают 15 минут. Добавляют 0,5 н. хлористоводородную кислоту (400 мл) и смесь экстрагируют дихлорметаном (400 мл) и, после промывки раствором бикарбоната натрия, смесь сушат над сульфатом магния и растворитель выпаривают, тем самым получая указанное в заголовке соединение (22,5 г, 157 ммоль, 73%) в виде твердого вещества бежевого цвета.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,24 (3H, с), 7,16-7,23 (1H, м), 7,66 (1H, д, J=8 Гц), 8,35 (1H, с).
(2c) 2,6-Дихлор-3-метилпиридин
[Формула 20]
(Способ 1)
2-Хлор-3-метилпиридин-1-оксид (9,00 г, 62,7 ммоль) и триэтиламин (10,4 мл, 75,2 ммоль) растворяют в дихлорметане (70 мл) и добавляют по каплям, при 0°C, раствор оксихлорида фосфора (7 мл, 75,3 ммоль) в дихлорметане (40 мл). После перемешивания в течение 3 часов во время повышения реакционной температуры до комнатной температуры реакционную смесь перемешивают при нагревании до температуры кипения с обратным холодильником в течение 1 часа. После завершения взаимодействия добавляют воду (30 мл) и реакционную смесь нейтрализуют раствором гидроксида натрия и после экстракции дихлорметаном (70 мл) сушат над сульфатом магния. Растворитель выпаривают и очищают колоночной хроматографией на силикагеле (элюирующий растворитель: смесь этилацетат/н-гексан = 3/100), тем самым получая указанное в заголовке соединение (3,47 г) в виде белой твердой смеси 10:3 с 2,4-дихлор-3-метилпиридином.
(Способ 2)
2-Хлор-5-метилпиридин-1-оксид (22,5 г, 157 ммоль) и триэтиламин (27,6 мл, 188 ммоль) растворяют в дихлорметане (160 мл) и добавляют по каплям, при -10°C, раствор оксихлорида фосфора (17,5 мл, 188 ммоль) в дихлорметане (80 мл). После перемешивания при температуре в интервале от -10°C до 0°C в течение 2 часов осуществляют перемешиванием течение еще 1 часа и 35 минут во время повышения реакционной температуры до комнатной температуры. После завершения взаимодействия добавляют воду (60 мл), смесь нейтрализуют раствором гидроксида натрия и отделенный органический слой промывают насыщенным раствором соли. Водный слой реакционного раствора экстрагируют этилацетатом, промывают насыщенным раствором соли, органический слой объединяют и сушат над сульфатом магния. Растворитель выпаривают и очищают колоночной хроматографией на силикагеле (элюирующий растворитель: смесь этилацетат/н-гексан), тем самым получая указанное в заголовке соединение (17,4 г) в виде белой твердой смеси 10:1,5 с 2,4-дихлор-5-метилпиридином.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,33 (3H, с), 7,50 (1H, д, J=8 Гц), 7,89 (1H, д, J=8 Гц).
(2d) 2,6-Дихлор-3-метил-5-нитропиридин
[Формула 21]
Безводную трифторметансульфоновую кислоту (21,9 мл, 129 ммоль) прикапывают к смеси нитрата тетраметиламмония (17,3 г, 127 ммоль) и дихлорметана (60 мл) при 0°C в токе азота и реакционную смесь перемешивают 1,5 часа во время нагревания до комнатной температуры. После добавления 10:1,5 смеси (13,7 г) из 2,6-дихлор-3-метилпиридина и 2,4-дихлор-5-метилпиридина в дихлорметане (20 мл) и перемешивания в течение 30 минут при комнатной температуре реакционную смесь перемешивают при нагревании до температуры кипения с обратным холодильником 48 часов. Реакционную смесь выливают в насыщенный раствор бикарбоната натрия и экстрагируют дихлорметаном (200 мл) и после промывки водой сушат над сульфатом магния. Остаток, полученный выпариванием растворителя, порошкуют с гептаном, тем самым получая указанное в заголовке соединение (6,55 г, 31,6 ммоль) в виде светло-коричневого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,42 (3H, с), 8,70 (1H, с).
(2e) 6-Хлор-5-метил-3-нитро-2-пиридинамин
[Формула 22]
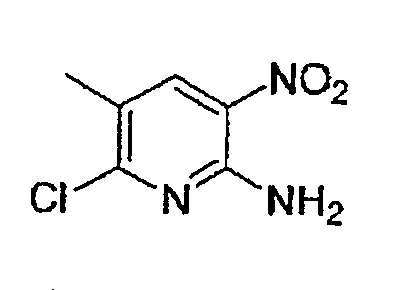
Смесь 2,6-дихлор-3-метил-5-нитропиридина (10,41 г, 50,3 ммоль), 28% водного раствора аммиака (17 мл, 0,25 моль), карбоната калия (10,4 г, 75,5 ммоль) и трет-бутанола (167 мл) перемешивают в течение ночи при 60°C в атмосфере азота. После перемешивания при комнатной температуре в течение 3 часов осадок фильтруют и затем трижды промывают водой, тем самым получая указанное в заголовке соединение (4,25 г, 22,7 ммоль, 45%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,23 (3H, с), 8,04 (2H, ушир.с), 8,39 (1H, с).
(2f) 5-Метил-3-нитро-6-(2,2,2-трифторэтокси)-2-пиридинамин
[Формула 23]
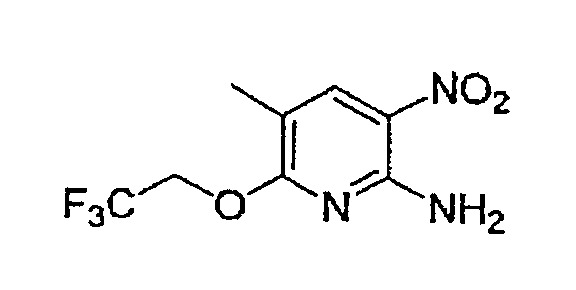
2,2,2-Трифторэтанол (340 мг, 3,4 ммоль) растворяют в тетрагидрофуране (10 мл), добавляют гидрид натрия (60%) (120 мг, 3,0 ммоль) и реакционную смесь перемешивают 30 минут при комнатной температуре в атмосфере азота. Прикапывают раствор 6-хлор-5-метил-3-нитро-2-пиридинамина, сырого продукта, (400 мг) в тетрагидрофуране (10 мл), и реакционную смесь перемешивают при комнатной температуре 2,5 дня. К реакционному раствору добавляют воду и экстрагируют этилацетатом и после промывки раствором бикарбоната натрия сушат над сульфатом магния. Остаток, полученный выпариванием растворителя, очищают колоночной хроматографией на силикагеле (элюирующий растворитель: смесь этилацетат/н-гексан = 15/85), получая указанное в заголовке соединение (225 мг, 0,90 ммоль) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,07 (3H, с), 5,06 (2H, кв, J=9 Гц), 8,05 (2H, ушир.с), 8,24 (1H, с).
(2g) 6-Метил-5-(2,2,2-трифторэтокси)-3H-имидазо[4,5-b]пиридин-2-тиол
[Формула 24]
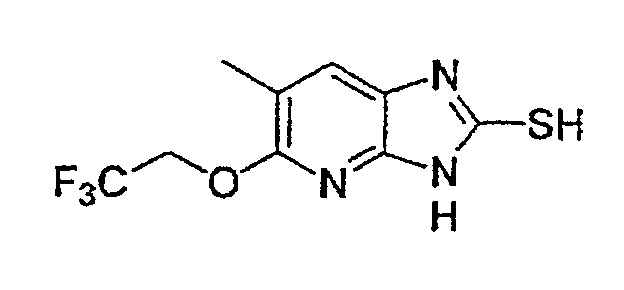
5-Метил-3-нитро-6-(2,2,2-трифторэтокси)-2-пиридинамин (225 мг, 0,90 ммоль) растворяют в метаноле (10 мл), добавляют 10% порошкообразный Pd-на-угле (50% содержание воды в продукте) (110 мг) и реакционную смесь перемешивают в атмосфере водорода 2 часа и 25 минут. После завершения взаимодействия реакционную смесь фильтруют через целит, добавляют бисульфид углерода (3 мл) и перемешивают при комнатной температуре в атмосфере азота 2,5 дня и затем растворитель выпаривают, тем самым получая указанное в заголовке соединение (238 мг, 0,90 ммоль) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,20 (3H, с), 4,94 (2H, кв, J=9 Гц), 7,44 (1H, с), 12,60 (1H, ушир.с), 13,00 (1H, ушир.с).
(2h) 2-(((4-Метокси-3-метил-2-пиридинил)метил)тио)-6-метил-5-(2,2,2-трифторэтокси)-3H-имидазо[4,5-b]пиридин
[Формула 25]
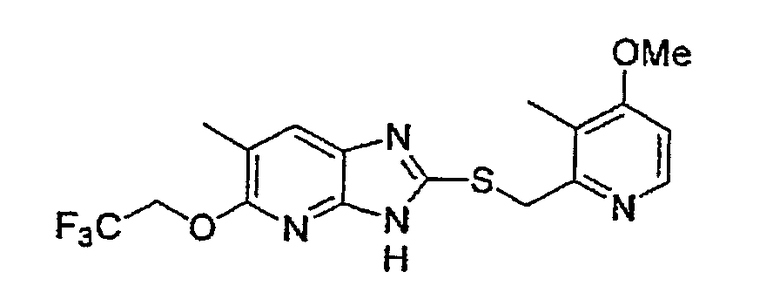
6-Метил-5-(2,2,2-трифторэтокси)-3H-имидазо[4,5-b]пиридин-2-тиол (238 мг, 0,90 ммоль) и хлористоводородную соль 2-хлорметил-4-метокси-3-метилпиридина (243 мг, 1,17 ммоль) растворяют в метаноле (20 мл), добавляют гидроксид натрия (218 мг, 5,45 ммоль) и смесь перемешивают при комнатной температуре в течение ночи. Добавляют раствор хлорида аммония и смесь экстрагируют хлороформом (100 мл) и сушат над сульфатом магния. Остаток, полученный выпариванием растворителя, очищают колоночной хроматографией на силикагеле (элюирующий растворитель: смесь этилацетат/н-гексан = 1/1-4/1), получая указанное в заголовке соединение (196 мг, 0,49 ммоль, 54%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,19 (3H, с), 2,24 (3H, с), 3,85 (3H, с), 4,67 (2H, с), 4,99 (2H, кв, J=9 Гц), 6,96 (1H, д, J=6 Гц), 7,72 (1H, ушир.с), 8,24 (1H, д, J=6 Гц).
(2i) 2-(((4-Метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-5-(2,2,2-трифторэтокси)-3H-имидазо[4,5-b]пиридин
[Формула 26]
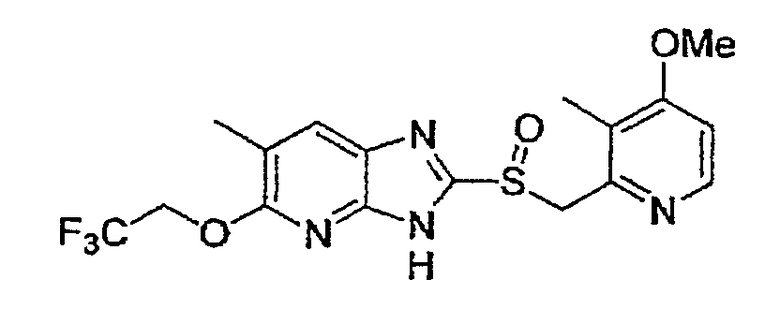
2-(((4-Метокси-3-метил-2-пиридинил)метил)тио)-6-метил-5-(2,2,2-трифторэтокси)-3H-имидазо[4,5-b]пиридин (270 мг, 0,68 ммоль) растворяют в смеси метанола (2 мл) и толуола (18 мл) и добавляют по каплям раствор метахлорпербензойной кислоты (162 мг) в смеси метанола (0,5 мл) и толуола (0,5 мл), при -40°C, в токе азота. После перемешивания при температуре в интервале от -20°C до -40°C в течение 2 часов добавляют раствор бикарбоната натрия, смесь экстрагируют хлороформом (30 мл) и сушат над сульфатом натрия. Растворитель выпаривают и твердый продукт осаждают из смеси хлороформа и н-гексана, получая указанное в заголовке соединение (263 мг, 0,63 ммоль, 93%) в виде красновато-серого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,14 (3H, с), 2,28 (3H, с), 3,85 (3H, с), 4,68 (1H, д, J=14 Гц), 4,80 (1H, д, J=14 Гц), 5,04 (2H, кв, J=9 Гц), 6,96 (1H, д, J=6 Гц), 7,88 (1H, ушир.с), 8,22 (1H, д, J=6 Гц).
(2j) Натриевая соль 2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-5-(2,2,2-трифторэтокси)-3H-имидазо[4,5-b]пиридина
[Формула 27]
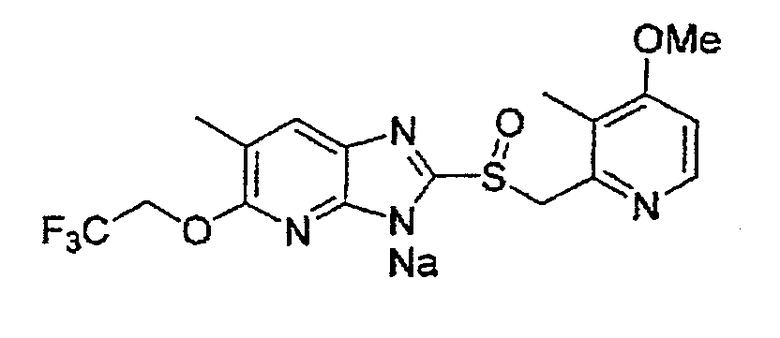
2-(((4-Метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-5-(2,2,2-трифторэтокси)-3H-имидазо[4,5-b]пиридин (263 мг, 0,64 ммоль) суспендируют в этаноле (30 мл), добавляют 1 н. раствор гидроксида натрия (635 мкл, 0,64 ммоль) и реакционную смесь перемешивают 30 минут при комнатной температуре. После выпаривания растворителя добавляют этанол и вновь осуществляют выпаривание. Добавляют диэтиловый эфир и осуществляют выпаривание. Эту операцию повторяют дважды, тем самым получая указанное в заголовке соединение (272 мг, 0,62 ммоль, 98%) в виде красновато-серого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,16 (3H, с), 2,22 (3H, с), 3,84 (3H, с), 4,38 (1H, д, J=13 Гц), 4,78 (1H, д, J=13 Гц), 4,97 (2H, кв, J=9 Гц), 6,92 (1H, д, J=6 Гц), 7,61 (1H, с), 8,28 (1H, д, J=6 Гц).
Пример 3
Натриевая соль 5-(2,2-дифторэтокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридина
[Формула 28]
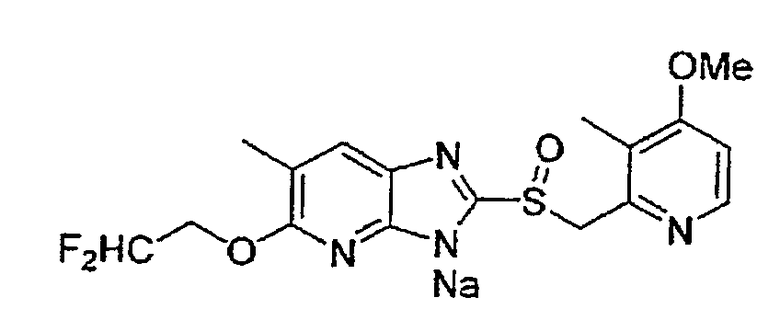
(3a) 6-(2,2-Дифторэтокси)-5-метил-3-нитро-2-пиридинамин
[Формула 29]
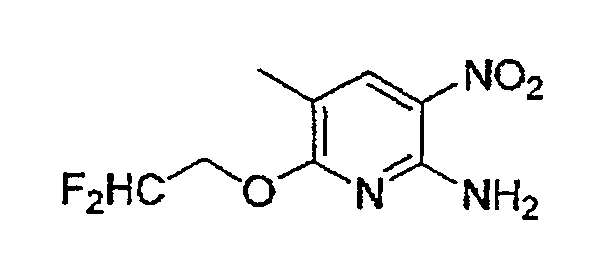
2,2-Дифторэтанол (418 мг, 5,1 ммоль) растворяют в тетрагидрофуране (15 мл), добавляют гидрид натрия (60%) (180 мг, 4,5 ммоль), в атмосфере азота, и реакционную смесь перемешивают 30 минут при комнатной температуре. Прикапывают раствор 6-хлор-5-метил-3-нитро-2-пиридинамина (600 мг, 3,20 ммоль) в тетрагидрофуране (15 мл) и смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют воду и экстрагируют этилацетатом и, после промывки раствором бикарбоната натрия, сушат над сульфатом магния. Остаток, полученный выпариванием растворителя, порошкуют с н-гексаном, получая указанное в заголовке соединение (685 мг, 3,1 ммоль, 96%) в виде оранжевого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,05 (3H, с), 4,56-4,69 (2H, м), 6,29-6,60 (1H, м), 8,03 (2H, ушир.с), 8,19 (1H, с).
(3b) 5-(2,2-Дифторэтокси)-6-метил-3H-имидазо[4,5-b]пиридин-2-тиол
[Формула 30]
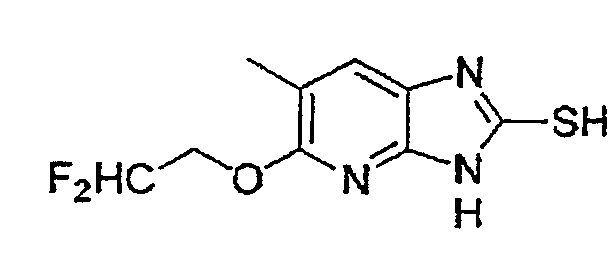
6-(2,2-Дифторэтокси)-5-метил-3-нитро-2-пиридинамин (685 мг, 3,07 ммоль) растворяют в метаноле (30 мл), добавляют 10% порошкообразный Pd-на-угле (50% содержание воды в продукте) (300 мг) и реакционную смесь перемешивают в атмосфере водорода 2 часа и 30 минут. После завершения взаимодействия смесь фильтруют через целит, добавляют бисульфид углерода (7 мл) и смесь перемешивают при комнатной температуре в атмосфере азота 2,5 дня. После чего растворитель выпаривают, получая указанное в заголовке соединение (700 мг, 2,85 ммоль) в виде красновато-серого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,18 (3H, с), 4,46-4,59 (2H, м), 6,23-6,54 (1H, м), 7,39 (1H, с), 12,51 (1H, ушир.с), 12,92 (1H, ушир.с).
(3c) 5-(2,2-Дифторэтокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)тио)-6-метил-3H-имидазо[4,5-b]пиридин
[Формула 31]
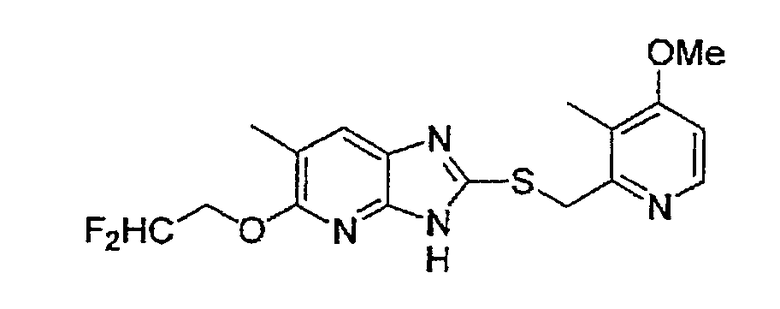
5-(2,2-Дифторэтокси)-6-метил-3H-имидазо[4,5-b]пиридин-2-тиол (700 мг, 2,85 ммоль) и хлористоводородную соль 2-хлорметил-4-метокси-3-метилпиридина (832 мг, 4,0 ммоль) растворяют в метаноле (30 мл), добавляют гидроксид натрия (561 мг, 14,0 ммоль) и смесь перемешивают в течение ночи при комнатной температуре, в атмосфере азота. К реакционному раствору добавляют раствор хлорида аммония, смесь экстрагируют этилацетатом и хлороформом (100 мл) и затем сушат над сульфатом магния. Остаток, полученный выпариванием растворителя, очищают колоночной хроматографией на силикагеле (NH-силикагель, элюирующий растворитель: смесь этилацетат/н-гексан = 1/1-1/0) и порошкуют с этанолом, тем самым получая указанное в заголовке соединение (360 мг, 0,95 ммоль, 33%) в виде твердого вещества бежевого цвета.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,19 (3H, с), 2,24 (3H, с), 3,85 (3H, с), 4,53-4,64 (2H, м), 4,67 (2H, с), 6,26-6,57 (1H, м), 6,96 (1H, д, J=6 Гц), 7,68 (1H, ушир.с), 8,24 (1H, д, J=6 Гц).
(3d) 5-(2,2-Дифторэтокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридин
[Формула 32]
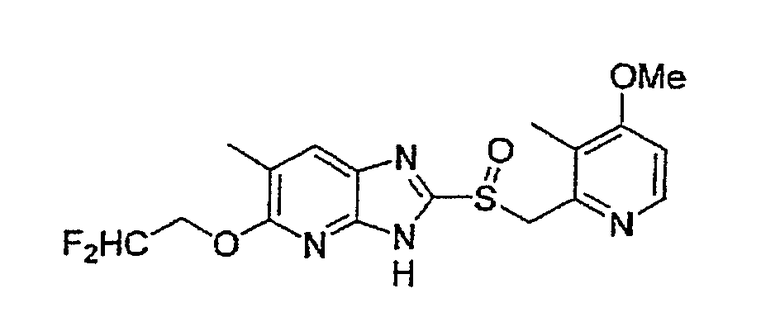
5-(2,2-Дифторэтокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)тио)-6-метил-3H-имидазо[4,5-b]пиридин (150 мг, 0,39 ммоль) растворяют в смеси метанола (1,5 мл) и толуола (13,5 мл) и добавляют по каплям раствор метахлорпербензойной кислоты (94 мг) в смеси метанола (0,5 мл) и толуола (0,5 мл), при -40°C, в токе азота.
После перемешивания при температуре в интервале от -20°C до -40°C в течение 2 часов добавляют раствор бикарбоната натрия, органический слой отделяют и водный слой экстрагируют хлороформ (20 мл), органический слой объединяют и сушат над сульфатом натрия. Растворитель выпаривают и твердое вещество затем осаждают из смеси хлороформа, диэтилового эфира и н-гексана, тем самым получая указанное в заголовке соединение (134 мг, 0,34 ммоль, 86%) в виде светло-голубого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,13 (3H, с), 2,28 (3H, с), 3,85 (3H, с), 4,56-4,69 (2H, м), 4,72 (1H, д, J=14 Гц), 4,79 (1H, д, J=14 Гц), 6,28-6,60 (1H, м), 6,95 (1H, д, J=6 Гц), 7,88 (1H, ушир.с), 8,20 (1H, д, J=6 Гц).
(3e) Натриевая соль 5-(2,2-дифторэтокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридина
[Формула 33]
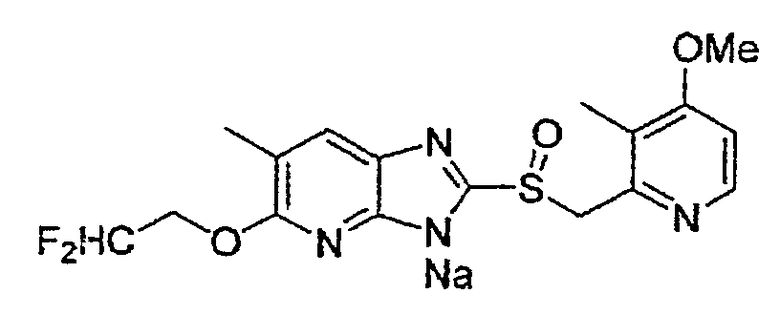
5-(2,2-Дифторэтокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил]-6-метил-3H-имидазо[4,5-b]пиридин (286 мг, 0,72 ммоль) суспендируют в этаноле (10 мл). Добавляют смесь 1 н. раствора гидроксида натрия (720 мкл, 0,72 ммоль) и этанола (3 мл) и реакционную смесь перемешивают 20 минут при комнатной температуре. После выпаривания растворителя добавляют этанол и выпаривание осуществляют снова, добавляют диэтиловый эфир и осуществляют выпаривание. Эту операцию повторяют дважды, тем самым получая указанное в заголовке соединение (277 мг, 0,66 ммоль, 92%) в виде твердого вещества бежевого цвета.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,16 (3H, с), 2,21 (3H, с), 3,85 (3H, с), 4,38 (1H, д, J=13 Гц), 4,56 (2H, дт, J=4,15 Гц), 4,78 (1H, д, J=13 Гц), 6,42 (1H, тт, J=4,55 Гц), 6,94 (1H, д, J=6 Гц), 7,60 (1H, с), 8,30 (1H, д, J=6 Гц).
Пример 4
Оптические изомеры 5-метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридина
[Формула 34]
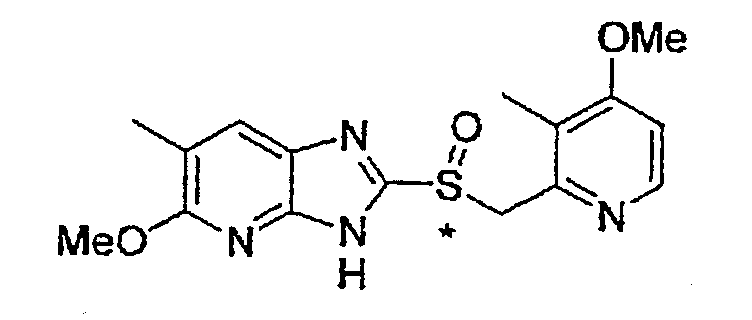
5-Метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил]-6-метил-3H-имидазо[4,5-b]пиридин (рацемат) (360 мг) получают в виде раствора, содержащего 3-4,5 мг рацемата на мл смеси этанол/н-гексан = 3/2, и фракционируют методом ВЭЖХ (колонка: CHIRALPAK AD-H 2 см ϕ × 25 см (Daicel Chemical Ind., Ltd.), температура: порядка 22°C, подвижная фаза: смесь этанол/н-гексан = 3/2 и объемная скорость потока: 9 мл/мин, длина волны детектирования: 254 нм, 15 мг-22,5 мг/5 мл впрыскивают за раз). Собирают фракции оптического изомера с большим временем удерживания и оптического изомера с меньшим временем удерживания соответственно и конденсируют. Указанное в заголовке соединение с меньшим временем удерживания (128 мг, 0,37 ммоль) и указанное в заголовке соединение с большим временем удерживания (116 мг, 0,33 ммоль) соответственно получают, таким образом, в виде твердого вещества бежевого цвета.
Указанное в заголовке соединение с меньшим временем удерживания:
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,14 (3H, с), 2,25 (3H, с), 3,85 (3H, с), 3,94 (3H, с), 4,71 (1H, д, J=14 Гц), 4,81 (1H, ушир.д, J=14 Гц), 6,96 (1H, д, J=6 Гц), 7,82 (1H, ушир.с), 8,22 (1H, д, J=6 Гц).
Указанное в заголовке соединение с большим временем удерживания:
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,14 (3H, с), 2,25 (3H, с), 3,85 (3H, с), 3,94 (3H, с), 4,71 (1H, д, J=14 Гц), 4,81 (1H, ушир.д, J=14 Гц), 6,96 (1H, д, J=6 Гц), 7,82 (1H, ушир.с), 8,22 (1H, д, J=6 Гц).
Пример 5
Оптические изомеры 5-(2,2-дифторэтокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридина
[Формула 35]
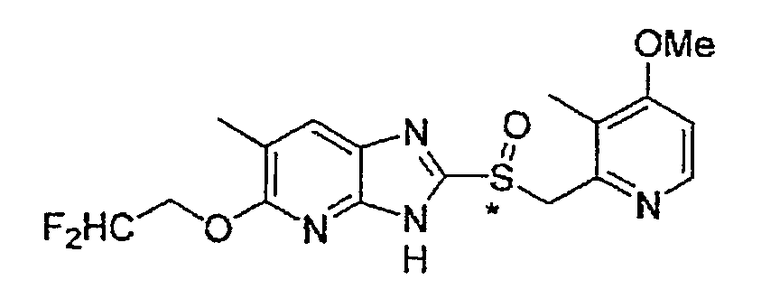
5-(2,2-Дифторэтокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридин (рацемат) (350 мг) получают в виде раствора, содержащего 5 мг рацемата на мл смеси этанол/н-гексан = 1/4 (содержание диэтиламина 0,1%), и фракционируют методом ВЭЖХ (колонка: CHIRALPAK AD-H 2 см ϕ × 25 см (Daicel Chemical Ind., Ltd.), температура: порядка 22°C, подвижная фаза: смесь этанол/н-гексан = 1/4 (содержание диэтиламина 0,1%), объемная скорость потока: 9 мл/мин, длина волны детектирования: 254 нм, 20 мг/4 мл впрыскивают за раз). Собирают фракции оптического изомера с большим временем удерживания и оптического изомера с меньшим временем удерживания соответственно и конденсируют, тем самым получая указанное в заголовке соединение с меньшим временем удерживания (125 мг, 0,32 ммоль) и указанное в заголовке соединение с большим временем удерживания (107 мг, 0,27 ммоль) соответственно в виде твердого вещества бежевого цвета.
Указанное в заголовке соединение с меньшим временем удерживания:
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,14 (3H, с), 2,27 (3H, с), 3,85 (3H, с), 4,56-4,69 (2H, м), 4,68 (1H, д, J=14 Гц), 4,79 (1H, д, J=14 Гц), 6,28-6,60 (1H, м), 6,95 (1H, д, J=6 Гц), 7,84 (1H, ушир.с), 8,21 (1H, д, J=6 Гц).
Указанное в заголовке соединение с большим временем удерживания:
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,14 (3H, с), 2,27 (3H, с), 3,85 (3H, с), 4,56-4,69 (2H, м), 4,68 (1H, д, J=14 Гц), 4,80 (1H, д, J=14 Гц), 6,28-6,60 (1H, м), 6,95 (1H, д, J=6 Гц), 7,84 (1H, ушир.с), 8,21 (1H, д, J=6 Гц).
Пример 6
Натриевая соль оптического изомера с меньшим временем удерживания, 5-метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридина
[Формула 36]
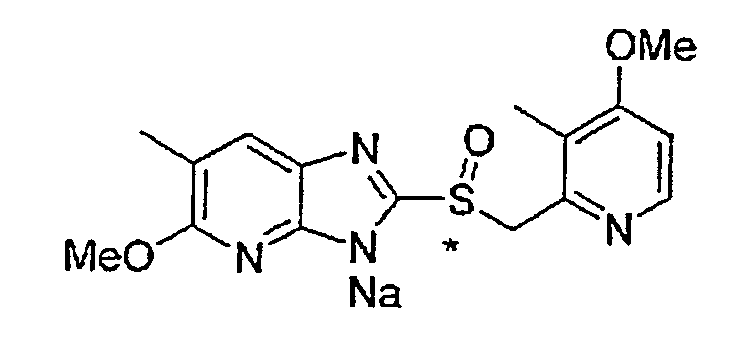
5-Метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридин в форме оптического изомера с меньшим временем удерживания (124 мг, 0,36 ммоль) растворяют в этаноле (20 мл) и добавляют смешанный раствор 1 н. раствора гидроксида натрия (0,36 мл, 0,36 ммоль) и этанола (2 мл) и реакционную смесь перемешивают 30 минут при комнатной температуре. Остаток, полученный после выпаривания растворителя, растворяют в этаноле и растворитель вновь выпаривают. К полученному остатку добавляют диэтиловый эфир до образования суспензии, диэтиловый эфир выпаривают и вновь добавляют диэтиловый эфир до образования суспензии и растворитель вновь выпаривают, тем самым получают указанное в заголовке соединение (133 мг, 0,36 ммоль) в виде твердого вещества бежевого цвета.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,16 (3H, с), 2,18 (3H, с), 3,85 (3H, с), 3,86 (3H, с), 4,36 (1H, д, J=13 Гц), 4,80 (1H, д, J=13 Гц), 6,92 (1H, д, J=6 Гц), 7,52 (1H, с), 8,28 (1H, д, J=6 Гц).
Пример 7
Натриевая соль оптического изомера с большим временем удерживания, 5-метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридина
[Формула 37]
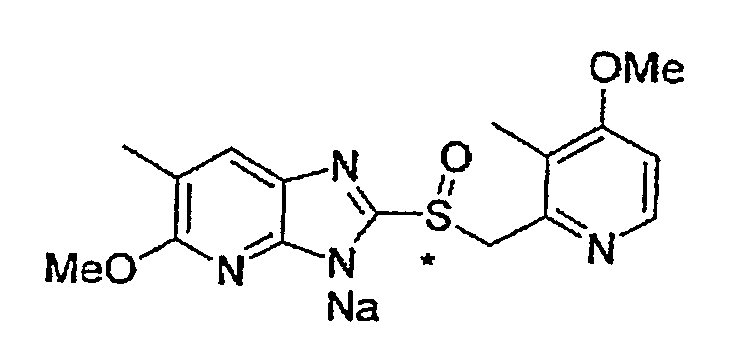
5-Метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридин в форме оптического изомера с большим временем удерживания (83 мг, 0,24 ммоль) растворяют в этаноле (15 мл) и добавляют смешанный раствор 1 н. раствора гидроксида натрия (0,24 мл, 0,24 ммоль) и этанола (2 мл) и реакционную смесь перемешивают 30 минут при комнатной температуре. Остаток, полученный после выпаривания растворителя, растворяют в этаноле и растворитель вновь выпаривают. К полученному остатку добавляют диэтиловый эфир до образования суспензии, диэтиловый эфир выпаривают и вновь добавляют диэтиловый эфир до образования суспензии и растворитель выпаривают, тем самым получают указанное в заголовке соединение (88 мг, 0,24 ммоль) в виде твердого вещества бежевого цвета.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,16 (3H, с), 2,18 (3H, с), 3,84 (3H, с), 3,85 (3H, с), 4,36 (1H, д, J=13 Гц), 4,80 (1H, д, J=13 Гц), 6,92 (1H, д, J=6 Гц), 7,51 (1H, с), 8,28 (1H, д, J=6 Гц).
Пример 8
Натриевая соль оптического изомера с меньшим временем удерживания, 5-(2,2-дифторэтокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридина
[Формула 38]
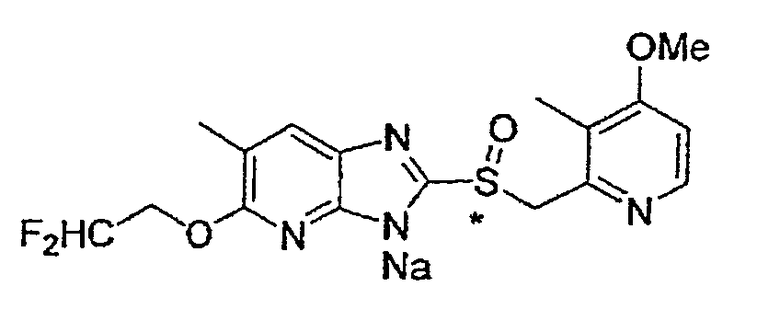
5-(2,2-Дифторэтокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридин в форме оптического изомера с меньшим временем удерживания (125 мг, 0,32 ммоль) растворяют в этаноле (20 мл) и добавляют смешанный раствор 1 н. раствора гидроксида натрия (0,32 мл, 0,32 ммоль) и этанола (5 мл) и реакционную смесь перемешивают 30 минут при комнатной температуре. Остаток, полученный после выпаривания растворителя, растворяют в этаноле и растворитель вновь выпаривают. К полученному остатку добавляют диэтиловый эфир до образования суспензии и растворитель выпаривают, тем самым получают указанное в заголовке соединение (122 мг, 0,29 ммоль) в виде твердого вещества бежевого цвета.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,16 (3H, с), 2,21 (3H, с), 3,84 (3H, с), 4,37 (1H, д, J=13 Гц), 4,55 (2H, дт, J=4,15 Гц), 4,78 (1H, д, J=13 Гц), 6,42 (1H, тт, J=4,55 Гц), 6,93 (1H, д, J=6 Гц), 7,58 (1H, с), 8,28 (1H, д, J=6 Гц).
Пример 9
Натриевая соль оптического изомера с большим временем удерживания, 5-(2,2-дифторэтокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридина
[Формула 39]
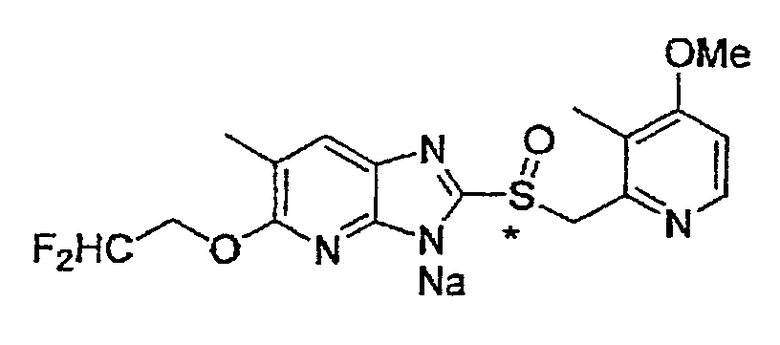
5-(2,2-Дифторэтокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридин в форме оптического изомера с большим временем удерживания (107 г, 0,27 ммоль) растворяют в этаноле (20 мл) и добавляют смешанный раствор 1 н. раствора гидроксида натрия (0,27 мл, 0,27 ммоль) и этанола (5 мл) и реакционную смесь перемешивают 30 минут при комнатной температуре. Остаток, полученный после выпаривания растворителя, растворяют в этаноле и растворитель вновь выпаривают. К полученному остатку добавляют диэтиловый эфир до образования суспензии и растворитель выпаривают, тем самым получают указанное в заголовке соединение (99 мг, 0,24 ммоль) в виде твердого вещества бежевого цвета.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,16 (3H, с), 2,21 (3H, с), 3,84 (3H, с), 4,38 (1H, д, J=13 Гц), 4,55 (2H, дт, J=4,15 Гц), 4,79 (1H, д, J=13 Гц), 6,41 (1H, тт, J=4,55 Гц), 6,92 (1H, д, J=6 Гц), 7,59 (1H, с), 8,28 (1H, д, J=6 Гц).
Пример 10
Натриевая соль 5-(4-фторфенокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-3H-имидазо[4,5-b]пиридина
[Формула 40]
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,15 (3H, с), 3,84 (3H, с), 4,40 (1H, д, J=13 Гц), 4,70 (1H, д, J=13 Гц), 6,59 (1H, д, J=8 Гц), 6,94 (1H, д, J=6 Гц), 6,93-7,11 (2H, м), 7,16-7,21 (2H, м), 7,84 (1H, д, J=8 Гц), 8,29 (1H, д, J=6 Гц).
Пример 11
Натриевая соль 5-(3-фторфенокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-3H-имидазо[4,5-b]пиридина
[Формула 41]
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,14 (3H, с), 3,83 (3H, с), 4,41 (1H, д, J=13 Гц), 4,70 (1H, д, J=13 Гц), 6,63 (1H, д, J=8 Гц), 6,86-6,94 (4H, м), 7,37 (1H, кв, J=8 Гц), 7,86 (1H, д, J=8 Гц), 8,29 (1H, д, J=6 Гц).
Пример 12
Натриевая соль 2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-5-(4-метоксифенокси)-6-метил-3H-имидазо[4,5-b]пиридина
[Формула 42]
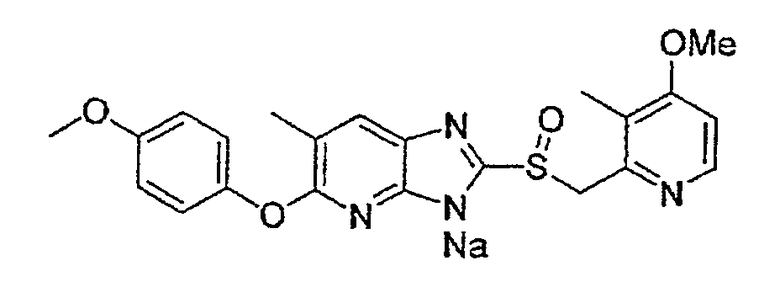
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,14 (3H, с), 2,30 (3H, с), 3,74 (3H, с), 3,84 (3H, с), 4,35 (1H, д, J=13 Гц), 4,74 (1H, д, J=13 Гц), 6,86-6,97 (5H, м), 7,65 (1H, с), 8,28 (1H, д, J=6 Гц).
Пример 13
Натриевая соль 2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-5-(2-феноксиэтокси)-3H-имидазо[4,5-b]пиридина
[Формула 43]
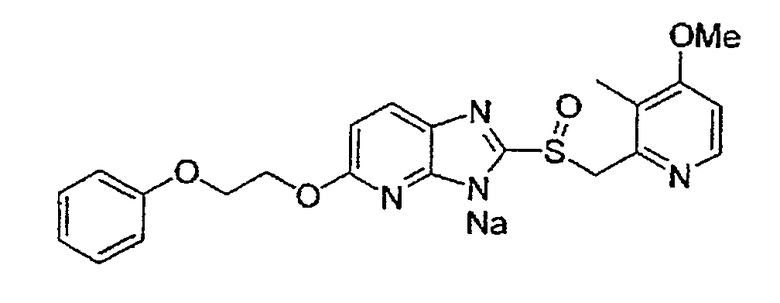
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,18 (3H, с), 3,85 (3H, с), 4,30-4,36 (2H, м), 4,39 (1H, д, J=13 Гц), 4,55-4,62 (2H, м), 4,80 (1H, д, J=13 Гц), 6,38 (1H, д, J=8 Гц), 6,92-6,97 (2H, м), 6,98-7,03 (2H, м), 7,27-7,33 (2H, м), 7,71 (1H, д, J=8 Гц), 8,30 (1H, д, J=6 Гц).
Пример 14
Натриевая соль 5-(2-(4-фторфенил)этокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-3H-имидазо[4,5-b]пиридина
[Формула 44]
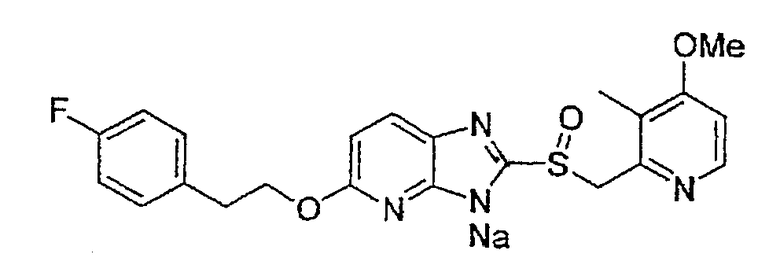
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,17 (3H, с), 3,04 (2H, т, J=7 Гц), 3,85 (3H, с), 4,38 (1H, д, J=13 Гц), 4,44 (2H, т, J=7 Гц), 4,78 (1H, д, J=13 Гц), 6,31 (1H, д, J=8 Гц), 6,94 (1H, д, J=6 Гц), 7,10-7,17 (2H, м), 7,33-7,39 (2H, м), 7,68 (1H, д, J=8 Гц), 8,30 (1H, д, J=6 Гц).
Пример 15
Натриевая соль 2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-5-(2-фенилпропокси)-3H-имидазо[4,5-b]пиридина
[Формула 45]
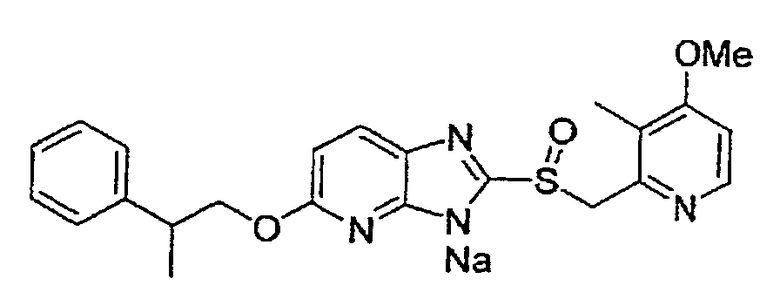
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 1,30 (3H, д, J=7 Гц), 2,15 (3H, с), 3,18-3,28 (1H, м), 3,38 (3H, с), 4,25-4,40 (2H, м), 4,37 (1H, д, J=13 Гц), 4,75 (1H, д, J=13 Гц), 6,27 (1H, д, J=8 Гц), 6,92 (1H, д, J=6 Гц), 7,17-7,23 (1H, м), 7,28-7,34 (4H, м), 7,64 (1H, д, J=8 Гц), 8,28 (1H, д, J=6 Гц).
Пример 16
Натриевая соль 5-(2,2-дифторэтокси)-6-этил-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-3H-имидазо[4,5-b]пиридина
[Формула 46]
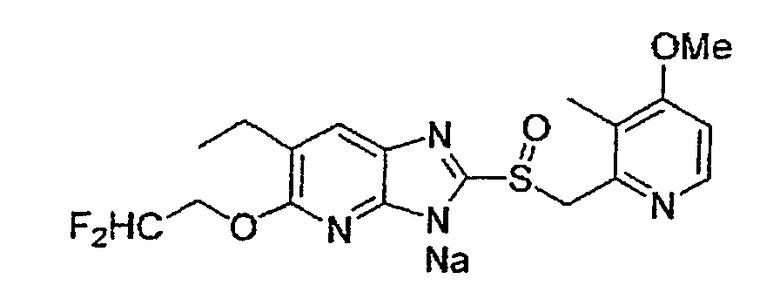
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 1,17 (3H, т, J=7 Гц), 2,17 (3H, с), 2,60 (2H, кв, J=7 Гц), 3,84 (3H, с), 4,37 (1H, д, J=13 Гц), 4,51-4,60 (2H, м), 4,76 (1H, д, J=13 Гц), 6,41 (1H, тт, J=4,55 Гц), 6,93 (1H, д, J=6 Гц), 7,58 (1H, с), 8,28 (1H, д, J=6 Гц).
Пример 17
Натриевая соль 5-(2,2-дифторэтокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-пропил-3H-имидазо[4,5-b]пиридина
[Формула 47]
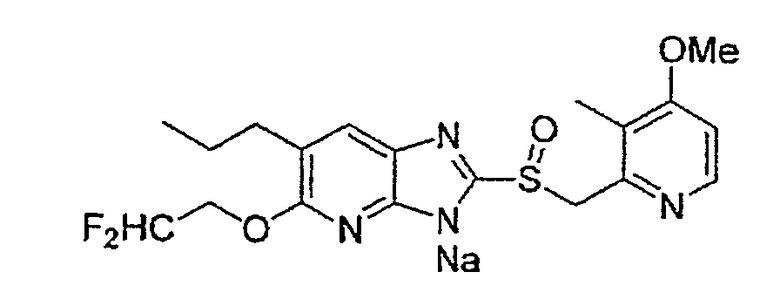
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 0,90 (3H, т, J=7 Гц), 1,59 (2H, с, J=7 Гц), 2,17 (3H, с), 2,57 (2H, т, J=7 Гц), 3,84 (3H, с), 4,37 (1H, д, J=13 Гц), 4,55 (2H, дт, J=4,15 Гц), 4,76 (1H, д, J=13 Гц), 6,40 (1H, тт, J=4,55 Гц), 6,93 (1H, д, J=6 Гц), 7,56 (1H, с), 8,29 (1H, д, J=6 Гц).
Пример 18
Натриевая соль 2-(((3-этил-4-метокси-2-пиридинил)метил)сульфинил)-(5-метокси-6-метил-3H-имидазо[4,5-b]пиридина
[Формула 48]
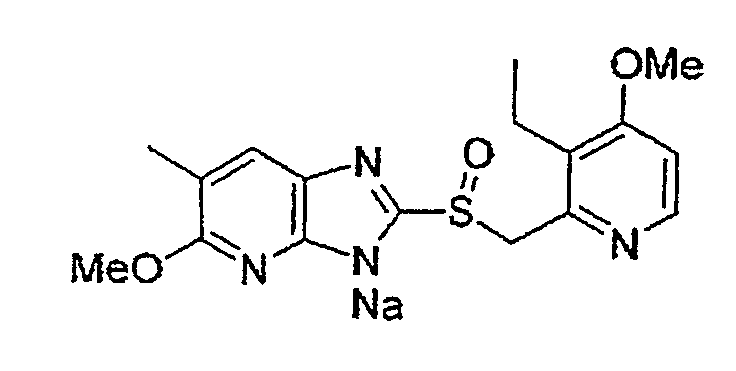
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 1,07 (3H, т, J=8 Гц), 2,18 (3H, с), 2,60-2,83 (2H, м), 3,86 (6H, с), 4,33 (1H, д, J=13 Гц), 4,76 (1H, д, J=13 Гц), 6,96 (1H, д, J=6 Гц), 7,54 (1H,с), 8,32 (1H, д, J=6 Гц).
Пример 19
Натриевая соль 5-(2-бутинилокси)-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридина
[Формула 49]
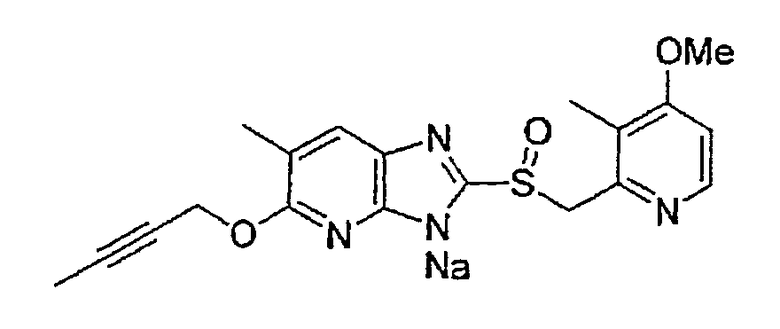
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 1,03 (3H, т, J=2 Гц), 2,17 (3H, с), 2,19 (3H, с), 3,85 (3H, с), 4,36 (1H, д, J=13 Гц), 4,80 (1H, д, J=13 Гц), 4,93 (2H, кв, J=2 Гц), 6,93 (1H, д, J=6 Гц), 7,55 (1H, с), 8,29 (1H, д, J=6 Гц).
Пример 20
Натриевая соль 2-[[(4-метокси-3-метил-2-пиридинил)метил]сульфинил]-5-(3-пентинилокси)-3H-имидазо[4,5-b]пиридина
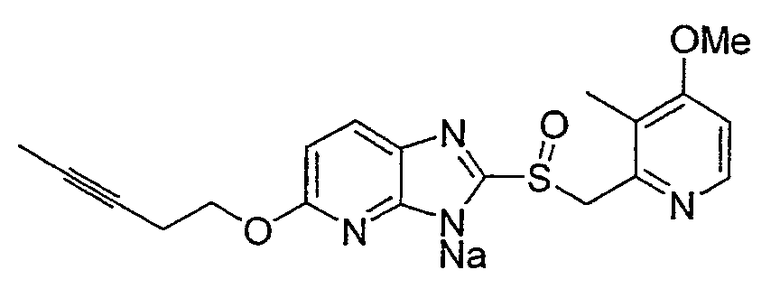
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 1,76 (3H, т, J=2 Гц), 2,16 (3H, с), 2,52-2,62 (2H, м), 3,84 (3H, с), 4,28 (2H, т, J=7 Гц), 4,38 (1H, д, J=13 Гц), 4,75 (1H, д, J=13 Гц), 6,32 (1H, д, J=8 Гц), 6,93 (1H, д, J=6 Гц), 7,67 (1H, д, J=8 Гц), 8,28 (1H, д, J=6 Гц).
Пример 21
Натриевая соль 5-этокси-2-[[(4-метокси-3-метил-2-пиридинил)метил]сульфинил]-6-метил-3H-имидазо[4,5-b]пиридина
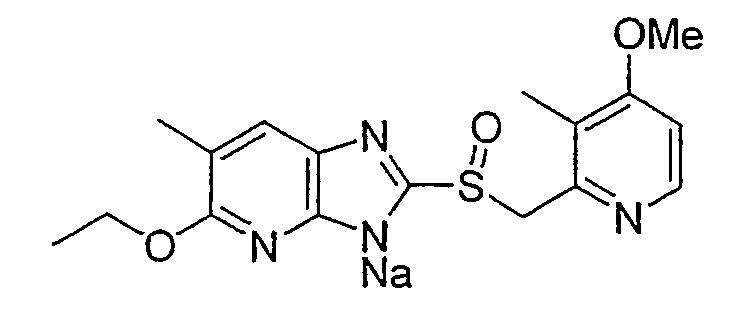
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 1,34 (3Н, т, J=7 Гц), 2,16 (3Н, с), 2,17 (3Н, с), 3,85 (3Н, с), 4,31 (2Н, кв, J=7 Гц), 4,37 (1Н, д, J=13 Гц), 4,78 (1Н, д, J=13 Гц), 6,94 (1Н, д, J=6 Гц), 7,52 (1Н, с), 8,30 (1Н, д, J=6 гц).
Пример 22
Натриевая соль 5-изопропокси-2-[[(4-метокси-3-метил-2-пиридинил)метил]сульфинил]-6-метил-3H-имидазо[4,5-b]пиридина
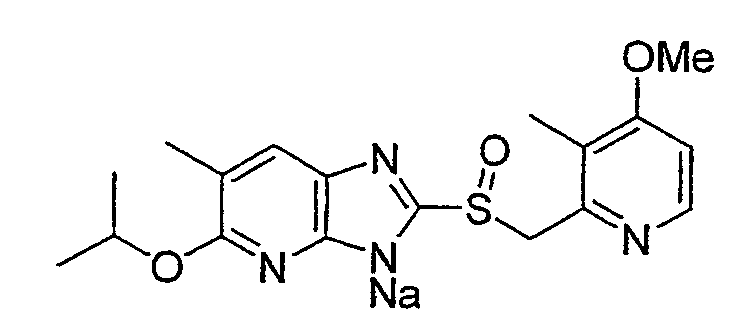
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 1,29 (6H, д, J=6 Гц), 2,13 (3H, с), 2,15 (3H, с), 3,83 (3H, с), 4,35 (1H, д, J=13 Гц), 4,77 (1H, д, J=13 Гц), 5,27 (1H, гепт, J=6 Гц), 6,92 (1H, д, J=6 Гц), 7,49 (1H, с), 8,28 (1H, д, J=6 Гц).
Пример 23
Натриевая соль 5-(циклопропилметокси)-2-[[(4-метокси-3-метил-2-пиридинил)метил]сульфинил]-6-метил-3H-имидазо[4,5b]пиридина
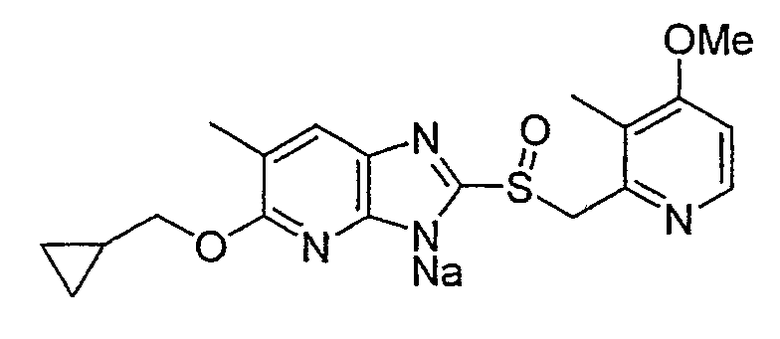
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 0,32-0,36 (2H, м), 0,51-0,56 (2H, м), 1,24-1,34 (1H, м), 2,16 (3H, с), 2,20 (3H, с), 3,84 (3H, с), 4,12 (2H, д, J=7 Гц), 4,38 (1H, д, J=13 Гц), 4,80 (1H, д, J=13 Гц), 6,93 (1H, д, J=6 Гц), 7,53 (1H, с), 8,29 (1H, д, J=6 Гц).
Пример 24
Натриевая соль 5-(2-бутинилокси)-2-[[(4-метокси-3-метил-2-пиридинил)метил]сульфинил]-3H-имидазо[4,5-b]пиридина
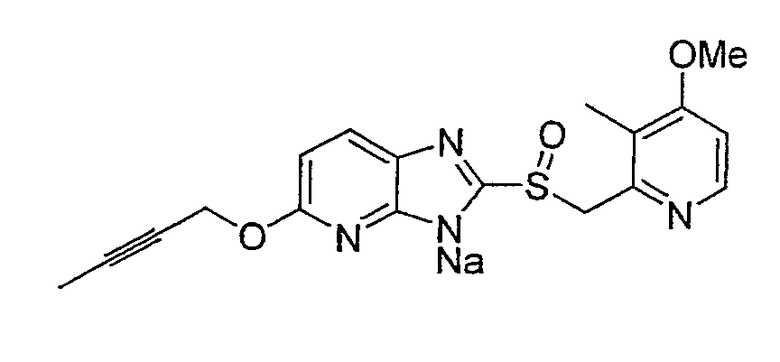
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 1,81 (3H, т, J=2 Гц), 2,15 (3H, с), 3,83 (3H, с), 4,36 (1H, д, J=13 Гц), 4,76 (1H, д, J=13 Гц), 4,85-4,90 (2H, м), 6,34 (1H, д, J=8 Гц), 6,93 (1H, д, J=6 Гц), 7,69 (1H, д, J=8 Гц), 8,28 (1H, д, J=6 Гц).
Пример 25
Натриевая соль 2-[[(4-метокси-3-метил-2-пиридинил)метил]сульфинил]-5-метокси-6-метил-3H-имидазо[4,5-b]пиридина
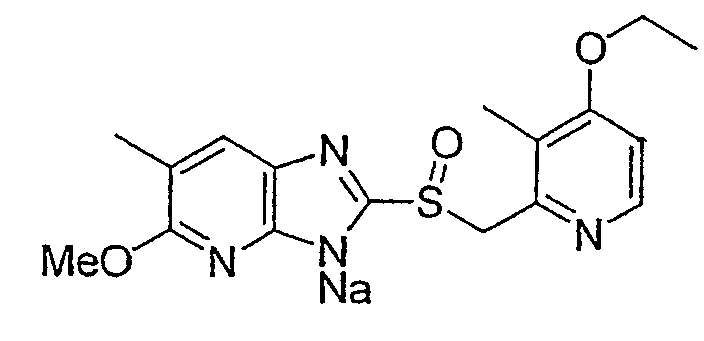
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 1,36 (3H, т, J=7 Гц), 2,16 (3H, с), 2,18 (3H, с), 3,86 (3H, с), 4,10 (2H, кв, J=7 Гц), 4,37 (1H, д, J=13 Гц), 4,78 (1H, д, J=13 Гц), 6,91 (1H, д, J=6 Гц), 7,53 (1H, с), 8,27 (1H, д, J=6 Гц).
Пример 26
Натриевая соль 2-[[(4-метокси-3-метил-2-пиридинил)метил]сульфинил]-6-метил-5-(2-фторэтокси)-3H-имидазо[4,5-b]пиридина
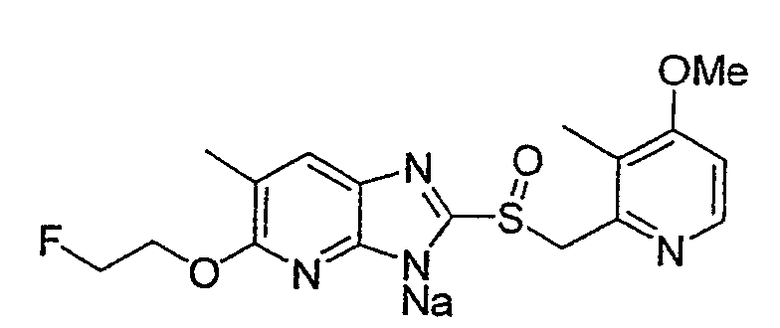
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,16 (3H, с), 2,20 (3H, с), 3,84 (3H, с), 4,37 (1H, д, J=13 Гц), 4,46-4,50 (1H, м), 4,54-4,58 (1H, м), 4,70-4,74 (1H, м), 4,79 (1H, д, J=13 Гц), 4,82-4,86 (1H, м), 6,93 (1H, д, J=5 Гц), 7,56 (1H, с), 8,29 (1H, д, J=5 Гц).
Пример 27
Натриевая соль 2-[[(4-метокси-3-метил-2-пиридинил)метил]сульфинил]-6-метил-5-пропокси-3H-имидазо[4,5-b]пиридина
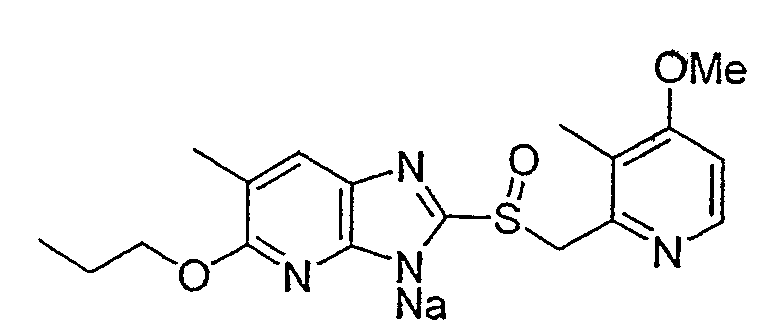
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 1,00 (3H, т, J=7 Гц), 1,71-1,79 (2H, м), 2,16 (3H, с), 2,18 (3H, с), 3,84 (3H, с), 4,22 (2H, т, J=7 Гц), 4,37 (1H, д, J=13 Гц), 4,80 (1H, д, J=13 Гц), 6,93 (1H, д, J=6 Гц), 7,52 (1H, с), 8,29 (1H, д, J=6 Гц).
Пример 28
Натриевая соль 5-изобутокси-2-[[(4-метокси-3-метил-2-пиридинил)метил]сульфинил]-6-метил-3H-имидазо[4,5-b]пиридина
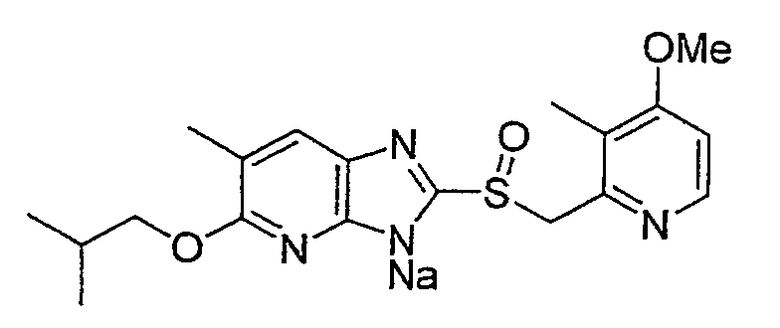
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 1,01 (6H, д, J=7 Гц), 2,01-2,12 (1H, м), 2,16 (3H, с), 2,19 (3H, с), 3,85 (3H, с), 4,04 (2H, д, J=7 Гц), 4,37 (1H, д, J=13 Гц), 4,81 (1H, д, J=13 Гц), 6,93 (1H, д, J=5 Гц), 7,52 (1H, д, J=1 Гц), 8,29 (1H, д, J=5 Гц).
Пример 29
Натриевая соль 5-(циклогексилокси)-2-[[(4-метокси-3-метил-2-пиридинил)метил]сульфинил]-6-метил-3H-имидазо[4,5b]пиридина
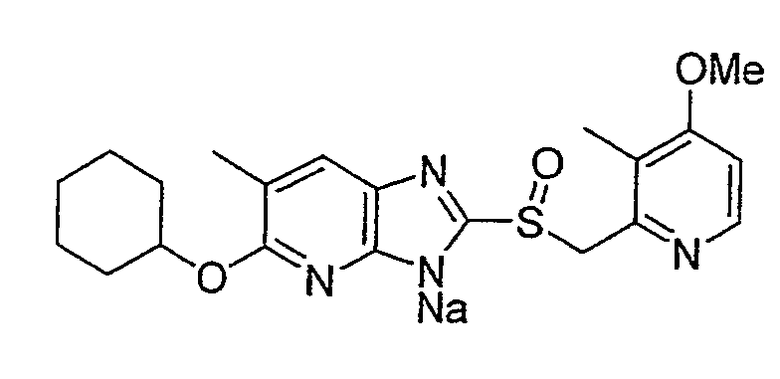
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 1,29-1,59 (6H, м), 1,70-1,79 (2H, м), 1,91-2,00 (2H, м), 2,17 (3H, с), 2,17 (3H, д, J=1 Гц), 3,85 (6H, с), 4,38 (1H, д, J=13 Гц), 4,81 (1H, д, J=13 Гц), 5,04-5,12 (1H, м), 6,93 (1H, д, J=6 Гц), 7,53 (1H, д, J=1 Гц), 8,29 (1H, д, J=6 Гц).
Препаративный пример 1
6-Метокси-3-нитро-2-пиридинамин
[Формула 50]
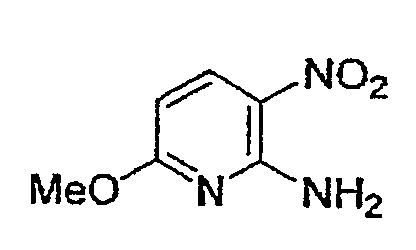
Раствор 2-хлор-6-метокси-3-нитропиридина (25,3 г, 0,134 моль) и концентрированного водного раствор аммиака (70 мл) в N,N-диметилформамиде (200 мл) перемешивают при 70°C в течение 4 часов и 15 минут. Реакционную смесь охлаждают до комнатной температуры и затем разбавляют водой. Образовавшийся осадок собирают фильтрованием, получая указанное в заголовке соединение (16,8 г, 99,2 ммоль, 74,0%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 3,90 (3H, с), 6,16 (1H, д, J=9 Гц), 8,16 (2H, ушир.с), 8,26 (1H, д, J=9 Гц).
Препаративный пример 2
5-Иод-6-метокси-3-нитро-2-пиридинамин
[Формула 51]
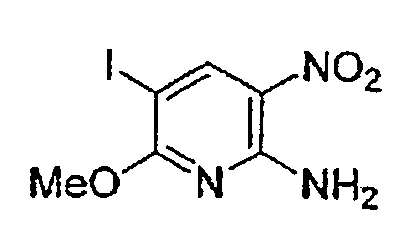
Суспензию 6-метокси-3-нитро-2-пиридинамина (14,6 г, 86,4 ммоль) и N-иодсукцинимида (29,2 г, 130 ммоль) в уксусной кислоте (280 мл) перемешивают при комнатной температуре 21 час и 30 минут. Реакционную смесь концентрируют и остаток растворяют в этилацетате и 0,5 н. гидроксиде натрия. Этилацетатный слой промывают насыщенным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют. Остаток суспендируют в гексане и образовавшийся осадок фильтруют и промывают гексаном, тем самым получая указанное в заголовке соединение (25,2 г, 85,5 ммоль, 98,9%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 3,91 (3H, с), 8,20 (2H, ушир.с), 8,54 (1H, с).
Препаративный пример 3
6-Метокси-5-метил-3-нитро-2-пиридинамин
[Формула 52]
Смесь 5-иод-6-метокси-3-нитро-2-пиридинамина (1,03 г, 3,49 ммоль), триметилбороксина (456 мг, 3,63 ммоль), карбоната цезия (3,56 г, 10,9 ммоль), тетракис(трифенилфосфин)палладия(0) (412 мг, 0,357 ммоль) и N,N-диметилформамида (10 мл) перемешивают при 90°C в атмосфере азота. Спустя 2 часа и 30 минут добавляют триметилбороксин (500 мкл, 3,58 ммоль) и реакционную смесь дополнительно перемешивают в тех же самых условиях 5 часов и 30 минут. Реакционную смесь охлаждают до комнатной температуры и затем разбавляют этилацетатом и водой. Нерастворимое вещество отделяют фильтрованием, органический слой фильтрата промывают 3 раза насыщенным раствором хлорида аммония, сушат над безводным сульфатом натрия, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (силикагель: 40 г, элюирующий растворитель: гептан, смесь гептан/этилацетат = 90/10), получая указанное в заголовке соединение (350 мг, 1,91 ммоль, 54,8%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСO-d6) δ м.д.; 2,03 (3H, с), 3,93 (3H, с), 8,02 (2H, ушир.с), 8,11 (1H, с).
Пример испытания 1
<Ингибирующие действия на секрецию кислоты желудочного сока, на крысах>
Используют самцов SD-крыс, в возрасте семи недель, которых не кормят за день до начала эксперимента. Выполняют лапаротомию крыс по срединной линии, под анестезией диэтиловым эфиром, и лигируют привратник. Испытуемые соединения растворяют или суспендируют в 0,5% растворе метилцеллюлозы (растворитель), получая концентрацию 5 мг/мл. Гистамин растворяют в насыщенном растворе соли (растворитель), получая концентрацию 10 мг/мл. 0,5% Раствор метилцеллюлозы или раствор испытуемого соединения (10 мг/кг) объемом 0,2 мл на 100 г массы тела впрыскивают в двенадцатиперстную кишку во время лигирования и затем вводят подкожно раствор гистамина (20 мг/кг) объемом 0,2 мл на 100 г массы тела. После чего живот зашивают.
Спустя восемь часов после введения растворителя или испытуемого соединения крыс умерщвляют и желудок изолируют для измерения объема желудочного сока. После определения объема желудочного сока измеряют концентрацию кислоты, используя 0,25 мл желудочного сока, путем титрования против 0,04 моль/л раствора NaOH до pH 7,0. Выброс кислоты рассчитывают как (объем желудочного сока) × (концентрация кислоты). Степень ингибирования (%) рассчитывают по приведенной ниже формуле. Результаты представлены в таблице 1. Число животных в каждой экспериментальной группе равно четырем.
Степень ингибирования (%) = 100×(A-B)/A
A: выброс кислоты в группе с введенным растворителем
B: выброс кислоты в группе с введенным испытуемым соединением
Пример испытания 2
<Оценка генной индукции цитохрома P450 (CYP) в замороженных гепатоцитах человека>
Замороженные гепатоциты человека, полученные от In Vitro Technology, быстро размораживают при 37°C.
Затем к гепатоцитам постепенно добавляют охлажденную льдом среду Уильяма E (WE), пополненную 10% FCS, пенициллином (100 Ед/мл), стрептомицином (100 мкг/мл) и глутамином (2 мМ) (WE-среду), клетки центрифугируют при 500 об/мин в течение 5 мин при 4°C. Супернатант удаляют, и клетки ресуспендируют в WE-среде, получая концентрацию 5×105 клетки/мл. Клетки высевают на покрытые коллагеном 48-луночные планшеты (1×105 клетки/см2) и культивируют при 37°C и 5% CО2 около 24 час.
Среду заменяют Hepato-STIM (торговая марка, BD Biosciences), пополненной EGF, пенициллином (100 Ед/мл), стрептомицином (100 мкг/мл) и глутамином (2 мМ) (HS-средой), и клетки культивируют около 24 час. Приблизительно через 48 час после посева культуры клетки обрабатывают испытуемым соединением и β-нафтофлавоном (β-NF, положительный контроль на CYP1A1 и CYP1A2 человека, SIGMA), полученным с применением HS-среды приблизительно за 48 час. Среду меняют ежедневно. Конечная концентрация β-NF составляет 10 M. Все соединения растворяют в диметилсульфоксиде (ДМСО, Wako), получая конечную концентрацию в растворителе 0,1% (о/о). К клеткам контроля добавляют HS-среду, содержащую 0,1% ДМСО.
После 48-часовой выдержки клетки однократно промывают, используя PBS, и суммарную РНК очищают, применяя мининабор Qiagen RNeasy (Qiagen) согласно инструкции производителя. Очищенную суммарную РНК затем используют в качестве матрицы для первичного синтеза тяжевой кДНК. Для реакции обратной транскрипции (RT) используют Oligo dT. RT-реакцию осуществляют с применением реагентов для обратной транскрипции TaqMan (Applied Biosystems) при 25°C в течение 10 мин и последующем 60-минутным взаимодействии при 48°C, после чего фермент инактивируют при 95°C в течение 5 мин в системе Gene Amp PCR System 9700. Полученную кДНК подвергают полимеразной цепной реакции (PCR) в системе ABI7700 Sequence Detection System (Applied Biosystems). Для анализов на мРНК CYP1A1 и GAPDH используют набор реагентов SYBR Green PCR Core Reagents kit (Applied Biosystems) и мРНК CYP1A2 определяют количественно, используя набор реагентов TaqMan PCR Core Reagents kit (Applied Biosystems). Прямой (F) и обратный (R) праймеры для анализа каждой мРНК и используемые PCR-условия приведены в таблицах 2 и 3-5 соответственно.
Таблица 2

PCR-условия
GAPDH
GYP1A1
GYP1A2
<Анализ полученных данных>
Анализ полученных данных осуществляют следующим образом. Количество мРНК CYP1A1 или CYP1A2 делят на количество GAPDH. Затем рассчитывают соотношение (кратность) значений, полученных для испытуемых соединений (X) и положительного контроля (P) по сравнению с контролем. Индукционную эффективность испытуемого соединения (%) находят по следующему уравнению:
Индукционная эффективность испытуемого соединения (%)=100×(X-1)/(P-1)
<Результаты>
В примере испытания 2, для определения CYP-индукции в печени, представляющей одну из проблем в разработке нового лекарственного средства, изучают индукцию мРНК изоферментов CYP1A, используя замороженные гепатоциты человека. В результате установлено, что испытуемое соединение характеризуется слабой индукционной эффективностью, составляющей менее 12% при 3 мкМ и менее 30% при 10 мкМ по сравнению с положительным контролем (100%).
Каждое значение в таблице 6 соответствует % от положительного контроля (100%). Цифры в круглых скобках соответствуют кратной индукции положительного контроля по сравнению с контролем.
Промышленная применимость
Поскольку соединение по настоящему изобретению обладает улучшенной ингибирующей активностью секреции кислоты желудочного сока, большей безопасностью и более подходящей физико-химической устойчивостью, указанное соединение может служить в качестве лекарственного средства, в особенности полезного от вызываемых кислотой заболеваний.
[Список последовательностей]
SEQ ID No:1: Праймер F
SEQ ID No:2: Праймер R
SEQ ID No:3: Праймер F
SEQ ID No:4: Праймер R
SEQ ID No:5: Зонд (FAM/TAMRA)
SEQ ID No:6: Праймер F
SEQ ID No:7: Праймер R

| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ БЕНЗИМИДАЗОЛА | 2006 |
|
RU2409573C2 |
| НОВОЕ ПРОИЗВОДНОЕ КУМАРИНА, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2428420C2 |
| ПРОИЗВОДНОЕ ПИРАЗОЛА, ПРИГОДНОЕ В КАЧЕСТВЕ ИНГИБИТОРА РI3К | 2016 |
|
RU2710549C2 |
| ПИРИДИЛОКСИ ПРОИЗВОДНЫЕ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ АКТИВАТОРА/МОДУЛЯТОРА ГАММА-РЕЦЕПТОРА, АКТИВИРУЕМОГО ПРОЛИФЕРАТОРОМ ПЕРОКСИСОМ (PPAR) ГАММА | 2010 |
|
RU2480463C1 |
| БЕНЗИМИДАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2456276C2 |
| ПРОЛЕКАРСТВО ПРОИЗВОДНОГО АМИНОКИСЛОТЫ | 2017 |
|
RU2739318C2 |
| ИНДАЗОЛЬНЫЕ ИНГИБИТОРЫ СИГНАЛЬНОГО ПУТИ WNT И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2017 |
|
RU2682245C1 |
| ИНДАЗОЛЬНЫЕ ИНГИБИТОРЫ СИГНАЛЬНОГО ПУТИ WNT И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2013 |
|
RU2638932C2 |
| СОЕДИНЕНИЯ ДЛЯ ИНГИБИРОВАНИЯ КИНАЗЫ EGFR, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2020 |
|
RU2832925C2 |
| 1Н-ПИРАЗОЛО[3,4-B]ПИРИДИНЫ И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2013 |
|
RU2689141C2 |
Изобретение относится к органической химии, а именно к 5-метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридину или к его соли, а также к фармацевтической композиции, ингибирующей секрецию кислоты желудочного сока, на его основе. Технический результат - получение нового соединения и фармацевтической композиции на его основе, которая может найти применение в медицине для лечения таких заболеваний, как язва желудка, язва двенадцатиперстной кишки, пептическая язва анастомоза, гастроэзофагеальный рефлюкс, синдром Золлингера-Эллисона, симптоматический гастроэзофагеальный рефлюкс, эндоскопически-негативный гастроэзофагеальный рефлюкс, гастроэзофагеальная регургитация, глоточно-гортанная парестезия, пищевод Барретта, язва, вызванная приемом нестероидного противовоспалительного лекарственного средства (NSAID), гастрит, желудочное кровотечение, желудочно-кишечное кровотечение, пептическая язва, кровоточащая язва, стрессовая язва, желудочная гиперхлоргидрия, диспепсия, гастропарез, сенильная язва, неустранимая язва, изжога, бруксизм, боль в желудке, тяжесть в желудке или эрозивный гастрит. 2 н. и 5 з.п. ф-лы, 6 табл.
1. 5-Метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3Н-имидазо[4,5-b]пиридин
или его соль.
2. Соединение или его соль по п.1, представляющее собой натриевую соль 5-метокси-2-(((4-метокси-3-метил-2-пиридинил)метил)сульфинил)-6-метил-3H-имидазо[4,5-b]пиридина.
3. Фармацевтическая композиция, ингибирующая секрецию кислоты желудочного сока, содержащая соединение по п.1, либо соль указанного соединения и фармацевтически приемлемый носитель.
4. Фармацевтическая композиция по п.3, представляющая собой средство для лечения таких болезней, как язва желудка, язва двенадцатиперстной кишки, пептическая язва анастомоза, гастроэзофагеальный рефлюкс, синдром Золлингера-Эллисона, симптоматический гастроэзофагеальный рефлюкс, эндоскопически негативный гастроэзофагеальный рефлюкс, гастроэзофагеальная регургитация, глоточно-гортанная парестезия, пищевод Барретта, язва, вызванная приемом нестероидного противовоспалительного лекарственного средства (NSAID), гастрит, желудочное кровотечение, желудочно-кишечное кровотечение, пептическая язва, кровоточащая язва, стрессовая язва, желудочная гиперхлоргидрия, диспепсия, гастропарез, сенильная язва, неустранимая язва, изжога, бруксизм, боль в желудке, тяжесть в желудке или эрозивный гастрит.
5. Фармацевтическая композиция по п.3, представляющая собой средство для лечения таких болезней, как язва желудка, язва двенадцатиперстной кишки, пептическая язва анастомоза, гастроэзофагеальный рефлюкс, синдром Золлингера-Эллисона или симптоматический гастроэзофагеальный рефлюкс.
6. Фармацевтическая композиция по п.3, представляющая собой средство для лечения таких болезней, как гастроэзофагеальный рефлюкс или симптоматический гастроэзофагеальный рефлюкс.
7. Фармацевтическая композиция по п.3, представляющая собой средство для лечения таких болезней, как язва желудка или язва двенадцатиперстной кишки.
| Приспособление для подготовки стопки книг к ручному обвязыванию | 1935 |
|
SU50037A1 |
| 0 |
|
SU254588A1 | |
| JP 1190682 A, 31.07.1989 | |||
| ТИОПИРИДИНЫ ДЛЯ БОРЬБЫ С БАКТЕРИЯМИ HELICOBAKTER | 1995 |
|
RU2142459C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗО[1,2-А]ПИРИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ИХ ОСНОВЕ, СПОСОБ ИНГИБИРОВАНИЯ СЕКРЕЦИИ ЖЕЛУДОЧНОЙ КИСЛОТЫ, СПОСОБ ЛЕЧЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНЫХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ И СПОСОБ ЛЕЧЕНИЯ СОСТОЯНИЙ, В КОТОРЫЕ ВОВЛЕЧЕНО ИНФИЦИРОВАНИЕ H.PYLORI | 1998 |
|
RU2193036C2 |
Авторы
Даты
2009-11-20—Публикация
2005-04-21—Подача