Область техники, к которой относится изобретение
Настоящее изобретение относится к лекарственному средству, в частности новому конденсированному бициклическому гетероарильному соединению или его фармакологически приемлемлемой соли, которое обладает гипогликемическим эффектом или лечит и/или предупреждает нарушение метаболизма углеводородов или липидов или заболевание, опосредованное рецептором, активируемым пероксисомным пролифератором (PPAR)γ.
Настоящее изобретение относится также к терапевтическому и/или профилактическому средству против диабета (в частности, диабета типа II), гипергликемии, гиперлипидемии, ожирения, нарушенной толерантности к глюкозе, инсулинорезистентности, нарушенной толерантности к глюкозе натощак, кахексии, псориаза, диабетических осложнений, артериосклероза, атеросклероза, гипертензии, панкреатита, синдрома поликистоза яичников, жировой дистрофии печени (жирная печень), неалкогольного стеатогепатита (NASH), гестационного сахарного диабета, воспалительного заболевания, рака, остеопороза, инволюционного остеопороза, нейродегенеративного заболевания, болезни Альцгеймера, гиперурекимии, метаболического синдрома или тому подобного, которое обладает эффектом улучшения метаболизма углеводов или липидов, эффектом улучшения инсулинорезистентности, противовоспалительным эффектом или эффектом ингибирования роста раковых клеток, терапевтическому средству и/или профилактическому средству, содержащему новое конденсированное бициклическое гетероарильное соединение или его фармакологически приемлемую соль в качестве активного компонента.
Предпосылки создания изобретения
В последние годы число пациентов с метаболическим синдромом, таким как диабет типа II, гиперинсулинемия, дислипидемия, ожирение, гипертензия или атеросклеротическое заболевание, увеличивалось по всему миру по таким причинам, как изменения стиля жизни. Пациенты с метаболическим синдромом подвержены многократно повышенному риску болезни коронарных артерий, церебрального инфаркта и внутримозгового кровоизлияния, а также хроническим осложнениям, таким как нефропатия, нейропатия и ретинопатия. Увеличение числа пациентов с осложнениями было основной причиной роста затрат на лечение (непатентный документ 1).
Последние исследования показали, что лиганды, действующие на PPARγ, полезны для предупреждения или ослабления симптомов патологии, вызываемой метаболическим синдромом, таким как диабет типа II, гиперинсулинемия, дислипидемия, ожирение, гипертензия, атеросклеротическое заболевание или инсулинорезистентность (непатентный документ 2). Лиганды, действующие на PPARγ, ингибируют продукцию воспалительных цитокинов (непатентные документы 3 и 4) и, индуцируя апоптоз, ингибируют рост раковых клеток (непатентный документ 5). Таким образом, лиганды полезны также для предупреждения или ослабления симптомов воспалительного заболевания или рака. Конкретные примеры лигандов, действующих на PPARγ, включают пиоглитазон (непатентный документ 6) и розиглитазон (непатентный документ 7), входящие в класс тиазолидиндионовых лекарственных средств, уже используемых в медицине для лечения диабета типа II. Указанные тиазолидиндионовые лекарственные средства имеют побочные эффекты, такие как удерживание жидкости, увеличение массы тела и увеличение рисков заболевания сердца. Следовательно, существовала потребность в разработке безопасных фармацевтических препаратов (патентный документ 1). Многие исследователи занимаются сейчас исследованиями и разработкой фармацевтических препаратов с целью предотвратить инсулинорезистентность, заболевания, вызываемые воспалением или тому подобным, или метаболический синдром или улучшить их симптоматику путем выявления лигандов, активирующих или ингибирующих PPARα, PPARγ или PPARδ (непатентный документ 8).
Непатентный документ 1: Annual Reports in Medicinal Chemistry, 39, 41-56 (2004).
Непатентный документ 2: Annual Reviews of Medicine, 53, 409-435 (2002).
Непатентный документ 3: Nature, 391, 79-82 (1998).
Непатентный документ 4: Nature, 391, 82-86 (1998).
Непатентный документ 5: Biochemical and Biophysical Research Communications, 270, 400-405 (2000).
Непатентный документ 6: Chem. Pharm. Bull., 39, 1440-1445 (1991).
Непатентный документ 7: Bioorganic and Medicinal Chemistry Letter, 4, 1181-1184 (1994).
Патентный документ 1: WO 2004/014308.
Непатентный документ 8: Annual Report in Medicinal Chemistry, 38, 71-80 (2003).
Раскрытие сущности изобретения
Проблемы, решаемые изобретением
Авторы настоящего изобретения провели обширные исследования по созданию терапевтических и/или профилактических средств против нарушений метаболизма углеводов или липидов или заболеваний, опосредованных рецептором, активируемым пероксисомным пролифератором (PPAR) γ. В результате авторы обнаружили, что конденсированные бициклические гетероарильные соединения, имеющие определенную химическую структуру, обладают превосходным гипогликемическим эффектом или обладают эффектом улучшения метаболизма углеводов или липидов, эффектом ослабления симптомов инсулинорезистентности или эффектом ослабления симптомов так называемого метаболического синдрома, такого как артериосклероз, гипертензия, сердечно-сосудистое нарушение или их осложнения, или патологии, вызываемой различными воспалениями. Авторы обнаружили также, что указанные соединения являются лигандами, действующими на PPARγ, и поэтому обладают эффектом ингибирования роста раковых клеток. Указанные результаты исследований привели к созданию настоящего изобретения.
В частности, в соответствии с настоящим изобретением предлагаются новые конденсированные бициклические гетероарильные соединения или их фармакологически приемлемые соли, которые полезны в качестве терапевтических или профилактических средств против метаболического синдрома, в частности заболеваний, таких как диабет (в частности, диабет типа II), гипергликемия, гиперлипидемия, ожирение, нарушенная толерантность к глюкозе (IGT), инсулинорезистентность, нарушенная толерантность к глюкозе натощак (IFG), гипертензия, жирная печень, неалкогольный стеатогепатит (NASH), диабетические осложнения (такие как ретинопатия, нефропатия или нейропатия), артериосклероз, гестационный сахарный диабет (GDM) или синдром поликистоза яичников (PCOS), воспалительного заболевания (такого как остеоартрит, боль или воспалительный энтерит), акне, солнечной эритемы, псориаза, экземы, аллергического заболевания, астмы, пептической язвы, язвенного колита, болезни Крона, болезни коронарных артерий, артериосклероза, атеросклероза, диабетической ретинопатии, диабетической макулопатии, макулярного отека, диабетической нефропатии, ишемической болезни сердца, цереброваскулярного нарушения, нарушения периферического кровообращения, аутоиммунного заболевания (такого как системная красная волчанка, хронический ревматизм, синдром Шегрена, системный склероз, смешанная соединительнотканая болезнь, болезнь Хашимото, болезнь Крона, язвенный колит, идеопатическая болезнь Аддисона, мужское бесплодие, синдром Гудпасчера, быстро прогрессирующий гломерулонефрит, тяжелая псевдопаралитическая миастения, полимиозит, рассеянный склероз, аутоиммунная гемолитическая анемия, идиопатическая тромбоцитопеническая пурпура, болезнь Бехчета или CREST синдром), панкреатита, кахексии, рака (такого как рак желудка, рак легкого, рак молочной железы, рак толстой кишки, рак предстательной железы, рак поджелудочной железы или рак печени), лейкоза, саркомы (такой как липосаркома), остеопороза, инволюционного остеопороза, нейродегенеративного заболевания, болезни Альцгеймера, гиперурикемии, сухих глаз или тому подобного.
Средства для решения проблемы
Настоящее изобретение относится к
(1) Соединению общей формулы (I):
[Формула 1]
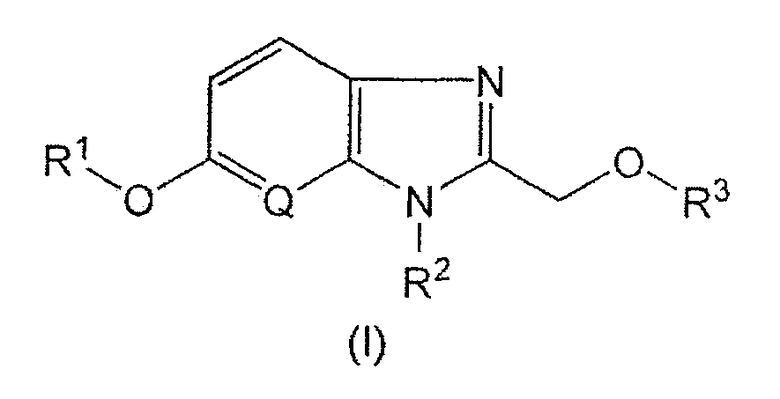
[где R1 представляет собой C1-C6 алкильную группу, C6-C10 арильную группу, которая может быть замещенной 1-5 группами, независимо выбранными из группы заместителей (a), гетероциклическую группу, которая может быть замещенной 1-3 группами, независимо выбранными из группы заместителей (a), или C3-C6 циклоалкильную группу,
R2 представляет собой C1-C6 алкильную группу,
R3 представляет собой C6-C10 арильную группу, которая может быть замещенной 1-5 группами, независимо выбранными из группы заместителей (a), или гетероциклическую группу, которая может быть замещенной 1-3 группами, независимо выбранными из группы заместителей (a),
Q представляет собой группу, представленную формулой =CH-, или атом азота и
группа заместителей (a) представляет собой группу, состоящую из атома галогена, C1-C6 алкильной группы, C1-C6 гидроксиалкильной группы, C1-C6 галогенированной алкильной группы, карбоксильной группы, карбамоильной группы, C2-C7 алкилкарбонильной группы, C2-C7 алкоксикарбонильной группы, гидроксигруппы, C1-C6 алкоксигруппы, C1-C6 галогенированной алкоксигруппы, C2-C7 алкилкарбонилоксигруппы, C2-C7 алкоксикарбонилоксигруппы, аминогруппы, C2-C7 алкилкарбониламиногруппы, C2-C7 алкоксикарбониламиногруппы, C1-C6 алкилсульфониламиногруппы, 4-морфолинильной группы и ди-(C1-C6 алкил)аминогруппы],
или его фармакологически приемлемой соли.
Предпочтительные варианты осуществления настоящего изобретения включают следующие соединения:
(2) соединение или его фармакологически приемлемая соль по пункту (1), где R1 представляет собой 1-этилпропильную группу, фенильную группу, которая может быть замещенной 1-3 группами, независимо выбранными из атома галогена, C1-C6 алкильной группы, C1-C6 алкоксигруппы, C1-C6 галогенированной алкоксигруппы и аминогруппы, или 2,3-дигидро-1-бензофуран-6-ильную группу;
(3) соединение или его фармакологически приемлемая соль по пункту (1), где R1 представляет собой 1-этилпропильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-хлорфенильную группу, 2,5-дифторфенильную группу, 4-хлор-3-фторфенильную группу, 3-хлор-4-фторфенильную группу, 4-метилфенильную группу, 3-этилфенильную группу, 3,4-диметилфенильную группу, 3-трифторметоксифенильную группу, 3-метоксифенильную группу, 3-метокси-4-метилфенильную группу, 4-амино-3,5-диметилфенильную группу или 2,3-дигидро-1-бензофуран-6-ильную группу;
(4) соединение или его фармакологически приемлемая соль по пункту (1), где R1 представляет собой 2-фторфенильную группу, 3-фторфенильную группу, 3-хлорфенильную группу, 2,5-дифторфенильную группу, 4-хлор-3-фторфенильную группу, 3-хлор-4-фторфенильную группу, 4-метилфенильную группу или 2,3-дигидро-1-бензофуран-6-ильную группу;
(5) соединение или его фармакологически приемлемая соль по любому из пунктов (1)-(4), где R2 представляет собой метильную группу и Q представляет собой группу, представленную формулой =CH-;
(6) соединение или его фармакологически приемлемая соль по любому из пунктов (1)-(5), где R3 представляет собой фенильную группу, замещенную 1-3 атомами фтора и/или карбоксильной группой(ами);
(7) соединение или его фармакологически приемлемая соль по любому из пунктов (1)-(5), где R3 представляет собой 3-карбоксилфенильную группу или 3-карбоксил-5-фторфенильную группу;
(8) соединение или его фармакологически приемлемая соль по пункту (1), где R1 представляет собой 1-этилпропильную группу, фенильную группу, которая может быть замещенной 1-3 группами, независимо выбранными из атома галогена, C1-C6 алкильной группы, C1-C6 алкоксигруппы, C1-C6 галогенированной алкоксигруппы и аминогруппы, или 2,3-дигидро-1-бензофуран-6-ильную группу, R2 представляет собой метильную группу, R3 представляет собой фенильную группу, замещенную 1-3 атомами фтора и/или карбоксильной группой(ами), и Q представляет собой группу, представленную формулой =CH-, или атом азота;
(9) соединение или его фармакологически приемлемая соль по пункту (1), где R1 представляет собой 1-этилпропильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-хлорфенильную группу, 2,5-дифторфенильную группу, 4-хлор-3-фторфенильную группу, 3-хлор-4-фторфенильную группу, 4-метилфенильную группу, 3-этилфенильную группу, 3,4-диметилфенильную группу, 3-трифторметоксифенильную группу, 3-метоксифенильную группу, 3-метокси-4-метилфенильную группу, 4-амино-3,5-диметилфенильную группу или 2,3-дигидро-1-бензофуран-6-ильную группу, R2 представляет собой метильную группу, R3 представляет собой 3-карбоксилфенильную группу или 3-карбоксил-5-фторфенильную группу и Q представляет собой группу, представленную формулой =CH-, или атом азота;
(10) соединение или его фармакологически приемлемая соль по пункту (1), где R1 представляет собой 2-фторфенильную группу, 3-фторфенильную группу, 3-хлорфенильную группу, 2,5-дифторфенильную группу, 4-хлор-3-фторфенильную группу, 3-хлор-4-фторфенильную группу, 4-метилфенильную группу или 2,3-дигидро-1-бензофуран-6-ильную группу, R2 представляет собой метильную группу, R3 представляет собой 3-карбоксилфенильную группу или 3-карбоксил-5-фторфенильную группу и Q представляет собой группу, представленную формулой =CH-;
(11) соединение или его фармакологически приемлемая соль по пункту (1), где соединением, имеющим общую формулу (I), является
3-{[6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-[6-(3-хлорфенокси)-1-метил-1H-бензимидазол-2-илметокси]бензойная кислота,
3-{[6-(4-хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(3-хлор-4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(1-этилпропокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(2-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[1-метил-6-(4-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(3-этилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(3-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-({1-метил-6-[3-(трифторметокси)фенокси]-1H-бензимидазол-2-ил}метокси)бензойная кислота,
3-{[6-(2,5-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(3,4-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(3-метокси-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(2,3-дигидро-1-бензофуран-6-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[3-метил-5-(4-метилфенокси)-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота,
3-фтор-5-{[3-метил-5-(4-метилфенокси)-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота или
3-{[5-(3,4-диметилфенокси)-3-метил-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота;
(12) соединение или его фармакологически приемлемая соль по пункту (1), где соединением, имеющим общую формулу (I), является
3-{[6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-[6-(3-хлорфенокси)-1-метил-1H-бензимидазол-2-илметокси]бензойная кислота,
3-{[6-(4-хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(3-хлор-4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(2-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[1-метил-6-(4-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(2,5-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота или
3-{[6-(2,3-дигидро-1-бензофуран-6-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота;
(13) соединение по пункту (1), где соединением, имеющим общую формулу (I), является
3-{[6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-[6-(3-хлорфенокси)-1-метил-1H-бензимидазол-2-илметокси]бензойная кислота,
3-{[6-(4-хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(3-хлор-4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(2-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[1-метил-6-(4-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(2,5-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота или
3-{[6-(2,3-дигидро-1-бензофуран-6-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота;
(14) фармацевтическая композиция, содержащая соединение по любому из пунктов (1)-(13) или его фармакологически приемлемую соль в качестве активного компонента;
(15) фармацевтическая композиция по пункту (14) для снижения глюкозы в крови, содержащая соединение по любому из пунктов (1)-(13) или его фармакологически приемлемую соль в качестве активного компонента;
(16) фармацевтическая композиция по пункту (14) для лечения и/или предупреждения диабета, содержащая соединение по любому из пунктов (1)-(13) или его фармакологически приемлемую соль в качестве активного компонента;
(17) фармацевтическая композиция по пункту (14) для лечения и/или предупреждения диабета типа II, содержащая соединение по любому из пунктов (1)-(13) или его фармакологически приемлемую соль в качестве активного компонента;
(18) фармацевтическая композиция по пункту (14) для активации PPARγ, содержащая соединение по любому из пунктов (1)-(13) или его фармакологически приемлемую соль в качестве активного компонента;
(19) фармацевтическая композиция по пункту (14) для улучшения метаболизма углеводов или липидов, для ослабления симптоматики инсулинорезистентности, для ингибирования воспаления или для ингибирования роста раковых клеток, содержащая соединение по любому из пунктов (1)-(13) или его фармакологически приемлемую соль в качестве активного компонента;
(20) фармацевтическая композиция по пункту (14) для лечения и/или предупреждения заболевания, вызываемого метаболическим синдромом, содержащая соединение по любому из пунктов (1)-(13) или его фармакологически приемлемую соль в качестве активного компонента;
(21) фармацевтическая композиция по пункту (14) для лечения и/или предупреждения гипергликемии, гиперлипидемии, ожирения, нарушенной толерантности к глюкозе, инсулинорезистентности, нарушенной толерантности к глюкозе натощак, гипертензии, жирной печени, неалкогольного стеатогепатита, диабетических осложнений, артериосклероза, атеросклероза, гестационного сахарного диабета или синдрома поликистоза яичников, содержащая соединение по любому из пунктов (1)-(13) или его фармакологически приемлемую соль в качестве активного компонента;
(22) фармацевтическая композиция по пункту (14) для лечения и/или предупреждения воспалительного заболевания, рака, остеопороза, инволюционного остеопороза, нейродегенеративного заболевания, болезни Альцгеймера или гиперурикемии, содержащая соединение по любому из пунктов (1)-(13) или его фармакологически приемлемую соль в качестве активного компонента;
(23) фармацевтическая композиция по пункту (14) для лечения и/или предупреждения акне, солнечной эритемы, псориаза, экземы, аллергического заболевания, астмы, пептической язвы, язвенного колита, болезни Крона, болезни коронарных артерий, артериосклероза, атеросклероза, диабетической ретинопатии, диабетической макулопатии, макулярного отека, диабетической нефропатии, ишемической болезни сердца, цереброваскулярного нарушения, нарушения периферического кровообращения, аутоиммунного заболевания, панкреатита, кахексии, лейкоза, саркомы или сухих глаз, содержащая соединение по любому из пунктов (1)-(13) или его фармакологически приемлемую соль в качестве активного компонента;
(24) активатор/модулятор PPARγ, содержащий соединение по любому из пунктов (1)-(13) или его фармакологически приемлемую соль в качестве активного компонента;
(25) применение соединения по любому из пунктов (1)-(13) или его фармакологически приемлемой соли для изготовления фармацевтической композиции;
(26) применение по пункту (25), где фармацевтическая композиция предназначена для снижения глюкозы в крови;
(27) применение по пункту (25), где фармацевтическая композиция предназначена для лечения и/или предупреждения диабета;
(28) применение по пункту (25), где фармацевтическая композиция предназначена для лечения и/или предупреждения диабета типа II;
(29) применение по пункту (25), где фармацевтическая композиция предназначена для активации PPARγ;
(30) применение по пункту (25), где фармацевтическая композиция предназначена для улучшения метаболизма углеводов или липидов, для ослабления симптоматики инсулинорезистентности, для ингибирования воспаления или для ингибирования роста раковых клеток;
(31) применение по пункту (25), где фармацевтическая композиция предназначена для лечения и/или предупреждения заболевания, вызываемого метаболическим синдромом;
(32) применение по пункту (25), где фармацевтическая композиция предназначена для лечения и/или предупреждения гипергликемии, гиперлипидемии, ожирения, нарушенной толерантности к глюкозе, инсулинорезистентности, нарушенной толерантности к глюкозе натощак, гипертензии, жирной печени, неалкогольного стеатогепатита, диабетических осложнений, артериосклероза, атеросклероза, гестационного сахарного диабета или синдрома поликистоза яичников;
(33) применение по пункту (25), где фармацевтическая композиция предназначена для лечения и/или предупреждения воспалительного заболевания, рака, остеопороза, инволюционного остеопороза, нейродегенеративного заболевания, болезни Альцгеймера или гиперурикемии;
(34) применение по пункту (25), где фармацевтическая композиция предназначена для лечения и/или предупреждения акне, солнечной эритемы, псориаза, экземы, аллергического заболевания, астмы, пептической язвы, язвенного колита, болезни Крона, болезни коронарных артерий, артериосклероза, атеросклероза, диабетической ретинопатии, диабетической макулопатии, макулярного отека, диабетической нефропатии, ишемической болезни сердца, цереброваскулярного нарушения, нарушения периферического кровообращения, аутоиммунного заболевания, панкреатита, кахексии, лейкоза, саркомы или сухих глаз;
(35) применение по пункту (25), где фармацевтическая композиция является активатором/модулятором PPARγ;
(36) способ снижения глюкозы в крови, включающий введение фармакологически эффективного количества соединения по любому из пунктов (1)-(13) или его фармакологически приемлемой соли теплокровному животному;
(37) способ активации PPARγ, содержащий введение фармакологически эффективного количества соединения по любому из пунктов (1)-(13) или его фармакологически приемлемой соли теплокровному животному;
(38) способ улучшения метаболизма углеводов или липидов, ослабления симптоматики инсулинорезистентности, ингибирования воспаления или ингибирования роста раковых клеток, включающий введение фармакологически эффективного количества соединения по любому из пунктов (1)-(13) или его фармакологически приемлемой соли теплокровному животному;
(39) способ лечения и/или предотвращения заболевания, содержащий введение фармакологически эффективного количества соединения по любому из пунктов (1)-(13) или его фармакологически приемлемой соли теплокровному животному;
(40) способ по пункту (39), где указанным заболеванием является диабет;
(41) способ по пункту (39), где указанным заболеванием является диабет типа II;
(42) способ по пункту (39), где указанным заболеванием является заболевание, вызываемое метаболическим синдромом;
(43) способ по пункту (39), где указанным заболеванием является гипергликемия, гиперлипидемия, ожирение, нарушенная толерантность к глюкозе, инсулинорезистентность, нарушенная толерантность к глюкозе натощак, гипертензия, жирная печень, неалкогольный стеатогепатит, диабетические осложнения, артериосклероз, атеросклероз, гестационный сахарный диабет или синдром поликистоза яичников;
(44) способ по пункту (39), где указанным заболеванием является воспалительное заболевание, рак, остеопороз, инволюционный остеопороз, нейродегенеративное заболевание, болезнь Альцгеймера или гиперурикемия;
(45) способ по пункту (39), где указанным заболеванием является акне, солнечная эритема, псориаз, экзема, аллергическое заболевание, астма, пептическая язва, язвенный колит, болезнь Крона, болезнь коронарных артерий, артериосклероз, атеросклероз, диабетическая ретинопатия, диабетическая макулопатия, макулярный отек, диабетическая нефропатия, ишемическая болезнь сердца, цереброваскулярное нарушение, нарушение периферического кровообращения, аутоиммунное заболевание, панкреатит, кахексия, лейкоз, саркома или сухие глаза; и
(46) способ по любому из пунктов (36)-(45), где указанным теплокровным животным является человек.
"C1-C6 алкильная группа" в настоящем изобретении является неразветвленной или разветвленной алкильной группой, имеющей 1-6 углеродных атомов. Примеры такой группы включают метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, пентильную группу, изопентильную группу, 2-метилбутильную группу, неопентильную группу, 1-этилпропильную группу, гексильную группу, изогексильную группу, 4-метилпентильную группу, 3-метилпентильную группу, 2-метилпентильную группу, 1-метилпентильную группу и 3,3-диметилбутильную группу. Группа представляет собой предпочтительно 1-этилпропильную группу для R1 и предпочтительно неразветвленную или разветвленную алкильную группу, имеющую 1-4 углеродных атома (C1-C4 алкильную группу), более предпочтительно метильную группу или этильную группу (C1-C2 алкильную группу) и еще более предпочтительно метильную группу для других заместителей.
"C3-C6 циклоалкильная группа" в настоящем изобретении представляет собой циклопропильную группу, циклобутильную группу, циклопентильную группу или циклогексильную группу, предпочтительно циклопентильную группу.
"Атом галогена" в настоящем изобретении является атомом фтора, атомом хлора, атомом брома или атомом йода. Предпочтительно атом галогена представляет собой атом фтора или атом хлора.
"C1-C6 гидроксиалкильная группа" в настоящем изобретении представляет собой группу, в которой гидроксигруппа присоединена к указанной выше "C1-C6 алкильной группе". Данная группа представляет собой, например, гидроксиметильную группу, гидроксиэтильную группу или гидроксипропильную группу и является предпочтительно группой, в которой гидроксигруппа присоединена к неразветвленной или разветвленной алкильной группе, имеющей 1-4 углеродных атома (C1-C4 алкильной группой, замещенной гидроксигруппой), более предпочтительно гидроксиметильной группой или 2-гидроксиэтильной группой и еще более предпочтительно гидроксиметильной группой.
"C1-C6 галогенированная алкильная группа" в настоящем изобретении представляет собой группу, в которой одинаковые или разные 1-5 указанных выше "атомов галогена" присоединены к указанной выше "C1-C6 алкильной группе". Примеры такой группы включают трифторметильную группу, трихлорметильную группу, дифторметильную группу, дихлорметильную группу, дибромметильную группу, фторметильную группу, 2,2,2-трифторэтильную группу, 2,2,2-трихлорэтильную группу, 2-бромэтильную группу, 2-хлорэтильную группу и 2-фторэтильную группу. Данная группа представляет собой предпочтительно группу, в которой одинаковые или разные 1-5 указанных выше "атомов галогена" присоединены к указанной выше "C1-C4 алкильной группе" (C1-C4 галогенированную алкильную группу), более предпочтительно группу, в которой одинаковые или разные 1-5 указанных выше "атомов галогена" присоединены к указанной выше "C1-C2 алкильной группе" (C1-C2 галогенированную алкильную группу), и еще более предпочтительно трифторметильную группу.
"C2-C7 алкилкарбонильная группа" в настоящем изобретении представляет собой группу, в которой указанная выше "C1-C6 алкильная группа" присоединена к карбонильной группе. Примеры такой группы включают ацетильную группу, пропионильную группу, бутирильную группу, изобутирильную группу, пентаноильную группу, пивалоильную группу, валерильную группу и изовалерильную группу. Данная группа представляет собой предпочтительно группу, в которой указанная выше "C1-C4 алкильная группа” присоединена к карбонильной группе (C2-C5 алкилкарбонильную группу), более предпочтительно ацетильную группу или пропионильную группу (C2-C3 алкилкарбонильную группу) и еще более предпочтительно ацетильную группу.
"C1-C6 алкоксигруппа" в настоящем изобретении представляет собой группу, в которой указанная выше "C1-C6 алкильная группа” присоединена к атому кислорода и является неразветвленной или разветвленной алкоксигруппой, содержащей 1-6 углеродных атомов. Примеры такой группы включают метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, пентоксигруппу и 2-метилбутоксигруппу. Данная группа представляет собой предпочтительно неразветвленную или разветвленную алкоксигруппу, содержащую 1-4 углеродных атома (C1-C4 алкоксигруппу), и более почтительно метоксигруппу или изопропоксигруппу.
"C2-C7 алкоксикарбонильная группа" в настоящем изобретении представляет собой группу, в которой указанная выше "C1-C6 алкоксигруппа" присоединена к карбонильной группе. Примеры такой группы включают метоксикарбонильную группу, этоксикарбонильную группу, пропоксикарбонильную группу, изопропоксикарбонильную группу, бутоксикарбонильную группу, изобутоксикарбонильную группу, втор-бутоксикарбонильную группу, трет-бутоксикарбонильную группу и пентоксикарбонильную группу. Данная группа представляет собой предпочтительно группу, в которой указанная выше "C1-C4 алкоксигруппа" присоединена к карбонильной группе (C2-C5 алкоксикарбонильную группу), более предпочтительно метоксикарбонильную группу или этоксикарбонильную группу (C2-C3 алкоксикарбонильную группу) и еще более предпочтительно метоксикарбонильную группу.
"C1-C6 галогенированная алкоксигруппа" в настоящем изобретении представляет собой группу, в которой одинаковые или разные 1-5 указанных выше "атомов галогена" присоединены к указанной выше "C1-C6 алкоксигруппе". Примеры такой группы включают трифторметоксигруппу, трихлорметоксигруппу, дифторметоксигруппу, фторметоксигруппу, 2,2,2-трифторэтоксигруппу, 2,2,2-трихлорэтоксигруппу, 2-бромэтоксигруппу, 2-хлорэтоксигруппу и 2-фторэтоксигруппу. Данная группа представляет собой предпочтительно группу, в которой одинаковые или разные 1-5 указанных выше "атомов галогена" присоединены к указанной выше "C1-C4 алкоксигруппе" (C1-C4 галогенированную алкоксигруппу), более предпочтительно группу, в которой одинаковые или разные 1-5 указанных выше "атомов галогена" присоединены к указанной выше "C1-C2 алкоксигруппе" (C1-C2 галогенированную алкоксигруппу), и еще более предпочтительно трифторметоксигруппу.
"C2-C7 алкилкарбонилоксигруппа" в настоящем изобретении представляет собой группу, в которой указанная выше "C2-C7 алкилкарбонильная группа” присоединена к атому кислорода. Примеры такой группы включают ацетоксигруппу, пропионилоксигруппу, бутирилоксигруппу и изобутирилоксигруппу. Данная группа представляет собой предпочтительно группу, в которой указанная выше "C2-C5 алкилкарбонильная группа” присоединена к атому кислорода (C2-C5 алкилкарбонилоксигруппу), более предпочтительно ацетоксигруппу или пропионилоксигруппу (C2-C3 алкилкарбонилоксигруппу) и еще более предпочтительно ацетоксигруппу.
"C2-C7 алкоксикарбонилоксигруппа" в настоящем изобретении представляет собой группу, в которой указанная выше "C2-C7 алкоксикарбонильная группа” присоединена к атому кислорода. Примеры такой группы включают метоксикарбонилоксигруппу, этоксикарбонилоксигруппу, пропоксикарбонилоксигруппу, изопропоксикарбонилоксигруппу, бутоксикарбонилоксигруппу и изобутоксикарбонилоксигруппу. Данная группа представляет собой предпочтительно группу, в которой указанная выше "C2-C5 алкоксикарбонильная группа” присоединена к атому кислорода (C2-C5 алкоксикарбонилоксигруппу), более предпочтительно метоксикарбонилоксигруппу или этоксикарбонилоксигруппу (C2-C3 алкоксикарбонилоксигруппу) и еще более предпочтительно метоксикарбонилоксигруппу.
"C2-C7 алкилкарбониламиногруппа" в настоящем изобретении представляет собой группу, в которой одна карбонильная группа с присоединенной к ней указанной выше "C1-C6 алкильной группой" присоединена к аминогруппе. Примеры такой группы включают ацетамидогруппу, этилкарбониламиногруппу, пропилкарбониламиногруппу, изопропилкарбониламиногруппу и бутилкарбониламиногруппу. Данная группа представляет собой предпочтительно группу, в которой одна карбонильная группа с присоединенной к ней указанной выше "C1-C4 алкильной группой" присоединена к аминогруппе (C2-C5 алкилкарбониламиногруппу), и более предпочтительно ацетамидогруппу или этилкарбониламиногруппу (C2-C3 алкилкарбониламиногруппу).
"C2-C7 алкоксикарбониламиногруппа" в настоящем изобретении представляет собой группу, в которой одна карбонильная группа с присоединенной к ней указанной выше "C1-C6 алкоксигруппой" присоединена к аминогруппе. Примеры такой группы включают метоксикарбониламиногруппу, этоксикарбониламиногруппу, пропоксикарбониламиногруппу, изопропоксикарбониламиногруппу, бутоксикарбониламиногруппу, изобутоксикарбониламиногруппу и втор-бутоксикарбониламиногруппу. Данная группа представляет собой предпочтительно группу, в которой карбонильная группа с присоединенной к ней указанной выше "C1-C4 алкоксигруппой" присоединена к аминогруппе (C2-C5 алкоксикарбониламиногруппу), более предпочтительно метоксикарбониламиногруппу или этоксикарбониламиногруппу (C2-C3 алкоксикарбониламиногруппу) и еще более предпочтительно метоксикарбониламиногруппу.
"C1-C6 алкилсульфониламиногруппа" в настоящем изобретении представляет собой группу, в которой одна сульфонильная группа с присоединенной к ней указанной выше "C1-C6 алкильной группой" присоединена к аминогруппе. Примеры такой группы включают метилсульфониламиногруппу, этилсульфониламиногруппу, пропилсульфониламиногруппу, изопропилсульфониламиногруппу и бутилсульфониламиногруппу. Данная группа представляет собой предпочтительно группу, в которой одна сульфонильная группа с присоединенной к ней указанной выше "C1-C4 алкильной группой" присоединена к аминогруппе (моно-C1-C4 алкилсульфониламиногруппу), более предпочтительно метилсульфониламиногруппу или этилсульфониламиногруппу (моно-C1-C2 алкилсульфониламиногруппу) и еще более предпочтительно метилсульфониламиногруппу.
"Ди-(C1-C6 алкил)аминогруппа" в настоящем изобретении представляет собой группу, в которой одинаковые или разные две указанные выше "C1-C6 алкильные группы" присоединены к аминогруппе. Примеры такой группы включают диметиламиногруппу, диэтиламиногруппу, дипропиламиногруппу, диизопропиламиногруппу, дибутиламиногруппу, диизобутиламиногруппу, дипентиламиногруппу, диизопентиламиногруппу, динеопентиламиногруппу, дигексиламиногруппу, N-этил-N-метиламиногруппу, N-метил-N-пропиламиногруппу, N-изопропил-N-метиламиногруппу, N-бутил-N-метиламиногруппу, N-изобутил-N-метиламиногруппу, N-метил-N-пентиламиногруппу, N-изопентил-N-метиламиногруппу, N-этил-N-пропиламиногруппу, N-этил-N-изопропиламиногруппу, N-бутил-N-этиламиногруппу и N-этил-N-изопентиламиногруппу. Данная группа представляет собой предпочтительно группу, в которой одинаковые или разные две указанные выше "C1-C4 алкильные группы" присоединены к аминогруппе (ди-(C1-C4 алкил)аминогруппу), более предпочтительно диметиламиногруппу, диэтиламиногруппу или N-этил-N-метиламиногруппу (ди-(C1-C2 алкил)аминогруппу) и еще более предпочтительно диметиламиногруппу.
"C6-C10 арильная группа" в настоящем изобретении представляет собой ароматическую углеводородную группу, содержащую 6-10 углеродных атомов. Данная группа представляет собой предпочтительно фенильную группу или нафтильную группу и более предпочтительно фенильную группу.
"Гетероциклическая группа" в настоящем изобретении представляет собой четырех-семичленную гетероциклическую группу, которая содержит 1-3 атома серы, атома кислорода и/или атома азота и может дополнительно содержать 1 или 2 атома азота и в которой два атома кислорода могут быть присоединены к атому серы. Примеры такой группы включают "ароматическую гетероциклическую группу", такую как фурильная группа, тиенильная группа, пирролильная группа, азепинильная группа, пиразолильная группа, имидазолильная группа, оксазолильная группа, изоксазолильная группа, тиазолильная группа, изотиазолильная группа, 1,2,3-оксадиазолильная группа, триазолильная группа, тетразолильная группа, тиадиазольная группа, пиранильная группа, пиридильная группа, пиридазинильная группа, пиримидинильная группа и пиразинильная группа, и "частично или полностью восстановленную насыщенную гетероциклическую группу", такую как тетрагидропиранильная группа, тетрагидротиенильная группа, морфолинильная группа, тиоморфолинильная группа, пирролидинильная группа, пирролинильная группа, имидазолидинильная группа, пиразолидинильная группа, пиперидинильная группа, пиперазинильная группа, оксазолидинильная группа, изоксазолидинильная группа, тиазолидинильная группа, пиразолидинильная группа, диоксоланильная группа и диоксанильная группа. Указанная выше гетероциклическая группа может быть конденсирована с другой циклической группой, такой как бензольное кольцо ("конденсированная бициклическая гетероарильная группа"). Примеры такой группы включают бензотиенильную группу, бензотиазолильную группу, бензоксазолильную группу, изобензофуранильную группу, 1,3-дигидроизобензофуранильную группу, хинолильную группу, 1,3-бензодиоксоланильную группу, 1,4-бензодиоксанильную группу, индолильную группу, изоиндолильную группу и индолинильную группу. Данная группа представляет собой предпочтительно шестичленную гетероциклическую группу или конденсированную бициклическую гетероарильную группу, содержащую 1-3 атома серы, атома кислорода и/или атома азота, более предпочтительно пиридильную группу, морфолинильную группу, тетрагидро-2H-пиранильную группу, 2,3-дигидро-1-бензофуранильную группу или 1,3-бензодиоксольную группу, еще более предпочтительно 3-пиридильную группу, 4-морфолинильную группу, тетрагидро-2H-пиран-4-ильную группу, 2,3-дигидро-1-бензофуран-6-ильную группу или 1,3-бензодиоксол-5-ильную группу и особенно предпочтительно 2,3-дигидро-1-бензофуран-6-ильную группу.
"C6-C10 арильная группа, которая может быть замещенной 1-5 группами, независимо выбранными из группы заместителей (а)", в настоящем изобретении представляет собой указанную выше "C6-C10 арильную группу", которая может быть замещенной 1-5 группами, независимо выбранными из группы заместителей (а). Такая группа для R1 представляет собой предпочтительно фенильную группу, которая может быть замещенной 1-3 группами, независимо выбранными из атома галогена, C1-C6 алкильной группы, C1-C6 алкоксигруппы, C1-C6 галогенированной алкоксигруппы и аминогруппы, более предпочтительно 2-фторфенильную группу, 3-фторфенильную группу, 3-хлорфенильную группу, 2,5-дифторфенильную группу, 4-хлор-3-фторфенильную группу, 3-хлор-4-фторфенильную группу, 4-метилфенильную группу, 3-этилфенильную группу, 3,4-диметилфенильную группу, 3-трифторметоксифенильную группу, 3-метоксифенильную группу, 3-метокси-4-метилфенильную группу или 4-амино-3,5-диметилфенильную группу и еще более предпочтительно 2-фторфенильную группу, 3-фторфенильную группу, 3-хлорфенильную группу, 2,5-дифторфенильную группу, 4-хлор-3-фторфенильную группу, 3-хлор-4-фторфенильную группу или 4-метилфенильную группу. Такая группа для R3 представляет собой предпочтительно фенильную группу, замещенную 1-3 атомами фтора и/или карбоксильной группой(ами), и более предпочтительно 3-карбоксилфенильную группу или 3-карбоксил-5-фторфенильную группу.
"Гетероциклическая группа, которая может быть замещенной 1-3 группами, независимо выбранными из группы заместителей (а)", в настоящем изобретении представляет собой указанную выше "гетероциклическую группу", которая может быть замещенной 1-3 группами, независимо выбранными из группы заместителей (а). Такая группа представляет собой предпочтительно пиридильную группу, замещенную 1-3 группами, независимо выбранными из атома галогена и C1-C6 алкоксигруппы, пиридильную группу, тетрагидро-2H-пиран-4-ильную группу, тетрагидрофуран-3-ильную группу, 2,3-дигидро-1-бензофуран-6-ильную группу или 1,3-бензодиоксол-5-ильную группу и более предпочтительно 2,3-дигидро-1-бензофуран-6-ильную группу.
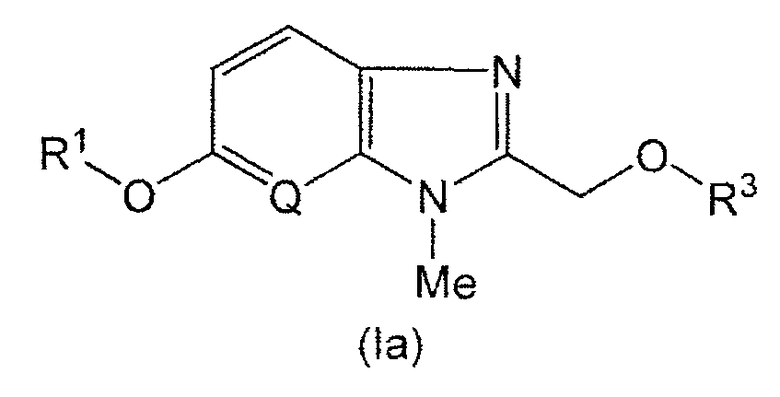
В настоящем изобретении R1 представляет собой предпочтительно 1-этилпропильную группу, фенильную группу, которая может быть замещенной 1-3 группами, независимо выбранными из атома галогена, C1-C6 алкильной группы, C1-C6 алкоксигруппы, C1-C6 галогенированной алкоксигруппы и аминогруппы, или 2,3-дигидро-1-бензофуран-6-ильную группу. R1 представляет собой более предпочтительно 1-этилпропильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-хлорфенильную группу, 2,5-дифторфенильную группу, 4-хлор-3-фторфенильную группу, 3-хлор-4-фторфенильную группу, 4-метилфенильную группу, 3-этилфенильную группу, 3,4-диметилфенильную группу, 3-трифторметоксифенильную группу, 3-метоксифенильную группу, 3-метокси-4-метилфенильную группу, 4-амино-3,5-диметилфенильную группу или 2,3-дигидро-1-бензофуран-6-ильную группу. R1 представляет собой еще более предпочтительно 2-фторфенильную группу, 3-фторфенильную группу, 3-хлорфенильную группу, 2,5-дифторфенильную группу, 4-хлор-3-фторфенильную группу, 3-хлор-4-фторфенильную группу, 4-метилфенильную группу или 2,3-дигидро-1-бензофуран-6-ильную группу.
В настоящем изобретении R2 представляет собой предпочтительно метильную группу.
В настоящем изобретении R3 представляет собой предпочтительно фенильную группу, замещенную 1-3 атомами фтора и/или карбоксильной группой(ами). R3 представляет собой более предпочтительно 3-карбоксилфенильную группу или 3-карбоксил-5-фторфенильную группу.
В настоящем изобретении Q представляет собой предпочтительно группу, представленную формулой =CH-.
Конденсированное бициклическое гетероарильное соединение или его фармакологически приемлемая соль общей формулы (I) в соответствии с настоящим изобретением включает все изомеры (такие как кетоенольный изомер, диастереомер, оптический изомер, ротамер и т.д.).
Конденсированное бициклическое гетероарильное соединение или его фармакологически приемлемая соль общей формулы (I) в соответствии с настоящим изобретением имеет различные изомеры, потому что в молекуле существует(ют) асимметрический(е) атом(ы) углерода. Указанные изомеры и смеси этих изомеров по настоящему изобретению представлены все одной формулой, в частности общей формулой (I). Таким образом, настоящее изобретение включает все указанные изомеры и их смеси в произвольных соотношениях.
Указанные выше стереоизомеры при необходимости могут быть получены синтезом соединения по настоящему изобретению с использованием оптически активного исходного соединения или асимметрическим синтезом или по технологии асимметрической индукции или выделением синтезированного соединения по настоящему изобретению обычным методом оптического разделения или отделения.
"Фармакологически приемлемая соль" представляет собой соль, которая может быть получена осуществлением взаимодействия конденсированного бициклического гетероарильного соединения общей формулы (I) в соответствии с настоящим изобретением, содержащего оснóвную группу, такую как аминогруппа, с кислотой или осуществлением взаимодействия указанного соединения, содержащего кислотную группу, такую как карбоксильная группа, с основанием.
Предпочтительные примеры соли по оснóвной группе включают гидрогалогениды, такие как гидрофториды, гидрохлориды, гидробромиды и гидроиодиды; соли неорганических кислот, такие как нитраты, перхлораты, сульфаты и фосфаты; алкилсульфонаты, такие как метансульфонаты и этансульфонаты; галогеналкилсульфонаты, такие как трифторметансульфонаты; арилсульфонаты, такие как бензолсульфонаты и п-толуолсульфонаты, и соли органических кислот, такие как ацетаты, малаты, фумараты, сукцинаты, цитраты, аскорбаты, тартраты, оксалаты и малеаты.
С другой стороны, предпочтительные примеры соли по кислотной группе включают соли щелочных металлов, такие как натриевые соли, калиевые соли и литиевые соли; соли щелочноземельных металлов, такие как кальциевые соли и магниевые соли, и соли металлов, такие как алюминиевые соли и железные соли.
Конденсированное бициклическое гетероарильное соединение или его фармакологически приемлемая соль общей формулы (I) в соответствии с настоящим изобретением может абсорбировать воду или адсорбировать воду с образованием гидрата при оставлении на воздухе или на стадии очистки или получения, и соль по настоящему изобретению охватывает также и такой гидрат.
Конденсированное бициклическое гетероарильное соединение или его фармакологически приемлемая соль общей формулы (I) в соответствии с настоящим изобретением может абсорбировать некоторые другие специфические растворители с образованием сольвата и соль по настоящему изобретению охватывает также и такой сольват.
Конкретные примеры соединения общей формулы (I) в соответствии с настоящим изобретением включают соединения, показанные в таблице 1, но указанные группы не ограничивают настоящее изобретение.
Сокращения в данной ниже таблице 1 означают следующее. В частности:
Me означает метильную группу,
Et означает этильную группу,
1-Et-Pr означает 1-этилпропильную группу,
Cycpent означает циклопентильную группу,
Ph означает фенильную группу,
3-CO2H-Ph означает 3-карбоксифенильную группу,
4-Mor означает 4-морфолинильную группу,
5-CO2H-3-Py означает 5-карбокси-3-пиридильную группу,
Het (A) означает тетрагидро-2H-пиран-4-ильную группу,
Het (B) означает тетрагидрофуран-3-ильную группу,
Het (C) означает 2,3-дигидро-1-бензофуран-6-ильную группу и
Het (D) означает 1,3-бензодиоксол-5-ильную группу.
[Формула 2]
В таблице 1 предпочтительными соединениями являются соединения № 1-19, 1-27, 1-35, 1-43, 1-50, 1-59, 1-99, 1-107, 1-115, 1-123, 1-131, 1-139, 1-161, 1-164, 1-168, 1-170, 1-173, 1-175, 1-176, 1-179, 1-188, 1-198, 1-204, 1-210, 1-217, 1-220, 1-221, 1-222, 1-223, 1-224 и 1-227.
Более предпочтительными соединениями являются
3-{[6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-35),
3-[6-(3-хлорфенокси)-1-метил-1H-бензимидазол-2-илметокси]бензойная кислота (соединение № 1-51),
3-{[6-(4-хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-99),
3-{[6-(3-хлор-4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-115),
3-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-131),
3-{[6-(1-этилпропокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-161),
3-{[6-(2-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-164),
3-{[1-метил-6-(4-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-168),
3-{[6-(3-этилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-170),
3-{[6-(3-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-173),
3-({1-метил-6-[3-(трифторметокси)фенокси]-1H-бензимидазол-2-ил}метокси)бензойная кислота (соединение № 1-176),
3-{[6-(2,5-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-179),
3-{[6-(3,4-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-198),
3-{[6-(3-метокси-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-204),
3-{[6-(2,3-дигидро-1-бензофуран-6-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-210),
3-{[3-метил-5-(4-метилфенокси)-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота (соединение № 1-221),
3-фтор-5-{[3-метил-5-(4-метилфенокси)-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота (соединение № 1-222) и
3-{[5-(3,4-диметилфенокси)-3-метил-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота (соединение № 1-223).
Еще более предпочтительными соединениями являются:
3-{[6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-35),
3-[6-(3-хлорфенокси)-1-метил-1H-бензимидазол-2-илметокси]бензойная кислота (соединение № 1-51),
3-{[6-(4-хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-99),
3-{[6-(3-хлор-4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-115),
3-{[6-(2-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-164),
3-{[1-метил-6-(4-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-168),
3-{[6-(2,5-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-179) и
3-{[6-(2,3-дигидро-1-бензофуран-6-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-210).
Преимущества изобретения
Как было обнаружено, конденсированные бициклические гетероарильные соединения или их фармакологически приемлемые соли, имеющие общую формулу (I), в соответствии с настоящим изобретением обладают превосходным гипогликемическим эффектом, эффектом улучшения метаболизма углеводов или липидов, эффектом ослабления симптоматики инсулинорезистентности или эффектом ослабления симптоматики так называемого метаболического синдрома, такого как артериосклероз, гипертензия, сердечно-сосудистое нарушение или вызываемые ими осложнения или патология, вызываемая различными воспалениями. Было также обнаружено, что указанные соединения являются лигандами, действующими на PPARγ, и потому обладают эффектом ингибирования роста раковых клеток. Соединения полезны в качестве терапевтического или профилактического средства против метаболического синдрома, в частности заболевания, такого как диабет, гипергликемия, гиперлипидемия, ожирение, нарушенная толерантность к глюкозе (IGT), инсулинорезистентность, нарушенная толерантность к глюкозе натощак (IFG), гипертензия, жирная печень, неалкогольный стеатогепатит (NASH), диабетические осложнения (такие как ретинопатия, нефропатия или нейропатия), артериосклероз, гестационный сахарный диабет (GDM) или синдром поликистоза яичников (PCOS), воспалительного заболевания (такого как остеоартрит, боль или воспалительный энтерит), акне, солнечной эритемы, псориаза, экземы, аллергического заболевания, астмы, пептической язвы, язвенного колита, болезни Крона, болезни коронарных артерий, артериосклероза, атеросклероза, диабетической ретинопатии, диабетической макулопатии, макулярного отека, диабетической нефропатии, ишемической болезни сердца, цереброваскулярного нарушения, нарушения периферического кровообращения, аутоиммунного заболевания (такого как системная красная волчанка, хронический ревматизм, синдром Шегрена, системный склероз, смешанная соединительнотканая болезнь, болезнь Хашимото, болезнь Крона, язвенный колит, идиопатическая болезнь Аддисона, мужское бесплодие, синдром Гудпасчера, быстро прогрессирующий гломерулонефрит, тяжелая псевдопаралитическая миастения, полимиозит, рассеянный склероз, аутоиммунная гемолитическая анемия, идиопатическая тромбоцитопеническая пурпура, болезнь Бехчета или CREST синдром), панкреатита, кахексии, рака (такого как рак желудка, рак легкого, рак молочной железы, рак толстой кишки, рак предстательной железы, рак поджелудочной железы или рак печени), лейкоза, саркомы (такой как липосаркома), остеопороза, инволюционного остеопороза, нейродегенеративного заболевания, болезни Альцгеймера, гиперурикемии или сухих глаз. Указанные соединения могут быть также использованы в качестве лекарственного средства для лечения и/или предупреждения указанных выше заболеваний.
Краткое описание чертежей
На фиг.1 представлено схематическое изображение PPARγ экспрессионной плазмиды, упомянутой в примере 1 испытаний;
на фиг.2 представлено схематическое изображение PPRE репортерной плазмиды, упомянутой в примере 1 испытаний; и
на фиг.3 представлено концептуальное изображение зависимой от дозы кривой, упомянутой в примере 1 испытаний.
На фиг.3 люциферазная активность положительной контрольной группы определена как 100% и люциферазная активность контрольной группы определена как 0%. Максимальная люциферазная активность, проявленная только испытуемым соединением, определена как Emax (%) и максимальное ингибирование люциферазной активности, проявленной испытуемым соединением в присутствии соединения A, определена как Imax (%). Концентрация частичного агониста как лекарственного средства, представленная Emax/2, определена как EC50 и концентрация частичного антагониста в качестве лекарственного средства, представленная (100-Imax)/2, определена как IC50. ---- означает концентрацию в присутствии соединения A и ········· означает концентрацию в отсутствие соединения A.
Наилучший способ осуществления изобретения
Соединение, имеющее общую формулу (I), в соответствии с настоящим изобретением может быть получено способами A-C, описанными ниже.
Растворитель, используемый в реакции на каждой стадии следующих способов A-C, особо не ограничивают, лишь бы он не замедлял реакцию и до некоторой степени растворял исходный материал. Растворитель выбирают, например, из следующей группы растворителей. Группа растворителей состоит из углеводородов, таких как пентан, гексан, октан, петролейный эфир, лигроин и циклогексан; амидов, таких как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-метил-2-пирролидинон и гексаметилфосфорный триамид; простых эфиров, таких как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диэтиленгликоль диметилового эфира; спиртов, таких как метанол, этанол, н-пропанол, изопропанол, н-бутанол, 2-бутанол, 2-метил-1-пропанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; сульфоксидов, таких как диметилсульфоксид; сульфонов, таких как сульфолан; нитрилов, таких как ацетонитрил, пропионитрил, бутиронитрил и изобутиронитрил; сложных эфиров, таких как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; кетонов, таких как ацетон, метилэтилкетон, 4-метил-2-пентанон, метилизобутилкетон, изофорон и циклогексанон; нитросоединений, таких как нитроэтан и нитробензол; галогенированных углеводородов, таких как дихлорметан, 1,2-дихлорэтан, хлорбензол, дихлорбензол, хлороформ и тетрахлорид углерода; ароматических углеводородов, таких как бензол, толуол и ксилол; карбоновых кислот, таких как уксусная кислота, муравьиная кислота, пропионовая кислота, масляная кислота и трифторуксусная кислота; воды; и смешанных растворителей из указанных выше растворителей.
Примеры основания, используемого в реакции на каждой стадии следующих способов A-C, включают неорганические основания, такие как карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат лития и карбонат цезия; бикарбонаты щелочных металлов, такие как бикарбонат натрия, бикарбонат калия и бикарбонат лития; гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия, гидроксид бария и гидроксид лития, и фториды щелочных металлов, такие как фторид натрия и фторид калия; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид натрия, метоксид калия, этоксид калия, трет-бутоксид калия и метоксид лития; триалкилсиланолаты щелочных металлов, такие как триметилсиланолат натрия, триметилсиланолат калия и триметилсиланолат лития; меркаптаны щелочных металлов, такие как метилмеркаптан натрия и этилмеркаптан натрия; органические основаниия, такие как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4,3,0]нон-5-ен (DBN), 1,4-диазабицикло[2,2,2]октан (DABCO) и 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU); и металлоорганические основания, такие как бутиллитий, диизопропиламид лития и бис(триметилсилил)амид лития.
В реакции на каждой стадии следующих ниже способов A-C температура реакции изменяется в соответствии с растворителем, исходным материалом, реагентом и тому подобным и время реакции изменяется в соответствии с растворителем, исходным материалом, реагентом, температурой реакции и тому подобным.
В реакции на каждой стадии следующих ниже способов A-C каждое требуемое соединение собирают из реакционной смеси в соответствии с традиционными способами после окончания реакции. Требуемое соединение получают, например, следующим образом. Реакционную смесь подходящим образом нейтрализуют и удаляют фильтрованием нерастворимый материал, если он есть. Затем добавляют воду и несмешивающийся органический растворитель, такой как этилацетат, и органический слой, содержащий требуемое соединение, отделяют. Органический слой промывают водой или тому подобным и затем сушат над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным и фильтруют. Затем растворитель выпаривают. Полученное требуемое соединение может быть выделено и очищено, если нужно, подходящим образом комбинированными обычными методами, например методами, используемыми для выделения и очистки органических соединений, такими как перекристаллизация и переосаждение, и методом хроматографии с элюированием подходящим элюентом. Требуемое соединение, нерастворимое в растворителе, может быть очищено промывкой полученного твердого продукта растворителем. Требуемое соединение на каждой стадии может быть также использовано как таковое для следующей реакции без очистки.
Ниже описана реакция на каждой стадии способов A-C.
Способ A является способом получения соединения, имеющего общую формулу (I).
[Формула 3]
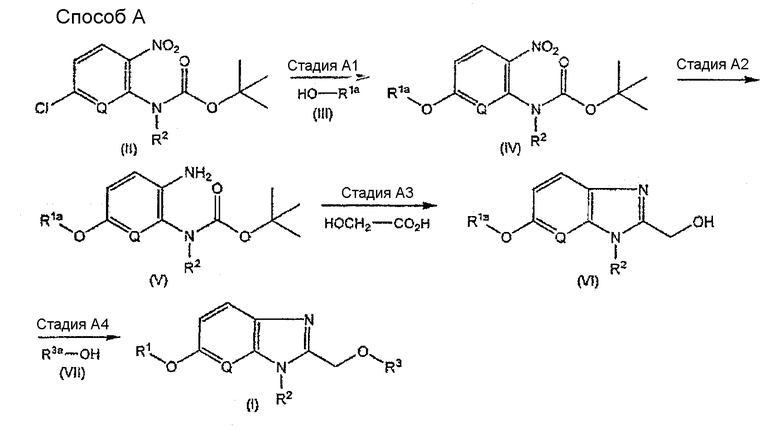
В настоящем изобретении R1, R2, R3 и Q - такие как определенные выше, и R1a и R3a - такие же группы, как определенные выше R1 и R3, за исключением того, что аминогруппа, гидроксигруппа и/или карбоксильная группа, присутствующая(ие) в качестве заместителя(ей) в группах R1 и R3, является аминогруппой, гидроксигруппой и/или карбоксильной группой, которая может быть защищена.
Стадия A1
Данная стадия является стадией получения соединения, имеющего общую формулу (IV).
Данную стадию проводят осуществлением взаимодействия соединения, имеющего общую формулу (II), которое является известным соединением или его легко получают из известного соединения в качестве исходного материала способом, подобным известному способу, с соединением, имеющим общую формулу (III), которое является известным соединением или его легко получают из известного соединения в качестве исходного материала способом, подобным известному способу, в растворителе в присутствии основания.
Растворителем, используемым на данной стадии, является предпочтительно амид, а более предпочтительно N,N-диметилформамид или N-метил-2-пирролидон.
Основанием, используемым на данной стадии, является предпочтительно карбонат щелочного металла или гидрид щелочного металла, а более предпочтительно карбонат цезия или гидрид натрия.
Температура реакции на данной стадии составляет обычно 50°C-150°C, а предпочтительно 80°C-120°C.
Время реакции на данной стадии составляет обычно 0,5-48 часов, а предпочтительно 1-30 часов.
Стадия A2
Данная стадия является стадией получения соединения, имеющего общую формулу (V).
Данную стадию проводят осуществлением взаимодействия соединения, имеющего общую формулу (IV), с железом в растворителе в присутствии хлорида аммония или восстановления соединения, имеющего общую формулу (IV), в растворителе в присутствии палладиевого катализатора в атмосфере водорода.
Растворителем, используемым на данной стадии, является предпочтительно простой эфир, спирт или вода, более предпочтительно тетрагидрофуран, метанол, этанол или вода, и еще более предпочтительно этанол или смешанный растворитель из этанола и воды.
Палладиевым катализатором, используемым на данной стадии, является, например, катализатор на основе двухвалентного палладия или катализатор на основе нуль-валентного палладия, предпочтительно палладий на активированном угле, ацетат палладия(II), трифторацетат палладия(II), палладиевая чернь, бромид палладия(II), хлорид палладия(II), иодид палладия(II), цианид палладия(II), нитрат палладия(II), оксид палладия(II), сульфат палладия(II), дихлорбис(ацетонитрил)палладий(II), дихлорбис(бензонитрил)палладий(II), дихлор(1,5-циклооктадиен)палладий(II), ацетилацетонпалладий(II), сульфид палладия(II), трис(дибензилиденацетон)дипалладий(0), тетрафторборат тетракис(ацетонитрил)палладия(II) или арилхлорид-димер палладия, а более предпочтительно палладий-на-активированном угле.
Температура реакции на данной стадии составляет обычно -20°C-120°C, а предпочтительно 0°C-100°C.
Время реакции на данной стадии составляет обычно 1-48 часов, а предпочтительно 2-24 часа.
Стадия A3
Данная стадия является стадией получения соединения, имеющего общую формулу (VI).
Данную стадию проводят осуществлением взаимодействия соединения, имеющего общую формулу (V), с гликолевой кислотой в растворителе в присутствии хлористоводородной кислоты (предпочтительно 4 н. хлористоводородной кислоты).
Растворителем, используемым на данной стадии, является предпочтительно простой эфир или вода, более предпочтительно диоксан или вода и еще более предпочтительно смешанный растворитель из диоксана и воды.
Температура реакции на данной стадии составляет обычно 50°C-150°C, а предпочтительно 80°C-120°C.
Время реакции на данной стадии составляет обычно 0,5-48 часов, а предпочтительно 1-24 часа.
Стадия A4
Данная стадия является стадией получения соединения, имеющего общую формулу (I).
Данную стадию проводят осуществлением взаимодействия соединения, имеющего общую формулу (VI), с соединением, имеющим общую формулу (VII), которое является известным соединением или его легко получают из известного соединения в качестве исходного материала способом, подобным известному способу, в растворителе в присутствии конденсирующего агента, и затем удаления, когда требуется, защитной группы или групп для аминогруппы, гидроксильной группы и/или карбоксильной группы в R1a и/или R3a.
Растворителем, используемым на данной стадии, является предпочтительно ароматический углеводород, а более предпочтительно толуол.
Примеры конденсирующего агента, используемого на данной стадии, включают комбинацию из азодикарбоксилата и третичного фосфина, комбинацию из азодикарбонового амида и третичного фосфина и (триалкилфосфоранилиден)ацетонитрил. Конденсирующим агентом предпочтительно является комбинация из азодикарбонового амида и третичного фосфина, а более предпочтительно - комбинация из трибутилфосфина и 1,1'-(азодикарбонил)дипиперидина.
Температура реакции на данной стадии составляет обычно -78°C-120°C, а предпочтительно 0°C-50°C.
Время реакции на данной стадии составляет обычно 0,5-24 часа, а предпочтительно 1-12 часов.
Способ B является другим способом получения соединения, имеющего общую формулу (I).
[Формула 4]
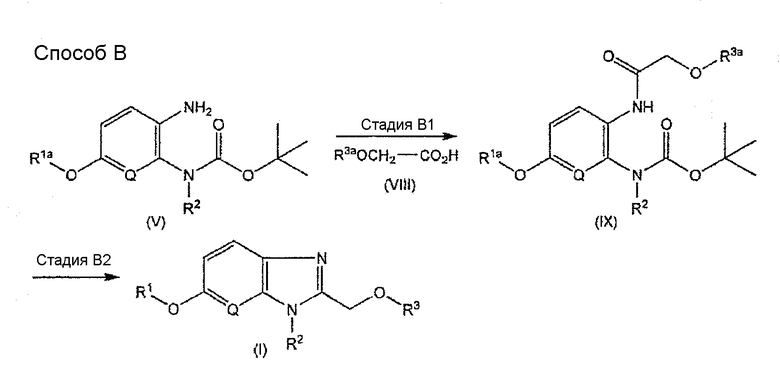
В настоящем изобретении R1, R2, R3, Q, R1a и R3a - такие, как определенные выше.
Стадия B1
Данная стадия является стадией получения соединения, имеющего общую формулу (IX).
Данную стадию проводят осуществлением взаимодействия соединения, имеющего общую формулу (V), с соединением, имеющим общую формулу (VIII), которое является известным соединением или его легко получают из известного соединения в качестве исходного материала способом, подобным известному способу, в растворителе в присутствии конденсирующего агента и основания.
Растворителем, используемым на данной стадии, является предпочтительно амид или галогенированный углеводород, а более предпочтительно N,N-диметилформамид или дихлорметан.
Примеры конденсирующего агента используемого на данной стадии включают гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), циклический ангидрид 1-пропанфосфоновой кислоты (T3P), дициклогексилкарбодиимид (DCCD), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (EDCI), 1-этил-3-(3-диметиламинопропил)карбодиимид (EDAC), изобутилхлорформиат (IBCF), 1,1'-карбонилбис-1H-имидазол (CDI), диэтилцианофосфонат (DEPC), дифенилфосфорилазид (DPPA), N-гидроксисукцинимид, N-гидрокси-5-норборнен-2,3-дикарбоксиимид и дипиридилдисульфид. Конденсирующий агент может быть использован, когда требуется, в присутствии 1-гидроксибензотриазола или гидрата 1-гидроксибензотриазола. Конденсирующим агентом предпочтительно является EDCI.
Основанием, используемым на данной стадии, является предпочтительно триэтиламин, N-метилморфолин или 4-(N,N-диметиламино)пиридин.
Температура реакции на данной стадии составляет обычно -50°C-100°C, а предпочтительно -20°C-60°C.
Время реакции на данной стадии составляет обычно 0,1-24 часа, а предпочтительно 0,5-10 часов.
Стадия B2
Данная стадия является стадией получения соединения, имеющего общую формулу (I).
Данную стадию проводят осуществлением взаимодействия соединения, имеющего общую формулу (IX), с хлористоводородной кислотой и затем удаления, когда требуется, защитной группы или групп для аминогруппы, гидроксигруппы и/или карбоксильной группы в R1a и/или R3a.
Температура реакции на данной стадии составляет обычно -20°C-150°C, а предпочтительно 0°C-100°C.
Время реакции на данной стадии составляет обычно 0,5-150 часов, а предпочтительно 1-72 часа.
Способ C является другим способом получения соединения, имеющего общую формулу (I).
[Формула 5]
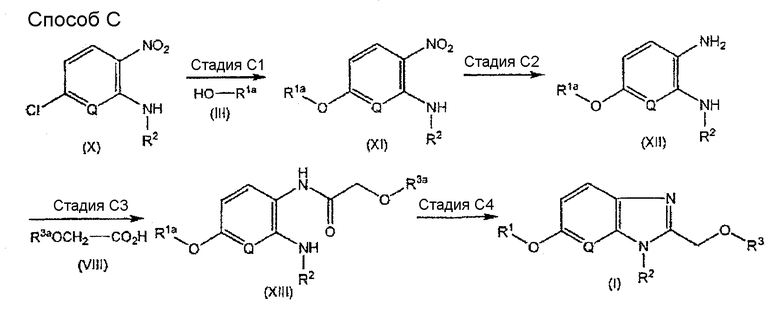
В настоящем изобретении R1, R2, R3, Q, R1a и R3a - такие, как определенные выше.
Стадия C1
Данная стадия является стадией получения соединения, имеющего общую формулу (XI).
Данную стадию проводят осуществлением взаимодействия соединения, имеющего общую формулу (X), которое является известным соединением или его легко получают из известного соединения в качестве исходного материала способом, подобным известному способу, с соединением, имеющим общую формулу (III), в растворителе в присутствии основания.
Растворителем, используемым на данной стадии, является предпочтительно амид, а более предпочтительно N,N-диметилформамид или N-метил-2-пирролидон.
Основанием, используемым на данной стадии, является предпочтительно гидрид щелочного металла, а более предпочтительно гидрид натрия.
Температура реакции на данной стадии составляет обычно -78°C-150°C, а предпочтительно 0°C-100°C.
Время реакции на данной стадии составляет обычно 0,5-48 часов, а предпочтительно 1-24 часа.
Стадия C2
Данная стадия является стадией получения соединения, имеющего общую формулу (XII).
Данную стадию осуществляют таким же способом, как стадию A2 указанного выше способа A, осуществлением взаимодействия соединения, имеющего общую формулу (XI), с железом в растворителе в присутствии хлорида аммония или восстановления соединения, имеющего общую формулу (XI), в растворителе в присутствии палладиевого катализатора в атмосфере водорода.
Стадия C3
Данная стадия является стадией получения соединения, имеющего общую формулу (XIII).
Данную стадию осуществляют таким же способом, как стадию B1 указанного выше способа B, осуществлением взаимодействия соединения, имеющего общую формулу (XII), с соединением, имеющим общую формулу (VIII), в растворителе в присутствии конденсирующего агента и основания.
Стадия C4
Данная стадия является стадией получения соединения, имеющего общую формулу (I).
Данную стадию проводят осуществлением взаимодействия соединения, имеющего общую формулу (XIII), с уксусной кислотой таким же способом, как на стадии B2 указанного выше способа B, и затем удаления, когда требуется, защитной группы или групп для аминогруппы, гидроксигруппы и/или карбоксильной группы в R1a и/или R3a.
Исходное соединение, имеющее общую формулу (II), (III), (VII), (VIII) или (X), является известным соединением или его легко получают из известного соединения в качестве исходного материала известным способом или способом, подобным известному способу.
Защитная группа для "аминогруппы, которая может быть защищена", "гидроксигруппы, которая может быть защищена" и "карбоксильной группы, которая может быть защищена", определенная выше для R1a и R3a, относится к защитной группе, которая может быть удалена химическим методом, таким как гидрогенолиз, гидролиз, электролиз или фотолиз, и является защитной группой, обычно используемой в химии органического синтеза (см., например, T. W. Greene et al., Protective Groups in Organic Synthesis, 3rd Edition, John Wiley & Sons, Inc. (1999)).
"Защитную группу" для "гидроксигруппы, которая может быть защищена", определенной выше для R1a и R3a, особо не ограничивают, лишь бы она была защитной группой для гидроксигруппы, используемой в области химии органического синтеза; указанная защитная группа является, например, "обычной защитной группой для гидроксигруппы, представляющей собой сложный эфир". Предпочтительные примеры защитной группы включают формильную группу; "алкилкарбонильные группы", такие как указанные выше, "C2-C7 алкилкарбонильные группы", галогенированные алкилкарбонильные группы, такие как хлорацетил, дихлорацетил, трихлорацетил и трифторацетил, алкоксиалкилкарбонильные группы, такие как метоксиацетил, и ненасыщенные алкилкарбонильные группы, такие как акрилоил, пропиолоил, метакрилоил, кротоноил, изокротоноил и (E)-2-метил-2-бутеноил; "арилкарбонильные группы", такие как арилкарбонильные группы, такие как бензоил, α-нафтоил и β-нафтоил, галогенированные арилкарбонильные группы, такие как 2-бромбензоил и 4-хлорбензоил, C1-C6 алкилированные арилкарбонильные группы, такие как 2,4,6-триметилбензоил и 4-толуоил, C1-C6 алкоксилированные арилкарбонильные группы, такие как 4-анизоил, нитрированные арилкарбонильные группы, такие как 4-нитробензоил и 2-нитробензоил, C2-C7 алкоксикарбонилированные арилкарбонильные группы, такие как 2-(метоксикарбонил)бензоил, и арилированные арилкарбонильные группы, такие как 4-фенилбензоил; "алкоксикарбонильные группы", такие как указанные выше "C2-C7 алкоксикарбонильные группы" и C2-C7 алкоксикарбонильные группы, замещенные галогеном или три-(C1-C6 алкил)силильной группой, такие как 2,2,2-трихлорэтоксикарбонил и 2-триметилсилилэтоксикарбонил; "тетрагидропиранильные или тетрагидротиопиранильные группы", такие как тетрагидропиран-2-ил, 3-бромтетрагидропиран-2-ил, 4-метокситетрагидропиран-4-ил, тетрагидротиопиран-2-ил и 4-метокситетрагидротиопиран-4-ил; "тетрагидрофуранильные или тетрагидротиофуранильные группы", такие как тетрагидрофуран-2-ил и тетрагидротиофуран-2-ил; "силильные группы", такие как три-(C1-C6 алкил)силильные группы, такие как триметилсилил, триэтилсилил, изопропилдиметилсилил, трет-бутилдиметилсилил, метилдиизопропилсилил, метилди-трет-бутилсилил и триизопропилсилил, и (C1-C6 алкил)диарилсилильные или ди-(C1-C6 алкил)арилсилильные группы, такие как дифенилметилсилил, дифенилбутилсилил, дифенилизопропилсилил и фенилдиизопропилсилил; "алкоксиметильные группы", такие как (C1-C6 алкокси)метильные группы, такие как метоксиметил, 1,1-диметил-1-метоксиметил, этоксиметил, пропоксиметил, изопропоксиметил, бутоксиметил и трет-бутоксиметил, (C1-C6 алкокси)-(C1-C6 алкокси)метильные группы, такие как 2-метоксиэтоксиметил, и (C1-C6 галогенированные алкокси)метильные группы, такие как 2,2,2-трихлорэтоксиметил и бис(2-хлорэтокси)метил; "замещенные этильные группы", такие как (C1-C6 алкокси)этильные группы, такие как 1-этоксиэтил и 1-(изопропокси)этил, и галогенированные этильные группы, такие как 2,2,2-трихлорэтил; "аралкильные группы", такие как C1-C6 алкильные группы, замещенные 1-3 арильными группами, такие как бензил, α-нафтилметил, β-нафтилметил, дифенилметил, трифенилметил, α-нафтилдифенилметил и 9-антрилметил, и C1-C6 алкильные группы, замещенные 1-3 арильными группами, содержащими арильный цикл, замещенный C1-C6 алкилом, C1-C6 алкокси, нитро, галогеном или цианогруппой, такие как 4-метилбензил, 2,4,6-триметилбензил, 3,4,5-триметилбензил, 4-метоксибензил, 4-метоксифенилдифенилметил, 2-нитробензил, 4-нитробензил, 4-хлорбензил, 4-бромбензил и 4-цианобензил; "алкенилоксикарбонильные группы", такие как винилоксикарбонил и аллилоксикарбонил; и "аралкилоксикарбонильные группы", содержащие арильный цикл, который может быть замещен 1 или 2 C1-C6 алкокси- или нитрогруппами, такие как бензилоксикарбонил, 4-метоксибензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 2-нитробензилоксикарбонил и 4-нитробензилоксикарбонил. Алкилкарбонильные группы, силильные группы или аралкильные группы являются более предпочтительными.
"Защитную группу" для "карбоксильной группы, которая может быть защищена", определенной выше для R1a и R3a, особо не ограничивают, лишь бы она была защитной группой для карбоксильной группы, используемой в области химии органического синтеза; указанная защитная группа является, например, "обычной защитной группой для карбоксильной группы, представляющей собой сложный эфир". Предпочтительные примеры защитной группы включают указанные выше "C1-C6 алкильные группы"; "C2-C6 алкенильные группы", такие как этенил, 1-пропенил и 2-пропенил; "C2-C6 алкинильные группы", такие как этинил, 1-пропинил и 2-пропинил; указанные выше "C1-C6 галогенированные алкильные группы"; указанные выше "C1-C6 гидроксиалкильные группы"; (C2-C7 алкилкарбонил)-(C1-C6 алкильные группы), такие как ацетилметил; указанные выше "аралкильные группы" и указанные выше "силильные группы". C1-C6 алкильные группы или аралкильные группы являются более предпочтительными.
"Защитную группу" для "аминогруппы, которая может быть защищена", определенной выше для R1a и R3a, особо не ограничивают, лишь бы она была защитной группой для аминогруппы, используемой в области химии органического синтеза; указанная защитная группа представляет собой, например, такую же "алкилкарбонильную группу"; "арилкарбонильную группу"; "алкоксикарбонильную группу"; "силильную группу"; "аралкильную группу"; "алкенилоксикарбонильную группу" или "аралкилоксикарбонильную группу", как "обычная защитная группа для гидроксигруппы, представляющей собой сложный эфир", или "замещенную метиленовую группу, образующую основание Шиффа, такую как N,N-диметиламинометилен, бензилиден, 4-метоксибензилиден, 4-нитробензилиден, салицилиден, 5-хлорсалицилиден, дифенилметилен или (5-хлор-2-гидроксифенил)фенилметилен, и предпочтительно является алкилкарбонильной группой, арилкарбонильной группой или алкоксикарбонильной группой, а более предпочтительно - алкоксикарбонильной группой.
Стадии, заключающиеся в защите и снятии защиты, осуществляют в соответствии с известными способами (такими как способ, описанный в "Protective Groups in Organic Synthesis" (Theodora W. Greene, Peter G. M. Wuts, 1999, published by A Wiley-Interscience Publication)).
Конденсированное бициклическое гетероарильное соединение или его фармакологически приемлемая соль общей формулы (I) в соответствии с настоящим изобретением при применении в качестве лекарственного средства может быть введено(а), например, перорально в виде таблетки, капсулы, гранулы, порошка или сиропа или парентерально в виде лекарственной формы для инъекций или суппозитория в отдельности или в смеси с подходящим фармакологически приемлемым наполнителем, разбавителем или тому подобным.
Указанные препараты получают получают известными способами, используя добавки, такие как наполнители (примеры которых включают органические наполнители, такие как производные сахара, такие как лактоза, сахароза, глюкоза, маннит и сорбит; производные крахмала, такие как кукурузный крахмал, картофельный крахмал, α-крахмал и декстрин; производные целлюлозы, такие как кристаллическая целлюлоза; аравийскую камедь; декстран и пуллулан; и неорганические наполнители, такие как производные силиката, такие как легкий кремниевый ангидрид, синтетический алюмосиликат, силикат кальция и алюмометасиликат магния; фосфаты, такие как гидрофосфат кальция; карбонаты, такие как карбонат кальция, и сульфаты, такие как сульфат кальция), смазывающие вещества (примеры которых включают стеариновую кислоту и металлические соли стеариновой кислоты, такие как стеарат кальция и стеарат магния; тальк; коллоидальный диоксид кремния; воски, такие как veegum и спермацет; борную кислоту; адипиновую кислоту; сульфаты, такие как сульфат натрия; гликоль; фумаровую кислоту; бензоат натрия; DL-лейцин; натриевые соли жирных кислот; лаурилсульфаты, такие как лаурилсульфат натрия и лаурилсульфат магния; кремниевые кислоты, такие как кремниевый ангидрид и гидрат кремниевой кислоты; и указанные выше производные крахмала), связывающие вещества (примеры которых включают гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон, макрогол и соединения, подобные указанным выше наполнителям), разрыхлители (примеры которых включают производные целлюлозы, такие как низкозамещенная гидроксипропилцеллюлоза, карбоксиметилцеллюлоза, кальций-карбоксиметилцеллюлоза и внутренне сшитая натрий-карбоксиметилцеллюлоза, и химически модифицированные крахмалы, такие как карбоксиметилкрахмал, натрий-карбоксиметилкрахмал, стабилизаторы (примеры которых включают эфиры пара-гидроксибензойной кислоты, такие как метилпарабен и пропилпарабен; спирты, такие как хлорбутанол, бензиловый спирт и фенилэтиловый спирт; хлорид бензалкония; фенолы, такие как фенол и крезол; тимеросал; дегидроуксусную кислоту и сорбиновую кислоту), корригенты (примеры которых включают обычно используемые подсластители, подкислители и вкусовые вещества) и разбавители.
Доза препарата изменяется в соответствии с симтомами, возрастом и тому подобным пациента (теплокровное животное, в частности человек). Однако препарат вводят предпочтительно перорально с дозой от 0,0015 мг/кг массы тела (предпочтительно 0,008 мг/кг массы тела) в сутки при нижнем пределе до 70 мг/кг массы тела (предпочтительно 7 мг/кг массы тела) в сутки при верхнем пределе или внутривенно с дозой от 0,00015 мг/кг массы тела (предпочтительно 0,0008 мг/кг массы тела) в сутки при нижнем пределе до 8,5 мг/кг массы тела (предпочтительно 5 мг/кг массы тела) в сутки при верхнем пределе взрослому один-шесть раз в сутки в соответствии с симтомами.
ПРИМЕРЫ
Далее настоящее изобретение описано более подробно на примерах, примерах испытаний и примерах изготовления, однако объем настоящего изобретения ими не ограничивается.
Хроматографическое элюирование в примерах проводили под контролем с использованием ТСХ (тонкослойная хроматография). При контроле ТСХ в качестве пластинки для ТСХ использовали силикагель 60F254 производства Merck & Co., Inc., в качестве проявляющего растворителя использовали растворитель, применяемый в колоночной хроматографии в качестве элюирующего растворителя и в качестве метода детектирования использовали метод УФ-детектирования. В качестве силикагеля для колонки использовали силикагель SK-85 (230-400 меш) или силикагель SK-34 (70-230 меш) также производства Merck & Co., Inc. или Chromatorex NH (200-350 меш) производства Fuji Silysia Chemical Ltd. В дополнение к обычной системе для колоночной хроматографии подходящим образом использовали систему для автоматической хроматографии производства Biotage AB (SP-1). Сокращения, используемые в примерах, имеют следующие значения:
мг: миллиграмм, г: грамм, мл: миллилитр, МГц (MHz): мегагерц.
В следующих ниже примерах химические сдвиги в спектре ядерного магнитного резонанса (далее 1H ЯМР) представлены в значениях δ (м.д.) с использованием тетраметилсилана в качестве стандартного вещества. Что касается спектрограмм разделения, то с (s) представляет синглет, д (d) представляет дублет, т (t) представляет триплет, кв (q) представляет квартет, квинт (quint) представляет квинтет и сеп (sep) представляет септет.
Масс-спектрометрию (далее МС (MS)) осуществляли FAB (бомбардировкой быстрыми атомами), EI (электронной ионизацией) или ESI (электронной распылительной ионизацией).
(Пример 1) Дигидрохлорид метил 3-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата (дигидрохлорид соединения № 1-132)
(1a) [6-(4-трет-Бутоксикарбониламино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
[6-(4-Амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол ((13 г, 43,7 ммоль) Japanese Patent Laid-Open No. 2004-123711) и (Boc)2O (19 г, 87 ммоль) растворяли в 150 мл изопропанола с последующим перемешиванием в течение ночи. Реакционный раствор разбавляли этилацетатом, промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Затем растворитель выпаривали. Остаток подвергали хроматографии на колонке с силикагелем (10% метанол-этилацетат). Полученное пенообразное вещество кристаллизовали из смеси этилацетата и гексана с получением требуемого соединения (4,5 г, выход: 26%).
1H-ЯМР (CDCl3, 400 МГц) δ: 1,26 (9H, с), 2,21 (6H, с), 3,75 (3H, с), 4,89 (2H, с), 6,67 (2H, с), 6,93 (1H, д, J=2 Гц), 6,96 (1H, дд, J=2, 9 Гц), 7,63 (1H, д, J=9 Гц).
(1b) Дигидрохлорид метил 3-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата
Три-н-бутилфосфин (0,41 г, 2,0 ммоль) и 1,1'-(азодикарбонил)дипиперидин (0,50 г, 2,0 ммоль) добавляли к раствору {6-[4-(трет-бутилоксикарбониламино)-3,5-диметилфенокси]-1-метил-1H-бензимидазол-2-ил}метанола (0,40 г, 1,0 ммоль) и метил 3-гидроксибензоата (0,23 г, 1,5 ммоль) в толуоле с последующим перемешиванием в течение 10 часов. Реакционный раствор концентрировали и затем очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 1/2). Затем добавляли 4 н. раствор хлористоводорода в 1,4-диоксане (10 мл) с последующим перемешиванием в течение двух часов. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали этилацетатом и простым эфиром. Требуемое указанное в заголовке соединение (0,32 г, выход: 63%) получали сушкой при пониженном давлении.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,25 (6H, с), 3,87 (3H, с), 3,87 (3H, с), 5,60 (2H, с), 6,74 (2H, с), 7,03 (1H, д, J=8,8 Гц), 7,41 (1H, с), 7,45 (1H, д, J=8,3 Гц), 7,52 (1H, дд, J=7,8, 8,3 Гц), 7,63 (1H, д, J=7,8 Гц), 7,69 (1H, с), 7,72 (1H, д, J=8,8 Гц).
МС (ESI+) m/z: 432 (M+H)+.
МСВР(HRMS) (ESI+) m/Z: 432,19037 (M+H)+, вычислено 432,19233 (-1,96 mmu).
(Пример 2) Дигидрохлорид 3-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойной кислоты (дигидрохлорид соединения № 1-131)
1 н. водный раствор гидроксида натрия (10 мл, 10 ммоль) добавляли к раствору дигидрохлорида метил 3-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата, синтезированного в примере 1 (0,22 г, 0,4 ммоль), в 1,4-диоксане и смесь перемешивали при 60°C в течение двух часов. Реакционный раствор обрабатывали концентрированной хлористоводородной кислотой (1,5 мл) и затем концентрировали. Полученное твердое вещество промывали водой и этилацетатом и сушили при пониженном давлении с получением требуемого указанного в заголовке соединения (0,12 г, выход: 61%).
Т.пл. 235-239°C.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,30 (6H, с), 3,91 (3H, с), 5,65 (2H, с), 6,78 (2H, с), 7,11 (1H, дд, J=2,0, 8,8 Гц), 7,43 (1H, д, J=7,8 Гц), 7,49 (1H, дд, J=7,8, 7,8 Гц), 7,51 (1H, д, J=2,0 Гц), 7,63 (1H, д, J=7,8 Гц), 7,76 (1H, д, J=8,8 Гц).
МС (ESI+) m/z: 418 (M+H)+, 440 (M+Na)+, 462 (M+2Na-H)+.
МСВР (ESI+) m/Z: 418,18023 (M+H)+, вычислено 418,17668 (3,55 mmu).
(Пример 3) Дигидрохлорид этил 4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата (дигидрохлорид соединения № 1-134)
Три-н-бутилфосфин (0,41 г, 2,0 ммоль) и 1,1'-(азодикарбонил)дипиперидин (0,50 г, 2,0 ммоль) добавляли к раствору {6-[4-(трет-бутилоксикарбониламино)-3,5-диметилфенокси]-1-метил-1H-бензимидазол-2-ил}метанола (0,40 г, 1,0 ммоль) и этил 4-гидроксибензоата (0,25 г, 1,5 ммоль) в толуоле с последующим перемешиванием в течение 10 часов. Реакционный раствор концентрировали и затем очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 1/2). Затем добавляли 4 н. раствор хлористоводорода в 1,4-диоксане (10 мл) с последующим перемешиванием в течение двух часов. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали этилацетатом и простым эфиром. Требуемое указанное в заголовке соединение (0,35 г, выход: 67%) получали сушкой при пониженном давлении.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 1,31 (3H, т, J=7,0 Гц), 2,12 (6H, с), 3,90 (3H, с), 4,29 (2H, кв., J=7,0 Гц), 5,66 (2H, с), 6,71 (2H, с), 7,10 (1H, д, J=8,8 Гц), 7,29 (2H, д, J=8,8 Гц), 7,51 (1H, с), 7,75 (1H, д, J=8,8 Гц), 7,98 (2H, д, J=8,8 Гц).
МС (ESI+) m/z: 446 (M+H)+.
МСВР (ESI+) m/Z: 446,20801 (M+H)+, вычислено 446,20798 (0,03 mmu).
(Пример 4) Дигидрохлорид 4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойной кислоты (дигидрохлорид соединения № 1-133)
1 н. водный раствор гидроксида натрия (10 мл, 10 ммоль) добавляли к раствору дигидрохлорида этил 4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата (0,26 г, 0,4 ммоль) в 1,4-диоксане и смесь перемешивали при 60°C в течение двух часов. Реакционный раствор обрабатывали концентрированной хлористоводородной кислотой (1,5 мл) и затем концентрировали. Полученное твердое вещество промывали водой и этилацетатом и сушили при пониженном давлении с получением требуемого указанного в заголовке соединения (0,15 г, выход: 77%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,30 (6H, с), 3,89 (3H, с), 5,64 (2H, с), 6,77 (2H, с), 7,08 (1H, д, J=8,8 Гц), 7,25 (2H, д, J=8,8 Гц), 7,49 (1H, с), 7,75 (1H, д, J=8,8 Гц), 7,95 (2H, д, J=8,8 Гц).
МС (ESI+) m/z: 418 (M+H)+.
МСВР (ESI+) m/Z: 418,17523 (M+H)+, вычислено 418,17668 (-1,45 mmu).
(Пример 5) Дигидрохлорид этил 2-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата (дигидрохлорид соединения № 1-130)
Три-н-бутилфосфин (0,41 г, 2,0 ммоль) и 1,1'-(азодикарбонил)дипиперидин (0,50 г, 2,0 ммоль) добавляли к раствору {6-[4-(трет-бутилоксикарбониламино)-3,5-диметилфенокси]-1-метил-1H-бензимидазол-2-ил}метанола (0,40 г, 1,0 ммоль) и этил 2-гидроксибензоата (0,23 г, 1,5 ммоль) в толуоле с последующим перемешиванием в течение 10 часов. Реакционный раствор концентрировали и затем очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 1/2). Затем добавляли 4 н. раствор хлористоводорода в 1,4-диоксане (10 мл) с последующим перемешиванием в течение двух часов. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали этилацетатом и простым эфиром. Требуемое указанное в заголовке соединение (0,34 г, выход: 65%) получали сушкой при пониженном давлении.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 1,20 (3H, т, J=7,2 Гц), 2,33 (6H, с), 3,94 (3H, с), 4,23 (2H, кв., J=7,2 Гц), 5,64 (2H, с), 6,79 (2H, с), 7,11 (1H, д, J=8,8 Гц), 7,13 (1H, дд, J=7,3, 7,8 Гц), 7,45 (1H, д, J=8,4 Гц), 7,55 (1H, с), 7,60 (1H, ддд, J=1,4, 7,3, 8,4 Гц), 7,72 (1H, дд, J=1,4, 7,8 Гц), 7,77 (1H, д, J=8,8 Гц).
МС (ESI+) m/z: 446 (M+H)+, 468 (M+Na)+.
МСВР (ESI+) m/Z: 446,21002 (M+H)+, вычислено 446,20798 (2,04 mmu).
(Пример 6) Дигидрохлорид 2-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойной кислоты (дигидрохлорид соединения № 1-129)
1 н. водный раствор гидроксида натрия (10 мл, 10 ммоль) добавляли к раствору дигидрохлорида этил 3-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата (0,26 г, 0,4 ммоль) в 1,4-диоксане и смесь перемешивали при 60°C в течение двух часов. Реакционный раствор обрабатывали концентрированной хлористоводородной кислотой (1,5 мл) и затем концентрировали. Полученное твердое вещество промывали водой и этилацетатом и сушили при пониженном давлении с получением требуемого указанного в заголовке соединения (0,13 г, выход: 66%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,30 (6H, с), 3,92 (3H, с), 5,62 (2H, с), 6,87 (2H, с), 7,10 (1H, м), 7,11 (1H, м), 7,43 (1H, д, J=8,3 Гц), 7,55 (1H, м), 7,58 (1H, с), 7,69 (1H, дд, J=1,4, 7,6 Гц), 7,75 (1H, д, J=8,8 Гц).
МС (ESI+) m/z: 418 (M+H)+.
МСВР (ESI+) m/Z: 418,17421 (M+H)+, вычислено 418,17668 (-2,47 mmu).
(Пример 7) Гидрохлорид метил 3-{[6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата (гидрохлорид соединения № 1-36)
(7a) трет-Бутил [5-(3-фторфенокси)-2-нитрофенил]метилкарбамат
Трет-бутоксид калия (3,93 г, 35,0 ммоль) добавляли к раствору 3-фторфенола (3,53 г, 31,5 ммоль) и трет-бутил (5-хлор-2-нитрофенил)метилкарбамата (8,60 г, 30,0 ммоль) в N,N-диметилацетамиде (15 мл) и тетрагидрофуране (60 мл) при охлаждении льдом и смесь перемешивали при 100°C в течение 30 часов. Реакционный раствор концентрировали и добавляли к нему этилацетат (200 мл) и воду (200 мл) с последующим экстрагированием. Органический слой сушили и концентрировали с получением требуемого указанного в заголовке соединения (9,21 г, выход: 81%).
(7b) (6-Фтор-1-метил-1H-бензимидазол-2-ил)метанол
Железный порошок (7,53 г, 135,0 ммоль) добавляли к раствору трет-бутил [5-(3-фторфенокси)-2-нитрофенил]метилкарбамата (9,21 г, 25,4 ммоль) и хлорида аммония (0,80 г, 15,0 ммоль) в воде (30 мл) и этаноле (120 мл) и смесь перемешивали при 70°C в течение девяти часов. Реакционный раствор концентрировали и к полученному коричневому твердому веществу добавляли 4 н. хлористоводородную кислоту (90 мл). Смесь перемешивали при 120°C в течение 30 минут с получением гомогенного раствора. Гликолевую кислоту (6,84 г, 90,0 ммоль) добавляли к раствору и смесь перемешивали при 120°C в течение четырех часов. Реакционный раствор концентрировали и затем подщелачивали постепенным добавлением 2 н. водного раствора гидроксида натрия, чтобы осадить твердое вещество. Полученное твердое вещество перекристаллизовывали из этанола с получением требуемого указанного в заголовке соединения (4,90 г, выход: 71%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,80 (3H, с), 4,71 (2H, д, J=5,5 Гц), 5,59 (1H, т, J=5,5 Гц), 6,75-6,82 (2H, м), 6,87-6,97 (2H, м), 7,33-7,42 (2H, м), 7,62 (1H, д, J=8,6 Гц).
(7c) Гидрохлорид метил 3-{[6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата
Три-н-бутилфосфин (0,61 г, 3,0 ммоль) и 1,1'-(азодикарбонил)дипиперидин (0,76 г, 3,0 ммоль) добавляли к раствору [6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метанола (0,41 г, 1,5 ммоль) и метил 3-гидроксибензоата (0,34 г, 2,3 ммоль) в толуоле с последующим перемешиванием в течение 10 часов. Реакционный раствор концентрировали и затем очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 1/2). Затем добавляли 4 н. раствор хлористоводорода в 1,4-диоксане (10 мл) с последующим перемешиванием в течение двух часов. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали этилацетатом и простым эфиром. Требуемое указанное в заголовке соединение (0,43 г, выход: 64%) получали сушкой при пониженном давлении.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,87 (3H, с), 3,90 (3H, с), 5,62 (2H, с), 6,82 (1H, ддд, J=0,8, 2,4, 8,2 Гц), 6,86 (1H, ддд, J=2,4, 2,4, 8,2 Гц), 6,96 (1H, дддд, J=0,8, 2,4, 8,4, 8,4 Гц), 7,14 (1H, дд, J=2,2, 8,8 Гц), 7,41 (1H, ддд, J=6,9, 8,2, 8,4 Гц), 7,46 (1H, ддд, J=1,1, 2,6, 8,2 Гц), 7,52 (1H, дд, J=7,5, 8,2 Гц), 7,59 (1H, д, J=2,2 Гц), 7,64 (1H, ддд, J=1,1, 1,5, 7,5 Гц), 7,70 (1H, дд, J=1,5, 2,6 Гц), 7,78 (1H, д, J=8,8 Гц).
МС (ESI+) m/z: 407 (M+H)+, 429 (M+Na)+.
МСВР (ESI+) m/Z: 407,13957 (M+H)+, вычислено 407,14071 (-1,14 mmu).
(Пример 8) Гидрохлорид 3-{[6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойной кислоты (гидрохлорид соединения № 1-35)
1 н. водный раствор гидроксида натрия (15 мл, 15 ммоль) добавляли к раствору гидрохлорида метил 3-{[6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата, синтезированного в примере 7 (0,33 г, 0,74 ммоль), в 1,4-диоксане и смесь перемешивали при 60°C в течение двух часов. Реакционный раствор обрабатывали концентрированной хлористоводородной кислотой (2,5 мл) и затем концентрировали. Полученное твердое вещество промывали водой и этилацетатом и сушили при пониженном давлении с получением требуемого указанного в заголовке соединения (0,22 г, выход: 69%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,95 (3H, с), 5,70 (2H, с), 6,85 (1H, ддд, J=0,8, 2,4, 8,2 Гц), 6,89 (1H, ддд, J=2,3, 2,4, 8,2 Гц), 6,99 (1H, дддд, J=0,8, 2,3, 8,2, 8,4 Гц), 7,24 (1H, дд, J=2,2, 8,9 Гц), 7,42 (1H, ддд, J=6,9, 8,2, 8,2 Гц), 7,45 (1H, ддд, J=1,1, 2,6, 8,2 Гц), 7,51 (1H, дд, J=7,5, 8,2 Гц), 7,64 (1H, ддд, J=1,1, 1,3, 7,5 Гц), 7,69 (1H, д, J=2,23 Гц), 7,71 (1H, дд, J=1,3, 2,6 Гц), 7,84 (1H, д, J=8,9 Гц).
MS (ESI+) m/z: 393 (M+H)+, 415 (M+Na)+, 437 (M+2Na-H)+.
МСВР (ESI+) m/Z: 393,12228 (M+H)+, вычислено 393,12506 (-2,78 mmu).
(Пример 9) Гидрохлорид метил 3-{[6-(4-хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата (гидрохлорид соединения № 1-100)
(9a) трет-Бутил [(4-хлор-3-фторфенокси)-2-нитрофенил]метилкарбамат
Гидрид натрия (>56% в масле, 1,31 г, 30,0 ммоль) добавляли к раствору 4-хлор-3-фторфенола (4,94 г, 30,0 ммоль) и трет-бутил (5-хлор-2-нитрофенил)метилкарбамата (8,60 г, 30,0 ммоль) в N,N-диметилформамиде (150 мл) при охлаждении льдом. Смесь постепенно нагревали до комнатной температуры и затем нагревали до 80°C с последующим непосредственным перемешиванием в течение восьми часов. Реакционному раствору давали еще постоять при комнатной температуре в течение ночи и затем перемешивали при 80°C еще в течение одного часа. Дав реакционному раствору охладиться до комнатной температуры, добавляли к нему воду и насыщенный раствор соли с последующим экстрагированием этилацетатом три раза. Органические слои объединяли и сушили над сульфатом магния и выпаривали при пониженном давлении растворитель. Остаток очищали хроматографией на силикагеле с получением требуемого соединения (12,63 г, выход: 100%) в виде бледно-желтых игольчатых кристаллов.
1H-ЯМР (CDCl3, 400 МГц) δ: 1,32 (9H, с), 3,26 (3H, с), 6,85-6,92 (4H, м), 7,43 (1H, т, J=8,6 Гц), 7,93 (1H, т, J=8,6 Гц).
(9b) [6-(4-Хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
трет-Бутил [(4-хлор-3-фторфенокси)-2-нитрофенил]метилкарбамат (12,62 г, 30,0 ммоль) растворяли в этаноле (150 мл) и воде (75 мл). Затем добавляли железный порошок (8,03 г, 150 ммоль) и хлорид аммония (803,2 мг, 15,0 ммоль) и смесь нагревали при кипячении с обратным холодильником в течение 4,5 часов. Реакционному раствору давали охладиться и затем разбавляли водой, насыщенным раствором соли и этилацетатом и фильтровали его через целит. Фильтрат разделяли и органический слой сушили над сульфатом магния. Затем выпаривали при пониженном давлении растворитель с получением трет-бутил [2-амино-5-(4-хлор-3-фторфенокси)фенил]метилкарбамата в виде белого твердого вещества (12,01 г, выход: 100%). К полученному продукту добавляли гликолевую кислоту (3,42 г, 45,0 ммоль) и 4 н. раствор хлористоводородной кислоты в 1,4-диоксане (150 мл) и смесь нагревали при кипячении с обратным холодильником в течение двух часов. Реакционный раствор медленно вливали в насыщенный водный раствор бикарбоната натрия при охлаждении льдом. Добавляли далее диизопропиловый эфир с последующим перемешиванием. Через несколько минут образовывался бледно-желтый порошок. Порошок собирали фильтрованием, последовательно промывали смешанным раствором из этилацетата и н-гексана и водой и сушили с получением требуемого соединения (3,85 г, выход: 42%) в виде бледно-желтого порошок.
H-ЯМР (CDCl3, 400 МГц) δ: 3,78 (3H, с), 4,88 (2H, с), 6,69 (1H, дд, J=3,9, 10,1 Гц), 6,73 (1H, дд, J=3,2, 10,1 Гц), 6,93-6,95 (2H, м), 7,28 (1H, т, J=8,7 Гц), 7,05 (1H, д, J=8,7 Гц).
(9c) Гидрохлорид метил 3-{[6-(4-хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата
Три-н-бутилфосфин (0,61 г, 3,0 ммоль) и 1,1'-(азодикарбонил)дипиперидин (0,76 г, 3,0 ммоль) добавляли к раствору [6-(4-хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метанола (0,46 г, 1,5 ммоль) и метил 3-гидроксибензоата (0,34 г, 2,3 ммоль) в толуоле с последующим перемешиванием в течение 10 часов. Реакционный раствор концентрировали и затем очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 1/2). Затем добавляли 4 н. раствор хлористоводорода в 1,4-диоксане (10 мл) с последующим перемешиванием в течение двух часов. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали этилацетатом и простым эфиром. Требуемое указанное в заголовке соединение (0,44 г, выход: 61%) получали сушкой при пониженном давлении.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,87 (3H, с), 3,92 (3H, с), 5,66 (2H, с), 6,88 (1H, ддд, J=1,3, 2,8, 8,9 Гц), 7,15 (1H, дд, J=2,8, 10,8 Гц), 7,21 (1H, дд, J=2,2, 8,8 Гц), 7,47 (1H, ддд, J=1,1, 2,6, 8,3 Гц), 7,53 (1H, дд, J=7,5, 8,3 Гц), 7,59 (1H, дд, J=8,8, 8,9 Гц), 7,64 (1H, ддд, J=1,1, 1,5, 7,5 Гц), 7,65 (1H, д, J=2,2 Гц), 7,71 (1H, дд, J=1,5, 2,6 Гц), 7,81 (1H, д, J=8,8 Гц).
МС (ESI+) m/z: 441 (M+H)+, 443 (M+H+2)+, 463 (M+Na)+, 465 (M+Na+2)+.
МСВР (ESI+) m/Z: 441,10171 (M+H)+, вычислено 441,10174 (-0,03 mmu).
(Пример 10) Гидрохлорид 3-{[6-(4-хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойной кислоты (гидрохлорид соединения № 1-99)
1 н. водный раствор гидроксида натрия (10 мл, 10 ммоль) добавляли к раствору гидрохлорида метил 3-{[6-(4-хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата, синтезированного в примере 9 (0,33 г, 0,69 ммоль), в 1,4-диоксане и смесь перемешивали при 60°C в течение двух часов. Реакционный раствор обрабатывали концентрированной хлористоводородной кислотой (1,5 мл) и затем концентрировали. Полученное твердое вещество промывали водой и этилацетатом и сушили при пониженном давлении с получением требуемого указанного в заголовке соединения (0,23 г, выход: 72%).
Т.пл. 197-201°C.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,94 (3H, с), 5,68 (2H, с), 6,88 (1H, ддд, J=1,3, 2,8, 8,9 Гц), 7,16 (1H, дд, J=2,8, 10,7 Гц), 7,23 (1H, дд, J=2,2, 8,8 Гц), 7,44 (1H, ддд, J=1,1, 2,6, 8,3 Гц), 7,50 (1H, дд, J=7,6, 8,3 Гц), 7,59 (1H, дд, J=8,8, 8,9 Гц), 7,63 (1H, ддд, J=1,1, 1,3, 7,6 Гц), 7,68 (1H, д, J=2,2 Гц), 7,70 (1H, дд, J=1,3, 2,6 Гц), 7,82 (1H, д, J=8,8 Гц).
МС (ESI+) m/z: 427 (M+H)+, 429 (M+H+2)+, 449 (M+Na)+, 451 (M+Na+2)+.
МСВР (ESI+) m/Z: 427,08529 (M+H)+, вычислено 427,08609 (-0,80 mmu).
(Пример 11) Гидрохлорид метил 3-{[6-(3-хлор-4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата (гидрохлорид соединения № 1-116)
(11a) трет-Бутил [(3-хлор-4-фторфенокси)-2-нитрофенил]метилкарбамат
Требуемое соединение (15,50 г, выход: 100%) получали в виде бледно-желтых игольчатых кристаллов синтезом из 3-хлор-4-фторфенола (5,97 г, 36,7 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамата (10,40 г, 36,3 ммоль), гидрида натрия (>56% в масле, 1,58 г, 36,3 ммоль) и N,N-диметилформамида (200 мл) таким же способом, как в примере 7a.
1H-ЯМР (CDCl3, 400 МГц) δ: 1,32 (9H, с), 3,26 (3H, с), 6,79-6,85 (2H, м), 6,95-6,97 (1H, м), 7,15-7,18 (2H, м), 7,91-7,93 (1H, м).
(11b) трет-Бутил [2-амино-5-(3-хлор-4-фторфенокси)фенил]метилкарбамат
Требуемое соединение получали в виде коричневых кристаллов (6,98 г, выход: 93%) синтезом из трет-бутил [(3-хлор-4-фторфенокси)-2-нитрофенил]метилкарбамата (7,51 г, 18,1 ммоль), железного порошка (4,84 г, 90,5 ммоль), хлорида аммония (0,48 г, 9,05 ммоль), этанола (100 мл) и воды (50 мл) таким же способом, как в примере 7b.
1H-ЯМР (CDCl3, 400 МГц) δ: 1,58 (9H, с), 3,14 (3H, с), 3,72 (1H, ушир.), 6,74-6,82 (4H, м), 6,90-6,99 (1H, м), 7,05 (1H, т, J=8,8 Гц).
(11c) [6-(3-Хлор-4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Требуемое соединение получали в виде коричневых кристаллов (2,42 г, выход: 48%) синтезом из трет-бутил [2-амино-5-(3-хлор-4-фторфенокси)фенил]метилкарбамата (6,89 г, 16,6 ммоль), гликолевой кислоты (1,89 г, 24,9 ммоль) и 4 н. раствора хлористоводородной кислоты в 1,4-диоксане (120 мл) таким же способом, как в примере 7b.
H-ЯМР (CDCl3, 400 МГц) δ: 3,78 (3H, с), 4,89 (2H, с), 6,85-7,00 (4H, м), 7,09 (1H, т, J=8,6 Гц), 7,05 (1H, д, J=8,8 Гц).
(11d) Гидрохлорид метил 3-{[6-(3-хлор-4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата
Три-н-бутилфосфин (0,61 г, 3,0 ммоль) и 1,1'-(азодикарбонил)дипиперидин (0,76 г, 3,0 ммоль) добавляли к раствору [6-(3-хлор-4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метанола (0,46 г, 1,5 ммоль) и метил 3-гидроксибензоата (0,34 г, 2,3 ммоль) в толуоле с последующим перемешиванием в течение 10 часов. Реакционный раствор концентрировали и затем очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 1/2). Затем добавляли 4 н. раствор хлористоводорода в 1,4-диоксане (10 мл) с последующим перемешиванием в течение двух часов. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали этилацетатом и простым эфиром. Требуемое указанное в заголовке соединение (0,48 г, выход: 67%) получали сушкой при пониженном давлении.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,87 (3H, с), 3,92 (3H, с), 5,66 (2H, с), 7,06 (1H, ддд, J=3,0, 3,9, 9,1 Гц), 7,19 (1H, дд, J=2,2, 8,9 Гц), 7,28 (1H, дд, J=3,0, 6,3 Гц), 7,46 (1H, дд, J=8,9, 9,1 Гц), 7,47 (1H, ддд, J=1,1, 2,2, 8,2 Гц), 7,53 (1H, дд, J=7,6, 8,2 Гц), 7,59 (1H, д, J=2,2 Гц), 7,65 (1H, ддд, J=1,1, 1,5, 7,6 Гц), 7,71 (1H, дд, J=1,5, 2,2 Гц), 7,79 (1H, д, J=8,9 Гц).
МС (ESI+) m/z: 441 (M+H)+, 443 (M+H+2)+, 463 (M+Na)+, 465 (M+Na+2)+.
МСВР (ESI+) m/Z: 441,10182 (M+H)+, вычислено 441,10174 (0,08 mmu).
(Пример 12) Гидрохлорид 3-{[6-(3-хлор-4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойной кислоты (гидрохлорид соединения № 1-115)
1 н. водный раствор гидроксида натрия (10 мл, 10 ммоль) добавляли к раствору гидрохлорида метил 3-{[6-(3-хлор-4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата, синтезированного в примере 11 (0,34 г, 0,7 ммоль), в 1,4-диоксане и смесь перемешивали при 60°C в течение двух часов. Реакционный раствор обрабатывали концентрированной хлористоводородной кислотой (1,5 мл) и затем концентрировали. Полученное твердое вещество промывали водой и этилацетатом и сушили при пониженном давлении с получением требуемого указанного в заголовке соединения (0,23 г, выход: 70%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,94 (3H, с), 5,69 (2H, с), 7,07 (1H, ддд, J=3,0, 3,9, 9,1 Гц), 7,22 (1H, дд, J=2,2, 8,9 Гц), 7,29 (1H, дд, J=3,0, 6,2 Гц), 7,44 (1H, ддд, J=1,1, 2,7, 8,2 Гц), 7,46 (1H, дд, J=9,1, 9,1 Гц), 7,50 (1H, дд, J=7,6, 8,2 Гц), 7,63 (1H, д, J=2,2 Гц), 7,64 (1H, ддд, J=1,1, 1,3, 7,6 Гц), 7,70 (1H, дд, J=1,3, 2,7 Гц), 7,82 (1H, д, J=8,9 Гц).
МС (ESI+) m/z: 427 (M+H)+, 429 (M+H+2)+, 449 (M+Na)+, 451 (M+Na+2)+.
МСВР (ESI+) m/Z: 427,08535 (M+H)+, вычислено 427,08609 (-0,74 mmu).
(Пример 13) Гидрохлорид метил 3-[(1-метил-6-фенокси-1H-бензимидазол-2-ил)метокси]бензоата (гидрохлорид соединения № 1-20)
(13a) (6-Фенокси-1-метил-1H-бензимидазол-2-ил)метанол
трет-Бутил 2-нитро-4-хлорфенил(метил)карбамат (22,5 г, 78,6 ммоль) и фенол (7,5 г, 78,6 ммоль) растворяли в тетрагидрофуране (180 мл) и ДМФА (20 мл). Добавляли гидрид натрия (3,4 г, 78,6 ммоль) и смесь перемешивали при 80°C в течение 10 часов. Реакционный раствор вливали в ледяную воду с последующим экстрагированием этилацетатом. Органический слой промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Затем выпаривали при пониженном давлении растворитель. Остаток растворяли в 250 мл этанола и добавляли 10% палладий-на-угле (8 г). Смесь перемешивали в атмосфере водорода при 60°C в течение четырех часов. Удаляли через целит катализатор и выпаривали при пониженном давлении растворитель. Остаток растворяли в 1,4-диоксане (80 мл) и смеси 4 н. хлористоводородная кислота-диоксан (80 мл). Добавляли гликолевую кислоту (8,7 г, 115 ммоль) и смесь нагревали при кипячении с обратным холодильником в течение двух часов. Реакционный раствор охлаждали и затем нейтрализовали насыщенным раствором бикарбоната натрия. Образовавшиеся кристаллы отфильтровывали и промывали водой и этилацетатом с получением 14 г требуемого соединения (выход: 73%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,77 (3H, с), 4,70 (2H, с), 6,85-6,97 (3H, м), 7,05-7,11 (1H, м), 7,23-7,28 (3H, м), 7,58-7,61 (1H, м).
(13b) Гидрохлорид метил 3-[(1-метил-6-фенокси-1H-бензимидазол-2-ил)метокси]бензоата
Три-н-бутилфосфин (0,61 г, 3,0 ммоль) и 1,1'-(азодикарбонил)дипиперидин (0,76 г, 3,0 ммоль) добавляли к раствору (1-метил-6-фенокси-1H-бензимидазол-2-ил)метанола (0,38 г, 1,5 ммоль) и метил 3-гидроксибензоата (0,34 г, 2,3 ммоль) в толуоле с последующим перемешиванием в течение 10 часов. Реакционный раствор концентрировали и затем очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 1/2). Затем добавляли 4 н. раствор хлористоводорода в 1,4-диоксане (10 мл) с последующим перемешиванием в течение двух часов. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали этилацетатом и простым эфиром. Требуемое указанное в заголовке соединение (0,42 г, выход: 66%) получали сушкой при пониженном давлении.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,88 (3H, с), 3,93 (3H, с), 5,69 (2H, с), 7,02 (2H, д, J=8,7 Гц), 7,12 (1H, дд, J=2,2, 8,8 Гц), 7,15 (1H, т, J=7,5 Гц), 7,41 (2H, дд, J=7,5, 8,7 Гц), 7,48 (1H, ддд, J=1,3, 2,6, 8,2 Гц), 7,54 (1H, дд, J=7,5, 8,2 Гц), 7,59 (1H, д, J=2,2 Гц), 7,66 (1H, ддд, J=1,3, 1,5, 7,5 Гц), 7,72 (1H, дд, J=1,5, 2,6 Гц), 7,80 (1H, д, J=8,8 Гц).
МС (ESI+) m/z: 389 (M+H)+, 441 (M+Na)+.
МСВР (ESI+) m/Z: 389,15176 (M+H)+, вычислено 389,15013 (-1,63 mmu).
(Пример 14) Гидрохлорид 3-[(1-метил-6-фенокси-1H-бензимидазол-2-ил)метокси]бензойной кислоты (гидрохлорид соединения № 1-19)
1 н. водный раствор гидроксида натрия (10 мл, 10 ммоль) добавляли к раствору гидрохлорида метил 3-[(1-метил-6-фенокси-1H-бензимидазол-2-ил)метокси]бензоата, синтезированного в примере 13 (0,28 г, 0,7 ммоль), в 1,4-диоксане и смесь перемешивали при 60°C в течение двух часов. Реакционный раствор обрабатывали концентрированной хлористоводородной кислотой (1,5 мл) и затем концентрировали. Полученное твердое вещество промывали водой и этилацетатом и сушили при пониженном давлении с получением требуемого указанного в заголовке соединения (0,19 г, выход: 70%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,95 (3H, с), 5,72 (2H, с), 7,04 (2H, д, J=8,8 Гц), 7,16 (1H, т, J=7,5 Гц), 7,21 (1H, дд, J=2,4, 8,8 Гц), 7,41 (2H, дд, J=7,5, 8,8 Гц), 7,46 (1H, ддд, J=1,1, 2,6, 8,2 Гц), 7,50 (1H, дд, J=7,5, 8,2 Гц), 7,62 (1H, д, J=2,2 Гц), 7,64 (1H, ддд, J=1,1, 1,5, 7,5 Гц), 7,71 (1H, дд, J=1,5, 2,6 Гц), 7,82 (1H, д, J=8,8 Гц).
МС (ESI+) m/z: 375 (M+H)+, 397 (M+Na)+, 419 (M+2Na-H)+.
МСВР (ESI+) m/Z: 375,13441 (M+H)+, вычислено 375,13448 (-0,07 mmu).
(Пример 15) Дигидрохлорид метил 3-[(3-метил-5-фенокси-3H-имидазо[4,5-b]пиридин-2-ил)метокси]бензоата (дигидрохлорид соединения № 1-28)
(15a) (3-Метил-5-фенокси-3H-имидазо[4,5-b]пиридин-2-ил)метанол
Фенол (12,08 г, 128 ммоль) растворяли в ТГФ (200 мл) и добавляли гидрид натрия (60%, 5,12 г, 128 ммоль). Затем добавляли 6-хлор-N-метил-3-нитропиридин-2-амин (20 г, 107 ммоль) и смесь перемешивали при 80°C в течение четырех часов. Реакционный раствор вливали в воду с последующим экстрагированием этилацетатом. Органический слой последовательно промывали водой, 1 н. раствором гидроксида калия, водой и насыщенным раствором соли, сушили и затем концентрировали. Остаток растворяли в смеси ТГФ (50 мл)-этанол (50 мл) и добавляли гидроксид палладия (500 мг). Смесь перемешивали в атмосфере водорода в течение ночи. Удаляли через целит катализатор и выпаривали при пониженном давлении растворитель. Остаток растворяли в 1,4-диоксане (150 мл) и смеси 4 н. хлористоводородная кислота-диоксан (150 мл). Добавляли гликолевую кислоту (24,4 г, 321 ммоль) и смесь нагревали при кипячении с обратным холодильником в течение 10 часов. Реакционный раствор охлаждали и затем нейтрализовали насыщенным водным раствором бикарбоната натрия с последующим экстрагированием этилацетатом. Органический слой последовательно промывали водой и насыщенным раствором соли и сушили. Затем выпаривали при пониженном давлении растворитель. Образовавшиеся кристаллы осторожно промывали диизопропиловым эфиром с получением 21,8 г требуемого соединения (выход: 80%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,67 (3H, с, J=7 Гц), 4,69 (2H, д, J=5 Гц), 5,61 (1H, т, J=5 Гц), 6,84 (1H, д, J=8 Гц), 7,12-7,23 (3H, м), 7,39-7,45 (2H, м), 8,06 (1H, д, J=8 Гц).
(15b) Дигидрохлорид метил 3-[(3-метил-5-фенокси-3H-имидазо[4,5-b]пиридин-2-ил)метокси]бензоата
Три-н-бутилфосфин (0,61 г, 3,0 ммоль) и 1,1'-(азодикарбонил)дипиперидин (0,76 г, 3,0 ммоль) добавляли к раствору (3-метил-5-фенокси-3H-имидазо[4,5-b]пиридин-2-ил)метанола (0,38 г, 1,5 ммоль) и метил 3-гидроксибензоата (0,34 г, 2,3 ммоль) в толуоле с последующим перемешиванием в течение 10 часов. Реакционный раствор концентрировали и затем очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 1/2). Затем добавляли 4 н. раствор хлористоводорода в 1,4-диоксане (10 мл) с последующим перемешиванием в течение двух часов. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали этилацетатом и простым эфиром. Требуемое указанное в заголовке соединение (0,40 г, выход: 58%) получали сушкой при пониженном давлении.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,72 (3H, с), 3,86 (3H, с), 5,54 (2H, с), 6,96 (1H, д, J=8,6 Гц), 7,18 (1H, д, J=7,5 Гц), 7,22 (1H, т, J=7,3 Гц), 7,43 (2H, м), 7,45 (1H, дд, J=7,6, 8,2 Гц), 7,61 (1H, дд, J=1,5, 7,6 Гц), 7,66 (1H, дд, J=1,5, 2,3 Гц), 8,18 (1H, д, J=8,6 Гц).
МС (ESI+) m/z: 390 (M+H)+, 412 (M+Na)+.
МСВР (ESI+) m/Z: 390,14693 (M+H)+, вычислено 390,14538 (1,55 mmu).
(Пример 16) Дигидрохлорид 3-[(3-метил-5-фенокси-3H-имидазо[4,5-b]пиридин-2-ил)метокси]бензойной кислоты (дигидрохлорид соединения № 1-27)
1 н. водный раствор гидроксида натрия (10 мл, 10 ммоль) добавляли к раствору дигидрохлорида метил 3-[(3-метил-5-фенокси-3H-имидазо[4,5-b]пиридин-2-ил)метокси]бензоата, синтезированного в примере 15 (0,25 г, 0,6 ммоль), в 1,4-диоксане и смесь перемешивали при 60°C в течение двух часов. Реакционный раствор обрабатывали концентрированной хлористоводородной кислотой (1,5 мл) и затем концентрировали. Полученное твердое вещество промывали водой и этилацетатом и сушили при пониженном давлении с получением требуемого указанного в заголовке соединения (0,16 г, выход: 65%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,73 (3H, с), 5,53 (2H, с), 6,96 (1H, д, J=8,6 Гц), 7,18 (1H, д, J=8,7 Гц), 7,22 (1H, т, J=7,5 Гц), 7,38 (1H, ддд, J=1,1, 2,6, 8,2 Гц), 7,42 (2H, м), 7,46 (1H, дд, J=7,6, 8,2 Гц), 7,59 (1H, ддд, J=1,1, 1,3, 7,6 Гц), 7,64 (1H, дд, J=1,3, 2,6 Гц), 8,18 (1H, д, J=8,6 Гц).
МС (ESI+) m/z: 376 (M+H)+, 398 (M+Na)+, 420 (M+2Na-H)+.
МСВР (ESI+) m/Z: 376,12947 (M+H)+, вычислено 376,12973 (-0,26 mmu).
(Пример 17) 5/2 гидрохлорид метил 5-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}никотината (5/2 гидрохлорид соединения № 1-136)
Три-н-бутилфосфин (0,61 г, 3,0 ммоль) и 1,1'-(азодикарбонил)дипиперидин (0,76 г, 3,0 ммоль) добавляли к раствору {6-[4-(трет-бутилоксикарбониламино)-3,5-диметилфенокси]-1-метил-1H-бензимидазол-2-ил}метанола (0,60 г, 1,5 ммоль) и метил 5-гидроксиникотината (0,34 г, 2,3 ммоль) в толуоле с последующим перемешиванием в течение 10 часов. Реакционный раствор концентрировали и затем очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 1/2). Затем добавляли 4 н. раствор хлористоводорода в 1,4-диоксане (10 мл) с последующим перемешиванием в течение двух часов. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали этилацетатом и простым эфиром. Требуемое указанное в заголовке соединение (0,48 г, выход: 61%) получали сушкой при пониженном давлении.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,34 (6H, с), 3,91 (3H, с), 3,93 (3H, с), 5,80 (2H, с), 6,79 (2H, с), 7,15 (1H, дд, J=2,0, 8,0 Гц), 7,58 (1H, д, J=2,0 Гц), 7,78 (1H, д, J=8,6 Гц), 8,09 (1H, дд, J=1,6, 2,7 Гц), 8,75 (1H, д, J=2,7 Гц), 8,78 (1H, д, J=1,6 Гц).
МС (ESI+) m/z: 433 (M+H)+, 455 (M+Na)+.
МСВР (ESI+) m/Z: 433,18576 (M+H)+, вычислено 433,18758 (-1,82 mmu).
(Пример 18) Дигидрохлорид 5-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}никотиновой кислоты (дигидрохлорид соединения № 1-135)
1 н. водный раствор гидроксида натрия (10 мл, 10 ммоль) добавляли к раствору 5/2 гидрохлорида метил 5-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}никотината (0,35 г, 0,7 ммоль) в 1,4-диоксане и смесь перемешивали при 60°C в течение двух часов. Реакционный раствор обрабатывали концентрированной хлористоводородной кислотой (1,5 мл) и затем концентрировали. Полученное твердое вещество промывали водой и этилацетатом и сушили при пониженном давлении с получением требуемого указанного в заголовке соединения (0,17 г, выход: 52%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,30 (6H, с), 3,89 (3H, с), 5,71 (2H, с), 6,76 (2H, с), 7,05 (1H, дд, J=2,0, 8,6 Гц), 7,46 (1H, д, J=2,0 Гц), 7,73 (1H, д, J=8,6 Гц), 8,04 (1H, дд, J=1,6, 3,1 Гц), 8,68 (1H, д, J=3,1 Гц), 8,74 (1H, д, J=1,6 Гц).
МС (ESI+) m/z: 419 (M+H)+, 441 (M+Na)+.
МСВР (ESI+) m/Z: 419,17103 (M+H)+, вычислено 419,17193 (-0,90 mmu).
(Пример 19) Дигидрохлорид метил 3-{[1-метил-6-(3-морфолин-4-илфенокси)-1H-бензимидазол-2-ил]метокси}бензоата (дигидрохлорид соединения № 1-68)
(19a) трет-Бутил метил-[5-(3-морфолин-4-илфенокси)-2-нитрофенил]карбамат
Требуемое неочищенное соединение получали из трет-бутил (5-хлор-2-нитрофенил)метилкарбамата (5,0 г, 17 ммоль), гидрида натрия (761 мг, 17 ммоль) и 3-морфолин-4-илфенола (3,2 г, 17 ммоль) таким же способом, как в примере 7a. Полученное соединение очищали хроматографией на колонке с силикагелем с получением требуемого соединения (6,5 г, выход: 86%) в виде желтого пенообразного вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 1,32 (9H, с), 3,15-3,22 (4H, м), 3,25 (3H, с), 3,81-3,88 (4H, м), 6,57 (1H, т, J=7,3 Гц), 6,62 (1H, с), 6,79 (1H, д, J=7,8 Гц), 6,82-6,91 (2H, м), 7,24-7,33 (1H, м), 7,92 (1H, д, J=8,8 Гц).
(19b) трет-Бутил [2-амино-5-(3-морфолин-4-илфенокси)фенил]метилкарбамат
трет-Бутил метил-[5-(3-морфолин-4-илфенокси)-2-нитрофенил]карбамат, синтезированный в примере 19a (6,5 г, 15 ммоль), и палладий-на-угле (10%, 1,0 г) суспендировали в этилацетате (100 мл) и суспензию перемешивали в атмосфере водорода в течение двух часов. Катализатор удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением требуемого соединения (5,8 г, выход: 96%) в виде бледно-оранжевого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 1,38 (9H, с), 3,09-3,16 (7H, м), 3,80-3,84 (4H, м), 6,38 (1H, ушир.c), 6,51 (1H, с), 6,56 (1H, д, J=7,4 Гц), 6,70-6,80 (3H, м), 7,13 (1H, т, J=8,0 Гц).
(19c) [1-Метил-6-(3-морфолин-4-илфенокси)-1H-бензимидазол-2-ил]метанол
трет-Бутил [2-амино-5-(3-морфолин-4-илфенокси)фенил]метилкарбамат, синтезированный в примере 19b (5,8 г, 15 ммоль), и гликолевую кислоту (1,66 г, 22 ммоль) растворяли в смешанном растворителе из 4 н. хлористоводородной кислоты (60 мл) и 1,4-диоксана (60 мл) с последующим нагреванием с обратным холодильником. Органический растворитель выпаривали из реакционного раствора при пониженном давлении. Оставшийся водный раствор промывали метиленхлоридом, нейтрализовали избыточным количеством бикарбоната натрия, разбавляли этилацетатом и перемешивали. Образовавшееся твердое вещество отфильтровывали с получением требуемого соединения (2,8 г, выход: 57%) в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,03-3,08 (4H, м), 3,67-3,71 (4H, м), 3,76 (3H, с), 4,66-4,69 (2H, м), 6,30 (1H, дд, J=2,0, 7,8 Гц), 6,55 (1H, т, J=2,35), 6,65 (1H, дд, J=2,2, 8,0 Гц), 6,86 (1H, дд, J=2,4, 8,6 Гц), 7,14 (1H, т, J=8,2 Гц), 7,22 (1H, д, J=2,4 Гц), 7,55 (1H, д, J=8,6 Гц).
(19d) Дигидрохлорид метил 3-{[1-метил-6-(3-морфолин-4-илфенокси)-1H-бензимидазол-2-ил]метокси}бензоата
Три-н-бутилфосфин (0,61 г, 3,0 ммоль) и 1,1'-(азодикарбонил)дипиперидин (0,76 г, 3,0 ммоль) добавляли к раствору [1-метил-6-(3-морфолин-4-илфенокси)-1H-бензимидазол-2-ил]метанола (0,51 г, 1,5 ммоль) и метил 3-гидроксибензоата (0,34 г, 2,3 ммоль) в толуоле с последующим перемешиванием в течение 10 часов. Реакционный раствор концентрировали и затем очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 1/2). Затем добавляли 4 н. раствор хлористоводорода в 1,4-диоксане (10 мл) с последующим перемешиванием в течение двух часов. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали этилацетатом и простым эфиром. Требуемое указанное в заголовке соединение (0,49 г, выход: 60%) получали сушкой при пониженном давлении.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,13 (4H, т, J=4,7 Гц), 3,72 (4H, т, J=4,7 Гц), 3,87 (3H, с), 3,97 (3H, с), 5,76 (2H, с), 6,42 (1H, дд, J=2,0, 7,8 Гц), 6,70 (1H, дд, J=2,0, 2,0 Гц), 6,80 (1H, дд, J=2,0, 8,2 Гц), 7,23 (1H, дд, J=7,8, 8,2 Гц), 7,23 (1H, дд, J=2,3, 8,6 Гц), 7,50 (1H, ддд, J=1,2, 2,4, 8,3 Гц), 7,54 (1H, дд, J=7,1, 8,3 Гц), 7,64 (1H, д, J=2,3 Гц), 7,65 (1H, ддд, J=1,2, 1,6, 7,1 Гц), 7,72 (1H, дд, J=1,6, 2,4 Гц), 7,82 (1H, д, J=8,6 Гц).
МС (ESI+) m/z: 474 (M+H)+, 496 (M+Na)+.
МСВР (ESI+) m/Z: 474,20084 (M+H)+, вычислено 474,20290 (-2,06 mmu).
(Пример 20) 1/2 гидрохлорид 3-{[1-метил-6-(3-морфолин-4-илфенокси)-1H-бензимидазол-2-ил]метокси}бензойной кислоты (1/2 гидрохлорид соединения № 1-67)
1 н. водный раствор гидроксида натрия (10 мл, 10 ммоль) добавляли к раствору дигидрохлорида метил 3-{[1-метил-6-(3-морфолин-4-илфенокси)-1H-бензимидазол-2-ил]метокси}бензоата (0,34 г, 0,7 ммоль) в 1,4-диоксане и смесь перемешивали при 60°C в течение двух часов. Реакционный раствор обрабатывали концентрированной хлористоводородной кислотой (1,5 мл) и затем концентрировали. Полученное твердое вещество промывали водой и этилацетатом и сушили при пониженном давлении с получением требуемого указанного в заголовке соединения (0,18 г, выход: 59%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,69 (4H, т, J=4,7 Гц), 3,80 (4H, т, J=4,7 Гц), 5,45 (2H, с), 6,32 (1H, дд, J=2,0, 8,2 Гц), 6,57 (1H, дд, J=2,0, 2,4 Гц), 6,66 (1H, дд, J=2,4, 8,2 Гц), 6,90 (1H, дд, J=2,4, 8,6 Гц), 7,15 (1H, дд, J=8,2, 8,2 Гц), 7,28 (1H, д, J=2,4 Гц), 7,36 (1H, ддд, J=8,2 Гц), 7,43 (1H, дд, J=7,4, 8,2 Гц), 7,55 (1H, ддд, J=7,4 Гц), 7,61 (1H, ушир.), 7,62 (1H, д, J=8,6 Гц).
МС (ESI+) m/z: 460 (M+H)+, 482 (M+Na)+.
МСВР (ESI+) m/Z: 460,18678 (M+H)+, вычислено 460,18725 (-0,47 mmu).
(Пример 21) Дигидрохлорид этил 4-{[1-метил-6-(3-морфолин-4-илфенокси)-1H-бензимидазол-2-ил]метокси}бензоата (дигидрохлорид соединения № 1-70)
Три-н-бутилфосфин (0,61 г, 3,0 ммоль) и 1,1'-(азодикарбонил)дипиперидин (0,76 г, 3,0 ммоль) добавляли к раствору [1-метил-6-(3-морфолин-4-илфенокси)-1H-бензимидазол-2-ил]метанола (0,51 г, 1,5 ммоль) и этил 4-гидроксибензоата (0,37 г, 2,3 ммоль) в толуоле с последующим перемешиванием в течение 10 часов. Реакционный раствор концентрировали и затем очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 1/2). Затем добавляли 4 н. раствор хлористоводорода в 1,4-диоксане (10 мл) с последующим перемешиванием в течение двух часов. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали этилацетатом и простым эфиром. Требуемое указанное в заголовке соединение (0,55 г, выход: 65%) получали сушкой при пониженном давлении.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 1,31 (3H, т, J=7,0 Гц), 3,11 (4H, т, J=4,7 Гц), 3,71 (4H, т, J=4,7 Гц), 3,94 (3H, с), 4,28 (2H, кв., J=7,04 Гц), 5,73 (2H, с), 6,40 (1H, дд, J=2,0, 7,8 Гц), 6,66 (1H, дд, J=2,0, 2,0 Гц), 6,76 (1H, дд, J=2,0, 8,2 Гц), 7,18 (1H, дд, J=2,4, 9,0 Гц), 7,22 (1H, дд, J=7,8, 8,2 Гц) 7,29 (2H, д, J=9,0 Гц), 7,59 (1H, д, J=2,4), 7,78 (1H, д, J=9,0 Гц), 7,97 (2H, д, J=9,0 Гц).
МС (ESI+) m/z: 488 (M+H)+, 510 (M+Na)+.
МСВР (ESI+) m/Z: 488,21667 (M+H)+, вычислено 488,21855 (-1,87 mmu).
(Пример 22) Дигидрохлорид 4-{[1-метил-6-(3-морфолин-4-илфенокси)-1H-бензимидазол-2-ил]метокси}бензойной кислоты (дигидрохлорид соединения № 1-69)
1 н. водный раствор гидроксида натрия (10 мл, 10 ммоль) добавляли к раствору дигидрохлорида этил 4-{[1-метил-6-(3-морфолин-4-илфенокси)-1H-бензимидазол-2-ил]метокси}бензоата (0,43 г, 0,8 ммоль) в 1,4-диоксане и смесь перемешивали при 60°C в течение двух часов. Реакционный раствор обрабатывали концентрированной хлористоводородной кислотой (1,5 мл) и затем концентрировали. Полученное твердое вещество промывали водой и этилацетатом и сушили при пониженном давлении с получением требуемого указанного в заголовке соединения (0,24 г, выход: 59%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,11 (4H, т, J=4,7 Гц), 3,71 (4H, т, J=4,7 Гц), 3,94 (3H, с), 5,72 (2H, с), 6,39 (1H, дд, J=2,3, 7,8 Гц), 6,65 (1H, дд, J=2,0, 2,3 Гц), 6,76 (1H, дд, J=2,0, 8,2 Гц), 7,18 (1H, дд, J=2,4, 9,0 Гц), 7,22 (1H, дд, J=7,8, 8,2 Гц), 7,26 (2H, д, J=9,0 Гц), 7,58 (1H, д, J=2,3 Гц), 7,78 (1H, д, J=9,0 Гц), 7,94 (2H, д, J=9,0 Гц).
МС (ESI+) m/z: 460 (M+H)+, 482 (M+Na)+.
МСВР (ESI+) m/Z: 460,18703 (M+H)+, вычислено 460,18725 (-0,22 mmu).
(Пример 23) Гидрохлорид метил 3-[(6-этокси-1-метил-1H-бензимидазол-2-ил)метокси]бензоата (гидрохлорид соединения № 1-4)
(23a) (6-Этокси-1-метил-1H-бензимидазол-2-ил)метанол
трет-Бутил 2-нитро-4-этокси(метил)карбамат (4 г, 13,5 ммоль) растворяли в 100 мл этанола и добавляли 10% палладий-на-угле (1 г). Смесь перемешивали в атмосфере водорода в течение двух часов. Удаляли через целит катализатор и выпаривали при пониженном давлении растворитель. Остаток растворяли в 1,4-диоксане (30 мл) и смеси 4 н. хлористоводородная кислота-диоксан (30 мл). Добавляли гликолевую кислоту (2,05 г, 27 ммоль) и смесь нагревали с обратным холодильником в течение 5,5 часов. Реакционный раствор охлаждали и затем нейтрализовали насыщенным раствором бикарбоната натрия. Образовавшиеся кристаллы отфильтровывали и промывали водой и этилацетатом с получением 1,51 г требуемого соединения (выход: 54%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 1,36 (3H, т, J=7 Гц), 3,77 (3H, с), 4,07 (2H, кв., J=7 Гц), 4,65 (2H, с), 6,77 (1H, дд, J=2 Гц, 8 Гц), 7,05 (1H, д, J=2 Гц), 7,44 (1H, д, J=8 Гц).
(23b) Гидрохлорид метил 3-[(6-этокси-1-метил-1H-бензимидазол-2-ил)метокси]бензоата
Три-н-бутилфосфин (0,91 г, 4,5 ммоль) и 1,1'-(азодикарбонил)дипиперидин (1,13 г, 4,5 ммоль) добавляли к раствору (6-этокси)-1-метил-1H-бензимидазол-2-ил]метанола (0,60 г, 2,0 ммоль) и метил 3-гидроксибензоата (0,46 г, 3,0 ммоль) в толуоле с последующим перемешиванием в течение 10 часов. Реакционный раствор концентрировали и затем очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 1/2). Затем добавляли 4 н. раствор хлористоводорода в 1,4-диоксане (10 мл) с последующим перемешиванием в течение двух часов. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали этилацетатом и простым эфиром. Требуемое указанное в заголовке соединение (0,49 г, выход: 65%) получали сушкой при пониженном давлении.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 1,39 (3H, т, J=7,1 Гц), 3,88 (3H, с), 3,98 (3H, с), 4,16 (2H, кв., J=7,1 Гц), 5,71 (2H, с), 7,13 (1H, дд, J=2,2, 8,9 Гц), 7,47 (1H, д, J=2,2 Гц), 7,49 (1H, ддд, J=1,3, 2,6, 8,2 Гц), 7,55 (1H, дд, J=7,5, 8,2 Гц), 7,67 (1H, дд, J=1,3, 7,5 Гц), 7,69 (1H, д, J=8,9 Гц), 7,72 (1H, д, J=2,6 Гц).
МС (ESI+) m/z: 341 (M+H)+, 363 (M+Na)+.
МСВР (ESI+) m/Z: 341,15051 (M+H)+, вычислено 341,15013 (0,37 mmu).
(Пример 24) Гидрохлорид 3-[(6-этокси-1-метил-1H-бензимидазол-2-ил)метокси]бензойной кислоты (гидрохлорид соединения № 1-3)
1 н. водный раствор гидроксида натрия (10 мл, 10 ммоль) добавляли к раствору гидрохлорида метил 3-[(6-этокси-1-метил-1H-бензимидазол-2-ил)метокси]бензоата (0,38 г, 1,0 ммоль) в 1,4-диоксане и смесь перемешивали при 60°C в течение двух часов. Реакционный раствор обрабатывали концентрированной хлористоводородной кислотой (1,5 мл) и затем концентрировали. Полученное твердое вещество промывали водой и этилацетатом и сушили при пониженном давлении с получением требуемого указанного в заголовке соединения (0,22 г, выход: 61%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 1,40 (3H, т, J=7,1 Гц), 3,98 (3H, с), 4,16 (2H, кв., J=7,1 Гц), 5,71 (2H, с), 7,13 (1H, дд, J=2,2, 8,9 Гц), 7,45 (1H, ддд, J=1,1, 2,6, 8,2 Гц), 7,52 (1H, дд, J=7,5, 8,2 Гц), 7,65 (1H, ддд, J=1,1, 1,3, 7,5 Гц), 7,70 (1H, д, J=8,9 Гц), 7,71 (1H, дд, J=1,3, 2,6 Гц).
МС (ESI+) m/z: 327 (M+H)+, 349 (M+Na)+, 371 (M+2Na-H)+.
МСВР (ESI+) m/Z: 327,13292 (M+H)+, вычислено 327,13448 (-1,56 mmu).
(Пример 25) Дигидрохлорид метил 3-{[1-метил-6-(пиридин-3-илокси)-1H-бензимидазол-2-ил]метокси}бензоата (дигидрохлорид соединения № 1-148)
(25a) [1-Метил-6-(пиридин-3-илокси)-1H-бензимидазол-2-ил]метанол
Гликолевую кислоту (2,75 г, 36,2 ммоль) добавляли к смешанному раствору трет-бутил 2-амино-5-(пиридин-3-илокси)фенил(метил)карбамата (7,61 г, 24,1 ммоль) [US 6432993 B1] в 1,4-диоксане (75 мл) и 4 н. раствора хлористоводородной кислоты (75 мл). Смесь перемешивали при 50°C в течение 30 минут и нагревали с обратным холодильником в течение семи часов. Реакционный раствор нейтрализовали насыщенным водным раствором бикарбоната натрия с последующим экстрагированием этилацетатом. Органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом натрия. Выпаривали при пониженном давлении растворитель и полученный остаток очищали хроматографией на колонке с силикагелем (элюирующий растворитель: этилацетат/метанол = 5/1) с получением требуемого указанного в заголовке соединения (4,31 г, 16,9 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 3,78 (3H, с), 4,90 (2H, с), 6,96-7,01 (2H, м), 7,25-7,28 (2H, м), 7,65-7,68 (1H, м), 8,34-8,42 (2H, м).
(25b) Дигидрохлорид метил 3-{[1-метил-6-(пиридин-3-илокси)-1H-бензимидазол-2-ил]метокси}бензоата
[1-Метил-6-(пиридин-3-илокси)-1H-бензимидазол-2-ил]метанол, синтезированный в примере 25a (1,0 г, 3,92 ммоль), растворяли в толуоле (17 мл). Добавляли метил 3-гидроксибензоат (895 мг, 5,88 ммоль), 1,1'-(азодикарбонил)дипиперидин (2,97 г, 9,65 ммоль) и н-трибутилфосфин (2,90 мл, 11,8 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Выпаривали при пониженном давлении растворитель и полученный остаток очищали хроматографией на колонке с силикагелем (элюирующий растворитель: этилацетат/метанол = 5/1) с получением метил 3-{[1-метил-6-(пиридин-3-илокси)-1H-бензимидазол-2-ил]метокси}бензоата (1,5 г, 3,85 ммоль). Метил 3-{[1-метил-6-(пиридин-3-илокси)-1H-бензимидазол-2-ил]метокси}бензоат (681 мг, 1,75 ммоль) растворяли в этилацетате (15 мл). Добавляли 4 н. хлористоводородную кислоту (раствор в 1,4-диоксане, 5 мл) и смесь перемешивали при комнатной температуре в течение 10 минут. Твердое вещество собирали фильтрованием и перекристаллизовывали из этанола с получением требуемого указанного в заголовке соединения (627 мг, 1,36 ммоль).
Т.пл. 195-208°C.
IR (KBr) νmax 1238, 1272, 1489, 1546, 1707.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,88 (3H, с), 3,97 (3H, с), 5,75 (2H, с), 7,36 (1H, дд, J=8,8, 2,2 Гц), 7,50-7,56 (2H, м), 7,65-7,66 (1H, м), 7,73-7,82 (3H, м), 7,86-7,91 (2H, м), 8,57 (1H, дд, J=5,1, 1,3 Гц), 8,63 (1H, д, J=2,4 Гц).
МС (FAB) m/z: 390 (M+H)+.
Аналит. вычислено для C22H19N3O4+2HCl: C, 57,15; H, 4,58; Cl, 15,34; N, 9,09. Найдено C, 53,52; H, 4,99; Cl, 14,73; N, 8,48.
(Пример 26) 3-{[1-Метил-6-(пиридин-3-илокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-147) 1 н. водный раствор гидроксида натрия (2,26 мл, 2,26 ммоль) добавляли к раствору промежуточного метил 3-{[1-метил-6-(пиридин-3-илокси)-1H-бензимидазол-2-ил]метокси}бензоата, синтезированного в примере 25b (800 мг, 2,05 ммоль), в 1,4-диоксане (5 мл) и смесь перемешивали при 70°C в течение одного часа. Реакционный раствор доводили до pH 7 добавлением раствора 1 н. хлористоводородной кислоты. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали этилацетатом с получением требуемого указанного в заголовке соединения (332 мг, 0,885 ммоль).
Т.пл. 240-245°C.
IR (KBr) νmax 1219, 1290, 1421, 1478, 1586, 1697.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,83 (3H, с), 5,48 (2H, с), 7,00 (1H, дд, J=8,6, 2,4 Гц), 7,34-7,47 (5H, м), 7,57-7,59 (1H, м), 7,63-7,70 (2H, м), 8,32 (1H, дд, J=4,0, 1,5 Гц), 8,38 (1H, дд, J=2,8, 0,9 Гц).
МС (FAB) m/z: 376 (M+H)+.
Аналит. вычислено для C21H17N3O4: C, 67,19; H, 4,56; N, 11,19. Найдено C, 67,14; H, 4,71; N, 11,04.
(Пример 27) 3-{[6-(4-Фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-165)
(27a) трет-Бутил [5-(4-фторфенокси)-2-нитрофенил]метилкарбамат
Указанное в заголовке вещество (3,2 г, выход: 88%) получали в виде желтого твердого вещества синтезом из 4-фторфенола (1,1 г, 10 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамата (2,9 г, 10 ммоль), гидрида натрия (> 56% в масле, 0,38 г, 10 ммоль) и N,N-диметилформамида (40 мл) таким же способом, как в примере (28a), и кристаллизацией из гексана.
1H-ЯМР (CDCl3, 400 МГц) δ: 1,33 (6H, с), 1,50 (3H, с), 3,26 (3H, с), 6,81 (1H, дд, J=2,7, 9,0 Гц), 6,85 (1H, ушир.c), 7,07-7,17 (4H, м), 7,93-7,97 (1H, м).
(27b) трет-Бутил [2-амино-5-(4-фторфенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(4-фторфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (27a) (3,2 г, 8,8 ммоль), железный порошок (2,4 г, 12 ммоль), хлорид аммония (0,24 г, 1,2 ммоль), этанол (40 мл) и воду (20 мл). Полученное масло непосредственно использовали для следующей реакции.
(27c) [6-(4-Фторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Синтез осуществляли таким же способом, как в примере (28c), используя трет-бутил [2-амино-5-(4-фторфенокси)фенил]метилкарбамат, полученный в примере (27b) (2,9 г, 8,8 ммоль), гликолевую кислоту (1,0 г, 13 ммоль) и 4 н. раствор хлористоводородной кислоты в 1,4-диоксане (40 мл). Полученное темно-коричневое масло непосредственно использовали для следующей реакции.
(27d) Метил 3-{[6-(4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (27c) (0,30 г, 1,1 ммоль), метил 3-гидроксибензоат (0,25 г, 1,7 ммоль), три-н-бутилфосфин (0,55 мл, 2,2 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,56 г, 2,2 ммоль) и дихлорметан (6,0 мл), с получением требуемого соединения (0,36 г, выход: 81%).
1H-ЯМР (CDCl3, 500 МГц) δ: 3,82 (3H, с), 3,92 (3H, с), 5,39 (2H, с), 6,94-7,05 (5H, м), 7,29 (1H, ушир.c), 7,38 (1H, т, J=7,8 Гц), 7,69 (1H, д, J=7,8 Гц), 7,71-7,74 (2H, м).
МС (FAB) m/z: 407 (M+H)+.
(27e) 3-{[6-(4-Фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (27d) (0,34 г, 0,84 ммоль), 1 н. водный раствор гидроксида натрия (1,3 мл, 1,3 ммоль) и 1,4-диоксан, с получением требуемого соединения (0,10 г, выход: 37%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 500 МГц) δ: 3,81 (3H, с), 5,46 (2H, с), 6,93 (1H, дд, J=2,4, 8,8 Гц), 7,01-7,04 (2H, м), 7,19 (2H, т, J=8,8 Гц), 7,30 (1H, д, J=2,4 Гц), 7,37-7,39 (1H, м), 7,45 (1H, т, J=7,8 Гц), 7,57 (2H, д, J=7,8 Гц), 7,66 (1H, д, J=8,8 Гц), 7,63 (1H, с), 13,03 (1H, ушир.c).
МС (FAB) m/z: 393 (M+H)+.
Аналит. вычислено для C22H17FN2O4+0,14H2O: C, 66,91; H, 4,41; N, 7,09; F, 4,81. Найдено C, 66,85; H, 4,46; N, 7,21; F, 4,81.
(Пример 28) 3-{[6-(2-Фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-164)
(28a) трет-Бутил [5-(2-фторфенокси)-2-нитрофенил]метилкарбамат
2-Фторфенол (0,16 мл, 1,7 ммоль) растворяли в N,N-диметилформамиде (10 мл) в атмосфере азота. Добавляли трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (500 мг, 1,7 ммоль) и гидрид натрия (>56% в масле, 0,84 г, 1,9 ммоль) и смесь перемешивали при 80°C в течение семи часов. Реакционный раствор концентрировали и добавляли водный раствор бикарбоната натрия с последующим экстрагированием диэтиловым эфиром два раза. Затем органические слои промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Выпаривали при пониженном давлении растворитель и полученное желтое масло непосредственно использовали для следующей реакции.
(28b) трет-Бутил [2-амино-5-(2-фторфенокси)фенил]метилкарбамат
Железный порошок (0,47 г, 8,8 ммоль) и хлорид аммония (0,047 г, 0,88 ммоль) добавляли к смеси трет-бутил [5-(2-фторфенокси)-2-нитрофенил]метилкарбамата, полученного в примере (28a) (0,74 г, 1,7 ммоль), этанола (8,0 мл) и воды (4,0 мл) и полученную смесь нагревали с обратным холодильником в течение двух часов. Нерастворимый материал отфильтровывали через целит. К концентрированному фильтрату добавляли воду с последующим экстрагированием этилацетатом два раза. Затем органические слои промывали насыщенным раствором соли и сушили над безводным сульфатом магния. Выпаривали при пониженном давлении растворитель и полученное масло непосредственно использовали для следующей реакции.
(28c) [6-(2-Фторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
трет-Бутил [2-амино-5-(2-фторфенокси)фенил]метилкарбамат, полученный в примере (28b) (0,58 г, 1,749 ммоль), растворяли в 4 н. растворе хлористоводородной кислоты в 1,4-диоксане (10 мл). Добавляли гликолевую кислоту (0,20 г, 2,6 ммоль) и смесь нагревали с обратным холодильником в течение 1,5 суток. Реакционный раствор концентрировали и добавляли водный раствор бикарбоната натрия с последующим экстрагированием этилацетатом два раза. Затем органические слои промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Выпаривали при пониженном давлении растворитель и полученный остаток подвергали простой очистке хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 5/1 → только этилацетат → метанол/дихлорметан = 1/5). Выпаривали при пониженном давлении растворитель и полученное темно-коричневое масло непосредственно использовали для следующей реакции.
(28d) Метил 3-{[6-(2-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Три-н-бутилфосфин (0,36 мл, 1,4 ммоль) и 1,1'-(азодикарбонил)дипиперидин (0,36 г, 1,4 ммоль) добавляли к раствору [6-(2-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метанола, полученного в примере (28c) (0,20 г, 0,7 ммоль), и метил 3-гидроксибензоата (0,16 г, 1,1 ммоль) в дихлорметане с последующим перемешиванием в течение 12 часов. Реакционный раствор концентрировали и затем суспендировали в смешанном растворителе гексан/этилацетат (= 3/2). После ультразвуковой обработки выпавшее в осадок твердое вещество отделяли фильтрованием. Фильтрат концентрировали и затем очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 5/1→1/1). Требуемое соединение (0,16 г, выход: 58%) получали сушкой при пониженном давлении.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,81 (3H, с), 3,92 (3H, с), 5,39 (2H, с), 6,96 (1H, с), 7,00-7,05 (2H, м), 7,07-7,13 (2H, м), 7,20 (1H, т, J=9,5 Гц), 7,29 (1H, д, J=7,3 Гц), 7,37 (1H, т, J=7,3 Гц), 7,69 (1H, д, J=7,8 Гц), 7,70-7,74 (2H, м).
МС (FAB) m/z: 407 (M+H)+.
(28e) 3-{[6-(2-Фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
1 н. водный раствор гидроксида натрия (0,54 мл, 0,54 ммоль) добавляли к раствору метил 3-{[6-(2-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата, полученного в примере (28d) (0,16 г, 0,36 ммоль), в 1,4-диоксане и смесь перемешивали при 70°C в течение 1,5 часов. Реакционный раствор концентрировали и добавляли к нему воду. Смесь нейтрализовали добавлением по каплям 1 н. раствора хлористоводородной кислоты. Выпавшее в осадок твердое вещество собирали фильтрованием с получением требуемого соединения (0,096 г, выход: 68%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,81 (3H, с), 5,47 (2H, с), 6,94 (1H, дд, J=2,5, 8,8 Гц), 7,04-7,09 (1H, м), 7,18 (2H, ддд, J=3,1, 3,3, 6,1 Гц), 7,30 (1H, д, J=2,4 Гц), 7,35-7,42 (2H, м), 7,45 (1H, т, J=7,8 Гц), 7,58 (1H, д, J=7,4 Гц), 7,66 (1H, д, J=8,6 Гц), 7,63 (1H, с), 13,03 (1H, ушир.c).
МС (FAB) m/z: 393 (M+H)+.
Аналит. вычислено для C22H17FN2O4+0,14H2O: C, 66,91; H, 4,41; N, 7,09; F, 4,81. Найдено C, 66,86; H, 4,48; N, 7,08; F, 4,80.
(Пример 29) 3-{[6-(3-Метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-173)
(29a) трет-Бутил [5-(3-метоксифенокси)-2-нитрофенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя 3-метоксифенол (0,19 мл, 1,7 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (0,50 г, 1,7 ммоль), гидрид натрия (>56% в масле, 0,84 г, 1,9 ммоль) и N,N-диметилформамид (10 мл). Полученное желтое масло непосредственно использовали для следующей реакции.
(29b) трет-Бутил [2-амино-5-(3-метоксифенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(3-метоксифенокси)-2-нитрофенил]метилкарбамат, полученный в примере (29a) (0,65 г, 1,7 ммоль), железный порошок (0,47 г, 8,7 ммоль), хлорид аммония (0,047 г, 0,87 ммоль), этанол (8,0 мл) и воду (4,0 мл). Полученное масло непосредственно использовали для следующей реакции.
(29c) [6-(3-Метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Синтез осуществляли таким же способом, как в примере (28c), используя трет-бутил [2-амино-5-(3-метоксифенокси)фенил]метилкарбамат, полученный в примере (29b) (0,60 г, 1,7 ммоль), гликолевую кислоту (0,20 г, 2,6 ммоль) и 4 н. раствор хлористоводородной кислоты в 1,4-диоксане (10 мл). Полученное темно-коричневое масло непосредственно использовали для следующей реакции.
(29d) Метил 3-{[6-(3-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(3-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (29c) (0,24 г, 0,85 ммоль), метил 3-гидроксибензоат (0,20 г, 1,3 ммоль), три-н-бутилфосфин (0,43 мл, 1,7 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,43 г, 1,7 ммоль) и дихлорметан (6,0 мл), с получением требуемого соединения (0,23 г, выход: 65%).
1H-ЯМР (CDCl3, 400 МГц) δ: 3,77 (3H, с), 3,89 (3H, с), 5,57 (2H, с), 6,55-6,58 (2H, м), 6,61-6,69 (1H, м), 7,00-7,07 (2H, м), 7,19-7,25 (2H, м), 7,38 (1H, т, J=7,8 Гц), 7,84 (1H, д, J=8,6 Гц), 7,78 (1H, д, J=7,4 Гц), 8,03 (1H, с).
(29e) 3-{[6-(3-Метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(3-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (29d) (0,23 г, 0,56 ммоль), 1 н. водный раствор гидроксида натрия (0,83 мл, 0,83 ммоль) и 1,4-диоксан, с получением требуемого соединения (0,20 г, выход: 89%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,77 (3H, с), 3,89 (3H, с), 5,57 (2H, с), 6,55-6,58 (2H, м), 6,61-6,69 (1H, м), 7,00-7,07 (2H, м), 7,19-7,25 (2H, м), 7,38 (1H, т, J=7,8 Гц), 7,84 (1H, д, J=8,6 Гц), 7,78 (1H, д, J=7,4 Гц), 8,03 (1H, с).
МС (FAB) m/z: 405 (M+H)+.
Аналит. вычислено для C23H20N2O5+0,33H2O: C, 67,31; H, 5,08; N, 6,83. Найдено C, 67,47; H, 4,94; N, 6,92.
(Пример 30) 3-{[6-(4-Метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-174)
(30a) трет-Бутил [5-(4-метоксифенокси)-2-нитрофенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя 3-метоксифенол (0,20 г, 1,7 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (0,50 г, 1,7 ммоль), гидрид натрия (>56% в масле, 0,84 г, 1,9 ммоль) и N,N-диметилформамид (10 мл). Полученное желтое масло непосредственно использовали для следующей реакции.
(30b) трет-Бутил [2-амино-5-(4-метоксифенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(4-метоксифенокси)-2-нитрофенил]метилкарбамат, полученный в примере (30a) (0,65 г, 1,7 ммоль), железный порошок (0,47 г, 8,7 ммоль), хлорид аммония (0,047 г, 0,87 ммоль), этанол (8,0 мл) и воду (4,0 мл). Полученное масло непосредственно использовали для следующей реакции.
(30c) [6-(4-Метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Синтез осуществляли таким же способом, как в примере (28c), используя трет-бутил [2-амино-5-(4-метоксифенокси)фенил]метилкарбамат, полученный в примере (30b) (0,60 г, 1,7 ммоль), гликолевую кислоту (0,40 г, 5,2 ммоль) и 4 н. раствор хлористоводородной кислоты в 1,4-диоксане (20 мл). Полученное темно-коричневое масло непосредственно использовали для следующей реакции.
(30d) Метил 3-{[6-(4-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(4-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (30c) (0,23 г, 0,79 ммоль), метил 3-гидроксибензоат (0,18 г, 1,2 ммоль), три-н-бутилфосфин (0,40 мл, 2,0 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,39 г, 2,0 ммоль) и дихлорметан (4,0 мл), с получением требуемого соединения (0,25 г, выход: 75%) в виде бледно-коричневого масла.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,79 (3H, с), 3,81 (3H, с), 3,92 (3H, с), 5,38 (2H, с), 6,88-6,91 (3H, м), 6,97-7,01 (3H, м), 7,27-7,31 (1H, м), 7,37 (1H, т, J=7,8 Гц), 7,66-7,73 (3H, м).
(30e) 3-{[6-(4-Метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(4-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (30d) (0,25 г, 0,59 ммоль), 1 н. водный раствор гидроксида натрия (0,89 мл, 0,89 ммоль) и 1,4-диоксан, с получением требуемого соединения (0,21 г, выход: 86%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 500 МГц) δ: 3,79 (3H, с), 3,81 (3H, с), 5,36 (2H, ушир.с), 6,87-6,93 (3H, м) 6,98 (3H, д, J=8,3 Гц), 7,20-7,29 (1H, м), 7,36 (1H, с), 7,65-7,76 (3H, м).
МС (FAB) m/z: 405 (M+H)+.
Аналит. вычислено для C23H20N2O5+1,5H2O: C, 64,03; H, 5,37; N, 6,49. Найдено C, 63,96; H, 5,30; N, 6,52.
(Пример 31) Гидрохлорид 3-[6-(3-хлорфенокси)-1-метил-1H-бензимидазол-2-илметокси]бензойной кислоты (гидрохлорид соединения № 1-51)
(31a) трет-Бутил [5-(3-фторфенокси)-2-нитрофенил]метилкарбамат
Гидрид натрия (56%, 0,38 г, 10 ммоль) добавляли к раствору 3-хлорфенола (1,29 г, 10 ммоль) и трет-бутил (5-хлор-2-нитрофенил)метилкарбамата (2,87 г, 10 ммоль) в N,N-диметилформамиде (20 мл) при охлаждении льдом. Реакционную смесь перемешивали при 80°C в течение шести часов. Дав реакционному раствору охладиться, добавляли к реакционной смеси воду (100 мл) с последующим экстрагированием этилацетатом (100 мл). Затем органический слой промывали водой (100 мл) два раза и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали хроматографией на силикагеле (гексан:этилацетат, 6:1) с получением указанного в заголовке соединения (3,79 г, выход: 99%) в виде желтого масла.
1H-ЯМР (CDCl3, 400 МГц) δ: 1,33 (6H, с), 1,50 (3H, с), 3,27 (3H, с), 6,87 (1H, дд, J=2,7, 8,6 Гц), 6,89 (1H, ушир.c), 7,01 (1H, д, J=8,1 Гц), 7,12 (1H, т, J=2,0 Гц), 7,24-7,26 (1H, м), 7,38 (1H, т, J=8,2 Гц), 7,96 (1H, д, J=9,0 Гц).
(31b) трет-Бутил [2-амино-5-(3-хлорфенокси)фенил]метилкарбамат
Раствор трет-бутил [5-(3-хлорфенокси)-2-нитрофенил]метилкарбамата, полученного в примере (31a) (3,79 г, 10 ммоль), хлорида аммония (0,27 г, 5,0 ммоль) и железного порошка (2,79 г, 50 ммоль) в этаноле (50 мл) и воде (25 мл) перемешивали при нагревании с обратным холодильником в течение одного часа. Дав реакционному раствору охладиться, реакционную смесь фильтровали через целит. Фильтрат концентрировали и затем добавляли воду (100 мл) с последующим экстрагированием этилацетатом (100 мл). Затем органический слой сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении, остаток очищали хроматографией на силикагеле (гексан:этилацетат, 5:1) с получением указанного в заголовке соединения (3,49 г, выход: 99%) в виде желтого масла.
1H-ЯМР (CDCl3, 400 МГц) δ: 1,41 (9H, с), 3,16 (3H, с), 3,70 (2H, ушир.c), 6,77 (1H, д, J=8,6 Гц), 6,82-6,90 (4H, м), 6,99-7,01 (1H, м), 7,20 (1H, т, J=8,2 Гц).
(31c) [6-(3-Хлорфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Раствор трет-бутил [2-амино-5-(3-хлорфенокси)фенил]метилкарбамата (3,49 г, 10 ммоль), полученного в примере (31b), и гликолевой кислоты (1,52 г, 20 ммоль) в смеси 4 М хлористоводородная кислота-диоксан (10 мл) перемешивали при нагревании с обратным холодильником в течение девяти часов. Дав реакционному раствору охладиться, реакционную смесь вливали в насыщенный водный раствор бикарбоната натрия (100 мл) с последующим экстрагированием этилацетатом (100 мл). Затем органический слой сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали хроматографией на силикагеле (метиленхлорид:метанол, 95:5) с получением указанного в заголовке соединения (0,66 г, выход: 23%) в виде бледно-коричневого порошка.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,79 (3H, с), 4,91 (2H, с), 6,88 (1H, д, J=8,6 Гц), 6,95 (1H, с), 6,98-7,01 (2H, м), 7,05 (1H, д, J=8,2 Гц), 7,24 (1H, д, J=8,2 Гц), 7,69 (1H, д, J=9,4 Гц).
(31d) Метил 3-{[6-(3-хлорфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Раствор [6-(3-хлорфенокси)-1-метил-1H-бензимидазол-2-ил]метанола, полученного в примере (31c) (660 мг, 2,3 ммоль), метил 3-гидроксибензоата (522 мг, 3,4 ммоль), три-н-бутилфосфина (925 мг, 4,6 ммоль) и 1,1'-(азодикарбонил)дипиперидина (1,15 г, 4,6 ммоль) в метиленхлориде (5 мл) перемешивали в течение трех часов. Реакционную смесь концентрировали и затем очищали хроматографией на колонке с силикагелем (гексан:этилацетат, 2:1) с получением указанного в заголовке соединения (935 мг, выход: 97%) в виде белого аморфного твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,85 (3H, с), 3,93 (3H, с), 5,41 (2H, с), 6,89 (1H, ддд, J=0,8, 3,1, 8,2 Гц), 6,97 (1H, т, J=2,0 Гц), 7,01-7,07 (3H, м), 7,24 (1H, д, J=8,2 Гц), 7,29-7,32 (1H, м), 7,39 (1H, т, J=7,8 Гц), 7,70 (1H, дт, J=1,1, 7,4 Гц), 7,73-7,74 (1H, м), 7,77 (1H, д, J=9,4 Гц).
(31e) Гидрохлорид 3-[6-(3-хлорфенокси)-1-метил-1H-бензимидазол-2-илметокси]бензойной кислоты
Раствор метил 3-{[6-(3-хлорфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата, полученного в примере (31d) (933 мг, 2,21 ммоль), в 2 М водном растворе гидроксида натрия (5 мл) и диоксана (10 мл) перемешивали при нагревании с обратным холодильником в течение двух часов. Дав реакционному раствору охладиться, добавляли к реакционной смеси 5 М хлористоводородную кислоту (20 мл). Выпавшее в осадок твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (829 мг, выход: 84%) в виде белого порошка.
1H-ЯМР (ДМСО-d6, 400 MГц) δ: 3,91 (3H, с), 5,62 (2H, с), 6,98 (1H, дд, J=3,1, 9,0 Гц), 7,04 (1H, т, J=2,0 Гц), 7,17 (1H, дд, J=2,4, 9,0 Гц), 7,18-7,20 (1H, м), 7,40 (1H, д, J=8,2 Гц), 7,42-7,44 (1H, м), 7,49 (1H, т, J=7,8 Гц), 7,61 (1H, с), 7,62 (1H, д, J=7,4 Гц), 7,69 (1H, с), 7,79 (1H, д, J=9,0 Гц).
MS (FAB+) m/z: 409 (M+H)+.
Т.пл.: 218-222°C.
(Пример 32) 3-{[1-Метил-6-(3-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-167)
(32a) трет-Бутил метил[5-(3-метилфенокси)-2-нитрофенил]карбамат
Синтез осуществляли таким же способом, как в примере (28a), используя м-крезол (0,36 мл, 3,5 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (1,0 г, 3,5 ммоль), гидрид натрия (>56% в масле, 0,17 г, 3,8 ммоль) и N,N-диметилформамид (20 мл). Полученное желтое масло непосредственно использовали для следующей реакции.
(32b) трет-Бутил [2-амино-5-(3-метилфенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил метил[5-(3-метилфенокси)-2-нитрофенил]карбамат, полученный в примере (32a) (1,2 г, 3,5 ммоль), железный порошок (0,93 г, 17 ммоль), хлорид аммония (0,093 г, 1,7 ммоль), этанол (16 мл) и воду (8,0 мл). Полученное масло непосредственно использовали для следующей реакции.
(32c) [1-Метил-6-(3-метилфенокси)-1H-бензимидазол-2-ил]метанол
трет-Бутил [2-амино-5-(3-метилфенокси)фенил]метилкарбамат, полученный в примере (32b) (1,1 г, 3,5 ммоль), растворяли в 4 н. растворе хлористоводородной кислоты в 1,4-диоксане (20 мл). Добавляли гликолевую кислоту (0,80 г, 10 ммоль) и смесь нагревали с обратным холодильником в течение ночи. Выпаривали при пониженном давлении растворитель и затем добавляли водный раствор бикарбоната натрия (100 мл) с последующим экстрагированием этилацетатом (100 мл × 2). Полученный органический слой промывали насыщенным раствором соли (80 мл) и затем сушили над безводным сульфатом магния. Выпаривали при пониженном давлении растворитель. Полученное твердое вещество промывали диизопропиловым эфиром с получением требуемого соединения (0,59 г, выход: 63%).
1H-ЯМР (CDCl3, 400 МГц) δ: 2,32 (3H, с), 3,75 (3H, с), 4,90 (2H, с), 6,80 (2H, с), 6,90 (1H, д, J=7,4 Гц), 6,94-7,02 (2H, м), 7,21 (1H, т, J=7,8 Гц), 7,65 (1H, д, J=8,6 Гц).
(32d) Метил 3-{[1-метил-6-(3-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [1-метил-6-(3-метилфенокси)-1H-бензимидазол-2-ил]метанол, полученный в примере (32c) (0,24 г, 0,89 ммоль), метил 3-гидроксибензоат (0,20 г, 1,3 ммоль), три-н-бутилфосфин (0,45 мл, 1,8 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,45 г, 1,8 ммоль) и дихлорметан (6,0 мл), с получением требуемого соединения (0,31 г, выход: 85%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,81 (3H, ушир.c), 3,92 (3H, с), 5,39 (2H, с), 6,78-6,83 (2H, м), 6,91 (1H, д, J=7,8 Гц), 6,97-7,04 (2H, м), 7,21 (1H, т, J=8,0 Гц), 7,27-7,32 (1H, м), 7,38 (1H, т, J=7,8 Гц), 7,69 (1H, тд, J=1,2, 1,4, 7,6 Гц), 7,71-7,75 (2H, м).
МС (FAB) m/z: 403 (M+H)+.
(32e) 3-{[1-Метил-6-(3-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[1-метил-6-(3-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (32d) (0,29 г, 0,72 ммоль), 1 н. водный раствор гидроксида натрия (1,1 мл, 1,1 ммоль) и 1,4-диоксан (1,0 мл), с получением требуемого соединения (0,17 г, выход: 60%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,27 (3H, с), 3,81 (3H, с), 5,47 (2H, с), 6,74-6,83 (2H, м), 6,87-6,97 (2H, м), 7,32 (1H, д, J=2,4 Гц), 7,36-7,41 (1H, м), 7,45 (1H, т, J=8,0 Гц), 7,58 (1H, дт, J=1,2, 1,4, 7,6 Гц), 7,62-7,68 (2H, м).
МС (FAB) m/z: 389 (M+H)+.
Аналит. вычислено для C23H20N2O4+0,33H2O: C, 70,04; H, 5,28; N, 7,10. Найдено C, 69,99; H, 5,16; N, 7,15.
(Пример 33) 3-({1-Метил-6-[3-(трифторметокси)фенокси]-1H-бензимидазол-2-ил}метокси]бензойная кислота (соединение № 1-176)
(33a) трет-Бутил метил{2-нитро-5-[3-(трифторметокси)фенокси]фенил}карбамат
Требуемое указанное в заголовке соединение (4,28 г, выход: 99%) получали в виде желтого масла в соответствии со способом, описанным в примере (31a), используя 3-трифторметоксифенол (1,78 г, 10 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (2,87 г, 10 ммоль) и гидрид натрия (56%, 0,38 г, 10 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 1,33 (6H, с), 1,50 (3H, с), 3,27 (3H, с), 6,89-6,91 (2H, м), 6,99 (1H, с), 7,05 (1H, д, J=8,6 Гц), 7,13 (1H, д, J=7,8 Гц), 7,47 (1H, т, J=8,2 Гц), 7,97 (1H, д, J=8,6 Гц).
(33b) трет-Бутил {2-амино-5-[3-(трифторметокси)фенокси]фенил}метилкарбамат
Требуемое указанное в заголовке соединение (3,98 г, выход: 99%) получали в виде желтого масла в соответствии со способом, описанным в примере (31b), используя трет-бутил метил{2-нитро-5-[3-(трифторметокси)фенокси]фенил}карбамат, полученный в примере (33a) (2,87 г, 10 ммоль), и железный порошок (2,79 г, 50 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 1,41 (9H, ушир.с), 3,15 (3H, с), 3,72 (2H, ушир.c), 6,76-6,89 (5H, м), 7,26-7,30 (2H, м).
(33c) {1-Метил-6-[3-(трифторметокси)фенокси]-1H-бензимидазол-2-ил}метанол
Требуемое указанное в заголовке соединение (3,08 г, выход: 91%) получали в виде бледно-коричневого порошка в соответствии со способом, описанным в примере (31c), используя трет-бутил {2-амино-5-[3-(трифторметокси)фенокси]фенил}метилкарбамат, полученный в примере (33b) (3,98 г, 10 ммоль), и гликолевую кислоту (1,52 г, 20 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 3,79 (3H, с), 4,91 (2H, с), 6,85 (1H, с), 6,89 (1H, дд, J=2,4, 8,6 Гц), 6,92-6,95 (1H, м), 6,98-7,01 (2H, м), 7,32 (1H, т, J=8,2 Гц), 7,67 (1H, д, J=9,0 Гц).
(33d) Метил 3-({1-метил-6-[3-(трифторметокси)фенокси]-1H-бензимидазол-2-ил}метокси)бензоат
Требуемое указанное в заголовке соединение (3,52 г, выход: 91%) получали в виде белого порошка в соответствии со способом, описанным в примере (31d), используя {1-метил-6-[3-(трифторметокси)фенокси]-1H-бензимидазол-2-ил}метанол, полученный в примере (33c) (3,08 г, 9,1 ммоль), метил 3-гидроксибензоат (2,08 г, 13,7 ммоль), три-н-бутилфосфин (3,68 г, 18,2 ммоль) и 1,1'-(азодикарбонил)дипиперидин (4,59 г, 18,2 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 3,85 (3H, с), 3,93 (3H, с), 5,42 (2H, с), 6,86 (1H, с), 6,91 (1H, дд, J=2,4, 7,4 Гц), 6,93-6,96 (1H, м), 7,02-7,06 (2H, м), 7,29-7,34 (2H, м), 7,39 (1H, т, J=7,4 Гц), 7,69-7,74 (2H, м), 7,77 (1H, д, J=8,2 Гц).
(33e) 3-({1-Метил-6-[3-(трифторметокси)фенокси]-1H-бензимидазол-2-ил}метокси]бензойная кислота
Раствор метил 3-({1-метил-6-[3-(трифторметокси)фенокси]-1H-бензимидазол-2-ил}метокси)бензоата, полученного в примере (33d) (3,52 г, 7,45 ммоль), в 2 М водном растворе гидроксида натрия (20 мл) и диоксане (40 мл) перемешивали при нагревании с обратным холодильником в течение двух часов. Дав реакционному раствору охладиться, добавляли к реакционной смеси 1 М хлористоводородную кислоту (50 мл) и выпавшее в осадок твердое вещество собирали фильтрованием. Твердое вещество растворяли в 1 М водном растворе гидроксида натрия (50 мл) и добавляли 1 М хлористоводородную кислоту (50 мл). Выпавшее в осадок твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (2,75 г, выход: 81%) в виде белого порошка.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,83 (3H, с), 5,48 (2H, с), 6,95-6,97 (2H, м), 7,00 (1H, дд, J=2,4, 8,6 Гц), 7,07-7,09 (1H, м), 7,36-7,39 (1H, м), 7,43-7,49 (3H, м), 7,58 (1H, дт, J=1,2, 7,8 Гц), 7,64 (1H, дд, J=1,2, 2,4 Гц), 7,71 (1H, д, J=8,2 Гц), 13,08 (1H, ушир.c).
МС (FAB+) m/z: 459 (M+H)+.
Т.пл.: 221-227°C.
(Пример 34) 3-{[6-(4-Фтор-3-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-187)
(34a) трет-Бутил [5-(4-фтор-3-метилфенокси)-2-нитрофенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя 4-фтор-3-метилфенол (0,78 мл, 7,0 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (2,0 г, 7,0 ммоль), гидрид натрия (>56% в масле, 0,28 г, 7,0 ммоль) и N,N-диметилформамид (20 мл). Полученное желтое масло непосредственно использовали для следующей реакции.
(34b) трет-Бутил [2-амино-5-(4-фтор-3-метилфенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(4-фтор-3-метилфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (34a) (2,6 г, 7,0 ммоль), железный порошок (1,9 г, 35 ммоль), хлорид аммония (0,19 г, 3,5 ммоль), этанол (20 мл) и воду (10 мл). Полученное масло непосредственно использовали для следующей реакции.
(34c) [6-(4-Фтор-3-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
трет-Бутил [2-амино-5-(4-фтор-3-метилфенокси)фенил]метилкарбамат, полученный в примере (34b) (2,4 г, 7,0 ммоль), растворяли в растворе 5 н. хлористоводородной кислоте (20 мл) и 1,4-диоксане (20 мл). Добавляли гликолевую кислоту (0,80 г, 10 ммоль) и смесь нагревали с обратным холодильником в течение ночи. Реакционный раствор охлаждали до комнатной температуры и добавляли водный раствор бикарбоната натрия (100 мл) с последующим экстрагированием этилацетатом (100 мл × 2). Полученный органический слой промывали насыщенным раствором соли (80 мл) и затем сушили над безводным сульфатом магния. Выпаривали при пониженном давлении растворитель. Полученное твердое вещество промывали диизопропиловым эфиром с получением требуемого соединения (1,5 г, выход: 77%) в виде бледно-красно-коричневого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 2,25 (3H, д, J=2,0 Гц), 3,78 (3H, с), 4,05 (1H, ушир.c), 4,91 (2H, с), 6,75-6,81 (1H, м), 6,83 (2H, дд, J=2,9, 6,1 Гц), 6,87 (1H, д, J=2,0 Гц), 6,96 (2H, д, J=8,6 Гц), 7,60 (1H, д, J=8,6 Гц).
(34d) Метил 3-{[6-(4-фтор-3-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(4-фтор-3-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (34c) (0,25 г, 0,88 ммоль), метил 3-гидроксибензоат (0,20 г, 1,3 ммоль), три-н-бутилфосфин (0,44 мл, 1,8 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,44 г, 1,8 ммоль) и дихлорметан (4 мл), с получением требуемого соединения (0,30 г, выход: 80%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 2,25 (3H, д, J=2,0 Гц), 3,81 (3H, с), 3,92 (3H, с), 5,39 (2H, с), 6,76-6,86 (2H, м), 6,92-7,00 (3H, м), 7,27-7,31 (1H, м), 7,38 (1H, т, J=8,0 Гц), 7,71 (3H, д, J=8,6 Гц).
(34e) 3-{[6-(4-Фтор-3-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(4-фтор-3-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (34d) (0,31 г, 0,72 ммоль), 1 н. водный раствор гидроксида натрия (1,2 мл, 1,2 ммоль) и 1,4-диоксан (1,0 мл), с получением требуемого соединения (0,24 г, выход: 81%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 500 МГц) δ: 2,20 (3H, с), 3,81 (3H, с), 5,46 (2H, с), 6,80-6,87 (1H, м), 6,89-6,95 (2H, м), 7,12 (1H, т, J=9,0 Гц), 7,28 (1H, д, J=2,0 Гц), 7,36-7,41 (1H, м), 7,45 (1H, т, J=7,8 Гц), 7,57 (1H, д, J=7,8 Гц), 7,62-7,67 (2H, м), 13,03 (1H, ушир.c).
МС (FAB) m/z: 407 (M+H)+.
Аналит. вычислено для C23H19FN2O4+0,10 HCl: C, 67,37; H, 4,69; F, 4,63; N, 6,83; Cl, 0,86. Найдено C, 67,24; H, 4,70; F, 4,56; N, 7,00; Cl, 0,64.
(Пример 35) 3-{[6-(3,4-Дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-180)
(35a) трет-Бутил [5-(3,4-дифторфенокси)-2-нитрофенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя 3,4-дифторфенол (0,95 г, 7,0 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (2,0 г, 7,0 ммоль), гидрид натрия (>56% в масле, 0,28 г, 7,0 ммоль) и N,N-диметилформамид (20 мл). Полученное желтое твердое вещество непосредственно использовали для следующей реакции.
(35b) трет-Бутил [2-амино-5-(3,4-дифторфенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(3,4-дифторфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (35a) (2,7 г, 7,0 ммоль), железный порошок (1,9 г, 35 ммоль), хлорид аммония (0,19 г, 3,5 ммоль), этанол (20 мл) и воду (10 мл). Полученное масло непосредственно использовали для следующей реакции.
(35c) [6-(3,4-Дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Реакцию и последующую обработку осуществляли в соответствии с примером (34c), используя трет-бутил [2-амино-5-(3,4-дифторфенокси)фенил]метилкарбамат, полученный в примере (35b) (2,4 г, 7,0 ммоль), гликолевую кислоту (0,80 г, 10 ммоль), 5 н. раствор хлористоводородной кислоты (20 мл) и 1,4-диоксан (20 мл), с получением требуемого соединения (1,5 г, выход: 76%) в виде бледно-коричневого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,78 (3H, с), 4,90 (2H, с), 6,67-6,74 (1H, м), 6,77-6,85 (1H, м), 6,97 (2H, с), 7,11 (1H, кв., J=9,3 Гц), 7,67 (1H, д, J=8,2 Гц).
(35d) Метил 3-{[6-(3,4-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(3,4-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (35c) (0,25 г, 0,88 ммоль), метил 3-гидроксибензоат (0,20 г, 1,3 ммоль), три-н-бутилфосфин (0,44 мл, 1,8 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,44 г, 1,8 ммоль) и дихлорметан (4,0 мл), с получением требуемого соединения (0,30 г, выход: 80%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,84 (3H, с), 3,94 (3H, с), 5,40 (2H, с), 5,41 (10H, ушир.c), 6,69-6,75 (1H, м), 6,79-6,85 (1H, м), 6,97-7,02 (2H, м), 7,07-7,15 (1H, м), 7,28-7,32 (1H, м), 7,38 (1H, т, J=8,1 Гц), 7,67-7,71 (1H, м), 7,74 (2H, с).
МС (FAB) m/z: 425 (M+H)+.
(35e) 3-{[6-(3,4-Дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(3,4-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (35d) (0,31 г, 0,72 ммоль), 1 н. водный раствор гидроксида натрия (1,2 мл, 1,2 ммоль) и 1,4-диоксан (1,0 мл), с получением требуемого соединения (0,25 г, выход: 82%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,82 (3H, с), 5,47 (2H, с), 6,77-6,84 (1H, м), 6,97 (1H, дд, J=2,4, 8,6 Гц), 7,10-7,18 (1H, м), 7,35-7,48 (4H, м), 7,55-7,70 (3H, м).
МС (FAB) m/z: 411 (M+H)+.
Аналит. вычислено для C22H16F2N2O4+0,10HCl: C, 67,37; H, 4,69; F, 4,63; N, 6,83; Cl, 0,86. Найдено C, 67,24; H, 4,70; F, 4,56; N, 7,00; Cl, 0,64.
(Пример 36) 3-({1-Метил-6-[3-(трифторметил)фенокси]-1H-бензимидазол-2-ил}метокси)бензойная кислота (соединение № 1-175)
(36a) трет-Бутил метил{2-нитро-5-[3-(трифторметил)фенокси]фенил}карбамат
Синтез осуществляли таким же способом, как в примере (28a), используя 3-(трифторметил)фенол (0,87 мл, 7,0 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (2,00 г, 7,0 ммоль), гидрид натрия (>56% в масле, 0,28 г, 7,0 ммоль) и N,N-диметилформамид (20 мл). Полученное желтое твердое вещество непосредственно использовали для следующей реакции.
(36b) трет-Бутил {2-амино-5-[3-(трифторметил)фенокси]фенил}метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил метил{2-нитро-5-[3-(трифторметил)фенокси]фенил}карбамат, полученный в примере (36a) (2,9 г, 7,0 ммоль), железный порошок (1,9 г, 35 ммоль), хлорид аммония (0,19 г, 3,5 ммоль), этанол (20 мл) и воду (10 мл). Полученное масло непосредственно использовали для следующей реакции.
(36c) {1-Метил-6-[3-(трифторметил)фенокси]-1H-бензимидазол-2-ил}метанол
Реакцию и последующую обработку осуществляли в соответствии с примером (34c), используя трет-бутил {2-амино-5-[3-(трифторметил)фенокси]фенил}метилкарбамат, полученный в примере (36b) (2,4 г, 7,0 ммоль), гликолевую кислоту (0,80 г, 10 ммоль), 5 н. раствор хлористоводородной кислоты (20 мл) и 1,4-диоксан (20 мл), с получением требуемого соединения (1,3 г, выход: 57%) в виде бледно-коричневого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,78 (3H, с), 4,93 (2H, с), 6,97-7,04 (2H, м), 7,09-7,18 (1H, м), 7,21 (1H, с), 7,33 (1H, д, J=8,6 Гц), 7,43 (1H, т, J=7,8 Гц), 7,71 (1H, д, J=8,2 Гц).
(36d) Метил 3-({1-метил-6-[3-(трифторметил)фенокси]-1H-бензимидазол-2-ил}метокси)бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя {1-метил-6-[3-(трифторметил)фенокси]-1H-бензимидазол-2-ил}метанол, полученный в примере (36c) (0,25 г, 0,88 ммоль), метил 3-гидроксибензоат (0,20 г, 1,3 ммоль), три-н-бутилфосфин (0,44 мл, 1,8 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,44 г, 1,8 ммоль) и дихлорметан (4,0 мл), с получением требуемого соединения (0,33 г, выход: 81%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,85 (3H, с), 3,93 (3H, с), 5,41 (8H, с), 5,41 (2H, с), 7,00-7,06 (2H, м), 7,15 (1H, дд, J=2,4, 8,2 Гц), 7,23 (1H, с), 7,28-7,46 (4H, м), 7,68-7,79 (3H, м).
МС (FAB) m/z: 457 (M+H)+.
(36e) 3-({1-Метил-6-[3-(трифторметил)фенокси]-1H-бензимидазол-2-ил}метокси]бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-({1-метил-6-[3-(трифторметил)фенокси]-1H-бензимидазол-2-ил}метокси)бензоат, полученный в примере (36d) (0,33 г, 0,72 ммоль), 1 н. водный раствор гидроксида натрия (1,1 мл, 1,1 ммоль) и 1,4-диоксан (1,0 мл), с получением требуемого соединения (0,28 г, выход: 89%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,84 (3H, с), 5,48 (2H, с), 7,01 (1H, дд, J=2,2, 8,8 Гц), 7,22-7,28 (2H, м), 7,32-7,50 (4H, м), 7,60 (3H, с), 7,72 (1H, д, J=8,6 Гц).
МС (FAB) m/z: 443 (M+H)+.
Аналит. вычислено для C23H17F3N2O4+0,10 HCl: C, 61,93; H, 3,86; F, 12,78; N, 6,28; Cl, 0,79. Найдено C, 61,78; H, 3,85; F, 12,55; N, 6,37; Cl, 0,83.
(Пример 37) 3-{[6-(3-Фтор-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-186)
(37a) трет-Бутил [5-(3-фтор-4-метилфенокси)-2-нитрофенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя 3-фтор-4-метилфенол (0,93 г, 7,4 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (2,0 г, 7,0 ммоль), гидрид натрия (>56% в масле, 0,29 г, 7,4 ммоль) и N,N-диметилформамид (20 мл). Полученное желтое масло непосредственно использовали для следующей реакции.
(37b) трет-Бутил [2-амино-5-(3-фтор-4-метилфенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(3-фтор-4-метилфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (37a) (2,6 г, 7,0 ммоль), железный порошок (1,9 г, 35 ммоль), хлорид аммония (0,19 г, 3,5 ммоль), этанол (20 мл) и воду (10 мл). Полученное масло непосредственно использовали для следующей реакции.
(37c) [6-(3-Фтор-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Реакцию и последующую обработку осуществляли в соответствии с примером (34c), используя трет-бутил [2-амино-5-(3-фтор-4-метилфенокси)фенил]метилкарбамат, полученный в примере (37b) (2,4 г, 7,0 ммоль), гликолевую кислоту (0,80 г, 10 ммоль), 5 н. раствор хлористоводородной кислоты (20 мл) и 1,4-диоксан (20 мл), с получением требуемого соединения (1,6 г, выход: 81%) в виде бледно-коричневого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 2,24 (3H, д, J=2,0 Гц), 3,76 (3H, с), 4,90 (2H, с), 6,63-6,72 (2H, м), 6,92-7,01 (2H, м), 7,11 (1H, т, J=9,0 Гц), 7,65 (1H, д, J=8,6 Гц).
(37d) Метил 3-{[6-(3-фтор-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(3-фтор-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (37c) (0,25 г, 0,88 ммоль), метил 3-гидроксибензоат (0,20 г, 1,3 ммоль), три-н-бутилфосфин (0,44 мл, 1,8 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,44 г, 1,8 ммоль) и дихлорметан (4 мл), с получением требуемого соединения (0,30 г, выход: 82%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 2,24 (3H, д, J=1,6 Гц), 3,82 (3H, с), 3,92 (3H, с), 5,40 (2H, с), 6,66-6,71 (2H, м), 6,98-7,04 (2H, м), 7,11 (1H, т, J=9,0 Гц), 7,27-7,32 (1H, м), 7,38 (1H, т, J=8,0 Гц), 7,67-7,70 (1H, м), 7,71-7,75 (2H, м).
МС (FAB) m/z: 421 (M+H)+.
(37e) 3-{[6-(3-Фтор-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(3-фтор-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (37d) (0,30 г, 0,72 ммоль), 1 н. водный раствор гидроксида натрия (1,1 мл, 1,1 ммоль) и 1,4-диоксан (1,0 мл), с получением требуемого соединения (0,27 г, выход: 94%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,18 (3H, с), 3,82 (3H, с), 5,47 (2H, с), 6,72 (6H, дд, J=2,4, 8,6 Гц), 6,80 (6H, дд, J=2,5, 11,1 Гц), 6,95 (6H, дд, J=2,4, 8,6 Гц), 7,25 (6H, т, J=8,6 Гц), 7,35-7,40 (2H, м), 7,36 (1H, д, J=2,4 Гц), 7,45 (1H, т, J=7,8 Гц), 7,58 (1H, д, J=7,8 Гц), 7,67 (1H, д, J=8,6 Гц), 7,63-7,69 (1H, м), 13,08 (1H, ушир.c).
МС (FAB) m/z: 407 (M+H)+.
Аналит. вычислено для C23H19FN2O4: C, 67,97; H, 4,71; F, 4,67; N, 6,89. Найдено C, 67,58; H, 4,63; F, 4,67; N, 6,91.
(Пример 38) 3-{[6-(3-Хлор-5-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-207)
(38a) трет-Бутил [5-(3-хлор-5-фторфенокси)-2-нитрофенил]метилкарбамат
Требуемое указанное в заголовке соединение (7,94 г, выход: 99%) получали в виде желтого порошка в соответствии со способом, описанным в примере (31a), используя 3-хлор-5-фторфенол (2,93 г, 20 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (5,73 г, 20 ммоль) и гидрид натрия (56%, 0,76 г, 20 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 1,33 (6H, с), 1,51 (3H, с), 3,28 (3H, с), 6,74 (1H, дт, J=2,4, 9,0 Гц), 6,90-6,93 (3H, м), 7,00 (1H, д, J=7,8 Гц), 7,98 (1H, д, J=8,6 Гц).
(38b) трет-Бутил [2-амино-5-(3-хлор-5-фторфенокси)фенил]метилкарбамат
Требуемое указанное в заголовке соединение (7,34 г, выход: 99%) получали в виде коричневого масла в соответствии со способом, описанным в примере (31b), используя трет-бутил [5-(3-хлор-5-фторфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (38a) (7,94 г, 20 ммоль), и железный порошок (5,59 г, 100 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 1,42 (9H, с), 3,15 (3H, с), 3,74 (2H, ушир.c), 6,53 (1H, д, J=9,8 Гц), 6,68-6,82 (4H, м), 7,04 (1H, дд, J=2,0, 8,6 Гц).
(38c) [6-(3-Хлор-5-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Требуемое указанное в заголовке соединение (2,99 г, выход: 49%) получали в виде белого порошка в соответствии со способом, описанным в примере (31c), используя трет-бутил [2-амино-5-(3-хлор-5-фторфенокси)фенил]метилкарбамат, полученный в примере (38b) (7,34 г, 20 ммоль), и гликолевую кислоту (3,04 г, 40 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 3,80 (3H, с), 4,91 (2H, с), 6,58 (1H, дт, J=2,4, 10,2 Гц), 6,98-7,02 (2H, м), 7,23 (1H, дд, J=2,0, 9,4 Гц), 7,32 (1H, д, J=2,0 Гц), 7,70 (1H, д, J=8,6 Гц).
(38d) Метил 3-{[6-(3-хлор-5-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (1,30 г, выход: 32%) получали в виде белого порошка в соответствии со способом, описанным в примере (31d), используя [6-(3-хлор-5-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (38c) (2,99 г, 9,75 ммоль), метил 3-гидроксибензоат (2,22 г, 14,6 ммоль), три-н-бутилфосфин (3,94 г, 19,5 ммоль) и 1,1'-(азодикарбонил)дипиперидин (4,92 г, 19,5 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 3,87 (3H, с), 3,93 (3H, с), 5,42 (2H, с), 6,59 (1H, дт, J=2,4, 9,8 Гц), 6,75 (1H, с) 6,80 (1H, дт, J=2,4, 7,8 Гц), 7,03 (1H, дд, J=2,0, 8,6 Гц), 7,07 (1H, д, J=2,4 Гц), 7,31 (1H, ддд, J=1,2, 2,7, 8,2 Гц), 7,39 (1H, т, J=7,8 Гц), 7,70 (1H, дд, J=1,2, 7,8 Гц), 7,74 (1H, с), 7,79 (1H, д, J=8,6 Гц).
(38e) 3-[6-(3-Хлор-5-фторфенокси)-1-метил-1H-бензимидазол-2-илметокси]бензойная кислота
Требуемое указанное в заголовке соединение (1,26 г, выход: 86%) получали в виде белого порошка в соответствии со способом, описанным в примере (33e), используя метил 3-{[6-(3-хлор-5-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере в примере (38d) (1,30 г, 2,95 ммоль).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,84 (3H, с), 5,48 (2H, с), 6,83-6,86 (2H, м), 7,02 (1H, дд, J=2,4, 9,0 Гц), 7,15 (1H, дт, J=2,0, 8,6 Гц), 7,39 (1H, ддд, J=1,2, 2,4, 8,2 Гц), 7,45 (1H, т, J=7,4 Гц), 7,49 (1H, д, J=2,4 Гц), 7,58 (1H, дт, J=1,2, 7,4 Гц), 7,65 (1H, дд, J=1,2, 2,4 Гц), 7,72 (1H, д, J=8,6 Гц), 13,04 (1H, с).
МС (FAB+) m/z: 427 (M+H)+.
Т.пл.: 209-213°C.
(Пример 39) 3-{[6-(3,5-Дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-181)
(39a) трет-Бутил [5-(3,5-дифторфенокси)-2-нитрофенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя 3,5-дифторфенол (2,9 г, 22 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (6,0 г, 21 ммоль), гидрид натрия (>56% в масле, 0,88 г, 22 ммоль) и N,N-диметилформамид (30 мл). Полученное желтое твердое вещество непосредственно использовали для следующей реакции.
(39b) трет-Бутил [2-амино-5-(3,5-дифторфенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(3,5-дифторфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (39a) (8,4 г, 22 ммоль), железный порошок (5,9 г, 110 ммоль), хлорид аммония (0,59 г, 11 ммоль), этанол (30 мл) и воду (15 мл). Полученное красно-коричневое твердое вещество непосредственно использовали для следующей реакции.
(39c) [6-(3,5-Дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Реакцию и последующую обработку осуществляли в соответствии с примером (34c), используя трет-бутил [2-амино-5-(3,5-дифторфенокси)фенил]метилкарбамат, полученный в примере (39b) (7,7 г, 22 ммоль), гликолевую кислоту (2,5 г, 33 ммоль), 5 н. раствор хлористоводородной кислоты (40 мл) и 1,4-диоксан (40 мл), с получением требуемого соединения (4,5 г, выход: 69%) бледно-серого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,80 (3H, с), 4,92 (2H, с), 6,42-6,55 (3H, м), 7,00 (1H, дд, J=2,4, 8,6 Гц), 7,04 (1H, д, J=2,4 Гц), 7,71 (1H, д, J=8,6 Гц).
(39d) Метил 3-{[6-(3,5-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(3,5-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (39c) (0,25 г, 0,88 ммоль), метил 3-гидроксибензоат (0,20 г, 1,3 ммоль), три-н-бутилфосфин (0,44 мл, 1,8 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,44 г, 1,8 ммоль) и дихлорметан (4,0 мл), с получением требуемого соединения (0,32 г, выход: 86%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,86 (3H, с), 3,92 (3H, с), 3,93 (9H, с), 5,41 (2H, с), 6,44-6,55 (2H, м), 7,03 (1H, дд, J=2,2, 8,8 Гц), 7,07 (1H, д, J=2,4 Гц), 7,27-7,33 (2H, м), 7,39 (1H, т, J=7,8 Гц), 7,67-7,71 (1H, м), 7,73 (1H, дд, J=1,4, 2,5 Гц), 7,78 (1H, д, J=8,6 Гц).
(39e) 3-{[6-(3,5-Дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(3,5-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (39d) (0,32 г, 0,75 ммоль), 1 н. водный раствор гидроксида натрия (1,9 мл, 1,9 ммоль) и 1,4-диоксан (1,5 мл), с получением требуемого соединения (0,23 г, выход: 76%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,85 (3H, с), 5,47 (2H, с), 6,69 (2H, дд, J=2,2, 8,8 Гц), 6,95 (1H, тт, J=2,2, 9,3 Гц), 7,02 (1H, дд, J=2,4, 8,6 Гц), 7,30-7,36 (1H, м), 7,42 (1H, т, J=7,8 Гц), 7,48 (1H, д, J=2,4 Гц), 7,57 (1H, д, J=7,4 Гц), 7,63 (1H, дд, J=1,6, 2,4 Гц), 7,72 (1H, д, J=8,6 Гц).
МС (FAB) m/z: 411 (M+H)+.
Аналит. вычислено для C22H16F2N2O4+1,00H2O: C, 61,68; H, 4,24; F, 8,87; N, 6,54. Найдено C, 61,58; H, 3,95; F, 9,06; N, 6,51.
(Пример 40) 3-{[6-(3-Фтор-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-188)
(40a) 1-Фтор-3-метокси-5-метилбензол
Смешанный раствор 3-бром-5-фторанизола (2,05 г, 10 ммоль), триметилбороксина (50% раствор в ТГФ, 2,51 г, 20 ммоль), PdCl2(dppf) (0,82 г, 1,0 ммоль) и карбоната цезия (6,52 г, 20 ммоль) в диоксане (100 мл) и воде (50 мл) перемешивали при нагревании с обратным холодильником в течение 10 часов. Дав реакционному раствору охладиться, добавляли к реакционному раствору воду (100 мл) с последующим экстрагированием этилацетатом (200 мл) два раза. Органические слои промывали водой (100 мл) два раза и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали хроматографией на силикагеле (гексан:этилацетат, 6:1) с получением указанного в заголовке соединения (1,40 г, выход: 66%) в виде желтого масла.
1H-ЯМР (CDCl3, 400 МГц) δ: 1,78 (3H, с), 6,44 (1H, дд, J=2,0, 11,0 Гц), 6,50 (1H, д, J=11,0 Гц), 6,51 (1H, с).
(40b) 3-Фтор-5-метилфенол
Раствор 1-фтор-3-метокси-5-метилбензола, полученного в примере (40a) (0,92 г, 6,56 ммоль), и трибромида бора (1,0 М раствор в метиленхлориде, 8,53 мл, 8,53 ммоль) в метиленхлориде (20 мл) перемешивали при 0°C в течение 10 часов. К реакционному раствору добавляли воду (100 мл) с последующим экстрагированием метиленхлоридом (100 мл). Затем органический слой сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали хроматографией на силикагеле (гексан:этилацетат, 1:1) с получением указанного в заголовке соединения (0,83 г, выход: 99%) в виде желтого масла.
1H-ЯМР (CDCl3, 400 МГц) δ: 2,06 (3H, с), 4,97 (1H, с), 6,37 (1H, дт, J=2,4, 10,2 Гц), 6,44 (1H, с), 6,48 (1H, д, J=8,6 Гц).
(40c) трет-Бутил [5-(3-фтор-5-метилфенокси)-2-нитрофенил]метилкарбамат
Требуемое указанное в заголовке соединение (1,71 г, выход: 69%) получали в виде желтого масла в соответствии со способом, описанным в примере (31a), используя 4-фтор-5-метилфенол, полученный в примере (40b) (0,83 г, 6,56 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (1,88 г, 6,56 ммоль) и гидрид натрия (56%, 0,25 г, 6,56 ммоль).
1H-ЯМР (CDCl3, 400 МГц): δ 1,33 (6H, с), 1,51 (3H, с), 2,38 (3H, с), 3,27 (3H, с), 6,63 (1H, дт, J=2,4, 9,4 Гц), 6,71 (1H, с), 6,80 (1H, д, J=8,6 Гц), 6,86-6,88 (2H, м), 7,95 (1H, д, J=8,2 Гц).
(40d) трет-Бутил [2-амино-5-(3-фтор-5-метилфенокси)фенил]метилкарбамат
Требуемое указанное в заголовке соединение (1,38 г, выход: 88%) получали в виде желтого масла в соответствии со способом, описанным в примере (31b), используя трет-бутил [5-(3-фтор-5-метилфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (40c) (1,71 г, 4,54 ммоль), и железный порошок (1,27 г, 22,7 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 1,41 (9H, с), 2,29 (3H, с), 3,15 (3H, с), 3,70 (2H, ушир.c), 6,42-6,56 (3H, м), 6,75-6,83 (3H, м).
(40e) [6-(3-Фтор-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Требуемое указанное в заголовке соединение (0,76 г, выход: 67%) получали в виде бледно-коричневого масла в соответствии со способом, описанным в примере (31c), используя трет-бутил [2-амино-5-(3-фтор-5-метилфенокси)фенил]метилкарбамат, полученный в примере (40d) (1,38 г, 3,98 ммоль), и гликолевую кислоту (0,61 г, 7,97 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 2,31 (3H, с), 3,78 (3H, с), 4,92 (2H, с), 6,49 (1H, дт, J=2,0, 10,2 Гц), 6,58 (1H, с), 6,61 (1H, д, J=11,0 Гц), 6,99-7,01 (2H, м), 7,69 (1H, д, J=9,4 Гц).
(40f) Метил 3-{[6-(3-фтор-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (0,82 г, выход: 74%) получали в виде белого порошка в соответствии со способом, описанным в примере (31d), используя [6-(3-фтор-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (40e) (0,76 г, 2,65 ммоль), метил 3-гидроксибензоат (0,61 г, 3,98 ммоль), три-н-бутилфосфин (1,07 г, 5,31 ммоль) и 1,1'-(азодикарбонил)дипиперидин (1,34 г, 5,31 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 2,30 (3H, с), 3,84 (3H, с), 3,93 (3H, с), 5,40 (2H, с), 6,49 (1H, дт, J=2,4, 10,2 Гц), 6,58 (1H, с), 6,60 (1H, д, J=10,6 Гц), 7,00-7,03 (2H, м), 7,28-7,31 (1H, м), 7,38 (1H, т, J=7,8 Гц), 7,68 (1H, дт, J=1,6, 8,6 Гц), 7,72-7,76 (2H, м).
(40g) 3-{[6-(3-Фтор-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (0,55 г, выход: 73%) получали в виде белого порошка в соответствии со способом, описанным в примере (33e), используя метил 3-{[6-(3-фтор-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере в примере (40f) (0,82 г, 1,86 ммоль).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,25 (3H, с), 3,83 (3H, с), 5,47 (2H, с), 6,58-6,60 (2H, м), 6,75 (1H, д, J=10,6 Гц), 6,96 (1H, дд, J=2,4, 8,6 Гц), 7,37-7,39 (2H, м), 7,45 (1H, т, J=7,4 Гц), 7,57 (1H, дт, J=1,2, 7,8 Гц), 7,64 (1H, дд, J=1,2, 2,4 Гц), 7,68 (1H, д, J=8,6 Гц), 13,03 (1H, с).
МС (FAB+) m/z: 407 (M+H)+.
Т.пл.: 224-226°C.
(Пример 41) 3-{[6-(2,5-Дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-179)
(41a) трет-Бутил [5-(2,5-дифторфенокси)-2-нитрофенил]метилкарбамат
Реакцию и последующую обработку осуществляли в соответствии с примером (28a), используя 2,5-дифторфенол (5,1 г, 38 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (9,8 г, 34 ммоль), гидрид натрия (>56% в масле, 1,5 г, 38 ммоль) и N,N-диметилформамид (90 мл), с получением требуемого соединения (12 г, выход: 92%) в виде желтого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 1,32 (6H, с), 1,50 (3H, ушир.с), 3,28 (3H, с), 6,81-7,07 (4H, м), 7,17-7,26 (1H, м), 7,96 (1H, д, J=9,0 Гц).
(41b) трет-Бутил [2-амино-5-(2,5-дифторфенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(2,5-дифторфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (41a) (12 г, 31 ммоль), железный порошок (8,4 г, 160 ммоль), хлорид аммония (0,84 г, 16 ммоль), этанол (30 мл) и воду (15 мл). Полученное красно-коричневое твердое вещество непосредственно использовали для следующей реакции.
(41c) [6-(2,5-Дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Реакцию и последующую обработку осуществляли в соответствии с примером (34c), используя трет-бутил [2-амино-5-(2,5-дифторфенокси)фенил]метилкарбамат, полученный в примере (41b) (11 г, 31 ммоль), гликолевую кислоту (3,6 г, 47 ммоль), 5 н. раствор хлористоводородной кислоты (40 мл) и 1,4-диоксан (40 мл), с получением требуемого соединения (7,6 г, выход: 83%) в виде бледно-коричневого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,77 (3H, с), 4,91 (2H, с), 6,60-6,71 (1H, м), 6,71-6,82 (1H, м), 6,97-7,06 (2H, м), 7,09-7,21 (1H, м), 7,68 (1H, д, J=9,0 Гц).
(41d) Метил 3-{[6-(2,5-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(2,5-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (41c) (0,25 г, 0,86 ммоль), метил 3-гидроксибензоат (0,20 г, 1,3 ммоль), три-н-бутилфосфин (0,43 мл, 1,7 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,43 г, 1,7 ммоль) и дихлорметан (4,0 мл), с получением требуемого соединения (0,28 г, выход: 78%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ ммд: 3,84 (3H, с), 3,92 (3H, с), 5,40 (2H, с), 6,65-6,71 (1H, м), 6,73-6,80 (1H, м), 7,01-7,05 (2H, м), 7,11-7,18 (1H, м), 7,29 (1H, дд, J=2,7, 8,2 Гц), 7,38 (1H, т, J=8,0 Гц), 7,67-7,77 (3H, м).
(41e) 3-{[6-(2,5-Дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(2,5-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (41d) (0,28 г, 0,67 ммоль), 1 н. водный раствор гидроксида натрия (1,0 мл, 1,0 ммоль) и 1,4-диоксан (1,0 мл), с получением требуемого соединения (0,25 г, выход: 91%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 500 МГц) δ: 3,83 (3H, с), 5,47 (2H, с), 6,88-6,95 (1H, м), 6,98-7,05 (2H, м), 7,38 (2H, с), 7,41-7,48 (2H, м), 7,58 (1H, д, J=7,3 Гц), 7,63 (1H, с), 7,68 (1H, д, J=8,8 Гц), 13,03 (1H, ушир.c).
МС (FAB) m/z: 411 (M+H)+.
Аналит. вычислено для C22H16F2N2O4+0,25H2O: C, 63,69; H, 4,01; F, 9,16; N, 6,75. Найдено C, 63,84; H, 4,05; F, 9,22; N, 6,83.
(Пример 42) 3-{[6-(3-Этилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-170)
(42a) трет-Бутил [5-(3-этилфенокси)-2-нитрофенил]метилкарбамат
Требуемое указанное в заголовке соединение (20,5 г, выход: 97%) получали в виде желтого масла в соответствии со способом, описанным в примере (31a), используя 3-этилфенол (6,72 г, 55 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (14,19 г, 49,5 ммоль) и гидрид натрия (56%, 2,10 г, 55,0 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 1,27 (3H, т, J=7,4 Гц), 1,33 (6H, с), 1,50 (3H, с), 2,69 (2H, кв., J=7,4 Гц), 3,26 (3H, с), 6,82-6,94 (4H, м), 7,11 (1H, д, J=7,0 Гц), 7,35 (1H, т, J=7,4 Гц), 7,94 (1H, д, J=8,6 Гц).
(42b) трет-Бутил [2-амино-5-(3-этилфенокси)фенил]метилкарбамат
Требуемое указанное в заголовке соединение (18,2 г, выход: 99%) получали в виде бледно-коричневого масла в соответствии со способом, описанным в примере (31b), используя трет-бутил [5-(3-этилфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (42a) (19,8 г, 53,2 ммоль) и железный порошок (14,9 г, 266 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 1,22 (3H, т, J=7,4 Гц), 1,56 (9H, с), 2,61 (2H, кв., J=7,4 Гц), 3,15 (3H, с), 3,66 (2H, ушир.c), 6,73-6,84 (5H, м), 6,88 (1H, д, J=7,4 Гц), 7,19 (1H, т, J=7,8 Гц).
(42c) [6-(3-Этилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Требуемое указанное в заголовке соединение (15,0 г, выход: 83%) получали в виде коричневого порошка в соответствии со способом, описанным в примере (31c), используя трет-бутил [2-амино-5-(3-этилфенокси)фенил]метилкарбамат, полученный в примере (42b) (18,2 г, 53,2 ммоль), и гликолевую кислоту (8,09 г, 106 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 1,23 (3H, т, J=7,8 Гц), 2,63 (2H, кв., J=7,4 Гц), 3,77 (3H, с), 4,08 (2H, с), 6,80 (1H, дд, J=2,0, 8,2 Гц), 6,86 (1H, с), 6,94-6,95 (2H, м), 6,98 (1H, дд, J=2,4, 9,0 Гц), 7,24 (1H, т, J=7,8 Гц), 7,62 (1H, д, J=8,6 Гц).
(42d) Метил 3-{[6-[3-этилфенокси]-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (18,5 г, выход: 80%) получали в виде бледно-желтого масла в соответствии со способом, описанным в примере (31d), используя [6-(3-этилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (42c) (12,5 г, 44,3 ммоль), метил 3-гидроксибензоат (10,1 г, 66,5 ммоль), три-н-бутилфосфин (17,9 г, 88,7 ммоль) и 1,1'-(азодикарбонил)дипиперидин (22,4 г, 88,7 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 1,23 (3H, т, J=7,8 Гц), 2,63 (2H, кв., J=7,4 Гц), 3,82 (3H, с), 3,93 (3H, с), 5,40 (2H, с), 6,82 (1H, дд, J=2,4, 8,2 Гц), 6,87 (1H, с), 6,95 (1H, д, J=7,0 Гц), 7,01 (1H, д, J=2,4 Гц), 7,03 (1H, дд, J=2,4, 8,6 Гц), 7,23 (1H, д, J=7,8 Гц), 7,29-7,32 (1H, м), 7,38 (1H, т, J=7,4 Гц), 7,70 (1H, д, J=7,4 Гц), 7,72-7,74 (2H, м).
(42e) 3-{[6-(3-Этилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (14,2 г, выход: 83%) получали в виде белого порошка в соответствии со способом, описанным в примере (33e), используя метил 3-{[6-[3-этилфенокси]-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере в примере (42d) (14,7 г, 35,3 ммоль).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 1,15 (3H, т, J=7,4 Гц), 2,57 (2H, кв., J=7,4 Гц), 3,81 (3H, с), 5,47 (2H, с), 6,76 (1H, дд, J=2,4, 8,2 Гц), 6,84 (1H, с), 6,92-9,95 (2H, м), 7,25 (1H, т, J=7,8 Гц), 7,32 (1H, д, J=2,4 Гц), 7,37-7,40 (1H, м), 7,45 (1H, т, J=7,8 Гц), 7,58 (1H, д, J=7,4 Гц), 7,63-7,65 (1H, м), 7,66 (1H, д, J=8,6 Гц), 13,03 (1H, ушир.c).
МС (FAB+) m/z: 403 (M+H)+.
Т.пл.: 204-208°C.
(Пример 43) 3-{[6-(2,4-Дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-178)
(43a) 5-(2,4-Дифторфенокси)-N-метил-2-нитроанилин
Синтез осуществляли таким же способом, как в примере (28a), используя 2,4-дифторфенол (5,2 г, 38 ммоль), 5-хлор-N-метилнитроанилин (6,5 г, 35 ммоль), гидрид натрия (>56% в масле, 1,8 г, 46 ммоль) и N,N-диметилформамид (80 мл). Полученное желтое твердое вещество непосредственно использовали для следующей реакции.
(43b) 4-(2,4-Дифторфенокси)-2-N-метиламиноанилин
Синтез осуществляли таким же способом, как в примере (28b), используя 5-(2,4-дифторфенокси)-N-метил-2-нитроанилин (9,8 г, 35 ммоль), полученный в примере (43a), железный порошок (9,3 г, 170 ммоль), хлорид аммония (0,93 г, 17 ммоль), этанол (30 мл) и воду (15 мл). Полученное красно-коричневое масло непосредственно использовали для следующей реакции.
(43c) [6-(2,4-Дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Реакцию и последующую обработку осуществляли в соответствии с примером (34c), используя 4-(2,4-дифторфенокси)-2-N-метиламиноанилин, полученный в примере (43b) (2,4 г, 7,0 ммоль), гликолевую кислоту (3,1 г, 41 ммоль), 5 н. раствор хлористоводородной кислоты (40 мл) и 1,4-диоксан (40 мл), с получением требуемого соединения (7,7 г, выход: 76%) в виде красновато-серого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,74 (3H, с), 4,58 (1H, ушир.c), 4,87 (2H, с), 6,79-6,90 (2H, м), 6,90-7,07 (3H, м), 7,61 (1H, д, J=8,6 Гц).
(43d) Метил 3-{[6-(2,4-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(2,4-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (43c) (0,25 г, 0,86 ммоль), метил 3-гидроксибензоат (0,20 г, 1,3 ммоль), три-н-бутилфосфин (0,43 мл, 1,7 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,43 г, 1,7 ммоль) и дихлорметан (4,0 мл), с получением требуемого соединения (0,31 г, выход: 84%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,81 (3H, с), 3,92 (3H, с), 5,39 (2H, с), 6,81-6,88 (1H, м), 6,90 (1H, д, J=2,4 Гц), 6,94-7,07 (3H, м), 7,29 (1H, д, J=1,6 Гц), 7,37 (1H, т, J=8,2 Гц), 7,66-7,76 (3H, м).
МС (FAB) m/z: 425 (M+H)+.
(43e) 3-{[6-(2,4-Дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(2,4-дифторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (43d) (0,31 г, 0,73 ммоль), 1 н. водный раствор гидроксида натрия (1,2 мл, 1,2 ммоль) и 1,4-диоксан (1,0 мл), с получением требуемого соединения (0,14 г, выход: 48%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,80 (3H, с), 5,45 (2H, с), 6,93 (1H, дд, J=2,5, 8,8 Гц), 7,05-7,12 (1H, м), 7,19 (1H, дт, J=5,9, 9,2 Гц), 7,25 (1H, д, J=2,4 Гц), 7,32-7,37 (1H, м), 7,43 (1H, т, J=7,82 Гц), 7,44-7,51 (1H, м), 7,54-7,59 (1H, м), 7,62 (1H, дд, J=1,4, 2,5 Гц), 7,64 (1H, д, J=8,6 Гц).
МС (FAB) m/z: 411 (M+H)+.
Аналит. вычислено для C22H16F2N2O4+0,50H2O: C, 63,01; H, 4,09; F, 9,06; N, 6,68. Найдено C, 63,13; H, 3,86; F, 9,20; N, 6,70.
(Пример 44) 3-{[1-Метил-6-(2-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-166)
(44a) трет-Бутил метил[5-(2-метилфенокси)-2-нитрофенил]карбамат
Неочищенный продукт требуемого указанного в заголовке соединения получали в виде коричневого масла в соответствии со способом, описанным в примере (28a), используя 2-метилфенол (4,53 г, 41,9 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (10,0 г, 34,9 ммоль) и гидрид натрия (63%, 1,59 г, 41,9 ммоль). Полученный неочищенный продукт непосредственно использовали для следующей реакции.
(44b) трет-Бутил [2-амино-5-(2-метилфенокси)фенил]метилкарбамат
Неочищенный продукт требуемого указанного в заголовке соединения получали в виде коричневого масла в соответствии со способом, описанным в примере (28b), используя трет-бутил метил[5-(2-метилфенокси)-2-нитрофенил]карбамат, полученный в примере (44a) (12,5 г, 34,9 ммоль), железный порошок (9,74 г, 174 ммоль) и хлорид аммония (0,933 г, 17,4 ммоль). Полученный неочищенный продукт непосредственно использовали для следующей реакции.
(44c) [1-Метил-6-(2-метилфенокси)-1H-бензимидазол-2-ил]метанол
Требуемое указанное в заголовке соединение (6,71 г, выход: 72%) получали в виде коричневого порошка в соответствии со способом, описанным в примере (28c), используя трет-бутил [2-амино-5-(2-метилфенокси)фенил]метилкарбамат, полученный в примере (44b) (11,5 г, 34,9 ммоль), и гликолевую кислоту (3,98 г, 52,3 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 2,28 (3H, с), 3,73 (3H, с), 4,86 (2H, с), 6,80 (1H, д, J=2,0 Гц), 6,83-6,87 (1H, м), 6,91 (1H, дд, J=2,0, 8,6 Гц), 7,03-7,08 (1H, м), 7,12-7,18 (1H, м), 7,24-7,29 (1H, м), 7,59 (1H, д, J=8,6 Гц).
(44d) Метил 3-{[1-метил-6-(2-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (7,33 г, выход: 81%) получали в виде белого порошка в соответствии со способом, описанным в примере (28d), используя [1-метил-6-(2-метилфенокси)-1H-бензимидазол-2-ил]метанол, полученный в примере (44c) (6,00 г, 22,4 ммоль), метил 3-гидроксибензоат (4,08 г, 26,8 ммоль), три-н-бутилфосфин (8,38 мл, 33,5 ммоль) и 1,1'-(азодикарбонил)дипиперидин (8,46 г, 33,5 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 2,29 (3H, с), 3,79 (3H, с), 3,92 (3H, с), 5,38 (2H, с), 6,84 (1H, д, J=2,3 Гц), 6,88 (1H, д, J=8,2 Гц), 6,97 (1H, дд, J=2,3, 9,0 Гц), 7,04-7,10 (1H, м), 7,13-7,19 (1H, м), 7,25-7,32 (2H, м), 7,37 (1H, т, J=7,8 Гц), 7,66-7,73 (3H, м).
(44e) 3-{[1-Метил-6-(2-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (6,13 г, выход: 98%) получали в виде белого порошка в соответствии со способом, описанным в примере (28e), используя метил 3-{[1-метил-6-(2-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензоат (6,50 г, 16,2 ммоль), полученный в примере (44d), и 1 н. водный раствор гидроксида натрия (24,2 мл, 24,2 ммоль).
1H ЯМР (ДМСО-d6, 500 МГц) δ: 2,25 (3H, с), 3,79 (3H, с), 5,45 (2H, с), 6,81 (1H, д, J=7,8 Гц), 6,86 (1H, дд, J=2,4, 8,8 Гц), 7,06 (1H, т, J=7,3 Гц), 7,14-7,21 (2H, м), 7,32 (1H, д, J=7,3 Гц), 7,36-7,41 (1H, м), 7,45 (1H, т, J=8,1 Гц), 7,57 (1H, д, J=7,3 Гц), 7,63 (2H, д, J=8,3 Гц), 13,03 (1H, с).
МС (FAB) m/z: 389 (M+H)+.
(Пример 45) 3-{[6-(2-Фтор-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-184)
(45a) трет-Бутил [5-(2-фтор-5-метилфенокси)-2-нитрофенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя 2-фтор-5-метилфенол (5,1 г, 40 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (10 г, 36 ммоль), гидрид натрия (>56% в масле, 1,6 г, 40 ммоль) и N,N-диметилформамид (70 мл). Полученное желтое масло непосредственно использовали для следующей реакции.
(45b) трет-Бутил [2-амино-5-(2-фтор-5-метилфенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(2-фтор-5-метилфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (45a) (15 г, 40 ммоль), железный порошок (11 г, 200 ммоль), хлорид аммония (1,1 г, 20 ммоль), этанол (30 мл) и воду (15 мл). Полученное масло непосредственно использовали для следующей реакции.
(45c) [6-(2-Фтор-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Реакцию и последующую обработку осуществляли в соответствии с примером (34c), используя трет-бутил [2-амино-5-(2-фтор-5-метилфенокси)фенил]метилкарбамат, полученный в примере (45b) (15 г, 40 ммоль), гликолевую кислоту (4,0 г, 52 ммоль), 5 н. раствор хлористоводородной кислоты (30 мл) и 1,4-диоксан (30 мл), с получением требуемого соединения (8,0 г, выход: 70%) в виде бледно-коричневого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 2,27 (3H, с), 3,75 (3H, с), 4,89 (2H, с), 6,78-6,84 (1H, м), 6,85-6,91 (1H, м), 6,92 (1H, д, J=2,4 Гц), 6,98 (1H, дд, J=2,2, 8,8 Гц), 7,07 (1H, дд, J=8,6, 10,6 Гц), 7,64 (1H, д, J=9,0 Гц).
(45d) Метил 3-{[6-(2-фтор-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(2-фтор-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (45c) (0,25 г, 0,94 ммоль), метил 3-гидроксибензоат (0,16 г, 1,0 ммоль), три-н-бутилфосфин (0,47 мл, 1,9 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,47 г, 1,9 ммоль) и дихлорметан (4 мл), с получением требуемого соединения (0,20 г, выход: 49%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 2,27 (3H, с), 3,82 (3H, с), 3,92 (3H, с), 5,39 (2H, с), 6,82 (1H, с), 6,86-6,92 (1H, м), 6,95 (1H, д, J=2,4 Гц), 7,01 (1H, дд, J=2,4, 9,0 Гц), 7,07 (1H, дд, J=8,2, 10,6 Гц), 7,28-7,31 (1H, м), 7,38 (1H, т, J=7,8 Гц), 7,67-7,73 (3H, м).
МС (FAB) m/z: 421 (M+H)+.
(45e) 3-{[6-(2-Фтор-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(2-фтор-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (45d) (0,20 г, 0,46 ммоль), 1 н. водный раствор гидроксида натрия (0,70 мл, 0,70 ммоль) и 1,4-диоксан (1,0 мл), с получением требуемого соединения (0,18 г, выход: 95%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,23 (3H, с), 3,81 (3H, с), 5,46 (2H, с), 6,87 (1H, с), 6,93 (1H, дд, J=2,4, 9,0 Гц), 6,94-6,99 (1H, м), 7,22-7,31 (2H, м), 7,39 (1H, с), 7,45 (1H, т, J=7,8 Гц), 7,58 (1H, д, J=7,4 Гц), 7,62-7,68 (2H, м).
МС (FAB) m/z: 407 (M+H)+.
Аналит. вычислено для C23H19FN2O4+0,20H2O: C, 67,38; H, 4,77; F, 4,63; N, 6,83. Найдено C, 67,43; H, 4,71; F, 4,80; N, 6,87.
(Пример 46) 3-{[6-(4-Фтор-2-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-183)
(46a) трет-Бутил [5-(4-фтор-2-метилфенокси)-2-нитрофенил]метилкарбамат
Неочищенный продукт требуемого указанного в заголовке соединения получали в виде коричневого масла в соответствии со способом, описанным в примере (28a), используя 4-фтор-2-метилфенол (5,28 г, 41,9 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (10,0 г, 34,9 ммоль) и гидрид натрия (63%, 1,59 г, 41,9 ммоль). Полученный неочищенный продукт непосредственно использовали для следующей реакции.
(46b) трет-Бутил [2-амино-5-(4-фтор-2-метилфенокси)фенил]метилкарбамат
Неочищенный продукт требуемого указанного в заголовке соединения получали в виде коричневого порошка в соответствии со способом, описанным в примере (28b), используя трет-бутил [5-(4-фтор-2-метилфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (46a) (13,1 г, 34,9 ммоль), железный порошок (9,74 г, 174 ммоль) и хлорид аммония (0,933 г, 17,4 ммоль). Полученный неочищенный продукт непосредственно использовали для следующей реакции.
(46c) [6-(4-Фтор-2-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Требуемое указанное в заголовке соединение (8,62 г, выход: 86%) получали в виде коричневого порошка в соответствии со способом, описанным в примере (28c), используя трет-бутил [2-амино-5-(4-фтор-2-метилфенокси)фенил]метилкарбамат, полученный в примере (46b) (12,1 г, 34,9 ммоль), и гликолевую кислоту (3,98 г, 52,3 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 2,25 (3H, с), 3,73 (3H, с), 4,86 (2H, с), 6,73 (1H, д, J=2,3 Гц), 6,84-6,90 (3H, м), 6,96-7,00 (1H, м), 7,59 (1H, д, J=8,6 Гц).
(46d) Метил 3-{[6-(4-фтор-2-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (8,49 г, выход: 77%) получали в виде белого порошка в соответствии со способом, описанным в примере (28d), используя [6-(4-фтор-2-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (46c) (7,50 г, 26,2 ммоль), метил 3-гидроксибензоат (4,78 г, 31,4 ммоль), три-н-бутилфосфин (7,85 мл, 31,4 ммоль) и 1,1'-(азодикарбонил)дипиперидин (7,93 г, 31,4 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 2,25 (3H, с), 3,79 (3H, с), 3,92 (3H, с), 5,38 (2H, с), 6,77 (1H, д, J=2,3 Гц), 6,84-7,02 (4H, м), 7,25-7,33 (1H, м), 7,37 (1H, т, J=8,0 Гц), 7,66-7,74 (3H, м).
(46e) 3-{[6-(4-Фтор-2-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (6,48 г, выход: 89%) получали в виде белого порошка в соответствии со способом, описанным в примере (28e), используя метил 3-{[6-(4-фтор-2-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (46d) (7,50 г, 17,8 ммоль), и 1 н. водный раствор гидроксида натрия (26,8 мл, 26,8 ммоль).
1H ЯМР (ДМСО-d6, 400 МГц) δ: 2,22 (3H, с), 3,78 (3H, с), 5,45 (2H, с), 6,82-6,91 (2H, м), 6,98-7,05 (1H, м), 7,12 (1H, д, J=2,3 Гц), 7,20 (1H, дд, J=3,1, 9,4 Гц), 7,35-7,40 (1H, м), 7,45 (1H, т, J=7,8 Гц), 7,55-7,59 (1H, м), 7,60-7,65 (2H, м), 13,03 (1H, с).
МС (FAB) m/z: 407 (M+H)+.
(Пример 47) 3-{[6-(3-Фтор-5-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-195)
(47a) трет-Бутил [5-(3-фтор-5-метоксифенокси)-2-нитрофенил]метилкарбамат
Реакцию и последующую обработку осуществляли в соответствии с примером (27a), используя известный [WO 2005037763] 3-фтор-5-метоксифенол (4,5 г, 32 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (7,7 г, 27 ммоль), гидрид натрия (>56% в масле, 1,3 г, 32 ммоль) и N,N-диметилформамид (60 мл), с получением требуемого соединения (3,7 г, выход: 57%).
1H-ЯМР (CDCl3, 400 МГц) δ: 1,32 (6H, с), 1,50 (3H, с), 3,27 (3H, с), 3,81 (3H, с), 6,37-6,46 (2H, м), 6,52 (1H, д, J=11,0 Гц), 6,86-6,96 (2H, м), 7,91-8,03 (1H, м).
(47b) трет-Бутил [2-амино-5-(3-фтор-5-метоксифенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(3-фтор-5-метоксифенокси)-2-нитрофенил]метилкарбамат, полученный в примере (47a) (3,7 г, 9,5 ммоль), железный порошок (2,5 г, 47 ммоль), хлорид аммония (0,25 г, 4,7 ммоль), этанол (30 мл) и воду (15 мл). Полученное бледно-коричневое масло непосредственно использовали для следующей реакции.
(47c) [6-(3-Фтор-5-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Реакцию и последующую обработку осуществляли в соответствии с примером (34c), используя трет-бутил [2-амино-5-(3-фтор-5-метоксифенокси)фенил]метилкарбамат, полученный в примере (47b) (3,1 г, 8,7 ммоль), гликолевую кислоту (0,86 г, 11 ммоль), 5 н. раствор хлористоводородной кислоты (10 мл) и 1,4-диоксан (10 мл), с получением требуемого соединения (2,0 г, выход: 75%) в виде бледно-коричневого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,72 (3H, с), 3,75 (3H, с), 4,90 (2H, д, J=5,5 Гц), 6,54 (1H, дд, J=2,9, 6,8 Гц), 6,57-6,63 (1H, м), 6,95 (1H, д, J=2,4 Гц), 7,00 (1H, дд, J=2,2, 8,8 Гц), 7,10 (1H, дд, J=9,0, 10,6 Гц), 7,66 (1H, д, J=8,6 Гц).
(47d) Метил 3-{[6-(3-фтор-5-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(3-фтор-5-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (47c) (0,35 г, 1,2 ммоль), метил 3-гидроксибензоат (0,19 г, 1,3 ммоль), три-н-бутилфосфин (0,58 мл, 2,3 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,58 г, 2,3 ммоль) и дихлорметан (4 мл), с получением требуемого соединения (0,31 г, выход: 60%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,75 (3H, с), 3,84 (3H, с), 3,93 (3H, с), 5,41 (2H, с), 6,27 (1H, ддд, J=2,0, 2,2, 10,0 Гц), 6,32-6,37 (2H, м), 6,98-7,09 (2H, м), 7,30 (1H, дд, J=2,7, 8,2 Гц), 7,38 (1H, т, J=7,8 Гц), 7,69 (1H, дт, J=1,3, 7,5 Гц), 7,73 (1H, дд, J=1,4, 2,5 Гц), 7,75 (1H, дд, J=1,2, 8,2 Гц).
МС (FAB) m/z: 437 (M+H)+.
(47e) 3-{[6-(3-Фтор-5-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(3-фтор-5-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (47d) (0,31 г, 0,70 ммоль), 1 н. водный раствор гидроксида натрия (1,1 мл, 1,1 ммоль) и 1,4-диоксан (1,0 мл), с получением требуемого соединения (0,20 г, выход: 67%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,73 (3H, с), 3,84 (3H, с), 5,47 (2H, с), 6,38 (1H, с), 6,33 (1H, дт, J=2,3, 10,3 Гц), 6,56 (1H, дт, J=2,4, 11,0 Гц), 6,98 (1H, дд, J=2,4, 8,6 Гц), 7,37-7,48 (3H, м), 7,58 (1H, д, J=7,4 Гц), 7,64 (1H, с), 7,69 (1H, д, J=8,6 Гц), 13,03 (1H, ушир.c).
МС (FAB) m/z: 423 (M+H)+.
Аналит. вычислено для C23H19FN2O5+0,20H2O: C, 64,85; H, 4,59; F, 4,46; N, 6,58. Найдено C, 64,77; H, 4,50; F, 4,58; N, 6,65.
(Пример 48) 3-{[6-(2-Фтор-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-182)
(48a) трет-Бутил [5-(2-фтор-4-метилфенокси)-2-нитрофенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя 2-фтор-4-метилфенол (5,0 г, 40 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (10 г, 36 ммоль), гидрид натрия (>56% в масле, 1,6 г, 40 ммоль) и N,N-диметилформамид (50 мл). Полученное желтое масло непосредственно использовали для следующей реакции.
(48b) трет-Бутил [2-амино-5-(2-фтор-4-метилфенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(2-фтор-4-метилфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (48a) (14 г, 36 ммоль), железный порошок (10 г, 180 ммоль), хлорид аммония (0,96 г, 18 ммоль), этанол (30 мл) и воду (15 мл). Полученное коричневое масло непосредственно использовали для следующей реакции.
(48c) [6-(2-Фтор-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Реакцию и последующую обработку осуществляли в соответствии с примером (34c), используя трет-бутил [2-амино-5-(2-фтор-4-метилфенокси)фенил]метилкарбамат, полученный в примере (48b) (13 г, 36 ммоль), гликолевую кислоту (3,0 г, 47 ммоль), 5 н. раствор хлористоводородной кислоты (30 мл) и 1,4-диоксан (30 мл), с получением требуемого соединения (9,0 г, выход: 87%) в виде бледно-коричневого твердого вещества, которое непосредственно использовали для следующей реакции.
(48d) Метил 3-{[6-(2-фтор-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(2-фтор-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (48c) (0,35 г, 1,2 ммоль), метил 3-гидроксибензоат (0,19 г, 1,3 ммоль), три-н-бутилфосфин (0,58 мл, 2,3 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,58 г, 2,3 ммоль) и дихлорметан (4 мл), с получением требуемого соединения (0,38 г, выход: 78%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 2,36 (3H, с), 3,80 (3H, с), 3,92 (3H, с), 5,38 (2H, с), 6,88-7,04 (5H, м), 7,29 (1H, с), 7,37 (1H, т, J=8,0 Гц), 7,65-7,75 (3H, м).
МС (FAB) m/z: 421 (M+H)+.
(48e) 3-{[6-(2-Фтор-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(2-фтор-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (48d) (0,38 г, 0,90 ммоль), 1 н. водный раствор гидроксида натрия (1,4 мл, 1,4 ммоль) и 1,4-диоксан (1,5 мл), с получением требуемого соединения (0,41 г, выход: 100%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,31 (3H, с), 3,79 (3H, с), 5,45 (2H, с), 6,90 (1H, дд, J=2,4, 9,0 Гц), 6,99-7,02 (2H, м), 7,21 (1H, т, J=6,7 Гц), 7,21 (1H, с), 7,35-7,40 (1H, м), 7,45 (1H, т, J=7,8 Гц), 7,55-7,59 (1H, м), 7,63 (1H, д, J=8,6 Гц), 7,63 (1H, дд, J=1,6, 2,4 Гц), 13,03 (1H, ушир.c).
МС (FAB) m/z: 407 (M+H)+.
Аналит. вычислено для C23H19FN2O4+0,20 H2O: C, 67,38; H, 4,77; F, 4,63; N, 6,83. Найдено C, 67,46; H, 4,72; F, 4,75; N, 6,89.
(Пример 49) 3-{[1-Метил-6-(4-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-168)
(49a) трет-Бутил метил[5-(4-метилфенокси)-2-нитрофенил]карбамат
Неочищенный продукт требуемого указанного в заголовке соединения получали в виде желтого порошка в соответствии со способом, описанным в примере (28a), используя 4-метилфенол (4,53 г, 41,9 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (10,0 г, 34,9 ммоль) и гидрид натрия (63%, 1,59 г, 41,9 ммоль). Полученный неочищенный продукт непосредственно использовали для следующей реакции.
(49b) трет-Бутил [2-амино-5-(4-метилфенокси)фенил]метилкарбамат
Неочищенный продукт требуемого указанного в заголовке соединения получали в виде коричневого порошка в соответствии со способом, описанным в примере (28b), используя трет-бутил метил[5-(4-метилфенокси)-2-нитрофенил]карбамат, полученный в примере (49a) (12,5 г, 34,9 ммоль), железный порошок (9,74 г, 174 ммоль) и хлорид аммония (0,933 г, 17,4 ммоль). Полученный неочищенный продукт непосредственно использовали для следующей реакции.
(49c) [1-Метил-6-(4-метилфенокси)-1H-бензимидазол-2-ил]метанол
Требуемое указанное в заголовке соединение (8,31 г, выход: 89%) получали в виде коричневого порошка в соответствии со способом, описанным в примере (28c), используя трет-бутил [2-амино-5-(4-метилфенокси)фенил]метилкарбамат, полученный в примере (49b) (11,5 г, 34,9 ммоль), и гликолевую кислоту (3,98 г, 52,3 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 2,34 (3H, с), 3,74 (3H, с), 4,86 (2H, с), 6,87-6,92 (3H, м), 6,95 (1H, дд, J=2,3, 8,6 Гц), 7,14 (2H, д, J=7,8 Гц), 7,59 (1H, д, J=8,6 Гц).
(49d) Метил 3-{[1-метил-6-(4-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (9,40 г, выход: 83%) получали в виде беловато-коричневого порошка в соответствии со способом, описанным в примере (28d), используя [1-метил-6-(4-метилфенокси)-1H-бензимидазол-2-ил]метанол, полученный в примере (49c) (7,50 г, 28,0 ммоль), метил 3-гидроксибензоат (5,10 г, 33,5 ммоль), три-н-бутилфосфин (8,38 мл, 33,5 ммоль) и 1,1'-(азодикарбонил)дипиперидин (8,46 г, 33,5 ммоль).
1H ЯМР (CDCl3, 500 МГц) δ: 2,34 (3H, с), 3,80 (3H, с), 3,92 (3H, с), 5,39 (2H, с), 6,89-6,97 (3H, м), 7,01 (1H, дд, J=2,4, 8,8 Гц), 7,14 (2H, д, J=8,3 Гц), 7,27-7,31 (1H, м), 7,37 (1H, т, J=8,1 Гц), 7,66-7,74 (3H, м).
(49e) 3-{[1-Метил-6-(4-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (5,91 г, выход: 68%) получали в виде белого порошка в соответствии со способом, описанным в примере (28e), используя метил 3-{[1-метил-6-(4-метилфенокси)-1H-бензимидазол-2-ил]метокси}бензоат (9,00 г, 22,4 ммоль), полученный в примере (49d), и 1 н. водный раствор гидроксида натрия (33,6 мл, 33,6 ммоль).
1H ЯМР (ДМСО-d6, 400 МГц): δ 2,28 (3H, с), 3,80 (3H, с), 5,46 (2H, с), 6,87-6,94 (3H, м), 7,17 (2H, д, J=9,0 Гц), 7,26 (1H, д, J=2,3 Гц), 7,36-7,41 (1H, м), 7,45 (1H, т, J=8,0 Гц), 7,58 (1H, д, J=7,8 Гц), 7,62-7,67 (2H, м), 13,05 (1H, с).
МС (FAB) m/z: 389 (M+H)+.
(Пример 50) 3-{[6-(5-Фтор-2-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-185)
(50a) трет-Бутил [5-(5-фтор-2-метилфенокси)-2-нитрофенил]метилкарбамат
Неочищенный продукт требуемого указанного в заголовке соединения получали в виде коричневого масла в соответствии со способом, описанным в примере (28a), используя 5-фтор-2-метилфенол (5,28 г, 41,9 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (10,0 г, 34,9 ммоль) и гидрид натрия (63%, 1,59 г, 41,9 ммоль). Полученный неочищенный продукт непосредственно использовали для следующей реакции.
(50b) трет-Бутил [2-амино-5-(5-фтор-2-метилфенокси)фенил]метилкарбамат
Неочищенный продукт требуемого указанного в заголовке соединения получали в виде коричневого масла в соответствии со способом, описанным в примере (28b), используя трет-бутил [5-(5-фтор-2-метилфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (50a) (13,1 г, 34,9 ммоль), железный порошок (9,74 г, 174 ммоль) и хлорид аммония (0,933 г, 17,4 ммоль). Полученный неочищенный продукт непосредственно использовали для следующей реакции.
(50c) [6-(5-Фтор-2-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Требуемое указанное в заголовке соединение (8,52 г, выход: 85%) получали в виде коричневого порошка в соответствии со способом, описанным в примере (28c), используя трет-бутил [2-амино-5-(5-фтор-2-метилфенокси)фенил]метилкарбамат, полученный в примере (50b) (12,1 г, 34,9 ммоль), и гликолевую кислоту (3,98 г, 52,3 ммоль).
1H ЯМР (CDCl3, 500 МГц) δ: 2,26 (3H, с), 3,77 (3H, с), 4,88 (2H, с), 6,50 (1H, дд, J=2,4, 10,3 Гц), 6,73 (1H, дт, J=2,4, 8,3 Гц), 6,87 (1H, д, J=2,4 Гц), 6,93 (1H, дд, J=2,4, 8,8 Гц), 7,16-7,20 (1H, м), 7,63 (1H, д, J=8,8 Гц).
(50d) Метил 3-{[6-(5-фтор-2-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (7,15 г, выход: 65%) получали в виде белого порошка в соответствии со способом, описанным в примере (28d), используя [6-(5-фтор-2-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (50c) (7,50 г, 26,2 ммоль), метил 3-гидроксибензоат (4,78 г, 31,4 ммоль), три-н-бутилфосфин (7,85 мл, 31,4 ммоль) и 1,1'-(азодикарбонил)дипиперидин (7,93 г, 31,4 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 2,27 (3H, с), 3,82 (3H, с), 3,92 (3H, с), 5,40 (2H, с), 6,53 (1H, дд, J=2,7, 9,8 Гц), 6,74 (1H, дт, J=2,7, 8,2 Гц), 6,91 (1H, д, J=2,0 Гц), 6,98 (1H, дд, J=2,0, 8,6 Гц), 7,17-7,22 (1H, м), 7,27-7,32 (1H, м), 7,38 (1H, т, J=8,2 Гц), 7,67-7,76 (3H, м).
(50e) 3-{[6-(5-Фтор-2-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (6,29 г, выход: 93%) получали в виде белого порошка в соответствии со способом, описанным в примере (28e), используя метил 3-{[6-(5-фтор-2-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (50d) (7,00 г, 16,7 ммоль), и 1 н. водный раствор гидроксида натрия (25,0 мл, 25,0 ммоль).
1H ЯМР (ДМСО-d6, 400 МГц) δ: 2,24 (3H, с), 3,82 (3H, с), 5,47 (2H, с), 6,57 (1H, дд, J=2,5, 10,4 Гц), 6,85-6,95 (2H, м), 7,29 (1H, д, J=2,3 Гц), 7,31-7,41 (2H, м), 7,46 (1H, т, J=7,8 Гц), 7,58 (1H, д, J=7,8 Гц), 7,63-7,66 (1H, м), 7,67 (1H, д, J=8,6 Гц), 13,04 (1H, с).
МС (FAB) m/z: 407 (M+H)+.
(Пример 51) 3-{[6-(2-Фтор-5-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-191)
(51a) трет-Бутил [5-(2-фтор-5-метоксифенокси)-2-нитрофенил]метилкарбамат
Реакцию и последующую обработку осуществляли в соответствии с примером (27a), используя известный [Can. J. Chem., 1988, Vol. 66, p. 1479-1482] 2-фтор-5-метоксифенол (4,6 г, 32 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (7 г, 36 ммоль), гидрид натрия (>56% в масле, 1,3 г, 32 ммоль) и N,N-диметилформамид (60 мл), с получением требуемого соединения (5,5 г, выход: 57%) в виде желтого масла.
1H-ЯМР (CDCl3, 400 МГц) δ: 1,32 (6H, с), 1,50 (3H, с), 3,26 (3H, с), 3,80 (3H, с), 6,67-6,92 (4H, м), 7,15 (1H, т, J=9,4 Гц), 7,94 (1H, д, J=8,6 Гц).
(51b) трет-Бутил [2-амино-5-(2-фтор-5-метоксифенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(2-фтор-5-метоксифенокси)-2-нитрофенил]метилкарбамат, полученный в примере (51a) (5,5 г, 14 ммоль), железный порошок (6,5 г, 120 ммоль), хлорид аммония (0,65 г, 12 ммоль), этанол (30 мл) и воду (15 мл). Полученное масло непосредственно использовали для следующей реакции.
(51c) [6-(2-Фтор-5-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Реакцию и последующую обработку осуществляли в соответствии с примером (34c), используя трет-бутил [2-амино-5-(2-фтор-5-метоксифенокси)фенил]метилкарбамат, полученный в примере (51b) (5,0 г, 14 ммоль), гликолевую кислоту (1,4 г, 18 ммоль), 5 н. раствор хлористоводородной кислоты (30 мл) и 1,4-диоксан (30 мл), с получением требуемого соединения (2,3 г, выход: 64%) в виде бледно-коричневого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,72 (3H, с), 3,75 (3H, с), 4,90 (2H, д, J=5,5 Гц), 6,54 (1H, дд, J=2,9, 6,8 Гц), 6,57-6,63 (1H, м), 6,95 (1H, д, J=2,4 Гц), 7,00 (1H, дд, J=2,2, 8,8 Гц), 7,10 (1H, дд, J=9,0, 10,6 Гц), 7,66 (1H, д, J=8,6 Гц).
(51d) Метил 3-{[6-(2-фтор-5-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(2-фтор-5-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (51c) (2,7 г, 8,8 ммоль), метил 3-гидроксибензоат (1,3 г, 8,8 ммоль), три-н-бутилфосфин (4,4 мл, 18 ммоль), 1,1'-(азодикарбонил)дипиперидин (4,5 г, 18 ммоль) и дихлорметан (4 мл), с получением требуемого соединения (3,7 г, выход: 95%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,72 (3H, с), 3,82 (3H, с), 3,92 (3H, с), 5,39 (2H, с), 6,55 (1H, дд, J=3,1, 6,7 Гц), 6,61 (1H, дт, J=3,3, 9,0 Гц), 6,97 (1H, д, J=2,4 Гц), 7,03 (1H, дд, J=2,4, 8,6 Гц), 7,10 (1H, дд, J=9,0, 10,2 Гц), 7,29 (1H, дд, J=2,5, 9,2 Гц), 7,37 (1H, т, J=8,0 Гц), 7,67-7,70 (1H, м), 7,70-7,74 (2H, м).
МС (FAB) m/z: 437 (M+H)+.
(51e) 3-{[6-(2-Фтор-5-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(2-фтор-5-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (51d) (3,7 г, 8,4 ммоль), 1 н. водный раствор гидроксида натрия (13 мл, 13 ммоль) и 1,4-диоксан (10 мл), с получением требуемого соединения (2,9 г, выход: 81%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,68 (4H, с), 3,81 (3H, с), 5,43 (2H, с), 6,61 (1H, дд, J=2,9, 6,8 Гц), 6,73 (1H, дт, J=3,3, 9,1 Гц), 6,94 (1H, дд, J=2,5, 8,8 Гц), 7,24-7,40 (4H, м), 7,54 (1H, д, J=7,4 Гц), 7,61 (1H, ушир.с), 7,65 (1H, д, J=9,0 Гц).
МС (FAB) m/z: 423 (M+H)+.
Аналит. вычислено для C23H19FN2O5+0,20H2O: C, 64,85; H, 4,59; F, 4,46; N, 6,58. Найдено C, 64,74; H, 4,38; F, 4,63; N, 6,51.
(Пример 52) 3-({6-[3-(Диметиламино)фенокси]-1-метил-1H-бензимидазол-2-ил}метокси)бензойная кислота (соединение № 1-177)
(52a) Метил 3-({6-[3-(диметиламино)фенокси]-1-метил-1H-бензимидазол-2-ил}метокси)бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя известный [US6432993 B1] {6-[3-(диметиламино)фенокси]-1-метил-1H-бензимидазол-2-ил}метанол (0,30 г, 1,0 ммоль), метил 3-гидроксибензоат (0,15 г, 1,0 ммоль), три-н-бутилфосфин (0,50 мл, 2,0 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,51 г, 2,0 ммоль) и дихлорметан (3,0 мл), с получением требуемого соединения (0,37 г, выход: 84%) в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 МГц) δ: 2,93 (6H, с), 3,81 (3H, с), 3,92 (3H, с), 5,39 (2H, с), 6,27-6,35 (1H, м), 6,43 (1H, т, J=2,4 Гц), 6,4-6,51 (1H, м), 7,00 (1H, д, J=1,6 Гц), 7,04 (1H, дд, J=2,4, 8,6 Гц), 7,17 (1H, т, J=8,2 Гц), 7,29 (1H, дд, J=3,3, 8,8 Гц), 7,37 (1H, т, J=7,8 Гц), 7,66-7,75 (3H, м).
МС (FAB) m/z: 432 (M+H)+.
(52b) 3-({6-[3-(Диметиламино)фенокси]-1-метил-1H-бензимидазол-2-ил}метокси)бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-({6-[3-(диметиламино)фенокси]-1-метил-1H-бензимидазол-2-ил}метокси)бензоат, полученный в примере (52a) (0,44 г, 1,0 ммоль), 1 н. водный раствор гидроксида натрия (1,5 мл, 1,5 ммоль) и 1,4-диоксан (1,0 мл), с получением требуемого соединения (0,33 г, выход: 79%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,87 (6H, с), 3,81 (3H, с), 5,46 (2H, с), 6,18 (1H, дд, J=2,4, 7,4 Гц), 6,36 (1H, т, J=2,4 Гц), 6,46 (1H, дд, J=2,4, 7,8 Гц), 6,92 (1H, дд, J=2,4, 9,0 Гц), 7,12 (1H, т, J=8,2 Гц), 7,27 (1H, д, J=2,0 Гц), 7,39 (1H, дд, J=1,2, 2,7 Гц), 7,45 (1H, т, J=8,0 Гц), 7,56-7,60 (1H, м), 7,62-7,65 (2H, м), 13,03 (1H, ушир.c).
МС (FAB) m/z: 418 (M+H)+.
Аналит. вычислено для C24H23N3O4+0,20H2O: C, 68,46; H, 5,60; N, 9,98. Найдено C, 68,33; H, 5,52; N, 9,98.
(Пример 53) 3-{[6-(3-Метокси-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-206)
(53a) трет-Бутил [5-(3-метокси-5-метилфенокси)-2-нитрофенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя 3-метокси-5-метилфенол (4,9 г, 35 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (8,1 г, 1,7 ммоль), гидрид натрия (>56% в масле, 1,7 г, 42 ммоль) и N,N-диметилформамид (50 мл). Полученное желтое масло непосредственно использовали для следующей реакции.
(53b) трет-Бутил [2-амино-5-(3-метокси-5-метилфенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(3-метокси-5-метилфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (53a) (11 г, 28 ммоль), железный порошок (7,6 г, 140 ммоль), хлорид аммония (0,75 г, 14 ммоль), этанол (40 мл) и воду (10 мл). Полученное масло непосредственно использовали для следующей реакции.
(53c) [6-(3-Метокси-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Синтез осуществляли таким же способом, как в примере (34c), используя трет-бутил [2-амино-5-(3-метокси-5-метилфенокси)фенил]метилкарбамат, полученный в примере (53b) (10 г, 28 ммоль), гликолевую кислоту (2,8 г, 37 ммоль), 5 н. раствор хлористоводородной кислоты (20 мл) и 1,4-диоксан (20 мл). Полученное бледно-коричневое твердое вещество непосредственно использовали для следующей реакции.
(53d) Метил 3-{[6-(3-метокси-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Синтез осуществляли таким же способом, как в примере (28d), используя [6-(3-метокси-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (53c) (5,1 г, 17 ммоль), метил 3-гидроксибензоат (2,6 г, 17 ммоль), три-н-бутилфосфин (8,6 мл, 34 ммоль), 1,1'-(азодикарбонил)дипиперидин (8,6 г, 34 ммоль) и дихлорметан (50 мл). Полученное бледно-коричневое твердое вещество непосредственно использовали для следующей реакции.
(53e) 3-{[6-(3-Метокси-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(3-метокси-5-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (53d) (7,4 г, 17 ммоль), 1 н. водный раствор гидроксида натрия (26 мл, 26 ммоль) и 1,4-диоксан (25 мл), с получением требуемого соединения (5,2 г, выход: 70%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,22 (3H, с), 3,70 (3H, с), 3,82 (3H, с), 5,47 (2H, с), 6,32 (1H, с), 6,36 (1H, т, J=2,4 Гц), 6,50 (1H, с), 6,93 (1H, дд, J=2,4, 8,6 Гц), 7,32 (1H, д, J=2,4 Гц), 7,36-7,42 (1H, м), 7,45 (1H, т, J=7,8 Гц), 7,55-7,61 (1H, м), 7,66 (2H, д, J=9,0 Гц), 13,04 (1H, с).
МС (FAB) m/z: 419 (M+H)+.
Аналит. вычислено для C24H22N2O5: C, 68,89; H, 5,30; N, 6,69. Найдено C, 68,64; H, 5,26; N, 6,59.
(Пример 54) 3-{[6-(3-Метокси-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-204)
(54a) трет-Бутил [5-(3-метокси-4-метилфенокси)-2-нитрофенил]метилкарбамат
Неочищенный продукт требуемого указанного в заголовке соединения получали в виде коричневого масла в соответствии со способом, описанным в примере (28a), используя 5-фтор-2-метилфенол (5,78 г, 41,9 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (10,0 г, 34,9 ммоль) и гидрид натрия (63%, 1,59 г, 41,9 ммоль). Полученный неочищенный продукт непосредственно использовали для следующей реакции.
(54b) трет-Бутил [2-амино-5-(3-метокси-4-метилфенокси)фенил]метилкарбамат
Неочищенный продукт требуемого указанного в заголовке соединения получали в виде коричневого масла в соответствии со способом, описанным в примере (28b), используя трет-бутил [5-(3-метокси-4-метилфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (54a) (13,6 г, 34,9 ммоль), железный порошок (9,74 г, 174 ммоль) и хлорид аммония (0,933 г, 17,4 ммоль). Полученный неочищенный продукт непосредственно использовали для следующей реакции.
(54c) [6-(3-Метокси-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Требуемое указанное в заголовке соединение (8,93 г, выход: 86%) получали в виде коричневого порошка в соответствии со способом, описанным в примере (28c), используя трет-бутил [2-амино-5-(3-метокси-4-метилфенокси)фенил]метилкарбамат, полученный в примере (54b) (12,5 г, 34,9 ммоль), и гликолевую кислоту (3,98 г, 52,3 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 2,19 (3H, с), 3,75 (3H, с), 3,77 (3H, с), 4,87 (2H, с), 5,10 (1H, с), 6,45 (1H, дд, J=2,3, 8,2 Гц), 6,57 (1H, д, J=2,3 Гц), 6,90 (1H, д, J=2,0 Гц), 6,97 (1H, дд, J=2,0, 8,6 Гц), 7,03-7,07 (1H, м), 7,60 (1H, д, J=8,6 Гц).
(54d) Метил 3-{[6-(3-метокси-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (8,26 г, выход: 71%) получали в виде белого порошка в соответствии со способом, описанным в примере (28d), используя [6-(3-метокси-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (54c) (8,00 г, 26,8 ммоль), метил 3-гидроксибензоат (4,90 г, 32,2 ммоль), три-н-бутилфосфин (8,04 мл, 32,2 ммоль) и 1,1'-(азодикарбонил)дипиперидин (8,12 г, 32,2 ммоль).
1H ЯМР (CDCl3, 500 МГц) δ: 2,19 (3H, с), 3,77 (3H, с), 3,81 (3H, с), 3,92 (3H, с), 5,39 (2H, с), 6,47 (1H, дд, J=2,4, 8,3 Гц), 6,58 (1H, д, J=2,4 Гц), 6,96 (1H, д, J=2,4 Гц), 7,02 (1H, дд, J=2,0, 8,8 Гц), 7,05 (1H, д, J=8,3 Гц), 7,27-7,31 (1H, м), 7,37 (1H, т, J=7,8 Гц), 7,67-7,73 (3H, м).
(54e) 3-{[6-(3-Метокси-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (7,44 г, выход: 96%) получали в виде белого порошка в соответствии со способом, описанным в примере (28e), используя метил 3-{[6-(3-метокси-4-метилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (54d) (8,00 г, 18,5 ммоль), и 1 н. водный раствор гидроксида натрия (27,8 мл, 27,8 ммоль).
1H ЯМР (ДМСО-d6, 400 МГц) δ: 2,11 (3H, с), 3,74 (3H, с), 3,81 (3H, с), 5,46 (2H, с), 6,40 (1H, дд, J=2,3, 7,8 Гц), 6,67 (1H, д, J=2,3 Гц), 6,94 (1H, дд, J=2,3, 8,6 Гц), 7,08 (1H, д, J=8,2 Гц), 7,27 (1H, д, J=2,3 Гц), 7,36-7,42 (1H, м), 7,46 (1H, т, J=8,0 Гц), 7,56-7,61 (1H, м), 7,65 (1H, д, J=8,6 Гц), 7,63-7,65 (1H, м).
МС (EI) m/z: 418 M+.
(Пример 55) 3-{[6-(3,4-Диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-198)
(55a) трет-Бутил [5-(3,4-диметилфенокси)-2-нитрофенил]метилкарбамат
Неочищенный продукт требуемого указанного в заголовке соединения получали в виде коричневого порошка в соответствии со способом, описанным в примере (28a), используя 3,4-диметилфенол (5,11 г, 41,9 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (10,0 г, 34,9 ммоль) и гидрид натрия (63%, 1,59 г, 41,9 ммоль). Полученный неочищенный продукт непосредственно использовали для следующей реакции.
(55b) трет-Бутил [2-амино-5-(3,4-диметилфенокси)фенил]метилкарбамат
Неочищенный продукт требуемого указанного в заголовке соединения получали в виде коричневого масла в соответствии со способом, описанным в примере (28b), используя трет-бутил [5-(3,4-диметилфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (55a) (13,0 г, 34,9 ммоль), железный порошок (9,74 г, 174 ммоль) и хлорид аммония (0,933 г, 17,4 ммоль). Полученный неочищенный продукт непосредственно использовали для следующей реакции.
(55c) [6-(3,4-Диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Требуемое указанное в заголовке соединение (7,98 г, выход: 81%) получали в виде коричневого порошка в соответствии со способом, описанным в примере (28c), используя трет-бутил [2-амино-5-(3,4-диметилфенокси)фенил]метилкарбамат, полученный в примере (55b) (11,9 г, 34,9 ммоль), и гликолевую кислоту (3,98 г, 52,3 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 2,23 (3H, с), 2,24 (3H, с), 3,74 (3H, с), 4,86 (2H, с), 4,94 (1H, с), 6,74 (1H, дд, J=8,2, 2,3 Гц), 6,81 (1H, д, J=2,3 Гц), 6,89 (1H, д, J=2,3 Гц), 6,96 (1H, дд, J=8,6, 2,3 Гц), 7,08 (1H, д, J=8,2 Гц), 7,60 (1H, д, J=8,6 Гц).
(55d) Метил 3-{[6-(3,4-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (8,36 г, выход: 81%) получали в виде белого порошка в соответствии со способом, описанным в примере (28d), используя [6-(3,4-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (55c) (7,00 г, 24,8 ммоль), метил 3-гидроксибензоат (4,53 г, 29,8 ммоль), три-н-бутилфосфин (7,43 мл, 29,8 ммоль) и 1,1'-(азодикарбонил)дипиперидин (7,51 г, 29,8 ммоль).
1H ЯМР (CDCl3, 500 МГц) δ: 2,23 (3H, с), 2,24 (3H, с), 3,80 (3H, с), 3,92 (3H, с), 5,38 (2H, с), 6,75 (1H, дд, J=2,4, 8,3 Гц), 6,81 (1H, д, J=2,4 Гц), 6,95 (1H, д, J=2,4 Гц), 7,00 (1H, дд, J=2,4, 8,8 Гц), 7,08 (1H, д, J=8,3 Гц), 7,27-7,31 (1H, м), 7,37 (1H, т, J=8,3 Гц), 7,66-7,73 (3H, м).
(55e) 3-{[6-(3,4-Диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (6,21 г, выход: 80%) получали в виде белого порошка в соответствии со способом, описанным в примере (28e), используя метил 3-{[6-(3,4-диметилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (55d) (8,00 г, 19,2 ммоль), и 1 н. водный раствор гидроксида натрия (28,8 мл, 28,8 ммоль).
1H ЯМР (ДМСО-d6, 400 МГц) δ: 2,18 (3H, с), 2,18 (3H, с), 3,80 (3H, с), 5,46 (2H, с), 6,71 (1H, дд, J=2,7, 7,8 Гц), 6,80 (1H, д, J=2,7 Гц), 6,90 (1H, дд, J=2,2, 8,8 Гц), 7,11 (1H, д, J=8,2 Гц), 7,25 (1H, д, J=2,3 Гц), 7,36-7,41 (1H, м), 7,45 (1H, т, J=7,8 Гц), 7,56-7,60 (1H, м), 7,61-7,65 (2H, м).
МС (FAB) m/z: 402 M+.
(Пример 56) 3-{[6-(4-Этилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-171)
(56a) трет-Бутил [5-(4-этилфенокси)-2-нитрофенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя 4-этилфенол (4,0 г, 33 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (7,5 г, 26 ммоль), гидрид натрия (>56% в масле, 2,0 г, 51 ммоль) и N,N-диметилформамид (50 мл). Полученное желтое масло непосредственно использовали для следующей реакции.
(56b) трет-Бутил [2-амино-5-(4-этилфенокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(4-этилфенокси)-2-нитрофенил]метилкарбамат, полученный в примере (56a) (11 г, 26 ммоль), железный порошок (7,0 г, 130 ммоль), хлорид аммония (0,70 г, 13 ммоль), этанол (30 мл) и воду (15 мл). Полученное красное масло непосредственно использовали для следующей реакции.
(56c) [6-(4-Этилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол
Реакцию и последующую обработку осуществляли в соответствии с примером (34c), используя трет-бутил [2-амино-5-(4-этилфенокси)фенил]метилкарбамат, полученный в примере (56b) (9,0 г, 26 ммоль), гликолевую кислоту (2,6 г, 34 ммоль), 5 н. раствор хлористоводородной кислоты (20 мл) и 1,4-диоксан (20 мл), с получением требуемого соединения (5,8 г, выход: 78%) в виде бледно-коричневого твердого вещества, которое непосредственно использовали для следующей реакции.
(56d) Метил 3-{[6-(4-этилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(4-этилфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (56c) (5,3 г, 19 ммоль), метил 3-гидроксибензоат (2,8 г, 19 ммоль), три-н-бутилфосфин (9,3 мл, 37 ммоль), 1,1'-(азодикарбонил)дипиперидин (9,4 г, 37 ммоль) и дихлорметан (50 мл), с получением требуемого соединения (5,6 г, выход: 72%) в виде бледно-красного твердого вещества.
MС (FAB) m/z: 417 (М+Н)+.
(56e) 3-{[6-(4-Этилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(4-этилфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (56d) (5,6 г, 14 ммоль), 1 н. водный раствор гидроксида натрия (20 мл, 20 ммоль) и 1,4-диоксан (25 мл), с получением требуемого соединения (5,1 г, выход: 94%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 1,17 (3H, т, J=7,6 Гц), 2,58 (2H, кв., J=7,3 Гц), 3,80 (3H, с), 5,46 (2H, с), 6,87-6,94 (3H, м), 7,19 (2H, д, J=8,3 Гц), 7,28 (1H, д, J=2,4 Гц), 7,38 (1H, дд, J=2,7, 8,1 Гц), 7,45 (1H, т, J=7,8 Гц), 7,58 (1H, д, J=7,8 Гц), 7,62-7,67 (2H, м), 13,03 (1H, ушир.c).
МС (FAB) m/z: 403 (M+H)+.
Аналит. вычислено для C24H22N2O4+0,20H2O: C, 70,99; H, 5,56; N, 6,90. Найдено C, 70,82; H, 5,32; N, 6,88.
(Пример 57) 3-{[6-(2,3-Дигидро-1-бензофуран-6-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-210)
(57a) трет-Бутил [5-(2,3-дигидро-1-бензофуран-6-илокси)-2-нитрофенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя известный [J. Am. Chem. Soc., 1948, Vol. 70, p. 3619] 2,3-дигидро-1-бензофуран-6-ол (2,2 г, 16 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (4,0 г, 14 ммоль), гидрид натрия (>56% в масле, 0,66 г, 16 ммоль) и N-метилпирролидинон (30 мл). Полученное желтое масло непосредственно использовали для следующей реакции.
(57b) трет-Бутил [2-амино-5-(2,3-дигидро-1-бензофуран-6-илокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(2,3-дигидро-1-бензофуран-6-илокси)-2-нитрофенил]метилкарбамат, полученный в примере (57a) (5,4 г, 14 ммоль), железный порошок (3,7 г, 70 ммоль), хлорид аммония (0,37 г, 7,0 ммоль), этанол (40 мл) и воду (20 мл). Полученное масло непосредственно использовали для следующей реакции.
(57c) Метил 3-[2-({2-[(трет-бутоксикарбонил)(метил)амино]-4-(2,3-дигидро-1-бензофуран-6-илокси)фенил}амино)-2-оксоэтокси]бензоат
трет-Бутил [2-амино-5-(2,3-дигидро-1-бензофуран-6-илокси)фенил]метилкарбамат, полученный в примере (57b) (5,0 г, 14 ммоль), и [3-(метоксикарбонил)фенокси]уксусную кислоту (2,9 г, 14 ммоль) растворяли в дихлорметане (100 мл). Добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (3,2 г, 17 ммоль) и смесь перемешивали при комнатной температуре в течение 2,2 часа. Добавляли водный раствор бикарбоната натрия с последующим экстрагированием дихлорметаном два раза. Затем органические слои промывали насыщенным раствором соли и сушили над безводным сульфатом магния. Выпаривали при пониженном давлении растворитель и полученное твердое вещество непосредственно использовали для следующей реакции.
(57d) Моногидрохлорид метил 3-{[6-(2,3-дигидро-1-бензофуран-6-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата
Метил 3-[2-({2-[(трет-бутоксикарбонил)(метил)амино]-4-(2,3-дигидро-1-бензофуран-6-илокси)фенил}амино)-2-оксоэтокси]бензоат, полученный в примере (57c) (7,7 г, 14 ммоль), растворяли в 5 н. растворе хлористоводородной кислоты в этилацетате (50 мл) и смесь нагревали с обратным холодильником в течение двух часов. После охлаждения до комнатной температуры выпавшее в осадок бледно-красное твердое вещество собирали фильтрованием с получением требуемого соединения (7,9 г, выход: 100%).
1H-ЯМР (ДМСО-d6, 500 МГц) δ: 3,15 (2H, т, J=8,8 Гц), 3,88 (3H, с), 3,93 (3H, с), 4,57 (2H, т, J=8,8 Гц), 5,69 (2H, с), 6,47 (2H, с), 7,16 (1H, д, J=8,8 Гц), 7,21 (1H, д, J=7,8 Гц), 7,47-7,56 (3H, м), 7,66 (1H, д, J=8,3 Гц), 7,72 (1H, с), 7,78 (1H, д, J=9,3 Гц).
МС (FAB) m/z: 431 (M+H)+.
(57e) 3-{[6-(2,3-Дигидро-1-бензофуран-6-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя моногидрохлорид метил 3-{[6-(2,3-дигидро-1-бензофуран-6-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата, полученный в примере (57d) (6,5 г, 14 ммоль), 1 н. водный раствор гидроксида натрия (56 мл, 56 ммоль) и 1,4-диоксан (60 мл), с получением требуемого соединения (4,3 г, выход: 74%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,13 (2H, т, J=8,4 Гц), 3,81 (3H, с), 4,55 (2H, т, J=8,6 Гц), 5,46 (2H, с), 6,39-6,44 (2H, м), 6,91 (1H, дд, J=2,4, 8,6 Гц), 7,16 (1H, д, J=7,8 Гц), 7,28 (1H, д, J=2,4 Гц), 7,36-7,40 (1H, м), 7,45 (1H, т, J=7,8 Гц), 7,58 (1H, дт, J=1,2, 1,4, 7,6 Гц), 7,62-7,66 (2H, м), 13,04 (1H, ушир.c).
МС (FAB) m/z: 417 (M+H)+.
Аналит. вычислено для C24H20N2O5+0,33H2O: C, 68,24; H, 4,93; N, 6,63. Найдено C, 68,34; H, 4,84; N, 6,79.
(Пример 58) 3-{[6-(1,3-Бензодиоксол-5-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-211)
(58a) трет-Бутил [5-(1,3-бензодиоксол-5-илокси)-2-нитрофенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя сезамол (2,9 г, 21 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (5,0 г, 17 ммоль), гидрид натрия (>56% в масле, 0,82 г, 21 ммоль) и N-метилпирролидинон (50 мл). Полученное коричневое масло непосредственно использовали для следующей реакции.
(58b) трет-Бутил [2-амино-5-(1,3-бензодиоксол-5-илокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(1,3-бензодиоксол-5-илокси)-2-нитрофенил]метилкарбамат, полученный в примере (58a) (6,8 г, 17 ммоль), железный порошок (4,7 г, 87 ммоль), хлорид аммония (0,47 г, 8,7 ммоль), этанол (40 мл) и воду (20 мл). Полученное коричневое масло непосредственно использовали для следующей реакции.
(58c) Метил 3-[2-({4-(1,3-бензодиоксол-5-илокси)-2-[(трет-бутоксикарбонил)(метил)амино]фенил}амино)-2-оксоэтокси]бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (57c), используя трет-бутил [2-амино-5-(1,3-бензодиоксол-5-илокси)фенил]метилкарбамат, полученный в примере (58b) (6,7 г, 17 ммоль), [3-(метоксикарбонил)фенокси]уксусную кислоту (3,7 г, 17 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (4,0 г, 21 ммоль) и дихлорметан (70 мл), с получением твердого вещества, которое непосредственно использовали для следующей реакции.
(58d) Моногидрохлорид метил 3-{[6-(1,3-бензодиоксол-5-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата
Реакцию и последующую обработку осуществляли в соответствии с примером (57d), используя метил 3-[2-({4-(1,3-бензодиоксол-5-илокси)-2-[(трет-бутоксикарбонил)(метил)амино]фенил}амино)-2-оксоэтокси]бензоат, полученный в примере (58c) (9,6 г, 17 ммоль), и 5 н. раствор хлористоводородной кислоты в этилацетате (50 мл), с получением требуемого соединения (7,3 г, выход: 89%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,11 (3H, ушир.с), 3,93 (3H, с), 4,68 (2H, с), 5,99 (2H, с), 6,49 (1H, дд, J=2,4, 8,2 Гц), 6,58 (1H, д, J=2,4 Гц), 6,76 (1H, д, J=8,2 Гц), 6,82 (1H, ушир.c), 6,86-6,93 (1H, м), 7,20 (1H, дд, J=2,2, 8,0 Гц), 7,42 (1H, т, J=8,0 Гц), 7,63 (1H, ушир.с), 7,74 (1H, д, J=7,8 Гц).
(58e) 3-{[6-(1,3-Бензодиоксол-5-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя моногидрохлорид метил 3-{[6-(1,3-бензодиоксол-5-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоата, полученный в примере (58d) (7,3 г, 15 ммоль), 2 н. водный раствор гидроксида натрия (31 мл, 62 ммоль) и 1,4-диоксан (60 мл), с получением требуемого соединения (6,3 г, выход: 98%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 3,80 (3H, с), 5,46 (2H, с), 6,03 (2H, с), 6,45 (1H, дд, J=2,5, 8,4 Гц), 6,71 (1H, д, J=2,4 Гц), 6,86-6,93 (2H, м), 7,23 (1H, д, J=2,0 Гц), 7,36-7,41 (1H, м), 7,45 (1H, т, J=7,8 Гц), 7,56-7,60 (1H, м), 7,61-7,66 (2H, м), 13,07 (1H, ушир.c).
МС (FAB) m/z: 419 (M+H)+.
Аналит. вычислено для C23H18N2O6+0,25H2O: C, 65,32; H, 4,41; N, 6,62. Найдено C, 65,54; H, 4,71; N, 6,65.
(Пример 59) 3-{[6-(4-Хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}-5-фторбензойная кислота (соединение № 1-220)
(59a) Метил 3-{[6-(4-хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}-5-фторбензоат
Требуемое указанное в заголовке соединение (362 мг, выход: 81%) получали в виде белого порошка в соответствии со способом, описанным в примере (28d), используя [6-(4-хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (9b) (300 мг, 0,978 ммоль), метил 5-фтор-3-гидроксибензоат (200 мг, 1,17 ммоль), три-н-бутилфосфин (0,366 мл, 1,47 ммоль) и 1,1'-(азодикарбонил)дипиперидин (370 мг, 1,47 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 3,84 (3H, с), 3,93 (3H, с), 5,40 (2H, с), 6,71-6,76 (1H, м), 6,78 (1H, дд, J=2,7, 10,2 Гц), 7,00-7,06 (3H, м), 7,31 (1H, дд, J=8,6, 8,6 Гц), 7,36-7,41 (1H, м), 7,53-7,56 (1H, м), 7,77 (1H, дд, J=0,6, 8,6 Гц).
(59b) 3-{[6-(4-Хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}-5-фторбензойная кислота
Требуемое указанное в заголовке соединение (292 мг, выход: 85%) получали в виде белого порошка в соответствии со способом, описанным в примере (28e), используя метил 3-{[6-(4-хлор-3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}-5-фторбензоат, полученный в примере в примере (59a) (354 мг, 0,772 ммоль), и 1 н. водный раствор гидроксида натрия (1,16 мл, 1,16 ммоль).
1H ЯМР (ДМСО-d6, 400 МГц) δ: 3,83 (3H, с), 5,52 (2H, с), 6,83 (1H, ддд, J=1,2, 2,7, 9,0 Гц), 7,01 (1H, дд, J=2,3, 8,6 Гц), 7,09 (1H, дд, J=2,7, 10,6 Гц), 7,28-7,33 (1H, м), 7,35 (1H, ддд, J=2,3, 2,3, 10,6 Гц), 7,45 (1H, д, J=2,0 Гц), 7,47-7,51 (1H, м), 7,54 (1H, дд, J=8,6, 8,6 Гц), 7,71 (1H, д, J=8,6 Гц).
МС (FAB) m/z: 445 (M+H)+.
(Пример 60) 3-Фтор-5-{[6-(3-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-218)
(60a) Метил 3-фтор-5-{[6-(3-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (387 мг, выход: 84%) получали в виде белого порошка в соответствии со способом, описанным в примере (28d), используя [6-(3-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (29c) (300 мг, 1,06 ммоль), метил 5-фтор-3-гидроксибензоат (197 мг, 1,16 ммоль), три-н-бутилфосфин (0,395 мл, 1,58 ммоль) и 1,1'-(азодикарбонил)дипиперидин (399 мг, 1,58 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 3,78 (3H, с), 3,81 (3H, с), 3,93 (3H, с), 5,39 (2H, с), 6,56-6,60 (2H, м), 6,63-6,67 (1H, м), 7,00-7,07 (3H, м), 7,19-7,26 (1H, м), 7,36-7,40 (1H, м), 7,53-7,56 (1H, м), 7,74 (1H, д, J=9,0 Гц).
(60b) 3-Фтор-5-{[6-(3-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (303 мг, выход: 83%) получали в виде белого порошка в соответствии со способом, описанным в примере (28e), используя метил 3-фтор-5-{[6-(3-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере в примере (60a) (376 мг, 0,862 ммоль), и 1 н. водный раствор гидроксида натрия (1,29 мл, 1,29 ммоль).
1H ЯМР (ДМСО-d6, 500 МГц) δ: 3,72 (3H, с), 3,82 (3H, с), 5,50 (2H, с), 6,51 (1H, дд, J=2,2, 8,1 Гц), 6,56 (1H, т, J=2,2 Гц), 6,68 (1H, дд, J=2,4, 8,3 Гц), 6,95 (1H, дд, J=2,4, 8,8 Гц), 7,25 (1H, т, J=8,3 Гц), 7,28-7,33 (1H, м), 7,33-7,38 (2H, м), 7,48-7,51 (1H, м), 7,67 (1H, д, J=8,8 Гц).
МС (FAB) m/z: 423 (M+H)+.
(Пример 61) 3-Фтор-5-{[6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-212)
(61a) Метил 3-фтор-5-{[6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (426 мг, выход: 91%) получали в виде розового порошка в соответствии со способом, описанным в примере (28d), используя [6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (7c) (300 мг, 1,10 ммоль), метил 5-фтор-3-гидроксибензоат (206 мг, 1,21 ммоль), три-н-бутилфосфин (0,413 мл, 1,65 ммоль) и 1,1'-(азодикарбонил)дипиперидин (417 мг, 1,65 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 3,84 (3H, с), 3,93 (3H, с), 5,40 (2H, с), 6,66-6,72 (1H, м), 6,75-6,81 (2H, м), 7,01-7,06 (3H, м), 7,23-7,30 (1H, м), 7,36-7,40 (1H, м), 7,54-7,56 (1H, м), 7,75-7,78 (1H, м).
(61b) 3-Фтор-5-{[6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (304 мг, выход: 80%) получали в виде белого порошка в соответствии со способом, описанным в примере (28e), используя метил 3-фтор-5-{[6-(3-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере в примере (61a) (395 мг, 0,931 ммоль), и 1 н. водный раствор гидроксида натрия (1,40 мл, 1,40 ммоль).
1H ЯМР (ДМСО-d6, 500 МГц) δ: 3,83 (3H, с), 5,52 (2H, с), 6,77-6,85 (2H, м), 6,89-6,95 (1H, м), 6,99 (1H, дд, J=2,4, 8,8 Гц), 7,28-7,44 (4H, м), 7,49 (1H, с), 7,70 (1H, д, J=8,3 Гц), 13,37 (1H, с).
МС (FAB) m/z: 411 (M+H)+.
(Пример 62) 3-Фтор-5-{[6-(4-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-219)
(62a) Метил 3-фтор-5-{[6-(4-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (432 мг, выход: 94%) получали в виде желтого масла в соответствии со способом, описанным в примере (28d), используя [6-(4-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (30c) (300 мг, 1,06 ммоль), метил 5-фтор-3-гидроксибензоат (197 мг, 1,16 ммоль), три-н-бутилфосфин (0,395 мл, 1,58 ммоль) и 1,1'-(азодикарбонил)дипиперидин (399 мг, 1,58 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 3,79 (3H, с), 3,82 (3H, с), 3,93 (3H, с), 5,37 (2H, с), 6,87-6,93 (3H, м), 6,97-7,05 (4H, м), 7,35-7,40 (1H, м), 7,52-7,55 (1H, м), 7,70 (1H, д, J=8,6 Гц).
(62b) 3-Фтор-5-{[6-(4-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (332 мг, выход: 82%) получали в виде белого порошка в соответствии со способом, описанным в примере (28e), используя метил 3-фтор-5-{[6-(4-метоксифенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (62a) (420 мг, 0,962 ммоль), и 1 н. водный раствор гидроксида натрия (1,44 мл, 1,44 ммоль).
1H ЯМР (ДМСО-d6, 400 МГц) δ: 3,74 (3H, с), 3,79 (3H, с), 5,49 (2H, с), 6,89 (1H, дд, J=2,3, 8,6 Гц), 6,92-7,01 (4H, м), 7,20 (1H, д, J=2,3 Гц), 7,27-7,37 (2H, м), 7,47-7,50 (1H, м), 7,63 (1H, д, J=8,6 Гц), 13,37 (1H, с).
МС (FAB) m/z: 423 (M+H)+.
(Пример 63) 3-Фтор-5-{[6-(4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-213)
(63a) Метил 3-фтор-5-{[6-(4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (263 мг, выход: 56%) получали в виде желтого порошка в соответствии со способом, описанным в примере (28d), используя [6-(4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (27c) (300 мг, 1,10 ммоль), метил 5-фтор-3-гидроксибензоат (206 мг, 1,21 ммоль), три-н-бутилфосфин (0,413 мл, 1,65 ммоль) и 1,1'-(азодикарбонил)дипиперидин (417 мг, 1,65 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 3,81 (3H, с), 3,93 (3H, с), 5,38 (2H, с), 6,92-7,09 (7H, м), 7,35-7,41 (1H, м), 7,52-7,56 (1H, м), 7,73 (1H, д, J=9,0 Гц).
(63b) 3-Фтор-5-{[6-(4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (197 мг, выход: 80%) получали в виде белого порошка в соответствии со способом, описанным в примере (28e), используя метил 3-фтор-5-{[6-(4-фторфенокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере в примере (63a) (255 мг, 0,601 ммоль), и 1 н. водный раствор гидроксида натрия (0,900 мл, 0,900 ммоль).
1H ЯМР (ДМСО-d6, 400 МГц) δ: 3,81 (3H, с), 5,50 (2H, с), 6,94 (1H, дд, J=2,3, 8,6 Гц), 7,00-7,06 (2H, м), 7,16-7,24 (2H, м), 7,28-7,32 (2H, м), 7,35 (1H, дд, J=2,3, 10,6 Гц), 7,47-7,50 (1H, м), 7,67 (1H, д, J=9,0 Гц), 13,37 (1H, с).
МС (FAB) m/z: 411 (M+H)+.
(Пример 64) 3-{[1-Метил-(6-тетрагидро-2H-пиран-4-илокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-208)
(64a) трет-Бутил [5-(тетрагидро-2H-пиран-4-илокси)-2-нитрофенил]метилкарбамат
Указанное в заголовке вещество (1,59 г, выход: 60%) получали в виде желтого масла синтезом таким же способом, как в примере (28a), используя тетрагидро-4-пиранол (780 мг, 7,5 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (2,15 г, 7,5 ммоль), гидрид натрия (>56% в масле, 290 мг, 7,5 ммоль) и N,N-диметилформамид (30 мл), и очисткой с использованием автоматической системы очистки (Isco, 15% этилацетат-гексан).
1H-ЯМР (CDCl3, 400 МГц) δ: 1,33 (6H, с), 1,50 (3H, с), 3,26 (3H, с), 6,81 (1H, дд, J=2,7, 9,0 Гц), 6,85 (1H, ушир.c), 7,07-7,17 (4H, м), 7,93-7,97 (1H, м).
(64b) трет-Бутил [2-амино-5-(6-тетрагидро-2H-пиран-4-илокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(6-тетрагидро-2H-пиран-4-илокси)-2-нитрофенил]метилкарбамат, полученный в примере (64a) (3,2 г, 8,8 ммоль), железный порошок (2,4 г, 12 ммоль), хлорид аммония (0,24 г, 1,2 ммоль), этанол (40 мл) и воду (20 мл). Полученное масло непосредственно использовали для следующей реакции.
(64c) [6-(6-Тетрагидро-2H-пиран-4-илокси)-1-метил-1H-бензимидазол-2-ил]метанол
Синтез осуществляли таким же способом, как в примере (28c), используя трет-бутил [2-амино-5-(6-тетрагидро-2H-пиран-4-илокси)фенил]метилкарбамат, полученный в примере (64b) (2,9 г, 8,8 ммоль), гликолевую кислоту (1,0 г, 13 ммоль) и 4 н. раствор хлористоводородной кислоты в 1,4-диоксане (40 мл). Полученное темно-коричневое масло непосредственно использовали для следующей реакции.
(64d) Метил 3-{[1-метил-(6-тетрагидро-2H-пиран-4-илокси)-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(6-тетрагидро-2H-пиран-4-илокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (64c) (0,30 г, 1,1 ммоль), метил 3-гидроксибензоат (0,25 г, 1,7 ммоль), три-н-бутилфосфин (0,55 мл, 2,2 ммоль), 1,1'-(азодикарбонил)дипиперидин (0,56 г, 2,2 ммоль) и дихлорметан (6,0 мл), с получением требуемого соединения (0,36 г, выход: 81%).
1H-ЯМР (CDCl3, 500 МГц) δ: 3,82 (3H, с), 3,92 (3H, с), 5,39 (2H, с), 6,94-7,05 (5H, м), 7,29 (1H, ушир.c), 7,38 (1H, т, J=7,82 Гц), 7,69 (1H, д, J=7,82 Гц), 7,71-7,74 (2H, м).
МС (FAB) m/z: 407 (M+H)+.
(64e) 3-{[1-Метил-(6-тетрагидро-2H-пиран-4-илокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[1-метил-(6-тетрагидро-2H-пиран-4-илокси)-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (64d) (0,34 г, 0,84 ммоль), 1 н. водный раствор гидроксида натрия (1,3 мл, 1,3 ммоль) и 1,4-диоксан, с получением требуемого соединения (0,10 г, выход: 37%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 500 МГц) δ: 3,81 (3H, с), 5,46 (2H, с), 6,93 (1H, дд, J=2,44, 8,79 Гц), 7,01-7,04 (2H, м), 7,19 (2H, т, J=8,79 Гц), 7,30 (1H, д, J=2,44 Гц), 7,37-7,39 (1H, м), 7,45 (1H, т, J=7,81 Гц), 7,57 (2H, д, J=7,81 Гц), 7,66 (1H, д, J=8,79 Гц), 7,63 (1H, с), 13,03 (1H, ушир.c).
МС (FAB) m/z: 393 (M+H)+.
Аналит. вычислено для C24H22N2O5+0,14H2O: C, 66,91; H, 4,41; N, 7,09; F, 4,81. Найдено C, 66,85; H, 4,46; N, 7,21; F, 4,81.
(Пример 65) 3-[(6-Циклопентилокси-1-метил-1H-бензимидазол-2-ил)метокси]бензойная кислота (соединение № 1-162)
(65a) трет-Бутил (5-циклопентилокси-2-нитрофенил)метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя циклопентанол (861 мг, 10 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (2,87 г, 10 ммоль), гидрид натрия (>56% в масле, 380 мг, 10 ммоль) и N,N-диметилформамид (40 мл). Полученное масло (3,28 г) непосредственно использовали для следующей реакции.
(65b) трет-Бутил [2-амино-5-(циклопентилокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил (5-циклопентилокси-2-нитрофенил)метилкарбамат, полученный в примере (65a) (3,27 г, 9,7 ммоль), железный порошок (2,6 г, 49 ммоль), хлорид аммония (0,26 г, 4,9 ммоль), этанол (50 мл) и воду (25 мл). Полученное масло (2,98 г) непосредственно использовали для следующей реакции.
(65c) [6-(Циклопентилокси)-1-метил-1H-бензимидазол-2-ил]метанол
трет-Бутил [2-амино-5-(циклопентилокси)фенил]метилкарбамат, полученный в примере (65b) (2,98 г, 9,7 ммоль), гликолевую кислоту (1,1 г, 14,6 ммоль), 5 н. раствор хлористоводородной кислоты (25 мл) и диоксан (25 мл) нагревали с обратным холодильником в течение 19 часов. Реакционный раствор охлаждали до комнатной температуры и затем добавляли насыщенный водный раствор бикарбоната натрия с последующим экстрагированием этилацетатом. Органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом натрия и фильтровали. Далее фильтрат упаривали при пониженном давлении. Полученный неочищенный продукт промывали диизопропиловым эфиром с получением требуемого соединения (0,75 г, выход за три стадии: 31%).
1H-ЯМР (CDCl3, 400 МГц) δ: 1,76-1,92 (8H, м), 3,73 (3H, с), 4,76-4,81 (1H, м), 4,83 (2H, с), 6,69-6,72 (1H, м), 6,81-6,85 (1H, м), 7,51-7,54 (1H, м).
(65d) Метил 3-[(6-циклопентилокси-1-метил-1H-бензимидазол-2-ил)метокси]бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(циклопентилокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (65c) (0,75 г, 3,1 ммоль), метил 3-гидроксибензоат (0,70 г, 6,1 ммоль), три-н-бутилфосфин (1,5 мл, 6,1 ммоль), 1,1'-(азодикарбонил)дипиперидин (1,54 г, 2,2 ммоль) и дихлорметан (30 мл), с получением требуемого соединения (0,70 г, выход: 60%) в виде желтого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 1,63-1,71 (2H, м), 1,81-2,00 (6H, м), 3,85 (3H, с), 3,95 (3H, с), 4,84-4,87 (1H, м), 5,40 (2H, с), 6,80-6,83 (1H, м), 6,90-6,94 (1H, м), 7,30-7,34 (1H, м), 7,37-7,41 (1H, м), 7,65-7,68 (1H, м), 7,69-7,72 (1H, м), 7,73-7,75 (1H, м).
МС (ESI) m/z: 381 (M+H)+.
(65e) 3-[(6-Циклопентилокси-1-метил-1H-бензимидазол-2-ил)метокси]бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-[(6-циклопентилокси-1-метил-1H-бензимидазол-2-ил)метокси]бензоат, полученный в примере (65d) (0,69 г, 1,83 ммоль), 1 н. водный раствор гидроксида натрия (2,75 мл, 2,75 ммоль) и 1,4-диоксан (2,75 мл), с получением требуемого соединения (0,21 г, выход: 31%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-D6, 400 МГц) δ: 1,50-1,61 (2H, м), 1,62-1,75 (4H, м), 1,84-1,95 (2H, м), 3,77 (3H, с), 4,82-4,88 (1H, м), 5,38 (2H, с), 6,73-6,77 (1H, м), 7,03-7,05 (1H, м), 7,31-7,35 (1H, м), 7,38-7,43 (1H, м), 7,44-7,47 (1H, м), 7,51-7,54 (1H, м), 7,57-7,59 (1H, м), 13,00 (1H, ушир.c).
МС (FAB) m/z: 389 (M+Na)+.
Аналит. вычислено для C21H22N2O4+0,2H2O: C, 68,17; H, 6,10; N, 7,57. Найдено C, 68,34; H, 6,10; N, 7,54.
(Пример 66) 3-{[1-Метил-(6-тетрагидрофуран-3-илокси)-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-209)
(66a) трет-Бутил [5-(тетрагидрофуран-3-илокси)-2-нитрофенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя 3-гидрокситетрагидрофуран (881 мг, 10 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (2,87 г, 10 ммоль), гидрид натрия (>56% в масле, 380 мг, 10 ммоль) и N,N-диметилформамид (40 мл). Полученное масло (2,93 г) непосредственно использовали для следующей реакции.
(66b) трет-Бутил [2-амино-5-(тетрагидрофуран-3-илокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(тетрагидрофуран-3-илокси)-2-нитрофенил]метилкарбамат, полученный в примере (66a) (2,93 г, 8,7 ммоль), железный порошок (2,3 г, 43 ммоль), хлорид аммония (0,23 г, 4,3 ммоль), этанол (40 мл) и воду (20 мл). Полученное масло (2,67 г) непосредственно использовали для следующей реакции.
(66c) [6-(Тетрагидрофуран-3-илокси)-1-метил-1H-бензимидазол-2-ил]метанол
Синтез осуществляли таким же способом, как в примере (28c), используя трет-бутил [2-амино-5-(тетрагидрофуран-3-илокси)фенил]метилкарбамат, полученный в примере (66b) (2,67 г, 8,7 ммоль), гликолевую кислоту (1,0 г, 13,0 ммоль), 5 н. раствор хлористоводородной кислоты (25 мл) и диоксан (25 мл). Полученное масло (1,39 г, выход: 65%) непосредственно использовали для следующей реакции.
(66d) Метил 3-{[6-(тетрагидрофуран-3-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (28d), используя [6-(тетрагидрофуран-3-илокси)-1-метил-1H-бензимидазол-2-ил]метанол, полученный в примере (66c) (1,39 г, 5,6 ммоль), метил 3-гидроксибензоат (2,83 г, 11,2 ммоль), три-н-бутилфосфин (2,8 мл, 11,2 ммоль), 1,1'-(азодикарбонил)дипиперидин (2,83 г, 11,2 ммоль) и дихлорметан (56 мл), с получением требуемого соединения (1,28 г, выход: 60%) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 2,23-2,27 (2H, м), 3,86 (3H, с), 3,94-3,98 (1H, м), 3,95 (3H, с), 4,03-4,08 (3H, м), 5,01-5,05 (1H, м), 5,41 (2H, с), 6,80-6,82 (1H, м), 6,91-6,94 (1H, м), 7,30-7,34 (3H, м), 7,38-7,42 (1H, м), 7,68-7,72 (2H, м), 7,73-7,75 (1H, м).
МС (EI) m/z: 383 (M+H)+.
(66e) 3-{[6-(Тетрагидрофуран-3-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(тетрагидрофуран-3-илокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (66d) (1,28 г, 3,35 ммоль), 1 н. водный раствор гидроксида натрия (5,0 мл, 5,0 ммоль) и 1,4-диоксан (5,0 мл), с получением требуемого соединения (0,55 г, выход: 45%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-D6, 400 МГц) δ: 1,92-2,01 (1H, м), 2,16-2,25 (1H, м), 3,71-3,91 (4H, м), 3,78 (3H, с), 5,03-5,08 (1H, м), 5,38 (2H, с), 6,76-6,81 (1H, м), 7,07-7,10 (1H, м), 7,31-7,36 (1H, м), 7,38-7,43 (1H, м), 7,47-7,53 (2H, м), 7,57-7,60 (1H, м), 13,00 (1H, ушир.c).
МС (FAB) m/z: 391 (M+Na)+.
Аналит. вычислено для C20H20N2O5+0,2H2O: C, 64,58; H, 5,53; N, 7,53. Найдено C, 64,55; H, 5,43; N, 7,43.
(Пример 67) 3-{[6-(1-Этилпропокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота (соединение № 1-161)
(67a) трет-Бутил [5-(1-этилпропокси)-2-нитрофенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28a), используя 3-пентанол (4,23 г, 48 ммоль), трет-бутил (5-хлор-2-нитрофенил)метилкарбамат (11,47 г, 40 ммоль), гидрид натрия (>56% в масле, 1,83 г, 48 ммоль) и N,N-диметилформамид (200 мл). Полученное масло непосредственно использовали для следующей реакции.
(67b) трет-Бутил [2-амино-5-(1-этилпропокси)фенил]метилкарбамат
Синтез осуществляли таким же способом, как в примере (28b), используя трет-бутил [5-(1-этилпропокси)-2-нитрофенил]метилкарбамат, полученный в примере (67a) (13,54 г, 40 ммоль), железный порошок (10,71 г, 200 ммоль), хлорид аммония (1,07 г, 20 ммоль), этанол (100 мл) и воду (100 мл). Полученное масло непосредственно использовали для следующей реакции.
(67c) Метил 3-[2-({1-этилпропокси)-2-[(трет-бутоксикарбонил)(метил)амино]фенил}амино)-2-оксоэтокси]бензоат
Реакцию и последующую обработку осуществляли в соответствии с примером (68d), используя трет-бутил [2-амино-5-(1-этоксипропокси)фенил]метилкарбамат, полученный в примере (67b) (12,34 г, 40 ммоль), [3-(метоксикарбонил)фенокси]уксусную кислоту (8,41 г, 40 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (8,43 г, 44 ммоль), 1-гидроксибензотриазол (5,95 г, 44 ммоль) и дихлорметан (100 мл), с получением твердого вещества, которое непосредственно использовали для следующей реакции.
(67d) Метил 3-{[6-(1-этилпропокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат
Метил 3-[2-({1-этилпропокси)-2-[(трет-бутоксикарбонил)(метил)амино]фенил}амино)-2-оксоэтокси]бензоат, полученный в примере (67c), растворяли в 4 н. растворе хлористоводородной кислоты в диоксане и смесь нагревали с обратным холодильником в течение 10 минут. После охлаждения до комнатной температуры реакционный раствор упаривали при пониженном давлении и к полученному остатку добавляли дихлорметан. Смесь промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом натрия и фильтровали. Затем фильтрат упаривали при пониженном давлении. Полученный остаток очищали автоматической системой очистки производства Isco (30% этилацетат-гексан) и промывали смесью диизопропиловый эфир-гексан с получением указанного в заголовке соединения (7,7 г, выход в течение четырех стадий: 61%) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 0,95 (5H, т, J=7,4 Гц), 1,63-1,72 (4H, м), 3,79 (3H, с), 3,88 (3H, с), 4,08-4,16 (1H, м), 5,33 (2H, с), 6,77-6,80 (1H, м), 6,86-6,91 (1H, м), 7,22-7,26 (2H, м), 7,31-7,35 (1H, м), 7,57-7,70 (3H, м).
МС (EI) m/z: 369 (M+H)+.
(67e) 3-{[6-(1-Этилпропокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[6-(1-этилпропокси)-1-метил-1H-бензимидазол-2-ил]метокси}бензоат, полученный в примере (67d) (7,69 г, 20,11 ммоль), 1 н. водный раствор гидроксида натрия (30,16 мл, 30,16 ммоль) и тетрагидрофуран (100 мл), с получением требуемого соединения (6,8 г, выход: 92%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-D6, 400 МГц) δ: 0,89 (6H, т, J=7,4 Гц), 1,53-1,65 (4H, м), 3,77 (3H, с), 4,26 (1H, с), 5,38 (2H, с), 6,77-6,81 (1H, м), 7,07-7,10 (1H, м), 7,31-7,36 (1H, м), 7,38-7,44 (1H, м), 7,44-7,48 (1H, м), 7,51-7,55 (1H, м), 7,57-7,61 (1H, м), 12,99 (1H, с).
МС (FAB) m/z: 391 (M+Na)+.
Аналит. вычислено для C21H24N2O4: C, 68,46; H, 6,57; N, 7,60. Найдено C, 68,20; H, 6,52; N, 7,58.
(Пример 68) 3-{[5-(3-Фтор-4-метилфенокси)-3-метил-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота (соединение № 1-227)
(68a) 6-(3-Фтор-4-метилфенокси)-N-метил-3-нитропиридин-2-амин
Требуемое указанное в заголовке соединение (1,94 г, выход: 70%) получали в виде желтого порошка в соответствии со способом, описанным в примере (31a), используя 6-хлор-N-метил-3-нитропиридин-2-амин (J. Med. Chem., 43, 3052, 2000, 1,88 г, 10 ммоль), 3-фтор-4-метилфенол (1,51 г, 12 ммоль) и гидрид натрия (56%, 0,46 г, 12,0 ммоль).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,25 (3H, с), 2,76 (3H, д, J=4,7 Гц), 6,30 (1H, д, J=9,0 Гц), 7,02 (1H, дд, J=2,4, 8,6 Гц), 7,18 (1H, дд, J=2,0, 10,6 Гц), 7,35 (1H, т, J=8,6 Гц), 8,44 (1H, д, J=9,0 Гц), 8,75 (1H, ушир.c).
(68b) 6-(3-Фтор-4-метилфенокси)-N2-метилпиридин-2,3-диамин
Требуемое указанное в заголовке соединение (1,73 г, выход: 99%) получали в виде коричневого масла в соответствии со способом, описанным в примере (31b), используя 6-(3-фтор-4-метилфенокси)-N-метил-3-нитропиридин-2-амин, полученный в примере (68a) (1,94 г, 7,0 ммоль), и железный порошок (1,95 г, 35,0 ммоль).
1H-ЯМР (CDCl3, 400 МГц) δ: 2,24 (3H, с), 2,96 (3H, д, J=4,7 Гц), 4,41 (1H, ушир.с), 5,95 (1H, д, J=7,8 Гц), 6,80 (1H, с), 6,82 (1H, с), 6,88 (1H, д, J=7,8 Гц), 7,11 (1H, т, J=8,2 Гц).
(68c) [3-(Метоксикарбонил)фенокси]уксусная кислота
Раствор трет-бутилбромацетата (506 г, 2,6 моль), метил 3-гидроксибензоата (395 г, 2,60 моль) и карбоната калия (789 г, 5,71 моль) в ДМФА (2 л) перемешивали при комнатной температуре в течение четырех часов. Реакционную смесь концентрировали при пониженном давлении и добавляли этилацетат (2 л). Смесь промывали водой (1 л) два раза, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного трет-бутил [3-(метоксикарбонил)фенокси]ацетата. Анизол (100 мл) и трифторуксусную кислоту (680 мл) добавляли к раствору полученного сложного эфира в метиленхлориде (1 л) и смесь перемешивали при комнатной температуре в течение трех суток. Реакционную смесь концентрировали при пониженном давлении. Остаток кристаллизовали из диизопропилового эфира с получением указанного в заголовке соединения (476 г, 87%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц) δ: 3,93 (3H, с), 4,76 (2H, с), 7,18 (1H, дд, J=2,7, 8,2 Гц), 7,40 (1H, т, J=8,2 Гц), 7,58 (1H, дд, J=1,6, 2,7 Гц), 7,73 (1H, д, J=7,4 Гц).
(68d) Метил 3-(2-{[6-(3-фтор-4-метилфенокси)-2-(метиламино)пиридин-3-ил]амино}-2-оксоэтокси)бензоат
Раствор 6-(3-фтор-4-метилфенокси)-N2-метилпиридин-2,3-диамина, полученного в примере (68b) (1,11 г, 4,49 ммоль), [3-(метоксикарбонил)фенокси]уксусной кислоты, полученной в примере (68c) (0,94 г, 4,49 ммоль), WSC·HCl (0,86 г, 4,49 ммоль) и HOBt (0,61 г, 4,49 ммоль) в метиленхлориде (100 мл) перемешивали при комнатной температуре в течение суток. Реакционную смесь концентрировали при пониженном давлении. Затем остаток очищали хроматографией на силикагеле (гексан:этилацетат, 1:1) с получением указанного в заголовке соединения (1,97 г, выход: 79%) в виде коричневого масла.
1H-ЯМР (CDCl3, 400 МГц) δ: 2,27 (3H, д, J=2,0 Гц), 2,86 (3H, с), 3,95 (3H, с), 4,53 (1H, ушир.c), 4,73 (2H, с), 6,05 (1H, д, J=8,2 Гц), 6,85-6,90 (2H, м), 7,15 (1H, т, J=9,0 Гц), 7,21 (1H, ддд, J=0,8, 2,7, 8,2 Гц), 7,36 (1H, д, J=7,8 Гц), 7,46 (1H, т, J=7,8 Гц), 7,67 (1H, дд, J=1,1, 2,4 Гц), 7,74 (1H, с), 7,78 (1H, дт, J=1,1, 7,8 Гц).
(68e) Метил 3-{[5-(3-фтор-4-метилфенокси)-3-метил-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензоат
Метил 3-(2-{[6-(3-фтор-4-метилфенокси)-2-(метиламино)пиридин-3-ил]амино}-2-оксоэтокси)бензоат, полученный в примере в примере (68d) (1,56 г, 3,55 ммоль), и уксусную кислоту (20 мл) перемешивали при 80°C в течение суток. Дав реакционному раствору охладиться, добавляли к реакционной смеси воду (100 мл) с последующим экстрагированием этилацетатом (100 мл). Затем органический слой промывали насыщенным раствором бикарбоната натрия (100 мл) два раза и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали хроматографией на силикагеле (гексан:этилацетат, 1:1) с получением указанного в заголовке соединения (1,13 г, выход: 76%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 2,29 (3H, д, J=1,6 Гц), 3,84 (3H, с), 3,93 (3H, с), 5,38 (2H, с), 6,83 (1H, д, J=8,6 Гц), 6,86-6,91 (2H, м), 7,18 (1H, т, J=8,6 Гц), 7,26-7,29 (1H, м), 7,38 (1H, т, J=7,8 Гц), 7,69-7,72 (2H, м), 8,03 (1H, д, J=8,6 Гц).
(68f) 3-{[5-(3-Фтор-4-метилфенокси)-3-метил-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (0,79 г, выход: 72%) получали в виде белого порошка в соответствии со способом, описанным в примере (33e), используя метил 3-{[5-(3-фтор-4-метилфенокси)-3-метил-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензоат, полученный в примере (68e) (1,13 г, 2,68 ммоль).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,23 (3H, с), 3,70 (3H, с), 5,41 (2H, с), 6,91 (1H, д, J=8,2 Гц), 6,91-6,94 (1H, м), 7,05 (1H, дд, J=2,4, 11,0 Гц), 7,15 (1H, д, J=9,0 Гц), 7,28 (1H, д, J=7,8 Гц), 7,32 (1H, д, J=8,2 Гц), 7,51 (1H, д, J=7,4 Гц), 7,57 (1H, дд, J=1,2, 2,4 Гц), 8,14 (1H, д, J=8,6 Гц).
МС (FAB+) m/z: 408 (M+H)+.
Т.пл.: 205-207°C.
(Пример 69) 3-{[3-Метил-5-(4-метилфенокси)-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота (соединение № 1-221)
(69a) N-Метил-6-(4-метилфенокси)-3-нитропиридин-2-амин
Синтез осуществляли таким же способом, как в примере (28a), используя 4-метилфенол (5,0 г, 46 ммоль), 6-хлор-N-метил-3-нитропиридин-2-амин (7,4 г, 39 ммоль), гидрид натрия (>56% в масле, 2,0 г, 51 ммоль) и N,N-диметилформамид (50 мл). Полученное темно-коричневое твердое вещество непосредственно использовали для следующей реакции.
(69b) 3-Амино-2-N-метиламино-6-(4-метилфенокси)пиридин
Синтез осуществляли таким же способом, как в примере (28b), используя N-метил-6-(4-метилфенокси)-3-нитропиридин-2-амин, полученный в примере (69a) (10 г, 39 ммоль), железный порошок (11 г, 200 ммоль), хлорид аммония (1,1 г, 20 ммоль), этанол (30 мл) и воду (15 мл). Полученное масло очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 6/1 → 3/2). Требуемое соединение (2,2 г, выход: 25%) получали в виде темно-коричневого масла сушкой при пониженном давлении.
1H-ЯМР (CDCl3, 400 МГц) δ: 2,33 (3H, с), 2,91 (2H, ушир.c), 2,97 (3H, д, J=5,1 Гц), 4,41 (1H, ушир.с), 5,84 (1H, д, J=7,8 Гц), 6,85 (1H, д, J=7,8 Гц), 7,01 (2H, д, J=8,6 Гц), 7,13 (2H, д, J=8,2 Гц).
(69c) Метил 3-(2-{[2-(метиламино)-6-(4-метилфенокси)пиридин-3-ил]амино}-2-оксоэтокси)бензоат
Синтез осуществляли таким же способом, как в примере (28c), используя 3-амино-2-N-метиламино-6-(4-метилфенокси)пиридин (2,2 г, 9,7 ммоль), полученный в примере (69b), [3-(метоксикарбонил)фенокси]уксусную кислоту (2,0 г, 9,7 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (2,2 г, 12 ммоль), моногидрат 1-гидроксибензотриазола (1,8 г, 12 ммоль) и дихлорметан (40 мл). Полученный неочищенный продукт очищали хроматографией на колонке с силикагелем (элюирующий растворитель: гексан/этилацетат = 3/1→6/5). Требуемое соединение (3,7 г, выход: 90%) получали в виде темно-зеленого масла сушкой при пониженном давлении.
1H-ЯМР (CDCl3, 400 МГц) δ: 2,35 (3H, с), 2,88 (3H, с), 3,94 (3H, с), 4,72 (2H, с), 5,96 (1H, д, J=8,2 Гц), 7,02-7,08 (2H, м), 7,16 (2H, д, J=8,2 Гц), 7,20 (1H, ддд, J=1,2, 2,7, 8,2 Гц), 7,32 (1H, д, J=8,2 Гц), 7,45 (1H, т, J=8,0 Гц), 7,66 (1H, дд, J=1,4, 2,5 Гц), 7,73 (1H, с), 7,77 (1H, дт, J=1,0, 1,2, 7,6 Гц).
МС (FAB) m/z: 422 (M+H)+.
(69d) Моногидрохлорид метил 3-{[3-метил-5-(4-метилфенокси)-3Н-имидазо[4,5-b]пиридин-2-ил]метокси}бензоата
Метил 3-(2-{[2-(метиламино)-6-(4-метилфенокси)пиридин-3-ил]амино}-2-оксоэтокси)бензоат, полученный в примере (69c) (3,7 г, 8,7 ммоль), растворяли в уксусной кислоте (40 мл) и раствор нагревали с обратным холодильником в течение 3,5 часов. После охлаждения до комнатной температуры к концентрированному реакционному раствору добавляли водный раствор бикарбоната натрия (100 мл) с последующим экстрагированием этилацетатом (120 мл × 2). Полученные органические слои промывали водой (100 мл) и насыщенным раствором соли (80 мл) и затем сушили над безводным сульфатом магния. Выпаривали при пониженном давлении растворитель и полученное бледно-коричневое масло непосредственно использовали для следующей реакции.
(69e) 3-{[3-метил-5-(4-метилфенокси)-3Н-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[3-метил-5-(4-метилфенокси)-3Н-имидазо[4,5-b]пиридин-2-ил]метокси}бензоат, полученный в примере (69d) (3,5 г, 8,3 ммоль), 1 н. водный раствор гидроксида натрия (18 мл, 18 ммоль) и 1,4-диоксан (20 мл), с получением требуемого соединения (2,8 г, выход: 82%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,32 (3H, с), 3,70 (3H, с), 5,47 (2H, с), 6,86 (1H, д, J=8,6 Гц), 7,06 (2H, д, J=8,2 Гц), 7,22 (2H, д, J=7,8 Гц), 7,35-7,39 (1H, м), 7,45 (1H, т, J=7,8 Гц), 7,62 (1H, дд, J=1,4, 2,5 Гц), 7,58 (1H, дт, J=1,3, 7,5 Гц), 8,12 (1H, д, J=8,6 Гц), 13,05 (1H, ушир.c).
МС (FAB) m/z: 389 (M+H)+.
Аналит. вычислено для C22H19N3O4: C, 67,86; H, 4,92; N, 10,79. Найдено C, 67,69; H, 4,71; N, 10,72.
(Пример 70) 3-{[5-(3,4-Диметилфенокси)-3-метил-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота (соединение № 1-223)
(70a) 6-(3,4-Диметилфенокси)-N-метил-3-нитропиридин-2-амин
Неочищенный продукт требуемого указанного в заголовке соединения получали в виде желтого порошка в соответствии со способом, описанным в примере (28a), используя 3,4-диметилфенол (5,47 г, 44,8 ммоль), 6-хлор-N-метил-3-нитропиридин-2-амин (7,00 г, 37,3 ммоль) и гидрид натрия (63%, 1,71 г, 44,8 ммоль). Полученный неочищенный продукт непосредственно использовали для следующей реакции.
(70b) 6-(3,4-Диметилфенокси)-N2-метилпиридин-2,3-диамин
Требуемое указанное в заголовке соединение (2,83 г, выход: 31%) получали в виде коричневого масла в соответствии со способом, описанным в примере (28b), используя 6-(3,4-диметилфенокси)-N-метил-3-нитропиридин-2-амин, полученный в примере (70a) (10,2 г, 37,3 ммоль), железный порошок (10,4 г, 187 ммоль) и хлорид аммония (1,00 г, 18,7 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 2,05 (3H, с), 2,23 (3H, с), 2,98 (3H, д, J=5,1 Гц), 5,82 (1H, д, J=7,8 Гц), 6,84 (2H, с), 6,90 (1H, д, J=2,7 Гц), 7,07 (1H, д, J=8,2 Гц).
(70c) Метил 3-(2-{[6-(3,4-диметилфенокси)-2-(метиламино)пиридин-3-ил]амино}-2-оксоэтокси)бензоат
Требуемое указанное в заголовке соединение (4,45 г, выход: 88%) получали в виде коричневого порошка в соответствии со способом, описанным в примере (28c), используя 6-(3,4-диметилфенокси)-N2-метилпиридин-2,3-диамин, полученный в примере (70b) (2,83 г, 11,6 ммоль), [3-(метоксикарбонил)фенокси]уксусную кислоту (2,44 г, 11,6 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (2,23 г, 11,6 ммоль) и моногидрат 1-гидроксибензотриазола (1,57 г, 11,6 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 2,25 (3H, с), 2,25 (3H, с), 2,89 (3H, с), 3,94 (3H, с), 4,72 (2H, с), 5,93 (1H, д, J=8,2 Гц), 6,89 (1H, дд, J=2,7, 8,2 Гц), 6,94 (1H, д, J=2,3 Гц), 7,11 (1H, д, J=7,8 Гц), 7,19 (1H, дд, J=2,7, 8,2 Гц), 7,31 (1H, д, J=8,2 Гц), 7,44 (1H, т, J=8,0 Гц), 7,64-7,67 (1H, м), 7,73-7,80 (2H, м).
(70d) Метил 3-{[5-(3,4-диметилфенокси)-3-метил-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (3,21 г, выход: 75%) получали в виде белого порошка в соответствии со способом, описанным в примере (28d), используя метил 3-(2-{[6-(3,4-диметилфенокси)-2-(метиламино)пиридин-3-ил]амино}-2-оксоэтокси)бензоат, полученный в примере (70c) (4,45 г, 10,2 ммоль), и уксусную кислоту (51,0 мл).
1H ЯМР (CDCl3, 400 МГц) δ: 2,27 (3H, с), 2,27 (3H, с), 3,85 (3H, с), 3,92 (3H, с), 5,37 (2H, с), 6,75 (1H, д, J=8,6 Гц), 6,90 (1H, дд, J=2,3, 7,8 Гц), 6,95 (1H, д, J=2,3 Гц), 7,14 (1H, д, J=8,6 Гц), 7,25-7,29 (2H, м), 7,38 (1H, т, J=7,8 Гц), 7,67-7,73 (2H, м).
(70e) 3-{[5-(3,4-Диметилфенокси)-3-метил-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (2,90 г, выход: 95%) получали в виде белого порошка в соответствии со способом, описанным в примере (28e), используя метил 3-{[5-(3,4-диметилфенокси)-3-метил-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензоат, полученный в примере (70d) (3,16 г, 7,57 ммоль), и 1 н. водный раствор гидроксида натрия (11,4 мл, 11,4 ммоль).
1H ЯМР (ДМСО-d6, 400 МГц) δ: 2,22 (3H, с), 2,22 (3H, с), 3,71 (3H, с), 5,47 (2H, с), 6,82 (1H, д, J=8,6 Гц), 6,88 (1H, дд, J=2,7, 8,2 Гц), 6,96 (1H, д, J=2,7 Гц), 7,16 (1H, д, J=7,8 Гц), 7,37 (1H, ддд, J=1,2, 2,7, 8,2 Гц), 7,45 (1H, т, J=7,8 Гц), 7,56-7,59 (1H, м), 7,62-7,64 (1H, м), 8,10 (1H, д, J=8,2 Гц), 13,03 (1H, с).
МС (FAB) m/z: 404 (M+H)+.
(Пример 71) 3-{[5-(3,5-Диметилфенокси)-3-метил-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота (соединение № 1-225)
(71a) 6-(3,5-Диметилфенокси)-N-метил-3-нитропиридин-2-амин
Синтез осуществляли таким же способом, как в примере (28a), используя 3,5-диметилфенол (5,0 г, 45 ммоль), 6-хлор-N-метил-3-нитропиридин-2-амин (7,1 г, 38 ммоль), гидрид натрия (>56% в масле, 2,0 г, 49 ммоль) и N,N-диметилформамид (50 мл). Полученное желтое твердое вещество непосредственно использовали для следующей реакции.
(71b) 3-Амино-6-(3,5-диметилфенокси)-2-N-метиламинопиридин
6-(3,5-Диметилфенокси)-N-метил-3-нитропиридин-2-амин, полученный в примере (71a) (10 г, 37 ммоль), растворяли в этаноле (100 мл) в атмосфере азота и добавляли 10% палладий-на-угле (2,0 г). Атмосферу заменяли водородом и смесь интенсивно перемешивали при комнатной температуре в течение 1,2 часа. Опять заменяли атмосферу азотом, после чего катализатор отфильтровывали через целит. Фильтрат сушили при пониженном давлении с получением требуемого соединения в виде пурпурно-красного масла, которое непосредственно использовали для следующей реакции.
(71c) Метил 3-(2-{[6-(3,5-диметилфенокси)-2-(метиламино)пиридин-3-ил]амино}-2-оксоэтокси)бензоат
Синтез осуществляли таким же способом, как в примере (57c), используя 3-амино-6-(3,5-диметилфенокси)-2-N-метиламинопиридин (12 г, 37 ммоль), полученный в примере (71b), [3-(метоксикарбонил)фенокси]уксусную кислоту (7,7 г, 37 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (8,4 г, 44 ммоль) и дихлорметан (150 мл). Полученное требуемое соединение в виде серого аморфного соединения непосредственно использовали для следующей реакции.
(71d) Метил 3-{[5-(3,5-диметилфенокси)-3-метил-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензоат
Метил 3-(2-{[6-(3,5-диметилфенокси)-2-(метиламино)пиридин-3-ил]амино}-2-оксоэтокси)бензоат, полученный в примере (71c) (16 г, 37 ммоль), растворяли в уксусной кислоте (150 мл) и смесь нагревали с обратным холодильником в течение 2,5 часов. Реакционный раствор концентрировали. Добавляли этилацетат (5 мл) и насыщенный водный раствор бикарбоната натрия и смесь подвергали ультразвуковой обработке. Выпавшее в осадок бледно-коричневое твердое вещество собирали фильтрованием с получением требуемого соединения (13 г, выход: 86%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,32 (6H, с), 3,86 (3H, с), 3,93 (3H, с), 5,38 (2H, с), 6,71-6,81 (3H, м), 6,84 (1H, с), 7,29 (1H, дд, J=1,0, 2,5 Гц), 7,38 (1H, т, J=7,8 Гц), 7,67-7,71 (1H, м), 7,72 (1H, дд, J=1,4, 2,5 Гц), 7,99 (1H, д, J=8,6 Гц).
МС (FAB) m/z: 418 (M+H)+.
(71e) 3-{[5-(3,5-Диметилфенокси)-3-метил-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота
Реакцию и последующую обработку осуществляли в соответствии с примером (28e), используя метил 3-{[5-(3,5-диметилфенокси)-3-метил-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензоат, полученный в примере (71d) (13 г, 32 ммоль), 1 н. водный раствор гидроксида натрия (47 мл, 47 ммоль) и 1,4-диоксан (50 мл), с получением требуемого соединения (11 г, выход: 85%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 400 МГц) δ: 2,27 (6H, с), 3,72 (3H, с), 5,48 (2H, с), 6,75 (2H, с), 6,84 (2H, с), 7,34-7,41 (1H, м), 7,45 (1H, т, J=7,8 Гц), 7,58 (1H, д, J=7,4 Гц), 7,63 (1H, с), 8,12 (1H, д, J=8,6 Гц).
МС (FAB) m/z: 404 (M+H)+.
Аналит. вычислено для C23H21N3O4+0,33H2O: C, 67,47; H, 5,33; N, 10,26. Найдено C, 67,69; H, 5,30; N, 10,28.
(Пример 72) 3-Фтор-5-{[3-метил-5-(4-метилфенокси)-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота (соединение № 1-222)
(72a) Метил 3-фтор-5-(2-{[2-(метиламино)-6-(4-метилфенокси)пиридин-3-ил]амино}-2-оксоэтокси)бензоат
Требуемое указанное в заголовке соединение (2,65 г, выход: 73%) получали в виде коричневого порошка в соответствии со способом, описанным в примере (68d), используя 6-(4-метилфенокси)-N2-метилпиридин-2,3-диамин, полученный в примере (69b) (1,88 г, 8,22 ммоль), [3-фтор-5-(метоксикарбонил)фенокси]уксусную кислоту (1,88 г, 8,22 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (1,58 г, 8,22 ммоль) и моногидрат 1-гидроксибензотриазола (1,11 г, 8,22 ммоль).
1H ЯМР (CDCl3, 400 МГц) δ: 2,36 (3H, с), 2,90 (3H, с), 3,94 (3H, с), 4,71 (2H, с), 5,96 (1H, д, J=8,2 Гц), 6,93 (1H, тд, J=2,3, 9,4 Гц), 7,05 (2H, д, J=8,6 Гц), 7,17 (2H, д, J=8,6 Гц), 7,31 (1H, д, J=8,2 Гц), 7,44-7,49 (2H, м), 7,71 (1H, с).
(72b) Метил 3-фтор-5-{[3-метил-5-(4-метилфенокси)-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензоат
Требуемое указанное в заголовке соединение (2,17 г, выход: 85%) получали в виде белого порошка в соответствии со способом, описанным в примере (68e), используя метил 3-фтор-5-(2-{[2-(метиламино)-6-(4-метилфенокси)пиридин-3-ил]амино}-2-оксоэтокси)бензоат, полученный в примере (72a) (2,65 г, 6,09 ммоль), и уксусную кислоту (30,0 мл).
1H ЯМР (CDCl3, 500 МГц) δ: 2,37 (3H, с), 3,82 (3H, с), 3,92 (3H, с), 5,36 (2H, с), 6,78 (1H, д, J=8,8 Гц), 6,98-7,03 (1H, м), 7,06 (2H, д, J=8,3 Гц), 7,19 (2H, д, J=8,8 Гц), 7,36-7,40 (1H, м), 7,51-7,54 (1H, м), 7,99 (1H, д, J=8,3 Гц).
(72c) 3-Фтор-5-{[3-метил-5-(4-метилфенокси)-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензойная кислота
Требуемое указанное в заголовке соединение (1,52 г, выход: 72%) получали в виде белого порошка в соответствии со способом, описанным в примере (28e), используя метил 3-фтор-5-{[3-метил-5-(4-метилфенокси)-3H-имидазо[4,5-b]пиридин-2-ил]метокси}бензоат, полученный в примере (72b) (2,17 г, 5,15 ммоль), и 1 н. водный раствор гидроксида натрия (7,72 мл, 7,72 ммоль).
1H ЯМР (ДМСО-d6, 400 МГц) δ: 2,32 (3H, с), 3,69 (3H, с), 5,50 (2H, с), 6,86 (1H, д, J=8,6 Гц), 7,03-7,09 (2H, м), 7,20-7,25 (2H, м), 7,28-7,36 (2H, м), 7,46-7,49 (1H, м), 8,12 (1H, д, J=8,6 Гц), 13,38 (1H, с).
МС (FAB) m/z: 408 (M+H)+.
Пример 1 испытаний: Гипогликемический эффект
Шестинедельных мышей-самцов KK покупали у CLEA Japan, Inc. и затем кормили до возраста 15-20 недель так, чтобы развился диабет. Мышей кормили индивидуально в течение адаптационного периода и периода испытаний, причем воду и пищу (FR2, Funabashi Farm) мыши получали в режиме свободного приема.
В начале эксперимента после измерения массы тела брали кровь из хвостовой вены мышей в стеклянную пробирку с гепариновым покрытием и проводили центрифугирование, после чего отделяли плазму. Измеряли уровень глюкозы в плазме с помощью Glucoloader GXT (A&T Corp.) и выбирали особей с уровнем глюкозы в плазме около 350 мг/dl или более. Мышей группировали по 3-4 мыши в каждой группе так, чтобы средняя масса тела и средний уровень глюкозы в плазме были одинаковыми. Каждое соединение вводили в группу соединений с питательной смесью, содержащей 0,03% соединения. Отдельная группа, в которой мышей кормили только пищей, была контрольной группой.
Экспериментальный период (период введения лекарства) составлял три дня. День группирования был днем 0, на 3-й измеряли массу тела и брали кровь из хвостовой вены для измерения уровня глюкозы в плазме.
Гипогликемический коэффициент определяли по следующей формуле.
Гипогликемический коэффициент = [(уровень глюкозы в крови в контрольной группе - уровень глюкозы в крови в группе мышей, которым вводили соединение)/уровень глюкозы в крови в контрольной группе] × 100
Полученные результаты показаны в таблице 2.
Как ясно из таблицы 2, соединение по настоящему изобретению обладает гипогликемическим действием. Поэтому предполагается, что соединение по настоящему изобретению должно быть полезным в качестве терапевтического средства от диабета (в частности, терапевтического средства от диабета типа II).
В следующих примерах 2-5 испытаний каждую операцию осуществляли в соответствии со способом, описанным в литературе (Sambrook, J., Fritsch, E. F. and Maniatis, T., "Molecular Cloning", Cold Spring Harbor Laboratory Press, 1989), если не указано иное. Коммерчески доступные реактивы и наборы использовали в соответствии с прилагаемыми инструкциями.
Пример 2 испытаний: Оценка активности PPARγ модулятора
(Процедура 1) Химический синтез ДНК (DNA) олигомера в качестве праймера полимеразной цепной реакции
Праймеры полимеразной цепной реакции (далее "ПЦР" (PCR)) конструировали на основе генной последовательности человеческого PPARγ2 гена (GenBANK accession No. D83233). В областях до и за геном, кодирующим человеческий PPARγ2 белок, вводили последовательность распознавания для рестрикционного фермента BglII, где последовательность распознавания необходима для вставки гена в рестрикционный сайт BamHI экспрессирующей плазмиды pSG5 (Stratagene) для гена. В качестве праймеров ПЦР использовали два полинуклеотида, представленных как SEQ ID NO:1 и 2 в описанном позже перечне последовательностей (далее "S1" и "AS1", соответственно).
(Процедура 2) Химический синтез ДНК олигомера, содержащего чувствительную к PPARγ генную последовательность
Два полинуклеотида, представленных как SEQ ID NO:3 и 4 в описанном позже перечне последовательностей (далее "S2" и "AS2"), использовали для конструирования репортерной плазмиды, содержащей чувствительную к PPAR последовательность, для измерения способности к транскрипционной активности через PPARγ. Вставляемый фрагмент ДНК конструировали на основе генной последовательности в промоторной области ацил-КоА-оксидазы крысы (J. D. Tugwood, EMBO J, 1992, Vol. 11, No. 2, p. 433-439). Последовательность распознавания для рестрикционного фермента NheI вводили в S2 и последовательность распознавания для рестрикционного фермента XhoI вводили в AS2 для вставки в репортерную плазмиду pGV-P2 (Toyo Ink Mfg. Co., Ltd.).
(Процедура 3) Конструирование экспрессирующей плазмиды для человеческого PPARγ
На фиг.1 показано схематическое изображение экспрессирующей плазмиды для PPARγ.
ПЦР осуществляли, используя термоустойчивую ДНК-полимеразу Ex-Taq (Takara Shuzo Co., Ltd.) с библиотекой кДНК, полученной из человеческой жировой ткани (Clontech) в качестве матрицы и ДНК олигомеров S1 и AS1, полученных в процедуре 1, в качестве праймеров ПЦР. В результате амплифицировали фрагмент ДНК около 1500 пар оснований (далее “по” (bp)). Повторяли 30 раз цикл, состоящий из инкубации при 94°C в течение одной минуты, инкубации при 55°C в течение 30 секунд и инкубации при 72°C в течение 30 секунд. Полученный фрагмент ДНК около 1500 по частично расщепляли рестрикционным ферментом BglII и вставляли в рестрикционный сайт BamHI плазмиды pSG5 с получением экспрессирующей плазмиды pSG5-hPPARγ для человеческого PPARγ. Методом обрыва дидезоксинуклеотидной цепи подтверждали, что последовательность ДНК-оснований встроенного фрагмента ДНК, была человеческим PPARγ2.
(Процедура 4) Конструирование репортерной плазмиды
На фиг.2 показано схематическое изображение PPRE репортерной плазмиды.
Выщепленный фрагмент (digest) векторной pGV-P2 получали расщеплением рестрикционными ферментами NheI и XhoI и очисткой электрофорезом в 1,0% агарозном геле. ДНК олигомеры S2 и AS2, полученные в процедуре 2, смешивали, инкубировали на горячей водяной бане при 94°C в течение одной минуты и затем инкубировали при 25°C в течение одного часа, чтобы образовалась двухнитевая ДНК с отожженными S2 и AS2. Затем концы двухнитевой ДНК фосфорилировали, используя ДНК полинуклеотидкиназу (Toyobo Co., Ltd.), после чего лигировали к ранее полученному выщепленному фрагменту pGV-P2, используя рестрикционные сайты NheI и XhoI, с получением репортерной плазмиды pGV-P2-PPRE, содержащей чувствительную к PPAR последовательность.
(Процедура 5) Перенос генов в животные клетки
E. coli HB-101 трансформировали обычным методом, используя плазмиды, полученные в процедурах 3 и 4. HB-101, содержащий плазмиды, культивировали в L-питательной среде, содержащей 100 мкг/мл ампициллина (содержащего 10 г Tryptone (Difco), 5 г дрожжевого экстракта (Difco) и 5 г хлорида натрия в 1 л плазмиды раствора, соответственно) при 37°C в течение 17 часов. Затем соответственные плазмиды очищали щелочно-SDS методом и использовали для переноса генов в животные клетки. pSG5-hPPARγ, pGV-P2-PPRE и реактив LipofectAMINE (Invitrogen Cat. No. 18324-020) смешивали в соответствии с руководством, приложенным к реактиву LipofectAMINE. Ген временно переносили в клетки остеосаркомы линии MG63, после чего клетки собирали. Собранные клетки высевали в каждую лунку 96-луночного планшета (COSTAR 3917) с нормой 30000-40000 клеток/лунку, используя α-MEM среду (GIBCO BRL Cat. No. 12571-048), смешанную с 10% сывороткой плодной коровы (MOREGATE BATCH: 474030) при 10% (об./об.) и Penicillin-Streptomycin, Liquid (GIBCO BRL Cat. No. 15140-122) при 1% (об./об.) (далее сокращенно как 10% α-MEM). Клетки культивировали в CO2 инкубаторе (NAPCO) в условиях 37°C, 5% CO2 и 95%-RH в течение 24 часов.
(Процедура 6) Способ добавления реактива для оценки промотирующего эффекта транскрипционной активности
Из планшета с культурой, приготовленной в процедуре 5, удаляли среду. В контрольную группу вводили 10% α-MEM при 95 мкл/лунку. Следующее ниже соединение A (соединение A показано в качестве примера и агонист PPARγ им не ограничивается), приготовленное в виде 10 мкМ раствора в ДМСО, разбавляли 1000-кратно, используя 10% α-MEM; полученное вводили в положительную контрольную группу при 95 мкл/лунку. Затем ДМСО, разбавленный 20-кратно 10% α-MEM, вводили в контрольную группу и положительную контрольную группу при 5 мкл/лунку. В группу с введенным испытуемым соединением вводили 10% α-MEM при 95 мкл/лунку. Затем испытуемое соединение, разведенное ДМСО до различных концентраций, разбавляли 20-кратно, используя 10% α-MEM; полученное вводили в группу с введенным испытуемым соединением при 5 мкл/лунку.
(Соединение A и способ его получения)
Соединение A: N-[4-[2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиметил]-1-метил-1H-бензимидазол-6-илокси]фенил]бензамид
0,36 мл триэтиламина и 0,10 мл бензоилхлорида добавляли по каплям к раствору 400 мг дигидрохлорида 5-[4-[6-(4-аминофенокси)-1-метил-1H-бензимидазол-2-илметокси]бензил]тиазолидин-2,4-диона в 8 мл безводного N,N-диметилформамида. Реакционный раствор перемешивали при комнатной температуре в течение одного часа. Затем выпаривали при пониженном давлении растворитель и к остатку добавляли воду с последующим экстрагированием этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Этилацетат выпаривали. Остаток очищали хроматографией на колонке с силикагелем (этилацетат:н-гексан = 1:1→2:1→3:1→4:1) с получением 247 мг требуемого соединения в виде белого порошка.
Температура плавления: 200-204°C.
(Процедура 7) Способ добавления реактива для оценки ингибирующего эффекта транскрипционной активности
Из планшета c культурой, приготовленноой в процедуре 5, удаляли среду. В контрольную группу вводили 10% α-MEM при 95 мкл/лунку. Указанное выше соединение A, приготовленное в виде 10 мкМ раствора в ДМСО, разбавляли 1000-кратно, используя 10% α-MEM; полученное вводили в положительную контрольную группу при 95 мкл/лунку. Затем ДМСО разбавляли 20-кратно 10% α-MEM; полученное вводили в контрольную группу и положительную контрольную группу при 5 мкл/лунку. Соединение A, приготовленное в виде 10 мкМ раствора в ДМСО, разбавляли 1000-кратно, используя 10% α-MEM; полученное вводили в группу с введенным испытуемым соединением при 95 мкл/лунку. Затем испытуемое соединение, разведенное ДМСО до различных концентраций, разбавляли 20-кратно, используя 10% α-MEM; полученное вводили в группу с введенным испытуемым соединением при 5 мкл/лунку.
(Процедура 8) Способ измерения люциферазной активности
Клетки, полученные в процедурах 6 и 7, культивировали в течение 24 часов и затем удаляли среду. Солевой раствор Dulbecco, содержащий фосфатный буфер (GIBCO BRL Cat. No. 14040-117 или SIGMA CHEMICAL CO. Cat. No. D8662), добавляли к равному количеству люциферазного люминесцентного субстрата LT 2,0 (Wako Pure Chemical Industries, Ltd., Cat. No. 309-05884); полученное вводили при 50 мкл/лунку. Смеси давали постоять при комнатной температуре в течение примерно 10 минут и затем перемешивали микромиксером (TAITEC E-36). Измеряли люциферазную активность прибором Analyst (Molecular Devices) и чертили кривую зависимости от дозы.
(Процедура 9) Способ вычисления IC50 и EC50
IC50, Imax, EC50 и Emax испытуемого соединения определяли следующим образом. На фиг.3 показана концептуальная диаграмма.
Когда люциферазная активность положительной контрольной группы равна 100%, а люциферазная активность контрольной группы равна 0%, максимальную люциферазную активность, проявленную только испытуемым соединением, определяют как Emax (%), а максимальное ингибирование люциферазной активности испытуемым соединением в присутствии соединения A определяют как Imax (%). В данном случае концентрацию испытуемого соединения, представляющую собой Emax/2, вычисляют как EC50. Концентрацию испытуемого соединения, представляющую собой (100 - Imax)/2, вычисляют как IC50. Вычисленные описанным выше образом IC50 и EC50 использовали для оценки активности модулятора PPARγ.
Результаты измерений показаны в таблице 3.
Как показано в таблице 3, соединения по настоящему изобретению обладают модулирующей PPARγ активностью и полезны в качестве терапевтических средств или профилактических средств от заболевания, основанного на дислипидемии, артериосклерозе, гиперлипидемии, диабете, инволюционном остеопорозе, ожирении, раке или тому подобном.
Пример 3 испытаний: Испытание на ингибирование адипоцитной дифференцировки
Данному испытанию подвергали белые адипоциты крысы, включенные в набор для культивирования, купленный у Primary Cell Co., Ltd. Среду, входящую в набор для культивирования белых адипоцитов, купленный у Primary Cell Co., Ltd., использовали в качестве питательной среды или среды, индуцирующей дифференцировку. В данном испытании все клетки культивировали в инкубаторе с CO2 (37°C, 95% влажность, 5% CO2).
Всю среду для транспортировки удаляли сразу же после прибытия купленных клеток. Добавляли питательную среду в количестве 5 мл(/колбу 25 см2) и клетки культивировали в течение суток. После этого приготавливали клеточную суспензию (83000 клеток/мл), используя питательную среду. Клеточную суспензию распределяли по 96-луночному микропланшету, покрытому коллагеном типа I (Becton, Dickinson and Company) по 5000-6000 клеток/лунку (60 мкл/лунку). В каждом планшете предусматривали в качестве контрольной группы лунку, в которую вносили только питательную среду, не содержащую клетки (холостая лунка).
На следующий день всю питательную среду удаляли и вводили среду, индуцирующую дифференцировку, при 147 мкл/лунку. Затем 1) для группы с введенным испытуемым соединением 100 мкМ раствор испытуемого соединения в ДМСО разбавляли 20-кратно средой, индуцирующей дифференцировку; полученное вводили при 3 мкл/лунку (конечная концентрация испытуемого соединения: 100 нМ, конечная концентрация ДМСО: 0,1% (об./об.)) в лунки, в которые высевали клетки, и добавляли в лунки указанное выше соединение A при конечной концентрации 3,3 нМ (в данном испытании конечная концентрация ДМСО составляла 0,01% и, следовательно, была незначительной); 2) для положительной контрольной группы ДМСО, разбавленный 20-кратно средой, индуцирующей дифференцировку, вводили при 3 мкл/лунку (конечная концентрация ДМСО: 0,1% (об./об.)) в лунки, в которые высевали клетки, и добавляли в данные лунки соединение A при конечной концентрации 3,3 нМ; 3) для отрицательной контрольной группы ДМСО, разбавленный 20-кратно средой, индуцирующей дифференцировку, вводили при 3 мкл/лунку (конечная концентрация ДМСО: 0,1% (об./об.)) в лунки, в которые высевали клетки.
После культивирования в течение пяти суток из каждой лунки удаляли всю среду, индуцирующую дифференцировку, и вводили в каждую лунку 60 мкл 10% (об./об.) раствора формальдегида (фиксирующий раствор). Клетки инкубировали при комнатной температуре в течение 20 минут. Весь фиксирующий раствор удаляли и вводили в каждую лунку 60 мкл 0,2% (об./об.) раствора Triton X-100 (Sigma). Клетки инкубировали при комнатной температуре в течение пяти минут. Весь раствор Triton X-100 удаляли. Приготавливали жировой краситель растворением Oil Red O (Sigma) в 60% (об./об.) изопропаноловом растворе при 0,3% (масс./об.) и 60 мкл жирового красителя вносили в каждую лунку. Клетки инкубировали при комнатной температуре в течение 10 минут. Весь жировой краситель удаляли, после чего вводили и удаляли 60 мкл 60% (об./об.) изопропанолового раствора. Таким образом каждую лунку промывали два раза. После этого в каждую лунку вводили ДМСО при 100 мкл на лунку с последующим перемешиванием при комнатной температуре в течение пяти минут. Измеряли мультипланшетным ридером (Bio-Tek Instruments Inc.) или тому подобным оптическую плотность при 550 нМ (ABS550) и измеряли величину окрашивания красителем Oil Red O. Вычисляли степень адипоцитной дифференцировки (%) группы с введенным испытуемым соединением, предположив, что измеренная ABS550 положительной контрольной группы составляла 100%, а измеренная ABS550 отрицательной контрольной группы была равна 0.
Результаты показаны в таблице 4. В таблице н.о. (N.D.) означает “неопределяемое” (значение).
Как показано в таблице 4, соединения по настоящему изобретению ингибируют дифференцировку в адипоциты и полезны в качестве средств против ожирения.
Пример 4 испытаний: Испытание на промотирование адипоцитной дифференцировки
Данному испытанию подвергали белые адипоциты крысы, включенные в набор для культивирования, купленный у Primary Cell Co., Ltd. Среду, входящую в набор для культивирования белых адипоцитов, купленный у Primary Cell Co., Ltd., использовали в качестве питательной среды или среды, индуцирующей дифференцировку. В данном испытании все клетки культивировали в инкубаторе с CO2 (37°C, 95% влажность, 5% CO2).
Всю среду для транспортировки удаляли сразу же после прибытия купленных клеток. Добавляли питательную среду в количестве 5 мл(/колбу 25см2) и клетки культивировали в течение суток. После этого приготавливали клеточную суспензию (83000 клеток/мл), используя питательную среду. Клеточную суспензию распределяли по 96-луночному микропланшету, покрытому коллагеном типа I (SUMITOMO BAKELITE Co., Ltd.) по 5000 клеток/лунку (60 мкл/лунку). В каждом планшете предусматривали в качестве контрольной группы лунку, в которую вносили только питательную среду, не содержащую клетки (холостая лунка).
На следующий день всю питательную среду удаляли и вводили среду, индуцирующую дифференцировку, при 147 мкл/лунку. Затем 1) для группы с введенным испытуемым соединением 100 мкМ раствор испытуемого соединения в ДМСО разбавляли 20-кратно средой, индуцирующей дифференцировку; полученное вводили при 3 мкл/лунку (конечная концентрация испытуемого соединения: 100 нМ, конечная концентрация ДМСО: 0,1% (об./об.)) в лунки, в которые высевали клетки; 2) для положительной контрольной группы ДМСО, разбавленный 20-кратно средой, индуцирующей дифференцировку, вводили при 3 мкл/лунку (конечная концентрация ДМСО: 0,1% (об./об.)) в лунки, в которые высевали клетки, и добавляли в данные лунки соединение A при конечной концентрации 3,3 нМ (в данном испытании конечная концентрация ДМСО составляла 0,01% и, следовательно, была незначительной); 3) для отрицательной контрольной группы ДМСО, разбавленный 20-кратно средой, индуцирующей дифференцировку, вводили при 3 мкл/лунку (конечная концентрация ДМСО: 0,1% (об./об.)) в лунки, в которые высевали клетки.
После культивирования в течение пяти суток из каждой лунки удаляли всю среду, индуцирующую дифференцировку, и вводили в каждую лунку 60 мкл 10% (об./об.) раствора формальдегида (фиксирующий раствор). Клетки инкубировали при комнатной температуре в течение 20 минут. Весь фиксирующий раствор удаляли и вводили в каждую лунку 60 мкл 0,2% (об./об.) раствора Triton X-100 (Sigma). Клетки инкубировали при комнатной температуре в течение пяти минут. Весь раствор Triton X-100 удаляли. Приготавливали жировой краситель растворением Oil Red O (Sigma) в 60% (об./об.) изопропаноловом растворе при 0,3% (масс./об.) и 60 мкл жирового красителя вносили в каждую лунку. Клетки инкубировали при комнатной температуре в течение 10 минут. Весь жировой краситель удаляли, после чего вводили и удаляли 60 мкл 60% (об./об.) изопропанолового раствора. Таким образом каждую лунку промывали два раза. После этого в каждую лунку вводили ДМСО при 100 мкл на лунку с последующим перемешиванием при комнатной температуре в течение пяти минут. Измеряли мультипланшетным ридером (Bio-Tek Instruments Inc.) оптическую плотность при 550 нМ (ABS550) и измеряли величину окрашивания красителем Oil Red O. Вычисляли степень адипоцитной дифференцировки (%) группы с введенным испытуемым соединением, предположив, что измеренная ABS550 положительной контрольной группы составляла 100%, а измеренная ABS550 отрицательной контрольной группы была равна 0.
Результаты показаны в таблице 5.
Как показано в таблице 5, соединения по настоящему изобретению предположительно частично промотируют дифференцировку в адипоциты в результате повышенной чувствительности к инсулину и полезны в качестве противодиабетических средств.
Пример 5 испытаний: Измерение эффекта активации PPARγ и модулирующей активности по отношению к нему
Розиглитазон, используемый в примерах, является коммерчески доступным активатором PPARγ и представляет собой соединение, которое описано в патенте США № 5002953, и может быть получено в соответствии со способом, описанным в указанном документе.
Испытание осуществляли в соответствии с методом репортерного анализа, справляясь с сообщением Kliewer et al. (Journal of Biological Chemistry, 1995, Vol. 270 (22), p. 12953-12956) как способом измерения способности соединения активировать PPARγ (далее эффекта активации PPARγ и модулирующей активности по отношению к нему). Подробности описаны ниже.
(1) Получение экспрессирующей плазмиды для химерического рецептора GAL4-PPARγ
Лиганд-связывающий домен человеческого PPARγ (соответствующий примерно 300 аминокислотам на карбоксильном конце) связывали с ДНК-связывающим доменом дрожжевого транскрипционного фактора GAL4 (соответствующего 147 аминокислотам на аминовом конце), основываясь на сообщении Kliewer et al., с получением гена, экспрессирующего рецептор GAL4-PPARγ.
Последовательность оснований гена человеческого PPARγ описана в генной базе данных GenBank под номером доступа Accession No. X90563.
(1-1) Экстракция общей РНК из клеточной линии HepG2
Клеточную линию HepG2 (American Type Culture Collection HB-8065) покупали у Dainippon Pharmaceutical Co., Ltd. и культивировали в колбе для культивирования тканей, имеющей площадь культивирования 75 см2 (изготовитель BD Biosciences). В качестве среды использовали модифицированную Дульбекко среду Игла (Gibco D-MEM производства Invitrogen Corporation) с добавлением фетальной телячьей сыворотки (производства HyClone) в объемном отношениии 10% и антибиотический раствор [Antibiotic Antimycotic Solution, stabilized (100 ×), производства Sigma] в объемном отношении 1%.
Клетки культивировали в инкубаторе с атмосферой из диоксида углерода при 37°С в 95% диоксиде углерода в течение трех суток. Когда клетки вырастали приблизительно до состояния полуслияния, среду из колбы удаляли отсасыванием. Клетки промывали добавлением 10 мл охлаженного льдом солевого раствора, снабженного буфером (Gibco Dulbecco's Phosphate-Buffered Saline производства Invitrogen Corporation), после чего солевой раствор удаляли отсасыванием. Затем к клеткам в колбе добавляли 7,5 мл реактива Тризол (Gibco TRIZOL reagent производства Invitrogen Corporation) и перемешивали, многократно действуя пипеткой. Клетки лизировали инкубацией при комнатной температуре в течение примерно пяти минут.
Клеточный лизат подвергали осаждению изопропиловым спиртом в соответствии с инструкциями по применению Trizol. Полученный осадок РНК растворяли в чистой воде и хранили в морозильнике при примерно -20°C. В данном случае объем раствора РНК составлял 0,22 мл. Образец, полученный 100-кратным разведением части раствора РНК чистой водой, имел оптическую плотность, равную 0,562 при 260 нМ. Вычисляли выход общей РНК: 0,562×100×39,5×0,22=488 мкг, предположив, что 39,5 мкг/мл РНК имеется в наличии, когда оптическая плотность равна 1.
(1-2) Клонирование кДНК лиганд-связывающего домена PPARγ
Следующие два дезоксиолигонуклеотида (праймер № 3 и праймер № 4), сконструированные на основе генной последовательности человеческого PPARγ, химически синтезировали в качестве праймеров для амплификации полимеразной цепной реакцией с обратной транскрипцией (далее RT-ПЦР) кДНК лиганд-связывающего домена PPARγ, используя Beckman Oligo 1000 (производства Beckman).
кДНК PPARγ амплифицировали с помощью RT-ПЦР, используя бусины Ready-To-Go RT-PCR Beads (производства Amersham Pharmacia Biotech, Inc.) с ранее полученной HepG2 общей РНК в качестве матрицы и праймерами № 3 и № 4 в качестве праймеров. Продукт реакции подвергали электрофорезу в 1,5% агарозе. Амплифицированную ленту длиной около 900 пар оснований вырезали, очищали и клонировали в плазмиду PCRII (производства Invitrogen Corporation). Предполагалось, что амплифицированный фрагмент ДНК имеет нуклеотидную последовательность, представленную как SEQ ID NO:7 в перечне последовательностей, которая включает последовательность, кодирующую лиганд-связывающий домен, в частности аминокислоты 175-475, человеческого PPARγ, и к которой присоединены сайт отщепления фермента рестрикции BamHI и сайт фермента рестрикции HindIII на 5'-конце и 3'-конце соответственно. В подтверждение указанной нуклеотидной последовательности выбрали клон плазмиды, точно содержащий последовательность, представленную SEQ ID NO:7.
(1-3) Получение плазмиды pM-PPARγ
Далее выбранную плазмиду обрабатывали ферментами рестрикции BamHI и HindIII с получением фрагмента с 900 парами оснований, содержащего ген лиганд-связывающего домена PPARγ. Полученный фрагмент вставляли в BamHI-HindIII сайт плазмиды pM, имеющей ген ДНК-связывающего домена дрожжевого транскрипционного фактора GAL4 (производства Clontech Laboratories, Inc.), и клонировали.
Плазмида pM-PPARγ, полученная указанным выше способом, включает нуклеотидную последовательность, представленную SEQ ID NO:8 в перечне последовательностей, и кодирует аминокислотную последовательность, представленную SEQ ID NO:9 в перечне последовательностей, содержащую аминокислоты 1-147 дрожжевого фактора транскрипции GAL4 на аминовом конце и аминокислоты 175-475 человеческого PPARγ и стоп-кодон на карбоксильном конце. Данная плазмида является геном, который может экспрессировать химерический рецептор GAL4-PPARγ в клетках млекопитающих.
(2) Измерение способности к активации PPARγ
Ранее полученную плазмиду pM-PPARγ и плазмиду pFR-Luc, купленную у Stratagene Cloning Systems, Inc., растворяли в деионизированной воде при концентрации 1 мг/мл каждой.
Полученные из почки обезьяны клетки линии COS-7 (American Type Culture Collection CRL-1651) высевали в 75-см2 колбу для культивирования и культивировали, используя модифицированную Дульбекко среду Игла, содержащую 10% фетальную телячью сыворотку (далее, сыворотка), в условиях 37°C и 5% газообразного диоксида углерода до достижения состояния приблизительно 80% слияния.
Клетки COS-7 трансфектировали 4,8 микрограммами на колбу плазмиды pM-PPARγ и 19,2 мкг на колбу плазмиды pFR-Luc, используя трансфекционный реагент Lipofectamine 2000 (производства Invitrogen Corporation), и клетки культивировали в течение ночи.
На следующий день клетки собирали обработкой трипсином, суспендировали в свободной от фенола красного модифицированной Дульбекко среде Игла, содержащей 75 мл 10% фетальной телячьей сыворотки, высевали в белый 96-луночный планшет (производства Costar), используя среду в объеме 95 мкл на лунку, и культивировали в течение ночи.
Испытуемое соединение растворяли в диметилсульфоксиде в концентрации 30 мМ. Раствор серийно разбавляли 6-кратно диметилсульфоксидом с получением растворов соединения с концентрациями до 18 нМ. Для контрольной группы приготавливали диметилсульфоксид. Для положительной контрольной группы приготавливали розиглитазон, растворенный в диметилсульфоксиде в концентрации 30 мМ. Разбавляли их 150-кратно средой и 5 мкл разбавленного раствора вносили в лунки, в которые были засеяны клетки. Концентрации испытуемого соединения для обработки клеток находились в пределах от 10 мкМ до 0,006 нМ. После указанного внесения клетки культивировали в течение ночи.
На следующий день среду удаляли, приготавливали Luc Lite (производства PerkinElmer Inc.) в соответствии с приложенным документом и вносили при норме 50 микролитров на лунку. Планшеты с клетками в Luc Lite перемешивали в течение примерно 30 минут. Измеряли в качестве люциферазной активности величину люминесценции в каждой лунке, используя Analyst (Molecular Devices), в течение 0,5 секунды. Вычерчивали кривую зависимости от дозы.
Когда люциферазная активность положительной контрольной группы составляла 100%, а люциферазная активность контрольной группы была равна 0%, максимальную люциферазную активность, проявленную только испытуемым соединением, вычисляли в качестве Emax (%), а концентрацию испытуемого соединения, представленную Emax/2, вычисляли в качестве EC50.
Полученные результаты показаны в таблице 6.
Как показано в таблице 6, соединения по настоящему изобретению обладают эффектом активации PPARγ и модулирующей активностью по отношению к нему и полезны в качестве терапевтических средств или профилактических средств против заболевания, основанного на дислипидемии, артериосклерозе, гиперлипидемии, диабете, инволюционном остеопорозе, ожирении, раке или тому подобном.
Пример 1 изготовления: Капсулы
Смешивают порошок указанного выше состава и дают ему пройти сквозь сито с отверстиями 60 меш. Затем порошок помещают в 250-мг желатиновые капсулы № 3 с получением капсулы.
Пример 2 изготовления: Таблетки
Смешивают порошок указанного выше состава, подвергают его влажному гранулированию, используя тестообразную массу из кукурузного крахмала, сушат и затем таблетируют, используя таблетировочную машину, с получением таблеток, каждая из которых имеет массу 200 мг. Таблетки могут быть покрыты сахаром, когда это нужно.
Промышленная применимость
Конденсированные бициклические гетероарильные соединения или их фармакологически приемлемые соли общей формулы (I) в соответствии с настоящим изобретением обладают превосходными гипогликемическими эффектами и полезны в качестве терапевтических средств и/или профилактических средств против метаболического синдрома, в частности заболевания, такого как диабет, гипергликемия, гиперлипидемия, ожирение, нарушенная толерантность к глюкозе (IGT), инсулинорезистентность, нарушенная толерантность к глюкозе натощак (IFG), гипертензия, жирная печень, неалкогольный стеатогепатит (NASH), диабетические осложнения (такие как ретинопатия, нефропатия или нейропатия), артериосклероз, гестационный сахарный диабет (GDM) или синдром поликистоза яичников (PCOS), воспалительного заболевания (такого как остеоартрит, боль или воспалительный энтерит), акне, солнечной эритемы, псориаза, экземы, аллергического заболевания, астмы, пептической язвы, язвенного колита, болезни Крона, болезни коронарных артерий, артериосклероза, атеросклероза, диабетической ретинопатии, диабетической макулопатии, макулярного отека, диабетической нефропатии, ишемической болезни сердца, цереброваскулярного нарушения, нарушения периферического кровообращения, аутоиммунного заболевания (такого как системная красная волчанка, хронический ревматизм, синдром Шегрена, системный склероз, смешанная соединительнотканая болезнь, болезнь Хашимото, болезнь Крона, язвенный колит, идеопатическая болезнь Аддисона, мужское бесплодие, синдром Гудпасчера, быстро прогрессирующий гломерулонефрит, тяжелая псевдопаралитическая миастения, полимиозит, рассеянный склероз, аутоиммунная гемолитическая анемия, идиопатическая тромбоцитопеническая пурпура, болезнь Бехчета или CREST синдром), панкреатита, кахексии, рака (такого как рак желудка, рак легкого, рак молочной железы, рак толстой кишки, рак предстательной железы, рак поджелудочной железы или рак печени), лейкоза, саркомы (такой как липосаркома), остеопороза, инволюционного остеопороза, нейродегенеративного заболевания, болезни Альцгеймера, гиперурикемии или сухих глаз.
Перечень последовательностей
SEQ ID NO:1: ПЦР праймер S1
SEQ ID NO:2: ПЦР праймер AS1
SEQ ID NO:3: ПЦР праймер S2
SEQ ID NO:4: ПЦР праймер AS2
SEQ ID NO:5: ПЦР смысловой праймер
SEQ ID NO:6: ПЦР антисмысловой праймер
SEQ ID NO:7: Нуклеотидная последовательность кДНК синтетического человеческого PPARγ
SEQ ID NO:8: Нуклеотидная последовательность гена GAL4 химерического PPARγ рецептора
SEQ ID NO:9: Аминокислотная последовательность GAL4 химерического PPARγ рецептора
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРИДИЛОКСИ ПРОИЗВОДНЫЕ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ АКТИВАТОРА/МОДУЛЯТОРА ГАММА-РЕЦЕПТОРА, АКТИВИРУЕМОГО ПРОЛИФЕРАТОРОМ ПЕРОКСИСОМ (PPAR) ГАММА | 2010 |
|
RU2480463C1 |
| КОНДЕНСИРОВАННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2006 |
|
RU2408586C2 |
| ТРИАРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 1998 |
|
RU2149863C1 |
| АМИДЫ КОНДЕНСИРОВАННОГО ПИПЕРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2014 |
|
RU2741810C2 |
| ИНГИБИТОРЫ FXIA, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ФАРМАЦЕВТИКЕ | 2020 |
|
RU2802878C1 |
| ПРОИЗВОДНЫЕ ПИРИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ ДИПЕПТИДИЛПЕПТИДАЗЫ IV | 2004 |
|
RU2353617C2 |
| ИНДОЛЫ, ОБЛАДАЮЩИЕ ПРОТИВОДИАБЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2003 |
|
RU2328483C2 |
| ПРОИЗВОДНОЕ БЕНЗИМИДАЗОЛА | 2006 |
|
RU2409573C2 |
| СПИРОЦИКЛИЧЕСКИЕ ПИРРОЛОПИРАЗИН(ПИПЕРИДИН)АМИДЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2012 |
|
RU2634900C2 |
| МОДУЛЯТОРЫ АТФ-СВЯЗЫВАЮЩИХ ТРАНСПОРТЕРОВ | 2010 |
|
RU2552353C2 |







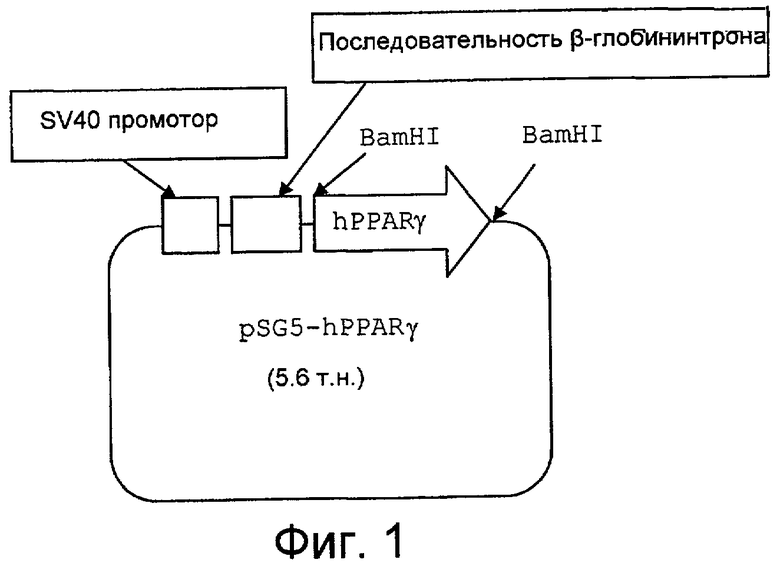
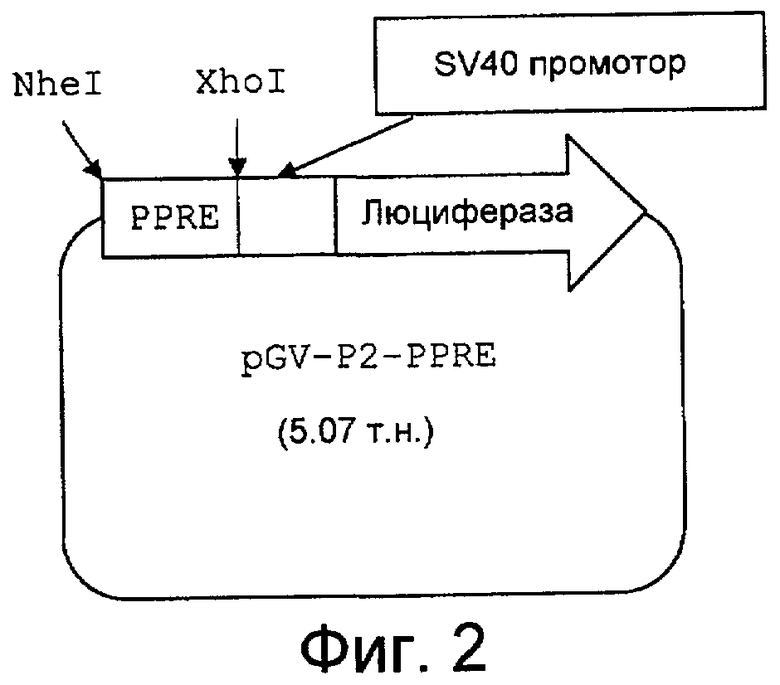
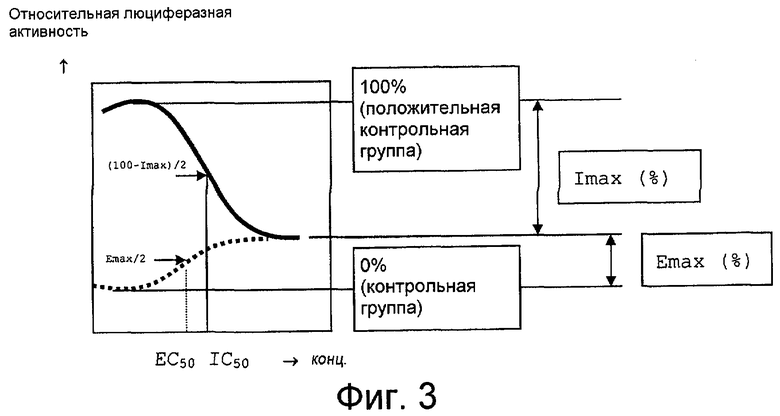
Настоящее изобретение относится к новым производным бензимидазола общей формулы (I) или к его фармакологически приемлемым солям, где R' представляет собой С6-арильную группу, которая может быть замещенной 1-3 группами, независимо выбранными из группы заместителей (а), или гетероциклическую группу, которая представляет пиридил, дигидробензофуранил, 1,3-бензодиоксолил, тетрагидропиранил, тетрагидрофуранил, которая может быть замещенной 1-3 группами, независимо выбранными из группы заместителей (а), R2 представляет собой C1-С6 алкильную группу, R3 представляет собой С6-арильную группу, которая может быть замещенной 1-2 группами, независимо выбранными из группы заместителей (a), Q представляет собой группу, представленную формулой =СН-, или атом азота и группа заместителей (а) представляет собой группу, состоящую из атома галогена, C1-С6 алкильной группы, C1-С6 галогенированной алкильной группы, карбоксильной группы, C1-C7 алкилкарбонильной группы, C2-C7 алкоксикарбонильной группы, C1-С6 алкоксигруппы, C1-С6 галогенированной алкоксигруппы, аминогруппы, 4-морфолинильной группы и ди-(С1-С6алкил)аминогруппы. Также изобретение относится к фармацевтической композиции на основе соединения формулы (I), активатору/модулятору PPARγ на основе соединения формулы (I), применению соединения формулы (I), способу снижения глюкозы в крови, способу активации PPARγ, способу лечения и/или предупреждения указанных патологических состояний. Технический результат: получены новые производные бензимидазола, обладающие модулирующей активностью в отношении PPARγ. 8 н. и 33 з.п. ф-лы, 3 ил., 6 табл., 76 пр.

1. Соединение общей формулы (I)
[Формула 1]

где R1 представляет собой С6-арильную группу, которая может быть замещенной 1-3 группами, независимо выбранными из группы заместителей (а), или гетероциклическую группу, которая представляет пиридил, дигидробензофуранил, 1,3-бензодиоксолил, тетрагидропиранил, тетрагидрофуранил, которая может быть замещенной 1-3 группами, независимо выбранными из группы заместителей (а),
R2 представляет собой С1-С6алкильную группу,
R3 представляет собой С6-арильную группу, которая может быть замещенной 1-2 группами, независимо выбранными из группы заместителей (а),
Q представляет собой группу, представленную формулой =СН-, или атом азота и
группа заместителей (а) представляет собой группу, состоящую из атома галогена, C1-С6 алкильной группы, C1-С6 галогенированной алкильной группы, карбоксильной группы, C2-C7 алкилкарбонильной группы, С2-С7 алкоксикарбонильной группы, C1-С6 алкоксигруппы, C1-С6 галогенированной алкоксигруппы, аминогруппы, 4-морфолинильной группы и ди-(С1-С6 алкил)аминогруппы,
или его фармакологически приемлемая соль.
2. Соединение или его фармакологически приемлемая соль по п.1, где R1 представляет собой фенильную группу, которая может быть замещенной 1-3 группами, независимо выбранными из атома галогена, C1-С6 алкильной группы, C1-С6 алкоксигруппы, C1-С6 галогенированной алкоксигруппы и аминогруппы, или 2,3-дигидро-1-бензофуран-6-ильную группу.
3. Соединение или его фармакологически приемлемая соль по п.1, где R1 представляет собой 2-фторфенильную группу, 3-фторфенильную группу, 3-хлорфенильную группу, 2,5-дифторфенильную группу, 4-хлор-3-фторфенильную группу, 3-хлор-4-фторфенильную группу, 4-метилфенильную группу, 3-этилфенильную группу, 3,4-диметилфенильную группу, 3-трифторметоксифенильную группу, 3-метоксифенильную группу, 3-метокси-4-метилфенильную группу, 4-амино-3,5-диметилфенильную группу или 2,3-дигидро-1-бензофуран-6-ильную группу.
4. Соединение или его фармакологически приемлемая соль по п.1, где R1 представляет собой 2-фторфенильную группу, 3-фторфенильную группу, 3-хлорфенильную группу, 2,5-дифторфенильную группу, 4-хлор-3-фторфенильную группу, 3-хлор-4-фторфенильную группу, 4-метилфенильную группу или 2,3-дигидро-1-бензофуран-6-ильную группу.
5. Соединение или его фармакологически приемлемая соль по п.1, где R2 представляет собой метильную группу, и Q представляет собой группу, представленную формулой =СН-.
6. Соединение или его фармакологически приемлемая соль по п.1, где R3 представляет собой фенильную группу, замещенную 1-2 атомами фтора и/или карбоксильной группой(ами).
7. Соединение или его фармакологически приемлемая соль по п.1, где R3 представляет собой 3-карбоксилфенильную группу или 3-карбоксил-5-фторфенильную группу.
8. Соединение или его фармакологически приемлемая соль по п.1, где соединением общей формулы (I) является
3-{[6-(3-фторфенокси)-1-метил-1Н-бензимидазол-2-ил]метокси}бензойная кислота,
3-[6-(3-хлорфенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензойная кислота,
3-{[6-(4-хлор-3-фторфенокси)-1-метил-1Н-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(3-хлор-4-фторфенокси)-1-метил-1Н-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(2-фторфенокси)-1-метил-1Н-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[1-метил-6-(4-метилфенокси)-1Н-бензимидазол-2-ил]метокси}бензойная кислота,
3-{[6-(2,5-дифторфенокси)-1-метил-1Н-бензимидазол-2-ил]метокси}бензойная кислота или
3-{[6-(2,3-дигидро-1-бензофуран-6-илокси)-1-метил-1Н-бензимидазол-2-ил]метокси}бензойная кислота.
9. Фармацевтическая композиция, обладающая модулирующей активностью в отношении PPARγ, содержащая соединение по любому из пп.1-8 или его фармакологически приемлемую соль в качестве активного компонента.
10. Фармацевтическая композиция по п.9, предназначенная для снижения глюкозы в крови.
11. Фармацевтическая композиция по п.9, предназначенная для лечения и/или предупреждения диабета.
12. Фармацевтическая композиция по п.9, предназначенная для лечения и/или предупреждения диабета типа II.
13. Фармацевтическая композиция по п.9, предназначенная для активации PPARγ.
14. Фармацевтическая композиция по п.9, предназначенная для улучшения метаболизма углеводов или липидов, для ослабления симптоматики инсулинорезистентности, для ингибирования воспаления или для ингибирования роста раковых клеток.
15. Фармацевтическая композиция по п.9, предназначенная для лечения и/или предупреждения заболевания, вызываемого метаболическим синдромом.
16. Фармацевтическая композиция по п.9, предназначенная для лечения и/или предупреждения гипергликемии, гиперлипидемии, ожирения, нарушенной толерантности к глюкозе, инсулинорезистентности, нарушенной толерантности к глюкозе натощак, гипертензии, жирной печени, неалкогольного стеатогепатита, диабетических осложнений, артериосклероза, атеросклероза, гестационного сахарного диабета или синдрома поликистоза яичников.
17. Фармацевтическая композиция по п.9, предназначенная для лечения и/или предупреждения воспалительного заболевания, рака, остеопороза, инволюционного остеопороза, нейродегенеративного заболевания, болезни Альцгеймера или гиперурикемии.
18. Фармацевтическая композиция по п.9, предназначенная для лечения и/или предупреждения акне, солнечной эритемы, псориаза, экземы, аллергического заболевания, астмы, пептической язвы, язвенного колита, болезни Крона, болезни коронарных артерий, артериосклероза, атеросклероза, диабетической ретинопатии, диабетической макулопатии, макулярного отека, диабетической нефропатии, ишемической болезни сердца, цереброваскулярного нарушения, нарушения периферического кровообращения, аутоиммунного заболевания, панкреатита, кахексии, лейкоза, саркомы или сухих глаз.
19. Активатор/модулятор PPARγ, содержащий соединение по любому из пп.1-8 или его фармакологически приемлемую соль в качестве активного компонента.
20. Применение соединения по любому из пп.1-8 или его фармакологически приемлемой соли для изготовления фармацевтической композиции, обладающей модулирующей активностью в отношении PPARγ.
21. Применение по п.20, где фармацевтическая композиция предназначена для снижения глюкозы в крови.
22. Применение по п.20, где фармацевтическая композиция предназначена для лечения и/или предупреждения диабета.
23. Применение по п.20, где фармацевтическая композиция предназначена для лечения и/или предупреждения диабета типа II.
24. Применение по п.20, где фармацевтическая композиция предназначена для активации PPARγ.
25. Применение по п.20, где фармацевтическая композиция предназначена для улучшения метаболизма углеводов или липидов, для ослабления симптоматики инсулинорезистентности, для ингибирования воспаления или для ингибирования роста раковых клеток.
26. Применение по п.20, где фармацевтическая композиция предназначена для лечения и/или предупреждения заболевания, вызываемого метаболическим синдромом.
27. Применение по п.20, где фармацевтическая композиция предназначена для лечения и/или предупреждения гипергликемии, гиперлипидемии, ожирения, нарушенной толерантности к глюкозе, инсулинорезистентности, нарушенной толерантности к глюкозе натощак, гипертензии, жирной печени, неалкогольного стеатогепатита, диабетических осложнений, артериосклероза, атеросклероза, гестационного сахарного диабета или синдрома поликистоза яичников.
28. Применение по п.20, где фармацевтическая композиция предназначена для лечения и/или предупреждения воспалительного заболевания, рака, остеопороза, инволюционного остеопороза, нейродегенеративного заболевания, болезни Альцгеймера или гиперурикемии.
29. Применение по п.20, где фармацевтическая композиция предназначена для лечения и/или предупреждения акне, солнечной эритемы, псориаза, экземы, аллергического заболевания, астмы, пептической язвы, язвенного колита, болезни Крона, болезни коронарных артерий, артериосклероза, атеросклероза, диабетической ретинопатии, диабетической макулопатии, макулярного отека, диабетической нефропатии, ишемической болезни сердца, цереброваскулярного нарушения, нарушения периферического кровообращения, аутоиммунного заболевания, панкреатита, кахексии, лейкоза, саркомы или сухих глаз.
30. Применение по п.20, где фармацевтическая композиция является активатором/модулятором PPARγ.
31. Способ снижения глюкозы в крови, включающий введение фармакологически эффективного количества соединения по любому из пп.1-8 или его фармакологически приемлемой соли теплокровному животному.
32. Способ активации PPARγ, включающий введение фармакологически эффективного количества соединения по любому из пп.1-8 или его фармакологически приемлемой соли теплокровному животному.
33. Способ улучшения метаболизма углеводов или липидов, ослабления симптоматики инсулинорезистентности, ингибирования воспаления или ингибирования роста раковых клеток, включающий введение фармакологически эффективного количества соединения по любому из пп.1-8 или его фармакологически приемлемой соли теплокровному животному.
34. Способ лечения и/или предупреждения заболевания, опосредованного рецептором, активируемым пероксисомным пролифератором PPARγ, включающий введение фармакологически эффективного количества соединения по любому из пп.1-8 или его фармакологически приемлемой соли теплокровному животному.
35. Способ по п.34, где указанным заболеванием является диабет.
36. Способ по п.34, где указанным заболеванием является диабет типа II.
37. Способ по п.34, где указанным заболеванием является заболевание, вызываемое метаболическим синдромом.
38. Способ по п.34, где указанным заболеванием является гипергликемия, гиперлипидемия, ожирение, нарушенная толерантность к глюкозе, инсулинорезистентность, нарушенная толерантность к глюкозе натощак, гипертензия, жирная печень, неалкогольный стеатогепатит, диабетические осложнения, артериосклероз, атеросклероз, гестационный сахарный диабет или синдром поликистоза яичников.
39. Способ по п.34, где указанным заболеванием является воспалительное заболевание, рак, остеопороз, инволюционный остеопороз, нейродегенеративное заболевание, болезнь Альцгеймера или гиперурикемия.
40. Способ по п.34, где указанным заболеванием является акне, солнечная эритема, псориаз, экзема, аллергическое заболевание, астма, пептическая язва, язвенный колит, болезнь Крона, болезнь коронарных артерий, артериосклероз, атеросклероз, диабетическая ретинопатия, диабетическая макулопатия, макулярный отек, диабетическая нефропатия, ишемическая болезнь сердца, цереброваскулярное нарушение, нарушение периферического кровообращения, аутоиммунное заболевание, панкреатит, кахексия, лейкоз, саркома или сухие глаза.
41. Способ по любому из пп.31-40, где указанным теплокровным животным является человек.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| RU 2003133744 A, 20.04.2005 | |||
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ТЕРАПЕВТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ ПРОИЗВОДНЫХ БЕНЗИМИДАЗОЛА | 1996 |
|
RU2125048C1 |
Авторы
Даты
2012-07-20—Публикация
2008-04-02—Подача