Настоящее изобретение относится к способам извлечения металлов из руд или концентратов мокрыми химическими способами и может быть использовано как для очистки отработанных растворов химического или гальванического никелирования от ионов никеля, кобальта, молибдена, вольфрама, ванадия, висмута, так и для извлечения этих металлов из других растворов промышленного производства, а также для изготовления порошков указанных металлов или их суспензий с использованием химических процессов. При этом целью данного способа является увеличение степени извлечения указанных металлов из растворов их солей.
Известен способ извлечения никеля из водных растворов, описанный в патенте РФ №2186136 (МКИ7 С22В 23/00, опубл. 2002.07.27). В соответствии с этим способом в качестве реагента для извлечения никеля используют CYANEX 272, активным компонентом которого является ди(2,4,4-триметилпентил) фосфиновая кислота. При этом извлечение никеля осуществляют экстракцией с использованием эстрагента CYANEX 272 6 при рН<10 и регулированием величины pH в процессе экстракции, а непосредственное извлечение осуществляют осаждением никеля в составе фосфорорганического соединения при pH 10.
Используемый в данном способе экстрагент CYANEX 272 обеспечивает извлечение из раствора соли металла в невысокой степени, т.к. извлечение металла осуществляется не за счет связывания его путем образования нового соединения, а за счет более высокого сродства соли этого металла к экстрагенту, как к растворителю этой соли. По этой причине степень извлечения металла из раствора его соли является не достаточно высокой.
Известен также способ извлечения никеля из отработанных щелочных растворов химического никелирования, описанный в патенте РФ №2023034 (МКИ5 С22В 20/00, опубл. 1994.11.15). В соответствии с этим способом аммиачно-карбонатный раствор, содержащий никель, нагревают до 70-80°С, добавляют в него при перемешивании раствор серы в водном растворе гидрооксида натрия или аммиака, затем отгоняют аммиак при 80°С до его остаточной концентрации в растворе 50-65 г/л и отделяют осадок, содержащий никель, фильтрованием.
В данном способе никель выделяют из раствора путем восстановления его до порошка металла, который нерастворим в воде и выпадает в осадок, а осадок отфильтровывают. При этом восстановление происходит за счет восстанавливающих свойств серы (S°), которую вводят в раствор. Для усиления процесса восстановления весь раствор подогревают. Однако сера (S°) обладает не очень высокой способностью к восстановлению, поэтому даже при подогревании никель, находящийся в растворе, восстанавливается далеко не весь и, естественно, далеко не весь выделяется из раствора.
Ближайшим из известных является способ извлечения никеля из отработанных кислых растворов химического никелирования, описанный в патенте РФ №2166552 (МКИ7 С22В 23/44, опубл. 2001.05.10). В соответствии с этим способом в отработанный кислый раствор химического никелирования, содержащий гипофос-фит натрия в мольном соотношении к ионам никеля 1:1, сначала вводят мелкодисперсный порошок никеля, а затем сухой карбонат натрия. При этом карбонат натрия вводят в раствор небольшими порциями при температуре 55-65°С, при pH 6-7.
В известном способе восстанавливающую активность гипофосфита натрия повышают за счет введения в раствор мелкодисперсного порошка никеля, который в условиях, создаваемых введением карбоната натрия и поддерживанием заданных температуры и pH среды, действует как катализатор восстановления никеля. Тем не менее, следует отметить, что и в этом случае восстанавливающая активность гипофосфита натрия увеличивается не очень сильно, поэтому выделение никеля из раствора и в этом случае происходит недостаточно полно.
Задачей данного изобретения является создание в водном растворе цветных металлов таких условий, при которых процесс восстановления находящихся в растворе ионов цветного металла, в частности никеля или кобальта, или молибдена, или вольфрама, или ванадия, или висмута будет значительно усилен, вследствие чего и степень преобразования этих ионов в металл, т.е. в нерастворимую форму, будет также значительно увеличена. В результате этого степень выделения цветного металла из раствора будет также значительно увеличена.
Поставленная задача решается тем, что, как и в известном, в предлагаемом способе извлечения цветных металлов, в частности никеля, кобальта, молибдена, вольфрама, ванадия и висмута из водного раствора, содержащего соль этих металлов. предварительно определяют содержание ионов никеля и гипофосфита натрия в этом растворе, после чего соотношение мольных концентраций ионов никеля в растворе и гипофосфита натрия доводят до величины больше чем 1:1 и создают в растворе условия, способствующие восстановлению находящихся в растворе ионов цветных металлов до нейтрального металла, а выпавший осадок цветных металлов отделяют фильтрованием.
В отличии от известного концентрацию ионов никеля в растворе доводят до величины 5-2 г/л, а для создания в растворе условий, способствующих восстановлению находящихся в растворе ионов цветных металлов до металла, в раствор вводят гидроксид аммония в количестве, при котором рН раствора станет равной 7,8-8,3, затем в раствор вводят гидроксид натрия в количестве, при котором его концентрация станет равной 150-400 г/л, после чего раствор выдерживают при комнатной температуре в течение 12-15 часов.
В оставшийся после извлечения цветных металлов раствор целесообразно добавить щелочь, например NaOH, и довести рН раствора до значения, равного, по меньшей мере 11, после чего в этот же раствор следует добавить треххлористое железо в количестве, превышающем мольную концентрацию содержащегося в этом растворе гипофосфита натрия, по меньшей мере, в 2 раза. После проведения этих операций из раствора выпадает осадок фосфита железа и раствор таким образом очищается от соединений фосфора.
Известно, что извлечение цветных металлов из водных растворов их солей осуществляется путем восстановления содержащихся в растворе ионов этих металлов до порошковых металлических частиц. При этом при осуществлении реакции восстановления в раствор помимо веществ-восстановителей добавляют и другие вещества, которые входят, например, в состав буферных смесей или являются стабилизаторами. При этом содержащиеся в водном растворе ионы цветных металлов, входящие в состав растворимой соли, в присутствии восстановителя реагируют с этими веществами, образовывая новые соединения, в том числе и комплексные, в составе которых ионы цветных металлов не реагируют с восстановителем и вследствие этого не восстанавливаются. Учитывая эти процессы, авторами изобретения был разработан и впервые реализован процесс восстановления ионов цветных металлов из растворов их солей, основанный на том, что в никельсодержащем растворе при выделении из него ионов никеля путем восстановления их до порошкообразного металла с последующим его осаждением при наличии в этом же растворе ионов Co2+, 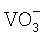 ,
, 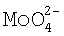 , Fe2+, Bi3+,
, Fe2+, Bi3+, 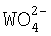 , и Sn2+ в присутствии ионов Bi3+ происходит восстановление и соосаждение металлов, входящих в указанный выше перечень. Кроме того, совместно с никелем соосаждаются также ионы Cu2+, Ag+, Sb3+, Pb2+, In3+, Cd2+, Ga3+, Zn2+ при заданном соотношении Ni - металл, обусловленном электродными потенциалами этих металлов. В соответствии с вышесказанным, извлечение цветных металлов из водных растворов их солей осуществляется, прежде всего, из никельсодержащих растворов. Поэтому в раствор, из которого извлекаются цветные металлы, обязательно должна быть введена растворимая соль никеля. При этом общий процесс восстановления ионов цветных металлов в растворе основывается на следующих более простых процессах. Во-первых, осуществляется разрушение всех образовавшихся в растворе комплексов никеля и создание в этом же растворе стабильных аммиакатных комплексов. Это обеспечивается введением в раствор гидроокиси аммония - NH4OH в количестве, при котором pH раствора станет равной 7,8-8,3. Затем осуществляется разрушение аммиакатных комплексов никеля, для чего в раствор вводится гидроксид натрия - NaOH -, в количестве 150-400 г/л или 4-10 моль/л. При этом авторами было впервые установлено, что в сильнощелочной среде в присутствии гидроксида натрия аммиакатные комплексы никеля разрушаются с появлением свободных ионов никеля. Свободные же ионы никеля взаимодействуют с восстановителем с образованием гипофосфита никеля. Одновременно происходит гидролиз свободного гипофосфита натрия и образование активного водорода, который взаимодействует с гидроксил ионами с появлением свободного электрона. Гидролиз гипофосфита никеля и наличие свободного электрона приводит к зародышеобразованию металлического никеля в объеме раствора. Дальнейший рост кристаллитов никеля протекает по механизму автокаталитической реакции. Размер кристаллита никеля определяется концентрацией остаточного никеля в растворе. При выдержке раствора в течение 10-12 часов кристаллиты никеля восстанавливают практически все ионы никеля из раствора. Количество остаточного никеля в растворе составляет 0,05-0,1% от исходной концентрации.
, и Sn2+ в присутствии ионов Bi3+ происходит восстановление и соосаждение металлов, входящих в указанный выше перечень. Кроме того, совместно с никелем соосаждаются также ионы Cu2+, Ag+, Sb3+, Pb2+, In3+, Cd2+, Ga3+, Zn2+ при заданном соотношении Ni - металл, обусловленном электродными потенциалами этих металлов. В соответствии с вышесказанным, извлечение цветных металлов из водных растворов их солей осуществляется, прежде всего, из никельсодержащих растворов. Поэтому в раствор, из которого извлекаются цветные металлы, обязательно должна быть введена растворимая соль никеля. При этом общий процесс восстановления ионов цветных металлов в растворе основывается на следующих более простых процессах. Во-первых, осуществляется разрушение всех образовавшихся в растворе комплексов никеля и создание в этом же растворе стабильных аммиакатных комплексов. Это обеспечивается введением в раствор гидроокиси аммония - NH4OH в количестве, при котором pH раствора станет равной 7,8-8,3. Затем осуществляется разрушение аммиакатных комплексов никеля, для чего в раствор вводится гидроксид натрия - NaOH -, в количестве 150-400 г/л или 4-10 моль/л. При этом авторами было впервые установлено, что в сильнощелочной среде в присутствии гидроксида натрия аммиакатные комплексы никеля разрушаются с появлением свободных ионов никеля. Свободные же ионы никеля взаимодействуют с восстановителем с образованием гипофосфита никеля. Одновременно происходит гидролиз свободного гипофосфита натрия и образование активного водорода, который взаимодействует с гидроксил ионами с появлением свободного электрона. Гидролиз гипофосфита никеля и наличие свободного электрона приводит к зародышеобразованию металлического никеля в объеме раствора. Дальнейший рост кристаллитов никеля протекает по механизму автокаталитической реакции. Размер кристаллита никеля определяется концентрацией остаточного никеля в растворе. При выдержке раствора в течение 10-12 часов кристаллиты никеля восстанавливают практически все ионы никеля из раствора. Количество остаточного никеля в растворе составляет 0,05-0,1% от исходной концентрации.
Выделение из раствора ионов других цветных металлов - Co, V, Mo, Fe, Bi, W, Sn, происходит за счет соосаждения их с никелем, как это показано в примерах.
Реализация данного способа в существующих на дату подачи заявки промышленных условиях подтверждается примерами.
Пример 1.
Объектом исследования является раствор химического никелирования, приготовленный по ГОСТ 9.305-84 и содержащий никель сернокислый (25 г/дм3), натрия гипофосфит (25 г/дм3), натрий уксуснокислый (15 г/дм3), кислоту аминоуксусную (20 г/дм3), свинец (II) сернистый (0,050 г/дм3). Концентрация никеля в отработанном растворе химического никелирования составляет 4038,0 мг/л. К 100 мл раствора добавляют водный раствор аммиака до рН=7,8-8,3 и 28,0 г гидроксида натрия. При этих условиях начинается процесс образования мелкодисперсного металлического никеля. Продолжительность реакции составляет около 12 часов. Концентрация никеля в растворе снижается до 26,30 мг/л. Концентрацию никеля определяют методом фотоколориметрии.
Пример 2.
Объектом исследования является раствор химического никелирования, приготовленный по ГОСТ 9.305-84, карта 32, содержащий никель сернокислый (25 г/дм3), натрия гипофосфит (20 г/дм3), тиомочевину (0,001 г/дм3), кислоту борную (15 г/дм3). кислоту молочную (45 г/дм3). Концентрация никеля в отработанном растворе химического никелирования составляет 4038,0 мг/л. К 100 мл раствора добавляют водный раствор аммиака до рН=7,8-8,3 и 38,0 г гидроксида натрия. При этих условиях начинается процесс образования мелкодисперсного металлического никеля. Продолжительность реакции составляет около 12 часов. Концентрация никеля в растворе снижается до 1,54 мг/л. Концентрацию никеля определяют методом фотоколориметрии.
Пример 3.
Объектом исследования является раствор химического никелирования, приготовленный по ГОСТ 9.305-84, карта 32, состоящий из никеля сернокислого (30 г/дм3). натрия гипофосфита (20 г/дм3), аммония хлористого (45 г/дм3), натрия лимоннокислого трехзамещенного (45 г/дм3). Концентрация никеля в отработанном растворе химического никелирования составляет 4710,0 мг/л. К 100 мл раствора добавляют водный раствор аммиака до рН=7,8-8,3 и 16,0 г гидроксида натрия. При этих условиях начинается процесс образования мелкодисперсного металлического никеля. Продолжительность реакции составляет около 12 часов. Концентрация никеля в растворе снижается до 2,38 мг/л. Концентрацию никеля определяют методом фотоколориметрии.
Пример 4.
Объектом исследования является раствор химического никелирования, приготовленный по ГОСТ 9.305-84, карта 32, состоящий из никеля сернокислого (25 г/дм3), натрия гипофосфита (20 г/дм3), натрия уксуснокислого (13 г/дм3), тиомочевины (0,002 г/дм3), кислоты уксусной (8 г/дм3). Концентрация никеля в отработанном растворе химического никелирования составляет 4038,0 мг/л. К 100 мл раствора добавляют водный раствор аммиака до рН=7,8-8,3 и 36,0 г гидроксида натрия. При этих условиях начинается процесс образования мелкодисперсного металлического никеля. Продолжительность реакции составляет около 12 часов. Концентрация никеля в растворе снижается до 1,20 мг/л. Концентрацию никеля определяют методом фотоколориметрии.
Пример 5.
Объектом исследования является раствор гальванического никелирования, приготовленный по ГОСТ 9.305-84, карта 35, состоящий из никеля сернокислого (200 г/дм3), натрия хлористого (15 г/дм3), кислоты борной (30 г/дм3). Отработанный раствор гальванического никелирования разбавляют деионизованной водой до концентрации никеля сернокислого 3140,7 мг/л. К 100 мл полученного растворяют 4,2 г гипофосфита натрия, после чего добавляют водный раствор аммиака до рН=7,8-8,3 и 20,0 г гидроксида натрия. При этих условиях начинается процесс образования мелкодисперсного металлического никеля. Продолжительность реакции составляет около 1 часа. Концентрация никеля в растворе снижается до 18,20 мг/л.
Для соосаждения металлов использовали раствор гальванического никелирования, приготовленный по ГОСТ 9.305-84, карта 35, состоящий из никеля серно-кислого (200 г/дм3), натрия хлористого (15 г/дм3), кислоты борной (30 г/дм3). Отработанный раствор гальванического никелирования разбавляли деионизованной водой до концентрации 3140,7 мг/л, добавляли восстановитель - гипофосфит натрия, растворяли в данном растворе соли металлов Co, Pe, Mo, V, Bi и подвергали раствор двухстадийному выщелачиванию.
Пример 6.
Объектом исследования является раствор гальванического никелирования, приготовленный по ГОСТ 9.305-84, карта 35, состоящий из никеля сернокислого (200 г/дм3), натрия хлористого (15 г/дм3), кислоты борной (30 г/дм3). Отработанный раствор гальванического никелирования разбавляют деионизованной водой до концентрации никеля сернокислого 3140,7 мг/л. В 100 мл полученного раствора растворяют 4,2 г гипофосфита, натрия, после чего в полученный раствор вводят 10, 20, 40% Co в виде кобальта хлористого 6-водного и затем добавляют водный раствор аммиака до рН раствора 7,8-8,3 и 20,0 г гидроксида натрия. При этих условиях происходит образование осадков, содержащих Ni и Co. Продолжительность реакции составляет около 1 часа.
Наличие ионов Co2+ в очищенном растворе определяют посредством проведения качественной реакции ионов кобальта с тиоцианат-ионами. Катионы Co2+ в слабо кислой среде реагируют с тиоцианат-ионами NCS- с образованием синего комплекса - тетратиоцианатокобальтат(II)-иона: Co2++4NCS-↔[Co(NCS)4]2+. В пробирку вносят 2-3 капли анализируемого раствора, прибавляют несколько капель соляной кислоты до рН=5-6,8-10 капель насыщенного раствора тиоцианата калия и 5-6 капель органического растворителя (изоамилового эфира) и встряхивают смесь. Окрашивание верхнего органического слоя в синий цвет не наблюдается, что свидетельствует об отсутствии ионов Со2+ в растворе.
Пример 7.
Объектом исследования является раствор гальванического никелирования, приготовленный по ГОСТ 9.305-84, карта 35, состоящий из никеля сернокислого (200 г/дм3), натрия хлористого (15 г/дм3), кислоты борной (30 г/дм3). Этот раствор разбавляют деионизованной водой до концентрации в нем никеля 3140,7 мг/л. В 100 мл полученного раствора растворяют 4,2 г гипофосфита натрия, затем в раствор вводят 10, 20, 40% V в виде метаванадата аммония, после чего добавляют водный раствор аммиака до рН раствора 7,8-8,3 и 20,0 г гидроксида натрия. В данных условиях происходит образование осадков, металлический никель и ванадий. Продолжительность реакции составляет около 1 часа.
Наличие ионов 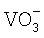 в очищенном растворе определяют действием перекиси водорода. В присутствии ионов
в очищенном растворе определяют действием перекиси водорода. В присутствии ионов 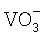 вследствие образования надванадиевой кислоты появляется красно-розовая окраска:
вследствие образования надванадиевой кислоты появляется красно-розовая окраска:
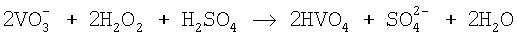 .
.
На фарфоровой пластинке смешивают каплю анализируемого раствора с каплей серной кислоты и спустя минуту прибавляют каплю перекиси водорода. Отсутствие изменения окраски свидетельствует об отсутствии ионов 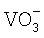 в растворе.
в растворе.
Пример 8.
Объектом исследования является раствор гальванического никелирования, приготовленный по ГОСТ 9.305-84, карта 35, содержащий никель сернокислый (200 г/дм3), натрий хлористый (15 г/дм3), кислоту борную (30 г/дм3). Отработанный раствор разбавляют деионизованной водой до концентрации никеля сернокислого 3140,7 мг/л, а затем в 100 мл этого раствора растворяют 4,2 г гипофосфита натрия. В полученный раствор вводят 10, 20, 40% Mo в виде аммония молибденовокислого, добавляют водный раствор аммиака до рН раствора 7,8-8,3 и 20,0 г гидроксида натрия. В данных условиях происходит образование осадка, содержащего металлические никель и молибден, причем интенсивность осаждения имеет параболическую зависимость от концентрации молибдена. Продолжительность реакции составляет около 1 часа.
Наличие ионов 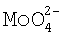 в очищенном растворе определяют посредством проведения качественной реакции ионов
в очищенном растворе определяют посредством проведения качественной реакции ионов 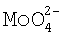 с гидрофосфатами. Ионы
с гидрофосфатами. Ионы 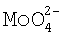 в присутствии гидрофостфат-ионов в азотнокислой среде образуют желтый кристаллический осадок фосфоромолибдата аммония: 12(NH4)2MoO4+Na2HPO4+23HNO3→(NH4)3H4[P(Mo2O7)6]↓+2NaNO3+10H2O+21NH4NO3.
в присутствии гидрофостфат-ионов в азотнокислой среде образуют желтый кристаллический осадок фосфоромолибдата аммония: 12(NH4)2MoO4+Na2HPO4+23HNO3→(NH4)3H4[P(Mo2O7)6]↓+2NaNO3+10H2O+21NH4NO3.
В пробирку помещают 3-4 капли анализируемого раствора, прибавляют несколько капель соляной кислоты до pH=7, добавляют 5-6 капель азотной кислоты и 2-3 капли раствора гидрофосфата натрия. Содержимое пробирки встряхивают. Образование осадка не наблюдается, что свидетельствует об отсутствии в растворе ионов 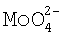 .
.
Пример 9.
Объектом исследования является раствор гальванического никелирования, приготовленный по ГОСТ 9.305-84, карта 35, состоящий из никеля сернокислого (200 г/дм3), натрия хлористого (15 г/дм3), кислоты борной (30 г/дм3). Отработанный раствор гальванического никелирования разбавляют деионизованной водой до концентрации в нем никеля сернокислого 3140,7 мг/л. В 100 мл полученного раствора растворяют 4,2 г гипофосфита натрия и затем вводят в него 10, 20, 30, 40% Fe в виде железа(II) сернокислого 7-водного, после чего добавляют водный раствор аммиака до рН раствора 7,8-8,3 и 20,0 г гидроксида натрия. В данных условиях при концентрации железа 10-30% происходит образование осадка. Продолжительность реакции составляет около 1 часа.
Наличие ионов Fe2+ в очищенном растворе определяют посредством проведения качественной реакции ионов железа(II) с гексацианоферратом(III) калия. При наличии ионов железа(II) образуется темно-синий осадок либо синий раствор турнбулевой сини: 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓. В пробирку помещают 1 мл анализируемого раствора, приливают 0,5 мл 2н раствора соляной кислоты, затем 5 -6 капель раствора гексацианоферрата(III) калия и встряхивают. Отсутствие синего окрашивания и выпадение осадка свидетельствует об отсутствии ионов железа(II) в растворе.
Пример 10.
Объектом исследования является раствор гальванического никелирования, приготовленный по ГОСТ 9.305-84, карта 35, состоящий из никеля сернокислого (200 г/дм3), натрия хлористого (15 г/дм3), кислоты борной (30 г/дм3). Отработанный раствор гальванического никелирования разбавляют деионизованной водой до концентрации 3140,7 мг/л, в 100 мл которого растворяют 4,2 г гипофосфита натрия. В полученный раствор вводят 5, 10, 15, 20% Fe в виде железа(II) сернокислого 7-водного и кобальт (Co) в виде кобальта двухлористого 6-водного при мольном соотношении железо(II) сернокислое 7-водное: кобальт двухлористый 6-водный, равном 1:1, добавляют водный раствор аммиака до рН раствора 7,8-8,3 и 20,0 г гидроксида натрия. В данных условиях происходит образование осадков, содержащих металлические никель, кобальт и железо. Продолжительность реакции составляет около 1 часа.
Наличие ионов Fe2+ и Co2+ в очищенном растворе определяют посредством проведения качественных реакций, описанных в примерах 7 и 10.
Пример 11.
Объектом исследования является раствор гальванического никелирования. приготовленный по ГОСТ 9.305-84, карта 35, состоящий из никеля сернокислого (200 г/дм3), натрия хлористого (15 г/дм3), кислоты борной (30 г/дм3). Отработанный раствор гальванического никелирования разбавляют деионизованной водой до концентрации 3140,7 мг/л, в 100 мл которого растворяют 4,2 г гипофосфита натрия. В полученный раствор вводят 10, 20, 40% Bi в виде висмута(III) сернокислого 3-водного в пересчете на металлический никель, добавляют водный раствор аммиака до pH раствора 7,8-8,3 и 20,0 г гидроксида натрия. В данных условиях происходит образование осадков. Продолжительность реакции составляет 30 минут.
Наличие ионов Bi3+ в очищенном растворе определяют посредством проведения качественной реакции с иодидами. При добавлении растворов иодидов к солянокислым растворам Bi(III) выпадает черный осадок иодида висмута, растворимый в избытке реагента с образованием желто-оранжевого раствора, содержащего тетраиодовисмутат(III)-ионы: [BiCl6]3-+3I-→BiI3+6Cl-
BiI3+I-=[BiI4]-.
В пробирку вносят 5 капель анализируемого раствора, добавляют 10 капель соляной кислоты и прибавляют по каплям раствор иодида калия. Образование осадка не наблюдается, что свидетельствует об отсутствии ионов висмута в растворе.
Пример 12.
Объектом исследования является раствор гальванического никелирования, приготовленный по ГОСТ 9.305-84, карта 35, состоящий из никеля сернокислого (200 г/дм3), натрия хлористого (15 г/дм3), кислоты борной (30 г/дм3). Отработанный раствор гальванического никелирования разбавляют деионизованной водой до концентрации 3140,7 мг/л, в 100 мл которого растворяют 4,2 г гипофосфита натрия. В полученный раствор вводят 10, 20, 40% Bi в виде висмута(III) сернокислого 3-водного в пересчете на металлический никель и Sn в виде олова двухлористого 2-водного при мольном соотношении висмут(III) сернокислый 3-водный: олово двухлористое 2-водное, равном 1:1, добавляют водный раствор аммиака до pH раствора 7,8-8,3 и 20,0 г гидроксида натрия. В данных условиях происходит бурное выделение черных осадков, содержащих металлические никель, висмут и олово. Продолжительность реакции составляет 10 минут.
Растворы, очищенные от ионов никеля и ионов металла, очищали от соединений фосфора путем добавления раствора треххлористого железа.
Пример 13.
Объектом исследования является раствор гальванического никелирования, приготовленный по ГОСТ 9.305-84, карта 35, состоящий из никеля сернокислого (200 г/дм3), натрия хлористого (15 г/дм3), кислоты борной (30 г/дм3). Отработанный раствор гальванического никелирования разбавляли деионизованной водой до концентрации в нем никеля сернокислого 3140,7 мг/л. Затем в 100 мл полученного раствора растворяли 4,2 г гипофосфита натрия, добавляли водный раствор аммиака до рН=7,8-8,3 и 20,0 г гидроксида натрия. При этих условиях начинается процесс образования мелкодисперсного металла. Продолжительность реакции составляет около 1 часа. Затем раствор отделяют от осадков методом фильтрации. К полученному раствору добавляют железо треххлористое в мольном соотношении фосфит натрия: железо треххлористое, равном 2:1. В данных условиях происходит выпадение осадка фосфита железа.
Изобретение относится к способу извлечения цветных металлов из водных растворов их солей и может быть использовано как для очистки отработанных растворов химического или гальванического никелирования от ионов никеля, кобальта, молибдена, вольфрама, ванадия висмута, так и для извлечения этих металлов из других растворов промышленного производства, а также для изготовления порошков указанных металлов или их суспензий. Техническим результатом изобретения является увеличение степени выделения цветного металла из раствора. Способ включает извлечение цветных металлов из водных растворов, содержащих гипофосфит натрия и ионы никеля, доведением соотношения мольных концентраций ионов никеля и гипофосфита натрия до величины, большей чем 1:1, концентрации ионов никеля в растворе до величины 5-2 г/л. Создают условия, способствующие восстановлению находящихся в растворе ионов цветных металлов до свободных металлов введением в раствор гидроксида аммония до рН раствора, равного 7,8-8,3. Затем вводят в раствор гидроксид натрия до концентрации, равной 150-400 г/л, и выдерживают при комнатной температуре в течение 12-15 часов с выпадением цветных металлов в осадок, который отделяют фильтрованием. Затем ведут очистку раствора от фосфора. 1 з.п. ф-лы.
1. Способ извлечения цветных металлов из водных растворов их солей, содержащих гипофосфит натрия и ионы никеля, характеризующийся тем, что доводят соотношение мольных концентраций ионов никеля и гипофосфита натрия до величины, большей чем 1:1, концентрацию ионов никеля в растворе до величины 5-2 г/л и создают условия, способствующие восстановлению находящихся в растворе ионов цветных металлов до свободных металлов введением в раствор гидроксида аммония до pH раствора, равного 7,8-8,3, с последующим введением в раствор гидроксида натрия до концентрации, равной 150-400 г/л, и выдержкой при комнатной температуре в течение 12-15 ч с выпадением цветных металлов в осадок, который отделяют фильтрованием.
2. Способ по п.1, в котором в оставшийся после отделения осадка цветных металлов раствор добавляют щелочь и доводят pH раствора до значения, равного по меньшей мере 11, и вводят треххлористое железо в количестве, превышающем мольную концентрацию содержащегося в растворе гипофосфита натрия по меньшей мере в 2 раза, для очистки раствора от фосфора.
| СПОСОБ ИЗВЛЕЧЕНИЯ НИКЕЛЯ ИЗ ОТРАБОТАННЫХ КИСЛЫХ РАСТВОРОВ ХИМИЧЕСКОГО НИКЕЛИРОВАНИЯ | 1998 |
|
RU2166552C2 |
| Способ выделения никеля из отработанных растворов химического никелирования | 1989 |
|
SU1673616A1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ КОРМОВ ДЛЯ РЫБ | 2007 |
|
RU2346458C1 |
| Складывающаяся аэродинамическая поверхность | 1983 |
|
SU1692079A1 |
| СПОСОБ ПОЛУЧЕНИЯ ТЕРМОСТОЙКИХ ПОЛУПРОВОДНИКОВЫХ ПОЛИМЕРОВ | 0 |
|
SU134859A1 |
| US 6712874 B1, 30.03.2004 | |||
| JP 2007077459 A, 29.03.2007. | |||
Авторы
Даты
2009-11-20—Публикация
2007-04-16—Подача