Изобретение относится к химии фосфорорганических соединений, а именно к новому способу получения N,N-диалкил,N'-ацил-(ацилдиалкоксифосфорил)этанамидинов общей формулы
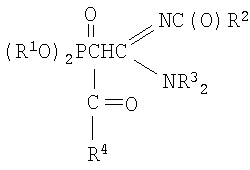
где R1=С3-С4- алкил или изоалкил;
R2=СН3, С6Н5; R3=С2-С3 - алкил; R4=СН3, С6Н5;
которые являются новыми по структуре фосфорорганическими соединениями и могут служить для получения потенциально биологически активных соединений для нужд медицины и сельского хозяйства.
Имеется большое число публикаций, подтверждающих различные виды биологической активности у соединений, содержащих в своей структуре амидиновый фрагмент. Например, в обзоре Patai S. «The chemistry of Amidines and Imidates», изданном в Лондоне в 1975 году, стр.262-269, перечислены различные структуры замещенных и незамещенных амидинов, проявивших высокую антивирусную, антибактериальную, противораковую и другие виды активностей. Заявленные в изобретении С-фосфорилированные амидины также содержат амидиновый фрагмент, как в вышеприведенной ссылке [Patai S. The chemistry ofAmidines and Imidates. - Intrscience: London, 1975. - p.262-269], и можно ожидать, что синтезированные нами соединения обладают этими видами активностей. Кроме того, введение фосфорильной группы добавляет антихолинэстеразные свойства соединениям [Кабачник М.И. Фосфорорганические вещества.- М.: Знание, 1967. - с.14-17]. Имеются также данные, что соединения, содержащие фосфорильный фрагмент, обладают инсектицидной, гербицидной и фунгицидной активностью, полезной для сельскогохозяйства [Пурдела Д., Вылчану Р. Химия органических соединений фосфора. - М.: Химия, 1972. - с.557-565].
Известно ацилирование нитрилов диалкоксифосфорилуксусных кислот галогенангидридами кислот. Ацилированию подвергали их калиевые производные, так как натриевые и этоксимагниевые производные не дали результатов [Кирилов М., Петров Г. // Докл. Болг. АН, 1965, 18, С.331-334]. Недостатками данного метода являются невысокие выходы (менее 40%) целевых соединений, а использование калиевых производных делает процесс пожаро- и взрывоопасным. А также в результате получают соединения иной структуры, чем в предлагаемом изобретении.
Задачей предлагаемого изобретения является разработка нового технологичного малостадийного метода синтеза N,N-диалкил,N'-ацил-(ацилдиалкоксифосфорил)этанамидинов.
Техническим результатом является расширение арсенала химических соединений, получение новых N,N-диалкил,N'-ацил-(ацилдиалкоксифосфорил)этанамидинов с высоким выходом 80-86%.
Поставленный технический результат достигается разработкой нового способа получения N,N-диалкил,N'-ацил-(ацилдиалкоксифосфорил)-этанамидинов формулы
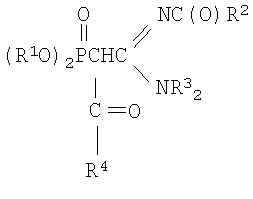
где R1=С3-С4- алкил или изоалкил;
R2=СН3, С6Н5; R3=С2-С3 - алкил; R4=СН3, С6H5;
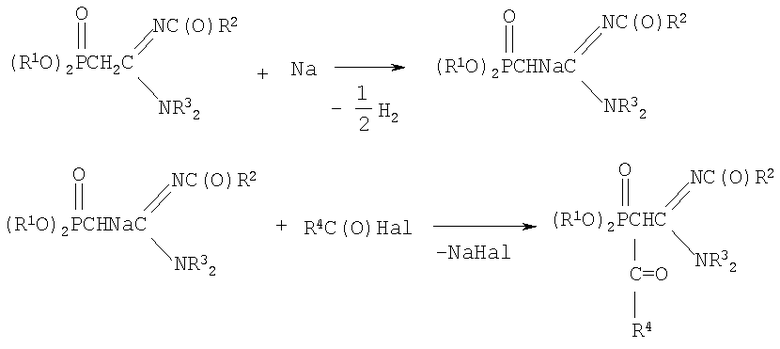
заключающийся в получении натриевых производных С-фосфорилированных ацетамидинов путем взаимодействия С-фосфорилированных ацетамидинов с натрием с последующим ацилированием полученного натриевого производного галогенангидридами кислот, такими как бромистый или хлористый ацетил и хлористый бензоил, в среде диоксана при мольном соотношении натрий: С-фосфорилированный ацетамидин: галогенангидрид = 1:1:1÷1.1 соответственно и температуре 20÷50°С.
Химическая схема предложенного способа получения N,N-диалкил,N'-ацил-(ацилдиалкоксифосфорил)этанамидинов:
Реакции ацилирования сводятся к нуклеофильному замещению галогена в молекуле галогенангидрида, причем в качестве нуклеофильного реагента выступает анион СН-кислотного соединения. На основании изучения литературных данных можно утверждать, что реакция ацилирования натриевых производных С-фосфорилированных ацетамидинов протекает по механизму SN2. В галогенангидридах кислот на атоме углерода карбонильной группы имеется большой дефицит электронной плотности, обусловленный электроноакцепторным воздействием атома кислорода и атома галогена. Анион натриевого производного амидина можно рассматривать как амбидентный анион, в котором местом с наибольшей нуклеофильной реакционной способностью является атом углерода метиновой группы, а местом наибольшей электронной плотности - атом кислорода фосфорильной группы и атом азота иминогруппы. Принимая во внимание все вышесказанное, механизм взаимодействия галогенангидридов с Na-производными С-фосфорилированных ацетамидинов можно представить следующим образом:
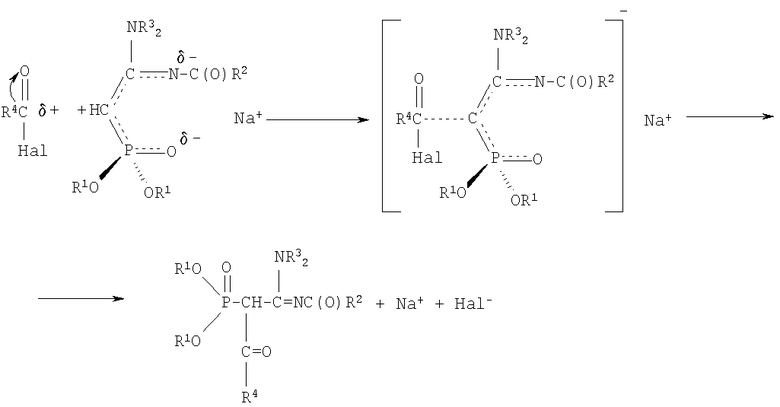
При выборе растворителя для проведения реакций ацилирования следует принять во внимание, что при использовании неполярных или малополярных растворителей натриевое производное существует в виде ионных пар, причем ион натрия координируется по местам с наибольшей электронной плотностью. Натриевому производному С-фосфорилированного ацетамидина правильнее приписывать структуру, согласно которой ион натрия координирован одновременно по атому кислорода фосфорильной группы и атому азота иминогруппы - местам с наибольшей электронной плотностью, а не по какому-либо одному из них или по атому углерода:
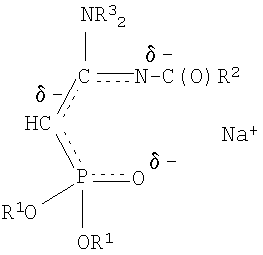
В этих условиях ион натрия экранирует атом кислорода фосфорильной группы и атом азота иминогруппы и реакция ацилирования протекает в основном по атому углерода метиновой группы. Если же использовать апротонные полярные растворители, такие как диметилформамид или диметилсульфоксид, то их молекулы будут сольватировать ион натрия, разъединять ионные пары и тем самым благоприятствовать протеканию реакции по местам с наибольшей электронной плотностью - атомам кислорода и азота, что приведет к смеси продуктов.
В этих реакциях наибольший выход продуктов С-ацилирования отмечен при использовании в качестве растворителей диэтилового эфира и диоксана. Так как натриевые производные ацетамидинов малорастворимы в диэтиловом эфире, реакции ацилирования проводили в среде безводного диоксана.
В начальный момент взаимодействия нет необходимости в дополнительном нагреве, так как реакция начинается самопроизвольно даже при комнатной температуре. Затем для ускорения реакций ацилирования реакционную массу нагревали до 50°С.
Использование в данном процессе избытка до 10% ацилирующего агента, по сравнению со стехиометрическим количеством, необходимо из-за частичного уноса этого реагента, что обусловлено высокой летучестью галогенангидридов. Предложенный метод получения N,N-диалкил,N'-ацил-(ацилдиалкоксифосфорил)этанамидинов характеризуется простотой эксперимента, не требует выделения промежуточного натриевого производного, осуществляется в достаточно мягких условиях и обеспечивает высокий (более 80%) выход целевых соединений.
Способ осуществляется следующим образом.
Синтез натриевых производных С-фосфорилированных ацетамидинов осуществляют прибавлением к С-фосфорилированному ацетамидину, растворенному в осушенном диоксане, эквимольного количества мелкодиспергированного натрия при перемешивании и температуре 20÷30°С. Процесс проводят до полного превращения натрия, что легко контролируется визуально. Так как выход натриевого производного является количественным, то ацилирование проводят без выделения последнего. Для этого в реакционную массу, полученную вышеописанным способом, при перемешивании и температуре 20÷30°С добавляют по каплям расчетное количество галогенангидрида в диоксане. Для завершения процесса ацилирования рекомендуется постепенное повышение температуры реакционной смеси до 50°С к концу процесса. Для выделения целевого вещества реакционную массу охлаждают до температуры 20÷30°С, галогенид натрия отделяют фильтрацией, растворитель удаляют отгонкой в вакууме (при 15-30 гПа), остаток вакуумируют в течение 1 часа при 50°С и 1÷3 гПа. Выход составил более 80%. Для получения химически чистых соединений осуществляли дополнительную очистку полученных соединений методом колоночной адсорбционной хроматографии на силикагеле марки µLC 5/40. Идентификацию синтезированных соединений проводили по данным элементного анализа, молекулярной рефракции, определения молекулярной массы, ИК- и ПМР-спектроскопии. Для лучшего понимания сущности предложенного технического решения приводятся конкретные примеры синтезов.
Пример 1
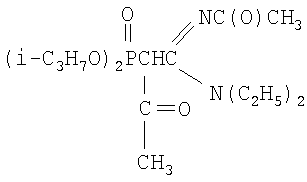
N,N-диэтил,N'-ацетил-(ацетилдибутоксифосфорил)-этанамидин
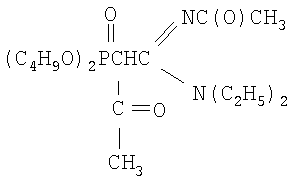
К раствору 2.08 г (0.0060 моль) N,N-диэтил-N'-ацетил-(дибутоксифосфорил)ацетамидина в 4 мл сухого диоксана при перемешивании и температуре 20÷30°С прибавляют небольшими порциями 0.14 г (0.0060 моль) натрия. Реакционную массу перемешивают до полного исчезновения натрия. К раствору полученного натриевого производного ацетамидина при перемешивании и температуре 20-30°С добавляют по каплям 0.81 г (0.0066 моль, 10% изб. мольн.) бромистого ацетила в 2 мл диоксана. Температуру реакционной массы повышают до 50°С и перемешивают в течение 1 часа. Соль бромида натрия отделяют фильтрацией, растворитель удаляют отгонкой в вакууме (при 15-20 гПа), остаток вакуумируют в течение 1 часа при 50°С и 2-4 гПа. Получают 2.0 г N,N-диэтил-N'-ацетил-(ацетилдибутоксифосфорил) этанамидина. Выход 86%. nD 20 1.4624, d4 20 1.1039. MRD 97.07, выч. 96.18. Найдено, %: N 7.39, Р 8.23. С18Н35O5N2P. Вычислено, %: N 7.19, Р 7.95.
Спектр ЯМР 1H (CCl4), м.д.: 0.89 т (12Н, СН3); 1.28 м (8Н, CH2); 1.89 с (3Н,СН3С(O)); 1.96 с (3Н,СН3С(O)); 2.83 д (1Н, СНР); 3.24 к (4Н, NCH2); 3.98 м (4Н, CH2OP); ИК-спектр, ν, см-1: 986-1061 (РОС); 1242 (Р=O); 1673 (C=N); 1725, 1730 (С=O).
Пример 2
N,N-дипропил-N'-ацетил-(ацетилдибутоксифосфорил)-этанамидин
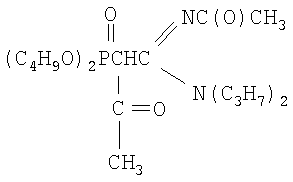
К раствору натриевого производного, приготовленного из 2.62 г (0.0069 моль) N,N-дипропил-N'-ацетил-(дибутоксифосфорил) ацетамидина и 0.16 г (0.0069 моль) натрия (по методике из примера 1) в диоксане (5 мл), при перемешивании и температуре 20÷30°С добавляют по каплям 0.59 г (0.0076 моль, 10% изб. мольн.) хлористого ацетила в 2 мл диоксана. Реакционную массу перемешивают в течение 3 часов при 50°С. Соль хлорида натрия отделяют фильтрацией, растворитель удаляют отгонкой в вакууме (при 15-20 гПа), остаток вакуумируют в течение 1 часа при 50°С и 2-4 гПа. Получают 2.42 г N,N-дипропил-N'-ацетил-(ацетилдибутоксифосфорил)этанамидина. Выход 84%. nD 20 1.4697, d4 20 1.0943. MRD, 106.51 выч. 105.48. Найдено, %: N 6.40, Р 7.19. С20Н39O5N2P. Вычислено, %: N 6.69, Р 7.39.
Спектр ЯМР 1Н (CCl4), м.д.: 0.89 т (12Н, СН3); 1.38 м (8Н, СН2); 1.88 с (3Н, СН3С(О)); 1.93 с (3Н, СН3С(О)); 2.76 д (1Н, СНР); 3.12 т (4Н, NСН2); 3.92 м (4Н, СН2OР); ИК-спектр, ν, см-1: 982-1060 (РОС); 1248 (Р=O); 1678 (C=N); 1720, 1730 (C=O).
Пример 3
N,N-дипропил-N'-бензоил-(ацетилдибутоксифосфорил)-этанамидин
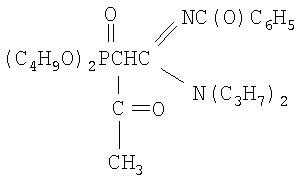
К раствору натриевого производного, приготовленного из 2.50 г (0.0057 моль) N,N-дипропил-N'-бензоил-(дибутоксифосфорил)ацетамидина и 0.13 г (0.0057 моль) натрия (по методике из примера 1) в диоксане (5 мл), при перемешивании и температуре 20÷30°С добавляют по каплям 0.49 г (0.0063 моль, 10% изб. мольн.) хлористого ацетила в 2 мл диоксана. Реакционную массу перемешивают в течение 3 часов при 50°С. Соль хлорида натрия отделяют фильтрацией, растворитель удаляют отгонкой в вакууме (при 15-20 гПа), остаток вакуумируют в течение 1 часа при 50°С и 2-4 гПа. Получают 2.27 г N,N-дипропил-N'-бензоил-(ацетилдибутоксифосфорил)этанамидина. Выход 83%. nD 20 1.5029, d4 20 1.0738. MRD, 132.12, выч. 131.66. Найдено, %: N 5.64, Р 6.31. C25H41O5N2P. Вычислено, %: N 5.83, Р 6.44.
Спектр ЯМР 1Н (CCl4), м.д.: 0.76 т (12Н, СН3); 1.26 м (12Н, СH2); 1.88 с (3Н, СН3С(О)); 2.77 д (1Н, СНР); 3.46 т (4Н, NCH2); 3.75 м (4Н, СН2OР); 7.33 м (5Н,С6Н5);
ИК-спектр, ν, см-1: 982-1058 (РОС); 1246 (Р=O); 1666 (C=N); 1725, 1732 (С=O);1600(С-Сар).
Пример 4
N,N-диэтил-N'-ацетил-(ацетилдиизопропоксифосфорил)этанамидин
К раствору натриевого производного, приготовленного из 1.96 г (0.0061 моль) N,N-диэтил-N'-ацетил-(диизопропоксифосфорил)ацетамидина и 0.141 г (0.0061 моль) натрия (по методике из примера 1) в диоксане (5 мл), при перемешивании и температуре 20÷30°С добавляют по каплям 0.48 г (0.0061 моль) хлористого ацетила в 5 мл абсолютного диоксана. Реакционную массу перемешивают в течение 3 часов при 50°С. Соль хлорида натрия отделяют фильтрацией, растворитель удаляют отгонкой в вакууме (при 15-20 гПа), остаток вакуумируют в течение 1 часа при 50°С и 2-4 гПа. Получают 1.63 г N,N-диэтил-N'-ацетил-(ацетилдиизопропоксифосфорил)этанамидина. Выход 84%. nD 20 1.4678, d4 201.0724, MRD 93.80, выч. 93.42. Найдено, %: N 7.91, Р 8.36.
C16H31O5N2P. Вычислено, %: N 7.73, Р 8.56.
Спектр ЯМР 1H (CCl4), м.д.: 1.13 т (6Н, СН3); 1.25 д (12Н, СН3); 1.89 с (3Н, СН3С(О)); 1.97 с (3Н, СН3С(О)); 2.77 д (1Н, СНР); 3.25 к (4Н, NCH2); 4.65 м (2Н, CHOP);
ИК-спектр, ν, см-1: 988-1058 (РОС); 1240 (Р=O); 1672 (C=N); 1725, 1730 (С=O).
Пример 5
N,N-диэтил-N'-ацетил-(бензоилдиизопропоксифосфорил)этанамидин
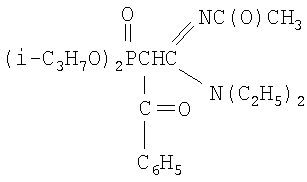
К раствору натриевого производного, приготовленного из 2.08 г (0.0065 моль) N,N-диэтил-N'-ацетил-(дибутоксифосфорил)ацетамидина и 0.15 г (0.0065 моль) натрия (по методике из примера 1) в диоксане (4 мл), при перемешивании и температуре 20÷30°С добавляют по каплям 0.91 г (0.0065 моль) хлористого бензоила в 2 мл диоксана. Реакционную массу перемешивают в течение 6 часов при 50°С. Соль хлорида натрия отделяют фильтрацией, растворитель удаляют отгонкой в вакууме (при 15-20 гПа), остаток вакуумируют в течение 1 часа при 50°С и 2-4 гПа. Получают 2.5 г N,N-диэтил-N'-ацетил-(бензоилдиизопропоксифосфорил)этанамидина. Выход 80%. nD 201.4987, d4 20 1.0997. MRD 113.88, выч. 112.90. Найдено, %: N 6.39, Р 7.54. C21H33O5N2P. Вычислено, %: N 6.60, Р 7.31.
Спектр ЯМР 1Н (ССl4), м.д.: 1.12 т (6Н, СН3); 1.24 д (12Н, СН3); 1.96 с (3Н, СН3С(О)); 2.80 д (1Н,СНР); 3.23 к (4Н,NСН2); 4.67 м (2Н, РОСН); 7.35 м (5Н, С6Н5); ИК-спектр, ν, см-1: 988-1060 (РОС); 1240 (Р=O); 1668 (C=N); 1722, 1730 (C=O).
Предложенный метод заключается во взаимодействии С-фосфорилированных ацетамидинов с натрием с образованием натриевых производных, которые не выделяются из реакционной смеси, а подвергаются сразу же ацилированию с образованием N,N-диалкил,N'-ацил-(ацилдиалкоксифосфорил)этанамидинов, что оказалось возможным вследствие высоких СН-кислотных свойств активированной метиленовой группы исходных ацетамидинов. Достоинством разработанного метода является простота технологии и универсальность.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ С-ФОСФОРИЛИРОВАННЫХ АЛКИЛАМИДИНОВ | 2007 |
|
RU2334752C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ЗАМЕЩЕННЫХ (2-ДИАЛКОКСИФОСФОРИЛ-4-ЦИАНО)БУТАНАМИДИНОВ | 2009 |
|
RU2385870C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ЗАМЕЩЕННЫХ (2-БЕНЗОЛСУЛЬФОНИЛ-2-ДИАЛКОКСИФОСФОРИЛ)АЦЕТАМИДИНОВ | 2013 |
|
RU2529199C1 |
| С-ФОСФОРИЛИРОВАННЫЕ АЦЕТАМИДИНЫ, СОДЕРЖАЩИЕ РЕАКЦИОННОСПОСОБНУЮ СН-КИСЛОТНУЮ МЕТИЛЕНОВУЮ ГРУППУ, В КАЧЕСТВЕ ИСХОДНЫХ СОЕДИНЕНИЙ ДЛЯ ПОЛУЧЕНИЯ БРОМПРОИЗВОДНЫХ С-ФОСФОРИЛИРОВАННЫХ АЦЕТАМИДИНОВ | 2007 |
|
RU2334753C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ЗАМЕЩЕННЫХ БИС[ДИАЛКОКСИФОСФОРИЛ]АЦЕТАМИДИНОВ | 2009 |
|
RU2415861C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ЗАМЕЩЕННЫХ АЛКИЛ-(2-ДИАЛКОКСИФОСФОРИЛ)АЛКИЛИМИДАТОВ | 2001 |
|
RU2203284C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ЗАМЕЩЕННЫХ (2-ТРИМЕТИЛСИЛИЛ-2-ДИАЛКОКСИФОСФОРИЛ)АЦЕТАМИДИНОВ | 2010 |
|
RU2427583C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ЗАМЕЩЁННЫХ ЭТИЛ-(2-ДИАЛКОКСИФОСФОРИЛ-4ЦИАНО)-БУТАНИМИДАТОВ | 2003 |
|
RU2236414C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-АЦИЛИРОВАННЫХ АЛКИЛ-(2-АЦЕТИЛ-2-ДИАЛКОКСИФОСФОРИЛ)ЭТАНИМИДАТОВ | 2001 |
|
RU2203283C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОЛЕЙ ФОСФОРИЛЗАМЕЩЕННЫХ 1,4-ДИКАРБОНОВЫХ КИСЛОТ | 2008 |
|
RU2413733C2 |
Настоящее изобретение относится к способу получения N,N-диалкил,N'-ацил-(ацилдиалкоксифосфорил)-этанамидинов и может быть использовано для получения биологически активных соединений. Предложенный способ получения N,N-диалкил,N'-ацил-(ацилдиалкоксифосфорил)-этанамидинов формулы
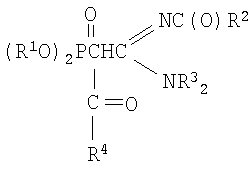
где Rl=C3-C4- алкил или изоалкил; R2=СН3,
С6Н5; R3=С3-С3-алкил; R4=СН3, С6Н5; включает взаимодействие С-фосфорилированных ацетамидинов с натрием с последующим ацилированием полученного натриевого производного галогенангидридами кислот, такими как бромистый или хлористый ацетил и хлористый бензоил, в среде диоксана при мольном соотношении натрий: С-фосфорилированный ацетамидин: галогенангидрид = 1:1:1÷1.1 соответственно и температуре 20÷50°С. Технический результат - разработка нового способа получения новых N,N-диалкил,N'-ацил-(ацилдиалкоксифосфорил)-этанамидинов с высоким выходом 80-86%.
Способ получения N,N-диалкил,N'-ацил-(ацилдиалкоксифосфорил)-этанамидинов формулы
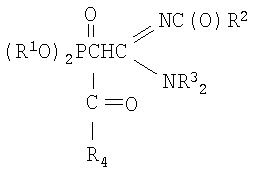
где R1=С3-С4- алкил или изоалкил;
R2=СН3, С6Н5; R3=С3-С3 - алкил; R4=СН3, C6H5,
заключающийся в получении натриевых производных С-фосфорилированных ацетамидинов путем взаимодействия С-фосфорилированных ацетамидинов с натрием с последующим ацилированием полученного натриевого производного галогенангидридами кислот, такими как бромистый или хлористый ацетил и хлористый бензоил, в среде диоксана при мольном соотношении натрий: С-фосфорилированный ацетамидин: галогенангидрид = 1:1:1÷1.1, соответственно, и температуре 20÷50°С.
| КИРИЛЛОВ М | |||
| и др.: Докл | |||
| Болг | |||
| АН., 1965, 18, 331-334 | |||
| КАБАЧНИК М.И | |||
| Фосфорорганические вещества | |||
| - М.: Знание, 1967, 14-17 | |||
| Фосфорилированные триметилизомочевины, обладающие инсектоакарицидной активностью | 1978 |
|
SU707233A1 |
Авторы
Даты
2009-11-27—Публикация
2008-05-12—Подача