Изобретение относится к применению микроорганизма или клетки, содержащего(ей) последовательность ДНК, кодирующую детектируемый белок или белок, способный индуцировать детектируемый сигнал, например люминесцирующий или флуоресцирующий белок, для изготовления диагностической композиции, предназначенной для диагностики и/или визуализации пораненной или воспаленной ткани или связанного с ней заболевания. Данное изобретение также относится к терапевтическому применению указанного микроорганизма или клетки, дополнительно содержащего(ей) экспрессируемую последовательность ДНК, кодирующую белок, который может быть использован для терапии, например, фермент, вызывающий гибель клеток или расщепление остатков.
Бактериемия может возникнуть вследствие травматических повреждений и хирургических вмешательств, а также из-за физиологических действий, таких как жевание или чистка зубов. Культуры клеток крови, взятой у здоровых людей до и после инвазивных процедур и физиологических действий, показывают, что если до манипуляций образцы крови являются стерильными, то после них в крови присутствуют бактерии в различных количествах в зависимости от процедур. Потенциальным результатом бактериемии является колонизация восприимчивых участков. Однако, несмотря на возникновение кратковременной бактериемии, бактериальная колонизация потенциально восприимчивых участков развивается лишь у нескольких процентов больных с высокой степенью риска. Ряд исследователей предположили, что бактерии из системы кровообращения могут колонизировать воспаленные ткани экспериментальных моделей на животных и поверхности имплантированных материалов. Неустойчивость патологических изменений у людей после бактериемии также может быть следствием сопротивляемости (резистентности) иммунной системы хозяина, непостоянства концентрации бактерий в крови при различных случаях бактериемии, а также вирулентности любого заданного штамма бактерий.
Ряд исследователей сосредоточились на изучении природы имплантированных материалов как на факторе, влияющем на способность бактерий закрепляться. Материалы, такие как нити и хирургические зажимы, которые используют для закрытия ран, являются потенциальными участками бактериальной колонизации. Инфицирование этих материалов может препятствовать заживлению ран и/или подвергать пациентов повышенному риску вторичных инфекций. Было изготовлено множество ранозаживляющих материалов с различной аффинностью к бактериям. Использование определенных материалов для закрытия ран, таких как плетеные нити, было связано с большей степенью распространения инфекции. Многоканальная (многониточная) природа шовных материалов этого типа сама по себе ведет к повышенной восприимчивости к бактериальной колонизации, а также вызывает эффект капиллярного затекания, который дает бактериям возможность проникать через ткани. Обычные имплантируемые материалы с непрерывной структурой обладают сходной аффинностью к бактериям. Протезы сердечных клапанов и суставов могут быть подвержены повышенному риску бактериальной колонизации. Принято считать, что такая повышенная восприимчивость вызвана присущей бактериям способностью более легко закрепляться на поверхности имплантатов. Альтернативное объяснение может состоять в том, что воспаление в тканях вокруг имплантатов создает среду, более подходящую для бактериальной колонизации. Помимо перечисленных возможностей еще одним фактором, который может влиять на восприимчивость участка к бактериальной колонизации, может быть степень воспаления травмированных тканей. Имплантированные материалы могут создавать временные или постоянные очаги воспаления в теле.
Присутствие имплантированных материалов не является необходимым условием бактериальной колонизации. Изменения природных анатомических структур, которые могут возникать вследствие болезненных состояний, могут порождать создание поверхностей, которые легче подвергаются бактериальной колонизации. Было выдвинуто предположение, что для распространения инфекционного эндокардита (ИЭ) поверхность клапана должна быть изменена таким образом, чтобы создать подходящий участок для бактериального присоединения и колонизации. Кроме того, микроорганизмы должны достичь этого участка и закрепиться на нем, хотя невозможно вызвать ИЭ у экспериментального животного путем инъекций бактерий, если поверхность клапана не повреждена. Повреждения со значительным завихрением создают условия, приводящие к бактериальной колонизации, в то время как повреждения с большой площадью поверхности или слабым потоком редко вовлечены в ИЭ.
Однако до настоящего времени нельзя было доказать, что временные бактериемии действительно вызывают колонизацию воспаленной или пораненной ткани, так как не существовало доступной модели, позволяющей отслеживать бактерии в живом организме, то есть позволяющей объяснить временную и пространственную взаимосвязь между бактериальными инфекциями и нездоровыми участками ткани. Более того, к сожалению, ранняя диагностика и терапия воспаленных или пораненных тканей или связанных с ними заболеваний, например, атеросклероза, эндокардита, перикардита и других, пока еще являются неудовлетворительными.
Поэтому задачей данного изобретения явилась разработка средств эффективной и надежной диагностики, а также терапии пораненной или воспаленной ткани или связанных с ней заболеваний, которые были бы лишены недостатков диагностических и терапевтических подходов, используемых в настоящее время.
Поставленная задача решена созданием настоящего изобретения, сущность которого раскрыта в формуле изобретения. В ходе экспериментальной работы, результатом которой явилось данное изобретение, было установлено, что на воспаленных тканях, например, вблизи имплантированного материала, возможно возникновение бактериальной колонизации. Поэтому, как правило, можно визуализировать воспаленные ткани посредством применения описанной далее системы по данному изобретению. Можно показать, что экспрессия генов, кодирующих испускающие свет белки у бактерий, позволяет создать генетический инструмент, дающий возможность проследить за бактериями в живом хозяине, то есть оценить динамику процесса инфицирования в живом хозяине. Наружное (внешнее) обнаружение испускающих свет бактерий позволило изобретателям осуществлять бесконтактное (неинвазивное) исследование пространственных и временных взаимосвязей между инфекциями и выраженными болезненными состояниями. Для получения испускающих свет бактерий был использован бактериальный luxab оперон, кодирующий фермент люциферазу, которая катализирует окисление восстановленного флавин-мононуклеотида (FMNE2) в присутствии субстрата, деканаля (decanal). В результате этой реакции образуется флавин-мононуклеотид (FMN), каприновая (декановая) кислота, вода и фотон света. Световые фотоны регистрируют с помощью радиографов, приборов для измерения люминесценции или с помощью устройств для визуализации световых пятен малой интенсивности. Недавно для детектирования бактерий у живых животных был использован полный бактериальный luxcdabe оперон, кодирующий как субстрат, так и фермент люциферазу. Преимущество этой системы состоит в том, что она не требует экзогенного (внешнего) введения субстрата, что делает ее идеальной для исследований in vivo.
В ходе исследований, результатом которых явилось данное изобретение, можно было продемонстрировать колонизацию пораненной или воспаленной ткани бактериями, изначально присутствующими в системе кровообращения, и можно было показать, что ткани, раздраженные имплантированными материалами, такими как нити, зажимы для закрытия ран и протезы, являются более восприимчивыми к бактериальной колонизации, следующей за бактериемией. Данные, полученные из экспериментов с аттенуированными S. typhimurium, показывают, что после внутривенной инъекции бактерии распространяются по всему телу живых животных. Поэтому разумно предположить, что бактерии достигают пораненных или воспаленных участков посредством циркуляции (кровообращения). Эти данные, детально описанные далее в примерах, открывают путь для (а) конструирования многофункциональных вирусных векторов, которые можно применять для обнаружения пораненной или воспаленной ткани на основе сигналов, таких как испускание света, или сигналов, которые могут быть визуализированы посредством отображения магнитного резонанса (Magnetic Resonance Imaging, MRI), и (б) разработки систем на основе бактериальных клеток и клеток млекопитающих в комбинации с терапевтическими генными конструктами, причем мишенью систем является пораненная или воспаленная ткань, и они предназначены для лечения заболеваний, связанных с пораненной или воспаленной тканью, таких как, например, атеросклероз. Такие системы обладают следующими преимуществами: (а) они точно нацелены на пораненную или воспаленную ткань и не затрагивают нормальную ткань, (б) экспрессия и секреция терапевтических генных конструктов находятся, предпочтительно, под контролем индуцибельного промотора, дающего возможность включать или выключать секрецию, и (в) локализация системы доставки внутри ткани может быть проверена посредством прямой визуализации до активации экспрессии гена и доставки белка. И, наконец, существует ряд способов диагностики, которые могут быть усовершенствованы или успешно заменены способом диагностики согласно данному изобретению. Например, и традиционная ангиография, и магнитно-резонансная ангиография (MRA) позволяют получать изображение кровотока через просвет сосуда для визуализации бляшки, но не прямое изображение бляшки. Метод магнитно-резонансной ангиографии (MRA) является особенно чувствительным к турбулентности, вызванной бляшкой, и, в результате, часто является неточным. Указанные недостатки можно преодолеть при применении диагностических подходов согласно данному изобретению.
Таким образом, данное изобретение относится к применению микроорганизма или клетки, содержащего(ей) последовательность ДНК, кодирующую детектируемый белок или белок, способный индуцировать детектируемый сигнал, для изготовления диагностической композиции, предназначенной для диагностики и/или визуализации пораненной или воспаленной ткани или связанного с ней заболевания. Кроме того, такие микроорганизмы также могут быть использованы для терапии, так как после визуализации пораненной или воспаленной ткани могут быть использованы, например, путем местного введения, соединения, подходящие для терапии, такие как, например, ацилированные иридоидные гликозиды из Scrophularia nodosa, кортизол, аналоги кортикостероида, колхицин, метотрексат, нестероидные противовоспалительные лекарства (NSAIDs), лефлуномид, этанерсепт, миноциклин, циклоспорин, талидомид, цитотоксический агент, 6-меркаптопурин, азатиоприн, антибиотики или один или более из перечисленных далее белков.
Данное изобретение также относится к применению микроорганизма или клетки, содержащего(ей) последовательность ДНК, кодирующую детектируемый белок или белок, способный индуцировать детектируемый сигнал, для изготовления фармацевтической композиции, предназначенной для лечения пораненной или воспаленной ткани или связанного с ней заболевания, причем такой микроорганизм или клетка дополнительно содержит одну или более экспрессируемую последовательность ДНК, кодирующую (а) белок (белки), подходящий (подходящие) для терапии пораненной или воспаленной ткани или связанных с ней заболеваний.
Белки, подходящие для терапии пораненной или воспаленной ткани или связанных с ней заболеваний, включают в себя трансформирующий фактор роста (TGF-альфа), тромбоцитарный фактор роста (PDG-F), фактор роста кератиноцитов (KGF) и инсулиноподобный фактор роста 1 (IGF-1), белки, связывающие инсулиноподобный фактор роста (IGFBPs), IL-4, IL-8, эндотелин-1 (ЕТ-1), фактор роста соединительной ткани (CTGF), TNF-α, фактор роста сосудистого эндотелия (VEGF), циклооксигеназу, ингибитор циклооксигеназы-2, инфликсимаб (infliximab, химерное моноклональное антитело к TNF-α), IL-10, липазу, протеазу, лизозим, фактор проапоптоза (pro-apoptotic factor), агонист рецептора, активируемого пролифератором пероксисомы (peroxisome proliferator-activated receptor (PRAR) agonist) и другие.
Любой микроорганизм или клетка могут быть использованы для диагностического и терапевтического применения согласно данному изобретению при условии, что он (она) реплицируется организмом, не является патогенным для организма, например, аттенуированным, распознается иммунной системой организма и так далее. Термины «микроорганизм» и «клетка» в контексте данного изобретения относятся к микроорганизмам и клеткам, которые сами по себе не имеют в качестве мишеней пораненные или воспаленные ткани (то есть они не могут различать пораненные и воспаленные ткани, с одной стороны, и аналогичные не пораненные и не воспаленные ткани, с другой), так как результаты экспериментов, лежащих в основе данного изобретения, показывают, что микроорганизмы и клетки аккумулируются в пораненной или воспаленной ткани вследствие того, что в таком окружении они не являются открытыми (легко уязвимыми) для атаки иммунной системы хозяина. Микроорганизмы и клетки аккумулируются в течение определенного времени, например, в течение от 3 до 5 дней, до тех пор, пока не будет восстановлена система васкуляризации/лимфатическая система.
В предпочтительном варианте выполнения изобретения микроорганизм или клетка содержит последовательность ДНК, кодирующую люминесцирующий и/или флуоресцирующий белок. Термин «последовательность ДНК, кодирующая люминесцирующий и/или флуоресцирующий белок» в контексте данного изобретения также включает в себя последовательность ДНК, кодирующую люминесцирующий и флуоресцирующий белок в виде фьюжн-белка.
В альтернативном предпочтительном варианте данного изобретения микроорганизм или клетка содержит последовательность ДНК, кодирующую белок, способный индуцировать сигнал, детектируемый посредством отображения магнитного резонанса (MRI), например, белок, связывающий металл. Более того, белок может связывать контрастирующий агент, хромофор или соединение, необходимый(е) для визуализации тканей.
Подходящие устройства для проведения анализа локализации или распределения люминесцирующих и/или флуоресцирующих белков в тканях хорошо известны специалистам и, кроме того, описаны в цитируемой литературе, а также в приведенных далее Примерах.
Предпочтительно, для трансфекции клеток, последовательности ДНК, кодирующие детектируемый белок или белок, способный индуцировать детектируемый сигнал, например, люминесцирующий или флуоресцирующий белок, содержатся в векторе или в векторе экспрессии. Специалисты знакомы с примерами таких систем. Последовательности ДНК могут также содержаться в рекомбинантном вирусе, содержащем подходящие кассеты экспрессии. Подходящие вирусы, которые могут быть использованы, включают в себя бакуловирус, Vaccinia, вирус Синдбис (sindbis virus), вирус Сендай (Sendai virus), аденовирус, аденоассоциированный вирус (AAV) или парвовирус, такой как MVM или Н-1. Вектор также может быть ретровирусом, таким как MoMULV, MoMuLV, HaMuSV, MuMTV, RSV или GaLV. Для экспрессии у млекопитающих подходящим промотором является, например, «моментальный ранний промотор» человеческого цитомегаловируса, (pCMV). Более того, могут быть использованы промоторы, имеющие специфичность к органам и/или тканям. Предпочтительно, последовательности ДНК, кодирующие детектируемый белок или белок, способный индуцировать детектируемый сигнал, оперативно связаны с промотором, дающим возможность высокой экспрессии. Такие промоторы, например индуцибельные промоторы, хорошо известны специалистам.
Для создания описанных выше последовательностей ДНК и конструирования векторов экспрессии или вирусов, содержащих такие последовательности ДНК, можно использовать обычные способы, известные из уровня техники. Эти способы включают в себя, например, рекомбинантные способы in vitro, синтетические способы и рекомбинантные способы in vivo, описанные, например в Sambrook и др.. Molecular Cloning, A Laboratory Manual, 2nd edition (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, (Молекулярное клонирование. Лабораторный справочник, 2-е издание, Нью-Йорк, 1989). Способы трансфекции клеток, фенотипического отбора трансфектантов и экспрессии последовательностей ДНК с использованием описанных выше векторов известны из уровня техники.
Специалистам известны последовательности ДНК, кодирующие люминесцирующие или флуоресцирующие белки, которые могут быть использованы для осуществления данного изобретения. В течение последнего десятилетия были описаны идентификация и выделение структурных генов, кодирующих белки, испускающие свет, например, бактериальную люциферазу из Vibrio harveyi (Belas и др.. Science 218 (1982), 791-793) и Vibrio fischerii (Foran и Brown, Nucleic acids Res. 16 (1988), 177), люциферазу светляков (de Wet и др., Mol. Cell. Biol. 7 (1987), 725-737), экворин (aequorin) из Aequorea victoria (Prasher и др., Biochem. 26 (1987), 1326-1332), люциферазу Renilla из Renilla reniformis (Lorenz и др., PNAS USA 88 (1991), 4438-4442) и зеленый флуоресцентный белок из Aequorea victoria (Prasher и др., Gene 111 (1987), 229-233), что позволяет отслеживать бактерии или вирусы по испусканию света. Трансформация и экспрессия этих генов в бактериях делает возможным обнаружение бактериальных колоний с помощью камеры, позволяющей получать изображение световых пятен малой интенсивности, или отдельных бактерий под флуоресцентным микроскопом (Engebrecht и др.. Science 227 (1985), 1345-1347; Legocki и др., PNAS 83 (1986), 9080-9084; Chalfie и др., Science 263 (1994), 802-805).
Гены люциферазы были экспрессированы рядом микроорганизмов. Основанная на испускании света промоторная активация с использованием luxAB, соединенного с нитрогеназным промотором, была продемонстрирована на примере жизнедеятельности Rhizobia внутри цитоплазмы клеток инфицированных корневых клубеньков с помощью отображения световых пятен малой интенсивности (Legocki и др., PNAS 83 (1986), 9080-9084; O'Kane и др., J.Plant Mol. Biol. 10 (1988), 387-399). Результатом слияния lux А и lux В генов явился полностью функциональный белок люциферазы (Escher и др., PNAS 86 (1989), 6528-6532). Этот фьюжн-ген (Fab2) был внедрен в Bacillus subtilis и Bacillus megatherium под ксилозным промотором, а затем был введен в личинки насекомых и был введен посредством инъекции в гемолимфу червяков. Визуализацию испускания света проводили с помощью видеокамеры, позволяющей получать изображение световых пятен малой интенсивности. Движение и локализация патогенных бактерий в трансгенных растениях arabidopsis, несущих фьюжн конструкт гена патоген-активируемого PAL промотора и бактериальной люциферазы, были продемонстрированы посредством изучения культур инфекции Pseudomonas или Ervinia spp., а также растения томата и кусков картофеля при помощи устройства для визуализации световых пятен низкой интенсивности (Giacomin и Szalay, Plant Sci. 116 (1996), 59-72).
Таким образом, в предпочтительном варианте выполнения изобретения люминесцирующим или флуоресцирующим белком, присутствующим в описанных выше микроорганизме или клетке, является люцифераза, RFP (Red Fluorescent Protein, красный флуоресцентный белок) или GFP (Green Fluorescent Protein, зеленый флуоресцентный белок).
Все люциферазы, экспрессируемые бактериями, требуют для испускания света экзогенно (извне) введенных субстратов, таких как деканаль или коэлентеразин (coelenterazine). Напротив, для визуализации флуоресценции GFP субстрат не требуется, но необходим источник возбуждающего света. Совсем недавно из Xenorhabdus luminescens (Meighen и Szittner, J.Bacteriol. 174 (1992), 5371-5381) и Photobacterium leiognathi (Lee и др., Eur. J. Biochem. 201 (1991), 161-167) был выделен кластер генов, включая luxCDABE, кодирующих бактериальную люциферазу и белки для доставки деканаля внутрь клетки. Этот кластер генов был внедрен в бактерии, в результате чего было получено длительное испускание света, не зависящее от экзогенно добавленного субстрата (Femandez-Pinas и Wolk, Gene 150 (1994), 169-174). Внутрибрюшинное, внутримышечное или внутривенное введение бактерий, содержащих полную последовательность lux оперона, позволило визуализировать и установить местонахождение бактерий у живых мышей. Полученные данные показали, что свет, испускаемый люциферазой, может проникать через ткани и, в результате, может быть зарегистрирован извне (Contag и др., Mol. Microbiol. 18 (1995), 593-603).
Таким образом, в более предпочтительном варианте выполнения изобретения микроорганизм или клетка, содержащие последовательность ДНК, кодирующую люциферазу, дополнительно содержит ген, кодирующий субстрат для люциферазы.
Предпочтительно, микроорганизм является бактерией. Особенно предпочтительными являются аттенуированная Salmonella thyphimurium, аттенуированная Vibrio cholerae, аттенуированная Listeria monocytogenes или Е.coll.
Альтернативно, для диагностического и терапевтического применения согласно данному изобретению также подходят вирусы, такие как Vaccinia virus, AAV, ретровирус и другие. Предпочтительно, вирусом является Vaccinia virus.
Предпочтительно, клеткой для применения согласно данному изобретению является клетка млекопитающих, такая как стволовая клетка, которая по отношению к организму может быть аутологической или гетерологичной.
В другом предпочтительном варианте выполнения изобретения микроорганизм или клетка, подходящие для применения согласно данному изобретению, содержат ruc-gfp кассету экспрессии, содержащую последовательности кДНК люциферазы Renilla (rue) и Aequorea gfp под контролем сильного синтетического раннего/позднего (PE/L) промотора на основе Vaccinia или кассеты luxCDABE.
Согласно предпочтительному способу применения описанных выше микроорганизмов и клеток белок, подходящий для терапии заболеваний, связанных с пораненной или воспаленной тканью, таких как атеросклероз, представляет собой фермент, вызывающий гибель клетки, или фермент, вызывающий расщепление остатков, например, во внутренней части атеросклеротической бляшки, результатом чего является коллапс бляшки под действием внутрипросветного давления крови. Подходящие ферменты включают в себя липазу, протеазу, лизозим, фактор проапоптоза, агонист рецептора, активируемого пролифератором пероксисомы, и другие. В том случае, когда следует лечить воспалительную компоненту атеросклероза, подходящими соединениями являются кортизол, аналоги кортикостероида, циклооксигеназа и ингибиторы циклооксигеназы-2, колхицин, метотрексат, нестероидные противовоспалительные лекарства (NSAIDs), лефлуномид, этанерсепт, миноциклин, циклоспорин, талидомид, инфликсимаб, IL-10, 6-меркаптопурин, азатиоприн или цитотоксический агент. Некоторые из указанных соединений могут быть представлены в форме пролекарств.
Соответственно, белок, экспрессируемый микроорганизмом по данному изобретению, может представлять собой фермент, переводящий неактивное вещество (пролекарство), введенное в организм, в активное соединение.
Предпочтительно, ген, кодирующий фермент, как описано выше, направляется индуцибельным промотором, например IPTG-, антибиотик-, тепло-, рН-, свет-, металл-, аэробно-, клетка-хозяин-, лекарство-, клеточный цикл- или ткане-специфичным индуцибельным промотором, который дополнительно обеспечивает, например, перевод пролекарства в активное соединение только в ткани-мишени. Более того, система доставки согласно данному изобретению также позволяет использовать соединения, которые до настоящего времени не использовали для терапии вследствие их высокой токсичности при систематическом употреблении или вследствие того обстоятельства, что их нельзя было ввести, например, внутривенно в достаточно высоких дозах для достижения уровня внутри, например, свищей (фистул), гнойников (абсцессов) или через гемоэнцефалический барьер. Такие соединения включают в себя талидомид, цитотоксические лекарства, антибиотики и другие.
Более того, микроорганизм или клетка согласно данному изобретению может содержать ВАС (бактериальную искусственную хромосому. Bacterial Artificial Chromosome) или MAC (искусственную хромосому млекопитающих, Mammalian Artificial Chromosome), кодирующую несколько или все белки специфической направленности, например, направленные на заживление ран, такие как TNF-α, COX-2, фактор роста соединительной ткани (CTGF) и другие. Кроме того, клетка может быть кибер клеткой или кибер вирусом, кодирующим эти белки.
Описанные выше микроорганизмы и клетки для введения предпочтительно объединяют с подходящими фармацевтическими носителями. Примеры подходящих фармацевтических носителей известны из уровня техники и включают фосфатно-солевые буферные растворы, воду, эмульсии, такие как эмульсии масла в воде, различные типы смачивающих агентов, стерильные растворы и так далее. Такие носители могут быть изготовлены традиционными способами и введены субъекту в подходящей дозе. Введение микроорганизмов или клеток может быть осуществлено различными способами, например, внутривенно, внутрибрюшинно, подкожно, внутримышечно, путем местного или интрадермального введения. Предпочтительным способом введения является внутривенная инъекция. Способ введения, естественно, зависит от природы ткани и вида микроорганизмов или клеток, содержащихся в фармацевтической композиции. Режим дозирования будет определяться наблюдающим врачом, а также будет зависеть от других клинических факторов. Как хорошо известно медицинским работникам, дозировки для любого конкретного пациента зависят от множества факторов, включая размеры пациента, площадь поверхности тела, возраст, пол, конкретное соединение, которое предполагается вводить, время и способ введения, тип и расположение ткани, общее состояние здоровья и наличие других применяемых одновременно лекарств.
Предпочтительным терапевтическим применением является изготовление фармацевтической композиции для лечения эндокардита, перикардита, воспалительного заболевания кишечника (например, болезни Крона или язвенного колита), поясничной боли (herniated nucleus pulposis), темпорального артериита, нодозного полиартериита или артрита.
В последние несколько лет появилось множество сообщений, подтверждающих наличие Chlamydia pneumoniae, Heliobacter pylori, CMV, HSV и других инфицирующих агентов внутри атеросклеротических бляшек. Присутствие таких инфицирующих агентов внутри атеросклеротической бляшки означает, что внутренняя часть бляшки является защищенным местом (средой), допускающим репликацию, так как в противном случае инфицирующие агенты были бы уничтожены иммунной системой. Более того, существует заслуживающее внимания доказательство того, что внутри атеросклеротической бляшки протекает воспалительный процесс. Соответственно, разумно предположить, что это заболевание можно диагностировать и лечить с помощью микроорганизмов или клеток по данному изобретению, которые после внутривенной инъекции проникнут внутрь атеросклеротической бляшки, где начнут реплицироваться. Через соответствующий промежуток времени бляшку можно визуализировать, используя, например, светочувствительные камеры или подходящее оборудование для получения отображения магнитного резонанса (MRI). Кроме того, указанные микроорганизмы или клетки могут дополнительно продуцировать фермент, например один из описанных выше, вызывающий уничтожение бляшек. Таким образом, еще одним предпочтительным вариантом выполнения изобретения является применение для диагностики и лечения атеросклероза.
Кроме того, предпочтительным вариантом выполнения является применение для диагностики и лечения заболевания коронарной артерии, заболевания периферических сосудов или заболевания мозговой артерии. Терапевтические воздействия по данному изобретению могут заменить такие способы лечения, как баллонная ангиопластика, введение стента, обходного имплантата коронарной артерии, эндартерэктомию сонной артерии, введение обходного аорто-бедренного имплантата и другие инвазивные процедуры. Более того, бляшки на недоступных участках, таких как основная и средняя артерии мозга, можно лечить, используя терапевтический подход согласно данному изобретению.
Для лечения ранений, трещин, хирургических порезов и ожогов микроорганизмы по данному изобретению предпочтительно используют в комбинации с белками, такими как трансформирующий фактор роста (TGF-α), тромбоцитарный фактор роста (PDG-F), фактор роста кератиноцитов (KGF) и инсулиноподобный фактор роста-1 (IGF-1), белки, связывающие инсулиноподобный фактор роста (IGFBPs), IL-4, IL-8, эндотелин-1 (ЕТ-1), фактор роста соединительной ткани (CTGF), TNF-α, фактор роста сосудистого эндотелия (VEGF), циклооксигеназа, ингибитор циклооксигеназы-2, инфликсимаб (infliximab, химерное моноклональное антитело к TNF-α), IL-10, липаза, протеаза, лизозим, фактор проапоптоза, агонист рецептора, активируемого пролифератором пероксисомы (или содержат экспрессируемые последовательности ДНК, кодирующие указанные белки). Для лечения инфекционных заболеваний микроорганизмы по данному изобретению предпочтительно используют в комбинации с антибиотиками. Для лечения аутоиммунных и воспалительных заболеваний, включая ревматоидный артрит, воспалительное заболевание кишечника и рассеянный склероз, микроорганизмы по данному изобретению предпочтительно используют в комбинации с кортизолом, аналогами кортикостероида, цикллооксигеназой и ингибиторами циклооксигеназы-2, колхицином, метотрексатом, нестероидными противовоспалительными лекарствами, лефлуномидом, этанерсептом, миноциклином, циклоспорином, талидомидом, инфликсимабом, IL-10, 6-меркаптопурином, азатиоприном или цитотоксическим агентом. Для терапии таких заболеваний, как атеросклероз, микроорганизмы по данному изобретению предпочтительно используют в комбинации с липазами, лизозимами, факторами проапоптоза, агонистами рецептора, активируемого пролифератором пероксисомы (или соответствующими последовательностями ДНК) или агентом из числа перечисленных ранее для лечения воспалительных заболеваний. Для лечения болезни Альцгеймера микроорганизмы по данному изобретению предпочтительно используют в комбинации с одним или более из агентов, перечисленных выше для лечения аутоиммунных или воспалительных заболеваний.
И, наконец, описанные ранее микроорганизмы и клетки могут быть использованы для (а) мониторинга эффективности режимов дозирования антибиотика, предпочтительно на основании испускания света и (б) сравнения устойчивости различных нитей и имплантируемых материалов к бактериальной колонизации.
Краткое описание чертежей
Фиг.1: Визуализация бактерий, введенных бестимусным мышам посредством внутривенной инъекции.
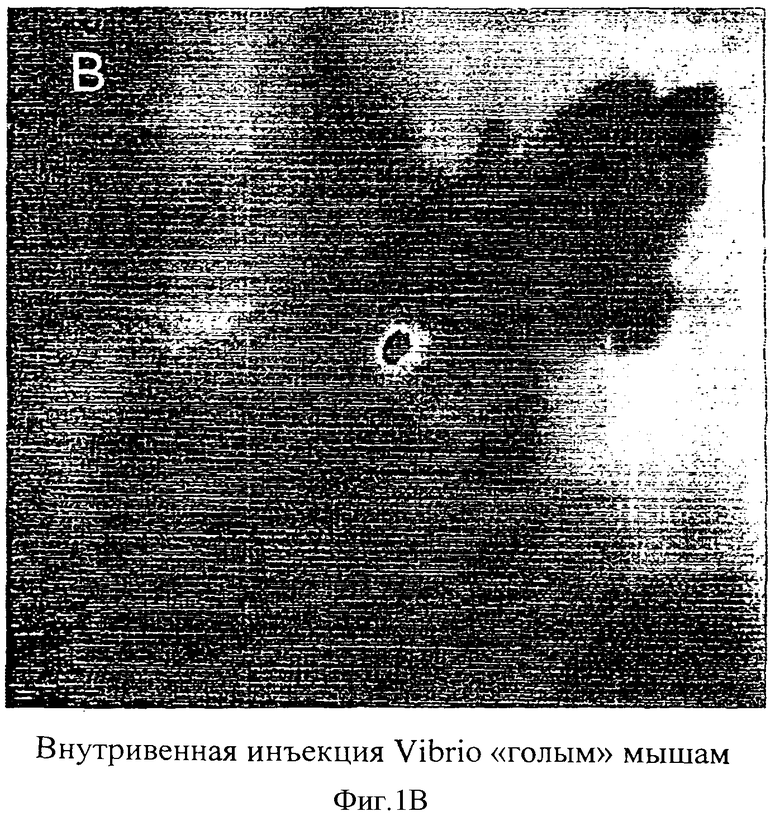
Бестимусным мышам (линия «голых» мышей) делали инъекции 1×107 аттенуированных Salmonella typhimurium (А) или 1×107 аттенуированных Vibrio cholera (В). Оба штамма трансформировали pLITE201, несущим lux оперон. Через 20 минут после инъекции бактерий в течение 1 минуты производили регистрацию фотонов.
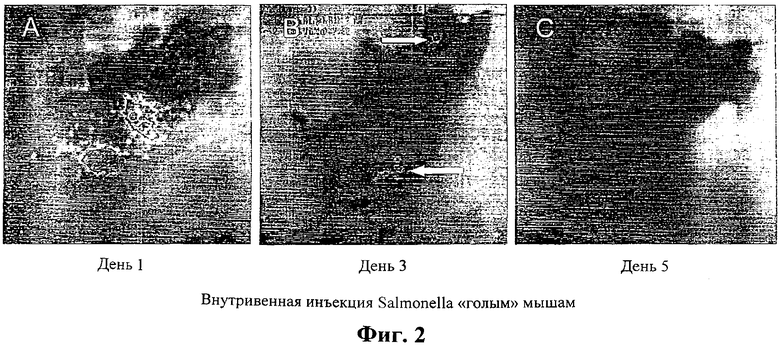
Фиг.2: Визуализация S. typhimurium у одного животного в течение 5 дней наблюдения.
Бестимусным мышам делали инъекцию 1×107 аттенуированных S. typhimurium. На первом этапе наблюдений бактерии рассредоточились по телу животного (А). Через два дня бактерии у животного пропали за исключением раны (надреза) и области ушной метки, как показано стрелками (В). На пятый день пораненные участки зажили (С).
Фиг.3: Визуализация V.cholera у одного животного в течение 8 дней наблюдения.
Бестимусным мышам делали инъекцию 1×107 аттенуированных V.cholera. На первом этапе наблюдений бактерии визуализировались в области печени животного (А). Пять дней спустя во всем теле животного не наблюдалось бактерий, за исключением раны (надреза), как показано стрелками (В). На 8-й день пораненный участок зажил (С).
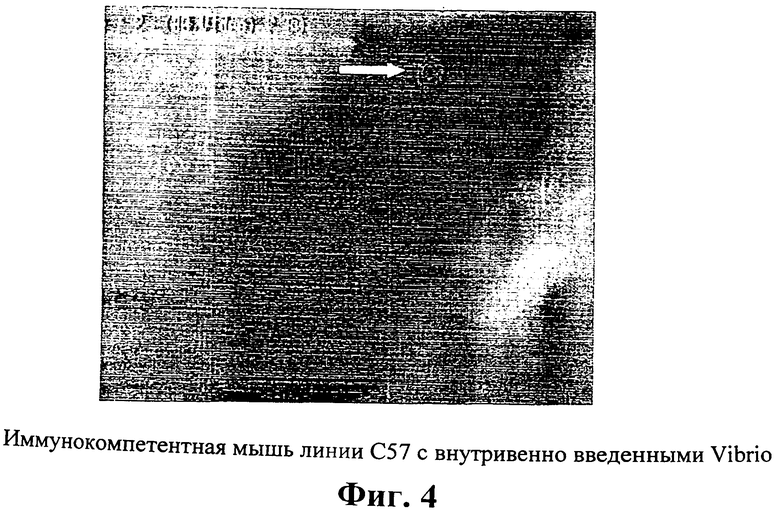
Фиг.4: Визуализация V.cholera у иммунокомпетентной мыши линии С57
1×107 аттенуированных V.cholera ввели животному внутривенно. Испускающие свет бактерии колонизировали область ушной метки на четвертый день после инъекции бактерий (показано белой стрелкой).
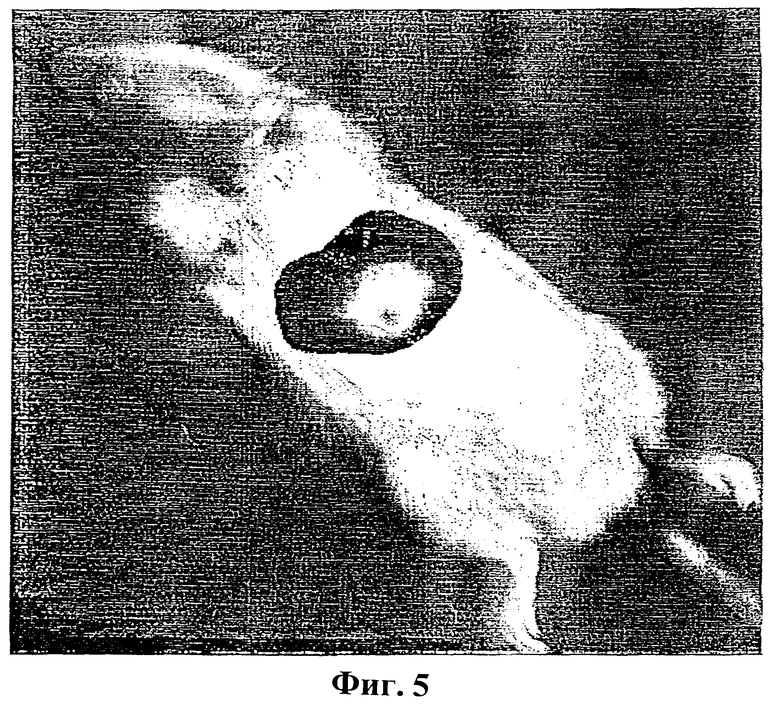
Фиг.5: Визуализация испускающих свет бактерий в печени крыс.
Крысам линии Sprague Dawley внутривенно ввели 1×108 аттенуированных Е.Coli, трансформированных плазмидной ДНК pLITE201, несущей оперон Iuxcdabe. Регистрацию фотонов проводили немедленно после инъекции (инфицирования) в течение одной минуты с помощью визуализатора световых пятен малой интенсивности (Low Light Imager) (Night Owl). Свечение бактерий наблюдали в печени целого живого животного.
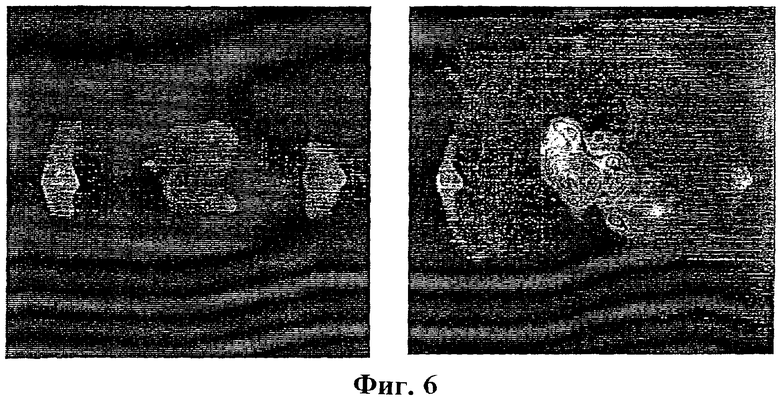
Фиг.6: Колонизация крысиных сердец испускающими свет бактериями.
Внутривенное введение крысам 1×108 аттенуированных Е.coli, трансформированных плазмидой pLITE201, несущей оперон luxedabe, не привела к колонизации сердец контрольных животных, которые не были катетеризированы (А). Аналогичная провокация бактериемии у мышей, катетеризированных через правую сонную артерию, привела к колонизации сердца испускающими свет бактериями (В).
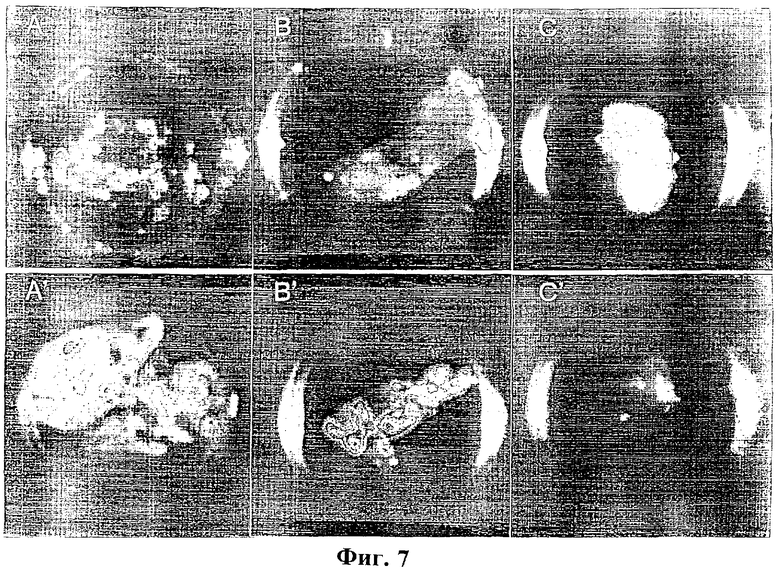
Фиг.7: Обнаружение остаточных бактерий в органах крыс.
Через три дня после внутривенного введения крысам 1×108 аттенуированных Е.Coli, сердце, печень и селезенку удалили и культивировали в течение ночи. Испускающие свет бактерии визуализировали с помощью визуализатора световых пятен низкой интенсивности (Hamamatsu) во всех образцах, полученных от катетеризированных крыс (А-С), в то время как у контрольных животных бактерии были обнаружены в печени (А) и селезенке (В), но не в сердце (С).
Далее изобретение объяснено с помощью приведенных ниже примеров.
Пример 1: Материалы и способы.
(A) Штаммы бактерий
Использовали непатогенный лабораторный штамм бактерий Escherichia coli, штамм DH5α, аттенуированный Salmonella typhimurium (SL7207 hisG46, DEL407 [аrоА544::Тn101] и аттенуированный Vibrio cholerae (Bengal 2 Serotyp 0139, M010DattRSI).
(Б) Плазмидные конструкты
Плазмидная ДНК pLITE201, содержащая кассету генов luxcdabe, была получена от доктора F.Marines (Voisey и Marines, Biotech. 24 (1998) 56-58).
(B) Животные-реципиенты
Самцы мышей BALB/c nu/nu пяти-шестинедельного возраста (масса тела 25-30 г) и крысы линии Sprague Dawley (масса тела 300-325 г) были приобретены у Harlan (Frederick, Мэриленд, США). Мыши линии CS7BL/6J получены из Jackson Laboratories (Bar Harbor, ME, США). Все эксперименты на животных проводили согласно протоколам, утвержденным комитетом по исследованиям на животных Lorna Linda University. Животных, содержащих материалы рекомбинантной ДНК и аттенуированные патогены, содержали в центре по уходу за животными Lorna Linda University в условиях биологической безопасности 2 уровня.
(Г) Регистрация люминесценции
Непосредственно перед получением изображения животных анестезировали посредством внутрибрюшинных инъекций пентобарбитала натрия (Nembutal® натриевый раствор, Abbot Laboratories, North Chicago, Иллинойс; 60 мг/кг массы тела). Животных поместили внутрь темного ящика для регистрации фотонов и записи наложенных изображений (ARGUS 100 Low Light Imaging System, Hamamatsu, Hamamatsu, Япония и Night Owl, Berthold Technologies, GmbH and Co. KG, Bad Wildbad, Германия). Регистрацию фотонов проводили в течение 1 минуты со стороны брюшины и со стороны спины животных. Затем получали фотографическое изображение, и отображения световых пятен низкой интенсивности накладывали на фотографическое изображение для демонстрации местонахождения люминесцентной активности.
Пример 2: Колонизация кожных ранений у живых животных испускающими свет бактериями, введенными посредством внутривенной инъекции
1×107 бактерий, несущих плазмидную ДНК pLITE201, в 50 мкл вводили бестимусным мышам посредством инъекции в левую бедренную вену под анестезией для того, чтобы определить, что происходит с внутривенно введенными люминесцирующими бактериями у животных. Для того чтобы открыть бедренную вену, хирургическим скальпелем делали надрез длиной 1 см. Последующее закрытие надреза осуществляли нитями 6-0, мышей исследовали при помощи визуализатора световых пятен низкой интенсивности, а испускаемые фотоны регистрировали в течение одной минуты. Изображения каждого животного фиксировали через различные промежутки времени для изучения распространения испускающих свет бактерий по телу животных. Было установлено, что картина распределения испускающих свет бактерий после внутривенного введения бактерий мышам зависит от штамма бактерий. Инъекция аттенуированных S.typhimurium вызвала обширное распространение бактерий по телу животных (Фиг.1А). Такую картину распределения наблюдали в течение 5 минут после инъекции бактерий, и ее можно было видеть в течение одного часа наблюдений. Инъекция аттенуированных V.cholera в кровоток привела, однако, к испусканию света, которое было локализовано в печени в течение 5 минут после инъекции бактерий и оставалось видимым в печени в течение одного часа наблюдений (Фиг.1В).
Различие в картинах распределения бактерий означает различное взаимодействие этих штаммов с хозяином внутри тела животного. Исследование тех же животных через 48 часов после инъекции бактерий показало, что у животных, которым была сделана инъекция, вся наблюдаемая ранее эмиссия света ослабла и исчезла совсем за исключением воспаленных пораненных тканей, таких как область надреза и ушной метки. Воспаление в этих тканях было идентифицировано по их покраснению и отечному виду. Испускание света фиксировали в области надреза и/или воспаленной области ушной метки вплоть до 5-8 дней после инъекции, что было подтверждено более длительными временами регистрации фотонов (10 минут) (Фиг.2А-С и Фиг.3А-С). Отсутствие испускания света происходило не вследствие потери плазмидной ДНК или подавления экспрессии гена в бактериях. В других экспериментах эмиссия света у животных могла быть стойко зафиксирована вплоть до 50 дней. Аналогичные данные были получены на иммунокомпетентных мышах C57BU6J (Фиг.4), что свидетельствует о том, что эти наблюдения не ограничиваются животными с измененной иммунной системой. Тщательные обследования отдельных удаленных органов, а также образцов крови инфицированных животных подтвердило отсутствие люминесценции в этих нормальных неповрежденных тканях. Более того, экспериментальные данные показали, что колонизация поврежденных тканей является частым явлением у мышей. Двадцать четыре из 29 надрезов (82.8%) и 12 из 29 областей ушных меток (41.4%) у мышей были колонизированы бактериями, введенными посредством внутривенной инъекции. Колонизация ранений бактериями, введенными посредством внутривенной инъекции, происходит после инъекции V. cholera даже при такой низкой концентрации, как 1×105 бактериальных клеток.
Пример 3: Колонизация подвергнутых катетеризации крысиных сердец после инъекции в бедренную вену бактерий, испускающих свет.
Хирургические повреждения сердца были созданы согласно описанным ранее процедурам (Santoro и Levison, Infect. Immun. 19 (3) (1978), 915-918; Overholser и др., J.Infect. Dis. 155 (1) (1987), 107-112). Животных подвергли анестезии при помощи пентобарбитала натрия (60 мг/кг, внутрибрюшинно). Для того чтобы открыть плотную сонную артерию, выполнили срединный разрез шеи. Ввели полипропиленовый катетер и продвигали его вперед до тех пор, пока не начали чувствовать сопротивление, что указывало на то, что достигли уровня клапана аорты. Затем катетер закрепили, используя нити 10-0 (AROSurgical Instrument Corporation, Япония) и надрез закрыли, используя шелковые нити 4-0 (American Cyanamide Company, Wayne, Нью Джерси). Введение катетера вызывает раздражение и последующее воспаление клапана аорты (Santoro и Levison, 1978). Контрольным животным катетер не вводили. Бактериемию вызывали посредством введения в бедренную вену 1×108 испускающих свет бактериальных клеток Е.Coli. Сразу после инъекции наблюдение с помощью визуализатора световых пятен низкой интенсивности выявило бактериальную колонизацию в области печени (Фиг.5). Через три дня животные, подвергнутые катетеризации, устойчиво демонстрировали колонизацию сердца испускающими свет бактериями, в то время как у контрольных животных испускания света от сердца не наблюдали (Фиг.6). Для того чтобы определить возможное присутствие низких и неопределяемых уровней бактерий в тканях, сердце, печень и селезенку удалили у каждого животного и культивировали в течение ночи. У животных обеих групп обнаружено наличие испускающих свет бактерий в печени и селезенке, то есть в органах, напрямую участвующих в очистке организма от бактерий. Сильное испускание света зарегистрировано в сердцах, подвергнутых катетеризации, в отличие от сердец контрольных животных, в которых испускание света полностью отсутствовало (Фиг.7). Наличия бактерий не обнаружено в культурах после культивирования катетеров.
Полученные данные указывают на то, что испускающие свет бактерии, введенные в кровоток посредством инъекции в бедренную вену, из нормальных тканей удаляются, в то время как поврежденные или воспаленные ткани у животных с нарушенным иммунитетом или иммунокомпетентных животных представляют собой участки, продолжающие удерживать бактерии в течение длительного периода времени.

Изобретение относится к области биотехнологии и медицины. Способ предусматривает введение субъекту бактерии, которая кодирует детектируемый белок или белок, индуцирующий детектируемый сигнал, и детектирование белка или сигнала. Способ позволяет выявить ранение, пораненную ткань, участок воспаления или воспаленную ткань. Изобретение может быть использовано в медицине. 3 н. и 30 з.п. ф-лы, 8 ил.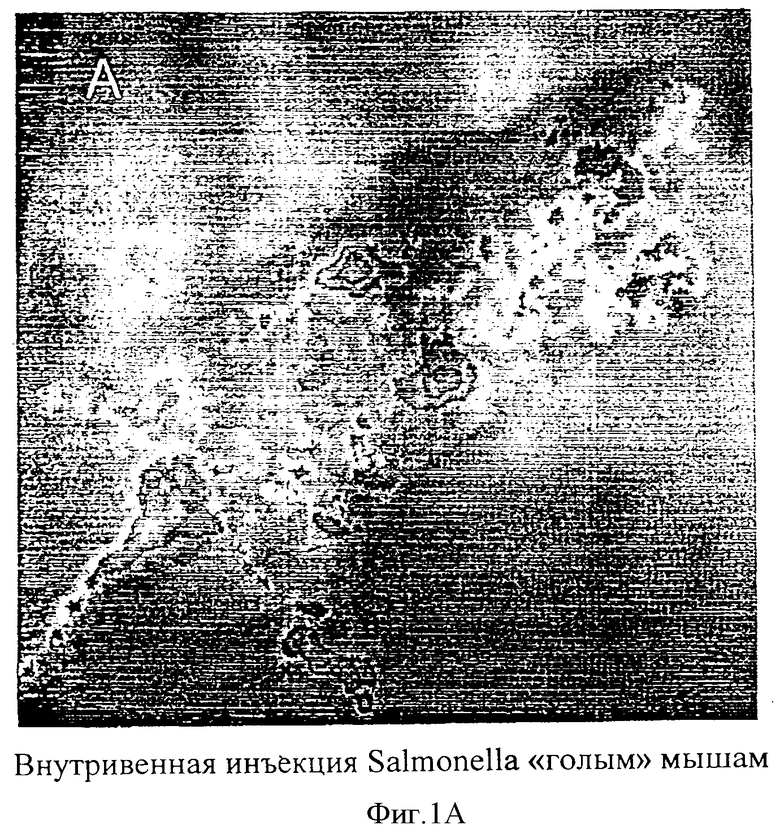
1. Способ обнаружения присутствия или отсутствия ранения, пораненной ткани, участка воспаления или воспаленной ткани, в котором субъекту вводят микроорганизм, являющийся бактерией, которая кодирует детектируемый белок или белок, индуцирующий детектируемый сигнал, проводят мониторинг субъекта для обнаружения детектируемого белка или сигнала с целью выявления аккумулирования бактерий в ранении, пораненной ткани, участке воспаления или воспаленной ткани субъекта, проводя таким образом обнаружение присутствия или отсутствия ранения, пораненной ткани, участка воспаления или воспаленной ткани у субъекта, при этом субъектом является тот, у кого необходимо обнаружить присутствие или отсутствие ранения, пораненной ткани, участка воспаления или воспаленной ткани, бактерия не является патогенной или аттенуированной, бактерии аккумулируются в ранении, пораненной ткани, участке воспаления или воспаленной ткани вследствие того, что в ранении, в пораненной ткани, в участке воспаления или в воспаленной ткани бактерия оказывается защищенной от удаления иммунной системой субъекта, бактерия не нацелена на ранение, пораненную ткань, участок воспаления или воспаленную ткань, бактерия реплицируется в субъекте.
2. Способ по п.1, отличающийся тем, что бактерия (а) не способна различать пораненную и непораненную ткань, и/или (b) не способна различать воспаленную и невоспаленную ткань.
3. Способ по п.1 или 2, отличающийся тем, что бактерию вводят субъекту внутривенно.
4. Способ по любому из пп.1-3, отличающийся тем, что микроорганизм является бактерией, выбранной из группы, включающей Salmonella typhimurium, Vibrio cholerae, Listeria monocytogenes и Escherichia coli.
5. Способ по п.1, отличающийся тем, что кодируемый ДНК детектируемый белок или белок, индуцирующий детектируемый сигнал, является белком, индуцирующим детектируемый сигнал.
6. Способ по любому из пп.1-5, отличающийся тем, что детектируемый белок или белок, индуцирующий детектируемый сигнал, способен связываться с контрастирующим агентом, хромофором, или соединением, или лигандом для визуализации ранения, пораненной ткани, участка воспаления, или воспаленной ткани.
7. Способ по любому из пп.1-5, отличающийся тем, что детектируемый белок или белок, индуцирующий детектируемый сигнал, испускает детектируемый свет.
8. Способ по п.7, отличающийся тем, что детектируемый белок или белок, индуцирующий детектируемый сигнал, является флуоресцирующим или люминесцирующим белком.
9. Способ по п.7, отличающийся тем, что детектируемый белок или белок, индуцирующий детектируемый сигнал, является люциферазой и/или субстратом люциферазы.
10. Способ по п.1, отличающийся тем, что детектируемый белок или белок, индуцирующий детектируемый сигнал, является белком, связывающим металл.
11. Способ по п.5, отличающийся тем, что белок, индуцирующий детектируемый сигнал, является белком, связывающим металл.
12. Способ по любому из пп.1-11, отличающийся тем, что микроорганизм включает ДНК, кодирующую белок, подходящий для терапии ранения, пораненной ткани, участка воспаления или воспаленной ткани.
13. Способ обнаружения присутствия или отсутствия ранения, пораненной ткани, участка воспаления или воспаленной ткани и лечения ранения или воспаления, в котором субъекту вводят микроорганизм, являющийся бактерией, которая кодирует детектируемый белок или белок, индуцирующий детектируемый сигнал, проводят мониторинг субъекта для обнаружения детектируемого белка или сигнала с целью выявления аккумулирования бактерий в ранении, пораненной ткани, участке воспаления или воспаленной ткани субъекта, таким образом проводя обнаружение присутствия или отсутствия ранения, пораненной ткани, участка воспаления или воспаленной ткани у субъекта, при этом субъектом является тот, у кого необходимо обнаружить присутствие или отсутствие ранения, пораненной ткани, участка воспаления или воспаленной ткани, бактерия не является патогенной или аттенуированной, бактерии аккумулируются в ранении, пораненной ткани, участке воспаления или воспаленной ткани вследствие того, что в решении, в пораненной ткани, в участке воспаления или в воспаленной ткани бактерия оказывается защищенной от удаления иммунной системой субъекта, бактерия не нацелена на ранение, пораненную ткань, участок воспаления или воспаленную ткань, бактерия реплицируется в субъекте, и субъекту, у которого обнаружено ранение или воспаление, вводят соединение, подходящее для терапии ранения, пораненной ткани, участка воспаления или воспаленной ткани.
14. Способ по п.13, отличающийся тем, что соединение для терапии выбрано из группы, включающей ацилированные иридоидные глюкозиды, кортизол, аналоги кортикостероида, колхицины, метотрексат, нестероидные противовоспалительные лекарства, лефлуномид, этанерсепт, миноциклин, циклоспорин, талидомид, цитотоксический агент, 6-меркаптопурин и азатиоприн.
15. Способ по любому из пп.1-14, отличающийся тем, что субъект имеет заболевание, выбранное из группы, включающей эндокардит, перикардит, воспалительное заболевание кишечника, болезнь Крона, язвенный колит, поясничную боль, грыжу межпозвонкового диска (herniated nucleus pulposis), темпоральный артериит, нодозный полиартериит, артрит, атеросклероз, заболевание коронарной артерии, заболевание периферических сосудов, заболевание мозговой артерии, аутоиммунное заболевание, ревматоидный артрит, рассеянный склероз и болезнь Альцгеймера.
16. Способ по п.12, отличающийся тем, что кодируемый белок для терапии является белком, выбранным из группы, включающей трансформирующий фактор роста (TGF-альфа), тромбоцитарный фактор роста (PDGF), фактор роста кератиноцитов, инсулиноподобный фактор роста 1 (IGF-1), белки, связывающие инсулиноподобный фактор роста, IL-4, IL-8, эндотелии-1, фактор роста соединительной ткани, TNF-α, фактор роста сосудистого эндотелия (VEGF), циклооксигеназу, ингибитор циклооксигеназы-2, инфликсимаб, IL-10, липазу, протеазу, лизозим, фактор проапоптоза, СОХ-2 и агонист PPAR.
17. Способ по п.12, отличающийся тем, что кодируемый белок для терапии является ферментом, вызывающим гибель клетки, или ферментом, вызывающим расщепление остатков.
18. Способ по п.12, отличающийся тем, что кодируемый белок для терапии является ферментом, переводящим пролекарство в активное соединение.
19. Способ по любому из пп.1-6 и 10-16, отличающийся тем, что детектируемый белок индуцирует детектируемый сигнал, который может быть обнаружен с помощью отображения магнитного резонанса.
20. Способ обнаружения присутствия или отсутствия атеросклеротической бляшки, в котором субъекту вводят микроорганизм, являющийся бактерией, которая кодирует детектируемый белок или белок, индуцирующий детектируемый сигнал, проводят мониторинг субъекта для обнаружения детектируемого белка или сигнала с целью выявления аккумулирования бактерий в атеросклеротической бляшке у субъекта, таким образом проводя обнаружение присутствия или отсутствия атеросклеротической бляшки, при этом субъектом является тот, у кого необходимо обнаружить присутствие или отсутствие атеросклеротической бляшки, бактерия не является патогенной или аттенуированной, бактерии аккумулируются в атеросклеротической бляшке вследствие того, что в ранении, в пораненной ткани, в участке воспаления или в воспаленной ткани бактерия оказывается защищенной от удаления иммунной системой, бактерия не нацелена на атеросклеротическую бляшку, и бактерия реплицируется в субъекте.
21. Способ по п.20, отличающийся тем, что микроорганизм кодирует белок для лечения атеросклероза.
22. Способ по п.20, отличающийся тем, что микроорганизм является бактерией, выбранной из группы, включающей Salmonella typhimurium, Vibrio cholerae, Listeria monocytogenes и Escherichia coli.
23. Способ по п.20, отличающийся тем, что кодируемый ДНК детектируемый белок или белок, индуцирующий детектируемый сигнал, является белком, индуцирующим детектируемый сигнал.
24. Способ по п.22 или 23, отличающийся тем, что детектируемый белок или белок, индуцирующий детектируемый сигнал, способен связываться с контрастирующим агентом, хромофором, или соединением, или лигандом для визуализации атеросклеротической бляшки.
25. Способ по любому из пп.20-24, отличающийся тем, что детектируемый белок или белок, индуцирующий детектируемый сигнал, испускает детектируемый свет.
26. Способ по п.25, отличающийся тем, что детектируемый белок или белок, индуцирующий детектируемый сигнал, является флуоресцирующим или люминесцирующим белком.
27. Способ по п.25, отличающийся тем, что детектируемый белок или белок, индуцирующий детектируемый сигнал, является люциферазой, и/или субстратом лоциферазы.
28. Способ по любому из пп.20-24, отличающийся тем, что детектируемый белок или белок, индуцирующий детектируемый сигнал, является белком, связывающим металл.
29. Способ по любому из пп.13-15, отличающийся тем, что соединение для терапии является белком, выбранным из группы, включающей трансформирующий фактор роста (TGF-альфа), тромбоцитарный фактор роста (PDGF), фактор роста кератиноцитов, инсулиноподобный фактор роста 1 (IGF-1), белки, связывающие инсулиноподобный фактор роста, IL-4, IL-8, эндотелии-1, фактор роста соединительной ткани, TNF-α, фактор роста сосудистого эндотелия (VEGF), циклооксигеназу, ингибитор циклооксигеназы-2, инфликсимаб, IL-10, липазу, протеазу, лизозим, фактор проапоптоза, СОХ-2 и агонист PPAR.
30. Способ по п.21, отличающийся тем, что кодируемый белок для терапии атеросклероза выбран из группы, включающей трансформирующий фактор роста (TGF-альфа), тромбоцитарный фактор роста (PDGF), фактор роста кератиноцитов, инсулиноподобный фактор роста 1 (IGF-1), белки, связывающие инсулиноподобный фактор роста IL-4, IL-8, эндотелин-1, фактор роста соединительной ткани, TNF-α, фактор роста сосудистого эндотелия (VEGF), циклооксигеназу, ингибитор циклооксигеназы-2, инфликсимаб, IL-10, липазу, протеазу, лизозим, фактор проапоптоза, СОХ-2 и агонист PPAR.
31. Способ по любому из пп.13-15, отличающийся тем, что соединение для терапии является ферментом, вызывающим гибель клетки, или ферментом, вызывающим расщепление остатков.
32. Способ по любому из пп.13-15, отличающийся тем, что соединение для терапии является ферментом, переводящим пролекарство в активное соединение.
33. Способ по любому из пп.20-24 и 28-32, отличающийся тем, что детектируемый белок является белком, индуцирующим детектируемый сигнал, который может быть обнаружен с помощью отображения магнитного резонанса.
| US 6217847, 17.04.2001 | |||
| RODRIGUEZ J.F | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Expression of the firefly luciferase gene in vaccinia virus: a highly sensitive gene marker to follow virus dissemination in tissues of infected animals | |||
| Proc Natl Acad Sci USA | |||
| Механическая топочная решетка с наклонными частью подвижными, частью неподвижными колосниковыми элементами | 1917 |
|
SU1988A1 |
Авторы
Даты
2009-12-10—Публикация
2003-06-05—Подача