Изобретение относится к способу получения аттенуированных штаммов бактерий Salmonella, способных продуцировать гетерологичный белок и к вакцинам, содержащим указанные бактерии.
Вирулентные штаммы сальмонеллы (Salmonella) могут быть ослаблены посредством осуществления определенных мутаций в генах, необходимых для их существования и роста in vivo. Разновидности с ослабленной вирулентностью, которые вызывают ограниченные и клинически незначительные заражения, можно рассматривать в качестве потенциальных живых вакцин для перорального применения против заражения сальмонеллой. Так Ту-21a является ослабленным вариантом Salmonella typhi, сохраняющим мутации в galE и других неизвестных ослабленных вариантах, и является производимым по лицензии в ряде стран продуктом, используемым в качестве вакцины против тифа для перорального применения.
В последнее время генетически определенные штаммы Salmonella, сохраняющие определенные индивидуальные мутанты в различных генах, проходили испытания в качестве экспериментальных вакцин для перорального применения для ряда заболеваний. Так, например, показано, что мутанты Salmonella aro, обладающие ауксотрофным сочетанием с рядом ароматических соединений, являются эффективными пероральными вакцинами для мышей, овец, крупного скота, цыплят, а в последнее время на добровольных пациентах продемонстрировано, что они могут быть ослаблены и являться иммуногенными по отношению к человеку. Двойные мутанты Salmonella aro описаны в европейской патентной заявке EP-A-0322237. Двойные мутанты Salmonella cya crp также являются эффективными вакцинами перорального применения.
Наряду с тем, что разновидности Salmonellae с ослабленной вирулентностью являются полноправными вакцинами против сальмонеллеза, их можно рассматривать также в качестве носителей или гетерологичных антигенов для иммунной системы слизистой. Это происходит потому, что Salmonellae могут проникать в организм пероральным путем и являются мощными иммуногенами, способными стимулировать системические и местные клеточные и антительные отзовы. Гетерологичные антигены из бактерий, вирусов и паразитов могут вводиться пациенту с использованием вакцин на основе Salmonella.
Одни из потенциально наиболее серьезных препятствий для использования подобных живых вакцин или поставки антигенов связаны с проблемами стабильности экспрессии чужого антигена in vivo. Нерегулируемая экспрессия больших количеств чужих белков в бактериях на основе множеств копировочных плазмид обычно приводит к быстрой потере плазмины или экспрессированного гена в клетках. Проблему можно поставить под контроль при ферментизации за счет использования индуцируемых промоторных систем, например trp или lac, для осуществления регулируемой индукции генной экспрессии с использованием соответствующей биомассы. Очевидно, что подобные промоторы не могут быть индуцированы с применением экзогенных индукторов типа ПП или ИПТГ в случае, когда бактерии развиваются в тканях хозяина в процессе самоограниченного роста после вакцинации.
Нестабильность плазмид in vivo в ходе вакцинации с использованием живых бактериальных векторов отмечена в ряде работ (Маскелл с сотр., Microb Path, 2, 295 - 305, 1987, Накаяма с сотр., Bio/technology, 6, 693 - 697, 1988, Тайт с сотр., Immunology, 70, 540 - 546, 1990). Был предпринят ряд попыток для решения этой проблемы, включая использование интеграционной системы для экспрессии гетерологичного антигена из бактериальных хромосом (см. Хон с сотр. , Microb Path, 5, 407 - 418, 1988, Страгнели с сотр., Gene, 88, 57-63, 1990). Однако подобный подход применим только для некоторых антигенов, поскольку уровень экспрессии часто довольно низок (см. работу Маскелла с сотр., 1987). Накаями с сотр. описано использование связывания основного гена с экспрессионной плазмидой для стабилизации экспрессии in vivo. Хотя подобный подход и является высокоэффективным, он не предотвращает генерации свободных вариантов плазмиды, а только дает уверенность в том, что они не сохраняются. Дальнейшая стабильная, но нерегулируемая экспрессия высокого уровня чужого антигена в штамме Salmonella для вакцины может замедлять скорость роста, и, следовательно, обладает потенциальным воздействием на иммуногенность живой вакцины.
Настоящее изобретение обеспечивает способ получения штаммов аттенуированных бактерий Salmonella, содержащих nirB промотор, оперативно связанный с последовательностью ДНК, кодирующей гетерологичный белок патогенного организма, предусматривающий получение ДНК-конструкта, содержащего nirB-промотор, оперативно связанный с ДНК последовательностью, кодирующий гетерологичный белок патогенного организма, трансформацию указанным конструктом аттенуированного штамма бактерий Salmonella, выращивание трансформированных бактерий в подходящей питательной среде и отбор целевого штамма.
Изобретение также обеспечивает вакцину против болезни, вызываемой патогенным организмом, содержащую фармацевтически приемлемый носитель или разбавитель и, в качестве активного ингредиента штамм аттенуированных бактерий Salmonella, полученный способом согласно изобретению.
Стабильная экспрессия гетерологичного белка может быть осуществлена in vivo. Salmonella проникают и растут в эукариотических клетках и дают колонии на слизистых поверхностях.
Bordetella, Vibrio, Haemophilus, Neisseria Versinia. В альтернативном варианте бактерии с ослабленной вирулентностью могут представлять собой ослабленный штамм энтеротоксигенной разновидности Escherichia coli. В частности, можно отметить следующие разновидности: S.typhi для случая тифа у человека, S.typhimurium в случае сальмонелеза у некоторых видов животных: S. enteritidis в случае пищевых отравлений у человека, S.choleraesuis в случае сальмонелеза у свиней, Bordetella pertussis в случае коклюшного кашля; Haemophilus influenzal в случае менингита: Neisseria gonorrhoeal в случае гонореи, и Versinia - в случае пищевых отравлений.
Ослабление вирулентного действия бактерий может быть приписана необратимой мутации в генах при пути биосинтеза бактерий через ароматические аминокислоты. По меньшей мере 10 генов включены в синтез хориамата - соединения, соответствующего узловой точке пути биосинтеза через ароматические аминокислоты. Некоторые из элементов этой карты располагаются в далеко отстоящих частях бактериального генома (например aro A (5-снолпирувилсикимат-3-фосфатсинтеза), aro C (хоризматсинтеза), aro D (3-пегидрохинатнергипратаза), и aro E (сикаматиегипрогеназа). Следовательно, мутации могут иметь место в генах aro A, aro C, aro D и aro E.
Однако предпочтительно, если ослабленные бактерии включают необратимую мутацию в каждом из двух дискретных генов пути биосинтеза через ароматические аминокислоты. Подобные бактерии описаны в европейской заявке EP-A-0322237. Двойными мутантами aro-типа, пригодными согласно настоящему изобретению, являются мутантные бактерии aro A, aro C, aro A, aro D и aro A, aro E. Однако и другие бактерии, имеющие мутации в других комбинациях генов aro A, aro C, aro D и aro E, также могут оказаться полезными согласно изобретению. Особенно предпочтительными являются двойные aro-мутанты Salmonella, например двойные aro-мутанты S.typhi или S.typhimurium, в частности мутанты aro A, aro C, aro A, aro D и aro A, aro E.
В альтернативном варианте бактерии с ослабленной вирулентностью могут включать необратимые мутации в гене, связанном с регуляцией одного или нескольких других генов (см. европейскую патентную заявку EP-A-0400958). Предпочтительно мутация имеет место в omp R - гене или в другом гене, включенном в регуляцию. Существует значительное количество прочих генов, связанных с регуляцией, о которых известно, что они обладают способностью давать отзыв на стимуляцию со стороны окружающей среды (см. Ронсон с сотр., cell 49, 579 - 581).
Подобный тип ослабленных бактерий может служить хранителем второй мутации во втором гене. Предпочтительно указанный второй ген является геном, копирующим фермент, включаемый в определенный путь биосинтеза, в особенности геном, включенным в предхоризматную стадию при биосинтезе через ароматические соединения. Следовательно, вторая мутация предпочтительно соответствует типам генов aro A, aro C, или aro D.
Еще одним типом бактерий с ослабленной вирулентностью является те из них, для которых ослабление осуществляется при наличии необратимой мутации в копирующей ДНК бактерии, или связанной с регуляцией экспрессии копирующей ДНК, для белка, получаемого в ответ на воздействие окружающей среды. Подобные бактерии описаны в патенте WO 91/15572. Необратимая мутация может представлять собой делецию, вставку, инверсию или заменение. Мутация в форме делеции может быть сгенерирована с использованием транспозона.
В число примеров белков, которые получают в результате отзыва на воздействие окружающей среды, входят белки, реагирующие на тепловое воздействие (их получают в результате повышения температуры выше 42oC), белки, реагирующие на уменьшение количества питательных веществ (которые получают в результате отзыва на уменьшение содержания основных питательных элементов, например фосфатов или азота до уровня, лежащего ниже того, который требуется для выживания микроорганизмов), белки, реагирующие на токсическое воздействие (которые получают в результате отзыва на токсические соединения, например красители, кислоты, или возможно эксудаты растений), или белки, реагирующие на метаболическое разрушение (которые получают в результате отзыва на флуктуации, например, в уровне содержания ионов, воздействующих на способность микроорганизмов к осморегуляции, или в уровне содержания витаминов или кофакторов, которые способны вызвать прекращение метаболизма.
Предпочтительным белком, реагирующим на тепловое воздействие, является белок, копируемый геном htr A (обозначается также как dep P). Прочие белки кодируются генами, о которых известно, что они участвуют в отзыве на внешнее воздействие, например grp E, gro EL (moPA), dna K, gro ES, lon и dna J. Существует также много других белков, кодируемых генами, вовлеченными в индукцию в виде отзыва на воздействие окружающей среды (см. Ронсон с сотр., Cell 49, 579 - 581). Среди них следует отметить систему ntr B/ntr C E.coli, которая индуцируется в виде отзыва на уменьшение содержания азота и которая положительно регулирует gln A и nif LA (см. Бак с сотр., Nature 320, 374 - 378, 1986; Хиршман с сотр. , Proc. Natl, Acad, Sci, USA 82, 7525, 1985; Никсон с сотр., Proc, Natl, Acad, Sci, USA 83, 7850 - 7854, 1986; Райтцер и Маганзаник, Cell, 45, 785. 1986), система phob/phob E.coli, которая индуцируется при отзыве на уменьшение содержания фосфатов (Макино с сотр., J.Mol. Biol. 192, 549 - 556, 1986), система cpx A/sfr A E.coli, которая индуцируется при отзыве на красители и другие токсичные производные (см. Альбин с сотр. J.Biol.Chem., 261, 4698, 1986, Друри с сотр., J.Biol.Chem., 260, 4236 - 4272, 1985). Аналогичная система для Rhisobium - это dct B/dct D, которая дает отзыв на 4C-дикарбоновые кислоты (Ронсон с сотр., J.Bacteriol, 169, 2424, 49, 579 - 581, 1987). Вирулентная система этого типа описана для Agrobacterium. Она соответствует типу vir A/vir G и индуцируется в виде отзыва на эксудаты растений (см. Ле-Ру со сотр. EMBO. J., 6, 849 - 856, 1987, Стечел и Замбриски, Am. J.Vet. Res, 45, 59 - 66, 1986, Вайненс с сотр., Proc.Natl.Acad.Sci. USA, 83, 8278, 1986). Аналогичным образом система bvg C - bvg A Bordetella pertussis (ранее известная как Vir) регулирует продуцирование вирулентной детерминанты в виде отзыва на флуктуации концентраций иона Mg2+ и никотиновой кислоты (см. Зрико с сотр., Proc. Natl. Acad. Sci. USA, 86, 6671 - 6675).
Для использования в форме живой вакцины бактерии с ослабленной вирулентностью не должны обращаться вновь в вирулентное состояние. Вероятность подобного события при мутации опиничной последовательности ДНК можно рассматривать как незначительную. Однако риском обратного перехода, который может произойти в случае бактерий, ослабленных в результате мутаций в каждой из двух дискретных последовательностей ДНК, пренебрегать нельзя. Следовательно, предпочтительными бактериями с ослабленной вирулентностью являются те из них, или которых ослабление достигается в случае мутации в последовательности ДНК, кодирующей белок, который продуцируется в виде отзыва на воздействие окружающей среды, а также в случае мутации во второй последовательности ДНК.
Вторая последовательность ДНК предпочтительно кодирует Фермент, включенный в основное ауксотрофное направление синтеза или является последовательностью, продукт которой управляет регуляцией генов, реагирующих на изменение условий осмоса, например omp А (Infect and Jmmun) 1989, 2136 - 2140). Наиболее предпочтительным является случай, когда мутация имеет место в последовательности ДНК, включенной в направление биосинтеза через ароматические аминокислоты, более конкретно - последовательности ДНК, кодирующей aro A, aro C, aro D.
Бактерии с ослабленной вирулентностью могут быть получены в результате созданием мутации в последовательности ДНК с использованием известных способов (см. Маниатие, "Лабораторное руководство по молекулярному клонированию", 1982). Невозвратные мутации могут быть вызваны посредством введения гибридного транспозона Ihpho A, например в штамм S.typhimurium Inpho A может генерировать ферментационно активные белковые сшивки щелочной фосфатазы с периплазменными или мембранными белками. Транспозон Inpho A переносит ген, кодирующий способность противостоять воздействию канамидина. Транспуктанты подбирают таким образом, чтобы они обладали способностью противостоять воздействию канамицина, при росте колоний на соответствующей среде или селекции.
Альтернативные способы включают клонирование последовательности ДНК в векторе, например плазмиде или космиде, и вставку избирательного маркеровочного гена в клонируемую последовательность ДНК, приводящего к ее дезактивации. Плазмиду, несущую дезактивированную последовательность ДНК и различные избирательные маркеры, можно вводить в организм с использованием известных способов (см. Маниатие "Лабораторное руководство по молекулярному клонированию", 1982). Имеется возможность путем подходящей селекции идентифицировать мутант, для которого дезактивированная последовательность ДНК рекомбинирует в хромосому микроорганизма, а "дикая" последовательность ДНК становится нефункциональной в процессе, известном как аллельный обмен. В частности используемый вектор предпочтительно нестабилен в микроорганизме и будет спонтанно исчезать. Мутационная последовательность ДНК из плазмиды и "дикая" последовательность ДНК могут взаимно обменяться в результате обмена генотипами. Дополнительные способы предусматривают исключение введения чужой ДНК в штамм вакцины в месте мутации, а также введение в указанный штамм резистентных и антибиотикам маркеров.
Гетерологичный антиген, который бактерии с ослабленной вирулентностью могут экспрессировать, может например включать антигенную петерминанту патогенного организма. Антиген может быть получен из вируса, бактерии, грибков, дрожжей или паразитов. Следовательно гетерологичный белок обычно включает антигенную последовательность, выделенную из вируса, бактерии, грибков, дрожжей или паразитов. Более конкретно, антигенная последовательность может быть получена из вируса иммунодефицита человека (ВИЧ), например ВИЧ-1 или ВИЧ-2, вируса гепатита A или Б, риновируса человека, например типа 2 или типа 14, вируса лихорадки (герпеса), поливируса типа 2 или 3, вируса ящура, вируса гриппа, вируса поражения тазобедренного сустава, антигена клеточной поверхности CD-4 и Chlamydia trachomatis. Антиген может включать сайт связывания рецептора CD-4 ВИЧ, например ВИЧ-1 или ВИЧ-2. В число прочих пригодных антигенов входят субъединица лабильного к нагреванию токсина B E.coli (LT-B), антигены E, coli K-88, белок P.69 из B.pertussis, фрагмент C токсина столбняка и антигены трематоны, микоплазмы, круглых червей, ленточных червей, вируса бешенства и ротавируса.
Предпочтительным промотором для регулирования экспрессии гетерологичного белка является промотор nir B. Промотор nir B был выделен из E.coli, где он направляет экспрессию оперона, включающего ген нитритной репуктазы nir B (см. Джейермен с сотр., J.Mol.Biol, 196, 781 - 788, 1987), nirD, nirC и cys G (см. Пикмен с сотр., Eur J.Biochem 191, 315 - 323, 1990). Он регулируется как нитритами, так и изменениями давления кислорода в окружающей среде, становясь активным при недостатке кислорода (Коул, Biochem.Biophys.Acta. 162, 356 - 368, 1968). Отзыв на анаэробное передается через блок FNR, который действует в качестве транскрипционного активатора, а в соответствии с механизмом, общим для многих анаэробных респираторных генов.
В результате анализа с применением селекции и мутации была выделена часть промотора, дающая отзыв только на анаэробиоз, и в результате сравнения с прочими анаэробно регулируемыми промоторами было идентифицировано состояние сайта FNR-связывания (Белл с сотр., Nucl.Acids Res. 17, 3865 - 3874, 1989; Джейермен с сотр. , Nucl.Acids.Res. 17, 135 - 1454, 1989). Показано также, что расстоянием между путативным сайтом FNR-связывания и гомологической областью - 10 является критическим (Белл с сотр., Molec.Microbiol., 4, 1753 - 1763, 1990). Следовательно предпочтительно использовать только ту часть nirB-промотора, которая дает отзыв только на анаэробиоз. В данном описании под термином "nir B-промотор" понимается как сам по себе промотор, так и часть его производного, способная промотировать экопрессию копирующей последовательности в анаэробных условиях. Последовательность, реально использованная согласно настоящему изобретению, содержащая nir B-промотор, имеет структуру:
AATTCAGGTAAAXXXGATGTACATCAAATGGTACCCCTTGCTGAATCGTTAAGGTAGGCGGTAGGGCC
Для трансформации в способе согласно изобретению можно использовать любые известные методы, например, электрофорез. Таким образом получают ослабленные бактерии, способные к экспрессии белка, гетерологичного по отношению к бактерии. Культуру бактерий с ослабленной вирулентностью можно выращивать в аэробных условиях. Таким способом получают достаточное количество бактериального препарата для приготовления вакцины при минимальной экспрессии гетерологичного белка.
Генная конструкция ДНК обычно представляет собой способный к репликации вектор экспрессии, включающий nirB-промотор, связанный с последовательностью ДНК, кодирующей гетерологичный белок. nir B-промотр можно вводить в вектор экспрессии, который уже содержит ген, кодирующий гетерологичный белок, вместо имеющегося промотора, регулирующего экспрессию белка. Естественно, что вектор экспрессии должен быть совместим с ослабленными бактериями, в которые необходимо его ввести.
Вектор экспрессии должен быть снабжен соответствующими контрольными элементами транскрипции и трансляции, включающими, помимо nirB-промотор, сайт завершения транскрипции и кодоны начала и конца трансляции. Предусматривается также соответствующий сайт рибосомного связывания. Вектор обычно содержит область начала репликации и при желании - специальный маркерный ген, например, ген, отвечающий за сопротивляемость антибиотикам. Вектор может представлять собой плазмиду.
Вакцину предпочтительно получают в лиофилизированной форме, например, в виде капсул, предназначенной для перорального введения. Указанные капсулы могут иметь пищевую оболочку, например, из "Юдрегейт-S", "Юдрегейт-L", ацетата целлюлозы, фталата целлюлозы или оксипропилметилцеллюлозы. Капсулы можно применять как сами по себе, так и после восстановления первичного состояния лиофилизированного продукта перед введением, например, в виде суспензии. Восстановление исходного состояния осуществляют в буферном растворе при подходящем pH, обеспечивающем жизнеспособность микроорганизмов. Для защиты ослабленных бактерий и вакцины от желудочной кислотной среды, перед каждым ее введением предпочтительно вводят препарат бикарбоната натрия. В альтернативном варианте вакцину получают в виде рецептуры для парентерального, насального способа введения, или для введения через молочную железу.
Вакцину согласно настоящему изобретению можно использовать для профилактики пациентов, предпочтительно человека, хотя возможно ее применение и на животных. Возникновение заражения, вызванного патогенным источником, таким образом, может быть предотвращено в результате введения эффективной дозы вакцины согласно настоящему изобретению. Вслед за этим бактерии экспрессируют гетерологичный белок, способный повышать уровень антител к данному микроорганизму. Используемые дозировки зависят от различных факторов, включая рост и вес пациента, типа вакцины и природы гетерологичного белка. Однако в случае ослабленных бактерий S.typhi для взрослого пациента с весом тела 70 кг предпочтительной является дозировка для перорального введения, содержащая 109 - 1010 микроорганизмов S.typhi на дозу.
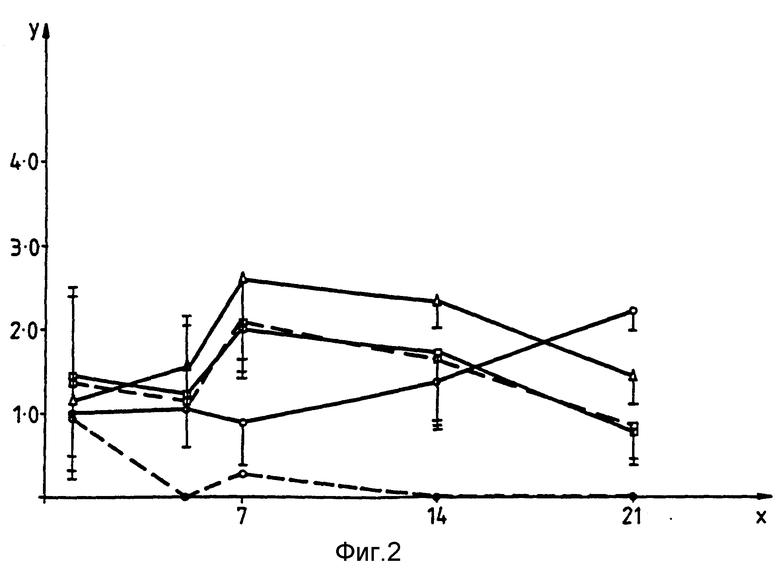
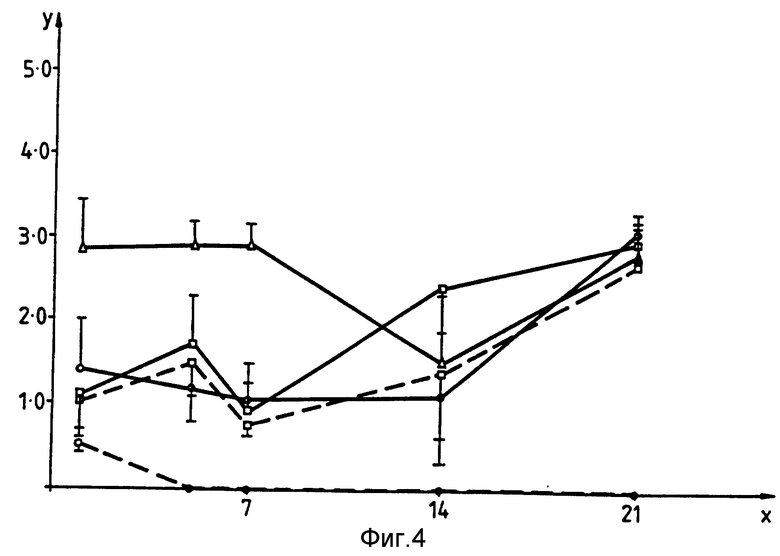
Приведенные ниже примеры иллюстрируют изобретение. На прилагаемых фиг. 1-4 показана способность изолятов S typhimurium к росту in vivo соответственно в печени, селезенке, лимфатических фолликулах (Пейеровых бляшках) и брыжеечных лимфатических узлах мышей BALB/C. На оси X отложено количество суток после заражения, на оси Y - десятичный логарифм от числа выживших микроорганизмов на каждый из органов, на графике Δ обозначает изолят BRD - 509, □ - изолят BRD - 847,  изолят BRD - 743, --- обозначает отсутствие, а --- -введение ампициллина.
изолят BRD - 743, --- обозначает отсутствие, а --- -введение ампициллина.
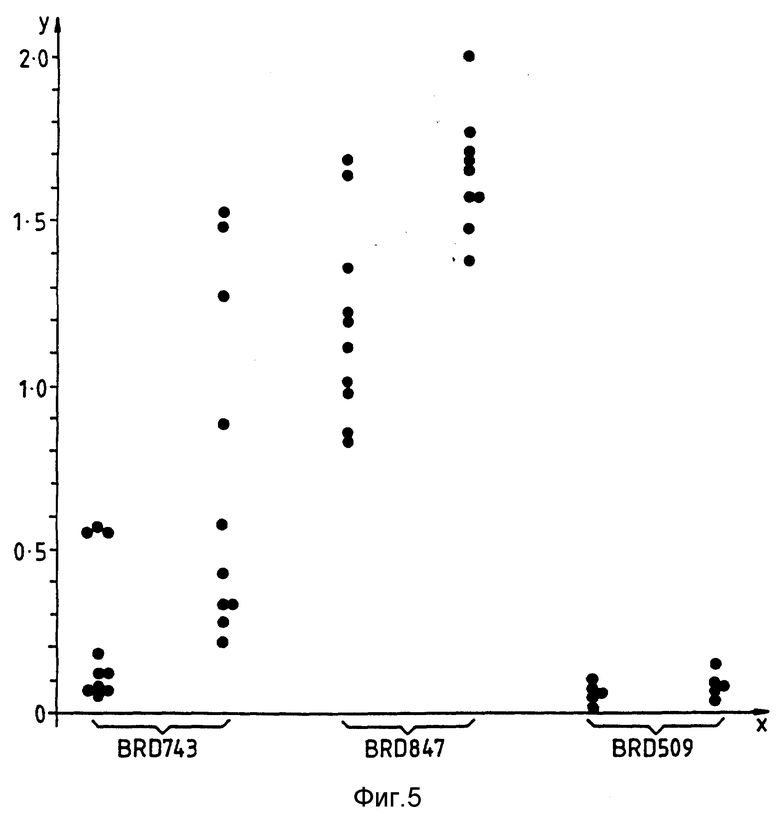
На фиг. 5 показаны титры мышиной сыворотки против фрагмента C противостолбнячного токсина. На оси X обозначены типы бактерий, использованных для заражения мышей; число доз указано в скобках. На оси Y обозначено значение поглощения при 492 нм.
Пример. Получение pTET nir 15.
Экспрессионную плазмиду pTET nir 15 получают из pTET 115 (см. Макофф с сотр. Nucl. Acids. Res. 17, 10191-10202, 1989) в результате замены области EcoRI-ApaI, длинной 1354 пар оснований, содержащей lacI-ген и tac-промотор, на следующую пару олигонуклеотидов 1 и 2:
oligo - 1 5'-AATTCAGGTAAAXXXGATGTACATCAAATGGTACCCCTTGCTGAATC
oligo - 2 3'-GTCCAXXXAAACTACATGTAGXXXACCATGGGGAACGACTTAG
GTTAAGGTAGGCGGTAGGGCC - 3'
CATTCCATCCGCCATC - 5'
Олигонуклеотиды синтезируют с использованием "Ген Ассемблер" фирмы "Фармация", наличие полученной плазмиды подтверждает секвенированием (см. Макофф с сотр. Bio/Technology 7, 1043 - 1046, 1989).
Получение SL - 1334 aro A aro D, содержащего pTET nir 15.
С целью получения штамма вакцины Salmonella, экопрессирующего фрагмент C токсина столбняка по контролем nirB-промотора, промежуточный штамм, S.typhimuriam LB-5010 (r) (см. Буллас и Рио. J.Bact., 156, 471 - 474, 1983) трансформируют pTET nir 15. Колонии, экспрессирующие фрагмент C, детектируют посредством селекции с применением антибиотиков с последующим иммунноблотированнием посредством сыворотки фрагмента C токсина столбняка. Колонии выращивают в течение ночи в аэробных условиях на нитроцеллюлозном фильтре, после чего осуществляют индуцирование посредством выдерживания в течение 4 часов перед иммуноблотированием в анаэробных условиях. Штамм, стабильно экспрессирующий фрагмент C используют для получения плазмидной ДНК. Ее применяют для трансформации методом электрофореза изолята S.typhimurium SL-1344 aro A aro D, обозначаемого BRD-509. Штамм, стабильно экспрессирующий фрагмент C (что проверяют иммуноблотированием в соответствии с описанным выше способом), используют для опытов in vivo под обозначением BR D - 847.
Сравнение кинетики in vivo для BRD-743 и BRD-847 на мышах BAL B/C.
Способность расти in vivo или BRD-734 (BRD-509, содержащий pTET85) и BRD-847 проверяют при пероральном введении препарата мышам BAL B/C. pTET 85 получают из pTET tac 115 (см. Макофф с сотр., Nucl.Acids.Res., 17 10191 - 10202, 1989) в результате делеции фрагмента EcoRI, длинной 1,2 тыс. пар оснований, несущего lacI-ген. В результате происходит экспрессия фрагмента C в штамме Salmonella. Число бактерий определяют в печени, селезенке, лимфатических фолликулах (Пайеровых бляшках) и в брыжеечных лимфатических узлах. Выделенные у мышей бактерии также исследуют на предмет их способности расти на содержащих ампициллин культурах (в качестве индивикатора процентного количества микроорганизмов, еще сохраняющих экспрессионный фрагмент C плазмиды. Результаты приведены на фиг. 1-4. При использовании одинаковых начальных количеств микроорганизмов (5•109) для заражения мышей обнаружено, что как BRD-743, так и BRD-847 способны проникать и сохраняться во всех исследованных тканях мышей, однако при более низком уровне по сравнению с BRD-509. Однако интересное отличие состоит в том, что количество резистентных к ампициллину микроорганизмов, полученных от мышей, зараженных BRD-743 быстро уменьшается, и все выделенные микроорганизмы становятся чувствительными к ампициллину на 14 сутки. Этот факт говорит о том, что селекция in vivo быстро приводит к потере pTET 85 из штамма вакцины Salmonella. Напротив, исследования, проведенные в отсутствии и в присутствии ампициллина для BRD-847, давали одинаковые результаты при наблюдении времени заражения. Это иллюстрирует дополнительное преимущество pTET 15 в вакцинном штамме S.typhimurium, получаемом из микроорганизмов, обладающих потенциальной возможностью к экспрессии Фрагмента C in vivo в течение более продолжительного периода времени, что является основным преимуществом с точки зрения иммуногенности.
Иммунизация мышей BAl B/C с использованием штаммов Salmonella, содержащих pTET85 (BRD-743) или рTET nir 15 (BRD-847).
Группам из 20 мышей вводят перорально от 5•109 клеток культур BRD-743, BRD-847 или BRD-509. На 25 сутки у всех мышей отбирают образцы сыворотки и анализируют методом иммуноферментного анализа на предмет наличия противостолбнячных антител. У всех мышей, зараженных BRD-847, наблюдается измеримое количество антител против фрагмента C спустя 25 суток, тогда как у мышей, зараженных BRD-743, или BRD-509, этого не наблюдается (см. фиг. 5). На 25 сутки по 10 мышей каждой из групп подвергают повторной иммунизации (для групп, зараженных BRD-743 и BRD-847). Полученные значения для мышей, повторно иммунизированных BRD-847, значительно выше, чем для мышей, повторно иммунизированных BRD-743. Мыши, повторно иммунизированные перорально BRD-509, не дают сколь-нибудь значительного отзыва на фрагмент С.
Контрольное заражение токсином столбняка мышей, иммунизированных путем перорального введения BRD-743 и BRD-847.
Вакцинацию мышей осуществляют перорально с использованием BRD-743, BRD-847 и BRD-509, после чего их используют для испытания иммунизации против контрольного заражения токсином столбняка (после введения одной или двух доз иммунизирующего штамма). Группам по 20 мышей дают по единичной пероральной дозе в 5 х 109 микроорганизмов, и группы по 10 мышей подвергаются контрольному заражению на 25-е сутки после вакцинации с использованием 50 50%-ных смертельных доз токсина столбняка (см.табл.1). Вакцинированные BRD-847 мыши являются полностью защищенными против контрольного заражения после однократного перорального введения единичной дозы, тогда как вакцинированные BRD-743 мыши защищены только частично (2 уцелевших на 10 животных). Остальные группы по 10 мышей получают по второй дозе (5 х 109) микроорганизмов на 15 сутки после начала испытания, и подвергаются контрольному заражению на 46 сутки после введения первой дозы. Вновь вакцинированные BRD-847 мыши являются полностью защищенными против контрольного заражения, тогда как вакцинированные BRD-743 мыши защищены только частично (5 уцелевших из 10). Мыши, иммунизированные 1 или 2 дозами BRD- 509, полностью погибают после контрольного заражения. BRD- 847 является эффективной после однократного перорального приема вакцины против токсина столбняка при контрольном заражении мышей. Для некоторых групп мышей проводили контрольное заражение токсином столбняка после внутривенного введения 1 или 2 доз по 10 микроорганизмов штаммов BRD-847 и BRD-743. Все мыши являются полностью защищенными против контрольного заражения токсином столбняка после введения 1 и 2 доз штамма вакцины.


Изобретение обеспечивает способ получения штаммов аттенуированных бактерий Salmonellа, содержащих nirB-промотор, оперативно связанный с последовательностью ДНК, кодирующей гетерологичный белок патогенного микроорганизма, предусматривающий получение ДНК-конструктора, содержащего nirB-промотор, оперативно связанный с ДНК-последовательностью, кодирующий гетерологичный белок патогенного микроорганизма, трансформацию указанным конструктором аттенуированного штамма бактерий Salmonellа, выращивание трансформированных бактерий в подходящей питательной среде и отбор целевого штамма. Изобретение также обеспечивает вакцину против болезни, вызываемой патогенным микроорганизмом, содержащую фармацевтически приемлемый носитель или разбавитель и, в качестве активного ингредиента штамм аттенуированных бактерий Salmonellа, полученный способом согласно изобретению. Вакцину можно использовать для профилактики пациентов, предпочтительно человека, хотя возможно ее применение и на животных. 2 с. и 5 з.п. ф-лы, 5 ил., 1 табл.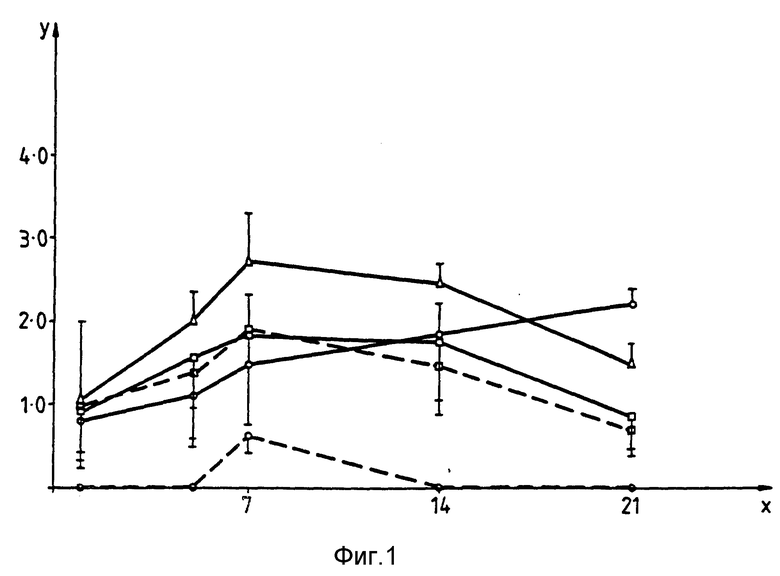
| ШАГОВЫЙ ПНЕВЛ110ДВИГАТЕЛЬ | 0 |
|
SU285152A1 |
Авторы
Даты
1999-02-20—Публикация
1992-03-05—Подача