Изобретение относится к рекомбинантным полипептидам, которые представляют собой антигены Helicobacter pylory; указанные антигены экспрессируются на поверхности как делящихся (бациллярных), так и покоящихся (коккоидных) форм Н. pylori, и вызывают как системное, так и местное (в слизистой оболочке) увеличение синтеза антител. Изобретение, кроме того, относится к молекулам нуклеиновых кислот, кодирующим вышеуказанные полипептиды, а также векторам и клеткам-хозяевам, содержащим такие молекулы нуклеиновых кислот. Указанные рекомбинантные полипептиды полезны для диагностики инфекций, вызываемых Н. pylori, и для изготовления вакциннных композиций, которые будут вызывать (элисировать) защитный иммунный ответ против таких инфекций, вышеуказанные вакциннные композиции подходят как для терапевтического, так и для профилактического применения.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Грамотрицательная бактерия Helicobacter pylori является важным патогенным микроорганизмом человека, вовлеченным в несколько гастродуоденальных заболеваний. Колонизация этой бактерией эпителиальной ткани желудка ведет к активному воспалению и к прогрессирующему хроническому гастриту со значительно увеличенным риском развития пептической язвенной болезни.
Для того, чтобы колонизировать слизистую оболочку желудка, бактерии Н. pylori используют ряд факторов вирулентности. Такие факторы вирулентности включают в себя несколько адгезинов, с помощью которых бактерия соединяется со слизью и/или связывается с эпителиальными клетками; уреазы, которые помогают нейтрализовать кислотную среду; и протеолитические ферменты, которые делают слизь более жидкой.
Несмотря на очевидный сильный иммунный ответ организма-хозяина на Н. pylori, который сопровождается синтезом как местных (в слизистой оболочке), так и системных антител, патоген сохраняется в слизистой оболочке желудка, обычно в продолжении жизни хозяина. Причина этого, вероятно, заключается в том, что спонтанно индуцированный иммунный ответ либо неадекватен, либо направлен против неправильных эпитопов антигена.
Для того, чтобы понять патогенез и иммунологию инфекций, вызываемых Н. pylori, очень важно определить антигенную структуру этих бактерий. Это необходимо, в частности, для характеристики поверхностно-проявляющихся (подобно адгезинам) и секретирующихся белков, которые у многих бактериальных патогенов, как было ранее показано, составляют основные факторы вирулентности, и которые могут быть полезны для диагностики инфекций Н.pylori и для изготовления вакцинных композиций.
Известно (Evans et al. (1993) J.Bacteriol. 175, 674-683) клонирование гена hpaА, который кодирует 20 кДа рецептор-связывающуюся субединицу N-ацетилнейроаминиллактозо-связывающегося фибриллярного гемагглютинина (NLBH) Н.pylori.
Известны (Bolin et al. (1995) J. Clin. Microbiol. 33, 381-384) моноклональные антитела (MAbs) против мембранных препаратов Н.pylori. Одно из этих моноклональных антител, обозначенное НР30-1:1:6, реагирует с белком 30 кДа, который, как было показано, проявляется на поверхности неповрежденых бактерий и имеет свойства, аналогичные свойствам адгезина.
В стрессовых состояниях или в условиях, угрожающих ее существованию, клетка Н. pylori переходит из бациллярной в коккоидную форму. В коккоидной форме клетка Н. pylori намного менее чувствительна к антибиотикам и другим антибактериальным агентам. Косвенные данные указывают на то, что бактерии Н. pylori могут переноситься между индивидуумами в этой форме, возможно через воду или при прямом контакте. Таким образом, эффективная вакцинная композиция должна вызывать иммунный ответ как на коккоидную, так и на бациллярную формы Н.pylori. Так как системный иммунитет играет, вероятно, только ограниченную роль в защите против инфекций слизистой оболочки, важно также, чтобы вакцинная композиция усиливала защитные иммунные механизмы локально в желудке.
ЗАДАЧА ИЗОБРЕТЕНИЯ
Задача изобретения заключается в получении антигенного полипептида Н. pylori, который может быть полезным среди прочего для того, чтобы вызывать защитный иммунный ответ против инфекции Н.pylori, и для ее диагностики. Эта задача была решена рекомбинантным клонированием гена Н.pylori, который кодирует проявляющийся на поверхности белок. Нуклеотидная последовательность этого гена похожа на известную (Evans et al. (1993), Journal of Bacteriology, vol. 175, 674-683) последовательность гена hpaA. Однако в то время как ген hpaA, как было показано, кодирует белок 20 кДа, в данном случае неожиданно было обнаружено, что молекула ДНК по изобретению кодирует полипептид с молекулярной массой 29 кДа.
Полипептид 29 кДа, как было показано, является антигенным белком, который экспрессируется во всех штаммах Н.pylori, a также в коккоидных формах этой бактерии, и который способен индуцировать в организме-хозяине иммунный ответ как в слизистой оболочке, так и системный иммунный ответ, измеряемый как продукция антител. Этот полипептид 29 кДа экспрессируется всеми проверенными штаммами Н. pylori, и антитела, полученные к этому белку, не дают перекрестной реакции с распространенными эндогенными бактериями человека других видов или с отобранными тканями человека, включая слизистую оболочку желудка. Таким образом, будучи существенным, высоко консервативным адгезином с иммуногенными свойствами, полипептид 29 кДа будет полезен как для обнаружения инфекций Н.pylori, так и для изготовления вакцинных композиций, которые в виде соответствующего фармацевтического препарата будут вызывать защитный или терапевтический иммунный ответ против таких инфекций.
Приведенные ниже экспериментальные данные указывают на то, что белок 29 кДа Н. pylori важен для колонизации Н.pylori и/или сохранения инфекции, так как связывание моноклонального антитела для белка 29 кДа приводит к полному ингибированию колонизации Н.pylori у мышей. Кроме того, белок 29 кДа Н.pylori при использовании в качестве орального иммуногена действует как стимулятор иммунного ответа, приводящий к существенному уменьшению колонизации Н. pylori у мышей, которые были инфицированы Н.pylori за месяц до иммунизации.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
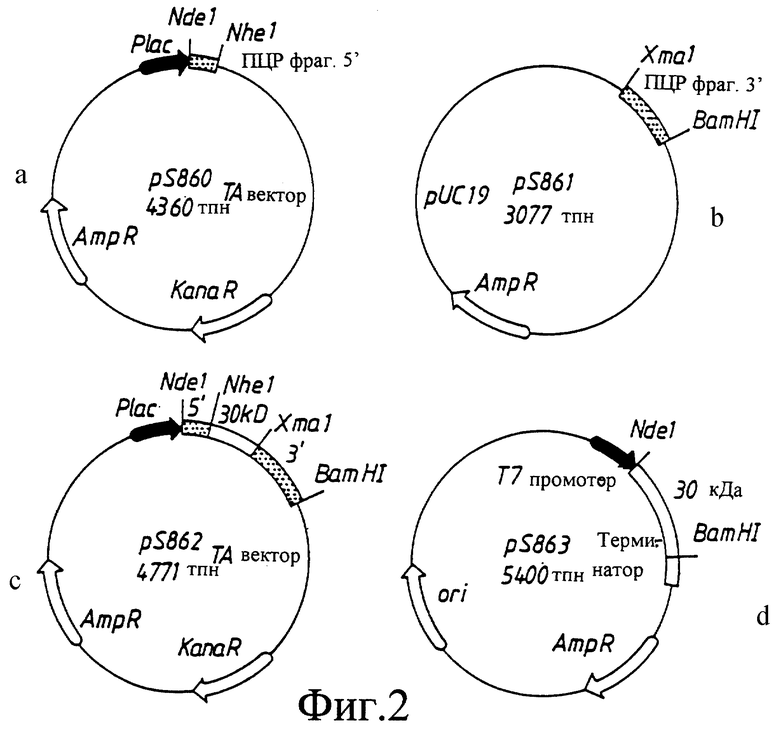
фиг. 1: Рестрикционная карта плазмиды pAEI, содержащей фрагмент ДНК Н. pylori размером 1,7 тпн, кодирующий полипептид 29 кДа. Заштрихованный прямоугольник указывает положение структурного гена. Расположение Т3 и Т7 промоторных последовательностей показано над черными прямоугольниками, обозначающими вектор.
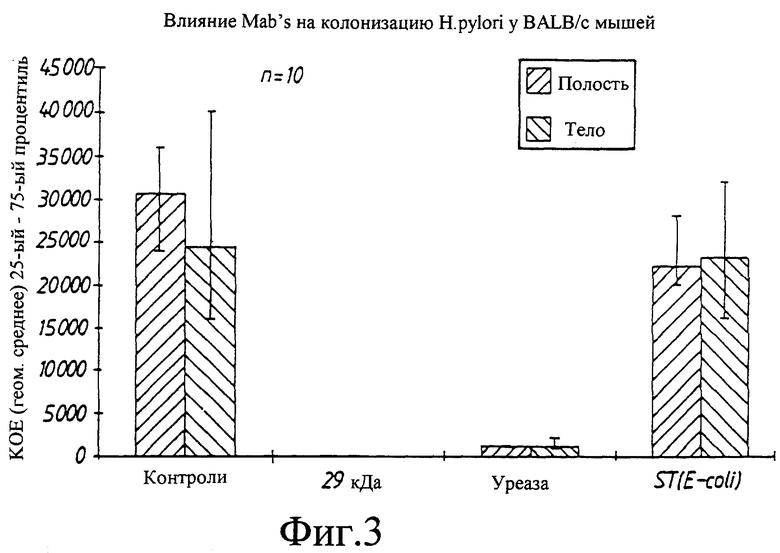
фиг.2 (а,b,с,d). Карты плазмид pS860, pS861, pS862 и pS863. Черные стрелки: промотор lac-оперона (Plac) или промотор РНК-полимеразы бактериофага Т7 (Т7 промотор). Закрашенные серым цветом участки: 5'-конец или 3'-конец гена, кодирующего белок 29 кДа, полученные при помощи ПЦР. Терминатор: терминатор Т7-транскрипции. Ori: ориджин репликации плазмиды pBR322.
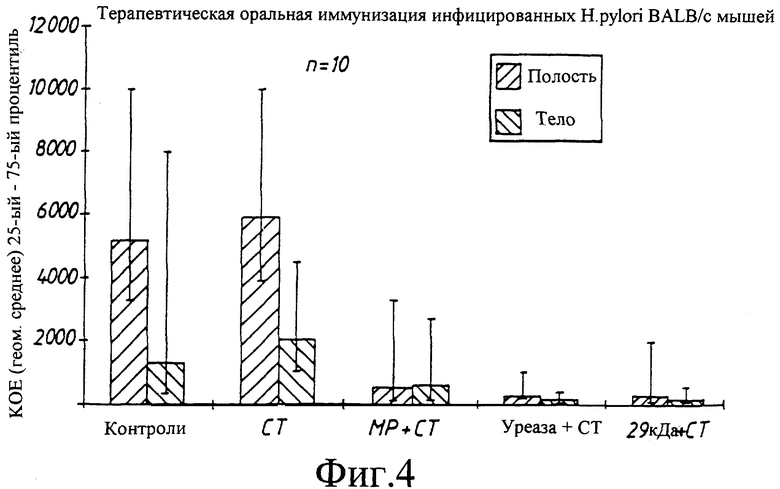
фиг. 3: Влияние моноклональных антител на колонизацию Н.pylori у мышей линии BALB/c.
фиг. 4: Терапевтическая оральная иммунизация инфицированных Н.pylori мышей линии BALB/c.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В тексте данного описания, в частности в приведенных ниже примерах, под терминами "стандартные протоколы" и "стандартные процедуры" при их использовании в контексте методов молекулярного клонирования, понимаются те протоколы и процедуры, которые можно найти в любом традиционном лабораторном руководстве (Sambrook, J., Fritsch, E.F. and Maniatis, Т. (1989) Molecular Cloning: A laboratory manual, 2nd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY).
В первом важном аспекте данного изобретения предлагается рекомбинантный полипептид, который имеет аминокислотную последовательность, идентичную или по существу схожую с поверхностно-проявляющимся антигеном Helicobacter pylori с молекулярной массой примерно 29 кДа.
Указанный поверхностно-проявляющийся антиген по изобретению обладает, среди прочих, следующими важными свойствами:
- он является адгезином, который важен для колонизации слизистой оболочки желудка;
- он экспрессируется на поверхности как делящихся (бациллярных), так и покоящихся (коккоидных) форм Н.pylori;
- он является сильным антигеном, вызывающим увеличение как системной, так и местной (в слизистой оболочке) продукции антител;
- он сохраняется во всех проверенных штаммах Н.pylori;
- антитела к полипептиду 29 кДа не дают перекрестной реакции с целым рядом различных бактерий, не принадлежащих к роду Helicobacter, или с отобранными тканями человека, включая слизистую оболочку желудка;
- полипептид 29 кДа является липидизированным и, следовательно, пост-трансляционно модифицированным полипептидом. Эта особенность полипептида может иметь значение для его иммуногенности и для его надлежащего проявления на поверхности Н. pylori. Из уровня техники известно, что липидная модификация может быть существенной для иммунологических свойств бактериальных липопротеинов (Weis, J.J. et al. (1994) Infection и Immunity, vol. 62, 4632-4636);
- он является предполагаемым фактором вирулентности, в результате чего под термином "фактор вирулентности" должна подразумеваться молекула, специфически вовлеченная в прилипание Н.pylori к эпителиальной поверхности слизистой оболочки желудка и/или в установление и поддержание инфекции, вызываемой Н.pylori.
В предпочтительной форме указанный полипептид имеет аминокислотную последовательность, соответствующую положениям аминокислот 1-260, или 28-260 в последовательностях SEQ ID NO: 2 или 4, указанных в Списке последовательностей. Как описано далее в экспериментальном разделе, предполагается, что положения 1-260 в SEQ ID NO:2 и 4 представляют нерасщепленный белок, в то время как положения 1-27 представляют сигнальную последовательность, а положения 28-260 представляют зрелый полипептид. Единственное различие между SEQ ID NO:2 и 4 заключается в том, что SEQ ID NO:2 имеет Ser-остаток в положении 222, в то время как SEQ ID NO:4 имеет в том же самом положении Аrg-остаток.
Однако полипептид по изобретению не должен строго ограничиваться полипептидом с аминокислотной последовательностью, идентичной с вышеупомянутыми положениями аминокислот в SEQ ID NO:2 или 4 из Списка последовательностей. Скорее изобретение охватывает полипептиды, имеющие модификации типа замен, маленьких делеций, вставок или инверсий, но которые тем не менее обладают по существу свойствами полипептида 29 кДа по изобретению. Такие свойства включают в себя способность вызывать иммунный ответ в слизистой оболочке, а также системный иммунный ответ против Н.pylori у млекопитающего-хозяина; способность действовать как адгезин; присутствие полипептида как в бациллярных, так и коккоидных формах Н.pylori.
Следовательно, изобретение охватывает полипептиды, аминокислотная последовательность которых по меньшей мере на 90% гомологична, предпочтительно по меньшей мере на 95% гомологична аминокислотной последовательности, показанной в положениях 1-260, или в положениях 28-260 в SEQ ID NO:2 или 4 в Списке последовательностей, которые тем не менее обладают по существу биологическими активностями полипептида 29 кДа по изобретению.
Изобретение охватывает также пептиды с длиной по меньшей мере 5 аминокислот, которые содержат иммуногенный эпитоп полипептида 29 кДа по изобретению и сохраняют способность вызывать в хозяине-млекопитающем иммунный ответ против бактерии Н. pylori. Такой эпитоп (эпитопы) может быть представлен один или в виде слитых белков, где эпитоп слит с инертным или иммунологически активным полипептидом-носителем. Идентификация этих эпитопов может быть основана на присутствии синтезируемых хозяином антител к различным сегментам полипептида 29 кДа.
Один из способов получения структурной информации относительно эпитопов полипептида 29 кДа заключается в продуцировании и характеристике моноклональных антител, связывающихся с полипептидом, с последующим картированием эпитопов, например, при помощи метода Pepscan. Моноклональные антитела могут быть получены стандартными методами (De St. Groth (1980) J. Immunol. Methods, vol. 35, 1-21).
В другом аспекте изобретения предлагается выделенная и очищенная молекула нуклеиновой кислоты, которая имеет нуклеотидную последовательность, кодирующую полипептид, как он определен выше. В предпочтительной форме изобретения указанная молекула нуклеиновой кислоты представляет собой молекулу ДНК, которая имеет нуклеотидную последовательность, идентичную последовательностям SQE ID NO:1 или 3 из Списка последовательностей. Однако молекула ДНК по изобретению не должна быть строго ограничена последовательностью, показанной как SEQ ID NO:1 или 3. Изобретение скорее охватывает молекулы ДНК, имеющие модификации типа замен, небольших делеций, вставок или инверсий, которые тем не менее кодируют полипептиды, обладающие по существу биохимической активностью полипептида 29 кДа по изобретению. Специалистам в данной области известно, что замены оснований А на G и Т на С, которые не влияют на аминокислотную последовательность, не являются необычными в Н. pylori. Единственное различие между SEQ ID NO:1 и 3 заключается в том, что SEQ ID NO: 1 имеет в положении 1458 остаток А, в то время как SEQ ID NO:3 имеет в том же самом положении остаток С.
В данное изобретение включаются также молекулы ДНК, нуклеотидные последовательности которых из-за генетического кода являются вырожденными относительно нуклеотидных последовательностей, обозначенных как SEQ ID NO:1 или 3. Так как имеется 64 возможных кодона, но только 20 природных аминокислот, большинство аминокислот кодируются более чем одним кодоном. Это естественная "вырожденность" или "избыточность" генетического кода, хорошо известна специалистам в данной области. Таким образом, должно быть очевидно, что последовательность ДНК, показанная в Списке последовательностей, является только одним примером из большой, но определенной группы последовательностей ДНК, которые будут кодировать описанный выше полипептид.
Следовательно, данное изобретение включает в себя выделенную молекулу нуклеиновой кислоты, выбранную из:
(а) молекул нуклеиновых кислот, содержащих нуклеотидную последовательность, которая идентична или существенно схожа с положениями 796-1572 в SEQ ID NO:1 или 3 в Списке последовательностей соответственно;
(б) молекул нуклеиновых кислот, содержащих нуклеотидную последовательность, способную к гибридизации с нуклеотидной последовательностью, комплементарной кодирующей полипептид области молекулы ДНК, как она определена в (а), которая кодирует полипептид по изобретению, или его функционально эквивалентную модифицированною форму; и
(в) молекул нуклеиновых кислот, содержащих последовательность нуклеиновой кислоты, которая является вырожденной как результат генетического кода относительно нуклеотидной последовательности, как она определена в (а) или (б), и которая кодирует полипептид по изобретению, или его функционально эквивалентную модифицированную форму.
Еще один аспект изобретения составляет вектор, который содержит молекулу нуклеиновой кислоты по изобретению. Такой вектор может предпочтительно быть плазмидным вектором рАЕ1 (депонирован согласно Будапештскому Соглашению под регистрационным номером NCIMB 40732).
Вектор по изобретению также может быть реплицирующимся вектором экспрессии, который содержит молекулу нуклеиновой кислоты по изобретению и способен обеспечивать ее экспрессию. В настоящем контексте термин "реплицирующийся" означает, что вектор способен к репликации в том типе клеток-хозяев, в которые он был введен. Примерами векторов являются вирусы, например бактериофаги, космиды, плазмиды и другие рекомбинационные векторы. Молекулы нуклеиновой кислоты встраиваются в геномы векторов при помощи стандартных методов, известных специалистам. Вектор экспрессии согласно изобретению предпочтительно может быть любым из векторов pAL30:l, pAL30:2, pAL30: 3, pAL30:4 или, более предпочтительно, вектором рS863.
В изобретение входит также клетка-хозяин, наследующая вектор по изобретению. Такой клеткой-хозяином может быть прокариотическая клетка, одноклеточный эукариотический организм или клетка, полученная из многоклеточного организма. Таким образом, клеткой-хозяином может быть, например, бактериальная клетка, такая как клетка E.coli; дрожжевая клетка, например клетка Saccharomyces cerevisiae или Pichia pastoris, или клетка млекопитающих. Методы, используемые для эффективного введения вектора в клетку-хозяина, являются стандартными методами, хорошо известными специалистам, знакомым с методами рекомбинантной ДНК.
В другом аспекте изобретения предлагается способ получения полипептида, как определено выше, при котором клетку-хозяина, транформированную вектором экспрессии, как определено выше, культивируют в условиях, при которых продуцируется указанный полипептид, и выделяют указанный полипептид.
Среда, используемая для выращивания клеток, может быть любой традиционной средой, подходящей для данных целей. Подходящим вектором может быть любой из векторов, описанных выше, и соответствующей клеткой-хозяином может быть любая из типов клеток, перечисленных выше. Методы, используемые для конструирования вектора и эффективного его введения в клетку-хозяина, могут быть любыми методами, используемыми для этих целей, известными в области рекомбинантной ДНК. Рекомбинантный полипептид, экспрессируемый такими клетками, может быть секретируемым полипептидом, то есть экспортируемым через клеточную мембрану, в зависимости от типа клетки и строения вектора.
Если полипептид продуцируется внутриклеточно рекомбинантной клеткой-хозяином, то есть не секретируется клеткой, он может быть выделен стандартными методами, включающими в себя разрушение клетки механическими средствами, например с помощью разрушения ультразвуком или гомогенизации, или ферментативными или химическими средствами с последующей очисткой полипептида. Чтобы полипептид был секретируемым, последовательности ДНК, кодирующей полипептид, должна предшествовать последовательность, кодирующая сигнальный пептид, присутствие которого гарантирует секрецию полипептида из клетки таким образом, чтобы по меньшей мере существенная доля экспрессируемого полипептида секретировалась в культуральную среду и затем могла быть выделена в чистом виде.
Дальнейший аспект изобретения составляет полипептид по изобретению для использования в терапии, для использования в диагностике инфекции Helicobacter pylori у млекопитающих, включая человека, и для использования в качестве терапевтической или профилактической вакцины.
Другой важный аспект изобретения составляет вакцинная композиция для индуцирования защитного иммунного ответа у млекопитающих, включая людей, против бациллярной и/или коккоидной формы Helicobacter pylori. Такая вакцинная композиция содержит иммуногенно эффективное количество полипептида, как определено выше, включая по меньшей мере часть полипептида 29 кДа, содержащую иммуногенный эпитоп, или модифицированной формы указанного полипептида, которая сохраняет способность индуцировать защитный иммунитет против инфекции Helicobacter pylori. Термин "модифицированная форма" включает в себя, но не ограничен ими, такие формы полипептида, которые являются посттрансляционно модифицированными, например липидизированными. Полагается, что белок 29 кДа является липидизированным, см. Пример 4 ниже.
Оптимально вакцинная композиция содержит также фармацевтически приемлемый носитель или разбавитель, или другие иммунологически активные антигены для профилактического или терапевтического применения. Физиологически приемлемые носители и разбавители хорошо известны специалистам в данной области и включают в себя, например, забуференный фосфатом солевой раствор (PBS), или, в случае оральных вакцин, препараты на основе НСО3 - или порошковые препараты с энтеросолюбильным покрытием.
Вакцинная композиция может дополнительно включать в себя или вводиться совместно с ингибиторами кислой секреции, предпочтительно с ингибиторами протонного насоса (PPIs), например с омепразолом. Вакцина может быть изготовлена в виде препарата в известных системах доставки, например в липосомах, ISCOMs (иммуностимулирующие комплексы), коклеаты и т.д. (Rabinovich et al. (1994) Science 265, 1401-1404), или может быть присоединена или включена в полимерные микросферы разлагаемой или неразлагаемой природы. Антигены могут быть ассоциированы с живыми аттенуированными бактериями, вирусами или фагами или с убитыми векторами того же рода.
Как будет показано ниже в экспериментальной части, вакцинная композиция по изобретению может использоваться как для терапевтических, так и для профилактических целей. Вакцинная композиция по изобретению предпочтительно вводится в любую слизистую оболочку млекопитающих, например слизистую оболочку рта, носа, небной миндалины, желудка, кишечника (толстой и тонкой кишки), прямой кишки или влагалища. Вакцины для слизистой оболочки можно вводить вместе с соответствующими этой цели адъювантами. Вакцину можно также вводить парентерально, подкожно, внутрикожно или внутримышечно, возможно вместе с соответствующим адъювантом.
Альтернативный подход к созданию иммунного ответа против полипептида 29 кДа заключается в использовании метода, известного как "вакцинация нуклеиновой кислотой" или вакцинация "голой ДНК". Из уровня техники известно (Rabinovich et al. (1994) Science 265, 1401-1404), что инъекция в мышцу плазмидной ДНК, кодирующей интересующий антиген, может приводить к длительной экспрессии антигена и к генерированию иммунного ответа. Возможно несколько путей введения, таких как парентеральный, в слизистую оболочку или при помощи "генетического ружья", которое стреляет крошечными количествами золотых шариков, покрытых ДНК (Fynan et al. (1993) Proc Natl. Acad. Sci. U.S.A. 90, 11478-11482).
Таким образом, молекула нуклеиновой кислоты по изобретению может экспрессироваться в плазмиде, содержащей подходящий эукариотический промотор. Затем эта "голая ДНК" может быть инъецирована внутримышечно или введена внутрикожно при помощи "генетического ружья". Эпитопы экспрессируемого белка будут экспрессироваться молекулами МНС (главного комплекса гистосовместимости) на поверхности клеток и стимулировать иммунный ответ. Дальнейшими аспектами данного изобретения, следовательно, являются молекулы нуклеиновой кислоты и векторы, как описано в предыдущих параграфах, для применения в терапии, в особенности для использования в качестве вакцины. Дальнейшими аспектами изобретения также является применение таких молекул нуклеиновой кислоты и векторов в изготовлении композиций для лечения, профилактики или диагностики инфекций, вызываемых Helicobacter pylori.
Еще один аспект изобретения составляет применение полипептида, как определено выше, или модифицированной формы указанного полипептида, которая сохраняет способность индуцировать защитный иммунитет против инфекции Helicobacter pylori, в изготовлении композиций для лечения, профилактики или диагностики инфекции Helicobacter pylori. Такие композиции включают в себя, в частности, вакцинную композицию, вызывающую защитный иммунный ответ против бациллярной и/или коккоидной форм Helicobacter pylori. В изобретение входит также указанное применение в изготовлении диагностического набора для диагностики инфекции Helicobacter pylori. Такой диагностический набор описан ниже.
В еще одном аспекте изобретения предлагается способ получения и млекопитающих, включая человека, защитного иммунного ответа против инфекции Helicobacter pylori, причем указанный способ включает в себя стадию воздействия на указанного млекопитающего иммунологически эффективным количеством вакцинной композиции, как определено выше. Термин "иммунологически эффективное количество" предназначен для обозначения такого количества, которое вызывает существенный защитный ответ против Helicobacter pylori, который уничтожит инфекцию Н.pylori у инфицированного млекопитающего или предотвратит инфицирование восприимчивого млекопитающего. Обычно иммунологически эффективное количество составляет приблизительно от 1 мкг до 100 мг, предпочтительно приблизительно от 10 мкг до 10 мг, антигена Н.pylori для перорального введения, или приблизительно менее 100 мкг для парентерального введения.
Другой аспект изобретения составляет способ диагностики инфекции Helicobacter pylori in vitro, включающий в себя по меньшей мере одну стадию, на которой используют полипептид, как определено выше, содержащий часть полипептида 29 кДа, причем эта часть содержит иммуногенный эпитоп. Полипептид может быть возможно маркирован и/или пришит к твердой подложке. Способ диагностики может, например, включать в себя стадии (а) контактирования указанного полипептида, возможно связанного с твердой подложкой, с водой организма, взятой у млекопитающего; и (б) обнаружения антител в указаний воде, связавшихся с указанным полипептидом. Предпочтительными методами обнаружения антител являются методы ELISA (твердофазный иммуноферментный анализ), хорошо известные из уровня техники.
В еще одном аспекте изобретения предлагается диагностический набор для обнаружения инфекции Helicobacter pylori у млекопитающих, включая человека, содержащий компоненты, которые дают возможность выполнить диагностический метод таким образом, как он проиллюстрирован выше.
ПРИМЕРЫ
ПРИМЕР 1: Клонирование и экспрессия полипептида 29 кДа из Н.pylori
1.1. Бактериальные штаммы, векторы и условия роста
Н. pylori CCUG 17874 (= NTCC 11637) выращивали на чашках с агаром с лошадиной кровью в микроаэрофильной атмосфере. В экспериментах по клонированию в качестве штаммов-хозяев использовали штаммы E.coli XLl-Blue MRF' и XLOLR (Stratagene, La Jolla, California), которые выращивали в питательной среде Luria-Bertani (LB) или в NZY среде с добавлением 0,2% мальтозы и 10 мМ MgSO4 при использовании для лямбда инфекции. Лямбда вектор экспрессии ZAP ExpressTM и его фагмидное производное pBK-CMV были получены от фирмы Stratagene.
1.2. Методы работы с ДНК
Хромосомную ДНК из Н.pylori 17874 получали путем суспендирования бактерий с чашек, которые предварительно инкубировали в течение 48 часов, в буфере, содержащем 50 мМ трис-Cl, рН 8,0, 25% сахарозы, 50 мМ ЭДТА, содержащем 10 мг/мл лизоцима и 5 нг/мл РНКазы без примеси ДНКаз (Boehringer Mannheim Scandinavia АВ, Bromma, Sweden). Суспензию инкубировали в течение 10 мин при 37oС. Затем добавляли равный объем лизирующего буфера (0,4% тритон-Х100 в 50 мМ трис-Cl, рН 8,0 и 62,5 мМ ЭДТА) и суспензию инкубировали при комнатной температуре до появления заметного лизиса бактерий. После этого суспензию трижды экстрагировали соответственно забуференным фенолом (рН 8,0), смесью фенол/хлороформ и хлороформом соответственно. ДНК осаждали из водной фазы и растворяли в ТЕ-буфере (10 мМ трис-Cl, рН 8,0 и 1 мМ ЭДТА).
Рестрикционные ферменты были получены от фирмы Boehringer Mannheim Scandinavia АВ и использовались согласно инструкциям изготовителей. Плазмиды и ДНК фага лямбда очищали с использованием наборов Wizard (Promega, Madison, Wisconsin). Секвенирование проводили с использованием набора Sequenase 2,0 (Amersham Sweden AB, Solna, Sweden). Олигонуклеотиды были приобретены у фирмы Innovagen, Lund, Sweden. ПЦР проводили с использованием Tag ДНК-полимеразы (Boehringer-Mannheim Scandinavia AB).
1.3. Конструирование геномной библиотеки Н.pylori
Фрагменты хромосомной ДНК размерам 2-12 тпн очищали из препарата, полученного в результате неполного расщепления ДНК Н.pylori 17874 рестриктазой Sau3A, и клонировали в обработанном рестриктазой BamHI векторе ZAP ExpressТМ, как описано в протоколе фирмы Stratagene. После паковки in vitro полученную библиотеку титровали инфицирующим штаммом XL-1 Blue MRF и высевали клетки на индикаторные чашки, содержащие изопропил-β-D-тиогалактопиранозид (IPTG) и 5-бромо-4-хлоро-3-индолил-β-D-галактопиранозид (X-Gal). Титр библиотеки был равен 1,2•106 бляшкообразующих единиц/мл с 85% рекомбинантов.
Бляшки, экспрессирующие полипептид 29 кДа, выявляли при помощи иммунологического скриннинга, используя моноклональные антитела НР30-1:1:6 (Bolin et al. (1995) J. Clin. Microbiol. 33, 381-384) по стандартным методикам. Позитивные бляшки изолировали и повторяли посев и скрининг с использованием моноклональных антител до получения чистых бляшек. Превращение в фагмидную форму ZAP Express клонов проводили согласно ExAssist протоколу фирмы Stratagene.
1.4. Иммуноблотинг и дот-блоттинг
Ночные культуры Е.coli XLOLR, содержащей плазмиды с клонированными вставками ДНК Н.pylori 17874, изображенные на фиг.1, разбавляли в 100 раз в 5 мл LB-среды, содержащей 50 мг/мл канамицина. Культуры инкубировали при 37oС до тех пор, пока оптическая плотность при 600 нм не достигала значения, равного 0,7. Затем добавляли IPTG до конечной концентрации 1 мМ и бактерии выращивали дополнительно в течение двух часов. Культуры без IPTG выращивали аналогичным образом. Культуры центрифугировали и ресуспендировали в 1/10 объема. 10 мкл ресуспензировали в 1/10 объема. 10 мкл суспензии смешивали с равным объемом 2х буфера для образцов, кипятили и анализировали методом SDS-PAGE (электрофорез с додецилсульфатом натрия в полиакриламидном геле). Штамм XLOLR, выращенный аналогично, но в среде без канамицина, служил в качестве негативного контроля. Суспензию бактерий Н.pylori 17874 в PBS (OD при 600 нм = 1,0) использовали как позитивный контроль.
После иммобилизации белковых профилей на нитроцеллюлозных фильтрах проводили реакцию со специфическими для полипептида 29 кДа моноклональными антителами НР30-1: 1: 6, разбавленными 1;10, как описано ранее (Bolin et al, 1995), и связанные антитела выявляли при помощи меченного пероксидазой антимышиного IgG. Фильтры проявляли субстратом перекисью водорода и 4-хлоро-нафтолхромогеном (BioRad Svenska AB).
Дот-блот тест выполняли, используя ночные культуры вышеупомянутых штаммов. 2 мкл суспензии наносили на нитроцеллюлозные фильтры, подвергали воздушной сушке и инкубировали в течение 1 часа с моноклональными антителами НР30-1:1:6, разбавленными 1:10. Последующие шаги выполняли, как описано выше для иммуноб-лоттинга.
1.5. Молекулярное клонирование
Частично расщепленную хромосомную ДНК штамма Н.pylori 17874 клонировали в векторе экспрессии на основе фага лямбда (ZAP ExpressTM). Четыре бляшки, экспрессирующих полипептид 29 кДа, обнаружили в результате скрининга 24000 бляшек на реакцию со специфичными для полипептида 29 кДа моноклональными антителами. Позитивные бляшки очищали, и размер клонированных вставок проверяли гидролизом выделенной ДНК рестриктазами XbaI, и SalI. Размер вставок составлял от 3,7 до 1,78 тпн. После эксцизии in vivo фагмид pBK-CMV из четырех позитивных бляшек строили рестрикционные карты и сравнивали их со вставками в лямбда-векторе. Эти фагмиды, как было обнаружено, содержали перекрывающиеся ДНК-фрагменты того же размера, что и в лямбда-векторе. Большинство проверенных рестрикционных ферментов, кроме SmaI и NheI, не разрезали клонированные фрагменты.
Рестрикционная карта наименьшего (1,7 тпн) из клонированных фрагментов (pAEI), которые были дополнительно проанализированы, показана на фиг.1. Одна из клонированных вставок находилась в противоположном по отношению к векторному промотору направлении. Когда полные клеточные экстракты штаммов E. coli, содержащих указанные плазмиды, проанализировали иммуноблоттингом с моноклональными антителами НР30-1:1:6, то обнаружили, что они все экспрессировали полипептид с той же самой молекулярной массой, что и Н.pylori 17874. Не было замечено никакого различия в экспрессии полипептида 29 кДа в том случае, когда промотор вектора индуцировали IPTG. Это указало на то, что ген транскрибировался с собственного промотора. Были сконструированы и исследованы на экспрессию полипептида 29 кДа три субклона, содержащие показанные на фиг. 1 фрагменты ДНК. Ни один из клонов не экспрессировал полипептид. Когда XLOLR (pAEI) проверили дот-блот тестом (Bolin et al., 1995) и сравнили с Н.pylori, то было обнаружено, что он является слабо позитивным, что свидетельствовало о том, что некоторые из экспрессирующихся полипептидов могут быть доступны на поверхности.
1.6. Анализ последовательности ДНК
Обе нити 1,7 тпн вставки в pAEI и в субклонах секвенировали, используя Т3- и Т7-специфические праймеры, и в случае необходимости дополнительно использовали специфические праймеры, чтобы секвенировать те участки последовательности, которые не доступны при применении стандартных праймеров. Компьютерный анализ показал, что последовательность (SEQ ID NO:l) содержала открытую рамку считывания (ORF) размером 780 нп на одной нити, перекрывающую рестрикционные сайты, используемые при субклонировании (фиг.1). Предполагаемый сайт связывания рибосомы может быть идентифицирован (положения 782-785 SEQ ID NO:l). ORF кодировала 260 аминокислот полипептида с молекулярной массой 29126 Да (SEQ ID NO:2).
Аминокислотная последовательность, как было обнаружено, содержала возможную сигнальную последовательность размером 27 аминокислот. Последовательность Leu-Val-Gly-Cys (положения с 25 по 28 в SEQ ID NO:2 и 4) является одной из консенсусных последовательностей (Leu-X-Y-Cys), которую рассматривают как сайт узнавания для фермента сигнальной пептидазы II. Сигнальная пептидаза II расщепляет сигнальные последовательности перед остатком цистеина в пролипопротеинах. Таким образом, характеристики сигнальной последовательности подтверждают, что белок 29 кДа является липопротеином, и что зрелый белок содержит аминокислоты с 28 до 260.
1.7. Экспрессия рекомбинантного полипептида 29 кДа в Е. coli
Рекомбинантный полипептид 29 кДа продуцировался в высокой концентрации в Е. coli N4830-1 с конструкта вектора экспрессии pAL30, который содержит полный ген полипептида 29 кДа (положения 771-1667 в SEQ ID NO:l и 3). Для получения конструкта использовали вектор pML-LCTB λ7, который содержит сильный λPL промотор (получен от Michael Lebens, University of Gothenburg, Sweden). Этот вектор также содержит ген β-лактамазы, обеспечивающий устойчивость к ампициллину. Ген LCTB (кодирующий холерный токсин и его сигнальный пептид), который вставлен в вектор между λPL промотором и терминирующей областью, был вырезан из вектора в результате его обработки рестрикционными ферментами SmaI и HindIII.
Структурный ген, кодирующий полипептид 29 кДа, включая его сигнальную последовательность, амплифицировали при помощи ПЦР. Использовали праймер HP30N (GGC GTA GAA ATG GAA GCG С; соответствующий положениям от 522 до 540 в SEQ IN NO:1 и 3), который связывается с областью, расположенной в обратном направлении от стартового кодона ATG на расстоянии 271 нп, и праймер НР30С (ССС AAG ААТ CAT CAG ССС ТТА ААТ АСА CG), который распознает фрагмент ДНК, расположенный на 855 нп в прямом направлении от стартового кодона (соответствующий положениям с 1648 до 1667 в SEQ ID NO:l и 3). Праймер НР30С содержал HindIII сайт, который был добавлен к последовательности гена, кодирующего полипептид 29 кДа, при помощи реакции ПЦР. Полученный ПЦР продукт имел размер 1,1 тпн. Этот фрагмент ДНК был разрезан рестриктазами SspI и HindIII, дающими фрагмент 0,9 тпн, который затем лигировали с векторным фрагментом (2,7 тпн). Сконструированный вектор, получивший название рАL30 (3,6 тпн), трансформировали в Е. coli N4830-1 методом электропорации. Было обнаружено четыре позитивных клона (pAL30:l, 2, 3, 4).
Для индукции экспрессии рекомбинантного полипептида клетки N4830-1, содержащие рАL30: 1-4, варащивали в течении ночи при 30oС (репрессор фага лямбда сI ингибирует транскрипцию при указанной температуре) в среде 1•LB с ампициллином (100 мкг/мл). Небольую часть этой ночной культуры инокулировали в 5 мл 1•LB среды с ампициллином, и клетки выращивали при +30oС до тех пор, пока OD при 600 нм не достигала значения примерно 0,7. Затем температуру поднимали до +42oС, в результате чего репрессор инактивировался, и клетки инкубировали еще в течение двух часов.
Образцы, взятые до и после индукции, анализировали при помощи 14%-ного SDS-PAGE и иммуноблотинга, используя моноклональные антитела НР30-1:1:6, которые специфичны для полипептида 29 кДа. Все три индуцированных клона, использованных в иммуноблотинге (рАL30:1,3 и 4), экспрессировали после индукции большое количество рекомбинантного полипептида. Суспензия из неиндуцированных клеток содержала только низкое количество полипептида 29 кДа.
Клон pAL30: l был выбран для дальнейшего анализа. Чтобы проверить, что этот клон действительно содержал ген, кодирующий полипептид 29 кДа, концы фрагмента, вставленного в вектор, секвенировали. Было подтверждено, что последовательность, вставленная в вектор экспрессии, соответствовала ожидаемой последовательности клонированного ПЦР-фрагмента.
ПРИМЕР 2: Кинетика экспрессии полипептида 29 кДа при различных условиях культивирования
Использовали два штамма Н.pylori, а именно CCUG 17874 (лабораторный штамм) и Не1 73 (недавно выделенный от пациента. страдающего от язвы двенадцатиперстной кишки). Культивирование проводили на чашках с кровяным агаром, а также в бруцеллезной питательной среде (Brucella Broth) с добавлением циклодекстрина. Все культуры инкубировали в микроаэрофильной атмосфере, состоящей из 5% О2, 10% СО2 и 85% N2. Бактерии собирали после 2, 4 и 7 дней, промывали один раз в PBS и хранили при -20oС для последующего анализа. Экспрессию поверхностного полипептида 29 кДа анализировали методом ингибирование-ELISA (твердофазный иммуноферментный анализ), с применением специфических моноклональных антител, использовавшихся ранее для обнаружения поверхностных антигенов Е. coli (Lopez-Vidal, Y and Svennerholm, A-M., J. Clin. Microbiol. 28, 1906), против полипептида. Эти антитела также использовали в иммуноэлектронной микроскопии.
Когда CCUG 17874 культивировали в течение 7 дней, на чашках с кровяным агаром, также как и в бруцеллезной среде, приблизительно 70% бактерий переходили из спиральной формы в коккоидную форму. Это преобразование происходило уже после 3 дней в случае штамма Не1 73. Анализ методом ингибирование-ELISA показал довольно постоянную концентрацию 29 кДа полипептида в образцах, полученных как из чашечных, так и из бульонных культур, в течение 7 дней. Присутствие полипептида было подтверждено иммуноэлектронной микроскопией. 29 кДа полипептид, как было обнаружено, хорошо сохраняется в коккоидных формах Н. pylori. Как было обнаружено, полипептида 29 кДа было больше в штамме Не1 73, чем в CCUG 17874.
ПРИМЕР 3: Гуморальные иммунные ответы против полипептида 29 кДа
Гуморальные иммунные ответы против полипептида 29 кДа определяли в сыворотках и в желудочном материале, полученном путем аспирации, от пациентов с язвами двенадцатиперстной кишки (n=19), у бессимптомных Н.pylori носителей (n=18) и у неинфицированных контрольных субъектов такого же возраста (n=20).
Уровни антител против 29 кДа полипептида тестировали в желудочном материале, полученном путем аспирации, и в сыворотках, полученных от трех групп субъектов, посредством различных ELISA методов. Большинство инфицированных субъектов имело существенно более высокие по сравнению со здоровыми контрольными людьми уровни специфических антител против полипептида 29 кДа как в сыворотке, так и в желудочном материале, полученном путем аспирации. Титры антител у бессимптомных носителей были сравнимы с таковыми у пациентов с симптомами.
ПРИМЕР 4: Мечение полипептидов [3H]пальмитатом
Так как аминокислотная последовательность полипептида 29 кДа содержала возможный сигнальный пептид, типичный для липопротеинов, исследовали мечение белка с радиоактивной пальмитиновой кислотой.
Е. coli N4830-1, как без вектора, так и с вектором pAL30:l, выращивали при 30oС в питательной среде LB, содержавшей 50 мкг/мл карбенициллина. При плотности клеток 108 бактерий/мл добавляли [3Н]пальмитиновую кислоту (5 мкКи/мл; DuPont NEN, Boston, MA) до конечной концентрации 50 мкКи/мл. Температуру доводили до 42oС и культуры инкубировали дополнительно в течение 12 часов. Клетки собирали центрифугированием и лизировали в SDS-PAGE лизирующем буфере. После электрофореза гель обрабатывали для флоуграфии, погружая гель в AmplifyTM (Amersham International, ПК) на 30 мин, высушивая его между листами целлофана и экспонируя гель на рентгеновской пленке при -70oС в течение 36 часов.
Результаты показали, что полипептид 29 кДа является липидизированным и, таким образом, пост-трансляционно модифицированным.
ПРИМЕР 5: Распределение с помощью тритона Х-114 E.coli, экспрессирующих рекомбинантный полипептид 29 кДа
Клетки E. coli, несущие pAL30:l, выращивали при +30oС в LB-среде, содержащей 50 мкг карбенициллина/мл. При клеточной плотности 108 бактерий/мл температуру поднимали до +42oС и культуры инкубировали долнительно в течение 3 часов. Клетки собирали центрифугированием (11,300•g, 10 мин, +4oС) и ресуспендировали в 25 мл PBS на грамм клеточного осадка. Суспензию замораживали и затем оттаивали при комнатной температуре, добавляли 25 мкл ДНКазы I (10 мкг/мкл). Образец мягко перемешивали переворачиванием в течение 30 мин при комнатной температуре и охлаждали до 8-12oС с последующим добавлением тритона Х-114 (конечная концентрация 0,3%). После инкубации с медленным переворачиванием при +4oС в течение 3 часов нерастворенный материал собирали центрифугированием (18,900•g, 10 мин, 25oС).
Фазы анализировали посредством SDS-PAGE, идентичность полипептида 29 кДа проверяли вестерн-блоттингом с использованием моноклональных антител НР30-1: 1: 6. Результаты показали, что 29 кДа полипептид появился в фазе детергента, что подтверждает то, что он является липопротеином. Известно из уровня техники, что интегративные мембранные белки обычно переходят в фазу детергента (Bordier, С. (1981) J. Biol. Chem., vol. 256, 1604-1607).
Этот эксперимент также показал, что плазмида, введенная в E.coli, может экспрессироваться и продуцировать 29 кДа белок. Это важно для будущего производства вакцины в большом масштабе, так как Н.pylori растет недостаточно хорошо или быстро.
ПРИМЕР 6: Конструирование вектора экспрессии pS863 для продуцирования высоких уровней белка 29 кДа Н.pylori
6.1. Получение pS860
Чтобы получить удобные рестрикционные сайты на 5'-конце гена 29 кДа, синтезировали два синтетических олигонуклеотида для ПЦР амплификации. Плазмиду pS852 (идентичная плазмиде pAL30:l, описанной в Примере 1.7) использовали как матрицу для ПЦР амплификации. Последовательности этих двух олигонуклеотидов показаны ниже:
EcoRI Ndel
5'-CGGAATTCCATATGAGAGCAAATAATCATTTTAAAG-3'
BamHI XmaI NheI
5'-GCGGATCCCCCGGGGCTAGCTGGATGGTAATTCAATTTC-3'
Проводили ПЦР амплификацию и амплифицированный фрагмент 169 нп лигировали в ТА вектор (Mead, D.A. et al. (1991) Bio/Technology 9, 657-663). Полученная плазмида была обозначена как pS860 (фиг.2). Последовательность полученного конструкта подтвердили путем дидезокси-секвенирования (Sanger et. al (1977) Proc Natl. Acad. Sci. USA 74, 5463-5467).
6.2. Получение pS861
Чтобы заменить рестрикционные сайты на 3'-конце гена 29 кДа, синтезировали два синтетических олигонуклеотида для ПЦР амплификации. Плазмиду pS852 (pAL30: l) использовали как матрицу для ПЦР амплификации. Последовательности двух олигонуклеотидов приведены ниже:
EcoRI XmaI
5'-CGGAATTCCCCGGGTTATTATTCTCCACCGG-3'
PstI BamHI
5'-CGCTGCAGGGATCCTTATTATCGGTTTCTTTTGCCTTTTAA-3'
Проводили амплификацию ПЦР и амплифицированный фрагмент расщепляли рестриктазами XmaI, и BamHI с образованием фрагмента 357 нп. Этот фрагмент клонировали в pUC19, полученную плазмиду обозначили как pS861 (фиг.2). Последовательность конструкта подтвердили дидезоксисеквенированием (Sanger et. al (1977) Proc Natl. Acad. Sci. USA 74, 5463-5467).
6.3. Получение плазмиды pS862
кДНК, кодирующую среднюю часть гена 29 кДа, выделяли при помощи гель-электрофореза в виде 280 нп NheI/XmaI фрагмента из плазмиды pS852 (pAL30:l). Этот фрагмент лигировали вместе с 357 нп XmaI/BamHI фрагментом из pS861 и 4061 нп NheI/BamHI фрагментом из pS861. Сконструированная плазмида была обозначена как pS862 (фиг.2).
6.4. Получение плазмиды pS863
Затем выделяли 795 нп NdeI и BamHI рестрикционный фрагмент из pS862 и лигировали с 4 тпн NdeI/BamHI фрагментом из Т7 вектора pS637 (рЕТ-3а) (Studier, F.W. et al. (1990) Methods Enzymol. 185, 60-89). Полученный вектор экспрессии был обозначен как pS863 (фиг.2).
ПРИМЕР 7: Очистка рекомбинантного Н.pylori 29 кДа липопротеина
7.1. Штаммы-хозяева и бактериальные культуры
Вектор экспрессии pS863 трансформировали в следующие штаммы-хозяева E. coli; BL21(DE3); BL21 (DE3)pLysS; и BL21 (DE3)pLysE. Эксперименты по экспрессии выполняли в основном так, как описано (Studier et al. Methods Enzymol. 185, 60-89, 1990). Бактерии выращивали в среде LB (Ausubel, P.M. et al. (eds. ) Current Protocols in Molecular Biology, John Wiley & Sons, New York, 1992), содержавшей 50 мкг/мл карбенициллина. Кроме того, при использовании BL21(DЕ3)pLysS и BL21(DE3)pLysE в среду добавляли 30 мкг/мл хлорамфеникола. Для индукции Т7 системы экспрессии культуры выращивали до плотности приблизительно OD600= 0.5 и затем добавляли 0,4 мМ IPTG для индукции. Клетки собирали через примерно 180 минут после индукции. Штаммом-хозяином, который дал самый высокий уровень экспрессии, был BL21(DE3)pLysS.
7.2. Очистка липопротеина 29 кДа Н.pylori
Культуры E.coli BL21(DE3)/pLysS, транформированные плазмидой pS863, выращивали, как описано выше. Клетки собирали центрифугированием и ресуспендировали в холодном буфере (50 мМ трис-HCl, 2 мМ ЭДТА, 10 мМ NaCl, рН 8,0). Для каждого грамма осадка (влажная масса) добавляли 35 мл буфера.
7.2.1. Экстракция тритоном Х-114
Чтобы экстрагировать липопротеин, тритон Х-114 (ТХ-114) добавляли до конечной концентрации 1,5 мас.% и суспензию перемешивали в течение одного часа при 0oС. Нерастворимый в тритоне материал был собран в осадок центрифугированием при 18900•g в течение 10 мин. В некоторых случаях осадок экстрагировали еще раз, но половинным объемом ТХ-114 содержащего буфера. После второй ТХ-114 экстракции осадок выбрасывали.
Фазовое распределение супернатанта от ТХ-114 экстракции получали, инкубируя его в течение 15 мин при 30oС с нерегулярным перемешиванием. Мутный раствор центрифугировали при 31300•g в течение 30 мин при +30oС. Собирали нижнию фазу детергента и разбавляли до 1% ТХ-114 холодным буфером (50 мМ трис-HCl, 2 MM ЭДТА, 10 мМ NaCl, pH 8,0).
7.2.2. Q-сефароза, pH 8,0
Разбавленную ТХ-114-фазу наносили на колонку с Q-сефарозой (Pharmacia) (20 мл/3 г клеточного осадка), уравновешенную буфером (50 мМ трис-HCl, 2 мМ ЭДТА, 10 мМ NaCl, 0,1% тритон Х-100, pH 8,0). 29 кДа липопротеин собирали как несвязывающуюся фракцию. Эта фракция была подвергнута фазовому распределению путем ее инкубирования при +30oС при кратковременном смешивании до тех пор, пока раствор был мутным. Две фазы были разделены центрифугированием при 31300 • g в течение 30 мин при +30oС. Нижнюю фазу детергента собирали и разбавляли до 1% ТХ-114 холодным буфером (10 мМ трис-HCl, 2 мM ЭДТА мМ, pH 8,6).
7.2.3. Q-сефароза, pH 8,6
Разбавленную ТХ-114-фазу наносили на 100 мл колонку с Q-сефарозой (Pharmacia), уравновешанную буфером (10 мМ трис-HCl, 2 мМ ЭДТА, pH 8,6). Несвязывающаяся фракция содержала ТХ-114. Колонку промывали буфером А (10 мМ трис-HCl, 2 мМ ЭДТА, 0,1% тритон Х-100, pH 8,6). 29 кДа липопротеин собирали градиентом соли с буфером В (10 мM трис-HCl, 2 мM ЭДТА mM, 0,1% тритон Х-100, 1 М NaCl, pH 8,6). Градиент был следующим: 0-50%В. 40 мл; 50-100%В, 100 мл. 29 кДа липопротеин элюировали между 60-70% В.
7.2.4. SDS-PAGE и белковый электроблоттинг
Образцы белка с различных стадий очистки растворяли в буфере для образцов (50 мМ трис-HCl, pH 6,8, 8% глицерин, 1,6% SDS, 4% β-меркаптоэтанол, 0,02% бромфенолового синего) и разделяли на Novex преформированных градиентных гелях (4-20% полиакриламида) или на BioRad преформированных градиентных гелях (10-20% полиакриламида). Буфер для проведения электрофореза содержал 25 мМ трис, 192 мМ глицина, 0,5% SDS, рН 8,3. Гели окрашивали 0,1% кумасси бриллиантовым синим (Coomassie Brilliant Blue) R-250 в 40% метанола, 10% уксусной кислоты и отмывали 10% метанола, 10% уксусной кислоты, уксусная кислота.
Гели, предназначенные для полусухого электроблоттинга, не окрашивали, а замачивали в буфере для переноса (48 мМ трис, 38 мМ глицин, 0,075% SDS, 20% МеОН), белки переносили на PVDF (поливинилиденфторидные) мембраны (ImmobilonR Millipore, USA) в аппарате для полусухого блоттинга (BioRad). Иммунологический анализ выполняли сначала путем блокады PVDF мембраны в течение одного часа в 2%-ном BSA (бычьем сывороточном альбумине) в TBS (50 мМ трис-HCl, 2,5 М NaCl, рН 8,2), затем мембрану инкубировали в течение одного часа со специфическим моноклональным антителом (IgGl) против 29 кДа липопротеина, разбавленного 1: 10 1%-ным BSA в TBS. После стадии отмывки в TBS мембрану инкубировали в течение одного часа с антителом против мышиного IgG, сконъюгированным с щелочной фосфатазой (Dakopatts, Denmark). После дополнительной отмывки мембрану обрабатывали соответствующими субстратами (5-бромо-4-хлоро-3-индолил фосфатом (BCIP) и нитросиним тетразолием (NBT) (Sigma)).
7.2.5. Концентрация белка и пирогенность
Общую концентрацию белка определяли методом на основе бицинхониновой кислоты (ВСА Protein Assay. Pierce Chemical Company. USA).
Содержание эндотоксина оценивали с помощью пробы с лизатом хромогенных амебоцитов мечехвоста (LAL)(LAL COAMATICR Endotoxin. Endosafe Inc. USA).
Окрашенные SDS-гели сканировали (BioRad Imager GS-) для определения относительного количества белковых примесей в конечных препаратах. Препараты содержали <10% белковых примесей.
ПРИМЕР 8: Анализ Н.pylori 29 кДа белка для его использования в качестве вакцины
8.1. Материалы и методы
8.1.1. Животные
Самки SPF BALB/c мышей были приобретены в Bomholt цетре по разведению (Breeding centre, Denmark). Их содержали в обычных макролоновых клетках со свободным доступом к воде и пище. Возраст животных при прибытии составлял 4-6 недель.
8.1.2. Инфекция
Минимум через одну неделю акклиматизации животные были инфицированы штаммом Н. pylori типа 2 (штамм 244, первоначально выделенный у пациента с язвой). Этот штамм, как было ранее доказано, является активным колонистом желудка мышей. Бактерии выращивали в течение ночи в бруцеллезной питательной среде с добавлением 10% фетальной телячьей сыворотки при +37oС в микроаэрофильной атмосфере (10% СО2, 5% O2). Животные получали оральную дозу омепразола (400 ммоль/кг), а через 3-5 ч их орально инокулировали Н.pylori (приблизительно 108 КОЕ/животное). Инфекция была проверена у контрольных животных через 2-3 недели после инокуляции.
8.1.3. Иммунизации
Животных иммунизировали 4 раза в течение периода продолжительностью 34 дня (дни 1, 15, 25 и 35). Очищенный антиген вводили в дозе 100 мкг/мышь, а мембранные белки (МР) - в дозе 0,5 мг/дозу. Мембранные белки получали путем разрушения ультразвуком бактерий в PBS. Дебрис удаляли путем центрифугирования гомогената, полученного из клеток при воздействии ультразвука, при +4oС, 2000 об/мин в течение 5 мин. Супернатант переносили в новую пробирку и цетрифугировали при +4oС, 15000 об/мин в течение 20 мин. Осадок собирали и хранили при -70oС до использования.
В качестве адъюванта животные также получали 10 мкг/мышь холерного токсина (СТ) с каждой иммунизацией. Животным перорально давали омепразол (400 мкмоль/кг) за 3-5 ч до иммунизации как средство защиты антигенов от кислотной деградации. Животных умерщвляли через 4 недели после заключительной иммунизации.
8.1.4. Пассивная защита
Для того, чтобы проанализировать влияние моноклональных антител (MAbs) на способность Н.pylori колонизировать желудок мышей, MAbs с различными специфичностями смешивали с Н.pylori за 10 мин до инокуляции, как описано выше. Использовали MAbs, индуцированные против 29 кДа белка (НР30-1:1:6), против уреазы (Ure 8:1); и против устойчивого к нагреванию белка Е. coli (ST 1:3). MAbs титровали в ELISA, чтобы получить равные количества каждого МАb для использования в эксперименте. Для инокуляции использовали количество бактерий, составлявшее 107 на мышь. Мышей умерщвляли через 2 недели после инокуляции.
8.1.5. Анализ инфекции
Мышей умерщвляли с помощью СО2 и цервикального смещения. Брюшную полость вскрывали и удаляли желудок. После рассечения желудка вдоль большой кривизны желудка его промывали физиологическим раствором. Участки слизистой оболочки полости и тела площадью 25 мм2 соскабливали по отдельности хирургическим скальпелем. Соскобы слизистой оболочки суспендировали в бруцеллезной питательной среде и помещали на кровяные Skirrow чашки. Чашки инкубировали в микроаэрофильных условиях в течение 3-5 дней и подсчитывали количество колоний. Идентичность Н. pylori была установлена тестом на уреазу и каталазу и прямым микроскопированием или окрашиванием по Грамму.
8.2. Результаты
8.2.1 Пассивная защита
Трем группам из 10 животных в каждой давали смесь Н.pylori штамм 244 и Mab и одной группе давали только Н.pylori. Смесь Mab и бактерий оставляли для реагирования в течение 10 мин перед ее инокуляцией мышам. Ни одно из использовавшихся MAbs не оказывало очевидного влияния на бактерии in vitro. Через две недели после инокуляции мышей умерщвляли и для каждой группы определяли показатель инфекции (фиг.3). Все мыши в контрольной группе и мыши, инокулированные ST Mab, были инфицированы. В группе с уреаза Mab все мыши были инфицированы, но в значительно меньшей степени по сравнению с контрольными. В группе, инокулированной Mab против 29 кДа белка, ни одна из мышей не была инфицирована.
8.2.2. Терапевтическая иммунизация
В данном исследовании животных инфицировали Н.pylori штамм 244 за один месяц до иммунизаций. Мыши в группах из десяти особей были затем иммунизированы либо холерным токсином (СТ), либо СТ вместе с мембранными белками, уреазой или 29 кДа белком. Контрольные животные получали только наполнитель (PBS). Через месяц после заключительной иммунизации животных умерщвляли и определяли КОЕ (фиг. 4). Все контрольные животные, также как животные, иммунизированные только СТ, были инфицированы. Животные, активно иммунизированные уреазой и СТ или 29 кДа белком и СТ, имели значительно меньшие значения КОЕ по сравнению с контрольными. Только одно животное в группе, иммунизированной уреазой, было полностью излечено от инфекции.
8.3. Выводы
Вышеприведенные результаты свидетельствуют о том, что 29 кДа Н.pylori белок важен для колонизации и/или персистенции инфекции, поскольку связывание Mab с этой структурой приводит к полному ингбированию колонизации.
Кроме того, 29 кДа Н. pylori белок при его использовании в качестве орального иммуногена в сочетании с холерным токсином в качестве орального адъюванта действует как стимулятор иммунного ответа, приводящий к существенному снижению степени колонизации Н.pylori в используемой животной модели.
В совокупности эти результаты настоятельно подтверждают возможность использования 29 кДа Н.pylori белка в препарате оральной вакцины для применения на людях для лечения и профилактики Н.pylori инфекций.
ХРАНЕНИЕ МИКРООРГАНИЗМОВ
Плазмида pAEI была депонирована согласно Будапештскому Соглашению в Национальных коллекциях промышленных и морских бактерий (National Collections of Industrial and Marine Bacteria (NCIMB), Aberdeen, Scotland, UK) под регистрационным номером NCIMB 40732. Дата депонирования - 16 мая 1995.
Список последовательностей приведен в конце описания.









Изобретение относится к биотехнологии и касается рекомбинантного полипептида, представляющего собой поверхностно-проявляющийся антиген Helicobacter pylori с приблизительной молекулярной массой 29 кДа, и фрагментов нуклеиновых кислот, кодирующих указанный антиген. Рекомбинантный полипептид данного изобретения может быть использован для диагностики инфекций Helicobacter pylori, а также для изготовления вакцинных композиций, которые будут элисировать защитный иммунный ответ против указанной инфекции. 4 с. и 6 з.п. ф-лы, 4 ил.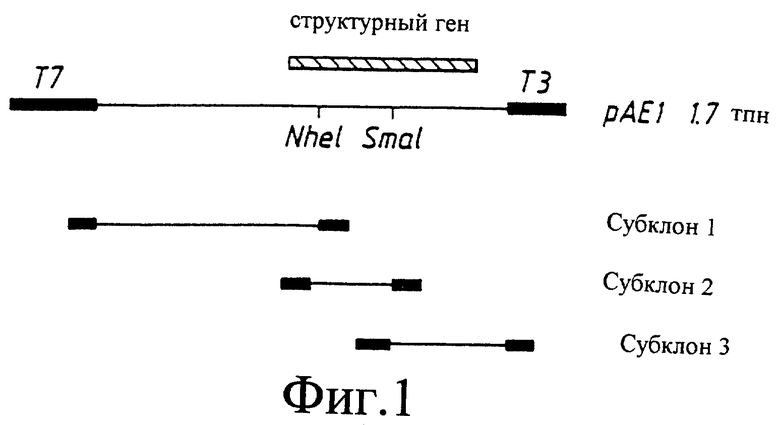
| DOLORES G | |||
| EVANS | |||
| Cloning, Nucleotide Sequence and Expression of a Gene Encoding an Adhesin Subunit Protein of a Helicobacter pylori | |||
| Journal of Bacteriology | |||
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
| СПОСОБ ДИАГНОСТИКИ ПИЛОРИЧЕСКОГО ГЕЛИКОБАКТЕРИОЗА | 1991 |
|
RU2009507C1 |
| CATHERINE J | |||
| LUKE | |||
| Солесос | 1922 |
|
SU29A1 |
| Microbiology | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
Авторы
Даты
2002-12-27—Публикация
1996-06-03—Подача