Настоящее изобретение относится к новым гетероциклическим производным, к способам их получения и к использованию их в медикаментах, в частности для лечения хронических обструктивных заболеваний легких, острого коронарного синдрома, острого инфаркта миокарда и прогрессирующей сердечной недостаточности.
Фибриллярный белок эластин, который в процентном отношении составляет значительную долю всех белков в некоторых тканях, например в артериях, в некоторых соединительных тканях, в тканях легких и сердца, может быть гидролизован или разрушен иным путем специальной группой ферментов, классифицируемых как эластазы. Лейкоцитарная эластаза человека (класс 3.4.21.37), известная также как нейтрофильная эластаза человека, представляет собой гликозилированную сильно основную сериновую протеазу, которая находится в азурофильных гранулах полиморфоядерных лейкоцитов человека. Нейтрофильная эластаза человека высвобождается из активированных полиморфоядерных лейкоцитов, она может участвовать в патогенезе острых и хронических воспалительных заболеваний. Нейтрофильная эластаза человека вызывает деградацию широкого спектра матричных белков, включая эластин и коллаген, в дополнение к этому действию на соединительную ткань нейтрофильная эластаза человека проявляет широкий спектр воспалительной активности, включая активацию экспрессии гена IL-8, образование отека, гиперплазию слизистых желез и гиперсекрецию слизи. Она также выполняет роль медиатора в поврежденной ткани в результате гидролиза коллагеновых структур, например, в сердце после острого инфаркта миокарда или в процессе развития сердечной недостаточности, повреждая таким образом клетки эндотелия, способствуя транссудации нейтрофилов, прилегающих к эндотелию, и влияя на сам процесс адгезии.
Легочные заболевания, в которых, как считается, играет роль нейтрофильная эластаза человека, включают фиброз легких, пневмонию, синдром острого респираторного заболевания, эмфизему легких, включая эмфизему, вызванную курением, хронические обструктивные легочные заболевания и кистозный фиброз. В сердечно-сосудистых заболеваниях нейтрофильная эластаза человека вовлечена в развитие ишемического повреждения ткани с последующим нарушением функционирования сердечной мышцы после острого инфаркта миокарда и в восстановительных процессах, происходящих при прогрессирующей сердечной недостаточности. Нейтрофильная эластаза человека может также участвовать в течении ревматоидного артрита, атеросклероза, в мозговой травме, в раковом заболевании и в аналогичных состояниях, в которых отмечено участие нейтрофилов.
В соответствии с этим, ингибиторы активности нейтрофильной эластазы человека могут быть использованы для лечения большого числа воспалительных заболеваний, в частности, хронических обструктивных заболеваний легких [R.A.Stockley, Neutrophils and protease/antiprotease imbalance. Am. J. Respir. Crit. Care 160, S49-S52 (1999)]. Ингибиторы активности нейтрофильной эластазы человека могут быть также использованы для лечения острого миокардного синдрома, перемежающейся стенокардии, острого инфаркта миокарда и при артериально-коронарном шунтировании [С.Р.Tiefen-bacher и др., Inhibition of elastase improves myocardial function after repetitive ischaemia and myocardial infarction in the rat heart, Eur. J. Physiol. 433, S563-S570 (1997); Dinerman и др., Increased neutrophil elastase release in unstable angina pectoris and acute myocardial infarction, J. Am. Coll. Cardiol. 15, 1559-1563 (1990)], при прогрессирующей сердечной недостаточности [S.J.Gilbert и др., Increased expression of promatrix metalloproteinase-9 and neutrophil elastase in canine dilated cardiomyopathy, Cardiov. Res. 34. S377-S383 (1997)] и при атеросклерозе [Dollery и др., Neutrophil elastase in human atherosclerotic plaque. Circulation 107, 2829-2836 (2003)].
Синтез 5-этоксикарбонил-1-фенил-6-метил-4-(3-нитрофенил)-3,4-дигидропиримидин-2(1Н)-она описан в J. Heterocyclic Chem. 38, 1051 (2001). Данные о фармакологической активности этого соединения отсутствуют.
Настоящее изобретение относится к соединениям общей формулы (I)
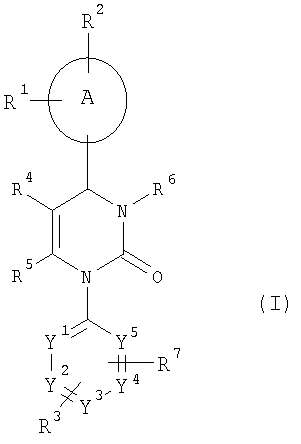
где
А означает арильный или гетероарильный цикл,
R1, R2 и R3 независимо друг от друга означают атом водорода, галогена, нитрогруппу, цианогруппу, алкильную группу с числом атомов углерода от одного до шести, гидроксильную группу или алкоксигруппу с числом атомов углерода от одного до шести, причем алкильная группа с числом атомов углерода от одного до шести и алкоксигруппа с числом атомов углерода от одного до шести могут быть также от одного до трех раз замещены одинаковыми или разными заместителями, выбираемыми из группы, состоящей из атомов галогенов, гидроксильной группы и алкоксигруппы с числом атомов углерода от одного до четырех,
R4 означает трифторметилкарбонильную, алкилкарбонильную группу с числом атомов углерода в алкильном остатке от одного до шести, алкоксикарбонильную группу с числом атомов углерода в алкоксильном остатке от одного до шести, алкеноксикарбонильную группу с числом атомов углерода в алкенильном остатке от одного до шести, гидроксикарбонильную, аминокарбонильную группу, моно- или диалкиламинокарбонильную группу с числом атомов углерода в каждом из алкильных остатков от одного до четырех, ариламинокарбонильную группу с числом атомов углерода в арильном остатке от шести до десяти, арилкарбонильную, гетероарилкарбонильную, гетероциклилкарбонильную, гетероарильную, гетероциклильную группу или цианогруппу, причем алкилкарбонильная группа с числом атомов углерода в алкильном остатке от одного до шести, алкоксикарбонильная группа с числом атомов углерода в алкоксильном остатке от одного до шести, моно- и диалкиламинокарбонильная группа с числом атомов углерода в каждом из алкильных остатков от одного до четырех могут быть также от одного до трех раз замещены одинаковыми или разными заместителями, выбираемыми из группы, состоящей из циклоалкильной группы с числом атомов углерода от трех до восьми, гидроксильной группы, алкоксигруппы с числом атомов углерода от одного до четырех, алкоксикарбонильной группы с числом атомов углерода в алкоксильном остатке от одного до четырех, гидроксикарбонильной, аминокарбонильной группы, моно- и диалкиламинокарбонильной группы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, алкилкарбониламиногруппы с числом атомов углерода в алкильном остатке от одного до четырех, алкилкарбонилзамещенной алкиламиногруппы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, цианогруппы, аминогруппы, моно- и диалкиламиногруппы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, гетероарильной, гетероциклильной группы и триалкилсилильной группы с числом атомов углерода в каждом из алкильных остатков от одного до шести, и где гетероарилкарбонильная, гетероциклил-карбонильная, гетероарильная и гетероциклильная группа могут быть также замещены алкильными группами с числом атомов углерода от одного до четырех,
R5 означает алкильную группу с числом атомов углерода от одного до четырех, которая может быть от одного до трех раз замещена одинаковыми или разными заместителями, выбираемыми из группы, состоящей из атомов галогенов, гидроксильной группы, алкоксигруппы с числом атомов углерода от одного до шести, алкеноксигруппы с числом атомов углерода от одного до шести, алкилтиольной группы с числом атомов углерода от одного до шести, аминогруппы, моно- и диалкиламиногруппы с числом атомов углерода в каждом из алкильных остатков от одного до шести, ариламиногруппы, гидроксикарбонильной группы, алкоксикарбонильной группы с числом атомов углерода в алкоксильном остатке от одного до шести и алкоксиалкоксильной группы с числом атомов углерода в каждом из алкоксильных остатков от одного до четырех,
или
R5 означает аминогруппу,
R6 означает атом водорода, алкильную группу с числом атомов углерода от одного до шести, формильную, аминокарбонильную группу, моно- или диалкиламинокарбонильную группу с числом атомов углерода в каждом из алкильных остатков от одного до четырех, циклоалкилкарбонильную группу с числом атомов углерода в циклоалкильном остатке от трех до восьми, алкилкарбонильную группу с числом атомов углерода в алкильном остатке от одного до шести, алкоксикарбонильную группу с числом атомов углерода в алкоксильном остатке от одного до шести, N-алкилсульфонилзамещенную аминокарбонильную группу с числом атомов углерода в алкильном остатке от одного до четырех, N-алкилсульфонилзамещенную N-алкиламинокарбонильную группу с числом атомов углерода в каждом из алкильных остатков от одного до четырех, гетероарильную, гетероциклильную, гетероарилкарбонильную или гетероциклилкарбонильную группу, причем алкильная группа с числом атомов углерода от одного до шести, моно- и диалкил-аминокарбонильная группа с числом атомов углерода в каждом из алкильных остатков от одного до четырех, алкилкарбонильная группа с числом атомов углерода в алкильном остатке от одного до шести, алкоксикарбонильная группа с числом атомов углерода в алкоксильном остатке от одного до шести, гетероарильная и гетероциклильная группа могут быть от одного до трех раз замещены одинаковыми или разными заместителями, выбираемыми из группы, состоящей из арильной, гетероарильной, гидроксильной группы, алкоксигруппы с числом атомов углерода от одного до четырех, гидроксикарбонильной группы, алкоксикарбонильной группы с числом атомов углерода в алкоксильном остатке от одного до шести, аминокарбонильной, моно- и диалкиламинокарбонильной группы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, аминогруппы, моно- и диалкиламиногруппы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, алкилкарбониламиногруппы с числом атомов углерода в алкильном остатке от одного до четырех, триалкилсилильной группы с числом атомов углерода в каждом из алкильных остатков от одного до шести, цианогруппы, N-алкиламиноалкилзамещенной аминокарбонильной группы и N,N-диалкиламиноалкилзамещенной аминокарбонильной группы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, N-алкоксиалкилзамещенной аминокарбонильной группы с числом атомов углерода в каждом из алкильных остатков от одного до четырех и атомов галогенов,
или
R6 означает структурную единицу формулы
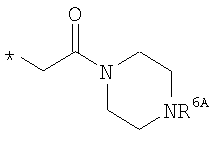 ,
, 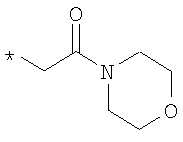 или
или 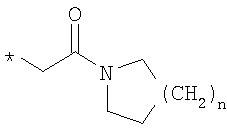
где
R6A выбирают из группы, состоящей из атома водорода и алкильной группы с числом атомов углерода от одного до шести, и
n означает целое число 1 или 2,
R7 означает атом галогена, нитрогруппу, цианогруппу, алкильную группу с числом атомов углерода от одного до шести, гидроксильную группу или алкоксигруппу с числом атомов углерода от одного до шести, причем алкильная группа с числом атомов углерода от одного до шести и алкоксигруппа с числом атомов углерода от одного до шести могут быть также от одного до трех раз замещены одинаковыми или разными заместителями, выбираемыми из группы, состоящей из атомов галогенов, гидроксильной группы и алкоксигруппы с числом атомов углерода от одного до четырех,
и
Y1, Y2, Y3, Y4 и Y5 независимо друг от друга означают СН-группу или атом азота, причем цикл может включать 0, 1 или 2 атома азота.
Соответствующие настоящему изобретению соединения могут быть также представлены в виде их солей, гидратов и/или сольватов.
В контексте настоящего изобретения предпочтение отдается физиологически приемлемым солям.
В соответствии с изобретением понятие физиологически приемлемых солей относится к нетоксичным солям, которые в общем случае могут быть получены в результате реакции соединений (I) с неорганическим или органическим основанием или же с неорганической или органической кислотой, которые обычно используются для этих целей. Примеры фармацевтически приемлемых солей соединений (I), которые не могут быть использованы для ограничения объема притязаний, включают соли с щелочными металлами, например это литиевые, калиевые и натриевые соли, такие соли с щелочноземельными металлами, как магниевые и кальциевые соли, такие четвертичные аммонийные соли, как, например, триэтиламмонийные соли, а также ацетаты, бензолсульфонаты, бензоаты, дикарбонаты, дисульфаты, дитартраты, бораты, бромиды, карбонаты, хлориды, цитраты, дигидрохлориды, фумараты, глюконаты, глютаматы, гексилрезорцинаты, гидробромиды, гидрохлориды, гидроксинафтоаты, иодиды, изотионаты, лактаты, лаураты, малаты, малеаты, соли миндальной кислоты, мезилаты, метилбромиды, метилнитраты, метилсульфаты, нитраты, олеаты, оксалаты, пальмитаты, пантотенаты, фосфаты, дифосфаты, полигалактуронаты, салицилаты, стеараты, сульфаты, сукцинаты, тартраты, тозилаты, валераты и другие соли, используемые обычно в медицинских целях.
Гидраты соответствующих изобретению соединений или их солей представляют собой стехиометрические композиции этих соединений с водой, например это полугидраты, моногидраты или дигидраты.
Сольваты соответствующих изобретению соединений или их солей представляют собой стехиометрические композиции этих соединений с растворителями.
Настоящее изобретение включает как индивидуальные энантиомеры или диастереомеры, так и соответствующие рацематы или смеси диастереомеров соответствующих изобретению соединений и соответствующих им солей. В дополнение к этому, в объем притязаний настоящего изобретения входят все возможные таутомерные формы представленных выше соединений. Диастереомерные смеси могут быть разделены на индивидуальные изомеры с помощью хроматографических процессов. Рацематы могут быть разделены на соответствующие энантиомеры как с помощью хроматографических процессов на хиральных фазах, так и обычными способами разделения.
В контексте настоящего изобретения заместители, если не указано иное, в общем случае имеют приведенное далее значение.
Алкильная группа в общем случае представляет собой углеводородный радикал с линейной или разветвленной цепью с числом атомов углерода от одного до шести, в предпочтительном случае от одного до четырех атомов углерода. Примеры, которые не могут быть использованы для ограничения объема притязаний, включают метальную, этильную, н-пропильную, изопропильную, н-бутильную, изобутильную, втор-бутильную, трет-бутильную, пентильную, изопентильную, гексильную, изогексильную группу. То же самое относится к таким заместителям, как алкоксильная группа, алкиламиногруппа, алкоксикарбонильная группа и алкоксикарбониламиногруппа.
Алкоксигруппа в качестве примера и предпочтительно представлена метоксигруппой, этоксигруппой, н-пропоксигруппой, изопропоксигруппой, трет-бутоксигруппой, н-пентоксигруппой и н-гексоксигруппой.
Алкилкарбонильная группа в общем случае представляет собой углеводородный радикал с линейной или разветвленной цепью с числом атомов углерода от одного до шести, в предпочтительном случае с числом атомов углерода от одного до четырех, который присоединен через карбонильную группу. Примеры, которые не могут быть использованы для ограничения объема притязаний, включают формильную, ацетильную, н-пропионильную, н-бутирильную, изобутирильную, пивалоильную, н-гексаноильную группу.
Алкоксикарбонильная группа в качестве примера и предпочтительно представлена метоксикарбонильной, этоксикарбонильной, н-пропоксикарбонильной, изопропокси-карбонильной, трет-бутоксикарбонильной, н-пентоксикарбонильной и н-гексоксикарбонильной группой.
Алкиламиногруппа представляет собой алкиламинный радикал с одним или двумя (выбираемыми независимо друг от друга) алкильными заместителями, в качестве примера и предпочтительно она представлена метиламиногруппой, этиламиногруппой, н-пропиламиногруппой, изопропиламиногруппой, трет-бутиламиногруппой, н-пентиламиногруппой, н-гексиламиногруппой, N,N-диметиламиногруппой, N,N-диэтиламиногруппой, N-метил-N-этиламиногруппой, N-метил-N-н-пропиламиногруппой, N-изопропил-N-н-пропиламиногруппой, N-трет-бутил-N-метиламиногруппой, N-этил-N-н-пентиламиногруппой и N-н-гексил-N-метиламиногруппой.
Алкиламинокарбонильная группа представляет собой алкиламинокарбонильный радикал с одним или двумя (выбираемыми независимо друг от друга) алкильными заместителями, в качестве примера и предпочтительно она представлена метиламинокарбонильной, этиламинокарбонильной, н-пропиламинокарбонильной, изопропиламинокарбонильной, трет-бутиламинокарбонильной, н-пентиламинокарбонильной, н-гексиламинокарбонильной, N,N-диметиламинокарбонильной, N,N-диэтиламинокарбонильной, N-метил-N-этиламинокарбонильной, N-метил-N-н-пропиламинокарбонильной, N-изо-пропил-N-н-пропиламинокарбонильной, N-трет-бутил-N-метиламинокарбонильной, N-этил-N-н-пентиламинокарбонильной и N-н-гексил-N-метиламинокарбонильной группой.
Алкилсульфонильная группа в общем случае представляет собой углеводородный остаток с линейной или разветвленной цепью с числом атомов углерода от одного до шести, в предпочтительном случае от одного до четырех атомов углерода, который присоединен через сульфонильную группу. Примеры, которые не могут быть использованы для ограничения объема притязаний, включают метилсульфонильную, этилсульфонильную, н-пропилсульфонильную, изопропилсульфонильную, н-бутилсульфонильную, трет-бутилсульфонильную группу.
Циклоалкильная группа в общем случае представляет собой циклический насыщенный углеводородный остаток с числом атомов углерода от трех до восьми, в предпочтительном случае от трех до шести атомов углерода. Примеры, которые не могут быть использованы для ограничения объема притязаний, включают циклопропильную, циклобутильную, циклопентильную, циклогексильную и циклогептильную группу.
Арильная группа сама по себе и она же в арилкарбонильной группе представляет собой моно-, ди- или трициклический ароматический карбоциклический остаток с числом атомов углерода в общем случае от шести до четырнадцати, в качестве примера и предпочтительно она представлена фенильной, нафтильной или фенантренильной группой. Арилкарбонильная группа в качестве примера и предпочтительно представлена бензоильной и нафтоильной группой.
Гетероарильная группа сама по себе и она же в гетероарилкарбонильной группе представляет собой ароматический моно- или дициклический остаток с числом атомов в цикле в общем случае от пяти до десяти, в предпочтительном случае от пяти до шести, и с числом гетероатомов до пяти, в предпочтительном случае до четырех, выбираемых из группы, состоящей из атомов серы, кислорода и азота, в качестве примера и предпочтительно она представлена тиенильной, фурильной, пирролильной, тиазолильной, оксазолильной, имидазолильной, оксадиазолильной, тиадиазолильной, пиридильной, пиримидильной, пиридазинильной, индолильной, индазолильной, бензофуранильной, бензтиофенильной, бензтиазолильной, хинолинильной, изохинолинильной группой. Гетероарилкарбонильная группа в качестве примера и предпочтительно представлена тиенилкарбонильной, фурилкарбонильной, пирролилкарбонильной, тиазолилкарбонильной, оксазолилкарбонильной, имидазолилкарбонильной, пиридилкарбонильной, пиримидилкарбонильной, пиридазинилкарбонильной, индолилкарбонильной, индазолилкарбонильной, бензофуранилкарбонильной, бензтиофенилкарбонильной, хинолинилкарбонильной, изохинолинилкарбонильной группой.
Гетероциклильная группа сама по себе и она же в гетероциклилкарбонильной группе представляет собой неароматический гетероциклический остаток с числом циклов от одного до нескольких, в предпочтительном случае от одного до двух, и с числом атомов в циклах в общем случае от четырех до десяти, в предпочтительном случае от пяти до восьми, и с числом гетероатомов и/или гетерогрупп до трех, в предпочтительном случае до двух, выбираемых из группы, состоящей из атомов азота, кислорода, серы, групп SO и SO2. Гетероциклильные радикалы могут быть насыщенными или частично ненасыщенными. Предпочтение отдается моноциклическим насыщенным гетероцинлильным остаткам с числом членов от пяти до восьми и с числом гетероатомов, выбираемых из группы, состоящей из атомов азота, кислорода и серы, до двух, в качестве примера и предпочтительно они представлены тетрагидрофуран-2-ильной, пирроли-дин-1-ильной, пирролидин-2-ильной, пирролидин-3-ильной, пирролинильной, пиперидинильной, морфолинильной, пергидроазепинильной группой.
Гетероциклилкарбонильная группа в качестве примера и предпочтительно представлена тетрагидрофуран-2-карбонильной, пирролидин-1-карбонильной, пирролидин-2-карбонильной, пирролидин-3-карбонильной, пирролинкарбонильной, пиперидинкарбонильной, морфолинкарбонильной, пергидроазепинкарбонильной группой.
Галоген представляет собой фтор, хлор, бром и иод.
Если указывается, что Y1, Y2. Y3, Y4 и Y5 означают CH-группу или атом азота, то это означает, что вместо СН-группы в цикле может также находиться атом углерода, который замещен заместителем R3 или R7.
Символ * рядом со связью означает место, которым она присоединена к молекуле.
В другом варианте настоящее изобретение относится к соединениям общей формулы (I), где
А означает арильный или гетероарильный цикл,
R1, R2 и R3 независимо друг от друга означают атом водорода, галогена, нитрогруппу, цианогруппу, алкильную группу с числом атомов углерода от одного до шести, гидроксильную группу или алкоксигруппу с числом атомов углерода от одного до шести, причем алкильная группа с числом атомов углерода от одного до шести и алкоксигруппа с числом атомов углерода от одного до шести могут быть также от одного до трех раз замещены одинаковыми или разными заместителями, выбираемыми из группы, состоящей из атомов галогенов, гидроксильной группы и алкоксигруппы с числом атомов углерода от одного до четырех,
R4 означает алкилкарбонильную группу с числом атомов углерода в алкильном остатке от одного до шести, алкоксикарбонильную группу с числом атомов углерода в алкоксильном остатке от одного до шести, алкеноксикарбонильную группу с числом атомов углерода в алкенильном остатке от одного до шести, гидроксикарбонильную, аминокарбонильную группу, моно- или диалкиламинокарбонильную группу с числом атомов углерода в каждом из алкильных остатков от одного до четырех, ариламинокарбонильную группу с числом атомов углерода в арильном остатке от шести до десяти, гетероарилкарбонильную, гетероциклилкарбонильную, гетероарильную, гетероциклильную группу или цианогруппу, причем алкилкарбонильная группа с числом атомов углерода в алкильном остатке от одного до шести, алкоксикарбонильная группа с числом атомов углерода в алкоксильном остатке от одного до шести, моно- и диалкиламинокарбонильная группа с числом атомов углерода в каждом из алкильных остатков от одного до четырех могут быть также от одного до трех раз замещены одинаковыми или разными заместителями, выбираемыми из группы, состоящей из циклоалкильной группы с числом атомов углерода от трех до восьми, гидроксильной группы, алкоксигруппы с числом атомов углерода от одного до четырех, алкоксикарбонильной группы с числом атомов углерода в алкоксильном остатке от одного до четырех, гидроксикарбонильной, аминокарбонильной группы, моно- и диалкиламинокарбонильной группы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, алкилкарбониламиногруппы с числом атомов углерода в алкильном остатке от одного до четырех, аминогруппы, моно- и диалкиламиногруппы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, гетероарильной, гетероциклильной группы и триалкилсилильной группы с числом атомов углерода в каждом из алкильных остатков от одного до шести,
R5 означает алкильную группу с числом атомов углерода от одного до четырех, которая может быть от одного до трех раз замещена одинаковыми или разными заместителями, выбираемыми из группы, состоящей из атомов галогенов, гидроксильной группы, алкоксигруппы с числом атомов углерода от одного до шести, алкеноксигруппы с числом атомов углерода от одного до шести, алкилтиольной группы с числом атомов углерода от одного до шести, аминогруппы, моно- и диалкиламиногруппы с числом атомов углерода в каждом из алкильных остатков от одного до шести, ариламиногруппы, гидроксикарбонильной группы, алкоксикарбонильной группы с числом атомов углерода в алкоксильном остатке от одного до шести и алкоксиалкоксильной группы с числом атомов углерода в каждом из алкоксильных остатков от одного до четырех,
или
R5 означает аминогруппу,
R6 означает атом водорода, алкильную группу с числом атомов углерода от одного до шести, формильную, аминокарбонильную группу, моно- или диалкиламинокарбонильную группу с числом атомов углерода в каждом из алкильных остатков от одного до четырех, циклоалкилкарбонильную группу с числом атомов углерода в циклоалкильном остатке от трех до восьми, алкилкарбонильную группу с числом атомов углерода в алкильном остатке от одного до шести, алкоксикарбонильную группу с числом атомов углерода в алкоксильном остатке от одного до шести, N-алкилсульфонилзамещенную аминокарбонильную группу с числом атомов углерода в алкильном остатке от одного до четырех, N-алкилсульфонилзамещенную N-алкиламинокарбонильную группу с числом атомов углерода в каждом из алкильных остатков от одного до четырех, гетероарильную, гетероциклильную, гетероарилкарбонильную или гетероциклилкарбонильную группу, причем алкильная группа с числом атомов углерода от одного до шести, моно- и диалкиламинокарбонильная группа с числом атомов углерода в каждом из алкильных остатков от одного до четырех, алкилкарбонильная группа с числом атомов углерода в алкильном остатке от одного до шести, алкоксикарбонильная группа с числом атомов углерода в алкоксильном остатке от одного до шести, гетероарильная и гетероциклильная группа могут быть от одного до трех раз замещены одинаковыми или разными заместителями, выбираемыми из группы, состоящей из арильной, гетероарильной, гидроксильной группы, алкоксигруппы с числом атомов углерода от одного до четырех, гидроксикарбонильной группы, алкоксикарбонильной группы с числом атомов углерода в алкоксильном остатке от одного до шести, аминокарбонильной, моно- и диалкиламинокарбонильной группы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, аминогруппы, моно- и диалкиламиногруппы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, алкилкарбониламиногруппы с числом атомов углерода в алкильном остатке от одного до четырех, триалкилсилильной группы с числом атомов углерода в каждом из алкильных остатков от одного до шести, цианогруппы, N-алкиламиноалкилзамещенной аминокарбонильной группы и N,N-диалкиламиноалкилзамещенной аминокарбонильной группы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, N-алк-оксиалкилзамещенной аминокарбонильной группы с числом атомов углерода в каждом из алкильных остатков от одного до четырех и атомов галогенов,
или
R6 означает структурную единицу формулы
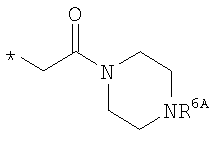 ,
, 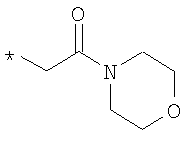 или
или 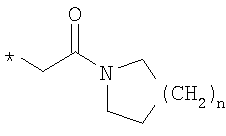
где
R6A выбирают из группы, состоящей из атома водорода или алкильной группы с числом атомов углерода от одного до шести, и n означает целое число 1 или 2,
R7 означает атом галогена, нитрогруппу, цианогруппу, алкильную группу с числом атомов углерода от одного до шести, гидроксильную группу или алкоксигруппу с числом атомов углерода от одного до шести, причем алкильная группа с числом атомов углерода от одного до шести и алкоксигруппа с числом атомов углерода от одного до шести могут быть также от одного до трех раз замещены одинаковыми или разными заместителями, выбираемыми из группы, состоящей из атомов галогенов, гидроксильной группы и алкоксигруппы с числом атомов углерода от одного до четырех,
и
Y1, Y2, Y3, Y4 и Y5 независимо друг от друга означают СН-группу или атом азота, причем цикл может включать 0, 1 или 2 атома азота.
В другом варианте настоящее изобретение относится к соединениям общей формулы (I), где
А означает фенильный, нафтильный или пиридильный цикл,
R1, R2 и R3 независимо друг от друга означают атом водорода, фтора, хлора, брома, нитрогруппу, цианогруппу, метальную, этильную, трифторметильную группу или трифторметоксигруппу,
R4 означает алкилкарбонильную группу с числом атомов углерода в алкильном остатке от одного до шести, алкоксикарбонильную группу с числом атомов углерода в алкоксильном остатке от одного до шести, гидроксикарбонильную, аминокарбонильную группу, моноалкиламинокарбонильную группу с числом атомов углерода в алкильном остатке от одного до четырех или цианогруппу, причем алкилкарбонильная группа с числом атомов углерода в алкильном остатке от одного до шести, алкоксикарбонильная группа с числом атомов углерода в алкоксильном остатке от одного до шести и моноалкиламинокарбонильная группа с числом атомов углерода в алкильном остатке от одного до четырех могут быть также от одного до трех раз замещены одинаковыми или разными заместителями, выбираемыми из группы, состоящей из циклоалкильной группы с числом атомов углерода от трех до восьми, гидроксильной группы, алкоксигруппы с числом атомов углерода от одного до четырех, алкоксикарбонильной группы с числом атомов углерода в алкоксильном остатке от одного до четырех, аминогруппы, моно- или диалкиламиногруппы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, гетероарильной и гетероциклильной группы,
R5 означает метальную или этильную группу,
R6 означает атом водорода, алкильную группу с числом атомов углерода от одного до шести, моно- или диалкиламинокарбонильную группу с числом атомов углерода в каждом из алкильных остатков от одного до четырех, алкилкарбонильную группу с числом атомов углерода в алкильном остатке от одного до шести, алкоксикарбонильную группу с числом атомов углерода в алкоксильном остатке от одного до шести или гетероциклилкарбонильную группу, причем алкильная группа с числом атомов углерода от одного до шести и алкоксикарбонильная группа с числом атомов углерода в алкоксильном остатке от одного до шести могут быть от одного до трех раз замещены одинаковыми или разными заместителями, выбираемыми из группы, состоящей из гетероарильной, гидроксильной группы, алкоксигруппы с числом атомов углерода от одного до четырех, гидроксикарбонильной группы, алкоксикарбонильной группы с числом атомов углерода в алкоксильном остатке от одного до шести, аминокарбонильной, моно- и диалкиламинокарбонильной группы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, цианогруппы, аминогруппы, моно- и диалкиламиногруппы с числом атомов углерода в каждом из алкильных остатков от одного до четырех,
или
R6 означает структурную единицу формулы
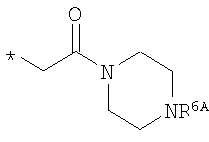 ,
, 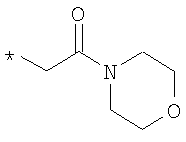 или
или 
где
R6A выбирают из группы, состоящей из атома водорода и алкильной группы с числом атомов углерода от одного до четырех, и
n означает целое число 1 или 2,
R7 означает атом галогена, нитрогруппу, цианогруппу, трифторметильную группу, трифторметоксигруппу, метильную или этильную группу
и
Y1, Y2, Y3, Y4 и Y5, каждый, означает СН-группу.
В другом варианте настоящее изобретение относится к соединениям общей формулы (I), где
А означает фенильный или пиридильный цикл,
R1 и R3, каждый, означают атом водорода,
R2 означает атом фтора, хлора, брома, нитрогруппу или цианогруппу,
R4 означает цианогруппу, алкилкарбонильную группу с числом атомов углерода в алкильном остатке от одного до четырех или алкоксикарбонильную группу с числом атомов углерода в алкоксильном остатке от одного до четырех, причем алкоксикарбонильная группа с числом атомов углерода в алкоксильном остатке от одного до четырех может быть также замещена заместителем, выбираемым из группы, состоящей из гидроксильной группы, алкоксигруппы с числом атомов углерода от одного до четырех, алкоксикарбонильной группы с числом атомов углерода в алкоксильном остатке от одного до четырех, моно- и диалкиламиногруппы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, гетероарильной и гетероциклильной группы,
R5 означает метальную группу,
R6 означает атом водорода, алкильную группу с числом атомов углерода от одного до четырех, моно- или диалкиламинокарбонильную группу с числом атомов углерода в каждом из алкильных остатков от одного до четырех, алкилкарбонильную группу с числом атомов углерода в алкильном остатке от одного до четырех или алкоксикарбонильную группу с числом атомов углерода в алкоксильном остатке от одного до четырех, причем алкильная группа с числом атомов углерода от одного до четырех и алкоксикарбонильная группа с числом атомов углерода в алкоксильном остатке от одного до четырех могут быть замещены заместителем, выбираемым из группы, состоящей из гетероарильной, гидроксильной группы, алкоксигруппы с числом атомов углерода от одного до четырех, гидроксикарбонильной группы, аминокарбонильной, моно- и диалкиламинокарбонильной группы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, аминогруппы, моно- и диалкиламиногруппы с числом атомов углерода в каждом из алкильных остатков от одного до четырех,
или
R6 означает структурную единицу формулы
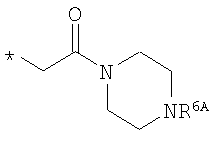 или
или 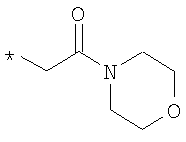
где
R6A выбирают из группы, состоящей из атома водорода и метальной группы,
R7 означает трифторметильную группу или нитрогруппу
и
Y1, Y2, Y3, Y4 и Y5, каждый, означает СН-группу.
В еще одном варианте настоящее изобретение относится к соединениям, соответствующим общей формуле (I), где А означает фенильную или пиридильную группу.
В еще одном варианте настоящее изобретение относится к соединениям, соответствующим общей формуле (I), где R1 означает атом водорода.
В еще одном варианте настоящее изобретение относится к соединениям, соответствующим общей формуле (I), где R2 означает цианогруппу, в частности, когда А означает фенильную или пиридильную группу и R2 означает цианогруппу, присоединенную в параположение по отношению к центральному дигидропиримидиноновому циклу.
В еще одном варианте настоящее изобретение относится к соединениям, соответствующим общей формуле (I), где R3 означает атом водорода.
В еще одном варианте настоящее изобретение относится к соединениям, соответствующим общей формуле (I), где R4 означает алкоксикарбонильную группу с числом атомов углерода в алкоксильном остатке от одного до четырех, который может быть замещен гидроксильной группой, в частности, это может быть 2-гидроксиэтокси-карбонильная группа, или же где R4 означает алкилкарбонильную группу с числом атомов углерода в алкильном остатке от одного до четырех, в частности, означает метилкарбонильную группу.
В еще одном варианте настоящее изобретение относится к соединениям, соответствующим общей формуле (I), где R5 означает метильную группу.
В еще одном варианте настоящее изобретение относится к соединениям, соответствующим общей формуле (I), где R6 означает атом водорода.
В еще одном варианте настоящее изобретение относится к соединениям, соответствующим общей формуле (I), где R7 означает трифторметильную группу или нитрогруппу, в частности, когда R7 означает трифторметильную группу, присоединенную в метаположение по отношению к центральному дигидропиримидиноновому циклу.
В еще одном варианте настоящее изобретение относится к соединениям общей формулы (IA)
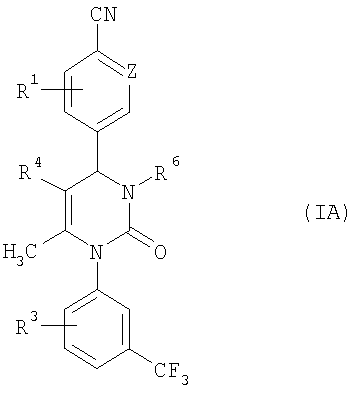 ,
,
где
Z означает СН-группу или атом азота и
R1, R3, R4 и R6 имеют приведенное выше значение.
Соответствующие настоящему изобретению соединения, у которых R6 означает атом водорода, могут енолизоваться в соответствующие гидроксиамидины:
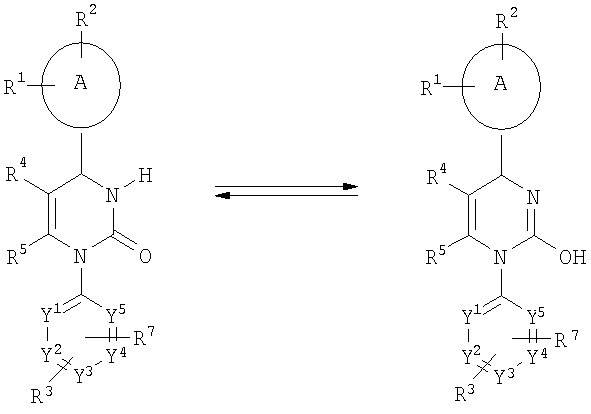
Соединения общей формулы (I) могут быть синтезированы путем конденсации соединений общей формулы (II)
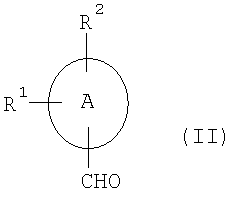 ,
,
где A, R1 и R2 имеют приведенные выше значения,
с соединениями общей формулы (III)
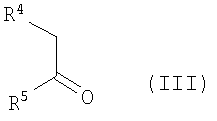 ,
,
где
R4 и R5 имеют приведенные выше значения,
и с соединениями общей формулы (IV)
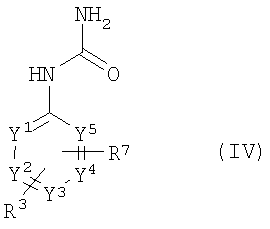 ,
,
где
R3, R7 и фрагменты от Y1 до Y5 имеют приведенные выше значения,
в присутствии кислоты в результате одностадийной трехкомпонентной реакции или же в последовательном превращении с образованием соединений общей формулы (IB)
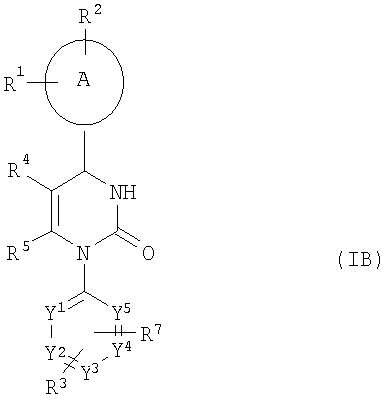 ,
,
где
А, заместители от R1 до R5, R7 и фрагменты от Y1 до Y5 имеют приведенные выше значения,
при этом соединения общей формулы (IB) могут затем реагировать с соединениями общей формулы (V)
 ,
,
где
R6* имеет значение, приведенное выше для R6, но не означает атом водорода, и
Х означает уходящую группу, например, атом галогена, тозилатную, мезилатную или сульфатную группу,
в присутствии основания.
Соединения общей формулы (I), где R4 означает цианогруппу, R5 означает аминогруппу и R6 означает атом водорода, могут быть получены альтернативным способом в результате конденсации соединений общей формулы (II) с соединениями общей формулы (IV) и с соединением формулы (VI)
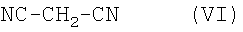
в присутствии кислоты в ходе трехкомпонентной одностадийной реакции или в ходе последовательного превращения.
Подходящими растворителями для процесса (II)+(III)/(VI)+(IV)→(IB) являются в общем случае обычные органические растворители, которые не изменяются в условиях проведения реакции. В их число входят такие простые эфиры, как диэтиловый эфир, диизопропиловый эфир, 1,2-диметоксиэтан, диоксан или тетрагидрофуран, а также этилацетат, ацетон, ацетонитрил, диметилсульфоксид, диметилформамид или такие спирты, как метанол, этанол, н-пропанол, изопропанол, н-бутанол или трет-бутанол, или такие углеводороды, как пентан, гексан, циклогексан, бензол, толуол или ксилол, или же такие галогензамещенные углеводороды, как дихлорметан, дихлорэтан, трихлорметан или хлорбензол. Можно также использовать смеси названных выше растворителей. Предпочтение отдается проведению процесса в тетрагирофуране.
Подходящими кислотами для процесса (II)+(III)/(VI)+(IV)→(IB) являются в общем случае неорганические или органические кислоты. В предпочтительном случае их перечень включает такие карбоновые кислоты, как, например, уксусная кислота или трифторуксусная кислота, такие сульфокислоты, как, например, метансульфокислота или н-толуолсульфокислота, хлористоводородная кислота или такие фосфорные кислоты, как полифосфорная кислота. Предпочтение отдается этиловому эфиру полифосфорной кислоты. Кислоту используют в количестве от 0,25 молей до 100 молей из расчета на один моль соединения общей формулы III.
В общем случае процесс проводят в температурном интервале от +20°С до +150°С, в предпочтительном случае от +60°С до +100°С.
В общем случае процесс проводят при нормальном давлении. Тем не менее, не исключена возможность проведения его при повышенном давлении или при пониженном давлении (например, в пределах от 0,5 до 5 бар).
Подходящими растворителями для процесса (IB)+(V)→(I) являются в общем случае обычные органические растворители, которые не изменяются в условиях проведения реакции. В их число входят такие простые эфиры, как диэтиловый эфир, диизопропиловый эфир, 1,2-диметоксиэтан, диоксан или тетрагидрофуран, а также этилацетат, ацетон, ацетонитрил, диметилсульфоксид, диметилформамид или такие углеводороды, как пентан, гексан, циклогексан, бензол, толуол или ксилол, или же такие галогензамещенные углеводороды, как дихлорметан, дихлорэтан, трихлорметан или хлорбензол. Можно также использовать смеси названных выше растворителей. Предпочтение отдается проведению процесса в тетрагидрофуране.
Подходящими основаниями для проведения процесса (IB)+(V)→(I) в общем случае являются неорганические или органические основания. В предпочтительном случае в их число входят такие циклические амины, как, например, пиперидин или 4-N,N-диметиламинопиридин, или же триалкиламины с числом атомов углерода в каждом из алкильных остатков от одного до четырех, например такие, как триэтиламин или диизопропилэтиламин, или же такие гидриды, как гидрид натрия. Предпочтение отдается гидриду натрия. Основание используют в количестве от 0,1 моля до 10 молей, в предпочтительном случае от 1 моля до 3 молей, из расчета на 1 моль соединения общей формулы (V).
В общем случае процесс проводят в температурном интервале от 0°С до +150°С, в предпочтительном случае от +20°С до +80°С, в частности, при комнатной температуре. В общем случае процесс проводят при нормальном давлении. Тем не менее, не исключена возможность проведения его при повышенном давлении или при пониженном давлении (например, в пределах от 0,5 до 5 бар).
Соединения общих формул (II), (III), (IV), (V) и (VI) сами по себе известны или же они могут быть получены известными способами.
Представленный выше способ может быть иллюстрирован следующей схемой:
Соответствующие изобретению соединения проявляют полезный спектр фармакологической и фармакокинетической активности, что нельзя было предвидеть заранее. Поэтому они подходят для использования в качестве медикаментов для лечения и/или для профилактики болезненных проявлений у человека или у животных.
Неожиданно оказалось, что соответствующие настоящему изобретению соединения проявляют ингибирующую активность по отношению к нейтрофильной эластазе человека, благодаря чему они могут найти применение для изготовления медикаментов для лечения болезней, ассоциированных с активностью нейтрофильной эластазы человека. Они могут представлять собой эффективное средство для лечения острых и хронических воспалительных процессов, например, ревматоидного артрита, атеросклероза и, в частности, таких острых и хронических заболеваний легких, как фиброз легких, кистозный фиброз, воспаление легких, острый респираторный дистресс-синдром, в частности легочная эмфизема, включая сюда эмфизему курильщика, и хронические обструктивные легочные заболевания, хронический бронхит и бронхоэктаз. Соответствующие настоящему изобретению соединения могут также представлять собой эффективные средства для лечения таких ишемических сердечно-сосудистых заболеваний, как острый коронарный синдром, острый инфаркт миокарда, перемежающаяся и стойкая стенокардия, последствия артериально-коронарного шунтирования и прогрессирующая сердечная недостаточность, для лечения атеросклероза, заболеваний митрального клапана, дефектов перегородки предсердия, последствий перкутанной транслуминальной коронарной ангиопластики, воспалений после операций на открытом сердце и легочной гипертензии. Они также могут оказаться полезными для эффективного лечения ревматоидного артрита, острого воспалительного артрита, рака, острого панкреатита, язвенного колита, периодонтальных болезней, синдрома Чури-Штраусса, острого и хронического аллергического дерматита, псориаза, системной эритематозной волчанки, пузырчатки, сепсиса, алкогольного гепатита, фиброза печени, болезни Бехчета, аллергического грибкового синусита, аллергического синусита, болезни Крона, болезни Кавасаки, гломерулонефрита, острого пиелонефрита, колоректальных болезней, хронического гнойного отита среднего уха, хронического венозного варикоза ног, воспалительных заболеваний пищеварительного тракта, бактериальных и вирусных инфекций, травм головного мозга, удара и других состояний, в которых отмечено участие нейтрофилов.
Настоящее изобретение относится также к медикаментам, содержащим по крайней мере одно соответствующее настоящему изобретению соединение, в предпочтительном случае вместе с одним или с несколькими фармакологически безопасными разбавителями или носителями, а также к использованию их для представленных выше целей. Активная компонента может оказывать местное и/или системное действие. С этой целью ее вводят соответствующим способом, например, через рот, парентерально, через легкие, назально, под язык, лингвально, буккально, ректально, трансдермально, через конъюнктиву, в ухо или в виде имплантанта.
Для этих способов применения активная компонента может быть введена в виде соответствующих лекарственных форм.
Соответствующие лекарственные формы для введения через рот включают лекарственные формы, которые высвобождают активную компоненту быстро и/или в модифицированном виде, например, это таблетки (таблетки без покрытия или таблетки с покрытием, например, с покрытием для тонкого кишечника), капсулы, таблетки, покрытые сахаром, гранулы, пилюли, порошки, эмульсии, суспензии, растворы и аэрозоли.
Парентеральные лекарственные формы могут быть использованы для введения, минуя стадию абсорбции (внутривенно, внутриартериально, внутрисердечно, интраспинально или в область поясницы), или же включая стадию абсорбции (внутримышечно, подкожно, интрадермально, трансдермально или внутрибрюшинно). Соответствующие лекарственные формы для парентерального введения включают составы для инъекций и для вливаний в виде растворов, суспензий, эмульсий, лиофилизатов и стерильных порошков.
Лекарственные формы, используемые для других способов введения, представлены, например, ингаляционными фармацевтическими формами (включая порошковые ингаляторы, пульверизаторы), назальные капли/растворы, аэрозоли, таблетки или капсулы на язык, под язык или за щеку (буккально), суппозитории, ушные и глазные лекарственные формы, вагинальные капсулы, водные суспензии (лосьоны, микстуры, которые надо встряхивать), липофильные суспензии, мази, кремы, молочко, пасты, порошки для опудривания или имплантанты.
Активные компоненты могут быть превращены в названные лекарственные формы способами, которые хорошо известны. Для этого используют инертные, нетоксичные, фармацевтически приемлемые носители. В их число входят наряду с другими носители (например, микрокристаллическая целлюлоза), растворители (например, жидкие полиэтиленгликоли), эмульгаторы (например, додецилсульфат натрия), диспергаторы (например, поливинилпирролидон), синтетические и натуральные биополимеры (например, альбумин), стабилизаторы (например, такие антиоксиданты, как аскорбиновая кислота), окрашенные вещества (например, такие неорганические пигменты, как оксид железа) или же средства для коррекции вкуса и/или запаха.
При использовании людьми, в случае введения через рот, рекомендуется вводить дозы от 0,001 до 50 мг/кг, в предпочтительном случае от 0,01 мг/кг до 20 мг/кг. При парентеральном введении, например, при введении внутривенно или через слизистые оболочки назально, буккально или ингаляционно, рекомендуется использовать дозы от 0,001 мг/кг до 0,5 мг/кг.
Тем не менее, в определенных обстоятельствах может возникнуть необходимость в отклонении от указанных количеств, а именно в зависимости от массы тела, пути введения, индивидуальных особенностей по отношению к активной компоненте, вида лекарственной формы и времени или интервала, в котором происходит прием лекарственной формы. В определенных случаях, например, может оказаться достаточным использование меньшего по сравнению с вышеуказанным количества, тогда как в других случаях следует превысить указанный выше верхний предел. В случае введения повышенных дозировок можно рекомендовать дробление их на несколько индивидуальных доз, распределяемых на весь день.
Процентные соотношения в приводимых далее опытах и примерах, если не указано иное, относятся к соотношениям масс, части также относятся к единицам масс. Соотношения растворителей, разбавления и концентрации, относящиеся к растворам жидкость в жидкости, во всех случаях основаны на объемах.
А. Определение физиологической активности
Способность соответствующих изобретению соединений ингибировать активность нейтрофильной эластазы может быть продемонстрирована, например, с помощью приведенных далее экспериментов.
I. Ферментативные опыты in vitro на нейтрофильной эластазе человека
Описание опыта
Используемый в опыте буфер: 0,1 моль/л 4-(2-гидроксиэтил)-1-пиперазинэтансульфокислоты с гидроксидом натрия, рН буфера 7,4, 0,5 моль/л хлорида натрия, 0,1% (массы в объеме) альбумина сыворотки крупного рогатого скота.
Соответствующая концентрация (смотри далее) нейтрофильной эластазы человека (18 единиц на мг, в виде лиофилизата, #20927.01, SERVA Electrophoresis GmbH, Гейдельберг, Германия) в используемом для эксперимента буфере.
Соответствующая концентрация (смотри далее) субстрата в используемом для эксперимента буфере.
Соответствующая концентрация исследуемых соединений, разбавленных используемым для эксперимента буфером, получена из базового раствора в диметилсульфоксиде с концентрацией 10 ммоль/л.
Пример А
Ингибирование in vitro нейтрофильной эластазы человека с использованием флуорогенного пептидного субстрата (постоянное считывание сигнала в формате 384 МТР)
По ходу этого опыта используют субстрат эластазы MeOSuc-Ala-Ala-Pro-Val-AMC (#324740, Calbiochem-Novabiochem Corporation, Merck KGaA, Дармштадт, Германия). Исследуемый раствор готовят путем смешения 10 мкл разбавленного раствора исследуемого вещества, 20 мкл разбавленного ферментного раствора нейтрофильной эластазы человека (конечная концентрация от 8 до 0,4 мкЕд/мл, в стандартных условиях 2,1 мкЕд/мл) и 20 мкл разбавленного раствора субстрата (конечная концентрация от 1 ммоль/л до 1 мкмоль/л, в стандартных условиях 20 мкмоль/л), соответственно. Раствор инкубируют в течение 0-2 часов при 37°С (в стандартных условиях в течение 1 часа). Флуоресценцию выделившегося в результате ферментативной реакции АМС измеряют при 37°С (TECAN spectra fluor plus plate reader). Скорость усиления флуоресценции (возбуждение 395 нм, излучение 460 нм) пропорциональна активности эластазы. Значения IC50 определяют по графику RFU-[I]. Значения Km и Km(набл.) определяют по графику Лайнуивера-Берка и переводят их в значения Ki по координатам Диксона.
В этом опыте приготовленные образцы имели значения IC50 в пределах от 5 нмоль/л до 5 мкмоль/л. Характерные примеры приведены в таблице 1.
Пример Б
Ингибирование in vitro нейтрофильной эластазы человека с использованием флуорогенного нерастворимого эластинового субстрата (периодическое считывание сигнала в формате 96 МТР)
По ходу этого опыта используют эластин-флуоресцеиновый субстрат эластазы (#100620, ICN Biomedicals GmbH, Эшвеге, Германия). Исследуемый раствор готовят путем смешения 3 мкл разбавленного раствора исследуемого вещества, 77 мкл разбавленного ферментного раствора нейтрофильной эластазы человека (конечная концентрация от 0,22 Ед/мл до 2,2 Ед/мл, в стандартных условиях 21,7 мк Ед/мл) и 80 мкл суспензии субстрата (конечная концентрация 2 мг/мл). Суспензию инкубируют в течение 0-16 часов при 37°С (в стандартных условиях в течение 4 часов), слегка встряхивая ее. Для остановки ферментативной реакции к исследуемому раствору прибавляют 160 мкл децимолярной уксусной кислоты (конечная концентрация 50 ммоль/л). Полимерный эластин-флуоресцеин осаждают центрифугированием (центрифуга Eppendorf 5804, 3000 об/мин, 10 минут). Супернатант переносят в новый МТР и определяют флуоресценцию выделившегося в результате ферментативной реакции пептидного флуоресцеина (BMG Fluostar plate reader). Скорость усиления флуоресценции (возбуждение 490 нм, излучение 520 нм) пропорциональна активности эластазы. Значения IC50 определяют по графику RFU-[I].
II. Опыты in vitro на нейтрофилах человека
Пример А
Опыт in vitro на эластолитическую активность на полиморфоядерных клетках
Этот опыт используют для определения эластолитической способности полиморфоядерных клеток человека и оценки степени деградации, относящейся к нейтрофильной эластазе [см. также Z.W.She и др., Am. J. Respir. Cell. Mol. Biol. 9, 386-392 (1993)].
Меченный тритием эластин в виде суспензии наносят на 96-луночный планшет по 10 мкг на лунку. В соответствующих концентрациях в лунки прибавляют исследуемое вещество, вещество сравнения [ZD-0892 (J. Med. Chem. 40, 1876-1885, 3173-3181 (1997), заявка на международный патент №95/21855), и ингибитор α1 протеазы (α1PI)]. Полиморфоядерные клетки человека отделяют от периферической венозной крови здоровых доноров и снова суспендируют в культуральной среде. В лунки с нанесенным эластином прибавляют нейтрофилы в концентрациях, лежащих в пределах от 1×106 до 1×105 клеток на лунку. В положительном контроле для опыта используют свиную панкреатическую эластазу (1,3 мкмоль/л), тогда как α1PI (1,2 мкмоль/л) используют в качестве положительного ингибитора нейтрофильной эластазы. Контрольные клетки представляют собой полиморфоядерные клетки без добавления веществ для каждой соответствующей плотности клеток. Клетки с добавленными соединениями инкубируют в инкубаторе с увлажнением при 37°С в течение 4 часов. Планшеты центрифугируют для того, чтобы иметь возможность отбора только супернатанта над клетками. Супернатант объемом 75 мкл переносят в соответствующие лунки 96-луночного планшета Lumaplate™ (планшеты, содержащие твердый сцинтиллянт). Планшеты сушат до полного отсутствия в лунках видимой жидкости и проводят подсчет в бета-счетчике в течение 3 минут на лунку.
Лизис 3H-эластина приводит к увеличению показаний счетчика в супернатанте. Ингибирование такого эластолизиса приводит к снижению содержания трития в супернатанте по сравнению с клеточным контролем. С α1PI получают ингибирование на 83,46±3,97% (± означает статистически достоверный доверительный интервал) при 1,2 мкмоль/л (для трех разных источников данных при 3,6×105 клеток на лунку). Значения IC50, полученные для вещества сравнения ZD-0892, соответствуют 45,50±7,75 нмоль/л (± означает статистически достоверный доверительный интервал) (для двух разных источников данных при 3,6×105 клеток на лунку).
Если принять во внимание, что ZD-0892 представляет собой селективный ингибитор эластазы полиморфоядерных лейкоцитов, и учесть данные по ингибированию с α1PI, то эти результаты свидетельствуют о том, что основная деградация эластина полиморфоядерными лейкоцитами связана с выделением нейтрофильной эластазы, а не с другими эластолитическими ферментами, например, с матричными металлопротеазами. Соответствующие настоящему изобретению соединения проявили ингибирующую активность в этом зависящем от нейтрофильной эластазы человека модельном опыте по лизису эластина нейтрофилами.
Пример Б
Ингибирование in vitro эластазы, связанной с мембраной
Определение ингибирования эластазы, связанной с мембраной нейтрофилов, проводят в опытах, использующих нейтрофилы человека. Нейтрофилы стимулируют с LPS при 37°С в течение 35 минут и после этого центрифугируют при 1600 об/мин. После этого связанную с мембранами эластазу фиксируют на нейтрофилах с помощью 3%-ного параформальдегида и 0,25%-ного глутарового альдегида в течение 3 минут при 4°С. После этого нейтрофилы центрифугируют и прибавляют носитель и исследуемое соединение, затем прибавляют субстрат MeOSuc-Ala-Ala-Pro-Val-AMC (#324740, Calbiochem-Novabiochem Corporation, Merck KGaA, Дармштадт, Германия) с концентрацией 200 мкмоль/л. После инкубирования в течение 25 минут при 37°С останавливают реакцию фенилметансульфонилфторидом и определяют флуоресценцию при возбуждении светом 400 нм на излучение при 505 нм. Значения IC50 определяют графическим интерполированием данных по относительной флуоресценции в зависимости от концентрации ингибитора.
III. Модельные опыты in vivo
Пример А
Модель острого повреждения легкого крысы in vivo
Инстилляция нейтрофильной эластазы человека в легкое крысы вызывает его острое повреждение. Развитие этого повреждения может оцениваться по измерению легочной геморрагии.
Крыс анестезируют с помощью Hypnorm/Hypnovel/water и инсталлируют нейтрофильной эластазой человека или солевым раствором в легкие через микропульверизатор. Исследуемые соединения вводят внутривенной инъекцией, перорально или ингаляционно в установленное время перед введением нейтрофильной эластазы человека. Через шестьдесят минут после введения эластазы животных усыпляют передозировкой анестетика (пентабарбитона-натрия) и промывают легкие двумя миллилитрами фосфатного солевого буфера с добавлением и гепарина. Объем бронхоальвеолярного лаважа регистрируют и устанавливают образцы в лед. Каждый образец бронхоальвеолярного лаважа центрифугируют при 900 об/мин в течение 10 минут при 4-10°С. Супернатант отбрасывают, а осажденные клетки снова суспендируют в фосфатном солевом буфере и еще раз центрифугируют. Снова отбрасывают супернатант, а осажденные клетки ресуспендируют в 1 мл солевого фосфатного солевого буфера, содержащем 0,1% бромида цетилтриметиламмония для лизирования клеток. До определения содержания крови образцы замораживают. Перед анализом на геморрагию образцы размораживают и перемешивают. В отдельные лунки 96-луночного планшета с плоским основанием вносят по 100 мкл каждого образца. Все образцы анализируют два раза. В холостом опыте берут 100 мкл фосфатного солевого буфера с гепарином, содержащим 0,1% бромида цетилтриметиламмония. Абсорбцию в лунках определяют с помощью спектрофотометра при 415 нм. Стандартную кривую строят по данным измерения оптической плотности при 415 нм на различных концентрациях крови в фосфатном солевом буфере, содержащем 0,1% бромида цетилтриметиламмония. Значения содержания крови рассчитывают по результатам сравнения со стандартной кривой (ее строят для каждого планшета) и приводят их к полученному объему жидкого бронхоальвеолярного лаважа.
На этой модели индуцированной нейтрофильной эластазой человека геморрагии у крыс ингибирующая активность соответствующих изобретению соединений исследовалась при внутривенном, пероральном и ингаляционном введении.
Пример Б
Модельный опыт на крысах при остром инфаркте миокарда in vivo
Ингибиторы эластазы исследуют в опыте на моделированном с помощью перевязки инфаркте у крысы. Самцы крыс линии Wistar (весом более 300 г) получают 10 мг/кг аспирина за 30 минут перед хирургическим вмешательством. Их анестезируют изофлураном и во время всей операции проводят искусственную вентиляцию (120-130 ударов в минуту, разовый объем 200-250 мкл, MiniVent Type 845, Hugo Sachs Elektronik, Германия). После вскрытия грудной клетки с левой стороны в четвертом межреберном пространстве вскрывают перикард и на короткое время извлекают сердце. Петлю накладывают вокруг левой коронарной артерии, не закрывая ее. Жгут пропускают под кожей к затылку животного. Грудь закрывают и дают животному поправиться в течение четырех дней. На пятый день крыс в течение трех минут анестезируют эфиром, петлю затягивают, закрывая левую коронарную артерию, контролируя процесс по электрокардиограмме. Исследуемые соединения вводят перед окклюзией левой коронарной артерии или после этого перорально, внутрибрюшинно или внутривенно (инъекция или постоянное вливание). Через 1 час после окклюзии перетяжку открывают, восстанавливая кровоток. Сердца извлекают и через 48 часов определяют размеры инфарктов окрашиванием сердец после повторной окклюзии красителем синий Эванса, с последующим окрашиванием хлоридом трифенилтетразолия 2 мм срезов сердца. Зоны с нормальной оксигенацией (ткань, не затронутая окклюзией) окрашиваются в синий цвет, ишемические зоны (затронутые окклюзией, но не погибшие) окрашиваются в красный цвет, а некротические зоны (отмершая в результате окклюзии ткань) остаются белыми. Каждый срез ткани сканируют и с помощью компьютерной планиметрии определяют размеры инфарктов.
Б. Примеры
Сокращения:
Общие методики
Все реакции проводят в атмосфере аргона, если не указано иное. Растворители используют в том виде, в котором они получены от компании Aldrich без дополнительной очистки. Термин “силикагель” или “кремнезем” относится к силикагелю марки 60 (0,040 мм-0,063 мм) компании Merck KGaA. Температуры плавления определяют на приборе Büchi 512 или на аналогичном приборе для определения температуры плавления, они не исправлены.
Соединения, очищенные с помощью препаративной ВЭЖХ, очищены на колонке RP18 с использованием в качестве элюента ацетонитрила с водой, градиент от 1:9 до 9:1.
Жидкостная хроматомасс-спектрометрия и ВЭЖХ
Жидкостная хроматомасс-спектрометрия, способ 1
Тип прибора: Micromass Quattro LCZ, HP 1100; колонка: Uptisphere HDO, 50 мм ×2,0 мм, 3 мкм; элюент А: вода +0,05% муравьиной кислоты, элюент Б: ацетонитрил +0,05% муравьиной кислоты; градиент: 0,0 минут 100% А→0,2 минуты 100% А→2,9 минуты 30% А→3,1 минуты 10% А→4,5 минуты 10% А; термостат: 55°С; скорость потока: 0,8 мл/мин; УФ-детектор: 208-400 нм.
Жидкостная хроматомасс-спектрометрия, способ 2
Прибор: Waters Alliance 2790 LC; колонка: Symmetry C18, 50 мм ×2,1 мм, 3,5 мкм; элюент А: вода+0,1% муравьиной кислоты, элюент Б: ацетонитрил +0,1% муравьиной кислоты; градиент: 0,0 минут 5% Б→5,0 минут 10% Б→6,0 минут 10% Б; температура 50°С; скорость потока: 1,0 мл/мин; УФ-детектор: 210 нм.
Жидкостная хроматомасс-спектрометрия, способ 3
Прибор: Micromass Platform LCZ, HP1100; колонка: Aquasil C-18, 50 мм ×2,0 мм, 3 мкм; элюент А: вода+0,05% муравьиной кислоты, элюент Б: ацетонитрил +0,05% муравьиной кислоты; градиент: 0,0 минут 100% А→0,2 минуты 100% А→2,9 минуты 30% А→3,1 минуты 10% А→4,5 минуты 10% А; термостат: 55°С; скорость потока: 0,8 мл/мин; УФ-детектор: 208-400 нм.
Жидкостная хроматомасс-спектрометрия, способ 4
Прибор: HP 1100 с цифровым диодно-матричным детектором; колонка: Kromasil RP-18, 60 мм ×2 мм, 3,5 мкм; элюент: А=5 мл HClO4 на 1 л воды, Б = ацетонитрил; градиент: 0 минут 2% Б, 0,5 минуты 2% Б, 4,5 минуты 90% Б, 6,5 минуты 90% Б; скорость потока: 0,75 мл/мин; температура: 30°С; УФ-детектор: 210 нм.
Жидкостная хроматомасс-спектрометрия, способ 5
Прибор: Micromass TOF-MUX-Interface, 4-кратный параллельный ввод, с ВЭЖХ Waters 600; колонка: Uptisphere HDO, 50 мм ×2,0 мм, 3,0 мкм; элюент А: 1 л воды +1 мл 50%-ной муравьиной кислоты, элюент Б: 11 ацетонитрила +1 мл 50%-ной муравьиной кислоты; градиент: 0,0 минут 100% А→0,2 минуты 100% А→2,9 минуты 30% А→3,1 минуты 10% А→4,5 минуты 10% А→4,6 минуты 100% А→6,5 минуты 100% А; термостат: комнатная температура; скорость потока: 0,8 мл/мин; УФ-детектор: 210 нм.
Жидкостная хроматомасс-спектрометрия, способ 6
Прибор: Micromass Platform LCZ с ВЭЖХ Agilent Serie 1100; колонка: Grom-SIL120 ODS-4 HE, 50 мм ×2,0 мм, 3 мкм; элюент А: 1 л воды +1 мл 50%-ной муравьиной кислоты, элюент Б: 1 л ацетонитрила +1 мл 50%-ной муравьиной кислоты; градиент: 0,0 минут 100% А→0,2 минуты 100% А→2,9 минуты 30% А→3,1 минуты 10% А→4,5 минуты 10% А; термостат: 55°С; скорость потока: 0,8 мл/мин; УФ-детектор: 208-400 нм.
Жидкостная хроматомасс-спектрометрия, способ 7
Прибор: Micromass Quattro LCZ с ВЭЖХ Agilent Serie 1100; колонка: Uptisphere HDO, 50 мм ×2,0 мм, 3 мкм; элюент А: 1 л воды +1 мл 50%-ной муравьиной кислоты, элюент Б: 1 л ацетонитрила +1 мл 50%-ной муравьиной кислоты; градиент: 0,0 минут 100% А→0,2 минуты 100% А→2,9 минуты 30% А→3,1 минуты 10% А→4,5 минуты 10% А; термостат: 55°С; скорость потока: 0,8 мл/мин; УФ-детектор: 208-400 нм.
Исходные продукты
Пример1А
2-Бром-5-(1,3-Диоксолан-2-ил)пиридин
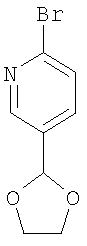
В круглодонной колбе, снабженной обратным холодильником и ловушкой Дина-Старка, в толуоле (50 мл) растворяют 6-бром-3-пиридинкарбальдегид (500 мг, 2,7 ммоля) и 1,2-этандиол (200 мг, 3,2 ммоля) вместе со смолой Amberlyst 15 (100 мг). Раствор оставляют на ночь при кипячении с обратным холодильником и перемешивании, затем охлаждают до комнатной температуры, фильтруют и концентрируют в вакууме. Сырой продукт хроматографируют на силикагеле с циклогексаном и этилацетатом в качестве элюента и получают целевое соединение в виде бесцветного масла.
Выход 0,489 г (79% от теории).
ВЭЖХ (способ 4): 3,46 минуты.
Масс-спектр (ионизация электрораспылением, положительные ионы): m/z=231 (М+Н)+.
1H-ЯМР (300 МГц, дейтерохлороформ): δ=8,46 (д., 1Н), 7,64 (м., 1Н), 7,49 (м., 1Н), 4,15-4,00 (м., 4Н) м.д.
Пример 2А
5-(1,3-Диоксолан-2-ил)-2-пиридинкарбонитрил
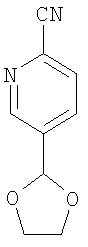
Вещество по примеру 1А (2,8 г, 12,5 ммоля), цианид цинка (1,6 г, 13,8 ммоля) и тетракис(трифенилфосфин)палладий(0) (1,4 г, 1,3 ммоля) растворяют в диметилформамиде (100 мл) и оставляют на ночь (на 18 часов) при перемешивании при 80°С. Прибавляют еще тетракис(трифенилфосфин)палладий(0) (0,1 г) и снова оставляют на ночь (на 18 часов) при перемешивании при 80°С, после этого оставляют на 2 дня (48 часов) при комнатной температуре. Растворитель удаляют в вакууме, к остатку прибавляют воду (100 мл) и экстрагируют продукт этилацетатом (1 л). Органическую фазу промывают раствором хлорида натрия (200 мл), сушат моногидратом сульфата магния, фильтруют и концентрируют в вакууме. Сырой продукт хроматографируют на силикагеле с циклогексаном и этилацетатом в качестве элюента и получают целевое соединение в виде твердого аморфного вещества белого цвета.
Выход 0,94 г (42% от теории).
ВЭЖХ (способ 4): 3,21 минуты.
Масс-спектр (ионизация электрораспылением, положительные ионы): m/z=177 (М+Н)+.
1H-ЯМР (400 МГц, d6-диметилсульфоксид): δ=8,81 (с., 1Н), 8,09 (с., 2Н), 5,95 (с., 1H), 4,13-3,94 (м., 4Н) м.д.
Пример 3А
5-Формил-2-пиридинкарбонитрил
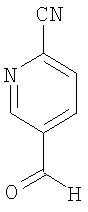
Способ а)
Синтез ведут по аналогии с методикой Dodd, D. и др. [J. Org. Chem. 1992, 57, 7226-7234]. К перемешиваемому раствору 5-(1,3-диоксолан-2-ил)-2-пиридинкарбонитрила (по примеру 2А, 850 мг, 4,8 ммоля) в ацетоне с водой 85:15 (59,5 мл) прибавляют n-толуол-сульфокислоту (102 мг, 0,59 ммоля). Реакционную смесь оставляют на ночь (на 18 часов) при кипячении с обратным холодильником и при перемешивании, затем прибавляют дополнительное количество n-толуолсульфокислоты (50 мг) и воду (5 мл). Реакционную смесь перемешивают при кипячении с обратным холодильником еще 48 часов. Раствор охлаждают до комнатной температуры и прибавляют насыщенный раствор бикарбоната натрия. Продукт экстрагируют этилацетатом (3 раза по 100 мл), сушат над моногидратом сульфата магния, фильтруют и концентрируют в вакууме. Сырой продукт очищают с помощью препаративной ВЭЖХ, получают твердое вещество светло-желтого цвета.
Выход 0,66 г (93% от теории).
Т.пл. 80-82°С.
ВЭЖХ (способ 4): 2,13 минуты.
Масс-спектр (ионизация электрораспылением, положительные ионы): m/z=133 (М+Н)+.
1Н-ЯМР (400 МГц, d6-диметилсульфоксид): δ=10.18 (с, 1Н), 9,21 (м., 1Н), 8,49 (м, 1H), 8,27 (м, 1Н) м.д.
Способ б)
В 8 мл дихлорметана растворяют 1,04 г (8,2 ммоля) оксалилхлорида. При -78°С прибавляют по каплям 1,28 г (16,4 ммоля) диметилсульфоксида. Раствор перемешивают при -78°С в течение 20 минут, затем прибавляют 1 г (7,46 ммоля) вещества по примеру 5А в виде раствора в 7 мл дихлорметана, продолжают перемешивание при -78°С в течение еще 2 часов, затем прибавляют по каплям 3,4 г (33,6 ммоля) триэтиламина и после нагрева до комнатной температуры очищают смесь с помощью колоночной хроматографии (кремнезем, элюент: от циклогексана до циклогексана с этилацетатом 2:1).
Выход 0,76 г (77% от теории).
Аналитические данные приведены выше.
Пример 4А
5-Метил-2-пиридинкарбонитрил
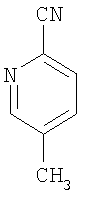
В 500 мл диметилформамида два часа кипятят с обратным холодильником 36 г (209 ммолей) 2-бром-5-метилпиридина и 37,5 г (418 ммолей) цианида меди. После охлаждения до 50°С прибавляют при перемешивании 10%-ный раствор водного аммиака (500 мл). Продукт экстрагируют дихлорметаном, сушат органическую фазу над сульфатом магния и удаляют растворитель в вакууме. Продукт очищают хроматографированием на колонке (кремнезем, элюент циклогексан с этилацетатом 9:1).
Выход 18 г (73% от теории).
1Н-ЯМР (300 МГц, дейтерохлороформ): δ=2,4 (с., 3H), 7,6 (м., 2Н), 8,6 (с., 1Н) м.д.
Пример 5А
5-(Гидроксиметил)-2- пиридинкарбонитрил
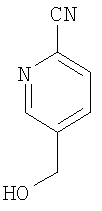
Соединение по примеру 4А (13 г, 110 ммолей) растворяют в 400 мл тетрахлорметана и прибавляют 29,4 г (165 ммолей) N-бромсукцинимида и 0,4 г (1,6 ммоля) дибензоилпероксида. Реакционную смесь три часа кипятят с обратным холодильником, охлаждают до комнатной температуры и фильтруют. Раствор промывают водным тиосульфатом натрия, сушат над сульфатом магния и удаляют растворитель в вакууме. Остаток растворяют в 200 мл диоксана и 200 мл воды, прибавляют карбонат кальция (44 г, 440 ммолей) и 2 часа кипятят смесь с обратным холодильником при перемешивании. После охлаждения до комнатной температуры смесь фильтруют и прибавляют дихлорметан. После разделения фаз органическую фазу сушат над сульфатом магния и удаляют растворитель в вакууме. Продукт очищают с помощью хроматографии (кремнезем, элюент циклогексан с этилацетатом 2:1).
Выход 5,2 г (35% от теории).
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=4,7 (д., 2Н), 5,6 (т., 1Н), 8,0 (м., 2Н), 8,7 (с., 1Н) м.д.
Примеры получения
Пример 1
Этиловый эфир 6-метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты

В 250 мл тетрагидрофурана суспендируют 7,0 г (34,29 ммоля) N-[3-трифторметил)фенил]мочевины, 8,99 г (68,58 ммоля) 4-цианобензальдегида, 8,92 г (68,58 ммоля) этилового эфира 3-кетобутановой кислоты и 20 г этилового эфира полифосфорной кислоты. Смесь 18 часов кипятят с обратным холодильником при перемешивании. После охлаждения до комнатной температуры удаляют растворитель в вакууме и очищают остаток хроматографированием на колонке на кремнеземе с циклогексаном и этилацетатом в качестве элюента.
Выход 13,4 г (91%).
1Н-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,1 (т., 3H); 2,0 (с., 3H); 4,0 (кв., 2Н); 5,4 (д., 1H); 7,6 (м., 3H); 7,7 (м, 3H); 7,9 (м., 2Н); 8,4 (д., 1Н) м.д.
Пример 2
4-{5-Ацетил-6-метил-2-оксо-1-[3-(трифторметил)фенил]-1,2,3,4-тетрагидро-4-пиримидинил}бензонитрил
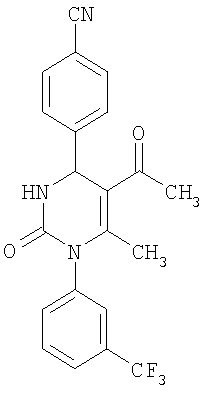
В 2 мл тетрагидрофурана суспендируют 265 мг (1,3 ммоля)
N-[3-(трифторметил)фенил]мочевины, 131 мг (1,0 ммоль) 4-цианобензальдегида и 100 мг (1,0 ммоль) 2,4-пентандиона и прибавляют каталитическое количество концентрированной хлористоводородной кислоты. Смесь 18 часов кипятят с обратным холодильником при перемешивании. После охлаждения до комнатной температуры удаляют растворитель в вакууме и очищают остаток хроматографированием на колонке на кремнеземе с циклогексаном и этилацетатом в качестве элюента.
Выход 29 мг (7%).
1H-ЯМР (200 МГц, d6-диметилсульфоксид): δ=2,0 (с., 3H); 2,2 (с., 3H); 5,5 (д., 1Н); 7,5 (м., 1Н); 7,6 (м., 3H); 7,7 (м., 1Н); 7,8 (м., 1Н); 7,9 (м., 2Н); 8,5 (д., 1Н) м.д.
Пример 3
Этиловый эфир 4-(4-бромфенил)-6-метил-2-оксо-1-[3-(трифторметил)фенил]-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
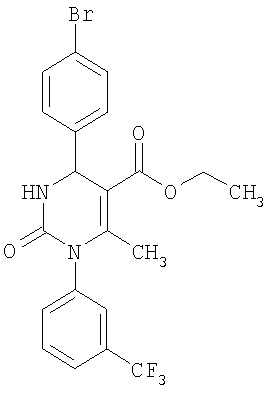
В 2 мл тетрагидрофурана суспендируют 204 мг (1,0 ммоль) N-[3-(трифторметил)фенил]мочевины, 142 мг (0,77 ммоля) 4-бромбензальдегида и 100 мг (0,77 ммоля) этилового эфира 3-кетобутановой кислоты, прибавляют каталитическое количество концентрированной хлористоводородной кислоты. Смесь 18 часов кипятят с обратным холодильником при перемешивании. После охлаждения до комнатной температуры удаляют растворитель в вакууме и очищают остаток хроматографированием на колонке на кремнеземе с циклогексаном и этилацетатом в качестве элюента.
Выход 23 мг (6%).
1H-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,1 (т., 3H); 2,0 (с., 3H); 4,0 (кв., 2Н); 5,3 (д., 1Н); 7,4 (м., 2Н); 7,6 (м., 3H); 7,7 (м., 3H); 8,3 (д., 1Н) м.д.
Пример 4
Этиловый эфир 6-метил-2-оксо-1-(4-фторфенил)-4-(4-цианофенил)-1,2,3,4-тетра-гидро-5-пиримидинкарбоновой кислоты
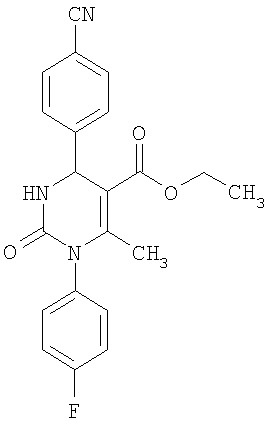
В 2 мл тетрагидрофурана суспендируют 154 мг (1,0 ммоль) N-(4-фторфенил)мочевины, 101 мг (0,77 ммоля) 4-цианобензальдегида и 100 мг (0,77 ммоля) этилового эфира 3-кетобутановой кислоты, прибавляют каталитическое количество концентрированной хлористоводородной кислоты. Смесь 18 часов кипятят с обратным холодильником при перемешивании. После охлаждения до комнатной температуры удаляют растворитель в вакууме и очищают остаток хроматографированием на колонке на кремнеземе с циклогексаном и этилацетатом в качестве элюента.
Выход 40 мг (14%).
1H-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,1 (т., 3H); 2,0 (с., 3H); 4,0 (кв., 2Н); 5,3 (д., 1Н); 7,3 (м., 4Н); 7,5 (м., 2Н); 7,9 (м., 2Н); 8,3 (д., 1Н) м.д.
Пример 5
Этиловый эфир 6-метил-2-оксо-1-(3-хлорфенил)-4-(4-цианофенил)-1,2,3,4-тетра-гидро-5-пиримидинкарбоновой кислоты
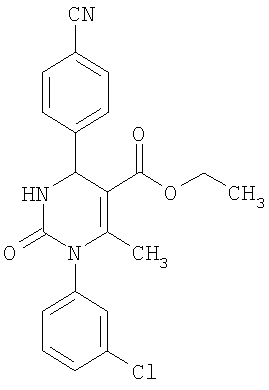
В 2 мл тетрагидрофурана суспендируют 170 мг (1,0 ммоль) N-(3-хлорфенил)мочевины, 100 г (0,77 ммоля) 4-цианобензальдегида и 100 мг (0,77 ммоля) этилового эфира 3-кетобутановой кислоты, прибавляют каталитическое количество концентрированной хлористоводородной кислоты. Смесь 18 часов кипятят с обратным холодильником при перемешивании. После охлаждения до комнатной температуры удаляют растворитель в вакууме и очищают остаток хроматографированием на колонке на кремнеземе с циклогексаном и этилацетатом в качестве элюента.
Выход 13 мг (4%).
1H-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,1 (т., 3H); 2,1 (с., 3H); 4,0 (кв., 2Н); 5,3 (д., 1Н); 7,2 (м., 1Н); 7,4 (м., 3H); 7,5 (м., 2Н); 7,9 (м., 2Н); 8,3 (д., 1Н) м.д.
Пример 6
(1S)-1-Метил-2-метокси-2-оксоэтиловый эфир 6-метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
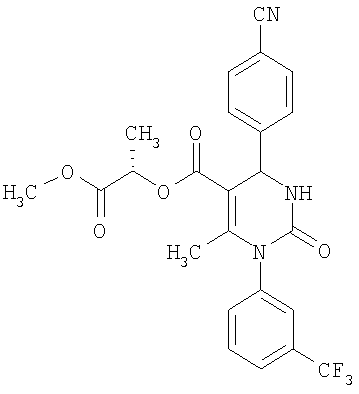
В 3 мл тетрагидрофурана суспендируют 200 мг (0,98 ммоля) N-[3-(трифторметил)фенил]мочевины, 129 мг (0,98 ммоля) 4-цианобензальдегида, 92 мг (0,49 ммоля) (1S)-1-метил-2-метокси-2-оксоэтилового эфира 3-кетобутановой кислоты и 295 мг этилового эфира полифосфорной кислоты. Смесь 18 часов кипятят с обратным холодильником при перемешивании. После охлаждения до комнатной температуры удаляют растворитель в вакууме и очищают остаток хроматографированием на колонке на кремнеземе с циклогексаном и этилацетатом в качестве элюента. Получают смесь диастереомеров.
Выход 96 мг (40%).
1H-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,3 (д., 3H); 1,4 (д., 3H); 2,0 (с., 3H+3H); 3,6 (с., 3H); 3,6 (с., 3H); 5.0 (м., 1Н+1Н); 5,4 (м., 1Н+1Н); 7,6-7,9 (м., 8Н+8Н); 8,4 (м., 1Н+1Н) м.д.
Пример 7
4-{6-Метил-5-(4-морфолинилкарбонил)-2-оксо-1-[3-(трифторметил)фенил]-1,2,3,4-тетрагидро-4-пиримидинил}бензонитрил
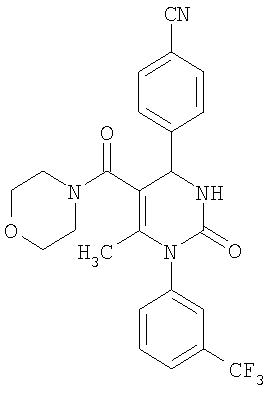
В 3 мл тетрагидрофурана суспендируют 150 мг (0,73 ммоля) N-[3-(трифторметил)фенил]мочевины, 96 мг (0,73 ммоля) 4-цианобензальдегида, 63 мг (0,37 ммоля) 4-(4-морфолинил)-4-кето-2-бутанона и 220 мг этилового эфира полифосфорной кислоты. Смесь 18 часов кипятят с обратным холодильником при перемешивании. После охлаждения до комнатной температуры удаляют растворитель в вакууме и очищают остаток хроматографированием на колонке на кремнеземе с дихлорметаном и метанолом в качестве элюента.
Выход 28 мг (16%).
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=1,5 (с., 3H); 3,1 (м., 4Н); 3,6 (м., 4Н); 5,3 (ш.с., 1H); 7,6 (м., 2Н); 7,7 (м., 1Н); 7,8 (м., 2Н); 7,9 (м., 2Н); 8,0 (ш.с., 1Н) м.д.
Пример 8
N,N-Диэтил-6-метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоксамид
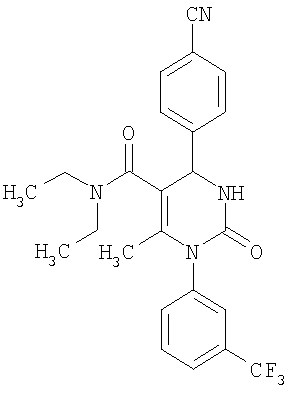
В 3 мл тетрагидрофурана суспендируют 200 мг (0,98 ммоля) N-[3-(трифторметил)фенил]мочевины, 128 мг (0,98 ммоля) 4-цианобензальдегида, 77 мг (0,49 ммоля) 4-(4-ди-этиламино)-4-кето-2-бутанона и 295 мг этилового эфира полифосфорной кислоты. Смесь 18 часов кипятят с обратным холодильником при перемешивании. После охлаждения до комнатной температуры удаляют растворитель в вакууме и очищают остаток хроматографированием на колонке на кремнеземе с дихлорметаном и метанолом в качестве элюента.
Выход 106 мг (47%).
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=0,9 (м., 6Н); 3,1 (м., 4Н); 5,2 (ш.с., 1H); 7,6 (м., 2Н); 7,7 (м., 1Н); 7,8 (м., 2Н); 7,9 (м., 2Н); 8,0 (ш.с., 1Н) м.д.
Пример 9
6-Амино-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбонитрил
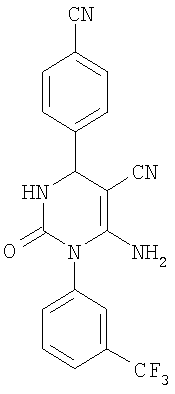
В 2 мл тетрагидрофурана суспендируют 400 мг (1,97 ммоля) N-[3-(трифторметил)фенил]мочевины, 199 мг (1,51 ммоля) 4-цианобензальдегида и 100 мг (1,51 ммоля) малононитрила и прибавляют каталитическое количество концентрированной хлористоводородной кислоты. Смесь 18 часов кипятят с обратным холодильником при перемешивании. После охлаждения до комнатной температуры удаляют растворитель в вакууме и очищают остаток хроматографированием на колонке на кремнеземе с дихлорметаном и метанолом в качестве элюента.
Выход 4 мг (1%).
1Н-ЯМР (400 МГц, d6-диметилсульфоксид): δ=5,2 (д., 1H); 6,0 (с., 2Н); 7,6 (м., 3H); 7,7 (м., 2Н); 7,8 (м., 1Н); 7,9 (м., 2Н); 8,4 (д., 1Н) м.д.
Пример 10
Этиловый эфир 6-метил-2-оксо-1-[3-(трифторметил)-фенил]-3-формил-4-(4-циано-фенил)-1,2,3,4-тетр агидро-5-пиримидинкарбоновой кислоты
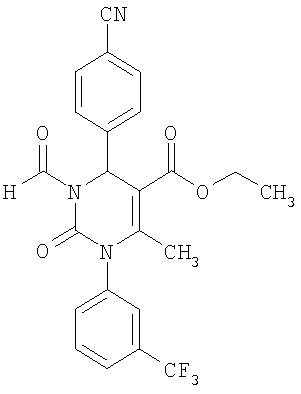
В 1 мл диметилформамида растворяют 100 мг (0,23 ммоля) соединения по примеру 1 и прибавляют 35,7 мг (0,23 ммоля) фосфорилхлорида. Реакционную смесь 2 часа перемешивают при 70°С. После охлаждения до комнатной температуры продукт выделяют с помощью препаративной ВЭЖХ.
Выход 43 мг (41%).
1Н-ЯМР (300 МГц, d6-диметилсульфоксид): δ=1,1 (т., 3H); 2,1 (с, 3H); 4,1 (кв., 2Н); 6,4 (с., 1Н); 7,6 (м., 2Н); 7,7 (м., 1Н); 7,8 (м, 1Н); 7,9 (м., 4Н); 9,2 (с., 1Н) м.д.
Пример 11
6-Метил-2-оксо-1-[3-(трифторметил)-фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновая кислота
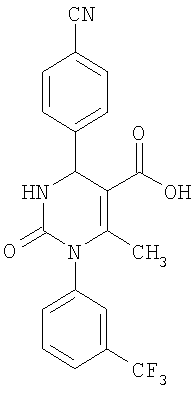
В смеси 50 мл воды и 100 мл 5%-ного гидроксида калия в этаноле растворяют 3 г (7 ммолей) соединения по примеру 1. Реакционную смесь 18 часов перемешивают при комнатной температуре. Растворитель удаляют в вакууме и очищают остаток хроматографированием на колонке на кремнеземе с дихлорметаном и метанолом в качестве элюента.
Выход 1,27 г (45%).
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=2,0 (с., 3H); 5,4 (д., 1Н); 7,6 (м., 1Н); 7,6 (м., 2Н); 7,7 (м., 1Н); 7,8 (м., 1Н); 7,9 (м., 3H); 8,3 (д., 1Н); 12,5 (с., 1Н) м.д.
Пример 12
6-Метил-2-оксо-N-пропил-1-[3-(трифторметил)-фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоксамид
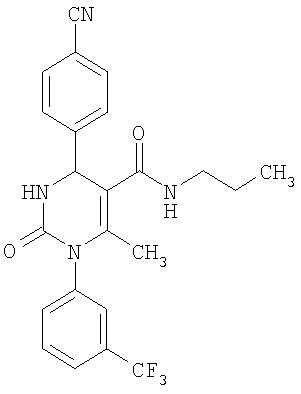
В 2 мл диметилформамида растворяют 40 мг (0,1 ммоля) соединения по примеру 11, прибавляют 7 мг (0,11 ммоля) н-пропиламина, 15 мг (0,11 ммоля) гидрата 1-гидрокси-1H-бензтриазола и 12 мг (0,1 ммоля) 4-диметиламинопиридина. Реакционную смесь перемешивают при 0°С и прибавляют 21 мг (0,11 ммоля) гидрохлорида 1-(3-диметил-аминопропил)-3-этилкарбодиимида. Реакционную смесь 18 часов перемешивают при комнатной температуре, затем прибавляют воду и этилацетат. Органическую фазу промывают насыщенным водным бисульфатом калия, водой и раствором хлорида натрия, сушат над сульфатом натрия и упаривают в вакууме досуха. Если необходимо, то продукт дополнительно очищают с помощью колоночной хроматографии или препаративной ВЭЖХ.
Выход 29 мг (66%).
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=0,7 (т., 3H); 1,3 (секст., 2Н); 1,7 (с., 3H); 3,0 (кв., 2Н); 5,4 (д., 1Н); 7,6 (м., 3H); 7,7 (м., 2Н); 7,8 (м., 2Н); 7.9 (м., 1Н); 8,1 (д., 1Н) м.д.
Пример 13
6-Метил-N-(2-метоксиэтил)-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоксамид
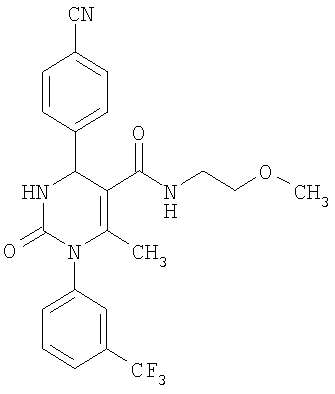
В 2 мл диметилформамида растворяют 48 мг (0,12 ммоля) соединения по примеру 11, прибавляют 10 мг (0,13 ммоля) 2-метоксиэтиламина, 18 мг (0,13 ммоля) гидрата 1-гидрокси-1H-бензтриазола и 15 мг (0,12 ммоля) 4-диметиламинопиридина. Реакционную смесь перемешивают при 0°С и прибавляют 25 мг (0,13 ммоля) гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида. Реакционную смесь 18 часов перемешивают при комнатной температуре, затем прибавляют воду и этилацетат. Органическую фазу промывают насыщенным водным бисульфатом калия, водой и раствором хлорида натрия, сушат над сульфатом натрия и упаривают в вакууме досуха. Если необходимо, то продукт дополнительно очищают с помощью колоночной хроматографии или препаративной ВЭЖХ.
Выход 22 мг (40%).
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=1,7 (с., 3H); 3,2 (с., 3H); 3,3 (м., 4Н); 5,4 (д., 1Н); 7,6 (м., 3H); 7,7 (м., 3H); 7,9 (м., 2Н); 8,1 (м., 1Н) м.д.
Пример 14
Этиловый эфир 3,6-диметил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
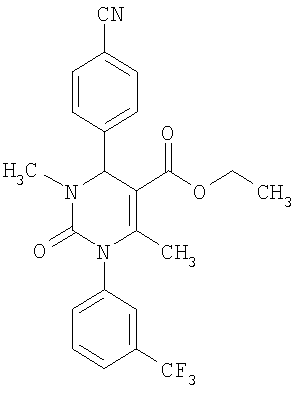
К суспензии 12,4 мг (0,31 ммоля) 60%-ного гидрида натрия (в минеральном масле) в 2 мл тетрагидрофурана прибавляют 89 мг (0,21 ммоля) соединения по примеру 1. Смесь 2 часа перемешивают при комнатной температуре. Затем прибавляют 26 мг (0,21 ммоля) диметилсульфата и перемешивают смесь при комнатной температуре еще 2 часа. После этого прибавляют воду и этилацетат и промывают органическую фазу водой и раствором хлорида натрия, сушат над сульфатом натрия и упаривают в вакууме досуха. Если необходимо, то продукт дополнительно очищают с помощью колоночной хроматографии или препаративной ВЭЖХ.
Выход 85 мг (93%).
1H-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,1 (т., 3H); 2.0 (с., 3H); 2,8 (с., 3H); 4.0 (кв., 2Н); 5,5 (с., 1H); 7,6 (м., 3H); 7,7 (м., 1Н); 7,8 (м., 2Н); 7,9 (м., 2Н) м.д.
Пример 15
Этиловый эфир 3-ацетил-6-метил-2-оксо-1-[3-(трифторметил)-фенил]-4-(4-циано-фенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
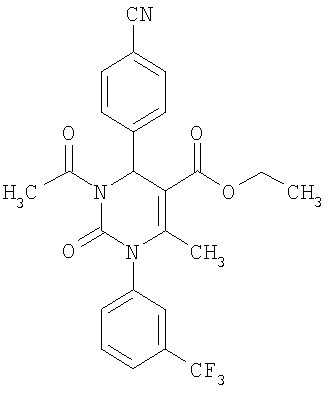
К суспензии 12 мг (0,28 ммоля) 60%-ного гидрида натрия (в минеральном масле) в 2 мл тетрагидрофурана прибавляют 100 мг (0,23 ммоля) соединения по примеру 1. Смесь 2 часа перемешивают при комнатной температуре. Затем прибавляют 91 мг (1,16 ммоля) ацетилхлорида и перемешивают смесь при комнатной температуре еще 2 часа. После этого прибавляют воду и этилацетат и промывают органическую фазу водой и раствором хлорида натрия, сушат над сульфатом натрия и упаривают в вакууме досуха. Если необходимо, то продукт дополнительно очищают с помощью колоночной хроматографии или препаративной ВЭЖХ.
Выход 93 мг (85%).
1H-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,2 (т., 3H); 2,1 (с., 3H); 2,5 (с., 3H); 4,2 (м., 2Н); 6,7 (с., 1Н); 7,4 (м., 1H); 7,5 (м., 2Н); 7,6 (м., 1Н); 7,7 (м., 1Н); 7,8 (м., 1Н); 7,9 (м., 2Н) м.д.
Пример 16
Диэтиловый эфир 4-метил-2-оксо-3-[3-(трифторметил)фенил]-6-(4-цианофенил)-3,6-дигидро-1,5(2Н)-пиримидиндикарбоновой кислоты
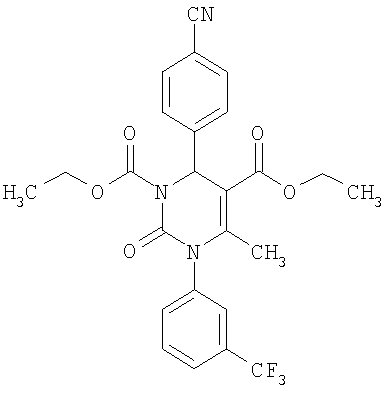
К суспензии 12 мг (0,28 ммоля) 60%-ного гидрида натрия (в минеральном масле) в 2 мл тетрагидрофурана прибавляют 100 мг (0,23 ммоля) соединения по примеру 1. Смесь 2 часа перемешивают при комнатной температуре. Затем прибавляют 126 мг (1,16 ммоля) этилхлоркарбоната и перемешивают смесь при комнатной температуре еще 2 часа. После этого прибавляют воду и этилацетат и промывают органическую фазу водой и раствором хлорида натрия, сушат над сульфатом натрия и упаривают в вакууме досуха. Если необходимо, то продукт дополнительно очищают с помощью колоночной хроматографии или препаративной ВЭЖХ.
Выход 92 мг (79%).
1H-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,2 (т., 3H; т., 3H); 2,1 (с., 3H); 4,2 (м., 2Н); 4,3 (кв., 2Н); 6,4 (с., 1Н); 7,4 (м., 1Н); 7,5 (м., 3H); 7,7 (м., 1Н); 7,8 (м., 1H); 7,9 (м., 2Н) м.д.
Пример 17
Этиловый эфир 6-метил-1-[3-(метил)фенил]-2-оксо-4-(4-цианофенил)-1,2,3,4-тетра-гидро-5-пиримидинкарбоновой кислоты
В 2 мл тетрагидрофурана суспендируют 150 мг (1,0 ммоль) N-(3-метилфенил)-мочевины, 101 мг (0,77 ммоля) 4-цианобензальдегида и 100 мг (0,77 ммоля) этилового эфира 3-кетобутановой кислоты и прибавляют каталитическое количество концентрированной хлористоводородной кислоты. Смесь 18 часов кипятят с обратным холодильником при перемешивании. После охлаждения до комнатной температуры удаляют растворитель в вакууме и очищают остаток хроматографированием на колонке на кремнеземе с циклогексаном и этилацетатом в качестве элюента.
Выход 8 мг (3%).
1Н-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,1 (т., 3H); 2,0 (с., 3H); 2,3 (с., 3H); 4,0 (кв., 2Н); 5,3 (д., 1Н); 7,0 (м., 2Н); 7,2 (м., 1Н); 7,3 (м., 1Н); 7,6 (м., 2Н); 7,9 (м., 2Н); 8,2 (д., 1Н) м.д.
Пример 18
Этиловый эфир 6-метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-хлорфенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
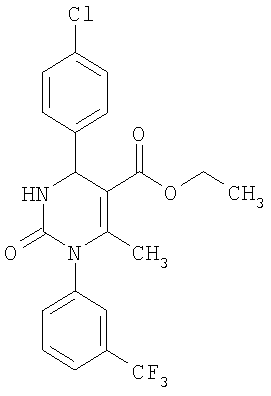
В 2 мл тетрагидрофурана суспендируют 204 мг (1,0 ммоль) N-[3-(трифторметил)-фенил]мочевины, 108 мг (0,77 ммоля) 4-хлорбензальдегида и 100 мг (0,77 ммоля) этилового эфира 3-кетобутановой кислоты и прибавляют каталитическое количество концентрированной хлористоводородной кислоты. Смесь 18 часов кипятят с обратным холодильником при перемешивании. После охлаждения до комнатной температуры удаляют растворитель в вакууме и очищают остаток хроматографированием на колонке на кремнеземе с циклогексаном и этилацетатом в качестве элюента.
Выход 29 мг (9%).
1H-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,1 (т., 3H); 2,0 (с., 3H); 4,0 (кв., 2Н); 5,3 (д., 1Н); 7,5 (м., 5Н); 7,6 (м., 1Н); 7.7 (м., 2Н); 8,3 (д., 1Н) м.д.
Пример 19
Этиловый эфир 6-бромметил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
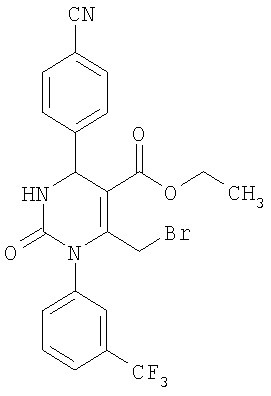
В 100 мл хлороформа растворяют 3 г (7 ммолей) соединения по примеру 1. При 0°С прибавляют по каплям 558 мг (3,48 ммоля) брома. Смесь два часа перемешивают при комнатной температуре, затем удаляют растворитель в вакууме. Остаток очищают хроматографированием на колонке на кремнеземе с циклогексаном и этилацетатом в качестве элюента.
Выход 3,2 г (90%).
1H-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,1 (т., 3H); 4,0 (кв., 2Н, д., 1Н); 4,6 (ш.д., 1Н); 5,4 (д., 1Н); 7,6 (м., 3H); 7,7 (м., 2Н); 7,8 (м., 1Н); 7,9 (м., 2Н); 8,6 (д., 1Н) м.д.
Пример 20
Этиловый эфир 6-[(диэтиламино)метил]-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
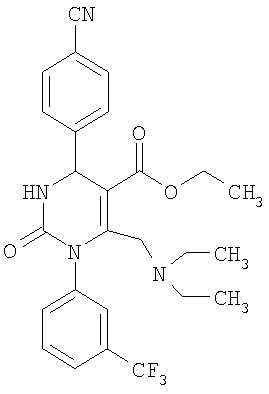
В 2 мл ацетона растворяют 20 мг (0,04 ммоля) соединения по примеру 19 и прибавляют 8 мг (0,10 ммоля) диэтиламина. Смесь 18 часов перемешивают при комнатной температуре, затем удаляют растворитель в вакууме. Остаток очищают с помощью препаративной ВЭЖХ.
Выход 15 мг (75%).
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=0,6 (т., 6Н); 1,1 (т., 3H); 2,0 (м., 2Н); 2,2 (м., 2Н); 3,1 (ш.д., 1Н); 3,9 (ш.д., 1Н); 4,1 (кв., 2Н); 5,4 (д., 1H); 7,5 (м., 1Н); 7,6 (м., 4Н); 7,7 (м., 1Н); 7,9 (м., 2Н) м.д.
Пример 21
Этиловый эфир 6-(анилино)метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
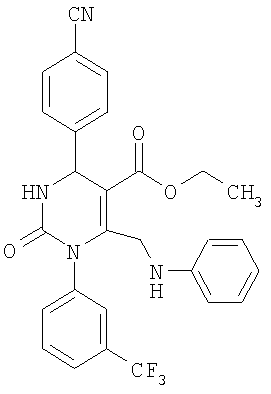
В 2 мл ацетона растворяют 50 мг (0,1 ммоля) соединения по примеру 19 и прибавляют 18 мг (0,20 ммоля) анилина. Смесь 18 часов перемешивают при комнатной температуре, затем удаляют растворитель в вакууме. Остаток очищают с помощью препаративной ВЭЖХ.
Выход 28 мг (55%).
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=1,1 (т., 3H); 3,6 (д.д., 1Н); 4,1 (кв., 2Н); 4,4 (д.д., 1Н); 5,4 (м., 2Н); 6,2 (м., 2Н); 6,5 (м., 1Н); 6,9 (м., 2Н); 7,6 (м., 6Н); 7,9 (м., 2Н); 8,4 (д., 1Н) м.д.
Пример 22
(+)-Этиловый эфир 6-метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
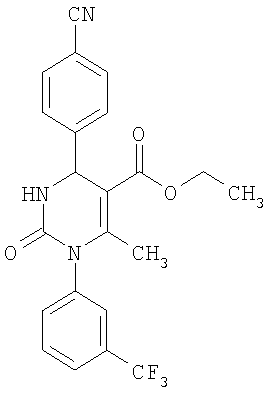
Энантиомеры соединения по примеру 1 разделяют с помощью препаративной ВЭЖХ на хиральной фазе: 100 мг соединения растворяют в 1,5 мл этилацетата, колонка KBD 8361 (хиральный силикагелевый селектор на основе мономера N-метакрилоил-L-лейцин-1-ментиламида, см. заявку на европейский патент № А-379917) 250 мм ×20 мм, этилацетат в качестве элюента, скорость потока 25 мл/мин, температура 23°С, вводимый объем 2500 мкл, детектор 254 нм.
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=1,1 (т., 3H); 2,0 (с., 3H); 4,0 (кв., 2Н); 5,4 (д., 1Н); 7,6 (м., 3H); 7,7 (м., 2Н); 7,8 (м., 1Н); 7,9 (м., 2Н); 8,4 (д., 1Н) м.д.
[α]20=+3,3° (λ=589 нм, дихлорметан, с=535,0 мг на 100 мл).
Пример 23
(-)-Этиловый эфир 3,6-диметил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
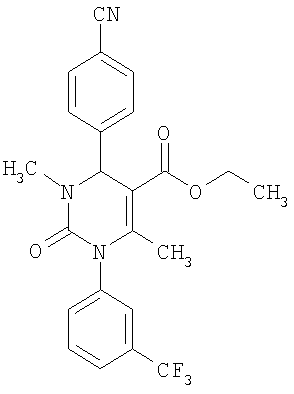
К суспензии 14 мг (0,35 ммоля) 60%-ного гидрида натрия (в минеральном масле) в 2 мл тетрагидрофурана прибавляют 100 мг (0,23 ммоля) соединения по примеру 22. Смесь 2 часа перемешивают при комнатной температуре. Затем прибавляют 29 мг (0,23 ммоля) диметилсульфата и перемешивают смесь при комнатной температуре еще 2 часа. После этого прибавляют воду и этилацетат и промывают органическую фазу водой и раствором хлорида натрия, сушат над сульфатом натрия и упаривают в вакууме досуха. Продукт очищают хроматографированием на колонке на силикагеле с циклогексаном и этилацетатом в качестве элюента.
Выход 76 мг (74%).
1H-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,1 (т., 3H); 2,0 (с., 3H); 2.8 (с., 3H); 4,0 (кв., 2Н); 5,5 (с., 1Н); 7,6 (м., 3H); 7,7 (м., 1Н); 7,8 (м., 2Н); 7,9 (м., 2Н) м.д.
[α]20=-18,1° (λ=589 нм, дихлорметан, с=530,0 мг на 100 мл).
Пример 24
Этиловый эфир 6-метил-2-оксо-1-[3-(трифторметил)фенил]-4-(6-циано-3-пиридинил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
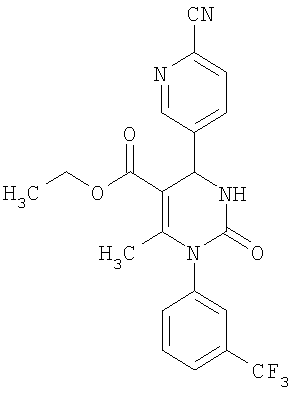
К раствору соединения по примеру 3А (76 мг, 0,58 ммоля) в тетрагидрофуране (5 мл) при перемешивании прибавляют этиловый эфир 3-кетобутановой кислоты (75 мг, 0,58 ммоля), N-[3-(трифторметил)фенил]мочевину (118 мг, 0,58 ммоля) и этиловый эфир полифосфорной кислоты (200 мг, свежеприготовленный по методике Cava и др., J. Org. Chem. 1969, 34, 2665). Реакционную смесь два дня (48 часов) кипятят с обратным холодильником, после чего раствор разбавляют диметилсульфоксидом (2 мл) и очищают с помощью препаративной ВЭЖХ. Фракции с продуктом концентрируют в вакууме и снова хроматографируют на кремнеземе с циклогексаном и этилацетатом в качестве элюента.
Выход 92 мг (35% от теории).
Масс-спектр (ионизация электрораспылением, положительные ионы): m/z=431 (М+Н)+.
ВЭЖХ (способ 4) = 4,63 минуты.
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=8,76 (с., 1Н), 8,36 (д., 1Н), 8,16-8,00 (м., 2Н), 7,83-7,74 (м., 2Н), 7,75-7,58 (м., 2Н), 5,47 (д., 1Н), 4,03 (кв., 2Н), 2,06 (с., 3H), 1,08 (т., 3H) м.д.
Пример 25
4-{5-(1Н-Имидазол-1-илкарбонил)-6-метил-2-оксо-1-[3-(трифторметил)фенил]-1,2,3,4-тетрагидро-4-пиримидинил}бензонитрил
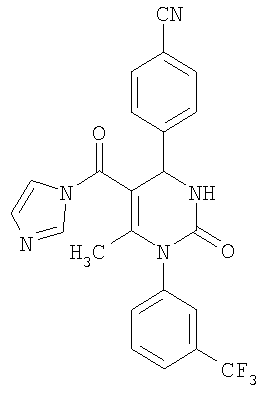
К раствору 501 мг (1,25 ммоля) соединения по примеру 11 в 5 мл сухого диметилформамида прибавляют 567 мг (3,5 ммоля) N,N-карбонилдиимидазола. Реакционную смесь оставляют на ночь, после чего отгоняют в вакууме растворитель. Остаток растворяют в этилацетате и промывают водой и раствором хлорида натрия. Затем сушат сульфатом магния и отгоняют растворитель в вакууме. Выход 500 мг (88,6% от теории).
Масс-спектр (ионизация электронным ударом): m/z=452 (М+Н)+.
1H-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,40 (д., 3H), 5,5 (д., 1Н), 7,0 (с., 1H), 7,55-8,0 (м., 9Н), 8,4 (с., 1Н), 8,45 (д., 1Н) м.д.
Пример 26
2-Гидроксиэтиловый эфир 6-метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
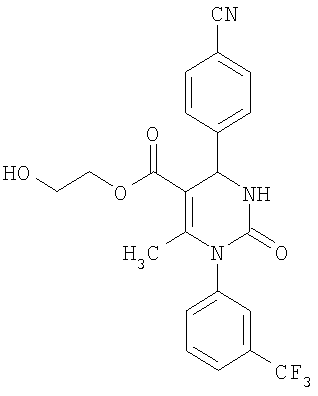
К 0,5 мл этиленгликоля прибавляют 45,1 мг (0,1 ммоля) соединения по примеру 25. Реакционную смесь 1 час перемешивают при температуре около 100°С. После охлаждения реакционную смесь очищают с помощью препаративной ВЭЖХ (колонка Agilent Zorbax Extend C18 20 мм ×50 мм, 5 мкм; растворитель А: ацетонитрил, растворитель Б:
вода+0,1% концентрированного аммиака; градиент: 0 минут 10% А, 2 минуты 10% А, 6 минут 90% А, 7 минут 90% А, 7,1 минуты 10% А, 8 минут 10% А; длина волны 220 нм; вводимый объем около 500 мкл, число вводов: 1). Фракции, содержащие продукт, объединяют и концентрируют в вакууме.
Выход 22 мг (49,4% от теории).
Масс-спектр (ионизация электронным ударом): m/z=446 (М+Н)+.
1H-ЯМР (300 МГц, d6-диметилсульфоксид): S=2,05 (д., 3H), 3,5 (кв., 2Н), 3,95-4,15 (м., 2Н), 4,75 (т., 1Н), 5,45 (д., 1H), 7,55-7,75 (м., 5Н), 7,75 (д., 1H), 7,85 (д., 2Н), 8,35 (д., 1Н) м.д.
Пример 27
2-(Диметиламино)этиловый эфир 6-метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
К 0,5 мл 2-(диметиламино)этанола прибавляют 45,1 мг (0,1 ммоля) соединения по примеру 25. Реакционную смесь 1 час перемешивают при температуре около 100°С. После охлаждения реакционную смесь очищают с помощью препаративной ВЭЖХ (колонка Agilent Zorbax Extend С 18 20 мм ×50 мм, 5 мкм; растворитель А: ацетонитрил, растворитель Б: вода +0,1% концентрированного аммиака; градиент: 0 минут 10% А, 2 минуты 10% А, 6 минут 90% А, 7 минут 90% А, 7,1 минуты 10% А, 8 минут 10% А; длина волны 220 нм; вводимый объем около 500 мкл, число вводов: 1). Фракции, содержащие продукт, объединяют и концентрируют в вакууме.
Выход 24 мг (50,8% от теории).
Масс-спектр (ионизация электронным ударом): m/z=473 (М+Н)+.
1Н-ЯМР (300 МГц, d6-диметилсульфоксид): δ=2,05 (д., 3H), 2,1 (с., 6Н), 2,4 (м., 2Н), 4,1 (м., 2Н), 5,35 (д., 1Н), 7,55 (д., 1Н), 7,6 (д., 2Н), 7,7 (м., 2Н), 7,8 (д., 1Н), 7,85 (д., 2Н), 8,35 (д., 1Н) м.д.
Пример 28
2-(4-Пиридинил)этиловый эфир 6-метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
К 0,5 мл 2-(4-пиридинил)этанола прибавляют 45,1 мг (0,1 ммоля) соединения по примеру 25. Реакционную смесь 1 час перемешивают при температуре около 100°С. После охлаждения реакционную смесь очищают с помощью препаративной ВЭЖХ (колонка Agilent Zorbax Extend С 18 20 мм ×50 мм, 5 мкм; растворитель А: ацетонитрил, растворитель Б: вода +0,1% концентрированного аммиака; градиент: 0 минут 10% А, 2 минуты 10% А, 6 минут 90% А, 7 минут 90% А, 7,1 минуты 10% А, 8 минут 10% А; длина волны 220 нм; вводимый объем около 500 мкл, число вводов: 1). Фракции, содержащие продукт, объединяют и концентрируют в вакууме.
Выход 17 мг (33,5% от теории).
Масс-спектр (ионизация электронным ударом): m/z=507 (М+Н)+.
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=2,0 (д., 3H), 2,9 (т., 2Н), 4,3 (т., 2Н), 5,25 (д., 1Н), 7,15 (д., 2Н). 7,45 (д., 2Н), 7,5 (д., 1Н), 7,65 (т., 2Н), 7.8 (м., 3H), 8,35 (д., 1Н). 8,4 (д.,2Н) м.д.
Пример 29
2-(2-Пиридинил)этиловый эфир 6-метил-2-оксо-1-[3-(трифтор-метил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
К 0,5 мл 2-(2-пиридинил)этанола прибавляют 45,1 мг (0,1 ммоля) соединения по примеру 25. Реакционную смесь 1 час перемешивают при температуре около 100°С. После охлаждения реакционную смесь очищают с помощью препаративной ВЭЖХ (колонка Agilent Zorbax Extend С 18 20 мм ×50 мм, 5 мкм; растворитель А: ацетонитрил, растворитель Б: вода +0,1% концентрированного аммиака; градиент: 0 минут 10% А, 2 минуты 10% А, 6 минут 90% А, 7 минут 90% А, 7,1 минуты 10% А, 8 минут 10% А; длина волны 220 нм; вводимый объем около 500 мкл, число вводов: 1). Фракции, содержащие продукт, объединяют и концентрируют в вакууме.
Выход 22 мг (43,4% от теории).
Масс-спектр (ионизация электронным ударом): m/z=507 (М+Н)+.
1Н-ЯМР (300 МГц, d6-диметилсульфоксид): δ=2,0 (д., 3H), 3,0 (т., 2Н), 4,4 (т., 2Н), 5,25 (д., 1Н), 7,15-7,25 (м., 2Н), 7.4 (д., 2Н), 7,5 (д., 1Н), 7,6-7,75 (м., 3H), 7,8 (м., 3H), 8,3 (д., 1H), 8,45 (д., 1Н) м.д.
Пример 30
2-(2-Оксо-1-пирролидинил)этиловый эфир 6-метил-2-оксо-1-[3-(трифторметил)-фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
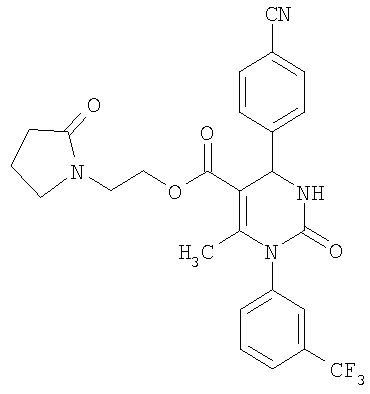
К 0,5 мл 1-(2-гидроксиэтил)-2-пирролидинона прибавляют 45,1 мг (0,1 ммоля) соединения по примеру 25. Реакционную смесь 1 час перемешивают при температуре около 100°С. После охлаждения реакционную смесь очищают с помощью препаративной ВЭЖХ (колонка Agilent Zorbax Extend CIS 20 мм ×50 мм, 5 мкм; растворитель А: ацетонитрил, растворитель Б: вода +0,1% концентрированного аммиака; градиент: 0 минут 10% А, 2 минуты 10% А, 6 минут 90% А, 7 минут 90% А, 7,1 минуты 10% А, 8 минут 10% А; длина волны 220 нм; вводимый объем около 500 мкл, число вводов: 1). Фракции, содержащие продукт, объединяют и концентрируют в вакууме.
Выход 25 мг (48,8% от теории).
Масс-спектр (ионизация электронным ударом): m/z=513 (М+Н)+.
1Н-ЯМР (300 МГц, d6-диметилсульфоксид): δ=1,8 (квин., 2Н), 2,0 (д., 3H), 2,1 (т., 2Н), 3,2 (т., 2Н), 3,4 (т., 2Н), 4,0-4,2 (м., 2Н), 5,35 (д., 1Н), 7.55 (д., 1Н), 7,6 (д., 2Н), 7,7 (т., 2Н), 7,8 (д., 1Н), 7,9 (д., 2Н), 8,4 (д., 1Н) м.д.
Приведенные далее соединения получены по аналогии с методиками примеров 14-16.
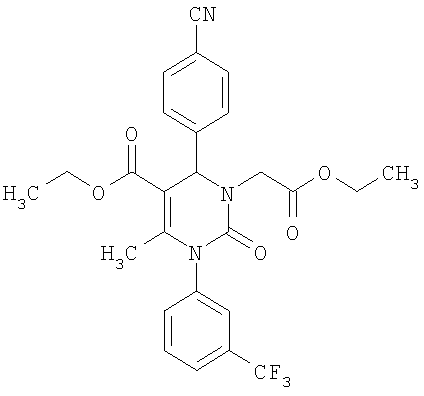
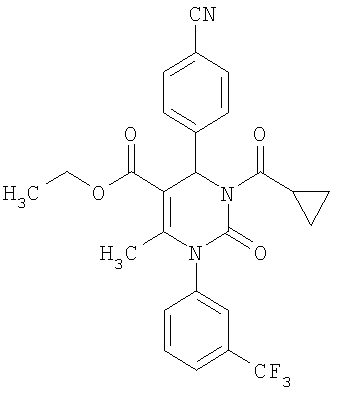
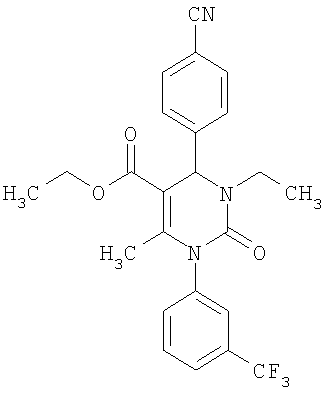
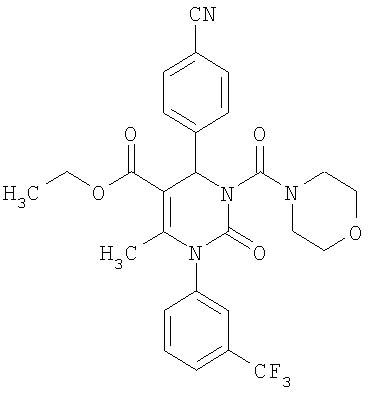
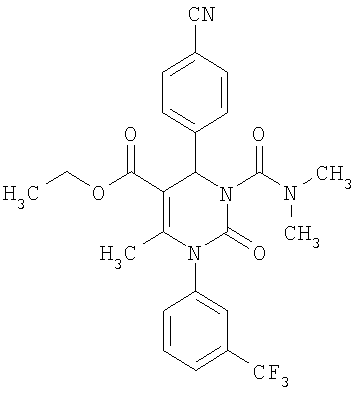
[M+Na]+
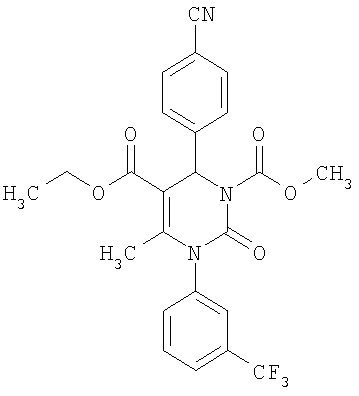
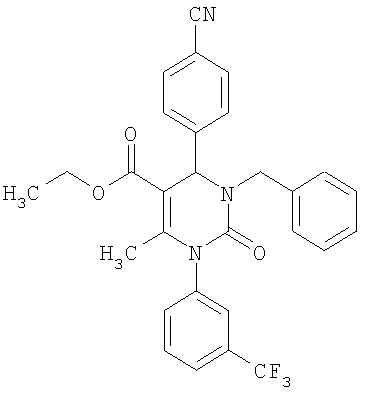
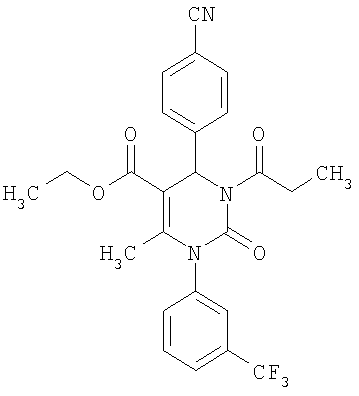
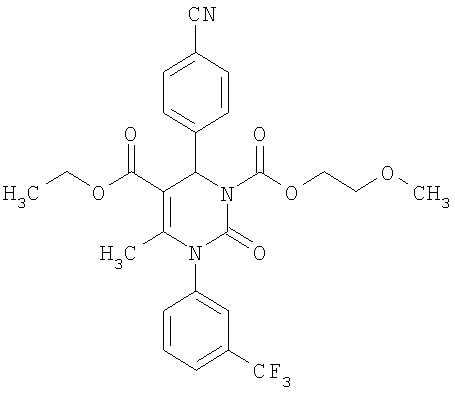
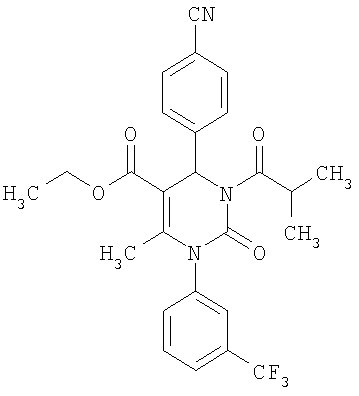
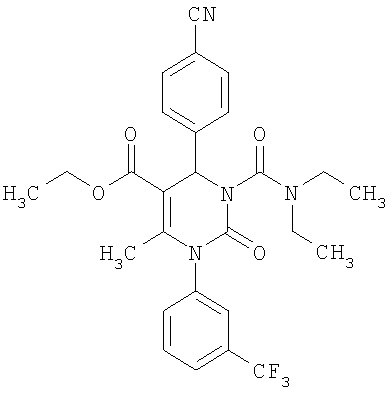
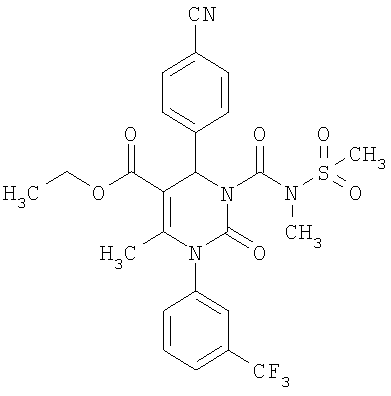
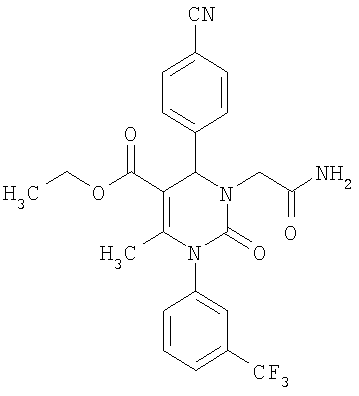
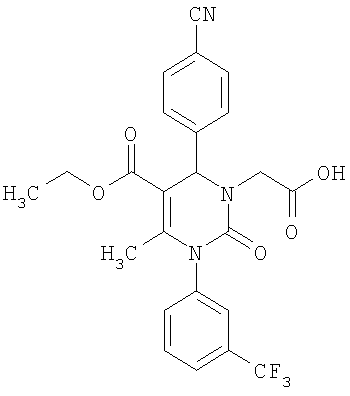
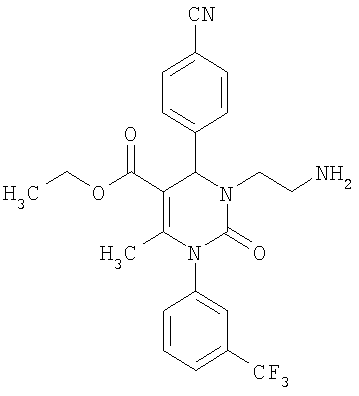
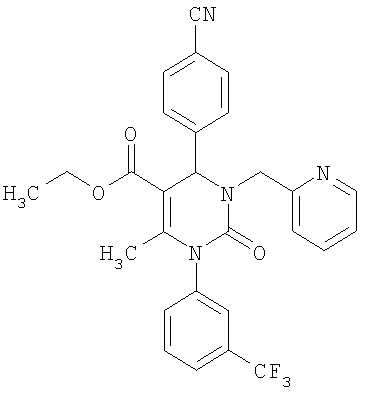
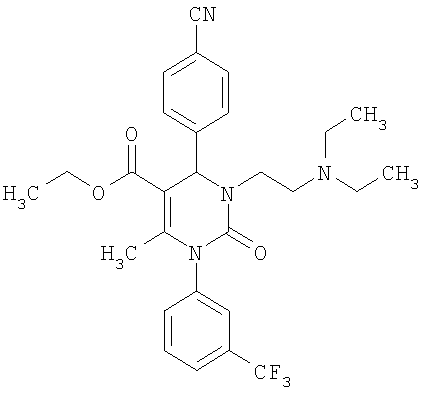
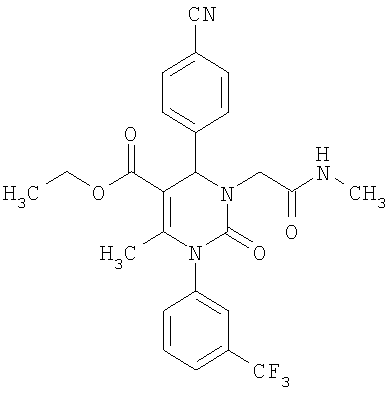
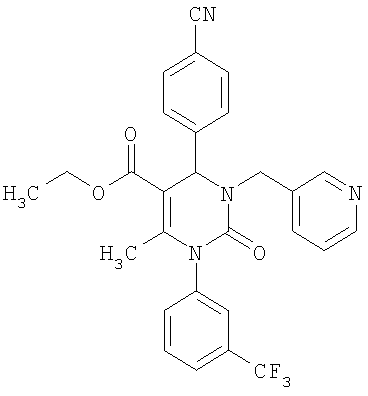
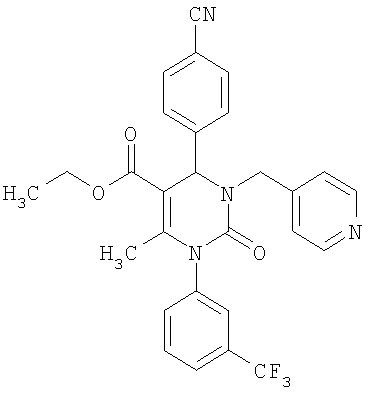
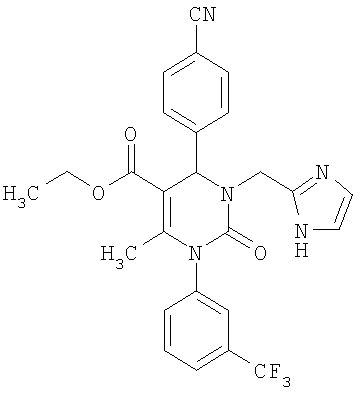
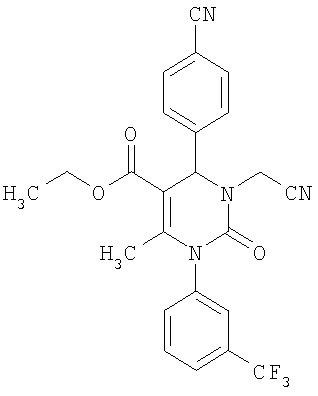
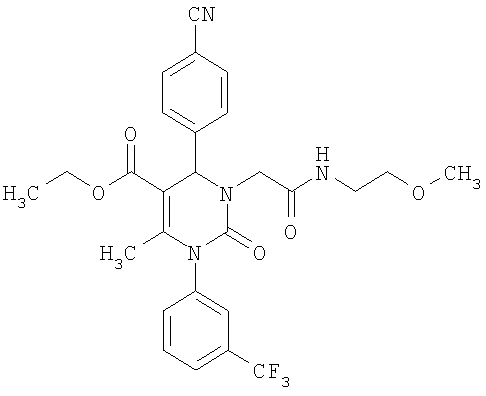
Приведенные далее соединения получены по аналогии с методиками примеров 6-8.
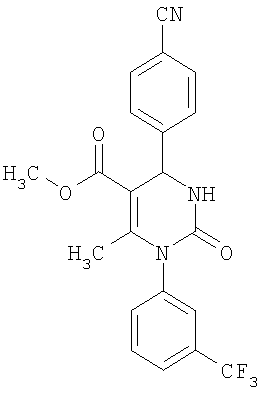
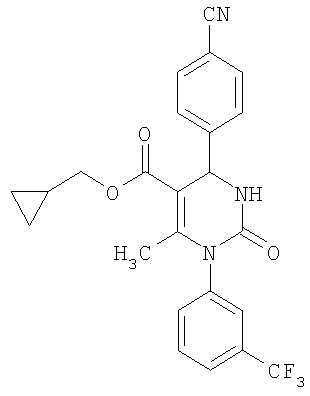
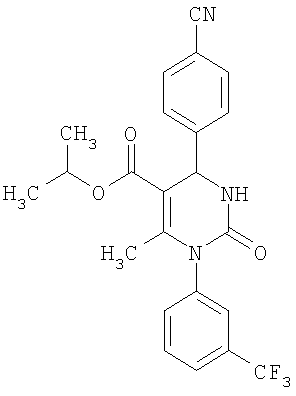
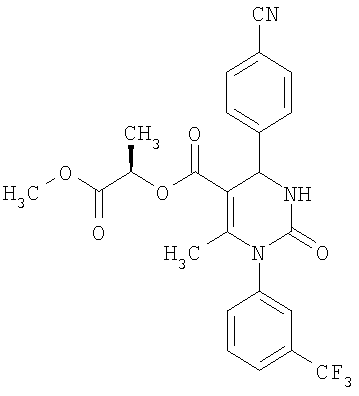
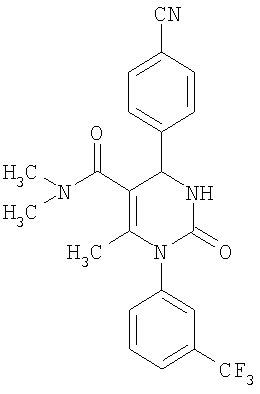
Пример 59
Этиловый эфир 6-метил-3-[2-(4-морфолинил)-2-оксоэтил]-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
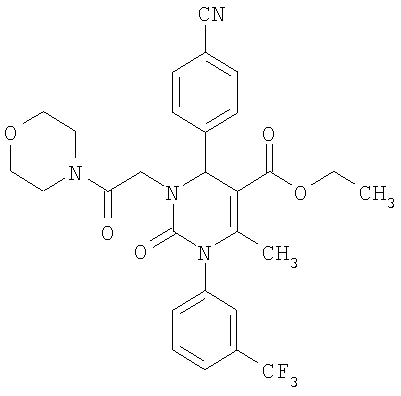
В 2 мл диметилформамида растворяют 80 мг (0,16 ммоля) соединения по примеру 44, прибавляют 16 мг (0,18 ммоля) морфолина, 24 мг (0,18 ммоля) гидрата 1-гидрокси-1H-бензтриазола и 20 мг (0,16 ммоля) 4-диметиламинопиридина. Реакционную смесь перемешивают при 0°С и после этого прибавляют 35 мг (0,18 ммоля) гидрохлорида 1-(3-ди-метиламинопропил)-3-этилкарбодиимида. Реакционную смесь 18 часов перемешивают при комнатной температуре, затем прибавляют воду и этилацетат. Органическую фазу сушат над сульфатом натрия и упаривают в вакууме досуха. Если необходимо, то продукт дополнительно очищают с помощью колоночной хроматографии или препаративной ВЭЖХ.
Выход 78 мг (85%).
1Н-ЯМР (300 МГц, d6-диметилсульфоксид): δ=1,1 (т., 3H); 2,0 (с., 3H); 3,4 (м., 4Н); 3,6 (м., 4Н); 3,7 (д., 1Н); 4,1 (м., 2Н); 4,5 (д., 1H); 5,5 (с., 1H); 7,6 (м., 5Н); 7,8 (м., 1Н); 7,9 (м., 2Н) м.д.
По аналогии с методикой примера 59 получают приведенные далее соединения.
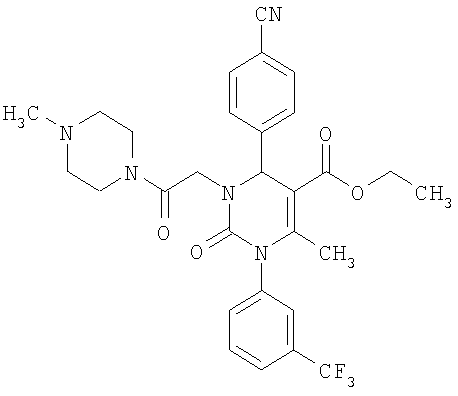
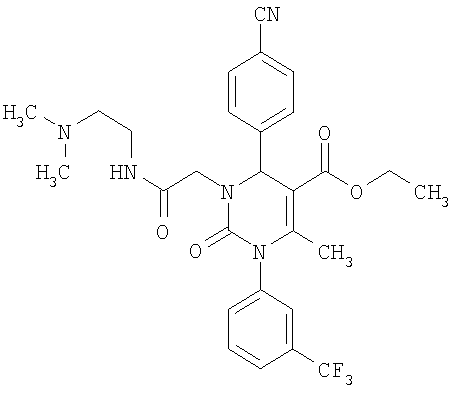
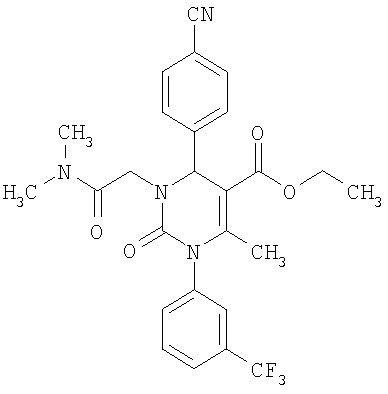
По аналогии с методиками примеров 6-8 получают приведенные далее соединения.
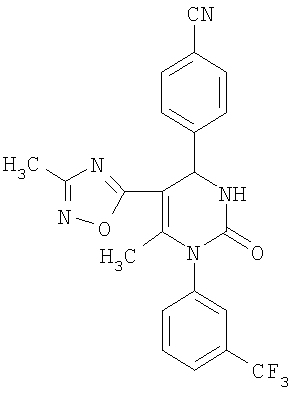
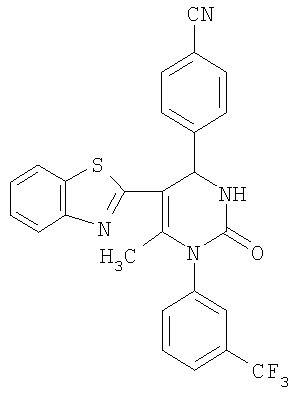
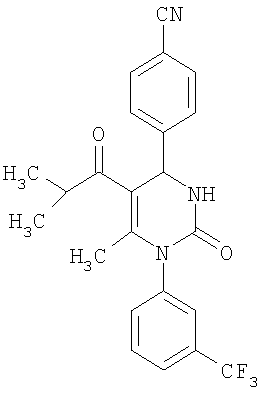
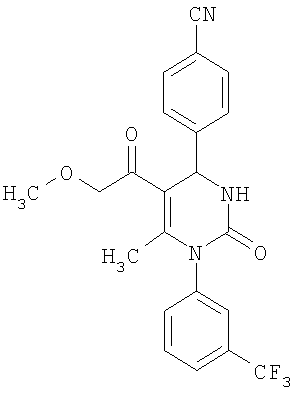
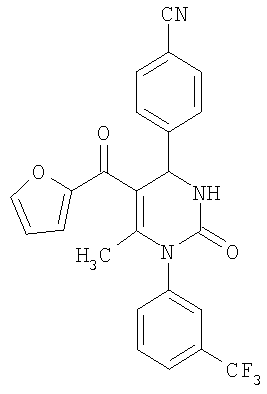
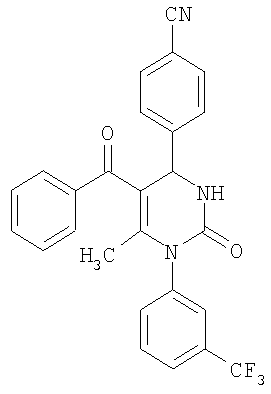
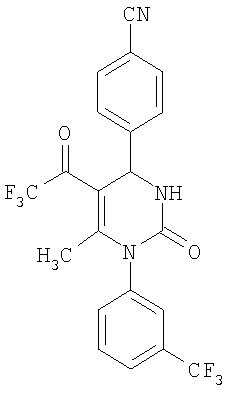
Пример 70
6-Метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоксамид
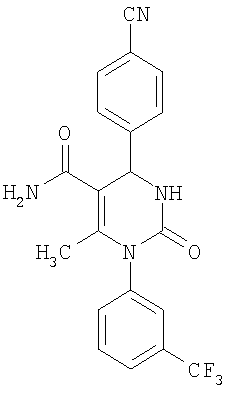
В 5 мл тетрагидрофурана растворяют 200 мг (0,5 ммоля) соединения по примеру 11 и прибавляют 6 мг (0,05 ммоля) 4-N,N-диметиламинопиридина, 77 мг (0,6 ммоля) N,N-диизопропилэтиламина и 115 мг (0,6 ммоля) гексафторфосфата бензтриазол-1-ил-окси-трис(пирролидино)фосфония. Реакционную смесь 15 минут перемешивают при комнатной температуре, затем прибавляют 5 мл раствора аммиака (2,5 ммоля в виде раствора в диоксане с концентрацией 0,5 моль/л). Реакционную смесь 1 час перемешивают при комнатной температуре, затем прибавляют воду и этилацетат. Органическую фазу сушат над сульфатом натрия и упаривают в вакууме досуха. Продукт дополнительно очищают с помощью препаративной ВЭЖХ.
Выход 55 мг (28% от теории).
1H-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,8 (с., 3H); 5,4 (д., 1H); 7,2 (ш.с., 1Н); 7,4 (ш.с., 1Н); 7,6 (м., 5Н); 7,7 (м., 1Н); 7,9 (м., 2Н); 8,1 (д., 1Н) м.д.
Пример 71
(+)-6-Метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновая кислота
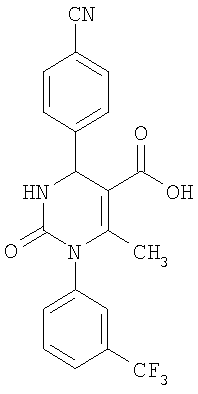
Энантиомеры соединения по примеру 11 разделяют с помощью препаративной ВЭЖХ на хиральной фазе [колонка KBD 8361 (хиральный силикагелевый селектор на основе мономера N-метакрилоил-L-лейцин-1-ментиламида, см. также заявку на европейский патент № А-379917), 250 мм ×20 мм, элюент: этилацетат→метанол→этилацетат, скорость потока 25 мл/мин, температура 23°С, детектор 254 нм].
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=2,0 (с., 3H); 5,4 (д., 1Н); 7,6 (м., 1Н); 7,6 (м., 2Н); 7,7 (м., 1Н); 7,8 (м., 1Н); 7,9 (м., 3H); 8,3 (д., 1Н); 12,5 (с., 1Н) м.д.
[α]20=+2,5° (λ=589 нм, метанол, с=505 мг/100 мл).
Пример 72
(+)-2-Гидроксиэтиловый эфир 6-метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
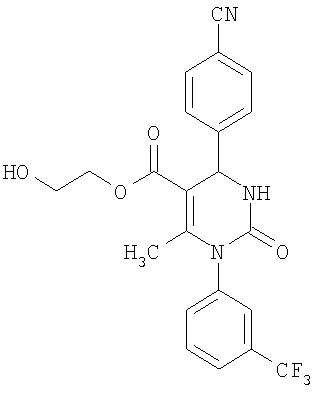
В атмосфере аргона к 19,6 мл диметилформамида прибавляют 1560 мг (3,89 ммоля) соединения по примеру 71. После прибавления 1,095 мл (7,86 ммоля) триэтиламина и 1,11 мл (15,7 ммоля) 2-бромэтанола перемешивают реакционную смесь при температуре около 70°С в течение 8 часов. После охлаждения реакционную смесь концентрируют в вакууме. Остаток растворяют в этилацетате и промывают водой. После сушки сульфатом магния органическую фазу упаривают в вакууме. Остаток растворяют в 8 мл метанола и очищают с помощью препаративной ВЭЖХ (колонка: Nucleosil 100-5 С 18 Nautilus, 20×50 мм, 5 мкм; растворитель А: ацетонитрил, растворитель Б: вода+0,3% муравьиной кислоты; градиент: 0 минут 10% А, 2 минуты 10% А, 6 минут 90% А, 7 минут 90% А, 7,1 минуты 10% А, 8 минут 10% А; длина волны: 220 нм; объем ввода: около 500 мкл; число вводов: 18). Фракции, содержащие продукт, объединяют и лиофилизуют.
Выход 1290 мг (74,5% от теории).
Масс-спектр (ионизация электронным ударом): m/z: 446 (M+H)+.
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=2,05 (д., 3H); 3,5 (кв., 2Н); 3,95-4,15 (м., 2Н); 4,75 (т., 1Н); 5,45 (д., 1Н); 7,55-7,75 (м., 5Н); 7,75 (д., 1Н); 7,85 (д., 2Н); 8,35 (д., 1Н) м.д.
[α]20=+14,3° (λ=589 нм, метанол, с=455 мг/100 мл).
Пример 73
5-{5-Ацетил-6-метил-2-оксо-1-[3-(трифторметил)фенил]-1,2,3,4-тетрагидро-4-пиримидинил}-2-пиридинкарбонитрил
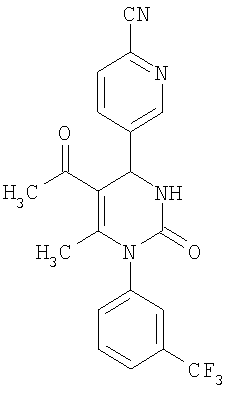
К раствору соединения по примеру 3А (75 мг, 0,57 ммоля) в тетрагидрофуране (5 мл) при перемешивании прибавляют 2,4-пентандион (57 мг, 0,57 ммоля), N-[3-(трифторметил)фенил]мочевину (116 мг, 0,57 ммоля) и этиловый эфир полифосфорной кислоты (200 мг, свежеприготовленный по методике Cava и др., J. Org. Chem. 1969, 34, 2665).
Реакционную смесь 24 часа кипятят с обратным холодильником, по истечении этого времени раствор разбавляют диметилсульфоксидом (2 мл) и очищают с помощью препаративной ВЭЖХ.
Выход 101 мг (44% от теории).
1H-ЯМР (200 МГц, d6-диметилсульфоксид): δ=2,02 (с., 3H); 2,24 (с., 3H); 5,54 (д., 1Н); 7,52-7,90 (м., 4Н); 8,08 (д., 2Н); 8,50 (д., 1Н); 8,81 (с., 1Н) м.д.
Пример 74
(+)-5-{5-Ацетил-6-метил-2-оксо-1-[3-(трифторметил)фенил]-1,2,3,4-тетрагидро-4-пиримидинил}-2-пиридинкарбонитрил
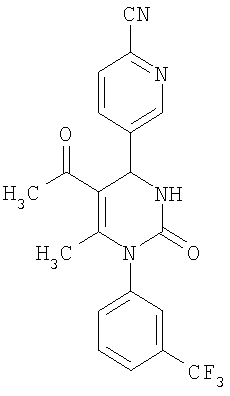
Энантиомеры соединения по примеру 73 разделяют с помощью препаративной ВЭЖХ на хиральной фазе [колонка KBD 8361 (хиральный силикагелевый селектор на основе мономера N-метакрилоил-L-лейцин-1-ментиламида, см. также заявку на европейский патент № А-379917), 250 мм ×20 мм, элюент: этилацетат→метанол→этилацетат, скорость потока 25 мл/мин, температура 23°С, детектор 254 нм].
1Н-ЯМР (300 МГц, дейтерохлороформ): δ=2,06 (с., 3H); 2,35 (с., 3H); 5,69 (д., 1Н); 6,02 (д., 1Н); 7,29-7,50 (м., 2Н); 7,57-7,75 (м., 3H); 7,83 (д.д, 1Н); 8,74 (д., 1Н) м.д.
[α]20=+25,1° (λ=589 нм, метанол, с=505 мг/100 мл).
Пример 75
2-(2-Пиридинил)метиловый эфир 6-метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
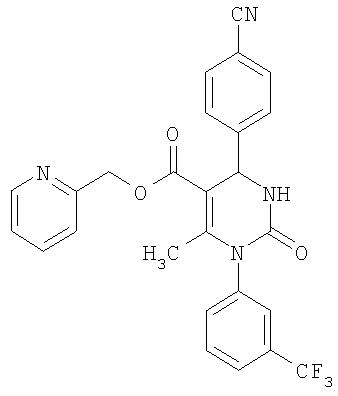
К раствору 40,1 мг (0,1 ммоля) соединения по примеру 11 в 0,4 мл сухого диметилформамида прибавляют 48,6 мг (0,3 ммоля) N,N-карбонилдиимидазола. Реакционную смесь оставляют на один час, после чего разбавляют реакционную смесь водой и экстрагируют дихлорметаном. После сушки сульфатом магния растворитель отгоняют в вакууме. К остатку прибавляют 0,5 мл (2-пиридинил)метанола. Реакционную смесь 1 час перемешивают при температуре около 100°С. После охлаждения реакционную смесь очищают с помощью препаративной ВЭЖХ (колонка: Nucleosil 100-5 С 18 Nautilus 20 мм ×50 мм, 5 мкм; растворитель А: ацетонитрил, растворитель Б: вода +0,1% муравьиной кислоты; градиент: 0 минут 10% А, 2 минуты 10% А, 6 минут 90% А, 7 минут 90% А, 7,1 минуты 10% А, 8 минут 10% А; скорость потока 25 мл/мин; длина волны: 220 нм; вводимый объем: около 550 мкл; число вводов: 1). Фракции, содержащие продукт, объединяют и упаривают в вакууме.
Выход 17 мг (34,5% от теории).
Масс-спектр (ионизация электронным ударом): m/z=493 (М+Н)+.
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=2,1 (д., 3H); 5,15 (д.д, 2Н); 5,45 (д., 1H); 7,05 (д., 1Н); 7,3 (д.д., 1Н); 7,5-7,85 (м., 9Н); 8,35 (д., 1Н); 8,5 (д., 2Н) м.д.
Пример 76
2-(3-Пиридинил)этиловый эфир 6-метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
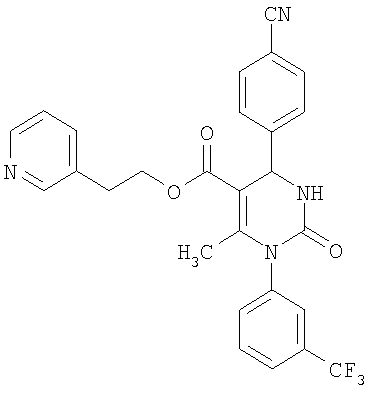
К раствору 60,2 мг (0,15 ммоля) соединения по примеру 11 в 0,57 мл сухого диметилформамида прибавляют 72,9 мг (0,45 ммоля) N,N-карбонилдиимидазола. Реакционную смесь оставляют на один час, после чего разбавляют реакционную смесь водой и экстрагируют этилацетатом. После сушки сульфатом магния растворитель отгоняют в вакууме. К остатку прибавляют 185 мг (1,5 ммоля) 2-(3-пиридинил)этанола и 20 мкл (0,27 ммоля) триэтиламина. Реакционную смесь 1 час перемешивают при 100°С. После этого реакционную смесь разбавляют добавлением 0,4 мл метанола, фильтруют и очищают с помощью препаративной ВЭЖХ (колонка: Nucleosil 100-5 С 18 Nautilus 20 мм ×50 мм, 5 мкм; растворитель А: ацетонитрил, растворитель Б: вода +0,1% муравьиной кислоты; градиент: 0 минут 10% А, 2 минуты 10% А, 6 минут 90% А, 7 минут 90% А, 7,1 минуты 10% А, 8 минут 10% А; скорость потока 25 мл/мин; длина волны: 220 нм; вводимый объем: около 550 мкл; число вводов: 1). Фракции, содержащие продукт, объединяют и упаривают в вакууме.
Выход 44 мг (57,9% от теории).
Жидкостная хроматомасс-спектрометрия (ионизация электронным ударом, способ 5): m/z=507 (М+Н)+, время удерживания 3,19 минуты.
Пример 77
3,6-Диметил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетра-гидро-5-пиримидинкарбоновая кислота
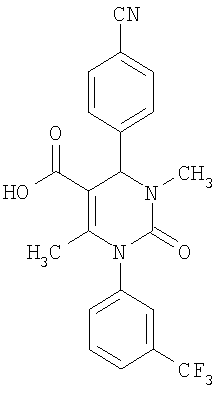
В 100 мл этанола растворяют 4,1 г (9,25 ммоля) соединения по примеру 14. К этому раствору прибавляют 6,2 мл (27,6 ммоля) раствора гидроксида калия в воде (25 мас.%). Реакционную смесь оставляют на 18 часов при комнатной температуре. После этого прибавляют еще 12,4 мл (55,2 ммоля) раствора гидроксида калия в воде (25 мас.%) и перемешивают реакционную смесь 2 часа. Реакционную смесь разбавляют водой и три раза экстрагируют этилацетатом. Водную фазу подкисляют 1 н. соляной кислотой и экстрагируют этилацетатом. Этот последний экстракт сушат над сульфатом магния и упаривают в вакууме. Остаток очищают хроматографированием на колонке на кремнеземе с циклогексаном и этилацетатом в качестве элюента.
Выход 1,5 г (39% от теории).
Масс-спектр (ионизация электронным ударом): m/z=416 (М+Н)+.
1H-ЯМР (300 МГц, d6-диметилсульфоксид): δ=2,0 (с., 3H); 2,8 (с., 3H); 5,5 (д., 1Н); 7,6-7,8 (м., 6Н); 7,9 (д., 2Н); 12,6 (с., 1Н) м.д.
По аналогии с методикой по примеру 76 получают приведенные далее соединения.
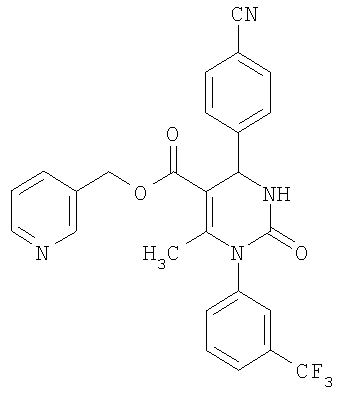
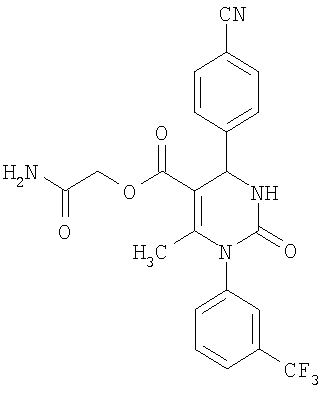
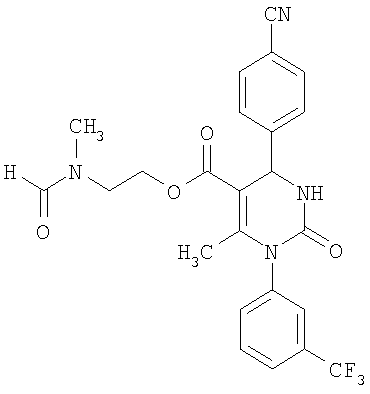
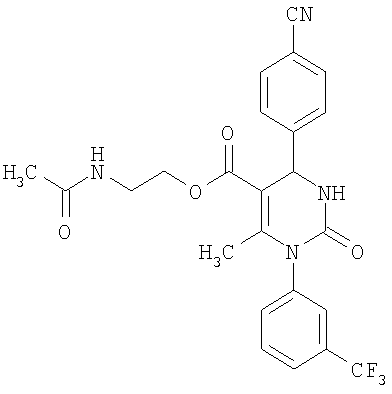
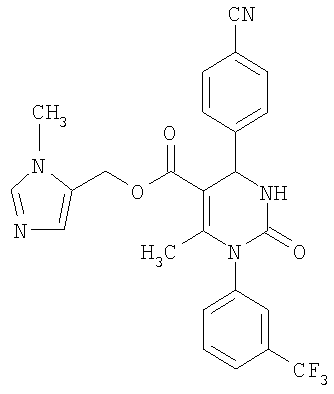
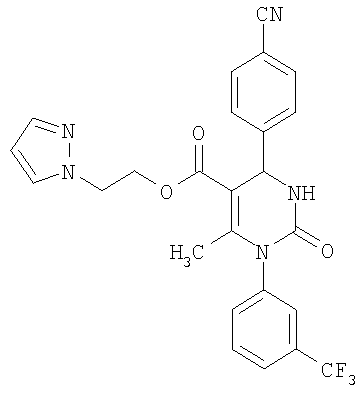
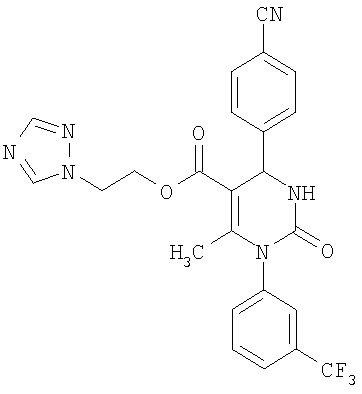
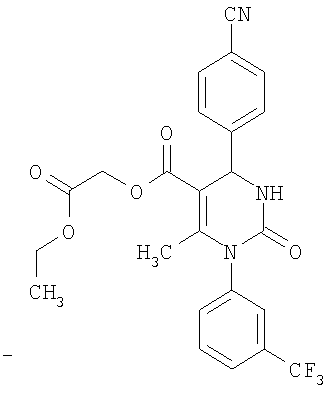
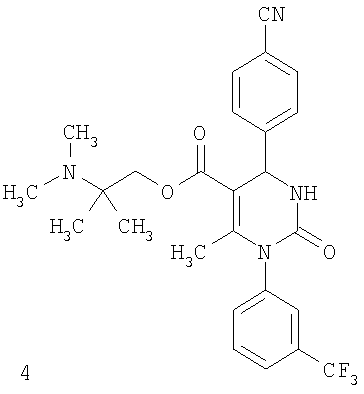
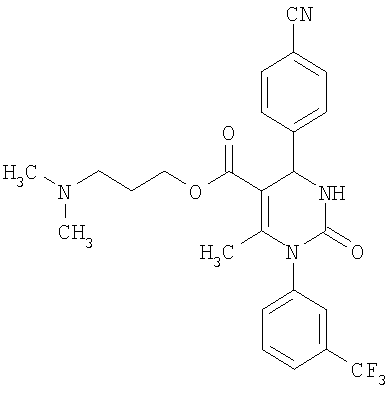
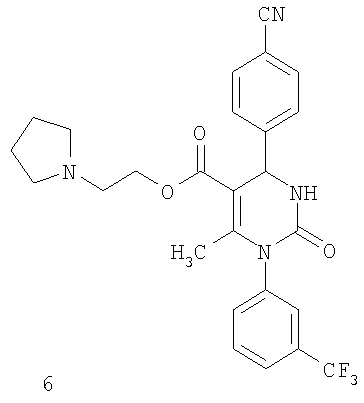
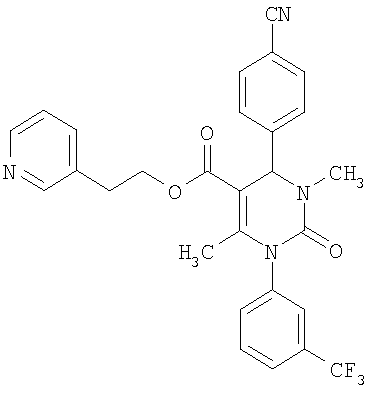
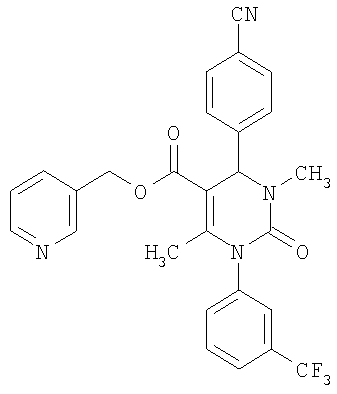
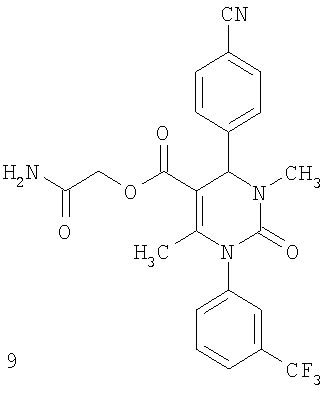
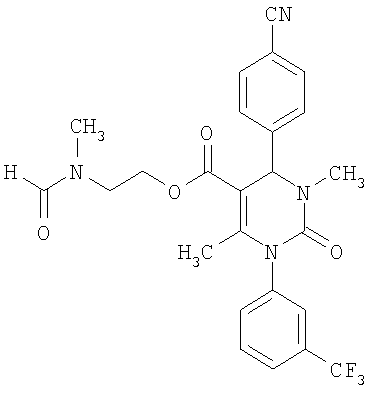
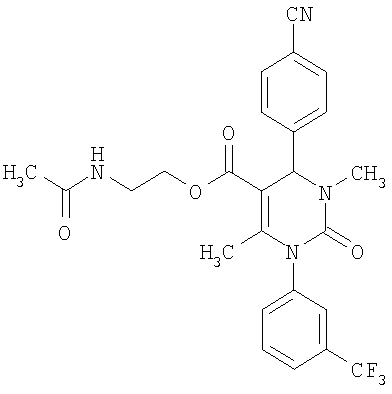
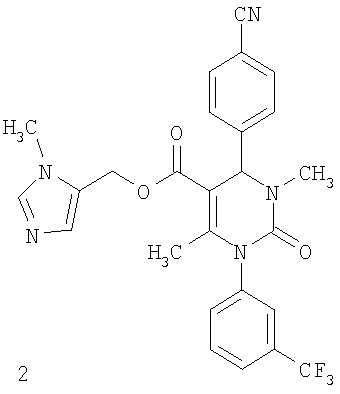
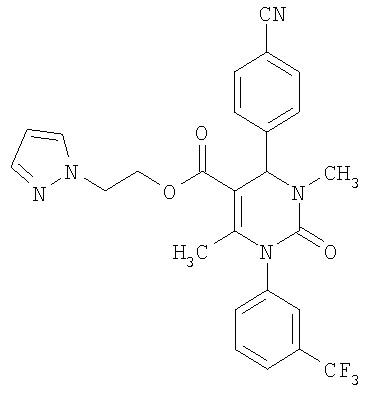
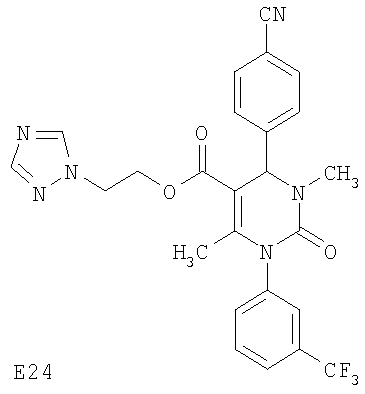
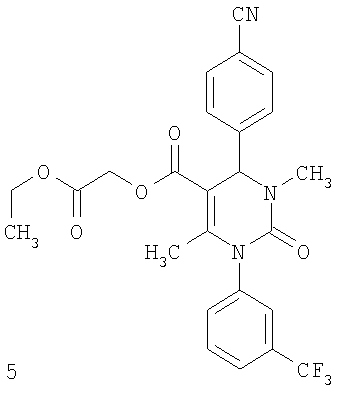
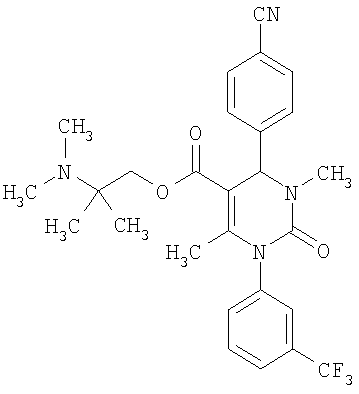
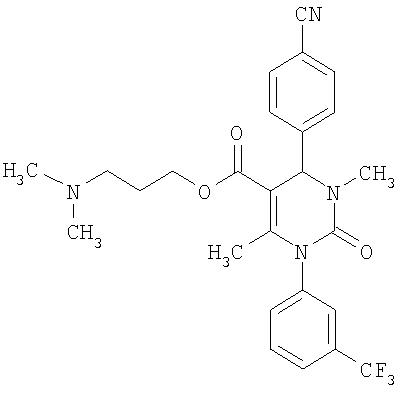
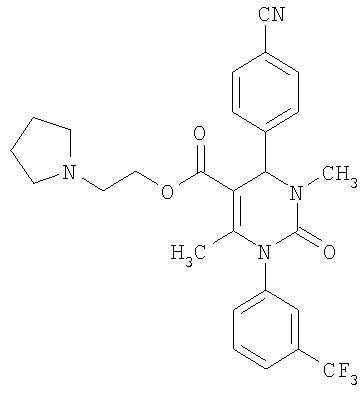
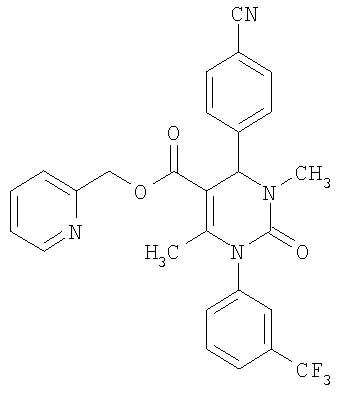
Пример 102
Этиловый эфир 1-(3,5-дихлорфенил)-6-метил-2-оксо-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
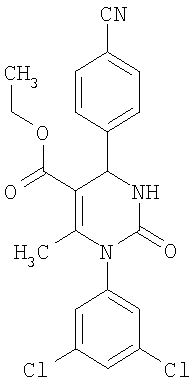
В атмосфере аргона в 0,5 мл диоксана 4 часа перемешивают при 80°С 30,8 мг (0,15 ммоля) N-(3,5-дихлорфенил)мочевины вместе с 39,3 мг (0,3 ммоля) 4-формил-бензонитрила, 39 мг (0,3 ммоля) этилового эфира 3-кетобутановой кислоты и 90 мг триметилсилилполифосфата. После прибавления небольшого количества диметилсульфоксида реакционную смесь фильтруют и очищают с помощью препаративной ВЭЖХ (колонка: Agilent Zorbax Extend С 18 Nautilus 20 мм ×50 мм, 5 мкм; растворитель А: ацетонитрил, растворитель Б: вода +0,1% концентрированного аммиака; 0 минут 10% А, 2 минуты 10% А, 6 минут 90% А, 7 минут 90% А, 7,1 минуты 10% А, 8 минут 10% А; скорость потока 25 мл/мин; длина волны: 220 нм; вводимый объем: около 500 мкл; число вводов: 1). Фракции, содержащие продукт, объединяют и упаривают в вакууме.
Выход 38,1 мг (59% от теории).
Жидкостная хроматомасс-спектрометрия (ионизация электронным ударом, способ 7): m/z=431 (М+Н)+, время удерживания 4,14 минуты.
Пример 103
Этиловый эфир 6-метил-4-(3-нитрофенил)-2-оксо-1-[3-(трифторметил)фенил]-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
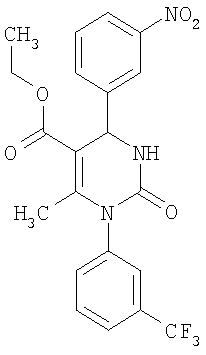
В 0,5 мл диоксана и 0,1 мл диметилформамида при температуре 80°С 18 часов встряхивают 30,6 мг (0,15 ммоля) N-[3-(трифторметил)фенил]мочевины вместе с 45,3 мг (0,3 ммоля) 3-нитробензальдегида, 39 мг (0,3 ммоля) этилового эфира 3-кетобутановой кислоты и 90 мг этилового эфира полифосфорной кислоты (свежеприготовленный по методике Cava и др., J. Org. Chem. 1969, 34, 2665). После прибавления 200 мкл диметилформамида реакционную смесь фильтруют и очищают с помощью препаративной ВЭЖХ (колонка: Nucleosil 100-5 С 18 Nautilus 20 мм ×50 мм, 5 мкм; растворитель А: ацетонитрил, растворитель Б: вода +0,1% муравьиной кислоты; градиент: 0 минут 10% А, 2 минуты 10% А, 6 минут 90% А, 7 минут 90% А, 7,1 минуты 10% А, 8 минут 10% А; скорость потока 25 мл/мин; длина волны: 220 нм; вводимый объем: около 800 мкл; число вводов: 1). Фракции, содержащие продукт, объединяют и упаривают в вакууме.
Выход 34 мг (50,4% от теории).
Жидкостная хроматомасс-спектрометрия (ионизация электронным ударом, способ 6): m/z=450 (М+Н)+, время удерживания 3,94 минуты.
По аналогии с методикой по примеру 102 получают приведенные далее соединения.
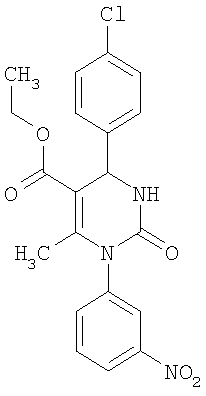
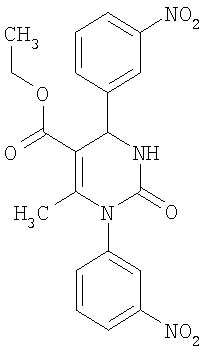
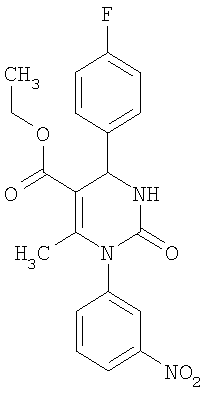
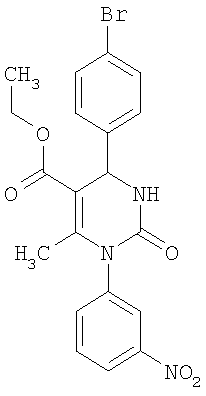
Пример 108
2-Цианоэтиловый эфир 6-метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
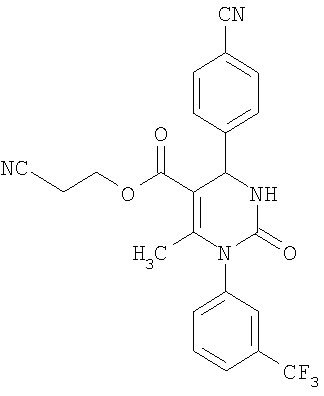
В 250 мл тетрагидрофурана суспендируют 9,87 г (48,3 ммоля) N-[3-(трифторметил)-фенил]мочевины, 12,68 г (96,68 ммоля) 4-цианобензальдегида, 15 г (96,68 ммоля) 2-цианоэтилового эфира 3-кетобутановой кислоты и 37,5 г этилового эфира полифосфорной кислоты. Смесь 18 часов перемешивают при кипячении с обратным холодильником. После охлаждения до комнатной температуры отгоняют растворитель в вакууме и очищают остаток хроматографированием на силикагеле с циклогексаном и этилацетатом в качестве элюента.
Выход 25 г (100% от теории).
1Н-ЯМР (200 МГц, d6-диметилсульфоксид): δ=2,1 (с., 3H); 2,8 (м., 2Н); 4,2 (м., 2Н); 5,4 (д., 1H); 7,6 (м., 4Н); 7,7 (м., 2Н); 7,9 (м., 2Н); 8,5 (д., 1Н) м.д.
Пример 109
6-Метил-2-оксо-1-[3-(трифторметил)фенил]-4-(4-цианофенил)-1,2,3,4-тетрагидро-5-пиримидинкарбонитрил
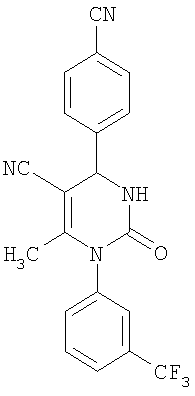
В 60 мл тетрагидрофурана растворяют 0,609 г (1,52 ммоля) соединения по примеру 70 и прибавляют 1,24 г (12,93) ммоля (метоксикарбонилсульфамоил)-триэтиламмонин-N-бетаина. Реакционную смесь 1 час перемешивают при комнатной температуре, отгоняют растворитель в вакууме и очищают остаток хроматографированием на колонке с силикагелем со смесями дихлорметана и метанола в качестве элюента.
Выход 249 мг (43% от теории).
1Н-ЯМР (300 МГц, d6-диметилсульфоксид): δ=1,8 (с., 3H); 5,4 (д., 1Н); 7,7 (м., 4Н); 7,8 (м., 2Н); 8,0 (м., 2Н), 8,4 (д., 1Н) м.д.
Пример 110
Этиловый эфир 6-метил-4-(4-нитрофенил)-2-оксо-1-[3-(трифторметил)фенил]-1,2,3,4-тетрагидро-5-пиримидинкарбоновой кислоты
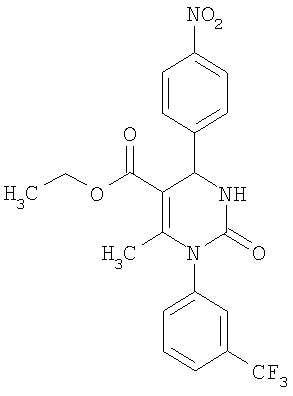
В 100 мл тетрагидрофурана суспендируют 7,84 г (38,4 ммоля) N-[3-(трифторметил)-фенил]мочевины, 5,81 г (38,4 ммоля) 4-нитробензальдегида, 5,0 г (38,4 ммоля) этилового эфира 3-кетобутановой кислоты и 15 г этилового эфира полифосфорной кислоты. Смесь 18 часов перемешивают при кипячении с обратным холодильником. После охлаждения до комнатной температуры отгоняют растворитель в вакууме и очищают остаток хроматографированием на колонке с силикагелем с толуолом и этилацетатом в качестве элюента.
Выход 8,75 г (51% от теории).
1Н-ЯМР (200 МГц, d6-диметилсульфоксид): δ=1,1 (т., 3H); 2,1 (с., 3H); 4,0 (м., 2Н); 5,4 (д., 1Н); 7,5-7,8 (м., 6Н); 8,3 (м., 2Н); 8,5 (д., 1Н) м.д.
Пример 111
5-Ацетил-6-метил-4-(4-нитрофенил)-2-оксо-1-[3-(трифторметил)фенил]-1,2,3,4-тетрагидропиримидин
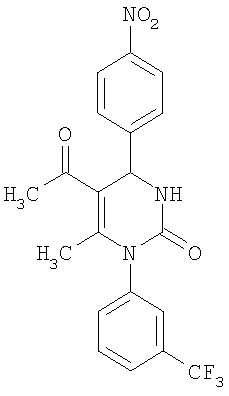
В 20 мл тетрагидрофурана суспендируют 0,407 г (2,0 ммоля) N-[3-(трифторметил)-фенил]мочевины, 0,302 г (2,0 ммоля) 4-нитробензальдегида, 0,2 г (2,0 ммоля) 2,4-пентандиона и 0,4 г этилового эфира полифосфорной кислоты. Смесь 18 часов перемешивают при кипячении с обратным холодильником. После охлаждения до комнатной температуры отгоняют растворитель в вакууме и очищают остаток хроматографированием на колонке с силикагелем с циклогексаном и этилацетатом в качестве элюента.
Выход 0,302 г (36% от теории).
1Н-ЯМР (200 МГц, d6-диметилсульфоксид): δ=2,0 (с., 3H); 2,2 (с., 3H); 5,5 (д., 1Н); 7,5-7,8 (м., 6Н); 8,3 (м., 2Н); 8,5 (д., 1Н) м.д.
В. Примеры способов получения, относящиеся к фармацевтическим композициям
Соответствующие изобретения соединения могут быть переведены в фармацевтические препараты приведенными далее способами.
Таблетка
Состав:
100 мг соединения по примеру 1, 50 мг лактозы (моногидрата), 50 мг кукурузного крахмала (немодифицированного), 10 мг поливинилпирролидона (PVP 25) (производства BASF, Людвигсхафен, Германия) и 2 мг стеарата магния.
Масса таблетки 212 мг, диаметр 8 мм, радиус кривизны 12 мм.
Способ получения
Смесь активной компоненты, лактозы и крахмала гранулируют с 5%-ным раствором (мас.%) поливинилпирролидона в воде. После сушки смешивают гранулы со стеаратом магния в течение 5 минут. Из этой смеси прессуют таблетки, используя обычный пресс для таблетирования (формат таблеток приведен выше). Усилие прессования в обычном случае равно 15 кН.
Суспензия для перорального введения
Состав:
1000 мг соединения по примеру 1, 1000 мг этанола (96%), 400 мг родигеля (ксантановый гуммиарабик производства FMC, Пеннсильвания, США) и 99 г воды. Разовая доза 100 мг соответствующего изобретению соединения содержится в 10 мл суспензии для перорального приема.
Способ получения
Родигель суспендируют в этаноле и прибавляют к суспензии активную компоненту. При перемешивании прибавляют воду. Перемешивание продолжают в течение примерно 6 часов до тех пор, пока не закончится процесс набухания родигеля.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННАЯ ТЕРАПИЯ С ПОМОЩЬЮ ЗАМЕЩЕННЫХ ОКСАЗОЛИДИНОНОВ | 2002 |
|
RU2321407C9 |
| ЗАМЕЩЕННЫЕ ОКСАЗОЛИДИНОНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ И ПРИМЕНЕНИЕ ЗАМЕЩЕННЫХ ОКСАЗОЛИДИНОНОВ | 2000 |
|
RU2297415C2 |
| Замещенные оксазолидиноны, способы их получения, лекарственное средство на их основе и применение замещенных оксазолидинонов | 2000 |
|
RU2836548C9 |
| ФЕНОКСИФЕНИЛАЛКАНСУЛЬФОНАТЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ В КАЧЕСТВЕ АГОНИСТА КАННАБИНОИДНЫХ РЕЦЕПТОРОВ | 2001 |
|
RU2278853C2 |
| ДИГИДРОПИРИМИДИНЫ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1999 |
|
RU2245881C9 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИМИДОНА ИЛИ ПИРРОЛОТРИАЗОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2014 |
|
RU2674977C2 |
| Производные тетрагидротриазолопиримидина в качестве ингибиторов нейтрофильной эластазы человека | 2012 |
|
RU2622643C2 |
| СОЕДИНЕНИЯ 8-МЕТИЛ-1-ФЕНИЛИМИДАЗО[1, 5-а]ПИРАЗИНА | 2011 |
|
RU2560162C2 |
| АМИНОЗАМЕЩЕННЫЕ ПИРАЗОЛЫ И ПРОМЕЖУТОЧНЫЕ АМИНОЗАМЕЩЕННЫЕ ПИРАЗОЛЫ | 1993 |
|
RU2142455C1 |
| ПРОИЗВОДНОЕ ФТАЛАЗИНОНКЕТОНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2011 |
|
RU2564527C2 |
Изобретение относится к новым гетероциклическим соединениям общей формулы (I), а также их фармацевтически приемлемым солям, гидратам и/или сольватам, обладающим свойствами ингибитора нейтрофильной эластазы человека, которые могут найти применение для лечения хронических обструктивных легочных заболеваний, острого коронарного синдрома, острого инфаркта миокарда и прогрессирующей сердечной недостаточности. В общей формуле (I)
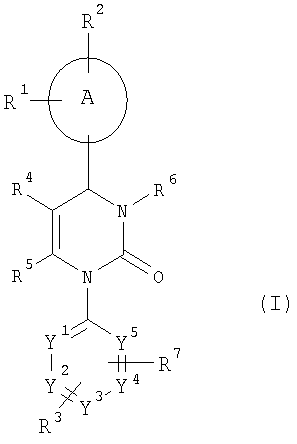 ,
,
где А означает фенильный или пиридильный цикл, R1 и R3 каждый означает атом водорода, R2 означает атом фтора, хлора, брома, нитрогруппу или цианогруппу, R4 означает цианогруппу, алкилкарбонильную группу с числом атомов углерода в алкильном остатке от одного до четырех, или алкоксикарбонильную группу с числом атомов углерода в алкоксильном остатке от одного до четырех, причем алкоксикарбонильная группа с числом атомов углерода в алкоксильном остатке от одного до четырех может быть замещена заместителем, выбираемым группы, состоящей из гидроксильной группы, алкокси с числом атомов углерода от одного до четырех, алкоксикарбонильной группы с числом атомов углерода в алкоксильном остатке от одного до четырех, моно- или диалкиламиногруппы, с числом атомов углерода в каждом из алкильных остатков от одного до четырех, 5-6-членной гетероарильной группы, содержащей от 1 до 4 гетероатомов в гетероарильном кольце, выбранных из азота, кислорода или серы, возможно замещенной алкильной группой, содержащей от 1 до 4 атомов углерода и возможно конденсированной с бензольным кольцом, и 5-8-членной гетероциклильной группы, содержащей от 1 до 3 гетероатомов из группы азота, кислорода или серы, или SO, SO2, возможно замещенной кетогруппой, R5 означает метильную группу, R6 означает атом водорода, алкильную группу с числом атомов углерода от одного до четырех, моно- или диалкиламинокарбонильную группу с числом атомов углерода в каждом из алкильных остатков от одного до четырех, и др., Y1, Y2, Y3, Y4 и Y5 каждый означает СН-группу. Изобретение также относится к фармацевтической композиции. 2 н. и 6 з.п. ф-лы.
1. Соединения общей формулы (I)
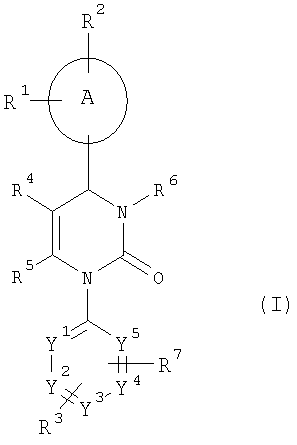 ,
,
где А означает фенильный или пиридильный цикл,
R1 и R3 каждый означает атом водорода,
R2 означает атом фтора, хлора, брома, нитрогруппу или цианогруппу,
R4 означает цианогруппу, алкилкарбонильную группу с числом атомов углерода в алкильном остатке от одного до четырех, или алкоксикарбонильную группу с числом атомов углерода в алкоксильном остатке от одного до четырех, причем алкоксикарбонильная группа с числом атомов углерода в алкоксильном остатке от одного до четырех может быть замещена заместителем, выбираемым группы, состоящей из гидроксильной группы, алкоксигруппы с числом атомов углерода от одного до четырех, алкоксикарбонильной группы с числом атомов углерода в алкоксильном остатке от одного до четырех, моно- или диалкиламиногруппы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, 5-6-членной гетероарильной группы, содержащей от 1 до 4 гетероатомов в гетероарильном кольце, выбранных из азота, кислорода или серы, возможно замещенной алкильной группой, содержащей от 1 до 4 атомов углерода и возможно конденсированной с бензольным кольцом, и 5-8 членной гетероциклильной группы, содержащей от 1 до 3 гетероатомов из группы азота, кислорода или серы, или SO, SO2, возможно замещенной кетогруппой,
R5 означает метильную группу,
R6 означает атом водорода, алкильную группу с числом атомов углерода от одного до четырех, моно- или диалкиламинокарбонильную группу с числом атомов углерода в каждом из алкильных остатков от одного до четырех, алкилкарбонильную группу с числом атомов углерода в алкильном остатке от одного до четырех, или алкоксикарбонильную группу с числом атомов углерода в алкоксильном остатке от одного до четырех, причем алкильная группа с числом атомов углерода от одного до четырех и алкоксикарбонильная группа с числом атомов углерода в алкоксильном остатке от одного до четырех могут быть замещены заместителем, выбираемым из группы, состоящей из 5-6-членной гетероарильной группы, содержащей от 1 до 4 гетероатомов в кольце, выбранных из азота, кислорода или серы, гидроксильной группы, алкоксигруппы с числом атомов углерода от одного до четырех, гидроксикарбонильной группы, аминокарбонильной, моно- и диалкиламинокарбонильной группы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, аминогруппы, моно- и диалкиламиногруппы с числом атомов углерода в каждом из алкильных остатков от одного до четырех, или
R6 означает структурную единицу формулы
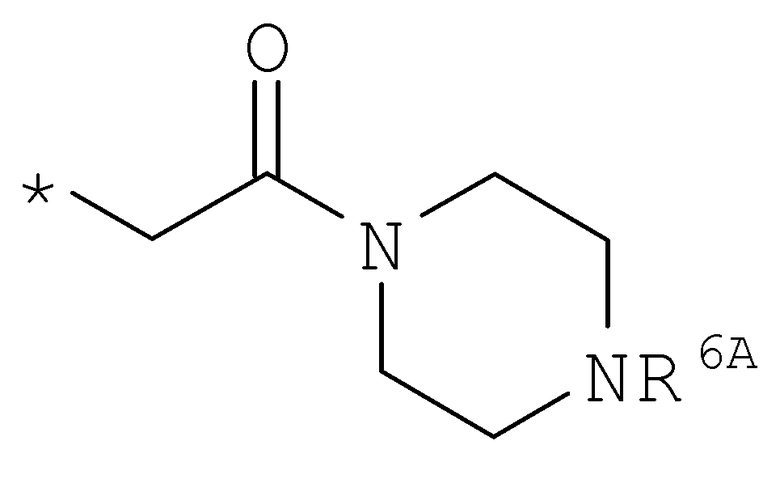 , или
, или 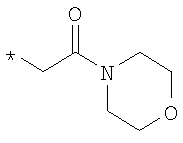
где R6A выбирают из группы, состоящей из атома водорода и метильной группы,
R7 означает трифторметильную группу или нитрогруппу, и
Y1, Y2, Y3, Y4 и Y5 каждый означает СН-группу, а также их фармацевтически приемлемые соли, гидраты и/или сольваты.
2. Соединения общей формулы (I) по п.1, где R2 означает цианогруппу.
3. Соединения общей формулы (I) по п.1 или 2, где R4 означает алкоксикарбонильную группу с числом атомов углерода в алкоксильном остатке от одного до четырех, который может быть замещен гидроксильной группой, или же где R4 означает алкилкарбонильную группу с числом атомов углерода в алкильном остатке от одного до четырех.
4. Соединения общей формулы (I) по любому из пп.1-3, где R6 означает атом водорода.
5. Соединения общей формулы (I) по п.1, где остаток
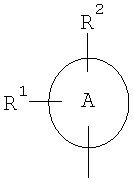 означает
означает 
где Z означает СН-группу или атом азота и
R1 имеет приведенные в п.1 значения,
R3, R4 и R6 имеют указанные в п.1 значения, R5 означает метил, Y1-Y4 означает СН-группу, каждая, а R7 означает трифторметил в положении 3 фенильного остатка.
6. Соединение общей формулы (I) по п.1, представляющее собой соединение 5-{5-ацетил-6-метил-2-оксо-1-[3-(трифторметил)фенил]-1,2,3,4-тетрагидро-4-пиримидинил}-2-пиридинкарбонитрил.
7. Соединение общей формулы (I) по п.1, представляющее собой соединение (+)-5-{5-ацетил-6-метил-2-оксо-1-[3-(трифторметил)фенил]-1,2,3,4-тетрагидро-4-пиримидинил}-2-пиридинкарбонитрил.
8. Фармацевтическая композиция, обладающая свойствами ингибитора нейтрофильной эластазы человека, содержащая по крайней мере одно соединение общей формулы (I) по пп.1 - 5, и фармацевтически приемлемый разбавитель.
| FRECHET J.M.J et al | |||
| "A Combinatorial Approach to Recognition of Highly Enantioselective | |||
| Aryl-Dihydropyrimidine Selectors for Chiral HPLC "Journal of Combinatorial Chemistry, 1999, v1, No.1, p.105-112 | |||
| Раструбное соединение труб | 1971 |
|
SU498918A3 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| US 5532366 A, 02.07.1996 | |||
| Способ повышения стабильности светового потока люминесцентных ламп | 1974 |
|
SU528633A1 |
Авторы
Даты
2009-12-20—Публикация
2003-08-28—Подача