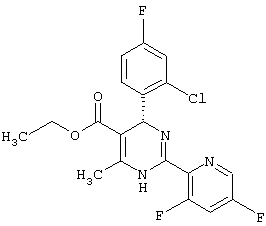
Предложенное изобретение относится к новым соединениям дигидропиримидина, способу их получения и их применению в качестве лекарственных средств, в частности для лечения и профилактики Гепатита В.
Из публикации европейской заявки на патент ЕР 103 796 А2 уже известны дигидропиримидины, оказывающие действие на кровообращение.
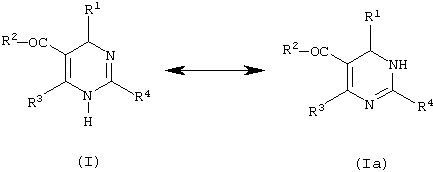
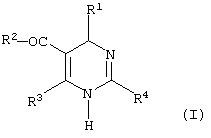
Изобретение относится теперь к новым соединениям дигидропиримидина общей формулы (I)
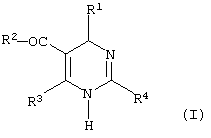
или ее изомерной формы (Ia)
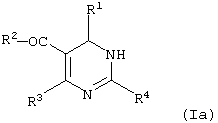
в которой
R1 - фенил, незамещенный или замещенный однократно или многоратно одинаковыми или различными заместителями, выбранными из группы, включающей галоген, трифторметил, нитро, амино, гидроксил и алкил с 1-6 атомами углерода, или остатки формул
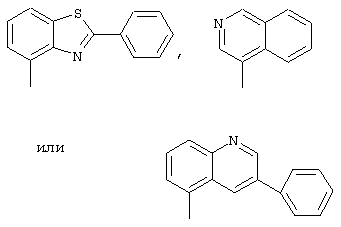
R2 - остаток формулы -XR5, где Х означает связь или атом кислорода,
R5 означает алкенил с 2-4 атомами углерода или алкил с 1-4 атомами углерода, незамещенные или замещенные феноксигруппой,
R3 - амино, алкил с 1-4 атомами углерода или циклопропил.
R4 представляет собой пиридил, который имеет до трех одинаковых или различных заместителей: галоген, трифторметил, алкокси с 1-6 атомами углерода, алкил с 1-6 атомами углерода и их соли.
Алкил с 1-6 атомами углерода в рамках изобретения представляет собой линейный или разветвленный алкильный остаток с 1-6 атомами углерода. В качестве примера следует назвать метил, этил, пропил, изопропил, трет-бутил, н-пентил или н-гексил.
Предпочтительным является линейный или разветвленный алкильный остаток с 1-4 атомами углерода.
Алкенил с 2-4 атомами углерода в рамках изобретения представляет собой линейный или разветвленный алкенильный остаток с 2-4 атомами углерода. Предпочтительным является линейный или разветвленный алкенильный остаток с 2-3 атомами углерода. В качестве примера следует назвать этенил, пропенил, бутенил.
Алкокси с 1-6 атомами углерода в рамках изобретения представляет собой линейный или разветвленный алкокси-остаток с 1-6 атомами углерода. Предпочтительным является линейный или разветвленный алкокси-остаток с 1-4 атомами углерода. В качестве примера следует назвать метокси, этокси и пропокси.
Заявляемые соединения могут существовать в стереоизомерных формах, которые относятся друг к другу или как изображение и зеркальное отображение (энантиомеры), или не как изображение и зеркальное отображение (диастереомеры). Изобретение относится как к энантиомерам, так и к диастереомерам и их текущим смесям. Рацемические формы, так же как и диастереомеры, могут быть разделены известным способом на стереоизомерные однородные составные части.
Соединения настоящего изобретения включают изомеры общих формул I и (Ia), а также смеси из них.
Заявляемые вещества могут находиться также в форме солей. В рамках изобретения предпочтительными являются физиологически приемлемые соли.
Физиологически приемлемыми солями могут быть соли заявляемых соединений с неорганическими и органическими кислотами. Предпочтительны соли с неорганическими кислотами, например такими как соляная кислота, бромистоводородная кислота, фосфорная кислота или серная кислота, или соли с органическими карбоновыми или сульфокилотами, например, такими как уксусная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, лимонная кислота, винная кислота, молочная кислота, бензойная кислота или метансульфокислота, этансульфокислота, фенилсульфокислота, толуол-сульфокислота или нафталиндисульфокислота.
Физиологически приемлемыми солями могут быть также соли металлов или аммонийные соли заявляемых соединений. Особенно предпочтительными являются, например, натриевые, калиевые, магниевые или кальциевые соли, а также аммонийные соли, которые происходят от аммиака или органических аминов, например, таких как этиламин, ди- или триэтиламин, ди- или триэтаноламин, дициклогексиламин, диметиламиноэтанол, аргинин, лизин, этилендиамин или 2-фенилэтиламин.
Предпочтительными являются соединения общей формулы (I) или (Ia), в которой
R1 представляет собой фенил или остатки формул

R4 представляет собой пиридил, который замещен до двух раз одинаковыми или различными заместителями: фтором, хлором, бромом, алкокси с 1-4 атомами углерода или алкилом с 1-4 атомами углерода,
и их соли.
Особо предпочтительными являются соединения общей формулы (I) или (Ia), в которой R1 представляет собой фенил или остатки формул

R4 представляет собой пиридил, который замещен до двух раз одинаковыми или различными заместителями: фтором, хлором, алкокси с 1-3 атомами углерода или алкилом с 1-3 атомами углерода,
и их соли.
Полностью предпочтительными являются соединения общей формулы (I) или (Ia).
в которой
R1 представляет собой фенил, который в некоторых случаях замещен до двух раз одинаковыми или различными заместителями: фтором, хлором, бромом, йодом, метилом или нитро,
R2 представляет собой -XR5, где Х представляет собой кислород и
R5 представляет собой линейный или разветвленный алкил, содержащий до 4 атомов углерода,
R3 представляет собой метил, этил или циклопропил,
R4 представляет собой пиридил, который замещен до двух раз одинаковыми или различными заместителями - фтором или хлором,
и их соли.
Еще более предпочтительными являются соединения общей формулы (I) или (Ia), в которой
R4 представляет собой пиридил, который может быть замещен одним или двумя атомами фтора.
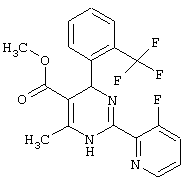
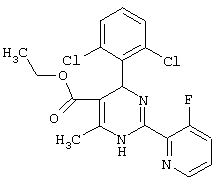
Также полностью предпочтительными являются заявляемые соединения общих формул (I) или (Ia), которые приведены в таблице А.
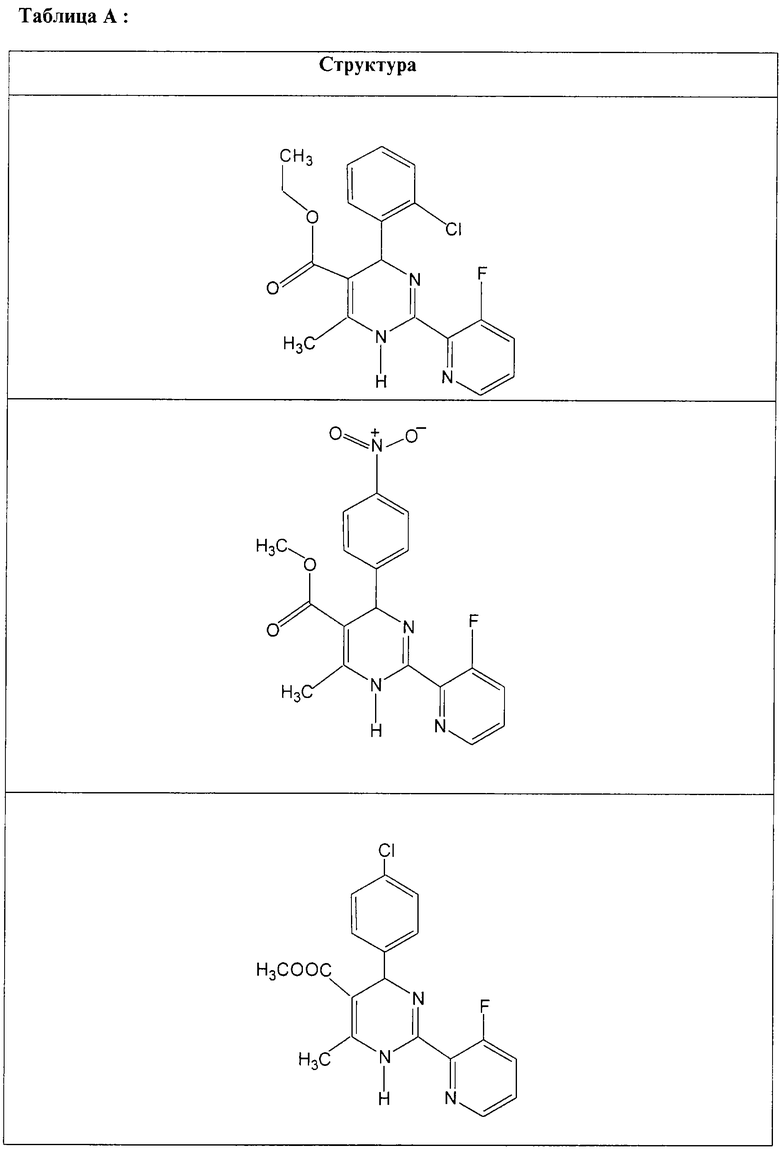
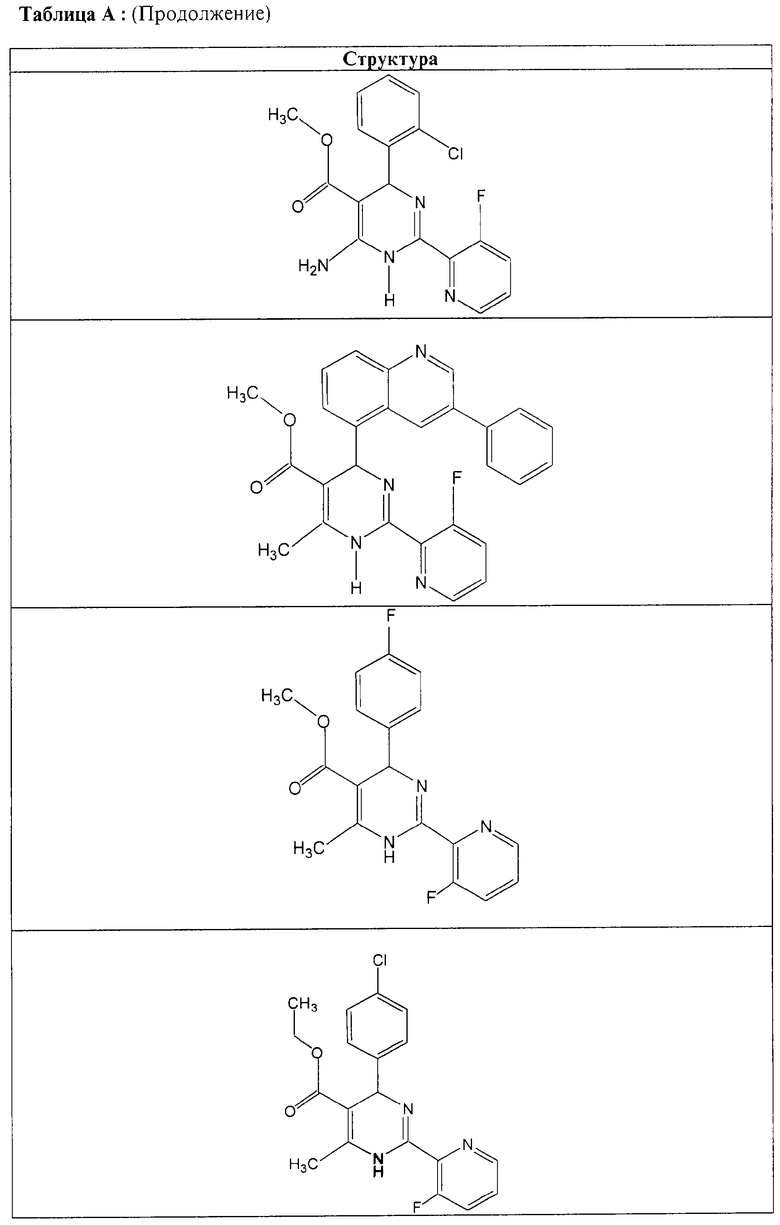
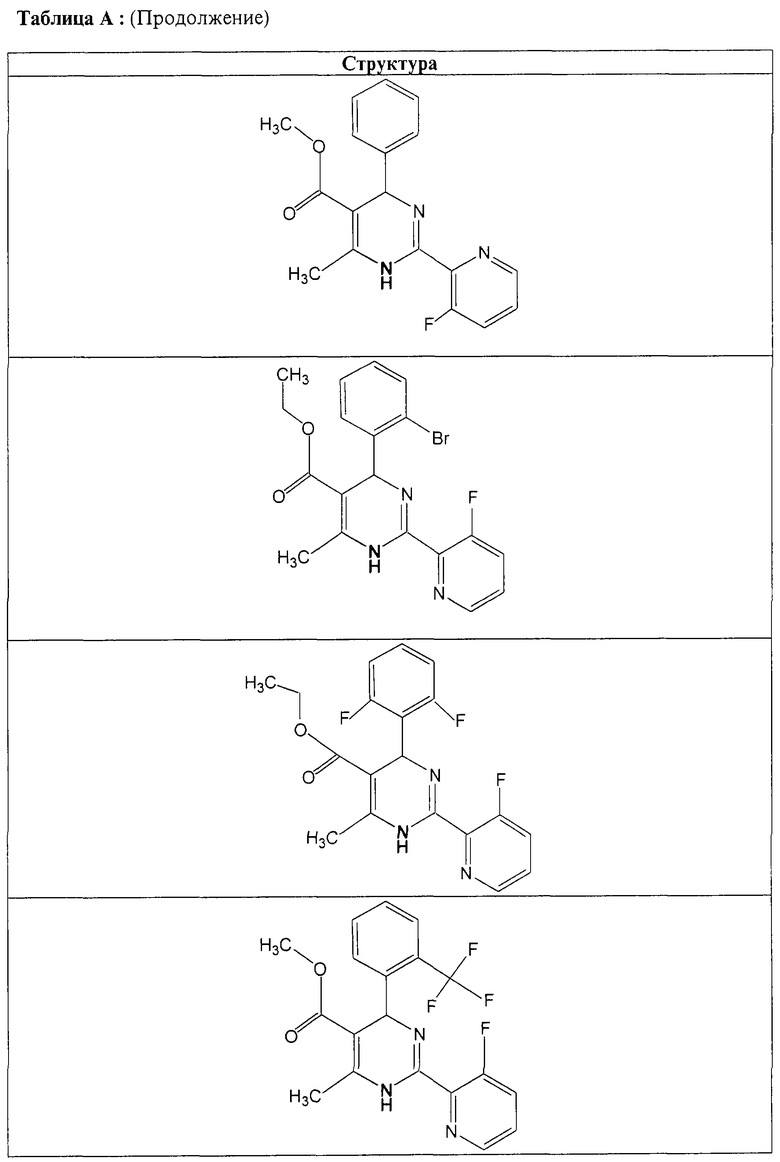
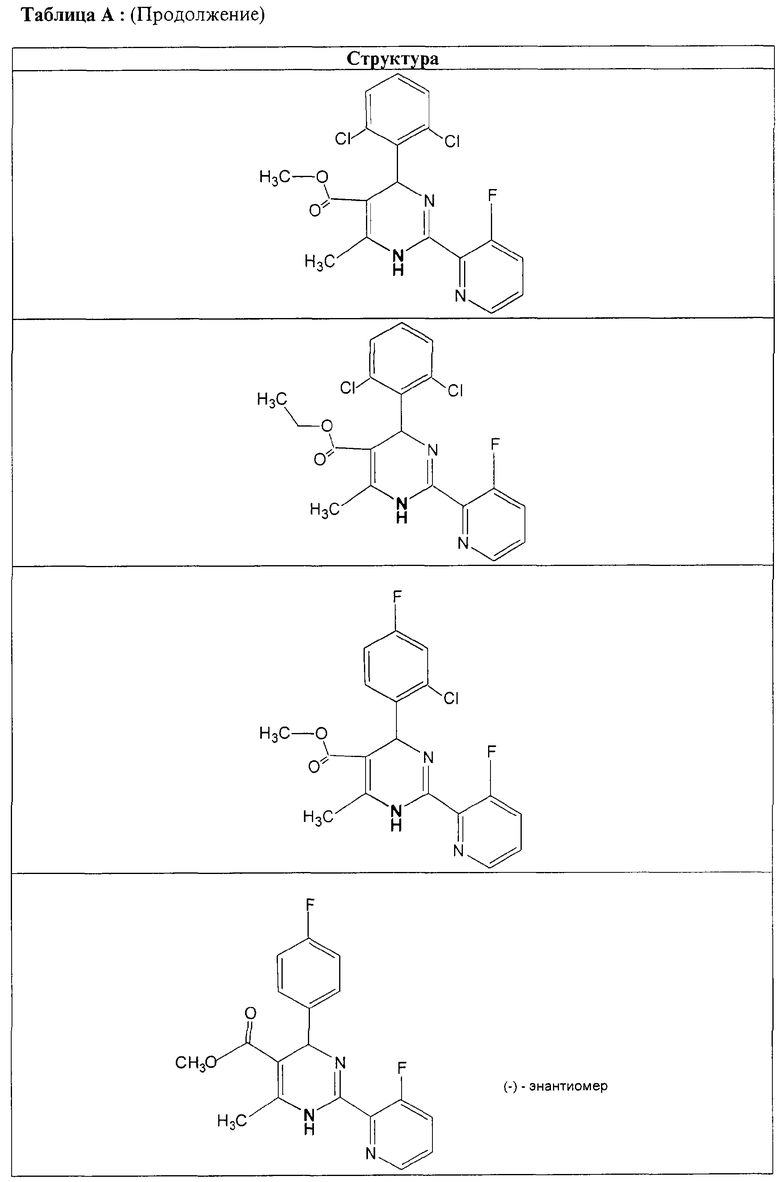
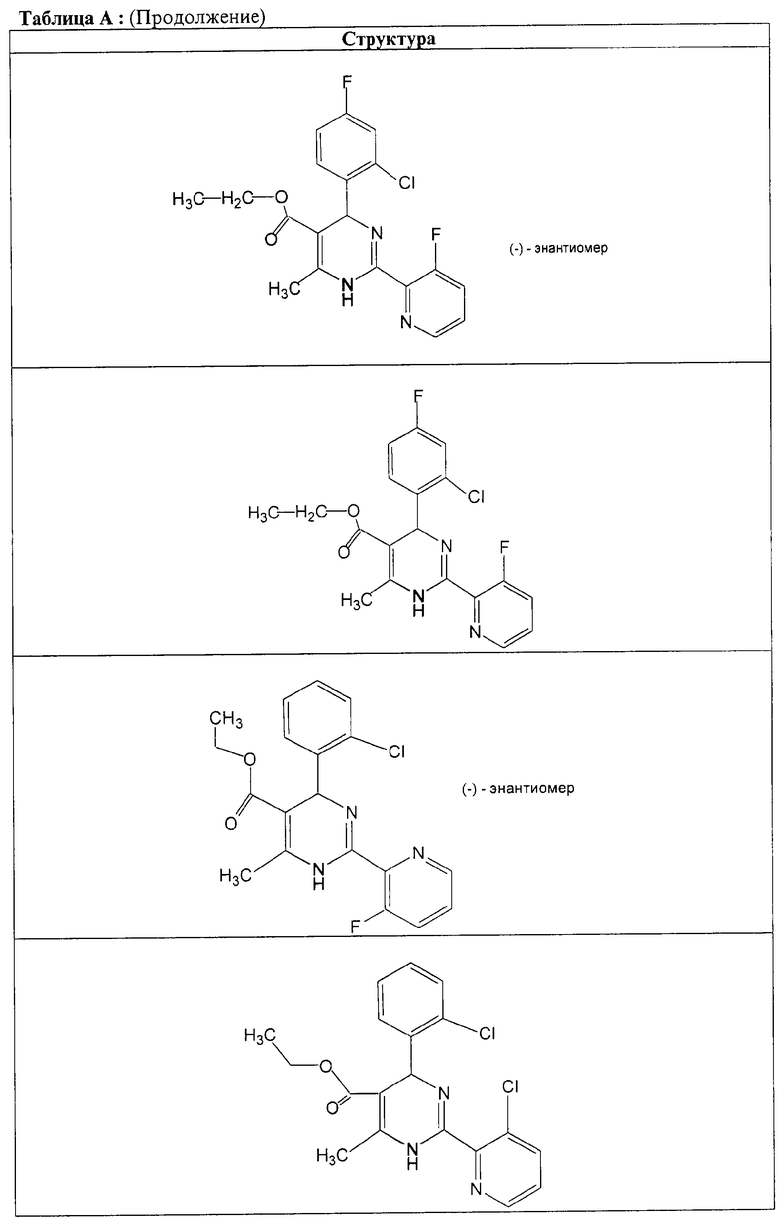
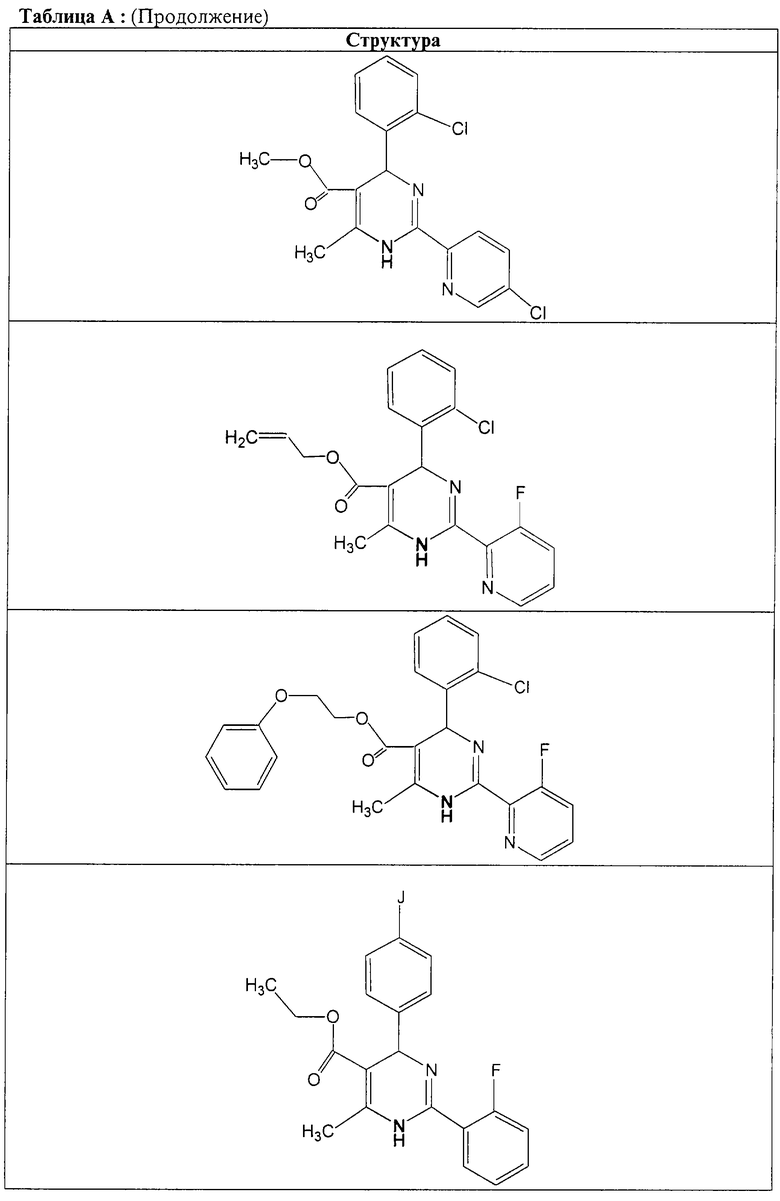
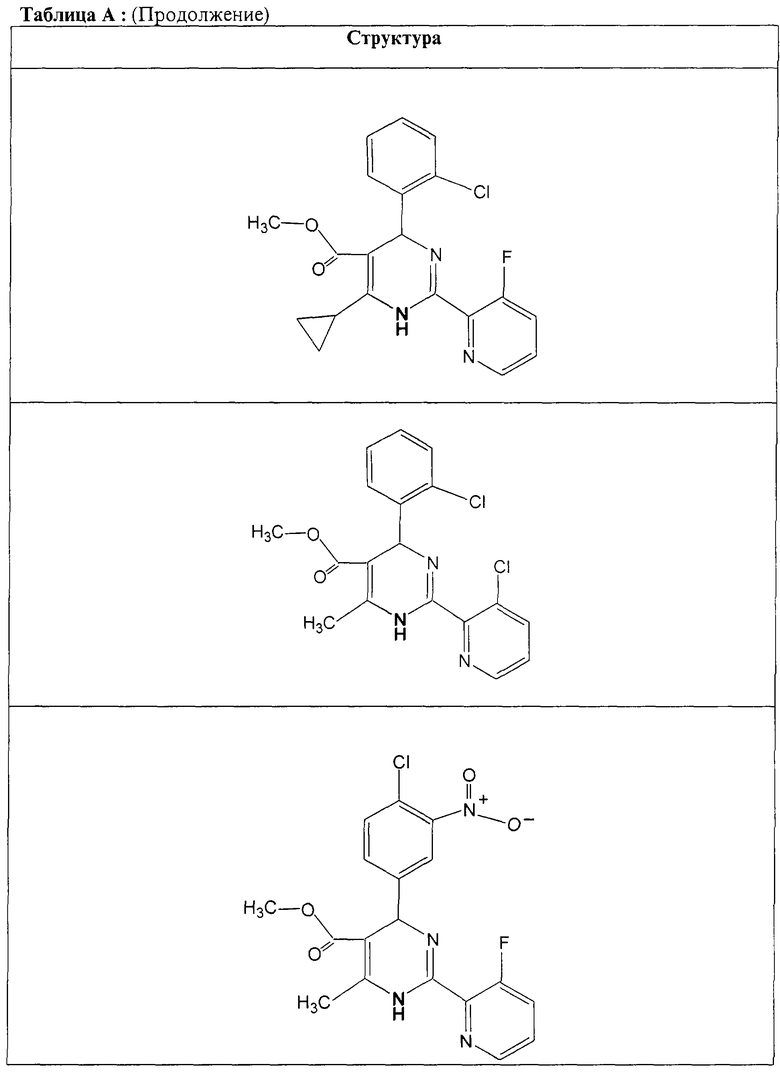
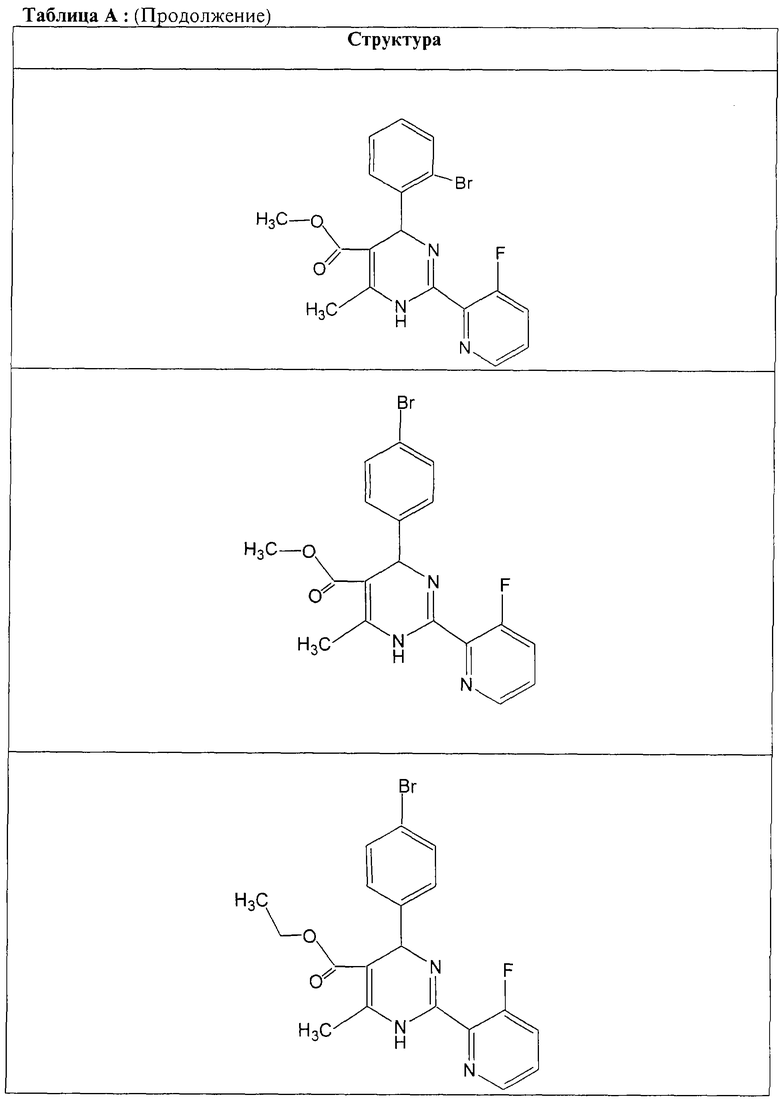
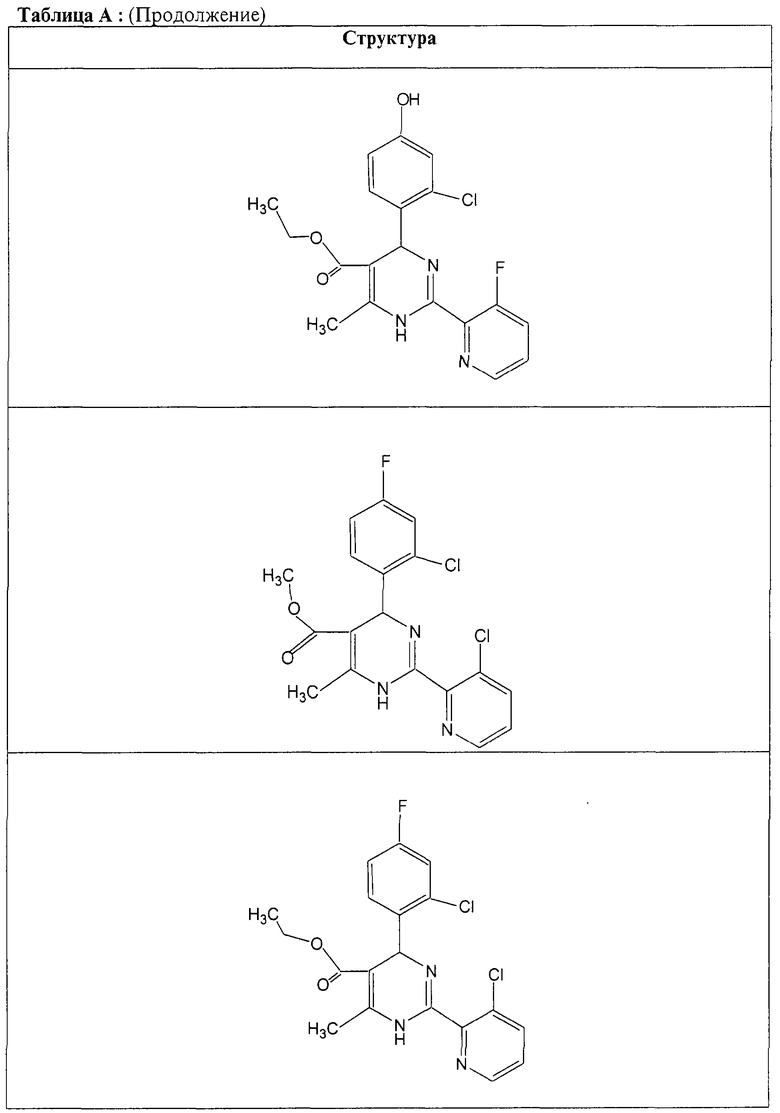
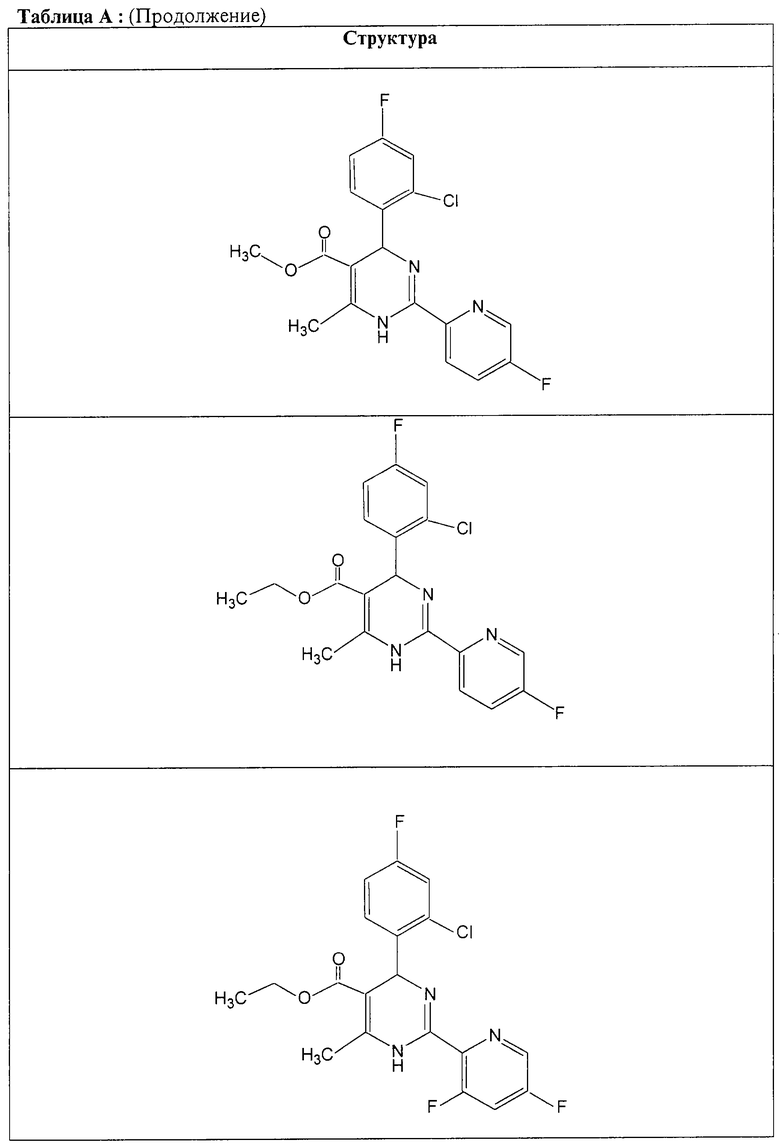
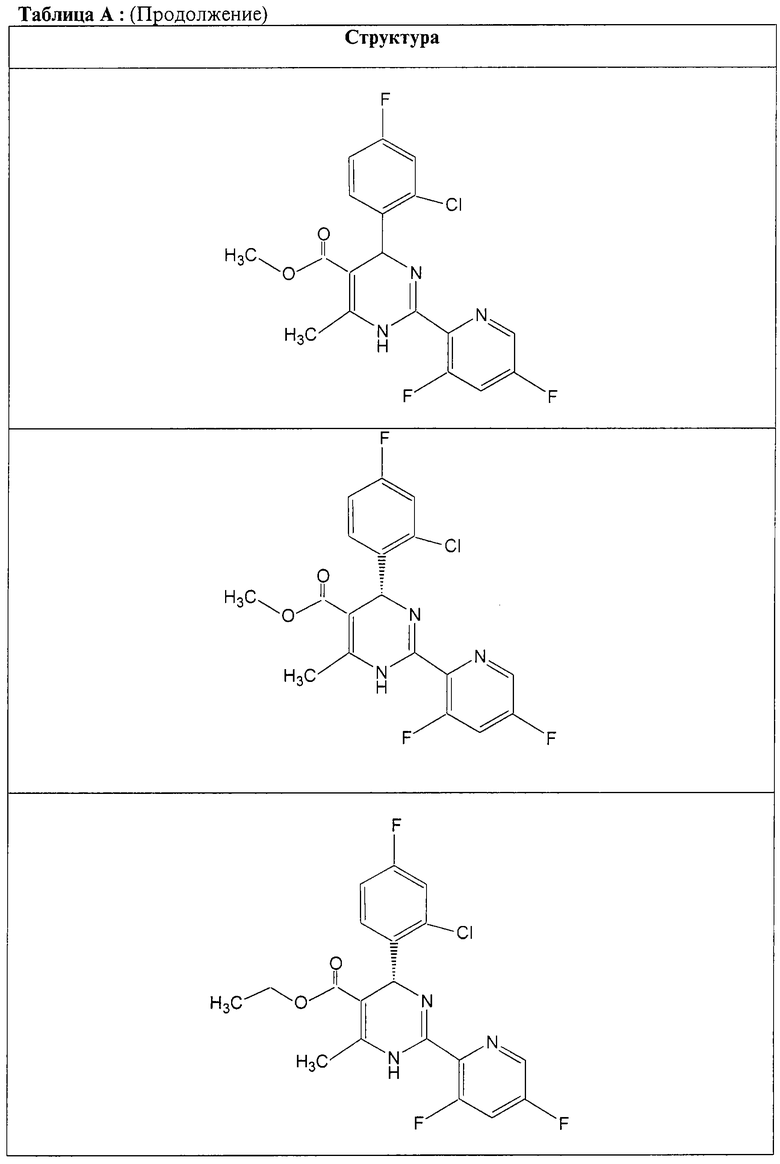
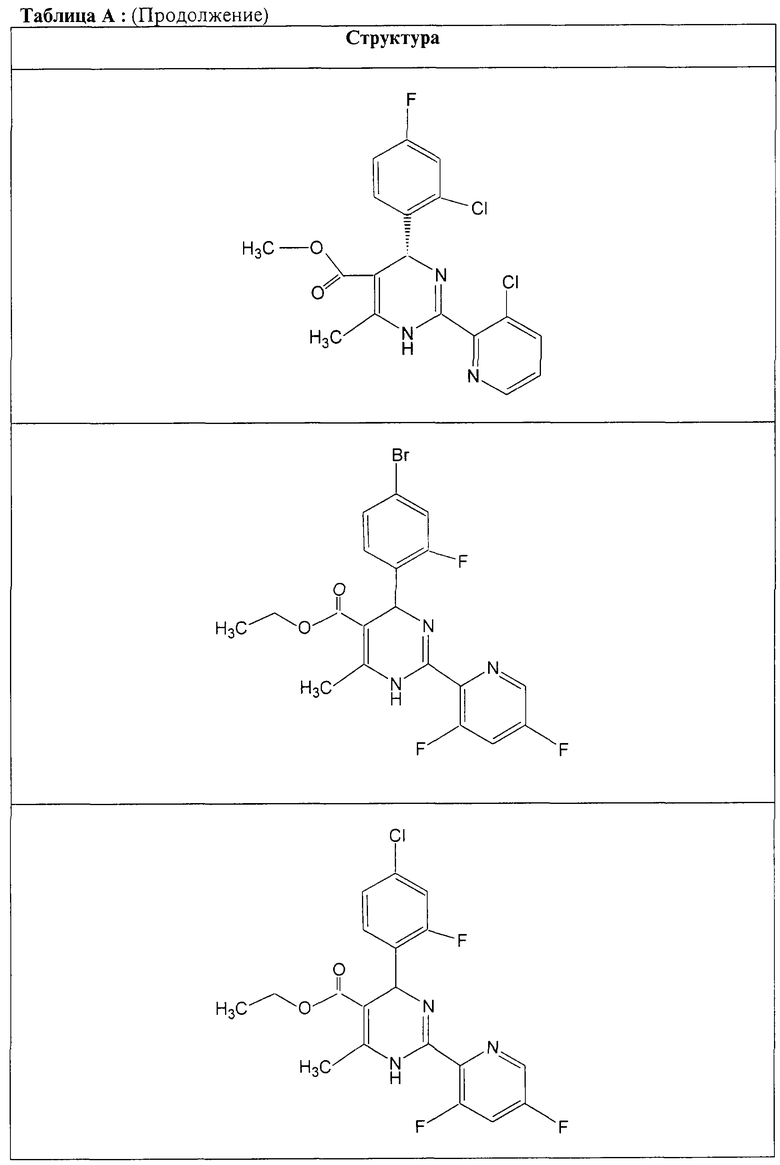
Полностью предпочтительными являются следующие соединения:

Заявляемые соединения общей формулы (I) могут быть получены таким образом, что
[А] альдегиды общей формулы (II)
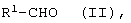
в которой R1 имеет вышеуказанное значение,
подвергают взаимодействию с амидинами или их гидрохлоридами формулы (III)
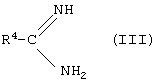
в которой
R4 имеет вышеуказанное значение,
и соединениями общей формулы (IV)
R3-CO-CH2-CO-R2 (IV),
в которой R2 и R3 имеют вышеуказанные значения,
в случае необходимости, в присутствии инертного органического растворителя с добавлением или без добавления основания или кислоты,
или [В] соединения общей формулы (V)
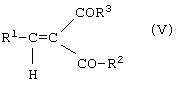
в которой R1, R2 и R3 имеют вышеуказанные значения,
подвергают взаимодействию с амидинами общей формулы (III)

в которой R4 имеет вышеуказанное значение,
в случае необходимости в присутствии инертного органического растворителя при температурах между 20°С и 150°С с добавлением или без добавления основания или кислоты, или
[C] альдегиды общей формулы (II)
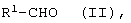
в которой R1 имеет вышеуказанное значение, подвергают взаимодействию с соединениями общей формулы (VI)
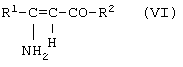
в которой R2 и R3 имеют вышеуказанные значения,
и амидинами общей формулы (III), как описано выше, или
[D] альдегиды общей формулы (II) подвергают взаимодействию с соединениями общей формулы (IV) и иминоэфирами общей формулы (VII)
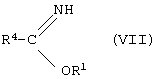
в которой R4 имеет вышеуказанное значение, и
R1 представляет собой алкил с 1-4 атомами углерода,
в присутствии солей аммония.
Заявляемый способ может быть раскрыт полнее на примере следующей реакционной схемы
[А]
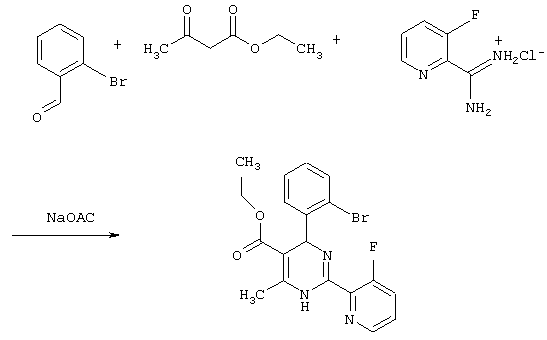
Для всех вариантов способа А, В, С и D в качестве растворителя рассматриваются все инертные органические растворители. К ним относятся, например, предпочтительно спирты, такие как этанол, метанол, изопропанол, эфиры, например, диоксан, диэтиловый эфир, тетрагидрофуран, монометиловый эфир этиленгликоля, диметиловый эфир этиленгликоля, или этилацетат, диметилформамид, диметилсульфоксид, ацетонитрил, пиридин или гексаметилтриамид фосфорной кислоты.
Реакционные температуры могут варьироваться в широкой области. В общем случае работают между 20 и 150°С, предпочтительно при температуре кипения используемого в конкретном случае растворителя.
Реакция может быть проведена при нормальном давлении, но также и при повышенном давлении. В общем случае работают при нормальном давлении.
Реакция может быть проведена с добавлением или без добавления оснований или кислот. Но показано, что согласно изобретению реакция прсдпочжюльно происходит в присутствии более слабых кислот, таких как, например, уксусная кислота или муравьиная кислота.
Используемые в качестве исходных веществ альдегиды общей формулы (I) известны или могут быть получены с использованием известных в литературе методов [ср. T.D.Harris und G.P.Roth, J.Org.Chem. 44, 146(1979), Deutsche Offenlegungsschrift 2 165 260, Juli 1972, Deutsche Offenlegungsschrift 2 401 665, Juli 1974, Mijano et al., Chem.Abstr. 59, (1963), 13 929 с, E.Adler und H.-D.Becker, Chem.Scand. 15, 849(1961), E.P.Papadopoulos, M.Mardin und Ch.Issidoridis, J.Org.Chem.Soc. 78, 2543(1956)].
Используемые в качестве исходных веществ илиден-β-кетоэфиры формулы (V) могут быть получены по известным из литературы методам [ср. G.Jones, "The Knoevenagel Condensation", in Organic Reaction, Vol. XV, 204 ff. (1967)]. Используемые в качестве исходных веществ эфиры енаминкарбоновых кислот формулы (VI) и иминоэфиры общей формулы (VII) известны или могут быть получены по известным из литературы методам [ср. S.A.Glickman and А.С.Соре, J.Amer.Chem.Soc. 67, 1017, (1945)].
Используемые в качестве исходных веществ эфиры β-кетокарбоновых кислот формулы (IV) могут быть получены по известным из литературы методам [например, D.Bormann, "Umsetzung von Diketen mit Alkoholen, Phenolen und Mercaptanen", in Houben-Weyl, Methoden der organischen Chemie, Vol. VII/4, 230 ff. (1968); Y.Oikawa, K.Sugano und O.Yonemitsu, J.Org.Chem. 43, 2087 (1978)].
Соединения общей формулы (III) известны частично и в случае, когда R4 представляет собой дифторированный пиридил, являются новыми и могут быть получены таким образом, что соединения формулы (VIII)
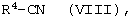
в которой R4 имеет указанное выше значение,
как обычно переводят в иминоэфиры и затем подвергают превращению с хлоридом аммония в метаноле [ср. W.K. Fife, Heterocycles 22, 93-96 (1984); Т. Sakamoto, S.Kaneda, S.Nishimura, H.Yamanaka, Chem.Pharm.Bull. 33, 565-571 (1986)] или другие известные из литературы способы, как, например, Garigipati. Tetraedron Lett. 1990. S.I 969-1972. Boere et al., J.Organomet.Chem. 1987. 161. Caton et al., J.Chem.Soc. 1967. 1204.
Все стадии процесса происходят при нормальном давлении и в области температур от 0°С до 130°С, предпочтительно, от 20°С до 100°С.
Изобретение относится также к промежуточному продукту следующей формулы
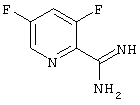
а также к его солям; из вышеприведенного соединения могут быть получены предпочтительные конечные продукты. Что касается солей этого соединения, то следует указать на вышеупомянутые соли, образованные за счет присоединения кислот, и в частности на гидрохлорид. Получение этого соединения происходит, как описано в примерах, и соответственно указано также на реакционной схеме, приведенной ниже.
Соединения формулы (VIII) известны и могут быть получены по известному способу аналогично примеру I и II, таким образом, что пиридины общей формулы (IX)
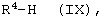
в которой водород находится в орто-положении по отношению к азоту и в которой R4 имеет указанное выше значение, сначала при 50-150°С, предпочтительно при 100°С, в смеси пероксид водорода/ледяная уксусная кислота вводят в реакцию с соответствующими N-оксидами, и затем проводят реакцию с триметилсилилцианидом (TMCCN) по известному из литературы способу в приведенных выше органических растворителях, предпочтительно в ацетонитриле, тетрагидрофуране (ТГФ), толуоле, при комнатной температуре, в некоторых случаях с добавлением оснований, таких как триэтиламин или диазабициклоундекан (DBU),
или таким образом, что в соединениях общей формулы (X)
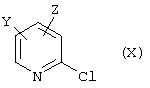
в которой Y и Z изображают остатки заместителей пиридильного кольца, указанные для R4, с помощью цианидов, таких как цианид калия или цианид меди, обменивают хлор на цианид,
или в случае, когда R4 означает дифторпиридил, соединения общей формулы (XI)
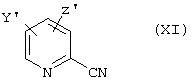
в которой Y' и Z' одинаковы или различны и означают хлор или бром, подвергают взаимодействию с фторидами щелочных металлов или аммония, предпочтительно с фторидом калия, по известному из литературы способу, в полярных растворителях, как, например, полигликолях и их эфирах, диметилсульфоксиде (ДМСО) или сульфолане, в некоторых случаях с добавлением катализаторов фазового переноса, для проведения реакции обмена галоген-фтор.
Изобретение относится также к соединению нижеприведенной формулы, из которого может быть получен соответствующий амидиновый промежуточный продукт по способу, описанному в примерах
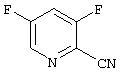
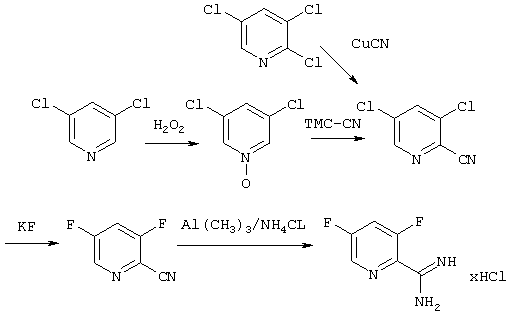
Вышерассмотренный способ раскрывается на примере 3,5-дифторпиридиновых соединений с помощью следующей реакционной схемы:
Антивирусная активность заявляемых соединений была исследована по методам, описанным Селлом и др. (М.A.Sells, M.-L.Chen and G.Acs (1987) Proc.Natl.Acad.Sci. 84, 1005-1009) и Корбой и др. (B.E.Korba and J.L.Gerin (1992) Antiviral Research 19, 55-70).
Антивирусные тесты проводили на микротитровальных пластинках с 96 углублениями (чашками). Первый вертикальный ряд пластинки содержал только среду для культивирования и НерG2.2.15-клетки. Он служил в качестве контроля в эксперименте.
Растворы штаммов тестируемых соединений (50 мМ) сначала растворяли в ДМСО, и следующие разбавления получали в среде для культивирования клеток HepG2.2.15. Заявляемые соединения были пипетированы, как правило, в тестовой концентрации 100 μМ (1. тестовая концентрация), соответственно, во второй вертикальный тестовый ряд микротитровальной пластинки и затем на второй стадии были разбавлены в 210 раза средой (в среде) для культивирования с добавлением 2% внутриутробной телячьей сыворотки (объем 25 μл).
В каждой чашке (углублении) микротитровальной пластинки содержалось таким образом 225 μл суспензии НерG2.2.15-клеток (5×104 клеток/мл) в среде для культивирования и плюс 2% внутриутробная телячья сыворотка. Тестовый образец инкубировали 4 дня, 37°С, 5% CO2.
Затем верхнюю часть отсасывали и отбрасывали, и таким образом в чашках содержалось 225 μл свежеприготовленной среды для культивирования. Заявляемые соединения добавляли, соответственно, вновь в виде 10-кратно сконцентрированного раствора в объеме 25 μл. Образцы инкубировали еще 4 дня.
Перед сбором верхней части для определения антивирусной активности НерG2.2.15-клетки исследовали под световым микроскопом или с помощью биохимического метода определения (например, голубое окрашивание с Alamar или окрашивание с Trypanblue) на цитотоксичные изменения.
Затем возвращались к отделенным верхним слоям, их отсасывали с помощью вакуума на соответствующих Dot-Blot - камерах с 96 чашками, обтянутых нейлоновой мембраной (в соответствии с указаниями изготовителя).
Определение цитотоксичности
Индуцированные веществами цитотоксичные или цитостатичные изменения НерG2.2.15-клеток обнаруживали, например, с помощью светового микроскопа в виде изменений клеточной морфологии. Подобные индуцированные веществами изменения НерG2.2.15-клеток в сравнении с клетками, не подвергавшимися обработке, проявлялись в виде целиза, вакуолизации или измененной клеточной морфологии. 50% цитотоксичность (токс.-50) означает, что 50% клеток имеют морфологию, сравнимую с соответствующими контрольными клетками.
Совместимость некоторых из заявляемых соединений проверяли дополнительно на других клетках хозяина, например, HeLa-клетках, первичных периферийных кровяных клетках человека или трансформированных клеточных линиях, например, Н-9-клетках.
Не могло быть установлено никаких цитотоксичных изменений при концентрации заявляемых соединений более 10 μМ.
Определение антивирусной активности
После переноса верхних частей на нейлоновую мембрану Блот-аппарата (см. выше) верхние части НерG2.2.15-клеток денатурировали (1,5 М NaCl/0,5 N NaOH), нейтрализовывали (3 М NaCl/0,5 трис-HCl, рН 7,5) и промывали (2× раствор хлорида и цитрата натрия (SSC)). Затем ДНК сушили посредством инкубации фильтра при 120°С 2-4 часа на мембране.
Гибридизация ДНК
Определение вирусных ДНК обработанных HepG2.2.15-клеток на нейлоновых фильтрах проводили, как правило, с нерадиоактивными, дигоксигенинмаркированными ДНК-зондами, специфичными в отношении Гепатита В, которые маркировали, соответственно, по указанию изготовителя дигоксигенином, очищали и использовали для гибридизации.
Прегибридизацию и гибридизацию проводили в смеси, содержащей 5 × SSC, 1 × блокирующего реагента, 0,1% N-лауроилсаркозина, 0,02% додецилсульфата натрия (SDS) и 100 μг ДНК из спермы морской сельди. Прегибридизацию проводили 30 минут при 60°С, а специфическую гибридизацию осуществляют с применением 20-40 нг/мл маркированной дидоксиненином денатурированной HBV специфичной ДНК (14 часов, 60°С). Затем фильтры промывают.
Обнаружение ГВВ (вирус Гепатита В)-ДНК с помощью диюксигенин-
антител.
Иммунологические свойства дигоксигенинмаркированных ДНК исследовали согласно указаниям изготовителя:
фильтры промывали и проводили прегибридизацию в блокирующем реагенте (по указанию изготовителя). Затем в течение 30 минут проводили гибридизацию с анти-ДИГ-антителом, которое было связано со щелочной фосфатазой. После стадии промывания добавляли субстрат щелочной фосфатазы(CSPD), инкубировали 5 минут с фильтрами, затем упаковывали в полиэтиленовую фольгу и инкубировали еще 15 минут при 37°С. Сигналы, отвечающие за хемилюминесценцию ДНК, специфичной в отношении Гепатита В, обнаруживали при экспозиции фильтра на Рентгеновской пленке (инкубация по сигналу крахмала: от 10 минут до 2 часов).
Концентрацию ингибитора на половине максимальной (КИ-50, ингибирующая концентрация 50%) определяли как концентрацию, при которой интенсивность полос, характерных для Гепатита-В, по отношению к необработанной пробе была снижена на 50%.
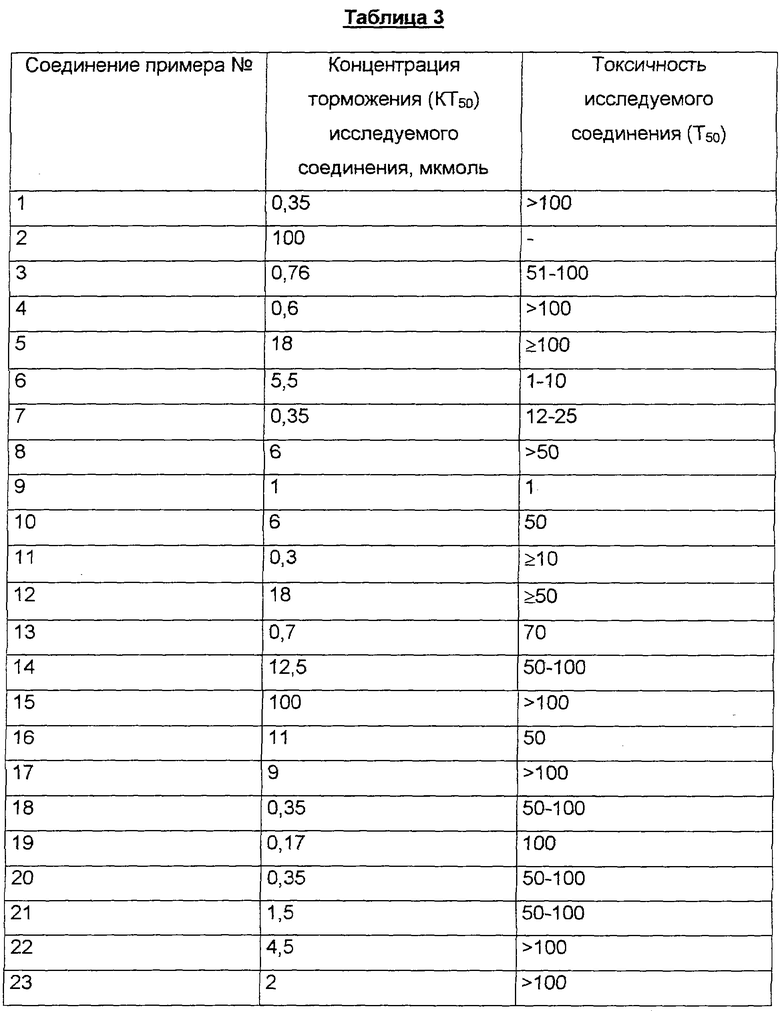
Обработка НерG2.2.15-клеток, продуцирующих вирус Гепатита-В, заявляемыми соединениями поразительным образом приводит к тому, что в верхней части клеточных культур снижается количество вирусной ДНК, которая выводится из клеток в форме вирионов в верхнюю часть клеточных культур. Показатели активности приведены в Таблице 3.
Заявляемые соединения проявляют новое, не предсказуемое заранее и весьма ценное действие в отношении вирусов. Они поразительным образом проявляют антивирусное действие в отношении вируса Гепатита-В (ГВ-вирус) и тем самым пригодны для лечения заболеваний, индуцируемых вирусами, в частности острых и хронических врожденных вирусных инфекций, связанных с ГВ-вирусом. Хроническое вирусное заболевание, вызванное ГВ-вирусом, может привести к различным тяжелым проявлениям болезни; известно, что вирусная инфекция хронического Гепатита-В во многих случаях приводит к циррозу печени и/или к печеночной карциноме.
В качестве показательных областей для соединений, применяемых согласно изобретению, могут быть, например, названы:
лечение острых и хронических вирусных инфекций, которые могут привести к инфекционному гепатиту, например, инфекции с вирусами Гепатита-В, особенно предпочтительным является лечение хронических инфекций Гепатита-В и лечение острых вирусных инфекций Гепатита-В.
Дальнейшим объектом изобретения является лекарственное средство, обладающее активностью против вируса гепатита В, содержащее, по меньшей мере, одно соединение вышеуказанной формулы (I) или (Ia).
Лекарственное средство может также содержать нетоксичные инертные фармацевтически пригодные носители.
Обычно содержание соединений формул (I) или (Ia) в предлагаемом лекарственном средстве составляет примерно от 0,1 до 99,5 вес.%, предпочтительно примерно от 0,5 до 95 вес.% общего веса смеси.
Получение предлагаемого лекарственного средства проводят обычным методом, например смешением одного или нескольких активных компонентов с одним или несколькими носителями.
В общем случае, как в медицине, так и в ветеринарии при лечении, для достижения желаемого результата оказывается предпочтительным вводить одно или несколько заявляемых веществ в общих количествах от примерно 0,5 до примерно 500, предпочтительно от 1 до 100 мг/кг веса тела за 24 часа, в случае необходимости в форме нескольких отдельных приемов. Отдельный прием включает одну или несколько активных компонент, предпочтительно в количествах от примерно 1 до примерно 80, в частности от 1 до 30 мг/кг веса тела. Но может все-таки потребоваться отклониться от указанной дозировки; дозировка, в частности, может зависеть от вида и веса тела объекта, подлежащего лечению, характера и тяжести заболевания, типа состава и способа приема лекарства, а также от температуры или интервала времени, в течение которого происходит прием лекарства.
Исходные соединения
Пример I
3-Фторпиридин-N-оксид
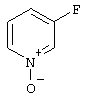
11,10 г (114,324 ммоль) 3-Фторпиридина растворяют в 74,00 мл уксусной кислоты. Добавляют 22,20 мл пероксида водорода и перемешивают 7 часов при 100°С (при температуре водяной бани). Затем раствор упаривают до 30 мл, добавляют 30 мл воды и снова упаривают до 30 мл. Полученную смесь размешивают с дихлорметаном, подщелачивают с помощью добавления карбоната калия до щелочной реакции, органический слой отделяют, водный слой встряхивают 2 раза с дихлорметаном, объединенные органические вытяжки сушат и упаривают.
Выход: 11,5 г (88,9%)
Т.пл.: 66-68°С
Пример II
2-Циано-3-фторпиридин
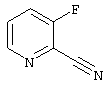
5,20 г (45,980 ммоль) Соединения из примера I растворяют в 50 мл ацетонитрила. Под аргоном добавляют 13,70 г (138,092 ммоль) триметилсилилнитрила и медленно приливают 12,80 мл триэтиламина. Раствор перемешивают 7 часов с обратным холодильником до следующего дня. После упаривания на водоструйном насосе добавляют дихлорметан, полученный раствор встряхивают 2 раза с 2 N раствором карбоната натрия, каждый раз по 50 мл, промывают водой, сушат и упаривают. Выход (сырой продукт): 5,3 г (масло)
Колоночная хроматография: элюент - от чистого метиленхлорида до смеси метиленхлорид/этилацетат 10: 1. Масло затвердевает.
Пример III
2-Амидино-3-фторпиридин-гидрохлорид
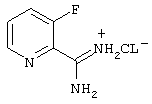
10,30 г (84,355 ммоль) Соединение из примера II растворяют в 30 мл метанола. К полученному раствору добавляют раствор 0,40 г (17,391 ммоль) натрия в 65 мл метанола и перемешивают 72 часа при 20°С. Затем добавляют 5,44 г (101,682 ммоль) хлорида аммония (растертого в ступке) и 17,39 ммоль (1,04 мл) уксусной кислоты, смесь перемешивают 28 часов при 40°С и охлаждают. Раствор отсасывают от нерастворимой соли (1,78 г), упаривают, добавляют ацетон и упаривают, затем остаток размешивают с ацетоном, отсасывают и промывают.
Выход: 10,6 г
Т.пл.: 150°С(разл.)
Пример IV
2-Циано-3,5-дихлорпиридин
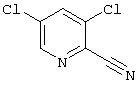
Метод 1
26 г (0,158 моль) 3,5-Дихлорипиридин-1-оксида (Johnson et al., J. Chem. Soc. B, 1967, 1211) растворяют в 80 мл метиленхлорида и добавляют последовательно 21,8 мл (0,174 моль) триметилсилилцианида и 14,6 мл (0,158 моль) хлорангидрида диметилкарбамидной кислоты и перемешивают 48 часов при комнатной температуре. К полученному раствору добавляют 100 мл 10%-ного раствора бикарбоната натрия и интенсивно перемешивают 10 минут. После разделения слоев водный слой встряхивают 1 раз с метиленхлоридом, и объединенные органические вытяжки сушат и упаривают. Остаток хроматографируют на силикагеле с метиленхлоридом и перекристаллизовывают из небольшого количества метанола.
Получают 11 г (40,2%) 2-циано-3,5-дихлорпиридина (Т.пл.: 102°С).
Метод 2
Аналогично тому, как описано в работе Troschuetz R. el al., J. Heterocycl. Chem. 1996. 33, 1815-1821, 150 мл диметилового эфира диэтиленгликоля (диглима), 47,68 г (0,261 моль) 2,3,5-трихлорпиридина, 2,0 г (0,005 моль) тетрафенилфосфоний-бромида, 4,0 г (0,0024 моль) измельченного в мелкий порошок йодида калия и 75,0 г (0,838 моль) цианида меди (I) добавляют друг к другу под азотом и перемешивают с обратным холодильником 24 часа. Затем к смеси добавляют еще 100 мл диглима, 2,0 г (0,005 моль) тетрафенилфосфоний-бромида, 4,0 г (0,024 моль) измельченного в мелкий порошок йодида калия и 75 г (0,838 моль) цианида меди (I) и перемешивают еще 89 часов с обратным холодильником (при кипении). После охлаждения до комнатной температуры твердый осадок отсасывают и из фильтрата тщательно удаляют диглим перегонкой. Остаток растворяют в толуоле, полученный раствор промывают раствором соли Мора и затем раствором бикарбоната натрия (пероксидный тест). Затем промывают водой, не содержащей диглима. Фильтруют через цеолит, фильтрат сушат над сульфатом магния и раствор упаривают. Получают 18,0 г (40,0%) 2-циано-3,5-дихлорпиридина.
Пример V
3,5-Дифторпиридин-2-карбонитрил
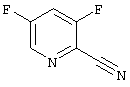
К смеси 50 г (0,29 моль) 3,5-дихлорпиридин-2-карбонитрила (пример 4), 33,6 г (0,58 моль) фторида калия и 10 г полиэтиленгликоля 8000 добавляют 125 мл ДМСО и нагревают 30 минут при 160°С. После охлаждения продукт отгоняют в высоком вакууме вместе с ДМСО, дистиллят выливают на воду, экстрагируют толуолом и сушат над сульфатом натрия. Продукт подвергают дальнейшему превращению в виде толуольного раствора. (Значение Rf: 0,43, циклогексан/этилацетат=7:3).
Пример VI
3,5-Дифтор-2-пиридинкарбоксимидамид-гидрохлорид
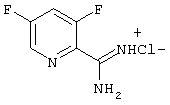
33,4 г (0,624 моль) хлорида аммония суспендируют в 1 л толуола и охлаждают до 0 -5°С. К полученной смеси прикапывают 328 мл триметилалюминия (2 М раствор в гексане, 0,624 моль) и перемешивают при комнатной температуре до окончания выделения метана. Затем прикапывают толуольный раствор 3,5-дихлорпиридинкарбонитрила (раствор из примера 5) и перемешивают до следующего дня при 80°С. После охлаждения до температуры от 0 до -5°С прикапывают метанол до окончания газовыделения, соль отсасывают и промывают 2 раза небольшим количеством метанола. Метанол упаривают на роторе, остаток растворяют в 500 мл смеси дихлорметан/метанол (9: 1) и еще раз отсасывают для освобождения от неорганических солей. После упаривания на роторе остается 23,6 г (39,1%) 3,5-дифтор-2-пиридинкарбоксимидамида в виде гидрохлорида (Т.пл.: 183°С).
1Н-ЯМР (ДМСО-D6): 8,3-8,45 (м, 1Н), 8,8 (д, J=2 Гц, 1Н), 9,7 (с, уш., 4Н) м.д.
Пример VII
Метиловый эфир 2-ацетил-3-(2-хлор-4-фторфенил)-2-пропеновой кислоты
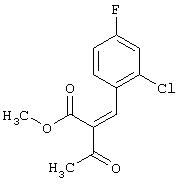
50 г (315 ммоль) 2-Хлор-4-фторбензальдегида и 36,6 г (315 ммоль) метилового эфира ацетоуксусной кислоты растворяют в 150 мл изопропанола и добавляют 1,7 мл пиперидин-ацетата. Смесь перемешивают до следующего дня при комнатной температуре, разбавляют метиленхлоридом и встряхивают с водой; органический слой сушат над сульфатом натрия и упаривают. Полученный сырой продукт в виде смеси цис/транс -изомеров подвергают дальнейшему превращению.
Примеры получения конечных соединений
Пример 1
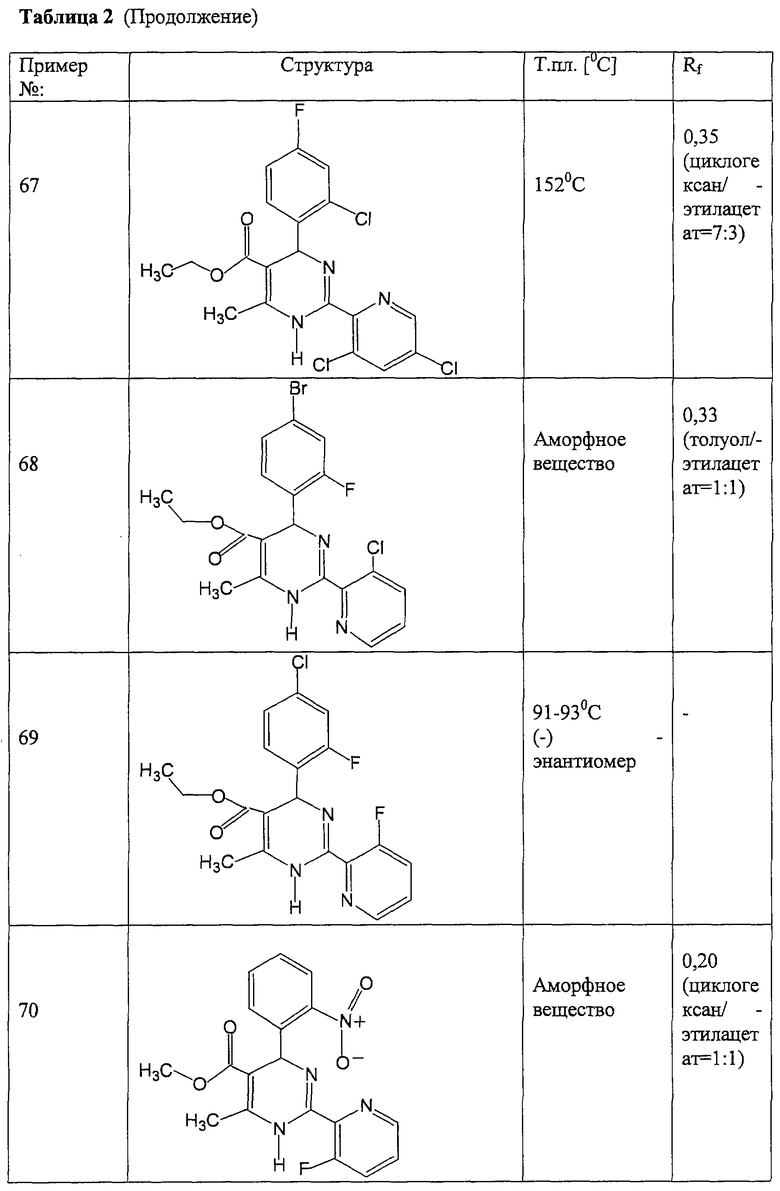
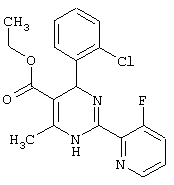
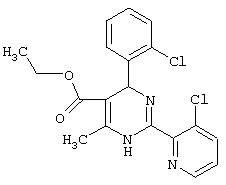
Этиловый эфир 4-(2-бромфенил)-2-(3-фторпиридин-2-ил)-6-метил-1,4-дигидропиримидин-5-карбоновой кислоты
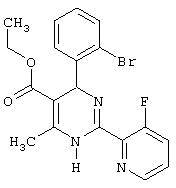
К 92,50 г (500 ммоль) 2-бромбензальдегида в 3,00 мл этанола последовательно добавляют 65,0 г ацетоуксусного эфира, 91,80 г соединения из примера III и 43,06 г ацетата натрия и кипятят 6 часов. Смесь охлаждают, упаривают, остаток растворяют в смеси 2 мл 1N соляной кислоты и 4 мл воды и этилацетата, разделяют слои, органический слой экстрагируют 1 мл 1N соляной кислоты и водой и объединенные водные слои промывают эфиром. Водный слой подщелачивают спиртовым раствором аммиака до щелочной реакции, экстрагируют этилацетатом, промывают водой, сушат и упаривают. Остаток растворяют в небольшом количестве эфира и дают выкристаллизоваться. Полученный осадок отсасывают, промывают эфиром и сушат в вакууме при 60°С. ТСХ (тонкослойная хроматография): чистое вещество (толуол/этлацетат=4: 1)
Выход: 92 мг (44%) Т.пл.: 163-165°С.
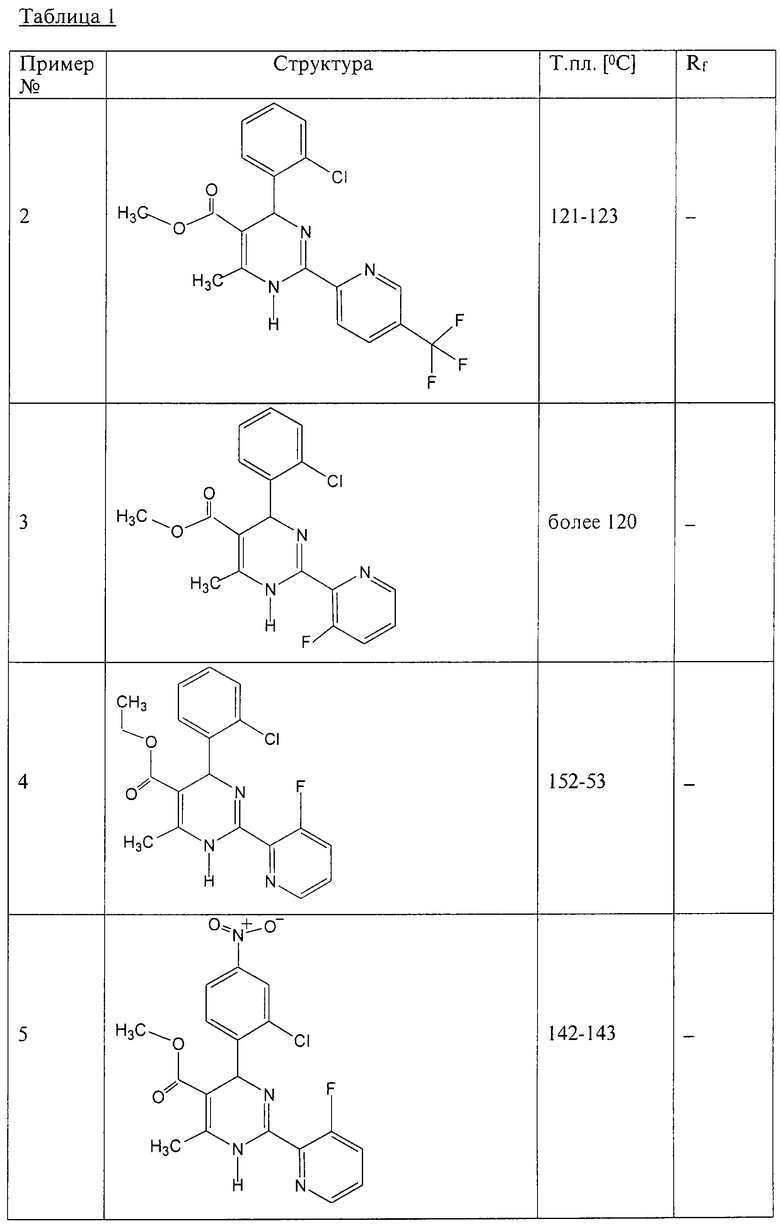
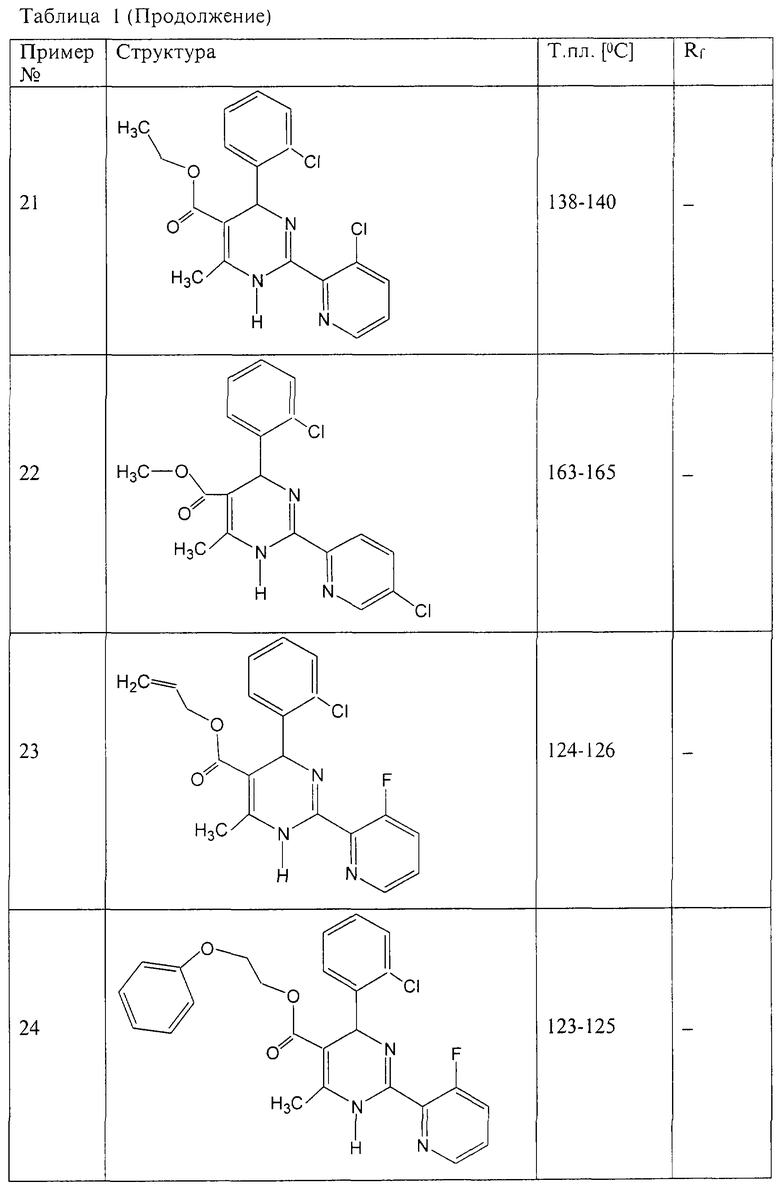
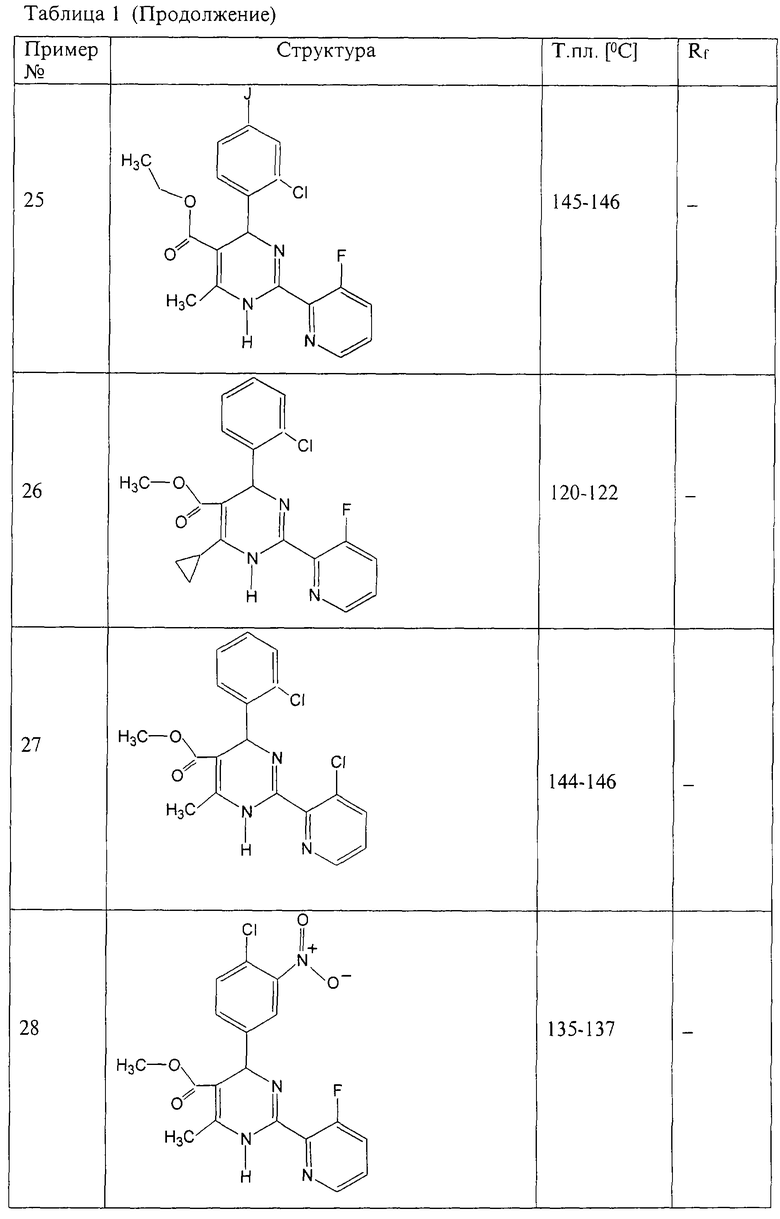
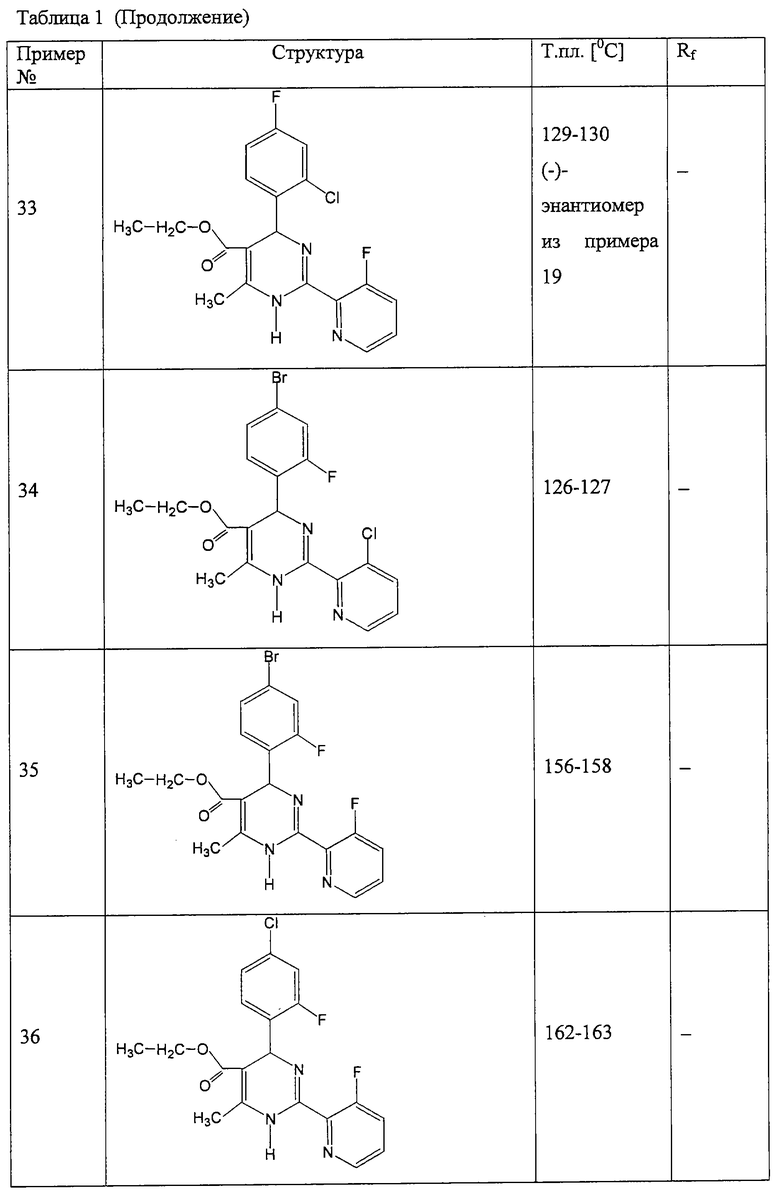
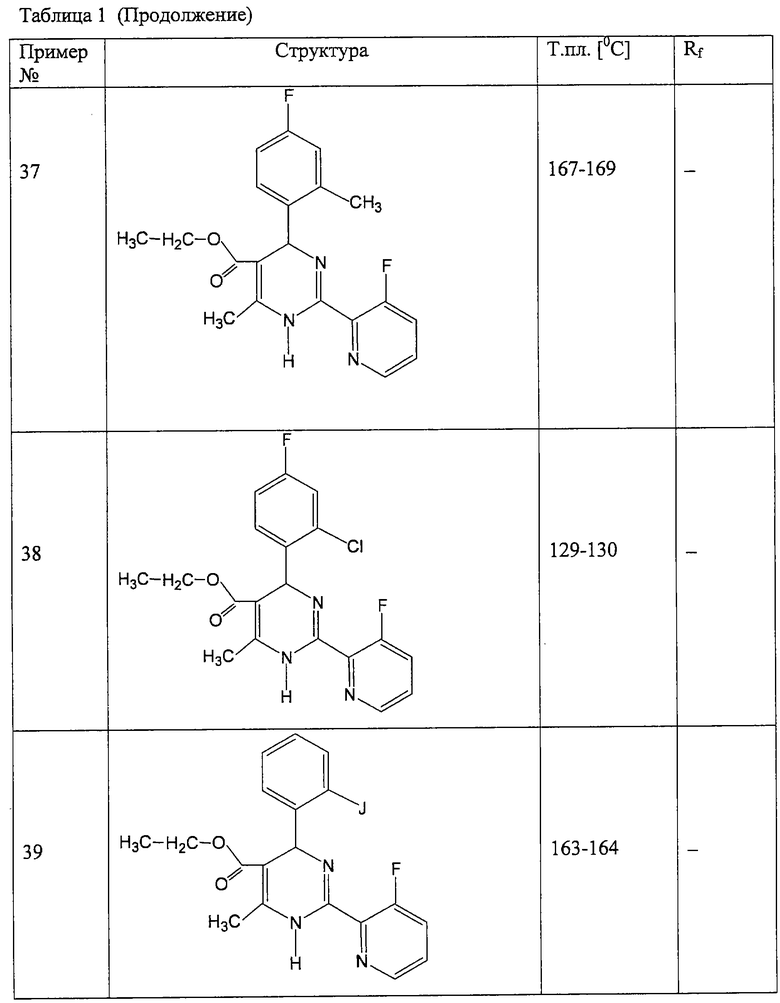
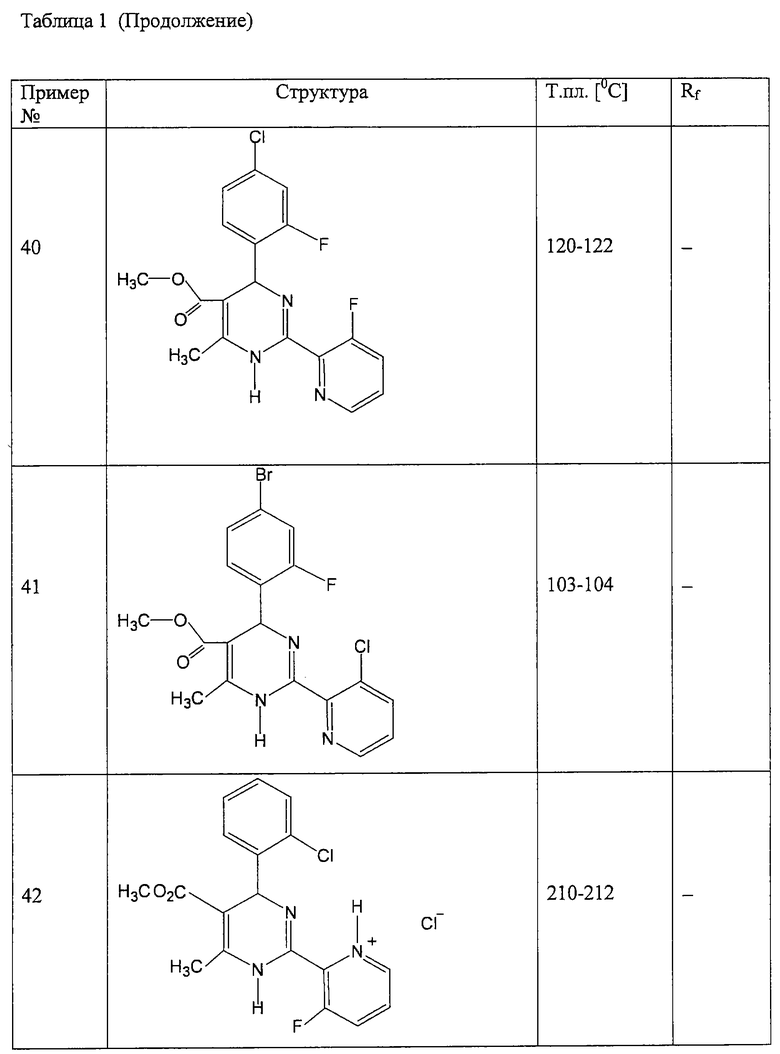
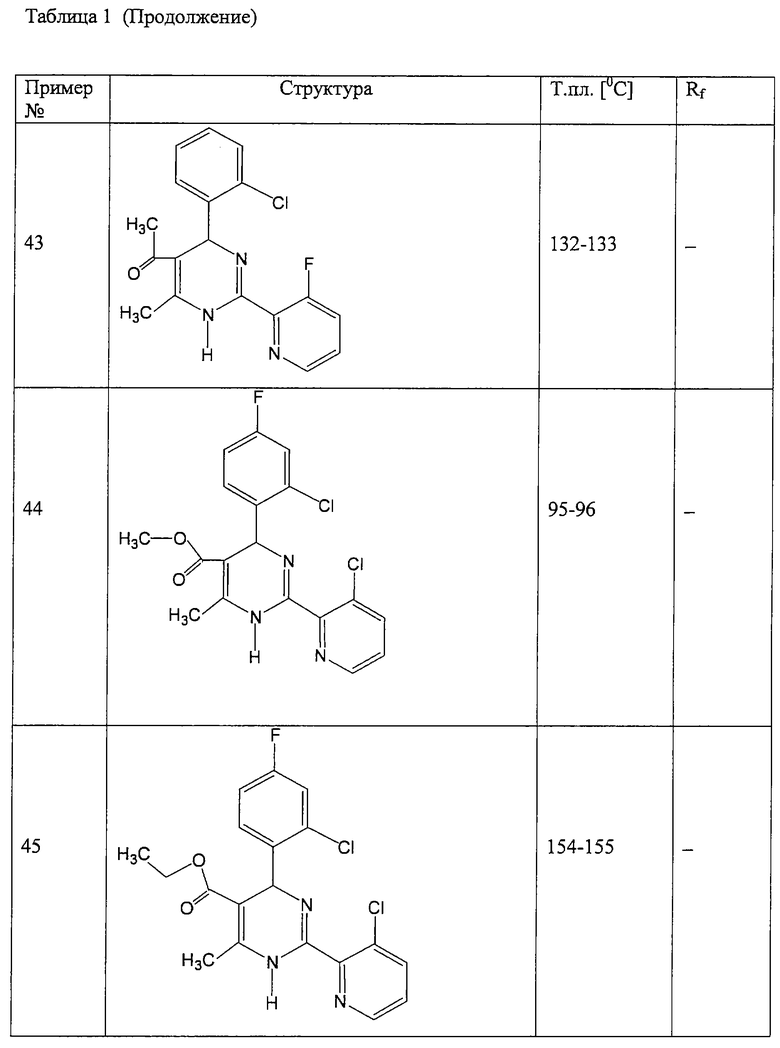
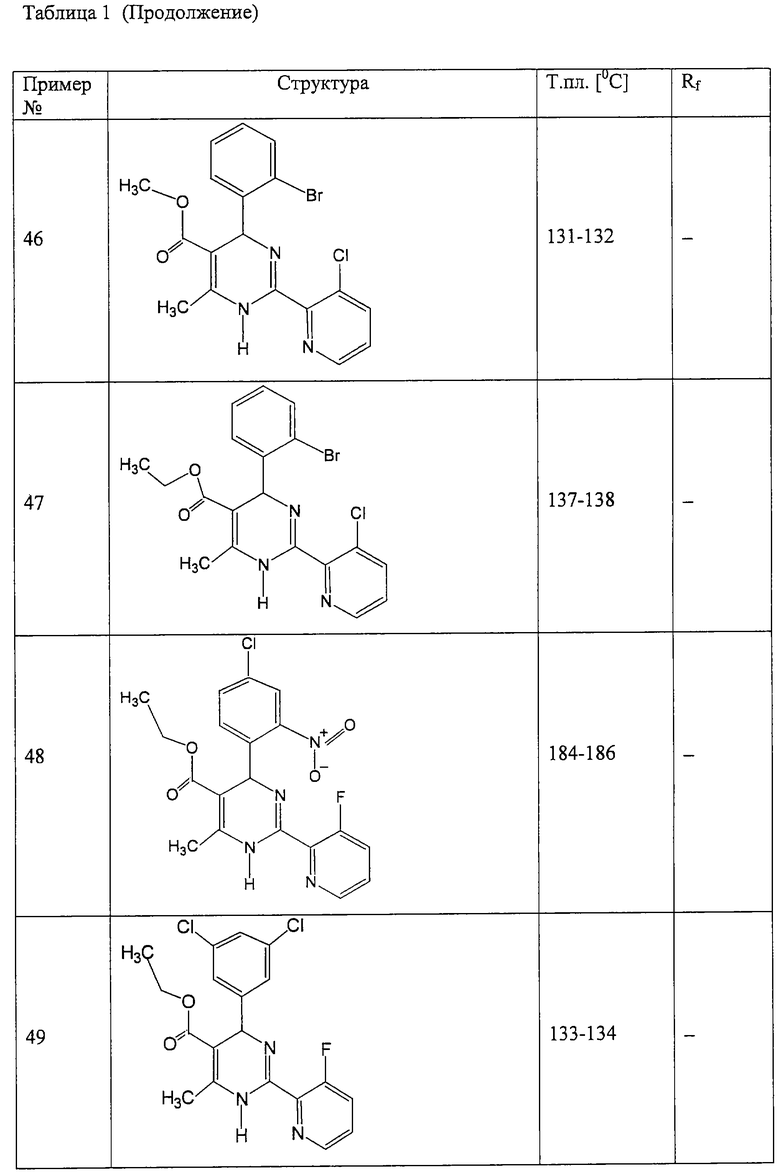
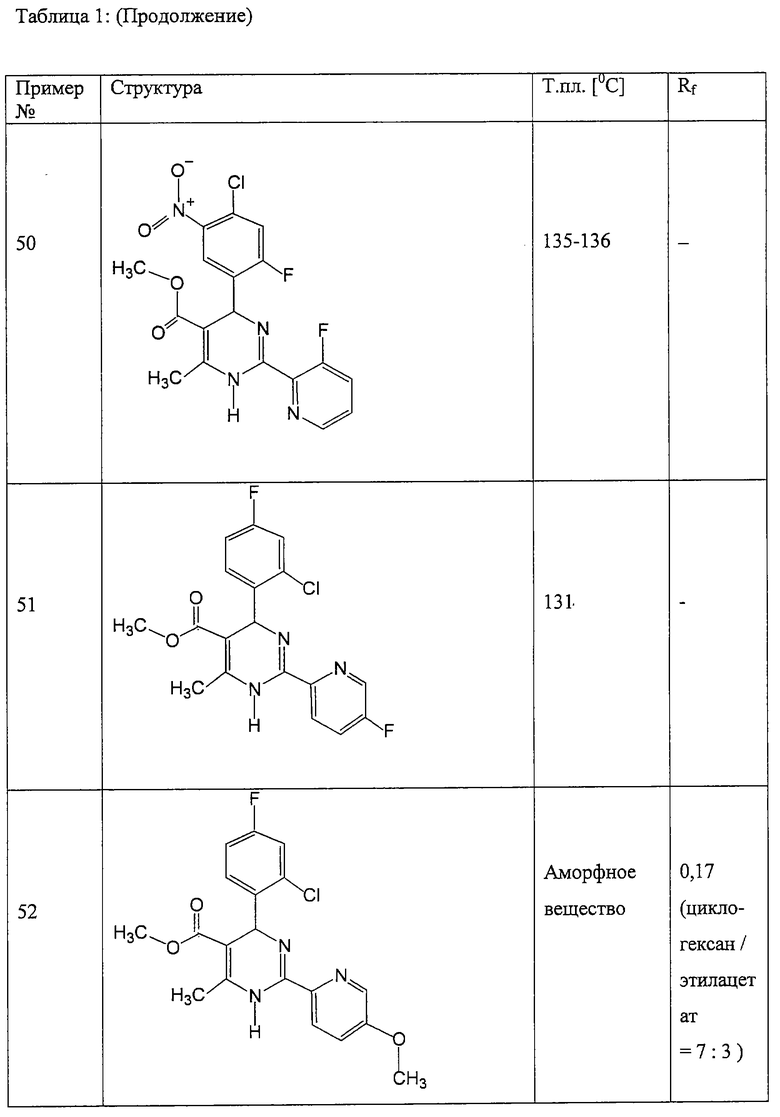
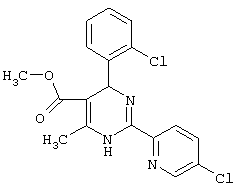
Аналогично методике примера 1 были получены соединения, приведенные в Таблице 1
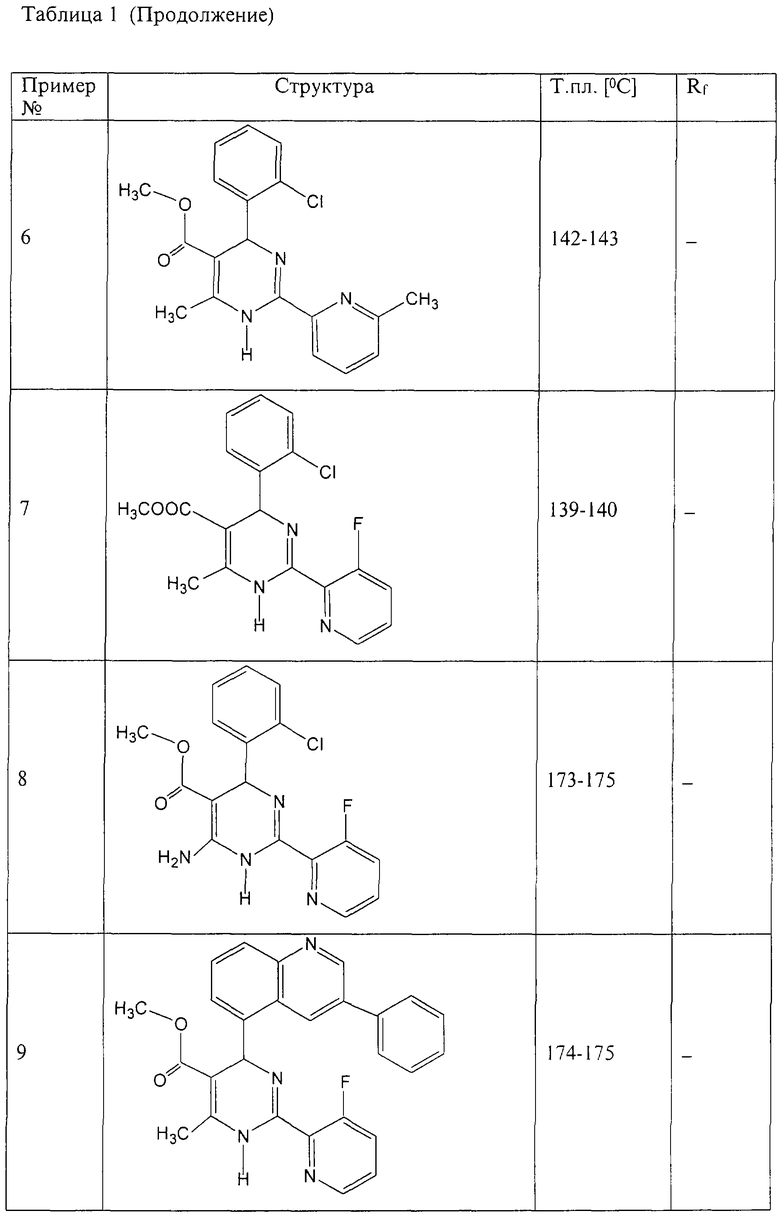
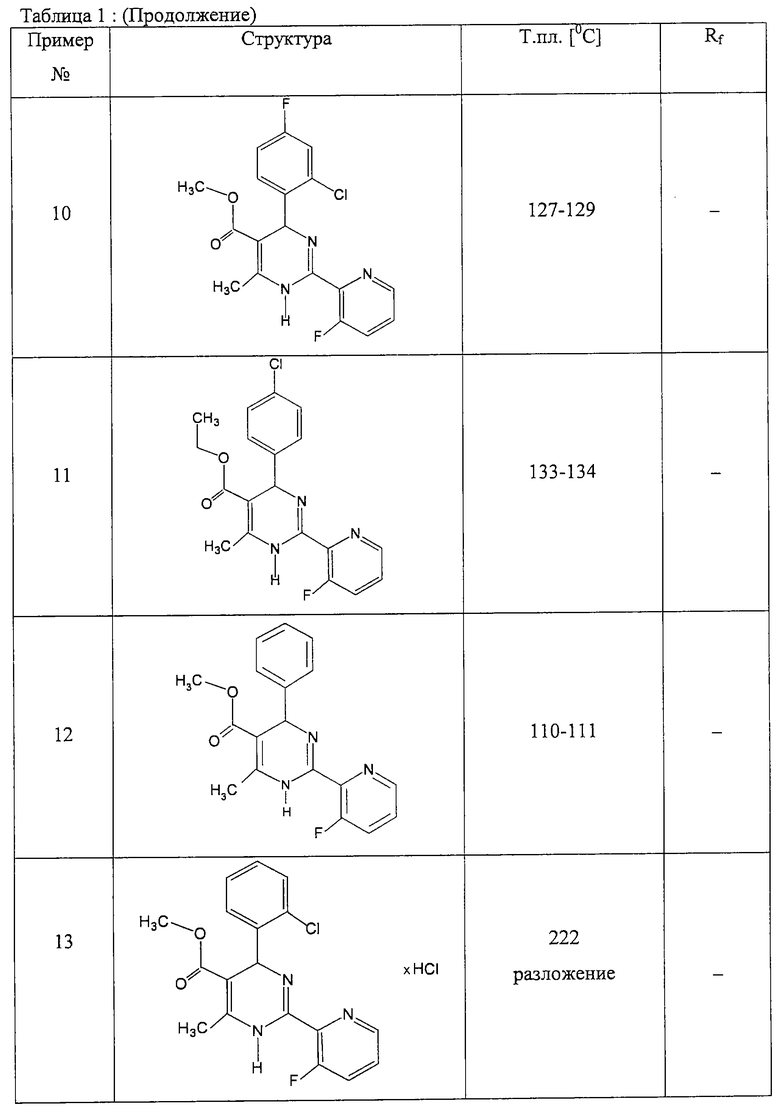
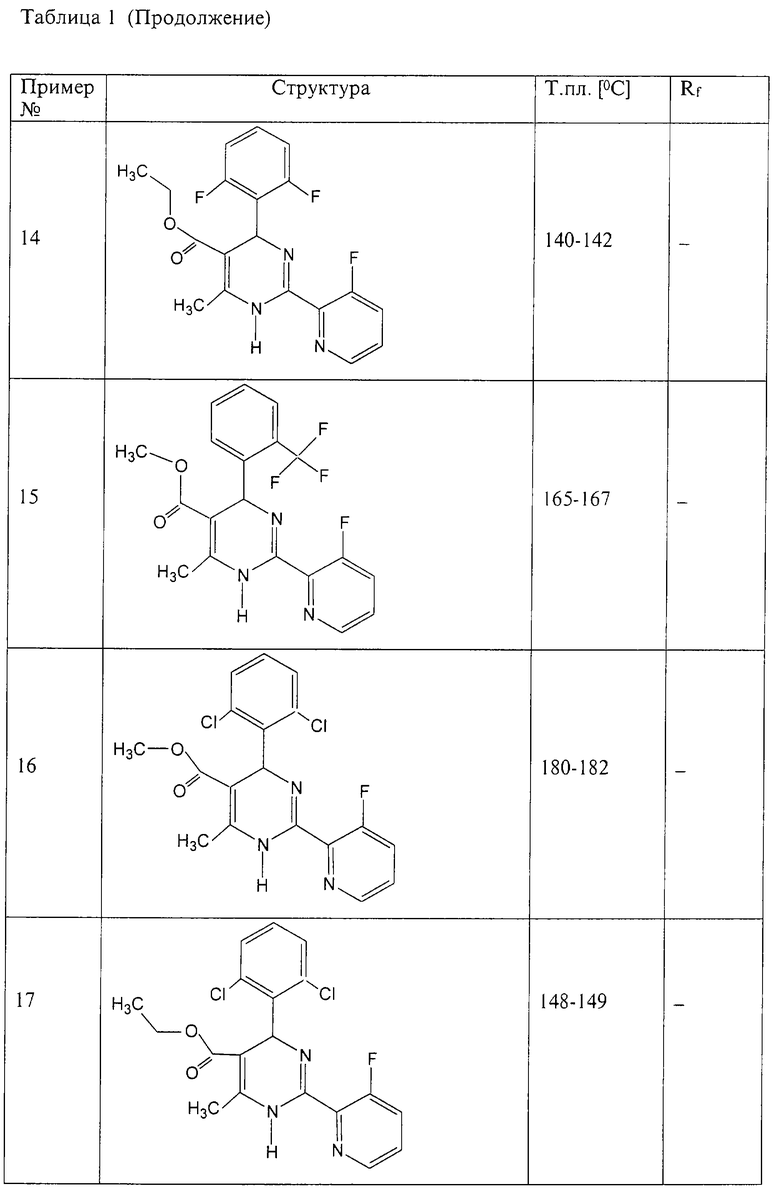
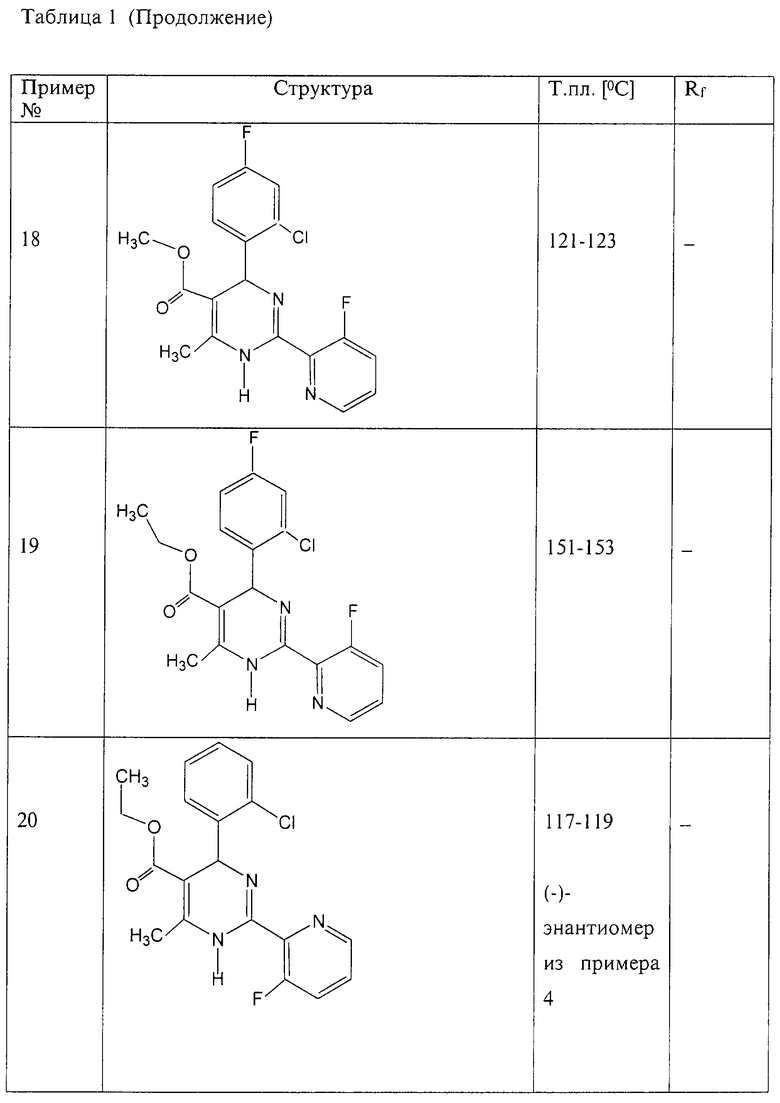

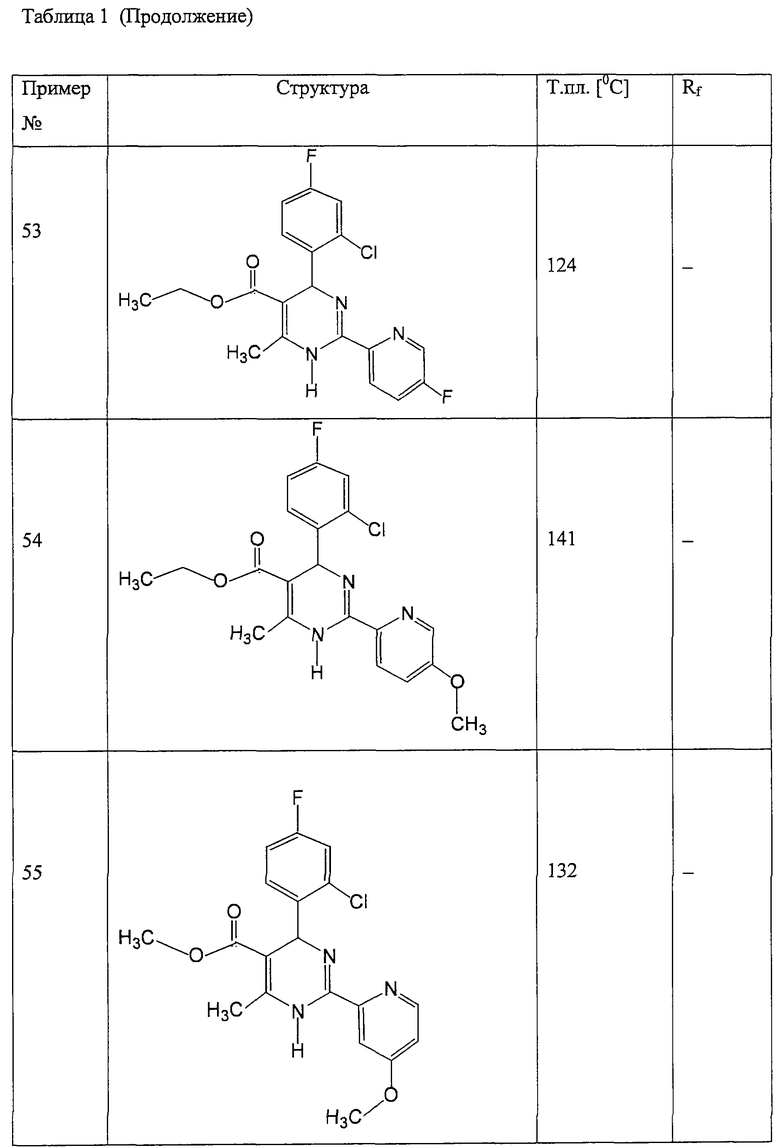
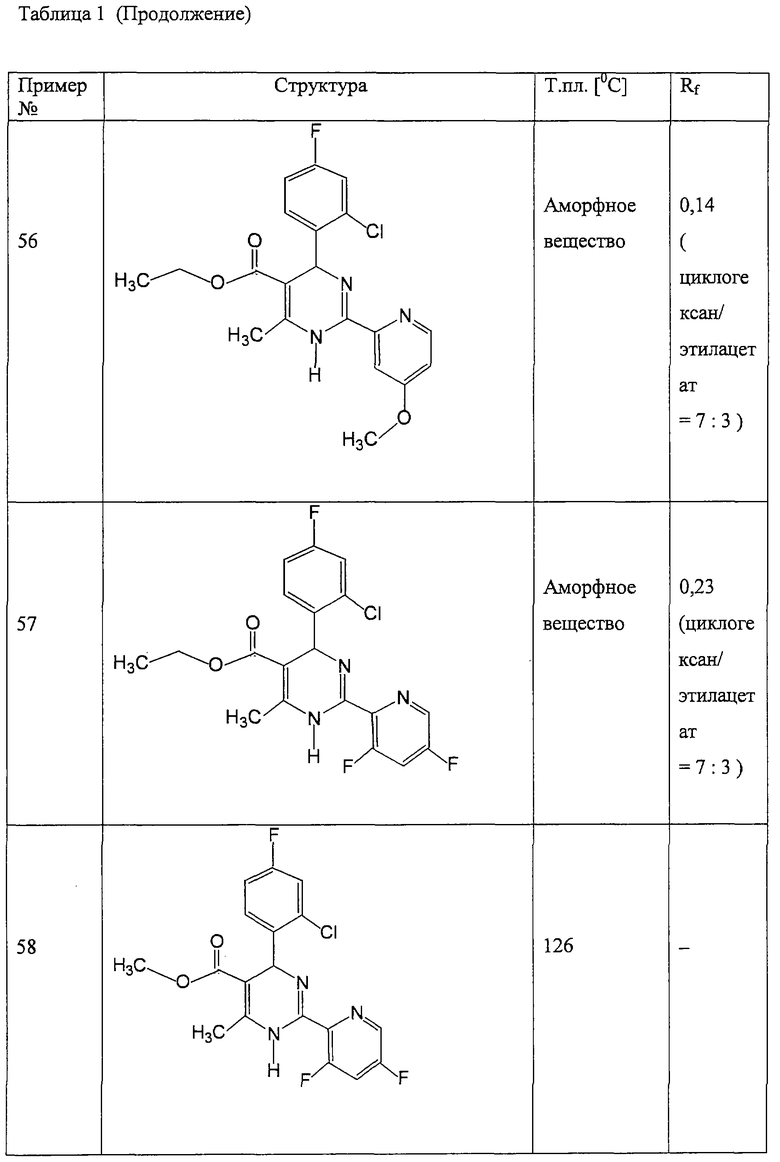
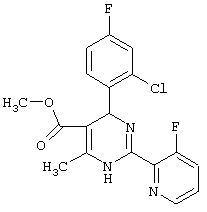
Пример 59
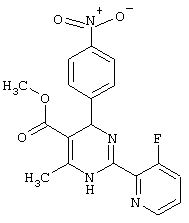
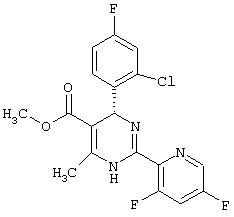
Метиловый эфир
4-(2-хлор-4-фторфенил)-2-(3,5-дифтор-2-пиридинил)-6-метил-1,4-дигидропиримидин-5-карбоновой кислоты (см. Таблицу 2)
4,5 г (23,2 ммоль) 3,5-дифтор-2-пиридинкарбоксимидамид-гидрохлорида (пример VI), 7,7 г (30 ммоль) метилового эфира 2-ацетил-3-(2-хлор-4-фтор-фенил)-2-пропеновая кислота (пример VII) и 2,3 г (27,9 ммоль) ацетата натрия растворяют, соответственно суспендируют в 120 мл изопропанола и кипятят 4 часа с обратным холодильником. После охлаждения до комнатной температуры реакционную смесь отсасывают от неорганических солей и упаривают. Остаток растворяют в 30 мл 1N соляной кислоты и 35 мл этилацетата, и разделяют слои. Слой этилацетата еще раз экстрагируют 30 мл IN соляной кислоты. Объединенные водные слои встряхивают три раза с диэтиловым эфиром, каждый раз, соответственно, по 10 мл. Водные вытяжки подщелачивают гидроксидом натрия до щелочной реакции и встряхивают с этилацетатом. Органические вытяжки сушат над сульфатом натрия и упаривают.
Получают 7,4 г (80%) целевого продукта (Т.пл.: 126°С) 1Н-ЯМР (ДМСО-D6): 2,4 (с, 3Н), 3,5 (с, 3Н), 6,0 (с, 1Н), 7,2 (м, 1Н), 7,4 (м, 2Н), 8,0 (м, 1Н), 8,55 (д, J=2 Гц, 1Н), 9,75 (с, NH) м.д.
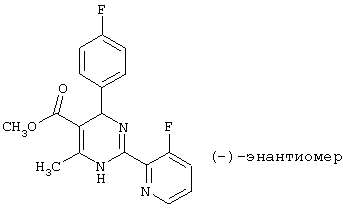
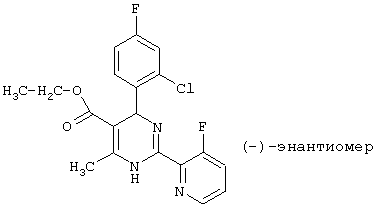
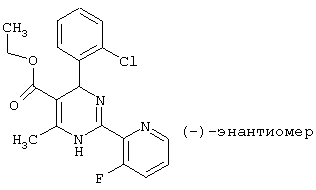
После разделения энантиомеров на хиральных колонках (Chiralpak AS von Baker, элюент н-гептан/этанол=8:2) может быть получен (-) -энантиомер.
Т.пл.: 117°С (из этанола)
Удельное вращение: -62,8° (метанол).
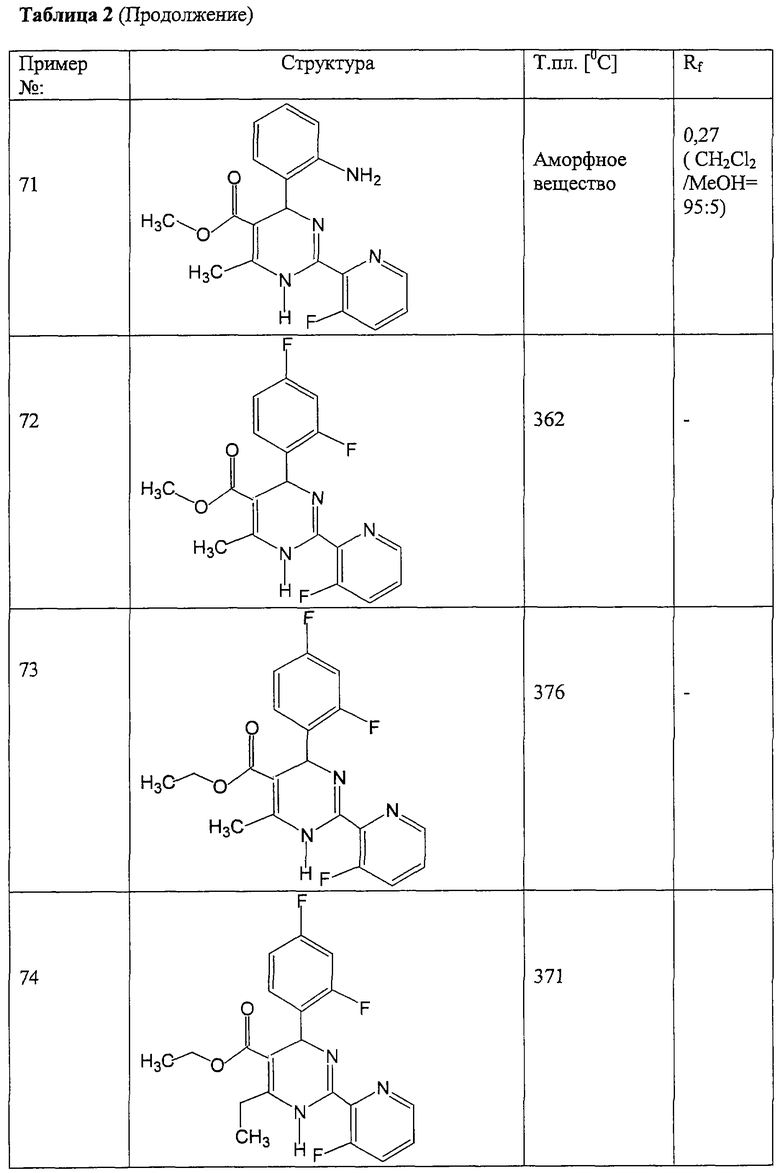
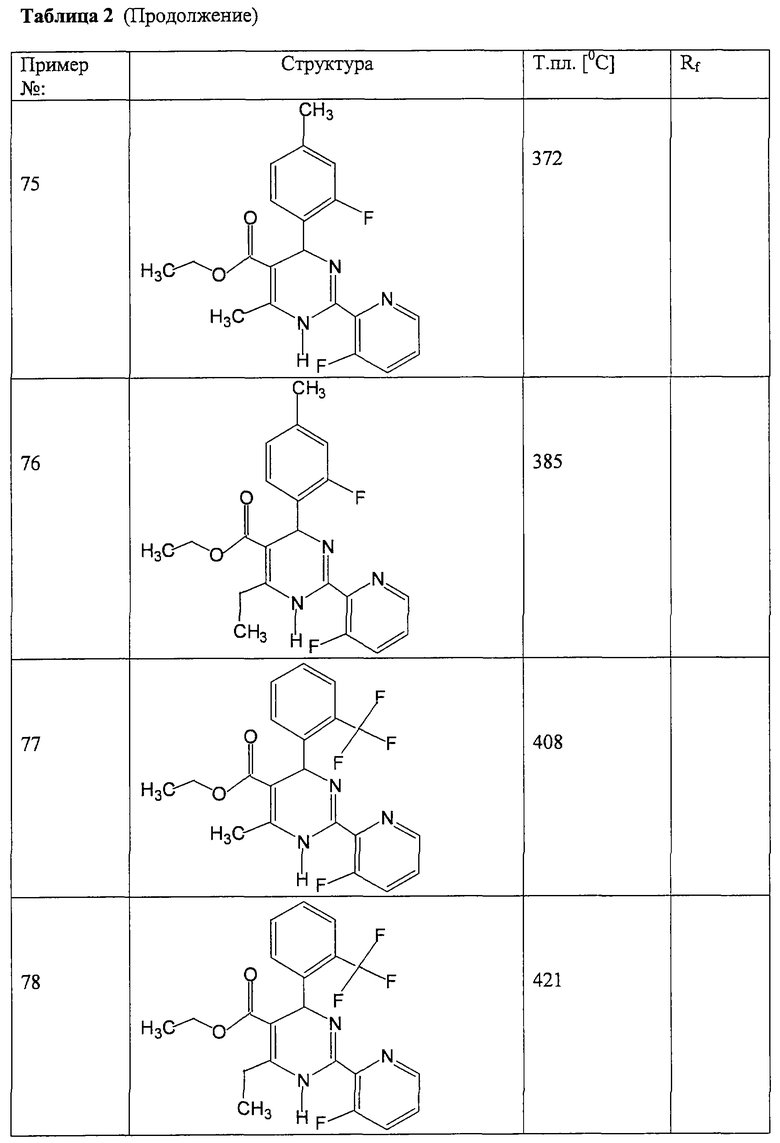
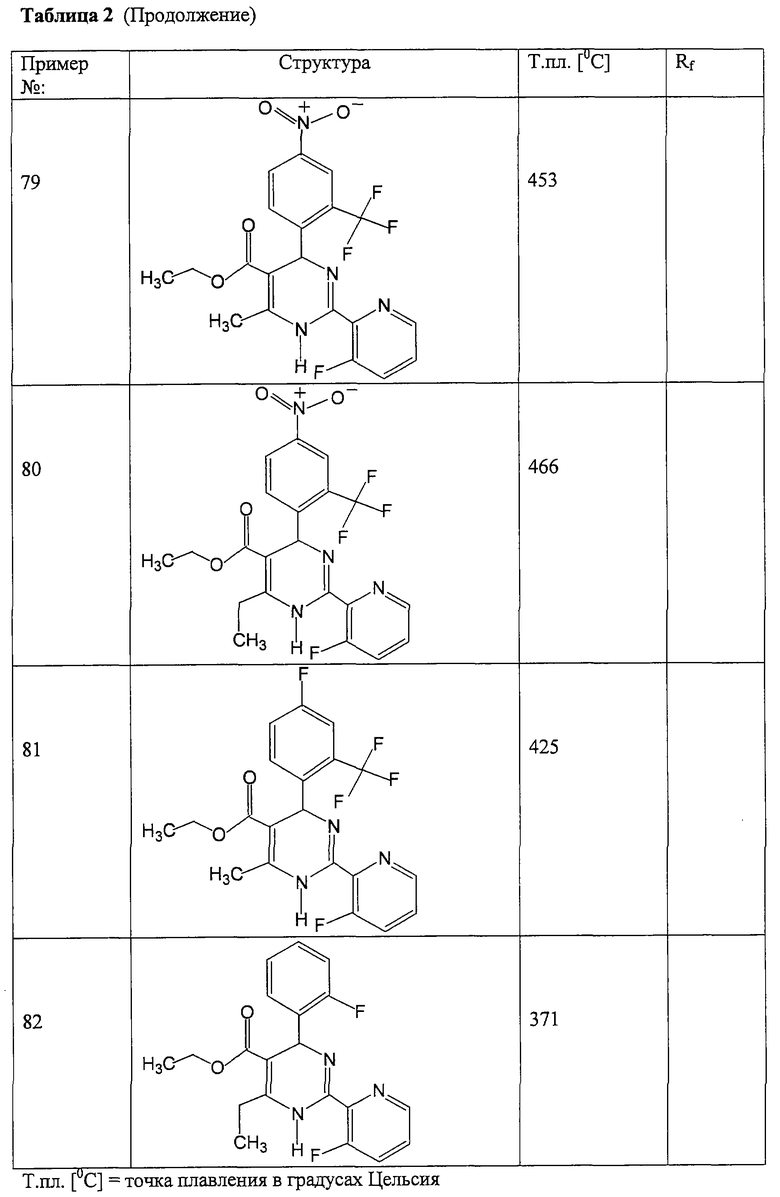
Соединения, полученные по примерам 62-84, представлены в Таблице 2.
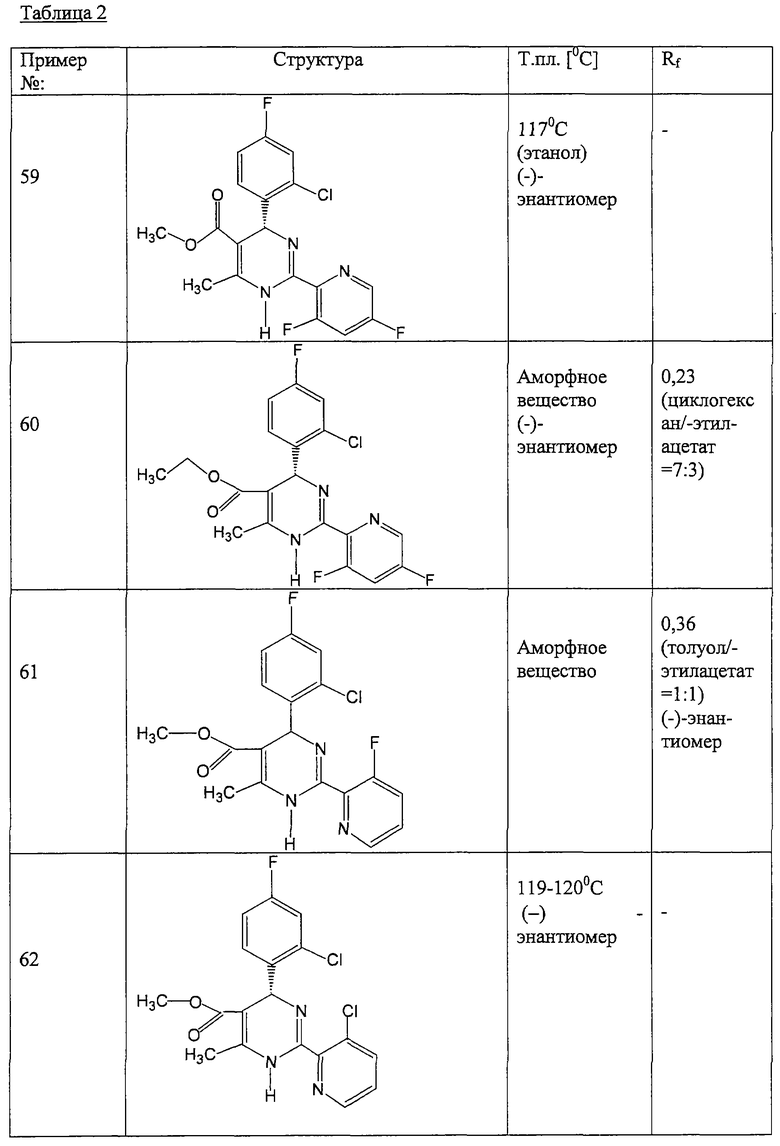
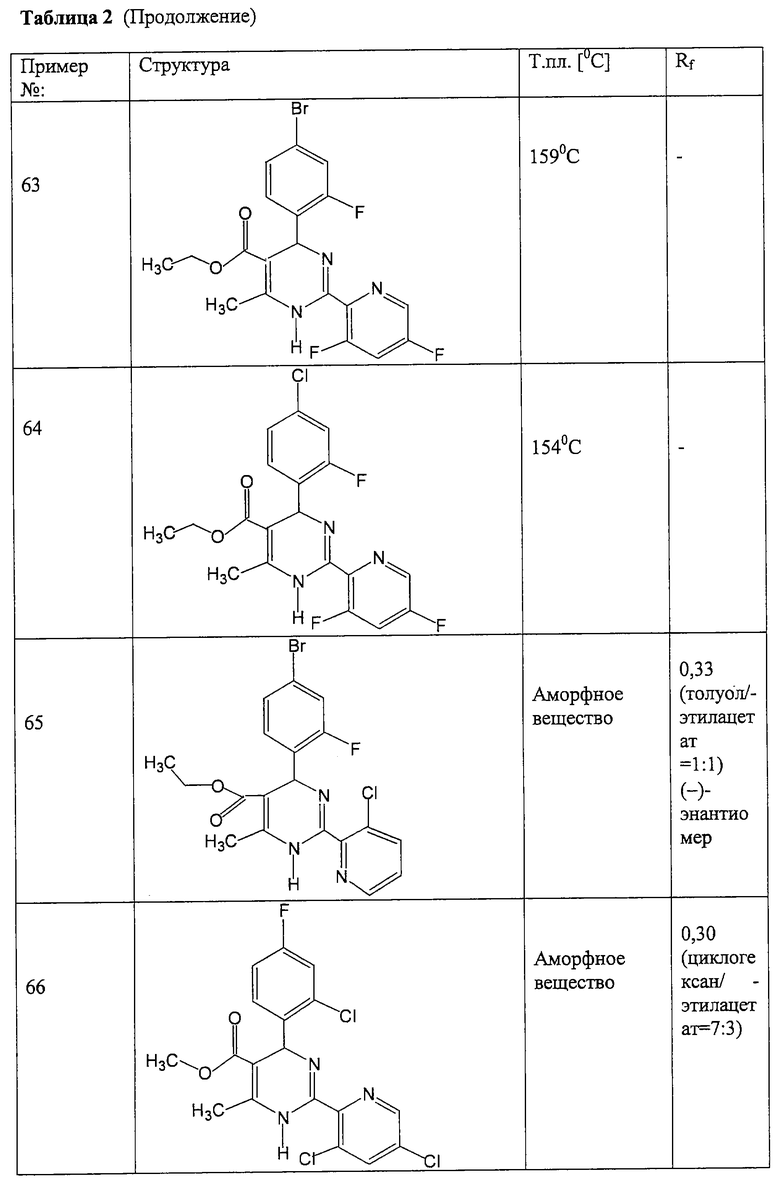
Примеры лекарственных форм
Таблетка
Состав:
100 мг соединения примера 59, 50 мг моногидрата лактозы, 50 мг нативного кукурузного крахмала, 10 мг поливинилпирролидона (продукт PVP 25 фирмы БАСФ, Людвигсхафен, Германия) и 2 мг стеарата магния.
Получение
Смесь соединения примера 59, лактозы и крахмала вместе с 5%-ным раствором поливинилпирролидона гранулируют в воде. Полученный гранулят сушат и смешивают со стеаратом магния в течение 5 минут. Полученную смесь спрессовывают в таблетки весом 212 мг, диаметром 8 мм и радиусом кривизны: 12 мм на обычном таблетировочном прессе.
Орально применяемая суспензия
Состав:
1000 мг соединения примера 59, 1000 мг 96%-ного этанола, 400 мг ксантановой камеди (торговый продукт Rhodigel®(фирмы FMC, Пенсильвания, США) и 99 г воды.
Отдельной дозе 100 мг указанного соединения соответствуют 10 мл орально применяемой суспензии.
Получение:
Ксантановую камедь суспендируют в этаноле и к полученной суспензии добавляют соединение примера 59. Перемешивая, добавляют воду. До завершения набухания ксантановой камеди перемешивают примерно 6 часов.
Орально применяемый раствор
Состав:
500 мг соединения примера 59, 2,5 г полисорбата и 97 г полиэтиленгликоля с молярной массой 400.
Отдельной дозе 100 мг указанного соединения соответствуют 20 г орально применяемого раствора.
Получение:
Указанное соединение при перемешивании суспендируют в смеси полиэтиленгликоля и полисорбата. Перемешивание продолжают до полного растворения указанного соединения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИМИЧЕСКИЕ СОЕДИНЕНИЯ | 2018 |
|
RU2800292C2 |
| ПРОИЗВОДНЫЕ БЕНЗОФУРАНИЛАЛКАН-КАРБОНОВОЙ КИСЛОТЫ, ИЛИ СМЕСЬ ИХ ИЗОМЕРОВ, ИЛИ ОТДЕЛЬНЫЕ ИЗОМЕРЫ, ИЛИ ИХ СОЛИ | 1994 |
|
RU2125564C1 |
| ПРОИЗВОДНЫЕ ЦИКЛОАЛКАНО-ИНДОЛА И АЗАИНДОЛА, СМЕСЬ ИХ ИЗОМЕРОВ ИЛИ ОТДЕЛЬНЫЕ ИЗОМЕРЫ И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ПРОИЗВОДНЫЕ КАРБОНОВОЙ КИСЛОТЫ В КАЧЕСТВЕ ИСХОДНЫХ СОЕДИНЕНИЙ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ ВЫСВОБОЖДЕНИЕ АССОЦИИРОВАННЫХ С АПОЛИПОПРОТЕИНОМ В-100 ЛИПОПРОТЕИНОВ | 1995 |
|
RU2157803C2 |
| 4`-ЗАМЕЩЕННЫЕ НУКЛЕОЗИДЫ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРИГОТОВЛЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ ВИРУСОМ ГЕПАТИТА C (HCV) | 2002 |
|
RU2322989C2 |
| ПРОИЗВОДНОЕ ПИРИДОПИРИМИДИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2019 |
|
RU2778524C2 |
| ПРОИЗВОДНЫЕ ЦИКЛОГЕКСАНКАРБОНОВОЙ КИСЛОТЫ, СМЕСЬ ИХ ИЗОМЕРОВ ИЛИ ОТДЕЛЬНЫЕ ИЗОМЕРЫ И ФИЗИОЛОГИЧЕСКИ ПЕРЕНОСИМЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2140416C1 |
| ЦИКЛИЧЕСКИЕ (АЗА) ИНДОЛИЗИНКАРБОКСАМИДЫ, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ | 2010 |
|
RU2539574C2 |
| ЗАМЕЩЕННЫЕ БЕТА-КАРБОЛИНЫ | 2001 |
|
RU2277095C2 |
| МАКРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ВИРУСА ГЕПАТИТА С | 2006 |
|
RU2486189C2 |
| СПОСОБ ПОДАВЛЕНИЯ ФИТОПАТОГЕННЫХ ГРИБКОВ, ПРОИЗВОДНОЕ БЕНЗОФЕНОНА, СПОСОБ ЗАЩИТЫ РАСТЕНИЙ ОТ ПОВРЕЖДЕНИЯ, ВЫЗВАННОГО ФИТОПАТОГЕННЫМ ГРИБКОМ, ФУНГИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБЫ ПОЛУЧЕНИЯ БЕНЗОФЕНОНОВ | 1996 |
|
RU2129788C1 |
Изобретение относится к новым производным дигидропиримидина общей формулы (I)
 ,
,
или ее изомерной формы (Ia)
которые могут быть использованы, например, для лечения и профилактики Гепатита В. В указанных формулах R1 означает фенил, незамещенный или замещенный однократно или многократно одинаковыми или различными заместителями, выбранными из группы, включающей галоген, трифторметил, нитро, амино, гидроксил и алкил с 1-6 атомами углерода, или остатки формул
 ,
,
R2 - остаток формулы -XR5, где Х означает связь или атом кислорода, R5 означает алкенил с 2-4 атомами углерода или алкил с 1-4 атомами углерода, незамещенные или замещенные феноксигруппой, R3 - амино, алкил с 1-4 атомами углерода или циклопропил, R4 - пиридил, который замещен до трех раз одинаковыми или различными заместителями, выбранными из группы, включающей галоген, трифторметил, алкокси с 1-6 атомами углерода и алкил с 1-6 атомами углерода, и их соли. Изобретение также относится к 3,5-дифтор-2-пиридинкарбоксиимидамиду и 3,5-дифтор-2-пиридинкарбонитрилу, которые могут быть использованы как промежуточные продукты для получения соединений формулы I или Ia, и к лекарственному средству. 4 н. и 6 з.п.ф-лы, 4 табл.
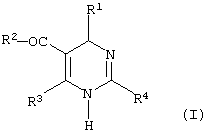
или ее изомерной формы (Ia)
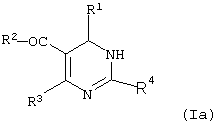
в которой R1 - фенил, незамещенный или замещенный однократно или многократно одинаковыми или различными заместителями, выбранными из группы, включающей галоген, трифторметил, нитро, амино, гидроксил и алкил с 1-6 атомами углерода, или остатки формул
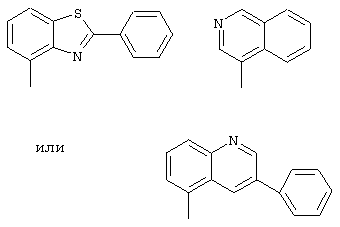 ,
,
R2 - остаток формулы -XR5, где Х означает связь или атом кислорода, R5 означает алкенил с 2-4 атомами углерода или алкил с 1-4 атомами углерода, незамещенные или замещенные феноксигруппой;
R3 - амино, алкил с 1-4 атомами углерода или циклопропил,
R4 - пиридил, который замещен до трех раз одинаковыми или различными заместителями, выбранными из группы, включающей галоген, трифторметил, алкокси с 1-6 атомами углерода и алкил с 1-6 атомами углерода,
и их соли.
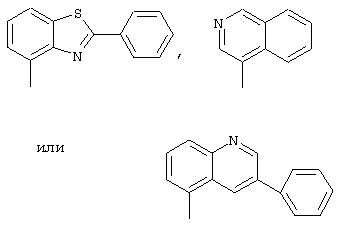 ,
,
R2 - остаток формулы -XR5, где Х означает связь или атом кислорода, R5 означает алкенил с 2-4 атомами углерода и алкил с 1-4 атомами углерода, незамещенные или замещенные феноксигруппой;
R3 - амино, алкил с 1-4 атомами углерода или циклопропил;
R4 - пиридил, который замещен до двух раз одинаковыми или различными заместителями, выбранными из группы, включающей фтор, хлор, бром, алкокси с 1-4 атомами углерода и алкил с 1-4 атомами углерода,
и их соли.
 ,
,
R2 - остаток формулы -XR5, где Х означает связь или атом кислорода, R5 означает алкенил с 2-3 атомами углерода и алкил с 1-4 атомами углерода, незамещенные или замещенные феноксигруппой; R3 - амино; R4 - пиридил, который замещен до двух раз одинаковыми или различными заместителями, выбранными из группы, включающей фтор, хлор, алкокси с 1-3 атомами углерода и алкил с 1-3 атомами углерода, и их соли.
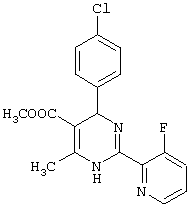
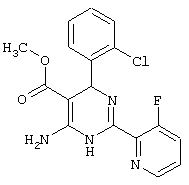
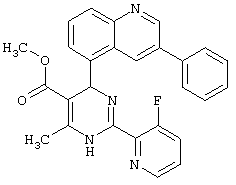
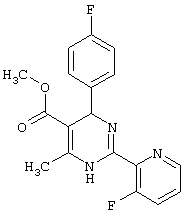
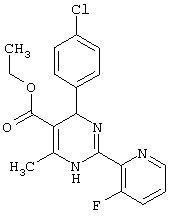
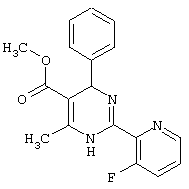
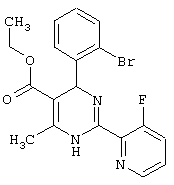
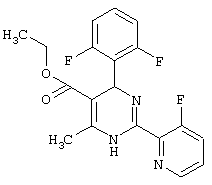


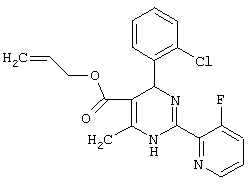
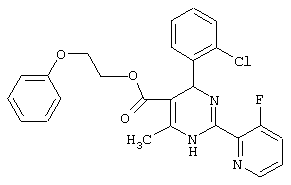
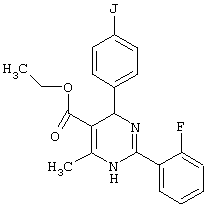

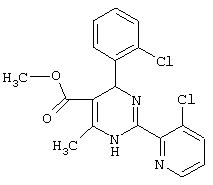
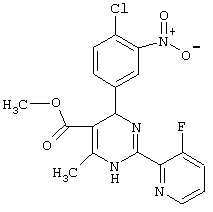
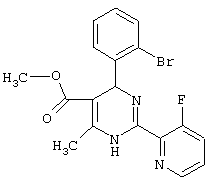
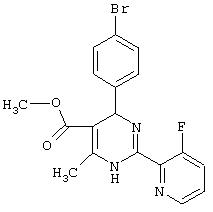
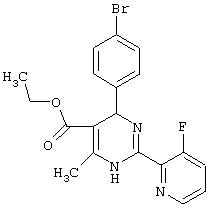
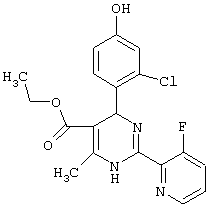
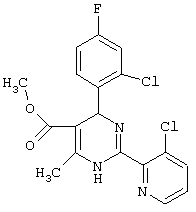
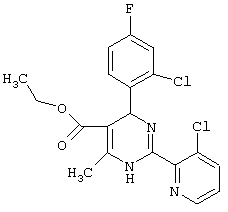
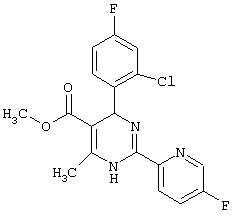
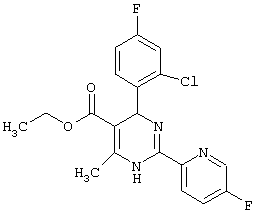
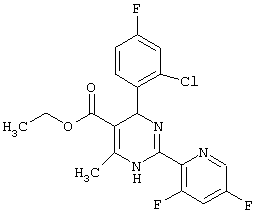
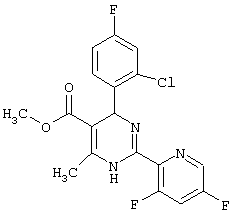
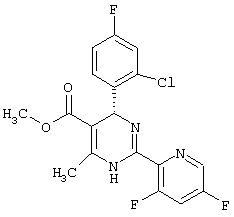
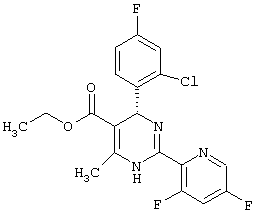
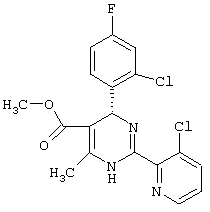
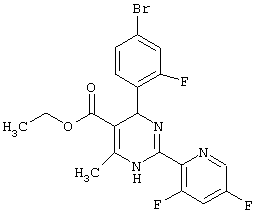
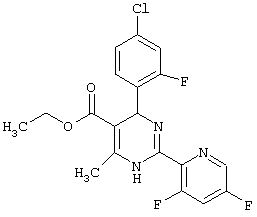

или их соли.
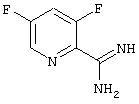
и его соли, представляющие собой промежуточные продукты для получения производных пиримидинкарбоновой кислоты формулы (I) по п.1.
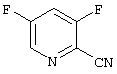
представляющий собой промежуточный продукт для получения производных пиримидинкарбоновой кислоты формулы (I) по п.1.
| СПОСОБ УСТАНОВКИ НАГРЕВАТЕЛЬНЫХ ЭЛЕМЕНТОВ | 0 |
|
SU169712A1 |
| Прибор для определения частоты сердцебиения | 1955 |
|
SU103796A1 |
| WO 9011281A1, 04.10.1990 | |||
| JP 60185764 A, 21.09.1985 | |||
| Способ получения бета-фторпиридинов | 1984 |
|
SU1376942A3 |
| HIROKAMI SHUNICHI et all | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| of Organic Chemistry,1987,52(12),p.2455-68 | |||
| Прибор для испытания эластомерных материалов на многократное двумерное растяжение | 1980 |
|
SU1041906A1 |
Авторы
Даты
2005-02-10—Публикация
1999-04-07—Подача