Настоящее изобретение относится к фармацевтическим композициям замедленного высвобождения допаминергических соединений, включающих S-2-[(бензиламино)метил]-2,3,8,9-тетрагидро-7H-1,4-диоксино[2,3-e]индол-8-он (аплиндор) и его фармацевтически приемлемые соли.
Сообщалось, что соединения, имеющие структуру 2-(аминометил)-2,3,8,9-7Н4-диоксино[2,3-e]индол-8-она, обладают значительной активностью в отношении допаминового рецептора, а также способностью модулировать синтез допамина. См. патент США 5756532, введенный посредством ссылки во всей его полноте для всех целей. Эти соединения полезны для лечения и профилактики различных допаминергических расстройств, включающих шизофрению, шизоаффективное расстройство, симптомы болезни Паркинсона, синдром Туретта, психоз при болезни Льюиса-Боди, психоз при болезни Альцгеймера, гиперлактинемию, наркоманию и острую манию при биполярных расстройствах. Мощный и селективный частичный агонист D2/D3 аплиндор (S-2-[(бензиламино)метил]-2,3,8,9-тетрагидро-7H-1,4-диоксино[2,3-e]индол-8-он) был идентифицирован как лекарственное средство для больных шизофренией.
Введение аплиндора приводит к высоким начальным концентрациям лекарственного средства. Такая картина "немедленного” высвобождения может создать трудности, которые включают невозможность поддерживать оптимальные уровни воздействия во времени и неприятные побочные эффекты ввиду наличия слишком большой начальной дозы. Таким образом, имеется значительная потребность в композициях аплиндора регулируемого высвобождения, способных к повышению Тмакс и/или уменьшению Смакс без снижения суммарного воздействия лекарственного средства. Данное изобретение направлено на достижение этих, а также других важных целей.
В некоторых вариантах осуществления настоящее изобретение предлагает лекарственные препараты регулируемого высвобождения, содержащие соединение формулы I:
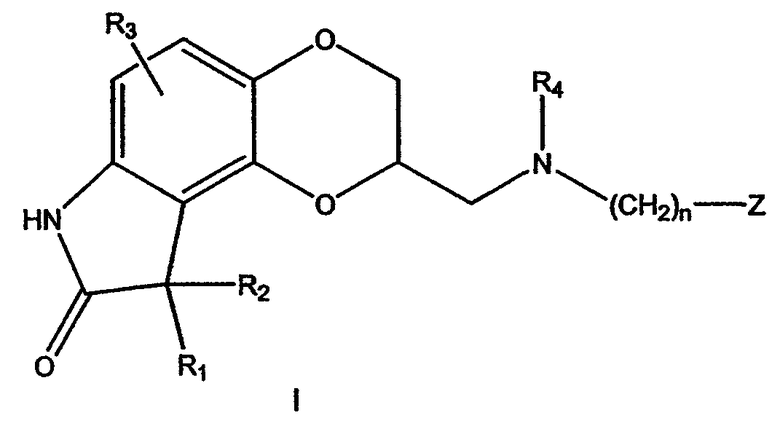
в которой:
R1 и R2 независимо представляют водород, алкил с 1-6 атомами углерода, фенил или бензил;
или R1 и R2, взятые вместе, представляют бензилиден, необязательно замешенный R3, который определен ниже, или алкилиден, имеющий до 6 атомов углерода;
или R1 и R2, взятые вместе с атомом углерода, к которому они присоединены, образуют карбонильный фрагмент или циклоалкильную группу, имеющую от 3 до 6 атомов углерода;
R3 представляет водород, гидрокси, галоген, трифторметил, трифторметокси, алкил с 1-6 атомами углерода, алкокси с 1-6 атомами углерода, арилалкокси с 7-12 атомами углерода, алканоилокси с 2-6 атомами углерода, аминогруппу, моно- или диалкиламиногруппу, в которой каждая алкильная группа имеет от 1 до 6 атомов углерода, алканамидо с 2-6 атомами углерода или алкансульфонамидо с 1-6 атомами углерода;
R4 представляет водород или алкил с 1-6 атомами углерода;
n равно одному из целых чисел 0, 1, 2, 3, 4, 5 или 6;
Z представляет водород, гидрокси, алкил с 1-6 атомами углерода, алкенил с 2-6 атомами углерода, алкинил с 2-6 атомами углерода, алкокси с 1-6 атомами углерода, циклоалкил с 3-8 атомами углерода, полициклический алкил с 7-15 атомами углерода, фенил, необязательно замещенный R3, как определено выше, феноксигруппу, необязательно замещенную R3, как определено выше, нафтил, необязательно замещенный R3, как определено выше, или нафтилоксигруппу, необязательно замещенную R3, как определено выше, гетероарил или гетероарилоксигруппу, в которой гетероциклическое кольцо гетероарильной или гетероарилоксигруппы выбрано из тиофена, фурана, пиридина, пиразина, пиримидина, индола, индазола, имидазола, хромана, кумарина, карбостирила, хинолина, бензиоксазола, бензоксазола, пиразола, пиррола, тиазола, оксазола или изоксазола и гетероциклическое кольцо необязательно замещено R3, как определено выше,
или его фармацевтически приемлемую соль.
В некоторых предпочтительных вариантах осуществления настоящего изобретения соединением является 2-[(бензиламино)метил]-2,3,8,9-тетрагидро-7H-1,4-диоксино[2,3-e]индол-8-он или его фармацевтически приемлемая соль. В некоторых особо предпочтительных вариантах осуществления настоящего изобретения соединением является S-2-[(бензиламино)метил]-2,3,8,9-тетрагидро-7H-1,4-диоксино[2,3-e]индол-8-он (аплиндор) или его фармацевтически приемлемая соль.
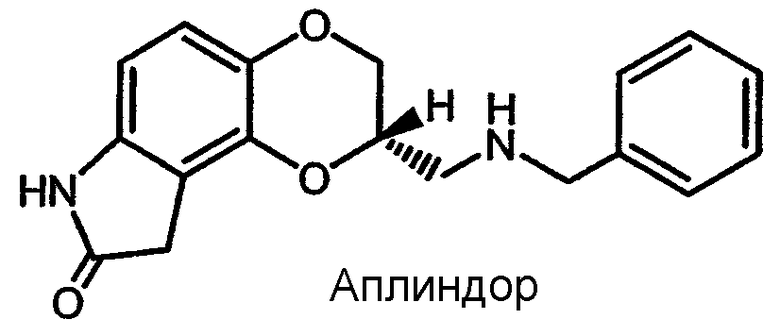
В некоторых предпочтительных вариантах осуществления настоящего изобретения каждым из описываемых лекарственных препаратов регулируемого высвобождения соединением является аплиндора фумарат.
В некоторых вариантах осуществления настоящего изобретения лекарственный препарат регулируемого высвобождения представляет собой пероральную дозированную композицию.
В некоторых вариантах осуществления настоящего изобретения препарат содержит одну или несколько микрочастиц, которые могут быть, например, пилюлями, бусинами, таблетками, сфероидами или сочетанием двух или более из них.
В некоторых вариантах осуществления лекарственных препаратов регулируемого высвобождения для перорального применения настоящего изобретения соединение высвобождается из указанной дозированной формы со скоростью, эффективной для того, чтобы увеличить время достижения максимальной терапевтической концентрации (т.е. Тмакс) по сравнению с Тмакс лекарственного препарата мгновенного высвобождения, например, так, чтобы Тмакс композиции регулируемого высвобождения было по меньшей мере примерно в 1,5 раза, 2 раза, 3 раза, 4 раза, 5 раз или 6,5 раз больше, чем Тмакс лекарственного препарата мгновенного высвобождения.
В некоторых вариантах осуществления настоящего изобретения соединение высвобождается из указанной дозированной формы со скоростью, эффективной для того, чтобы снизить максимальную терапевтическую концентрацию указанного соединения (т.е. Смакс) по сравнению с Смакс лекарственного препарата мгновенного высвобождения, например, так, чтобы Смакс препарата регулируемого высвобождения была меньше, чем примерно 0,75, 0,60, 0,50 или 0,40 от Смакс лекарственного препарата мгновенного высвобождения.
В некоторых вариантах осуществления лекарственных препаратов регулируемого высвобождения для перорального применения настоящего изобретения соединение высвобождается из препарата со скоростью, эффективной для того, чтобы увеличить фармацевтически эффективную концентрацию соединения в млекопитающем в течение периода времени (т.е. площадь под кривой (ППК) зависимости концентрации в плазме (сыворотке или крови) от времени, такая как ППК0-12) относительно лекарственного препарата мгновенного высвобождения, например, так, чтобы ППК0-12 препарата регулируемого высвобождения было по меньшей мере примерно в 1,05 раз, 1,2 раза, 1,3 раза или 1,4 раза больше чем ППК0-12 лекарственного препарата мгновенного высвобождения.
В некоторых вариантах осуществления настоящего изобретения соединение высвобождается из 0,1 мг дозированной формы со скоростью, эффективной для обеспечения площади под кривой (ППК) зависимости концентрации в плазме (сыворотке или крови) от времени от нуля до 12 часов (ППК0-12) примерно от 260 пкг*ч/мл до примерно 2400 пкг*ч/мл, тогда как для других таких вариантов осуществления ППК0-12 составляет примерно от 290 пкг*ч/мл до примерно 1300 пкг*ч/мл. ППК может быть измерена так, как описано в Principles of Drug Action: The Basis of Pharmacology, 3rd Ed., W.B. Pratt & P. Taylor, eds. (Churchill Livingstone: New York) 1990. В некоторых вариантах осуществления настоящего изобретения 5 мг соединения обеспечивают ППКss (площадь под кривой в стационарном состоянии от 0 до 12 часов) примерно от 36000 пкг*ч/мл до примерно 109000 пкг*ч/м, тогда как другие обеспечивают ППКss примерно от 36000 пкг*ч/мл до примерно 75000 пкг*ч/мл. В некоторых вариантах осуществления настоящего изобретения 30 мг соединения обеспечивают ППК0-12 примерно от 121000 пкг*ч/мл до примерно 890000 пкг*ч/мл, тогда как другие такие осуществления настоящего изобретения обеспечивают ППК0-12 примерно от 170000 пкг*ч/мл до примерно 760000 пкг*ч/мл.
В некоторых вариантах осуществления настоящего изобретения соединение высвобождается из 0,1 мг дозированной формы со скоростью, эффективной для обеспечения максимальной концентрации в плазме (сыворотке или крови) (Смакс) примерно от 40 пкг/мл до примерно 190 пкг/мл, и в других таких вариантах осуществления примерно от 40 пкг/мл до примерно 180 пкг/мл. Максимальную концентрацию в плазме измеряли так, как описано в Principles of Drug Action: The Basis of Pharmacology, 3rd Ed., W.B. Pratt & P. Taylor, eds. (Churchill Livingstone: New York) 1990; Human Pharmacology: Molecular to Clinic, K. Kist, ed. (Mosby-Year Books: Philadelphia, 1991. В некоторых вариантах осуществления настоящего изобретения 5 мг соединения обеспечивают Смакс примерно от 4000 пкг/мл до примерно 14000 пкг/мл, тогда как в других таких вариантах осуществления Смакс составляет примерно от 6000 пкг/мл до примерно 12000 пкг/мл. В некоторых вариантах осуществления настоящего изобретения 30 мг соединения обеспечивают Смакс примерно от 18000 пкг/мл до примерно 110000 пкг/мл; в других таких вариантах осуществления Смакс составляет примерно от 20000 пкг/мл до примерно 92000 пкг/мл.
В некоторых вариантах осуществления настоящего изобретения дозы постепенно увеличивали (т.е. титровали) во времени (например, сутки или недели) до желаемой дозы, чтобы избежать или уменьшить тяжесть возможных побочных эффектов, таких как тошнота или другие проявления непереносимости у пациента. Например, некоторые варианты осуществления настоящего изобретения предлагают вводить увеличивающиеся дозы с постепенным приращением, где начальная доза находится в интервале примерно от 0,05 мг до примерно 0,4 мг в сутки. В других вариантах осуществления дозы увеличивают с постепенным приращением за период времени до конечной дозы, какова она есть, или в каждый последующий день вводят более высокую дозу, которая может находиться в интервале, например, от 2 мг до 75 мг в сутки. В других вариантах осуществления период титрования дозы до достижения конечной дозы составляет по меньшей мере около 3 суток, по меньшей мере около 5 суток, по меньшей мере около 12 суток или по меньшей мере около 15 суток.
В других вариантах осуществления применяют набор дозированных форм регулируемого высвобождения, который содержит множество отдельных дозированных форм регулируемого высвобождения, где две или более из указанных отдельных дозированных форм содержат различные количества соединения. Отдельная дозированная форма может быть одной единичной дозой (например, одной таблеткой или капсулой) или может включать многократные единичные дозы (например, 2 или более таблеток или капсул). В некоторых вариантах осуществления настоящего изобретения набор дозированных форм регулируемого высвобождения имеет 2 или более отдельных дозированных форм регулируемого высвобождения, содержащих начальную дозу и конечную дозу (где конечную дозу или дозу с большим количеством вводят по дням позднее, и конечная доза выше начальной дозы). Например, набор может содержать две или более различные отдельные дозированные формы регулируемого высвобождения, в диапазоне примерно от 0,05 мг до примерно 30 мг соединения. В других вариантах осуществления набор лекарственных препаратов регулируемого высвобождения имеет по меньшей мере две или более отдельных дозированных форм, выбранных из 0,05 мг, 0,1 мг, 0,2 мг, 0,25 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,75 мг, 1 мг, 1,5 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 8 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 20 мг, 23 мг, 24 мг, 25 мг, 26 мг или 30 мг указанного соединения.
В некоторых вариантах осуществления настоящего изобретения набор дозированных форм регулируемого высвобождения имеет по меньшей мере две отдельные дозированные формы регулируемого высвобождения, содержащие различное количество соединения, причем количество соединения в каждой из различных дозированных форм отличается по меньшей мере на десять процентов, и, более предпочтительно, по меньшей мере на 20 процентов. В других вариантах осуществления каждая из отдельных дозированных форм обеспечивает ППК0-12 в интервале примерно от 260 пкг*ч/мл до примерно 890000 пкг*ч/мл.
В некоторых вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения содержат по меньшей мере некоторое количество микрочастиц, которые включают инертное ядро, слой активного соединения, отложенный на инертное ядро, и покрытие, включающее по меньшей мере один регулирующий скорость высвобождения полимер, нанесенное на слой соединения. В некоторых вариантах осуществления настоящего изобретения все микрочастицы включают инертное ядро, слой соединения и покрытие.
В некоторых вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения содержат по меньшей мере некоторое количество микрочастиц, которые включают инертное ядро, слой покрытия, нанесенный на инертное ядро, слой покрытия, включающий соединение и по меньшей мере один регулирующий скорость высвобождения полимер. В некоторых вариантах осуществления настоящего изобретения все микрочастицы включают инертное ядро и покрывающий слой.
В следующих вариантах осуществления препараты регулируемого высвобождения для перорального применения содержат по меньшей мере некоторое количество микрочастиц, которые включают ядро, которое включает активное соединение, и слой покрытия, нанесенный на ядро, включающий по меньшей мере один регулирующий скорость высвобождения полимер. В некоторых вариантах осуществления настоящего изобретения все микрочастицы включают ядро, которое содержит соединение, и покрывающий слой.
В некоторых вариантах осуществления лекарственных препаратов регулируемого высвобождения для перорального применения настоящего изобретения процентное содержание по массе активного соединения в композиции составляет примерно от 1% до примерно 25%, предпочтительно примерно от 2% до примерно 15%, предпочтительно примерно от 5% до примерно 10%.
В некоторых вариантах осуществления лекарственных препаратов регулируемого высвобождения для перорального применения настоящего изобретения препарат включает капсулы, содержащие микрочастицы. В некоторых вариантах осуществления настоящего изобретения микрочастицы спрессованы в таблетку или пилюлю.
В некоторых вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения включают одну или несколько гранул. В некоторых вариантах осуществления настоящего изобретения гранулы дополнительно включают покрытие, которое дополнительно включает по меньшей мере один регулирующий скорость высвобождения полимер. В некоторых вариантах осуществления настоящего изобретения гранулы содержатся внутри капсулы.
В некоторых вариантах осуществления лекарственных препаратов регулируемого высвобождения для перорального применения настоящего изобретения препарат дополнительно содержит один или несколько ингредиентов, выбранных из наполнителей, дезинтегрантов, эксципиентов и сочетаний двух или нескольких из них. В некоторых вариантах осуществления настоящего изобретения гранулы и ингредиенты спрессовывают в таблетки.
В некоторых вариантах осуществления лекарственных препаратов регулируемого высвобождения для перорального применения настоящего изобретения процентное содержание по массе активного соединения в препарате составляет примерно от 1% до примерно 25%, предпочтительно примерно от 2% до примерно 15%, предпочтительно примерно от 5% до примерно 10%.
В некоторых вариантах осуществления лекарственных препаратов регулируемого высвобождения для перорального применения настоящего изобретения препарат включает восковую матрицу, предпочтительно, когда препарат представляет собой таблетку. В некоторых вариантах осуществления настоящего изобретения воск присутствует в количестве по массе примерно от 10 до примерно 60%, предпочтительно примерно от 20% до примерно 40%.
В некоторых вариантах осуществления настоящего изобретения воск включает воск карнаба, цетостеариловый спирт, жирные кислоты или смесь двух или нескольких из них. В некоторых вариантах осуществления настоящего изобретения содержащее воск средство дополнительно включает по меньшей мере один регулирующий скорость высвобождения полимер.
В некоторых вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения включают полиэтиленоксидную матрицу, предпочтительно, когда форма представляет собой таблетку. В некоторых вариантах осуществления настоящего изобретения таблетка включает полиэтиленоксидную матрицу.
В некоторых вариантах осуществления настоящего изобретения полиэтиленоксид присутствует в количестве по массе примерно от 5 до примерно 40%, предпочтительно примерно от 10% до примерно 20% от средства.
В некоторых вариантах осуществления настоящего изобретения лекарственный препарат регулируемого высвобождения представляет собой таблетку, которая включает по меньшей мере один регулирующий скорость высвобождения полимер. В некоторых предпочтительных вариантах осуществления настоящего изобретения дозированная форма представляет собой совместно спрессованную таблетку. В некоторых предпочтительных вариантах осуществления настоящего изобретения совместно спрессованная таблетка включает ядро и внешнее спрессованное покрытие, где ядро включает активное соединение и по меньшей мере один регулирующий скорость высвобождения полимер. В следующих вариантах осуществления совместно спрессованная таблетка включает ядро и внешнее спрессованное покрытие, где спрессованное покрытие включает по меньшей мере один регулирующий скорость высвобождения полимер. В некоторых предпочтительных вариантах осуществления настоящего изобретения совместно спрессованная таблетка включает ядро и внешнее спрессованное покрытие, где каждое из ядра и спрессованного покрытия включает активное соединение и по меньшей мере один независимо выбранный регулирующий скорость высвобождения полимер. В некоторых предпочтительных вариантах осуществления настоящего изобретения ядро и внешнее спрессованное покрытие каждое содержит по меньшей мере одну образующую матрицу гидроксипропилметилцеллюлозу высокой вязкости, и по меньшей мере одну образующую матрицу гидроксипропилметилцеллюлозу низкой вязкости. Предпочтительно, образующий матрицу полимер низкой вязкости включает гидроксипропилметилцеллюлозу, выбранную из Methocel K100LV, Methocel E50LV, Methocel E5, Methocel E15LV или комбинации двух или нескольких из них, и образующий матрицу полимер высокой вязкости включает гидроксипропилметилцеллюлозу, выбранную из Methocel K4M, Methocel K15M, Methocel K100M, Methocel E4M или комбинаций двух или нескольких из них. В некоторых особо предпочтительных вариантах осуществления настоящего изобретения образующий матрицу полимер низкой вязкости включает Methocel K100LV, и образующий матрицу полимер высокой вязкости включает Methocel K4M.
В некоторых вариантах осуществления лекарственных препаратов регулируемого высвобождения для перорального применения настоящего изобретения препарат включает по меньшей мере один образующий матрицу полимер, который предпочтительно выбирают из восков, смол, гидроксипропилметилцеллюлоз, гтдроксиэтилцеллюлоз, гидроксипропилцеллюлоз, карбаполов, полиметилакрилатов, полиэтиленоксидов и комбинаций двух или нескольких из них.
В некоторых вариантах осуществления лекарственных препаратов регулируемого высвобождения для перорального применения настоящего изобретения активное соединение содержится в количестве примерно от 0,02% до примерно 16 мас.%, предпочтительно примерно от 0,02% до примерно 4% от массы препарата.
В некоторых вариантах осуществления лекарственных препаратов регулируемого высвобождения для перорального применения настоящего изобретения препараты включают одну гидроксипропилметилцеллюлозу высокой вязкости и одну гидроксипропилметилцеллюлозу низкой вязкости. Предпочтительно образующий матрицу полимер высокой вязкости включает гидроксипропилметилцеллюлозу, выбранную из Methocel K4M, Methocel K15M, Methocel K100M, Methocel E4M и комбинаций двух или нескольких из них. Предпочтительно гидроксипропилметилцеллюлоза присутствует в количестве по массе примерно от 15% до примерно 80%, предпочтительно примерно от 25% до примерно 50%, и предпочтительно представляет собой Methocel K4M. Предпочтительно гидроксипропилметилцеллюлоза низкой вязкости включает Methocel K100LV, Methocel E50LV, Methocel E5, Methocel E15LV или комбинацию двух или нескольких из них, предпочтительно в количестве по массе примерно от 15% до примерно 80%, предпочтительно примерно от 20% до примерно 50%, и предпочтительно представляет собой Methocel K100LV.
В некоторых вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения могут содержать водорастворимый эксципиент, предпочтительно в количестве по массе вплоть до 50%, предпочтительно в количестве по массе примерно от 2% до примерно 25%. В некоторых предпочтительных вариантах осуществления эксципиентом является сахар.
В некоторых вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения могут включать диспергируемый в воде эксципиент, которым предпочтительно является микрокристаллическая целлюлоза, коллоидальная двуокись кремния, силицированная микрокристаллическая целлюлоза, крахмал, сверхдезинтегрант или комбинация двух или нескольких из них. Предпочтительно диспергируемый в воде эксципиент присутствует в количестве по массе примерно от 2% до примерно 50%, предпочтительно примерно от 5% до примерно 25%.
В некоторых вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения включают один или несколько антиоксидантов, стабилизаторов, хелатирующих агентов, модификаторов кислотного рН, модификаторов щелочного рН или комбинации двух или нескольких из них.
В некоторых вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения включают одно или несколько связующих, агентов, повышающих текучесть, лубрикантов или модификаторов растворимости, которыми может являться поверхностно-активное вещество, кислотное соединение или щелочное соединение.
В некоторых вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения включают покрытие, которое включает водорастворимый полимер и краситель и/или рН-зависимый полимер, регулирующий скорость высвобождения, рН-независимый полимер, регулирующий скорость высвобождения, или их комбинацию.
В некоторых из предшествующих лекарственных препаратов регулируемого высвобождения для перорального применения дозированная форма включает один или несколько регулирующих скорость высвобождения полимеров, которыми могут быть, например, один или несколько из полиметилакрилатов, сополимеров метакриловой кислоты - эфира метакриловой кислоты, фталата ацетата целлюлозы, этилцеллюлозы, фталата поливинилацетата, фталата гидроксипропилметилцеллюлозы или комбинаций двух или нескольких из них. В некоторых предпочтительных вариантах осуществления настоящего изобретения регулирующим скорость высвобождения полимером может быть один или несколько из полиметилакрилатов, сополимеров метакриловой кислоты - эфира метакриловой кислоты, этилцеллюлозы или комбинаций двух или нескольких из них.
В следующих вариантах осуществления регулирующий скорость высвобождения полимер выбирают из образующих матрицу гидроксипропилметилцеллюлоз высокой вязкости, и из образующих матрицу гидроксипропилметилцеллюлоз низкой вязкости
В некоторых вариантах осуществления настоящего изобретения образующую матрицу гидроксипропилметилцеллюлозу высокой вязкости выбирают из Methocel K4M, Methocel K15M, Methocel K100M, Methocel E4M и комбинаций двух или нескольких из них.
В некоторых вариантах осуществления настоящего изобретения образующую матрицу гидроксипропилметилцеллюлозу низкой вязкости выбирают из Methocel K100LV, Methocel E50LV, Methocel E5, Methocel E15LV и комбинаций двух или нескольких из них.
В некоторых вариантах осуществления настоящего изобретения регулирующий скорость высвобождения полимер включает один или несколько из Eugradit RS, Eugradit RL, сюрелеазы или комбинацию двух или нескольких из них.
В некоторых вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения содержат один или несколько из модификаторов растворимости, например поверхностно-активных веществ, кислотных соединений, основных соединений и их комбинации.
В некоторых вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения содержат один или несколько из антиоксидантов, модификаторов рН, агентов, образующих хелаты металлов, или комбинации двух или нескольких из них.
В следующих вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения могут содержать один или несколько из наполнителей, дезинтегрантов, связующих или комбинации двух или нескольких из них.
В некоторых вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения содержат один или несколько наполнителей, связующих, дезинтегрантов, лубрикантов, стабилизаторов, модификаторов рН, антиоксидантов или комбинации двух или нескольких из них.
В некоторых предпочтительных вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения содержат фармацевтически эффективное количество активного соединения, гидроксипропилметилцеллюлозу высокой вязкости в количестве примерно от 20% до примерно 60 мас.%, и гидроксипропилметилцеллюлозу низкой вязкости в количестве примерно от 20% до примерно 60 мас.%.
В некоторых следующих вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения содержат фармацевтически эффективное количество активного соединения, водорастворимый компенсирующий эксципиент в количестве примерно от 0,5% до примерно 5 мас.%, диспергируемый в воде эксципиент в количестве примерно от 5% до примерно 30 мас.%, гидроксипропилметилцеллюлозу высокой вязкости в количестве примерно от 20% до примерно 60 мас.%, и гидроксипропилметилцеллюлозу низкой вязкости в количестве примерно от 20% до примерно 60 мас.% и, необязательно, лубрикант в количестве примерно от 0,1 до примерно 1 мас.%.
В некоторых следующих предпочтительных вариантах осуществления препараты регулируемого высвобождения для перорального применения настоящего изобретения содержат фармацевтически эффективное количество активного соединения, диспергируемый в воде эксципиент в количестве примерно от 10% до примерно 30 мас.%, гидроксипропилметилцеллюлозу высокой вязкости в количестве примерно от 20% до примерно 40 мас.% и гидроксипропилметилцеллюлозу низкой вязкости в количестве примерно от 20% до примерно 40 мас.% и, необязательно, лубрикант в количестве примерно от 0,1 до примерно 1 мас.%.
В некоторых вариантах осуществления настоящее изобретение предоставляет способы лечения расстройства допаминэргической системы, которые включают введение нуждающемуся в таком лечении пациенту лекарственного препарата регулируемого высвобождения согласно изобретению.
В некоторых следующих вариантах осуществления настоящее изобретение предоставляет способы лечения шизофрении, шизоаффективного расстройства, болезни Паркинсона, синдрома Туретта, психоза при болезни Льюиса-Боди, психоза при болезни Альцгеймера, гиперлактинемии, наркомании и острой мании при биполярных расстройствах, включающие введение нуждающемуся в таком лечении пациенту лекарственного препарата регулируемого высвобождения согласно изобретению.
В некоторых следующих вариантах осуществления настоящее изобретение предлагает способы лечения симптомов болезни Паркинсона, включающие введение нуждающемуся в таком лечении пациенту лекарственного средства регулируемого высвобождения согласно изобретению.
Настоящее изобретение предоставляет также способы получения предлагаемых лекарственных препаратов и продукты этих способов.
Настоящее изобретение предоставляет лекарственные препараты регулируемого высвобождения, которые содержат в качестве активного ингредиента соединение формулы I:

в которой составляющие переменные являются такими, как описано выше.
Термин "активное соединение”, как использовано в данном описании, предназначен для обозначения соединений формулы I и, в частности, 2-[(бензиламино)метил]-2,3,8,9-тетрагидро-7H-1,4-диоксино[2,3-e]индол-8-она, S-2-[(бензиламино)метил]-2,3,8,9-тетрагидро-7H-1,4-диоксино[2,3-e]индол-8-она (аплиндора) и их фармацевтически приемлемых солей, предпочтительно, но без ограничения, фумаратных солей, и пролекарств предшествующих соединений.
Описанные в данном описании лекарственные препараты обеспечивают регулируемое высвобождение активных соединений у млекопитающего при различных путях введения, включая пероральное введение. В некоторых предпочтительных вариантах осуществления настоящего изобретения лекарственные препараты включают соединение S-2-[(бензиламино)метил]-2,3,8,9-тетрагидро-7H-1,4-диоксино[2,3-e]индол-8-он, называемое аплиндором, предпочтительно, его фумаратную соль.
Аплиндор может образовывать фармацевтически приемлемые соли с различными кислотами, включая неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, хлорная кислота, азотная кислота, йодистая кислота и т.п., а также органические кислоты, такие как щавелевая кислота, фумаровая кислота, янтарная кислота, уксусная кислота, бензойная кислота, гликолевая кислота, яблочная кислота, лимонная кислота, метансульфоновая кислота, бензолсульфоновая кислота, салициловая кислота, паратолуолсульфоновая кислота, адипиновая кислота и т.п. Композиции, включающие все такие соли, входят в объем настоящего изобретения.
Термин "пролекарство”, как использовано в данном описании, имеет привычное значение ковалентно модифицированного производного соединения или его фармацевтически приемлемой соли, где такая модификация дает в результате производное, которое является метаболически лабильным и после ввода млекопитающему приводит в результате к высвобождению родительского соединения в кишечнике, плазме или ткани. Такие производные могут быть получены этерификацией, ацилированием или модификацией соединения иным способом так, чтобы ввести физиологически подвижную группу.
Аплиндор содержит один хиральный центр и используется преимущественно в виде S-изомера. Однако активность присуща также и R-изомеру. Лекарственные препараты настоящего изобретения включают оба изомера и не ограничены одним энантиомером или конкретной энантиомерной смесью.
Для целей данного изобретения термины "мгновенное высвобождение”, "форма мгновенного высвобождения” относятся к лекарственным препаратам, которые обеспечивают быстрое и непостепенное высвобождение активного соединения из препарата, т.е. к лекарственным препаратам, которые содержат активное соединение и быстро растворяющийся носитель, который не замедляет высвобождение активного соединения из препарата. Такой лекарственный препарат мгновенного высвобождения или не имеет регулирующих скорость высвобождения полимеров или других веществ, которые замедляют высвобождение активного соединения из препарата, или содержит такие полимеры и вещества в количествах, которые достаточно малы, чтобы высвобождение активного соединения из препарата не замедлялось относительно других, во всем остальном идентичных лекарственных препаратов, лишенных таких полимеров или веществ. Одним из примеров такого препарата "мгновенного высвобождения” является активное соединение, примешанное к микрокристаллической целлюлозе Avicel, что дает в результате более чем 75%-ное растворение аплиндора или его фармацевтически приемлемой соли в 0,1N растворе HCl за менее чем 0,25 часа, как описано ниже.
Термины "медленное высвобождение”, "умеренное высвобождение” и "быстрое высвобождение” представляют препараты регулируемого высвобождения, которые описаны выше, которые высвобождают активное соединение со скоростью, являющейся медленной, умеренной или быстрой в отношении друг другу.
Термины "регулируемое высвобождение”, "форма регулируемого высвобождения”, "лекарственный препарат регулируемого высвобождения” и т.п. относятся к препаратам, которые содержат средства, замедляющие высвобождение активного соединения из препарата относительно препарата "мгновенного высвобождения”, который описан выше, например, относительно во всем остальном идентичного препарата, лишенного регулирующих скорость высвобождения полимеров или других замедляющих высвобождение веществ. Таким образом, термин "регулируемое высвобождение” может прилагаться к любому числу лекарственных препаратов продолжительного высвобождения и должен рассматриваться как по существу синоним высвобождению с задержкой, высвобождению во времени, пролонгированному высвобождению, программированному во времени высвобождению, высвобождающимся во времени, высвобождению с временным покрытием, замедленному высвобождению, медленному действию, длительному действию, действию с задержкой, разнесенному высвобождению, разнесенному во времени высвобождению, продленно действующему, продленному действию и т.п.
Должно быть понятно, что препараты регулируемого высвобождения могут привести в результате к высвобождению активного соединения из дозированной формы со скоростью, эффективной для увеличения времени, которое требуется, чтобы достичь максимальной терапевтической концентрации
(т.е. Тмакс) по сравнению с Тмакс лекарственного препарата мгновенного высвобождения, так, например, что Тмакс препарата регулируемого высвобождения составляет по меньшей мере примерно 1,5, 2, 2,5, 3, 4,5 или 5,5 Тмакс лекарственного препарата мгновенного высвобождения. Препараты регулируемого высвобождения могут также приводить в результате к высвобождению активного соединения из дозированной формы со скоростью cнижения максимальной терапевтической концентрации указанного соединения (т.е. Смакс) по сравнению с Смакс лекарственного препарата мгновенного высвобождения, например, так, что Смакс препарата регулируемого высвобождения составляет менее чем примерно 0,75, 0,60, 0,50 или 0,40 от Смакс лекарственного препарата мгновенного высвобождения. Препараты регулируемого высвобождения могут также давать в результате высвобождение активного соединения из дозированной формы со скоростью, эффективной для повышения фармацевтически эффективной концентрации соединения у млекопитающего за период времени (т.е. площади под кривой, ППК, зависимости концентрации в плазме (сыворотке или крови) от времени, такой
как ППК0-12) относительно лекарственного препарата мгновенного высвобождения, например, так, что ППК0-12 препарата регулируемого высвобождения составляет по меньшей мере примерно 1,05, 1,1, 1,2, 1,3 или 1,4 от ППК0-12 лекарственного препарата мгновенного высвобождения.
Величины "Смакс", "Тмакс” и "ППК”, приведенные в данном описании, если не указано, что они являются "средними" значениями, относятся к значениям, наблюдавшимся у отдельного пациента. Кроме того, величины Смакс, Тмакс и ППК, если не указано иное, могут быть значениями, наблюдавшимися в стационарном состоянии при дозировании через регулярные промежутки времени (например, каждые 12 часов) в течение многих дней (например, введение многократных доз) или значениями при однократном введении.
Термин "регулирующий скорость высвобождения полимер”, как использовано в данном описании, предназначен для обозначения любого полимерного материала, пригодного для фармацевтических дозированных форм, который замедляет высвобождение лекарственных средств из таких дозированных форм. Примеры подходящих регулирующих скорость высвобождения полимеров можно найти в Remington's Pharmaceutical Sciences, 18th Ed., Gennaro, ed., Mack Publishing Co., Faston, PA, 1990, введенной посредством ссылки во всей полноте для всех целей. Некоторые предпочтительные регулирующие скорость высвобождения полимеры, пригодные для использования в настоящем изобретении, включают, но без ограничения, один или несколько из полиметакрилатов, сополимеров метакриловой кислоты - эфира метакриловой кислоты, фталата ацетата целлюлозы, этилцеллюлозы, фталата поливинилацетата, фталата гидроксипропилметилцеллюлозы, образующих матрицу гидроксипропилметилцеллюлоз высокой вязкости, таких как Methocel K4M, Methocel K15M, Methocel K100M, Methocel E4M, и образующих матрицу гидроксипропилметилцеллюлоз низкой вязкости, таких как Methocel K100LV, Methocel E50LV, Methocel E5, Methocel E15LV, или комбинацию двух или нескольких из них. Дополнительные предпочтительные регулирующие скорость высвобождения полимеры включают один или несколько из Eugradit RS, Eugradit RL, Surelease или комбинации двух или нескольких из них.
Должно быть ясно, что различные регулирующие скорость высвобождения полимеры придают препарату различные свойства скорости высвобождения. Варьируя тип и количество таких полимеров в препарате, можно получить широкое разнообразие профилей высвобождения активного соединения. Специалисты в данной области имеют возможность выбора нужных полимеров в нужных количествах для достижения желаемых скоростей высвобождения активного соединения.
Твердые композиции регулируемого высвобождения аплиндора или фармацевтически приемлемых солей аплиндора могут включать любые из многих дозированных форм, известных в данной области, включая таблетки, например совместно спрессованные таблетки и матричные таблетки, инкапсулированные дозированные формы, такие как капсулы или гранулы, содержащие микрочастицы в виде гранул, бусин, таблеток, сфероидов или комбинаций двух или нескольких из них, порошки и т.п.
В соответствии с некоторыми предпочтительными вариантами осуществления лекарственный препарат регулируемого высвобождения может содержать микрочастицы, которые содержат активное соединение и по меньшей мере один регулирующий скорость высвобождения полимер в локализации, подходящей для того, чтобы замедлить высвобождение активного соединения. Такие микрочастицы могут быть в виде, например, гранул, бусин или сфероидов, в некоторых вариантах осуществления настоящего изобретения микрочастицы включают ядро и по меньшей мере один покрывающий слой. Или ядро, или покрывающий слой может быть или инертным (т.е. не содержать активное соединение), или может содержать активное соединение, при условии, что по меньшей мере в одном из ядра или одного покрывающего слоя содержится активное соединение. В некоторых вариантах осуществления настоящего изобретения микрочастицы содержатся внутри капсулы или спрессованы в таблетку.
Лекарственные препараты из микрочастиц по изобретению могут содержать активное соединение в любом обычном процентном содержании по массе. Обычно препарат содержит активное соединение в процентном содержании по массе примерно от 1% до примерно 25%, предпочтительно примерно от 2% до примерно 15%, предпочтительно примерно от 5% до примерно 10%.
В дополнение к активному соединению и регулирующему скорость высвобождения полимеру препараты по изобретению могут содержать любой из множества дополнительных материалов, которые придают препарату благоприятные свойства. Такие материалы включают, например, модифицирующие растворимость агенты, такие как поверхностно-активные вещества, кислотные соединения и основные соединения, антиоксиданты, кислые и щелочные модификаторы рН, хелатирующие агенты, наполнители, дезинтегранты, связующие, лубриканты, стабилизаторы, эксципиенты, включая водорастворимые эксципиенты, такие как сахара, и диспергируемые в воде эксципиенты, такие как микрокристаллическая целлюлоза, коллоидальный диоксид кремния, силицированная микрокристаллическая целлюлоза и крахмал.
Неограничивающие примеры водорастворимых или диспергируемых в воде эксципиентов включают лактозу, маннит, сахарозу и т.п. Водорастворимые эксципиенты могут присутствовать в интервале, зависящем от конкретной поставленной терапевтической цели. В общем случае интервалом для водорастворимых эксципиентов является интервал от 0 до 50%, или от 2% до 25%. Примеры диспергируемых в воде эксципиентов включают микрокристаллическую целлюлозу, коллоидальный диоксид кремния, силицированную микрокристаллическую целлюлозу (Prosolve), крахмалы, сверхдезинтегранты, такие как кросскармелоза натрия, и т.п. Интервал для диспергируемых в воде эксципиентов обычно составляет примерно от 5% до примерно 50%, предпочтительно примерно от 10% до примерно 30 мас.%.
Неограничивающие примеры стабилизаторов включают антиоксиданты, такие как ВНА, ВНТ, аскорбиновые кислоты, токоферолы и т.п. Неограничивающие примеры хелаторов металлов включают ЭДТА, лимонную кислоту и т.п. Неограничивающими примерами модификаторов рН являются или кислотные, или основные соединения, такие как лимонная кислота, цитрат натрия, фумаровая кислота, фумарат натрия и т.п. Неограничивающие примеры связующих включают крахмалы, PVP, HPMC, HPC и т.п. Неограничивающие примеры повышающих текучесть агентов включают стеарат магния и т.п. Неограничивающие примеры модификаторов растворимости включают поверхностно-активные вещества, подобные SLS или Tween 80, и т.п.
В некоторых предпочтительных вариантах осуществления настоящего изобретения препараты по изобретению находятся в виде покрытых гранул или сфер. Одним неограничивающим примером таких лекарственных препаратов являются сферы, содержащие ядро активного соединения в инертной матрице, покрытой регулирующим скорость высвобождения полимером, который описан выше. Неограничивающими примерами регулирующих скорость высвобождения полимеров являются рН-зависимые или независимые полимеры, такие как полиметакрилаты Eugradit L/S, Eugradit RS/RL, фталат ацетата целлюлозы, этилцеллюлоза и т.п. Следующие примеры включают один или несколько из образующих матрицу гидроксипропилметилцеллюлоз, высокой вязкости и образующих матрицу гидроксипропилметилцеллюлоз низкой вязкости, которые описаны выше.
В некоторых вариантах осуществления настоящего изобретения препараты по изобретению находятся в виде гранул. Примеры таких лекарственных препаратов включают композиции, содержащие гранулы, которые содержат слой активного соединения поверх инертного ядра, например сахарной сферы, и поверхностное покрытие, содержащее один или несколько регулирующих скорость высвобождения полимеров.
В некоторых вариантах осуществления настоящего изобретения препараты по изобретению находятся в виде таблеток. В некоторых таких вариантах осуществления массовое процентное содержание активного соединения в препарате составляет примерно от 1% до примерно 25%, предпочтительно примерно от 2% до примерно 15%, предпочтительно примерно от 5% до примерно 10%. Неограничивающими примерами таких таблеток являются совместно спрессованные таблетки (т.е. "таблетка-в-таблетке”) и матричные таблетки.
Обычно совместно спрессованные таблетки включают ядро и внешнее спрессованное покрытие. Или одно, или оба из ядра и внешнего спрессованного покрытия могут содержать активное соединение и/или один или несколько регулирующих скорость высвобождения полимеров. В некоторых предпочтительных вариантах осуществления настоящего изобретения дозированная форма представляет собой совместно спрессованную таблетку, в которой и ядро, и внешнее спрессованное покрытие содержат активное соединение и по меньшей мере один, предпочтительно два, регулирующих скорость высвобождения полимера, одним из которых предпочтительно является образующая матрицу гидроксипропилметилцеллюлоза высокой вязкости, и другим предпочтительно является образующая матрицу гидроксипропилметилцеллюлоза низкой вязкости. Предпочтительные образующие матрицу полимеры высокой вязкости включают гидроксипропилметилцеллюлозу, выбранную из Methocel K4M, Methocel K15M, Methocel K100M, Methocel E4M и комбинаций двух или нескольких из них, предпочтительно Methocel K4M. Предпочтительные образующие матрицу полимеры низкой вязкости включают гидроксипропилметилцеллюлозу, выбранную из Methocel K100LV, Methocel E50LV, Methocel E5, Methocel E15LV или комбинации двух или нескольких из них, предпочтительно Methocel K100LV.
В некоторых предпочтительных вариантах осуществления настоящего изобретения таблетка является матричной таблеткой. Образующая матрицу композиция может содержать воски, смолы, полиэтиленоксиды, карбаполы, гидроксипропилметилцеллюлозы, гидроксиэтилцеллюлозы, полиметакрилаты или другие регулирующие скорость высвобождения полимеры, как описано выше. В некоторых вариантах осуществления настоящего изобретения такие матричные таблетки готовят смешиванием активного соединения вместе с образующим матрицу полимером и прессованием смеси.
В некоторых вариантах осуществления настоящего изобретения таблетка является матричной таблеткой, которая включает восковую матрицу. Такие таблетки могут быть получены, например, плавлением воска, такого как воск карнаба, цетостеариловый спирт или жирные кислоты, или их сочетания, добавлением активного соединения вместе с наполнителем, таким как микрокристаллическая целлюлоза, а также других эксципиентов, наполнителей, лубрикантов и т.п., и предоставлением смеси возможности остыть. Полученные композиции могут быть, необязательно, покрыты слоем одного или нескольких регулирующих скорость высвобождения полимеров или содержать их. Обычно воск присутствует в композиции в общем количестве по массе примерно от 10% до примерно 60%, предпочтительно примерно от 20% до примерно 40%, предпочтительно примерно от 10% до примерно 60%. Широкое разнообразие восков является пригодным для настоящего изобретения. Неограничивающие примеры таких восков включают воск карнаба, цетостеариловый спирт, жирные кислоты или смеси двух или нескольких из них. Матричная таблетка может также содержать один или несколько регулирующих скорость высвобождения полимеров, как описано выше.
Следующим неограничивающим примером такой матричной таблетки является таблетка, которая включает полиэтиленоскидную матрицу, например, но без ограничения, полиэтиленоксидные смолы, такие как SENTRY POLYOX (Union Carbide Corp.) или ее эквиваленты. Подходящие смолы POLYOX включают POLYOX WSR N-10, N-60 K, WSR-1105N, WSR-303. Используемый POLYOX может иметь молекулярную массу в интервале от 100000 до 7000000 или от 900000 до 5000000. Обычно полиэтиленоксид присутствует в композиции в общем количестве по массе примерно от 5% до примерно 40%, предпочтительно примерно от 10% до примерно 20% от всей композиции. Матричная таблетка может также содержать один или несколько регулирующих скорость высвобождения полимеров, как описано выше.
Следующим неограничивающим примером матричной таблетки является таблетка, которая включает один или несколько регулирующих скорость высвобождения полимеров, которые описаны выше, в качестве образующего матрицу полимера. В некоторых предпочтительных вариантах осуществления настоящего изобретения такие таблетки включают в качестве образующего матрицу полимера одну или несколько из образующих матрицу гидроксипропилметилцеллюлоз высокой вязкости и/или одну или несколько из образующих матрицу гидроксипропилметилцеллюлоз низкой вязкости, которые описаны выше. В некоторых предпочтительных вариантах осуществления настоящего изобретения выгодно использовать гидроксипропилметилцеллюлозу высокой вязкости, такую как Methocel K4M, в количестве по массе примерно от 15% до примерно 80%, предпочтительно примерно от 25% до примерно 50%. Могут быть также использованы другие полимеры высокой вязкости, такие как Methocel K15M, Methocel K100M или Methocel E4M и т.п. В некоторых вариантах осуществления настоящего изобретения используют гидроксипропилметилцеллюлозу низкой вязкости, такую как Methocel E50LV, Methocel E5 или MethocelE15LV или их сочетания, и т.п. В определенных вариантах осуществления настоящего изобретения в матрице используют вместе и гидроксипропилметилцеллюлозу высокой вязкости и гидроксипропилметилцеллюлозу низкой вязкости, где гидроксипропилметилцеллюлоза низкой вязкости присутствует в количестве примерно от 15% до 80%, предпочтительно примерно от 25% до примерно 50%, и гидроксипропилметилцеллюлоза высокой вязкости присутствует в количестве по массе примерно от 20% до примерно 50%.
В общем случае, активное соединение может содержаться в любом слое дозированной формы по изобретению, и регулируемое высвобождение активного соединения может быть достигнуто путем использования регулирующего скорость высвобождения полимера, содержащегося или внутри слоя, содержащего активное соединение, или в любом слое, окружающем слой, содержащий активное соединение, например в кишечно-растворимом покрытии. Такое кишечно-растворимое покрытие может быть также нанесено на гранулы, бусинки или сфероиды, содержащие активное соединение, или активное соединение может содержаться в самом кишечно-растворимом покрытии.
В некоторых вариантах осуществления настоящего изобретения препараты регулируемого высвобождения представляет собой препарат матричной таблетки, где активное соединение присутствует в количестве по массе примерно от 0,02% до примерно 16%, предпочтительно примерно от 0,02% до примерно 4%.
Таблетки лекарственных препаратов по изобретению могут быть покрыты водорастворимыми полимерными красящими агентами или покрыты рН-зависимыми или рН независимыми полимерами для дополнительного регулирования скорости высвобождения активного соединения. В некоторых вариантах осуществления настоящего изобретения на таблетки по данному изобретению нанесено подпокрытие, кишечно-растворимое покрытие или дополнительное верхнее покрытие, или любая их комбинация.
Типы лекарственных препаратов, охватываемых настоящим изобретением, не ограничены представленными примерами. Скорее, примеры показывают, что огромное число лекарственных препаратов достигает главной цели настоящего изобретения, и специалисту в данной области будет очевидно, что предполагаются варианты лекарственных препаратов вне пределов, представленных в примерах, где композиция варьируется так, чтобы достичь главной цели изобретения, обеспечения регулируемого высвобождения активного соединения.
В особо предпочтительных вариантах осуществления настоящего изобретения каждого из лекарственных препаратов по изобретению активным соединением является аплиндор. Аплиндор и его фармацевтически приемлемая соль являются особенно хорошо подходящими для лечения различных расстройств центральной нервной системы и, более конкретно, тех расстройств центральной нервной системы, которые связаны с допаминергической системой. Поскольку аплиндор (или любое лекарственное средство) требует достаточного уровня воздействия для достижения своего желаемого эффекта, лекарственное средство должно дозироваться способом, достаточным для достижения конкретного уровня в плазме крови на протяжении периода времени, считающегося достаточным, чтобы соответствовать объективным клиническим запросам. Однако было найдено, что в некоторых случаях дозирование подлежащих лечению пациентов аплиндором приводит к побочным эффектам, включающим тошноту и рвоту, которые коррелируют с временным периодом, когда аплиндор достигал своих максимальных уровней в плазме. Простое уменьшение дозы не всегда было удовлетворительным, поскольку в то время как побочные эффекты могли уменьшиться или исчезнуть, общие уровни воздействия лекарственного средства могли быть неудовлетворительными для лечения конкретного состояния. Скорее, желательным является режим лечения, который поддерживает или повышает эффективность лекарственного средства, но не дает относительно высокой начальной концентрации в крови, наблюдаемой при введении мгновенно высвобождающихся доз аплиндора.
Таким образом, в соответствии с настоящим изобретением предложены дозированные формы регулируемого высвобождения, включающие пероральные и неоральные композиции, которые уменьшают вредные побочные эффекты введения аплиндора мгновенного высвобождения. Соответственно, настоящее изобретение включает каждый из многочисленных методов, которые существуют для неоральных лекарственных препаратов регулируемого высвобождения, включая насосы, имплантаты, пластыри, депонированную инъекцию, инъекцию с носителем регулируемого высвобождения и т.п. Доставка активного соединения в соответствии с настоящим изобретением может проводиться через слизистую оболочку, вагинальным, ректальным, окулярным, трансдермальным, интрауринальным путями и т.п.
В других вариантах осуществления было найдено, что желательным является постепенное увеличение дозы аплиндора млекопитающему до требуемой дозы на протяжении периода времени (например, титровать), чтобы уменьшить возможные начальные побочные эффекты аплиндора. Так, настоящее изобретение предлагает способ введения аплиндора, который включает введение нуждающемуся в этом млекопитающему начального лекарственного препарата регулируемого высвобождения, включающего аплиндор, и затем введение млекопитающему по меньшей мере одной другого лекарственного препарата регулируемого высвобождения, включающего аплиндор, где начальный лекарственный препарат регулируемого высвобождения содержит меньшее количество аплиндора относительно другого лекарственного препарата регулируемого высвобождения. В некоторых вариантах осуществления настоящего изобретения начальный лекарственный препарат регулируемого высвобождения содержит примерно от 0,05 мг до примерно 0,4 мг аплиндора.
В соответствии с настоящим изобретением включены также любые из многочисленных способов, которые существуют для получения пероральных лекарственных препаратов замедленного высвобождения, включая описанные выше, а также микро- и макрокапсулированные, волокна, матрицы, полимерные (высокой вязкости и низкой вязкости) и неполимерные, пены, липосомы, мицеллы, гели, физически диспергированные лекарственные средства в полимерных, пористых, слабо пористых или непористых матрицах, адсорбированные на ионообменных смолах, смешанные с химически или биологически разлагаемыми матрицами или адсорбированные на них, и т.п. Активное соединение может быть введено в лекарственный препарат таким образом, что лекарственное средство достигает единственного максимума концентрации, или может быть введено в лекарственный препарат так, что лекарственное средство дает пульсацию из двух или нескольких пиков. Пероральная доставка может проводиться путем жидкой или твердой дозированной формы. Жидкие дозированные формы включают сиропы, суспензии, эмульсии, эликсиры и т.п. Жидкий носитель может включать органическую или водную основу и может быть дополнительно модифицирован подходящими фармацевтическими добавками, такими как солюбилизаторы, эмульгаторы, буферные агенты, консерванты, подсластители, вкусовые агенты, суспендирующие агенты, загустители, регуляторы цвета и вязкости, стабилизаторы или регуляторы осмотического давления, или их сочетания. Водный носитель может также содержать полимерные вещества или масла.
Хотя настоящее изобретение описано с учетом особенностей в соответствии с его определенными предпочтительными вариантами осуществления, следующие примеры служат только для пояснения изобретения и не предназначены для его ограничения.
Примеры
Следующие примеры иллюстрируют некоторые лекарственные препараты регулируемого высвобождения, которые достигают цели изобретения путем снижения скорости растворения, увеличения времени достижения максимальной концентрации или понижения величины максимальной концентрации для заданного количества аплиндора, или сочетания этих трех факторов. Следующие неограничивающие примеры носителей пероральной доставки, составленных для регулируемой доставки, перечислены ниже. Примеры являются иллюстрацией неограничивающих интервалов доз от 0,05 до 10 мг и широкого интервала пероральных лекарственных препаратов регулируемого высвобождения для того, чтобы продемонстрировать ряд профилей высвобождения, которые были дополнительно испытаны на обезьянах и на людях, о чем сообщено ниже.
Тремя подходами к препаратам, показанными ниже, являются: 1) гранулы с покрытием, 2) совместно спрессованные таблетки (таблетка-в-таблетке) и 3) матричные таблетки.
Гранулы с покрытием
Низкая требуемая доза аплиндора или его фармацевтически приемлемой соли позволяет наносить слой лекарственного средства на поверхность инертной сахарной сферы с последующим покрытием, регулирующим высвобождение полимером. Лекарственное средство может быть также введено в сферу методом экструзии/сферонизации, который не показан в настоящих примерах.
Таблетки совместного прессования
Применение совместно спрессованной таблетки исследовалось с целью получения профиля высвобождения нулевого или почти нулевого порядка и различных профилей высвобождения, полученных путем варьирования количеств лекарственного средства и полимера (НРМС) в ядре таблетки и во внешнем прессованном покрытии, а также общей массы таблетки. Таблетки могут быть изготовлены по отдельности на различных прессах или оборудовании, хорошо известном специалистам в данной области. Совместно спрессованные таблетки по настоящему изобретению были изготовлены индивидуально на прессе Carver с использованием стандартных приспособлений.
Матричные таблетки
Образцы матричных таблеток готовили, используя гидроксипропилметилцеллюлозу (ГПМЦ)), воски, полиэтиленоксиды (ПЭО) по одному или в сочетаниях.
Для того чтобы сделать таблетки аплиндора прямого прессования легкими для проглатывания и избежать какого-либо раздражения пищевода, на ядро таблеток аплиндора наносили 3 мас.%. Opadry II White.
Пример 1
Гранулы аплиндора фумарата замедленного высвобождения, приготовленные с использованием экструзии/сферонизации и SR покрытия
Партии готовили путем смешиванием лекарственного средства с микрокристаллической целлюлозой (Avicel PH102) и гранулирования с водой для образования влажной массы. Влажную массу экструдировали через 1,0 мм сито и предавали сферическую форму на малой системе Caleva. Рецептуры и данные по растворению в 0,1N HCl для гранул без покрытия представлены в таблице 1. Матрица Avicel не замедляет высвобождение аплиндора и практически все лекарственное средство высвобождается из гранул без покрытия за 30 минут.
Препарат и растворение гранул без покрытия
Сферы, приготовленные экструзией/сферонизацией, покрывали Eugradit RS/RL и Surelease для того, чтобы регулировать высвобождение аплиндора. Рецептура и профили растворения показаны в таблице 2. Сферы, покрытые Surelease, композиции 3 испытывали на обезьянах, чтобы оценить высвобождение in vivo, и соответствующие уровни в плазме обезьян показаны в таблице 3.
Препарат и растворение сфер с покрытием замедленного высвобождения, приготовленных экструзией/сферонизацией
мас.%
мас.%
Пример 2
Гранулы аплиндора фумарата замедленного высвобождения, приготовленные нанесением покрытия замедленного высвобождения на слоистые сахарные сферы
Гранулы аплиндора фумарата замедленного высвобождения готовили также нанесением слоя активного лекарственного средства на сахарные сферы. Рецептура и данные о растворении приведены в таблице 3. Композиция 5 была испытана на высвобождение in vivo на обезьянах. Данные включены в таблицу 4.
Препарат и растворение сахарных сфер, с нанесенным слоем аплиндора с покрытием замедленного высвобождения
мас.%
Суммарные параметры биоусвояемости аплиндора на обезьянах
(нг*ч/мл)
(нг/мл)
(ч)
Пример 3
Таблетки замедленного высвобождения, приготовленные с использованием метода совместного прессования
Применение совместно спрессованной таблетки исследовалось с целью получения профиля высвобождения нулевого или почти нулевого порядка. Различные профили высвобождения могли быть получены путем варьирования количеств лекарственного средства и полимера (НРМС) в ядре таблетки и во внешнем прессованном покрытии, а также общей массы таблетки. Все таблетки были изготовлены индивидуально на прессе Carver с использованием стандартной круглой оснастки. Рецептура и данные о растворении приведены в таблице 5. Данные по поглощению на обезьянах для композиции 8 включены в таблицу 4.
Препараты совместно спрессованных таблеток аплиндора (таблетка-в-таблетке)
Пример 4
Таблетки с восковой матрицей
В таблице 6 перечислены составы матричных таблеток, содержащих воск карнаба и цетостеариловый спирт в качестве образующих матрицу полимеров с микрокристаллической целлюлозой. Воск плавили и добавляли при перемешивании аплиндор, один или его смесь с микрокристаллической целлюлозой. Смеси давали остыть до комнатной температуры и измельчали ее. Полученный гранулят смешивали с лубрикантом стеаратом магния и прессовали в таблетки. Таблетки показали профиль замедленного высвобождения.
Препараты и растворение восковой матрицы
мас.%
мас.%
Пример 5
Таблетки с полиэтиленоксидной матрицей
В таблице 6А приведены составы и профили растворения матричных таблеток, приготовленных с использованием ПЭО полимеров. Таблетки показывают профили замедленного высвобождения.
Препараты и растворение восковой и полиоксиэтиленоксидной матрицы
мас.%
мас.%
Пример 6
10 мг таблетки с гидроксипропилметилцеллюлозной матрицей
Гидроксипропилметилцеллюлозы, использованные в соответствии с примерами изобретения, представляют собой гидроксипропилметилцеллюлозы, продающиеся под торговой маркой METHOCEL (Dow Chemical Co.) и их эквиваленты. Подходящие полимеры METHOCEL включают сорта K, такие как METHOCEL K15M Premium CR, METHOCEL K100M Premium CR, METHOCEL K100 Premium LV и METHOCEL K4M Premium. Другие подходящие полимеры METHOCEL включают сорта E, F и J.
В таблице 7 перечислены примеры матричных таблеток, использующие гидроксипропилметилцеллюлозы (ГПМЦ) низкой вязкости Methocel KLV 100 (содержание гидрокисипропилметилцеллюлозы менее 9%) и высоковязкий Methocel K4M. Аплиндора фумарат и полимеры смешивали, смазывали стеаратом магния и прессовали в таблетки. Эти таблетки показывают растворение замедленного высвобождения в 0,1N HCl и буфере с рН 6,5.
Для того чтобы сделать таблетки аплиндора фумарата легкими для проглатывания и избежать какого-либо раздражения пищевода на ядро таблеток аплиндора фумарата наносили 3 мас.%. Opadry II White.
Таблетки с 10 мг аплиндора быстрого высвобождения, с 10 мг умеренного высвобождения и 10 мг медленного высвобождения с матрицей ГПМЦ в ядре испытывали на обезьянах вместе с капсульной формой замедленного высвобождения. Рецептуры и данные по растворению приведены в таблице 7. Таблетки прессовали, используя 11/32-дюймовую стандартную вогнутую круглую оснастку. Растворение определяли, как рекомендовано в USP, используя аппарат 2 (лопасти) при 50 об/мин, используя 0,1N HCl в течение первых 2 часов и 0,05М фосфатный буфер, рН 6,8 при 37±0,5оС. Объем среды растворения составлял 900 мл.
Фармакологические параметры представлены в таблице 8. Эти средства аплиндора умеренного высвобождения и медленного высвобождения согласно их проведению in vivo в опытах на обезьянах удовлетворяют требованиям. Биоусвояемость трех таблетированных форм с матрицей ГПМЦ составляла 85,5, 95,0 и 116,4%, соответственно, для форм медленного высвобождения, умеренного высвобождения и быстрого высвобождения относительно капсульной средства немедленного высвобождения.
Препараты и растворение быстро растворимых, умеренно растворимых и медленно растворимых (с матрицей ГПМЦ) таблеток АПЛИНДОР 10,0 мг
Таблетки медленного высвобождения
Таблетки умеренного высвобождения
Таблетки быстрого высвобождения
Капсулы немедленного высвобождения (сравнение)
** Количество скорректировано в расчете на чистоту фумаратной соли аплиндора. Соответствующая корректировка сделана для предварительно желатинизированного крахмала LM.лактозы.
Параметры биоусвояемости для матричных 10 мг таблеток аплиндора замедленного высвобождения на обезьянах
(нг*ч/мл)
(нг/мл)
(ч)
Пример 7
Матричные таблетки регулируемого высвобождения 5,0 мг, 2,0 мг, 0,5 мг и 0,05 мг
Четыре различные концентрации 5,0 МГ, 2,0 МГ, 0,5 МГ И 0,05 МГ были изготовлены для каждой из форм умеренного высвобождения и медленного высвобождения. Было желательно, чтобы профили плазмы in vivo были подобны профилям для форм 10 мг умеренного и медленного высвобождения, показанным в таблице 7.
Формы таблеток и общие массы таблеток выдерживали одинаковыми для всех четырех различных концентраций и для двух различных скоростей высвобождения таблеток. Существует большая разница между концентрациями этих таблеток, поэтому для хорошо растворимого в воде аплиндора фумарата трудно приготовить четыре дозы, меняя только долю уровней полимера ГПМЦ. Это было осуществлено путем компенсации уменьшенного количества водорастворимого активного лекарственного средства добавлением обычно используемого хорошо растворимого в воде эксципиента, поддерживая в то же время другие эксципиенты в тех же пропорциях. В рецептурах форм умеренного и медленного высвобождения с 5,0 МГ, 2,0 МГ, 0,5 МГ И 0,05 МГ аплиндора фумарата в качестве водорастворимого компенсирующего эксципиента была выбрана лактоза Fast Flo. Лактоза Fast Flo является хорошо растворимой в воде и имеет хорошие свойства текучести и прессования. Она была использована в 10,0 мг форме умеренного высвобождения.
Таблетки аплиндора фумарата 5,0 МГ, 2,0 МГ, 0,5 МГ И 0,05 с матрицами ГПМЦ умеренного высвобождения и медленного высвобождения были все изготовлены на Cotton Press. Композиции были доведены до конца на основании результатов растворения при мг0 об/мин и перечислены в таблицах 9 и 10.
Данные о растворении матричных таблеток аплиндора фумарата 5,0 МГ, 2,0 МГ, 0,5 МГ И 0,05 МГ умеренного высвобождения и таблеток 5,0 МГ, 2,0 МГ, 0,5 МГ И 0,05 С ГПМЦ матрицей медленного высвобождения также перечислены в таблицах 9 и 10.
Препараты и растворение умеренно растворимых таблеток с 5,0 мг, 2,0 мг, 0,5 мг и 0,05 мг аплиндора фумарата с матрицей ГПМЦ в буфере с рН 6,8 с USP II методом со скоростью лопасти 150 об/мин
5,0 мг
Умеренное высвобождение
2,0 мг
Умеренное высвобождение
0,5 мг
Умеренное высвобождение
0,05 мг
Умеренное высвобождение
Скорость лопасти 150 об/мин
Скорость лопасти 150 об/мин
Скорость лопасти 150 об/мин
Скорость лопасти 50 об/мин
Препараты и растворение медленно растворимых таблеток с 5,0 мг, 2,0 мг, 0,5 мг и 0,05 мг аплиндора фумарата с матрицей ГПМЦ в буфере с рН 6,8 с USP II методом со скоростью лопасти 150 об/мин
5,0 мг
Медленное высвобождение
2,0 мг
Медленное высвобождение
0,5 мг
Медленное высвобождение
0,05 мг
Медленное высвобождение
Скорость лопасти 150 об/мин
Скорость лопасти 150 об/мин
Скорость лопасти 150 об/мин
Скорость лопасти 50 об/мин
Пример 8
Покрытые пленкой таблетки с матрицей ГПМЦ
Для того чтобы сделать таблетки аплиндора фумарата с матрицей ГПСЦ более легко глотаемыми, на активное ядро таблетки наносили покрытие Opadry и кишечно-растворимое покрытие, и было найдено, что биоусвояемости являются сопоставимыми (данные не приведены).
Пример 9
Добавочные средства и процессы
Дополнительные средства таблеток аплиндора показаны в таблице ниже.
Препараты умеренного высвобождения с аплиндора фумаратом (таблетки с ядром)
10,0 мг
Умеренное высвобождение
5,0 мг
Умеренное высвобождение
2,0 мг
Умеренное высвобождение
0,5 мг
Умеренное высвобождение
0,05 мг
Умеренное высвобождение
Препараты медленного высвобождения с аплиндора фумаратом (таблетки с ядром)
10,0 мг
Умеренное высвобождение
5,0 мг
Умеренное высвобождение
2,0 мг
Умеренное высвобождение
0,5 мг
Умеренное высвобождение
0,05 мг
Умеренное высвобождение
Пример способа изготовления таблеток умеренного высвобождения с ядром:
В одном примере способа для изготовления таблеток умеренного высвобождения с ядром осуществляют следующие стадии:
1. Просеивание аплиндора фумарат в пакет.
Промывание контейнера, который содержал аплиндора фумарат, порциями лактозы Fast Flo, пропуская через сито в пакет на стадии 1.
2. Пропускание порции лактозы Fast Flo через сито в пакет и перемешивание пакета.
3. Пропускание порции лактозы Fast Flo через сито в пакет и перемешивание пакета.
3. Перенос смеси в блендер переворачивающегося типа подходящего размера.
5. Промывание пакета двумя порциями лактозы Fast Flo, затем добавление в блендер и перемешивание. Пропускание лактозы Fast Flo через сито перед добавлением в пакет.
6. Просеивание оставшейся лактозы Fast Flo в блендер и перемешивание.
7. Просеивание Avicel PH 301, Methocel K4M Premium CR и Methocel K100LV Premium CR LH в блендер и перемешивание.
8. Просеивание стеарата магния и смешивание с примерно равной порцией смеси со стадии 8, добавление в блендер и перемешивание.
9. Прессование таблеток из конечной смеси стадии 9 с заданной массой 250 мг.
Пример способа изготовления таблеток медленного высвобождения с ядром:
В одном примере способа для изготовления таблеток медленного высвобождения с ядром осуществляют следующие стадии:
1. Просеивание аплиндора фумарат в пакет.
2. Промывание контейнера, который содержал аплиндора фумарат, порциями Pro Solv HD 90, пропуская через сито в пакет на стадии 1.
3. Пропускание порции Pro Solv HD 90 через сито в пакет и перемешивание пакета.
4. Пропускание порции Pro Solv HD 90 через сито в пакет и перемешивание пакета.
затем перенос смеси в блендер переворачивающегося типа подходящего размера.
5. Промывание пакета со стадии 4 лактозой моногидратом, предварительно пропущенной через сито, в блендер.
6. Промывание пакета порцией Pro Solv HD 90, затем добавление в блендер и перемешивание. Пропускание Pro Solv HD 90 через сито перед добавлением в пакет.
7. Просеивание оставшийся Pro Solv HD 90 в блендер и перемешивание.
8. Просеивание Methocel K4M Premium CR и Methocel K100LV Premium CR LH в блендер и перемешивание.
9. Просеивание стеарата магния и смешивание с примерно равной порцией смеси со стадии 8, добавление в блендер и перемешивание.
10. Прессование таблеток из конечной смеси стадии 9 с заданной массой 250 мг.
* Примечание: для более высоких доз стадии геометрического разведения меньше.
В некоторых вариантах осуществления настоящего изобретения способом является сухое смешивание и прямое прессование. В следующих способах может быть использован процесс сухого гранулирования, состоящий из комкования и размола, или уплотнение на вальцах и размалывание, или, предпочтительно, сухое гранулирование для улучшения свойств текучести смеси. В следующих вариантах осуществления может быть также использован процесс мокрого гранулирования. Однако это не является предпочтительным в общем случае из-за возможной чувствительности активного соединения к влаге и возможного разложения с образованием нерастворимого гидрата. Таблетки могут быть с покрытием или без покрытия.
Пример 10
Исследование поглощения и переносимости у человека
Клиническое испытание на людях проводили как исследование многократного приема двух форм регулируемого высвобождения аплиндора фумарата, препараты медленного высвобождения (SR) и препараты умеренного высвобождения (MR). Было привлечено тридцать два (32) субъекта, и 31 завершил испытания. Субъекты были случайным образом отобраны на получение одной из двух форм аплиндора или плацебо. Двенадцать субъектов получали аплиндора фумарат SR, 12 субъектов - аплиндора фумарат MR, и 8 субъектов получали плацебо. Дозу субъектов титровали от 0,05 мг до 5,0 мг в дни от 1 до 12. В дни от 12 до 16 субъекты голодали перед получением испытуемого изделия (5,0 мг доза два раза в день (BID)). На 16-ый день снимали полный фармакокинетический профиль после АМ дозы в условиях голодания. В дни с 17 по 21 субъекты получали умеренно жирную пищу за 30 минут до введения испытуемого изделия (5,0 мг дозы BID) и на 24-ый день снимали полный фармакокинетический профиль.
В таблице 13 суммированы фармакокинетический профиль 5,0 мг BID аплиндора фумарата SR, 5,0 мг BID аплиндора фумарата MR после еды и в условиях голодания и результаты такой же дозы аплиндора IR (5,0 мг) у пациентов каждого опыта.
Фармакокинетические параметры для матричных таблеток аплиндора фумарата замедленного высвобождения у человека
% CV
26,7%
43,9%
45,7;
30,7%
% CV
27,3%
43,1%
45,7%
29,7%
% CV
27,5%
46,1%
33,2%
17,5%
% CV
27,0%
48,6%
34,4%
23,3%
(25 день)
% CV
27,9%
38,7%
44,7%
53,5%
После введения и аплиндора MR, и аплиндора SR, аплиндор абсорбировался более медленно при среднем tmax в интервале от 1,8 до 3,5 по сравнению с 0,7 час для аплиндора мгновенного высвобождения (R).
В условиях голодания MR и SR имели одинаковые концентрации и фармакокинетические параметры, причем SR обеспечивал немного более высокие концентрации. Среднее Смакс для SR составляло 9229 пкг/мл по сравнению с 8065 пкг/мл для MR. ППКss для SR приблизительно на 25% выше, чем ППКss для MR.
Подобные результаты получены в условиях после еды (SR Cмакс≅9276 пкг/мл и MR Смакс≅8653 пкг/мл). Суммарная экспозиция для SR была лишь на 15% выше, чем для MR.
Оба препарата регулируемого высвобождения дают фармакокинетические профили, отличные от аплиндора фумарата IR 5,0 мг. Смакс для SR и MR составляет примерно одну треть от Смакс для IR, и tmax было продлено на 1-2 часа. Неожиданно, суммарное воздействие (ППКss) было выше для двух препаратов замедленного высвобождения (≅66000 пкг*ч/мл для SR, ≅55000 пкг*ч/мл для MR против ≅49500 пкг*ч/мл для IR), и вариабельность ППКss для препаратов MR и SR была ниже, чем для средства IR.
Профили побочных эффектов убеждают, что препараты SR и MR являются намного более толерантными, чем препараты немедленного высвобождения.
Подразумевается, что каждый из патентов, заявок и печатных публикаций, включая книги, приведенные в данном описании, является тем самым включенным посредством ссылки во всей своей полноте.
Специалистам в данной области будет очевидно, что многочисленные изменения и модификации могут быть сделаны в предпочтительных вариантах осуществления настоящего изобретения без отклонения от существа изобретения. Подразумевается, что все такие вариации входят в объем изобретения. Каждый источник, процитированный в настоящем описании, включая литературные источники, патенты и патентные заявки, введен в данное описание посредством ссылки во всей своей полноте. Данная заявка испрашивает приоритет по предварительной заявке США № 60/515315, поданной 29 октября 2003 г., включенной в данное описание посредством ссылки во всей своей полноте.
Изобретение относится к области фармацевтики и касается лекарственного средства для перорального применения для лечения расстройств допаминергической системы, включающего аплиндор и один или несколько замедляющих высвобождение полимеров. Лекарственное средство обеспечивает снижение побочных эффектов от введения аплиндора. 6 н. и 36 з.п. ф-лы, 13 табл.
1. Лекарственное средство для орального применения для лечения расстройств допаминергической системы, включающее аплиндор формулы:
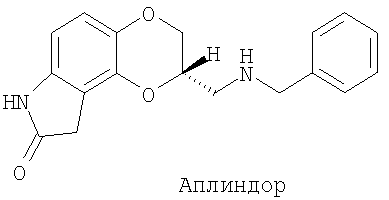
или его фармацевтически приемлемую соль;
и один или несколько замедляющих высвобождение полимеров, выбранных из образующих матрицу гидроксипропилметилцеллюлозы высокой вязкости, образующих матрицу гидроксипропилметилцеллюлозы низкой вязкости, полиметилакрилатов, сополимеров метакриловой кислоты-эфира метакриловой кислоты, фталата ацетата целлюлозы, этилцеллюлозы, фталата поливинилацетата, фталата гидроксипропилметилцеллюлозы или сочетания двух или нескольких из них, в котором аплиндор или его указанная фармацевтически приемлемая соль высвобождается со скоростью, обеспечивающей Смакс плазме, которое меньше, чем примерно 0,75 раз Смакс лекарственного препарата мгновенного высвобождения, содержащего аплиндор или его фармацевтически приемлемую соль.
2. Лекарственное средство для орального применения по п.1, где указанный замедляющий высвобождение полимер представляет собой образующие матрицу гидроксипропилметилцеллюлозы высокой вязкости, образующие
матрицу гидроксипропилметилцеллюлозы низкой вязкости или их комбинации.
3. Лекарственное средство для орального применения по п.2, где указанная образующая матрицу гидроксипропилметилцеллюлоза высокой вязкости представляет собой Methocel K4M, Methocel К15М, Methocel К100М, Methocel E4M или их комбинацию.
4. Лекарственное средство для орального применения по п.3, где указанная образующая матрицу гидроксипропилметилцеллюлоза высокой вязкости представляет собой Methocel K4M.
5. Лекарственное средство для орального применения по п.4, где указанная, образующая матрицу гидроксипропилметилцеллюлоза высокой вязкости включает Methocel K4M в количестве по массе примерно от 15% до примерно 80%.
6. Лекарственное средство для орального применения по п.4, где указанная образующая матрицу гидроксипропилметилцеллюлоза высокой вязкости включает Methocel K4M в количестве по массе примерно от 25% до примерно 50%.
7. Лекарственное средство для орального применения по п.2, где указанный образующий матрицу полимер низкой вязкости представляет собой гидроксипропилметилцеллюлозу, выбранную из Methocel K100LV, Methocel E50LV, Methocel E5, Methocel E15LV или комбинацию двух или нескольких из них.
8. Лекарственное средство для орального применения по п.7, где указанная образующая матрицу гидроксипропилметилцеллюлоза низкой вязкости представляет собой Methocel K100LV.
9. Лекарственное средство для орального применения по п.8, где указанная образующая матрицу гидроксипропилметилцеллюлоза низкой вязкости присутствует в количестве по массе примерно от 15% до примерно 80%.
10. Лекарственное средство для орального применения по п.8, где указанная образующая матрицу гидроксипропилметилцеллюлоза низкой вязкости присутствует в количестве по массе примерно от 20% до примерно 50%.
11. Лекарственное средство для орального применения по п.1, где указанные один или несколько замедляющих высвобождение полимеров содержат:
образующую матрицу гидроксипропилметилцеллюлозу высокой вязкости в количестве примерно от 20 до примерно 60 мас.% и
образующую матрицу гидроксипропилметилцеллюлозу низкой вязкости в количестве примерно от 20 до примерно 60 мас.%.
12. Лекарственное средство для орального применения по п.1, дополнительно включающее:
водорастворимый, компенсирующий эксципиент в количестве примерно от 0,5% до примерно 5 мас.%;
диспергируемый в воде эксципиент в количестве примерно от 5% до примерно 30 мас.% и
лубрикант в количестве примерно от 0,1% до примерно 1 мас.%, и
где указанный замедляющий высвобождение полимер представляет собой образующую матрицу гидроксипропилметилцеллюлозу, присутствующую в количестве от примерно 20% до примерно 80 мас.%.
13. Лекарственное средство для орального применения по п.1, дополнительно включающее:
водорастворимый компенсирующий эксципиент в количестве примерно от 0,5% до примерно 5 мас.%;
диспергируемый в воде эксципиент в количестве примерно от 5% до примерно 30 мас.% и
лубрикант в количестве примерно от 0,1% до примерно 1 мас.%;
где указанный замедляющий высвобождение полимер представляют собой образующую матрицу гидроксипропилметилцеллюлозу, присутствующую в количестве от примерно 25% до примерно 50 мас.%.
14. Лекарственное средство для орального применения по п.12, где указанная образующая матрицу гидроксипропилметилцеллюлоза представляет собой гидроксипропилметилцеллюлозу высокой вязкости, гидроксипропилметилцеллюлозу низкой вязкости или их сочетание.
15. Лекарственное средство для орального применения по п.2, где аплиндор присутствует в количестве примерно от 0,02% до примерно 16 мас.% от указанного препарата.
16. Лекарственное средство для орального применения по п.2, где указанное соединение присутствует в количестве примерно от 0,02% до примерно 4 мас.% от указанного препарата.
17. Способ лечения расстройства допаминергической системы, включающий введение нуждающемуся в таком лечении пациенту лекарственного средства для орального применения по п.1.
18. Способ лечения расстройства допаминергической системы, включающий введение нуждающемуся в таком лечении пациенту лекарственного средства для орального применения по п.15.
19. Лекарственное средство для орального применения по п.1, где указанное соединение высвобождается из указанного лекарственного средства со скоростью, обеспечивающей время достижения максимальной терапевтической концентрации аплиндора в плазме (Тмакс), которое, по меньшей мере, примерно в 1,5 раза больше, чем Тмакс лекарственного препарата мгновенного высвобождения, содержащего указанное соединение.
20. Лекарственное средство для орального применения по п.1, где указанное соединение высвобождается из указанного лекарственного средства со скоростью, обеспечивающей Тмакс, которое, по меньшей мере, примерно в 2 раза больше, чем Тмакс лекарственного препарата мгновенного высвобождения, содержащего указанное соединение.
21. Лекарственное средство для орального применения по п.1, где указанное соединение высвобождается из указанного лекарственного средства со скоростью, эффективной для обеспечения ППК0-12, которая составляет, по меньшей мере, примерно 1,05 от ППК0-12 лекарственного препарата мгновенного высвобождения, содержащего указанное соединение.
22. Лекарственное средство для орального применения по п.1, где указанное соединение высвобождается из указанного лекарственного средства со скоростью, эффективной для обеспечения ППК0-12, которая составляет, по меньшей мере, примерно 1,10 от ППК0-12 лекарственного препарата мгновенного высвобождения, содержащего указанное соединение.
23. Лекарственное средство для орального применения по п.1, содержащее около 0,1 мг указанного соединения, которое обеспечивает ППК0-12 примерно от 260 пкг·ч/мл до примерно 2400 пкг·ч/мл.
24. Лекарственное средство для орального применения по п.23, где указанная ППК0-12 составляет примерно от 290 пкг·ч/мл до примерно 1300 пкг·ч/мл.
25. Лекарственное средство для орального применения по п.1, содержащее около 0,1 мг указанного соединения, которое обеспечивает Cmax примерно от 40 пкг·ч/мл до примерно 190 пкг·ч/мл.
26. Лекарственное средство для орального применения по п.25, где указанная Cmax составляет примерно от 40 пкг·ч/мл до примерно 180 пкг·ч/мл.
27. Лекарственное средство для орального применения по п.1, содержащее около 5 мг указанного соединения, которое обеспечивает ППК0-12 примерно от 36000 пкг·ч/мл до примерно 109000 пкг·ч/мл.
28. Лекарственное средство для орального применения по п.27, где указанная ППК0-12 составляет примерно от 36000 пкг·ч/мл до примерно 75000 пкг·ч/мл.
29. Лекарственное средство для орального применения по п.1, содержащее около 5 мг указанного соединения, которое обеспечивает Смакc в плазме примерно от 4000 пкг/мл до примерно 14000 пкг/мл.
30. Лекарственное средство для орального применения по п.29, где указанная Смакс в плазме составляет примерно от 6000 пкг/мл до примерно 12000 пкг/мл.
31. Лекарственное средство для орального применения по п.1, содержащее около 30 мг указанного соединения, которое обеспечивает ППК0-12 примерно от 121000 пкг·ч/мл до примерно 890000 пкг·ч/мл.
32. Лекарственное средство для орального применения по п.31, где указанная ППК0-12 составляет примерно от 170000 пкг·ч/мл до примерно 760000 пкг·ч/мл.
33. Лекарственное средство для орального применения по п.1, содержащее около 30 мг указанного соединения, которое обеспечивает Смакc в плазме примерно от 18000 пкг/мл до примерно 110000 пкг/мл.
34. Лекарственное средство для орального применения по п.33, где указанная Смакc в плазме составляет примерно от 20000 пкг/мл до примерно 92000 пкг/мл.
35. Набор лекарственных средств для орального применения, включающий множество отдельных лекарственных средств для орального применения по п.1, где два или несколько из указанных отдельных лекарственных средств для орального применения включают различные количества указанного аплиндора.
36. Набор лекарственных средств для орального применения по п.35, в котором, по меньшей мере, одно из указанных отдельных лекарственных средств для орального применения включает примерно от 0,05 до примерно 0,4 мг указанного аплиндора по п.1.
37. Набор лекарственных средств для орального применения по п.35, в котором два или несколько из указанных отдельных лекарственных средств для орального применения включают 0,05 мг, 0,1 мг, 0,2 мг, 0,25 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,75 мг, 1 мг, 1,5 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 8 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 20 мг, 23 мг, 24 мг, 25 мг, 26 мг или 30 мг аплиндора.
38. Набор по п.35, в котором два или несколько различных отдельных лекарственных средства для орального применения включают различные количества аплиндора, в количествах, отличающихся, по меньшей мере, на десять процентов, и где количество аплиндора в двух или нескольких из различных отдельных лекарственных средствах для орального применения находится в интервале примерно от 0,05 мг до примерно 30 мг.
39. Набор по п.38, в котором два или несколько из различных отдельных лекарственных средств замедленного высвобождения для орального применения обеспечивают ППК0-12 в интервале примерно от 260 пкг·ч/мл до примерно 890000 пкг·ч/мл.
40. Способ введения аплиндора или его фармацевтически приемлемой соли, включающий:
a) введение нуждающемуся в этом млекопитающему исходного лекарственного средства для орального применения, содержащего аплиндор и один или несколько замедляющих высвобождение полимеров, в котором аплиндор или его указанная фармацевтически приемлемая соль высвобождается со скоростью, обеспечивающей Смакc в плазме, которое меньше, чем примерно 0,75 раз Смакc в плазме лекарственного препарата мгновенного высвобождения, содержащего аплиндор или его фармацевтически приемлемую соль, и затем
b) введение млекопитающему, по меньшей мере, одного другого лекарственного средства для орального применения, содержащего аплиндор и один или несколько замедляющих высвобождение полимеров, в котором аплиндор или его указанная фармацевтически приемлемая соль высвобождается со скоростью, обеспечивающей Смакc в плазме, которое меньше, чем примерно 0,75 раз Смакc в плазме лекарственного препарата мгновенного высвобождения, содержащего аплиндор или его фармацевтически приемлемую соль,
где указанное исходное лекарственное средство для орального применения включает, по меньшей мере, десять процентов аплиндора относительно другого лекарственного средства для орального применения.
41. Лекарственное средство для орального применения для лечения расстройства допаминергической системы, содержащее аплиндор и один или несколько замедляющих высвобождение полимеров, где один или несколько замедляющих высвобождение полимеров замедляют или контролируют высвобождение аплиндора, или его фармацевтически приемлемую соль, где аплиндор присутствует в препарате в количестве, обеспечивающем ППК0-12 в интервале примерно от 260 пкг·ч/мл до примерно 89000 пкг·ч/мл во время введения млекопитающему.
42. Лекарственное средство для орального применения по п.41, где лекарственное средство представлено в виде единичной дозы или множественных доз.
| US 6350773, B1, 26.02.2002 | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
Авторы
Даты
2009-12-27—Публикация
2004-10-28—Подача