Настоящая заявка имеет приоритет по патентной заявке США №09/071699, поданной 1 мая 1998 г., полное содержание которой включено в данную заявку в качестве ссылки. В тексте данной заявки ссылки на другие публикации приведены в скобках. Полную библиографию для этих ссылок можно найти в конце текста непосредственно перед списком последовательностей. Содержание этих публикаций в полном объеме включено в настоящую заявку в качестве ссылок с целью более полного описания состояния проблемы в той области техники, к которой относится настоящее изобретение.
Предпосылки изобретения
В настоящее время отсутствуют эффективные вакцины для профилактики иммунодефицита кошачьих и инфекционного перитонита кошачьих у домашних кошек. Сейчас доступны вакцины против вируса лейкоза кошачьих, однако их эффективность остается сомнительной, а в ряде случаев они могут вызывать заболевание. Следовательно, в данной области техники имеется потребность в агентах и композициях, которые бы защищали от этих и других заболеваний, против которых пока нет вакцин, или улучшали уже существующие и обычно применяемые вакцины. Кроме того, затруднена вакцинация котят из-за невозможности противостоять материнским антителам у них. Значит, также есть необходимость в безопасных и эффективных агентах для преодоления таких барьеров.
Стимуляция в организме активации и пролиферации Т-лимфоцитов в ответ на заболевание, как считается, определяется двумя взаимодействиями: распознаванием Т-клеточного рецептора (TCR) иммуногенными пептидами с участием молекул класса I главного комплекса гистосовместимости (МНС) и вторичное взаимодействие вспомогательных лигандов, таких как CD80 и CD86, с соответствующими им рецепторами - CD28 и (или) CTLA-4 - на поверхности Т-лимфоцита. Эффективное взаимодействие этих двух механизмов обусловливает активацию и пролиферацию и CD4-позитивных, и CD8-позитивных Т-клеток и увеличение выработки иммунорегуляторных цитокинов типов Th1 и Тh2. В отсутствие адекватной костимуляции Т-клеток может развиваться анергическое состояние, при котором Т-клетки не способны пролиферировать и выделять цитокины. В течение многих лет ключевыми регуляторами Т-клеточных ответов считались две молекулы - рецептор CD28 и его лиганды CD80 и CD86. CD28 является первичным Т-клеточным костимуляторным рецептором, который по связыванию с CD80 и CD86 усиливает пролиферацию Т-клеток и синтез цитокинов, предотвращая гибель Т-клеток. CTLA-4 (также обозначаемый как CD152), являющийся гомологом CD28, также играет важную роль в процессе костимуляции. Хотя это точно не определено, предполагается, что он подавляет костимуляторные Т-клеточные ответы. Взаимодействие между CD28, CTLA-4 и их лигандами CD80 и CD86 в процессе костимуляции является ключом к индукции и супрессии иммунных ответов на заболевание в организме в целом. Путем манипулирования этими четырьмя костимуляторными молекулами, по-видимому, можно регулировать Т-клеточный ответ по пути активации, подавления или изменения направления, можно усиливать желаемый иммунный ответ в отношении конкретного патогена или заболевания. В частности, они могут быть использованы для вакцинации против инфекционных заболеваний, для лечения инфекционных заболеваний и лечения опухолевых дегенеративных, аутоиммунных и иммунодефицитных состояний.
Т-лимфоциты иммунной системы млекопитающих выполняют и регуляторные, и эффекторные функции. Предшественники Т-клеток возникают в костном мозге из стволовых клеток и мигрируют в тимус. В тимусе происходят процессы созревания и селекции с образованием популяции наивных иммунокомпетентных клеток, которые способны распознавать антиген при его презентации в сочетании с главным комплексом гистосовместимости (MHC), но при этом не являются аутореактивными. После созревания в тимусе каждая Т-клетка несет клональный Т-клеточный рецептор (TCR), который определяет ее антигенную специфичность. Кроме того, Т-клетки двух основных подклассов, обнаруживаемых у большинства взрослых млекопитающих - CD4+ и CD8+, несут TCR, составленный α- и β-субъединицами (Allison & Lanier, 1987).
Полипептидная и генная организация белка TCR сходна с таковой, характерной для молекул иммуноглобулина (Ig), и она проявляет многие сходные характеристики по сравнению с мембраносвязанными Ig В-лимфоцитов (Allison & Lanier, 1987). Как и молекула Ig, TCR потенциально должен распознавать огромное количество возможных антигенных последовательностей. С этой точки зрения организация и реаранжировка гена TCR сходна по своей сложности с таковыми в В-клетках (Davis & Bjorkman, 1988). Как и в случае с иммуноглобулинами В-клеток, образование идиотипического многообразия Т-клеток связано с наличием множественных копий генов вариабельных доменов (V) в линии половых клеток, происходящими случайным образом реаранжировками α- и β-субъединиц и с изменчивостью, обусловливаемой явлениями соединений и вставок (Davis & Bjorkman, 1988). Однако, в отличие от В-клеток, образование многообразия Т-клеток, по-видимому, не связано с соматическими мутациями, хотя потенциальный репертуар молекул TCR не уступает таковому молекул Ig (Lechler et al., 1990).
Молекула TCR, хотя и отвечает за распознавание антигена, не способна к передаче сигнала (Allison & Lanier, 1987). Конформационные изменения TCR после связывания с участием антигена MHC, находящегося на антиген-презентирующих клетках (АРС), обусловливает передачу сигнала через нековалентный комплекс поверхностных молекул, включающий CD3 и ζ-субъединицы (Clevers et al., 1988). Связывание на TCR обусловливает фосфорилирование CD3-комплекса, что косвенным образом приводит к внесению в клетку ионов кальция, в результате чего происходит инициация выработки IL-2 и IL-2R (Weiss & Littman, 1994). Этот каскад рассматривается как исходное событие в активации Т-клеток.
TCR распознает антиген только тогда, когда он презентирован с участием МНС. Известны два класса МНС-белков, которые связаны с процессом презентирования антигена на Т-клетке. Молекулы класса I МНС обнаруживаются практически на всех ядерных клетках тела, и их функцией является перенос эндогенных пептидов на поверхность клеток (Matаsumura et al., 1992). Пептид, экспрессированный с участием МНС класса I, распознается Т-клетками, экспрессирующими CD8 в связи с TCR (Littman, 1987). CD8-позитивные Т-клетки выполняют функцию иммунного надзора за уничтожением клеток, зараженных вирусом, и опухолевых клеток. Распознавание Т-клеткой CD8+ «чужих» молекул (пептидов или измененных своих пептидов, что может свидетельствовать о развитии опухоли) обусловливает разрушение этой клетки, осуществляемое с участием цитотоксичных Т-лимфоцитов (CTL) (Berke, 1994).
Молекулы класса II МНС, представляющие вторую группу факторов главного комплекса гистосовместимости, в норме обнаруживаются только у специализированных антиген-презентирующих клеток, включая В-лимфоциты, макрофаги/моноциты и дендритные клетки, хотя возможна их индукция и в некоторых других типах клеток в ответ на специфичные стимулы (Germain, 1993). Молекула класса II МНС отвечает за презентирование внешнего антигена на CD4-позитивную Т-клетку. Антиген, который был фагоцитирован, эндоцитирован или связан поверхностным Ig с последующим поглощением клеткой, претерпевает эндогенную обработку и связывается с молекулой класса II МНС (Unanue, 1987). Затем такая молекула выходит на поверхность клетки и становится доступной для распознавания ее CD4-позитивными Т-клетками αβ-TCR (Littman, 1987). Распознавание антигена Т-клетками CD4+ обусловливает выработку цитокинов и факторов роста, необходимых для инициации и распространения различных элементов активного иммунного ответа (Mosmann & Coffman, 1987).
Дифференцировка групп Т-клеток αβ-TCR определяется наличием CD4 и CD8, что связано с детерминацией функций каждой из этих групп. Одновременное присутствие CD4 и CD8 на Т-клетке исключено (Littman, 1987). Т.е. в процессе селекции и созревания в тимусе Т-клетки-αβ получают только CD4 либо CD8. Эти молекулы обеспечивают стабильность взаимодействия между TCR и МНС-связанным антигеном и определяют для данной Т-клетки то, каким классом молекул МНС (I или II) презентируется антиген (Littman, 1987). Связывающий домен молекулы CD4 или CD8 распознает соответствующий неполиморфный участок молекулы класса I или класса II (Clayberger et al., 1994). Связывание CD4 или CD8 с этими специфическими участками обеспечивает стабильность взаимодействия TCR и МНС-связанного антигена с точки зрения инициации Т-клеточной активации (Littman, 1987). Таким образом, CD4-позитивные Т-клетки функционально взаимодействуют только с клетками АРС, презентирующими антиген с помощью молекул класса II и инициирующими тем самым Т-хелперный ответ, в то время как CD8-позитивные Т-клетки распознают только антиген, презентируемый с участием молекул класса I, после связывания которого инициируется цитотоксический ответ (Germain, 1993). Два различающихся фенотипа - Т-хелперы и CTL - могут быть идентифицированы по поверхностно-клеточной экспрессии либо CD4, либо CD8.
Большинство СD4-позитивных Т-лимфоцитов в целом рассматриваются как Т-хелперная популяция, хотя имеется и предполагаемый CD4-позитивный CTL-подтип (Yasukawa et al., 1989). CD4-позитивные Т-хелперы являются основными регуляторами иммунного ответа за счет выработки серии стимуляторных и супрессорных цитокинов (Mosmann & Coffman, 1987). Вырабатываемые этими клетками факторы являются важными медиаторами инициации и гуморального, т.е. опосредованного антителами, и клеточного, т.е. гиперчувствительности замедленного типа (DTH), ответов (Mosmann & Coffman, 1987). Для того чтобы Т-клетки CD4+ активировались по выработке растворимых факторов роста, должен произойти сложный каскад процессов. Антиген выявляется и подвергается эндоцитозу специфическими АРС-клетками, которые в норме являются макрофагами (Unanue, 1984). АРС денатурируют антигенный белок и разделяют его на меньшие фрагменты, после чего 15-18-аминокислотные пептиды связываются молекулами МНС в эндоплазматическом ретикулюме и после этого переносятся на поверхность клетки (Rotzschke et al., 1994). Перенесенный на поверхность антиген становится в результате «видимым» для Т-клеток и может быть распознан группами Т-клеток, экспрессирующих CD4 и имеющих соответствующий TCR-идиотип (Germain, 1993). Когда происходит точное распознавание антигена Т-клеткой и образуются точные вспомогательные сигналы, происходит дифференцировка «наивного» лимфоцита и запускается его клональная пролиферация. По пока не установленным причинам происходит предпочтительное формирование ответа 1-го типа (клеточного) по отношению к ответу 2-го типа (гуморальному) (Mosmann & Coffman, 1989).
Участие Т-хелперов является необходимым для обеспечения активности и гуморального, и клеточного ответов. В зависимом от Т-клеток В-клеточном ответе, необходимом для выработки антител к большинству антигенов, Т-хелперы нужны для обеспечения правильного созревания В-клеток (Chesnut et al., 1986). После того, как экспрессируемый В-клеткой поверхностный Ig связал антиген, происходит интернализация, процессинг и вывод антигена на поверхность молекулами класса II МНС (Germain, 1993). Непосредственный межклеточный контакт между Т-клеткой CD4+, имеющей точный TCR-идиотип, и В-клеткой способствует активации и пролиферации этой Т-клетки (Chesnut et al., 1986). Активированный Т-хелпер может инициировать ответ 2-го типа за счет секреции факторов, необходимых для роста и дифференцировки В-клеток (Mosmann & Coffman, 1989). Этими факторами являются интерлейкины IL-4, IL-5 и IL-13, которые способны индуцировать активацию и пролиферацию В-клеток, а также важны в процессе изотипического переключения молекул антител, в то время как IL-10 предотвращает инициацию ответа 1-го типа, что в свою очередь является фактором негативной регуляции гуморального ответа (Mosmann & Coffman, 1989).
Клеточные ответы (1-й тип) индуцируются не так, как гуморальные ответы (2-й тип) (Sher et al., 1992). После активации Т-клеток и их созревания для ответа 1-го типа этой Т-клеткой вырабатываются факторы, которые способствуют клеточному иммунитету. IL-2 является Т-клеточным фактором роста, который также активирует CTL-ответы, в то время как γ-интерферон активирует макрофаги, CTL и нейтрофилы (Wang et al., 1993).
Таким образом, Т-хелперы способны опосредовать два принципиально взаимоисключающих ответа. Признак секреции цитокинов, связанный с инициацией гуморального ответа, включает факторы, которые являются супрессорами клеточного ответа, и наоборот (Mosmann & Coffman, 1989). Пока неясно, что заставляет Т-клетку проявлять либо признак 1-го типа (выработка IL-2, γ-интерферона и лимфотоксина), либо признак 2-го типа (IL-4, IL-5, IL-6, IL-10 и IL-13), хотя предполагается, что на формирующийся вариант цитокинового профиля могут влиять тип АРС, которая презентирует данный антиген, или растворимые факторы, вырабатываемые этой АРС (Mosmann & Coffman, 1989). В дополнение к хелперным клеткам 1-го и 2-го типов существует так называемый 0-й тип хелперов, который характеризуется параметрами цитокиновой секреции, промежуточными по отношению к 1-му и 2-му типам (Gajewski et al., 1989). Хотя типы хелперов в основном были охарактеризованы в экспериментах in vitro, т.е. могут отражать культуральные артефакты, они являются важными моделями той роли, которую Т-хелпер играет в контроле развития специфических ответов в ситуации in vivo.
В дополнение к CD4-позитивным Т-хелперным лимфоцитам вторая популяция Т-клеток-αβ составлена CD8-позитивными цитотоксическими лимфоцитами (CTL). Считается, что CTL-CD8+ играют ведущую роль в системе иммунного надзора, основная функция которой связана с разрушением клеток, инфицированных вирусами или внутриклеточными бактериями, а также опухолевых клеток (Berke, 1994). Эти клетки также способы вырабатывать цитокины, но, в целом, только такие, которые связаны с индукцией клеточных ответов (IL-2, γ-интерферон и TNF) (Fong & Mosmann, 1990). Рецептор TCR этих клеток с участием CD8 распознает антиген, презентированный с помощью молекул класса I МНС (Littman, 1987). В целом, все ядерные клетки характеризуются поверхностной экспрессией молекул класса I, презентирующих внутриклеточно синтезированные пептиды (Matasumara, 1992). Специфичные по иммунной активности участки, включая головной мозг и семенники, характеризуются низким уровнем белкового синтеза, хотя он и индуцируется в этих участках под воздействием интерферона (Moffett & Paden, 1994).
Белки, вырабатываемые в эндоплазматическом ретикулюме в ходе нормальной жизнедеятельности клетки, денатурируются, частично расщепляются и с помощью молекул класса I МНС выносятся на поверхность (Engelhard, 1994). Эти полипептиды протеолитически линеаризуются и связываются в виде 9-12-аминокислотных эпитопов молекулами класса I, которые затем выносятся на поверхность этой клетки (Engelhard, 1994). Теоретически таким образом на поверхности могут оказаться любые внутриклеточно синтезированные белки, поэтому в результате селекции в тимусе обусловливается идеальная элиминация всех аутореактивных Т-клеток, а система иммунного надзора может выявить присутствие инфицированных вирусом или трансформированных клеток (Berke, 1993). Распознавание чужеродных пептидов, экспрессируемых молекулами класса I, осуществляется антиген-специфичными Т-клеточными рецепторами на поверхности CTL-CD8+ (Lechler et al., 1990). Для активации необходим контакт между эффекторной клеткой и мишенью (Berke, 1994). Когда антиген, рассматриваемый как чужеродный, детектируется рецептором TCR, взаимодействие молекул стабилизируется за счет связывания CD8 с молекулой класса I на поверхности инфицированной клетки (Littman, 1987). После распознавания и активации Т-клетки образуется «конъюгат» между клеткой-мишенью и эффекторной Т-клеткой, после чего эффекторная клетка уничтожается (Taylor & Cohen, 1992). Таким образом, в таком механизме при изменении собственных белков или при нарушении клеточных механизмов в результате атаки патогена пептиды становятся распознаваемыми системой иммунного надзора, в результате чего данный элемент иммунной системы обеспечит уничтожение больной клетки (Berke, 1994).
Цитотоксичность, как считается, обусловливается одним из двух основных механизмов. Либо в клетке индуцируется апоптоз, либо она лизируется с участием цитотоксических гранул, секретируемых CTL (Berke, 1993). Апоптоз в клетках-мишенях индуцируется путем секреции клетками CTL факторов, которые индуцируют экспрессию генов, обусловливающих гибель клетки (Russel, 1983). Преимуществом этого механизма является отсутствие лизиса клетки, что снижает вероятность выхода потенциально инфекционно опасного содержимого этой клетки (Nagata & Golstein, 1995). Однако клеточный лизис может являться наиболее общим механизмом, в соответствии с которым происходит направленное уничтожение клеток. Основным компонентом вырабатываемых клетками CTL «цитотоксических гранул» является белок перфорин, который «протыкает» мембраны клеток-мишеней (Liu et al., 1995). Хотя существуют и другие типы клеток, вовлеченных в данную форму иммунного надзора, считается, что CTL являются основным компонентом противовирусного и противоопухолевого иммунитета и рассматриваются как необходимое звено в защите от конкретных патогенов (Kupfer & Singer, 1989).
Исходно поверхностно-клеточные белки использовались для разграничения конкретных клеточных популяций. Позже были установлены функциональные аспекты многих из этих молекул, а с учетом их значения для дифференцировки клеточных популяций стала более понятной их важная роль в функционировании многих клеток.
Различные вспомогательные молекулы и молекулы адгезии, которые участвуют в развитии иммунного ответа, экспрессируются Т-клетками и антиген-презентирующими клетками (van Seventer et al., 1991). Молекулы адгезии экспрессируются на определенном уровне большинством клеток иммунной системы. Они важны для сохранения клеток в определенном участке и для инициации и поддержания межклеточных контактов (Mescher, 1992).
Два комплекса молекул адгезии - CD2/LFA-3 (CD58) и LFA-1/ICAM-1 - участвуют в стабилизации взаимодействия Т-клеток и клеток АРС и усилении активности (Springer et al., 1987). CD2 является одним из первых маркеров, экспрессируемых предшественниками Т-лимфоцитов, и существует на протяжении всей жизни этой клетки, в то время как LFA-1 экспрессируется Т-клетками позже и позитивно регулируется в клетках памяти или по типу индуцибельности (Springer et al., 1987).
Комплексы вспомогательных молекул также проявляют адгезионные свойства, но их основной функцией, по-видимому, является передача межклеточного сигнала после связывания лиганда (Anderson et al., 1988). После установления взаимодействия между рецептором и его лигандом происходит такое изменение конформационной структуры молекулы, которое обусловливает передачу сигнала в цитоплазму одной или обеих клеток (Hutchcroft & Bierer, 1994). Передаваемые этими молекулами сигналы выполняют ряд функций по способствованию развитию Т-клеток, однако в отсутствие сигналов, опосредуемых этими молекулами, Т-клетки могут становиться анергическими (Leung & Lindsley, 1994).
Взаимодействие CD28/CD80 является основным компонентом интенсивного иммунного ответа, опосредуемого Т-клетками (Linsley et al., 1993a). Взаимодействие вспомогательных молекул CD28 с соответствующим им лигандом CD80 необходимо для полной активации и пролиферации «наивных» Т-клеток (Linsley et al., 1991a). Также это взаимодействие, как считается, играет ключевую роль в пролиферации активированных CD4-позитивных Т-клеток памяти и в предотвращении апоптотической гибели клеток (Linsley et al., 1991a). Установление такого взаимодействия и расшифровка его механизмов дает ключ к пониманию процессов иммунитета, опосредуемого Т-клетками.
Сущность изобретения
Настоящее изобретение относится к выделенной и очищенной ДНК, кодирующей лиганд CD80 (B7-1) кошки, лиганд CD86 (B7-2) кошки, рецептор CD28 кошки или рецептор CTLA-4 (CD152) кошки, а также к векторам, включающим нуклеиновую кислоту, кодирующую CD80 кошки, CD86 кошки, CD28 кошки или CTLA-4 кошки. Настоящее изобретение относится к клеткам-хозяевам, трансформированным CD80-кодирующими векторами, CD86-кодирующими векторами, CD28-кодирующими векторами или CTLA-4-кодирующими векторами. Настоящее изобретение относится к полипептидам, кодируемым нуклеиновой кислотой CD80 кошки, CD86 кошки, CD28 кошки или CTLA-4 кошки.
Настоящее изобретение относится к вакцине, содержащей эффективное количество полипептидов, кодируемых нуклеиновой кислотой CD80 кошки, CD86 кошки, CD28 кошки или CTLA-4 кошки. Также настоящее изобретение относится к вакцинам, которые дополнительно содержат иммуногены, производные от патогенов. Настоящее изобретение относится к вакцинам, способным усиливать иммунный ответ. Также настоящее изобретение относится к вакцинам, способным подавлять иммунный ответ.
Краткое описание чертежей
Фиг.1А - нуклеотидная и аминокислотная последовательности CD80 (B7-1) кошки (TAMU) (SEQ ID NO: 1 и 2).
Фиг.1В - спектр гидрофобности аминокислотной последовательности CD80 (B7-1) кошки (TAMU).
Фиг.2А - нуклеотидная и аминокислотная последовательности CD80 (B7-1) кошки (SYNTRO) (SEQ ID NO: 3 и 4).
Фиг.2В - спектр гидрофобности аминокислотной последовательности CD80 (B7-1) кошки (SYNTRO).
Фиг.3А - нуклеотидная и аминокислотная последовательности CD86 (B7-2) кошки (SEQ ID NO: 5 и 6).
Фиг.3В - спектр гидрофобности аминокислотной последовательности CD86 (B7-2) кошки.
Фиг.4А - нуклеотидная и аминокислотная последовательности CD28 кошки (SEQ ID NO: 7 и 8).
Фиг.4В - спектр гидрофобности аминокислотной последовательности CD28 кошки.
Фиг.5А - нуклеотидная и аминокислотная последовательности CTLA-4 (CD152) кошки (SEQ ID NO: 9 и 10).
Фиг.5В - спектр гидрофобности аминокислотной последовательности CTLA-4 (CD152) кошки.
Подробное описание изобретения
Настоящее изобретение представляет выделенную нуклеиновую кислоту, кодирующую лиганд CD80 кошки или растворимый лиганд CD80 кошки. Также настоящее изобретение представляет выделенную нуклеиновую кислоту, кодирующую лиганд CD86 кошки или растворимый лиганд CD86 кошки. Также настоящее изобретение представляет выделенную нуклеиновую кислоту, кодирующую рецептор CD28 кошки или растворимый рецептор CD28 кошки. Также настоящее изобретение представляет выделенную нуклеиновую кислоту, кодирующую рецептор CTLA-4 кошки или растворимый рецептор CTLA-4 кошки.
В одном из осуществлений настоящее изобретение представляет нуклеиновую кислоту, кодирующую лиганд CD80 кошки, который характеризуется аминокислотной последовательностью, показанной на фиг. 1А, начиная с остатка метионина и заканчивая остатком треонина (SEQ ID NO: 1). В другом осуществлении настоящее изобретение представляет нуклеиновую кислоту, кодирующую лиганд CD86 кошки, который характеризуется аминокислотной последовательностью, показанной на фиг. 3А, начиная с остатка метионина и заканчивая остатком глутамина (SEQ ID NO: 5). Еще в одном осуществлении настоящее изобретение представляет нуклеиновую кислоту, кодирующую рецептор CD28 кошки, который характеризуется аминокислотной последовательностью, показанной на фиг. 4А, начиная с остатка метионина и заканчивая остатком серина (SEQ ID NO: 7). В другом осуществлении настоящее изобретение представляет нуклеиновую кислоту, кодирующую рецептор CTLA-4 кошки, который характеризуется аминокислотной последовательностью, показанной на фиг. 5А, начиная с остатка метионина и заканчивая остатком аспарагина (SEQ ID NO: 9).
В осуществлении описанного выше изобретения нуклеиновой кислотой является ДНК или РНК. В другом осуществлении ДНК является кДНК или геномной ДНК.
Настоящее изобретение представляет олигонуклеотид, состоящий по крайней мере из 12 нуклеотидов, характеризующийся комплементарностью по отношению к уникальной последовательности, имеющейся в составе нуклеиновой кислоты, кодирующей CD28, CD80, CD86 или CTLA-4, описанной выше. В другом осуществлении настоящего изобретения представляется олигонуклеотид, состоящий по крайней мере из 15 или 16 нуклеотидов, который характеризуется комплементарностью по отношению к уникальной последовательности, присутствующей в составе нуклеиновой кислоты, кодирующей CD28, CD80, CD86 или CTLA-4, описанной выше.
В другом осуществлении описываемого выше изобретения представляется олигонуклеотид, который помечен определяемой меткой. В одном из осуществлений выявляемой меткой является радиоактивный изотоп, флуорофор или биотин. В другом осуществлении такой олигонуклеотид избирательно метилирован.
Настоящее изобретение представляет вектор, включающий нуклеиновую кислоту, кодирующую лиганд CD80 кошки или растворимый лиганд CD80 кошки. В другом осуществлении настоящего изобретения представляется плазмидный вектор, обозначенный PSI-B7-1/871-35 (Коллекция АТСС, депозитарный № 209817). Эта плазмида была депонирована в Американскую коллекцию типовых культур (АТСС) 29 апреля 1998 года (адрес которой - 10801 University Boulevard, Manassas, VA 20108-0971, США) в соответствии с Будапештским соглашением о Международных правилах депонирования микроорганизмов для целей осуществления процедуры патентования.
Настоящее изобретение представляет вектор, включающий нуклеиновую кислоту, кодирующую лиганд CD86 кошки или растворимый лиганд CD86 кошки. В другом осуществлении настоящего изобретения представляется плазмидный вектор, обозначенный B7-2#19-2/011298 (АТСС, депозитарный № 209821). Эта плазмида была депонирована в Американскую коллекцию типовых культур (АТСС) 29 апреля 1998 года (адрес которой - 10801 University Boulevard, Manassas, VA 20108-0971, США) в соответствии с Будапештским соглашением о Международных правилах депонирования микроорганизмов для целей осуществления процедуры патентования.
Настоящее изобретение представляет вектор, включающий нуклеиновую кислоту, кодирующую рецептор CD28 кошки или растворимый рецептор CD28 кошки. В другом осуществлении настоящего изобретения представляется плазмидный вектор, обозначенный PSI-CD28-#7/100296 (АТСС, депозитарный № 209819). Эта плазмида была депонирована в Американскую коллекцию типовых культур (АТСС) 29 апреля 1998 года (адрес которой - 10801 University Boulevard, Manassas, VA 20108-0971, США) в соответствии с Будапештским соглашением о Международных правилах депонирования микроорганизмов для целей осуществления процедуры патентования.
Настоящее изобретение представляет вектор, включающий нуклеиновую кислоту, кодирующую рецептор CTLA-4 кошки или растворимый рецептор CTLA-4 кошки. В другом осуществлении настоящего изобретения представляется плазмидный вектор, обозначенный CTLA-4-#1/091997 (АТСС, депозитарный № 209820). Эта плазмида была депонирована в Американскую коллекцию типовых культур (АТСС) 29 апреля 1998 года (адрес которой - 10801 University Boulevard, Manassas, VA 20108-0971, США) в соответствии с Будапештским соглашением о Международных правилах депонирования микроорганизмов для целей осуществления процедуры патентования.
Настоящее изобретение представляет описанный выше вектор, который дополнительно включает промотор, функционально присоединенный к нуклеиновой кислоте. В другом осуществлении настоящее изобретение представляет клетку-хозяина, которая несет любой из упоминавшихся выше векторов. В одном из осуществлений такой клеткой-хозяином, несущей один из упомянутых выше векторов, является эукариотическая или прокариотическая клетка. В другом осуществлении клеткой-хозяином являются клетки E.coli, клетки дрожжей, клетки COS, клетки РС12, клетки СНО или клетки GH4C1.
Настоящее изобретение представляет полипептид, кодируемый нуклеиновой кислотой лиганда CD80 кошки или растворимого лиганда CD80 кошки. В осуществлении настоящего изобретения представляется полипептид, кодируемый нуклеиновой кислотой лиганда CD86 кошки или растворимого лиганда CD86 кошки. В другом осуществлении настоящего изобретения представляется полипептид, кодируемый нуклеиновой кислотой рецептора CD28 кошки или растворимого рецептора CD28 кошки. Настоящее изобретение представляет полипептид, кодируемый нуклеиновой кислотой рецептора CTLA-4 кошки или растворимого рецептора CTLA-4 кошки.
В другом осуществлении настоящего изобретения представляется способ продукции упоминавшихся выше полипептидов путем культивирования клетки-хозяина, которая экспрессирует эти полипептиды, и выделения этих полипептидов, получаемых таким образом.
Настоящее изобретение представляет вакцину, содержащую эффективное количество упоминавшихся выше полипептидов и подходящий носитель. В другом осуществлении изобретения представляется вакцина, в составе которой эффективное количество упомянутого выше полипетида и подходящего носителя является количеством от примерно 0,01 мг до примерно 100 мг на 1 дозу. В другом осуществлении изобретения представляется вакцина, в которой эффективное количество упомянутого выше полипетида и подходящего носителя является количеством от примерно 0,25 мг на 1 кг веса тела кошки в день до примерно 25 мг на 1 кг веса тела кошки в день.
Далее настоящее изобретение представляет упоминавшуюся выше вакцину, которая дополнительно содержит иммуноген, производный от патогена. В другом осуществлении изобретения такой иммуноген в составе вакцины происходит от кошачьего патогена, вируса бешенства, хламидии, Toxoplasma gondii, Dirofilaria immitis, блох или бактериальных патогенов. В другом осуществлении изобретения представляется вакцина, в составе которой патогеном является вирус иммунодефицита кошачьих (FIV), вирус лейкоза кошачьих (FeLV), вирус инфекционного перитонита кошачьих (FIP), вирус панлейкопении кошачьих, калицивирус кошачьих, реовирус кошачьих 3-го типа, ротавирус кошачьих, коронавирус кошачьих, респираторно-синцитиальный вирус кошачьих, вирус саркомы кошачьих, герпес-вирус кошачьих, вирус болезни Борна кошек или кошачий паразит.
Также настоящее изобретение представляет способ индукции иммунитета у кошек, который включает введение кошке дозы вакцины, содержащей любой из указывавшихся выше иммуногенов. Также настоящее изобретение представляет способ усиления иммунного ответа у кошки, который включает эффективную дозу полипептида, иммуногена и подходящего носителя. Настоящее изобретение представляет способ введения упомянутой выше вакцины подкожно, внутримышечно, системно, местно или перорально.
В другом осуществлении настоящего изобретения представляется способ подавления иммунного ответа у кошки, который включает введение этой кошке эффективного по подавлению иммунного ответа количества полипептида, кодируемого нуклеиновой кислотой CTLA-4 кошки. В другом осуществлении изобретения представляется способ подавления иммунного ответа у кошки, включающий введение этой кошке эффективного по подавлению иммунного ответа количества растворимого полипептида, кодируемого CD80 кошки, CD86 кошки или CD28 кошки.
В другом осуществлении настоящего изобретения представляется способ подавления иммунного ответа у кошки путем введения полипептида, кодируемого нуклеиновой кислотой CTLA-4 кошки, в количестве от примерно 0,25 мг на 1 кг веса тела в день до 25 мг на 1 кг веса тела в день. В другом осуществлении изобретения представляется способ подавления иммунного ответа у кошки путем введения полипептида, кодируемого CD80 кошки, CD86 кошки или CD28 кошки, в количестве от примерно 0,25 мг на 1 кг веса тела в день до 25 мг на 1 кг веса тела в день.
Также настоящее изобретение представляет способ подавления иммунного ответа у кошки с диагнозом аутоиммунного заболевания или у кошки-реципиента пересадки ткани или органа путем введения этой кошке эффективного по подавлению иммунного ответа количества полипептида, кодируемого нуклеиновой кислотой CTLA-4 кошки.
Настоящее изобретение также представляет способ подавления иммунного ответа у кошки с диагнозом аутоиммунного заболевания или у кошки-реципиента пересадки ткани или органа путем введения этой кошке эффективного по подавлению иммунного ответа количества полипептида, кодируемого CD80 кошки, CD86 кошки или CD28 кошки.
Настоящее изобретение представляет выделенную и очищенную кДНК CD80 (B7-1) длиной примерно 941 нуклеотид. Изобретение также представляет выделенный и очищенный полипептид CD80 кошки, состоящий примерно из 292 аминокислот, являющийся связанной с мембранной или зрелой формой с молекулярной массой 33,485 кДа, изоэлектрической точкой примерно pI=9,1 и общим зарядом при рН 7,0, равным 10. Коэкспрессия CD80 с костимуляторной молекулой CD28 и с опухолевым антигеном или антигеном патогенного организма проявляет способность к активации или усилению активации Т-лимфоцитов, индуцируя тем самым выработку иммуностимулирующих цитокинов, и к регуляции роста других клеточных типов. Коэкспрессия CD80 с костимуляторной молекулой CTLA-4 проявляет способность к регуляции активации Т-лимфоцитов.
Настоящее изобретение представляет выделенную и очищенную кДНК CD86 (B7-2) длиной примерно 1176 нуклеотидов. Также изобретение представляет выделенный и очищенный полипептид CD86 кошки, состоящий примерно из 320 аминокислот, являющийся связанной с мембранной или зрелой формой с молекулярной массой 36,394 кДа, изоэлектрической точкой примерно pI=9,19 и общим зарядом при рН 7,0, равным 11,27. Коэкспрессия CD86 с костимуляторной молекулой CD28 и с опухолевым антигеном или антигеном патогенного организма проявляет способность к активации или усилению активации Т-лимфоцитов, индуцируя тем самым выработку иммуностимулирующих цитокинов, и к регуляции роста других клеточных типов. Коэкспрессия CD86 с костимуляторной молекулой CTLA-4 проявляет способность к регуляции активации Т-лимфоцитов.
CD80 или CD86 кошки по настоящему изобретению были получены из нативных или рекомбинантных источников. CD80 или CD86 кошки по настоящему изобретению включают нативную и связанную с мембраной форму или секретируемую форму, утратившую трансмембранный домен.
Настоящее изобретение представляет выделенную и очищенную кДНК CD28 длиной примерно 689 нуклеотидов. Также изобретение представляет выделенный и очищенный полипептид CD28 кошки, состоящий примерно из 221 аминокислоты, являющийся связанной с мембранной или зрелой формой с молекулярной массой 25,319 кДа, изоэлектрической точкой примерно pI=9,17 и суммарным зарядом при рН 7,0, равным 9,58.
Также настоящее представляет выделенную и очищенную кДНК CTLA-4 длиной примерно 749 нуклеотидов. Также изобретение представляет выделенный и очищенный полипептид CTLA-4 кошки, состоящий примерно из 223 аминокислот, являющийся связанной с мембранной или зрелой формой с молекулярной массой 24,381 кДа, изоэлектрической точкой примерно pI=6,34 и суммарным зарядом при рН 7,0, равным -0,99.
В другом аспекте настоящее изобретение представляет способ усиления иммунного ответа у кошки на иммуноген, что достигается введением этого иммуногена до, после или по существу одновременно с CD80 кошки или CD86 кошки вместе с CD28 кошки или CTLA-4 кошки или без них в количестве, эффективном по усилению иммунного ответа.
В другом аспекте настоящего изобретения представляется способ подавления иммунного ответа у кошки на иммуноген, что достигается введением этого иммуногена до, после или по существу одновременно с CD80 кошки или CD86 кошки вместе с CD28 кошки или CTLA-4 кошки или без них или с антисмысловой РНК или ДНК, частично или полностью кодирующих CD80 кошки или CD86 кошки, или CD28 кошки, или CTLA-4 кошки, в количестве, эффективном по подавлению иммунного ответа.
В следующем аспекте настоящего изобретения представляется вакцина для индукции иммунного ответа у кошек на иммуноген, содержащая этот иммуноген и количество CD80, эффективное по усилению иммунного ответа. Иммуноген является производным, например, от кошачьих патогенов, таких как вирус иммунодефицита кошки, вирус лейкоза кошки, парвовирус кошки, коронавирус кошки, лептовирус кошки и подобное.
В другом аспекте настоящего изобретения представляется вакцина для индукции иммунного ответа у кошки на иммуноген, что достигается введением ДНК или РНК иммуногена и ДНК или РНК вспомогательных молекул CD80, CD86, CD28 кошки в любом сочетании, которые кодируют белки или белковые фрагменты, в количестве, эффективном по модуляции иммунного ответа.
Белок CD80 кошки характеризуется аминокислотной последовательностью, которая на 59% и 46% идентична полипептидам человека и мыши соответственно. Белок CD86 кошки характеризуется аминокислотной последовательностью, которая на 68% и 64% идентична таким белкам человека и кролика соответственно. Белок CD28 кошки характеризуется аминокислотной последовательностью, которая на 82% и 74% идентична полипептидам человека и мыши соответственно. Белок CTLA-4 кошки характеризуется аминокислотной последовательностью, которая на 88% и 78% идентична полипептидам человека и мыши соответственно. Белки CD80 или CD86 мыши или человека не могут функционально заменить кошачьи белки CD80 или CD86. Следовательно, белки CD80 кошки, CD86 кошки, CD28 кошки и CTLA-4 кошки являются новыми реагентами, необходимыми для контроля иммунитета у кошек.
Настоящее изобретение охватывает Т-клеточные регуляторные вспомогательные молекулы - CD80 (B7-1) или CD86 (B7-2), или CD28, или CTLA-4 (CD152) домашних кошек. Настоящее изобретение представляет выделенные и очищенные нуклеиновые кислоты, кодирующие частично или полностью CD80 кошки, CD86 кошки, CD28 кошки и CTLA-4 кошки, равно как и полипептиды CD80, CD86, CD28 или CTLA-4, очищенные либо из нативных, либо из рекомбинантных источников. Выработанные в соответствии с настоящим изобретением CD80, CD86, CD28 или CTLA-4 кошки используют для повышения эффективности кошачьих вакцин против опухолей и патогенных организмов, а также в качестве лекарственного средства для лечения вирусных и бактериальных болезней домашних кошек. Выработанные в соответствии с настоящим изобретением CD80, CD86, CD28 или CTLA-4 кошки также используют для ослабления заболевания за счет сверхактивных, гиперактивных или перенаправленных иммунных ответов.
Нуклеиновые кислоты, векторы, трансформанты
Последовательности кДНК, кодирующие CD80 кошки (SEQ ID NO: 1), CD86 кошки (SEQ ID NO: 5), CD28 кошки (SEQ ID NO: 7) или CTLA-4 кошки (SEQ ID NO: 9), показаны на фиг. 1-5, а расшифрованные аминокислотные последовательности CD80 кошки (SEQ ID NO: 2), CD86 кошки (SEQ ID NO: 6), CD28 кошки (SEQ ID NO: 8) или CTLA-4 кошки (SEQ ID NO: 10) показаны на фиг. 1-5. Идентификация этих кошачьих полипептидов как CD80, CD86, CD28 или CTLA-4 основывается на определенном уровне гомологии аминокислотных последовательностей и гомологичных полипептидов человека или мыши, или кролика, и на способности полипептидов CD80 или CD86 связываться с рецептором CD28 кошки (см. ниже) или с CTLA-4 и активировать или стимулировать, или каким-либо иным образом регулировать активацию Т-лимфоцитов. Более того, не ограничиваясь какой-либо теорией, предсказывается, что полипептиды CD80 кошки или CD86 кошки также проявляют одну или большее число из следующих биологических активностей: активация клеток NK (нативные клетки-киллеры), стимуляция созревания В-клеток, активация ограниченных по МНС цитотоксических Т-лимфоцитов, пролиферация тучных клеток, взаимодействие с рецепторами цитокинов и индукция иммунорегулирующих цитокинов.
Из-за вырожденности генетического кода (т.е. наличия более одного кодона, кодирующего некоторые аминокислоты) последовательности ДНК, не совпадающие с показанными на фиг. 1-5, также могут кодировать аминокислотные последовательности CD80, CD86, CD28 или CTLA-4 кошки, показанные на фиг. 1-5. Такие «другие ДНК» включают те последовательности, которые включают «структурно консервативные» изменения, при которых изменение одного или большего числа нуклеотидов в составе данного кодона не приводит к изменению аминокислоты, кодируемой этим кодоном. Более того, данный аминокислотный остаток в полипептиде часто может быть изменен без изменения общей конформации и функций нативного полипептида. Такие «функционально консервативные» варианты включают, тем самым не ограничиваясь, замену аминокислоты на аминокислоту, характеризующуюся сходными физико-химическими параметрами, такими как, например, кислые, основные, гидрофобные, гидрофильные, ароматические и подобные свойства (например, замена лизина на аргинин, аспарагиновой кислоты на глутаминовую кислоту или глицина на аланин). Кроме того, аминокислотные последовательности добавляются или удаляются без нарушения биологической активности данной молекулы. Например, дополнительные аминокислотные последовательности добавляют либо с N-, либо с С-конца, которые служат метками для очистки данного белка, такими как полигистидиновые метки (т.е. для обеспечения одноэтапной очистки данного белка, после чего их удаляют химическим или каталитическим путем). С другой стороны, дополнительные последовательности предоставляют дополнительный сайт поверхностного связывания или каким-либо иным путем изменяют специфичность CD80, CD86, CD28 или CTLA-4 кошки в отношении клеток-мишеней, например, путем добавления антиген-связывающего сайта для антител.
Попадающие в объем настоящего изобретения кДНК CD80 кошки, или CD86 кошки, или CD28 кошки, или CTLA-4 кошки соответствуют последовательностям, показанным на фиг. 1-5, структурно-консервативным вариантам ДНК, последовательностям ДНК, кодирующим функционально-консервативные варианты полипептидов, и их сочетаниям. Настоящее изобретение охватывает фрагменты CD80, CD86, CD28 или CTLA-4 кошки, которые проявляют эффективную степень биологической активности как по отдельности, так и в сочетании с другими последовательностями или компонентами. Как будет объяснено далее, в компетенции специалиста в данной области техники предсказать результаты манипуляций последовательностями CD80, CD86, CD28 или CTLA-4 и установить, будет ли данный вариант CD80, CD86, CD28 или CTLA-4 кошки проявлять соответствующую стабильность и биологическую активность в отношении данного применения, или определить параметры, которые нарушают активность по связыванию этих молекул, что обусловит повышение эффективности. Каждый из CD80 и CD86 кошки связывается с корецептором CD28 или корецептором CTLA-4. Этого можно достичь путем экспрессии и очистки вариантных полипептидов CD80, CD86, CD28 или CTLA-4 в рекомбинантной системе и оценки их Т-стимуляторной активности и (или) активности по активации роста в клеточных культурах и у животных с последующим тестированием на возможное применение. Вариант CD80 тестируют по его биологической активности по функциональному связыванию с рецепторами CD28 или CTLA-4. Вариант CD86 тестируют по его биологической активности по функциональному связыванию с рецепторами CD28 или CTLA-4. Сходным образом вариант CD28 или вариант CTLA-4 тестируют по их биологической активности.
Также настоящее изобретение охватывает ДНК CD80, CD86, CD28 или CTLA-4 кошки (и полипептиды), производные от других видов кошачьих, включая, но тем самым не ограничиваясь, домашних кошек, львов, тигров, гепардов, рысей и т.д. Гомологи CD80, CD86, CD28 или CTLA-4 кошки по отношению к показанному на фиг. 1-5 могут быть легко идентифицированы путем скрининга библиотек кДНК или геномных клонотек с целью идентификации клонов, которые гибридизуются с зондами, включающими полностью или частично последовательность, показанную на фиг. 1-5. С другой стороны, экспрессионные библиотеки подвергают скринингу с использованием антител, которые распознают CD80, CD86, CD28 или CTLA-4 кошки. Вне связи с какой-либо теорией можно считать, что гены CD80 или CD86 кошки других видов кошачьих будут по крайней мере на 70% гомологичны генам CD80, CD86, CD28 или CTLA-4 кошки. Также в объем настоящего изобретения попадают ДНК, которые кодируют гомологи CD80, CD86, CD28 или CTLA-4, определяемые как ДНК-кодируемые полипептиды, характеризующиеся по крайней мере примерно 25%-ным уровнем идентичности с аминокислотными последовательностями CD80, CD86, CD28 или CTLA-4 кошки.
В целом, в манипуляциях нуклеиновыми кислотами в соответствии с настоящим изобретением используются методы, которые хорошо известны в науке, такие как те, которые описаны, например, в руководствах Sambrook, Fritsch & Maniatis, 1989, “Molecular Cloning: A Laboratory Manual”, 2nd ed., Cold Spring Harbor или “Current Protocols in Molecular Biology”, eds. Ausubel, Brent, Kingston, More, Feidman, Smith & Stuhl, Greene Publ. Assoc., Wiley-Interscience, NY, 1992.
Настоящее изобретение охватывает последовательности кДНК и РНК в смысловом и антисмысловом порядках. Также изобретение охватывает последовательности геномной ДНК CD80, CD86, CD28 или CTLA-4 кошки и фланкирующие последовательности, включая, но тем самым не ограничиваясь, регуляторные последовательности. Нуклеиновые последовательности, кодирующие полипептиды CD80, CD86, CD28 или CTLA-4 кошки, также связывают с гетерологичными последовательностями, включая промоторы, энхансеры, регуляторные элементы, сигнальные последовательности, сигналы полиаденилирования, интроны, 5'- и 3'-некодирующие сегменты и подобное. Транскрипционными регуляторными элементами, которые функционально связаны с последовательностями кДНК CD80, CD86, CD28 или CTLA-4 кошки, являются без каких-либо ограничений последовательности, способные контролировать экспрессию генов, производные от прокариотических клеток, эукариотических клеток, вирусов прокариот, вирусов эукариот и любых их сочетаний. Также в данной области техники известны и другие гетерологичные регуляторные последовательности.
Нуклеиновые кислоты по настоящему изобретению модифицируют с применением методов, известных в данной области техники, с целью изменения их стабильности, растворимости, аффинности связывания и специфичности. Например, последовательности метилируют селективным образом. Также нуклеотидные последовательности по настоящему изобретению модифицируют меткой, способной обеспечивать эффективный прямой или косвенный сигнал. Примерами меток являются радиоактивные изотопы, флуоресцентные молекулы, биотин и подобное.
Также настоящее изобретение представляет векторы, которые включают нуклеиновые кислоты, кодирующие полипептиды CD80, CD86, CD28 или CTLA-4 частично или полностью. Такими векторами являются, например, плазмидные векторы, предназначенные для экспрессии в различных прокариотических и эукариотических организмах-хозяевах. Предпочтительно векторы также включают промотор, функционально присоединенный к участкам, кодирующим CD80, CD86, CD28 или CTLA-4 кошки. Кодируемые кошачьи CD80, CD86, CD28 или CTLA-4 экспрессируются с использованием любых подходящих векторов и клеток-хозяев в соответствии с описанным в данном тексте и в соответствии с известным специалистам в данной области техники.
Подходящими векторами для использования в практике настоящего изобретения являются, тем самым не ограничиваясь, YEp352, pcDNAI (Invitrogen, Carlsbad, CA), pRc/CMV (Invitrogen) и pSFV1 (Gibco BRL), Gaithersburg, MD). Одним из предпочтительных по использованию в настоящем изобретении вектором является pSFV1. Подходящими клетками-хозяевами являются клетки E.coli, клетки дрожжей, клетки COS, клетки РС12, клетки СНО, клетки GH4C1, клетки ВНК-21 и клетки меланофоров амфибий. Клетки ВНК-21 являются предпочтительными клетками-хозяевами с точки зрения использования в практике настоящего изобретения. Подходящими векторами для конструирования «голой» ДНК или для «генетической вакцинации» являются, тем самым не ограничиваясь, pTarget (Promega, Madison, WI), pSI (Promega, Madison, WI) и pcDNA (Invitrogen, Carlsbad, CA).
Нуклеиновые кислоты, кодирующие полипептиды CD80, CD86, CD28 или CTLA-4 кошки, также вносят в клетки с помощью рекомбинантных приемов. Например, такую последовательность вносят в клетку с помощью микроинъекции, обеспечивая гомологичную рекомбинацию по сайту локализации эндогенного гена, кодирующего такой полипептид, его аналог или псевдоген, или последовательности, характеризующейся существенным уровнем гомологии с геном, кодирующим CD80, CD86, CD28 или CTLA-4 кошки. Также могут быть использованы другие рекомбинантные методы, такие как обеспечение негомологичной рекомбинации и делетирование эндогенного гена путем гомологичной рекомбинации, особенно в геноме плюрипотентной клетки.
Настоящее изобретение представляет способ усиления у кошки иммунного ответа на иммуноген, что достигается введением иммуногена до, после или по существу одновременно с CD80 или CD86 кошки, наряду с CD28 кошки, или CTLA-4 кошки, или без них в количестве, эффективном по усилению иммунного ответа.
Настоящее изобретение представляет способ усиления у кошки иммунного ответа на иммуноген, что достигается введением экспресирующего вектора, который включает производный от кошачьего патогена иммуноген, до, после или по существу одновременно с CD80 или CD86 кошки, наряду с CD28 кошки, или CTLA-4 кошки, или без них, в количестве, эффективном по усилению иммунного ответа.
Настоящее изобретение представляет способ перенаправления у кошки иммунного ответа на иммуноген, что достигается введением экспресирующего вектора, который включает производный от кошачьего патогена иммуноген, до, после или по существу одновременно с CD80 или CD86 кошки, наряду с CD28 кошки, или CTLA-4 кошки, или без них, в количестве, эффективном по усилению иммунного ответа.
Настоящее изобретение представляет способ подавления у кошки иммунного ответа на иммуноген, что достигается введением экспресирующего вектора, который включает производный от кошачьего патогена иммуноген, до, после или по существу одновременно с CD80 или CD86 кошки, наряду с CD28 кошки, или CTLA-4 кошки, или с антисмысловой РНК, или ДНК, кодирующей CD80 кошки, CD86 кошки, CD28 кошки или CTLA-4 кошки, в количестве, эффективном по подавлению иммунного ответа.
Настоящее изобретение представляет вакцину для индукции у кошки иммунного ответа на иммуноген(ы), содержащую иммуноген и эффективное количество CD80 кошки или CD86 кошки вместе с CD28 кошки, или CTLA-4 кошки, или без них, для усиления иммунного ответа или CD80 кошки, или CD86 кошки вместе с CTLA-4 кошки для подавления иммунного ответа. В другом осуществлении по настоящему изобретению представляется вакцина, содержащая экспрессирующий вектор, включающий гены, кодирующие иммуноген(ы) кошачьих патогенов, и гены CD80, CD86 вместе с CD28 кошки, или CTLA-4 кошки, или без них, для усиления или подавления иммунного ответа.
Полипептиды CD80, CD86, CD28 или CTLA-4 кошки
Ген CD80 кошки (кДНК и соответствующая ей аминокислотная последовательность показаны на фиг. 1 и 2) кодирует полипептид, состоящий примерно из 292 аминокислот. Ген CD86 кошки (кДНК и соответствующая ей аминокислотная последовательность показаны на фиг. 3) кодирует полипептид, состоящий примерно из 320 аминокислот. Ген CD28 кошки (кДНК и соответствующая ей аминокислотная последовательность показаны на фиг. 4) кодирует полипептид, состоящий примерно из 221 аминокислоты. Ген CTLA-4 кошки (кДНК и соответствующая ей аминокислотная последовательность показаны на фиг. 5) кодирует полипептид, состоящий примерно из 223 аминокислот.
Очистку CD80, CD86, CD28 или CTLA-4 кошки из натуральных или рекомбинантных источников проводят с применением методов, хорошо известных в данной области техники, включая, но тем самым не ограничиваясь, ионообменную хроматографию, обращенно-фазную хроматографию на колонках С4, гель-фильтрацию, изоэлектрическое фокусирование, аффинную хроматографию и подобное. В предпочтительном осуществлении большое количество биологически активного белка CD80, CD86, CD28 или CTLA-4 кошки получают путем конструирования рекомбинантной последовательности ДНК, включающей кодирующий участок CD80, CD86, CD28 или CTLA-4 кошки, которая в общей кодирующей рамке объединена с последовательностью, кодирующей 6 С-концевых остатков гистидина в репликоне pSFV1 (Gibco BRL). Кодируемую этой плазмидой мРНК синтезируют с применением методов, хорошо известных специалистам в данной области техники, и вносят в клетки линии ВНК-21 методом электропорации. Клетки вырабатывают и секретируют процессированные гликозилированные полипептиды CD80, CD86, CD28 или CTLA-4 кошки, включающие С-концевой гексагистидин. Модифицированные кошачьи полипептиды CD80, CD86, CD28 или CTLA-4 очищают из клеточного супернатанта методом аффинной хроматографии с использованием гистидин-связывающей смолы (His-bind: Novagen, Madison, WI).
Полипептиды CD80 кошки или CD86 кошки, выделенные из любых источников, модифицируют с применением методов, известных в данных области техники. Например, кошачьи CD80, CD86, CD28 или CTLA-4 фосфорилируют или дефосфорилируют, гликозилируют или дегликозилируют и подобное. Наиболее применимыми модификациями являются те, которые изменяют растворимость, стабильность, а также специфичность и аффинность связывания у CD80, CD86, CD28 или CTLA-4 кошки.
Химерные молекулы CD80, CD86, CD28 или CTLA-4 кошки
Настоящее изобретение охватывает получение химерных молекул, образуемых фрагментами кошачьих CD80, CD86, CD28 или CTLA-4 в любом сочетании. Например, внесение сайта связывания CTLA-4 вместо сайта связывания CD28 должно повысить аффинность связывания CD28 с сохранением усиленного иммунного ответа.
В одном осуществлении сайты связывания CD80 или CD86 на молекулах CTLA-4 и CD28 заменяются таким образом, что сайт связывания на CD28 заменяется на сайт связывания CTLA-4. Влияние химерной молекулы CD28, включающей сайт связывания CTLA-4, связано с повышением аффинности CD28 в отношении CD80 или CD86 и повышением степени усиления иммунного ответа. В альтернативном осуществлении химерные молекулы CD80 и CD28, или CD86 и CD28, или их фрагменты являются связанными с мембранами формами и улучшают свойства этих молекул по усилению иммунного ответа. В другом осуществлении химерные молекулы CD80 и CTLA-4, или CD86 и CTLA-4, или их фрагменты являются связанными с мембранами формами, которые являются молекулами, более эффективными по подавлению иммунного ответа. В другом осуществлении химерные молекулы CD80 и CTLA-4, или CD86 и CTLA-4, или их фрагменты являются связанными с мембранами формами, которые перенаправляют иммунный ответ с достижением желаемого эффекта.
Антитела, специфичные в отношении CD80, CD86, CD28 или CTLA-4 кошки
Настоящее изобретение охватывает антитела, специфичные в отношении полипептидов CD80, CD86, CD28 или CTLA-4 кошки, идентифицированных в соответствии с описанным выше. Антителами являются поликлональные или моноклональные антитела, разделяющие CD80, CD86, CD28 или CTLA-4 кошки и другие белки, идентифицирующие их функциональные домены и подобное. Такие антитела получают стандартными способами с помощью методов и композиций, описанных у Harlow & Lane, 1988, “Antibodies: A Laboratory Manual”, Cold Spring Harbor Lab., а также с использованием иммунологических и гибридомных методов, известных в данной области техники. В случае использования нативных или синтетических пептидов, производных от CD80, CD86, CD28 или CTLA-4 кошки, для индукции у кошки CD80-, CD86-, CD28- или CTLA-4-специфичного иммунного ответа эти пептиды стандартным образом соединяют с подходящим носителем, таким как гемоцианин слизня (KLH), и вводят с подходящим адъювантом, таким как адъюванты Фройнда.
Предпочтительно отобранные пептиды соединяют с носителем, имеющим «лизиновую сердцевину», по сути в соответствии с методами Tan, 1988, Proc. Natl. Acad. Sci. USA, 85, 5409-5413. Такие антитела, особенно так называемые антиидиотипические антитела «внутреннего соответствия», также приготавливают с использованием известных методов.
В одном из осуществлений очищенные кошачьи CD80, CD86, CD28 или CTLA-4 используют для иммунизации мышей, после чего у них удаляют селезенку и спленоциты используют для получения клеточных гибридов с миеломными клетками с целью получения клонов секретирующих антитело клеток в соответствии со стандартными методами данной области техники. Полученные в результате моноклональные антитела, секретируемые такими клетками, подвергают скринингу в тестах in vitro на следующие активности: связывание с кошачьими белками CD80, CD86, CD28 или CTLA-4, подавление активности CD80, CD86, CD28 или CTLA-4 по связыванию рецепторов и подавление Т-клеточной стимуляторной активности CD80, CD86, CD28 или CTLA-4.
Антитела к CD80 кошки, к CD86 кошки, к CD28 кошки и к CTLA-4 кошки используют для идентификации и количественного анализа кошачьих CD80, CD86, CD28 или CTLA-4, применяя такие иммунологические тесты, как ТИФА, РИА и подобное. Антитела к CD80 кошки, к CD86 кошки, к CD28 кошки и к CTLA-4 кошки также используют для иммунологического истощения экстрактов CD80 кошки, CD86 кошки, CD28 кошки или CTLA-4 кошки. Кроме того, эти антитела могут быть использованы для идентификации, выделения и очистки кошачьих CD80, CD86, CD28 или CTLA-4, происходящих из различных источников, и для исследований по субклеточному и гистохимическому картированию.
Применение
Лиганд CD80 (B7-1) кошки, лиганд CD86 (B7-2) кошки, рецептор CD28 кошки или рецептор CTLA-4 (CD152) кошки, выработанные в соответствии с настоящим изобретением, могут быть эффективно использованы в качестве вакцины для профилактики инфекционного заболевания или способствования росту у гомологичных или гетерологичных видов кошачьих. Например, коэкспрессия CD80 или CD86 с костимуляторными молекулами CD28 или CTLA-4 в любом сочетании с опухолевым антигеном или антигеном патогенного организма. Коэкспрессия CD80 или CD86 с кошки с рецептором CTLA-4 кошки обеспечивает способность подавлять активацию Т-лимфоцитов и подавлять иммунный ответ. Конкретным примером должна быть коэкспрессия CD80 или CD86 с иммуногенами, производными от вирусов FIV, FeLV или FIP, с вирусного вектора или ДНК-экспрессирующего вектора, который, в случае введения в виде вакцины, будет активировать, усиливать или регулировать пролиферацию CD4-позитивных и CD8-позитивных Т-лимфоцитов и индуцировать выработку иммунорегуляторных цитокинов, таких как IL-2, IFN-γ, IL-12, TNFα, IL-6 и т.п. Другим конкретным примером должна быть экспрессия CD80, CD86, CD28 или CTLA-4 с вирусного вектора или ДНК-экспресирующего вектора, который, в случае введения в виде лекарственного средства, будет регулировать или перенаправлять иммунный ответ.
Усиление иммунитета за счет взаимодействия кошачьих CD80 или CD86 с CD28 или CTLA-4 или подавление иммунного ответа за счет взаимодействия кошачьих CD80 или CD86 с CTLA-4 обеспечивает преимущества в естественном процессе регуляции в большей степени, чем при добавлении чужеродных субстанций, которые бы оказывали множественные и даже вредные влияния на здоровье в целом или в течение длительного времени. Молекулы CD80, CD86, CD28 или CTLA-4 вводят наряду с другими рекомбинантными молекулами, такими как те, которые кодируют антигены, являющиеся желательными с точки зрения индукции иммунитета. Ген CD80, CD86, CD28 или CTLA-4 кошки встраивают в состав экспрессирующего вектора и инфицируют им или трансфицируют клетку-мишень с последующей экспрессией генного продукта в этой клетке-мишени так, что он прикрепляется к плазмалемме этой клетки-мишени или антигенпрезентирующей клетки или секретируется во внешнюю для этой клетки-мишени или антигенпрезентирующей клетки среду. Экспрессирующий вектор, такой как плазмида, вирус Semliki Forest, поксивирус или герпес-вирус, переносит ген в антигенпрезентирующую клетку. Ген CD80, CD86, CD28 или CTLA-4 кошки или фрагменты этих генов в любом сочетании встраивают в состав ДНК- или РНК-экспрессирующего вектора и инъецируют кошке с экспрессией данного генного продукта у кошки в виде «голой» ДНК/РНК или генетической вакцины. Коэкспрессия иммуногена и CD80, CD86, CD28 или CTLA-4 в клетке-мишени или в организме кошки обусловливает активацию, усиленную активацию или регуляцию Т-лимфоцитов, В-лимфоцитов и других клеток. С другой стороны, экспрессированный белок может быть введен после экспрессии с плазмиды. Кошачьи белки CD80, CD86, CD28 или CTLA-4 в норме функционируют, будучи прикрепленными к мембране клетки, как вспомогательные молекулы клеточной мембраны, но могут быть презентированы и в других формах, в частности, в отсутствие в их составе «мембранных якорей».
В одном осуществлении CD80 кошки и CD86 кошки растворимы («свободны» в клеточных и внеклеточных жидкостях) за счет утраты трансмембранного домена или гидрофобного участка и взаимодействуют с костимуляторными молекулами CD28 или CTLA-4, находящимися либо в связанной с мембраной, либо в растворимой форме. В другом варианте CD80 кошки и CD86 кошки находятся в связанной с мембраной форме, а костимуляторные молекулы CD28 или CTLA-4 - в растворимой форме, т.е. не имеют трансмембранного домена или гидрофобного участка. Растворимые CD28 или CTLA-4, предпочтительно находящиеся в форме димеров, применяются для лечения кошек, связанного с иммуносупрессией, опосредуемой Т-клетками. Растворимые CD28 или CTLA-4 предотвращают отторжение пересаженной ткани и могут быть использованы для лечения аутоиммунного заболевания. Конкретные растворимые CD28 или CTLA-4 применяются для профилактики реакции «трансплантат против хозяина» при пересадках костного мозга. Растворимые CD28 или CTLA-4 предотвращают связывание клетки, несущей мембранные формы кошачьих лигандов CD80 или CD86.
Структурно-консервативные и функционально-консервативные варианты ДНК и полипептидов CD80, CD86, CD28 или CTLA-4 кошки или биологически активный фрагмент или субфрагмент CTLA-4 объединяют в общей рамке считывания с другой последовательностью, такой как цитокин, интерлейкин, интерферон, колониестимулирующий фактор, антиген патогенного микроорганизма, антитело или необходимая для очистки последовательность, такая как полигистидиновая метка, или ген-репортер, такой как гены lacZ и uidA E.coli, или зеленый флуоресцентный белок.
Вакцины
Настоящее изобретение охватывает способы и композиции для повышения эффективности иммунного ответа у домашних кошек. В этом осуществлении кошачьи CD80, CD86, CD28 или CTLA-4 используют вместе с иммуногеном, в отношении которого желательно индуцировать иммунный ответ. Например, в состав вакцин для кошек, содержащих иммуногены таких патогенов, как вирус иммунодефицита кошачьих и вирус лейкоза кошачьих, и других патогенов, таких как парвовирус кошачьих, лептовирус кошачьих и коронавирус кошачьих, желательно включить CD80, CD86, CD28 или CTLA-4 кошки с целью регуляции степени и эффективности иммунного ответа. Для этой цели кошачьи CD80, CD86, CD28 или CTLA-4, очищенные из нативных или рекомбинантных источников в соответствии с описанным выше, включают в состав вакцинной композиции в концентрации, находящейся в диапазоне от примерно 0,01 до 100,0 мг на одну вакцинацию одной кошки.
Специалистам в данной области техники известны коммерческие источники вакцин для кошек (Compendium of Veterinary Pharmaceuticals, 1997), которые могут быть использованы в сочетании с настоящим изобретением для получения более эффективной вакцины.
Вакцина для индукции и регуляции у кошки иммунного ответа на иммуноген содержит иммуноген и эффективное количество CD80 кошки или CD86 кошки вместе с CD28 кошки или CTLA-4 кошки или без них для усиления иммунного ответа или CD80 кошки или CD86 вместе с CNLA-4 кошки для подавления иммунного ответа.
Иммуноген выбирают из группы, которая включает, тем самым не ограничиваясь, кошачьи патогены, такие как вирус иммунодефицита кошачьих, вирус лейкоза кошачьих, вирус инфекционного перитонита кошачьих, вирус панлейкопении кошачьих (парвовирус), калицивирус кошачьих, реовирус 3-го типа кошачьих, ротавирус кошачьих, коронавирус кошачьих (инфекционный перитонит), вирус бешенства, респираторно-синцитиальный вирус кошачьих, вирус саркомы кошачьих, герпес-вирус кошачьих (вирус ринотрахеита), вирус болезни Борна кошек, хламидии, Toxoplasma gondii, паразиты кошек, Dirofilaria immitis, блохи, бактериальные патогены и подобное.
Регуляция роста или регуляция активации клеточного типа, такого как Т-лимфоцит, определяет то, что регуляторный ответ либо стимулирует, либо подавляет рост клеток. Регуляция иммунного ответа у кошки определяет то, что этот иммунный ответ либо стимулируется, либо подавляется в связи с лечением заболевания или воздействием на инфекционный агент у кошки.
Экспрессия CD80, CD86, CD28 или CTLA-4 кошки по отдельности или в любом сочетании частей или целых в составе экспрессирующего вектора включает ген(ы) кошачьих иммуногенов для целей введения в виде генетической вакцины или «голой ДНК-вакцины». Векторами являются, тем самым не ограничиваясь, pTarget (Promega, Madison, WI), pcDNA (Invitrogen, Carlsbad, CA) (J.J. Donnelly et al., 1997; Hassett & Whitton, 1996).
Гены или фрагменты генов CD80, CD86, CD28 или CTLA-4 по отдельности или в сочетании, полноразмерные или частичные, могут быть встроены или трансфицированы в геном кошки или другого млекопитающего. Такая интеграция генов или фрагментов этих генов, которая может быть достигнута с использованием ретровирусного вектора, может быть использована для целей генотерапии.
Настоящее изобретение представляет способы и композиции для повышения устойчивости к заболеванию у домашних кошек, для применения в медицинских и (или) коммерческих целях. В этом осуществлении CD80, CD86, CD28 или CTLA-4 кошки, экспрессируемые по отдельности или в любом сочетании, полноразмерные или частичные, и в сочетании с генами, кодирующими кошачьи иммуногены, или без этого, вводят кошке с использованием подходящего способа введения. Для способствования росту или устойчивости к заболеванию кошачьи CD80, CD86, CD28 или CTLA-4, экспрессируемые по отдельности или в любом сочетании, вводят в виде композиции в концентрации, варьирующейся от примерно 0,01 до 100,0 мг на 1 дозу вакцины на 1 кошку, предпочтительно в композиции в концентрации от примерно 0,25 мг/кг в день до примерно 25 мг/кг в день. Должно быть понятно, что необходимое количество CD80, CD86, CD28 или CTLA-4 кошки может быть определено с помощью рутинных тестов, хорошо известных в данной области техники, так, чтобы установить схему дозировок и частот их введения и сравнить группы экспериментальных единиц или субъектов по каждой точке такой схемы.
В соответствии с настоящим изобретением нативные или рекомбинантные кошачьи CD80, CD86, CD28 или CTLA-4 приготавливают с физиологически приемлемым носителем, таким как, например, фосфатно-солевой буфер или деионизированная вода. Данная композиция также может содержать наполнители, включая смазывающие компоненты, пластификаторы, усилители поглощения, бактерициды и подобное, что хорошо известно в данной области техники. Полипептиды CD80, CD86, CD28 или CTLA-4 кошки по настоящему изобретению вводят любым эффективным путем, включая, тем самым не исчерпываясь, внутривенный, подкожный, внутримышечный, чрезмышечный, местный или пероральный пути. Для подкожного введения, например, доза включает кошачий CD80, CD86, CD28 или CTLA-4 в стерильном физиологическом растворе. Для перорального или ингаляционного введения кошачьи CD80, CD86, CD28 или CTLA-4 упаковывают на микро- или макроуровнях, например, в липосомы или микросферы. Также могут быть использованы кожные бляшки (или другие формы с медленной секрецией).
ПРИМЕРЫ
Пример 1
А. Клонирование кДНК CD80 (B7-1)-TAMU, CD86 (В7-2), CD28 и CTLA-4 кошки
Последовательности кошачьих CD80 (В7-1), CD86 (В7-2), CD28 и CTLA-4 клонировали сначала путем амплифицирования методом ОТ-ПЦР (полимеразная цепная реакция с ревертированием, или с обратной транскриптазой) участка между двумя последовательностями, которые достаточно консервативны для того, чтобы сформировать вырожденные праймеры, взаимодействующие с кошачьей мРНК. Источником мРНК были моноядерные клетки периферической крови (РВМС), простимулированные конканавалином-А по крайней мере в течение 16 часов. Полученный ПЦР-продукт секвенировали. Полученную последовательность использовали для конструирования праймеров для RACE (быстрая амплификация кДНК-концов). 5'-Конец амплифицировали сначала с получением кДНК с обратным праймером, комплементарным заново секвенированному консервативному участку. Олигонуклеотид лигировали на 3'-конец кДНК (комплемент 5'-концу мРНК). Эта последовательность являлась сайтом связывания для прямого праймера, который совместим по ПЦР с обратным ПЦР-праймером, соответствующим другому участку нового секвенированного участка. Вырожденные праймеры использовали в неоднократных циклах «гнездовых» реакций для получения 3'-концевой последовательности. Этот прямой праймер для ПЦР конструировали для взаимодействия с последовательностью нового секвенированного сегмента. Продукты либо секвенировали напрямую, либо клонировали в клонирующий вектор ТА и секвенированы из полученной плазмиды. Полноразмерную кодирующую рамку (ORF) клонировали путем амплификации по всей ее длине с использованием праймеров, сконструированных по параметрам известных последовательностей. ORF клонировали и секвенировали трижды. ORF B7-1 субклонировали в плазмиду pSI, включающую промотор SV40, и плазмиду SFV. Плазмиду pSI использовали для установления функционального взаимодействия В7-1 с кошачьим CD28.
ДНК-праймеры, использовавшиеся для ОТ-ПЦР кДНК CD80 (B7-1) кошки, были такими:
Прямой праймер: 5'-CGCGGATCCGCACCATGGGTCACGCAGCAAAGTGGAAAAC-3' (SEQ ID NO: 11)
Обратный праймер: 5'-CCTAGTAGAGAAGAGCTAAAGAGGC-3' (SEQ ID NO: 12)
(см. выше полный перечень праймеров для кДНК CD28).
ДНК-праймеры, использовавшиеся для ОТ-ПЦР кДНК CD28 кошки, были такими:
Прямой праймер: 5'- CGCGGATCCACCGGTAGCACAATGATCCTCAGG-3' (SEQ ID NO: 13)
Обратный праймер: 5'-CGCGGATCCTCTGGATAGGGGTCCATGTCAG-3' (SEQ ID NO: 14)
(см. выше полный перечень праймеров для кДНК CD28).
ДНК-праймеры, использовавшиеся для ОТ-ПЦР кДНК CTLA-4 кошки, были такими:
1. Вырожденные праймеры для первого ПЦР-продукта (672 нуклеотида):
Deg-5'-P: 5'-ATGGCTT(C)GCCTTGGATTT(C)CAGC(A)GG-3' (SEQ ID NO: 15)
Deg-3'-P: 5'-TCAATTG(A)ATG(A)GGAATAAAATAAGGCTG-3' (SEQ ID NO: 16)
2. 5'-Концевая последовательность CTLA-4 (455 нуклеотидов): вырожденные ген-специфичные (GSP) «гнездовые» ген-специфичные (NGSP) праймеры:
Первый раунд ПЦР:
Deg-5'-P: 5'-TGTTGGGTTTC(T)G(A)CTCTG(A)CTT(C)CCTG-3' (SEQ ID NO: 17)
3'-GSP: 5'-GCATAGTAGGGTGGTGGGTACATG-3' (SEQ ID NO: 18)
«Гнездовая» ПЦР с ПЦР-продуктом, полученным в первом раунде:
Deg-5'-P: 5'-TGTTGGGTTTC(T)G(A)CTCTG(A)CTT(C)CCTG-3' (SEQ ID NO: 19)
3'-NGSP: 5'-ACATGAGCTCCACCTTGCAG-3' (SEQ ID NO: 20).
3. 3'-Концевая последовательность CTLA-4: адапторный праймер-1 (AP1; Clontech Lab. Inc., Palo Alto, CA); «гнездовой» адапторный праймер (AP2; Clontech Lab.), ген-специфичный праймер (GSP) и «гнездовой» ген-специфичный праймер (NGSP):
3'-RACE:
AP1: 5'-CCATCCTAATACGACTCACTATAGGGC-3' (SEQ ID NO: 21)
5'-GSP: 5'-GTGAATATGGGTCTTCAGGCAATG-3' (SEQ ID NO: 22)
3'-Гнездовая RACE с продуктом 3'-RACE:
AP2: 5'-ACTCACTATAGGGCTCGAGCGGC-3' (SEQ ID NO: 23)
5'-NGSP: 5'-GAAATCCGAGTGACTGTGCTGAG-3' (SEQ ID NO: 24).
4. Праймеры для полноразмерного гена CTLA-4:
Fel CTLA-4 5'-праймер: 5'-AACCTGAACACTGCTCCCATAAAG-3' (SEQ ID NO: 25)
Fel CTLA-4 3'-праймер: 5'-GCCTCAGCTCTTAGAAATTGGACAG-3' (SEQ ID NO: 26).
ДНК-праймеры, использовавшиеся для ОТ-ПЦР кДНК CD86 (B7-2) кошки, были такими:
1. Вырожденные праймеры для первого ПЦР-продукта (423 нуклеотида):
Deg-5'-P: 5'-TAGTATTTTGGCAGGACCAGG-3' (SEQ ID NO: 27)
Deg-3'-P: 5'-CTGTGACATTATCTTGAGATTTC-3' (SEQ ID NO: 28).
2. Вырожденные праймеры для второго ПЦР-продукта (574 нуклеотида):
Deg-5'-P: 5'-GA(G)CA(T)GCACT(A)ATGGGACTGAG-3' (SEQ ID NO: 29)
Deg-3'-P: 5'-CTGTGACATTATCTTGAGATTTC-3' (SEQ ID NO: 30).
3. 5'-Конец CD86: AP1, AP2 (Clontech Lab.), вырожденный 3'-ген-специфичный (GSP) и 3'-«гнездовой» ген-специфичный (NGSP) праймеры:
5'-RACE:
AP1: 5'-CCATCCTAATACGACTCACTATAGGGC-3' (SEQ ID NO: 31)
3'-GSP: 5'-TGGGTAACCTTGTATAGATGAGCAGGTC-3' (SEQ ID NO: 32).
«Гнездовая» 5'-RACE c ПЦР-продуктом 5'-RACE:
AP2: 5'-ACTCACTATAGGGCTCGAGCGGC-3' (SEQ ID NO: 33)
3'-NGSP: 5'-CAGGTTGACTGAAGTTAGCAAGCAC-3' (SEQ ID NO: 34).
4. 3'-Концевая последовательность В7-2: праймеры AP1, AP2, 5'-GSP и 5'-NGSP:
3'-RACE:
AP1: 5'-CCATCCTAATACGACTCACTATAGGGC-3' (SEQ ID NO: 35)
5'-GSP: 5'-GGACAAGGGCACATATCACTGTTTC-3' (SEQ ID NO: 36).
«Гнездовая» 3'-RACE с ПЦР-продуктом 3'-RACE:
AP2: 5'-ACTCACTATAGGGCTCGAGCGGC-3' (SEQ ID NO: 37)
5'-NGSP: 5'-CAGTGCTTGCTAACTTCAGTCAACC-3' (SEQ ID NO: 38).
Полноразмерный ген CD86:
Прямой праймер Fel-B72 (1): 5'-CGGGAATGTCACTGAGCTTATAG-3' (SEQ ID NO: 39)
Обратный праймер Fel-B72 (1176): 5'-GATCTTTTTCAGGTTAGCAGGGG-3' (SEQ ID NO: 40).
В. Клонирование CD80 (B7-1)-Syntro/SPAH; плазмида 917-19-8/16
Отбирали клетки кошачьей селезенки и культивировали их с конканавалином-А в течение 5 часов. После этого клетки центрифугировали, промывали в ФСБ и использовали для выделения тотального пула РНК в системе RNeasy (Qiagen). Тотальную РНК обрабатывали ДНКазой-I (Boehringer Mannheim) с целью удаления ДНК, загрязняющей препарат РНК. Затем из этих препаратов выделяли мРНК с использованием шариков Oligotex (Qiagen, Santa Clara, CA) и высокоскоростных колонок. С матриц мРНК синтезировали ДНК-копии в присутствии случайных гексамеров, dNTP, RNAsin, обратной транскриптазы (Promega) и обратно-транскриптазного буфера (Promega) с инкубацией в течение 30 минут при 42°С. Затем для получения двухцепочечных молекул полноразмерного кДНК-клона кодирующей рамки (ORF) В7-1 кошки применяли ПЦР со смысловым праймером 5/97.50 (5'-ATGGGTCACGCAGCAAAGTG-3') (SEQ ID NO: 41) и антисмысловым праймером 5/97.51 (5'-CTATGTAGACAGGTGAGATC-3') (SEQ ID NO: 42), dNTP, кДНК В7-1 (первая цепь), сульфатом магния, полимеразой Vent (Gibco BRL) и Vent-полимеразного буфера (Gibco BRL). Условия ПЦР: 1 цикл 15 секунд при 94°С; 35 циклов - 30 секунд при 94°С, 2 минуты при 48°С, 2 минуты при 72°С; 1 цикл достройки при 72°С в течение 10 минут. ПЦР осуществляли в 1%-ной низкоплавкой агарозе и выделяли ДНК-фрагменты, соответствующие ожидаемому размеру ORF В7-1, очищали в геле (набор реактивов для гель-очистки Qiagen, Santa Clara, CA) и клонировали в плазмиду pCR-BLUNT с использованием набора Zero Blunt PCR Cloning Kit (Invitrogen, San Diego, CA). ДНК, экстрагированную из резистентных к канамицину бактериальных колоний, подвергали предварительному скринингу на присутствие уникального NheI-сайта (имеющегося в составе CD80 [B7-1]-TAMU кошки). Вставки размером 800-900 пар нуклеотидов (п.н.), включавшие NheI-сайт, секвенировали методом флуоресцентного автоматического секвенирования на соответствующем оборудовании фирмы Perkin-Elmer-Cetus (Applied Biosystems Inc.). Плазмидный вектор и В7-1, ген-специфичные праймеры, производные от ранее клонированного гена В7-1, использовали для получения последовательности pCR-Blunt: праймеры - 1/97.36 (5'-CAGGAAACAGCTATGAC-3') (SEQ ID NO: 43) и 1/97.37 (5'-AATACGACTCACTATAGG-3') (SEQ ID NO: 44). Специфичные для гена В7-1 праймеры - 12/96.22 (5'-AACACCATTTCATCATCCTTT-3') (SEQ ID NO: 45), 1/97.33 (5'-ATACAAGTGTATTTGCCATTGTC-3') (SEQ ID NO: 46), 12/96.20 (5'-AGCTCTGACCAATAACATCA-3') (SEQ ID NO: 47), 12/96.21 (5'-ATTAGAAATCCAGTTCACTGCT-3') (SEQ ID NO: 48), 1/97.32 (5'-TCATGTCTGGCAAAGTACAAG-3') (SEQ ID NO: 49), 11/96.32 (5'-ATTCACTGACGTCACCGA-3') (SEQ ID NO: 50) 11/96.31 (5'-AAGGCTGTGGCTCTGA-3') (SEQ ID NO: 51). Были идентифицированы два клона, которые включают полноразмерную последовательность CD80, соответствующую исходной последовательности CD80, за исключением двух точковых мутаций. Одна такая мутация аминокислотную последовательность не изменяла. Другая мутация приводила к замене лейцина на изолейцин. Полученный в результате клон CD80 кошки был обозначен 917-19.8/16 (CD80-Syntro/SPAH).
Для облегчения клонирования гена CD80 (B7-1) кошки, находящегося за любым промотором вируса оспы (поксивируса), включающим EcoRI- и BamHI-сайты клонирования, два новых праймера были сконструированы таким образом, чтобы внести рестрикционные EcoRI- и BamHI-сайты клонирования по 5'- и 3'-концам кодирующей рамки CD80 соответственно. Эти два праймера были такими: прямой праймер 1/97.43 (5'-TGCAGAATTCGGGTCACGCAGCAAAGTGG-3') (SEQ ID NO: 52) и обратный праймер 1/97.6 (5'-GCTAGGATCCAATCTATGTAGACAGGTGAGAT-3') (SEQ ID NO: 53). Полученный ПЦР-фрагмент расщепляли рестриктазами EcoRI и BamHI и клонировали в состав вектора O1L-SPV (по AccI-сайту в последовательности геномного HindIII-фрагмента М поксивируса свиней - SPV) с получением рекомбинантного вируса SPV. В результате была получена кассета 930-23.А1 - вектор O1L-SPV, включающий кодирующую рамку CD80 кошки, находящуюся за синтетическим «поздне-ранним» промотором LP2EP2 генома SPV и примыкающую к кассете маркерного гена lacZ E.coli, помещенного под контроль синтетического промотора позднего гена LP2.
Плазмидный вектор 930-23.А1 котрансфицировали вместе с SPV-001 с получением рекомбинантного вируса SPV, экспрессирующего белок В7-1 кошки и β-галактозидазу E.coli.
С. Субклонирование CD28 в гомологичный поксивирусному геному вектор
Кодирующий сегмент гена CD28 амплифицировали с помощью ПЦР с синтетическими праймерами, включающими стандартные сайты клонирования, что должно облегчить клонирование CD28 за любым промотором генома поксивируса в ходе конструирования специфичного вектора, гомологичного поксивирусу. Синтетические праймеры были сформированы так, чтобы внести EcoRI- и BglII-сайты клонирования по 5'- и 3'-концам ПЦР-фрагмента соответственно. Эти два праймера были такими: прямой праймер 7/97.1 (5'-GATGAATTCCATGATCCTCAGGCTGGGCTTCT-3') (SEQ ID NO: 54) и обратный праймер 7/97.2 (5'-GATCAGATCTCAGGAACGGTATGCCGCAA-3') (SEQ ID NO: 55). Полученный в результате проведения ПЦР ДНК-фрагмент расщепляли рестриктазами EcoRI и BglII и клонировали в состав вектора O1L-SPV с целью получения рекомбинантного поксивируса. Была получена кассета 930-26.А1 - вектор O1L-SPV, включающий (по AccI-сайту в последовательности геномного HindIII-фрагмента М поксивируса свиней) кодирующую рамку CD28 кошки, находящуюся за синтетическим «поздне-ранним» промотором LP2EP2 генома SPV и примыкающую к кассете маркерного гена lacZ E.coli, помещенного под контроль синтетического промотора позднего гена LP2. Гомологичный плазмидный вектор 930-26.А1 котрансфицировали вместе с SPV-001 с получением рекомбинантного поксивируса. Была получена кассета 930-26.А1 - вектор O1L-SPV, включающий (по AccI-сайту в последовательности геномного HindIII-фрагмента М поксивируса свиней) кодирующую рамку CD28 кошки, находящуюся за синтетическим «поздне-ранним» промотором LP2EP2 генома SPV и примыкающую к кассете маркерного гена lacZ E.coli, помещенного под контроль синтетического промотора позднего гена LP2. Гомологичный плазмидный вектор 930-26.А1 котрансфицировали вместе с SPV-001 с получением рекомбинантного вируса SPV, экспрессирующего белок CD28 кошки и β-галактозидазу E.coli.
Пример 2
Характеристика кДНК и полипептидов CD80 (B7-1)-TAMU, CD86 (B7-2), CD28, CTLA-4 и CD80 (B7-1)-Syntro/SPAH кошки
Выделенная и очищенная кДНК CD80 (B7-1) кошки длиной примерно 941 нуклеотид составляет открытую рамку, кодирующую кошачий полипептид CD80, состоящий примерно из 292 аминокислот, в виде нативной связанной с мембраной или зрелой формы с молекулярной массой примерно 33,485 кДа, изоэлектрической точкой 9,1 и суммарным зарядом 10,24 при рН 7,0. Трансмембранный домен этого белка ориентировочно приходится на аминокислоты 241-271.
Кошачьи CD80-TAMU и CD80-Syntro/SPAH - это кДНК и соответствующие полипептиды, которые были выделены независимо друг от друга из двух различных источников, и при этом их нуклеотидные и аминокислотные последовательности чуть-чуть различаются. Источником мРНК CD80-TAMU были моноядерные клетки периферической крови кошки, простимулированные конканавалином-А, а источником мРНК CD80-Syntro/SPAH были спленоциты кошки, простимулированные конканавалином-А. Различие по последовательности кДНК между CD80-TAMU и CD80-Syntro/SPAH связано с нуклеотидными заменами Т → С в 351-м положении и С → А в 670-м положении. По аминокислотной последовательности замена 351-го нуклеотида является несмысловой, а замена 670-го нуклеотида приводит к замене нейтральной аминокислоты на нейтральную - лейцина на изолейцин - в 224-м положении полипептида.
Выделенная и очищенная кДНК CD86 (B7-2) кошки состоит примерно из 1176 нуклеотидов, соответствуя открытой рамке, кодирующей полипептид CD86 кошки, состоящий из примерно 320 аминокислот, в виде нативной связанной с мембраной или зрелой формы с молекулярной массой примерно 36,394 кДа, изоэлектрической точкой 9,19 и суммарным зарядом 11,27 при рН 7,0.
Выделенная и очищенная кДНК CD28 кошки состоит примерно из 689 нуклеотидов, соответствуя открытой рамке, кодирующей полипептид CD28 кошки, состоящий из примерно 221 аминокислоты, в виде нативной связанной с мембраной или зрелой формы с молекулярной массой примерно 25,319 кДа, изоэлектрической точкой 9,17 и суммарным зарядом 9,58 при рН 7,0.
Выделенная и очищенная кДНК CTLA-4 кошки состоит примерно из 749 нуклеотидов, соответствуя открытой рамке, кодирующей полипептид CTLA-4 кошки, состоящий из примерно 223 аминокислот, в виде нативной связанной с мембраной или зрелой формы с молекулярной массой примерно 24,381 кДа, изоэлектрической точкой 6,34 и суммарным зарядом -0,99 при рН 7,0.
Коэкспрессия CD80 с костимуляторной молекулой CD28 или CTLA-4 и с опухолевым антигеном или антигеном патогенного организма обусловливает способность активировать или усиливать активацию Т-лимфоцитов, в частности лимфоцитов пула Th-1, и активировать рост других типов клеток. Коэкспрессия CD80 с костимуляторной молекулой CTLA-4 обусловливает способность подавлять активацию Т-лимфоцитов, в частности лимфоцитов пула Th-1. Коэкспрессия CD86 с костимуляторной молекулой CD28 или CTLA-4 и с опухолевым антигеном или антигеном патогенного организма обусловливает способность активировать или усиливать активацию Т-лимфоцитов, в частности лимфоцитов Th-1, и активировать рост других типов клеток. Коэкспрессия CD86 с костимуляторной молекулой CTLA-4 обусловливает способность подавлять активацию Т-лимфоцитов, более конкретно лимфоцитов Th-1.
Процентная идентичность (%) ДНК и аминокислотных последовательностей (АА)
Пример 3
Использование кошачьих CD80 (В7-1), CD86 (В7-2), CD28 и CTLA-4 в вакцинах
Следующие эксперименты были проведены с целью оценки усиливающей иммунитет активности кошачьих CD80, CD86, CD28 и CTLA-4 в составе вакцин для кошек.
В одной из процедур кошкам в возрасте 8 недель внутримышечно инъецировали по 100 мкг плазмиды, включающей кДНК, кодирующую кошачьи молекулы CD80, CD86, CD28 и CTLA-4, в смеси с плазмидой, включающей кДНК вирусных генов env и gag вируса FIV или env и gag вируса FeLV, или, с другой стороны, внутримышечно инъецировали по 100 мкг плазмиды, включающей кДНК, экспрессирующей попарные комбинации CD80/CD28 или CD80/CTLA-4, или CD86/CD28, или CD86/CTLA-4, в смеси с плазмидой, включающей кДНК вирусных генов env и gag (FIV) или env и gag (FeLV). Контрольные особи инъекций CD80, CD86, CD28 и CTLA-4 не получали. Кошек предварительно заражали вирулентными штаммами FeLV или FIV и анализировали симптомы заболевания в соответствии с описанным выше. В результате исходного инфицирования было установлено, что кошки, которым вводили вектор с кДНК кошачьих CD80, CD86, CD28 и CTLA-4 и вектор с кДНК генов FIV или генов FeLV, проявили 100% защищенность от заболевания по сравнению с животными, которым вводили только вектор, включающий кДНК генов FIV или генов FeLV: в этой группе устойчивость к заболеванию составила 75%.
В другой процедуре кошкам в возрасте 8 недель внутримышечно инъецировали от 0,1 до 100 мг очищенного белка кошачьих молекул CD80, CD86, CD28 и CTLA-4 или, в другом варианте, попарные комбинации CD80 или CD86 в сочетании с CD28 или CTLA-4, с использованием рекомбинантных векторов, включающих кДНК, описанных выше, а также внутримышечно инъецировали от 0,1 до 100 мкг вакцины, содержащей белки env и gag вируса FIV или белки env и gag вируса FeLV. Контрольным особям инъекций CD80, CD86, CD28 и CTLA-4 не проводили. Кошек предварительно заражали вирулентными штаммами FeLV или FIV и регулярно анализировали развитие заболевания у них. Полученные результаты показали существенно сниженную заболеваемость у кошек, которым вводили очищенный белок CD80, CD86, CD28 и CTLA-4 вместе с вирусной вакциной FIV или FeLV, по сравнению с кошками, получавшими вакцину, содержащую только белки FIV или FeLV.
Пример 4
Использование кошачьих CD80 (B7-1), CD86 (B7-2), CD28 и CTLA-4 для подавления и предотвращения роста опухолевых клеток
Опухолевые клетки кошки трансфицировали вектором, экспрессирующим CD80 или CD86 кошки в сочетании либо с CD28, либо с CTLA-4. Трансфицированные опухолевые клетки вновь вводили той же кошке, и присутствие CD80, CD86, CD28 и CTLA-4 на поверхности опухолевой клетки усиливало неспецифический иммунный ответ в отношении и трансфицированных, и нетрансфицированных опухолевых клеток, что приводило к уничтожению локализованных и метастазирующих опухолевых клеток. В другой процедуре векторы, экспрессирующие CD80 или CD86 кошки в сочетании либо с CD28, либо с CTLA-4, непосредственно инъецировали кошке в опухоль, в результате чего наблюдался неспецифический иммунный ответ в отношении опухолевых клеток, приводивший к уничтожению как локализованных, так и метастазирующих опухолевых клеток.
Пример 5
Клонирование и секвенирование кДНК CD80 кошки
Введение
В дополнение к цитокинам некоторые поверхностно-клеточные молекулы, как было показано, могут усиливать или подавлять определенный иммунный ответ. CD80 (B7-1) является вспомогательной молекулой, которая связывается на соответствующем ей рецепторе на поверхности Т-лимфоцитов (Freeman et al., 1989). Такое взаимодействие обеспечивает доставку вторичных стимулов, что в сочетании с первичным сигналом, опосредуемым распознаванием Т-клеточным рецептором антигена, презентированного с участием молекул МНС, обусловливает активацию и пролиферацию Т-клеток (Allison & Lanier, 1994). Хотя белок CD80 впервые был описан как антиген В-лимфоцитов, затем было установлено, что он экспрессируется рядом клеточных типов, в основном, обладающих свойством презентирования антигена (Freeman et al., 1989).
У приматов и грызунов молекула CD80 - полипептид с молекулярной массой 60 кДа, составленный приблизительно 290 аминокислотами (Freedman et al., 1987; Freeman et al., 1989). Подтверждение предполагаемой аминокислотной последовательности указывает на характеристики, в соответствии с которыми она является членом иммуноглобулинового суперсемейства (IgSF) (Peach et al., 1995). Она составлена двумя внеклеточными иммуноглобулиноподобными (IgSF) доменами, гидрофобным трансмембранным доменом и коротким цитоплазматическим «хвостом» (Freeman et al., 1989). Внеклеточный домен зрелого белка состоит из 124 N-концевых остатков вариабельного (V) IgSF-домена и затем из 100 аминокислот константного (С-подобного) IgSF-домена (Freeman et al., 1989). В составе гомолога CD80 человека имеется 8 потенциальных сайтов N-гликозилирования, и, хотя зрелый белок характеризуется существенным уровнем гликозилирования, эти углеводные остатки, как считается, не связаны с процессами связывания с рецепторами CD28 или CТLA-4, потому что они ориентированы в противоположную от предполагаемого домена связывания сторону (Bajorath et al., 1994). Более того, удаление углеводных остатков, по-видимому, не влияет на способность к связыванию, в связи с чем предполагается, что их функции связаны с повышением растворимости внеклеточной части данной молекулы (Linsley et al., 1994a).
CD80 связывается на двух различных рецепторах, экспрессируемых в различное время процесса Т-клеточной активации. Рецептор CD28 обнаруживается у различных тимоцитов, «наивных» и активированных Т-клеток, и для него было продемонстрировано участие в активации и пролиферации Т-клеток (Aruffo, 1987). Второй рецептор для CD80 - CTLA-4 - обычно обнаруживается позже на полностью активированных Т-клетках (Linsley et al., 1991b). Хотя роль CTLA-4 пока точно не определена, предполагается, что эта молекула может действовать как фактор супрессии активного, уже имеющегося Т-клеточного ответа (Hutchcroft & Bierer, 1996).
Сама по себе молекула CD80, по-видимому, не способна к передаче сигнала. Ее цитоплазматический сегмент относительно мал и не включает аминокислот, для которых была бы подтверждена сигнальная и каталитическая функция (Hathcock et al., 1994). Отсутствие консерватизма в структуре цитоплазматических участков у пептидов человека и мыши также согласуется с вероятным отсутствием сигнальных функций у белка CD80, который активен лишь по связыванию с рецепторами CD28 или CTLA-4 (Linsley et al., 1994a).
Взаимодействие между CD80 и CD28, как было показано, является необходимым для перехода «наивных» Т-клеток в активированное состояние, что инициирует первичный Т-клеточный ответ (Damle et al., 1988). Хотя CD80 был впервые найден на активированных В-клетках (Freedman et al., 1987), после этого он был обнаружен у большинства групп специфичных антиген-презентирующих клеток, включая макрофаги и моноциты (Freedman et al., 1987), клетки Лангерганса (Symington et al., 1993), дендритные клетки (Liu et al., 1992), активированные Т-клетки (Razi-Wolf et al.,. 1992) и различные опухолевые клетки (Chen et al., 1992). Присутствие молекулы CD80 на клетках АРС, как было подтверждено, является важным для активации и CD4-позитивных, и CD8-позитивных Т-клеток (Allison & Lanier, 1994; Bellone et al., 1994). Хотя эта молекула в норме в значительном количестве присутствует только на специфичных АРС, в линиях клеток некоторых опухолей было установлено усиление выработки сигнальной молекулы (Chen et al., 1992).
Предполагается, что в результате трансформации в некоторых опухолеродных линиях имеет место усиление экспрессии CD80. В этих опухолевых линиях, производных не от антиген-презентирующих клеток, равно как и в некоторых иммортализованных клеточных линиях CD80 является поверхностным белком, экспрессированным на таком уровне, который достаточен для обусловливания полной активации Т-клеток (Chen et al., 1992). Хотя кинетика экспрессии неясна, возможно, что происходящий от опухолевых клеток CD80 может быть ответом на «онкогенный шок» и отражать эволюционный механизм, с помощью которого иммунная система способна удалять трансформированные или опухолеродные клетки (Antonia et al., 1995).
Роль взаимодействия CD28-B7 считается ключевой в процессе первичной активации Т-клеток. Распознавание антигена с участием молекул МНС Т-клеточными рецепторами само по себе недостаточно для инициации оптимальной пролиферации и активации Т-клеток (Schwartz, 1992). TCR-стимуляция в отсутствие вспомогательных сигналов может приводить к анергии или снижению реактивности Т-клеточных популяций (Jenkins et al., 1987). Связывание молекулы CD28 на Т-клетке с молекулой CD80 на антиген-презентирующей клетке рассматривается как передача второго сигнала, необходимого для Т-клеточной активации (Schwartz, 1992). Когда рецепторы TCR загружены, в отсутствие такого второго сигнала «наивные» клетки не активируются и могут стать анергическими (Lanier et al., 1995). Такая принципиальная роль взаимодействия CD28-CD80 была отчетливо выявлена не только для процесса активации «наивных» клеток CD4+, но также и в клонах CD4+ Th1 и Th2 и для «наивных» Т-клеток CD8+, производных от малых покоящихся лимфоцитов периферической крови (Linsley et al., 1993a).
Как и в случае с семейством рецепторов CTLA-4/CD28, также имеется по крайней мере еще один дополнительный рецептор, имеющий отношение к CD80. Исследования, в которых делалась попытка выявить значение CD80 для первичного иммунного ответа, поставили ряд вопросов из-за того, что, хотя внесение CTLA-4Ig подавляло иммунные ответы, напротив, добавление моноклонального антитела (mAb) к CD80, как казалось, не обусловливало сходного эффекта (Lenschow et al., 1993). При получении линии мышей, «выключенных» по гену CD80, неожиданно было установлено наличие второго рецептора CTLA-4/CD28 (Freeman et al., 1993). Предположили, что такие мыши должны иметь сходный фенотип с ранее полученными мышами, «выключенными» по CD28, у которых имелся неадекватный Т-клеточный ответ (Freeman et al., 1993). Однако было установлено, что «выключенные» по CD80 мыши формируют нормальный ответ, а их клетки АРС способны формировать вторичный сигнал, необходимый для созревания Т-клеток (Freeman et al., 1993). На основании этих данных было предположено существование второго рецептора, который в конечном счете и был выделен. Последующее обнаружение родственного рецептора CD86 (B7-2 или В7-0), как представляется, снимает то противоречие, которое возникло в анализе «выключенных» по CD80 мышей, а в сочетании со сходством структуры и параметров связывания оно указывает на возможность того, что эти молекулы характеризуются общностью функций и происхождения (Hathcock et al., 1994).
СD86 (B7-2) проявляет определенный уровень сходства с CD80, в частности, по структуре внеклеточных доменов IgSF-V и IgSF-C (Freeman et al., 1993). Суммарный уровень гомологии этих молекул, однако, меньше 25%, притом, что консервативные остатки сосредоточены на противоположных концах обоих внеклеточных доменов (Bajorath et al., 1994). Хотя связывающий сегмент не был установлен ни для одной из этих молекул, гомология последовательностей позволила выделить участок, перспективный с точки зрения установления потенциального сайта взаимодействия (Linsley et al., 1994a). Несмотря на отсутствие консерватизма, CD80 и CD86 характеризуются сходными параметрами связывания на обоих рецепторах, хотя CD86 характеризуется более быстрым высвобождением с рецептора CTLA-4 (Linsley et al., 1995a).
CD86, по-видимому, характеризуется сходными параметрами экспрессии по сравнению с CD80, будучи экспрессированным на активированных В-клетках, Т-клетках, макрофагах и моноцитах (Azuma et al., 1993a). Однако динамика экспрессии этих двух молекул в небольшой степени различается (Hathcock et al., 1994). В целом, CD86 появляется раньше в процессе активного иммунного ответа по сравнению с CD80 и предположительно экспрессируется моноцитами по конститутивному типу (Freeman et al., 1991). Хотя CD80 может появляться спустя 24 часа после исходной стимуляции, CD86 появляется на раннем этапе ответа или вообще экспрессируется миелоидными клетками постоянно на невысоком уровне (Hathcock et al., 1994). Эти два поверхностных белка обусловливают сходные внутриклеточные реакции, будучи связаны на соответствующих им рецепторах на поверхности Т-клеток как CD4+, так и CD8+ (Lanier et al., 1995). По-видимому, отсутствуют какие-либо различия в способности каждой из этих молекул инициировать активацию и пролиферацию Т-клеток или индуцировать активность CTL (Hathcock et al., 1994). Таким образом, имеющиеся данные подтверждают, что обе молекулы инициируют сходный сигнальный каскад после их связывания рецепторами CD28 или CTLA-4 соответственно (Hathcock et al., 1994). Хотя, как представляется, кинетика связывания обеих этих молекул со своими рецепторами одинакова и при этом отсутствуют какие-либо различающиеся проявления этого, пока неясно эволюционное значение существования такой системы «пара лигандов/пара рецепторов» (Lanier et al., 1995).
CD80 вначале был описан как маркер В-клеток, и высокие уровни и CD80, и CD86 обнаруживаются на В-клетках, стимулированных липополисахаридом (ЛПС), анти-Ig, анти-CD40, конканавалином-А (Кон-А), цАМФ, IL-2 и IL-4 (Hathcock et al., 1994). Как было показано, в В-клетках мышей γ-интерферон и IL-5 усиливают выработку CD86, хотя пока нет аналогичных данных для человека или для CD80 в связи с указанными иммунорегуляторами (Azuma et al., 1993a). Динамика экспрессии в В-клетках у этих двух молекул несколько различна. CD86 экспрессируется почти сразу после стимуляции (6 часов), в то время как CD80 отсутствует почти 24 часа и вплоть до 48-го часа не достигает пика своей экспрессии (Lenschow et al., 1993). Считается, что позитивная регуляция CD80 на В-клетках находится под контролем сигнальных механизмов, опосредуемых молекулами класса II МНС (Nabavi et al., 1992). Два других поверхностно-клеточных рецептора также, по-видимому, важны в связи с экспрессией CD80. Перекрестное связывание CD40, экспрессированного на В-клетках, с Ig или Т-клетками, экспрессирующими соответствующий рецептор, обусловливает усиление экспрессии CD80 (Azuma et al., 1993b), в то время как перекрестное связывание Fc-рецептора обусловливает снижение экспрессии обеих молекул (Barcy et al., 1995).
CD40 и лиганд этого рецептора CD40L, как предполагалось, являются элементами механизма, участвующего в регуляции экспрессии CD80 на клетках АРС (Page et al., 1994). CD40 экспрессирован в различных типах клеток, включая В-лимфоциты, моноциты, дендритные клетки, фибробласты и эндотелиальные клетки человека, и может позитивно регулироваться на этих клетках в присутствии γ-интерферона (de Boer et al., 1993). Лиганд CD40 (CD40L) экспрессируется активированными CD4-позитивными Т-клетками. Связывание CD40 и CD40L, как было показано, усиливает экспрессию CD80 клетками АРС, хотя, по-видимому, это не индуцирует экспрессию в других типах клеток, экспрессирующих данный рецептор, включая эндотелиальные клетки (Page et al., 1994).
Молекулы CD80 и CD86, хотя и проявляют лишь 25% уровень аминокислотного сходства друг с другом, обладают структурным сходством и рассматриваются как «отдаленно-родственные» (Freeman et al., 1993). Гомологичные остатки сконцентрированы в составе иммуноглобулино-подобных доменов при небольшом количестве консервативных остатков в составе трансмембранного и цитоплазматического доменов (June et al., 1995). Предполагается, что семейство, включающее продукты генов В7, также, в дополнение к CD80 и CD86, охватывает бутирофилин (ВТ), гликопротеин миелин/олигодендроцитов (MOG), МНС-аналог курицы - B-G (Linsley et al., 1994b). BT, MOG и B-G кодируются генами, входящими в геномный комплекс МНС, что указывает на вероятную эволюционную связь между главным комплексом гистосовместимости и необходимыми костимуляторными молекулами (Linsley et al., 1994b).
Покоящиеся Т-лимфоциты мыши и человека на низком уровне экспрессируют CD86, в то время как Т-клетки мыши и человека (и Т-клеточные клоны), активированные действием антител к CD3, экспрессируют CD80 и CD86 на существенном уровне (Hathcock et al., 1994). Экспрессия и CD80, и CD86 на активированных Т-клетках может отражать способность этих Т-клеток пролиферировать по механизму аутокринной костимуляции (Azuma et al., 1993b). Интересно, что, как было показано, CD80 позитивно регулируется на ВИЧ-инфицированных CD4-позитивных Т-клетках при одновременной негативной регуляции CD28. Предполагается, что это является вероятным механизмом вирусной передачи в случае, когда неинфицированные Т-клетки CD4+ инициируют опосредованный взаимодействием СD28/CD80 контакт с инфицированными лимфоцитами (Haffar et al., 1993).
Моноциты периферической крови человека на низком уровне экспрессируют CD80 и на высоком уровне - CD86, в то время как обработка фактором GM-CSF или γ-интерфероном приводит к интенсификации поверхностной экспрессии и CD80, и CD86 (Barcy et al., 1995). ЛПС является мощным индуктором экспрессии CD80 в моноцитах периферической крови человека (Schmittel et al., 1994). Пока нет данных о брюшинных макрофагах человека, в то время как известно, что покоящиеся макрофаги мыши экспрессируют CD80 и CD86 на низких уровнях (Freeman et al., 1991; Hathcock et al., 1994). Стимуляция ЛПС и γ-интерфероном макрофагов мышей увеличивает уровень поверхностной экспрессии, хотя γ-интерферон в сочетании с интерлейкином-10 снижает уровень синтеза обоих этих рецепторов (Ding et al., 1993).
Дендритные клетки селезенки на низком уровне экспрессируют обе молекулы, а клетки Лангерганса на низком уровне экспрессируют CD86, хотя при культивировании имеется тенденция к усилению экспрессии в обоих типах клеток (Larsen et al., 1994). При культивировании дендритных клеток CD86, по-видимому, подвержен более мощной, а также более ранней позитивной регуляции, что может играть важную роль в опосредовании сигнальных путей в этих клетках (Hathcock et al., 1994). Интересно, что, хотя IL-10 не влияет на экспрессию CD80 дендритными клетками, он активен по негативной регуляции экспрессии CD86 (Buelens et al., 1995). Сообщалось (O'Doherty et al., 1993), что, хотя исходные уровни CD80 в дендритных клетках очень низки, после их созревания имеющийся уровень СD80 повышается. Экспрессия CD80 клетками Лангерганса подавляется и IL-10, и γ-интерфероном, хотя обработка колониестимулирующим фактором гранулоцитов/макрофагов ревертирует подавление, вызванное γ-интерфероном, но не подавление, вызванное IL-10 (Ozawa et al., 1996).
Как было показано, у человека и мыши специфичные цитокины осуществляют контроль экспрессии и CD80, и CD86. Интерлейкин-4 является мощным индуктором CD86 и в меньшей степени индуктором CD80 в В-клетках (Stack et al., 1994), в то время как γ-интерферон усиливает экспрессию CD86 в различных типах клеток, включая В-клетки, моноциты и макрофаги (Hathcock et al., 1994). Хотя, как видно, γ-интерферон обусловливает усиление экспрессии CD80 в моноцитах, он может приводить к ослаблению экспрессии а макрофагах. IL-10, даже в присутствии γ-интерферона, ослабляет экспрессию CD80 и CD86 (Ding et al., 1993). Такое взаимодействие может отражать вероятный механизм переключения Th1-ответа (DTH) на Th2-ответ (гуморальный). Однако IL-10 не влияет на экспрессию CD80 в дендритных клетках (Buelens et al., 1995). Это, кроме того, может отражать роль этих молекул в регуляции групп Т-хелперов, поскольку считается, что дендритные клетки играют важную роль в инициации иммунного ответа 2-го типа. Интерлейкин-7 усиливает экспрессию CD80 в Т-клетках, хотя его влияние в других типах клеток пока не определено (Yssel et al., 1993), в то время как было установлено, что экспрессия CD80 В-клетками опосредуется за счет перекрестного связывания с TNF-рецептором р75, а экспрессия может быть увеличена в присутствии IL-4 (Ranheim & Kipps, 1995). Интересно, что TNF принадлежит к тому же семейству молекул, что и CD40 - другой потенциальный инициатор экспрессии CD80. По-видимому, GM-CSF усиливает поверхностную экспрессию CD80 дендритными клетками и клетками Лангерганса, в то время как γ-интерферон обусловливает усиление выработки только CD86 в этих клетках (Larson et al., 1994).
Долгое время считалось, что распознавание, связывание и лизис трансформированных и инфицированных вирусом клеток-мишеней CD8-позитивными цитотоксичными Т-лимфоцитами (CTL) опосредуются только за счет TCR-распознавания чужеродных пептидов, экспрессируемых в связи с молекулами класса I МНС (Berke, 1993). Недавно было установлено, что ряд поверхностно-клеточных молекул, экспрессируемых и CTL, и клетками-мишенями, необходим для того, чтобы произошло полное взаимодействие (Mescher, 1992). Ключевым участником данного взаимодействия является CD80 и соответствующий ему рецептор CD28. Вспомогательный сигнал, генерируемый взаимодействием B7-CD28, необходим для того, чтобы малые покоящиеся CD8-позитивные лимфоциты дифференцировались в литическое состояние (Mescher, 1992). Интересно, что после дифференцировки CTL этот вторичный сигнал перестает быть необходимым для проявления литических свойств (Hodge et al., 1994).
Долгое время было известно, что CTL являются ключевыми медиаторами противовирусного иммунитета. У человека в случае заражения вирусом иммунодефицита (ВИЧ) долговременное отсутствие симптомов заболевания связывается с высокими уровнями CTL памяти CD8+, специфичными в отношении вирусных белков Gag, Pol и Env, и очень низким числом копий ВИЧ-ДНК и РНК в моноядерных клетках периферической крови (Rinaldo, 1995). Напротив, у больных на поздних стадиях СПИД число CTL памяти (mCTL) резко снижено (Zanussi et al., 1996). Согласованность этих данных указывает на то, что CTL памяти могут быть основным фактором контроля инфекции в организиме-реципиенте и могут играть ключевую роль в формировании иммунитета у неинфицированных лиц (Zanussi et al., 1996). Кроме того, патогенетические связи с ВИЧ-инфекцией отражают вероятную роль CD80 и CD28 в развитии СПИДа.
Также было высказано предположение о том, что CD80 участвует в патогенезе ВИЧ-инфекции (Haffar et al., 1993). В норме Т-клетки экспрессируют CD80, но на невысоком уровне и только после активации (Schwartz, 1992). В модельном анализе ВИЧ-инфекции in vitro в аллостимулированных линиях первичных Т-клеток было показано, что CD28 регулируется негативно, а экспрессия CD80, очевидно, усиливается наряду с МНС CII (Haffar et al., 1993). Хотя точные механизмы этих процессов пока не определены, можно предположить существование двух механизмов возможного повреждающего действия. Присутствие CD80 на поверхности вместе с молекулами класса II может обусловливать интенсификацию контактов между инфицированными Т-клетками и неинфицированными CD4-позитивными клетками (Haffar et al., 1993). Хотя такое взаимодействие может приводить к повышению интенсивности обмена между этими Т-клетками, другой функцией может являться повышение CTL-опосредованного распознавания и уничтожения клеток за счет генерирования вторичного сигнала в результате взаимодействия CD80 на поверхности инфицированной клетки с рецептором CD28, экспрессируемым CD8-позитивной Т-клеткой (Haffar et al., 1993). Это может ускорять сокращение популяции лимфоцитов CD4+, что коррелирует с манифестацией заболеваний, связанных со СПИДом (Haffar et al., 1993).
И у мыши, и у человека экспрессия белков семейства В7 рассматривается как важный фактор иммунного распознавания трансформированных клеток (Chen et al., 1992). Хотя экспрессия была установлена в некоторых типах трансформированных клеток, большинство опухолей в норме не экспрессируют CD80 или CD86, что тем самым делает невероятным то, что в случае экспрессии потенциально иммуногенного опухолевого антигена будет иметь место полноценное его распознавание Т-клетками (Chen et al., 1993). Однако эксперименты по трансфекции с использованием молекулы CD80 с целью усиления цитолиза опухолевых клеток оказались успешными (Hоdge et al., 1994).
Ретровирусные и основанные на вирусе коровьей оспы векторы, экспрессирующие функциональную молекулу CD80, были использованы для трансфекции злокачественных клеток (Li et al., 1994; Hodge et al., 1994). Эти клетки, экспрессирующие CD80 в дополнение к плохо (в норме) распознаваемым опухолевым антигенам, после этого обратно вносили донору, что, как предполагалось, приведет к возникновению клеточного иммунного ответа в отношении опухолевых антигенов, экспрессируемых на клетках злокачественных опухолей (Townsend & Allison, 1993). Результаты этих экспериментов с различными формами опухолей оказались на удивление высокоэффективными. Во многих случаях организм-реципиент формировал мощный клеточный ответ против злокачественной опухоли, контролируя или уничтожая ее (Hodge et al., 1994). Последующая реинтродукция в организм донора опухолевых клеток, имеющих поверхностную молекулу CD80 или лишенных ее, обусловливает сходные уровни противоопухолевого иммунитета (Hodge et al., 1994). Таким образом, считается, что после установления иммунной памяти молекула CD80 не является необходимой для поддержания ответа или для инициации его в случае реинтродукции (Hodge et al., 1994). Эти эксперименты показали, что молекула CD80 является эффективным медиатором клеточного иммунитета и что в конкретных типах опухолей клеточные ответы могут быть индуцированы по вероятному контролю злокачественных новообразований и предотвращению рецидивов (Hodge et al., 1994).
Усиление экспрессии CD80 может иметь негативные последствия, что выявляется в развитии некоторых форм аутоиммунитета. Считается, что CD80 во взаимодействии с IL-12 является важным на ранних стадиях развития рассеянного склероза и обусловливает стимуляцию Т-клеток и развитие DTH (Windhagen et al., 1995). Экспериментально вызванный аутоиммунный энцефаломиелит (ЕАЕ) может быть отчасти подавлен введением немембранного CTLA-4Ig экспериментальному объекту. Подавление демиелинизации при блокировании взаимодействия CD28/CD80 отражает вероятную роль этого взаимодействия в обострении заболевания (Arima et al., 1996).
Важность молекулы CD80 в развитии эффективного иммунного ответа очевидна. Хотя кДНК, кодирующая этот белок, была выделена у грызунов и приматов, она не была ранее обнаружена в других таксономических группах млекопитающих. Кошка является распространенным домашним животным и потенциальной моделью ретровирусных заболеваний. Клонирование иммунологических факторов у кошек предоставляет важный инструмент ветеринарных исследований, в частности, в связи с исследованиями развития и профилактики заболеваний у других видов организмов.
Материалы и методы
Выделение исходного фрагмента
мРНК была экстрагирована из моноядерных клеток периферической крови (РВМС), простимулированных в течение 16 часов Кон-А с использованием реагента для РНК-экстракции RNAzolB (Biotexc, Houston, TX). Исходно кДНК была синтезирована на матрице этой РНК с помощью обратной транскриптазы (ОТ), где в качестве обратного праймера использовали олиготимидин. Вкратце, РНК и олиго-dT нагревали до 75°С в течение 3 минут с целью удаления вторичных структур. Затем добавляли ОТ, dNTP, буфер и дистиллированную воду и полученную смесь инкубировали в течение 1 часа при 42°С. После этой инкубации образец нагревали до 95°С в течение 5 минут с целью инактивации ОТ. Вырожденные праймеры, производные от консенсусных участков в составе опубликованных нуклеотидных последовательностей CD80 человека и мыши (GeneBank, Gaithersburg, MA), использовали затем для исходной амплификации из состава данного гена 344-нуклеотидного фрагмента, кодирующего центральный сегмент в составе константного домена:
прямой праймер В7-2: GGC CCG AGT A(CT)A AGA ACC GGA C
обратный праймер В7-3: CAG (AT)TT CAG GAT C(CT)T GGG AAA (CT)TG (SEQ ID NO: 56).
Для амплификации данного продукта использовали протокол полимеразной цепной реакции (ПЦР) с «горячим стартом» с Taq-полимеразой. Вначале реакционную смесь без Taq-полимеразы нагревали до 95°С в течение 5 минут (этап «горячего старта») с целью предотвращения образования димеров между праймерами. Полимеразу добавляли перед началом температурного цикла. Затем ПЦР-реакцию нагревали до 95°С на 30 секунд с целью диссоциации двухцепочечной ДНК. Затем реакцию охлаждали до 42°С на 30 секунд для обеспечения отжига вырожденных праймеров. Относительно низкая температура отжига облегчала связывание праймеров в случае их не-100%-ной гомологичности с мишенью. Затем реакцию нагревали до 72°С на 45 секунд, что является оптимальной температурой для активности Taq-полимеразы, обеспечивающей достройку (удлинение цепи) праймера и копии противоположной цепи ДНК. Данный температурный цикл повторяли 30 раз. После этих 30 циклов заключительный этап проводили при 72°С в течение 7 минут с целью облегчения достройки любых неполных продуктов. После визуализации в 1%-ном агарозном геле полученный продукт лигировали в течение ночи при 16°С в состав клонирующего вектора ТА (InVitrogen, San Diego, CA) для последующего секвенирования. По 2 мкл лигационной реакции использовали для трансформации компетентных клеток InvαF'. Трансформированных бактерий наносили полосами на пластины LB (50 мкг/мл ампициллина), покрытые 40 мкл раствора 50 мкг/мл X-Gal. На следующий день отбирали колонии белого цвета и инокулировали их в 5 мл культуральной среды LB, содержащей 100 мкг/мл ампициллина, и культивировали в течение ночи при 37°С при вращении со скоростью 225 об/мин.
Мини-препарирование проводили на материале ночных культур с целью выявления клонов, которые несут плазмиду со вставкой в правильной ориентации. Плазмиду экстрагировали из культур с использованием стандартной процедуры щелочного лизиса с последующей очисткой ДНК путем экстракции смесью фенола и хлороформа (Maniatis et al., 1982). ДНК осаждали 2 объемами этанола и затем расщепляли рестриктазой EcoRI. Результаты этого расщепления визуализовали в 1%-ном агарозном геле с целью идентификации колоний, несущих плазмиду, включающую вставку в правильной ориентации. Затем такую плазмиду очищали из позитивных клонов и секвенировали с использованием реактивов для секвенирования методом терминации цепи с 35S-мечением по Сэйнджеру (Sequenase®, US Biochemicals, Cleveland, OH) или методом циклического секвенирования с концевой флуоресцентной меткой (Perkin Elmer, Norwalk, CT). По данным нуклеотидной последовательности кДНК специфичные обратные и прямые праймеры были сконструированы для использования в методе «быстрой амплификации концов кДНК» (5'-RACE) и для выделения 3'-последовательности в сочетании с вырожденными праймерами из состава 3'-нетранслируемого сегмента (UTR).
Выделение 5'-сегмента
Амплификационный протокол кДНК Marathon (Clontech, Palo Alto, CA) использовали для получения 5'-последовательности данного гена. мРНК была выделена из РВМС, простимулированных в течение 12 часов Кон-А и одновременно в течение 4 часов - липополисахаридом. мРНК экстрагировали с использованием реагента для экстракции РНК ULTRASPEC (Biotexc, Houston, TX). кДНК получили с использованием «якорного праймера» олиго-dT с вырожденными нуклеотидами по 5'-концу для облегчения связывания этого праймера с дальним 5'-концом полиаденилового «хвоста». Затем кДНК транскрибировали в соответствии с описанным выше. Специфичные линкеры лигировали на эту кДНК с использованием ДНК-лигазы фага Т4. ПЦР «вниз от точки лигирования» осуществляли на матрице кДНК с использованием внутреннего обратного праймера, специфичного в отношении исходно амплифицированного участка:
B7-284: TTA TAC TAG GGA CAG GGA AG (SEQ ID NO: 58)
B7-190: AGG CTT TGG AAA ACC TCC AG (SEQ ID NO: 59), - и якорного праймера, комплементарного лигированной линкерной последовательности. Параметры ПЦР «вниз от точки» с химерной полимеразой KlenTaq (Clontech, Palo Alto, CA) были такими: 5 минут при 95°С - 1 цикл; 30 секунд при 95°С, 30 секунд при 72°С и 45 секунд при 68°С - 5 циклов; 30 секунд при 95°С, 30 секунд при 65°С и 45 секунд при 68°С - 5 циклов; 30 секунд при 95°С, 30 секунд при 60°С и 45 секунд при 68°С - 25 циклов. 1 мкл данной реакции разбавляли в 50 мкл воды и 5 мкл полученного разведения затем использовали для «гнездовой» ПЦР (5 минут при 95°С - 1 цикл; 30 секунд при 95°С, 30 секунд при 65°С и 45 секунд при 68°С - 30 циклов, с полимеразой KlenTaq) с линкер-специфичным якорным праймером и ген-специфичным обратным праймером, расположенным с 5'-стороны по отношению к исходному праймеру.
B7-20: TTG TTA TCG GTG ACG TCA GTG (SEQ ID NO: 60)
B7-135: CAA TAA CAT CAC CGA AGT CAG G (SEQ ID NO: 61).
По 20 мкл каждой реакции визуализовали в 1,5%-ном агарозном геле и точный по размеру фрагмент вырезали из геля. кДНК экстрагировали и очищали из агарозы путем центрифугирования среза геля через распылитель геля и фильтр Micropure с порами 0,22 мкм (Amicon, Beverly, MA). Затем очищенную ДНК напрямую секвенировали с использованием секвенирования с концевой флуоресцентной меткой (Perkin Elmer, Norwalk, CN).
Выделение 3'-сегмента
3'-Сегмент данного гена выделяли путем отбора пяти ген-специфичных праймеров по последовательности 344-нуклеотидного фрагмента ранее и секвенированного 5'-участка:
B7-s220: GTC ATG TCT GGC AAA GTA CAA G (SEQ ID NO: 62)
B7-50: CAC TGA CGT CAC CGA TAA CCA C (SEQ ID NO: 63)
B7-140: CTG ACT TCG GTG ATG TTA TTG G (SEQ ID NO: 64)
B7-550: GCC ATC AAC ACA ACA GTT TCC (SEQ ID NO: 65)
B7-620: TAT GAC AAA CAA CCA TAG CTT C (SEQ ID NO: 66).
Затем вырожденные обратные праймеры подбирали по консенсусным участкам 3'-UTR гена CD80 человека и мыши:
B7-1281: G(A/G)A AGA (A/T)TG CCT CAT GA(G/T) CC (SEQ ID NO: 67)
B7-1260: CA(C/T) (A/G)AT CCA ACA TAG GG (SEQ ID NO: 68).
кДНК были получены на материале РНК, экстрагированных с помощью ULTRASPEC (Biotexc, Houston, TX), выделенных из РВМС, простимулированных Кон-А и ЛПС в соответствии с описанным выше. Якорный праймер олиго-dT использовали в качестве исходного обратного праймера для транскрипции РНК в кДНК. ПЦР с полимеразой Taq проводили на матрице полученной кДНК с использованием специфичных прямых праймеров вырожденных обратных праймеров (5 минут при 95°С 1 цикл; 30 секунд при 95°С, 30 секунд при 42°С и 45 секунд при 72°С - 30 циклов; 72°С в течение 7 минут). Два раунда «гнездовых» ПЦР-реакций были необходимы для того, чтобы получить единственный фрагмент правильного размера. Полученный продукт вырезали из 1,5%-ного агарозного геля, очищали в соответствии с описанным выше и секвенировали методом секвенирования с концевой флуоресцентной меткой (Perkin Elmer, Nоrwalk, CN).
По данным секвенирования 5'- и 3'-сегментов конструировали праймеры, которые бы позволили амплифицировать участок, кодирующий полноразмерную открытую рамку гена CD80 кошки:
B7-START: ATG GGT CAC GCA GCA AAG TGG (SEQ ID NO: 69)
B7-960: CCT AGT AGA GAA GAG CTA AAG AGG C (SEQ ID NO: 12).
Была использована ранее полученная на материале РВМС кДНК, для которой известно наличие в ней ДНК, кодирующей искомый ген. В этой реакции ПЦР (5 минут при 95°С - 1 цикл; 30 секунд при 95°С, 30 секунд при 42°С и 45 секунд при 72°С - 30 циклов; 72°С в течение 7 минут) использовали химерную полимеразу KlenTaq - этот «сборный» фермент сохраняет некоторую 5'-экзонуклеазную активность, что позволяет снизить частоту случайных ошибок, часто происходящих при проведении ПЦР с полимеразой Taq. В реакции амплифицировали 960-нуклеотидный фрагмент, который клонировали в состав клонирующего вектора ТА (InVitrogen, San Diego, CA) и секвенировали в соответствии с ранее описанным. В окончательной последовательности искомого гена были учтены кДНК от двух разных животных. Каждый нуклеотид в последовательности этого гена независимо проверяли по крайней мере по трем разным последовательностям, полученным в отдельных ПЦР-реакциях, с целью снижения вероятности неточностей, происходящих от ошибок, индуцируемых самой ПЦР.
Результаты
РНК, экстрагированную из тканей экспериментальной кошки НК5, использовали для исходных попыток амплифицировать ген CD80, однако эта кошка после этого была умерщвлена, и последующие продукты брали от других животных. В исходной амплификации РНК клеток РВМС кошки НК5, простимулированных Кон-А, получили 344-нуклеотидный продукт, проявлявший 70%-ный уровень идентичности с геном CD80 человека. Праймеры были специфичны в отношении участка в центре кодирующей последовательности, соответствующего константному иммуноглобулино-подобному домену. Хотя в этих исходных экспериментах использовали дополнительные вырожденные праймеры с целью амплификации участков, которые бы кодировали более значительный сегмент пептида, только при сочетании праймеров В7-2 (прямой) и В7-3 (обратный) получили продукт подходящего размера. Последующие эксперименты, в которых эти дополнительные вырожденные праймеры использовали наряду с ген-специфичными праймерами, оказались безуспешными. Следовательно, и 5'-, и 3'-участки должны быть выделены с применением иных методов.
Группу из шести новых ген-специфичных праймеров сформировали на материале данных секвенирования, проведенного на исходном продукте (прямые: В7-20, В7-135, В7-284, В7-190; обратные: В7-140, В7-50). Исходно обратные праймеры использовали в ПЦР-методе 5'-RACE, который в определенной степени сходен с методом, применявшимся для успешной амплификации 5'-сегмента молекулы CD28. Однако при использовании этого метода продукты не были получены.
В амплификационной системе для кДНК Marathon RACE (Clontech, Palo Alto, CA) успешно амплифицировали участок, который соответствует 5'-кодирующей последовательности. РНК, производная от клеток ЕК6, простимулированных Кон-А, была успешно амплифицирована с помощью данного протокола. Исходную амплификацию осуществили с праймерами В7-284 и В7-3 и якорным праймером АР1. В этой реакции не было получено отчетливого единого бэнда, поэтому с использованием этого продукта в качестве матрицы провели «гнездовые» реакции с использованием праймеров В7-20 и В7-135 как «гнездовых» (т.е. внутренних по отношению к предыдущим праймерам) обратных праймеров и якорного праймера АР1 в качестве прямого праймера. Продукт подходящей длины получили в каждой из этих реакций.
Данные, полученные при прямом секвенировании продуктов реакции RACE, позволили добиться полной идентичности на участках длиной 20 и 135 п.н. соответственно, которые перекрывались с исходным секвенированным продуктом длиной 344 п.н. Продукты удлиняли от известного 5'-участка через старт-кодон ATG гена кошки в сторону 5'-нетранслируемого сегмента. Идентичность 5'-кодирующей последовательности, производной от этих продуктов, и 5'-участка гена CD80 человека была меньшей, чем идентичность, определяемая между 344-нуклеотидным сегментом гена кошки и аналогичным участком гена человека. Было установлено, что сходная утрата гомологии обнаруживается между последовательностями человека и мыши по тем же самым сегментам. Сравнение данных по последовательностям участков за пределами кодирующего сегмента показало дальнейшее отчетливое снижение уровня консерватизма (данные не включены).
Новую группу вырожденных праймеров, кодирующих 3'-нетранслируемый участок, синтезировали по параметрам консенсусных участков в пределах 3'-UTR последовательностей человека и мыши. С помощью этих праймеров успешно амплифицировали кДНК, транскрибируемую с РНК, выделенной из РВМС, простимулированных Кон-А, взятых от кошки ED3. В отличие от исходной амплификации, для получения конечного продукта необходимо было провести серию «гнездовых» реакций. В первичных реакциях ПЦР, в которых использовались эти вырожденные праймеры и якорные праймеры из пределов 344-нуклеотидной последовательности и 5'-сегмента, не удалось исходно получить отчетливые идентифицируемые бэнды. Однако «гнездовые» реакции при использовании разбавленного первичного продукта и дополнительных специфичных 5'-праймеров позволили получить продукт, который кодирует оставшийся 3'-участок.
После секвенирования 3'-продукта было установлено, что за пределами константного Ig-подобного домена уровень идентичности вновь снижался. Дистальный конец кодирующей последовательности указал на очень низкий уровень идентичности, который еще более снижался после стоп-кодона.
На материале 3'-последовательности сконструировали обратный праймер, выходивший за пределы кодирующей последовательности, начиная с 960-го нуклеотида. С этой конструкцией в сочетании с праймером, покрывающим старт-кодон, амплифицировали продукт ожидаемого размера. Секвенирование конечного продукта показало, что все ранее установленные участки действительно перекрываются, и полученный фрагмент представляет собой непрерывную и полную нуклеотидную последовательность гена CD80 кошки.
Для амплификации конечного продукта образцы амплифицировали на материале РНК, выделенной из РВМС, простимулированных Кон-А, взятых у животных ED3 и ЕК6. По крайней мере два продукта от каждого животного секвенировали полностью, а каждый из нуклеотидных сайтов был проверен и подтвержден по крайней мере по трем правильно считанным последовательностям. Продукт, полученный от животного ЕК6, затем клонировали в состав клонирующего вектора ТА для последующего манипулирования и в качестве эталона.
Фрагмент длиной 960 нуклеотидов включает старт-кодон по 1-му положению, стоп-кодон по положению 888 и дополнительно 72 нуклеотида 3'-нетранслируемого участка. Среди продуктов, которые получили и секвенировали в ходе установления полноразмерного фрагмента, были секвенированы дополнительные 5'- и 3'-участки (данные не показаны). Секвенирование участка, расположенного выше старт-кодона, на материале продуктов 5'-RACE показало, что кодон ATG, определенный в положениях 1-3, является первым кодирующим сайтом (метионин) в рамке считывания и занимает аналогичное положение в последовательностях мыши и человека. Стоп-кодон, находящийся в положении 888, также, как подтверждается, находится в сходном положении в ранее секвенированных генах. Сопоставление последовательностей продемонстрировало уровни идентичности 77% и 62% с опубликованными нуклеотидными последовательностями генов CD80 человека и мыши соответственно. Уровень гомологии с последовательностями других приматов и грызунов сравним с уровнями, установленными для человека и мыши соответственно. У каждого из видов уровень идентичности с геном CD86 был менее 25%.
С использованием компьютерного пакета программ для анализа ДНК MacVector (IBI, Rochester, NY) нуклеотидную последовательность «транслировали» в аминокислотную последовательность. В результате такой расшифровки определили 292-аминокислотный пептид, сходный по размеру, с белками и мыши, и человека, хотя и не идентичный им. Сигнальный сегмент, как предполагается охватывает первые 25 аминокислот. Внеклеточный домен данной молекулы составлен 115 аминокислотами домена, сходного с вариабельным иммуноглобулиновым доменом (до 139-го остатка), и 110 аминокислотами домена, сходного с константным иммуноглобулиновым доменом (примерно до 240-го остатка). Трансмембранный домен, который составлен остатками 241-271, переходит в короткий цитоплазматический «хвост», состоящий из 21 аминокислоты. Как и в молекуле человека, полипептид кошки включает 8 потенциальных сайтов N-гликозилирования, хотя их расположение не идентично. Уровень гомологии между белками кошки, человека и мыши существенно меньше чем уровень идентичности соответствующих нуклеотидных последовательностей (табл.2).
Сравнение уровней гомологии последовательностей CD80 кошки, мыши и человека
Сопоставление предполагаемой аминокислотной последовательности CD80 кошки с предполагаемой последовательностью человека указывает на то, что большая часть гомологичности этих двух молекул сосредоточена в константном домене (аминокислоты 140-240). Имеется незначительная гомология между этими пептидами по сигнальному сегменту, и она отсутствует за пределами IgV-подобного домена. Как уже говорилось, консерватизм существен в последовательности константного домена, однако эта идентичность почти не выходит за его пределы, и очень низкий уровень гомологии обнаруживается по трансмембранному домену и цитоплазматическому «хвосту» пептида кошки и аналогичных участков в молекуле человека.
Сопоставление генов CD80 кошки, человека и мыши с генами CD86 мыши и человека показывает, что, хотя имеется весьма ограниченный уровень гомологии между этими двумя членами семейства В7, аминокислоты, которые рассматриваются как диагностические для генов семейства В7, сохраняются и в составе белка кошки. Эти молекулы включают остатки, которые предположительно участвуют в пространственной укладке («фолдинге») и составляют сайт связывания.
Хотя уровень гомологии между последовательностями CD80 человека и кошки не столь велик, как уровень идентичности между молекулами CD28, сравнение полученных графиков гидрофобности показывает, что, хотя и имеется ряд замен аминокислот в конкретной аминокислотной последовательности, эти изменения часто являются гомологичными и, по-видимому, не изменяют поверхностных характеристик данного пептида.
Обсуждение
Уровни идентичности нуклеотидных последовательностей кошки и человека, а также кошки и мыши CD80 средние, хотя уровень такой гомологии не переносится на пептид. Предполагается, что, хотя генетический код и является вырожденным, в некоторых молекулах (например, в CD28) различия между нуклеотидными последовательностями в существенной степени не изменяют пептид, в случае же CD80 консерватизм аминокислотной последовательности в целом не столь критичен, а следовательно, изменения по длине этой молекулы в ходе эволюции «более допустимы».
Хотя в целом нуклеотидные последовательности весьма проявляют средний уровень идентичности, имеются определенные трудности в выделении полноразмерной последовательности. Исходный продукт CD80 был получен по константному домену этой молекулы, т.е. тому участку, который проявляет наивысший уровень консерватизма в последовательности кДНК данного вида. Праймеры, которые маркируют этот участок и позволяют эффективно амплифицировать продукт, получили простым образом, в результате чего 344-нуклеотидный фрагмент охватил наиболее консервативный участок IgC-сходства. К сожалению, из-за отсутствия гомологии в последовательностях сигнального сегмента, цитоплазматического домена и 3'-UTR для выделения последовательностей этих участков нужно приложить больше усилий. Наличие данных по секвенированию центрального участка белка, однако, позволяет определить отправную точку, от которой могут быть определены другие участки этой молекулы. CD80 кошки является отличным примером того, как путем получения короткого фрагмента искомой молекулы и применяя методы RACE и вырожденные праймеры в сочетании с якорными праймерами, соответствующими установленному сегменту, может быть достаточно легко получена полноразмерная последовательность этой молекулы.
Сравнение предполагаемой аминокислотной последовательности этих клонированных молекул CD80 показывает отсутствие общей гомологии. Полипептиды мыши и человека проявляли менее чем 50% уровень гомологии по аминокислотным последовательностям. Это сопоставимо с 59% уровнем идентичности при сравнении белков кошки и человека и 46% идентичности полипептидов кошки и мыши, что, возможно, отражает эволюционное родство этих видов. Сравнение предсказываемых профилей гидрофильности аминокислот кошки и человека, которые позволяют определить те остатки, которые были затронуты или перемещены из-за их относительной гидрофильности, показало, что, хотя на уровне аминокислотной последовательности конкретные аминокислоты могли и не сохраниться, эти изменения, по-видимому, носили относительно консервативный характер. Это указывает на вероятное сохранение признака гидрофильности/гидрофобности данной молекулы, что, значит, может соответствовать сходному по структуре в целом полипептиду. Для поверхностно-клеточного белка, очевидно, характерно наличие конкретных аминокислот, которые непосредственно вовлечены в процесс связывания, а также других аминокислот, которые нужны только для того, чтобы поддерживать структуру, необходимую для обеспечения взаимодействия с сайтом связывания.
Хотя имеются несовпадения аминокислотных остатков в молекулах CD80 у примата, грызуна и кошки, тем не менее сохраняются признаки IgSF. Молекула CD80 кошки включает концевые IgC-подобный домен и IgV-подобный домен, расположенные проксимально по отношению к участку, ассоциированному с мембраной. Как и в случае с уровнем консерватизма при сравнении CD80 мыши и кошки, уровень идентичности константных участков выше, чем при сравнении вариабельных участков (Freeman et al., 1989). В целом, консерватизм вариабельного домена превышает 50%, в то время как этот показатель для константного сегмента превышает 70%, при том, что короткий участок аминокислот 164-198 (тот самый участок, по которому был выделен исходный 344-нуклеотидный фрагмент) характеризуется наибольшим уровнем идентичности. Этот центральный 56-аминокислотный участок (остатки 165-221) в составе константного домена проявляет 87% уровень гомологии между последовательностями человека и кошки, при том, что на 28-нуклеотидном участке (остатки 171-198) имеется только одно различие. Также этот участок кошачьей последовательности проявляет существенный уровень гомологии по сравнению с соответствующими остатками полипептида мыши. Гидрофильная природа аминокислот на этом участке указывает на высокую степень вероятности экспрессии на поверхности клеток, а с учетом определенного уровня консерватизма между видами - на вероятное участие во взаимодействиях «лиганд-рецептор». Было предположено, что IgC-часть данной молекулы напрямую вовлечена в презентирование связывающего домена к связыванию на рецепторе (Peach et al., 1995). Однако экспериментальным образом установили, что для осуществления эффективного связывания необходимы и константный, и вариабельный домены (Peach et al., 1995). Концентрация гомологичных остатков в IgC-участке внеклеточных доменов, наряду с высоким уровнем дивергенции трансмембранного и цитоплазматического доменов, рассматривается как дополнительное доказательство роли CD80 как лиганда в большей степени, нежели фактора, способного вырабатывать сигнал.
Как и у человека, и у мыши CD80 кошки характеризуется высоким уровнем гликозилирования. Углеводные остатки, как считается, не участвуют напрямую в связывании, однако могут способствовать повышению растворимости внеклеточного сегмента этой молекулы (Peach et al., 1995). Из восьми потенциальных сайтов гликозилирования, обнаруживаемых в последовательности пептида человека, семь распложены в положениях, идентичных таковым в белке кошки. Сайт, расположенный в 39-м положении аминокислотной последовательности кошки, не воспроизведен в молекуле CD80 человека, в то время как имеется сайт в 232-м положении, отсутствующий в последовательности кошки (Freedman et al., 1987). В молекуле мыши имеется семь сайтов гликозилирования, только два из которых находятся в идентичных положениях, хотя в принципе они расположены в тех же участках молекулы, что и в молекулах кошки и человека (Freeman et al., 1989). Сходство в числе и положении сайтов гликозилирования, как можно считать, отражает важность соответствующих мотивов для функционирования данной молекулы.
Имеется широкий круг возможных способов применения молекулы CD80 кошки. В соответствии с обсуждавшимся выше, эта молекула является ключевым элементом обеспечения точности в развитии ответа зрелых Т-клеток. Контроль экспрессии данного гена и на уровне РНК, и на уровне белка должен помочь установить пути, по которым иммунная система кошки взаимодействует с инфекцией. Выяснение того, как эта система воздействует на конкретные патогены, с учетом данных, получаемых при исследованиях других модельных систем, прольет дополнительный свет на параметры иммунной системы человека. Кроме того, вклад в изучение возможностей манипуляции иммунной системой кошки, являющейся одним из наиболее распространенных видов домашних животных, придаст ветеринарии новые импульсы.
Важным перспективным применением, предполагаемым для молекулы CD80 у других видов, является индукция опухоль-специфичного иммунитета путем внесения гена CD80 в трансформированные клетки с последующей реинтродукцией донору с целью индукции противоопухолевого иммунитета, опосредуемого лимфоцитами CTL (Townsend & Allison, 1993). Как обсуждалось выше, считается, что результатом поверхностной экспрессии CD80 опухолевыми клетками является специфический CTL-ответ, направленный на злокачественную опухоль (Hodge et al., 1994). Кроме того, у организма-хозяина образуется популяция клеток памяти, происходящая от CD8-позитивных Т-клеток (Hodge et al., 1994). Хотя данный подход в целом направлен на противоопухолевый иммунитет, по аналогии его также можно распространить на развитие противовирусного иммунитета.
Как обсуждалось выше, долговременное латентное состояние синдрома приобретенного иммунодефицита рассматривается как следствие исходного формирования мощного CTL-опосредованного иммунного ответа на ВИЧ-инфекцию (Landay et al., 1994). Предполагается, что те больные, кто в течение долгого времени не проявляет симптомов СПИДа после заражения им, способны формировать и поддерживать сильный CTL-клеточный иммунитет, направленный против ВИЧ.
Хотя большинство современных вакцин направлено на формирование гуморального иммунного ответа, однако если вакцина способна индуцировать развитие популяции mCTL, направленной на вирусы ВИЧ и FIV, то эта популяция должна обеспечивать защиту, сходную с таковой, которая характерна для долговременного бессимптомного СПИДа. Введение новым индивидуумам «генной» вакцины, в составе которой белки FIV объединены с белком CD80, должно приводить к поверхностной экспрессии костимуляторной молекулы в сочетании с презентацией вирусных эпитопов FIV, обеспечиваемой молекулами МНС CI. В случае успеха это должно привести к пролиферации популяции FIV-специфичных лимфоцитов mCTL. После последующего воздействия вирулентного вируса у вакцинированных индивидуумов будет происходить индукция ответа на клетки, которые были инфицированы данным вирусом, уничтожая их до того, как этот вирус будет способен размножаться и начнет разрушать компоненты иммунной системы.
Пример 6
Клонирование и секвенирование кДНК CD28 кошки
Введение
CD28 является поверхностно-клеточным гликопротеином, который в норме экспрессирован в виде гомодимера, составленного идентичными субъединицами с молекулярной массой 44 кДа, соединенными дисульфидными связями. Он входит в иммуноглобулиновое суперсемейство и характеризуется наличием единственного внеклеточного вариабельного (V) участка, трансмембранного домена и короткого цитоплазматического «хвоста» (Aruffo & Seed, 1987). Хотя эта молекула гликозилирована, углеводные составляющие, по-видимому, не участвуют в связывании и предположительно обеспечивают повышение растворимости внеклеточного домена (Peach et al., 1994). кДНК, кодирующая пептиды человека, крысы, мыши и кролика и аналогичная молекула курицы были ранее клонированы и секвенированы (Linsley et al., 1995a).
CD28 обнаруживается в большинстве тимоцитов CD4+/CD8+ и периферических Т-клеток CD4+/CD8+ и характеризуется усилением экспрессии в ответ на стимуляцию αντι-ХΔ3, ФГА и ФМА и подавлением ее в результате связывания с антителом к CD28 (Linsley et al., 1993b). Вскоре после открытия этого белка выяснилось, что CD28 играет важную роль в регуляции активации Т-клеток CD4+/CD8+ (June et al., 1990). В дополнение к стимулированию активации и пролиферации Т-клеток также было установлено, что формирование такого вторичного сигнала индуцирует цитолитическую активность CTL (Azuma et al., 1993c).
CD28 экспрессируется на ранних этапах созревания Т-клеток. В то время как незрелые CD3-негативные клетки негативны и по CD28, промежуточные клетки CD4+/CD8+ экспрессируют этот белок на низком уровне, а зрелые CD3-позитивные тимоциты CD4+/CD8+ экспрессируют CD28 на высоком уровне (Turka et al., 1991). У человека после созревания данный рецептор обнаруживается почти во всех Т-клетках CD4+ и более чем у половины Т-клеток CD8+ (Turka et al., 1991), а также почти у всех Т-лимфоцитов мышей (June et al., 1990). После активации Т-клеток поверхностная экспрессия усиливается, в то время как связывание данной молекулы с соответствующим ей лигандом или специфичными моноклональными антителами обусловливает в активированных клетках негативную регуляцию данного гена и на транскрипционном, и на трансляционном уровнях (Linsley et al., 1993a). Хотя CD28 обнаруживается в основном на лимфоцитах Т-клеточных популяций, этот белок, как сообщалось, выявляется в плазмацитомах костномозговых биопсийных проб (Kozber et al., 1987) и экспрессируется в культурах линии лейкозных клеток, сходных с натуральными клетками-киллерами (Azuma et al., 1992).
CD28 проявляет определенную степень структурной гомологии с другим В7-рецептором - CTLA-4: они оба относятся к подсемейству в группе белков IgSF (Linsley et al., 1995a). Эти две молекулы включают внеклеточный IgV-домен, единственный трансмембранный домен и короткий цитоплазматический сигнальный домен (Aruffo et al., 1987). Хотя суммарный уровень гомологии между этими двумя молекулами составляет только 31%, имеются два коротких участка и специфичные остатки, которые полностью инвариантны у этих двух молекул: это отражает вероятную важную роль данных мотивов в распознавании лигандов В7 и поддержании структурной целостности (Leung & Linsley, 1994). Гексапептидный мотив MYPPPY сохраняется у всех выделенных членов семейства рецепторов CD28/CTLA-4 (Peach et al., 1994). Он картируется в CD3-подобный выпетленный участок данных молекул; в случае его мутирования происходит снижение авидности по связыванию и у CD28, и у CTLA-4 (Peach et al., 1994). Этот участок, как предполагалось, служит потенциальным сайтом связывания лигандов в составе обоих белков - CD28 и CTLA-4, однако неизвестно, является ли этот участок прямым сайтом связывания лиганда В7 или же он представляет структурные мотивы, косвенным образом вовлеченные в связывание (Peach et al., 1994). Несмотря на консерватизм остатков в последовательностях CD28 и CTLA-4, CTLA-4 связывает CD80 и CD86 с более высокой авидностью, чем CD28 (Ellis et al., 1996). Таким образом, хотя в активированных Т-клетках in vitro CTLA-4 экспрессирован на уровне лишь 2-3% от такового у CD28, он связывает лиганды с большей в 20 раз авидностью (Linsley et al., 1995b).
Хотя молекулы CTLA-4 и CD28 эволюционно родственны и имеют общие лиганды, тем не менее их функции и сигнальные способности, по-видимому, дифференцированы (Balazano et al., 1992). Сравнение сигнальных участков в составе каждой из этих молекул не отражает существенный уровень идентичности: следовательно, эти молекулы инициируют разные сигнальные механизмы (Hutchcroft & Bierer, 1996).
В то время как CD28 экспрессирован в покоящихся Т-клетках и позитивно регулируется в начале ответа на активацию, экспрессия CTLA-4 достигает пика через 48 часов после активации и возвращается на исходный уровень через 96 часов после активации (Linsley et al., 1992a). Экспрессия CTLA-4, как предполагается, согласуется с негативной регуляцией CD28 (Lindsten et al., 1993). Кроме того, сигнальные механизмы, опосредуемые связыванием лигандов рецептором CD28, по-видимому, играют важную роль в интенсификации экспрессии CTLA-4 (Linsley et al., 1993a). Т-клетки, которые негативны по CD28, не экспрессируют CTLA-4 в ответ на стимуляцию ФМА или источником ионов кальция (Lindsten et al., 1993).
Полная последовательность событий в опосредуемом CD28 сигнальном пути пока не определена, хотя имеется гипотеза о составе этого каскада процессов (Hutchcroft & Bierer, 1996). Было высказано предположение о том, что сигнальный механизм CD28 вовлекает мобилизацию внутриклеточного кальция, метаболизм фосфатидилинозитола и индукцию фосфорилирования белков по остаткам тирозина (Hutchcroft & Bierer, 1996).
Цитоплазматический «хвост» молекулы CD28 включает определенные мотивы, для которых предполагается участие во внутриклеточных сигнальных процессах после связывания лигандов CD80 или CD86 (June et al., 1994). Состоящий из 41 аминокислоты внутрицитоплазматический участок не обладает выявляемой каталитической активностью, так как не включает внутриклеточных мотивов «тирозиновой активации» (как в последовательности TCR) или остатков цистеина, необходимых для связывания цитоплазматических тирозинкиназ семейства Src (June et al., 1994). Однако некоторые из сайтов потенциального гликозилирования в составе выделенных последовательностей консервативны (Hutchcroft & Bierer, 1996). Внутриклеточная каталитическая активность и межбелковые взаимодействия часто регулируются по пути дифференцированного фосфорилирования белков, хотя ферменты, которые бы обеспечивали такую активность рецептора CD28, пока не определены (Lu et al., 1992). Консенсусный мотив YMXM, имеющийся в составе цитоплазматического домена, является предполагаемым сайтом Src-гомологии фосфотирозинового связывания (домен SH2), определяющего в свою очередь связывание фосфатидилинозитол-3-киназы (киназы PI3) (Prasad et al., 1995). Хотя это является лишь одним из возможных сигнальных механизмов для участия CD28, было показано, что активность киназы PI3 не коррелирует с активностью IL-2; но так как увеличение выработки IL-2 является первичным следствием сигнальной активности CD28, то представляется, что другие механизмы влияют на активность, обусловливаемую внутриклеточными сигнальными процессами (June et al., 1994).
Хотя значение этих процессов пока полностью не расшифровано, костимуляция CD28 приводит к усилению выработки цитокинов Т-клетками. В CD28-позитивных Т-клетках, активированных действием антител к CD3 или ФГА, анти-CD28 обусловливает превышение исходного уровня РНК ряда цитокинов, включая IL-1, IL-2, IL-3, IL-4, фактор некроза опухолей (TNFα), лимфотоксин, γ-интерферон и колоние-стимулирующий фактор гранулоцитов-моноцитов (GM-CSF), равно как и рецептор интерлейкина-2 (Lenschow et al., 1996). Повышение исходного содержания мРНК обусловливается и повышением уровня транскриптов, и интенсификацией самой транскрипции (Hutchcroft & Bierer, 1996).
Хотя костимуляция CD28 впервые была описана в клонах CD4-позитивных Т-клеток (Martin et al., 1986), сейчас известно, что CD28 участвует в активации многих типов клеток. Костимуляция этого механизма, как было показано, регулирует в субпопуляциях «наивных» Т-клеток CD4+ выработку γ-интерферона, цитокинов Th1-ответа и выработку IL-4, являющегося цитокином Th2-ответа (Seder et al., 1994). Костимуляторный механизм с участием CD28 также важен для активации CTL CD8+, хотя, по-видимому, он не является необходимым для эффекторной фазы уничтожения клеток с участием CTL (Hodge et al., 1994). Интересно, что CD28 также предположительно играет роль в процессах ВИЧ-инфекции. В культивируемых лимфоцитах, происходящих от некоторых пациентов с позитивной реакцией на СПИД, связывание CD28 с моноклональным антителом может усиливать размножение вируса ВИЧ (Asjo et al., 1993).
У приматов и грызунов вторичный сигнал, образуемый в результате связывания CD80 c CD28, отчетливо указывает на его роль в исходной активации Т-клеток (Aruffo & Seed, 1987). Недавно полученные данные, однако, позволяют предположить, что основное следствие такого взаимодействия может быть направлено на обеспечение пролиферации за счет подавления апоптоза (Lenschow et al., 1996). Покоящиеся Т-клетки, находящиеся в G0-фазе роста, могут активироваться путем образования комплекса TCR, однако они не способны пролиферировать или секретировать IL-2 в отсутствие связывания CD28: такой эффект называют анергией (Linsley et al., 1991a). Зрелые Т-клетки могут активироваться исключительно по связыванию TCR с молекулами МНС на поверхности клеток АРС, однако это в конечном счете приводит к активации индуцированной клеточной гибели, т.е. к апоптозу (Radvanyi et al., 1996). Хотя другие вторичные взаимодействия (например, костимуляция ICAM-1) могут формировать вспомогательные сигналы к пролиферации, предполагается, что CD28-опосредованная костимуляция является уникальным механизмом, предотвращающим последующее наступление клональной анергии и апоптоза (Linsley et al., 1993a). Было показано, что CD28 может участвовать в регуляции генов, для которых известна вовлеченность в защиту Т-лимфоцитов от апоптоза (Boise et al., 1995). Постоянное усиление экспрессии bcl-xt было выявлено в Т-клетках, костимулированных связыванием на рецепторе CD28 (Boise et al., 1995). Считается, что костимуляция CD28 может стабилизировать мРНК bcl-xt, с которой транслируется белок, предотвращающий апоптоз (Radvanyi et al., 1996).
Связывание на CD28, как было показано, способствует усилению выработки различных цитокинов Т-хелперами в ответах и 1-го, и 2-го типов (Lenschow et al., 1996). Также предполагается, что это взаимодействие участвует в формировании конкретных типов Т-хелперов. «Наивные» CD4-позитивные Т-лимфоциты должны в норме формировать фенотип Th1, если они активировались в отсутствие сигнального пути, опосредованного связыванием CD28/CD80 (Lenschow et al., 1996). Это может иметь косвенное значение в выработке IL-4, индуцированной добавлением экзогенного IL-2, в то время как роль сигналов CD28 в выработке IL-2 ранее уже была подтверждена (Seder et al., 1994). Проведенные исследования на мышах, «выключенных» по гену CD28, дополнительно подтвердили роль этого рецептора в дифференцировке клеток Th2.
Мыши, являющиеся гомозиготными нулевыми мутантными по CD28, были получены Шахиняном с соавторами с целью установления того, как животное адаптируется к инфекции в отсутствие вторичного сигнала, генерируемого CD28 (Shahinian et al., 1993). Этот ген был разрушен в эмбриональных стволовых клетках путем частичного замещения второго экзона геном резистентности к неомицину (Shahinian et al., 1993). Было показано, что мыши, гомозиготные по «выключенному» гену, не экспрессируют CD28 на своих Т-клетках, в то время как гетерозиготные особи CD28 (-/+), как было установлено, характеризуются сниженной поверхностной экспрессией этого рецептора (Shahinian et al., 1993). Стимуляция митогеном Т-клеток, производных от гомозиготных «выключенных» по CD28 мышей, ослабляет пролиферацию Т-клеток и выработку цитокинов, что может быть лишь частично восстановлено действием экзогенного IL-2 (Shahinian et al., 1993). Было показано, что высокоочищенные Т-клетки не активируются лектинами в отсутствие клеток АРС (Unanue, 1984). На материале названной «выключенной» линии было показано, что взаимодействие CD28/CD80 необходимо для проявления митогенной активности Т-клеточных лектинов (Shahinian et al., 1993). Также было обнаружено, что данное взаимодействие является важным для опосредования переключения изотипов В-клеток в ответ на действие антигена (Shahinian et al., 1993). В отличие от «выключенных» по CD80 мышей, функциональная роль CD28 может быть установлена с применением генно-инженерной технологии «выключения генов». О мышах, «выключенных» по гену CТLA-4, пока не сообщалось, однако мыши, сверхэкспрессирующие CTLA-4 Ig, уже были исследованы (Lane et al., 1994). Как и следовало ожидать, фенотипические характеристики этой линии мышей сходны с признаками линий, дефицитных по CD28 (Lane et al., 1994). Хотя изолированные Т-клетки вырабатывают нормальное количество γ-интерферона, после стимуляции выявляется существенно меньшее количество IL-4 (Ronchese et al., 1994). Это приводит к неспособности В-клеток инициировать или поддерживать точный гуморальный иммунный ответ (Ronschese et al., 1994). Хотя известны различные предполагаемые пути дифференцировки Th1 и Th2, взаимодействие CD28/B7 отчетливо влияет на дифференцировку подгрупп Т-лимфоцитов.
Стабилизация мРНК интерлейкина-2 может играть ключевую роль в связывании на CD28, однако некоторые другие цитокины, как было показано, напрямую или опосредованно влияют на это взаимодействие (Linsley et al., 1991a). Медиаторы воспаления IL-1α, IL-6 и TNFα вырабатываются популяциями Т-клеток памяти в ответ на сигнал молекул CD28, в то время как в популяциях «наивных» клеток вырабатывается только IL-1α (Cerdan et al., 1991; van Kooten et al., 1991). Экспрессия IL-4 также регулируется с участием сигнального механизма CD28 (Seder et al., 1994). Также указанное взаимодействие обеспечивает позитивную регуляцию IL-5, IL-10 и IL-13, являющихся важными медиаторами гуморального ответа (deWaal Malefyt et al., 1993; Minty et al., 1993). Кроме того, колоние-стимулирующие факторы и факторы роста, включая GM-CSF, CSF-1 и IL-3, и хемотаксические факторы, включая IL-8, позитивно регулируются с участием сигнала, генерируемого рецептором CD28 (Harlan et al., 1995).
С учетом того, что выше обсуждалась вероятное использование CD80 в индукции противоопухолевого иммунитета, существует ряд других потенциальных способов клинического применения CD28 и CD80. Предотвращение взаимодействия между CD28 и CD80, как было показано в модельной системе грызунов, способствует профилактике или лечению ряда аутоиммунных заболеваний, профилактике отторжения органов или проявлению реакции «трансплантат против хозяина», а также профилактике секреции цитокинов, ассоциированной с сепсисом (Harlan et al., 1995; Nickoloff et al., 1993; Thomas et al., 1994; Zhou et al., 1994). Добавление CTLA-4 Ig с целью блокировки взаимодействия CD28/CD80 у мышей может предотвращать симптомы волчаночного типа у мышей линии NZB/NZW и частично защищать от летального ЕАЕ и от летального нефрита у крыс (Harlan et al., 1995). Хотя данный иммунотерапевтический подход в отношении аутоиммунных заболеваний для человека пока не применялся, было установлено, что в медицинской практике при биопсиях у пациентов с псориазом и ревматоидным артритом выявляется экспрессия CD80, в то время как в нормальных биопсийных пробах такая экспрессия отсутствует (Nickoloff et al., 1993; Thomas et al., 1994). При пересадках костного мозга и органов у мышей и в модельных экспериментах на человеке in vitro добавление CTLA-4 Ig и предотвращение взаимодействия CD28/B7 может обусловливать по крайней мере частичную защиту от отторжения органа, проявления реакции «ТПХ» или индукцию антиген-специфичной устойчивости (Harlan et al., 1995). Наконец, секреция цитокинов и проявление сепсиса, что может приводить к заражению крови и септическому шоку, могут быть предотвращены у мышей путем прижизненного введения CTLA-4 Ig (Zhou et al., 1994). Манипуляции взаимодействием CD28/CD80 позволяют глубже понять процессы Т-клеточной костимуляции и позволяют приблизиться к решению различных проблем.
Материалы и методы
Выделение исходного фрагмента CD28
мРНК экстрагировали из лимфоцитов периферической крови животного НК5, простимулированных в течение 16 часов Кон-А, с использованием реагента для РНК-экстракции RNAzolB (Biotexc, Houston, TX). Исходно кДНК синтезировали на матрице выделенной РНК с обратной транскриптазой (ОТ), используя в качестве 3'-праймера олиго-dT. Вкратце, РНК и олиго-dT нагревали до 75°С на 3 минуты для удаления вторичных структур. Затем добавляли ОТ, dNTP, буфер и дистиллированную воду и полученную смесь инкубировали в течение 1 часа при 42°С. После инкубации образец нагревали до 95°С на 5 минут с целью инактивации ОТ. Вырожденные праймеры, производные от консенсусных сегментов, найденных в опубликованных нуклеотидных последовательностях CD28 человека, мыши и кролика (GenBank, Bethesda, MD), затем использовали для исходной амплификации 673-нуклеотидного фрагмента, кодирующей большую часть открытой рамки:
CD28-113: CAA CCT TAG CTG CAA GTA CAC (SEQ ID NO: 70)
CD28-768: GGC TTC TGG ATA GGG ATA GG (SEQ ID NO: 71).
Метод ПЦР «с горячим стартом» на основе использования Taq-полимеразы применяли для амплификации продукта (5 минут при 95°С - 1 цикл; 30 секунд при 95°С, 30 секунд при 48°С и 45 секунд при 72°С - 30 циклов; 7 минут при 72°С - 1 цикл). Затем полученный фрагмент визуализовали в 1%-ном агарозном геле и лигировали в состав клонирующего вектора ТА (InVitrogen, San Diego, CA) и секвенировали в соответствии с описанным выше. На основе последовательности кДНК были получены специфичные 3'-праймеры, которые синтезировали для использования в методе 5'-RACE:
CD28-190: CGG AGG TAG AAT TGC ACT GTC C (SEQ ID NO: 72)
CD28-239: ATT TTG CAG AAG TAA ATA TCC (SEQ ID NO: 73).
Выделение 5'-сегмента
Модифицированный по GIBCO протокол метода 5'-RACE (Gibco BRL, Gaithersburg, MD) использовали для получения оставшейся 5'-последовательности молекулы CD28 кошки. РНК экстрагировали из РВМС, простимулированных в течение 16 часов Кон-А. Обратный ген-специфичный праймер использовали для синтеза первой цепи кДНК. РНК и этот праймер нагревали до 75°С на 5 минут с последующим добавлением других ОТ-реагентов. После денатурации полученную смесь охлаждали до 4°С и добавляли реакционный буфер, хлорид магния, dNTP, дитиотреитол и обратную транскриптазу SuperScript (Gibco BRL, Gaithersburg, MD). Смесь с ОТ инкубировали при 42°С в течение 30 минут и затем нагревали до 70°С в течение 15 минут с целью денатурации ОТ. Затем добавляли РНКазную смесь и реакцию инкубировали при 55°С в течение 10 минут с целью удаления остатков РНК и предотвращения неправильной достройки с участием терминальной трансферазы (TdT). Затем кДНК очищали с использованием центрифужной колонки GlassMax (Gibco BRL, Gaithersburg, MD) с целью удаления не включившихся нуклеотидов и праймера. Затем очищенную кДНК, элюированную с данной колонки, замыкали с помощью TdT. TdT использовали для добавления 20-30-нуклеотидного дезоксицитидинового «хвоста» к кДНК. Этот фермент добавляли к смеси очищенной кДНК, хлорида магния, реакционного буфера и dCTP после 3-минутной денатурации кДНК при 95°С. Реакцию инкубировали при 37°С в течение 10 минут и фермент затем инактивировали нагреванием до 70°С в течение еще 10 минут. кДНК с присоединенным «хвостом» амплифицировали с использованием Taq-полимеразы в реакции ПЦР с «горячим стартом» (5 минут при 95°С; 30 секунд при 95°С, 30 секунд при 55°С и 45 секунд при 72°С - 35 циклов; 72°С в течение 7 минут). Праймерами для этой реакции являлись обратный праймер, соответствующий 5'- участку праймера для синтеза кДНК, и якорный праймер, специфичный для dC-линкера и состоящий в основном из остатков dG и небольшого числа dI. 1 мкл этой реакции разбавляли добавлением 50 мкл воды и 5 мкл полученной смеси затем использовали для «гнездовой» ПЦР (5 минут при 95°С - 1 цикл; 30 секунд при 95°С, 30 секунд при 55°С и 45 секунд при 72°С - 30 циклов; с химерной полимеразой KlenTaq) с якорным прямым праймером dG/dI и дополнительным верхним «гнездовым» ген-специфичным обратным праймером. 30 мкл «гнездовой» реакции затем визуализовали в 1,5%-ном агарозном геле и точный фрагмент вырезали из геля. кДНК очищали в соответствии с описанным выше с использованием гель-распылителя Amicon и фильтра Micropure (Amicon, Beverly, MA). Очищенный образец кДНК секвенировали методом секвенирования с концевой флуоресцентной меткой (Perkin Elmer, Nоrwalk, CN). На материале завершенных фрагментов определили консенсусную последовательность. На основе этой последовательности была синтезирована пара праймеров, соответствовавших полноразмерной кодирующей рамке гена CD28 кошки:
Прямой feCD28: CGC GGA TCC ACC GGT AGC ACA ATG ATC CTC AGG (SEQ ID NO: 13)
Обратный feCD28: CGC GGA TCC TCT GGA TAG GGG TCC ATG TCA G (SEQ ID NO: 14).
С использованием этих праймеров молекулу кДНК, включающую полноразмерный кодирующий участок, амплифицировали на материале кДНК, синтезированной на РНК из РВМС, взятых у животных ЕК6 и ED3 и простимулированных Кон-А. Эта производная от РВМС кДНК была получена ранее и, как было установлено, включала РНК, соответствующую данному гену. В данной ПЦР (5 минут при 95°С - 1 цикл; 30 секунд при 95°С, 30 секунд при 42°С и 45 секунд при 72°С - 30 циклов; 72°С в течение 7 минут) использовали ДНК-полимеразу KlenTaq, которая снижает случайные ошибки, обычно сопровождающие использование Taq-полимеразы, и в результате получили 754-нуклеотидный фрагмент, который клонировали в состав клонирующего вектора ТА и секвенировали в соответствии с описанным ранее. Как и в случае с молекулой CD80, каждый нуклеотид подтверждали по крайней мере по трем независимо полученным последовательностям.
Результаты
Вырожденные праймеры, выбранные по параметрам консенсусных участков последовательностей кДНК CD28 мышей, человека и кролика, использовали в ПЦР с успешным получением продукта, который охватывает практически всю кодирующую последовательность кошки. Благодаря более высокой степени консерватизма, свойственного молекуле CD28, в результате исходной амплификации с использованием данных вырожденных праймеров получили виртуально полноразмерную молекулу. В отличие от молекулы CD80 кошки, в которой вначале был получен только небольшой центральный фрагмент, в кодирующей рамке кДНК CD28 не «хватало» лишь 113 «крайних» 5'-нуклеотидов. Этот исходный фрагмент последовательности проявлял 86% уровень гомологии с аналогичным участком последовательности человека, 86% уровень гомологии с кДНК кролика и 79% уровень гомологии с кодирующей последовательностью мыши.
Старт-кодон ATG и дополнительные 110 нуклеотидов, а также некоторые 5'-фланкирующие последовательности были выделены с применением метода 5'-RACE (Gibco, Gaithersburg, MA). В реакции «присоединения хвоста» использовали кДНК, полученную на материале РНК клеток РВМС кошки ЕК6, простимулированных Кон-А. На этом материале в результате амплификации с праймером CD28-786 и якорным праймером dG получили небольшой различимый материал.
Хотя не было выявлено различимых бэндов при амплификации с комбинацией праймеров dG/CD28-786, разбавленную кДНК из этой реакции амплифицировали с использованием «гнездовых» праймеров для CD28 - CD28-182 и CD28-239. Отчетливый бэнд присутствовал в области примерно 600 пар нуклеотидов. Этот продукт выделили из агарозного геля и секвенировали с подтверждением наличия в нем 5'-фрагмента, включая старт-кодон и фланкирующую последовательность за его пределами.
На основе нуклеотидной последовательности этих продуктов был сформирован прямой праймер, который включал старт-кодон. Этот праймер в сочетании с 3'-конструкцией использовали для амплификации кДНК из экстрактов РНК клеток РВМС, взятых у животных ЕК6 и ED3 и простимулированных Кон-А, и получили 754-нуклеотидный фрагмент.
По крайней мере два продукта от каждого животного секвенировали полностью и каждый нуклеотид проверяли и подтверждали по крайней мере по трем независимым точно считанным последовательностям. После этого полноразмерный продукт секвенировали из состава клонирующего вектора ТА с целью подтверждения точности и воспроизводимости полученного продукта.
В окончательном 685-нуклеотидном фрагменте, составляющем полную открытую рамку, старт-кодон ATG находится в положении 1, стоп-кодон - в положении 664-666, а еще 19 нуклеотидов составляют 3'-UTR. Как и в случае с молекулой CD80 кошки, положение старт-кодона ATG подтвердили по параметрам секвенирования продуктов реакции 5'-RACE (данные не включены).
Ген CD28 кошки, будучи секвенирован, проявил наибольший уровень суммарной идентичности с последовательностями кролика и человека. Гомология с кДНК также была значительна, хотя идентичность с последовательностью курицы выражалась в меньшей степени и была сопоставима с уровнями сходства других генов, сравниваемых у курицы и млекопитающих (табл.3).
Сравнение последовательностей CD28 кошки и CD28 мыши, человека, курицы и кролика
Аминокислотная последовательность была расшифрована по нуклеотидной последовательности в соответствии с описанным выше. Величины идентичности расшифрованной аминокислотной последовательности с другими опубликованными последовательностями оказались сравнимы с идентичностью на уровне нуклеотидных последовательностей. Сигнальный сегмент пептида простирается от старт-остатка метионина до 19-й аминокислоты. Представляется, что, как и в других клонированных полипептидах CD28, в молекуле кошки единственный внеклеточный вариабельный иммуноглобулино-подобный домен приходится на остатки 19-153. Гидрофобный трансмембранный домен занимает следующие 27 остатков, а еще 41 аминокислота составляют цитоплазматический «хвост». Как и молекула CD28 человека, полипептид кошки включает пять сайтов потенциального N-гликозилирования.
Сравнение расшифрованной аминокислотной последовательности белков CD28 кошки и человека показало наличие участков гомологии при некоторых различиях. Большинство изменений приходятся на трансмембранный домен, сигнальный сегмент и N-концевой домен. Наивысший уровень гомологии характерен для центрального IgV-подобного домена и для цитоплазматического «хвоста».
Сравнение молекулы CD28 кошки с расшифрованными аминокислотными последовательностями членов семейства CD28/CTLA-4 человека и мыши показало, что, хотя общий уровень гомологии членов этой группы белков составляет лишь 25%, сохраняются специфичные участки и аминокислоты. Мотив MYPPPY сохраняется у всех членов этой группы. В последовательности кошки предполагается наличие дополнительных остатков, важных для обеспечения структурной целостности, включая ряд консервативных остатков цистеина.
Цитоплазматический домен в молекуле СВ28 характеризуется консерватизмом средней степени по сравнению с другими опубликованными последовательностями, особенно последовательностями млекопитающих. Предполагается, что различные внутриклеточные сигнальные механизмы опосредуются перекрестным связыванием внеклеточного сегмента данного рецептора (Hutchcroft & Bierer, 1995).
Графики гидрофильности расшифрованной аминокислотной последовательности CD28 кошки при сравнении с такими же графиками полипептида человека дополнительно показывают вероятность того, что каждый из этих белков характеризуется сходной структурой. Однако при наличии замен аминокислот это, по-видимому, не приводит к существенным изменениям гидрофильности данной молекулы: это отражает в основном гомологичную природу таких замен аминокислот. Надо заметить, что очень высокий уровень сходства профилей гидрофильности характеризует трансмембранные домены пептидов кошки и человека, характеризующихся лишь 75% уровнем гомологии.
Обсуждение
Все последовательности клонированных молекул CD28 проявляют средний уровень эволюционного консерватизма. Можно предположить, что участие этой молекулы в активации и опосредовании Т-клеточного иммунитета имеет место у различных высших позвоночных животных - от куриных птиц «через» грызунов и хищных млекопитающих до высших приматов.
Сравнение аминокислотнотных последовательностей каждой из этих молекул указывает на средний уровень гомологии участков внеклеточного домена, который предположительно вовлечен в связывание лиганда, а также внутриклеточных участков, предположительно участвующих в формировании внутриклеточных сигналов. В целом, наивысший уровень гомологии обнаруживается в участке, окружающем предполагаемый сайт связывания лиганда - MYPPPY, - расположенный в составе IgV-подобного домена полипептида кошки, аминокислоты 118-123.
Предполагаемый сигнальный сегмент соответствует участку от начального метионина до 19-го остатка (Aruffo et al., 1987). Мономер CD28 составлен единственным внеклеточным вариабельным иммуноглобулино-подобным доменом, занимающим аминокислоты 19-153 (Aruffo et al., 1987). Гидрофобный трансмембранный домен приходится на следующие 27 остатков, после которого расположен 41-аминокислотный цитоплазматический домен (Aruffo et al., 1987). Белок кошки включает 5 сайтов потенциального N-гликозилирования в идентичных положениях по отношению к тому, что было найдено в полипептиде человека. Интересно, что сайтом гликозилирования, находящимся в остатке 105 белка кошки, является мотив NQS, в то время как в последовательности человека он - NQT. Такая аминокислотная дивергенция дополнительно подтверждает то, что, несмотря на наличие изменений в последовательностях, их общие структурные характеристики сохраняются.
Как можно было ожидать исходя из уровней гомологии, проявляемых этими белками, сравнение графиков гидрофильности CD28 кошки и человека показывает, что эти молекулы характеризуются в принципе сходными конформационными параметрами. Однако также ясно, что в случае замены аминокислоты результирующие изменения оказываются гомологичными. Притом, что трансмембранный домен является областью данной молекулы, характеризующейся наименьшим уровнем консерватизма при простом сохранении им свойства гидрофобности, цитоплазматический домен молекулы CD28 кошки по сравнению с другими опубликованными последовательностями консервативен в средней степени. Предполагается существование ряда внутриклеточных сигнальных механизмов, опосредуемых связыванием на данном рецепторе, и, хотя внутриклеточный сегмент полипептида CD28 не обладает собственной каталитической активностью, тем не менее связывание им лиганда обусловливает активацию внутриклеточных эффекторных молекул (Aruffo et al., 1987). Имеется четыре консервативных остатка тирозина (положения 173, 188, 191 и 200), для которых предполагалось их фосфорилирование (Lu et al., 1992). С другой стороны, мотив MNM, начинающийся со 193-й аминокислоты молекулы кошки, рассматривается как сайт домена SH2 в белках человека и мыши (Prasad et al., 1995). Потенциальный сайт фосфорилирования с участием протеинкиназы-С остается в остатке серина-185, в то время как треонин-202 может быть мишенью для атаки пролин-ориентированной активности серин-треониновых протеинкиназ Erk1 или Erk2 (Hutchcroft & Bierer, 1996). Как обсуждалось выше, сигнальная функция рецептора CD28 является многообразной, поэтому вовсе неудивительно то, что его цитоплазматический домен включает несколько потенциальных сайтов атаки для сигнальных медиаторов.
Будущее использование молекулы CD28 кошки должно включать разработку способов выявления поверхностной экспрессии этого рецептора и контроля экспрессии CD28 после заражения вирусом, таким как FIV. Если такой способ может быть объединен с уже существующими способами выявления мРНК, то может быть получена ценная информация об уровне экспрессии в процессе инфицирования. Последующая связь параметров экспрессии CD28 в ходе хронической FIV-инфекции позволит рассматривать организм кошки как репрезентативную модель ВИЧ-инфекции человека, что позволит дать более точные данные об инфекционных процессах у обоих видов организмов.
Пример 7
Экспрессия белков CD28/CD80
Введение
При том, что связи в иммунной системе по большей части опосредованы «растворимыми» (немембранными) факторами, инициация первичного Т-клеточного ответа у приматов и грызунов, как было установлено, зависит от непосредственного межклеточного контакта (Mescher, 1992). Вначале считалось, что такое взаимодействие включает в себя лишь взаимодействие между TCR на поверхности Т-клетки и молекулой МНС на поверхности антиген-презентирующей клетки, однако затем стало ясно, что связывание между вспомогательными молекулами также необходимо для полной активации Т-клетки (Schwartz, 1992). Как обсуждалось выше, было получено доказательство взаимодействия между белками CD28 и CD80, как медиаторами такого вспомогательного сигнала (Linsley et al., 1991a).
Многие играющие важную роль рецепторы и лиганды у позвоночных животных относятся к суперсемейству иммуноглобулинов (Springer, 1990). Эти молекулы характеризуются присутствием иммуноглобулиноподобного участка - обычно во внеклеточной части данной молекулы (Buck, 1992). Хотя уровни консерватизма неодинаковы, часто он ограничен именно теми остатками, которые обеспечивают пространственную укладку белка по иммуноглобулиновому типу (Beale, 1985). Характеристикой Ig-домена является наличие двух тесно взаимодействующих антипараллельных β-цепей, связанных петлей, обеспечивающей консервативную топологию (Williams & Barclay, 1988). Хотя имеются общие признаки структуры членов данного семейства, существует разнообразие в параметрах связывания и сигнальных свойствах у отдельных представителей данного семейства (Anderson et al., 1988).
Являясь членами семейства IgSF, и CD28, и CD80 в определенной степени сходны по структуре своих внеклеточных доменов. У CD28 имеется единственный V-подобный домен, хотя он и экспрессирован в виде гетеродимера, связанного дисульфидными «мостиками» (Aruffo et al., 1987). Внеклеточный участок молекулы CD80, однако, включает и V-, и С-подобные иммуноглобулиновые домены и экспрессируется как мономер (Freedman et al., 1989). Поскольку члены семейства IgSF характеризуются общими структурными параметрами, по крайней мере в ограниченной степени можно переносить некоторые шаблоны пространственной структуры на родственные молекулы, которые кристаллизовать не удается (Bajorath et al., 1993). Хотя кристаллизация ни CD28, ни CD80 не была осуществлена, методами рентгенографической кристаллографии были исследованы молекулы CD2 (Driscoll et al., 1991) и CD8 (Leathy et al., 1992), характеризующиеся аналогичными внеклеточными доменами, что позволило определить некоторые принципы структуры родственных молекул семейства IgSF (Linsley et al., 1995a).
Как обсуждалось выше, CD80 и CD86 проявляют сходные активности по связыванию на рецепторах CD28 и CTLA-4. Однако CD28 является менее аффинным рецептором для этих лигандов, в то время как CTLA-4 более аффинен по отношению к обеим этим молекулам (Linsley et al., 1994a). Хотя вероятный механизм известен, пока неясно, как низкоаффинный рецептор, характеризующийся высокой скоростью отщепления лиганда, что характерно для CD28, способен обеспечивать необходимый костимуляторный сигнал в дифференцировку Т-клеток (Linsley et al., 1995a). Предполагается, что связывание CD80 на CD28 на поверхности Т-клеток может способствовать олигомеризации данного рецептора, что и обеспечивает эффективность связывания и выработки сигнала (Linsley et al., 1995a). Было показано, что CD28 равномерно распределен на поверхности активированных Т-клеток, т.е. предположительно эти молекулы перемещаются на мембрану после загрузки Т-клетки (Damle et al., 1994). Высокая концентрация олигомеризованного CD28 будет способствовать реассоциированности растворимых CD28 в области межклеточного контакта и тем самым обеспечивать генерирование сигнала, несмотря на быстрое отщепление лиганда (Linsley et al., 1995a). Такой процесс, названный «взаимным кэпированием», хотя напрямую и не установлен при взаимодействии CD28/CD80, был подтвержден для других рецепторов, для которых необходим похожий инициирующий межклеточный контакт (Singer, 1992).
Хотя, как было показано, взаимодействие CD28/CD80 является ключевым в развитии Т-клеточного иммунного ответа, до сих пор остаются вопросы в выяснении точного механизма данного сигнального механизма (Linsley et al., 1993a). Существование двух рецепторов и двух лигандов в данном взаимодействии поднимает вопрос о роли каждого из них в активации Т-клеток (Linsley et al., 1992b). Хотя рецептор CTLA-4 проявляет более сильное связывание, он экспрессируется гораздо позже события активации, и хотя сигнальные механизмы связывались с CD28, так и не было определено, генерируется ли сигнал после связывания лиганда на рецепторе CTLA-4 (Linsley et al., 1995a).
Материалы и методы
Получение вставок
Следующие праймеры использовали для амплификации полноразмерной кодирующей рамки генов CD28 и CD80 кошки для встраивания его в экспрессирующие векторы:
Прямой feCD80: CGC GGA TCC GCA CCA TGG GTC ACG CAG CAA AGT GGA AAA C (SEQ ID NO: 11)
feCD80-960: CCT AGT AGA GAA GAG CTA AAG AGG C (SEQ ID NO: 12)
Прямой feCD28: CGC GGA TCC ACC GGT AGC ACA ATG ATC CTC AGG (SEQ ID NO: 13)
Обратный feCD28: CGC GGA TCC TCT GGA TAG GGG TCC ATG TCA G (SEQ ID NO: 14).
Прямой праймер для CD80 и оба праймера для CD28 были сконструированы с включением BamHI-сайтов и подходящими линкерами с целью облегчения встраивания по множественным сайтам клонирования. 3'-Расположенный BamHI-сайт вносили в последовательность CD80 путем расщепления клонирующего вектора ТА. Также прямые праймеры включали бокс Козака и старт-кодон ATG обоих генов. В каждом случае полученные праймеры использовали для амплификации с матрицы, кодирующей полноразмерную последовательность каждого гена, которые были предварительно внесены в состав клонирующего вектора ТА, описанного выше. Приблизительно 10 нг каждой такой плазмиды использовали в ПЦР с Taq-полимеразой (5 минут при 95°С - 1 цикл; 30 секунд при 95°С, 30 секунд при 60°С и 45 секунд при 68°С - 30 циклов; 7 минут при 68°С - 1 цикл). Амплифицированные продукты визуализовали методом электрофореза в агарозном геле и затем лигировали в состав клонирующего вектора ТА (InVitrogen, San Diego, CA) в соответствии с описанным выше. Реакцию лигирования использовали для трансформации компетентных клеток InvαF' и позитивные клоны скринировали и отбирали в соответствии с описанным выше.
Клонирование в плазмиду pSI
Для клонирования в состав вектора pSI, предназначенного для трансформации клеток COS-7, эту плазмиду расщепляли рестриктазой EcoRI и затем этот фермент удаляли с использованием центрифужной колонки Micropure EZ (Amicon, Beverly, MA). После удаления рестриктазы плазмиду обрабатывали смесью фенола и хлороформа с целью удаления остаточного белка и осаждали спиртом. Вставки отщепляли от 50 мкг очищенной реактивами QIAGEN плазмидной ДНК (Qiagen, Chatsworth, CA) тех клонов, которые включали клонирующий вектор ТА с правильными вставками, используя EcoRI-сайты, имеющиеся во фланкирующих вставку последовательностях вектора. 100 мкл отщепленного материала подвергали электрофорезу в 1,5%-ном агарозном геле и отщепленный фрагмент вырезали из геля. Вставку затем очищали из агарозы с использованием гель-распылителя и фильтра Microcon (Amicon, Beverly, MA). Обработку EcoRI-расщепленной плазмиды pSI щелочной фосфатазой использовали для снижения вероятности лигирования данного вектора самого на себя. Путем обработки в течение 1 часа при 37°С 0,1 ед./мкг щелочной фосфатазы кишечника теленка (ЩФКТ) дефосфорилировали расщепленные концы вектора. ЩФКТ удаляли путем тепловой денатурации при 65°С в течение 30 минут с последующей очисткой на центрифужной колонке Micropure EZ (Amicon, Beverly, MA). Вставки лигировали напрямую в разрезанный и дефосфорилированный вектор pSI в течение ночи при 16°С с использованием ДНК-лигазы фага Т4. Молярное отношение лиганда и вектора составляло приблизительно 3:1 при соотношении 0,05 мкг вставки CD28 или CD80 к 0,1 мкг pSI. Затем 1 мкл реакции лигирования использовали для трансформации компетентных клеток InvαF'. Эти клетки высевали полосами на пластины LB, содержащие 50 мкг/мл ампициллина. Пластины инкубировали в течение ночи при 37°С и на следующий день полученные колонии пересевали в 5 мл жидкой среды LB, содержащей 100 мкг/мл ампициллина. После инкубации в течение ночи при 37°С с вращением при 220 об/мин плазмидную ДНК экстрагировали методом щелочного лизиса, ДНК очищали путем экстракции фенолом-хлороформом и осаждали двумя объемами 95%-ного этанола. ДНК обрабатывали РНКазой и затем расщепляли обработкой 10 ед. рестриктазы EcoRI. Продукты расщепления визуализовали в 1%-ном агарозном геле с целью идентификации позитивных клонов. Затем плазмидную ДНК экстрагировали из ночной культуры позитивного клона объемом 5 мл с использованием центрифужных колонок QIAprep (Qiagen, Chatsworth, CA). Затем нуклеотидную последовательность очищенной ДНК определяли методом секвенирования с концевой флуоресцентной меткой с использованием внутреннего 3'-праймера, позволяющего определить ориентацию вставки в данной плазмиде. Расположение этого праймера таково, что секвенирование «пересекает» участок стыковки вектора и вставки, чтобы убедиться в правильности ее ориентации. Затем клон каждого гена в плазмиде с правильной ориентацией выращивали в 100-мл культуре и плазмиду экстрагировали на максипрепаративной колонке QIAGEN (Qiagen, Chatsworth, CA).
Клонирование в SFV
Для встраивания в состав вектора SFV вставки и плазмиду обрабатывали в основном таким же образом. 100 мкг вектора SFV расщепляли 120 ед. рестриктазы BamHI в течение 1 часа при 37°С. Рестриктазу удаляли от расщепленного продукта центрифугированием через фильтр Micropure EZ (Amicon, Beverly, MA). Затем плазмиду обрабатывали ЩФКТ. ЩФКТ инактивировали нагреванием и затем плазмиду вновь очищали на фильтре Micropure EZ. Вставки экстрагировали из ДНК очищенного клонирующего вектора ТА путем обработки рестриктазой BamHI. Вставки очищали и лигировали в состав вектора в соответствии с описанным выше. После трансформации компетентных клеток InvαF' плазмидную вставку и ее ориентацию подтверждали методом секвенирования с концевой флуоресцентной меткой. Крупномасштабную выработку плазмиды проводили на материале позитивного клона каждого из генов.
Экспрессия белка с pSI
Для трансформации эукариотических клеток плазмидой pSI клетки COS-7 были получены из Американской коллекции типовых культур (АТСС). Замороженный блок ресуспендировали в 15 мл среды DMEM, дополненной 10% плодной телячьей сыворотки (ПТС). Культуры затем выращивали монослоем в колбах Т-75. Вечером накануне проведения трансфекции клетки удаляли из колб путем трипсинизации (0,25% в ЭДТА) с промывкой ФСБ. Клетки затем высевали при примерно 20% уровне слияния на 100-мм чашки и оставляли расти до уровня слияния примерно 50% до следующего дня. Для каждой предназначенной для трансфекции чашки 5 мл DMEM-NuSerum (Collaborative Biomedical Products, Bedford, MA) смешивали с 0,2 мл раствора DEAE-декстрана и хлорохина. Затем к этой смеси добавляли 10 мкг/мл очищенной плазмиды pSI. Культуральную среду отсасывали из клеток COS и к этим клеткам добавляли раствор DMEM-NuSerum, DEAE-декстрана, хлорохина и ДНК. Культуру инкубировали в течение 3,5 часов в инкубаторе при 5% углекислоты с последующим удалением культуральной среды и заменой ее на 5 мл 10% ДМСО в ФСБ. Через 2 минуты этот раствор отсасывали и клетки культивировали в течение ночи в 5 мл среды DMEM с 10% ПТС. На следующий день клетки переливали в 100-мм культуральные чашки. Через 3 дня среду отсасывали и трансформированные клетки отбирали с использованием ФСБ с 0,5 мкМ ЭДТА. Смесь ФСБ/ЭДТА добавляли к клеткам, которые затем инкубировали в течение 15 минут при 37°С. Супернатанты отбирали и объединяли с последующими промывками в ФСБ. Супернатанты и промывки затем центрифугировали. Полученный в результате сгусток ресуспендировали в DMEM/ПТС и подсчитывали клетки COS.
Экспрессия белков с SFV
Трансфекцию вектором SFV осуществляли в отношении почечных клеток новорожденных хомячков (ВНК). 30 мкг очищенной плазмиды расщепляли рестриктазой SpeI в течение 1 часа при 37°С. Затем рестриктазу удаляли на фильтре Micropure EZ (Amicon, Beverly, MA) и ДНК осаждали 2,5 объемами 95%-ного этанола. Затем 1,5 мкг плазмиды использовали в качестве матрицы для Sp6-опосредованной транскрипции in vitro. Вкратце, ДНК инкубировали в течение 1 часа при 37°С с: транскрипционным буфером, 100 мМ дитиотреитола, 10 мМ G(5')ppp(5')G, смесью NTP, водой, RNasin и 60 ед. РНК-полимеразы Sp6. После транскрипции реакцию разделяли на аликвоты и образец визуализовали в 1%-ном агарозном геле. 45 мкл транскрипционной реакции использовали для трансфекции клеток ВНК при уровне слияния примерно 80% в колбах Т-75. Культуральную среду GMEM, дополненную 10% ПТС, отсасывали от клеток и заменяли на среду Opti-MEM. Через 2 минуты инкубации эту среду заменяли на среду Opti-MEM, 9 мкг/мл липофектина и транскрибированную РНК. Культуры инкубировали в течение 2 часов при 37°С при 5% СО2 с частым ручным встряхиванием. Через 2 часа культуральную среду удаляли и заменяли на GMEM + 10% ПТС. Культуры инкубировали в течение 7-9 часов и клетки затем отделяли путем обработки трипсином.
Клонирование в вектор pQE
Бактериальный экспрессионный вектор pQE также был сконструирован с включением генов CD80 и CD28 кошки. Расщепленную и обработанную ЩФКТ плазмиду pQE приготавливали и очищали в соответствии с описанным выше и лигировали с использованием ДНК-лигазы Т4 в молярном соотношении «вставка:плазмида=4:1» с 50 нг очищенного в геле CD28 или CD80. Реакцию лигирования инкубировали в течение 16 часов при 16°С. Затем 2 мкл этой реакции использовали для трансформации компетентных клеток INVαF'. Отбирали позитивные колонии и правильность ориентации вставки подтверждали путем прямого секвенирования. Проводили крупномасштабное получение очищенной плазмиды и полученное использовали для трансформации клеток М15 pREP4, которые делали компетентными по трансформации обработкой хлоридом рубидия. Трансформированные клетки культивировали на пластинах LB с содержанием по 50 мкг/мл канамицина и ампициллина с целью обеспечения того, чтобы обе плазмиды - pQE и плазмида-помощник pREP4 - сохранялись в этих колониях. Позитивные колонии затем подвергали скринингу путем минипрепарирования с щелочным лизисом и расщеплением рестриктазой BamHI. Колонии с подтвержденными вставками замораживали в маточном растворе 50% глицерина для дальнейшего использования.
Тест на связывание
Тесты на связывание в отношении трансфицированных клеток, экспрессирующих CD80 кошки и CD28 кошки, проводили в соответствии с протоколом, описанным Linsley et al., 1994a. Через 1 день после трансфекции клетки COS-7, экспрессирующие CD28, отбирали из колб T-75 путем обработки трипсином в ЭДТА. Эти клетки оставляли прикрепляться к лункам 24-луночных планшетов при концентрации 105 клеток на 1 мл. Через 2 дня клетки COS-7, трансфицированные feCD80/pSI, отбирали из колб Т-75 с использованием ФСБ с 0,5 мкМ ЭДТА. Эти клетки затем метили флуоресцентно с использованием раствора 5 мкМ Calcein AM (Molecular Probes, Eugene, OR) в стерильном ФСБ с 1% бычьего сывороточного альбумина (БСА) в течение 30 минут при 37°С (Akeson & Woods, 1993). Трансфицированные «пустышкой» клетки COS-7 помечали таким же образом. Помеченные клетки затем трижды промывали средой DMEM, содержащей 10% ПТС, с целью удаления неприсоединившейся метки, подсчитывали их и добавляли непосредственно к монослою. Эти две клеточные популяции оставляли взаимодействовать друг с другом в течение 1 часа при 37°С. Прикрепившиеся клетки отбирали путем аккуратной трехкратной промывки монослоя средой DMEM с добавлением 10% ПТС. После промывки уровень флуоресценции каждой лунки определяли количественно с помощью планшетного микрофлуориметра. Уровень флуоресценции лунок, содержащих трансфицированные клеточные популяции, сравнивали с лунками, в которых клетки, экспрессирующие CD80, были добавлены к клеткам COS-7, трансфицированным только плазмидой pSI.
Тесты на конкурентное связывание с использованием химерных белков CTLA-4/Ig и CD80/Ig (любезно предоставленных P.Linsley, Bristol-Meyers Squibb) для подавления межклеточных взаимодействий выстраивали таким образом, чтобы продемонстрировать специфичность такого взаимодействия. После мечения кальцеином, но перед добавлением к монослою клеток, экспрессирующих CD80, химеру CTLA-4/Ig в среде DMEM/ПТС в концентрации 1 мкг/мл инкубировали с помеченными трансфицированными клетками в течение 30 минут. Клетки дважды промывали в DMEM/ПТС и добавляли к монослою. С другой стороны, клетки монослоя, экспрессирующие CD28, инкубировали в течение 30 минут с химерой CD80/Ig в концентрации 1 мкг/мл в среде DMEM/ПТС и затем промывали, после чего добавляли флуоресцентно помеченные клетки, экспрессирующие CD80. Подавление связывания химерными белками оценивали путем сравнения уровней флуоресценции в данных лунках с параметрами связывания в лунках, не содержащих конкурентных факторов.
ПЦР с ревертированием
Также трансфицированные клетки COS оценивали по транскрипции мРНК методом ПЦР с ревертированием. Через 3 дня РНК экстрагировали из клеток, трансфицированных плазмидой, несущей вставку feCD28, feCD80 или лишенную вставки. РНК обрабатывали ДНКазой, свободной от РНКазы, с целью удаления возможных загрязняющих ДНК. Затем 0,5 мкг РНК подвергали обратной транскрипции с получением кДНК с использованием праймера олиго-dT и обратной транскриптазы вируса MuMLV. Каждый образец кДНК затем амплифицировали с использованием наборов праймеров, специфичных для CD28, CD80 и G3РDH в следующих циклах: 5 минут при 95°С - 1 цикл; 30 секунд при 95°С, 30 секунд при 55°С, 30 секунд при 72°С - 30 циклов; 5 минут при 72°С - 1 цикл. Затем по 20 мкл каждой реакции визуализовали в 1%-ном агарозном геле.
Результаты
Гены кошачьих CD28 и CD80 были успешно встроены в состав «трехбелковых» экспрессирующих векторов (pSI, SFV и pQE). После лигирования в соответствующие векторы эти гены использовали для трансформации компетентных клеток INVαF'.
Тесты на связывание проводили для того, чтобы показать возможность экспрессии функционального белка. Исходные тесты осуществляли с целью определения отношений между связыванием клеток COS-7, трансфицированных CD28 и CD80, и клетками COS-7, трансфицированными CD28 и «пустышками». Уровень флуоресценции в лунках, в которые были добавлены флуоресцентно помеченные неслившиеся трансфицированные CD80 клетки, оказался выше по сравнению с контрольными лунками по двум исходным разведениям. Данное взаимодействие зависело от дозы и после двух исходных разведений уровни флуоресценции в лунках, в которых слившиеся клетки экспрессируют поверхностный белок, сохранялись такими же, как и в контролях, трансфицированных «пустышками».
Для того чтобы показать возможность подавления такого взаимодействия, линии трансфицированных клеток перед смешиванием инкубировали с растворимыми (немембранными) рецепторами. При концентрациях 5×105 и 1×105 клеток флуоресценция лунок, содержащих клетки COS, экспрессирующие CD28 и CD80, оказывается сходной с тем, что наблюдалось в предыдущем эксперименте. В лунках, в которых слившиеся клетки перед смешиванием проинкубировали с контр-рецептором CD80/Ig, сохранение флуоресценции было сравнимо с тем, которое обнаруживается в лунках с контрольными (трансфицированными «пустышками») клетками. Однако, когда клетки COS, трансфицированные pSI c CD80, инкубировали с растворимым CTLA-4 перед их взаимодействием с клетками, трансфицированными pSI c CD28, флуоресценция полностью не подавлялась. Хотя эти уровни оказались не столь существенными, как те, которые выявлялись в неингибированной группе, тем не менее они были отчетливо больше, чем и в контроле, и в другой экспериментальной группе.
ПЦР с ревертированием проводили на материале РНК, производной от клеток COS-7, трансформированных конструкциями pSI-CD28, pSI-CD80 и «пустышками», с целью выявления присутствия мРНК, специфичной для каждого гена в этой клеточной линии. Ген глицеральдегид-3-фосфат-дегидрогеназы (G3PDH) амплифицировали в каждой группе, чтобы показать целостность РНК и в качестве позитивного контроля в группе «пустой» трансформации. Клетки COS-7, трансфицированные pSI-CD80, экспрессировали мРНК CD80 и мРНК G3PDH, в то время как клетки COS-7, трансфицированные pSI-CD28, экспрессировали гены CD28 и G3PDH. Клетки, трансфицированные «пустышками», экспрессировали только G3PDH.
Обсуждение
Отсутствие подходящих антител объясняет то, что для выявления экспрессии пептида не может быть проведен прямой тест. Доступные на коммерческой основе антитела, специфичные в отношении CD28 и CD80 человека, были протестированы на материале изолированных лимфоцитов с целью установления их возможной перекрестной реактивности. Анализ клеток методом FACS с указанными антителами с использованием ПЦР для выявления экспрессии мРНК для обоих поверхностных белков, оказался безуспешным. Это, в сочетании с данными о том, что эти антитела не распознают поверхностную экспрессию в клетках, трансфицированных конструкциями pSI, позволило сделать вывод о том, что данные антитела перекрестной (гетерологичной) реактивностью не обладают. Но перекрестная активность антител к CD80 и не ожидалась. Ограниченная гомология CD80 человека и кошки должна ограничивать и потенциал по перекрестной активности моноклональных антител, специфичных для них. Однако было весьма удивительно, что и антитела, специфичные в отношении CD28 человека, также не были перекрестно реактивными. Хотя в этом случае уровень консерватизма между клонированными молекулами CD28 более существен, доступные на коммерческой основе антитела к CD28 человека, которые бы перекрестно реагировали с таким же белком мыши, найдены не были. Как и в случае с антителом к CD80 человека, тестирование моноклональных антител к CD28 человека оказалось безрезультатным. Следовательно, необходимо было разработать тест, который бы позволил продемонстрировать не только вероятность экспрессии данных белков, но также показал их функциональность и способность к взаимодействию.
кДНК CD80 и CD28 кошки были успешно встроены в группу экспрессирующих векторов. В то время как вектор pSI удовлетворял всем требованиям, необходимым для осуществления теста на связывание, дополнительные векторы могли облегчить будущую экспрессию этих белков.
После трансфекции экспрессия мРНК CD28 и CD80 линиями трансформированных клеток COS-7 была подтверждена с применением метода ПЦР с ревертированием. Обработка РНК ДНКазой перед ПЦР резко снижала вероятность загрязнения геномной или плазмидной ДНК. Кроме того, не предполагалось, что клетки COS-7 будут исходно экспрессировать любой из лигандов, что было затем подтверждено по отсутствию мРНК для любого из этих поверхностных белков в контроле, трансфицированном «пустыми» векторами. Амплификация точной мРНК на материале РНК, выделенной из трансфицированных клеток, по-видимому, отражает то, что в клетках роль матрицы выполняет вектор pSI и что мРНК, кодируемая этой плазмидой, действительно транскрибируется.
Проведенные тесты на связывание моделировали в соответствии с теми тестами, которые были осуществлены P.Linsley, продемонстрировавшим сходные параметры активности по связыванию для CD80 и CD28 человека (Linsley et al., 1994a). Модифицированный формат теста использовали для того, чтобы показать, что поверхностно экспрессированный CD28 кошки связывается с поверхностно экспрессированным CD80 кошки и что это взаимодействие может быть подавлено растворимым рецептором. Уровень связывания может быть определен по сохранению флуоресцентно помеченных клеток в конкретных лунках. Благодаря использованию автоматического флуоресцентного планшетного сканера не было необходимости в лизировании клеток перед измерением уровня флуоресценции.
В начальном тесте установили, что сохранение флуоресцентно помеченных клеток COS, трансфицированных CD80-pSI, было более интенсивным в лунках со слившимися клетками, которые трансфицировали CD28-pSI, по сравнению с лунками, содержащими слившиеся клетки, подвергнутые «пустой» трансформации. Контрольные клетки, т.е. клетки COS, трансформированные «пустышкой», т.е. вектором pSI, в котором не было вставки, подтвердили, что ни присутствие вектора (т.е. процесс трансфекции per se), ни адгезионные свойства клеток не обусловливают адгезии (слияния) клеток, опосредуемой взаимодействием между поверхностно-экспрессированными CD80 и CD28. При исходном разведении в 1 млн клеток уровень флуоресценции в лунках, в которых клетки экспрессировали CD28, был приблизительно в 5 раз выше по сравнению с лунками, в которые к клеткам, трансфицированным «пустышками», вносили флуоресцентно помеченные клетки, трансфицированные CD80. При концентрации 5×105 клеток уровень флуоресценции резко снижался из-за снижения числа клеток, однако этот уровень все же был достоверно выше флуоресценции в контроле. При концентрации 1×105 клеток различие между экспериментом и контролем статистически недостоверно, а при 1×104 клеток эти уровни практически идентичны. Данный тест показывает, что взаимодействие происходит между клетками COS, трансфицированными CD80, и клетками COS, трансфицированными CD28, что приводит к сохранению в данной лунке флуоресцентно помеченных клеток, трансфицированных CD80. Однако, когда слившиеся клетки не экспрессируют поверхностно-клеточные белки, клетки, трансфицированные CD80, удаляются при тщательной промывке. Этот эффект может быть титрован, и при концентрации в 1×104 клеток уровень флуоресценции в лунках виртуально одинаков. Для подтверждения того, что взаимодействие имело место, растворимые рецепторы были внесены с целью подавления взаимодействия CD28/CD80.
Во втором тесте использовали включение растворимых форм соответствующих рецепторов для каждого из пептидов с целью подавления взаимодействия между адгезионными партнерами. Растворимые рецепторы для CD80 - huCTLA-4Ig, и для CD28 - huCD80-Ig, инкубировали с соответствующими трансфицированными клетками COS, экспрессирующими рецептор, соответствующий каждой из данных молекул, с последующим смешиванием клеток двух типов. Хотя растворимые белки происходили не от кошки, предположили, что благодаря определенному уровню консерватизма, обнаруживаемого между предполагаемыми сайтами связывания в молекулах человека и кошки, этого будет достаточно для достижения перекрестной реактивности. Более того, известно, что лиганды человека связываются с соответствующими рецепторами мыши (P.Linsley, уст. сообщ.). Исходя из количества клеток, необходимого для проведения данного теста, оказалось невозможно провести тест с 1×106 клеток. Исходная концентрация составила 5×105 клеток, при том, что сами по себе клетки, трансфицированные CD28/CD80, характеризовались средним уровнем флуоресценции, сходным с тем уровнем, который был определен в предыдущем эксперименте. Неясно, почему слившиеся клетки, проинкубированные с растворимым рецептором CD80, дают флуоресцентный сигнал, близкий к таковому у контроля с «пустой» трансфекцией, в то время как неслившиеся флуоресцентно помеченные клетки, трансфицированные CD80, проинкубированные со растворимым CTLA-4, проявляют в 2-3 раза более высокий уровень флуоресценции. Несмотря на различия, обусловленные типом растворимого рецептора, имелось отчетливое снижение уровня флуоресценции в лунках, в которых рецепторы отсутствовали. Данное взаимодействие, выявленное в предыдущем тесте, может быть подавлено внесением соответствующего растворимого рецептора перед смешиванием клеток.
Хотя моноклональные антитела, специфичные в отношении поверхностно-клеточных белков, в принципе выглядят предпочтительнее для тестов подобного типа, в отсутствие нужных реагентов описанный тест представляется эффективным подходом, в котором может быть продемонстрирована экспрессия функционального контр-рецептора. Данные исходного теста на связывание в сочетании с данными конкурентного теста подтверждают, что были выделены кДНК функциональных CD80 и CD28 кошки, а также то, что экспрессируемые в виде мРНК белки эффективно взаимодействуют. Хотя применимость подобного теста на связывание ограничена, он остается эффективной системой для установления вероятности функциональной поверхностной экспрессии и взаимодействия.
Пример 8
Инфекция
Введение
По определению Львова вирусы являются «строго внутриклеточными и потенциально патогенными элементами с инфекционной фазой, (1) проявляющими только один тип нуклеиновой кислоты, (2) размножающимися в форме своего генетического материала, (3) неспособными расти и проходить стадии деления, и (4) лишенными системы Липпмана» (Lwoff, 1957). Природные вирусы являются бесклеточными организмами, геном которых в форме РНК или ДНК контролирует синтез последующих вирусных частиц в процессе инфицирования клетки-хозяина (Luria & Darnell, 1968). Вирусные заболевания представляют интересную систему, в которой может быть продемонстрировано практическое применение сигнального комплекса B7/CD28. Заражение являющимися ретровирусами ВИЧ у человека и FIV (вирус иммунодефицита кошачьих) у кошек обусловливает нарушение нормального функционирования иммунной системы, что предположительно обусловлено элиминацией Т-клеток CD4+ (Fauci et al., 1984; Pedersen et al., 1987). Считается, что сигнальный комплекс CD28/CD80 играет важную роль в данном заболевании и что путем манипулирования экспрессией рецепторов можно обострить инфекцию (Harlan et al., 1995).
FIV является весьма актуальной клинической проблемой для домашних кошек, так как обусловливает ряд клинических и субклинических симптомов, которые очень сходны с ВИЧ-инфекцией человека (Pedersen et al., 1987). По мере накопления информации о FIV соответствие вызываемого им заболевания животной модели СПИДа человека становится все более очевидным, т.е. она является не связанной с приматами моделью, которая наиболее точно имитирует развитие данного заболевания у человека (Siebelink, 1990). Молекулярное, биологическое и патологическое сходство также подтверждает то, что большая часть информации, получаемой при исследованиях ВИЧ, может способствовать лучшему пониманию FIV-инфекции у кошек.
Вначале ВИЧ-инфекция проявляется в непостоянной лимфопении с развитием мононуклеозо-подобного синдрома практически одновременно с сероконверсией (Clark et al., 1991). Происходит кратковременное снижение числа Т-клеток CD4+ и экспансия Т-клеток CD8+, что приводит к снижению отношения CD4:CD8, а в следующей бессимптомной фазе заболевания может происходить дальнейшее снижение данного соотношения (Cooper et al., 1984). При появлении связанных со СПИДом симптомов, популяция Т-клеток CD4+ резко обедняется, а по мере развития заболевания и перехода его в заключительную стадию резко снижается и общее количество лимфоцитов (Fauci et al., 1984). При том, что исходная лимфопения, по-видимому, обусловливается сдвигами в популяциях клеток иммунной системы, индуцируемыми кортикостероидами, что наблюдается и при других вирусных инфекциях, дальнейшие потеря Т-клеток CD4+ и экспансия Т-клеток CD8+, как считается, связаны с размножением вируса и патогенетическими процессами (Fauci & Dale, 1975; Fauci et al., 1984). Формирование информативных модельных систем является ключевым этапом в дальнейшем понимании механизмов инфекции и вызываемого вирусами заболевания.
FIV, являющийся Т-лимфотропным ретровирусом, впервые был описан в популяции домашних кошек в Калифорнии, в которой имели место многократные, часто встречающиеся хронические инфекции (Pedersen et al., 1987). Хотя данное заболевание само по себе манифестирует сходным с ВИЧ-инфекцией человека образом и таксономически вирусы относительно близки, по антигенным свойствам FIV отличается от возбудителя СПИДа человека (Siebelink et al., 1990). Передача патогена происходит при обмене жидкостями организма, как и ВИЧ, но, в отличие от ВИЧ, для которого преобладающей является передача половым путем, предполагается, что FIV в большинстве случаев передается через слюну при укусах (Yamamoto et al., 1989). Несмотря на различные пути передачи, итоговый синдром иммунодефицита является одной из лучших моделей родственного заболевания человека (Siebelink et al., 1990).
Клиническое развитие FIV сходно с ВИЧ-инфекцией: в частности, заболевание разделяют на пять клинических фаз. Начальная фаза характеризуется лихорадкой, недомоганием и лимфаденопатией, затем после заражения наступает долгая бессимптомная фаза, переходящая в три заключительные фазы, при которых наблюдаются потеря веса и возникают множественные вторичные и условно-патогенные инфекции (English et al., 1994). Хотя неясно, является ли механизм клеточной инфекции таким же, FIV оказывается трофическим и для CD4-позитивных, и для CD8-позитивных Т-клеток (Brown et al., 1991). У инфицированных этим вирусом животных наблюдается снижение активности Т-клеток CD4+, по-видимому, в результате образования ими синцитиев и их лизиса (Siebelink et al., 1990). Наступление заключительной фазы инфекции совпадает с существенной потерей Т-клеток CD4+ и снижением отношения CD4:CD8 (Nоvotney et al., 1990). Хотя заболевания, вызываемые вирусами FIV и ВИЧ, могут опосредоваться разными механизмами снижения числа Т-клеток CD4+, итоговый фенотип и характер повреждений иммунной системы, очевидно, проявляются весьма сходным образом.
Хотя понятно, что инфицирование Т-клеток CD4+ вирусом ВИЧ негативно сказывается на развитии нормального иммунного ответа, точный механизм, приводящий к иммунодефициту, окончательно не определен. На поздних фазах инфекции процессы, приводящие к снижению числа Т-клеток CD4+, не установлены (Connоr et al., 1993). Хотя при ВИЧ-инфекции было продемонстрировано формирование синцитиев, индукция апоптоза и элиминация с участием CTL, как факторы подавления популяции Т-клеток (Schattner & Laurence, 1994; Fouchier et al., 1996), также предполагалось наличие механизма, связанного с CD28 (Haffar et al., 1995). Как было показано, в линиях инфицированных Т-клеток под влиянием стимуляции аллоантигеном снижена экспрессия CD28 как на трансляционном, так и на транскрипционном уровнях (Haffar et al., 1995). Как обсуждалось выше, перекрестное связывание на рецепторе CD28 является ключевым сигналом для развития Т-клеточного ответа (Linsley et al., 1991a). Если ВИЧ-инфекция обусловливает подавление поверхностной экспрессии CD28, то инфицированные Т-клетки, распознающие присутствующий антиген, более вероятно вступают в апоптоз, нежели полностью активируются (Schattner & Laurence, 1994). Хотя апоптоз и является нормальным механизмом гибели ВИЧ-инфицированных клеток, данный механизм может обеспечивать дополнительный вклад в происходящую в этом случае элиминацию Т-клеток (Brinchmann et al., 1994).
Было указано на связь CD8-позитивных CTL с развитием долговременной жизнеспособности при ВИЧ-инфекции, при том, что высокий уровень лимфоцитов CTL ассоциирован с длительным подавлением СПИДа у инфицированных лиц (Landay et al., 1994). Напротив, гуморальный иммунитет не только оказывается в целом неэффективен в контроле вызванных лентивирусами заболеваний, но, как было показано, антитела могут в действительности даже усиливать заболевание (Lombardi et al., 1994; Siebelink et al., 1995). Наступление заключительной клинической фазы ВИЧ-инфекции и сопровождающего его иммунодефицита у большинства больных коррелирует с переключением клеточного иммунного ответа (1-й тип) на гуморальный ответ (2-й тип) (Schattner & Laurence, 1994). Это согласуется с наблюдениями, согласно которым переход из здорового состояния в СПИД связан со снижением противовирусной активности, обеспечиваемой CTL CD8+ (Lewis et al., 1994). Экспрессия CD28 на поверхности CTL CD8+ также рассматривается как связанная с их противовирусной активностью, при том, что мощная CTL-опосредованная противовирусная активность ассоциирована с экспрессией CD28 CD8-позитивной популяцией лимфоцитов у инфицированного больного (Landay et al., 1993).
Поверхностная экспрессия CD28, хотя для нее и предполагалась функция медиатора резистентности к ВИЧ, подвергается негативному влиянию в присутствии ВИЧ как в инфицированных, так и неинфицированных Т-клетках (Caruso et al., 1994). Начиная с бессимптомных фаз ВИЧ-инфекции, происходит снижение доли Т-клеток CD4+ и CD8+, несущих CD28 (Lewis et al., 1994). Предполагается, что это может быть причиной нарушений секреции цитокинов, обнаруживаемых в ранних фазах инфекции (Caruso et al., 1994), равно как и измененных ответов с участием CD8-позитивных Т-клеток в поздних фазах (Zanussi et al., 1996). У ВИЧ-инфицированных больных снижение пролиферации Т-клеток CD8+ в ранней фазе заболевания, как предполагается, связано с негативной регуляцией CD28, поскольку только экспрессирующие CD28 Т-клетки CD8+ пролиферируют в ответ на IL-2 (Brinchmann et al., 1994). К сожалению, у инфицированных больных Т-клетки CD28-/ CD8+ могут составлять до 75% CD8-позитивной популяции, в то время как у здоровых индивидуумов они составляют лишь 25% этой популяции (Saukkonen et al., 1993). Таким образом, хотя популяция клеток CD8+ может оставаться нормальной у инфицированных лиц, эффективность этой популяции по ее способности развивать действенный противовирусный иммунный ответ может быть нарушена даже на начальной фазе заболевания (Caruso et al., 1994).
Также проведенные исследования показали, что передача сигнала от CD28 может быть вовлечена в активность самого вируса (Asjo et al., 1993; Smithgall et al., 1995). Костимуляция ВИЧ-инфицированных Т-клеток CD4+ периферической крови с участием анти-CD3 и анти-CD28 обусловливает интенсификацию размножения вирусов по сравнению со стимуляцией только анти-CD3 (Smithgall et al., 1995). Такой эффект может быть преодолен путем внесения CTLA-4 Ig, как растворимой формы рецептора, специфичного для CD80, а в меньшей степени - внесением анти-IL2 (Smithgall et al., 1995). В другом исследовании инфицированных Т-клеток CD4+ у 40% больных было установлено, что связывание только CD28 обусловливает позитивную регуляцию размножения вируса при отсутствии необходимости в каких-либо дополнительных стимулах (Asjo et al., 1993).
Предобработка популяций лимфоцитов поверхностным гликопротеином ВИЧ - gp120 - обусловливает негативную регуляцию CD80 на поверхности антиген-презентирующих клеток (Chirmule, 1995). Хотя экспрессия CD28 на Т-клетках снижается при ВИЧ-инфекции, на этих же клетках экспрессия CD80 интенсифицируется (Haffar et al., 1993). Это является предполагаемым механизмом, по которому инфекция может передаваться неинфицированным Т-клеткам, так как взаимодействие между CD28 на поверхности неинфицированных Т-клеток с CD80 на инфицированных Т-клетках может способствовать межклеточному контакту, обеспечивающему перенос вируса (Haffar et al., 1993).
В то время как роль CD28 в ВИЧ-инфекции была исследована, установить значение этого поверхностного белка для FIV пока не удалось. Если на кошках могут быть получены результаты, сходные с теми, которые были выявлены у человека, то это послужит дополнительным подтверждением применимости кошек в качестве модели ретровирусной инфекции.
Материалы и методы
Инфицирование in vivo
Трех взрослых свободных от конкретного патогена кошек инфицировали внутривенно 1×105 TCID50 вируса FIV штамма Maryland. Две похожие кошки являлись контролем, которым инъецировали не содержащую вируса сыворотку. Пробы крови брали непосредственно перед заражением и затем еженедельно в течение 7 недель. В первую неделю после заражения кошек осматривали дважды в день для того, чтобы убедиться в отсутствие исходной реакции на заражение. После развития заболевания животных контролировали ежедневно. В ходе острой клинической фазы заболевания еженедельно по 5-10 мл крови отбирали для СВС (клинический анализ крови) и выделения РВМС. СВС включал подсчет типов клеток на быстрых окрашенных мазках крови (Jorgensen Lab., Loveland, CO).
Клетки РВМС выделяли из крови путем ее сепарирования в градиенте Histopaque (Sigma, St. Louis, MO). После исходной промывки раствором Олсивера примерно 5×105 клеток отбирали и разделяли между 5 лунками 48-лучного планшета. Клетки ресуспендировали в 500 мкл полной среды RPMI и затем помечали с использованием антител, специфичных в отношении либо CD4, либо CD8. Через 1 час инкубации при комнатной температуре при аккуратном качании клетки дважды промывали ФСБ. После промывки добавляли второе антитело - козий антимышиный IgG (H+L), помеченный FITC (KP&L, Gaithersburg, MD) - в концентрации 1:500 и инкубировали при комнатной температуре в течение 1 часа при аккуратном качании. Затем клетки трижды промывали ФСБ и фиксировали 3,7%-ным формалином. Флуоресцентно помеченные популяции затем подвергали количественному анализу на проточном цитофотометре FACSCalibur.
Оставшиеся РВМС промывали дополнительно 10 мл раствора Олсивера. После центрифугирования супернатант удаляли и для проведения экстракции РНК добавляли 1 мл ULTRASPEC (Biotexc, Houston, TX). РНК очищали и преципитировали в соответствии с описанным выше. Затем спектрометрически определяли концентрацию по уровню поглощения при 260 нм. Затем РНК ресуспендировали в 50 мкл DEPC-обработанной воды и замораживали до -70°С для последующего использования.
Полуколичественная ПЦР с ревертированием
Перед проведением ПЦР-амплификации образца РНК 60 мл крови отбирали у умерщвленного животного. РВМС выделяли в соответствии с описанным выше. Клетки подсчитывали в гемоцитометре и разделяли между 4 колбами в концентрации 5×105 клеток на 1 мл. Клетки стимулировали конканавалином-А в течение 0, 8, 16 и 24 часов с последующим центрифугированием и экстракцией РНК из клеточного сгустка с использованием ULTRASPEC в соответствии с описанным выше. ПЦР с ревертированием проводили на материале 1,5 мкг РНК, транскрибируемой в кДНК с использованием обратной транскриптазы MMLV и обратного праймера олиго-dT. Смесь РНК, праймера олиго-dT и DEPC-обработанной дистиллированной воды инкубировали в течение 5 минут при 70°С с целью разрушения вторичной структуры РНК и обеспечения отжига праймера. Затем добавляли транскрипционный буфер, MgCl2, dNTP и DTT и полученную смесь инкубировали при 42°С в течение 2 минут. Затем добавляли 1 мкл обратной транскриптазы и реакцию оставляли на полчаса. Затем по 4 мкл из 25 мкл обратно-транскриптазной реакции добавляли в каждую из 3 пробирок для амплификации CD80 и трех пробирок для амплификации CD28. Затем к кДНК добавляли смесь ПЦР-буфера 10×, dNTP и праймеры, специфичные для CD28 или CD80. Праймеры для CD80 были такими:
прямой праймер B7-S220: CAT GTC TGG CAA AGT ACA AG (SEQ ID NO: 74),
обратный праймер B7-284: TTA TAC TAG GGA CAG GGA AG (SEQ ID NO: 75),
в то время как праймеры для CD28 были такими:
прямой CD28-start: CGC GGA TCC ACC GGT AGC ACA ATG ATC CTC AGG (SEQ ID NO: 13),
обратный CD28-239: ATT TTG CAG AAG TAA ATA TCC (SEQ ID NO: 73).
Затем по три пробирки для каждого из продуктов инкубировали при 95°С в течение 5 минут и затем в каждую пробирку добавляли по 0,25 мкл Taq-полимеразы в 10 мкл воды. Реакции включали в такой температурный цикл: 95°С - 30 секунд, 55°С - 30 секунд, 72°С - 30 секунд. По одной пробирке изымали по прошествии 20, 25 и 30 циклов соответственно. По 20 мкл каждой реакции визуализовали в 1%-ном агарозном геле. Гели фотографировали и определяли число циклов, при котором появлялся искомый продукт. После этих предварительных экспериментов РНК, ранее экстрагированную из крови больных и здоровых животных, амплифицировали в сходном протоколе.
Инфицирование in vitro
Линии Т-клеток, инфицированные FIV in vitro, стимулировали Кон-А в течение 16 часов или не стимулировали вовсе, после чего экспрессию CD28 и CD80 оценивали методом полуколичественной ПЦР с ревертированием. Клеточная линия FETJ представляла собой смешанную популяцию Т-лимфоцитов и росла в отсутствие IL-2 в культуральной среде. Независимые субпопуляции этих клеток были подвергнуты инфицированию вирусом FIV штаммов Maryland и Petaluma. Примерно по 2×108 нормальных, Petaluma-инфицированных и Maryland-инфицированных клеток FETJ стимулировали в течение 16 часов Кон-А (8 мкг/мл) или не стимулировали вовсе. РНК экстрагировали из этих клеток после инкубации с реагентом ULTRASPEC (Biotexc, Houston, TX) и очищали в соответствии с описанным ранее.
МСН-5.4 - линия Т-клеток, производных от кошки из колонии, характеризовавшейся множественными FIV-инфекциями, хотя эта линия и не была хронически инфицирована. Приблизительно 2×108 клеток МСН-5.4 пеллетировали центрифугированием и ресуспендировали в 5 мл концентрированном по FIV супернатанте. Клетки при этой концентрации инкубировали в течение получаса в инкубаторе с 5% СО2 при 37°С с последующим доведением концентрации до примерно 5×105 и культивированием в течение 24 часов. После этого нормальные и инфицированные клетки МСН-5.4 стимулировали Кон-А (8 мкг/мл) в течение 16 часов или не стимулировали вовсе. РНК экстрагировали с использованием реагента ULTRASPEC (Biotexc, Houston, TX) и очищали в соответствии с описанным выше.
Нозерн-блоттинг
Для анализа методом Нозерн-блоттинга концентрацию РНК определяли спектрофотометрически при 260 нм. По 15 мкг каждого образца РНК концентрировали до 3 мкг/мкл и ресуспендировали в 3 объемах загрузочного буфера. Затем образцы нагревали до 70°С в течение 15 минут с целью денатурации РНК и разрушения ее вторичной структуры. Образцы в объеме 20 мкл загружали в 1%-ный денатурирующий агарозный гель и подвергали электрофорезу при напряжении 70 В в течение 2,5 часов до того момента, как край окрашивания бромфеноловым синим достигнет отметки 2 см над нижней кромкой геля. Затем РНК переносили из геля на нейлоновую мембрану Genescreen (Dupont NEN, Boston, MA) за счет капиллярного эффекта (блоттинг). РНК прикрепляли к мембране путем обработки низкоинтенсивным ультрафиолетом в течение 3 минут и затем дорожки визуализовали по четкости рибосомных бэндов методом УФ-экранирования.
Зонд, специфичный для CD28 кошки, был сконструирован с использованием мечения кДНК случайными праймерами. Полноразмерную молекулу CD28 вырезали из клонирующего вектора ТА по фланкирующим EcoRI-сайтам. Полученный фрагмент очищали методом гель-электрофореза и экстрагировали из агарозы с помощью гель-распылителя Amicon (Amicon, Beverly, MA). Затем 25 нг очищенного продукта инкубировали вместе со случайными декануклеотидами в течение 5 минут при 95°С с целью разрушения вторичных структур (Ambion, Austin, TX). Затем реакцию мгновенно замораживали на жидком азоте и к смеси добавляли dNTP (без dATP) и меченный нуклеотид 32P-αdATP. После инкубации в течение 1 минут при 37°С добавляли 1 мкл фрагмента Кленова и полученную смесь инкубировали в течение 30 минут. Реакцию останавливали добавлением 1 мкл 0,5 М ЭДТА и после этого очищали на вращающейся колонке Сефадекс G-50 (Sigma, St. Louis, MO) с целью удаления невключившегося радиоактивно помеченного нуклеотида. 1 мкл реакции разбавляли в 1 мл сцинтилляционной жидкости и активность зонда определяли с помощью счетчика сцинтилляций. Блоты прегибридизовали в течение 15 минут при 65°С в 5 мл реактива Rapid Hyb (Amersham Life Science, Cleveland, OH). По 5 мкл зонда в концентрации 3-5 млн имп/мин на 1 мкл добавляли к каждому блоту и инкубировали при вращении в течение 1,5 часов при 65°С. Затем зонд удаляли и блоты дважды промывали в 1% SSC + 0,1% SDS при комнатной температуре в течение 15 минут. Затем блоты сканировали с помощью счетчика Гейгера и при необходимости вновь промывали при 65°С. Результаты мечения оценивали количественно с помощью сканера Betagen. Проводили окончательную промывку при 65°С в течение 15 минут и блоты помещали на пленку на 16-24 часа при -70°С с использованием интенсифицирующего экрана. Авторадиограммы проявляли и количественно оценивали денситометрически. Для подтверждения целостности РНК и ее концентрации использовали специфичный для G3PDH зонд (любезно предоставленный проф. J.Piedrahita, Texas A&M University), который метили и гибридизовали аналогичным способом.
Полуколичественная ПЦР с ревертированием на материале in vitro инфицированных клеток
Далее для анализа присутствия CD28 применяли полуколичественную ПЦР. Как было описано выше, концентрацию экстрагированной РНК оценивали путем спектрофотометрического считывания при 260 нм. По 2 мкг (при конечном объеме 25 мкл) транскрибировали в кДНК с использованием праймера олиго-dT и обратной транскриптазы MMLV в соответствии с описанным выше. Затем 3,5 мкл обратно-транскриптазной реакции переносили в 7 пробирок для ПЦР. Три пробирки амплифицировали с использованием праймеров, специфичных для CD80, три пробирки - с использованием праймеров, специфичных для CD28, а оставшуюся пробирку - с праймерами, специфичными в отношении G3PDH:
прямой G3PDH: CCT TCA TTG ACC TCA ACT ACA T (SEQ ID NO: 76),
обратный G3PDH: CCA AAG TTG TCA TGG ATG ACC (SEQ ID NO: 77).
Как описывалось выше, пробирки изымали из реакции через 20, 25 и 30 циклов. По 20 мкл каждого образца визуализовали в 1%-ном агарозном геле. Кроме того, сходным образом на материале клеток линий FETJ и МСН-5.4 тестировали присутствие некоторых других Т-клеточных цитокинов. Специфичные для них праймеры были такими:
прямой IL-2: CAA CCC CAA ACT CTC CAG GAT G (SEQ ID NO: 78),
обратный IL-2: GGT CAG CGT TGA GAA GAT GCT TTG (SEQ ID NO: 79),
прямой IL-4: TAT TAA TGG GTC TCA CCT ACC (SEQ ID NO: 80),
обратный IL-4: TTG GCT TCA TTC ACA GAA CAG (SEQ ID NO: 81),
прямой INFγ: GGG TCG CTT TTC GTA GAC ATT TTG (SEQ ID NO: 82),
обратный INFγ: CAG GCA GGA CAA CCA TTA TTT C (SEQ ID NO: 83),
и их использовали для амплификации кДНК, транскрибированной на материале 1,25 мкг РНК. Для каждого цитокина амплифицировали по 20% транскрипционной реакции. Оставшуюся кДНК амплифицировали с использованием праймеров для G3PDH. кДНК амплифицировали на протяжении 30 циклов в следующем режиме: 5 минут при 95°С - 1 цикл; 30 секунд при 95°С, 30 секунд при 55°С, 30 секунд при 72°С - 30 циклов; 5 минут при 72°С - 1 цикл. Затем 20 мкл реакции визуализовали в 1%-ном агарозном геле.
Определение инфекции методом ПЦР с ревертированием
Инфицированность клеток FETJ и МСН-5.4 была подтверждена путем амплификации в ОТ-ПЦР последовательности вирусного гена gag. РНК в количестве 1,25 мкг транскрибировали в кДНК в соответствии с описанными выше параметрами с использованием обратной транскриптазы MMLV и обратного праймера, специфичного для gag. 10 мкл обратно-транскриптазной реакции амплифицировали методом ПЦР с «горячим стартом» в следующем режиме: 5 минут при 95°С; 30 секунд при 95°С, 30 секунд при 55°С, 30 секунд при 72°С - 30 циклов; 5 минут при 72°С. После амплификации 20 мкл каждого образца визуализовали в 1%-ном агарозном геле.
Результаты
Для того чтобы определить влияние острой инфекции in vivo на экспрессию CD28, кошки AUO4, AUU3 и OАС2 были заражены вирусом путем внутривенной инъекции, в то время как кошкам AWG3 и OАЕ6 инъецировали «пустую» среду. Анализ методом FACS показал наличие некоторой дифференцировки отношения CD4:CD8 у экспериментальных и контрольных животных. В то время как в контроле в целом соблюдалось постоянное отношение на уровне 2:1, в экспериментальной группе имелись определенные колебания этого отношения, у одного животного снизившегося до 1:1 (табл.4).
Отношение лимфоцитов СР4:СР8 среди РВМС у перенесших острую инфекцию и неинфицированных кошек
Анализ экспрессии РНК CD80 и CD28 во времени проводили для того, чтобы показать, что мРНК каждого белка присутствует и может быть амплифицирована методом ПЦР через 0, 8, 16 и 24 часа после стимуляции Кон-А. Данная процедура полуколичественной ПЦР была рассчитана на выявление визуализуемого бэнда при минимальном числе циклов амплификации, что можно было бы использовать в качестве относительного показателя количества данной мРНК. Отчетливый бэнд, специфичный для CD80, отсутствовал после 20 и 25 циклов через любое время после инфицирования, но после 30 циклов бэнд мРНК CD80 выявлялся в геле в каждой из экспериментальных групп. Также мРНК CD28 визуализовался на каждом временном этапе после 30 циклов амплификации, хотя на отрезке в 16 часов он также визуализовался (слабо) после 25 циклов.
Сходный подход был использован в отношении РНК, экстрагированной из РВМС FIV-инфицированных и неинфицированных кошек. Амплификацию методом ОТ-ПЦР специфичной для CD28 и CD80 РНК использовали для определения относительного количества транскрибируемой мРНК каждого из этих белков. Как это было осуществлено выше в эксперименте по временной динамике, образцы изымали по прошествии 20, 25 и 30 циклов. После 20 циклов мРНК не выявлялись, хотя оба продукта мРНК CD28 и CD80 визуализовались после 25 циклов (табл.5). Отсутствовали какие-либо отличия по экспрессии любой из этих мРНК между экспериментальной и контрольной группами. В обоих случаях имелись колебания признака числа циклов, при котором происходила визуализация продукта.
Полуколичественное определение продуктов ОТ-ПЦР для CD80 и CD28, амплифицированных на материале РНК инфицированных и неинфицированных РВМС в интервалах острой фазы FIV-инфекции
ПЦР-амплификация мРНК из клеток линий FETJ и МСН-5.4 с использованием FIV/gag-специфичных праймеров показала, что клеточная линия МСН-5.4 инфицируема и сохраняет активный инфекционный агент, в то время как клеточные линии FETJ не позволяют амплифицировать gag-специфичную РНК. FIV-специфичный продукт легко амплифицируется из РНК, экстрагированной из образцов клеток МСН-5.4, но не из РНК, экстрагированной из неинфицированного контроля. Сходные реакции, проведенные на материале клеточных линий FETJ, обработанных вирусом FIV штаммов Petaluma и Maryland, не позволили получить визуализуемый продукт при тех же условиях (данные не включены).
Нозерн-блоттинг и полуколичественную ПЦР проводили с целью выявления мРНК CD28 в нормальных клеточных линиях FETJ и МСН-
5.4. Линия клеток МСН-5.4 была представлена инфицированной (экспериментальной) группой и неинфицированным контролем, в то время как клеточную линию FETJ использовали в качестве непермиссивных контрольных Т-клеток.
Результаты полуколичественной ПЦР показали, что каждая клеточная линия способна вырабатывать мРНК CD28. При амплификации неинфицированных FETJ были выявлены параметры экспрессии, сходные с теми, которые были выявлены в описанном выше эксперименте по временной динамике экспрессии. Если в 0 часов после стимуляции (по сути без нее) бэнд отсутствовал вплоть до проведения 30 циклов, то к 16-му часу после стимуляции бэнд выявлялся после 25 циклов. Сходные параметры выявили в неинфицированной линии клеток МСН-5.4 при том, что бэнд отсутствовал до 30-го цикла в 0-й час и визуализовался после 25 циклов через 16 часов инкубации. Интересно, что в инфицированных клетках МСН-5.4 эти параметры отличались от таковых у контрольных клеток. В экспериментальной группе мРНК не визуализовались вплоть до 30 циклов ни в 0-й, ни в 16-й час. Для подтверждения целостности экстрагированной РНК и ее концентрации проводили амплификацию мРНК G3PDH. Таким образом, инфицирование влияет на экспрессию РНК CD28.
Анализ методом Нозерн-блоттинга использовали для подтверждения данных, которые были получены с применением полуколичественной ОТ-ПЦР. Наиболее сильную гибридизацию с зондом установили для РНК из неинфицированных клеток МСН-5.4, простимулированных Кон-А в течение 16 часов. Непростимулированный образец неинфицированных клеток характеризовался более интенсивной гибридизацией по сравнению с любыми инфицированными (стимулированными или нет) клетками МСН-5.4.
В дополнение к авторадиографической оценке измеряли уровень радиоактивности с помощью счетчика BetaGen. Предварительные подсчеты по гибридизации CD28 стандартизовали по подсчетам, полученным для того же блота с зондом для G3PDH (табл.6).
Нормализованный обсчет Нозерн-блотов по CD28 с помощью BetaGen
Амплификация методом ПЦР с ревертированием РНК цитокинов из клеточных линий МСН-5.4 показала амплифицируемость мРНК только для IL-2. Ни IL-4, ни IL-6, ни γ-интерферон не удалось амплифицировать в 30 циклах, хотя мРНК IL-2 выявлялась достаточно легко.
Обсуждение
мРНК CD28 анализировали при инфекциях in vivo и in vitro с целью определения того, может ли быть оценена экспрессия CD28 и изменяет ли ретровирусная инфекция экспрессию мРНК. Когда было выделено достаточное количество РНК, мРНК CD28 измеряли методом Нозерн-блоттинга, а при ограниченности такого выделения применяли полуколичественную ПЦР с ревертированием.
По результатам экспериментов in vivo по инфицированию трех животных вирусом FIV штамма Maryland в соответствии с объяснявшимся выше мРНК, специфичные для CD28 и CD80, амплифицировали из пула РНК, экстрагированного из РВМС, выделенных из проб крови этих инфицированных животных и неинфицированного контроля. Хотя анализ методом Нозерн-блоттинга является предпочтительным, полуколичественную ПЦР с ревертированием использовали из-за ограниченности числа клеток и доступного количества РНК из них. У кошек брали кровь каждую неделю, поэтому для каждого эксперимента могло быть взято максимум 10 мл крови.
Анализ методом FACS отношений CD4:CD8 в РВМС инфицированных животных показал его снижение в течение 8 недель у инфицированных животных по сравнению с неинфицированными животными, у которых это отношение оставалось относительно постоянным. Имеются различия между двумя экспериментальными группами. Хотя отношение CD4:CD8 различается у инфицированных и неинфицированных животных, не было выявлено различий по параметрам СВС или экспрессии CD80 и CD28 (данные не включены).
Для оптимального выявления экспрессии CD28 необходимы очищенные пулы Т-клеток. В выделенных фракциях РВМС на самом деле примерно 40% являются Т-клетками. Среди этих клеток на разных этапах эксперимента до половины клеток были CD8-позитивными Т-клетками, которые не экспрессировали CD28 в той же концентрации, что и Т-клетки CD4+. Это согласуется с тем фактом, что, как и у других видов, покоящимися Т-клетками (которые в кровотоке составляют большинство Т-клеток) CD28 на высоком уровне не экспрессируется, и это объясняет необходимость применения ПЦР вместо Нозерн-блоттинга. Предварительные эксперименты, направленные на выявление мРНК CD28 на материале 20 мкг РНК, экстрагированной из РВМС, оказались безуспешными. В полуколичественной ПЦР с ревертированием было установлено присутствие РНК, кодирующей CD28. Этот метод также был применен для амплификации мРНК CD80.
На материале клеточных линий in vitro получили пулы РНК, в которых мРНК CD28 выявляли методом Нозерн-блоттинга. Клетки линии МСН-5.4 выбрали потому, что, будучи линией Т-клеток, они являлись потенциальным экспрессантом мРНК CD28, а также она происходила от линии, предварительно приобретшей хроническую вирусную инфекцию. Наконец, достоинством этой линии клеток была доступность значительного количества РНК по сравнению с лимфоцитами крови, взятыми от единственного животного.
Также предпринимались попытки выявить мРНК методом Нозерн-блоттинга. В то время как на покоящихся В-клетках и моноцитах CD80 присутствует в низкой концентрации, в стимулированных моноцитах и макрофагах отмечены наивысшие уровни его экспрессии. Линия антиген-презентирующих клеток кошки оказалась недоступной, а Т-клетки в норме экспрессируют этот белок только на низком уровне. Эксперименты по выявлению мРНК CD80 в пулах РНК, экстрагированных из РВМС, оказались безуспешными, по-видимому, по тем же причинам, о которых говорилось выше при обсуждении CD28. С другой стороны, при использовании полуколичественной ПЦР с ревертированием в отношении клеток, полученных от инфицированных животных, были выявлены мРНК CD80 и CD28. Хотя данный метод и не дает точной количественной оценки мРНК, тем не менее он указывает на присутствие мРНК и на относительное его количество.
Успешным оказался анализ методом Нозерн-блоттинга мРНК CD28 Т-клеточной линии кошки. При сравнении параметров мРНК CD28 для инфицированных и неинфицированных клеток установили различия в параметрах экспрессии. Наиболее многочисленной мРНК CD28 была в неинфицированных клетках, простимулированных конканавалином-А в течение 16 часов. Также мРНК выявили в нестимулированных и неинфицированных клетках. При том, что данная мРНК обнаруживается в стимулированных и нестимулированных FIV-инфицированных клетках, эти уровни оказываются существенно меньшими по сравнению с неинфицированными клетками. Эти данные хорошо согласуются со сходными данными, полученными в методе ПЦР с ревертированием.
Выявление мРНК CD28 не затруднено теми же ограничениями, которые имели место в случае с молекулой CD80. Однако, если может быть выделена крупная популяциях клеток, экспрессирующих CD80, то можно было бы легко выявить мРНК с применением Нозерн-блоттинга. Когда будут сформированы специфичные моноклональные антитела для данных поверхностно-клеточных белков, будет интересно сопоставить уровни мРНК с уровнем поверхностной экспрессии каждого из этих белков.
кДНК цитокинов амплифицировали для того, чтобы подтвердить отсутствие различий между инфицированными и неинфицированными линиями. Независимо от статуса инфицированности в каждой группе амплифицировали IL-2. мРНК каких-либо иных цитокинов амплифицировать не удалось.
Данные Нозерн-блоттинга показывают, что in vitro экспрессия CD28 на уровне мРНК негативно регулируется вирусом FIV. Хотя такая закономерность еще должна быть подтверждена путем измерения уровней поверхностной экспрессии, ясно, что FIV-инфекция in vitro может влиять на экспрессию CD28, что было ранее продемонстрировано для Т-клеток человека в случае ВИЧ-инфекции (Brinchmann et al., 1994).
Заключение
Клонирование и секвенирование кДНК, кодирующей сигнальный комплекс молекул CD28 и CD80 кошки, привело к получению продуктов, аналогичных молекулам, выделявшимся у других видов. Хотя расшифрованная аминокислотная последовательность белка кошки проявила относительно низкий уровень идентичности по отношению к полипептидам человека и мыши, данные сравнения с ранее клонированными молекулами, сохранение характерных аминокислотных остатков и тот факт, что данный поверхностный лиганд, по-видимому, лишен прямых сигнальных функций, позволили сделать вывод о том, что выделенный продукт действительно является кошачьим аналогом CD80. Напротив, молекула CD28 кошки характеризуется средним уровнем идентичности и на уровне нуклеотидных, и на уровне аминокислотных последовательностей, т.е. является аналогом молекул, клонированных у других видов.
Природу этих молекул далее исследовали путем выявления их взаимодействия в тестах на связывание. Моноклональные антитела, специфичные в отношении аналогичных белков других видов, не могут реагировать с экспрессируемыми белками кошки. С учетом этого был разработан ряд тестов на связывание, нацеленных на выявление взаимодействия, а также того, что такое взаимодействие подавляется растворимым рецептором. В этих тестах связывание определяли по сохранению флуоресцентно помеченных клеток, которые могут быть подавлены внесением соответствующих растворимых рецепторов. Данные тесты показали не только то, что белки CD80 и CD28 кошки могут быть экспрессированы, но также и то, что эти поверхностно-экспрессируемые молекулы могут взаимодействовать.
Также экспрессия этих молекул была охарактеризована в ходе активной инфекции. Экспрессию CD28 и CD80 исследовали в моделях in vivo и in vitro, подвергавшихся заражению вирусом FIV. Экспрессия CD28, которая изменяется в ВИЧ-инфицированных клетках человека (Asjo et al., 1993), также претерпевала негативные изменения вслед за FIV-инфекцией Т-клеток кошки. Последующая информация, касающаяся экспрессии каждой из этих молекул при развитии заболевания, должна дополнительно подтверждать то, что организм кошки является важной моделью ретровирусной инфекции.
Способы долговременного применения указанных молекул потенциально могут быть широкими. Изучение структуры иммунных систем, эволюционно обособленных от иммунной системы человека, может обусловить лишь еще большее понимание того, как иммунная система работает в организме человека. Более того, важность домашней кошки как модельного организма ретровирусной инфекции, убедительно подтверждена (Siebelink et al., 1990). Предполагается, что белок CD80, входя в состав противоретровирусных вакцин, является потенциальным адъювантом при индукции CTL памяти. Кошка может быть исключительно информативной моделью с точки зрения проверки эффективности данной закономерности.
Библиография
Azuma, M., et al., J. Immunology 149, 1115-1123 (1992).
Azurna, M., et al., Nature 366, 76-79 (1993).
Chambers, et al., Current Opinion in Immunology 9, 396-404. (1997)
Chen, et al., J. Immunology 148, 2617-2621 (1992).
Chen, et al., Cell 71, 1093-1102 (1992).
Donnelly JJ, et al., Annu Rev Immunol. 1997; 15: 617-648
Freeman, et al., J. Immunology 143 2714-2722 (1989).
Freeman, et al., J. Exp. Med. 174, 625-631 (1991).
Gimmi, et al., Proc. Natl. Acad. Sci. USA 88, 6575-6579 (1991).
Hathcock, et al., J. of Exp. Med. 180, 631-640 (1994)
Hassett and Whitton, Trends Microbiol. 1996; 4: 307-312.)
Linsley, et al., Proc. Natl. Acad. Sci. USA 87, 5031-5035 (1990).
Jenkins, et al., J. Immunology 147, 2461-2466 (1991).
Riley, et al., J. Immunology 158, 5545-5553 (1997).
Tsuji, et al., Eur J. Immunology 27(3), 782-787 (1997).
PCT International Application WO 92/00092, Bristol Myers Squibb.
PCT International Application WO 92/15671, Cytomed, Inc. 17 September 1992.
PCT International Application WO 93/00431, Bristol Myers Squibb, 7 January 1993.
Akeson, A.L. and Woods, C.W. (1993). A fluorometric assay for the quantitation of cell adherance to endothelial cells. J. Irmnunol. Meth. 163, 181-185.
Allison, J.P., and Lanier L. (1987). The structure, serology, and function of the T-cell antigen receptor. Annu. Rev. Immunol. 5, 503-540.
Allison, J.P. (1994). CD28-B7 interaction in T-cell activation, Current Opinion Immunol. 6, 414-419.
Anderson, P., Morimoto, C., Breitmeyer, J.B., Schlossman, S.F. (1988). Regulatory interactions between members of the immunoglobulin superfamily. Immunol Today 9, 199-203.
Antonia, S.J., Munoz-Antonia, T., Soldevila, G., Miller, J., Flavell, R.A. (1995). B7-1 expression by a non-antigen presenting cell-derived tumor. Can. Res. 55, 2253-2256.
Arima, T., Rehman, A., Hickey, W., Flye, M. (1996). Inhibition by CTLA-4Ig of experimental allergic encephalomyelitis. J. Immunol. 156, 4917-4924.
Arruffo, A. and Seed, B. (1987). Molecular cloning of a CD28 cDNA by a COS cell expression system. Proc. Nat. Acad. Sci. USA, 84, 8573-8577.
Asjo, B., Cefai, D., Debre, P., Dudoit, Y., Autran, B. (1993). A novel mode of human immunodeficiency virus type 1 (HIV-1) activation: ligation of CD28 alone induces HIV-1 replication in naturally infected lymphocytes. J. Virol. 67, 4395-4398.
Azuma, M., Cayabyab, M., Buck, M., Phillips, J.H., Lanier, L.L. (1992). Involvement of CD28 in MHC unrestricted cytotoxicity mediated by a human killer leukaemic cell line. J. Immunol. 149, 1115-1123.
Azuma, M., Yssel, H., Phillips, J.H., Spits, H., Lanier, L.L., (1993b) Functional expression of B7/BB1 on activated T-lymphocytes. J. Exp. Med. 177, 845-850.
Azuma, M., Cayabyab, M., Phillips, J.H., Lanier, L.L. (1993с). Requirements for CD28-dependant T cell-mediated cytotoxicity. J. Immunol. 150, 2091-2101.
Bajorath, J., Stenkamp, R., Aruffo, A. (1993). Knowledge based protein modeling: concepts and examples. Prot. Sci. 2, 1798-1810.
Bajorath, J., Peach, R., Linsley, P.S. (1994). Immunoglobulin fold characteristics of B7-1 (CD80) and B7-2 (CD86). Prot. Sci. 3, 2148-2150.
Balazano, C., Buonavista, N., Rouvier, E., Golstein, P. (1992) CTLA-4 and CD28: similar proteins, neighbouring genes. Int. J. Can. Suppl. 7, 28-32.
Barcy, S., Wettendorf, M., Leo, C., Urbain, J., Kruger, M., Ceuppens, J.L., de Boers, M. (1995). FcR crosslinking on monocytes results in impaired T cell stimulatory capacity. Int. Immunol. 7, 179-189.
Beale, D. (1985). A comparison of the amino acid sequences of the extracellular domains of the immunoglobulin superfamily. Possible correlations between conservancy and conformation. Comp Biochem Physiol. 80, 181-194.
Bellone, M., Iezzi, G., Manfredi, A.A., Protti, M.P., Dellabona, P., Casorati, G., Rugarli, C. (1994). In vitro priming of cytotoxic T lymphocytes against poorly immunogenic epitopes by engineered antigen presenting cells. Eur. J. Immun. 24, 2691-2698.
Berke, G. (1S93). The functions and mechanisms of action of cytolytic lymphocytes. In "Fundamental Immunology," (W. Paul), pp. 965-1014. New York: Raven Publ. 3rd ed.
Berke, G. (1994). The binding and lysis of target T-cells by cytotoxic lymphocytes. Annu. Rev. of Immunol. 12, 735-773.
Boise, L.H., Minn, A.J., Noel, P.J., June, C.H., Accavitti, M., Lindstein, T., Thompson, C.B. (1993). CD28 costimulation can promote T cell survival by enhancing the expression of Bcl-xL. Immunity 3, 87-89.
Brinchmann, J.E., Doblung, J.H., Heger, B.H., Haaheim, L.L., Sannes, M., Egeland, T, (1994). Expression of costimulatory molecule CD28 on T-cells in human immunodeficiency virus type 1 infection: functional and clinical coorelations. J. Inf Dis. 169, 730-738.
Brown, W.C., Bissey, L., Logan, K.S., Pedersen, N.C., Elders, J.H., Collisson, E.W. (1991). Feline immunodeficiency virus infects both CD4+ and CD8+ T-lymphocytes. - J. of Virol. 62, 3359- 3364.
Buck, C.A. (1992). Immunoglobulin Superfamily: structure function and relationship to other receptor molecules. Semin. Cell Biol. 3. 179-188.
Buelens, C., Willems, F., Delvaux, A., Pierard, G., Delville, J.P., Velu, T., Goldman, M. (1995). Interleukin 10 differentially regulates B7-1 (CD80) and B7-2 (CD86) expression on human peripheral blood dendritic cells. Eur. J. Immunol. 25, 2668-2675.
Caruso, A., Cantalamessa, A., Licenziati, S., Peroni, L., Prati, E., Martinelli, F., Canaris, A.D., Folghera, S., Gorla, R., Balsari, A. (1994). Expression of CD28 on CD8+ and CD4+ lymphocytes during HIV infection. Scan. J. Immunol. 40, 485-490.
Cerdan, C., Martin, Y., Brailly, H., Courcoul, M., Flavetta, S., Costello, R., Mawas, C., Birg, F., Olive, D. (1991). IL-1 is produced by T lymphocytes activated via the CD2 plus CD28 pathways. J. Immunol. 146, 560-564.
Chen, L., Linsley, P.S., Hellstrom, K.E. (1993). Costimulation of T cells for tumor immunity. Immunol. Today 14, 483-486.
Chesnut, R.W and Grey, H.M. (1986). Antigen presentation by B cells and its significance in T-B interactions. Adv. Immunol. 39, 51-59.
Clark, S.J., Saag M.S., Decker, W.D., Campbell, H.S., Roberson, J.L., Veldkamp, P.J. (1991). High titers of cytopathic virus in plasma of patients with symptoms of primary HIV-1 infection. N. Eng. J. Med. 324, 954-960.
Clayberger, C., Lyu, S.C., DeKruyff, R., Parham, P., Krensky, A.M. (1994). Peptides corresponding to the CD8 and CD4 binding domains of HLA molecules block T-lymphocyte immune responses in vitro. J. Immunol. 153, 946-951.
Clevers, H., Alarcon, B., Wileman, T., Terhorst, C. (1988). The T-cell receptor-CD3 complex: A dynamic protein ensemble. Annu. Rev. Immunol. 6, 629-662.
Connor, R.I., Mohri, H., Cao, Y., Ho, D.D. (1993). Increased viral burden and cytopathicity correlate temporally with CD4+T-lymphocyte decline and clinical progression in human immunodeficiency virus type 1-infected individuals. J. Virol. 67, 1772-1777.
Cooper, D.A., Tindall, B., Wilson, E.J., Imreie, A.A., Penny, R. (1988). Characterization of T-lymphocyte responses during primary infection with human immunodeficiency virus. J. Inf. Dis. 157, 889-896.
Damle, N.K., Doyle, L.V., Grossmaire, L.S., Ledbetter, J.A. (1988). Differential regulatory signals delivered by antibody binding to the CD28 molecule during the activation of human T lymphocytes. J. Immunol. 140, 1753-1761.
Damle, N.K., Klussman, K., Leytze, G., Myrdal, S., Arruffo, A., Ledbetter, J.A., Linsley, P.S. (1994). Costimulation of lymphocytes with integrin ligands ICAM-1 or VCAM-1 induces fuctional expression of CTLA-4 a second receptor for B7. J. Immunol. 152, 2686-2697.
Davis, M.M. and Bjorkman, P.K. (1988). T-cell antigen receptor genes and T-cell recognition. Nature 334, 395-402.
de Boer, M., Kasran, A., Kwekkeboom, J., Walter, H., Vandenberghe, P., Ceuppens, J.L. (1993). Ligation of B7 with CD28/CTLA-4 on T-cells results in CD40 ligand expression, interleukin-4 secretion and efficient help for antibody production by B cells. Eur. J. Immunol. 23, 3120-3125.
deWaal Malefyt, R., Yssel, H., de Vries, J.E. (1993). Direct effects of IL-10 on subsets of human CD4+ T cell clones and resting T cells. Specific inhibition of Il-2 production and proliferation. J. Immunol. 150, 4754-4765.
Ding, L., Linsley, P.S., Huang, L.Y., Germain, R.N., Shevach, E.M. (1993). L-10 inhibits macrophage costimulatory activity by selectively inhibiting upregulation of B7 expression. J. Immunol. 151, 1224-1234.
Driscoll, P.C., Cyster, J., Campbell, I., Williams, A. (1991). Structure of domain 1 of rat T-lymphocyte CD2 antigen. Nature 353, 762-765.
Ellis, J.H., Burden, M., Vinogradov, D., Linge, C., Crowe, J. (1996). Interactions of CD80 and CD86 with CD28 and CTLA-4. J. Immunol. 155, 2700-2709.
Englehard, V.H. (1994). Structure of peptides associated with MHC class I molecules. Curr. Op. Immunol. 6, 13-21.
English, R.V., Nelson, P., Johnson, C.M., Nasisse, M., Tompkins, W.A., Tompkins, M.B. (1994). Development of clinical disease in cats experimentally infected with feline immunodeficiency virus. J. Inf. Dis. 170. 543-552.
Fauci, A.S. and Dale, D.C. (1975). The effect of hydrocortisone on the kinetics of normal human lymphocytes. Blood 46, 235-243.
Fauci, A., Macher, A., Longo, D., Lane, H., Rook, A., Masur, H., Gelmann, E. (1984). Acquired immunodeficiency syndrome: epidemiological, clinical, immunological and therapeutic considerations. Arm. Int. Med. 100, 92-106.
Fong, T.A. and Mosmann, T.R. (1990). Alloreactive murine CD8+ T cell clones secrete the Th1 pattern of cytokines. J. Immunol. 144, 1744-1752.
Fouchier, R.A., Meyaard, L., Brouwer, M., Hovenkamp, E., Schuitemaker, H. (1996). Broader tropism and higher cytopathicity for CD4+ T-cells of asyncytium-inducing compared to a non-syncytium-inducing HIV-1 isolate as a mechanism for accelerated CD4+ T cell decline in vivo. Virology 219, 87-95.
Freedman, A.S., Freeman, G., Horowitz, J.C., Daley, J., Nadler, L.M. (1987). A B-cell restricted antigen that identifies preactivated B cells. J. Immunol. 139, 3260-3267.
Freeman G.J., Borrillo, F., Hodes, R.J., Reiser, H., Hathcock, K.S., Laszlo, G., McKnight, A.J., Kim, J., Du, L., Lombard, D.B., Gray, G.S., Nadler, L.M., Sharpe, A.H. (1993). Uncovering a functional alternative CTLA-4 counter receptor in B7-1 deficient mice. Science 262, 907-909.
Gajewski, T.F., Schell, S.R., Nau, G., Fitch. F.W. (1989). Regulation of T-cell activation: Differences among T-cell subsets. Immunol Rev. 111, 79-110.
Germain, R.N. (1993). The Biochemistry and cell biology of antigen processing and presentation. Annu. Rev. Immunol. 11, 403-450.
Haffar, O.K., Smithgall, M.D., Bradshaw, J., Brady, W., Damle, N.K., Linsley, P.S. (1993). Costimulation of T-cell activation and virus production by B7 antigen on activated CD4+ T-cells from human immunodeficiency virus type 1-infected donors. Immunology 90, 11094-11098.
Harlan, D.M., Abe, R., Lee, K.P., June, C.H. (1995). Potential roles of the B7 and CD28 receptor families in autoimmunity and immune evasion. Clin. Immunol. Immunopath. 75, 99-111.
Hodge, J.W., Abrami, S., Schlom, J., Kantor, J.A. (1994). Induction of antitumor immunity by recombinant vaccinia viruses expressing B7-1 or B7-2 costimulatory molecules. Can. Res. 54, 5552-5555.
Hutchcroft, J.E. and Bierer, B.E. (1996). Signaling through CD28/CTLA-4 family receptors. J. Immunol. 155, 4071-4074.
Jenkins, M.K., Pardoll, D.M., Mizuguchi, J., Quill, H., Schwartz, R.H. (1987). T cell responsiveness in vivo and in vitro: Fine specificity of induction and molecular characterisation of the unresponsive state. Immunol. Rev. 95, 113-135.
June, C.H., Ledbetter, J.H., Linsley, P.S., Thompson, C.B. (1990). Role of the CD28 molecule in T-cell activation. Immunol. Today 11, 211-216.
June, C.H., Bluestone, J.A., Nadler, L.M., Thompson, C.B. (1994). The B7 and CD28 receptor families. Immunol. Today 12, 321-333.
Kozber, D., Moretta, A., Messner, H.A., Moretta, L., Croce, C.M. (1987). Tp44 molecules involved in antigen-independant T cell activation are expressed on human plasma cells. J. Immunol. 138, 4128-4132.
Kupfer, A. and Singer, S.J. (1989). Cell biology of cytotoxic and helper T-cell functions. Annu. Rev. Immunol. 7, 309-337.
Landay, A.L., Mackewicz, C.E., Levy, J.A. (1993). An activated CD8+ T cell phenotype coorelates with an anti-HIV activity and assymptomatic clinical status. Clin Immun. Immunopath. 69, 106-116.
Lane, P., Burdet, C., Hubele, S., Scheidegger, D., Muller, U., McConnell, F., Kosco-Vilbois, M. (1994). B cell function in mice transgenic for mCTLA4-H gamma 1: lack of germinal centers correlated with poor affinity maturation and class switching despite normal priming of CD4+ T-cells. J. Exp Med. 179, 819-830.
Lanier, L.L., O'Fallon, S., Somoza, C., Phillips, J.H., Linsley, P.S., Okumura, K., Ito, D., Azuma, M. (1995). CD80 (B7) and CD86 (B70) provide similar costimulatory signals for T cell proliferation, cytokine production, and generation of CTL. J. Immunol. 154, 97-105.
Larsen, C.P., Ritchie, S.C., Pearson, T.C., Linsley, P.S., Lowry, R.P. (1992). Functional expression of the costimulatory molecule B7/BB1 in murine dendritic cell populations. J. Exp. Med. 176, 1215-1220.
Leahy, D., Axel, R., Hendrickson, W. (1992). Crystal structure of a soluble form of human T cell counter receptor CD8 at 2.8 resolution. Cell 68, 1145-1162.
Lechler, R.I., Lombardi, G., Batchelor J.R., Reinsmoen N., Bach, F.H. (l990). The molecular basis of alloreactivity. Annu. Rev. Immunol. 10, 83-88.
Lenschow, D.J., Su, G.H-T., Zuckermann, L.A., Nabavi, N., Jellis, C.L., Gray, G.S., Miller, J., Bluestone, J.A. (1993). Expression and functional significance of an additional ligand for CTLA-4. Proc. Nat. Acad. Sci. USA. 90, 11054-11058.
Lenschow, D.J., Walunas, T.L., Bluestone, J.A. (1996). CD28/B7 system of T cell costimulation. Annu. Rev. Immunol. 14, 233-258.
Leung, H.T. and Linsley, P.S. (1994). The CD28 costimulatory pathway. Therap. Immunol, 1, 217-228.
Lewis, D.E., Ng Tang, D.S., Adu-Oppong, A., Schober, W., Rodgers, J. (1994). Anergy and apoptosis in CD8+ T-cells from HIV infected persons. J. Immunol. 153, 412-420.
Li, Y., McGowan, P., Hellstrom, I., Hellstrom, K.E., Chen, L. (1994). Costimulation of tumor reactive CD4 and CD8 T-lymphocytes by B7 a natural ligand for CD28 can be used to treat established mouse melanoma. J. Immunol. 153, 421-428.
Lindsten, T., Lee, K.P., Harris, E.S., Petryniak, B., Craighead, N., Reynolds, P.J., Lombard, D.B., Freeman, G.J., Nadler, L.M., Gray, G.S. (1993). Characterization of CTLA-4 structure and expression on human T-cells. J. Immunol. 151, 3489-3499.
Linsley, P.S., Brady, W., Urnes, M., Grosmaire, L.S., Damle, N.K., Ledbetter, J.A. (1991a). Binding of the B-cell activation antigen B7 to CD28 costimulates T-cell proliferation and Interleukin-2 mRNA accumulation. J. Exp. Med. 173, 721-730.
Linsley, P.S., Brady, W., Urnes, M., Grosmaire, L. S., Damle, N.K., Ledbetter, J. A. (1991b). CTLA-4 is a second receptor for the B-cell activation antigen B7. J. Exp. Med. 174, 561-569.
Linsley, P.S., Wallace, P.M., Johnson, J., Gibson, M.G., Greene, J.L., Ledbetter, J.A., Singh, C., Tepper, M.A. (1992a). Immunosuppression in vivo by a soluble form of the CTLA-4 T cell activation molecule. Science, 257, 792-795.
Linsley, P.S., Greene, J.L., Tan, P., Bradshaw, J., Ledbetter, J.A., Anasetti, C., Damle, N.K. (1992b). Coexpression and functional cooperation of CTLA-4 and CD28 on activated T-lymphocytes. J. Exp. Med. 176, 1595-1604.
Linsley, P. S. and Ledbetter, J. A. (1993a). The role of CD28 receptor during T cell responces to antigen. Ann. Rev. Immunol. 11, 191-212.
Linsley, P.S., Bradshaw, J., Urnes, M., Grosmaire, L., Thompson, C.B. (1993b). CD28 engagement by B7/BB-l induces transient down-regulation of CD28 synthesis and prolonged unresponsiveness to CD28 signaling. J. Immunol. 150, 3161- 3169.
Linsley, P.S., Greene, J.L., Brady, W., Bajorath, J., Ledbetter, J.A., Peach, R. (1994a). Human B7-1 (CD80) and B7-2 (CD86) bind with similar avidities but distinct kinetics to CD28 and CTLA-4 receptors. Immunity 1, 793-801.
Linsley, P.S., Peacn, R., Gladstone, P., Bajorath, J. (1994b). Extending the B7(CD80) gene family. Prot. Sci. 3, 1341-1343.
Linsley, P.S., Ledbetter, J., Peach, R., Bajorath, J. (1995a). CD28/CTLA-4 receptor structure, binding stoichiometry and aggregation during T cell activation. Res. Immunol. 146, 130-140.
Linsiey, P.S., Nadler, S.G., Bajorath, J., Peach, R., Leung, H.T., Rogers, J., Bradshaw, J., Stebbins, M., Leytze, G., Brady, W., Malacko, A.R., Marquardt, H., Shaw, S. (1995b). Binding stoichiometry of the cytotoxic T-lymphocyte-associated molecule-4 (CTLA-4). J. Biol. Chem. 270, 15417-15424.
Littman, D.R. (1987). The structure of the CD4 and CD8 genes. Annu. Rev. Immunol. 5, 561-584.
Liu, C.C., Welsh, C.M., Young, J. D-E. (1995). Perforin: Structure and function. Immunol. Today 16, 194-201.
Liu, Y., Jones, B., Brady, W., Janeway, C.A., Linsley, P. (1992). Murine CD4 T cell growth: B7 and heat stable antigen both participate in co-stimulation. Eur. J. Immunol. 115, 1905-1912.
Lombardi, S., Garzelli, C., Pistello, M., Massi, C., Matteucci, D., Baldinotti, F., Cammarota, G., Da Prato, L., Bandecchi, P., Tozzini, F., Bendinelli, M. (1994). A neutralizing antibody- inducing peptide of the V3 domain of feline immunodeficiency virus envelope glycoprotein does not induce protective immunity. J. Virol. 68, 8374-8379.
Lu, Y., Granelli-Piperno, A., Bjorndahl, J.M., Phillips, C.A., Trevillyan J.M. (1992). CD28-induced T cell activation. Evidence for a protein-tyrosine kinase signal transduction pathway. J. Immunol. 149, 24-29.
Luria, S.E. and Darnell, J.E (1968) "General Virology". New York: John Wiley and Sons, Inc.
Lwoff, A. (1957). The concept of virus. J. Gen. Microbiol. 17, 239-253.
Maniatis, T., Fritsch, E.F., and Sambrook, J. (1982). "Molecular Cloning: A Laboratory Manual." New York: Cold Spring Harbor Press.
Martin, P.J., Ledbetter, J.A., Morishita, Y., June, C.H., Beatty, P.J., Hansen, J.A. (1986). A 44 kilodalton cell surface homodimer regulates interleukin 2 production by activated human T lymphocytes. J. Immunol., 136, 3282-3287.
Matasumura, M., Fremont, D.H., Peterson, P.A., Wilson, I.A. (1992). Emerging principles for the recognition of peptide antigens by MHC class I molecules. Science 257, 927-934.
Mescher, M.F. (1992). Surface contact requirements for activation of cytotoxic T-lymphocytes. J. Immunol. 49, 2402-2405.
Minty, A., Chalon, P., Derocq, J.M., Dumont, X., Guillemot, J.C., Kaghad, M., Labit, C., Leplatois, P., Liauzun, P., Miloux, B., Minty, C., Casellas, P., Loison, G., Lupker, J., Shire, D., Ferrara, P., Caput, D., (1993). Interleukin 13 is a new human lymphokine regulating inflammatory and immune responses. Nature 362, 248-250.
Moffett, C.W. and Paden, C.M. (1994). Microglia in the rat neurohypophysis increase expression of class I major histocompatibility antigens following central nervous system injury. J. Neuroimmunol. 50, 139-51.
Mosmann, T. and Coffman, R.L. (1989). TH1 and TH2 cells: Different patterns of lymphokine secretion lead to different functional properties. Annu. Rev. Immunol. 7, 145-173.
Nabavi, N., Freeman, G.J., Gault, D., Godfrey, G.N., Nadler, L.M., Glimcher, L.M. (1992). Signaling through the MHC CII cytoplasmic domain is required for antigen presentation and induces B7 expression. Nature 360, 266-268.
Nagata, S. and Golstein, P. (1995). The Fas death factor. Science 267, 1449-1465.
Nickoloff, B.J., Mitra, R.S., Lee, K., Turka, L.A., Greem, J., Thompson, C., Shimizu, Y. (1993). Discordant expression of CD28 ligands BB-1 and B7 on keratinocytes in vitro and psoriatic cells in vivo. Am J. Path. 142, 1029-1040.
Novotney, C., English, R., Housman, J., Davidson, M., Nasisse, M., Jeng, C.R. (1990). Lymphocyte population changes in cats naturally infected with feline immunodeficiency virus. AIDS, 4, 1213-1218.
O'Doherty, U., Steinman, R.M., Peng, M., Cameron, P.U., Gezelter, S., Kopeloff, I., Swiggard, W.J., Pope, M., Bhardwaj, N. il993). Dendritic cells freshly isolated from human blood express CD4 and mature into typical immunostimulatory dendritic cells after culture in monocyte-conditioned media. J. Exp. Med. 178, 1067-1076.
Ozawa, H., Aiba, S., Nakagawa, S., Tagami, H. (1995). Inierferon gamma and interleukin 10 inhibit antigen presentation by Langerhan's cells for T helper type 1 cells by suppressing their CD80 (B7-1) expression. Eur. J. Immunol. 26, 648-652.
Page, C., Thompson, C., Yacoub, M., Rose, M. (1994). Human endothelial stimulation of allogenic T-celis via a CTLA-4 independant pathway. Trans. Immunol. 2, 342-347.
Peach, R., Bajorath, J., Brady, W., Leytze, G., Greene, J., Naemura, J., Linsley, P.S. (1994). CDR1 and CDR3-analogous regions in CTLA-4 and CD28 determine the binding to B7-1. J. Exp. Med. 180, 2049-2058.
Peach, R., Bajorath, J., Naemura, J., Leytze, G., Greene, J., Aruffo, A., Linsley, P.S. (1995). Both extracellular immunoglobulin-like domains of CD80 contain residues critical for binding T-cell surface receptors CTLA-4 and CD28. J. Biol. Chem. 270, 21181-21187.
Pedersen, N.C., Ho, E., Brown, M.L., Yamamoto, J.K. (1987). Isolation of a T lymphotrophic virus from domestic cats with an immunodeficiency like syndrome. Science 235, 790-793.
Prasad, K.V., Cai Y.C., Raab, M., Duckworth, B., Cantley, L., Shoelson, S.E., Rudd, C.E. (1994). T-cell antigen CD28 interacts with the lipid kinase phosphatidylinositol 3-Kinase by a cytoplasmic Tyr(P)-Met-Xaa-Met motif. Proc Natl Acad Sci USA. 91, 2834-2838.
Radvanyi, L.G., Shi, Y., Vaziri, H., Sharma, A., Dhala, R., Mills, G.B., Miller, R.G. (1996). CD28 costimulation inhibits TCR-induced apoptosis during a primary T cell response. J. Immunol. 158, 1788-1798.
Ranheim, E.A. and Kipps, T.J. (1995). Tumor necrosis factor-alpha facilitates induction of CD80 (B7-1) on human B cells by activated T-cells: complex regulation by IL-4, IL-10, and CD40L. Cell. Immunol. 161, 226-235.
Razi-Wolf, Z., Freeman, G., Galvin, F., Benacerraf, B., Nadler, L., Reiser, H. (1992). Expression and function of the murine B7 antigen and the major costimulatory molecule expressed by peritoneal exudate cells. Proc. Nat. Acad. Sci. USA. 89, 4210-4214.
Ronchese, F., Hausmann, B., Hubele, S., Lane, P. (1994). Mice transgenic for a soluble form of murine CTLA-4 show enhanced expansion of antigen-specific CD4+ T-cells and defective antibody production in vivo. J. Exp Med. 179, 809- 817.
Rotzschke, O. and Falk, K. (1994). Origin structure and motifs of naturally processed MHC class II ligands. Curr. Op Immunol. 6, 45-51.
Russel, J.H. (1983). Internal disintegration model of cytotoxic lymphocyte induced target damage. Immunol. Rev. 72, 97-118.
Saukkonen, J.J., Kornfield, H., Berman, J.S. (1993). Expansion of a CD8+CD28+ cell population in the blood and lung of HIV-positive patients. JAIDS 11, 1194-1199.
Schattner, E. and Laurence, J. (1994). HIV induced T-lymphocyte depletion. Clin. Lab. Med. 14, 221-227.
Schmittel, A., Scheibenbogen, C., Keilholz, U. (1995). Lipopolysaccharide effectively up-regulates B7-1 (CD80) expression and costimulatory function of human monocytes. Scan. J. Immunol. 42, 701-704.
Schwartz, R.H. (1992). Costimulation of T-lymphocytes: the role of CD28, CTLA-4 and B7/BB1 in interleukin-2 production and immunotherapy. Cell 71, 1065-1068.
Seder, R.A., Germain, R.N., Linsley, P.S., Paul, W.E. (1994). CD28 mediated co-stimulation of IL-2 production plays a critical role in T cell priming for IL-4 and IFNγ production, J. Exp Med. 179, 299-304.
Shahinian, A., Pfeffer, K., Lee, K.P., Kundig, T.M., Kishihara, K., Wakeham, A., Kawai, K., Ohashi, P.S., Thompson, C.B., Mak, T.B. (1993). Differential T cell costimulatory requirements in CD28 deficient mice. Science 261, 609-612.
Sher. A., Gazzinelli, R.T., Oswald, I.P., Clerici. M., Kullberg, M., Pearce, E.J., Berzofsky, J.A.. Mosmann, T.R., James, S.L., Morse, H.C. (1992). Role of T-cell derived cytokines in the downregulation of immune responses in parasitic and retroviral infection. Immunol Rev. 127, 183-204.
Siebelink, K.H., Chu, I.H., Rimmelzwaan, G.F., Weijer, K., van Herwijnen, H.R., Knell, P. (1990). Feline Immunodeficiency virus (FIV) infection in the cat as a model for HIV infection in man: FIV induced impairment of immune function. AIDS Res. Hum. Retroviruses 6, 1373-1378.
Siebelink, K.H., Tijhaar, E., Huisman, R.C., Huisman, W., deRonde, A., Darby, I.H., Francis, M.J., Rimmelzwaan, G.F., Osterhaus, A.D. (1995). Enhancement of feline immunodeficiency virus infection after immunization with envelope glycoprotein subunit vaccines. J Virol. 69, 3704-3711.
Singer, S.J. (1992). Intracellular communication and cell:cell adhesion. Science 255, 1671-1674.
Smithgall, M.D., Wong, J.G., Linsley, P.S., Haffar, O.K. (1995). Costimulation of CD4+ T-cells via CD28 modulates human immunodeficiency type 1 infection and replication in vitro. AIDS Res. Hu. Retro. 11, 885-892.
Springer, T.A., Dustin, M.L., Kishimoto, T.K., Marlin, S.D. (1987). The lymphocyte function associated LFA-1, CD2 and LFA-3 molecules: cell adhesion receptors of the immune system. Annu. Rev. Immunol. 5, 223-252.
Springer, T.A. (1990). Adhesion receptors of the immune system. Nature 346, 425-434.
Stack, R.M., Lenschow, D.J., Gray, G.S., Bluestone, J.A., Fitch, F.W. (1994). IL-4 treatment of small splenic B cells induces co-stimulatory molecules B7-1 and B7-2. J. Immunol. 152, 5723-5733.
Symington, F.W., Brady, W., Linsley, P.S. (1993). Expression and function of B7 on human epidermal Langerhan's cells. J. Immunol. 150, 1286-1295.
Taylor, M.K. and Cohen, J.J. (1992). Cell mediated cytotoxicity. Curr. Opin. Immunol. 4, 338-343.
Thomas, R., Davi, L.S., Lipsky, P.E. (1994). Rheumatoid synovium is enriched in mature antigen presenting dendritic cells. J. Inmunol. 152, 2613-2623.
Townsend, S.E., and Allison, J.P. (1993). Tumor rejection after direct costimulation of CD8+ T-cells by B7 transfected melanoma cells. Science 259, 368-370.
Turka L.A., Ledbetter, J.A., Lee, K., June, C.H., Thompson, C.B. (1990). CD28 is an inducible T cell surface antigen that transduces a proliferative signal in CD3+ mature thymocytes. J. Immunol. 144, 1646-1653.
Turka, L.A., Linsley, P.S., Paine, R., Schieven, G.L., Thompson, C.B., Ledbetter, J.A. (1991). Signal transduction via CD4, CD8 and CD28 in mature and immature thymocytes. J. Immunol. 146, 1428-1436.
Unanue, E.R. (1984). Antigen presenting function of the macrophage. Annu. Rev. Immunol. 2, 395-428.
van Kooten, C., Rensink, I., Pascual-Salcedo, D., van Oers, R., Aarden, L. (1991). Monokine production by human T-cells: IL-1 alpha production is limited to memory T-cells. J. Immunol. 146, 2654-2658.
van Seventer, G.A., Shimizu, Y., Shaw, S. (1991). Roles of multiple accessory molecules in T cell activation. Curr. Opin Immunol. 3, 294-303.
Wang, R., Murphy, K.M., Loh, D.Y., Weaver, C., Russell, J.H. (1993). Differential activation of antigen-stimulated suicide and cytokine production pathways in CD4+ T-cells is regulated by the antigen-presenting cell. J. Immunol. 150, 3832-42.
Weiss, A. and Littman, D.R. (1994). Signal transduction by lymphocyte antigen receptors. Cell 76, 263-274.
Williams, A. and Barclay, A. (1988). The immunoglobulin superfamily-domains for cell surface recognition. Ann. Rev. Immunol. 6, 381-405.
Windhagen, A., Newcombe, J., Dangond, F., Strand, C., Woodroofe, M.N., Cuzner, M.L., Hafler, D.A. (1995). Expression of costimulatory molecules B7-1 (CD80), B7-2 (CD86) and interleukin 12 in multiple schlerosis lesions. J. Exp. Med. 182, 1985-1996.
Yamamoto, J.K., Hansen, H., Ho, W.E., Morishita, T.Y., Okuda, T., Sawa, T.R. (1989). Epidemiological and clinical aspects of feline immunodeficiency virus infection in cats from the continental United States and Canada and possible mode of transmission. J.A.V.M.A. 194, 213-220.
Yasukawa, M., Inatsuki, A., Kobayashi, Y. (1989). Differential in vitro activation of CD4+CD8- and CD8+CD4-herpes simplex virus-specific human cytotoxic T-cells. J. Immunol. 143, 2051-2057.
Yssel, H., Schneider, P.V., Lanier, L.L. (1993). Interleukin 7 specifically induces B7/BB1 antigen on human cord blood and peripheral blood T-cells and T cell clones. Int. Immunol. 5, 753-759.
Zanussi, S., Simonelli, C., D'Andrea, M., Caffau, C., Clerici, M., Tirelli, U., DePaoli, P. (1996). CD8+ lymphocyte phenotype and cytokine production in long-term non-progressor and in progressor patients with HIV-1 infection. Clin. Exp. Immunol. 105, 220-224.
Zhou, T., Weaver, C., Linsley, P.S.. Mountz, J.D. (1994). T-cells of staphylococcal enterotoxin B-tolerized autoimmune MRL-lpr/lpr mice require costimulation through the B7-CD28/CTLA-4 pathway for activation and can be reanergized in vivo by stimulation of the T cell receptor in the absence of costimulatory signal. Eur. J. Immunol. 24, 1019-1025.























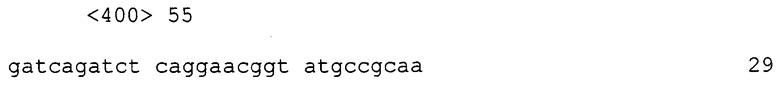
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЫДЕЛЕННАЯ НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ ЛИГАНД CD86 КОШКИ, ДИАГНОСТИЧЕСКИЙ ОЛИГОНУКЛЕОТИД, КЛОНИРУЮЩИЙ ВЕКТОР, ВАКЦИНА, СПОСОБЫ ИНДУКЦИИ ИЛИ ПОДАВЛЕНИЯ ИММУНИТЕТА У КОШКИ | 1999 |
|
RU2263145C2 |
| РЕКОМБИНАНТНЫЙ ВИРУС, ЭКСПРЕССИРУЮЩИЙ ЧУЖЕРОДНУЮ ДНК, КОДИРУЮЩУЮ КОШАЧИЙ CD80, КОШАЧИЙ CTLA-4 ИЛИ КОШАЧИЙ CD86, И ЕГО ИСПОЛЬЗОВАНИЕ | 1999 |
|
RU2244006C2 |
| ВАРИАНТЫ CTLA-4 | 2013 |
|
RU2671465C2 |
| РАСТВОРИМЫЕ МУТАНТНЫЕ МОЛЕКУЛЫ CTLA4 | 1998 |
|
RU2235555C2 |
| ИНГИБИТОРЫ Т-КЛЕТОЧНОЙ АКТИВАЦИИ | 2012 |
|
RU2657440C2 |
| ЛИГАНД GITR И СВЯЗАННЫЕ С ЛИГАНДОМ GITR МОЛЕКУЛЫ И АНТИТЕЛА И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2004 |
|
RU2369636C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИММУНОТЕРАПИИ | 2014 |
|
RU2680010C2 |
| CAR-T-КЛЕТКИ, СПЕЦИФИЧЕСКИ НАЦЕЛЕННЫЕ НА АНТИГЕН CD19 | 2020 |
|
RU2826298C2 |
| Тетрадекапептидный антагонист взаимодействия CTLA-4 c B7-1 | 2021 |
|
RU2757418C1 |
| Пептид со способностью специфически связываться с молекулой контроля иммунного ответа CTLA-4 | 2020 |
|
RU2747793C1 |




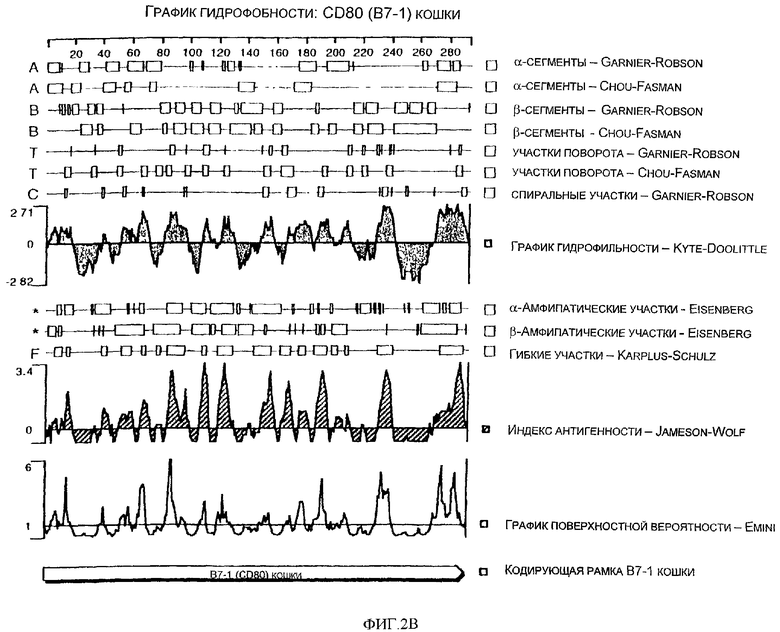

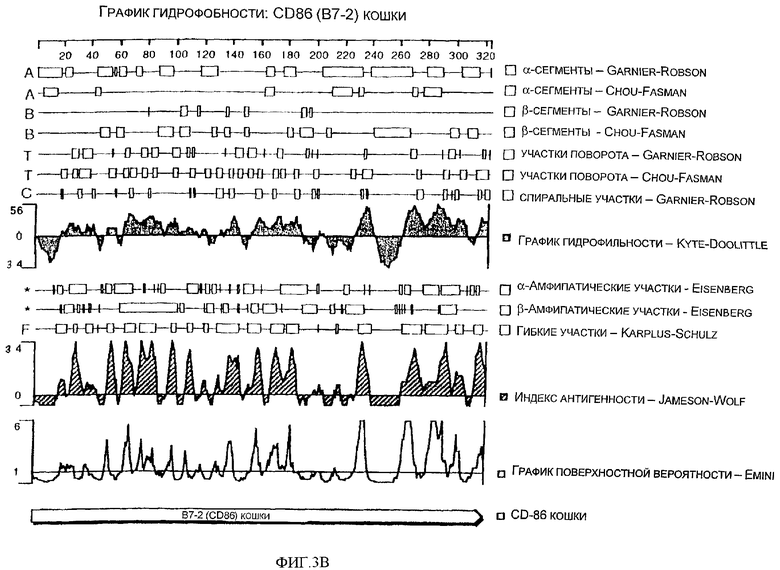


Изобретение относится к области биотехнологии и иммунологии. Представлена выделенная и очищенная ДНК, кодирующая рецептор CTLA-4 (CD152) кошки. Предложены также диагностический олигонуклеотид, клонирующий вектор, вакцина, способы индукции, усиления и подавления иммунного ответа у кошки. Группа изобретений может быть использована для создания модельной домашней кошки для изучения ретровирусной инфекции. 7 н. и 17 з.п. ф-лы, 13 ил., 6 табл.
1. Выделенная нуклеиновая кислота, кодирующая рецептор CTLA-4 кошки или растворимый рецептор CTLA-4 кошки, причем рецептор CTLA-4 кошки или растворимый рецептор CTLA-4 кошки кодируются нуклеотидной последовательностью SEQ ID NO: 9.
2. Нуклеиновая кислота по п.1, где рецептор CTLA-4 кошки содержит аминокислотную последовательность SEQ ID NO: 10.
3. Нуклеиновая кислота по п.1, где нуклеиновая кислота является ДНК или РНК.
4. Нуклеиновая кислота по п.3, где ДНК является кДНК или геномной ДНК.
5. Диагностический олигонуклеотид, содержащий последовательность по меньшей мере из 12 нуклеотидов, комплементарную последовательности, уникально присутствующей в нуклеотидной последовательности SEQ ID NO: 9 нуклеиновой кислоты по п.1.
6. Олигонуклеотид по п.5, который состоит по меньшей мере из 15 или 16 нуклеотидов.
7. Олигонуклеотид по п.5 или 6, где олигонуклеотид помечен выявляемой меткой.
8. Олигонуклеотид по п.7, где выявляемая метка содержит радиоактивный изотоп, флуорофор или биотин.
9. Олигонуклеотид по п.5 или 6, где олигонуклеотид избирательно метилирован.
10. Клонирующий вектор, содержащий нуклеиновую кислоту по п.1.
11. Вектор по п.10, обозначенный CTLA-4# 1/091997 (депозитарный №АТСС 209820).
12. Вектор по п.10 или 11, содержащий промотор, функционально присоединенный к нуклеиновой кислоте.
13. Вакцина для модулирования иммунного ответа у кошки, содержащая эффективное количество полипептида, кодируемого нуклеиновой кислотой по п.1, и подходящий носитель.
14. Вакцина по п.13, где эффективным количеством является количество примерно от 0,01 примерно до 100 мг на одну дозу.
15. Вакцина по п.13, где эффективным количеством является количество примерно от 0,25 примерно до 25 мг/кг массы тела кошки в сутки.
16. Вакцина по любому из пп.13-15, которая дополнительно содержит иммуноген, производный от патогена.
17. Вакцина по п.16, где патоген является патогеном кошки, вирусом бешенства, хламидией, Toxoplasma gondii, Dirofilaria immitis, патогеном блохи или бактериальным патогеном.
18. Вакцина по п.17, где патогеном кошки является вирус иммунодефицита кошачьих (FIV), вирус лейкоза кошачьих (FeLV), вирус инфекционного перитонита кошачьих (FIP), вирус панлейкопении кошачьих, калицивирус кошачьих, реовирус 3-го типа кошачьих, коронавирус кошачьих, респираторно-синцитиальный вирус кошачьих, вирус саркомы кошачьих, герпесвирус кошачьих, вирус болезни Борна кошек или паразит кошек.
19. Способ индукции иммунитета у кошки, предусматривающий введение кошке вакцины по любому из пп.13-18.
20. Способ усиления иммунного ответа у кошки, предусматривающий введение кошке вакцины по любому из пп.13-18.
21. Способ по п.19 или 20, где вакцину вводят подкожно, внутримышечно, системно, местно или перорально.
22. Способ подавления иммунного ответа у кошки, предусматривающий введение кошке эффективно подавляющего иммунный ответ количества полипептида, кодируемого нуклеиновой кислотой по п.1.
23. Способ по п.22, где указанное количество составляет примерно от 0,25 примерно до 25 мг/кг массы тела в сутки.
24. Способ по п.22, где кошка страдает аутоиммунным заболеванием или является реципиентом тканевого или органного трансплантата.
| УСТРОЙСТВО СОВМЕСТНОЙ ПЕРЕДАЧИ СООБЩЕНИЙ И СЛУЖЕБНОЙ ИНФОРМАЦИИ | 2014 |
|
RU2580812C2 |
| WO 9734633, 25.09.1997 | |||
| WO 9503408, 02.02.1995. | |||
Авторы
Даты
2009-12-27—Публикация
1999-04-30—Подача