Область, к которой относится изобретение
Антиген-неспецифические межклеточные взаимодействия между Т-лимфоцитами и антиген-презентирующими клетками (APCs) обусловливают Т-клеточные костимулирующие сигналы, которые вызывают Т-клеточный ответ на антиген (Jenkins and Jonson (1993) Curr. Opin.Immunol. 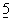 :361-367). Костимулирующие сигналы определяют величину Т-клеточного ответа на антиген, а также будет ли данный ответ активировать или инактивировать последующие ответы на антиген (Mueller et al., (1989) Annu. Rev.Immunol.
:361-367). Костимулирующие сигналы определяют величину Т-клеточного ответа на антиген, а также будет ли данный ответ активировать или инактивировать последующие ответы на антиген (Mueller et al., (1989) Annu. Rev.Immunol. 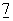 :445-480).
:445-480).
Активация Т-клеток в отсутствие костимуляции приводит к абортивному или анергическому Т-клеточному ответу (Schwartz, R.H. (1992) Cell 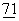 :1065-1068). Один из ключевых костимулирующих сигналов обеспечивается взаимодействием Т-клеточных поверхностных рецепторов CD28 и CTLA4 с В7-родственными молекулами на АРС (известными также как В7-1 и В7-2, или CD80 и CD86 соответственно) (P.Linsley and J.Ledbetter (1993) Annu. Rev.Immunol.
:1065-1068). Один из ключевых костимулирующих сигналов обеспечивается взаимодействием Т-клеточных поверхностных рецепторов CD28 и CTLA4 с В7-родственными молекулами на АРС (известными также как В7-1 и В7-2, или CD80 и CD86 соответственно) (P.Linsley and J.Ledbetter (1993) Annu. Rev.Immunol. 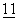 :191-212).
:191-212).
Молекула, известная как CD80 (В7-1), была исходно описана как человеческий активационный антиген, ассоциированный с В-клетками (Yokochi, Т. et al., (1981) J.Immunol.  :823-827; Freeman, G.J. et al., (1989) J.Immunol.
:823-827; Freeman, G.J. et al., (1989) J.Immunol.  :2714-2722), и впоследствии идентифицирована как противорецептор для родственных Т-клеточных молекул CD28 и CTLA4 (Linsley, P., et al., (1990) PNAS USA
:2714-2722), и впоследствии идентифицирована как противорецептор для родственных Т-клеточных молекул CD28 и CTLA4 (Linsley, P., et al., (1990) PNAS USA  :5031-5035; Linsley, P., et al., (1991a) J.Exp. Med.
:5031-5035; Linsley, P., et al., (1991a) J.Exp. Med.  :721-730; Linsley.P, et al., (1991b) J.Exp. Med.
:721-730; Linsley.P, et al., (1991b) J.Exp. Med.  :561-570).
:561-570).
Недавно на антиген-презентирующих клетках (АРС) был идентифицирован другой противорецептор CTLA4Ig (Azuma, N. et al., (1993) Nature  :76-79; Freeman (1993a) Science
:76-79; Freeman (1993a) Science  :909-911; Freeman. G.J. et al., (1993b) J.Exp. Med.
:909-911; Freeman. G.J. et al., (1993b) J.Exp. Med.  :2185-2192; Hathcock, K.L.S., et al., (1994) J.Exp. Med.
:2185-2192; Hathcock, K.L.S., et al., (1994) J.Exp. Med.  :631-640; Lenschow, D.J. et al., (1993) PNAS USA
:631-640; Lenschow, D.J. et al., (1993) PNAS USA  :11054-11058; Ravi-Wolf, Z., et al., (1993) PNAS USA
:11054-11058; Ravi-Wolf, Z., et al., (1993) PNAS USA  :11182-11186; Wu, Y., et al., (1993) J.Exp. Med.
:11182-11186; Wu, Y., et al., (1993) J.Exp. Med.  :1789-1793).
:1789-1793).
Эта молекула, известная сегодня как CD86 (Caux, С., et al., (1994) J.Exp. Med. 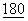 :1841-1848), но называемая также В7-0 (Azuma et al., 1993, supra) или В7-2 (Freeman et al., 1993a, supra), имеет в своей внеклеточной области около 25% идентичности по последовательности с CD80 (Azuma et al., 1993, supra; Freeman et al., 1993a, supra, 1993b, supra). Клетки, трансфицированные CD86, запускают СD28-обусловленные Т-клеточные реакции (Azuma et al., 1993, supra; Freeman et al., 1993a, 1993b, supra).
:1841-1848), но называемая также В7-0 (Azuma et al., 1993, supra) или В7-2 (Freeman et al., 1993a, supra), имеет в своей внеклеточной области около 25% идентичности по последовательности с CD80 (Azuma et al., 1993, supra; Freeman et al., 1993a, supra, 1993b, supra). Клетки, трансфицированные CD86, запускают СD28-обусловленные Т-клеточные реакции (Azuma et al., 1993, supra; Freeman et al., 1993a, 1993b, supra).
Предметом нескольких исследований явилось сравнение экспрессии CD80 и CD86 (Azuma et al., 1993, supra; Hathcock et al., 1994; supra; Larsen, C.P., et al., (1994) J.Immunol. 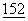 :5208-5219; Stack, R.M. et al., (1994) J.Immunol.
:5208-5219; Stack, R.M. et al., (1994) J.Immunol. 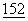 :5723-5733). Имеющиеся данные свидетельствуют о том, что экспрессия CD80 и CD86 регулируется раздельно, и что при иммунном ответе экспрессия CD86 предшествует экспрессии CD80.
:5723-5733). Имеющиеся данные свидетельствуют о том, что экспрессия CD80 и CD86 регулируется раздельно, и что при иммунном ответе экспрессия CD86 предшествует экспрессии CD80.
Были сконструированы растворимые формы CD28 и CTLA4 путем слияния вариабельно (v)-подобных внеклеточных доменов CD28 и CTLA4 с константными доменами иммуноглобулинов (Ig), что привело к образованию CD28Ig и CTLA4Ig. CTLA4Ig связывается с CD80+ и CD86+ клетками более сильно, чем CD28Ig (Linsley, P. et al., (1994) Immunity 1:793-80). Многие зависимые от Т-клеток иммунные реакции как in vitro, так и in vivo, блокируются CTLA4Ig. (Linsley et al., (1991b), supra; Linsley, P.S. et al., (1992a) Science 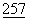 :792-795; Linsley, P.S. et al., (1992b) J.Exp.Med.
:792-795; Linsley, P.S. et al., (1992b) J.Exp.Med. 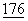 :1595-1604; Lenschow, D.J. et al., (1992), Science
:1595-1604; Lenschow, D.J. et al., (1992), Science 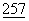 :789-792; Tan, P. et al., (1992) J.Exp.Med.
:789-792; Tan, P. et al., (1992) J.Exp.Med. 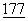 :165-173; Turka, L.A. (1992) PNAS USA
:165-173; Turka, L.A. (1992) PNAS USA 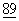 :11102-11105).
:11102-11105).
Peach et al (J.Exp.Med. (1994) 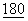 :2049-2058) идентифицировали районы внеклеточного домена CTLA4, которые важны для сильного связывания с CD80. В частности, гексапетидный мотив (MYPPPY) в определяющей комплементарность области 3 (CDR3-подобной области) был определен как полностью консервативный во всех членах семейства CD28 и CTLA4. Аланин-сканирующий мутагенез этого мотива в CTLA4 и отдельных остатков в CD28Ig снижал или отменял связывание с CD80.
:2049-2058) идентифицировали районы внеклеточного домена CTLA4, которые важны для сильного связывания с CD80. В частности, гексапетидный мотив (MYPPPY) в определяющей комплементарность области 3 (CDR3-подобной области) был определен как полностью консервативный во всех членах семейства CD28 и CTLA4. Аланин-сканирующий мутагенез этого мотива в CTLA4 и отдельных остатков в CD28Ig снижал или отменял связывание с CD80.
Были также сконструированы химерные молекулы взаимозамененными гомологичными областями CTLA4 и CD28. Молекулы HS4, HS4-A и HS4-B были получены переносом СDR3-подобных областей CTLA4, которые также содержали часть карбокситерминальной области с отдельными неконсервативными аминокислотными остатками, на CD28Ig. Эти гомологичные мутанты проявили более высокую авидность связывания с CD80 по сравнению с CD28.
В другой группе химерных гомологичных мутантов CDR1-подобная область CTLA4, которая неконсервативна в CD28 и которая пространственно прилегает к CDR3-подобной области, была перенесена на HS4 и HS4-A. Эти химерные гомологичные мутантные молекулы (oбoзначeнныe HS7 и HS8) проявили еще большую авидность связывания с CD80.
Были также получены химерные гомологичные мутантные молекулы путем переноса на HS7 и HS8 CDR2-подобной области CTLA4, но эта комбинация не привела к увеличению авидности связывания CD80. Таким образом, определено, что мотив MYPPPY CTLA4 и CD28 является критическим для связывания CD80, но определенные неконсервативные аминокислотные остатки в CDR1- и CDR3-подобных районах также ответственны за повышенную авидность связывания CTLA4 с CD86.
Показано, что CTLA4Ig эффективно блокирует CD80-ассоциированную Т-клеточную костимуляцию, но не столь эффективен при блокировании CD86-ассоциированных реакций. Были сконструированы растворимые мутантные молекулы CTLA4, обладающие большей авидностью к CD86, чем CTLA4 дикого типа, способные лучше блокировать прайминг антиген-специфических активированных клеток, чем CTLA4Ig.
Сайт-направленный мутагенез и новая процедура скрининга были использованы для идентификации нескольких мутаций во внеклеточном домене CTLA4, которые предпочтительно повышают авидность связывания CD86. Эти молекулы могут служить основой улучшенных фармацевтических композиций для иммуносупрессии и терапии рака, чем ранее известные растворимые формы CTLA4.
Краткое описание изобретения
Объектом изобретения является растворимые мутантные молекулы CTLA4, которые связываются с антигеном CD86 с большей авидностью, чем CTLA4 дикого типа.
В одном из вариантов осуществления изобретения мутантная молекула обозначена LEA29Y. LEA29Y связывается с CD86 приблизительно в 2 раза более авидно, чем CTLA4Ig дикого типа (обозначаемый далее как CTLA4Ig). Это более сильное связывание обусловливает тот факт, что LEA29Y в 10 раз более эффективен в блокировании иммунных реакций, чем CTLA4Ig.
В другом варианте осуществления изобретения мутантная молекула обозначена L106E. L106E также связывается с CD86 более авидно, чем CTLA4Ig.
Краткое описание чертежей
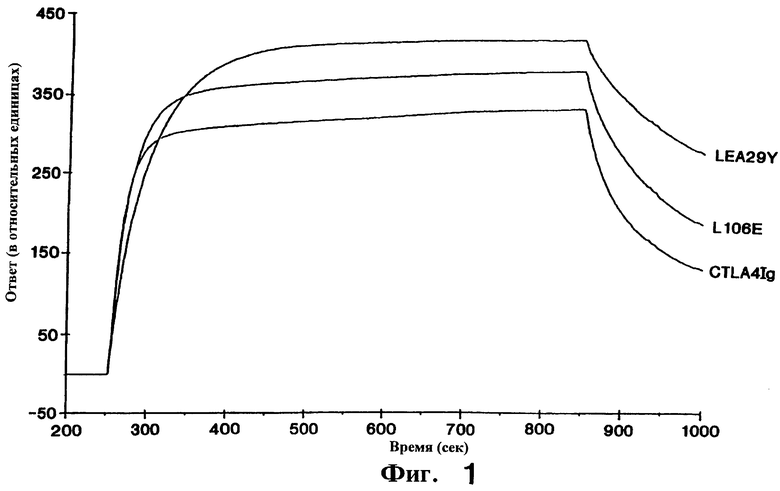
Фиг.1: Анализ равновесного связывания LEA29Y, L106E и CTLA4Ig дикого типа с CD86Ig. Были определены константы равновесного связывания (Kd), приведенные в таблице. Более низкое значение Kd для LEA29Y (2.6), чем для L106E (3.4) или CTLA4Ig (5.2) указывает на более высокую авидность связывания с CD86Ig. Все три молекулы имели сходные константы равновесного связывания с CD80Ig.
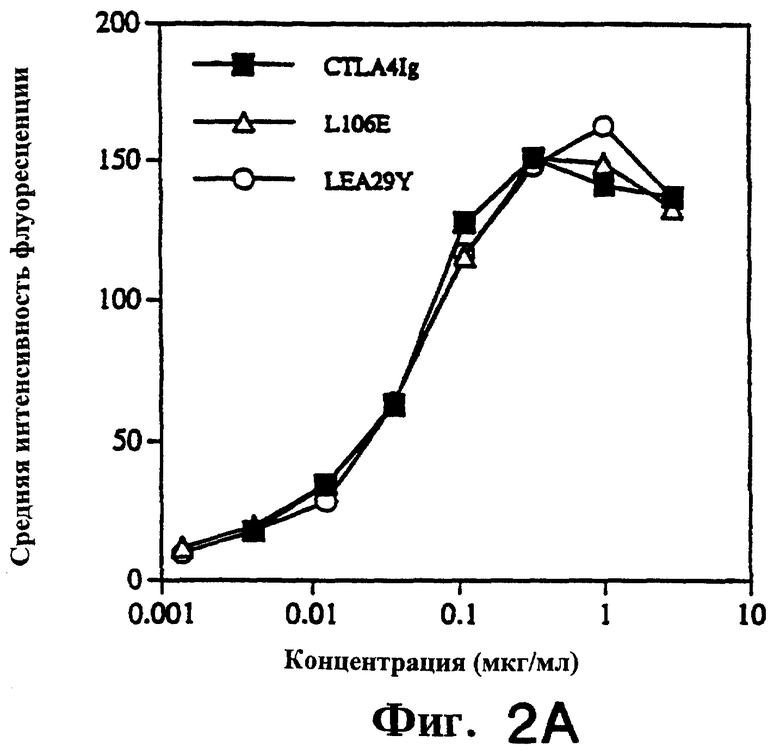
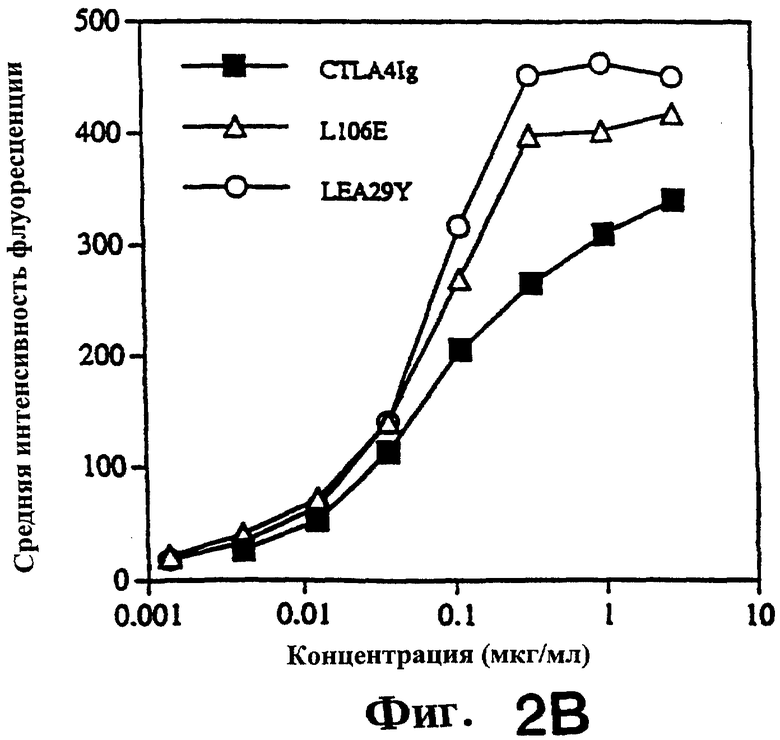
Фиг.2: Анализ проточной цитофлуориметрией показывает, что LEA29Y и L106E связываются с клетками СНО, стабильно трансфицированными CD86 человека, сильнее, чем CTLA4Ig. Связывание каждого белка с клетками СНО, трансфицированными CD80 человека, было аналогичным.
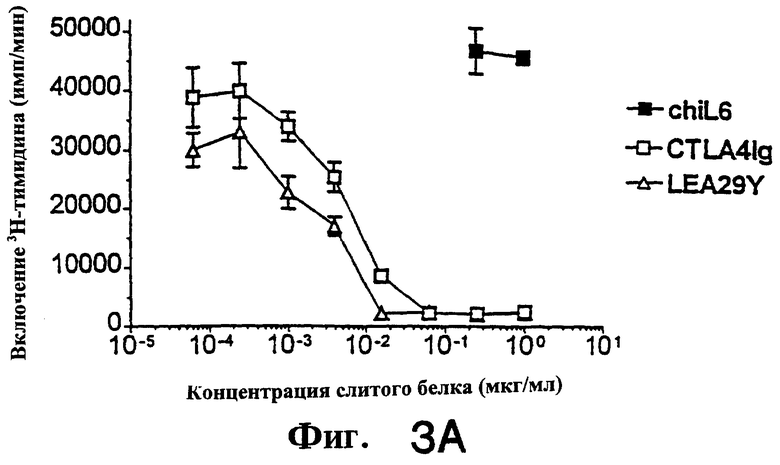
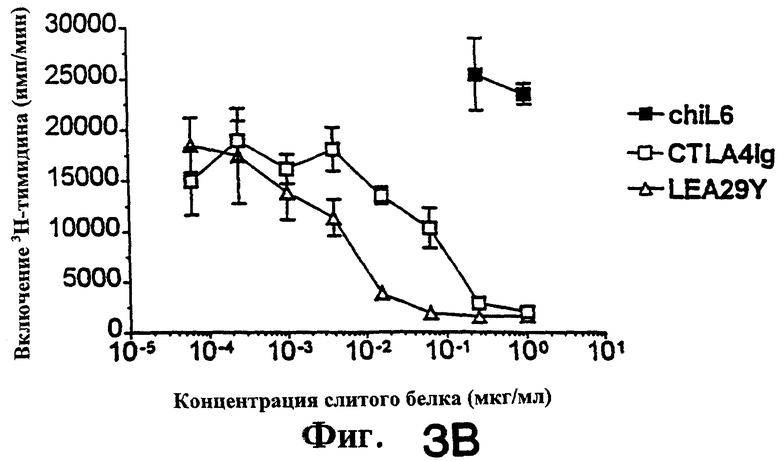
Фиг.3: Функциональные тесты in vitro показывают, что LEA29Y примерно в 10 раз более эффективен, чем CTLA4Ig, при подавлении пролиферации Т-клеток человека, обработанных CD86+ФГА. Подавление пролиферации Т-клеток человека, обработанных CD80+ФГА, было примерно одинаковым для CTLA4Ig и LEA29Y.
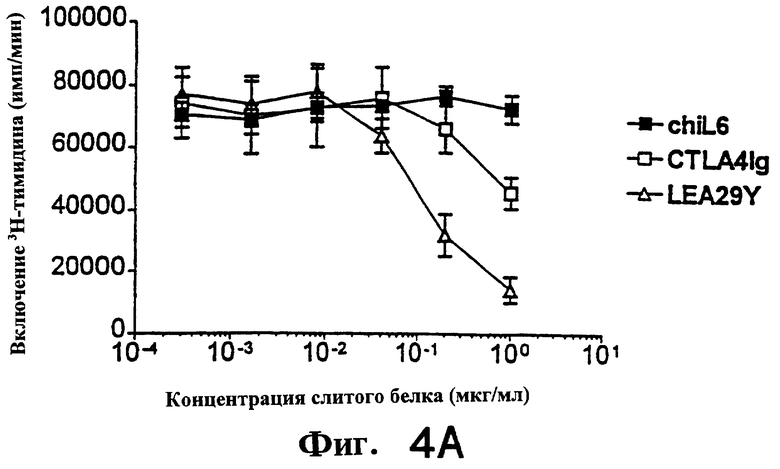
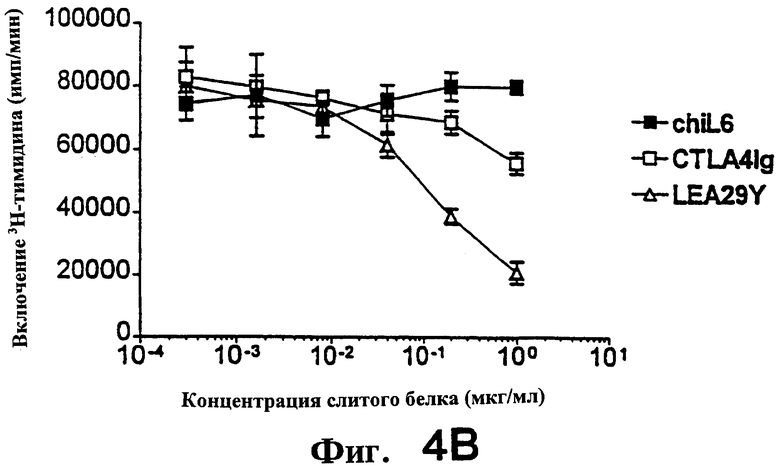
Фиг.4: LEA29Y примерно в 10 раз более эффективен, чем CTLA4Ig, при подавлении продукции цитокинов ИЛ-2, ИЛ-4 и К-интерферона аллостимулированными Т-клетками человека.
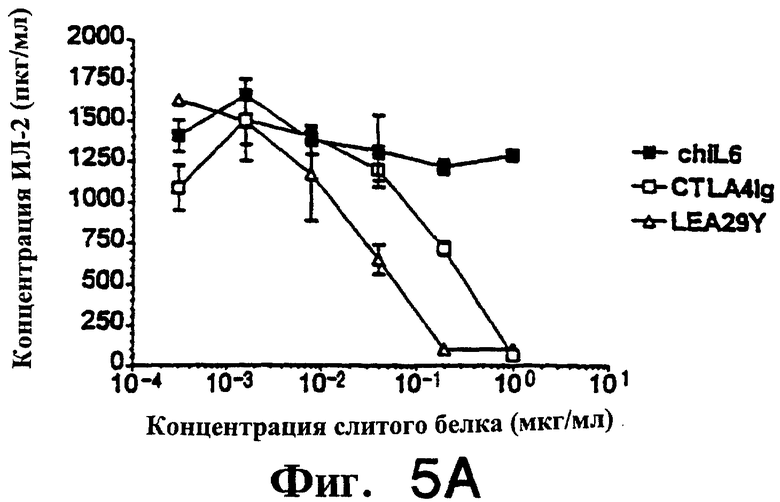
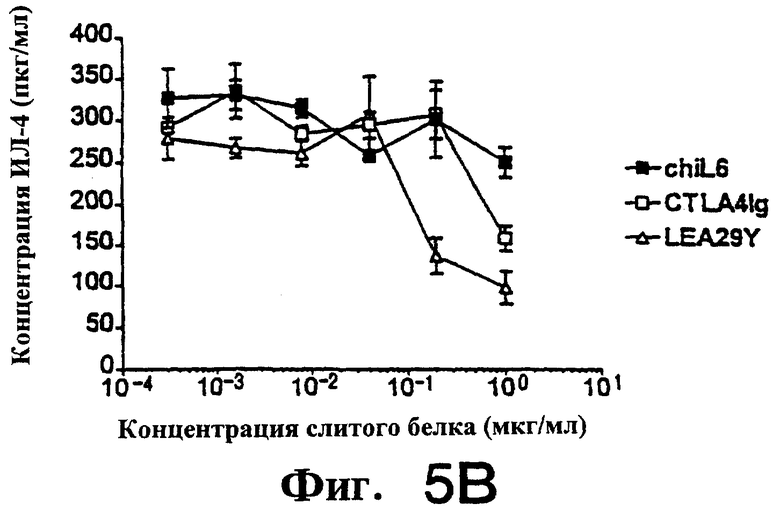
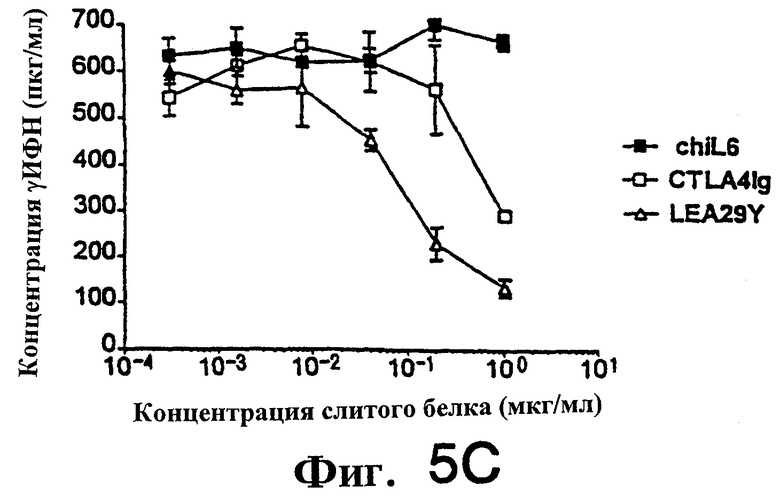
Фиг.5: LEA29Y примерно в 5-7 раз более эффективен, чем CTLA4Ig, при подавлении продукции цитокинов ИЛ-2, ИЛ-4 и К-интерферона аллостимулированными Т-клетками человека.
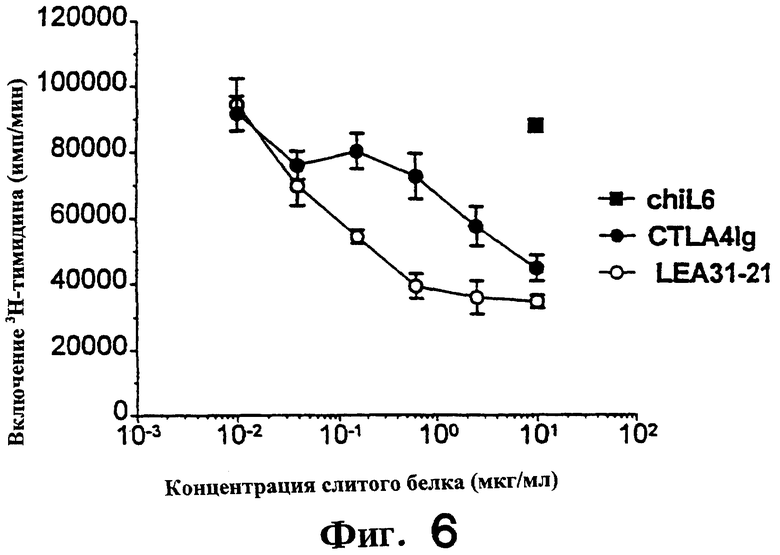
Фиг.6: LEA29Y примерно в 10 раз более эффективен, чем CTLA4Ig, при подавлении пролиферации ФГА-стимулированных PBMC'S обезьяны.
Фиг.7: отражает полную аминокислотную последовательность, кодирующую растворимую молекулу CTLA4.
Подробное описание изобретения
Определения
В контексте настоящей заявки следующие термины имеют следующие значения.
Термин "мутантная молекула CTLA4" обозначает молекулу, включающую по меньшей мере внеклеточный домен CTLA4 или любую его часть, которая распознает и связывает CD86. Молекула мутирована таким образом, что проявляет более высокую авидность связывания CD86, чем CTLA4 дикого типа. Она может включать биологически или химически активную нe-CTLA4 молекулу в свой состав или эта вторая молекула может быть присоединена к первой. Молекула может быть растворимой (т.е. циркулирующей) или связанной на поверхности.
Термин "CTLA4 дикого типа" обозначает естественно встречающийся CTLA4 или CTLA4Ig, описанный Linsley et al., (1989), supra.
Композиции, полученные согласно изобретению
В изобретении раскрыты растворимые мутантные молекулы CTLA4, которые связываются с антигеном CD86 с большей авидностью, чем CTLA4Ig. Растворимые мутантные молекулы CTLA4, имеющие более высокую авидность к CD86, чем CTLA4 дикого типа, будут способны лучше блокировать прайминг антиген-специфических активированных клеток, чем CTLA4Ig.
Согласно одному из вариантов осуществления изобретения растворимая мутантная молекула CTLA4 имеет аминокислотную последовательность, приведенную на фиг.7. В частности, аминокислота в положении 29, обозначенная Хаа, выбрана из группы, включающей аланин, лейцин, фенилаланин, триптофан и тирозин. Далее, аминокислота в положении 106, обозначенная Yaa, выбрана из группы, включающей глутаминовую кислоту и лейцин.
Согласно другому варианту осуществления изобретения растворимая мутантная молекула CTLA4 состоит из 187 аминокислот, приведенных в SEQ ID NО:1, начиная с аланина в положении 1 и кончая аспарагином в положении 187. В этом варианте осуществления изобретения Хаа является тирозином, а Yaa является глутаминовой кислотой (обозначен как LEA29Y). Альтернативно, Хаа является аланином, а Yaa является глутаминовой кислотой (обозначен как L106E).
В изобретении также заявлены растворимые мутантные молекулы CTLA4, имеющие первую аминокислотную последовательность, соответствующую внеклеточному домену мутантного CTLA4, как показано на фиг.7, и вторую аминокислотную последовательность, соответствующую сущности, которая изменяет аффинность и/или валентность мутантной молекулы CTLA4 при связывании антигена CD86.
В соответствии с настоящим изобретением данная сущность может быть константной областью иммуноглобулина или ее фрагментом. Для применения in vivo предпочтительно, чтобы константная область иммуноглобулина не вызывала неблагоприятного иммунного ответа у субъекта. Например, согласно клиническим протоколам предпочтительно, чтобы мутантные молекулы содержали константные области иммуноглобулинов человека или обезьяны. Одним из примеров приемлемых областей иммуноглобулинов служит С(гамма) 1. Возможно использование и других изотипов. Кроме того, возможно применение других слабо иммуногенных или неиммуногенных константных областей иммуноглобулинов.
В настоящем изобретении также заявлены растворимые мутантные слитые белки CTLA4, предпочтительно реагирующие с антигеном CD86 по сравнению с CTLA4 дикого типа, при этом белок имеет первую аминокислотную последовательность, соответствующую внеклеточному домену мутантного CTLA4, как показано на фиг.7, и вторую аминокислотную последовательность, соответствующую районам стыка, СН2 и СН3 иммуноглобулина человека, например Сγ 1.
В изобретении также заявлен растворимый мутантный рецепторный белок CTLA4, имеющий аминокислотную последовательность, приведенную на фиг.7 (SEQ ID NO:1), который предпочтительно распознает и связывает CD86 с авидностью по меньшей мере в пять раз большей, чем CTLA4 дикого типа.
Дополнительно, в изобретении заявлена растворимая мутантная молекула CTLA4, содержащая 187 аминокислот, приведенных в SEQ ID NО:1, начиная с аланина в положении 1 и кончая аспарагином в положении 187.
Кроме того, в изобретении заявлена растворимая мутантная молекула CTLA4, имеющая (а) первую аминокислотную последовательность мембранного гликопротеина, например CD28, CD86, CD80, CD40 и gp39, которая блокирует пролиферацию Т-клеток, слитую со второй аминокислотной последовательностью; (б) вторую аминокислотную последовательность, являющуюся фрагментом внеклеточного домена мутантного CTLA4, который блокирует пролиферацию Т-клеток, как показано на фиг.7; и (в) третью аминокислотную последовательность, которая выступает в качестве идентификационной метки или повышает растворимость молекулы. Например, третья аминокислотная последовательность может включать аминокислотные остатки, соответствующие районам стыка, СН2 и СН3 областям неиммуногенной молекулы иммуноглобулина. Примерами приемлемых молекул иммуноглобулинов служат без ограничения перечисленными иммуноглобулины человека или обезьяны, например С(гамма) 1. Возможно использование и других изотипов.
Мутантному CTLA4 (обозначаемому также как "молекула мутантного CTLA4") может быть обеспечена растворимость путем соединения со второй молекулой. Вторая молекула может усиливать растворимость CTLA4 или служить маркерным "ярлыком" для идентификации. Примерами примелемых вторых молекул могут служить без ограничения перечисленными молекула р97, молекула env gp120, молекула Е7 и молекула ova (Dash, В., et al., J.Gen Virol. 1994 June, 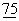 (Pt 6):1389-97; Ikeda, Т., et al., Gene, 1994 Jan 28,
(Pt 6):1389-97; Ikeda, Т., et al., Gene, 1994 Jan 28, 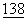 (1-2):193-6; Falk, К., et al., Cell. Immunol. 1993
(1-2):193-6; Falk, К., et al., Cell. Immunol. 1993 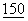 (2):447-52; Fujisaka, К. et al., Virology 1994
(2):447-52; Fujisaka, К. et al., Virology 1994  (2):789-93). Возможно использование и других молекул (Gerard, С. et al., Neuroscience 1994
(2):789-93). Возможно использование и других молекул (Gerard, С. et al., Neuroscience 1994  (3):721; Byrn, R., et al., 1989
(3):721; Byrn, R., et al., 1989  (10):4370; Smith, D. et al., Science 1987
(10):4370; Smith, D. et al., Science 1987  :1704; Laskey, L.Science 1996
:1704; Laskey, L.Science 1996  :209).
:209).
В изобретении также заявлены молекулы нуклеиновых кислот, кодирующие аминокислотную последовательность растворимых мутантных молекул CTLA4. Согласно одному из вариантов осуществления изобретения молекула нуклеиновой кислоты является ДНК (например кДНК) или их гибридами. Альтернативно, молекула является РНК или их гибридами.
Дополнительно, в изобретении заявлена плазмида, содержащая кДНК согласно изобретению. Заявлена также система "хозяин-вектор". Эта система состоит из плазмиды согласно изобретению в приемлемой клетке-хозяине. К примерам приемлемых клеток-хозяев относятся без ограничений перечисленными бактериальные клетки и эукариотические клетки.
В изобретении также заявлен способ получения белка, предусматривающий выращивание системы "хозяин-вектор" таким образом, что в клетке-хозяине образуется белок, с последующим выделением данного белка.
Дополнительно, в изобретении также заявлен способ регулирования функциональных взаимодействий CTLA4- и CD28-положительных Т-клеточных взаимодействий с CD80- и/или СD86-положительными клетками. Данным способом предусмотрено приведение в контакт CD80- и/или СD86-положительных клеток с растворимой мутантной молекулой CTLA4, полученной согласно изобретению, с образованием комплексов CTLA4/CD80 и/или CTLA4/CD86. Данные комплексы препятствуют реакции эндогенного антигена CTLA4 с CD80 и/или CD86. Согласно одному из вариантов осуществления изобретения растворимая мутантная молекула CTLA4 является слитым белком, который содержит по меньшей мере часть внеклеточного домена мутантного CTLA4. Согласно другому варианту осуществления изобретения растворимая мутантная молекула CTLA4 является слитым белком CTLA4Ig, включающим первую аминокислотную последовательность, содержащую аминокислотные остатки с положения 1 до положения 125 аминокислотной последовательности, соответствующей внеклеточному домену CTLA4, и вторую аминокислотную последовательность, содержащую аминокислотные остатки, соответствующие районам стыка, областям СН2 и СН3 иммуноглобулина человека гамма, т.е. Сγ , как показано в SEQ ID NО:1.
В соответствии с практикой осуществления изобретения CD86-пoлoжитeльныe клетки приводят в контакт с фрагментами или производными растворимой мутантной молекулы CTLA4. Альтернативно, растворимая мутантная молекула CTLA4 является слитым гибридным белком CD28Ig/CTLA4Ig, имеющим первую аминокислотную последовательность, соответствующую части внеклеточного домена рецептора CD28, слитую со второй аминокислотной последовательностью, соответствующей части внеклеточного домена мутантного рецептора CTLA4 (SEQ ID NO 1), и третьей аминокислотной последовательностью, соответствующей районам стыка, СН2 и СН3 иммуноглобулина человека Cγ 1.
В изобретении также заявлен способ лечения заболеваний иммунной системы, обусловленных взаимодействием CD28- и/или СTLА4-положительных клеток с CD86/CD80-положительными дендритными клетками. Согласно одному из вариантов осуществления изобретения подавляются Т-клеточные взаимодействия.
Этот способ предусматривает введение субъекту растворимой мутантной молекулы CTLA4 согласно изобретению для регулирования Т-клеточных взаимодействий с CD80- и/или CD86-положительными клетками. В соответствии с практикой осуществления изобретения растворимая мутантная молекула CTLA4 может быть слитым белком CTLA4Ig. Альтернативно, растворимая мутантная молекула CTLA4 является мутантным гибридом, в котором мембранный гликопротеин соединен с мутантным CTLA4.
В изобретении также заявлен способ подавления у субъекта реакции "трансплантат против хозяина". Этот способ предусматривает введение субъекту растворимой мутантной молекулы CTLA4 согласно изобретению вместе с лигандом, реагирующим с ИЛ-4.
Согласно изобретению возможно применение мутантных молекул CTLA4 в сочетании с другими иммуносупрессантами, например циклоспорином (Mathiesen, Prolonged Survival and Vascularization of Xenografted Human Glioblastoma Cells in the Central Nervous System of Cyclosporm A-Treated Rats, Cancer Lett., 44(2), 151-6 (1989), преднизоном, азатиоприном и метотрексатом (R.Handschumacher "Chapter 53: Drugs Used for Immunosuppession" pages 1264-1276). Возможно применение других иммуносупрессантов.
Экспрессия мутантных молекул CTLA4 в прокариотических клетках
Для отдельных целей предпочтительной является экспрессия мутантных молекул CTLA4 в прокариотических клетках.
Прокариоты наиболее часто представлены различными штаммами бактерий. Бактерии могут быть грамположительными или грамотрицательными. Обычно, предпочтительны такие грамотрицательные бактерии, как 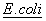 . Могут использоваться и другие штаммы микроорганизмов.
. Могут использоваться и другие штаммы микроорганизмов.
Последовательности, кодирующие мутантные молекулы CTLA4, могут быть встроены в вектор, сконструированный для экспрессии чужеродных последовательностей в таких прокариотических клетках, как клетки 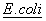 . Эти векторы могут содержать обычно используемые контрольные прокариотические последовательности, к которым относятся промоторы для инициации транскрипции, дополнительно - с оператором, вместе с последовательностями сайта связывания рибосом, включая такие обычно используемые промоторы, как бета-лактамазная (пенницилиназная) и лактозная (lac) промоторные системы (Chang et al., Nature
. Эти векторы могут содержать обычно используемые контрольные прокариотические последовательности, к которым относятся промоторы для инициации транскрипции, дополнительно - с оператором, вместе с последовательностями сайта связывания рибосом, включая такие обычно используемые промоторы, как бета-лактамазная (пенницилиназная) и лактозная (lac) промоторные системы (Chang et al., Nature  :1056 (1977), триптофановая промоторная система (trp) (Goeddel et al., Nucleic Acids Res.
:1056 (1977), триптофановая промоторная система (trp) (Goeddel et al., Nucleic Acids Res.  :4057 (1980), промотор РL, полученный из фага лямбда, и сайт связывания рибосом N-гена (Shimatake et al., Nature
:4057 (1980), промотор РL, полученный из фага лямбда, и сайт связывания рибосом N-гена (Shimatake et al., Nature  :128 (1981).
:128 (1981).
Такие векторы могут также содержать начала репликации и селективные маркеры, такие как бета-лактамазный или неомицинфосфотрансферазный гены, обеспечивающие устойчивость к антибиотикам, так что векторы могут реплицироваться в бактериях и клетках. Поэтому несущие данную плазмиду клетки могут быть отобраны при выращивании в присутствии ампициллина или канамицина.
Экспрессирующую плазмиду можно ввести в прокариотические клетки различными стандартными методами, включая, без ограничения перечисленными, СаСl2-шок (см. Cohen, Proc. Natl. Acad. Sci. USA (1972)  :2110 и Sambrook et al., (eds.). Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor Press, (1989) и электропорацию.
:2110 и Sambrook et al., (eds.). Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor Press, (1989) и электропорацию.
Экспрессия мутантных молекул CTLA4 в эукариотических клетках
В соответствии с практикой осуществления изобретения эукариотические клетки также служат приемлемыми клетками-хозяевами.
К примерам эукариотических клеток относятся любые клетки животных, первичные или иммортализованные, дрожжи (например, Saccharomvces cerevisae, Saccharomyces pombe и Pichia pastoris), и клетки растений. Клетки миеломы, клетки COS и СНО служат примерами животных клеток, используемых в качестве хозяев. Примерами растительных хозяев могут служить табак (целые растения или каллус табака), клетки кукурузы, сои и риса. Приемлемы также семена кукурузы, сои и риса.
Последовательности, кодирующие мутантные молекулы CTLA4, могут быть встроены в вектор, сконструированный для экспрессии чужеродных последовательностей в эукариотических хозяевах. Регуляторные элементы вектора могут быть различными в зависимости от того, какой конкретный эукариотический хозяин используется.
К обычно используемым контрольным последовательностям относятся промоторы и контрольные последовательности, совместимые с клетками млекопитающих, таких как, например, промотор цитомегаловируса (CMV) (в векторе CDM8) и промотор вируса саркомы птиц (ASV) (вектор π LN). К другим обычно используемым промоторам относятся промоторы ранних и поздних генов вируса SV40 (Fiers, et al., Nature  :113 (1973)) или другие вирусные промоторы, такие как полученные из вируса полиомы, аденовируса 2 и вируса бычьей папилломы. Может также применяться индуцибельный промотор, такой как hMTII (Karin et al., Nature
:113 (1973)) или другие вирусные промоторы, такие как полученные из вируса полиомы, аденовируса 2 и вируса бычьей папилломы. Может также применяться индуцибельный промотор, такой как hMTII (Karin et al., Nature 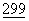 :797-802 (1982)).
:797-802 (1982)).
Векторы для экспрессии мутантных молекул CTLA4 в эукариотах могут также содержать последовательности, называемые энхансерными областями. Они важны для оптимизации экспрессии гена и обнаруживаются как "выше", так и "ниже" области промотора.
Последовательности, кодирующие мутантные молекулы CTLA4, могут интегрировать в геном эукариотической клетки-хозяина и реплицироваться вместе с хозяйским геномом. Альтернативно, вектор, несущий гены мутантных молекул CTLA4, может содержать начало репликации, делающее возможной экстрахромосомную репликацию.
Для экспрессии последовательностей в Saccharomyces cerevisae можно использовать начало репликации эндогенной плазмиды дрожжей, 2μ кольца (Broach, Meth. Enz. 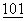 :307 (1983)). Альтернативно, могут быть использованы последовательности из генома дрожжей, обеспечивающие автономную репликацию (см., например, Stinchcomb et al., Nature
:307 (1983)). Альтернативно, могут быть использованы последовательности из генома дрожжей, обеспечивающие автономную репликацию (см., например, Stinchcomb et al., Nature 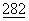 :39 (1979); Tschemper et al., Gene
:39 (1979); Tschemper et al., Gene 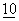 :157 (1980); and Clarke et al., Meth. Enz.
:157 (1980); and Clarke et al., Meth. Enz.  :300 (1983)).
:300 (1983)).
К последовательностям, контролирующим транскрипцию в дрожжевых векторах, относятся промоторы генов, участвующих в синтезе гликолитических ферментов (Hess et al., J.Adv.Enzyme Reg. 7:149 (1968); Holland et al., Biochemistry 17:4900 (1978)). К другим известным из уровня техники промоторам относятся цитомегаловирусный (CMV) промотор, содержащийся в векторе CDM8 (Toyama and Okayama, FEBS  :217-221 (1990)); промотор 3-фосфоглицераткиназы (Hitzeman et al., J.Biol. Chem.
:217-221 (1990)); промотор 3-фосфоглицераткиназы (Hitzeman et al., J.Biol. Chem.  :2073 (1980)) и промоторы других гликолитических ферментов.
:2073 (1980)) и промоторы других гликолитических ферментов.
К другим промоторам относятся индуцибельные промоторы, которые можно регулировать внешними воздействиями или изменениями в ростовой среде клеток. К этим индуцибельным промоторам относятся промоторы генов теплового шока, алькогольдегидрогеназы 2, изоцитохрома С, кислой фосфатазы, ферментов, участвующих в метаболизме азота, и ферментов, ответственных за утилизацию мальтозы и галактозы.
Регуляторные последовательности могут быть помещены на 3'-конец кодирующих последовательностей. Эти последовательности могут стабилизировать информационную РНК. Такие терминаторы обнаружены в 3'-нетранслируемых областях, прилегающих к кодирующим последовательностям нескольких генов дрожжей и млекопитающих.
Примерами векторов для растений и растительных клеток являются без ограничения перечисленными Тi плазмиды агробактерий, вирус мозаики цветной капусты (CaVM), вирус золотой мозаики томатов (TGVM).
Общие принципы трансформации клеточных хозяйских систем млекопитающих были описаны Axel (Патент США №4399216, выданный 16 августа 1983). Клетки млекопитающих можно трансформировать методами, к которым относятся без ограничения перечисленными трансфекция в присутствии фосфата кальция, электропорация или трансдукция вирусными векторами.
К способам введения чужеродных последовательностей ДНК в геном растений и дрожжей относятся (1) механические методы, такие как микроинъекция ДНК в единичные клетки или протопласты, перемешивание клеток со стеклянными бусами в присутствие ДНК или "стрельба" в клетки или протопласты покрытыми ДНК вольфрамовыми или золотыми шариками; (2) введение ДНК в протопласты, проницаемые для макромолекул после обработки полиэтиленгликолем или высоковольтными электрическими импульсами (электропорация); или (3) использование липосом (содержащих кДНК) для слияния с протопластами.
Идентификация и выделение мутантных молекул CTLA4
Экспрессию мутантных молекул CTLA4 выявляли SDS-PAGE с окрашиванием Кумасси и иммуноблоттингом с использованием связывающих CTLA4 антител. Выделение белка проводили стандартными методами очистки белков, например аффинной хроматографией или ионообменной хроматографией с получением по существу очищенного продукта (R.Scopes Protein Purification, Principles and Practice, Third Edition Springer-Verlag (1994)).
В одном из вариантов осуществления изобретения были использованы сайт-направленный мутазенез и новая процедура скрининга с целью идентификации нескольких мутаций во внеклеточном домене CTLA4, которые улучшают авидность связывания с CD86, при этом почти не затрагивая связывание с CD80. В данном варианте мутации проводили по остаткам петли CDR1 (с серина 25 до аргинина 33) С'-цепи (аланин 49 и треонин 51), F-цепи (лизин 95Ь глутаминовая кислота 97 и лейцин 98) и в CDR3 по положениям с метионина 99 по тирозин 104, с тирозина 105 по глицин 109 и G-цепи по положениям глутами 114, тирозин 116 и изолейцин 118. Эти сайты были выбраны на основе исследования слитых белков CD28/CTLA4 (J.Exp.Med., 1994,  :2049:2058), а также модели, предсказывающей, что аминокислотные остатки боковых цепей должны быть погружены в растворитель, а также отсутствие идентичности аминокислотных остатков или гомологии по отдельным положения между CD28 и CTLA4. Также, любые остатки, находящиеся в пространственной близости (от 5 до 20 ангстрем) к идентифицированным остаткам, считаются частью настоящего изобретения.
:2049:2058), а также модели, предсказывающей, что аминокислотные остатки боковых цепей должны быть погружены в растворитель, а также отсутствие идентичности аминокислотных остатков или гомологии по отдельным положения между CD28 и CTLA4. Также, любые остатки, находящиеся в пространственной близости (от 5 до 20 ангстрем) к идентифицированным остаткам, считаются частью настоящего изобретения.
Для синтеза и скрининга мутантных молекул CTLA4 с измененными аффинностями к CD86 применяли двухэтапную стратегию. Эксперименты были направлены на получение библиотеки мутаций в конкретном кодоне внеклеточной части CTLA4 с последующим скринингом мутантов при помощи анализа BIAcore для идентификации мутантов с измененной реактивностью с CD80 или CD86.
Преимущества изобретения
Растворимые мутантные молекулы CTLA4, обладающие большей авидностью к СВ86, чем CTLA4 дикого типа, должны лучше блокировать прайминг антиген-специфических активированных Т-клеток, чем CTLA4Ig.
Кроме того, стоимость получения CTLA4Ig очень высока. Высоко авидные мутантные молекулы CTLA4Ig, обладающие более сильными иммуносупрессивными свойствами, могут применяться в клинике в значительно более низких дозах, чем CTLA4Ig, для достижения аналогичных уровней иммуносупрессии. Растворимые мутантные молекулы CTLA4, например, LEA29H могут быть весьма экономичны.
Следующий пример приведен с целью иллюстрации настоящего изобретения, а также для помощи специалистам в получении и применении аналогичных молекул. Данный пример никоим образом не ограничивает объем изобретения.
Пример 1
Проводящиеся исследования in vitro и in vivo показывают, что CTLA4Ig сам по себе не способен полностью блокировать прайминг антиген-специфических активированных Т-клеток. Эксперименты in vitro с CTLA4Ig и моноклональными антителами, специфичными к CD80 или CD86, с определением подавления пролиферации Т-клеток показывают, что анти-СD80 моноклональные антитела не усиливают подавление пролиферации Т-клеток под действием CTLA4Ig. Однако анти-СD86 моноклональные антитела обладают таким эффектом, что указывает на тот факт, что CTLA4Ig не столь эффективен в блокировании СD86-обусловленных реакций. Эти данные служат подтверждением ранних результатов Linsley et al, (Immunity, 1994, 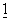 :793-801) о том, что для подавления СD80-обусловленных клеточных реакций требуются примерно в 100 раз более низкие концентрации CTLA4Ig, чем для подавления СD86-обусловленных реакций. На основе этих наблюдений было сделано предположение о том, что растворимые мутантные молекулы CTLA4, обладающие большей авидностью к СВ86, чем CTLA4 дикого типа, должны лучше блокировать прайминг антиген-специфических активированных Т-клеток, чем CTLA4Ig.
:793-801) о том, что для подавления СD80-обусловленных клеточных реакций требуются примерно в 100 раз более низкие концентрации CTLA4Ig, чем для подавления СD86-обусловленных реакций. На основе этих наблюдений было сделано предположение о том, что растворимые мутантные молекулы CTLA4, обладающие большей авидностью к СВ86, чем CTLA4 дикого типа, должны лучше блокировать прайминг антиген-специфических активированных Т-клеток, чем CTLA4Ig.
В данном варианте были использованы сайт-направленный мутазенез и новая процедура скрининга с целью идентификации нескольких мутаций во внеклеточном домене CTLA4, которые улучшают авидность связывания с CD86, при этом почти не затрагивая связывание с CD80. Мутации проводили по остаткам петли CDR1 (с серина 25 до аргинина 33) С'-цепи (аланин 49 и треонин 51), F-цепи (лизин 95Ь глутаминовая кислота 97 и лейцин 98) и в CDR3 по положениям с метионина 99 по тирозин 104, с тирозина 105 по глицин 109 и G-цепи по положениям глутами 114, тирозин 116 и изолейцин 118. Эти сайты были выбраны на основе исследований химерных слитых белков CD28/CTLA4 (J.Exp.Med., 1994, 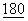 :2049:2058)), а также модели, предсказывающей, что аминокислотные остатки боковых цепей должны быть погружены в растворитель, а также отсутствие идентичности аминокислотных остатков или гомологии по отдельным положениям между CD28 и CTLA4.
:2049:2058)), а также модели, предсказывающей, что аминокислотные остатки боковых цепей должны быть погружены в растворитель, а также отсутствие идентичности аминокислотных остатков или гомологии по отдельным положениям между CD28 и CTLA4.
Методы:
Мутагенез конкретных кодонов CTLA4Ig:
Были сконструированы мутагенные праймеры для ПЦР, применимые для случайного мутагенеза конкретного кодона, дающие возможность вводить любое основание в положения 1 и 2 кодона, но только гуанин или тимин в положение 3 (XXG/T). Таким образом, специфический кодон, кодирующий аминокислоту, мог быть подвергнут случайному мутагенезу с тем, чтобы кодировать любую из 20 аминокислот. Продукты ПЦР, несущие мутации в непосредственной близости к СDR3-подобной петле CTLA4Ig (MYPPPY), рестрицировали SacI/XbaI и субклонировали в аналогично рестрипированный вектор экспрессии CTLA4Ig IILN. Для мутагенеза в районе CDR1-подобной петли CTLA4Ig в 5'-область этой петли ПЦР-направленным мутагенезом вводили "молчащий" сайт NheI. Продукты ПЦР рестрицировали NheI/XbaI и субклонировали в аналогично рестрицированный вектор экспрессии CTLA4Ig.
Получение плазмидной кДНК:
Были выращены девяносто шесть бактериальных колоний трансформантов и из каждого была выделена кДНК с использованием Biorobot 9600 (Qiagen).
Трансфекция клеток COS:
Клетки COS, выращиваемые на 24-луночных культуральных планшетах, транзиторно трансфицировали мутантным CTLA4Ig и культуральную среду собирали через три дня.
BIAcore анализ:
Кондиционированную культуральную среду клеток COS пропускали над биосенсорными чипами BIAcore, дериватизированными CD86Ig и CB80Ig и мутантные молекулы идентифицировали скоростям протока, более низким, чем в случае CTLA4Ig дикого типа. кДНК, соответствующую выбранным образцам среды, секвенировали и получали такое количество ДНК, которое было достаточным для проведения более широкомасштабной транзиторной трансфекции клеток COS, из культуральной среды которых при помощи белка А выделяли мутантный белок CTLA4Ig.
Условия анализа BIAcore и анализ данных равновесного связывания проводили, как описано J.Greene et al., (1996) JBC 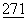 (42):26762.
(42):26762.
Данные BIAcore анализа: Исходные значения сенсограмм были нормализованы к нулевым единицам ответа (RU) до анализа. Образцы пропускали над мнимо-дериватизированными проточными ячейками для определения фоновых значений RU, поскольку значения индекса рефракции разнились значительно от раствора к раствору. Константы равновесной диссоциации (Кd) вычисляли из графика зависимости Req от С, где Req - ответ в равновесном состоянии минус ответ на мнимо-лериватизированном чипе, а С - молярная концентрация аналита. Кривые связывания анализировали с применением коммерческого программного обеспечения (Prism, GraphPAD Software).
Первоначально экспериментальные данные обрабатывали согласно модели связывания одного лиганда одним рецептором (одновалентные модель, т.е. простая лангмурова система, A+BNAB), константы равновесной ассоциации (Кd=[А]· [В]/[АВ]) вычисляли по уравнению R=Rmax·С/(Кd+С). Затем данные обсчитывали по простейшей двухвалентной модели связывания лиганда (т.е. рецептор имеет два независимых и невзаимодействующих сайта связывания, что описывается уравнением R=Rmax1·С/(Кd1+С)+Rmax2·С/(Кd2+С).
Доверительность этих двух моделей оценивали визуально при сравнении экспериментальных данных, а также статистически при помощи F-теста по суммам площадей. Обычно применялась более простая модель одновалентного связывания и только иногда модель двухвалентного связывания лучше описывала полученные результаты (р<0.1).
Анализы ассоциации и диссоциации проводили с использованием программы BIA evaluation 2.1 (Pharmacia). Константы скорости ассоциации kon определяли двумя способами исходя как из гомогенных одновалентных взаимодействий, так и параллельно, двухвалентных взаимодействий. Для одновалентных взаимодействий значения kon вычисляли по уравнению Rt=Req(1-exp-ks(t-t0)), где Rt - ответ в данный момент времени, t; Req - ответ в равновесном состоянии; t0 - время в момент инъекции; и ks=dR/dT=kon·Ckoff, где С - концентрация аналита, вычисленная для мономерных сайтов связывания. Для двухвалентных взаимодействий значения kon вычисляли по уравнению Rt=Req1(1-exp-ks1(t-t0))+Rt-Req2(1-exp-ks2(t-t0)). Для каждой модели значения kon определяли из вычисленной петли (около 70% максимальной ассоциации) на графике зависимости ks от С.
Данные по диссоциации анализировали в соответствии с моделями одного сайта (АВ=А+В) или двух сайтов (aiBj=Ai+Bj), а константы скорости (koff) вычисляли на основе наиболее совпадающих кривых. Модель одновалентного сайта применяли за исключением тех случаев, когда разности превышали приборный фон (2-10RU согласно прибору) и в этом случае применяли модель двухвалентного сайта. Полувремена занятости рецептора вычисляли по уравнению t1/2=0.693/koff.
Проточная цитофлуориметрия:
Мышиные МКА L307.4 (анти-CD80) были получены от Becton Dickinson (San Jose, California), a MKA IT2.2 (анти-В7-0 [CD86]) - от Pharmingen (San Diego, California). Для иммуноокрашивания CD80+ и/или CD86+ клетки СНО удаляли из культуральных сосудов, инкубируя их в фосфатном берном растворе, содержащем 10 мМ ЭДТА. Клетки СНО (1-10× 105) инкубировали с МКА или с иммуноглобулин-слитыми белками в среде DMEM, содержащей 10% эмбринальной телячьей сыворотки (FBS), затем отмывали и инкубировали с ФИТЦ-конъюгированными козьими антимышиными или античеловеческими иммуноглобулинами в качестве второго реагента (Tago, Burlingame, California). Затем клетки отмывали и анализировали на проточном цитофлуориметре FACScan (Becton Dickinson).
FACS-анализ связывания CTLA4Ig и мутантных молекул стабильно трансфицированными CD80+ и CD86+ клетками СНО проводили следующим образом.
CD80+ и CD86+ клетки СНО инкубировали с возрастающими концентрациями CD28Ig, отмывали и определяли связывание иммуноглобулин-слитых белков с применением ФИТЦ-конъюгированного козьего античеловеческого иммуноглобулина. Связывание CTLA4Ig измеряли тем же методом.
На фиг.2 показано, как клетки СНО (1.5× 105), трансформированные LEA29Y (кружки) и L106Е (треугольники) инкубировали с указанными концентрациями CTLA4Ig (закрашенные квадраты) 2 часа при 23° С, отмывали и инкубировали с ФИТЦ-конъюгированным козьим античеловеческим иммуноглобулином. Всего на FACScan было проанализировано связывание 5000 жизнеспособных клеток (одно определение). Среднюю интенсивность флуоресценции (MFI) определяли на основе гистограмм с использованием PC-LYSYS. Данные были скорректированы с учетом фоновой флуоресценции, определенной для клеток, инкубированных только со вторичным реагентом (MFI=7). Контрольные МКА L6 (80 мкг/мл) дали MFI<30. Данные получены в четырех независимых экспериментах.
Функциональные тесты:
CD4+ Т-клетки человека выделяли следующим образом.
CD4+ Т-клетки выделяли при помощи негативной иммуномагнитной селекции (Linsley et al., (1992) "Coexpression and functional cooperativity of CTLA4 and CD28 on activated Т lymphocytes" J. Exp. Med. 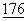 :1595-1604).
:1595-1604).
Проводили подавление стимуляции Т-клеток CD80-CHO и CD86-CHO при помощи ФГА (фиг. 3). Для тестов на стимуляцию ФГА-бласты (Linsley et al., (1991) "Binding of the B cell activation antigen B7 to CD28 costimulates Т cell proliferation and Il-2 mRNA accumulation" J.Exp.Med.  :561-570) культивировали в концентрации 4.0× 104/ячейку в присутствии или в отсутствие облученных стимуляторов (клеток СНО). CD4+ Т-клетки (8-10× 104/ячейку) культивировали в присутствии 1 нМ ФГА в присутствии или в отсутствие стимуляторов. Пролиферативный ответ определяли, добавляя 1 мкКи/ячейку [3H]-тимидина на последние 7 часов 72-часовой инкубации. Образование ИЛ-2 в кондиционированной среде (собранной спустя 24 часа после стимуляции) определяли ELISA (Biosource, Camarillo, California).
:561-570) культивировали в концентрации 4.0× 104/ячейку в присутствии или в отсутствие облученных стимуляторов (клеток СНО). CD4+ Т-клетки (8-10× 104/ячейку) культивировали в присутствии 1 нМ ФГА в присутствии или в отсутствие стимуляторов. Пролиферативный ответ определяли, добавляя 1 мкКи/ячейку [3H]-тимидина на последние 7 часов 72-часовой инкубации. Образование ИЛ-2 в кондиционированной среде (собранной спустя 24 часа после стимуляции) определяли ELISA (Biosource, Camarillo, California).
На фиг. 4 и 5 показано подавление аллостимулированных Т-клеток человека, полученных, как описано выше, и аллостимулированных В-клеточной линией человека LCL, обозначенной РМ. Т-клетки в концентрации 3.0× 104 /ячейку и РМ в концентрации 8.0× 103/ячейку. Первично аллостимулированные в течение 6 дней клетки метили [3Н]-тимидином в течение 7 часов, а затем определяли включение метки. Вторичную аллостимуляцию проводили следующим образом. Первично аллостимулированные в течение 7 дней Т-клетки очищали через LSM (Ficol) и оставляли в покое на 24 часа. Затем Т-клетки рестимулировали (вторично), добавляя РМ в тех же соотношениях, что и выше. Стимуляция продолжалась 3 дня, затем клетки метили и собирали, как описано выше. Для определения продукции цитокина (фиг. 5) использовали дублирующие планшеты с вторично аллостимулированными клетками. Спустя три дня культуральную среду тестировали с использованием наборов Biosource в условиях, рекомендованных производителем.
MLR обезьяны (фиг.6). PBMC'S от двух обезьян очищали в LSM и смешивали (3.5× 104 клеток/ячейку от каждой обезьяны) с 2 мкг/мл ФГА. Стимулированные в течение 3 дней клетки радиоактивно метили за 16 часов до сбора.

Анализ BIAcore™ : Все эксперименты проводили на биосенсорах ВIАсоге™ или BIAcore™ 2000 (Pharmacia Biotech AB, Uppsala) при 25° С. Лиганды были иммобилизованы на сенсорных чипах NCM5 (Pharmacia) с применением стандартного N-этил-N’-(диметиламинопропил)карбодиимидин-N-гидроксисукциниимидное связывания (Johnsson, В., et al., (1993) Anal. Biochem.  :268-277; Khilko, S.N., et al., (1993) J. Biol. Chem
:268-277; Khilko, S.N., et al., (1993) J. Biol. Chem  :5425-5434).
:5425-5434).
| название | год | авторы | номер документа |
|---|---|---|---|
| РАСТВОРИМЫЙ МУТАНТНЫЙ CTLA4 И ЕГО ПРИМЕНЕНИЕ | 2001 |
|
RU2283847C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РЕВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ С ПРИМЕНЕНИЕМ РАСТВОРИМОГО CTLA4 | 2001 |
|
RU2287340C2 |
| ИММУНОСУПРЕССОРНЫЕ ПОЛИПЕПТИДЫ И НУКЛЕИНОВЫЕ КИСЛОТЫ | 2008 |
|
RU2506275C2 |
| НУКЛЕИНОВЫЕ КИСЛОТЫ, КОДИРУЮЩИЕ РЕЦЕПТОР CTLA-4 КОШКИ, ВЕКТОР, КЛЕТКИ-ХОЗЯЕВА, ВАКЦИНЫ, ОЛИГОНУКЛЕОТИДЫ, ПОЛИПЕПТИДЫ CTLA-4 КОШКИ И СПОСОБЫ ИНДУКЦИИ И ПОДАВЛЕНИЯ ИММУННОГО ОТВЕТА У КОШКИ | 1999 |
|
RU2377302C2 |
| ВЫДЕЛЕННАЯ НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ ЛИГАНД CD86 КОШКИ, ДИАГНОСТИЧЕСКИЙ ОЛИГОНУКЛЕОТИД, КЛОНИРУЮЩИЙ ВЕКТОР, ВАКЦИНА, СПОСОБЫ ИНДУКЦИИ ИЛИ ПОДАВЛЕНИЯ ИММУНИТЕТА У КОШКИ | 1999 |
|
RU2263145C2 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ИНГИБИТОРОВ АКТИВАЦИИ ИЛИ СТИМУЛЯЦИИ Т-КЛЕТОК | 2016 |
|
RU2779308C2 |
| ИНГИБИТОРЫ Т-КЛЕТОЧНОЙ АКТИВАЦИИ | 2012 |
|
RU2657440C2 |
| ВАРИАНТЫ CTLA-4 | 2013 |
|
RU2671465C2 |
| ЧЕЛОВЕЧЕСКОЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ПРОТИВ AILIM, КОСТИМУЛИРУЮЩЕЙ МОЛЕКУЛЫ ПЕРЕДАЧИ СИГНАЛА, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2001 |
|
RU2262511C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИММУННЫХ ЗАБОЛЕВАНИЙ | 2000 |
|
RU2203682C2 |
Изобретение относится к медицине и биотехнологии и касается растворимых мутантных молекул CTLA4, которые связываются с антигеном CD86 с большей авидностью, чем CTLA4 дикого типа. Сущность изобретения включает как различные мутантные формы, так и слитые белки с использованием в качестве второй аминокислотной последовательности константной области иммуноглобулина, молекулу нуклеиновой кислоты, кодирующую CTLA4, комплементарную ДНК, плазмиду, содержащую комплементарную ДНК, а также способ регуляции взаимодействия функциональных CTLA4 положительных Т-клеток с CD80- и CD86-положительными клетками и способ подавления реакции “трансплантат против хозяина”. Преимущество изобретения заключается в повышении активности этих мутантных форм за счет улучшения авидности. 12 с. и 14 з.п. ф-лы, 1 табл., 6 ил.
| PEACH P.J., BAJORATH J.B., BRADY W | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Exper | |||
| Med, 1994, v.180, №6, p | |||
| Указатель адресов и направлений | 1924 |
|
SU2049A1 |
| MASAAKI MURAKAMI, YOHKO TAKANASHA, YASUHIRO ISASIHI et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Natl., Acad | |||
| Sci | |||
| USA, 1996, v.93, p | |||
| Электромагнитное приспособление для зажимания свариваемых предметов | 1925 |
|
SU7838A1 |
Авторы
Даты
2004-09-10—Публикация
1998-01-29—Подача