Перекрестная ссылка на родственные заявки
Настоящая заявка заявляет приоритет предварительной заявки на патент США с серийным номером 62/840774, поданной 30 апреля 2019 г., которая в полном объеме включена здесь посредством ссылки.
Уровень техники
Гематологические злокачественные новообразования представляют собой одни из наиболее распространенных видов рака, встречающихся как у детей, так и у взрослых. Например, примерно 4000 случаев de novo агрессивного злокачественного новообразования B-клеточной линии дифференцировки, B-клеточного острого лимфобластного лейкоза (B-ALL), диагностируется каждый год в Соединенных Штатах и представляет собой наиболее распространенное злокачественное новообразование в детском возрасте. Генетические мутации, которые вызывают аберрантную остановку нормального созревания лимфоидной ткани, уклонение от апоптоза и неконтролируемую клеточную пролиферацию, приводят к избыточной продукции B-клеточных лимфобластов. У взрослых ежегодно имеет место более 6000 случаев острого лимфобластного лейкоза (ALL) (Hanahan D. and Weinberg R. (2000) The hallmarks of cancer. Cell, 100: 57-70; Teitell M. and Pandolfi P. (2009) Molecular genetics of acute lymphoblastic leukemia. Annu. Rev. Pathol., 4: 175-198). Кроме того, лимфомы (например, новообразования лимфатических тканей) составляют примерно 5% от всех случаев рака в США. Основными группами являются злокачественные новообразования (т.е. рак) из лимфоцитов, относящихся к типу клеток, находящихся как в лимфе, так и в крови. Таким образом, лимфомы и лейкозы являются злокачественными образованиями (например, опухолями) гемопоэтической и лимфоидной тканей. Как лимфопролиферативные заболевания, лимфомы и лимфолейкозы тесно связаны между собой до такой степени, что некоторые из них имеют оба названия (например, Т-клеточный лейкоз/лимфома взрослых).
Усилия доклинических и клинических исследований были сосредоточены на изучении иммунотерапевтических методов, которые включают основанную на антителах и/или адоптивную клеточную терапию рака с высоким риском. Такие стратегии основываются на опухоль-ассоциированных антигенах для обеспечения специфического нацеливания на злокачественные клетки и сохранения незлокачественных клеток (т.е. от воздействия на опухоль/вне опухоли или посторонних эффектов). Особый интерес был проявлен к подходам адоптивной иммунотерапии, которые включают конструирование иммунных эффекторных клеток человека с синтетическими химерными антигенными рецепторами (CAR), которые нацелены на опухоль-ассоциированные антигены, экспрессируемые на клеточной поверхности в главном комплексе гистосовместимости (MHC) антиген-независимым образом. Не желая связываться какой-либо конкретной теории, взаимодействие CAR, экспрессированного на Т-клетке, с опухоль-ассоциированным антигеном приводит к внутриклеточной передаче сигналов через костимулирующие домены Т-клеток и последующей экспансии CAR-Т-клеток для индукции дальнейшего киллинга опухолевых клеток. Однако, несмотря на положительные результаты, полученные в ранней фазе испытаний, инфузия CD19 CAR-Т-клеток пациентам по-прежнему приводит к проявлению ряда побочных эффектов разной степени тяжести «на мишени/на опухоли» и «на мишени/вне опухоли», таких как синдром лизиса опухоли (TLS), синдром высвобождения цитокинов (CRS) и синдром активации макрофагов, миграция в ЦНС, пролонгированная аплазия B-клеток и ускользание от иммунного ответа. Следовательно, ввиду давно назревшей и неудовлетворенной потребности, описанной здесь, необходимы усовершенствованные способы лечения гематологических злокачественных новообразований.
Сущность изобретения
Настоящее изобретение основано, по меньшей мере частично, на открытии того, что B-лимфоцитарные антигены, такие как CD19 (B-лимфоцитарный антиген CD19), можно использовать для таргентной терапии рака крови (т.е. рака гемопоэтической и лимфоидной тканей). В некоторых аспектах настоящее изобретение относится к иммунным клеткам, которые экспрессируют полипептид химерного антигенного рецептора (CAR), нацеленный на линии дифференцировки B-клеток и опухолевые клетки, которые развиваются из них. В некоторых вариантах осуществления CAR, раскрытые здесь, содержат B-лимфоцитарный антиген-нацеливающий домен, такой как CD19, CD20 и/или CD22-связывающий домен, трансмембранный домен и внутриклеточный сигнальный домен. В некоторых предпочтительных вариантах осуществления B-лимфоцитарный антиген-связывающий домен нацелен на антиген CD19 дикого типа и/или мутантный антиген.
В определенных аспектах настоящее изобретение относится к биспецифическим Т-клеткам с химерным антигенным рецептором (CAR), где указанные клетки экспрессируют полипептид CAR, содержащий нацеливающий домен, который селективно связывается с B-лимфоцитарным антигеном (например, антигеном CD19, CD20 и/или CD22, ассоциированным с гематологическим злокачественным новообразованием, таким как лейкоз и/или лимфома), и полипептид CAR, содержащий нацеливающий домен, который избирательно связывается с еще одним другим опухоль-ассоциированным антигеном. В некоторых таких вариантах осуществления нацеливающий домен химерного антигенного рецептора (например, CD19 антиген-связывающий домен и/или еще один другой опухоль-ассоциированный антигенсвязывающий домен) содержит функциональный фрагмент антитела. Предпочтительно, антигенсвязывающий домен химерных антигенных рецепторов содержит одноцепочечный вариабельный фрагмент (scFv). В наиболее предпочтительных вариантах осуществления функциональный фрагмент антитела (например, scFv) происходит от моноклонального антитела FMC63.
В некоторых вариантах осуществления трансмембранный домен CAR, раскрытых здесь, содержит по меньшей мере один трансмембранный домен любого из CD28, 41BB, их мутантов или любой их комбинации. В некоторых предпочтительных вариантах осуществления внутриклеточный сигнальный домен CAR, раскрытых здесь, содержит, по меньшей мере, один сигнальный домен CD3ζ, его мутантов или любую их комбинацию. В некоторых вариантах осуществления CAR, раскрытые здесь, дополнительно содержат по меньшей мере одну костимулирующую сигнальную область, такую как костимулирующую сигнальную область, содержащую сигнальный домен любого из CD28 или его мутанта, CD137 (41BB) или его мутанта, или любую их комбинацию. В некоторых вариантах осуществления костимулирующая сигнальная область содержит 1, 2, 3 или 4 цитоплазматических домена одной или более внутриклеточных сигнальных и/или костимулирующих молекул. В некоторых вариантах осуществления костимулирующая сигнальная область содержит одну или более мутаций в цитоплазматических доменах CD28 и/или 4-1BB, которые ослабляют или предпочтительно усиливают передачу сигналов. В некоторых вариантах осуществления иммунная клетка, экспрессирующая CAR, уже не экспрессирует одну или более молекул иммунных контрольных точек. В некоторых таких вариантах осуществления молекулы иммунных контрольных точек блокируются и/или подавляются способами, известными в данной области.
В некоторых вариантах осуществления полипептид CAR содержит неполный эндодомен. Например, полипептид CAR может содержать либо внутриклеточный сигнальный домен, либо костимулирующий домен, но не оба вместе. В этих вариантах осуществления иммунная эффекторная клетка не активируется, пока она и второй полипептид CAR (или эндогенный Т-клеточный рецептор), содержащий отсутствующий домен, оба не связываются со своими соответствующими антигенами. Следовательно, в некоторых вариантах осуществления полипептид CAR содержит сигнальный домен CD3-дзета (CD3ζ), но не содержит костимулирующую сигнальную область (CSR). В еще одних вариантах осуществления полипептид CAR содержит цитоплазматический домен CD28, 4-1BB или их комбинацию, но не содержит сигнальный домен CD3ζ (SD).
В некоторых аспектах настоящее изобретение относится к способам лечения рака, ассоциированного с B-лимфоцитарным антигеном (например, CD19) (например, рака крови, включая лейкозы и лимфомы), у субъекта, где способ включает введение эффективного количества композиции для адоптивной иммунотерапии, содержащей CAR-экспрессирующие клетки, как здесь раскрыто. В некоторых вариантах осуществления CAR-экспрессирующие клетки композиции для адоптивной иммунотерапии происходят от субъекта (например, аутологичные). Предпочтительно, CAR экспрессирующие- клетки в композиции для адоптивной иммунотерапии происходят из донорского образца или из банка или библиотеки, содержащих иммунные клетки, полученные не от субъекта (например, аллогенные). Например, способы, раскрытые здесь, включают селектирование аллогенных Т-клеток (например, образца PBMC, CD4+ T-клеток и/или CD8+ T-клеток, таких как CTL) из банка клеток (например, предварительно созданного банка от стороннего донора эпитоп-специфичных CTL). В некоторых вариантах осуществления способ дополнительно включает введение, по меньшей мере, одного ингибитора иммунных контрольных точек.
В некоторых аспектах настоящее изобретение относится к выделенным нуклеиновым кислотам, кодирующим раскрытые полипептиды CAR, а также к нуклеиновокислотным векторам, содержащим указанные выделенные нуклеиновые кислоты, операбельно связанные с контрольной последовательностью экспрессии. Кроме того, настоящее изобретение относится к клеткам, трансфектированным этими векторами или которые иным образом содержат раскрытые нуклеиновые кислоты, и к применению этих клеток для экспрессии и/или продукции полипептидов CAR, раскрытых. Без намерения приведения исчерпывающего списка, клетка может представлять собой иммунную эффекторную клетку клеткой, такую как αβT-клетка, γδT-клетка, естественный киллер (NK), естественная Т-клетка-киллер (NKT), B-клетка, врожденная лимфоидная клетка (ILC), цитокин-индуцированная клетка-киллер (CIK), цитотоксический Т-лимфоцит (CTL), лимфокин-активированная клетка-киллер (LAK) или регуляторная Т-клетка. В некоторых вариантах осуществления клетка проявляет противоопухолевый иммунитет (например, вызывает иммунный ответ против опухоли), когда антигенсвязывающий домен CAR связывается с B-лимфоцитарным антигеном, таким как CD19, CD20 и/или CD22.
В дополнительных аспектах изобретение относится к фармацевтическим композициям, содержащим молекулы, описанные здесь, в фармацевтически приемлемом носителе. Здесь также раскрываются способы лечения рака у субъекта, которые включают введение субъекту терапевтически эффективного количества фармацевтических композиций, как здесь раскрыто. В некоторых вариантах осуществления рак может представлять собой, например, любое злокачественное новообразование, экспрессирующее В-лимфоцитарный антиген (например, экспрессирующее CD19, CD20 и/или CD22.
В некоторых вариантах осуществления изобретения B-лимфоцитарный антиген-связывающие агенты, раскрытые здесь, содержат фрагмент антитела, который специфически связывается с поверхностным пептидом В-лимфоцитов, таким как CD19, CD20 и/или CD22. Например, и без ограничения, антигенсвязывающий домен может представлять собой Fab или одноцепочечный вариабельный фрагмент (scFv) антитела, которое специфически связывается с CD19, CD20 и/или CD22. В некоторых таких вариантах осуществления антигенсвязывающий агент представляет собой аптамер, который специфически связывается с B-лимфоцитарными антигенами, такими как CD19, CD20 и/или CD22. Например, в некоторых вариантах осуществления антигенсвязывающий агент представляет собой или иным образом включает пептидный аптамер, выбранный из пула случайных последовательностей, основываясь его способности связываться с B-лимфоцитарными антигенами, такими как CD19, CD20 и/или CD22. В некоторых вариантах осуществления B-лимфоцитарный антиген-связывающие агенты могут также содержать природный лиганд или его вариант и/или фрагмент, способный связываться с B-лимфоцитарным антигеном.
Полипептиды CAR, описанные здесь (или CAR-ассоциированные) также могут содержать трансмембранный домен и эндодомен, способные активировать иммунную эффекторную клетку. Например, эндодомен может содержать сигнальный домен и одну или более костимулирующих сигнальных областей.
Подробная информация по одному или более вариантам осуществления изобретения приведена на прилагаемых фигурах и в описании ниже. Другие признаки, цели и преимущества изобретения будут очевидны из описания и фигур, и из формулы изобретения.
Краткое описание фигур
На фиг.1 показана характеристика экспрессии белка CD19 в целевых BLCL, полученных от донора.
На фиг. 2 приведены данные анализа электрического импеданса, использованного для оценки нацеленной цитотоксичности и аллореактивности, индуцированных полученными от донора EBV-сенсибилизированными анти-CD19 CAR-T-клетками при сокультивировании с совместимыми (аутологичными) или несовместимыми целевыми BLCL. Цитолитическая активность индуцируется как нетрансдуцированными (NTD) EBV-CTL, так и CAR-экспрессирующими EBV-CTL (верхний ряд). Однако CAR EBV-CTL способны индуцировать CD19-нацеленную, TCR-независимую цитолитическую активность в ответ на контактирование с несовместимыми целевыми BLCL, в то время как NTD EBV-CTL проявляют ограниченную EBV-специфическую, TCR-направленную цитолитическую активность.
На фиг. 3 показана характеристика экспрессии CD19 в каждой клеточной линии-мишени, используемой в люциферазных анализах. Следует понимать, что линия клеток K562 не экспрессирует CD19 или EBV антиген и функционирует в качестве двойного отрицательного контроля.
На фиг. 4 приведены данные люциферазного анализа, показывающие целевую цитолитическую активность, индуцированную EBV-CAR-T-клетками. EBV-CAR-T-клетки проявляли CAR-направленный цитолиз CD19-экспрессирующих клеток линий NALM6 и RAJI, и клеток K562, сконструированных для экспрессии CD19. Минимальную цитолитическую активность наблюдали в контрольных клетках К562.
На фиг. 5 показана вариабельность неспецифического цитолиза от донора к донору, индуцированного нетрансдуцированными эффекторными клетками.
На фиг. 6 приведены иллюстративные данные оценки высвобождения цитокинов в нескольких линиях клеток-мишеней.
На фиг. 7 приведены данные оценки высвобождения TH1 провоспалительных цитокинов в нескольких линиях клеток-мишеней.
На фиг. 8 приведены данные оценки высвобождения TH2 провоспалительных цитокинов в нескольких линиях клеток-мишеней.
На фиг. 9 приведены данные оценки высвобождения TH17 провоспалительных цитокинов в нескольких линиях клеток-мишеней.
На фиг. 10 приведены данные оценки высвобождения регуляторных воспалительных цитокинов и данные оценки высвобождения цитолитических цитокинов в нескольких линиях клеток-мишеней.
На фиг. 11 приведены данные оценки высвобождения хемокинов в нескольких линиях клеток-мишеней.
На фиг. 12 приведены данные оценки высвобождения цитокинов при активации в нескольких линиях клеток-мишеней.
На фиг. 13 представлена тепловая карта высвобождения цитокинов для эффекторных Т-клеток, полученных от донора 014-18 и целевых клеток K562-CD19 при различных соотношениях E:T.
На фиг. 14 представлена тепловая карта высвобождения цитокинов для эффекторных Т-клеток, полученных от донора 023-18 и целевых клеток K562-CD19 при различных соотношениях E:T.
На фиг. 15 представлена тепловая карта высвобождения цитокинов для эффекторных Т-клеток, полученных от донора 009-19 и целевых клеток K562-CD19 при различных соотношениях E:T.
На фиг. 16 показан дизайн исследования для оценки безопасности и эффективности EBV-сенсибилизированных, анти-CD19 CAR-экспрессирующих Т-клеток на системной мышиной модели Nalm6.
Подробное описание изобретения
Подробная информация
Как здесь раскрывается, настоящее изобретение относится, по меньшей мере, частично, к иммунным клеткам, которые рекомбинантно экспрессируют химерный антигенный рецептор (CAR), нацеленный на опухоль-ассоциированные B-лимфоцитарные антигены. Такие B-лимфоцитарные антигены включают, не ограничиваясь этим, CD19, CD20 и CD22. В некоторых таких вариантах осуществления антиген представляет собой CD19 и связан с гематологическим злокачественным новообразованием, таким как лейкозы и лимфомы. В предпочтительных вариантах осуществления на CD19 нацелена иммунная эффекторная клетка (т.е. Т-клетки или естественные киллеры (NK)), которая сконструирована для экспрессии полипептида химерного антигенного рецептора (CAR), который избирательно связывается с CD19.
Основным достижением Т-клеточной терапии стала разработка химерных антигенных рецепторов (CAR). CAR первого поколения были разработаны в виде искусственного рецепторы, который при экспрессии Т-клетками может перенацеливать их на заранее определенный антиген, ассоциированный с заболеванием (например, опухоль-ассоциированные антигены). Такие CAR обычно содержат одноцепочечный вариабельный фрагмент (scFv), полученный из мишень-специфического антитела, слитый с сигнальными доменами из Т-клеточного рецептора (TCR), такого как CD3ζ. После связывания с антигеном CAR запускают фосфорилирование иммунорецепторных мотивов активации на основе тирозина (ITAMS) и инициируют сигнальный каскад, необходимый для цитолиза, секреции и пролиферации цитокинов, минуя путь эндогенного процессинга антигена и рестрикции MHC. Конструкции CAR второго поколения включают дополнительные сигнальные домены для усиления активации и костимуляции, такие как CD28 и/или 4-1BB. По сравнению с их более ранними аналогами, CAR второго поколения, как было установлено, индуцируют более высокую секрецию IL-2, увеличивают пролиферацию и устойчивость Т-клеток, опосредуют большее отторжение опухоли и увеличивают выживаемость Т-клеток. CAR третьего поколения были получены объединением нескольких сигнальных доменов, таких как CD3ζ-CD28-OC40 или CD3ζ-CD28-41BB, для повышения эффективности за счет более сильной продукции цитокинов и способности к киллингу.
В некоторых вариантах осуществления CAR-T-клетки, описанные здесь, сконструированы таким образом, чтобы противодействовать любым толерогенным эффектам микроокружения злокачественных клеток (например, микроокружения опухоли), например, и без ограничения, подавляя или ингибируя сигнальный путь с участием PD-1. В некоторых вариантах осуществления CAR, описанные здесь, могут быть сенсибилизированы или селективно нацелены на вирусный или невирусный антиген. Идеальная мишень не должна экспрессироваться в нормальной ткани/органе или, по меньшей мере, не в тканях жизненно важных нормальных органов (сердце, печени, ЦНС, легких и других тканях, которые могут быть особенно чувствительными к транзиентным повреждениям), ни в близкородственных нормальных клеточных аналогах, например, стволовых клетках и/или клетках-предшественниках, чтобы минимизировать побочные эффекты (например, воздействие на опухоль/вне опухоли или побочные эффекты). Настоящее изобретение также относится к иммунным эффекторным клеткам, таким как Т-клетки или естественные киллеры (NK), которые сконструированы для экспрессии полипептидов химерных антигенных рецепторов (CAR), которые избирательно связываются с B-лимфоцитарными антигенами (например, CD19 дикого типа и/или мутантным CD19). Следовательно, также раскрываются способы обеспечения целевого иммунитета (например, противоопухолевого иммунитета) у субъекта с гематологическим злокачественным новообразованием, которые включают адоптивный перенос раскрытых иммунных эффекторных клеток, сконструированных для экспрессии раскрытых полипептидов CAR.
Злокачественные клетки в микроокружении опухоли и иммунные клетки хозяина взаимодействуют, потенциально приводя к стимуляции или подавлению прогрессирования рака. В идеале иммунная система должна идентифицировать опухолевые клетки и мобилизовать иммунный ответ для элиминации опухоли. К сожалению, на уровне Т-клеток положительная регуляция ингибирующих рецепторов, таких как PD-1 и Tim-3, коррелирует с дисфункцией Т-клеток. Это наблюдали как в отношении CD8+ Т-лимфоцитов, специфичных к вирусу гепатита С (HCV), так и неспецифичных к HCV, в кровеносной системе и печени пациентов с хронической инфекцией HCV. Частичное восстановление пролиферации Т-клеток и секреции IFN-γ может быть достигнуто ex vivo посредством ингибирования связывания PD-1 и Tim-3 с их соответствующими лигандами (т.е. B7-H1, также известным как PD-L1 и галектин-9). Более того, недавние сообщения показали, что длительное введение IFN-α, представляющего собой стандартную терапию стойкой инфекции HCV, способствует потере теломер в наивных Т-клетках. С учетом корреляции между укороченными теломерами Т-клеток и терминальной дифференцировкой (характеризующейся сниженным пролиферативным потенциалом), IFN-α-индуцированное «истощение» Т-клеток, вероятно, представляет собой значительный барьер для иммунотерапии у пациентов, инфицированных HCV. В некоторых аспектах, раскрытых здесь, в изобретении используются стратегии ингибирования иммунных контрольных точек. Терапия ингибиторами иммунных контрольных точек нацелена на ключевые регуляторы иммунной системы, которые либо стимулируют, либо подавляют иммунный ответ. Такие иммунные контрольные точки могут использоваться при злокачественных заболеваниях (например, при опухолях), чтобы избежать атак иммунной системы. Результаты исследований с ингибиторами иммунных контрольных точек показали активность терапии ингибиторами PD-1 (El-Khoueiry et al. (2017) «Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial», Lancet, 389 (10088): 2492-2502), и FDA одобрило ниволумаб в качестве терапии второй линии HCC с частотой объективного ответа 20%.
Определения
Термин «антитело» относится к иммуноглобулину, его производным, которые сохраняют способность к специфическому связыванию, и к белкам, содержащим связывающий домен, который является гомологичным или в значительной степени гомологичным связывающему домену иммуноглобулина. Такие белки могут быть получены из природных источников или частично или полностью получены синтетическим путем. Антитело может представлять собой моноклональное или поликлональное антитело. Антитело может быть членом любого класса иммуноглобулинов любого вида, включая любой из классов человека: IgG, IgM, IgA, IgD и IgE. В иллюстративных вариантах осуществления антитела, используемые со способами и композициями, описанными здесь, представляют собой производные класса IgG, такие как анти-CD19 антитело, клон FMC63. Помимо интактных иммуноглобулиновых молекул, в термин «антитела» также входят химеры, фрагменты или полимеры этих молекул иммуноглобулинов, и человеческие или гуманизированные варианты молекул иммуноглобулинов, которые селективно связываются с антигеном-мишенью.
Термин «фрагмент антитела» относится к любому производному антитела, которое меньше полного антитела. В иллюстративных вариантах осуществления фрагмент антитела сохраняет, по меньшей мере, значительную часть способности к специфическому связыванию, присущему полноразмерному антителу. Примеры фрагментов антител включают, не ограничиваясь этим, фрагменты Fab, Fab', F(ab')2, scFv, Fv, dsFv диатело, Fc и Fd. Фрагмент антитела можно получить любым способом. Например, фрагмент антитела может быть получен ферментативно или химически фрагментацией интактного антитела, он может быть получен рекомбинантно из гена, кодирующего частичную последовательность антитела, или он может быть получен полностью или частично синтетическим путем. Фрагмент антитела необязательно может представлять собой одноцепочечный фрагмент антитела. Альтернативно, фрагмент может содержать несколько цепей, которые связаны вместе, например, дисульфидными связями. Фрагмент также может необязательно представлять собой мультимолекулярный комплекс. Функциональный фрагмент антитела обычно будет содержать, по меньшей мере, примерно 50 аминокислот и более типично будет содержать, по меньшей мере, примерно 200 аминокислот.
Термин «сайт связывания антигена» относится к области антитела, которая специфически связывается с эпитопом на антигене.
Термин «аптамер» относится к молекулам олигонуклеиновой кислоты или пептида, которые связываются с определенной молекулой-мишенью. Такие молекулы обычно выбираются из пула случайных последовательностей. Выбранные аптамеры способны адаптировать уникальные третичные структуры и распознавать молекулы-мишени с высокой аффинностью и специфичностью. «Аптамер нуклеиновой кислоты» представляет собой олигонуклеиновую кислоту ДНК или РНК, которая связывается с молекулой-мишенью посредством ее конформации и тем самым ингибирует или подавляет функции такой молекулы. Аптамер нуклеиновой кислоты может состоять из ДНК, РНК или их комбинации. «Пептидный аптамер» представляет собой комбинированную белковую молекулу с вариабельной пептидной последовательностью, встроенной в константный каркасный белок. Идентификацию пептидных аптамеров обычно проводят в жестких условиях дрожжевой двугибридной системы, что увеличивает вероятность того, что выбранные пептидные аптамеры будут стабильно экспрессироваться и правильно укладываться во внутриклеточном контексте.
Термин «носитель» означает соединение, композицию, вещество или структуру, которые в комбинации с соединением или композицией способствуют или облегчают приготовление, хранение, введение, доставку, эффективность, селективность или любое другое свойство соединения, или любую деградацию активного ингредиента и минимизируют любые побочные эффекты у субъекта.
Термин «химерная молекула» относится к единой молекуле, созданной соединением двух или более молекул, которые в своем нативном состоянии существуют по отдельности. Единая химерная молекула обладает желаемой функциональностью всех составляющих ее молекул. Одним типом химерных молекул является слитый белок.
Термин «сконструированное антитело» относится к рекомбинантной молекуле, которая содержит, по меньшей мере, фрагмент антитела, содержащий антигенсвязывающий сайт, происходящий из вариабельной области тяжелой цепи и/или легкой цепи антитела, и может необязательно включать все или часть вариабельных и/или константных областей антитела из любого класса Ig (например, IgA, IgD, IgE, IgG, IgM и IgY).
Термин «эпитоп» относится к области антигена, с которой антитело связывается предпочтительно и специфично. Моноклональное антитело связывается преимущественно с одним специфическим эпитопом молекулы, который можно определить на молекулярном уровне. В настоящем изобретении многочисленные эпитопы могут распознаваться полиспецифическим антителом.
Термин «слитый белок» относится к полипептиду, образованному соединением двух или более полипептидов посредством пептидной связи, образованной между аминоконцом одного полипептида и карбоксильным концом другого полипептида. Слитый белок может быть образован химическим связыванием составляющих полипептидов, или он может экспрессироваться в виде одного полипептида из последовательности нуклеиновой кислоты, кодирующей один непрерывный слитый белок. Одноцепочечный слитый белок представляет собой слитый белок, имеющий единый непрерывный полипептидный остов. Слитые белки можно получить с использованием обычных методов молекулярной биологии для соединения двух генов в рамке считывания в единую нуклеиновую кислоту с последующей экспрессией нуклеиновой кислоты в подходящей клетке-хозяине в условиях, в которых продуцируется слитый белок.
Термин «Fab-фрагмент» относится к фрагменту антитела, содержащему антигенсвязывающий сайт, образованному расщеплением антитела ферментом папаином, который «разрезает» шарнирную область на N-конце по внутренней дисульфидной связи H-цепи и образует два Fab-фрагмента из одной молекулы антитела.
Термин «фрагмент F(ab')2» относится к фрагменту антитела, содержащему два антигенсвязывающих сайта, образованному расщеплением молекулы антитела ферментом пепсином, который «разрезает» шарнирную область на С-конце по внутренней дисульфидной связи H-цепи.
Термин «Fc-фрагмент» относится к фрагменту антитела, содержащему константную область его тяжелой цепи.
Термин «Fv-фрагмент» относится к фрагменту антитела, содержащему вариабельные области его тяжелой цепи и легкой цепи.
«Генная конструкция» относится к нуклеиновой кислоте, такой как вектор, плазмида, вирусный геном и т.п., которая включает «кодирующую последовательность» для полипептида или которая иным образом транскрибируется в биологически активную РНК (например, антисмысловую, ловушку, рибозимную) и т.д.), и может быть трансфектирована в клетки, например клетки млекопитающих, и могут обеспечивать экспрессию кодирующей последовательности в клетках, трансфектированных конструкцией. Генная конструкция может включать один или более регуляторных элементов, операбельно связанных с кодирующей последовательностью, а также интронные последовательности, сайты полиаденилирования, ориджин репликации, маркерные гены и т.д.
Термин «линкер» известен в данной области и относится к молекуле или группе молекул, соединяющих два соединения, например, два полипептида. Линкер может состоять из одной связывающей молекулы или может содержать связывающую молекулу и молекулу спейсера, предназначенную для разделения связывающей молекулы и соединения на определенное расстояние.
Термин «поливалентное антитело» относится к антителу или сконструированному антителу, содержащему более одного сайта распознавания антигена. Например, «двухвалентное» антитело имеет два сайта распознавания антигена, тогда как «четырехвалентное» антитело имеет четыре сайта распознавания антигена. Термины «моноспецифический», «биспецифический», «триспецифический», «тетраспецифический» и т.д. относятся к числу различных специфичностей сайтов распознавания антигена (в отличие от числа сайтов распознавания антигена), присутствующих в поливалентном антителе. Например, все сайты распознавания антигена «моноспецифического» антитела связываются с одним эпитопом. «Биспецифическое» антитело имеет, по меньшей мере, один сайт распознавания антигена, который связывается с первым эпитопом, и, по меньшей мере, один сайт распознавания антигена, который связывается со вторым эпитопом, отличным от первого эпитопа. «Поливалентное моноспецифическое» антитело имеет несколько сайтов распознавания антигена, которые все связываются с одним эпитопом. «Поливалентное биспецифическое» антитело имеет несколько сайтов распознавания антигена, некоторое число из которых связывается с первым эпитопом, и некоторое число связывается со вторым эпитопом, отличным от первого эпитопа.
Термин «нуклеиновая кислота» относится к природной или синтетической молекуле, содержащей один нуклеотид или два или более нуклеотидов, связанных фосфатной группой в 3’-положении одного нуклеотида с 5’-концом другого нуклеотида. Длина нуклеиновой кислоты не ограничивается, и, таким образом, нуклеиновая кислота может включать дезоксирибонуклеиновую кислоту (ДНК) или рибонуклеиновую кислоту (РНК).
Термин «операбельно связанный с» относится к функциональной связи нуклеиновой кислоты с другой нуклеиновокислотной последовательностью. Промоторы, энхансеры, сайты остановки транскрипции и трансляции и другие сигнальные последовательности являются примерами нуклеиновокислотных последовательностей, операбельно связанных с другими последовательностями. Например, функциональная связь ДНК с элементом контроля транскрипции относится к физическим и функциональным отношениям между ДНК и промотором, так что транскрипция такой ДНК инициируется с промотора РНК-полимеразой, которая специфически распознает, связывается и транскрибирует ДНК.
Термин «фармацевтически приемлемый» относится к таким соединениям, материалам, композициям и/или лекарственным формам, которые, в рамках здравого медицинского суждения, подходят для применения в контакте с тканями людей и животных без проявления чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, соизмеримых с разумным соотношением польза/риск.
Термины «полипептидный фрагмент» или «фрагмент», когда они используются по отношению к конкретному полипептиду, относятся к полипептиду, в котором аминокислотные остатки делецированы по сравнению с референсным полипептидом, но где оставшаяся аминокислотная последовательность обычно идентична таковой референсного полипептида. Такие делеции могут иметь место на аминоконце или на карбоксиконце референсного полипептида или, альтернативно, на обоих концах. Фрагменты обычно имеют длину, по меньшей мере, примерно 5, 6, 8 или 10 аминокислот, по меньшей мере, примерно 14 аминокислот в длину, по меньшей мере, примерно 20, 30, 40 или 50 аминокислот в длину, по меньшей мере, примерно 75 аминокислот в длину или, по меньшей мере, примерно 100, 150, 200, 300, 500 или более аминокислот в длину. Фрагмент может сохранять одну или более биологических активностей референсного полипептида. В различных вариантах осуществления фрагмент может обладать ферментативной активностью и/или содержать сайт взаимодействия референсного полипептида. В других вариантах осуществления фрагмент может обладать иммуногенными свойствами.
Термин «одноцепочечный вариабельный фрагмент» или «scFv» относится к Fv-фрагменту, в котором область тяжелой цепи и область легкой цепи связаны. Один или более фрагментов scFv могут быть связаны с другими фрагментами антитела (такими как константная область тяжелой цепи или легкой цепи) с образованием конструкций антител, имеющих один или более сайтов распознавания антигена.
В рамках настоящего изобретения, термин «спейсер» относится к пептиду, который соединяет белки, составляющие слитый белок. Как правило, спейсер не обладает специфической биологической активностью, кроме соединения белков или сохранения некоторого минимального расстояния или других пространственных отношений между ними. Однако составляющие аминокислоты спейсера могут быть выбраны таким образом, чтобы оказывать влияние на некоторые свойства молекулы, такие как фолдинг, суммарный заряд или гидрофобность молекулы.
В рамках настоящего изобретения, термин «специфически связывается с» или «специфическое связывание», когда относится к полипептиду (включая антитела) или рецептору, относится к реакции связывания, которая определяет присутствие белка или полипептида или рецептора в гетерогенной популяции белков и других биологических соединений. Таким образом, в определенных условиях (например, условиях иммуноанализа в случае антитела) указанный лиганд или антитело «специфически связывается» со своей конкретной «мишенью» (например, антитело специфически связывается с эндотелиальным антигеном), в то время оно не связывается со значительным числом других белков, присутствующих в образце, или другими белками, с которыми лиганд или антитело могут контактировать в организме. Как правило, первая молекула, которая «специфически связывает» вторую молекулу, имеет константу аффинности (Ka) выше, чем примерно 105 M-1 (например, 106 M-1, 107 M-1, 108 M-1, 109 M-1, 1010 M-1, 1011 M-1 и 1012 M-1 или более), с этой второй молекулой. Например, в случае способности TCR связываться с пептидом, презентированном молекулами MHC (например, MHC класса I или MHC класса II), то, как правило, TCR специфически связывается со своим пептидом/MHC с аффинностью, по меньшей мере, с KD примерно 10-4 M или ниже, и связывается с заранее определенным антигеном/партнером по связыванию с аффинностью (выраженной с помощью KD), которая, по меньшей мере, в 10 раз ниже, по меньшей мере, в 100 раз ниже или, по меньшей мере, в 1000 раз ниже, чем его аффинность связывания с неспецифическим и неродственным комплексом пептид/MHC (например, комплексом, содержащим пептид BSA или пептид казеина).
Термин «субъект» относится к любому индивидууму, который является мишенью для введения или лечения. Субъект может представлять собой позвоночное животное, например, млекопитающее. Таким образом, субъект может представлять собой пациента гуманной или ветеринарной медицины. Термин «пациент» относится к субъекту, находящемуся на лечении у клинициста, например, врача.
В некоторых вариантах осуществления агенты по изобретению можно использовать самостоятельно или совместно с другим типом терапевтического агента. В рамках настоящего изобретения, выражения «совместное введение» или «введенные совместно» относятся к любой форме введения двух или более различных терапевтических агентов (например, композиции, содержащей CAR-T, раскрытые здесь, и ингибитор иммунных контрольных точек), так что второй агент вводят, пока ранее введенный терапевтический агент все еще проявляет эффективность в организме (например, два агента одновременно эффективны у субъекта, что может включать синергетические эффекты двух агентов). Например, разные терапевтические агенты можно вводить либо в одном составе, либо в отдельных составах, либо одновременно, либо последовательно. В некоторых предпочтительных вариантах осуществления CAR-T-клетки экспрессируют (например, присутствуют на поверхности клетки или секретируют) дополнительные терапевтические агенты. В некоторых вариантах осуществления различные терапевтические агенты (например, CAR-Т-клетки и молекулы, блокирующие иммунные контрольные точки) можно вводить в течение примерно одного часа, примерно 12 ч, примерно 24 ч, примерно 36 ч, примерно 48 ч, примерно 72 ч или примерно с недельным интервалом друг друга. Таким образом, субъект, получающий такое лечение, может получить пользу от комбинированного действия различных терапевтических агентов.
Термины «трансформация» и «трансфекция» означают введение нуклеиновой кислоты, например, экспрессионного вектора, в реципиентную клетку, включая введение нуклеиновой кислоты в хромосомную ДНК указанной клетки.
В рамках настоящего изобретения, термин «лечение» относится к клиническому вмешательству, предназначенному для изменения естественного течения клинической патологии у субъекта, подвергающегося лечению. Желательные эффекты лечения включают снижение скорости прогрессирования, ослабление или смягчение патологического состояния, а также ремиссию или улучшение прогноза конкретного заболевания, расстройства или состояния. Субъекта успешно «лечат», например, если ослабляются или устраняются один или более симптомов, связанных с конкретным заболеванием, нарушением или состоянием.
Термин «вариант» относится к аминокислотной или пептидной последовательности, имеющей консервативные аминокислотные замены, неконсервативные аминокислотные замены (например, вырожденный вариант), замены в воблеровском положении каждого кодона (например, ДНК и РНК), кодирующего аминокислоту, аминокислоты, добавленные к С-концу пептида, или пептид, имеющий 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% идентичность последовательности с референсной последовательностью.
В рамках настоящего изобретения, термин «вектор» относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она была связана. Термин «экспрессионный вектор» включает любой вектор (например, плазмиду, космиду или фаговую хромосому), содержащий генную конструкцию в форме, подходящей для экспрессии в клетке (например, связанную с элементом контроля транскрипции).
Термин «В-лимфоцитарный антиген» и, в частности, «CD19» предназначен для включения фрагментов, вариантов (например, аллельных вариантов) и производных молекулы антигена, например молекулы CD19. Например, и без ограничения, в некоторых вариантах осуществления CD19 представляет собой CD19 дикого типа или мутантный CD19. В некоторых таких вариантах осуществления В-лимфоцитарный антиген экспрессируется на поверхности клетки (например, на поверхности предзлокачественных или злокачественных клеток).
Анти-CD19 антитела (и их форматы scFv), подходящие для связывания с CD19, хорошо известны в данной области и включают, например, без ограничения, антитела FMC63, SJ25C1 (JCAR015) и HD37 (блинатумомаб).
Химерные антигенные рецепторы (CAR)
Настоящее изобретение относится к полипептидам химерного антигенного рецептора (CAR), которые могут экспрессироваться в иммунных эффекторных клетках для усиления активности против конкретных мишеней (например, противоопухолевой активности при гематологических злокачественных заболеваниях).
В некоторых аспектах CAR, раскрытые здесь, состоят из трех доменов: эктодомена, трансмембранного домена и эндодомена.
В некоторых вариантах осуществления эктодомен включает В-лимфоцитарный антиген-связывающую область, такую как CD19-связывающая область, и отвечает за распознавание антигена. CD19 может представлять собой CD19 дикого типа или мутантный CD19. Он также необязательно содержит сигнальный пептид (SP), так что CAR может быть гликозилирован и заякорен в клеточной мембране эффекторной иммунной клетки.
В некоторых вариантах осуществления трансмембранный домен (TD) соединяет эктодомен (т.е. внеклеточный домен) с эндодоменом (т.е. внутриклеточным доменом) и находится внутри клеточной мембраны при экспрессии клеткой.
В некоторых вариантах осуществления эндодомен передает сигнал активации иммунной эффекторной клетке после распознавания антигена. В некоторых таких вариантах осуществления эндодомен может содержать внутриклеточный сигнальный домен (ISD) и, необязательно, костимулирующую сигнальную область (CSR). «Сигнальный домен (SD)», такой как ISD, обычно содержит иммунорецепторные мотивы активации на основе тирозина (ITAM), которые активируют сигнальный каскад, когда ITAM фосфорилируется. Термин «костимулирующая сигнальная область (CSR)» относится к внутриклеточным сигнальным доменам костимулирующих белковых рецепторов, таких как CD28, 41BB и ICOS, которые способны усиливать активацию Т-клеток рецепторами Т-клеток.
В некоторых вариантах осуществления эндодомен содержит SD или CSR, но не оба вместе. В этих вариантах осуществления иммунная эффекторная клетка, содержащая раскрытый CAR, активируется только в том случае, если другой CAR (или Т-клеточный рецептор), содержащий отсутствующий домен, также связывается с его соответствующим антигеном.
В некоторых вариантах осуществления раскрытый CAR определяется формулой:
SP-BCA-HG-TM-CSR-SD; или
SP-BCA-HG-TM-SD-CSR;
где «SP» представляет собой необязательный сигнальный пептид (например, полученный из лидерной последовательности CD8α),
где «BCA» представляет собой B-лимфоцитарный антиген-связывающую область (например, FMC63 и его производные),
где «HG» представляет собой необязательный шарнирный домен (спейсерный домен; например, полученный из CD28),
где «TM» представляет собой трансмембранный домен (например, полученный из CD28),
где «CSR» представляет собой одну или более костимулирующих сигнальных областей (например, полученных из CD28),
где «SD» представляет собой сигнальный домен (например, полученный из CD3ζ и его мутантов), и
где «-» представляет собой пептидную связь или линкер.
Дополнительные конструкции CAR описаны, например, в публикации Fresnak et al., «Engineered T cells: the promise and challenges of cancer immunotherapy», Nat. Rev. Cancer, 2016 Aug 23;16(9):566-81, которая в полном объеме включена здесь посредством ссылки в отношении таких моделей CAR.
В определенных вариантах осуществления CAR может представлять собой, например (и без ограничения), TRUCK, универсальный CAR, самонаправленный CAR, «бронированный» CAR, самоинактивирующийся CAR, кондиционный CAR, маркированный CAR, TanCAR, двойной CAR или sCAR.
TRUCK (Т-клетки, перенаправленные для универсального цитокин-опосредованного уничтожения) коэкспрессируют химерный антигенный рецептор (CAR) и противоопухолевый цитокин. Экспрессия цитокинов может быть конститутивной или индуцированной активацией Т-клеток. Нацеленная специфичностью CAR, локализованная продукция провоспалительных цитокинов привлекает эндогенные иммунные клетки к участкам опухоли и может усиливать противоопухолевый ответ.
Универсальные аллогенные CAR-Т-клетки сконструированы таким образом, чтобы не экспрессировать длительно эндогенный Т-клеточный рецептор (TCR) и/или молекулы главного комплекса гистосовместимости (MHC), тем самым предупреждая развитие синдрома «трансплантат против хозяина» (GVHD) или отторжение, соответственно.
Самонаправленные CAR коэкспрессируют CAR и хемокиновый рецептор, который связывается с опухолевым лигандом, тем самым усиливая хоминг к опухолям.
CAR-T-клетки, сконструированные для обеспечения устойчивости к иммуносупрессии («бронированный» CAR), могут быть генетически модифицированы, чтобы больше не экспрессировать различные молекулы иммунных контрольных точек (например, цитотоксический T-лимфоцит-ассоциированный антиген 4 (CTLA4) или белок запрограммированной гибели клеток 1 (PD-1)). Примеры способов «нокдауна» и «нокаута» включают, не ограничиваясь этим, РНК-интерференцию (RNAi) (например, asRNA, miRNA, shRNA, siRNA и т.д.) и CRISPR-интерференцию (CRISPRi) (например, CRISPR-Cas9). В некоторых вариантах осуществления CAR-T-клетки сконструированы для экспрессии доминантно-негативной формы молекулы контрольной точки. В некоторых таких вариантах осуществления внеклеточный лиганд-связывающий домен (т.е. эктодомен) молекулы иммунной контрольной точки сливается с трансмембранной мембраной, чтобы конкурировать за связывание лиганда. Например, внеклеточный лиганд-связывающий домен PD-1 может быть слит с трансмембранным доменом CD8, таким образом, конкурируя за лиганд PD-1 из клетки-мишени. В некоторых вариантах осуществления CAR T-клетки сконструированы для экспрессии рецептора переключения иммунных контрольных точек для использования ингибирующего лиганда иммунных контрольных точек, присутствующего на клетке-мишени. В таких вариантах осуществления внеклеточный лиганд-связывающий домен молекулы иммунной контрольной точки слит с сигнальным, стимулирующим и/или костимулирующим доменом. Например, внеклеточный лиганд-связывающий домен PD-1 может быть слит с доменом CD28, тем самым обеспечивая костимуляцию CD28 при блокировании передачи сигнала PD-1. В дополнительных вариантах осуществления CAR-T-клетки можно вводить с аптамером или моноклональным антителом, которое блокирует сигнальный путь иммунных контрольных точек. В некоторых таких вариантах осуществления CAR-T-клетки (например, терапия CAR T-клетками) комбинируют с методом блокирования PD-1, таким как введениес антагонистическими аптаперами PD-1/PD-L1 или анти-PD-1/PD-L1 антитела. В предпочтительных вариантах осуществления CAR T-клетки и антитела, блокирующие путь PD-1, вводят одновременно. В дополнительных вариантах осуществления CAR-T-клетки сконструированы для экспрессии или секреции антитела, блокирующего иммунные контрольные точки, такого как анти-PD-1 или анти-PD-L1, или их фрагментов. В еще дополнительных вариантах осуществления CAR T-клетки вводят с вектором (например, сконструированным вирусным вектором), который экспрессирует молекулу, блокирующую иммунные контрольные точки, описанную здесь.
Самоинактивирующийся CAR может быть сконструирован с использованием РНК, доставленной электропорацией для кодирования CAR. Альтернативно, индуцируемый апоптоз Т-клетки может быть достигнут на основе связывания ганцикловира с тимидинкиназой в ген-модифицированных лимфоцитах или недавно описанной системы активации человеческой каспазы 9 с помощью низкомолекулярного димеризатора.
Кондиционная CAR-Т-клетка по умолчанию не отвечает или выключена до тех пор, пока не будет добавлена небольшая молекула для завершения «цепи» (например, молекулярного пути), что обеспечивает полную трансдукцию как сигнала 1, так и сигнала 2, тем самым активируя CAR-Т-клетку. Альтернативно, Т-клетки могут быть сконструированы для экспрессии адаптор-специфического рецептора с аффинностью к вторичным антителам, направленным на антиген-мишень, которые вводят позднее.
Маркированные CAR-Т-клетки экспрессируют CAR плюс опухолевый эпитоп, с которым связывается имеющееся моноклональное антитело. В условиях тяжелых побочных эффектов введение моноклональных антител приводит к клиренсу CAR-Т-клетки, и снижает эффекты, не связанные с лечением опухолей.
Тандемная CAR-Т-клетка (TanCAR) экспрессирует один CAR, состоящий из двух связанных одноцепочечных вариабельных фрагментов (scFv), которые имеют разную аффинность, слитые с внутриклеточным костимулирующим доменом(ами) и доменом CD3ζ. Активация TanCAR Т-клеток достигается только тогда, когда клетки-мишени коэкспрессируют обе мишени.
Двойная CAR-Т-клетка экспрессирует два отдельных CAR с разными мишенями связывания лиганда. В качестве неограничивающего примера, один CAR может включать только домен CD3ζ, в то время как другой CAR включает только костимулирующий домен(ы). В некоторых таких вариантах осуществления двойная CAR-Т-клетка активируется, когда обе мишени экспрессируются в опухоли.
Безопасный CAR (sCAR) состоит из внеклеточного scFv, слитого с внутриклеточным ингибиторным доменом. sCAR Т-клетки, коэкспрессирующие стандартный CAR, активируются только при встрече с клетками-мишенями, которые обладают стандартной мишенью CAR, но не имеют мишени sCAR.
В некоторых вариантах осуществления домен распознавания антигена раскрытого CAR представляет собой scFv. В дополнительных вариантах осуществления домен распознавания антигена происходит из одиночных α- и β-цепей нативного Т-клеточного рецептора (TCR), как было здесь описано. Предпочтительно такие домены распознавания антигена имеют простые эктодомены (например, эктодомен CD4 для распознавания HIV-инфицированных клеток). Альтернативно такие домены распознавания антигена содержат экзотические компоненты распознавания, такие как связанный цитокин (который может приводить к распознаванию клеток, несущих цитокиновый рецептор). В общем, в отношении способов, раскрытых здесь, то практически любое, что связывается с данной мишенью с высокой аффинностью, можно использовать в качестве области распознавания антигена.
Внутриклеточный эндодомен передает сигнал иммунной эффекторной клетке, экспрессирующей CAR, после распознавания антигена, активируя, по меньшей мере, одну из нормальных эффекторных функций указанной иммунной эффекторной клетки. В некоторых вариантах осуществления эффекторная функция Т-клетки, например, может быть цитолитической активностью или хелперной активностью, включая секрецию цитокинов. Следовательно, эндодомен может включать «внутриклеточный сигнальный домен» Т-клеточного рецептора (TCR) и необязательных корецепторов. Несмотря на то, что обычно может использоваться полный внутриклеточный сигнальный домен, во многих случаях отсутствует необходимость использовать всю цепь. В той степени, в которой используется усеченная часть внутриклеточного сигнального домена, такая усеченная часть может использоваться вместо интактной цепи при условии, что она передает сигнал эффекторной функции.
Цитоплазматические сигнальные последовательности, которые регулируют первичную активацию комплекса TCR, которые действуют стимулирующим образом, могут содержать сигнальные мотивы, которые известны как иммунорецепторные мотивы активации на основе тирозина (ITAM). Примеры ITAM-содержащих цитоплазматических сигнальных последовательностей включают последовательности, полученные из CD8, CD3ζ, CD3δ, CD3γ, CD3ε, CD32 (FcγRIIA), DAP10, DAP12, CD79a, CD79b, FcγRIγ, FcγRIIIγ, FcεRIβ (FCERIB) и FcεRIγ (FCERIG).
В конкретных вариантах осуществления внутриклеточный сигнальный домен происходит из CD3 дзета (CD3ζ; например, TCR дзета, идентификационный номер в GenBank BAG36664.1). CD3ζ цепь поверхностного Т-клеточного гликопротеина, также известная как дзета-цепь Т-клеточного рецептора или CD247 (кластер дифференцировки 247), представляет собой белок, который у человека кодируется геном CD247. Внутриклеточные хвосты молекул CD3 содержат один ITAM, который необходим для сигнальной функции TCR. Внутриклеточный хвост ζ-цепи (CD3ζ) содержит 3 ITAM. В некоторых вариантах осуществления ζ-цепь представляет собой мутантную ζ-цепь. Например, мутантная ζ-цепь содержит мутацию, такую как точечная мутация, по меньшей мере в одном ITAM, чтобы сделать указанный ITAM нефункциональным. В некоторых таких вариантах осуществления либо проксимальный к мембране ITAM (ITAM1), либо дистальный к мембране ITAM (C-концевой третий ITAM, ITAM3) или либо оба являются нефункциональными. В дополнительных вариантах осуществления либо два проксимальных к мембране ITAM (ITAM1 и ITAM2), либо два дистальных к мембране ITAM (ITAM2 и ITAM3) являются нефункциональными. В еще дополнительных вариантах осуществления только ITAM2 является нефункциональным. В некоторых вариантах осуществления мутантная ζ-цепь содержит делеционную мутацию (например, усечение), так что по меньшей мере один ITAM отсутствует. В некоторых таких вариантах осуществления в ζ-цепи отсутствует проксимальный к мембране ITAM (ITAM1), дистальный к мембране ITAM (ITAM3) или и то, и другое. В еще одних вариантах осуществления в ζ-цепи отсутствуют либо два проксимальные к мембране ITAM (ITAM1 и ITAM2), либо два дистальных к мембране ITAM (ITAM2 и ITAM3). В дополнительных вариантах осуществления в цепи отсутствует ITAM2. Способы получения мутантного CD3ζ известны специалистам в данной области (Bridgeman J.S. et al., Clin. Exp. Immunol., 2014 Feb; 175 (2): 258-67). Удаление, по меньшей мере, одного ITAM из введенного CAR может снизить CD3ζ-опосредованный апоптоз. Альтернативно, удаление хотя бы одного ITAM из введенного CAR может уменьшить его размер без потери функции. CAR, содержащие такие измененные домены CD3ζ, входят в объем настоящего изобретения.
Также предусматриваются CAR, содержащие измененный домен CD28, который придает CAR уникальные функциональные свойства. В этом отношении нативный домен CD28 включает три внутриклеточных субдомена, состоящих из аминокислотных последовательностей YMNM, PRRP и PYAP, которые регулируют сигнальные пути после стимуляции (см., например, WO 2019/010383, включенную здесь посредством ссылки для иллюстрации этой идеи). Конструкции CAR, описанные здесь, могут содержать модифицированный домен CD28, в котором один или более субдоменов YMNM, PRRP и/или PYAP мутированы или делецированы с целью амплификации, ослабления или инактивации указанного субдомена(ов), тем самым модулируя функцию CAR-T.
CAR первого поколения обычно имели внутриклеточный домен из CD3ζ-цепи, который является первичным передатчиком сигналов от эндогенных TCR. В CAR второго поколения добавлены внутриклеточные сигнальные домены из различных рецепторов костимулирующих белков (например, CD28, 41BB, ICOS) к эндодомену CAR для передачи дополнительных сигналов Т-клетке. Например, мишень-специфический ScFv слит с внеклеточным, трансмембранным и внутриклеточным сигнальными доменами костимулирующего рецептора CD28 и цитоплазматическим сигнальным доменом CD3ζ-цепи, ассоциированной с Т-клеточным рецептором. Результаты доклинических исследований показали, что второе поколение конструкций CAR повышает противоопухолевую активность Т-клеток. В еще более поздних CAR третьего поколения объединяются несколько сигнальных доменов для дополнительного увеличения эффективности. Т-клетки, трансплантированные с этими CAR, показали повышенную экспансию, активацию, устойчивость и эффективность в элиминации опухолей независимо от взаимодействия костимулирующего рецептора/лиганда (Imai C. et al., Leukemia, 2004, 18: 676-84; Maher J. et al., Nat. Biotechnol., 2002 20: 70-5).
Например, эндодомен CAR может быть сконструирован таким образом, чтобы содержать сигнальный домен CD3ζ сам по себе или в сочетании с любым другим желаемым цитоплазматическим доменом(и), пригодным в контексте CAR по настоящему изобретению. Например, цитоплазматический домен CAR может включать участок CD3ζ-цепи и костимулирующую сигнальную область. Костимулирующая сигнальная область относится к участку CAR, содержащему внутриклеточный домен костимулирующей молекулы. Костимулирующая молекула представляет собой молекулу клеточной поверхности, отличную от антигенного рецептора или их лигандов, которая необходима для эффективного ответа лимфоцитов на антиген. Примеры таких молекул включают CD27, CD28, 4-1BB (CD137), OX40, CD30, CD40, ICOS, антиген-1, ассоциированный с функцией лимфоцитов (LFA-1), CD2, CD7, LIGHT, NKG2C, B7-H3 и лиганд, который специфически связывается с CD83, CD8, CD4, b2c, CD80, CD86, DAP10, DAP12, MyD88, BTNL3, NKG2D и их мутанты. Таким образом, несмотря на то, что CAR в качестве примера представлен в основном как CD28 в качестве костимулирующего сигнального элемента, другие костимулирующие элементы можно использовать отдельно или в комбинации с другими костимулирующими сигнальными элементами.
В некоторых вариантах осуществления CAR содержит шарнирную последовательность. Шарнирная последовательность представляет собой короткую аминокислотную последовательность, которая обеспечивает гибкость антитела (см., например, Woof et al., Nat. Rev. Immunol., 4 (2): 89-99 (2004)). Шарнирная последовательность может располагаться между участком распознавания антигена (например, анти-CD19, -CD20, -CD22 или scFv) и трансмембранным доменом. Шарнирная последовательность может быть любой подходящей последовательностью, производной или полученной из любой подходящей молекулы. В некоторых вариантах осуществления, например, шарнирная последовательность происходит из молекулы CD8a или молекулы CD28.
Трансмембранный домен может быть получен из природного или синтетического источника. Если источник является природным, то домен может происходить из любого мембраносвязанного или трансмембранного белка. Например, трансмембранный домен может происходить из (т.е. содержать, по меньшей мере, трансмембранную область(и)) альфа (α), бета (β) или дзета (ζ) цепи Т-клеточного рецептора, CD28, CD3ε, CD45, CD4, CD5, CD8 (например, CD8α, CD8β), CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, или CD154, KIRDS2, OX40, CD2, CD27, LFA-1 (CD11a, CD18), ICOS (CD278), 4-1BB (CD137), GITR, CD40, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), CD160, CD19, IL2Rβ, IL2Rγ, IL7Rα, ITGA1, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, TNFR2, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55) , PSGL1, CD100 (SEMA4D), SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR и PAG/Cbp). Альтернативно трансмембранный домен может быть синтетическим, и в этом случае преимущественно он будет содержать гидрофобные остатки, такие как остатки лейцина и валина. В некоторых вариантах осуществления триплет из фенилаланина, триптофана и валина будет находиться на каждом конце синтетического трансмембранного домена. Короткий олиго- или полипептидный линкер, например, длиной от 2 до 10 аминокислот, может образовывать связь между трансмембранным доменом и эндоплазматическим доменом CAR.
Следовательно, в предпочтительных вариантах осуществления изобретения, раскрытых здесь, CAR определяется формулой:
SP-BCA-HG-TM-CSR-SD
где необязательная сигнальная пептидная/лидерная последовательность происходит из лидерной последовательности CD8α,
где В-лимфоцитарный антиген-связывающая область представляет собой scFv, полученный из анти-CD19 антитела, клона FMC63,
где шарнирный домен происходит из человеческого CD28 (например, SEQ ID NO: 12),
где трансмембранный домен происходит из CD28 человека (например, SEQ ID NO: 13),
где костимулирующая сигнальная область происходит из человеческого CD28 (например, SEQ ID NO: 14), и
где сигнальный домен содержит CD3ζ-цепь, где только проксимальный к мембране ITAM (ITAM1) является функциональным (например, SEQ ID NO: 11). Необязательно, CAR может дополнительно содержать, по меньшей мере, одну молекулярную метку, известную в данной области. Например, и без ограничения, CAR может содержать рецептор фактора роста нервов с низким сродством (LNGFR) в качестве метки, которая связывает меченый лиганд, например, 124I-NGF, и такое взаимодействие, например, 124I-NGF/LNGFR, можно отслеживать предпочтительно неинвазивным методом (например, с помощью позитронно-эмиссионной томографии).
В некоторых вариантах осуществления CAR имеет более одного трансмембранного домена, который может представлять собой повтор одного и того же трансмембранного домена или может быть другим трансмембранным доменом.
В некоторых вариантах осуществления CAR представляет собой мультицепочечный CAR, описанный в WO2015/039523, которая включена здесь посредством ссылки. Мультицепочечный CAR может включать отдельные внеклеточные домены связывания лиганда и сигнальные домены в различных трансмембранных полипептидах. Сигнальные домены можно сконструировать таким образом, чтобы собираться в положении рядом c мембраной, что формирует гибкую структуру, близкую к естественным рецепторам, обеспечивая оптимальную передачу сигнала. Например, мультицепочечный CAR может включать участок α-цепи FcεRI и участок β-цепи FcεRI, так что цепи FcεRI спонтанно димеризуются вместе с образованием CAR.
В некоторых вариантах осуществления CAR содержит один сигнальный домен. В других вариантах осуществления CAR содержит один или несколько сигнальных доменов (костимулирующих сигнальных доменов). Один или более сигнальных доменов могут представлять собой полипептиды, выбранные из: CD8, CD3ζ, CD3δ, CD3γ, CD3ε, FcγRI-γ, FcγRIII-γ, FcεRIβ, FcεRIγ, DAP10, DAP12, CD32, CD79a, CD79b, CD28, CD3C, CD4, b2c, CD137 (41BB), ICOS, CD27, CD28δ, CD80, NKp30, OX40 и их мутантов.
В таблицах 1, 2 и 3 ниже представлены некоторые примеры комбинаций мишень-связывающих доменов, костимулирующейих сигнальных доменов и внутриклеточных сигнальных доменов. Такие примеры приведены в целях иллюстрации и не предназначены для того, чтобы представлять собой исчерпывающий список комбинаций, которые могут встречаться в CAR, раскрытых в данном документе.
CAR первого поколения
CAR второго поколения
CAR третьего поколения
CAR с отсутствием костимулирующего сигнала (для подхода с двойным CAR)
CAR с отсутствием костимулирующего сигнала (для подхода с двойным CAR)
CAR третьего поколения с отсутствием сигнального домена (для подхода с двойным CAR)
В некоторых вариантах осуществления B-лимфоцитарный антиген-связывающий агент представляет собой одноцепочечный вариабельный фрагмент антитела (scFv). Предпочтительно, такой B-лимфоцитарный антиген-связывающий агент представляет собой одноцепочечный вариабельный фрагмент (scFv) анти-CD19 антитела. Аффинность/специфичность анти-CD19 scFv в значительной степени определяется специфическими последовательностями в определяющих комплементарность участках (CDR) в вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL). Каждая последовательность VH и VL будет иметь три CDR (CDR1, CDR2, CDR3).
В некоторых вариантах осуществления анти-CD19 связывающий агент получают из природных антител, таких как моноклональные антитела. В некоторых случаях антитело является человеческим антителом. В некоторых случаях антитело подверглось изменению, чтобы сделать его менее иммуногенным при введении людям. Например, изменение включает оду или более методик, выбранных из химеризации, гуманизации, CDR-прививки, деиммунизации и мутации аминокислот каркасной области, чтобы соответствовать наиболее близкой последовательности зародышевой линии человека. Предпочтительно антитело представляет собой FMC63.
В предпочтительных вариантах осуществления анти-CD19 связывающий агент представляет собой одноцепочечный вариабельный фрагмент (scFv) антитела, полученного из антитела FMC63.
Также раскрываются биспецифические CAR, которые нацелены на B-лимфоцитарный антиген, такой как CD19, и, по меньшей мере, на один дополнительный антиген, ассоциированный со злокачественной опухолью (например, опухолевый антиген). Также раскрываются CAR, сконструированные для функционирования только в сочетании с другим CAR, который связывается с другим антигеном, таким как другой антиген, ассоциированный со злокачественной опухолью. Например, в этих вариантах осуществления эндодомен раскрытого CAR может содержать только сигнальный домен (SD) или костимулирующую сигнальную область (CSR), но не то и другое вместе. Второй CAR (или эндогенная Т-клетка) обеспечивает недостающий сигнал, если она активирована. Например, если описанный CAR содержит SD, но не CSR, то иммунная эффекторная клетка, содержащая этот CAR, активируется только в том случае, если другой CAR (или Т-клетка), содержащий CSR, связывается с соответствующим антигеном. Аналогично, если раскрытый CAR содержит CSR, но не SD, то иммунная эффекторная клетка, содержащая этот CAR, активируется только в том случае, если другой CAR (или Т-клетка), содержащий SD, связывается с его соответствующим антигеном.
Указанные опухолевые антигены включают белки, которые продуцируются опухолевыми клетками, вызывающими иммунный ответ, в частности иммунные ответы, опосредованные Т-клетками. Дополнительный антигенсвязывающий домен может представлять собой антитело или природный лиганд опухолевого антигена. Выбор дополнительного антигенсвязывающего домена будет зависеть от конкретного типа рака, подлежащего лечению. Опухолевые антигены хорошо известны в данной области и включают, например, глиома-ассоциированный антиген, карциноэмбриональный антиген (CEA), EGFRvIII, IL-11Ra, IL-13Ra, EGFR, FAP, B7H3, Kit, CA LX, CS-1, MUC1, BCMA, bcr-abl, HER2, β-хорионический гонадотропин человека, альфа-фетопротеин (AFP), ALK, CD19, TIM3, циклин Bl, лектин-реактивный AFP, Fos-родственный антиген 1, ADRB3, тиреоглобулин, EphA2, RAGE-1, RU1, RU2, SSX2, AKAP-4, LCK, OY-TES1, PAX5, SART3, CLL-1, фукозил GM1, GloboH, MN-CA IX, EPCAM, EVT6-AML, TGS5, обратную транскриптазу теломеразы человека, полисиаловую кислоту, PLAC1, RU1, RU2(AS), кишечную карбоксилэстеразу, lewisY, sLe, LY6K, HSP70, HSP27, mut hsp70-2, M-CSF, MYCN, RhoC, TRP-2, CYPIBI, BORIS, простазу, простатспецифический антиген (PSA), PAX3, PAP, NY-ESO-1, LAGE-la, LMP2, NCAM, p53, мутант p53, мутант Ras, gplOO, простеин, OR51E2, PANX3, PSMA, PSCA, Her2/neu, hTERT, HMWMAA, HAVCR1, VEGFR2, PDGFR-beta, сурвивин и теломеразу, легумаин, HPV E6, E7, белок спермы 17, SSEA-4, тирозиназу, TARP, WT1, опухолевый антиген-1 карциномы предстательной железы (PCTA-1), ML-IAP, MAGE, MAGE-A1, MAGE-A2, MAGE-C1, MAGE-C2, аннексин-A2, MAD-CT-1, MAD-CT-2, MelanA/MART 1, XAGE1, ELF2M, ERG (гибридный ген TMPRSS2 ETS), NA17, эластазу нейтрофилов, контрольные точки транслокации саркомы, NY-BR-1, ephnnB2, CD20, CD22, CD24, CD30, TIM3, CD38, CD44v6, CD97, CD171, CD179a, рецептор андрогенов, FAP, инсулиноподобный фактор роста (IGF)-I, IGFII, рецептор IGF-I, GD2, о-ацетил-GD2, GD3, GM3, GPRC5D, GPR20, CXORF61, рецептор фолиевой кислоты (FRa), рецептор фолиевой кислоты бета, ROR1, Flt3, TAG72, TN Ag, Tie 2, TEM1, TEM7R, CLDN6, TSHR, UPK2 и мезотелин. В некоторых предпочтительных вариантах осуществления опухолевый антиген выбран из рецептора фолиевой кислоты (FRa), мезотелина, EGFRvIII, IL-13Ra, CD123, CD19, TIM3, BCMA, GD2, CLL-1, CA-IX, MUC1, HER2 и любой их комбинации.
Дополнительные неограничивающие примеры опухолевых антигенов включают следующие: антигены дифференцировки, такие как тирозиназа, TRP-1, TRP-2, и опухолеспецифические антигены многих линий дифференцировки, такие как MAGE-1, MAGE-3, BAGE, GAGE-1, GAGE-2, pi 5; сверхэкспрессированные эмбриональные антигены, такие как СЕА; сверхэкспрессированные онкогены и мутированные гены-супрессоры опухолей, такие как p53, Ras, HER-2/neu; уникальные опухолевые антигены, образовавшиеся в результате хромосомных транслокаций; такие как BCR-ABL, E2A-PRL, H4-RET, IGH-IGK, MYL-RAR; и вирусные антигены, такие как антигены вируса Эпштейна-Барра EBVA и антигены E6 и E7 вируса папилломы человека (HPV). Другие крупные антигены на основе белков включают SCCA, GP73, FC-GP73, TSP-180, MAGE-4, MAGE-5, MAGE-6, RAGE, NY-ESO, pl85erbB2, pl80erbB-3, c-met, nm-23H1, PSA, CA 19-9, CA 72-4, CAM 17.1, NuMa, K-ras, бета-катенин, CDK4, Mum-1, p 15, p 16, 43-9F, 5T4, 791Tgp72, альфа-фетопротеин, beta-HCG, BCA225, BTAA, CA 125, CA 15-3/CA 27.29/BCAA, CA 195, CA 242, CA-50, CAM43, CD68/P1, CO-029, FGF-5, G250, Ga733/EpCAM, HTgp-175, M344, MA-50, MG7-Ag, MOV18, NB/70K, NY-CO-1, RCASl, SDCCAG1 6, TA-90/Mac-2 связывающий белок/циклофилин C-ассоциированный белок, TAAL6, TAG72, TLP, TPS, GPC3, MUC16, TAG-72, LMP1, EBMA-1, BARF-1, CS1, CD319, HER1, B7H6, L1CAM, IL6 и MET.
CAR-лиганд-связывающие домены
Внеклеточный домен CAR, раскрытых здесь, обычно включает домен распознавания антигена, который связывается с антигеном-мишенью. Такие антигенспецифические связывающие домены обычно получают из антитела. В некоторых вариантах осуществления антигенсвязывающий домен представляет собой функциональный фрагмент антитела или его производное (например, scFv или Fab, или любой подходящий антигенсвязывающий фрагмент антитела). В предпочтительных вариантах осуществления антигенсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент (scFv). В некоторых таких вариантах осуществления scFv происходит из моноклонального антитела (mAb). В некоторых предпочтительных вариантах осуществления антигенспецифический связывающий домен (например, scFv) слит с трансмембранными и/ или сигнальными мотивами, участвующими в активации лимфоцитов, как описано в публикации Sadelain et al., Nat. Rev. Cancer, 2003, 3: 35-45, которая в полном объеме включена здесь посредством ссылки.
Анти-B-лимфоцитарный антиген scFv
В некоторых вариантах осуществления анти-B-лимфоцитарный антиген scFv может содержать вариабельную область тяжелой цепи (VH), имеющую последовательности CDR1, CDR2 и CDR3, и вариабельную область легкой цепи (VL), имеющую последовательности CDR1, CDR2 и CDR3. В предпочтительных вариантах осуществления анти-B-лимфоцитарный антиген scFv представляет собой анти-CD19, анти-CD20 или анти-CD22 scFv. Наиболее предпочтительно scFv представляет собой анти-CD19 scFv.
Некоторые такие антитела описаны, например, в публикациях Zola et al., «Preparation and characterization of a chimeric CD19 monoclonal antibody», Immunology and Cell Biology 1991, 69, 411-422; и Nicholson et al., «Construction and Characterization of a Functional CD19 Specific Single Chain Fv Fragment For Immunotherapy of B Lineage Leukemia AND Lymphoma», Molecular Immunology 1997, (34) 16-17, 1147-1165. Данные публикации в полном объеме включены здесь посредством ссылки и, в частности, в отношении антител, описанных в них.
Нуклеиновые кислоты и векторы
Также настоящее изобретение относится к полинуклеотидам и полинуклеотидным векторам, кодирующим раскрытые В-лимфоцитарный антиген-специфические CAR, которые обеспечивают экспрессию В-лимфоцитарный антиген-специфических CAR, в раскрытых иммунных эффекторных клетках.
Последовательности нуклеиновых кислот, кодирующие раскрытые CAR и их домены, могут быть получены с использованием рекомбинантных методов, известных в данной области, например, таких как скрининг библиотек клеток, экспрессирующих ген, получением гена из вектора, о котором известно, что он включает его, или непосредственным выделением из клеток и тканей, содержащих его, с использованием стандартных методик. Альтернативно, ген, представляющий интерес, можно получить синтетическим путем, а не клонировать. Типичная последовательность нуклеиновой кислоты может кодировать CAR, содержащий каждое из лидерной последовательности CD8, нацеливающего домена scFv FMC63, домена CD28, мутантного домена CD3ζ (например, нефункционального домена CD3ζ в двух C-концевых доменах ITAM, т.е. ITAM2 и ITAM3) или любую их комбинацию. Предпочтительно, такой CAR может кодироваться последовательностью нуклеиновой кислоты, содержащей последовательность, показанную в SEQ ID NO: 1.
ATGGCTCTCCCAGTGACTGCCCTACTGCTTCCCCTAGCGCTTCTCCTGCATGCAGACATCCAGATGACCCAGACCACAAGCAGCCTGTCTGCCAGCCTGGGCGATAGAGTGACCATCAGCTGTAGAGCCAGCCAGGACATCAGCAAGTACCTGAACTGGTATCAGCAGAAACCCGACGGCACCGTGAAGCTGCTGATCTACCACACCAGCAGACTGCACAGCGGCGTGCCAAGCAGATTTTCTGGCAGCGGCTCTGGCACCGACTACAGCCTGACAATCAGCAACCTGGAACAAGAGGATATCGCTACCTACTTCTGCCAGCAAGGCAACACCCTGCCTTACACCTTTGGCGGAGGCACCAAGCTGGAAATCACCGGCTCTACAAGCGGCAGCGGCAAACCTGGATCTGGCGAGGGATCTACCAAGGGCGAAGTGAAACTGCAAGAGTCTGGCCCTGGACTGGTGGCCCCATCTCAGTCTCTGAGCGTGACCTGTACAGTCAGCGGAGTGTCCCTGCCTGATTACGGCGTGTCCTGGATCAGACAGCCTCCTCGGAAAGGCCTGGAATGGCTGGGAGTGATCTGGGGCAGCGAGACAACCTACTACAACAGCGCCCTGAAGTCCCGGCTGACCATCATCAAGGACAACTCCAAGAGCCAGGTGTTCCTGAAGATGAACAGCCTGCAGACCGACGACACCGCCATCTACTATTGCGCCAAGCACTACTACTACGGCGGCAGCTACGCCATGGATTATTGGGGCCAGGGCACCAGCGTGACCGTTTCTTCTGCGGCCGCAATTGAAGTTATGTATCCTCCTCCTTACCTAGACAATGAGAAGAGCAATGGAACCATTATCCATGTGAAAGGGAAACACCTTTGTCCAAGTCCCCTATTTCCCGGACCTTCTAAGCCCTTTTGGGTGCTGGTGGTGGTTGGTGGAGTCCTGGCTTGCTATAGCTTGCTAGTAACAGTGGCCTTTATTATTTTCTGGGTGAGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCCAGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACCAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTTCAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTTCAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTTCCAGGGGCTCAGTACAGCCACCAAGGACACCTTCGACGCCCTTCACATGCAGGCCCTGCCCCCTCGC (SEQ ID NO: 1)
(нуклеотиды 1-54)
(нуклеотиды 55-789)
(нуклеотиды 799-1119)
(нуклеотиды 1120-1455)
Экспрессия нуклеиновых кислот, кодирующих CAR, обычно достигается функциональным связыванием нуклеиновой кислоты, кодирующей полипептид CAR, с промотором и включением конструкции в экспрессионный вектор. Типичные клонирующие векторы содержат терминаторы транскрипции и трансляции, инициирующие последовательности и промоторы, пригодные для регуляции экспрессии желаемой последовательности нуклеиновой кислоты.
Раскрытую нуклеиновую кислоту можно клонировать в ряд векторов различных типов. Например, нуклеиновая кислота может быть клонирована в вектор, включая, не ограничиваясь этим, плазмиду, фагмиду, производное фага, вирус животного и космиду. Векторы, представляющие особый интерес, включают векторы экспрессии, векторы репликации, векторы генерации зондов и векторы секвенирования.
Кроме того, экспрессионный вектор может быть обеспечен в клетке в форме вирусного вектора. Технология вирусных векторов хорошо известна в данной области и описана, например, в руководстве Sambrook et al. (2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York), а также в других руководствах по вирусологии и молекулярной биологии. Вирусы, которые можно использовать в качестве векторов, включают, не ограничиваясь этим, ретровирусы, аденовирусы, аденоассоциированные вирусы, вирусы герпеса и лентивирусы. Как правило, подходящий вектор содержит ориджин репликации, функционирующий, по меньшей мере, в одном организме, промоторную последовательность, подходящие сайты рестрикционных эндонуклеаз и один или более селектируемых маркеров. В некоторых вариантах осуществления полинуклеотидные векторы представляют собой лентивирусные или ретровирусные векторы.
Для переноса генов в клетки млекопитающих был разработан ряд вирусных систем. Например, ретровирусы обеспечивают удобную платформу для систем доставки генов. Выбранный ген можно вставить в вектор и упаковать в ретровирусные частицы с использованием методов, известных в данной области. Затем рекомбинантный вирус можно выделить и доставить в клетки субъекта либо in vivo, либо ex vivo.
Одним примером подходящего промотора является последовательность промотора немедленно-ранних генов цитомегаловируса (CMV). Данная промоторная последовательность представляет собой последовательность конститутивного сильного промотора, способного обеспечивать высокие уровни экспрессии любой полинуклеотидной последовательности, функционально связанной с ним. Другим примером подходящего промотора является промотор фактора элонгации-1α (EF-1α). Однако также можно использовать другие конститутивные промоторные последовательности, включая, помимо прочего, ранний промотор обезьяньего вируса 40 (SV40), промотор MND (вируса миелопролиферативной саркомы), промотор вируса опухоли молочной железы мыши (MMTV), промотор вируса иммунодефицита человека (ВИЧ), промотор длинного концевого повтора (LTR), промотор MoMuLV, промотор вируса лейкоза птиц, немедленно-ранний промотор вируса Эпштейна-Барра, промотор вируса саркомы Рауса, а также промоторы генов человека, такие как, помимо прочего, промотор актина, промотор миозина, промотор гемоглобина и промотор креатинкиназы. В качестве альтернативы промотор может представлять собой индуцибельный промотор. Примеры индуцибельных промоторов включают, не ограничиваясь этим, промотор металлотионеина, промотор глюкокортикоида, промотор прогестерона и тетрациклин-зависимый промотор.
Дополнительные промоторные элементы, например энхансеры, регулируют частоту инициации транскрипции. Обычно они располагаются в области 30-110 п.н. выше стартового сайта, хотя недавно было показано, что ряд промоторов также содержат функциональные элементы ниже стартового сайта. Промежуток между промоторными элементами часто бывает гибким, так что функция промотора сохраняется, когда элементы инвертируются или перемещаются относительно друг друга.
Для оценки экспрессии полипептида CAR или его участков, экспрессионный вектор, который должен быть введен в клетку, может также содержать либо селектируемый маркерный ген, либо репортерный ген, либо оба, чтобы облегчить идентификацию и селекцию экспрессирующих клеток из популяции клеток, подлежащих трансфектированию или инфицированию вирусными векторами. В других аспектах селектируемый маркер может находиться на отдельном участке ДНК и использоваться в процедуре котрансфекции. Как селектируемые маркеры, так и репортерные гены могут быть фланкированы соответствующими регуляторными последовательностями для обеспечения экспрессии в клетках-хозяевах. Пригодные селектируемые маркеры включают, например, гены устойчивости к антибиотикам.
Репортерные гены используются для идентификации потенциально трансфектированных клеток и для оценки функциональности регуляторных последовательностей. В общем, репортерный ген представляет собой ген, который отсутствует или не экспрессируется в организме или ткани реципиента и который кодирует полипептид, экспрессия которого проявляется некоторым легко обнаруживаемым свойством, например ферментативной активностью, флуоресцентностью, специфическим связыванием с детектируемым лигандом. Экспрессию репортерного гена анализируют в соответствующее время после того, как ДНК была введена в клетки-реципиенты. Подходящие репортерные гены могут включать гены, кодирующие люциферазу, β-галактозидазу, хлорамфениколацетилтрансферазу, секретируемую щелочную фосфатазу или ген зеленого флуоресцентного белка. Например, в некоторых вариантах осуществления CAR, раскрытые здесь, и/или последовательность нуклеиновой кислоты, кодирующей указанные CAR, могут дополнительно содержать, по меньшей мере, одну молекулярную метку, которые известны в данной области. Не желая связываться какой-либо конкретной теорией или стратегией, метка может включать рецептор фактора роста нервов с низким сродством (LNGFR) в качестве метки трансдукции, которая связывает меченый лиганд 124I-NGF. Взаимодействие 124I-NGF/LNGFR можно контролировать неинвазивно (например, с помощью позитронно-эмиссионной томографии). В некоторых таких вариантах осуществления последовательности нуклеиновой кислоты вектора, кодирующего CAR, описанные здесь, могут содержать последовательность нуклеиновой кислоты, кодирующую последовательность рибосомного «пропуска», такую как последовательность, кодирующая 2А-пептид. 2А-пептиды, которые были идентифицированы в подгруппе афтовирусов пикорнавирусов, вызывают рибосомный «проскок» от одного кодона к другому без образования пептидной связи между двумя аминокислотами, кодированными кодонами. Таким образом, два полипептида могут синтезироваться из одной непрерывной открытой рамки считывания в мРНК, когда полипептиды разделены олигопептидной последовательностью 2А, которая находится в рамке (например, когда CAR и репортерный ген, такой как молекулярная метка, разделены олигопептидной последовательностью 2А). Такие механизмы рибосомного «проскока» или «саморасщепления» хорошо известны в данной области и, как известно, используются в нескольких векторах для экспрессии нескольких белков, кодированных одной информационной РНК.
Для направления полипептидов (например, секретированных, трансмембранных полипептидов и/или полипептидов на клеточной поверхности) на секреторный путь клетки-хозяина, обеспечивается секреторная сигнальная последовательность (также просто известная как сигнальная последовательность, лидерная последовательность, пре-про-последовательность или пре-последовательность) в полинуклеотидной последовательности или векторной последовательности. Секреторная сигнальная последовательность функционально связана с последовательностью нуклеиновой кислоты, кодирующей интересующий полипептид (например, CAR). Две последовательности объединяются в правильную рамку считывания и располагаются таким образом, чтобы направлять вновь синтезированный полипептид на секреторный путь клетки-хозяина. Такие секреторные сигнальные последовательности обычно располагаются 5' относительно последовательности нуклеиновой кислоты, кодирующей представляющий интерес полипептид, хотя некоторые секреторные сигнальные последовательности могут располагаться в других местах в интересующей последовательности нуклеиновой кислоты. Следовательно, в предпочтительных вариантах осуществления CAR, раскрытые здесь, и/или последовательность нуклеиновой кислоты, кодирующая указанные CAR, могут дополнительно содержать сигнальную последовательность. Наиболее предпочтительно сигнальная последовательность включает лидерную последовательность CD8α или ее фрагмент. Специалистам в данной области будет понятно, что в результате посттрансляционных модификаций такие лидерные последовательности могут удаляться из полипептида CAR, представленного на поверхности клетки (т.е. зрелого полипептида CAR).
Подходящие экспрессионные системы хорошо известны и могут быть получены с использованием известных методик или приобретены коммерчески. Как правило, конструкция с минимальной 5'-фланкирующей областью, показывающей наиболее высокий уровень экспрессии репортерного гена, идентифицируется в качестве промотора. Такие промоторные области могут быть связаны с репортерным геном и использоваться для оценки способности агентов модулировать управляемую промотором транскрипцию. Способы введения и экспрессии генов в клетке известны в данной области. В контексте экспрессионного вектора, то вектор можно легко ввести в клетку-хозяин, например, в клетку млекопитающих, бактерий, дрожжей или насекомых, любым способом, известным в данной области. Например, экспрессионный вектор может быть перенесен в клетку-хозяин физическими, химическими или биологическими способами.
Физические методы введения полинуклеотида в клетку-хозяин включают осаждение фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию и тому подобное. Способы получения клеток, содержащих векторы и/или экзогенные нуклеиновые кислоты, хорошо известны в данной области. См., например, Sambrook et al. (2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York).
Биологические методы введения полинуклеотида, представляющего интерес, в клетку-хозяин включают использование ДНК- и РНК-векторов. Вирусные векторы, и, в частности, ретровирусные векторы, стали наиболее широко используемым методом встраивания генов в клетки млекопитающих, например, в клетки человека.
Химические методы введения полинуклеотида в клетку-хозяин включают коллоидные дисперсионные системы, такие как макромолекулярные комплексы, нанокапсулы, микросферы, гранулы и системы на основе липидов, включая эмульсии масло-в-воде, мицеллы, смешанные мицеллы и липосомы. Типичной коллоидной системой для использования в качестве средства доставки in vitro и in vivo является липосома (например, искусственная мембранная везикула).
В случае использования невирусной системы доставки типичным средством доставки является липосома. В еще одном аспекте нуклеиновая кислота может быть связана с липидом. Нуклеиновую кислоту, связанную с липидом, можно инкапсулировать во внутреннем водном пространстве липосомы, встроить в липидный бислой липосомы, присоединить к липосоме через связывающую молекулу, которая связана как с липосомой, так и с олигонуклеотидом, включенным в липосому, комплексовать с липосомой, диспергировать в растворе, содержащем липид, смешать с липидом, объединить с липидом, включить в виде суспензии в липид, включить или комплексовать с мицеллой или иным образом связать с липидом. Композиции, связанные с липидом, липидом/ДНК или липидом/экспрессионным вектором, не ограничиваются какой-либо конкретной структурой в растворе. Например, они могут находиться в бислойной структуре, в виде мицелл или со «сжатой» структурой. Их также можно просто ввести в раствор, возможно, формируя агрегаты неоднородного размера или формы. Липиды представляют собой жиры, которые могут быть природными или синтетическими липидами. Например, липиды включают жировые капли, которые естественным образом встречаются в цитоплазме, а также группу соединений, которые содержат длинноцепочечные алифатические углеводороды и их производные, такие как жирные кислоты, спирты, амины, аминоспирты и альдегиды. Липиды, подходящие для использования, можно получить из коммерческих источников. Например, димиристилфосфатидилхолин («DMPC») можно получить от компании Sigma, St. Louis, Mo; дицетилфосфат («DCP») можно получить от компании K&K Laboratories (Plainview, N.Y.); холестерин («Choi») можно получить от компании Calbiochem-Behring; димиристилфосфатидилглицерин («DMPG») и другие липиды могут быть получены от компании Avanti Polar Lipids, Inc. (Birmingham, Ala.).
Иммунные эффекторные клетки
Настоящее изобретение также относится к иммунным эффекторным клеткам, которые сконструированы для экспрессии раскрытых CAR (также называемых здесь «CAR-T-клетками»). Эти клетки предпочтительно получают от субъекта, который подвергается лечению (т.е. являются аутологичными). Однако в некоторых вариантах осуществления используются линии иммунных эффекторных клеток или донорские эффекторные клетки (аллогенные). Иммунные эффекторные клетки могут быть получены из ряда источников, включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из очага инфекции, асцит, плевральный выпот, ткань селезенки и опухоли. Иммунные эффекторные клетки можно получить из крови, отобранной у субъекта, с использованием любого ряда методов, известных специалисту в данной области, таких как разделение в системе Ficoll™. Например, клетки из кровеносной системы субъекта можно получить аферезом. В некоторых вариантах осуществления иммунные эффекторные клетки выделяют из лимфоцитов периферической крови посредством лизиса эритроцитов и истощения моноцитов, например, центрифугированием в градиенте PERCOLL™ или проточным элютриационным центрифугированием. Конкретную субпопуляцию иммунных эффекторных клеток можно дополнительно выделить методами положительной или отрицательной селекции. Например, иммунные эффекторные клетки можно выделить с использованием комбинации антител, направленных на поверхностные маркеры, уникальные для положительно селектированных клеток, например, инкубацией с антитело-конъюгированными гранулами в течение периода времени, достаточного для положительной селекции желаемых иммунных эффекторных клеток. Альтернативно, обогащение популяции иммунных эффекторных клеток может быть достигнуто отрицательной селекцией с использованием комбинации антител, направленных на поверхностные маркеры, уникальные для отрицательно селектированных клеток.
В некоторых вариантах осуществления иммунные эффекторные клетки содержат любые лейкоциты, участвующие в защите организма от инфекционных заболеваний и чужеродных веществ. Например, иммунные эффекторные клетки могут включать лимфоциты, моноциты, макрофаги, дендритные клетки, тучные клетки, нейтрофилы, базофилы, эозинофилы или любые их комбинации. Например, иммунные эффекторные клетки могут включать Т-лимфоциты, предпочтительно цитотоксические Т-лимфоциты (CTL).
Т-клетки или Т-лимфоциты можно отличить от других лимфоцитов, таких как В-клетки и естественные киллеры (NK-клетки), по наличию Т-клеточного рецептора (TCR) на клеточной поверхности. Их называют Т-клетками, потому что они созревают в тимусе (хотя некоторые также созревают в миндалинах). Существует несколько субпопуляций Т-клеток, каждая из которых выполняет различную функцию.
Т-хелперные клетки (TH-клетки) помогают другим лейкоцитам в иммунологических процессах, включая созревание B-клеток с переходомом в плазматические клетки и B-клетки памяти, а также активацию цитотоксических T-клеток и макрофагов. Эти клетки также известны как CD4+ Т-клетки, потому что они экспрессируют гликопротеин CD4 на своей поверхности. Т-хелперные клетки активируются, когда они презентируются пептидными антигенами молекулами MHC класса II, которые экспрессируются на поверхности антигенпрезентирующих клеток (APC). После активации они быстро делятся и секретируют небольшие белки, называемые цитокинами, которые регулируют и помогают проявлению активного иммунного ответа. Эти клетки могут дифференцироваться в один из нескольких субтипов, включая TH1, TH2, TH3, TH17, TH9 или TFH, которые секретируют разные цитокины для обеспечения иммунного ответа другого типа.
Цитотоксические Т-клетки (TC-клетки или CTL) разрушают инфицированные вирусом клетки и опухолевые клетки, а также участвуют в отторжении трансплантата. Данные клетки также известны как CD8+ Т-клетки, поскольку они экспрессируют гликопротеин CD8 на своей поверхности. Эти клетки распознают свои мишени посредством связывания с антигеном, ассоциированным с молекулами MHC класса I, которые присутствуют на поверхности всех ядросодержащих клеток. Через IL-10, аденозин и другие молекулы, секретируемые регуляторными Т-клетками, CD8+ клетки могут инактивироваться до анергического состояния, что предотвращает развитие аутоиммунных заболеваний.
Т-клетки памяти представляют собой субпопуляцию антиген-специфических Т-клеток, которые сохраняются в течение длительного времени после разрешения инфекции. Они быстро экспандируют с образованием большого числа эффекторных Т-клеток при повторном контакте со своим родственным антигеном, тем самым обеспечивая иммунную систему «памятью» против предшествующих инфекций. Клетки памяти могут представлять собой CD4+ или CD8+ Т-клетки памяти, которые обычно экспрессируют белок клеточной поверхности CD45RO.
Регуляторные Т-клетки (Тreg-клетки), ранее известные как Т-супрессоры, имеют ключевое значение для поддержания иммунологической толерантности. Их основная роль заключается в «отключении» опосредованного Т-клетками иммунитета к концу иммунной реакции и в подавлении аутореактивных Т-клеток, которые избежали процесса негативной селекции в тимусе. Были описаны два основных класса CD4+ Treg-клеток - естественные Treg-клетки и адаптивные Treg-клетки.
Естественные T-клетки киллеры (NKT) (не следует путать с естественными киллерами (NK)) соединяют адаптивную иммунную систему с врожденной иммунной системой. В отличие от обычных T-клеток, которые распознают пептидные антигены, презентированные молекулами главного комплекса гистосовместимости (MHC), NKT-клетки распознают гликолипидный антиген, представленный молекулой CD1d.
В некоторых вариантах осуществления Т-клетки содержат смесь CD4+ клеток. В других вариантах осуществления Т-клетки обогащают одной или более субпопуляциями на основе экспрессии на клеточной поверхности. Например, в некоторых случаях Т-клетки представляют собой цитотоксические CD8+ Т-лимфоциты. В некоторых вариантах осуществления Т-клетки включают γδТ-клетки, которые обладают другим Т-клеточным рецептором (TCR), имеющим одну γ-цепь и одну δ-цепь вместо α- и β-цепей.
Естественные киллеры (NK) представляют собой крупные гранулярные CD56+CD3 лимфоциты, которые могут приводить к киллингу инфицированных вирусом и трансформированных клеток, и составляют критическую клеточную субпопуляцию врожденной иммунной системы (Godfrey J. et al., Leuk. Lymphoma, 2012, 53: 1666-1676). В отличие от цитотоксических CD8+ Т-лимфоцитов, NK-клетки проявляют цитотоксичность против опухолевых клеток без необходимости в предварительной сенсибилизации, а также могут уничтожать MHC-I-негативные клетки (Narni-Mancinelli E. et al., Int. Immunol., 2011, 23: 427-431). NK-клетки являются более безопасными эффекторными клетками, поскольку они могут избежать потенциально летальных осложнений «цитокиновых штормов» (Morgan R.A. et al., Mol. Ther., 2010, 18: 843-851), синдрома лизиса опухоли (Porter D.L. et al., N. Engl. J. Med., 2011 365: 725-733), а также эффектов на-мишени, вне опухоли. Несмотря на то, что NK-клетки играют хорошо известную роль киллеров опухолевых клеток, и повреждение NK-клеток широко задокументировано как имеющее решающее значение для прогрессирования множественной миеломы (MM) (Godfrey J. et al., Leuk. Lymphoma, 2012, 53: 1666-1676; Fauriat C. et al., Leukemia, 2006, 20: 732-733), средства, с помощью которых можно было бы усилить опосредованную NK-клетками активность против ММ, были в значительной степени не исследованы до раскрытых CAR.
Лимфопролиферативные заболевания (EBV-LPD), индуцированные вирусом Эпштейна-Барра (EBV), и другие виды рака, ассоциированного с EBV, являются важной причиной заболеваемости и смертности у реципиентов при аллогенной трансплантации гемопоэтических клеток (HCT) или трансплантации солидных органов (SOT), особенно для получивших определенные Т-клеточные реактивные Ab для профилактики или лечения синдрома «трансплантат против хозяина» (GVHD). Профилактика и лечение посредством адаптивного переноса аутологичных или аллогенных EBV-специфических цитотоксических Т-клеток и последующего длительного восстановления иммунитета против EBV-ассоциированной лимфопролиферации обеспечили положительные результаты в лечении таких неизменно фатальных осложнений, возникающих в результате переноса аллогенной ткани. Следовательно, в некоторых вариантах осуществления раскрытые иммунные эффекторные клетки, которые содержат один или более полипептидов CAR по настоящему изобретению, представляют собой аллогенные или аутологичные EBV-специфические цитотоксические Т-лимфоциты (CTL). Например, конструирование EBV-специфических цитотоксических Т-клеток может включать выделение PBMC от EBV-серопозитивного аутологичного или аллогенного донора и обогащение их Т-клетками посредством истощения моноцитов и NK-клеток. EBV-специфические цитотоксические Т-клетки также можно получить контактированием донорских РВМС или очищенных донорских Т-клеток со «стимулирующей» клеткой, которая экспрессирует один или более антигенов EBV и презентирует антиген(ы) EBV нестимулированным Т-клеткам, тем самым вызывая стимуляцию и экспансию EBV-специфических CTL. Антигены EBV включают, например, латентный мембранный белок (LMP) и белки ядерного антигена EBV (EBNA), такие как LMP-1, LMP-2A и LMP-2B и EBNA-1, EBNA-2, EBNA-3A, EBNA-3B, EBNA-3C и EBNA-LP. Цитотоксические Т-клетки, которые содержат Т-клеточный рецептор(ы), которые распознают один или более EBV-специфических антигенов, считаются «сенсибилизированными» к этому антигену(ам) EBV и, следовательно, называются здесь «EBV-сенсибилизированными цитотоксическими Т-клетками». Известные способы создания популяций аллогенных или аутологичных EBV-специфических цитотоксических Т-клеток, которые могут содержать один или более полипептидов CAR по настоящему изобретению, описаны, например, в публикациях Barker et al., Blood, 2010 116(23):5045-49; Doubrovina et al., Blood, 2012 119(11):2644-56; Koehne et al., Blood, 2002 99(5):1730-40; и Smith et al., Cancer Res., 2012, 72(5):1116-25, которые включены здесь посредством ссылки. Аналогично цитотоксические Т-клетки могут быть «сенсибилизированы» к другим вирусным антигенам, включая цитомегаловирус (CMV), папилломавирус (например, HPV), аденовирус, полиомавирус (например, BKV, JCV и вирус клеток Меркеля), ретровирус (например, HTLV-I, также включая лентивирус, такой как HIV), пикорнавирус (например, вирус гепатита А), гепаднавирус (например, вирус гепатита В), гепацивирус (например, вирус гепатита С), дельтавирус (например, вирус гепатита D), гепевирус (например, вирус гепатита Е) и тому подобное. В некоторых предпочтительных вариантах осуществления целевой антиген происходит из онковируса. В некоторых таких вариантах осуществления Т-клетки, используемые для генерации CAR-T-клеток по изобретению, представляют собой полифункциональные Т-клетки, т.е. такие Т-клетки, которые способны индуцировать многочисленные иммунные эффекторные функции, которые обеспечивают более эффективный иммунный ответ на патоген, чем клетки, которые продуцируют, например, только один иммунный эффектор (например, единственный биомаркер, такой как цитокин или CD107a). Менее полифункциональные, монофункциональные или даже «истощенные» Т-клетки могут доминировать в иммунных ответах во время хронических инфекций, тем самым отрицательно влияя на защиту от вирус-ассоциированных осложнений. В других предпочтительных вариантах осуществления CAR-T-клетки по настоящему изобретению являются полифункциональными. В некоторых вариантах осуществления, по меньшей мере, 50% Т-клеток, используемых для получения CAR-T-клеток по изобретению, представляют собой CD4+ Т-клетки. В некоторых таких вариантах осуществления указанные Т-клетки составляют менее 50% CD4+ Т-клеток. В других вариантах осуществления указанные Т-клетки преимущественно представляют собой CD4+ Т-клетки. В некоторых вариантах осуществления, по меньшей мере, 50% Т-клеток, используемых для генерации CAR-T-клеток по настоящему изобретению, представляют собой CD8+ Т-клетки. В некоторых таких вариантах осуществления указанные Т-клетки составляют менее 50% CD8+ Т-клеток. В еще одних вариантах осуществления указанные Т-клетки преимущественно представляют собой CD8+ Т-клетки. В некоторых вариантах осуществления Т-клетки (например, сенсибилизированные Т-клетки и/или CAR-T-клетки, описанные здесь) хранятся в библиотеке или банке клеток перед их введением субъекту. Способы, раскрытые здесь (например, селекция и/или получение иммунных эффекторных клеток, раскрытых здесь, включая CAR-T-клетки по изобретению), включают селекцию и/или модификацию аллогенных иммунных эффекторных клеток (например, PBMC, CD4+ T клетки, CD8+ Т-клетки и/или CAR-T-клетки) из банка клеток, такого как предварительно созданный банк клеток, полученный от стороннего донора. Такой банк клеток может включать образцы донорских РВМС. Предпочтительно банк клеток включает образцы доноров, где эффекторные иммунные клетки были обогащены. Наиболее предпочтительно, чтобы банк содержал донорские CD4+ и/или CD8+ Т-клетки. В некоторых таких вариантах осуществления банк донорских клеток включает антигенспецифические иммунные эффекторные клетки (например, сенсибилизированные Т-клетки и/или CAR-T-клетки, описанные здесь). В предпочтительных вариантах осуществления тип HLA донорских клеток, описанных здесь, известен. Соответственно, способы, раскрытые здесь, дополнительно включают селекцию аллогенных иммунных эффекторных клеток (например, Т-клеток и/ или CAR-T-клеток, описанных здесь), поскольку они экспрессируют TCR, ограниченный молекулами MHC класса I, который кодируется присутствующим аллелем HLA у субъекта. Например, аллогенные Т-клетки (например, CD4+ Т-клетки, CD8+ Т-клетки и/или CAR-T-клетки, описанные здесь) селектируются, если указанные Т-клетки и реципиент (например, субъект, нуждающийся в лечении) имеют, по меньшей мере, 2 общих (например, по меньшей мере, 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6) аллеля HLA и клетки ограничены общим аллелем HLA. Предпочтительно, такие методы включают тестирование репертуара TCR предварительно созданных эпитоп-специфических Т-клеток, полученных от стороннего донора (т.е. аллогенных Т-клеток и/или CAR-T-клеток), с помощью методов, известных в данной области, таких как проточная цитометрия, тетрамерный анализ, анализ ELISA, анализ вестерн-блоттингом, флуоресцентная микроскопия, анализ деградации Эдмана и/или масс-спектрометрический анализ (например, секвенирование белков). В некоторых вариантах осуществления репертуар TCR анализируется с использованием нуклеиновокислотного зонда, анализа амплификацией нуклеиновой кислоты и/или анализа секвенированием.
В некоторых вариантах осуществления сконструированные CAR T-клетки, экспрессирующие описанные CAR, дополнительно экспрессируют доминантно-негативную мутацию, которая влияет на блокаду иммунных контрольных точек (например, экспрессируют доминантно-негативную форму молекулы иммунных контрольных точек, такую как PD-1). Не являясь исчерпывающим списком, молекула иммунных контрольных точек выбрана из белка запрограммированной смерти клеток 1 (PD-1), цитотоксического Т-лимфоцитарного антигена-4 (CTLA-4), аттенюатора В- и Т-лимфоцитов (BTLA), Т-клеточного иммуноглобулина и муцина-3 (TIM-3), белка активации лимфоцитов 3 (LAG-3), Т-клеточного иммунорецептора с доменами Ig и ITIM (TIGIT), лейкоцит-ассоциированного иммуноглобулиноподобного рецептора 1 (LAIR1), рецептора естественных киллеров 2B4 (2B4) и CD160. Молекула иммунных контрольных точек также может представлять собой рецептор трансформирующего фактора роста β (TGF-β). Предпочтительно молекула иммунных контрольных точек представляет собой CTLA-4. Наиболее предпочтительно молекула иммунных контрольных точек представляет собой PD-1.
В заявке РСТ WO2017/040945 описаны способы конструирования CAR-T-клеток, которые экспрессируют доминантно-негативную форму ингибитора клеточно-опосредованного иммунного ответа. Заявка WO2017/040945 включена здесь посредством ссылки.
Терапевтические способы
Иммунные эффекторные клетки, экспрессирующие описанные CAR, могут обеспечивать терапевтически полезный иммунный ответ против опухолевых клеток, экспрессирующих B-лимфоцитарный антиген (например, рака, ассоциированного с CD19). Например, противоопухолевый иммунный ответ, индуцированный описанными CAR-модифицированными иммунными эффекторными клетками, может представлять собой активный или пассивный иммунный ответ. Кроме того, CAR-опосредованный иммунный ответ может быть составляющим компонентом подхода адоптивной иммунотерапии, в котором CAR-модифицированные иммунные эффекторные клетки индуцируют иммунный ответ, специфичный для B-лимфоцитарного антигена, такого как CD19.
Адоптивный перенос иммунных эффекторных клеток, экспрессирующих химерные антигенные рецепторы, является многообещающим противоопухолевым терапевтическим средством. После сбора иммунных эффекторных клеток пациента клетки можно генетически сконструировать для экспрессии раскрытых B-лимфоцитарный антиген-специфических CAR, и затем ввести обратно пациенту. Более того, иммунные эффекторные клетки, полученные от донора, отличного от пациента (т.е. аллогенные для пациента), можно генетически сконструировать для экспрессии раскрытых B-лимфоцитарный антиген-специфических CAR, и затем CAR-содержащие клетки ввести пациенту. В некоторых конкретных вариантах осуществления иммунные эффекторные клетки, которые содержат полипептид анти-В-лимоцитарный антиген-специфических CAR, представляют собой аллогенные EBV-специфические цитотоксические Т-клетки.
Раскрытые CAR-модифицированные иммунные эффекторные клетки можно вводить либо самостоятельно, либо в виде фармацевтической композиции в комбинации с разбавителями и/или с другими компонентами, такими как IL-2, IL-15 или другие цитокины или клеточные популяции. Вкратце, фармацевтические композиции могут включать популяцию клеток-мишеней, как здесь описано, в комбинации с одним или более фармацевтически или физиологически приемлемыми носителями, разбавителями или эксципиентами. Такие композиции могут содержать буферы, такие как нейтральный забуференный солевой раствор, забуференный фосфатом физиологический раствор и тому подобное; углеводы, такие как глюкоза, манноза, сахароза или декстраны, маннитол; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатирующие агенты, такие как ЭДТА или глутатион; адъюванты (например, гидроксид алюминия); и консерванты. Композиции для применения в раскрытых способах в некоторых вариантах осуществления формулированы для внутривенного введения. Фармацевтические композиции можно вводить любым способом, подходящим для лечения ММ. Число и частота введений будут определяться такими факторами, как состояние пациента и тяжесть заболевания пациента, хотя соответствующие дозировки могут определяться по результатам клинических испытаний.
Когда указано «иммунологически эффективное количество», «эффективное противоопухолевое количество», «эффективное количество, ингибирующее опухоль» или «терапевтическое количество», то можно определить точное количество композиций по настоящему изобретению, которые должны быть введены врачом с учетом индивидуальных различий в возрасте, массе тела, размере опухоли, степени тяжести инфекции или метастазирования и состоянии пациента (субъекта). В общем, можно утверждать, что фармацевтическую композицию, содержащую Т-клетки, описанные здесь, можно вводить в дозировке от 104 до 109 клеток/кг массы тела, например от 105 до 106 клеток/кг массы тела, включая все целые значения в этих диапазонах. Композиции на основе Т-клеток также можно вводить многократно в этих дозировках. Клетки можно вводить с использованием методов инфузии, которые широко известны в иммунотерапии (см., например, Rosenberg et al., New Eng. J. of Med., 319: 1676, 1988). Оптимальную дозировку и схему лечения для конкретного пациента могут легко определить специалисты в области медицины на основе наблюдения за пациентом на предмет признаков заболевания и соответствующей корректировки лечения.
В некоторых вариантах осуществления может быть желательным ввести активированные Т-клетки субъекту с последующим повторным забором крови (или провести аферез), активировать из них Т-клетки в соответствии с раскрытыми способами и повторно ввести пациенту эти активированные и экспансированные Т-клетки. Данный процесс можно проводить несколько раз каждые несколько недель. В некоторых вариантах осуществления Т-клетки можно активировать при взятии крови объемом от 10 до 400 см3. В некоторых вариантах осуществления Т-клетки активируются при взятии крови объемом 20 см3, 30 см3, 40 см3, 50 см3, 60 см3, 70 см3, 80 см3, 90 см3 или 100 см3. Использование этого протокола множественного забора крови/ множественной реинфузии может служить для отбора определенных популяций Т-клеток.
Введение раскрытых композиций можно проводить любым удобным способом, включая инъекцию, переливание или имплантацию. Композиции, описанные здесь, можно вводить пациенту подкожно, внутрикожно, интратуморально, интранодально, интрамедуллярно, внутримышечно, внутривенной (в/в) инъекцией или внутрибрюшинно. В некоторых вариантах осуществления раскрытые композиции вводят пациенту внутрикожной или подкожной инъекцией. В некоторых вариантах осуществления раскрытые композиции вводят внутривенной инъекцией. Композиции также можно вводить непосредственно в опухоль, лимфатический узел или место инфекции.
В некоторых вариантах осуществления описанные CAR-модифицированные иммунные эффекторные клетки вводят пациенту в сочетании (например, до, одновременно или после) с любым рядом соответствующих терапевтических средств, включая, не ограничиваясь этим, талидомид, дексаметазон, бортезомиб и леналидомид. В еще одних вариантах осуществления CAR-модифицированные иммунные эффекторные клетки можно использовать в комбинации с химиотерапией, лучевой терапией, иммуносупрессорами, такими как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антителами или другими иммуноаблативными средствами, такими как CAM PATH, анти-CD3 антитела или другие виды терапии антителами, цитоксин, флударибин, циклоспорин, FK506, рапамицин, микофеноловая кислота, стероиды, FR901228, цитокины и облучение. В некоторых вариантах осуществления CAR-модифицированные иммунные эффекторные клетки вводят пациенту в сочетании (например, до, одновременно или после) трансплантации костного мозга, Т-клеточной абляционной терапии с использованием химиотерапевтических агентов, таких как флударабин, дистанционная лучевая терапия (XRT), циклофосфамид или антитела, такие как OKT3 или CAMPATH. В других вариантах осуществления клеточные композиции по настоящему изобретению вводят после В-клеточной абляционной терапии, такой как агенты, которые взаимодействуют с CD20, например, ритуксан. Например, в некоторых вариантах осуществления изобретения субъекты могут проходить стандартное лечение с применением высоких доз химиотерапевтических препаратов с последующей трансплантацией стволовых клеток периферической крови. В некоторых вариантах осуществления после трансплантации субъекты получают инфузию экспандированных иммунных клеток по настоящему изобретению. В дополнительных вариантах осуществления увеличенные клетки вводят до или после хирургической операции.
Рак в раскрытых способах может представлять собой любую клетку, экспрессирующую B-лимфоцитарный антиген (например, любую клетку, экспрессирующую CD19) у субъекта, у которого имеет место нерегулируемый рост, инвазия или метастазирование. Злокачественные опухоли, которые экспрессируют B-лимфоцитарный антиген (например, CD19), включают лейкозы и лимфомы, такие как острые лейкозы, хронические лейкозы, лимфоцитарные лейкозы, миелоидные лейкозы, предлейкозные состояния, лимфому Ходжкина, неходжкинскую лимфому, EBV-ассоциированные лимфопролиферативные заболевания, новообразования из зрелых В-клеток, новообразования из зрелых Т-клеток и естественных киллеров (NK), новообразования из лимфоидных предшественников и лимфопролиферативные расстройства, ассоциированные с иммунодефицитом.
В некоторых вариантах осуществления рак может представлять собой любое новообразование или опухоль гематопоэтической и/или лимфатической тканей. Таким образом, рак может представлять собой любой злокачественное новообразование, поражающее кровь, костный мозг, лимфу и/или лимфатическую систему; и любое такое заболевание, приводящее к нерегулируемой миелопролиферации и/ или лимфопролиферации. Репрезентативный, но не ограничивающий список типов рака, для лечения которых могут быть использованы раскрытые композиции, включает острый лимфобластный лейкоз (ALL), острый лимфобластный лейкоз из B-предшественников, острый лимфобластный лейкоз из T-предшественников, лейкоз Беркитта, острый бифенотипический лейкоз, хронический лимфоцитарный лейкоз (CLL), В-клеточный пролимфоцитарный лейкоз, острый миелоидный лейкоз (AML), острый промиелоцитарный лейкоз (PML), острый миелобластный лейкоз, острый мегакариобластный лейкоз, хронический миелоидный лейкоз (CML), хронический миеломоноцитарный лейкоз, волосатоклеточный лейкоз (HCL), Т-клеточный пролимфоцитарный лейкоз (T-PLL), крупногранулярный лимфоцитарный лейкоз, Т-клеточный лейкоз взрослых, клональные эозинофилии, B-клеточный хронический лимфоцитарный лейкоз/ мелкоклеточную лимфому, лимфоплазмоцитарную лимфому (такую как макроглобулинемия Вальденстрема), лимфому маргинальной зоны селезенки, плазмоклеточные новообразования, такие как миелома из плазматических клеток (множественная миелома), плазмоцитома, болезнь отложения моноклональных иммуноглобулинов, болезнь тяжелых цепей, В-клеточную лимфому экстранодальной маргинальной зоны (лимфома MALT), нодальную В-клеточную лимфому маргинальной зоны, фолликулярную лимфому, первичную лимфому кожного фолликульного центра, лимфому из мантийных клеток, диффузную В-крупноклеточную лимфому (с хроническим воспалением или без него), вирус Эпштейна-Барра-положительная DLBCL у пожилых людей, лимфоматоидный гранулематоз, первичную медиастинальную (тимическую) B-крупноклеточную лимфому, внутрисосудистую B-крупноклеточную лимфому, ALK+ B-крупноклеточную лимфому, плазмобластную лимфому, первичную выпотную лимфому, крупную B-клеточную лимфому, возникающую при HHV8-ассоциированной мультицентрической болезни Кастлемана, лимфому/лейкоз Беркитта, Т-клеточный пролимфоцитарный лейкоз, Т-клеточный лейкоз из больших гранулярных лимфоцитов, агрессивный NK-клеточный лейкоз, Т-клеточный лейкоз/лимфома у взрослых, экстранодальную NK/T-клеточную лимфому, энтеропатия-ассоциированную Т-клеточную лимфому, гепатоспленическую Т-клеточную лимфому, бластную NK-клеточную лимфому, грибовидный микоз/синдром Сезари, первичные кожные CD30-положительные лимфопролиферативные Т-клеточные заболевания, периферические Т-лимфоциты-клеточные лимфомы, ангиоиммунобластную Т-клеточную лимфому, анапластическую крупноклеточную лимфому, В-лимфобластный лейкоз/лимфому, не определенные иначе, В-лимфобластный лейкоз/лимфому с рецидивирующими генетическими аномалиями, Т-лимфобластный лейкоз/лимфому; классические лимфомы Ходжкина, такие как нодулярный склероз, смешанно-клеточный вариант лимфомы Ходжкина, лимфома Ходжкина с высоким содержанием лимфоцитов, лимфома Ходжкина с истощенным или неистощенным содержанием лимфоцитов, лимфома Ходжкина с нодулярным типом преобладания лимфоцитов; и лимфопролиферативные расстройства, ассоциированные с иммунодефицитом, связанные с первичным иммунным расстройством, ассоциированные с вирусом иммунодефицита человека (ВИЧ), связанные с терапией метотрексатом, посттрансплантационной лимфомой и первичной лимфомой центральной нервной системы.
Раскрытые CAR можно использовать в комбинации с любым соединением, веществом или группой, которые обладают цитотоксическим или цитостатическим действием. Лекарственные вещества включают химиотерапевтические агенты, которые могут функционировать в качестве ингибиторов микротубулина, ингибиторов митоза, ингибиторов топоизомеразы или интеркаляторов ДНК, и особенно те, которые используются для лечения рака.
Раскрытые CAR можно использовать в комбинации с ингибитором иммунных контрольных точек. Два известных пути иммунных контрольных точек включают передачу сигналов через рецепторы цитотоксического Т-лимфоцитарного антигена-4 (CTLA-4) и белка запрограммированной смерти клеток 1 (PD-1). Данные белки являются членами семейства сигнальных молекул CD28-B7, которые играют важную роль на всех стадиях функционирования Т-клеток. Рецептор PD-1 (также известный как CD279) экспрессируется на поверхности активированных Т-клеток. Его лиганды, PD-L1 (B7-H1; CD274) и PD-L2 (B7-DC; CD273), экспрессируются на поверхности APC, таких как дендритные клетки или макрофаги. PD-L1 является преобладающим лигандом, тогда как PD-L2 имеет гораздо более ограниченный паттерн экспрессии. Когда лиганды связываются с PD-1, то ингибирующий сигнал передается в Т-клетку, что снижает выработку цитокинов и подавляет пролиферацию Т-клеток. Ингибиторы иммунных контрольных точек включают, не ограничиваясь этим, аптамеры и антитела, которые блокируют PD-1 (ниволумаб (BMS-936558 или MDX1106), CT-011, MK-3475), PD-L1 (MDX-1105 (BMS-936559), MPDL3280A , MSB0010718C), PD-L2 (rHIgM12B7), CTLA-4 (ипилимумаб (MDX-010), тремелимумаб (CP-675,206)), IDO, B7-H3 (MGA271), B7-H4, TIM3, LAG-3 (BMS-986016). Методы комбинирования CAR с ингибиторами контрольных точек в эффекторных иммунных клетках и их применение для лечения различных расстройств описаны, например, в WO 2017/040945, которая включена здесь посредством ссылки.
Человеческие моноклональные антитела к белку запрограммированной смерти клеток 1 (PD-1) и способы лечения рака с использованием только анти-PD-1 антител или в комбинации с другими иммунотерапевтическими средствами описаны в патенте США № 8008449, который включен здесь посредством ссылки в отношении этих антител. Анти-PD-L1 антитела и их применение описаны в патенте США № 8552154, который включен здесь посредством ссылки в отношении этих антител. Противораковое средство, содержащее анти-PD-1 антитело или анти-PD-L1 антитело, описано в патенте США № 8617546, который включен здесь посредством ссылки в отношении этих антител.
В некоторых вариантах осуществления ингибитор PDL1 включает антитело, которое специфически связывается с PDL1, такое как BMS-936559 (Bristol-Myers Squibb) или MPDL3280A (Roche). В некоторых вариантах осуществления ингибитор PD-1 включает антитело, которое специфически связывается с PD-1, такое как ламбролизумаб (Merck), ниволумаб (Bristol-Myers Squibb) или MEDI4736 (AstraZeneca). Человеческие моноклональные антитела к PD-1 и способы лечения рака с использованием анти-PD-1 антител или в комбинации с другими иммунотерапевтическими средствами описаны в патенте США № 8008449, который включен здесь посредством ссылки в отношении этих антител. Анти-PD-L1 антитела и их применение описаны в патенте США № 8552154, который включен здесь посредством ссылки в отношении этих антител. Противораковое средство, содержащее анти-PD-1 антитело или анти-PD-L1 антитело, описано в патенте США № 8617546, который включен здесь посредством ссылки в отношении этих антител.
Раскрытые CAR можно использовать в комбинации с другими видами иммунотерапии рака. Существует два различных типа иммунотерапии: пассивная иммунотерапия, в которой используются компоненты иммунной системы для направления нацеленной цитотоксической активности против опухолевых клеток, не обязательно вызывая иммунный ответ у пациента, в то время как активная иммунотерапия активно запускает эндогенный иммунный ответ. Пассивные стратегии включают применение моноклональных антител (mAb), продуцированных В-клетками в ответ на специфический антиген. Развитие гибридомной технологии в 1970-х годах и идентификация опухолеспецифических антигенов обеспечили фармацевтическую разработку mAb, которые могли бы специфически нацеливаться на опухолевые клетки для разрушения иммунной системой. Среди них ритуксимаб (Rituxan, Genentech), который связывается с белком CD20, который высоко экспрессируется на поверхности B-клеточных злокачественных новообразований, таких как неходжкинская лимфома (NHL). Ритуксимаб одобрен FDA для лечения NHL и хронического лимфоцитарного лейкоза (CLL) в сочетании с химиотерапией. Другим важным mAb является трастузумаб (Герцептин; Genentech), который произвел революцию в лечении HER2 (рецептор 2 эпидермального фактора роста человека)-позитивного рака молочной железы, нацеливаясь на экспрессию HER2.
Для генерации оптимальных «киллерных» CD8 Т-клеточных ответов также требуется активация Т-клеточного рецептора плюс костимуляция, которая может обеспечиваться посредством лигирования членов семейства рецепторов фактора некроза опухоли, включая OX40 (CD134) и 4-1BB (CD137). OX40 представляет особый интерес, поскольку лечение активирующими (агонистическими) анти-OX40 mAb усиливает дифференцировку Т-клеток и цитолитическую функцию, что приводит к усилению противоопухолевого иммунитета против различных опухолей.
В некоторых вариантах осуществления такой дополнительный терапевтический агент может быть выбран из антиметаболита, такого как метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, флударабин, 5-фторурацил, декарбазин, гидроксимочевина, аспарагиназа, гемцитабин или кладрибин.
В некоторых вариантах осуществления такой дополнительный терапевтический агент может быть выбран из алкилирующего агента, такого как мехлорэтамин, тиотепа, хлорамбуцил, мелфалан, кармустин (BSNU), ломустин (CCNU), циклофосфамид, бусульфан, диброманнитол, стрептозотоцин (дакарбазин), прокарбазин, митомицин C, цисплатин и другие производные платины, такие как карбоплатин.
В некоторых вариантах осуществления такой дополнительный терапевтический агент может быть выбран из антимитотического агента, такого как таксаны, например доцетаксел и паклитаксел, и алкалоидов барвинка, например виндезин, винкристин, винбластин и винорелбин.
В некоторых вариантах осуществления такой дополнительный терапевтический агент может быть выбран из ингибитора топоизомеразы, такого как топотекан или иринотекан, или цитостатического препарата, такого как этопозид и тенипозид.
В некоторых вариантах осуществления такой дополнительный терапевтический агент может быть выбран из ингибитора фактора роста, такого как ингибитор ErbBl (EGFR) (такого как антитело против EGFR, например залутумумаб, цетуксимаб, панитумумаб или нимотузумаб, или другие ингибиторы EGFR, такие как гефитиниб или эрлотиниб), другой ингибитор ErbB2 (HER2/neu) (такой как антитело против HER2, например трастузумаб, трастузумаб-DM 1 или пертузумаб) или ингибитор как EGFR, так и HER2, такой как лапатиниб).
В некоторых вариантах осуществления такой дополнительный терапевтический агент может быть выбран из ингибитора тирозинкиназы, такого как иматиниб (Glivec, Gleevec STI571) или лапатиниб.
Таким образом, в некоторых вариантах осуществления раскрытое антитело используется в комбинации с офатумумабом, занолимумабом, даратумумабом, ранибизумабом, нимотузумабом, панитумумабом, hu806, даклизумабом (зенапакс), базиликсимабом (Simulect), инфликсимабом (ремикумабат), адидалимабом (ремикумабад), адидалимабом (Tysabri), омализумабом (Xolair), эфализумабом (Raptiva) и/или ритуксимабом.
В некоторых вариантах осуществления терапевтический агент для применения в комбинации с CAR для лечения расстройств, описанных выше, может представлять собой противораковый цитокин, хемокин или их комбинацию. Примеры подходящих цитокинов и факторов роста включают IFNγ, IL-2, IL-4, IL-6, IL-7, IL-10, IL-12, IL-13, IL-15, IL-18, IL-23, IL-24, IL-27, IL-28a, IL-28b, IL-29, KGF, IFNa (например, INFa2b), IFN, GM-CSF, CD40L, лиганд Flt3, фактор стволовых клеток, анцестим и TNFa. Подходящие хемокины могут включать Glu-Leu-Arg (ELR)-негативные хемокины, такие как IP-10, MCP-3, MIG и SDF-la из семейств человеческих хемокинов CXC и C-C. Подходящие цитокины включают производные цитокинов, варианты цитокинов, фрагменты цитокинов и слитые белки цитокинов.
В некоторых вариантах осуществления терапевтический агент для применения в комбинации с CAR для лечения расстройств, описанных выше, может представлять собой регулятор контроля клеточного цикла/апоптоза (или «регулирующий агент»). Регулятор контроля клеточного цикла/апоптоза может включать в себя молекулы, которые нацелены и модулируют регуляторы контроля клеточного цикла/апоптоза, такие как (i) cdc-25 (например, NSC 663284), (ii) циклин-зависимые киназы, которые сверхстимулируют клеточный цикл (такие как флавопиридол (L868275, HMR1275), 7-гидроксистауроспорин (UCN-01, KW-2401) и росковитин (R-росковитин, CYC202)) и (iii) модуляторы теломеразы (такие как BIBR1532, SOT-095, GRN163 и композиции, описанные, например, в патентах США № 6440735 и 6713055). Неограничивающие примеры молекул, которые препятствуют путям апоптоза, включают TNF- зависимый лиганд, индуцирующий апоптоз (TRAIL)/лиганд апоптоза-2 (Apo-2L), антитела, которые активируют рецепторы TRAIL, IFN и антисмысловой Bcl-2.
В некоторых вариантах осуществления терапевтический агент для применения в комбинации с CAR для лечения расстройств, описанных выше, может представлять собой агент, регулирующий гормоны, такой как агенты, пригодные для антиандрогенной и антиэстрогенной терапии. Примерами таких агентов, регулирующих гормоны, являются тамоксифен, идоксифен, фулвестрант, дролоксифен, торемифен, ралоксифен, диэтилстильбестрол, этинилэстрадиол/эстинил, антиандроген (такой как флутаминд/эулексин), прогестин (такой как гидроксипрогестерона капроат, медроксипрогестерон/провера, мегестрола ацетат/мегаце), адренокортикостероид (такой как гидрокортизон, преднизон), лютеинизирующего гормона релизинг гормон (и его аналоги и другие агонисты LHRH, такие как бусерелин и гозерелин), ингибитор ароматазы (такой как анастразол/аримидедекс, аминоглутетимид/цитраден, эксеместан) или ингибитор гормонов (например, октреотид/сандостатин).
В некоторых вариантах осуществления терапевтический агент для применения в комбинации с CAR для лечения расстройств, описанных выше, может представлять собой противоопухолевую нуклеиновую кислоту или противоопухолевую ингибирующую молекулу РНК.
Комбинированное введение, как описано выше, может быть одновременным, раздельным или последовательным. Для одновременного введения агенты можно вводить в виде одной композиции или в виде отдельных композиций, в зависимости от ситуации.
В некоторых вариантах осуществления раскрытые CAR вводят в комбинации с проведением лучевой терапии. Лучевая терапия может включать облучение или сопутствующее введение пациенту радиофармпрепаратов. Источник излучения может быть внешним или внутренним по отношению к пациенту, которого лечат (например, лучевая терапия может быть в форме лучевой терапии внешним пучком (EBRT) или брахитерапии (ВТ)). Радиоактивные элементы, которые можно использовать в таких методах, включают, например, радий, цезий-137, иридий-192, америций-241, золото-198, кобальт-57, медь-67, технеций-99, йодид-123, йодид 131 и индий-111.
В некоторых вариантах осуществления раскрытые CAR вводят в сочетании с хирургическим вмешательством.
CAR-T-клетки могут быть сконструированы несколькими способами для повышения цитотоксичности и специфичности для опухоли, избегания иммуносупрессии опухоли, избегания отторжения хозяином и пролонгации полупериода их терапевтического действия. TRUCK (Т-клетки, перенаправленные для универсального цитокин-опосредованного уничтожения) Т-клетки, например, обладают CAR, но также сконструированы для высвобождения цитокинов, таких как IL-12, которые способствуют уничтожению опухолей. Поскольку эти клетки предназначены для высвобождения молекулярной полезной нагрузки при активации CAR, локализованного в среде опухоли, то эти CAR-T-клетки иногда также называют «бронированными CAR». Некоторые цитокины исследуются как доклинически, так и клинически в качестве средств лечения рака, и они также могут оказаться полезными при аналогичном включении в TRUCK-форму CAR-T терапии. К ним относятся IL -2, IL -3, IL-4, IL-5, IL-6, IL-7, IL-10, IL-12, IL-13, IL-15, IL-18, M-CSF, GM-CSF, IFN-, IFN-γ, TNF-α, TRAIL, лиганд FLT3, лимфотактин и TGF-β (Dranoff, (2004) «Cytokines in Cancer Pathogenesis and Cancer Therapy», Nat. Rev. Cancer, Jan 4(1):11-22). «Самонаправленные» или «хоминг» CAR-T-клетки сконструированы для экспрессии хемокинового рецептора в дополнение к своему CAR. Поскольку определенные хемокины могут активироваться в опухолях, то включение хемокинового рецептора способствует переносу опухоли и инфильтрации адоптивными Т-клетками, тем самым повышая как специфичность, так и функциональность CAR-T (Moon (2011) «Expression of a functional CCR2 receptor enhances tumor localization and tumor eradication by retargeted human T cells expressing a mesothelin-specific chimeric antibody receptor», Clin. Cancer Res., 2011 Jul 15; 17(14):4719-30). Универсальные CAR-T-клетки также обладают CAR, но сконструированы таким образом, что они не экспрессируют эндогенные белки TCR (Т-клеточный рецептор) или MHC (главный комплекс гистосовместимости). Удаление этих двух белков из сигнального репертуара адоптивной Т-клеточной терапии предотвращает развитие синдрома «трансплантат против хозяина» и отторжение, соответственно. «Бронированные» CAR-T-клетки названы так за счет их способности уклоняться от иммуносупрессии опухоли и индуцированной опухолью гипофункции CAR-T. Эти конкретные CAR-T обладают CAR и могут быть сконструированы таким образом, чтобы не экспрессировать ингибиторы контрольных точек. Альтернативно, эти CAR-T можно вводить совместно с моноклональным антителом (mAb), которое блокирует сигнальный путь иммунных контрольных точек. Введение антитела против PDL1 значительно восстанавливало киллинговую способность CAR TIL (лимфоцитов, инфильтрирующих опухоль). Несмотря на то, что сигнальные пути PD-1-PD-L1 и CTLA-4-CD80/CD86 были исследованы, возможно нацелить другие сигнальные молекулы иммунных контрольных точек в конструкции «бронированного» CAR-T, включая LAG-3, Tim-3, IDO-1, 2B4 и KIR. Другие внутриклеточные ингибиторы TIL включают фосфатазы (SHP1), убиквитинлигазы (т.е. cbl-b) и киназы (т.е. диацилглицеринкиназу). «Бронированные» CAR-T также могут быть сконструированы для экспрессии белков или рецепторов, которые защищают их или делают устойчивыми к воздействию цитокинов, секретированных опухолью. Например, CTL (цитотоксические Т-лимфоциты), трансдуцированные двойной негативной формой рецептора TGF-β, устойчивы к иммуносупрессии, генерированной лимфомой, секретирующей TGF-β. Эти трансдуцированные клетки показали заметно повышенную противоопухолевую активность in vivo по сравнению с их контрольными аналогами.
Тандемные и двойные CAR-T-клетки уникальны тем, что обладают двумя разными антигенсвязывающими доменами. Тандемный CAR содержит два последовательных антигенсвязывающих домена, обращенных к внеклеточной среде, связанных с внутриклеточными костимулирующими и стимулирующими доменами. Двойной CAR сконструирован таким образом, что один внеклеточный антигенсвязывающий домен связан с внутриклеточным костимулирующим доменом, и второй, отдельный внеклеточный антигенсвязывающий домен связан с внутриклеточным стимулирующим доменом. Поскольку стимулирующий и костимулирующий домены разделены между двумя отдельными антигенсвязывающими доменами, то двойные CAR также называются «расщепленными CAR». Как в тандемной, так и в двойной конструкции CAR, связывание обоих антигенсвязывающих доменов необходимо для обеспечения передачи сигнала цепи CAR в Т-клетке. Поскольку эти две конструкции CAR обладают аффинностью связывания с разными, разными антигенами, их также называют «биспецифическими» CAR.
Одной из основных проблем, связанных с CAR-T-клетками как формой «живого терапевтического средства», является их возможность манипулирования in vivo и их потенциальные иммуностимулирующие побочные эффекты. Для лучшего контролирования CAR-T-терапии и предупреждения нежелательных побочных эффектов, было разработано множество функций, включая выключатели, механизмы безопасности и механизмы кондиционного контроля. Например, как самоинактивирующиеся, так и маркированные/меченные CAR-T-клетки сконструированы так, чтобы иметь «выключатель», который способствует клиренсу CAR-экспрессирующих T-клеток. Самоинактивирующаяся CAR-T содержит CAR, но также сконструирована для экспрессии проапоптотического суицидного гена или «гена элиминации», индуцируемого при введении экзогенной молекулы. Для этой цели можно использовать различные суицидные гены, включая HSV-TK (тимидинкиназа вируса простого герпеса), Fas, iCasp9 (индуцибельная каспаза 9), CD20, MYC TAG и усеченный EGFR (рецептор фактора роста эндотелия). HSK, например, преобразует пролекарство ганцикловир (GCV) в GCV-трифосфат, который встраивается в реплицирующуюся ДНК, что в конечном итоге приводит к гибели клеток. iCasp9 представляет собой химерный белок, содержащий компоненты FK506-связывающего белка, который связывает небольшую молекулу AP1903, что приводит к димеризации каспазы 9 и апоптозу. Однако маркированная/ меченная CAR-Т-клетка представляет собой клетку, которая обладает CAR, но также сконструирована для экспрессии селектируемого маркера. Введение mAb против такого селектируемого маркера будет способствовать клиренсу CAR-T-клетки. Усеченный EGFR является одним из таких антигенов, на которые нацелено mAb против EGFR, и введение цетуксимаба способствует элиминации CAR-T-клетки. CAR, созданные для обеспечения этих функций, также называются sCAR для «переключаемых CAR» и RCAR для «регулируемых CAR». «Безопасный CAR», также известный как «ингибирующий CAR» (iCAR), сконструирован для экспрессии двух антигенсвязывающих доменов. Один из этих эктодоменов направлен против антигена, ассоциированного с опухолью, и связан с внутриклеточным костимулирующим и стимулирующим доменом. Однако второй внеклеточный антигенсвязывающий домен специфичен для нормальной ткани и связан с внутриклеточным доменом контрольной точки, таким как CTLA4, PD-1 или CD45. Также возможно включение нескольких внутриклеточных ингибирующих доменов в iCAR. Некоторые ингибирующие молекулы, которые могут обеспечивать эти ингибирующие домены, включают B7-H1, B7-1, CD160, PIH, 2B4, CEACAM (CEACAM-1. CEACAM-3 и/или CEACAM-5), LAG-3, TIGIT, BTLA, LAIR1 и TGFβ-R. В присутствии нормальной ткани стимуляция этого второго антигенсвязывающего домена будет работать на ингибирование CAR. Следует отметить, что из-за этой двойной антигенной специфичности iCAR также являются формой биспецифических CAR-T-клеток. Констуирование безопасных CAR-T увеличивает специфичность CAR-T-клетки для опухолевой ткани и является преимуществом в ситуациях, когда определенные нормальные ткани могут экспрессировать очень низкие уровни ассоциированного с опухолью антигена, что может привести к нецелевым эффектам при использовании стандартного CAR (Morgan (2010), «Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2» Molecular Therapy, 2010;18(4):843-851). Кондиционная CAR-T-клетка экспрессирует внеклеточный антигенсвязывающий домен, связанный с внутриклеточным костимулирующим доменом и отдельным внутриклеточным костимулятором. Последовательности костимулирующего и стимулирующего доменов сконструированы таким образом, что при введении экзогенной молекулы образующиеся в результате белки будут объединяться внутриклеточно для завершения цепи CAR. Таким образом, активацию CAR-T можно модулировать и, возможно, даже «настроить» или персонализировать для конкретного пациента. Подобно дизайну с двойным CAR, стимулирующие и костимулирующие домены физически разделены, когда они неактивны в кондиционном CAR; по этой причине они также называются «разделенными CAR».
В некоторых вариантах осуществления две или более из этих разработанных функций могут быть объединены для создания усовершенствованного многофункционального CAR-T. Например, можно создать CAR-T-клетку с дизайном двойного или кондиционного CAR, которая также высвобождает цитокины, как TRUCK. В некоторых вариантах осуществления двойная-кондиционная CAR-T-клетка может быть сконструирована так, чтобы она экспрессировала два CAR с двумя отдельными антигенсвязывающими доменами против двух различных опухолевых антигенов, каждый из которых связан со своими соответствующими костимулирующими доменами. Костимулирующий домен станет функциональным вместе со стимулирующим доменом только после введения активирующей молекулы. Чтобы эта CAR-T-клетка была эффективной, злокачественная опухоль должна экспрессировать оба опухолевых антигена, и активирующая молекула должна быть введена пациенту; эта конструкция, таким образом, включает в себя функции как двойных, так и кондиционных CAR-T-клеток.
Обычно CAR-T-клетки создают с использованием α,βТ-клеток, однако также могут использоваться γ,δТ-клетки. В некоторых вариантах осуществления описанные конструкции, домены и сконструированные функции CAR, используемые для генерации CAR-T-клеток, могут аналогичным образом использоваться для создания других типов CAR-экспрессирующих иммунных клеток, включая NK-клетки (естественные киллеры), B-клетки, тучные клетки, фагоциты миелоидного происхождения и NKT-клетки. В качестве альтернативы может быть создана CAR-экспрессирующая клетка, обладающая свойствами как Т-клеток, так и NK-клеток. В дополнительных вариантах осуществления клетки, трансдуцированные CAR, могут быть аутологичными или аллогенными для пациента, которому их вводят.
Можно использовать несколько различных методов экспрессии CAR, включая ретровирусную трансдукцию (включая γ-ретровирус), лентивирусную трансдукцию, систему транспозон/транспозазы (системы «Спящая красавица» и PiggyBac) и экспрессию гена, опосредованную переносом РНК-мессенджера. Редактирование генов (вставка гена или удаление/разрушение гена) приобретает все большее значение с точки зрения возможности конструирования CAR-T-клеток. Системы CRISPR-Cas9, ZFN (нуклеаза «цинковых пальцев») и TALEN (активатор транскрипции, подобный эффекторной нуклеазе) представляют собой три потенциальных способа, с помощью которых могут быть созданы CAR-T-клетки.
Примеры
Пример 1: конструирование CD19-CAR
Цитотоксические Т-клетки (CTL), сенсибилизированные к антигену EBV, использовали для конструирования CAR-Т-клеток, которые избирательно нацелены, по меньшей мере, на один опухоль-ассоциированный эпитоп CD19. Полипептид CAR был специально разработан для снижения истощения CAR-Т-клеток и повышения устойчивости CAR-T-клеток у субъекта. Вкратце, экспрессированный полипептид CAR содержал лидерную последовательность (т.е. аминокислотную последовательность, показанную в SEQ ID NO: 8), которая является N-концевой по отношению к нацеливающему домену CD19 (т.е. аминокислотной последовательности FMC63 scFv, показанной в SEQ ID NO: 9). Специалистам в данной области понятно, что, когда CAR экспрессируется внутри клетки, такой как EBV-сенсибилизированные CTL, то зарождающийся белок (т.е. белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 6) процессируется, что включает удаление лидерной последовательности. Полученный зрелый полипептид (т.е. полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 7) транслоцируется на поверхность клетки. Кроме того, домены CAR оптимизировали посредством комбинирования шарнирной области, трансмембранного домена и внутриклеточного домена, содержащего костимулирующие домены (т.е. аминокислотная последовательность, показанная в SEQ ID NO: 10, включающая шарнирную область CD28, трансмембранный домен и внутриклеточный домен, показанные в SEQ ID NO: 12, 13 и 14) и мутанты сигнального домена (т.е. мутант 1XX CD3ζ, в котором домен CD3ζ не имеет функциональности в двух C-концевых доменах ITAM, как в аминокислотной последовательности, показанной в SEQ ID NO: 11).
MALPVTALLLPLALLLHADIQMTQTTSSLSASLGDRVTISCRASQDISKYLNWYQQKPDGTVKLLIYHTSRLHSGVPSRFSGSGSGTDYSLTISNLEQEDIATYFCQQGNTLPYTFGGGTKLEITGSTSGSGKPGSGEGSTKGEVKLQESGPGLVAPSQSLSVTCTVSGVSLPDYGVSWIRQPPRKGLEWLGVIWGSETTYYNSALKSRLTIIKDNSKSQVFLKMNSLQTDDTAIYYCAKHYYYGGSYAMDYWGQGTSVTVSSAAAIEVMYPPPYLDNEKSNGTIIHVKGKHLCPSPLFPGPSKPFWVLVVVGGVLACYSLLVTVAFIIFWVRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRSRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLFNELQKDKMAEAFSEIGMKGERRRGKGHDGLFQGLSTATKDTFDALHMQALPPR
DIQMTQTTSSLSASLGDRVTISCRASQDISKYLNWYQQKPDGTVKLLIYHTSRLHSGVPSRFSGSGSGTDYSLTISNLEQEDIATYFCQQGNTLPYTFGGGTKLEITGSTSGSGKPGSGEGSTKGEVKLQESGPGLVAPSQSLSVTCTVSGVSLPDYGVSWIRQPPRKGLEWLGVIWGSETTYYNSALKSRLTIIKDNSKSQVFLKMNSLQTDDTAIYYCAKHYYYGGSYAMDYWGQGTSVTVSSAAAIEVMYPPPYLDNEKSNGTIIHVKGKHLCPSPLFPGPSKPFWVLVVVGGVLACYSLLVTVAFIIFWVRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRSRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLFNELQKDKMAEAFSEIGMKGERRRGKGHDGLFQGLSTATKDTFDALHMQALPPR
(SEQ ID NO: 9)
(SEQ ID NO: 10)
(SEQ ID NO: 12)
(SEQ ID NO: 13)
(SEQ ID NO: 14)
(SEQ ID NO: 11)
Альтернативно, CAR может дополнительно содержать домен LNGFR, способный связываться с детектируемым лигандом, например, 124I-NGF, и, таким образом, функционировать в качестве молекулярной метки.
Необязательно, CAR-Т-клетки способны экспрессировать ингибитор молекулы иммунных контрольных точек (т.е. доминантно-негативный полипептид PD-1), таким образом, преодолевая иммуносупрессивное влияние микроокружения опухоли, обнаруживаемое для многих опухолей.
Пример 2: анализ электрического импеданса для оценки целевой цитотоксичности и аллореактивности
Электрический импеданс клеток-мишеней использовали для оценки специфической цитотоксичности, индуцированной EBV-сенсибилизированными анти-CD19CAR-T-клетками (EBV-CAR-T). Вкратце, полученные от донора B-лимфоциты (BLCL), клетки-мишени, для которых была охарактеризована экспрессия CD-19 (см. фиг. 1), помещали в покрытые анти-CD40 96-луночные планшеты для измерения электрического импеданса, тем самым эффективно формируя монослой клеток для анализа. Изменения электрического импеданса относительно напряжения, приложенного к монослою связанных с антителом клеток, измеряли в ответ на добавление эффекторных клеток (например, EBV-CAR-T), что позволяло оценить цитотоксичность и/или аллореактивность.
Результаты
Совпадающие с донором (аутологичные) BLCL проявляли лизис как в присутствии EBV-CAR-T-клеток, так и нетрансдуцированных EBV-сенсибилизированных T-клеток (NTD-EBV-T) (см. фиг. 2, верхний ряд). Напротив, клетки EBV-CAR-T способны к цитолитической активности, нацеленной на антиген CD19, в несовпадающих донорских клетках-мишенях по сравнению с клетками NTD-EBV-T, которые способны только ограничивать EBV-TCR-направленную цитолитическую активность против несовпадающих клеток-мишеней (см. фиг. 2, нижний ряд).
Пример 3: люциферазные анализы для оценки целевой цитолитической активности
Цитолитическую активность антигенспецифических Т-клеток, трансдуцированных анти-CD19 CAR (т.е. EBV-CAR-T-клетки), также оценивали стандартными анализами на основе люциферазы. Клеточные линии, эндогенно экспрессирующие CD19, а также контрольные клетки K562 (нетрансдуцированные и трансдуцированные экспрессионной конструкцией CD19) были сконструированы для экспрессии люциферазы и служили клетками-мишенями, как показано в таблице 7 и на фиг. 3.
Эффекторные и опухолевые клетки-мишени сокультивировали при различных соотношениях эффектор:мишень (1:4, 1:2: 1:1; 2:1 и 4: 1) с использованием 96-луночных планшетов с черными стенками и 5 × 104 клеток-мишеней в общем объеме 100 мкл на лунку. Только одни клетки-мишени высевали с той же клеточной плотностью для определения максимальной экспрессии люциферазы (относительные световые единицы (RLU)). Спустя 24 ч и 48 ч в каждую лунку непосредственно добавляли 100 мкл субстрата люциферазы. Излучаемый свет детектировали в ридере для люминесцентных планшетов. Лизис обычно определяется как:
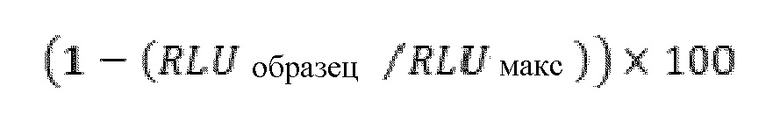
Линии клеток-мишеней
Вкратце, клетки-мишени, экспрессирующие люциферазу, и клетки, трансдуцированные имитатором эффектора, или клетки EBV-CAR-T высевали при желаемых соотношениях эффектор-мишень (E:T), как описано выше. Нетрансдуцированные клетки одного донора использовали для нормализации общего числа клеток во всех лунках так, чтобы все лунки, содержащие Т-клетки, имели одинаковое общее число клеток. Планшет для сокультивирования помещали в термостат на ночь при 37°C и 5% CO2. Через 24 ч из сокультуры удаляли 50 мкл супернатанта для использования в мультиплексных анализах цитокинов. Для измерения цитотоксической активности эффекторных клеток в каждую лунку добавляли 50 мкл культуральной среды, чтобы компенсировать объем, отобранный для анализа цитокинов/хемокинов. D-люциферин (субстрат люциферазы) добавляли в каждую лунку, и планшет инкубировали в течение 10 мин при комнатной температуре. Затем планшет анализировали, регистрировали RLU и рассчитывали специфический лизис. После 24-ч считывания люциферазы клетки помещали обратно в термостат на ночь и повторно считывали повторно через 48 ч. Процентный лизис опухолей рассчитывали по следующей формуле:

Результаты
Клетки EBV-CAR-T демонстрируют CAR-направленный цитолиз линий клеток, экспрессирующих CD19 (т.е. NALM6, K562-CD19 и RAJI) (см. фиг. 4). Примечательно, что цитолиз был наиболее эффективным в клеточной линии NALM6 (CD19-положительный; EBNA-отрицательный), за которой следуют клетки K562-CD19.RAJI (CD19-положительные; EBNA-положительные), которые проявляли большую устойчивость к направленному цитолизу.
Минимальный неспецифический цитолиз наблюдали в антиген-отрицательной клеточной линии (K562), при том, что некоторый цитолиз отмечали при увеличении соотношения E:T, EBV-CAR-T-клетки от донора 001-19 (001-19 X). Однако было отмечено, что эффекторные клетки проявляют вариабельность от донора к донору в неспецифическом цитолизе, но без доказательств наличия дозозависимого киллинга. Донор 001-19 показал самый высокий уровень неспецифического цитолиза по сравнению с двумя другими донорами (см. фиг. 5). В последующих анализах донор 001-19 демонстрировал самое высокое исходное высвобождение цитокинов и имел гораздо меньший лизис по сравнению с положительным целевым контролем.
Пример 4: профиль высвобождения цитокинов клетками EBV-CD19CAR-T
Секрецию цитокинов антигенспецифическими Т-клетками, трансдуцированными анти-CD19 CAR (т.е. EBV-CAR-T-клетками), определяли с использованием мультиплексного анализа цитокинов на основе гранул (например, Luminex® Technology Multiplex Assays; ThermoFisher Scientific, США). Профилирование цитокинов проводили с использованием супернатанта из сокультур, описанных выше (т.е. сокультур из примера 3).
Вкратце, как указано выше, профилирование цитокинов проводили с использованием супернатанта вышеуказанных сокультур в люциферазных анализах. Супернатант (50 мкл) из каждой лунки (24-ч или 48-ч сокультура) переносили в 96-луночный планшет для хранения, запечатывали снимающейся фольгой, и хранили при -80°C до использования. 27-плексную панель для определения цитокинов в предварительно составленной смеси специфичных для мишени гранул использовали для количественного анализа выбранных цитокинов (см. таблицу 8). Размороженные образцы добавляли в мультиплексный панельный планшет, а также вносили только одни Т-клетки, сокультуры и только линии клеток-мишеней для всех испытуемых образцов и нетрансдуцированных контролей. Образцы анализировали на микропланшетном ридере.
Мультиплексная панель цитокинов
Результаты
Анализ супернатанта из 48-ч сокультур при соотношении Е:Т 1: 1 показал, что клетки EBV-CAR-T индуцировали повышенные уровни цитокинов по сравнению с NTD контрольными Т-клетками и одними линиями клеток-мишеней (см. таблицу 9 и фиг. 6-18).
Обобщенные данные по полифункциональности антигенспецифического высвобождения цитокинов
Несмотря на то, что клетки EBV-CAR-T демонстрируют высокую степень полифункциональности в присутствии линий клеток, экспрессирующих CD19, профиль высвобождения цитокинов может частично определяться присущими свойствами используемых клеточных линий, что наблюдается в анализе цитолиза, описанного выше. Примечательно, что клетки K562-CD19 обеспечивают наибольшее количество антиген-индуцированного высвобождения цитокинов по сравнению с RAJI или NALM6 (см. фиг. 6-12)
Также проводили анализ на клетках K562-CD19, содержащих только Т-клетки (E: F) 2:1, 1:1, 1:2, 1:4, и только мишени, для каждого донора Т-клеток (001-19, 014-18, 023-18). Иллюстративные данные для Т-клеток (например, EBV-T-клеток и EBV-CAR-T-клеток), полученных от донора 014-18, представлены в таблицах 10-13.
Профиль секреции цитокинов NTD Т-клетками с использованием донора 014-18
Профиль секреции цитокинов EBVCARLNGFR-T-клетками с использованием донора 014-18
Профиль секреции цитокинов EBVCAR-Т-клетками с использованием донора 014-18
Профиль секреции цитокинов NTD EBV-CTL с использованием донора 014-18
EBV-CAR-T-клетки (т.е. EBVCAR-T-клетки и EBVCARLNGFR-T-клетки), полученные от всех доноров, продуцировали более высокие уровни цитокинов (таких как IFNγ, гранзим-B, IL6, TNFα, MCP-1) по сравнению с контрольными NTD и только одними Т-клетками, и при всех отношениях E:F (см. таблицы 10-13 и фиг. 13-15).
Пример 5: оценка безопасности и эффективности in vivo EBV-CAR-T-клеток
Эффективность сконструированных EBV-специфических анти-CD19-CAR-экспрессирующих Т-клеток оценивали на мышиной модели острого лимфобластного лейкоза (B-ALL) NALM6. Исследование включает определение стадии опухолевой нагрузки после обработки двумя-тремя дозами человеческих донорских клеток EBV-CAR-T (0,6×106 клеток или более на дозу для мышей=человеческий эквивалент, по меньшей мере, 2×106 клеток/кг).
Вкратце, клетки NALM6, экспрессирующие люциферазу, вводили иммунодефицитным мышам (0,5×106/мышь на сутки 3), и рост опухолей продолжался в течение 3 суток. Определение стадии опухолей проводили с использованием биолюминесцентного изображения на сутки 0, и обработку животных проводили внутривенно или внутрибрюшинно. Животных распределяли на группы обработки (восемь животных в группе), как показано в таблице 14. Рекомбинантный человеческий IL-2 (rhIL-2) вводили (2000 МЕ) сразу после дозы обработки с дополнительными дозами rhIL-2 на сутки 1 и 2 (2000 МЕ в сутки). Образцы крови собирали через 48 ч после обработки, и затем раз в неделю (например, на сутки 2, 10, 16 и 24). Опухолевую нагрузку оценивали с использованием биолюминесцентной визуализации два раза в неделю (например, на сутки 4, 7, 10, 13, 16, 18, 21 и 24). Клинические симптомы и массу тела оценивали два раза в неделю (например, на сутки 2, 4, 7, 10, 13, 16, 18, 21 и 24). На сутки 24 животных подвергали эвтаназии и отбирали образцы тканей (например, печени, костного мозга и селезенки) после вскрытия (см. фиг. 16).
Группы в опыте по оценке безопасности и эффективности
Результаты
У животных, получавших клетки EBV-CAR-T, наблюдали статистически значимое снижение клинических симптомов, включая уменьшение опухолевой нагрузки и повышение выживаемости. Дополнительный анализ показывает, что клетки EBV-CAR-T сохраняются у мышей в течение опыта и демонстрируют полифункциональный цитокиновый профиль с минимальными побочными эффектами, с отсутствием при этом проявлений острого токсического действия.
Пример 6: безопасность терапии EBV-CAR-T-клетками при рецидивирующей/рефрактерной агрессивной B-клеточной неходжкинской лимфоме
Данное исследование представляет собой открытое многоцентровое исследование с одной группой, состоящее из (а) эскалации дозы с последующей (b) эскалацией дозы при максимально переносимой биологически активной дозе для дальнейшей оценки безопасности, переносимости и предварительного клинического исхода у людей, подвергшихся лечению аллогенными (имеющимися в продаже) клетками EBV-CAR-T.
Вкратце, в исследуемую группу входят взрослые субъекты (в возрасте ≥ 18 лет) с гистологически подтвержденным диагнозом агрессивной В-клеточной неходжкинской лимфомы (NHL), определяемой как:
- диффузная B-крупноклеточная лимфома (DLBCL), если не указано иное, включая следующее:
- трансформированная латентная NHL,
- фолликулярная лимфома 3B степени,
- В-крупноклеточная лимфома, богатая Т-клетками/ гистиоцитами,
- EBV-положительная DLBCL, если не указано иное,
- первичная В-крупноклеточная медиастинальная (тимусная) лимфома, или
- B-клеточная лимфома высокой степени злокачественности с реаранжировками MYC и BCL2 и/или BCL6 с гистологией DLBCL (лимфома с двойным/тройным попаданием)
- у пациентов должен быть рецидив или рефрактерность как минимум двум предшествующим линиям системной терапии исследуемого заболевания.
Предшествующая терапия должна была включать агент, нацеленный на CD20, и антрациклин. Допускаются субъекты, получавшие аутологичную терапию анти-CD19-CAR-T, но они должны быть CD 19+.
Уровни доз, которые необходимо исследовать, включают следующие:
- низкая доза: 1×106 клеток/кг
- средняя доза: 3×106 клеток/кг
- высокая доза: 6×106 клеток/кг.
При каждой эскалации дозы используется размер выборки не менее 3 субъектов, оцениваемых по ограничивающей дозу токсичности (DLT), для каждого уровня дозы. Когорта с эскалацией дозы «открывается» на уровне дозы, который, как было показано, является безопасным, по меньшей мере, с 6 субъектами, подлежащими оценке DLT, которые завершили период DLT. За всеми субъектами после эскалации дозы и увеличения дозы наблюдают в течение 24 месяцев после инфузии EBV-CAR-T-клеток на предмет статуса заболевания и побочных эффектов, связанных с лечением.
Дополнительные цели включают следующее:
- общая частота ответов через 1, 3, 6, 12 и 24 месяца и как это связано с несоответствием HLA; и
- безопасность в отношении несовпадения HLA и его связи с синдромом высвобождения цитокинов (CRS), нейротоксичностью и синдромом «трансплантат против хозяина» (GVHD).
Результаты
Раскрытые дозы клеток EBV-CAR-T способны индуцировать и/или увеличивать выживаемость без прогрессирования заболевания с минимальными побочными эффектами. Клетки EBV-CAR-T способны как к экспансии, так и к персистенции у людей, демонстрируя полифункциональный цитокиновый профиль и избегая истощения CAR-T.
Был описан ряд вариантов осуществления изобретения. Тем не менее, следует понимать, что различные модификации могут быть выполнены без отклонения от сущности и объема изобретения. Соответственно, другие варианты осуществления находятся в рамках следующей формулы изобретения.
Если не указано иное, то все технические и научные термины, используемые в данном документе, имеют те же значения, которые обычно понимаются специалистами в области, к которой относится раскрытое изобретение. Публикации, цитируемые здесь, и материалы, для которых они цитируются, специально включены здесь посредством ссылки.
Специалисты в данной области поймут или смогут установить, используя не более чем рутинное экспериментирование, многие эквиваленты конкретных вариантов осуществления изобретения, описанных здесь. Такие эквиваленты охватываются следующей формулой изобретения.
--->
Список последовательностей
<110> ATARA BIOTHERAPEUTICS, INC.
<120> CAR-T-КЛЕТКИ, СПЕЦИФИЧЕСКИ НАЦЕЛЕННЫЕ НА АНТИГЕН CD19
<130> ABH-00725
<140>
<141>
<150> 62/840,774
<151> 2019-04-30
<160> 17
<170> PatentIn version 3.5
<210> 1
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический полинуклеотид
<400> 1
atggctctcc cagtgactgc cctactgctt cccctagcgc ttctcctgca tgcagacatc 60
cagatgaccc agaccacaag cagcctgtct gccagcctgg gcgatagagt gaccatcagc 120
tgtagagcca gccaggacat cagcaagtac ctgaactggt atcagcagaa acccgacggc 180
accgtgaagc tgctgatcta ccacaccagc agactgcaca gcggcgtgcc aagcagattt 240
tctggcagcg gctctggcac cgactacagc ctgacaatca gcaacctgga acaagaggat 300
atcgctacct acttctgcca gcaaggcaac accctgcctt acacctttgg cggaggcacc 360
aagctggaaa tcaccggctc tacaagcggc agcggcaaac ctggatctgg cgagggatct 420
accaagggcg aagtgaaact gcaagagtct ggccctggac tggtggcccc atctcagtct 480
ctgagcgtga cctgtacagt cagcggagtg tccctgcctg attacggcgt gtcctggatc 540
agacagcctc ctcggaaagg cctggaatgg ctgggagtga tctggggcag cgagacaacc 600
tactacaaca gcgccctgaa gtcccggctg accatcatca aggacaactc caagagccag 660
gtgttcctga agatgaacag cctgcagacc gacgacaccg ccatctacta ttgcgccaag 720
cactactact acggcggcag ctacgccatg gattattggg gccagggcac cagcgtgacc 780
gtttcttctg cggccgcaat tgaagttatg tatcctcctc cttacctaga caatgagaag 840
agcaatggaa ccattatcca tgtgaaaggg aaacaccttt gtccaagtcc cctatttccc 900
ggaccttcta agcccttttg ggtgctggtg gtggttggtg gagtcctggc ttgctatagc 960
ttgctagtaa cagtggcctt tattattttc tgggtgagga gtaagaggag caggctcctg 1020
cacagtgact acatgaacat gactccccgc cgccccgggc ccacccgcaa gcattaccag 1080
ccctatgccc caccacgcga cttcgcagcc tatcgctcca gagtgaagtt cagcaggagc 1140
gcagacgccc ccgcgtacca gcagggccag aaccagctct ataacgagct caatctagga 1200
cgaagagagg agtacgatgt tttggacaag agacgtggcc gggaccctga gatgggggga 1260
aagccgagaa ggaagaaccc tcaggaaggc ctgttcaatg aactgcagaa agataagatg 1320
gcggaggcct tcagtgagat tgggatgaaa ggcgagcgcc ggaggggcaa ggggcacgat 1380
ggccttttcc aggggctcag tacagccacc aaggacacct tcgacgccct tcacatgcag 1440
gccctgcccc ctcgc 1455
<210> 2
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический олигонуклеотид
<400> 2
atggctctcc cagtgactgc cctactgctt cccctagcgc ttctcctgca tgca 54
<210> 3
<211> 735
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический полинуклеотид
<400> 3
gacatccaga tgacccagac cacaagcagc ctgtctgcca gcctgggcga tagagtgacc 60
atcagctgta gagccagcca ggacatcagc aagtacctga actggtatca gcagaaaccc 120
gacggcaccg tgaagctgct gatctaccac accagcagac tgcacagcgg cgtgccaagc 180
agattttctg gcagcggctc tggcaccgac tacagcctga caatcagcaa cctggaacaa 240
gaggatatcg ctacctactt ctgccagcaa ggcaacaccc tgccttacac ctttggcgga 300
ggcaccaagc tggaaatcac cggctctaca agcggcagcg gcaaacctgg atctggcgag 360
ggatctacca agggcgaagt gaaactgcaa gagtctggcc ctggactggt ggccccatct 420
cagtctctga gcgtgacctg tacagtcagc ggagtgtccc tgcctgatta cggcgtgtcc 480
tggatcagac agcctcctcg gaaaggcctg gaatggctgg gagtgatctg gggcagcgag 540
acaacctact acaacagcgc cctgaagtcc cggctgacca tcatcaagga caactccaag 600
agccaggtgt tcctgaagat gaacagcctg cagaccgacg acaccgccat ctactattgc 660
gccaagcact actactacgg cggcagctac gccatggatt attggggcca gggcaccagc 720
gtgaccgttt cttct 735
<210> 4
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический полинуклеотид
<400> 4
attgaagtta tgtatcctcc tccttaccta gacaatgaga agagcaatgg aaccattatc 60
catgtgaaag ggaaacacct ttgtccaagt cccctatttc ccggaccttc taagcccttt 120
tgggtgctgg tggtggttgg tggagtcctg gcttgctata gcttgctagt aacagtggcc 180
tttattattt tctgggtgag gagtaagagg agcaggctcc tgcacagtga ctacatgaac 240
atgactcccc gccgccccgg gcccacccgc aagcattacc agccctatgc cccaccacgc 300
gacttcgcag cctatcgctc c 321
<210> 5
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический полинуклеотид
<400> 5
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgttcaat 180
gaactgcaga aagataagat ggcggaggcc ttcagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggccttttc caggggctca gtacagccac caaggacacc 300
ttcgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 6
<211> 485
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический полипептид
<400> 6
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser
20 25 30
Leu Gly Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser
35 40 45
Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu
50 55 60
Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe
65 70 75 80
Ser Gly Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu
85 90 95
Glu Gln Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu
100 105 110
Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Ser Thr
115 120 125
Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu
130 135 140
Val Lys Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser
145 150 155 160
Leu Ser Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser
195 200 205
Arg Leu Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys
210 215 220
Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Ser Val Thr Val Ser Ser Ala Ala Ala Ile Glu Val Met Tyr Pro
260 265 270
Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn Gly Thr Ile Ile His Val
275 280 285
Lys Gly Lys His Leu Cys Pro Ser Pro Leu Phe Pro Gly Pro Ser Lys
290 295 300
Pro Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser
305 310 315 320
Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg
325 330 335
Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro
340 345 350
Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe
355 360 365
Ala Ala Tyr Arg Ser Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
370 375 380
Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Phe
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Phe Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Phe Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Phe Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg
485
<210> 7
<211> 467
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический полипептид
<400> 7
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Ser Thr Ser Gly
100 105 110
Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val Lys
115 120 125
Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser Leu Ser
130 135 140
Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser
145 150 155 160
Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly Val Ile
165 170 175
Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu
180 185 190
Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys Met Asn
195 200 205
Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr
210 215 220
Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
225 230 235 240
Val Thr Val Ser Ser Ala Ala Ala Ile Glu Val Met Tyr Pro Pro Pro
245 250 255
Tyr Leu Asp Asn Glu Lys Ser Asn Gly Thr Ile Ile His Val Lys Gly
260 265 270
Lys His Leu Cys Pro Ser Pro Leu Phe Pro Gly Pro Ser Lys Pro Phe
275 280 285
Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu
290 295 300
Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg
305 310 315 320
Leu Leu His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro
325 330 335
Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala
340 345 350
Tyr Arg Ser Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
355 360 365
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
370 375 380
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
385 390 395 400
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Phe Asn Glu
405 410 415
Leu Gln Lys Asp Lys Met Ala Glu Ala Phe Ser Glu Ile Gly Met Lys
420 425 430
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Phe Gln Gly Leu
435 440 445
Ser Thr Ala Thr Lys Asp Thr Phe Asp Ala Leu His Met Gln Ala Leu
450 455 460
Pro Pro Arg
465
<210> 8
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический пептид
<400> 8
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala
<210> 9
<211> 245
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический полипептид
<400> 9
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Ser Thr Ser Gly
100 105 110
Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val Lys
115 120 125
Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser Leu Ser
130 135 140
Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser
145 150 155 160
Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly Val Ile
165 170 175
Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu
180 185 190
Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys Met Asn
195 200 205
Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr
210 215 220
Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
225 230 235 240
Val Thr Val Ser Ser
245
<210> 10
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический полипептид
<400> 10
Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn
1 5 10 15
Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu
20 25 30
Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val Val Gly Gly
35 40 45
Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe
50 55 60
Trp Val Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn
65 70 75 80
Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr
85 90 95
Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
100 105
<210> 11
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический полипептид
<400> 11
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Phe Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Phe Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Phe Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Phe Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 12
<211> 39
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический полипептид
<400> 12
Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn
1 5 10 15
Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu
20 25 30
Phe Pro Gly Pro Ser Lys Pro
35
<210> 13
<211> 27
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический пептид
<400> 13
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 14
<211> 41
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический полипептид
<400> 14
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 15
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический пептид
<400> 15
Tyr Met Asn Met
1
<210> 16
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический пептид
<400> 16
Pro Arg Arg Pro
1
<210> 17
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:
синтетический пептид
<400> 17
Pro Tyr Ala Pro
1
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ БУСТИНГА ЭФФЕКТИВНОСТИ АДОПТИВНОЙ КЛЕТОЧНОЙ ИММУНОТЕРАПИИ | 2015 |
|
RU2716716C2 |
| СПОСОБЫ ЭКСПАНДИРОВАНИЯ АНТИГЕНСПЕЦИФИЧЕСКИХ CAR-T-КЛЕТОК, КОМПОЗИЦИИ И ПРИМЕНЕНИЯ, СВЯЗАННЫЕ С НИМИ | 2019 |
|
RU2800920C2 |
| МЕЧЕНЫЕ ХИМЕРНЫЕ ЭФФЕКТОРНЫЕ МОЛЕКУЛЫ И ИХ РЕЦЕПТОРЫ | 2014 |
|
RU2729463C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2015 |
|
RU2753965C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ С МУТИРОВАННЫМИ КОСТИМУЛЯТОРНЫМИ ДОМЕНАМИ CD28 | 2018 |
|
RU2800922C2 |
| Т-КЛЕТКИ С ХИМЕРНЫМИ АНТИГЕННЫМИ РЕЦЕПТОРАМИ (CAR-T) ДЛЯ ЛЕЧЕНИЯ РАКА | 2019 |
|
RU2811466C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ СВЯЗАННЫХ С BCMA РАКОВЫХ ЗАБОЛЕВАНИЙ И АУТОИММУННЫХ РАССТРОЙСТВ | 2018 |
|
RU2799762C2 |
| ХИМЕРНЫЕ РЕЦЕПТОРЫ, СОДЕРЖАЩИЕ TRAF-6-ИНДУЦИРУЮЩИЕ ДОМЕНЫ, И СВЯЗАННЫЕ С НИМИ КОМПОЗИЦИИ И СПОСОБЫ | 2016 |
|
RU2773159C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР С КОСТИМУЛИРУЮЩИМ ДОМЕНОМ 4-1BB | 2020 |
|
RU2830540C2 |
| НЕ ОТНОСЯЩИЕСЯ К ЧЕЛОВЕКУ ЖИВОТНЫЕ, ЭКСПРЕССИРУЮЩИЕ ГУМАНИЗИРОВАННЫЙ КОМПЛЕКС CD3 | 2015 |
|
RU2726446C2 |
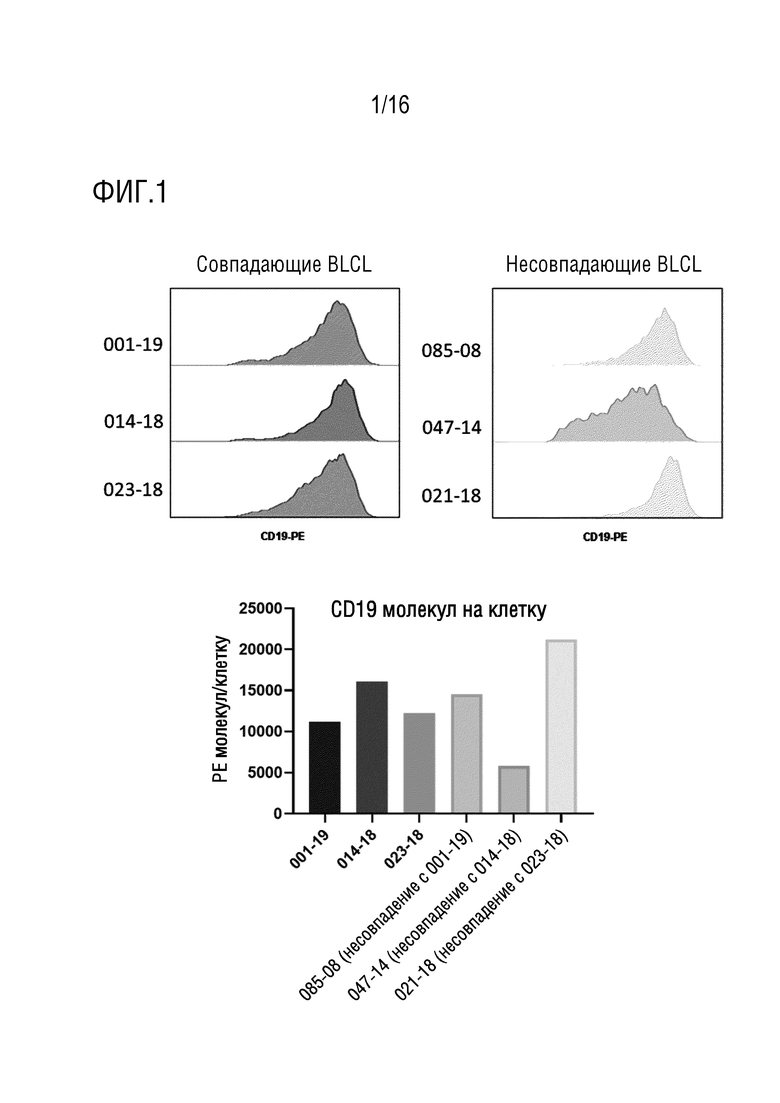
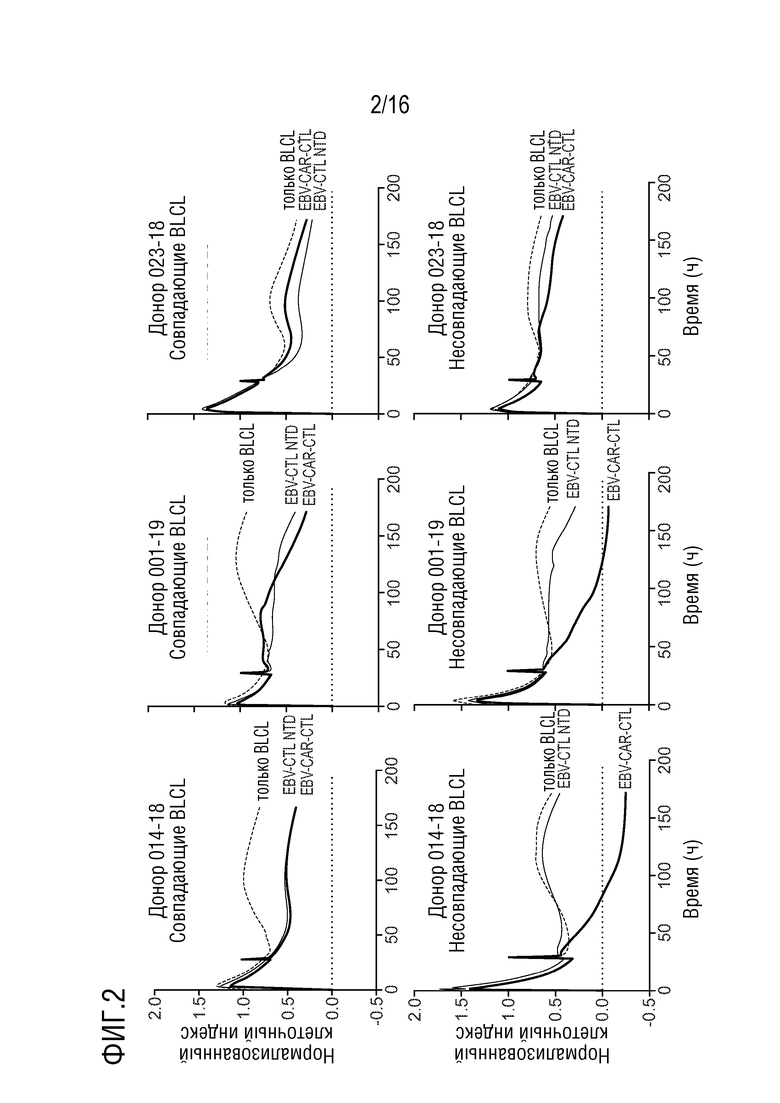
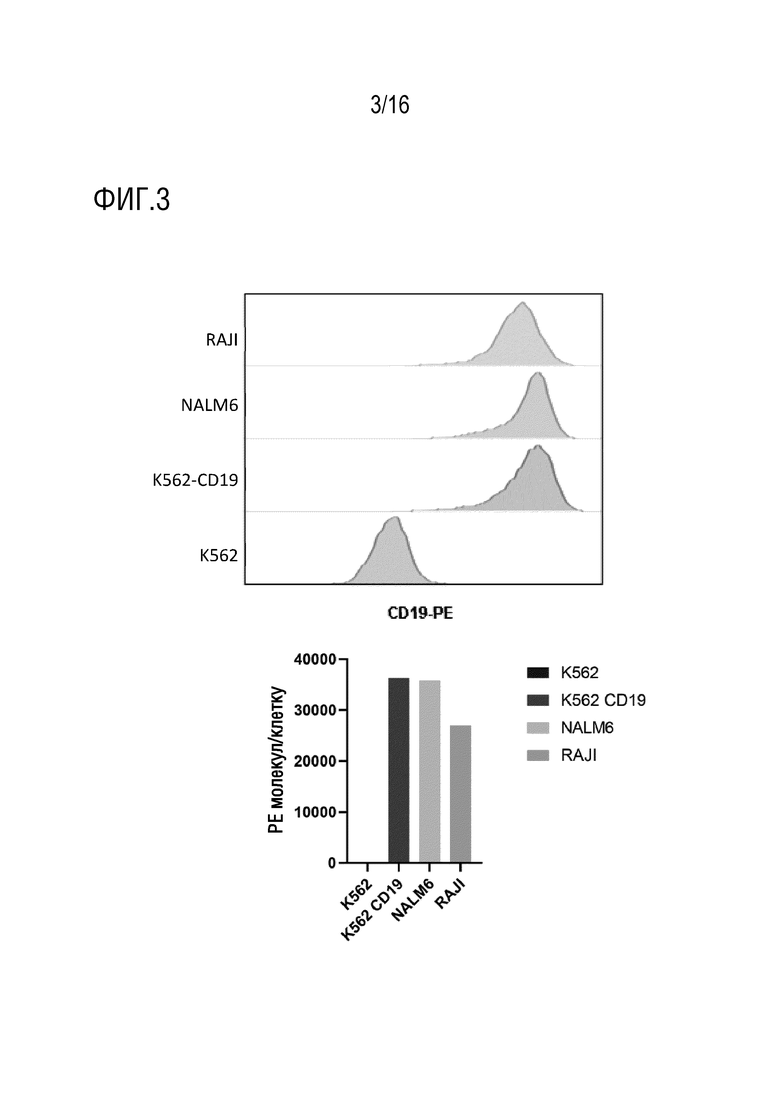
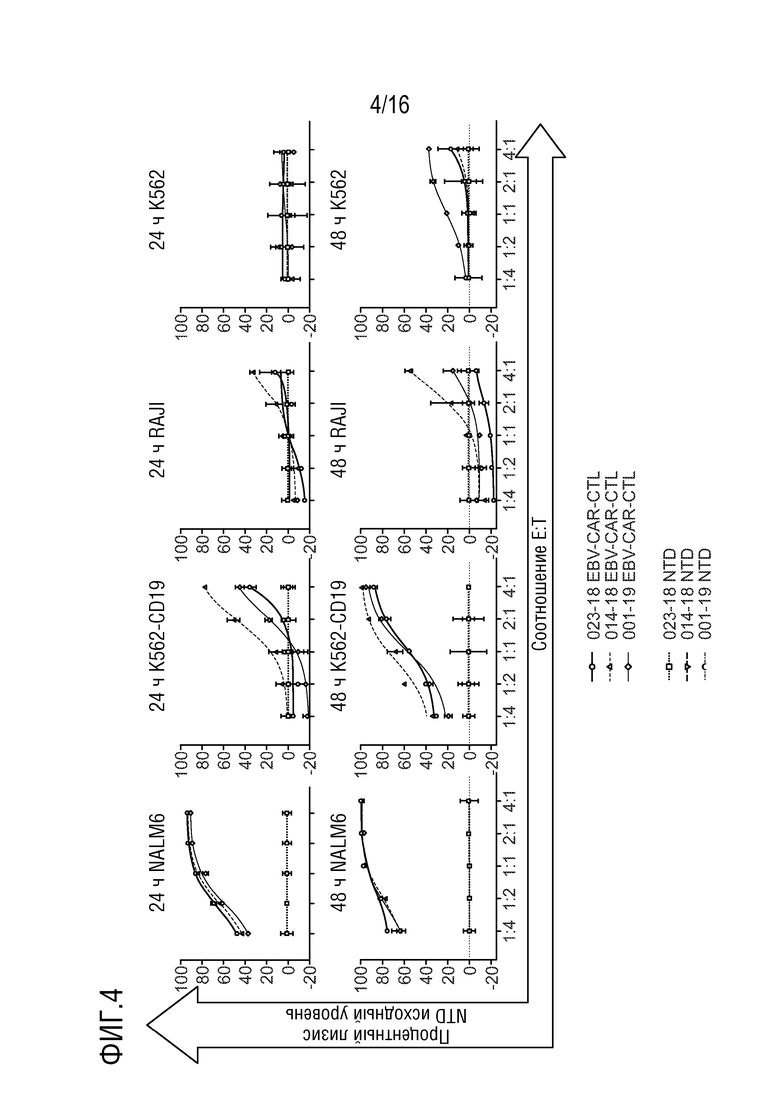
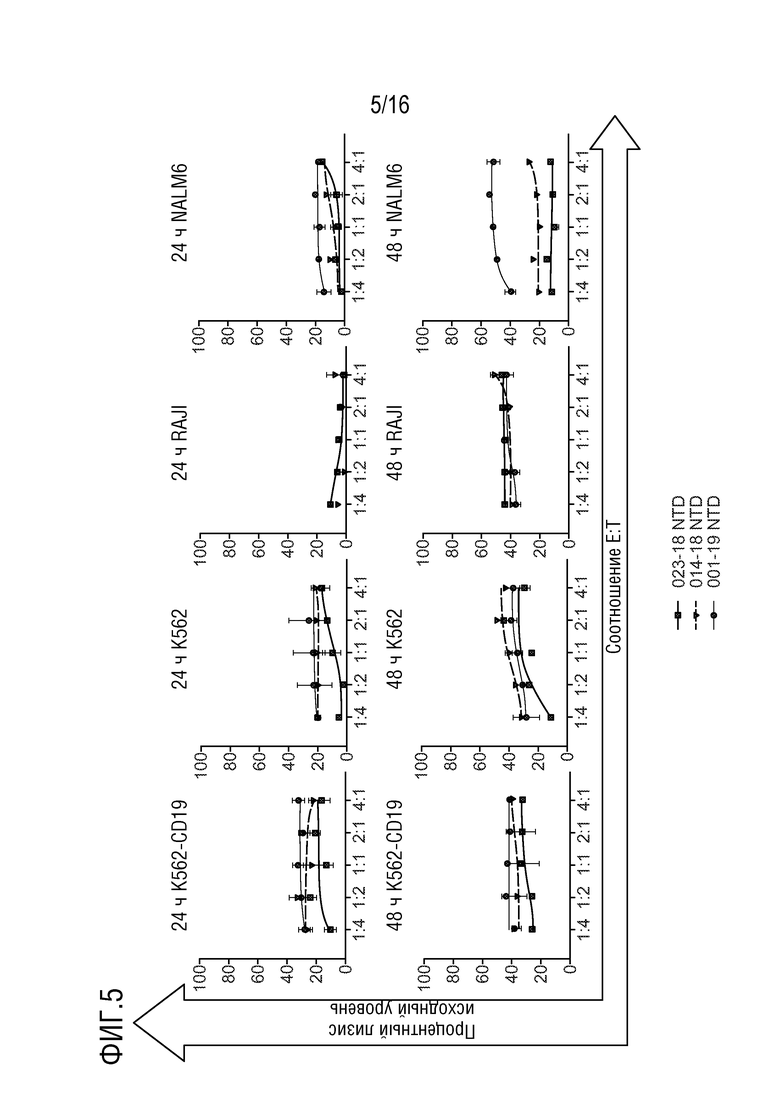
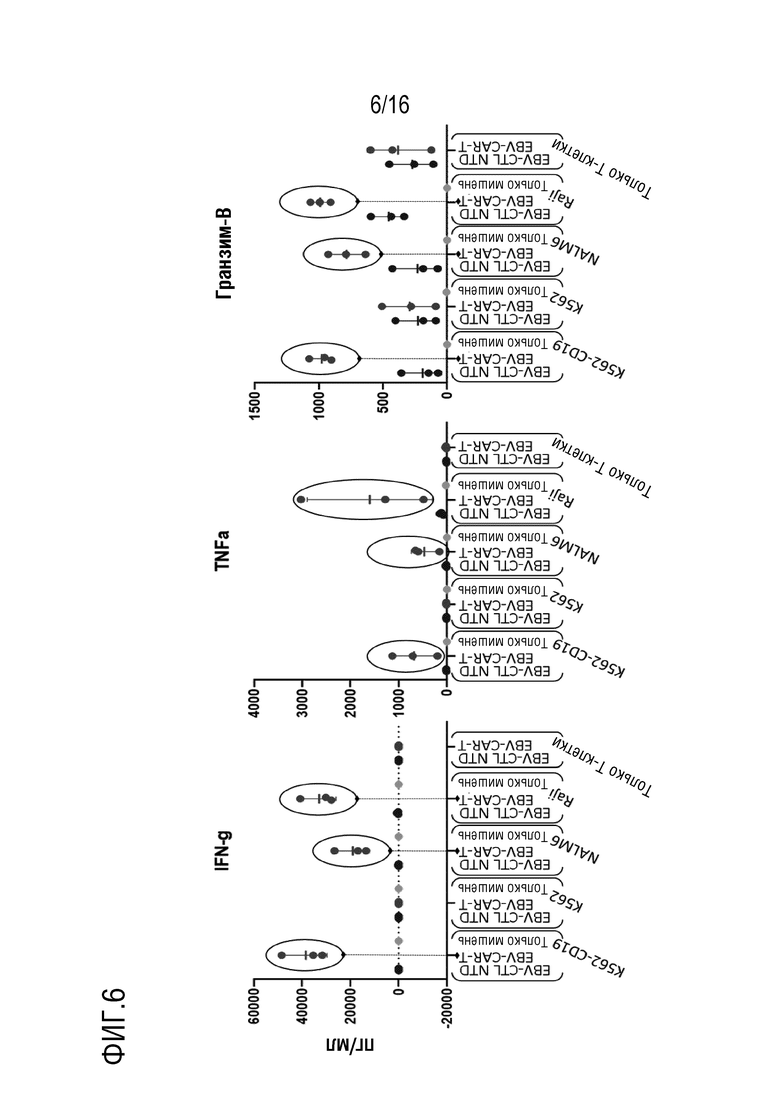
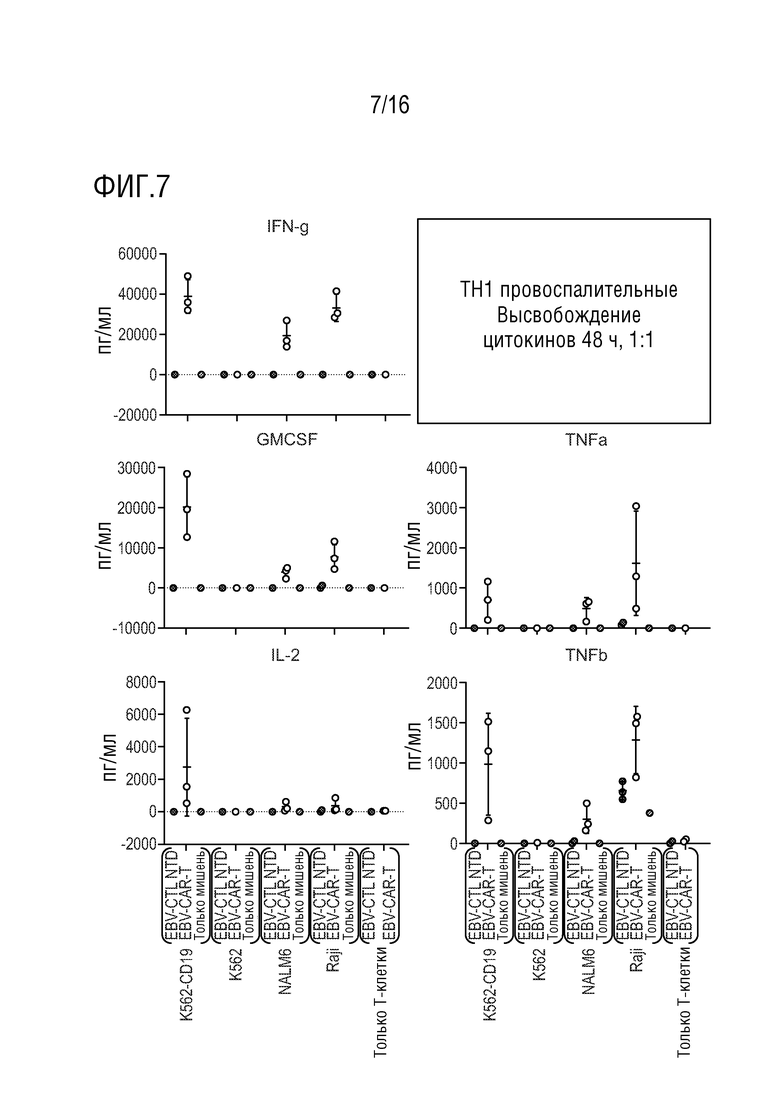
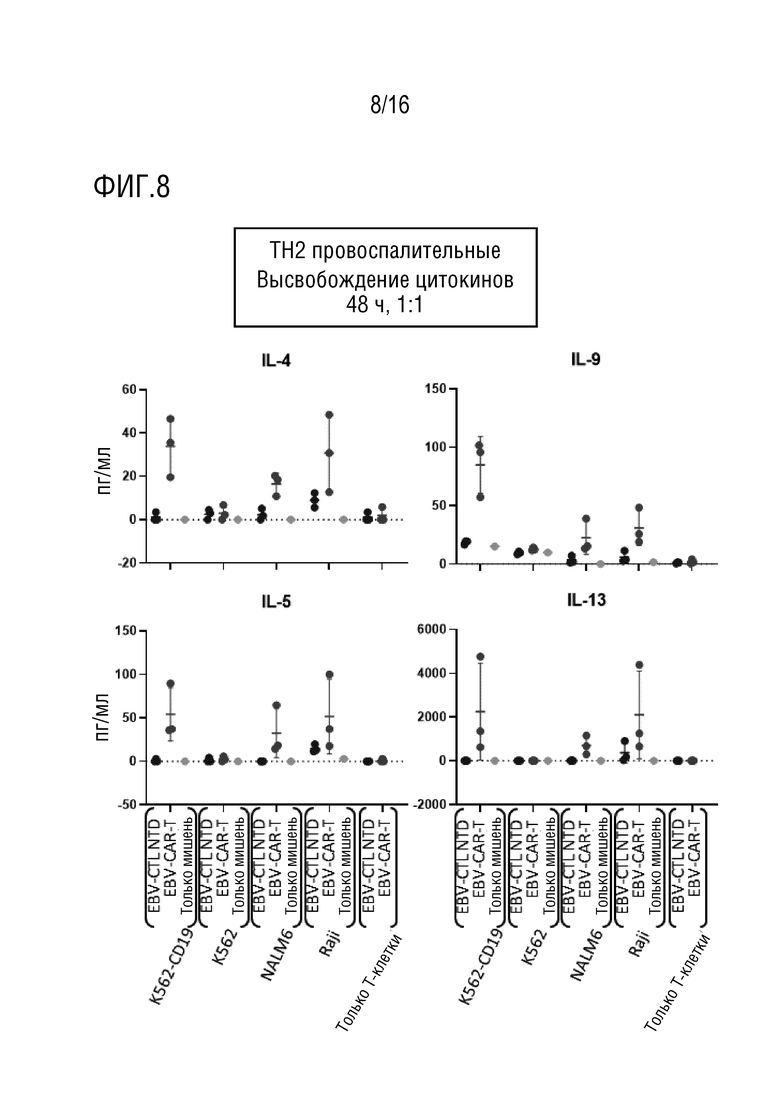
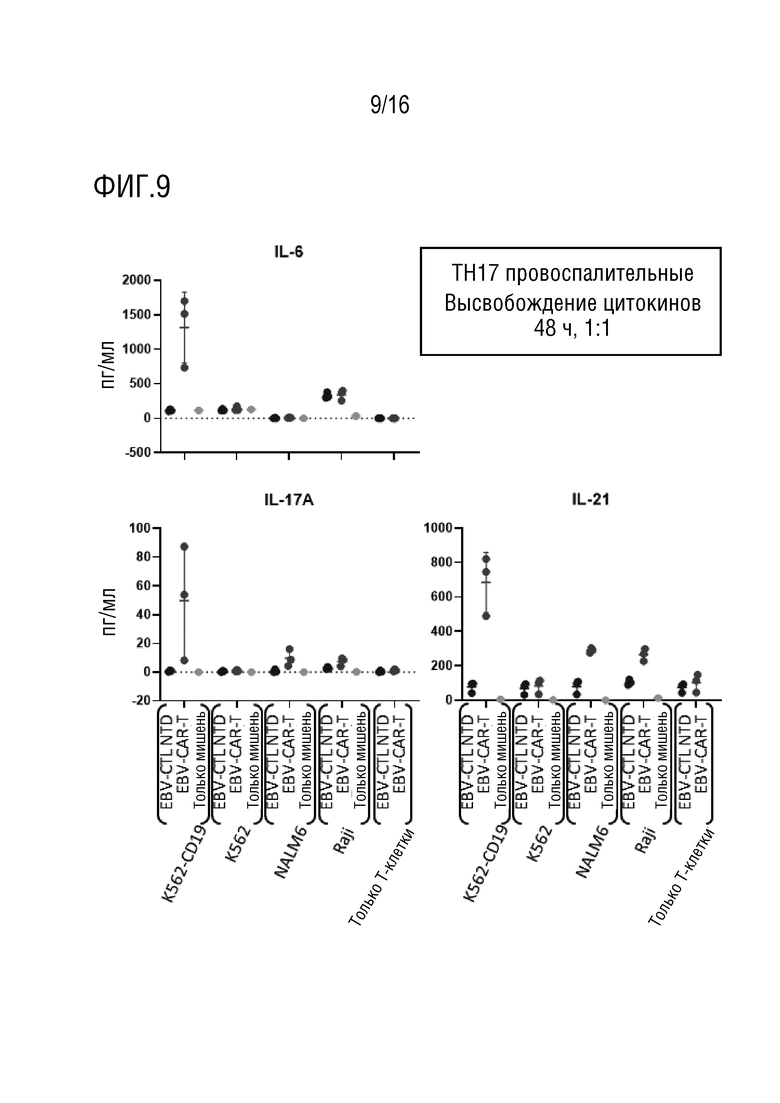
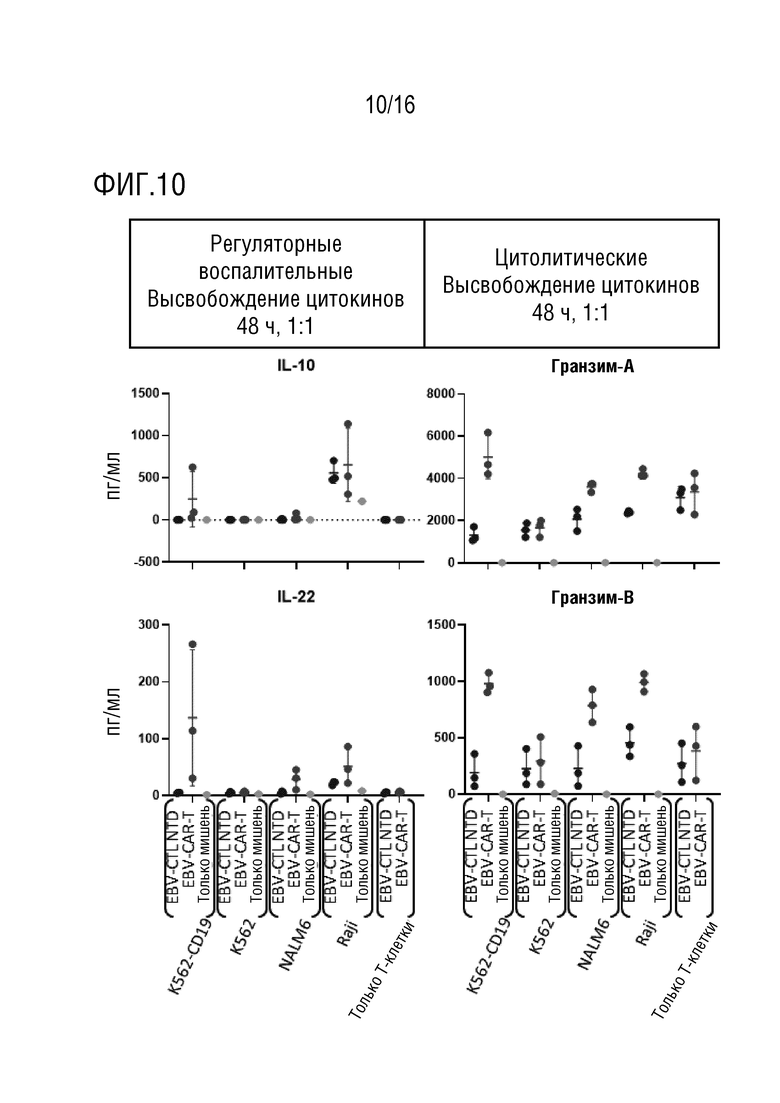
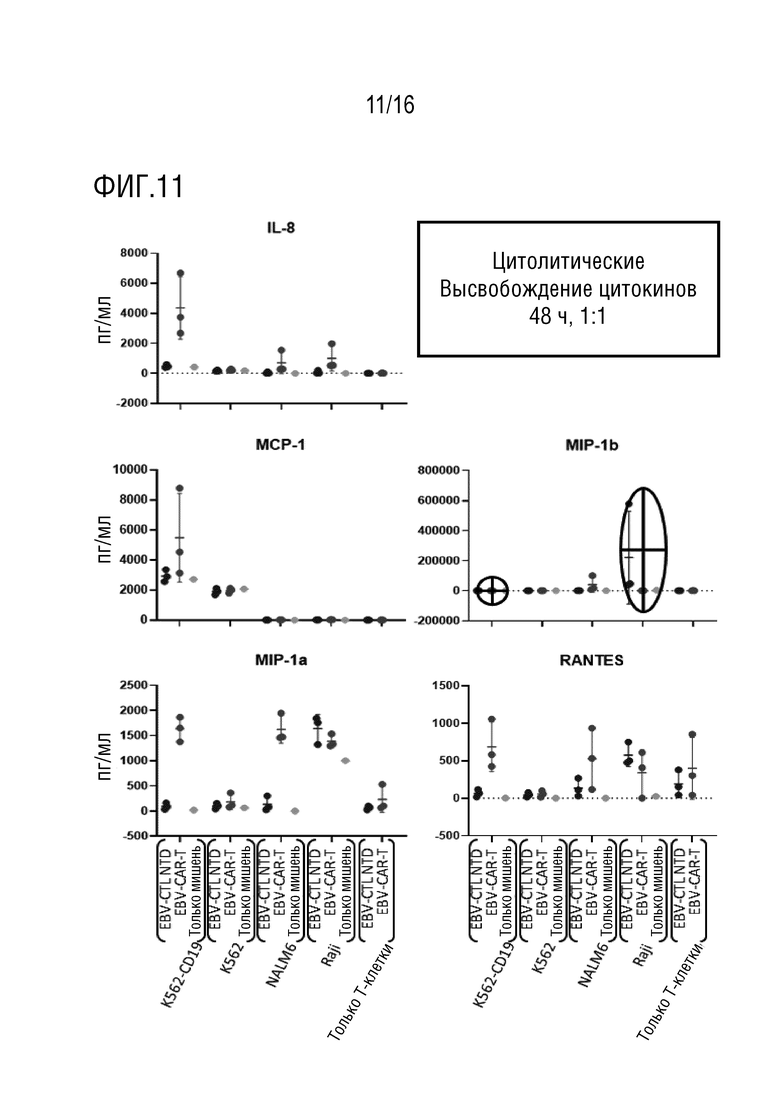
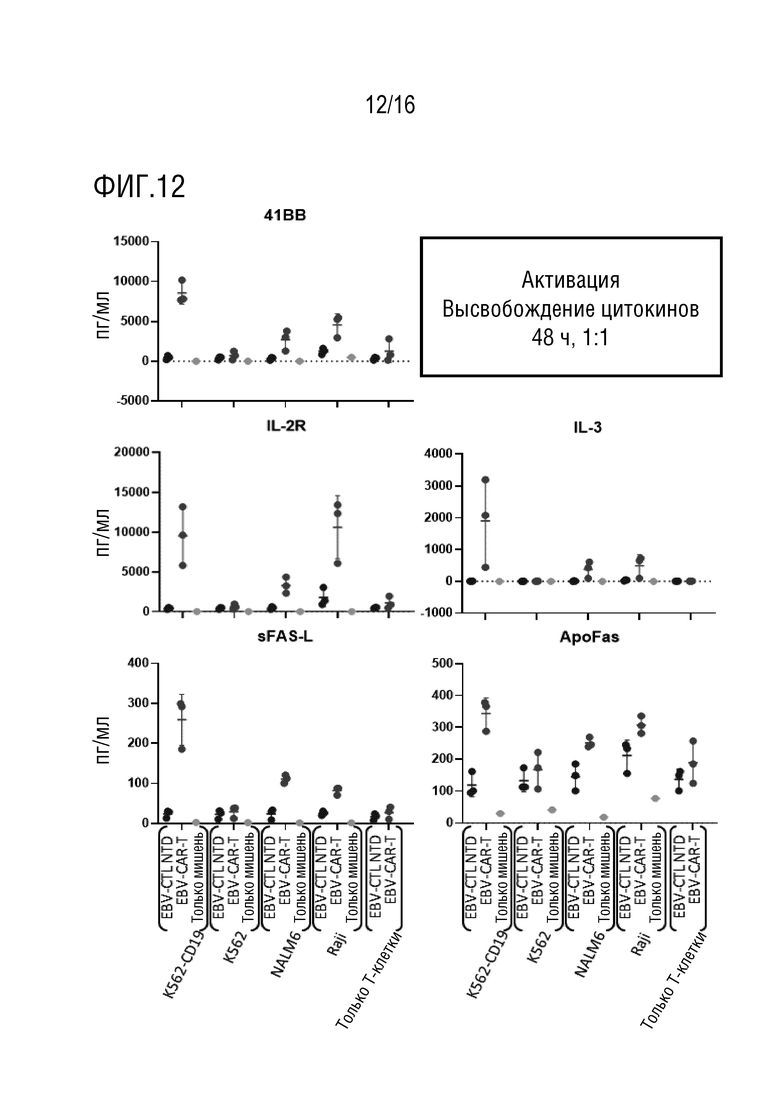
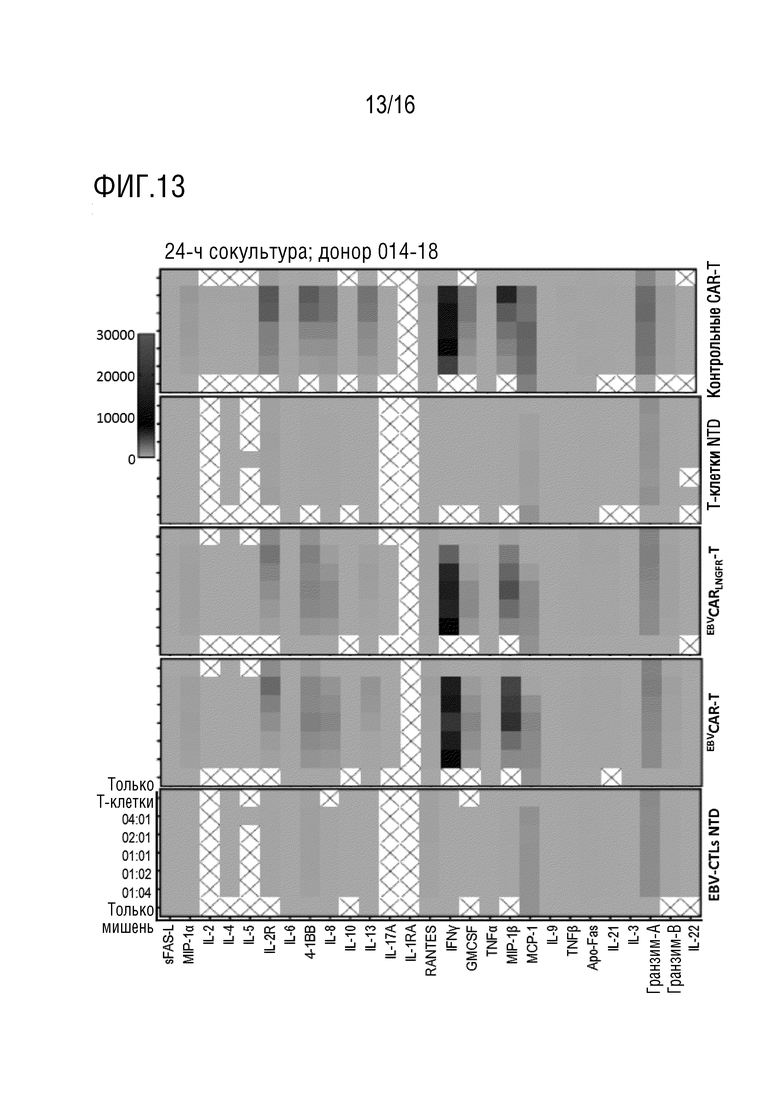
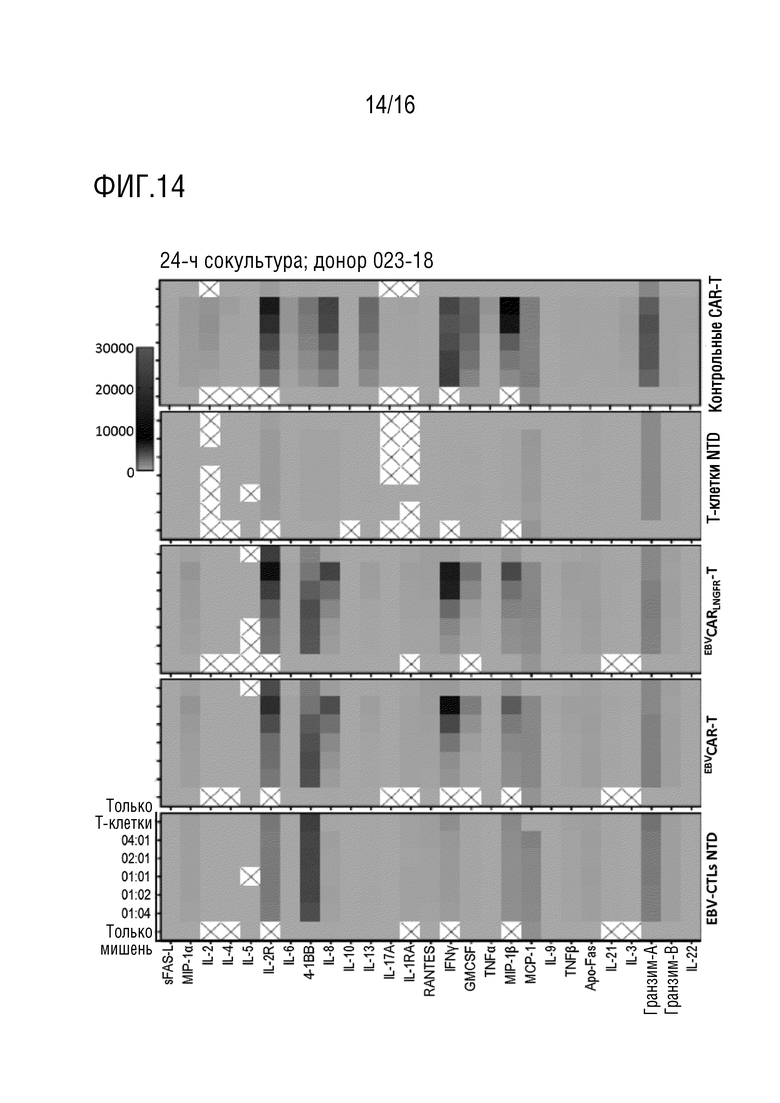
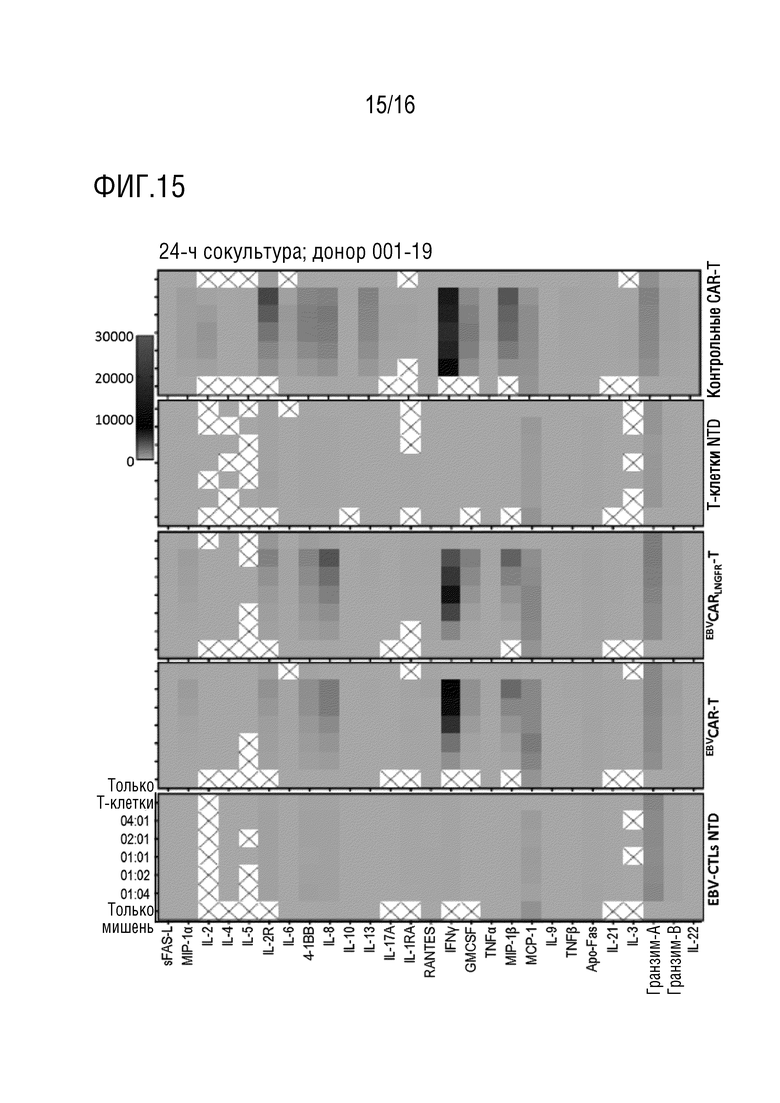
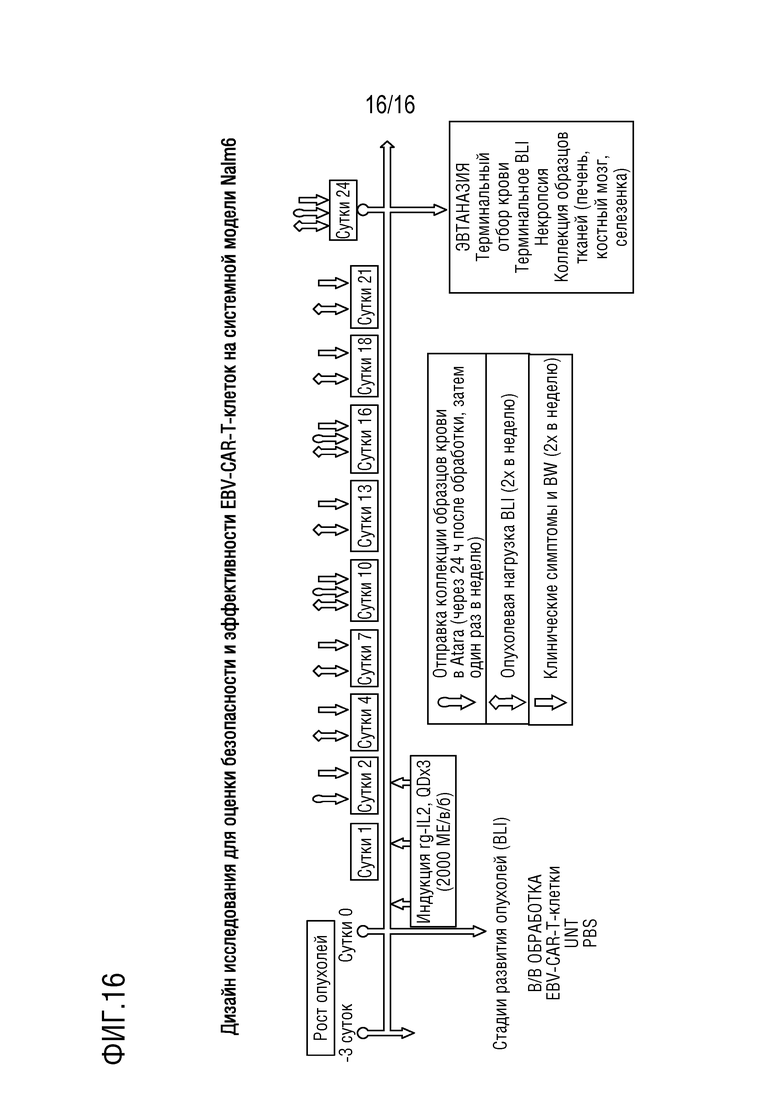
Группа изобретений относится к биотехнологии. Представлены: полипептид химерного антигенного рецептора (CAR), который связывается с B-лимфоцитарным антигеном, содержащий В-лимфоцитарный антигенсвязывающий домен, который содержит определенную аминокислотную последовательность, нуклеиновая кислота, кодирующая полипептид CAR, вектор экспрессии, содержащий нуклеиновую кислоту и иммунная клетка, экспрессирующая полипептид CAR. Также раскрыты способ лечения рака, применение композиции для адоптивной иммунотерапии, содержащей CAR-экспрессирующие клетки, для лечения рака и для изготовления лекарственного средства для лечения рака. Изобретение применяется для лечения рака, ассоциированного с В-лимфоцитарным антигеном у субъекта. 7 н. и 10 з.п. ф-лы, 16 ил., 14 табл., 6 пр.
1. Полипептид химерного антигенного рецептора (CAR), который связывается с B-лимфоцитарным антигеном, содержащий В-лимфоцитарный антигенсвязывающий домен, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 9, шарнирную область, содержащую аминокислотную последовательность, показанную в SEQ ID NO: 12, трансмембранный домен, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 13, внутриклеточный домен, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 14, и внутриклеточный сигнальный домен, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 11.
2. Полипептид CAR по п. 1, где В-лимфоцитарный антигенсвязывающий домен представляет собой анти-CD19 одноцепочечный вариабельный фрагмент (scFv).
3. Полипептид CAR по п. 1, содержащий сигнальный пептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 8.
4. Полипептид CAR по п. 1, содержащий любую из аминокислотных последовательностей, показанных в SEQ ID NO: 6 или 7.
5. Полипептид CAR по п. 1, состоящий из аминокислотных последовательностей, показанных в SEQ ID NO: 7.
6. Нуклеиновая кислота, кодирующая полипептид CAR по любому из пп. 1-5, содержащая любую из нуклеотидных последовательностей, показанных в SEQ ID NO: 1-5.
7. Экспрессионный вектор, содержащий нуклеиновую кислоту по п. 6.
8. Иммунная клетка, экспрессирующая полипептид CAR по любому из пп. 1-5, которая содержит вектор по п. 7, где иммунная клетка представляет собой цитотоксический Т-лимфоцит (CTL).
9. Иммунная клетка по п. 8, где иммунная клетка представляет собой сенсибилизированный вирусным антигеном CTL.
10. Иммунная клетка по п. 8, где иммунная клетка представляет собой CTL, сенсибилизированный к вирусному антигену любого из вируса Эпштейна-Барра (EBV), цитомегаловируса (CMV), вируса B.K. (BKV), вируса Джона Каннингема (JCV), пикорнавируса, гепаднавируса, гепацивируса, дельтавируса, гепевируса или любой их комбинации.
11. Иммунная клетка по п. 10, где иммунная клетка представляет собой EBV-сенсибилизированный CTL.
12. Способ лечения рака, ассоциированного с В-лимфоцитарным антигеном, у субъекта, включающий введение эффективного количества композиции для адоптивной иммунотерапии, содержащей CAR-экспрессирующие клетки по п. 1.
13. Способ по п. 12, где рак, ассоциированный с В-лимфоцитарным антигеном, представляет собой гематологическое злокачественное заболевание, выбранное из: острого лейкоза, хронического лейкоза, лимфоцитарного лейкоза, миелоидного лейкоза, предлейкозного состояния, лимфомы Ходжкина, неходжкинской лимфомы, EBV-ассоциированного лимфопролиферативного заболевания, новообразования из зрелых В-клеток, новообразования из зрелых Т-клеток и/или естественных киллеров (NK), новообразования из лимфоидных предшественников и лимфопролиферативного расстройства, ассоциированного с иммунодефицитом.
14. Способ по п. 12 или 13, где субъектом является человек.
15. Способ по п. 14, где CAR-экспрессирующие клетки в композиции для адоптивной иммунотерапии получены от субъекта, из донорского образца или из банка или библиотеки донорских образцов.
16. Применение композиции для адоптивной иммунотерапии, содержащей CAR-экспрессирующие клетки по п. 8, для лечения рака, ассоциированного с В-лимфоцитарным антигеном, у субъекта.
17. Применение композиции для адоптивной иммунотерапии, содержащей CAR-экспрессирующие клетки по п. 8, для изготовления лекарственного средства для лечения рака, ассоциированного с В-лимфоцитарным антигеном, у субъекта.
| JAMES N., KOCHЕNDERFER et al | |||
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| Blood, The Journal of the American Society of Hematology 119.12 (2012): 2709-2720 | |||
| JAMES N., KOCHЕNDERFER et al | |||
| Construction and pre-clinical | |||
Авторы
Даты
2024-09-09—Публикация
2020-04-29—Подача