Изобретение относится к медицине, в частности к антибактериальной терапии, а именно к средствам для лечения инфекционных болезней, вызванных множественно-устойчивыми бактериями. Изобретение может быть использовано для лечения преимущественно госпитальных, а также тяжелых и крайне тяжелых инфекционных болезней.
Госпитальные (нозокомиальные) инфекции и инфекционные осложнения в отделениях реанимации и интенсивной терапии (ОРИТ) остаются одной из существенных причин неблагоприятных исходов, удлинения сроков госпитализации и увеличения финансовых затрат на лечение. По данным многоцентрового когортного исследования, частота инфекций различной локализации в ОРИТ составила 18.9%, при этом в 65% случаев инфекции относились к госпитальным (Alberti С., Brun-Buisson С., Burchardi H., et al. Epidemiology of sepsis and infection in ICU patients from an international multicentre cohort study. Intensive Care Med 2002; 28: 108-21). Летальность среди пациентов без признаков инфекции в приведенном исследовании составляла 16.9%, а среди пациентов с инфекциями достигла 53.6%.
Среди госпитальных инфекций наибольшую угрозу представляют инфекции кровотока, дыхательных путей и раневые инфекции. Инфекции мочевыводящих путей в подавляющем большинстве случаев не представляют серьезной угрозы жизни пациентов, но могут потребовать дополнительной антибактериальной терапии и привести к удлинению сроков госпитализации. По данным исследования EPIC, среди всех госпитальных инфекций в ОРИТ на долю инфекций дыхательных путей приходилось 58.7%, на инфекции кровотока - 12%, на раневые инфекции 6.9%, на инфекции кожи и мягких тканей - 4.8%, на инфекции мочевыводящих путей - 17.6%, другие источники были отмечены в 13.7% случаев, у некоторых пациентов одновременно выявляли несколько очагов инфекции (Vincent J.L., Bihari D.J., Suter P.M., et al. The prevalence of nosocomial infection in intensive care units in Europe. Results of the European Prevalence of Infection in Intensive Care (EPIC) Study. EPIC International Advisory Committee. JAMA 1995; 274: 639-44).
Учитывая ограниченные возможности современной микробиологии по быстрой диагностике и оценке антибиотикочувствительности возбудителей госпитальных инфекций, назначение антибактериальных препаратов для лечения соответствующих инфекций может быть лишь эмпирическим. При этом выбор препаратов для эмпирической терапии должен основываться на вероятной этиологии инфекционного процесса и спектре антибиотикочувствительности возможных патогенов.
В зависимости от локализации среди госпитальных инфекций выделяют инфекции кровотока, дыхательных путей, мочевыводящих путей, кожи и мягких тканей, а также интраабдоминальные. По данным многолетних наблюдений в рамках Национальной системы контроля за нозокомиальными инфекциями, инфекции кровотока были вызваны коагулазонегативными стафилококками в 39% случаев, S. aureus - в 12% случаев, Enterococcus spp.- в 11%, Enterobacteriaceae - в 8.3%, Р. aeruginosa - в 3.7%, Candida spp. - в 11.5%. При инфекциях другой локализации существенно возрастает роль грамотрицательных бактерий (Richards M.J., Edwards J.R., Culver D.H., Gaynes RP. Nosocomial infections in combined medical-surgical intensive care units in the United States. Infect Control Hosp Epidemiol 2000; 21: 510-5). По данным изучения этиологии нозокомиальных инфекций в отделениях интенсивной терапии и реанимации Москвы, ведущими возбудителями инфекций тяжелых инфекций дыхательных путей в отделениях интенсивной терапии и реанимации являлись бактерии семейства Enterobacteriaceae (33.8%), Pseudomonas spp.(24.9%), Acinetobacter spp.(18.1%), Staphylococcus aureus (16.0%); инфекций кровотока - коагулазонегативные стафилококки (33.6%), S. aureus (26.1%), Enterobacteriaceae (17.6%); раневых инфекций - Enterobacteriaceae (35.7%), коагулазонегативные стафилококки (17.8%), Pseudomonas spp.(14.3%) (Сидоренко С.В., Резван С.П., Еремина Л.В и др. Этиология и антибиотикочувствительность возбудителей тяжелых госпитальных инфекций в отделениях реанимации. Антибиотики и химиотерапия, 2005; 33-41).
Таким образом, на грамотрицательные бактерии приходится более половины всех случаев тяжелых и крайне тяжелых инфекций в отделениях интенсивной терапии и реанимации. По существующей практике для лечения этих инфекций применяют антибактериальные препараты следующих групп - бета-лактамы, аминогликозиды и фторхинолоны. При этом в настоящее время основу лечения тяжелых инфекций составляет одна из подгрупп бета-лактамных антибиотиков - цефалоспорины III-IV поколений. Однако эффективность применения всех перечисленных препаратов существенно ограничивается формированием и широким распространением среди бактерий - возбудителей инфекционных болезней устойчивости к ним.
Развитие и распространение устойчивости к цефалоспоринам III-IV поколений среди представителей семейства Enterobacteriaceae является серьезной угрозой существующей системе здравоохранения. Ведущим механизмом устойчивости считается гидролиз указанных препаратов ферментами β-лактамазами. Из более чем 500 известных на сегодняшний день бета-лактамаз шире всего распространены ферменты, относящиеся к молекулярному классу А, чувствительные к действию ингибиторов (клавулановой кислоте, сульбактаму и тазобактаму), способные гидролизовать цефалоспорины I-IV поколений и получившие название бета-лактамаз расширенного спектра (БЛРС).
БЛРС выявляют у всех представителей семейства Enterobacteriaceae, но чаще всего у Escherichia coli и Klebsiella pneumoniae. Первые БЛРС, являвшиеся производными бета-лактамаз широкого спектра, были обнаружены в середине 80-х годов. С тех пор описано более 200 различных БЛРС, и этот список постоянно пополняется (www. lahey. org/studies). Исторически наиболее ранними и наиболее распространенными являются ферменты ТЕМ и SHV групп. В последние годы в ряде географических регионов широко распространяются и становятся преобладающими ферменты группы СТХ-М. Достаточно редко встречаются ферменты группы ОХА, еще более редки ферменты BES-1, FEC-1, GES-1, СМЕ-1, PER-1, PER-2, SFO-1, TLA-1, VEB-1.
По результатам исследования SENTRY, частота выделения штаммов К. pneumoniae, продуцирующих БЛРС, составляет: 45% в Латинской Америке, 25% в Западно-Тихоокеанском регионе, 23% в Европе, 8% в США, 5% в Канаде (Winokur P.L., Canton R., Casellas J.M., Legakis N., Variations in prevalence of strains expressing an extended-spectrum в-lactamase phenotype and characterization of isolates from Europe, the Americas, and the Western Pacific region, Clin Infect Dis 2001; 32: S94-S104). По данным исследования MYSTIC, в Европе частота БЛРС среди Klebsiella spp. достигает 32.8%, а среди Escherichia coli 14.4% (Jones RN, Pfaller MA. Antimicrobial activity against strains of Escherichia coli and Klebsiella spp.with resistance phenotypes consistent with an extended-spectrum "beta" - lactamase in Europe. Clinical Microbiology and Infection 2003; 9: 708-12). При этом наиболее высокая частота отмечается в Восточной Европе, в том числе и в Российской Федерации. По данным исследования MICROMAX, встречаемость этих ферментов в стационарах Р.Ф. среди Е.coli достигает 40%, а среди К. pneumoniae - 90% (Сидоренко С.В., Страчунский Л.С., Ахмедова Л.И. и др. Результаты многоцентрового исследования сравнительной активности цефепима и других антибиотиков в отношении возбудителей тяжелых госпитальных инфекций (программа "Micromax"). Антибиотики и химиотерапия 2005; 44:7-16).
Вторым ведущим механизмом устойчивости к цефалоспоринам III, но не IV поколения является гиперпродукция хромосомных бета-лактамаз класса С. Это явление чаще всего обнаруживается у Enterobacter spp., Serratia spp., Morganella spp., Providencia spp. и Citrobacter freundii, однако возможно и у Е.coli и К. pneumoniae. Кроме этого, возможна мобилизация хромосомных бета-лактамаз класса С на плазмиды. Признаком вероятной продукции бета-лактамах класса С является устойчивость к цефокситину. Этот цефалоспорин разрушается указанными бета-лактамазами, но устойчив к действию БЛРС.
Таким образом, очевидно, что современное здравоохранение остро нуждается в препаратах, преодолевающих устойчивость, связанную с продукцией бета-лактамаз. Применение антибактериальных препаратов из таких групп, как аминогликозиды и фторхинолоны, не может решить указанную проблему, так как в результате различных генетических процессов штаммы, продуцирующие бета-лактамазы, в подавляющем большинстве случаев обладают ассоциированной устойчивостью и к перечисленным антибактериальным препаратам.
Широкое применение для лечения тяжелых инфекций бета-лактамных препаратов из группы карбапенемов (имипенема, меропенема и других), проявляющих устойчивость к действию многих бета-лактамаз, также полностью не решает проблему, так как приводит к формированию множественно устойчивых штаммов такого актуального нозокомиального патогена, как Р. aeruginosa.
Одним из направлений преодоления устойчивости, связанной с продукций бета-лактамаз, является разработка комбинированных препаратов, включающих бета-лактамные антибиотики и необратимые ингибиторы бета-лактамаз.
В конце 70-х годов среди продуктов биосинтеза Streptomyces clavuligerus было обнаружено соединение бета-лактамной структуры, обладающее незначительной собственной антибактериальной активностью, но способное необратимо подавлять бета-лактамазы - клавулановая кислота (Brown A.G., Butterworth D., Cole M., Naturally occurring beta-lactamase inhibitors with antibacterial activity. Journal of Antibiotics 1979; 29: 668-9). Практически одновременно появилось сообщение о синтезе пенициллинат сульфона, впоследствии получившего название сульбактам (English A.R., Retsema J.A., Girard A.E., Lynch J.E., Barth W.E., CP-45, 899, a Beta-Lactamase Inhibitor That Extends the Antibacterial Spectrum of Beta-Lactams: Initial Bacteriological Characterization. Antimicrob Agents Chemother 1978; 14: 414-9). Позже был синтезирован еще один сульфон пенициллината - тазобактам (Aronoff S.C., Jacobs M.R., Johenning S., Yamabe S., Comparative activities of the beta-lactamase inhibitors YTR 830, sodium clavulanate, and sulbactam combined with amoxicillin or ampicillin. Antimicrob Agents Chemother 1984; 26: 580-2).
Перечисленным ингибиторам присущи общие особенности взаимодействия с бета-лактамазами, отличающие их от других бета-лактамных антибиотиков. На первом этапе взаимодействия (общем для всех соединений) происходит разрушение бета-лактамного кольца и образование комплекса фермент - антибиотик. Однако в дальнейшем пути протекания реакций различаются: для обычных антибиотиков образовавшийся комплекс практически сразу же распадается с высвобождением разрушенной молекулы антибиотика и активной молекулы фермента; в случае ингибиторов комплекс оказывается стабильным и молекула фермента «исключается» из процесса дальнейшего гидролиза антибиотиков. Благодаря описанным особенностям взаимодействия с бета-лактамазами клавулановая кислота, сульбактам и тазобактам получили название «суицидные» ингибиторы.
В настоящее время на практике широко применяется ряд комбинаций полусинтетических пенициллинов с ингибиторами бета-лактамаз («ингибитор-защищенные» пенициллины - амоксициллин/клавулановая кислота, амоксициллин/сульбактам, ампициллин/сульбактам, тикарциллин/клавулановая кислота и пиперациллин/тазобактам), известна также комбинация цефалоспорина III поколения цефоперазона с сульбактамом.
Однако для всех перечисленных комбинированных препаратов характерны определенные недостатки. Так комбинированные препараты на основе аминопенициллинов пригодны только для лечения относительно легких внебольничных инфекций, поскольку эти антибиотики обладают относительно узким спектром действия, не включающим многие госпитальные патогены, а уровень их активности невысок. Комбинированные препараты на основе карбоксипенициллинов (тикарциллин/клавуланат) и уреидопенициллинов (пиперациллин/тазобактам), несмотря на широкий спектр действия этих антибиотиков, также оказались недостаточно эффективными из-за высокой чувствительности к гидролизу бета-лактамазами и при высоком уровне продукции этих ферментов ингибиторы не могут полностью защитить антибиотики от разрушения. Кроме этого, клавулановая кислота, входящая в состав препарата тикарциллин/клавуланат, обладает способностью индуцировать синтез хромосомных бета-лактамаз класса С бактериями группы Enterobacter - Serratia - Citrobacter - Morganella, что снижает активность препарата в отношении указанных бактерий.
Более перспективной оказалась комбинация цефалоспорина III поколения цефоперазона и необратимого ингибитора сульбактама (сульперазон). Указанный препарат рассматривается в качестве аналога заявляемого препарата в плане антимикробной активности и клинической эффективности. К его недостаткам относится наибольшая среди всех цефалоспоринов III-IV поколений чувствительность к действию не только бета-лактамаз расширенного спектра, но и к ферментам широкого спектра. Кроме этого, препарат, как и другие цефалоспорины III поколения, разрушается хромосомными бета-лактамазами класса С.
Техническим результатом является создание препарата, обладающего лечебной эффективностью при тяжелых госпитальных (нозокомиальных) инфекциях, вызванных множественно устойчивыми грамотрицательными бактериями семейства Enterobacteriaceae, родов Pseudomonas, Acinetobacter за счет преодоления устойчивости перечисленных бактерий, обусловленной продукцией хромосомных и плазмидных бета-лактамаз класса С, а также плазмидных бета-лактамаз класса А широкого и расширенного спектров. Препарат должен иметь возможность использоваться как средство эмпирической терапии тяжелых инфекций до выделения возбудителей и получения результатов оценки их антибиотикочувствительности. Применение препарата должно позволить существенно повысить эффективность лечения инфекционных заболеваний.
Достижение указанных технических результатов обеспечивается средством для лечения инфекционных болезней, вызванных множественно-устойчивыми бактериями, которое представляет собой смесь цефалоспоринового антибиотика цефепима и ингибитора бета-лактамаз сульбактама при их соотношении соответственно от 1:1 до 1:2.
Выбор оптимального соотношения антибактериального препарата, ингибитора, активность различных комбинаций ингредиентов проводили и оценивали в отношении коллекции микроорганизмов с генетически установленными механизмами устойчивости, а также в отношении грамотрицательных бактерий, циркулирующих в стационарах г.Москвы в течение 2005-2006 гг. Изучение и сравнение антимикробной активности заявляемого препарата с другими комбинированными препаратами проводили с использованием штаммов бактерий с известными механизмами устойчивости.
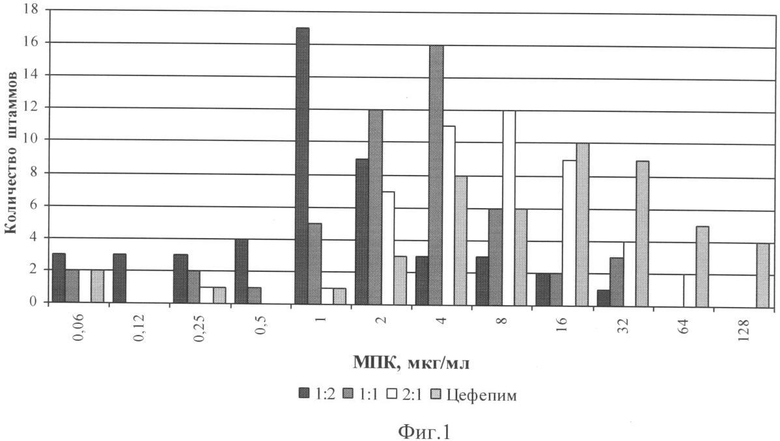
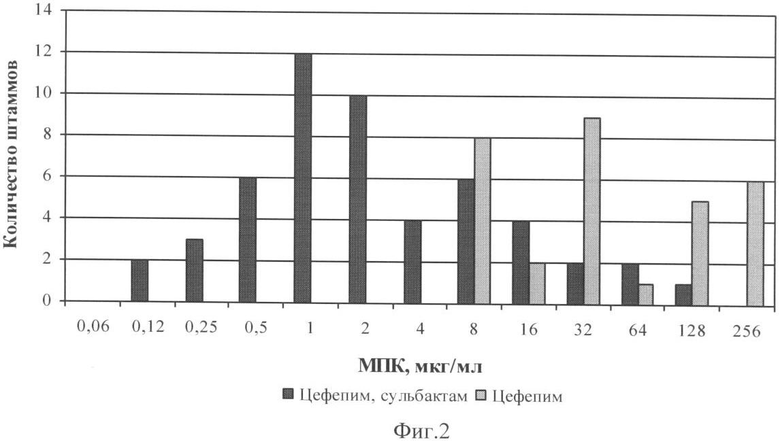
Изучение активности заявляемого препарата в отношении грамотрицательных бактерий, продуцирующих бета-лактамазы расширенного спектра групп ТЕМ, SHV и СТХ, показало его значительное преимущество перед другими цефалоспоринами и комбинированными препаратами по показателю величины минимальной подавляющей концентрации (МПК). Результаты исследования показаны на диаграммах - фиг.1 (Escherichia coli) и фиг.2 (Klebsiella pneumoniae).
Как следует из представленных данных, добавление к цефепиму сульбактама (в соотношении 1:1) приводит к существенному сдвигу МПК цефепима в отношении штаммов Escherichia coli, Klebsiella pneumoniae в сторону меньших значений. Эффект повышения активности цефепима при соотношении антибиотик/ингибитор - 2:1 оказывается существенно ниже, а при соотношении 1:2 выше. Аналогичный эффект снижения МПК цефепима был получен и в отношении других грамотрицательных бактерий, таких как Serratia marcescens, Enterobacter aerogenes, Citrobacter spp., Morganella spp., Providencia spp. Особо следует отметить высокую активность заявляемого комбинированного препарата в отношении таких патогенов, как Acinetobacter spp.
Эффект снижения значений МПК известен и при комбинации сульбактама с другими цефалоспориновыми антибиотиками: цефотаксим, цефтриаксон, цефтазидим и цефоперазон. Для количественного сравнения активности различных комбинаций цефалоспориновых антибиотиков и заявляемого препарата целесообразно использовать такой показатель, как среднегеометрическое значение МПК. Среднегеометрические значения МПК заявляемого препарата в отношении грамотрицательных бактерий, продуцирующих бета-лактамазы расширенного спектра групп ТЕМ, SHV и СТХ, приведены в таблице 1.
Как следует из полученных данных, комбинация цефепима и сульбактама в сравнении с другими комбинированными препаратами проявляет существенно большую активность в отношении всех изученных бактерий при использовании равных соотношений антибиотика и ингибитора.
Сравнительную оценку антимикробной активности различных комбинаций антибактериальных препаратов и ингибиторов бета-лактамаз в отношении грамотрицательных бактерий, циркулирующих в отделениях интенсивной терапии и реанимации г.Москвы, проводили с использованием применяющихся на практике критериев чувствительности, позволяющих прогнозировать клиническую эффективность антибиотиков и их комбинаций. Во всех случаях применяли соотношение антибиотика и ингибитора 1:1. В настоящее время в качестве таких критериев используют значения МПК, позволяющие отнести микроорганизм - возбудитель инфекционной болезни к одной из следующих категорий чувствительности: «чувствительный», «промежуточный» или «устойчивый» (Методические указания по определению чувствительности микроорганизмов к антибактериальным препаратам. Методические указания МУК 4.2.1890-04 Edn. Москва, 2004). Если возбудитель относится к категории «чувствительный», наиболее вероятный исход заболевания - выздоровление, если к категории «устойчивый», то наиболее вероятный исход - неудача лечения, если к категории «промежуточный», то исход лечения не определен.
Результаты оценки сравниваемых препаратов и их комбинаций приведены в таблице 2.
Как следует из данных таблицы 2, среди всех испытанных комбинаций комбинация цефепим/сульбактам проявила себя в отделениях интенсивной терапии и реанимации Москвы как наиболее активная в отношении возбудителей тяжелых инфекций. Наиболее демонстративно преимущества цефепима/сульбактама проявлялись в отношении Р. aeruginosa и бактерий группы Е. cloacae, P. stuartii, S. marcescens. В отношении Р. mirabilis, а также A. baumannii комбинации всех цефалоспоринов с сульбактамом были высокоактивны. Основные характеристики (частота чувствительных и устойчивых штаммов, а также значения МПК) цефотаксима и цефтриаксона, а также их комбинации с сульбактамом были близки.
Полученные данные свидетельствуют о способности препарата преодолевать большинство из наиболее распространенных механизмов резистентности.
Эффективность заявляемого препарата была изучена при экспериментальных инфекциях мышей, вызванных различными грамотрицательными, в том числе и множественно-устойчивыми, бактериями. В экспериментах использовались белые беспородные мыши-самцы массой 18-20 г. Животных инфицировали внутрибрюшинно. В предварительных экспериментах для каждого из использованных штаммов бактерий была определена величина инфицирующей дозы, вызывающая гибель 50% животных в течение 96 ч наблюдения (LD50). Использовали штаммы бактерий с различным уровнем чувствительности к бета-лактамным антибиотикам. Величина колебалась в пределах 105- 107 КОЕ (колониеобразующих единиц). В дальнейших экспериментах использовали инфицирующую дозу, равную 25-30 LD50. Антибактериальные препараты начинали вводить через 12 ч после заражения, препарат вводился по 6 раз с интервалом 12 ч. Использовали соотношение цефепим/сульбактам - 1/1. Данные представлены в таблице 3, где дозы препаратов приведены по цефепиму.
Как следует из материалов, представленных в таблице 3, при инфицировании животных чувствительным штаммом Е.coli эффективность цефепима и его комбинации с сульбактамом была практически одинакова. Однако при инфекциях, вызванных устойчивыми бактериями, эффективность заявляемого препарата была существенно выше.
Изучение фармакокинетики заявляемого препарата проводили в экспериментах на кроликах. Основные фармакокинетические параметры цефепима и сульбактама как при изолированном, так и при совместном введении приведены в таблице 4.
Представленные данные свидетельствуют об отсутствии взаимодействий компонентов комбинированного препарата.
Исследования фармакокинетики заявляемого препарата свидетельствуют о возможности поддержании необходимых концентраций обоих компонентов препарата в крови в течение интервала дозирования 8-12 ч.
Величина LD50 при изучении острой токсичности в экспериментах на белых беспородных мышах была выше 1500 мг/кг.
Таким образом, данные о микробиологической активности заявляемого препарата, его эффективности при экспериментальных инфекциях, данные о фармакокинетике и токсичности позволяют сделать вывод о возможности его использования как средства эмпирической терапии тяжелых инфекций до выделения возбудителей и получения результатов оценки их антибиотикочувствительности.
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство для лечения инфекционных болезней, вызванных множественно-устойчивыми бактериями | 2006 |
|
RU2831350C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ, ВЫЗВАННЫХ ОСНОВНЫМИ ВОЗБУДИТЕЛЯМИ ПАТОГЕНОВ | 2023 |
|
RU2825961C1 |
| Средство для лечения инфекций, вызванных множественно-устойчивыми бактериями, в том числе продуцирующими карбапенемазы | 2022 |
|
RU2793587C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ БЕТА-ЛАКТАМНЫЙ АНТИБИОТИК, СУЛЬБАКТАМ И ИНГИБИТОР БЕТА-ЛАКТАМАЗ | 2011 |
|
RU2569059C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ, ВЫЗВАННЫХ МНОЖЕСТВЕННО-УСТОЙЧИВЫМИ БАКТЕРИЯМИ | 2011 |
|
RU2455989C1 |
| КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ АНТИБАКТЕРИАЛЬНОЕ СРЕДСТВО И ТАЗОБАКТАМ | 2011 |
|
RU2593363C2 |
| БЕТА-ЛАКТАМАЗЫ С УЛУЧШЕННЫМИ СВОЙСТВАМИ ДЛЯ ЛЕЧЕНИЯ | 2015 |
|
RU2678124C2 |
| БЕТА-ЛАКТАМАЗА, СПОСОБ ЕЕ МОДИФИКАЦИИ, ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2011 |
|
RU2570551C2 |
| АНТИМИКРОБНОЕ ВЕЩЕСТВО | 2010 |
|
RU2447896C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ | 2010 |
|
RU2424801C1 |
Изобретение относится к медицине, в частности к антибактериальной терапии, а именно к средствам для лечения инфекционных болезней, вызванных множественно-устойчивыми бактериями. Изобретение может быть использовано для лечения преимущественно госпитальных, а также тяжелых и крайне тяжелых инфекционных болезней. Средство представляет собой смесь цефалоспоринового антибиотика цефепима и ингибитора бета-лактамаз сульбактама при их соотношении соответственно от 1:1 до 1:2. Использование средства позволяет существенно повысить эффективность лечения инфекционных заболеваний. 4 табл., 2 ил.
Средство для лечения инфекционных болезней, вызванных множественно-устойчивыми грамотрицательными бактериями, представляет собой смесь цефепима и сульбактама при их соотношении соответственно от 1:1 до 1:2.
| G.GARRET ET AL | |||
| COMITE DE L'ANTIBIOGRAMME DE LA SOCIETE FRANCAISE DE MICROBIOLOGIE | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| WEI SHENG WANG et al | |||
| Stenotrophomonas maltophilia bacteremia in adults: four years' | |||
Авторы
Даты
2010-01-10—Публикация
2006-12-25—Подача