Настоящее изобретение относится к антимикробным средствам и может быть использовано для лечения и профилактики инфекционных заболеваний человека и животных. Преимущественной областью применения изобретения является лечение заболеваний, вызываемых устойчивыми к антибиотикам бактериями, и профилактика развития лекарственной устойчивости у патогенных микроорганизмов.
В медицине и ветеринарии используется большое разнообразие токсичных для бактерий антибиотиков, принадлежащих к различным классам низкомолекулярных органических соединений (бета-лактамы, макролиды, тетрациклины, флуороквинолоны, сульфонамиды, аминогликозиды, имидазолы и др.). Известны также антимикробные пептиды животного происхождения, которые предлагается использовать для лечения бактериальных инфекций. В частности, известно применение в этом качестве дефензинов человека [1-7], ретроциклинов [8], виргизина, ойстеризина устриц и гиббозина скорпионов [9], дефензинов кольчатого червя [10], производных меланоцит-стимулирующего гормона [11], производных убиквицидина [12], магайнина [13], производных муцина [14], аналогов тета-дефензинов [15], антимикробных пептидов ракообразных [16], криптдина [17]. Кроме того, известно применение синтетических катионных пептидов в качестве антимикробных агентов [18, 19, 20]. Известны антимикробные пептиды насекомых, которые предлагается использовать для лечения бактериальных инфекций: бактериолитического пептида чешуекрылого Hyalophora cecropia [21], антибактериального пептида гловерина [22], антибактериальных пептидов жука Oryctes rhinoceros [23], дефензиноподобного пептида стрекозы Aeschna cyanea [24].
В последние годы положение в области терапии бактериальных инфекций значительно осложнилось в связи с широким распространением «супербактерий», устойчивых к большинству или всем известным антибиотикам [25, 26]. Особую опасность представляет распространение резистентных к антибиотикам нозокомиальных (госпитальных) инфекций в лечебных учреждениях, где они составляют основную причину инфекционных осложнений и связанной с этим смертности [27]. Лечение таких инфекций при помощи современного арсенала антибиотиков оказывается малоэффективным или невозможным. Если решение этой проблемы не будет найдено, смертность от бактериальных инфекций у людей и сельскохозяйственных животных в обозримом будущем может вернуться к уровню XIX века.
Для решения этой проблемы предлагается использовать методы профилактики развития лекарственной устойчивости у бактерий, представленные рекомендациями по рациональному использованию антибиотиков [28].
Известны также методы преодоления резистентности бактерий к антибиотикам путем введения в состав лекарственного средства дополнительных компонентов, блокирующих защитные системы патогена. В частности, известно комбинированное использование антибиотика цефепима из группы бета-лактамов и сульбактама [29]. Сульбактам является ингибитором фермента бета-лактамазы и препятствует инактивации антибиотика бактериальным ферментом. Известно предложение использовать белок молока лактоферрин или его метаболит лактоферрицин в качестве ингибитора бета-лактамазы для увеличения чувствительности к бета-лактамным антибиотикам резистентных к ним форм бактерий [30]. Известно также использование димера лизоцима для повышения чувствительности к антибиотикам метициллин-устойчивой формы золотистого стафилококка Staphilococcus aureus [31]. Димер лизоцима используется в качестве синергиста, усиливающего токсическое действие антибиотиков гентамицина, клиндамицина или ко-тримоксазола.
Предложен метод профилактики развития лекарственной устойчивости за счет блокирования передачи от одних бактерий к другим плазмид, несущих гены резистентности к антибиотикам [32]. Блокирование передачи плазмид в этом случае достигается путем введения в состав лекарственного средства фрагментов клеточной стенки дрожжей.
Перечисленные и аналогичные им методы способствуют решению отдельных аспектов проблемы резистентности бактерий к антибиотикам, однако проблема в целом остается нерешенной на данном этапе развития науки.
Основным способом преодоления множественной лекарственной устойчивости, используемым в практической медицине, остается лечение бактериальных инфекций при помощи эмпирически найденной комбинации двух и более антибиотиков различной структуры и механизма действия. В литературе описаны различные схемы комбинированной антибиотикотерапии [33]. Предполагается, что сочетание антибиотиков увеличивает эффективность терапии и препятствует развитию устойчивости бактерий. Однако такое усложнение и удорожание схемы лечения далеко не всегда дает положительный эффект. Зачастую суммируются отрицательные свойства каждого из антибиотиков (токсичность и другие побочные эффекты), нередко один компонент комбинации подавляет, а не усиливает действие другого компонента [34]. Экспериментально показано, что применение комбинации антибиотиков может провоцировать развитие резистентности даже в большей степени, чем применение каждого из них по отдельности и способствует формированию наиболее опасных мультирезистентных штаммов бактерий [35, 36].
Таким образом, дальнейшие поиски подходов к рациональной терапии бактериальных инфекций остаются одной из основных задач фармакологии и системы здравоохранения в целом. В рамках этой глобальной задачи наиболее актуальными представляются разработка средств, эффективных в отношении резистентных к антибиотикам бактерий, и поиск препаратов, затрудняющих появление новых резистентных форм.
Наиболее близким к заявленному антивирусному веществу является бактериолитический пептид насекомого Hyalophora cecropia [21], принятый в качестве прототипа. Недостатком известного вещества является узкий спектр его антимикробной активности (он действует лишь на определенные виды грамотрицательных бактерий). Другим недостатком прототипа является то обстоятельство, что он содержит только одно действующее вещество, открывая тем самым возможности для развития устойчивости к нему у микроорганизмов.
Существо изобретения
Технический результат изобретения состоит в существенном повышении эффективности борьбы с бактериальными инфекциями человека и животных, профилактике появления новых устойчивых к антибиотикам форм микроорганизмов.
Указанный технический результат достигается тем, что заявленное антимикробное вещество включает очищенный комплекс дефензинов, цекропинов, диптерицинов и пролин-богатых пептидов насекомых семейства Calliphoridae.
Кроме того, указанный технический результат достигается тем, что заявленное антимикробное вещество содержит пептид SEQ ID №1, или SEQ ID №2, или SEQ ID №3, или SEQ ID №4.
Помимо этого, указанный технический результат достигается тем, что заявленное антимикробное вещество получают из насекомых вида Calliphora vicina R.-D, или насекомых вида Calliphora vomitoria L, или насекомых вида Lucilia sericata Meig.
Указанный технический результат достигается также фармацевтической композицией на основе заявленного антимикробного вещества.
Как и известные методы комбинированной антибиотикотерапии, предлагаемый подход включает одновременное воздействие на бактериальную клетку двух и более компонентов, различающихся по структуре и механизму действия. Главное отличие состоит в том, что предлагаемый подход предусматривает использование комбинации действующих веществ, кодируемых генами одного вида или близкородственных видов многоклеточных организмов. По сравнению с используемым в настоящее время методом эмпирического подбора комбинаций антибиотиков, предлагаемый подход имеет существенные преимущества, поскольку такая комбинация образует коадаптированный комплекс действующих веществ. Под коадаптированным комплексом в контексте настоящего изобретения понимается комбинация двух и более антимикробных пептидов, сформированная в процессе биологической эволюции и оптимизированная естественным отбором в отношении совместимости ее компонентов. Вероятность получения оптимальной с точки зрения эффективности и безопасности комбинации действующих веществ в этом случае оказывается максимальной и многократно превышает вероятность получения аналогичного результата путем эмпирического подбора комбинаций антибиотиков, практикуемого в настоящее время в медицине.
Насколько нам известно из анализа научной и патентной литературы, предлагаемый подход является новым и до настоящего времени для разработки антимикробных лекарственных средств не применялся. В частности, в этом нетрудно убедиться, ознакомившись с патентами и научными публикациями по антимикробным пептидам [1-24, 33, 34].
Для целей реализации настоящего изобретения могут быть использованы коадаптированные комплексы антимикробных пептидов различных многоклеточных организмов. Минимальное требование при выборе конкретного вида организмов состоит в том, чтобы механизм естественного антибактериального иммунитета данного вида включал использование одновременно двух и более групп антимикробных пептидов, различающихся по структуре и механизму действия.
По данным авторов настоящего изобретения, наилучшим образом для этих целей подходят насекомые из группы мускоидных двукрылых (Diptera, Muscomorpha) подкласса крылатых насекомых (Insecta, Pterigota), в особенности представители мясных мух семейства Calliphoridae, такие как Calliphora vicina Robineau-Desvoidy, Calliphora vomitoria Linnaeus и Lucilia sericata Meigen.
Свойства антимикробных комплексов этой группы насекомых наиболее подробно изучены нами на примере синей мясной мухи С.vicina [37-40].
Как нам удалось установить, клетки жирового тела личинок С.vicina синхронно секретируют комплекс антимикробных пептидов, которые накапливаются в гемолимфе (крови) и обеспечивают защиту внутренней среды от патогенных микроорганизмов. Следует особо подчеркнуть, что личинки одновременно выделяют в гемолимфу антимикробные пептиды нескольких типов (семейств пептидов), включая дефензины, цекропины, диптерицины и пролин-богатые пептиды. Структура и характер антимикробной активности дефензинов, цекропинов и диптерицинов С.vicina описаны нами ранее [39], структура пролин-богатых пептидов приводится в настоящей заявке впервые.
Далее мы провели анализ гомологии аминокислотных последовательностей обнаруженных у С.vicina антимикробных пептидов и аналогичных пептидов других насекомых. Это позволило нам установить основные закономерности формирования коадаптированного комплекса антимикробных пептидов в процессе эволюции. В частности, было определено, что дефензины С.vicina гомологичны дефензинам, распространенным среди различных отрядов крылатых насекомых, и, вероятно, имеют эволюционный возраст порядка 500 миллионов лет. Цекропины С.vicina принципиально не отличаются от цекропинов других двукрылых и чешуекрылых (два родственных отряда насекомых, относящихся к группе Mecopteroidea), и их эволюционный возраст может насчитывать порядка 300 миллионов лет. Диптерицины характерны для представителей ряда близкородственных семейств отряда двукрылых, объединяемых в группу мускоидных двукрылых (Muscomorpha). Следовательно, диптерицины представляют эволюционно более молодую группу антимикробных пептидов по сравнению с цекропинами и дефензинами. Наконец, пролин-богатые пептиды С.vicina не имеют явных структурных аналогов среди известных антимикробных пептидов других насекомых, откуда можно заключить, что эти пептиды возникли на поздних этапах эволюции предков современного рода Calliphora.
Таким образом, в процессе эволюции мух-каллифорид сформировался «мускоидный» антимикробный комплекс, элементы которого оптимизированы естественным отбором как минимум в двух аспектах - эффективности подавления патогенных микроорганизмов и безопасности для организма-хозяина. Есть и третий аспект, особенно важный в контексте предлагаемого изобретения - сохранение эффективности элементов комплекса на протяжении длительных периодов, измеряемых десятками миллионов лет, без изменения их структурно-функциональных характеристик. В качестве примера отметим, что в структуре дефензина в ряду предков современного вида С.vicina мутация, выраженная в замене одной аминокислоты на другую, происходила, по нашим расчетам, в среднем один раз в десять миллионов лет [38].
Это дало нам основание предположить, что в ходе естественного отбора предками мускоидных двукрылых были найдены такие варианты организации комплекса, которые делают процесс адаптации бактерий крайне медленным или даже невозможным. Соответственно, антибактериальные лекарственные средства на основе антимикробного комплекса насекомых, в отличие от известных в настоящее время антибиотиков, должны сохранять терапевтическую эффективность на протяжении неограниченно долгого периода времени. Приведенные далее примеры осуществления изобретения служат экспериментальным доказательством этой гипотезы.
Мы предположили далее, что оптимальным выбором в контексте настоящего изобретения является использование организмов, у которых антимикробные пептиды выделяются клетками иммунной системы в кровь или другую биологическую жидкость и оказывают там избирательное токсическое действие на патогенные микроорганизмы. В этом случае антимикробные пептиды непосредственно контактируют с клетками тела организма-хозяина и по этой причине должны проходить жесткий естественный отбор на отсутствие токсичности для этих клеток в бактерицидных концентрациях. Такими организмами являются С.vicina и другие представители мускоидных двукрылых, у которых антимикробные пептиды синтезируются и выделяются в гемолимфу клетками специального органа - жирового тела. Чтобы пояснить преимущество организмов с таким типом организации иммунной системы, отметим, что, например, у млекопитающих сходные антимикробные пептиды (α-дефензины) локализованы внутри клеток крови (главным образом в нейтрофилах) и оказывают антимикробное действие в составе специализированных внутриклеточных органелл [41, стр.10-11]. Попадая в нехарактерную для них среду - межклеточное пространство или плазму крови, α-дефензины млекопитающих могут оказывать токсическое или иное побочное действие на клетки самого организма-хозяина. С этой точки зрения антимикробные пептиды С.vicina представляются более подходящими кандидатами на роль лекарства, предназначенного для введения в кровь, чем внутриклеточные антимикробные пептиды млекопитающих, такие, например, как описанные в литературе α- и β-дефензины [1-6]. При получении предлагаемого в настоящей заявке комплекса антимикробных пептидов могут быть использованы технологии трех типов:
1) Экстракция комплекса из организма-хозяина и его последующая очистка методами препаративной химии.
2) Химический синтез аналогов компонентов комплекса и их объединение в составе готовой лекарственной формы или комбинированной схемы лечения.
3) Использование генов, кодирующих структуру антимикробных пептидов, для получения генетически модифицированных клеток-продуцентов и биосинтеза соответствующих рекомбинантных пептидов.
Независимо от технологии получения комплекса, принципиально важным является введение в его состав нескольких антимикробных пептидов, связанных единством происхождения и существенно различающихся по химической структуре и механизму действия.
Каждая из указанных выше технологий получения комплекса имеет свою область преимущественного использования. Технология химического синтеза может быть применена для производства относительно коротких (предпочтительно не более 30 аминокислот) пептидов, сохраняющих антимикробную активность своих природных прототипов. Ее преимущество состоит в возможности получения препарата в промышленных масштабах и с максимальной степенью химической чистоты, необходимой, например, при производстве лекарственных форм для внутривенного введения. Ограничение этой технологии состоит в технической трудности и дороговизне синтеза длинных пептидных цепей, особенно в случае пептидов, имеющих сложную трехмерную организацию.
Генно-инженерная технология дает возможность синтезировать пептиды любой длины, однако в ряде случаев не позволяет точно воспроизводить пространственную структуру пептида и обычно отличается значительной стоимостью конечного продукта.
Технология получения комплекса непосредственно из организма-хозяина обеспечивает максимально точное воспроизведение структуры активных компонентов. Однако она применима главным образом в отношении организмов, пригодных для культивирования в промышленных масштабах.
Технология массового культивирования С.vicina и других перечисленных выше видов двукрылых хорошо отработана, в том числе авторами настоящего изобретения, и позволяет получать биомассу личинок в промышленных масштабах и при относительно небольших затратах (сырьем для производства биомассы могут служить отходы рыбной и мясной промышленности). Поэтому в качестве примера осуществления предлагаемого изобретения мы использовали технологию прямой экстракции комплекса из биомассы личинок.
Свойства антимикробного комплекса С.vicina и других видов были изучены нами в серии исследований, результаты которых изложены в приведенных ниже примерах. Основные с точки зрения раскрытия существа настоящего изобретения результаты состоят в следующем:
1) В состав антимикробного комплекса С.vicina входят четыре группы пептидов, различающихся по структуре, спектру активности и механизму действия: дефензины, цекропины, диптерицины и пролин-богатые пептиды. Дефензины и пролин-богатые пептиды избирательно токсичны для грамположительных бактерий, цекропины и диптерицины - для грамотрицательных. Таким образом, для бактерий каждого типа имеется как минимум два действующих вещества, различающихся по структуре и механизму действия.
2) Описанный выше антимикробный комплекс является эволюционно консервативным образованием. Филогенетический анализ аминокислотных последовательностей входящих в его состав пептидов показывает, что структура пептидов остается практически неизменной на протяжении миллионов или даже десятков миллионов лет. Отсюда следует, что близкородственные виды, в частности, виды С.vicina и С.vomitoria, относящиеся к одному роду Calliphora, обладают идентичным в структурном и функциональном отношении комплексом антимикробных пептидов и являются взаимозаменяемыми. Аналогичным образом структурно-функциональные характеристики антимикробного комплекса зеленой мясной мухи L.sericata, принадлежащей к тому же семейству Calliphoridae, должны быть близки или идентичны свойствам комплекса мух рода Calliphora.
3) Уровень чувствительности бактерий к токсическому действию данного комплекса остается неизменным в ряду поколений, подвергавшихся его воздействию, в то время как чувствительность бактерий к обычным антибиотикам быстро снижается. Это позволяет рассчитывать, что резистентность бактерий к лекарственному препарату, действующим веществом которого является данный комплекс, не будет развиваться или будет развиваться значительно медленнее, чем резистентность к антибиотикам, применяемым в настоящее время.
4) Одновременное применение предлагаемого комплекса и известного антибиотика (например, цефотаксима) задерживает развитие устойчивости к известному антибиотику. Следовательно, предлагаемый комплекс может быть использован в качестве средства для продления сроков эффективного применения известного антибиотика. При этом имеется в виду, что известный антибиотик может более эффективно применяться у данного больного при длительных курсах лечения, а также более длительное время находиться в арсенале лекарственных средств, применяемых в медицине, без потери терапевтической эффективности.
5) Предлагаемый комплекс обладает выраженной микробиоцидной активностью в отношении различных групп грамотрицательных и грамположительных бактерий. Наибольшую чувствительность проявляют представители энтеробактерий и некоторых кокков. Результаты исследований подтверждают перспективность использования комплекса в качестве средства для лечения различных бактериальных заболеваний человека и животных.
Примеры конкретной реализации.
Пример 1. Получение и анализ состава комплекса антимикробных пептидов С.vicina.
Для получения антимикробного комплекса С.vicina гемолимфу личинок подкисляли 0.05% трифторуксусной кислотой (ТФУ) (конечная концентрация) и центрифугировали в течение 5 мин при 5000g. Супернатант наносили на картридж Sep-Pak C18 classic (Waters), промывали 0.05% ТФУ и элюировали 50% ацетонитрилом/0.05% ТФУ. Элюат подвергали лиофильной сушке и использовали в данном и последующих примерах в качестве антимикробного комплекса С.vicina (здесь и далее обозначен сокращением AKCV).
Для предварительного определения состава антимикробного комплекса лиофилизат растворяли в водной фазе, наносили на хроматографическую колонку ChemcoPak C18 (4×100 мм, Chemco) и хроматографировали в градиенте ацетонитрила (0-60% в течение 60 мин). Фракции собирали с интервалом 1 мин и определяли антимикробную активность в каждой фракции при помощи метода агаровых пластинок [39]. Для этого в стерильные чашки Петри (диаметр 9 см) заливали 7.5 мл питательной среды Luria-Bertany с агарозой (Difco) (бактотриптон 1%, дрожжевой экстракт 0.5%, NaCl 1%). Перед застыванием в теплую среду вводили 2×105 клеток бактерий Micrococcus luteus A 270 или Escherichia coli D31. Тестируемый материал в объеме 2 µ1 наносили на поверхность застывшей среды. Чашки инкубировали 24 ч при +37°С и измеряли диаметр зоны ингибирования роста бактерий.
Результаты хроматографического анализа показали, что комплекс содержит несколько компонентов, токсичных для грамположительных (М.luteus) и грамотрицательных (Е.coli) бактерий и различающихся по хроматографической подвижности (Таблица 1).
Для изучения химической структуры компонентов антимикробного комплекса были использованы обратнофазная жидкостная хроматография высокого давления (RP HPLC), масспектрометрия (MALDI-TOF) и микросеквенирование по Эдману в соответствии с методикой, описанной ранее [39].
Для этого антимикробный комплекс, изолированный из 10 мл гемолимфы в соответствии с описанной выше процедурой подвергали обратнофазной хроматографии на колонке Aquapore OD-300 C18 (250×4.6 мм, Brownlee Associates) и разделению методом гель-фильтрации на колонке SEC 2000 (300×7.5 мм, Beckman) с использованием хроматографа Beckman Gold system. Антимикробную активность выделенных пептидов определяли методом агаровых пластинок, как описано ранее [39]. Чистоту выделенных пептидов контролировали масспектрометрически (MALDI-TOF), структуру (аминокислотный сиквенс) определяли методом автоматизированного микросеквенирования по Эдману на секвенаторе модели 473А (Applied Biosystems). Корректность сиквенса контролировали при помощи MALDI-TOF масспектрометрии. Характеристики идентифицированных антимикробных пептидов приведены в Таблице 2. В составе антимикробного комплекса идентифицированы активные компоненты четырех кластеров:
1) Дефензины - обнаружены три изоформы с молекулярными массами 4032.0, 4091.3 и 4114.3 дальтон. Полный аминокислотный сиквенс установлен для пептида с массой 4032.0 дальтон. Дефензины С.vicina, как и дефензины других насекомых, характеризуются наличием 6 остатков цистеина, образующих три дисульфидных мостика, и избирательно токсичны для грамположительных бактерий. Дефензины, как известно, относятся к числу наиболее широко распространенных антимикробных пептидов насекомых [37, 42].
2) Цекропин - линейный пептид с молекулярной массой 4156.0 дальтон, состоящий из двух амфипатических α-спиральных участков. Избирательно токсичен для грамотрицательных бактерий. Структурно и функционально сходен с цекропинами других насекомых. Цекропины распространены среди представителей отрядов Diptera и Lepidoptera [37, 42].
3) Диптерицины - представлены 4 изоформами с молекулярными массами 8886.2, 8913.9, 8999.7 и 9029.1 дальтон. N-терминальный участок диптерицина С.vicina, состоящий из 43 аминокислот, включая повтор из 5 остатков глицина, структурно сходен с диптерицинами других двукрылых. Диптерицины избирательно токсичных для грамотрицательных бактерий.
4) Пролин-богатые пептиды - обнаружено 4 изоформы с молекулярными массами 2987.0, 3025.7, 3040.0 и 3048.6 дальтон. В настоящее время секвенирован N-терминальный участок, содержащий 23 аминокислоты, включая 4 остатка пролина. По формальному признаку (высокое содержание пролина) они могут быть отнесены к пролин-богатым пептидам, однако их сиквенс не имеет гомологии с пролин-богатыми пептидами других насекомых. Функционально они также резко отличаются от известных пролин-богатых пептидов. В отличие от последних, преимущественно действующих на грамотрицательные бактерии, пролин-богатые пептиды С.vicina избирательно токсичны для грамположительных бактерий.
Пример 2. Спектр активности антимикробного комплекса С.vicina
Активность антимикробного комплекса С.vicina (AKCV) была исследована с использованием метода серийных разведений в жидкой питательной среде. Для этого последовательные двукратные разведения препарата в объеме 50 мкл помещали в лунки 96-луночного микробиологического планшета. Инокулят, полученный добавлением 5-6-часовой бульонной культуры в жидкую питательную среду Luria-Bertany (Difco), вносили в лунки планшета в объеме 50 мкл, при этом конечная концентрация микроорганизмов составляла 5×105 КОЕ (колониеобразующих единиц) на мл. В контрольные лунки добавляли стерильную питательную среду. Каждый вариант тестировали в 3 повторностях. Планшеты инкубировали 24 часа при температуре +35-37°С. Учет результатов проводили визуально или спектрофотометрически, сравнивая рост микроорганизма в присутствии препарата с ростом культуры в лунке без препарата. В качестве минимальной ингибирующей концентрации (МИК) принимали минимальную концентрацию, обеспечивающую полное ингибирование видимого роста.
Обобщенная информация о спектре антимикробной активности исследуемого препарата представлена в Таблице 3. Большинство изученных микроорганизмов оказалось чувствительно к нему. Эти микроорганизмы принадлежат к разным экологическим группам, включая условно патогенные виды, и к различным морфологическим типам - грамположительным и грамотрицательным бактериям. Таксономический спектр антимикробной активности препарата включает представителей семейств Enterobacteriacea, Bacillaceae, Coccaceae, Enterococcaceae, Pseudomonadaceae, Moraxellaceae и Corynebacteriaceae. Наиболее высокую активность антимикробный комплекс С.vicina проявляет в отношении большинства представителей семейства Enterobacteriaceae и Coccaceae. К малочувствительным формам относятся Enterococcus faecalis, Listeria monocytogenes, а также некоторые штаммы Staphilococcus aureus и Pseudomonas aeruginosa.
Пример 3. Изменения устойчивости к антимикробному комплексу С.vicina и известным антибиотикам в ряду поколений бактерии Escherichia coli
В исследовании использовали два штамма Е.coli дикого типа: чувствительный к антибиотикам штамм 774.1 (чувствителен, в частности, к амоксиклаву, амикацину, гентамицину, имипенему, меропенему, левомицетину, ципрофлоксацину, полимиксину, цефоперазону, цефоперазон/сульбактаму, цефотаксиму) и резистентный штамм 863.1 (устойчив к амоксиклаву, амикацину, нетилмицину, гентамицину, ципрофлоксацину, цефоперазону, цефтазидиму, умеренно устойчив к левомицетину и цефепиму, чувствителен к имипенему, меропенему, полимиксину, цефоперазон/сульбактаму).
В качестве препаратов сравнения использовали известные антибиотики цефотаксим (Биосинтез), полимиксин В (Киевский завод медпрепаратов) и меропенем (AstraZeneca). С помощью метода серийных разведений в жидкой среде, описанного в Примере 2, для каждого штамма Е.coli оценили минимальную ингибирующую концентрацию (МИК) антимикробного комплекса С.vicina (AKCV) и референтных антибиотиков. Для этого в лунки 96-луночного микробиологического планшета, содержащие по 100 мкл жидкой питательной среды Luria-Bertany (Invitrogen), помещали последовательные двукратные разведения препарата (3 разведения ниже МИК и 3 разведения выше МИК) и полученный из 5-6-часовой бульонной культуры инокулят в конечной концентрации 5×105 КОЕ/мл. В контрольные лунки препарат не добавляли. Планшеты инкубировали при температуре +35-37°С в течение 24 часов. Далее ежедневно из лунки с подпороговой концентрацией антибиотика, где наблюдали видимый рост бактериальных клеток, переносили по 2 мкл бактериальной суспензии в 100 мкл жидкой питательной среды, содержащей последовательные двукратные разведения препарата. После выполнения каждого пассажа определяли минимальную ингибирующую концентрацию. Чувствительность к исследуемым препаратам популяций, полученных после проведения пассажей, оценивали с помощью метода серийных разведений в жидкой питательной среде (см. Пример 2).
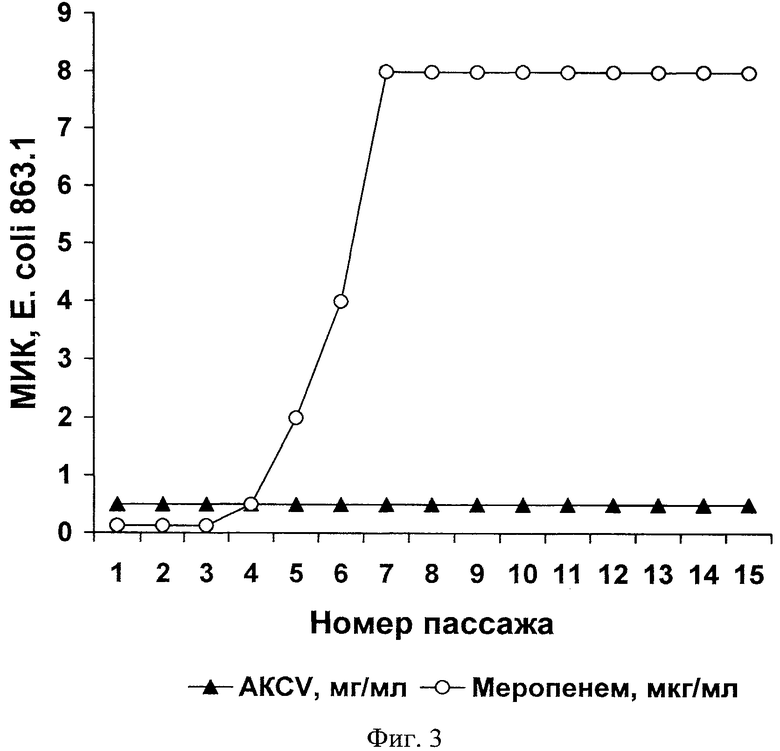
Анализ данных, представленных на Фиг.1, 2 и 3, показывает, что устойчивость бактерий Е.coli к токсическому действию цефотаксима, полимиксина и меропенема быстро увеличивается в ряду пассажей. В частности, Фиг.1 демонстрирует изменение минимальной ингибирующей концентрации (МИК) после серии пассажей Е.coli 774.1 с цефотаксимом или антимикробным комплексом С.vicina (AKCV), Фиг.2. - изменение МИК после серии пассажей Е.coli 774.1 с полимиксином или AKCV, Фиг.3. - изменение МИК после серии пассажей Е.coli 863.1 с меропенемом или AKCV.
После проведения серии пассажей уровень чувствительности к цефотаксиму снизился в 12, к полимиксину - в 8 и к меропенему - в 64 раза (Таблица 4). В то же время было установлено, что исследованные штаммы Е.coli в аналогичных условиях отбора не меняют своей чувствительности к антимикробному комплексу С.vicina в ряду поколений, подвергавшихся его действию.
Таким образом, AKCV, в отличие от известных антибиотиков, препятствует развитию устойчивости к данному комплексу у бактерий на примере Е.coli. Материалы данного примера показывают также, что предлагаемый антимикробный комплекс может быть использован для подавления роста как чувствительных, так и устойчивых к антибиотикам штаммов бактерий, что служит экспериментальным обоснованием п.10 формулы изобретения.
Пример 4. Изменения устойчивости к антимикробному комплексу С.vicina и известным антибиотикам в ряду поколений бактерии Klebsiella pneumonia
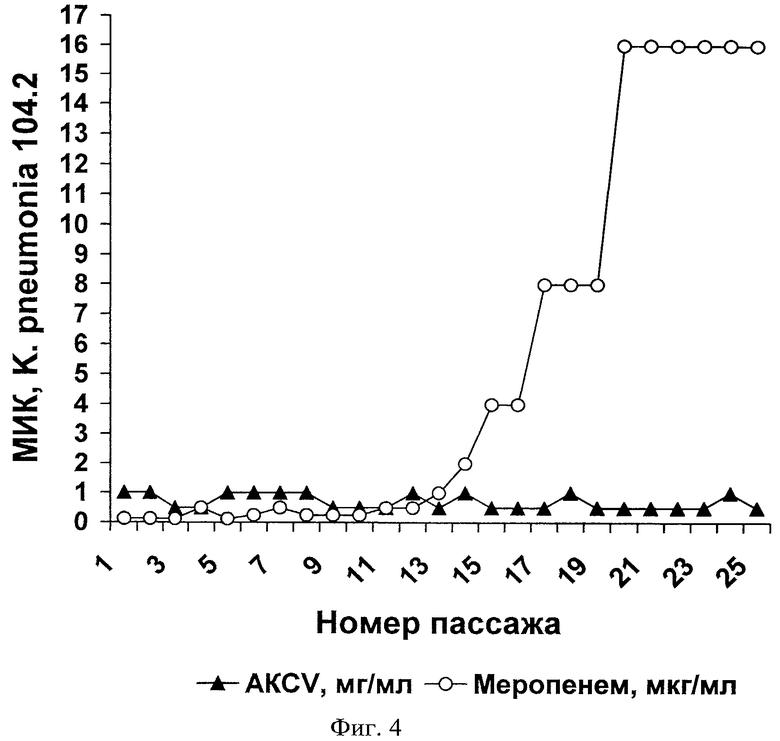
В этом разделе приводятся экспериментальные данные, демонстрирующие, с какой скоростью происходит изменение устойчивости бактерии Klebsiella pneumonia к антимикробному комплексу С.vicina (AKCV) и известному антибиотику меропенему (Фиг.4).
В исследовании использовали резистентный штамм 104.2 K.pneumonia (устойчив к амикацину, нетилмицину, гентамицину, ципрофлоксацину, цефоперазону, цефоперазон/сульбактаму, цефтазидиму, цефотаксиму, цефепиму, умеренно устойчив к левомицетину и амоксиклаву, чувствителен к имипенему, меропенему, полимиксину). Методика постановки экспериментов была аналогична описанной в Примере 3. Результаты, представленные на Фиг.4, показывают, что продолжительное культивирование K.pneumonia в среде с меропенемом вызывает развитие высокого уровня резистентности к этому антибиотику. Устойчивость штамма, полученного после 25 пассажей с меропенемом, в 128 раз превышала устойчивость к нему исходного штамма. После проведения пассажей K.pneumonia в присутствии антимикробного комплекса С.vicina изменений устойчивости в ряду поколений не отмечено (Таблица 4).
Материалы настоящего примера показывают, что бактерии K.pneumonia не формируют устойчивость к действию антимикробного комплекса С.vicina в условиях, в которых они легко адаптируются к действию известного антибиотика меропенема. Следует также отметить, что предлагаемый антимикробный комплекс эффективно подавляет развитие устойчивого к известным антибиотикам штамма K.pneumonia и может быть использован для лечения инфекций, вызываемых такими бактериями в соответствии с п.10 формулы изобретения.
Пример 5. Изменения устойчивости к антимикробному комплексу С.vicina и известным антибиотикам в ряду поколений бактерии Acinetobacter baumannii.
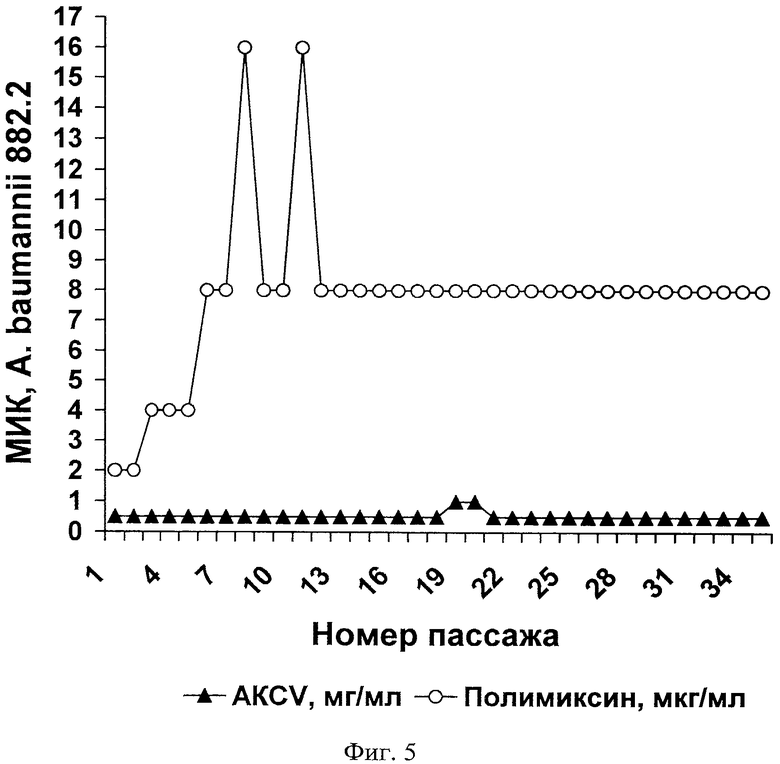
В этом разделе приводятся экспериментальные данные, позволяющие определить скорость формирования устойчивости А.baumannii к действию антимикробного комплекса С.vicina (AKCV) и антибиотику полимиксину В.
В исследовании использовали резистентный штамм 882.2 А.baumannii (устойчив к амоксиклаву, амикацину, нетилмицину, гентамицину, имипенему, меропенему, левомицетину, цефоперазону, цефтазидиму, цефотаксиму и цефепиму, умеренно устойчив к ципрофлоксацину, чувствителен к полимиксину и цефоперазон/сульбактаму). Методика постановки экспериментов аналогична описанной в Примере 3.
На Фиг.5 и в Таблице 4 показаны результаты, которые демонстрируют развитие резистентности A.baumannii при последовательных пассажах на средах с полимиксином и антимикробным комплексом С.vicina (AKCV). После 35 пассажей устойчивость к этому антибиотику возрастала примерно в 5 раз. В аналогичном эксперименте развитие устойчивости к антимикробному комплексу С.vicina не обнаружено.
Таким образом, бактерия A.baumannii, как и другие виды бактерий, рассмотренные в примерах 3 и 4, в предложенных условиях отбора оказалась неспособной сформировать устойчивость к действию антимикробного комплекса С.vicina. Полученные экспериментальные данные также служат подтверждением того факта, что предлагаемый антимикробный комплекс эффективен в отношении устойчивой к известным антибиотикам формы A.baumannii и может применяться в соответствии с п.10 формулы изобретения.
Пример 6. Влияние антимикробного комплекса С.vicina на скорость развития устойчивости к известным антибиотикам у бактерии Escherichia coli
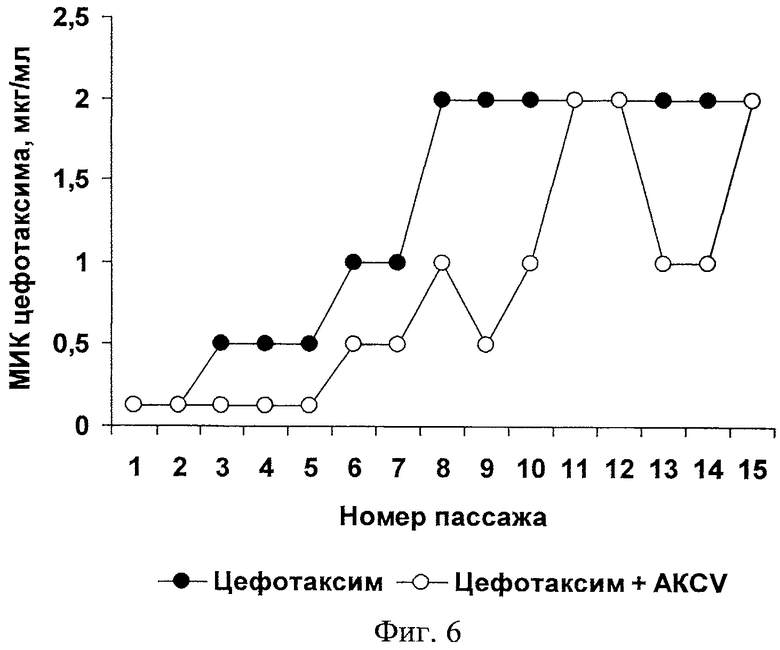
В настоящем примере изучена способность антимикробного комплекса С.vicina (AKCV) задерживать развитие устойчивости к антибиотику цефотаксиму в условиях массового отбора клеток Е.coli.
В опыте использовали штамм 774.1 Е.coli, чувствительный к антибиотикам (чувствителен, в частности, к амоксиклаву, амикацину, гентамицину, имипенему, меропенему, левомицетину, ципрофлоксацину, полимиксину, цефоперазону, цефоперазон/сульбактаму, цефотаксиму). Техника серийных пассажей соответствовала описанной выше в Примере 3. Клетки Е.coli подвергались многократным пересевам в жидкой питательной среде, содержащей антибиотик цефотаксим без добавления антимикробного комплекса С.vicina или с его добавлением в конечной концентрации 50 мкг/мл.
Анализ экспериментальных данных, приведенных на Фиг.6, показывает, что уже 3 пассажа кишечной палочки в среде с цефотаксимом приводят к адаптации бактерий, которая сопровождается развитием двукратной устойчивости к этому антибиотику. Максимальная устойчивость, в 16 раз превышавшая исходную, развивалась через 7 пассажей Е.coli с цефотаксимом. В то же время добавление антимикробного комплекса С.vicina (AKCV) в инкубационную среду с цефотаксимом снижало скорость развития устойчивости как минимум в два раза.
Таким образом, антимикробный комплекс С.vicina не только препятствует адаптации бактерий к его компонентам, но и задерживает развитие устойчивости к известным антибиотикам. Это позволяет использовать его в качестве средства для профилактики развития лекарственной устойчивости у патогенных микроорганизмов.
Данный пример служит экспериментальным обоснованием п.9 формулы изобретения.
Пример 7. Изменения устойчивости к антимикробному комплексу Calliphora vomitoria и известным антибиотикам в ряду поколений бактерии Е.coli
В этом примере приведены данные по изменению уровня чувствительности Е.coli к действию антимикробного комплекса мухи С.vomitoria (AKCVO), вида, близкородственного С.vicina, и антибиотика цефотаксима в ряду поколений, подвергавшихся отбору на устойчивость к тому или другому агенту.
В качестве стартового материала использовали лабораторную культуру мухи С.vomitoria. Методика получения антимикробного комплекса С.vomitoria соответствовала методике, описанной в Примере 1. В экспериментах использовали чувствительный штамм 774.1 Е.coli. Методика постановки экспериментов была описана в Примере 3.
Материалы, представленные на Фиг.7 и в Таблице 5, показывают, что культивирование Е.coli в присутствии цефотаксима вызывает быстрое нарастание устойчивости к этому антибиотику. В результате штамм, полученный после серии пассажей, приобрел значительную резистентность к цефотаксиму. Аналогичное воздействие антимикробного комплекса С.vomitoria (AKCVO) не вызывало развитие устойчивости у Е.coli.
Материалы настоящего примера показывают взаимозаменяемость антимикробных комплексов С.vomitoria и С.vicina в контексте настоящего изобретения. Как и препарат из С.vicina, антимикробный комплекс С.vomitoria препятствует развитию устойчивости к его бактерицидному действию у бактерий.
Пример 8. Изменения устойчивости к антимикробному комплексу Lucilia sericata и известным антибиотикам в ряду поколений бактерии Е.coli
L.sericata относится к семейству Calliphoridae и находится в близком филогенетическом родстве с видами рода Calliphora, в частности, С.vicina и С.vomitoria. В этом примере приведены данные по изменению уровня чувствительности Е.coli к действию антимикробного комплекса L.sericata (AKLS) и антибиотика цефотаксима в ряду поколений, подвергавшихся систематическому воздействию того или другого агента.
В качестве стартового материала использовали лабораторную культуру мухи L.sericata. Методика получения антимикробного комплекса L.sericata соответствовала методике, описанной в Примере 1.
В экспериментах использовали чувствительный к антибиотикам штамм 774.1 Е.coli. Методика постановки экспериментов была описана в Примере 3.
Результаты экспериментов представлены на Фиг.8 и в Таблице 5. Как и в случаях с С.vicina и С.vomitoria, рассмотренных в примерах 3-8, нам не удалось обнаружить закономерных изменений уровня резистентности в ряду поколений Е.coli, подвергавшихся систематическому воздействию антимикробным комплексом L. sericata (AKLS). В тех же условиях бактерии быстро приобретали устойчивость к действию референтного антибиотика цефотаксима. Таким образом, антимикробный комплекс L.sericata в контексте настоящего изобретения обладает такими же свойствами, как и антимикробные комплексы мух рода Calliphora, и может быть использован в качестве действующего вещества лекарственных средств, способных препятствовать развитию лекарственной устойчивости у бактерий.
Пример 9. Терапевтические свойства антимикробного комплекса С.vicina при экспериментальной бактериальной инфекции у мышей
В экспериментах использовали беспородных белых мышей весом 18-20 г. В качестве инфекционного агента использовали штамм дикого типа бактерии Klebsiella pneumonia. В предварительных опытах была подобрана минимальная летальная доза бактерий, вызывающая гибель 95-100% мышей в течение 24-48 ч. Для этого мышам вводили внутрибрюшинно взвесь суточной агаровой культуры бактерий в дозе от 1×109 до 10×109 клеток в изотоническом растворе NaCl. Минимальная летальная доза составляла 2×109 клеток. Реакция на введение этой дозы проявлялась через 3-4 часа - снижение активности животных, вздутие живота и диарея на более поздних сроках. Гибель животных происходила в течение 24-48 час после заражения.
Антимикробный комплекс С.vicina инъецировали внутрибрюшинно в разовой дозе 0.5 мг, растворенной в 0.5 мл изотонического раствора NaCl, через 30 мин, 3 и 24 часа после введения взвеси бактерий. Контрольным животным вводили изотонический раствор NaCl. В каждом варианте опыта использовано по 10 животных.
В эксперименте, результаты которого приведены в Таблице 6, мышам вводили инфекционный агент в дозе 4×109 клеток K.pneumonia. В контроле в течение первых трех суток пало 90% мышей, в опытной группе - 40%. Разница между опытной и контрольной группами была статистически достоверной (t=2,37 при N=19, Р<0.05).
Таким образом, антимикробный комплекс С.vicina обладает терапевтической активностью при введении в организм инфицированного патогенной бактерией животного.
Результаты данной серии экспериментов показывают также, что антимикробный комплекс С.vicina при введении в терапевтически эффективных концентрациях не проявляет токсичности для животных.
Приведенные выше примеры осуществления изобретения позволяют охарактеризовать комплексный технический результат от его использования. Этот результат состоит в пополнении арсенала лекарственных средств, предназначенных для лечения инфекционных заболеваний, вызываемых устойчивыми к антибиотикам бактериями. В настоящее время этот арсенал во многих случаях оказался практически исчерпанным, поскольку за последние десятилетия интенсивного применения антибиотиков возникли формы бактерий, которые не поддаются лечению никакими известными антибиотиками. Кроме того, этот результат состоит в профилактике развития устойчивости бактерий к известным антибиотикам при их совместном применении с предлагаемым антивирусным веществом. Это позволяет пролонгировать сроки эффективного использования известных антибиотиков в отношении бактерий, которые еще сохранили к ним чувствительность.
Использованные источники информации
1. Patent No.: WO 081486 Oral administration of defensins to treat intestinal diseases
2. Patent No.: US 034820 Use of antimicrobial proteins and peptides for the treatment of otitis media and paranasal sinusitis
3. Patent No.: WO 9807833 Compositions and methods for use of defensin
4. Patent No.: JP 288105 Antibacterial peptides for the treatment of periodontitis
5. Patent No.: WO 038349 Beta-defensins for antibiotics
6. Patent No.: WO 9421672 Beta-defensins: novel antimicrobial peptides from bovine neutrophils
7. Patent No.: US 110553 Use of antibiotic peptides produced by human corneal epithelial cells to manage infection
8. Patent No.: WO 044998 Retrocyclins: antiviral and antimicrobial peptides
9. Patent No.: WO 053565 Protein and cDNA sequences and heterologous expression of antimicrobial peptides from spruce, oyster and scorpion, and uses thereof
10. Patent No.: WO 097110 Defensin family polypeptides having antimicrobial activity and polynucleotides encoding them from Arenicola marina
11. Patent No.: US 6887846 Antimicrobial amino acid sequences derived from alpha-melanocyte-stimulating hormone
12. Patent No.: US 6884776 Antimicrobial peptides derived from ubiquicidine
13. Patent No.: US 6872705 Use of antimicrobial peptides as preservatives in ophthalmic preparations, including solutions, emulsions, and suspensions
14. Patent No.: US 6790833 Antifungal and antibacterial agents
15. Patent No.: US 014669 Antimicrobial theta defensins, analogs there of, and methods of use
16. Patent No.: US 6642203 Crustacean antimicrobial peptides
17. Patent No.: WO 9616075 Antibiotic cryptdin peptides and their complementary and genomic DNA sequences
18. Patent No.: US 6906035 Antimicrobial cationic peptides
19. Patent No.: US 6624140 Synthetic peptides with antimicrobial and endotoxin neutralizing properties for management of the sepsis syndrome
20. Patent No.: US 6172185 Antimicrobial cationic peptide derivatives of bactenecin
21. Patent No.: US 4355104 Bacteriolytic proteins (прототип)
22. Patent No.: US 6063765 Antibacterial protein
23. Patent No.: US 6476189 Antibacterial peptides and antibacterial agents containing such peptides as an effective ingredient
24. Patent No.: FR 2695392 Antibacterial peptides from the hemolymph of the dragonfly Aeschna cyanea and their purification and use
25. Arias C.A., Murray M.D. Antibiotic-resistant bugs in the 21st century - a clinical super-challenge, New England Journal of Medicine, 2009, 360 (5): 439-443
26. Alanis A.J. Resistance to anitibiotics: are we in the post-antibiotic era? Archives of medical research, 2005, 36:697-705
27. International Nosocomial Infection Control Consortium report, data, summary for 2002-2007, issued January 2008, Am J Infect Control 2008; 36:627-37
28. MacKenzie F.M., M.J.Struelens, K.J.Towner and I.M.Gould Report of the Consensus Conference on Antibiotic Resistance; Prevention and Control (ARPAC). Clinical Microbiology and Infection, Volume 11 Number 11, November 2005:938-954
29. USPTO Patent Application №: 20090275552 Therapy for treating resistant bacterial infections
30. European Patent №: EP 1246640 Method and composition for treatment and/or prevention of antibiotic-resistant microorganism infections
31. European patent application №: EP 1174147 A1 (00113551.6) Reversal of antibiotic resistance with lysozyme dimer
32. US Patent Application №: 20090263416 Reduction of antibiotic resistance in bacteria
33. Eliopulos G.M., Eliopulos C.T. Antibiotic Combinations: Should They Be Tested? Clinical microbiology reviews, 1988, 1 (2): 139-156
34. Bollenbach Т., Quan S., Chait R, Kishony R. Nonoptimal microbial response to antibiotics underlies suppressive drug interactions. Cell, 2009, 139 (4): 707-718
35. Michel J.-B., Yeh P.J., Chait R., Moellering R.C. and R. Kishony. Drug interactions modulate the potential for evolution of resistance, Proc Natl Acad Sci USA, 2008, 105(39): 14918-14923
36. Hegreness M, Shoresh N, Damian D, Hartl D, Kishony R. Accelerated evolution of resistance in multidrug environments. Proc Natl Acad Sci USA. 2008, 105(37): 13977-81
37. Chernysh S.I. Antimicrobial substances from insects. In: Bioresources and Biotechnology, Proceedings of the I Korea/Russia joint symposium, Taejon, 1996, p.281-296
38. Черныш С.И., Гордя Н.А., Филатова Н.А. Протекнторные механизмы насекомых: темпы молекулярной и фенотипической эволюции. Исследования по генетике, вып. 12, СПб., Изд-во С.-Петерб. Ун-та, 1999:52-59
39. Chernysh S.I, Gordja N.A, Simonenko N.P. Diapause and Immune Response: Induction of Antimicrobial Peptides Synthesis in the Blowfly, Calliphora vicina R.-D. (Diptera, Calliphoridae). Entomological science, 2000, v.3, No 1:139-144
40. Chernysh S.I., N.A.Filatova, N.S.Chernysh. Cytotoxic activity of blow fly Calliphora vicina hemocytes. Journal of Insect Physiology, 2004, v. 50:777-781
41. Кокряков В.Н. Биология антибиотиков животного происхождения, Санкт-Петербург, «Наука», 1999, с.1-162.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ разрушения и предотвращения образования бактериальных биопленок комплексом антимикробных пептидов насекомых | 2017 |
|
RU2664708C1 |
| ПОЛИПЕПТИДЫ ЛИЗИНА, АКТИВНЫЕ ПРОТИВ ГРАМОТРИЦАТЕЛЬНЫХ БАКТЕРИЙ | 2016 |
|
RU2724545C2 |
| ПЕПТИДЫ ЛАТАРЦИНЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 2006 |
|
RU2306148C1 |
| СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИОЦИНСОДЕРЖАЩЕЙ КОМПОЗИЦИИ | 2020 |
|
RU2773131C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА АНТИМИКРОБНЫХ ПЕПТИДОВ НАСЕКОМОГО | 2013 |
|
RU2552157C1 |
| КОМПОЗИЦИИ И СООТВЕТСТВУЮЩИЕ СПОСОБЫ ДЛЯ СЕЛЬСКОГО ХОЗЯЙСТВА | 2018 |
|
RU2783258C2 |
| КОМПОЗИЦИИ И СООТВЕТСТВУЮЩИЕ СПОСОБЫ КОНТРОЛЯ ЗАБОЛЕВАНИЙ, ПЕРЕДАВАЕМЫХ ПЕРЕНОСЧИКАМИ | 2018 |
|
RU2777518C2 |
| ПЛАЗМИДНЫЙ ВЕКТОР pET-His8-TrxL-Acip1, ШТАММ БАКТЕРИИ Escherichia coli BL21(DE3)/pET-His8-TrxL-Acip1 ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА АЦИПЕНСИНА-1 И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА | 2015 |
|
RU2580031C2 |
| КОМПОЗИЦИИ И СООТВЕТСТВУЮЩИЕ СПОСОБЫ КОНТРОЛЯ ЗАБОЛЕВАНИЙ, ПЕРЕДАВАЕМЫХ ПЕРЕНОСЧИКАМИ | 2018 |
|
RU2804136C2 |
| СПОСОБЫ И СООТВЕТСТВУЮЩИЕ КОМПОЗИЦИИ ДЛЯ ИЗГОТОВЛЕНИЯ ПРОДУКТОВ ПИТАНИЯ И КОРМОВ | 2018 |
|
RU2780586C2 |






Изобретение относится к антимикробным средствам, преимущественной областью его применения является лечение заболеваний, вызываемых устойчивыми к антибиотикам бактериями, и профилактика развития лекарственной устойчивости у патогенных микроорганизмов. Вещество включает очищенный комплекс антимикробных пептидов насекомых семейства Calliphoridae, в состав которого входят дефензин, характеризуемый аминокислотным сиквенсом Ala-Thr-Cys-Asp-Leu-Leu-Ser-Gly-Thr-Gly-Ala-Asn-Hys-Ser-Ala-Cys-Ala-Ala-Hys-Cys-Leu-Leu-Arg-Gly-Asn-Arg-Gly-Gly-Tyr-Cys-Asn-Gly-Lys-Ala-Val-Cys-Val-Cys-Arg-Asn, пролин-богатый пептид, характеризуемый N-терминальным аминокислотным сиквенсом Phe-Val-Asp-Arg-Asn-Arg-Ile-Pro-Arg-Ser-Asn-Asn-Gly-Pro-Lys-Ile-Pro-Ile-Ile-Ser-Asn-Pro-, цекропин, характеризуемый аминокислотным сиквенсом Gly-Trp-Leu-Lys-Lys-Ile-Gly-Lys-Lys-Ile-Glu-Arg-Val-Gly-Gln-Hys-Thr-Arg-Asp-Ala-Thr-Ile-Gln-Gly-Leu-Ala-Val-Ala-Gln-Gln-Ala-Ala-Asn-Val-Ala-Ala-Thr-Ala-Arg, диптерицин, характеризуемый N-терминальным аминокислотным сиквенсом Asp-Ser-Lys-Pro-Leu-Asn-Leu-Val-Leu-Pro-Lys-Glu-Glu-Pro-Pro-Asn-Asn-Pro-Gln-Thr-Tyr-Gly-Gly-Gly-Gly-Gly-Ser-Arg-Lys-Asp-Asp-Phe-Asp-Val-Val-Leu-Gln-Gly-Ala-Gln. Преимуществами антимикробного средства является то, что бактерии не развивают устойчивости к предложенному веществу при его длительном применении, также его применение задерживает развитие устойчивости бактерий к известным антибиотикам и оказывает бактерицидное действие на штаммы с приобретенной лекарственной устойчивостью. 7 з.п. ф-лы, 6 табл., 8 ил.
1. Антимикробное вещество, включающее очищенный комплекс дефензинов, цекропинов, диптерицинов и пролин-богатых пептидов насекомых семейства Calliphoridae.
2. Антимикробное вещество по п.1, содержащее пептид SEQ ID №1.
3. Антимикробное вещество по п.1, содержащее пептид SEQ ID №2.
4. Антимикробное вещество по п.1, содержащее пептид SEQ ID №3.
5. Антимикробное вещество по п.1, содержащее пептид SEQ ID №4.
6. Антимикробное вещество по п.1, получаемое из насекомых вида Calliphora vicina R.-D.
7. Антимикробное вещество по п.1, получаемое из насекомых вида Calliphora vomitoria L.
8. Антимикробное вещество по п.1, получаемое из насекомых вида Lucilia sericata Meig.
| Устройство для контроля процесса дуговой сварки | 1981 |
|
SU1006124A1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА АМИЛОЛИТИЧЕСКИХ И ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ | 0 |
|
SU320528A1 |
| ПЛЕСКАЧ В.А | |||
| Ростмодулирующее и цитотоксическое действие пептида из гемолимфы личинок мухи Calliphora Vicina (Diptera Calliphoridae) in vitro | |||
| - Цитология, 2010, т.52, №12, с.1005-1011. | |||
Авторы
Даты
2012-04-20—Публикация
2010-11-15—Подача