Изобретение относится к новым терапевтически пригодным производным хинуклидина, к некоторым способам их получения и к содержащим их фармацевтическим композициям.
Новые соединения по настоящему изобретению являются антимускариновыми агентами, которые обладают высокоэффективным и долгосрочным действием. Прежде всего, такие соединения характеризуются высоким сродством в отношении мускариновых рецепторов М3. Мускариновые рецепторы данного подвида расположены в железах и гладкой мускулатуре и опосредуют стимулирующий эффект в парасимпатической системе на секрецию железы и сокращение гладкой мускулатуры внутренних органов (см. книгу Cholinergic Transmission, H.P.Rang и др., Pharmacology, Churchill Livingstone, гл.6, New York (1995)).
Известно, что антагонисты рецепторов М3 используют для лечения заболеваний, характеризующихся повышенным парасимпатическим тонусом, избыточной железистой секрецией или сокращением гладкой мускулатуры (R.M.Eglen и S.S.Hegde, Drug News Perspect, 10(8), сс. 462-469 (1997)).
Примеры заболеваний такого рода включают респираторные заболевания, такие как хроническое обструктивное заболевание легких (COPD), бронхит, повышенная бронхиальная реактивность, астма, кашель и ринит; урологические заболевания, такие как недержание мочи, поллакиурия, нейрогенный или нестабильный мочевой пузырь, цистоспазм и хронический цистит; заболевания желудочно-кишечного тракта, такие как синдром раздраженного кишечника, спастический колит, дивертикулит и пептическая язва; а также сердечно-сосудистые заболевания, такие как синусовая брадикардия, индуцированная блуждающим нервом (см. книгу Muscarinic Receptor Agonists and Antagonists, Goodman и Gilman, The Pharmacological Basis of Therapeutics, 10-е изд., McGraw Hill, гл.7, New York (2001)).
Соединения по настоящему изобретению можно использовать в отдельности или в комбинации с другими лекарственными средствами, эффективными при лечении таких заболеваний. Такие соединения вводят, например, в комбинации с β2-агонистами, стероидами, противоаллергическими лекарственными средствами, ингибиторами фосфодиэстеразы IV и/или антагонистами лейкотриена D4 (LTD4) для одновременного, отдельного или последовательного использования при лечении респираторных заболеваний. Соединения по настоящему изобретению можно использовать для лечения респираторных заболеваний, описанных выше, в комбинации с β2-агонистами, стероидами, противоаллергическими лекарственными средствами или ингибиторами фосфодиэстеразы IV.
Соединения со сходной структурой описаны в ряде патентов в качестве антихолинэргических агентов и/или спазмолитиков.
Например, в патенте FR 2012964 описаны производные хинуклидина формулы

где R означает Н, ОН или алкильную группу, содержащую от 1 до 4 атомов углерода, R1 означает фенил или тиенил, а R2 означает циклогексил, циклопентил или тиенил, или если R означает Н, то R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют трициклическую группу формулы
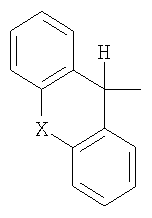
где Х означает -O-, -S- или -СН2-,
или кислотно-аддитивные или соли четвертичного аммония указанных выше соединений.
В патенте США №4465834 описан класс антихолинергических лекарственных препаратов формулы

где R1 означает карбоциклическую или разветвленную алифатическую группу, содержащую от 3 до 8 атомов углерода (такую как фенил, циклогексил, циклопентил, циклопропил, циклогептил и изопропил), R2 означает разветвленную или прямую алифатическую группу, содержащую от 3 до 10 атомов углерода и 1 или 2 олефиновых или ацетиленовых связи, или фенилэтинил, стирил или этинил, а R означает алкильную или циклическую группу, содержащую от 4 до 12 атомов углерода и атом азота третичного амина. Соединения по настоящему изобретению включают также свободные основания или их кислотно-аддитивные соли, а также соли четвертичного аммония указанных соединений.
В патенте США №4843074 описаны продукты формулы

где X означает Н, галоген, (низш.)алкил, (низш.)алкокси, гидрокси, a R означает морфолинил, тиоморфолинил, пиперидинил, 1,4-диокса-8-азаспиро[4,5]деканил, 4-(2,6-диметилморфолинил), 4-кетопиперидинил, 4-гидроксипиперидинил, 4-замещенный пиперазинил. В настоящее изобретение включены также четвертичные соли (низш.)алкилгалогенидов и фармацевтически приемлемые кислотно-аддитивные соли.
В патенте США №4644003 описаны сложные эфиры 3-хинуклидинола и α-дизамещенных гликолевых кислот

и их фармацевтически приемлемые соли,
где R означает фенил, незамещенный или замещенный не более 3 заместителями, которые включают алкокси, галоген, нитро, амино, алкиламино, диалкиламино, ациламино и трифторметил, а R1 означает водород, алкил, циклоалкил, алкенил, циклоалкенил, алкинил, алкилоксиалкил, циклоалкилоксиалкил, галогеналкил или галогеналкенил.
В заявке WO 92/04346 описаны соединения формулы
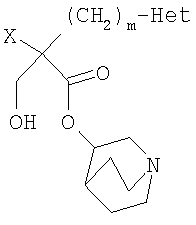
и их фармацевтически приемлемые соли, где Х означает фенил (необязательно замещенный) или тиенил, a "Het" означает (а) пятичленный азотсодержащий гетероцикл, (б) оксадиазолил или тиадиазолил или (в) шестичленную азотсодержащую гетероциклическую группу, m равно 1 или 2 (более подробное описание приведено в указанных выше публикациях).
В заявках WO 01/04118 и WO 02/053564 описаны бициклические соединения азония, общая формула которых аналогична формуле соединений по настоящему изобретению.
В заявке WO 2004/096800 описаны сложные эфиры кватернизованных 3-хинуклидинолов формулы
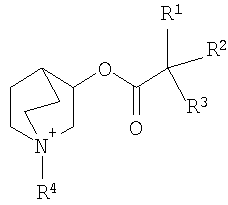
где кватернизующая группа (R4) означает С1-С8алкил, замещенный, например, группами -OR11, -OCO-R13 или -COO-R14, где R11 означает водород, C1-C8алкил, C1-C8алкилC1-C8алкокси или С1-С8алкилО-С3-С15карбоциклил, R13 означает С1-С8алкил или С3-С15карбоциклил, а R14 означает водород, С3-С15карбоциклическую группу, С1-С8алкенил или С1-С8алкил, необязательно замещенный С3-С15карбоциклической группой, причем прежде всего указанные соединения включают, например, соединения 1-аллилоксикарбонилметил-3-(2-гидрокси-2,2-дитиофен-2-илацетокси)-1-азоний бицикло[2.2.2]октан и 1-карбоксиметил-3-(2-гидрокси-2,2-дитиофен-2-илацетокси)-1-азоний бицикло[2.2.2]октан.
В настоящем изобретении предлагаются новые производные сложных эфиров хинуклидина формулы (I), обладающие высокой антагонистической активностью в отношении мускариновых рецепторов М3:

где В означает атом водорода или группу, которую выбирают из группы, включающей -R1, -OR1, гидрокси, -O(CO)R1, циано и необязательно замещенный неароматический гетероциклил, содержащий один или более гетероатомов, где R1 выбирают из группы, включающей атомы водорода, необязательно замещенный С1-С8алкил, необязательно замещенный С2-С8алкенил и необязательно замещенный С3-С8циклоалкил, n равно целому числу от 0 до 4,
А выбирают из группы, включающей -CH2-, -CH=CR3-, -CR3=CH-, -CR3R4-, -O-, -СО-, -O-(СН2)2-O-, где R3 и R4 каждый независимо означает атом водорода или С1-С8алкил,
m равно целому числу от 0 до 8,
p равно целому числу от 1 до 2,
бициклическое кольцо азония содержит заместители в положениях 2, 3 или 4, включая все возможные конфигурации асимметрических центров,
D выбирают из группы, включающей:
 или
или 
где R5 выбирают из группы, включающей фенил, 2-тиенил, 3-тиенил, 2-фуранил, 3-фуранил, причем указанные группы необязательно замещены одним или более заместителями Ra,
R6 выбирают из группы, включающей 2-тиенил, 3-тиенил, 2-фуранил, 3-фуранил, С3-С8циклоалкил, С3-С8циклоалкенил, С1-С8алкил, С2-С8алкенил, С2-С8алкинил, бензил и фенетил, причем указанные группы необязательно замещены одним или более заместителями Rb,
R7 означает атом водорода или группу, которую выбирают из группы, включающей гидроксил, гидроксиметил и метил,
Q означает простую связь или группу, которую выбирают из группы, включающей -СН2-, -СН2СН2-, -O-, -O-CH2-, -S-, -S-CH2- и -СН=СН-,
Ra и Rb независимо выбирают из группы, включающей атомы галогена, необязательно замещенный С1-С8алкил, необязательно замещенный C1-С8алкокси, гидрокси, трифторметил, нитро, циано, -COOR8, -NR8R9, где R8 и R9 независимо означают атом водорода или С1-С8алкил,
у означает целое число от 0 до 3,
X- означает фармацевтически приемлемый анион моно- или полиосновной кислоты, при условии, что группа B-(CH2)n-A-(CH2)m- не означает прямой С1-4алкил, а также что исключены следующие соединения:
1-аллилоксикарбонилметил-3-(2-гидрокси-2,2-дитиофен-2-илацетокси)-1-азоний бицикло[2.2.2]октан и
1-карбоксиметил-3-(2-гидрокси-2,2-дитиофен-2-илацетокси)-1-азоний бицикло[2.2.2]октан.
Другие объекты настоящего изобретения включают: а) способ получения соединений формулы (I), б) фармацевтические композиции, включающие эффективное количество указанных соединений, в) применение указанных соединений для получения лекарственных средств, предназначенных для лечения респираторных заболеваний, заболеваний мочевой системы и/или заболеваний желудочно-кишечного тракта, и г) способы лечения респираторных заболеваний, заболеваний мочевой системы и/или желудочно-кишечного тракта, причем указанные способы включают введение соединений по настоящему изобретению субъекту, нуждающемуся в таком лечении.
Использованный в данном контексте термин «(низш.)алкил» означает необязательно замещенные, прямые или разветвленные радикалы, содержащие от 1 до 8, предпочтительно от 1 до 6 и более предпочтительно от 1 до 4 атомов углерода.
Примеры включают радикалы метил, этил, н-пропил, изопропил, н-бутил, втор-бутил и трет-бутил, н-пентил, 1-метилбутил, 2-метилбутил, изопентил, 1-этилпропил, 1,1-диметилпропил, 1,2-диметилпропил, н-гексил или 1-этилбутил, 2-этилбутил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 2-метилпентил, 3-метилпентил, трифторметил и изогексил.
Использованный в данном контексте термин «(низш.)алкенил» означает необязательно замещенные, прямые или разветвленные моно- или полиненасыщенные радикалы, содержащие от 2 до 8, предпочтительно от 2 до 6 и более предпочтительно от 2 до 4 атомов углерода. Прежде всего предпочтительные алкенильные радикалы являются моно- или диненасыщенными.
Примеры включают радикалы винил, аллил, 1-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил, 1-пентенил, 2-пентенил, 3-пентенил и 4-пентенил.
Использованный в данном контексте термин «(низш.)алкинил» означает необязательно замещенные, прямые или разветвленные моно- или полиненасыщенные радикалы, содержащие от 2 до 8, предпочтительно от 2 до 6 и более предпочтительно от 2 до 4 атомов углерода. Прежде всего предпочтительные алкинильные радикалы являются моно- или диненасыщенными.
Примеры включают радикалы 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил и 3-бутинил.
Использованный в данном контексте термин «(низш.)алкокси» означает необязательно замещенные прямые или разветвленные кислородсодержащие радикалы, содержащие в алкильном фрагменте от 1 до 8, предпочтительно от 1 до 6 и более предпочтительно от 1 до 4 атомов углерода.
Предпочтительные алкоксирадикалы включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, трет-бутокси, трифторметокси, дифторметокси, гидроксиметокси, 2-гидроксиэтокси или 2-гидроксипропокси.
Использованный в данном контексте термин «циклоалкил» означает насыщенные карбоциклические радикалы и, если не указано иное, циклоалкильный радикал в большинстве случаев содержит от 3 до 7 атомов углерода.
Циклоалкильный радикал в большинстве случаев является незамещенным или замещенным 1, 2 или 3 заместителями, которые являются одинаковыми или различными. Если циклоалкильный радикал содержит 2 или более заместителей, то заместители являются одинаковыми или различными.
Примеры включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Предпочтительными являются радикалы циклопропил, циклопентил или циклогексил.
Использованный в данном контексте термин «циклоалкенил» означает частично ненасыщенные карбоциклические радикалы и, если не указано иное, циклоалкенильный радикал в большинстве случаев содержит от 3 до 7 атомов углерода.
Циклоалкенильный радикал в большинстве случаев является незамещенным или замещенным 1, 2 или 3 заместителями, которые являются одинаковыми или различными. Если циклоалкенильный радикал содержит 2 или более заместителей, то заместители являются одинаковыми или различными.
Примеры включают циклобутенил, циклопентенил, циклогексенил и циклогептенил. Предпочтительными являеются циклопентенил или циклогексенил.
Использованный в данном контексте термин «гетероциклический радикал» в большинстве случаев означает неароматическое, насыщенное или ненасыщенное С3-С10карбоциклическое кольцо, такое как 5-, 6- или 7-членный радикал, в котором один или более, например, 1, 2, 3 или 4 атома углерода, предпочтительно 1 или 2 атомов углерода заменены на гетероатом, который выбирают из группы, включающей N, О и S, за исключением группы бензо[1,3]диоксолил. Предпочтительными являются насыщенные гетероциклические радикалы. Гетероциклический радикал включает одно кольцо, два или более конденсированных колец, причем по крайней одно кольцо содержит гетероатом. Если гетероциклический радикал содержит 2 или более заместителей, то заместители являются одинаковыми или различными.
Гетероциклический радикал в большинстве случаев является незамещенным или замещенным 1, 2 или 3 заместителями, которые являются одинаковыми или различными. Заместители предпочтительно выбирают из группы, включающей атомы галогена, предпочтительно атомы фтора, гидрокси, оксо, алкил, содержащий от 1 до 4 атомов углерода, и алкокси, содержащий от 1 до 4 атомов углерода. Если гетероциклический радикал содержит 2 или более заместителей, то заместители являются одинаковыми или различными.
Примеры неароматических гетероциклических радикалов включают пиперидил, пирролидинил, пирролинил, пиперазинил, морфолинил, тиоморфолинил, пиразолинил, пиразолидинил, хинуклидинил, имидазолидинил, оксиранил и азаридинил.
Использованный в данном контексте термин «атом галогена» означает атомы хлора, фтора, брома или иода, в большинстве случаев атомы фтора, хлора или брома, наиболее предпочтительно атомы хлора или фтора.
Использованный в данном контексте термин «необязательно замещенная группа или радикал» означает, что некоторые атомы водорода в данной группе или радикале заменены не более чем на 3 заместителя, которые выбирают из группы, включающей атомы галогена, гидрокси, алкил, содержащий от 1 до 4 атомов углерода, и алкокси, содержащий от 1 до 4 атомов углерода. Если группа содержит более 1 заместителя, предпочтительными являются заместители, связанные с различными атомами в указанной группе.
Использованный в данном контексте термин «моно- или полиосновная кислота» означает фармацевтически приемлемые кислоты, включающие как неорганические кислоты, например, хлористоводородную, серную, фосфорную, дифосфорную, бромистоводородную, иодистоводородную и азотную кислоты, и органические кислоты, например, лимонную, фумаровую, малеиновую, яблочную, миндальную, аскорбиновую, щавелевую, янтарную, винную, бензойную, муравьиную, уксусную, трифторуксусную, метансульфоновую, этансульфоновую, бензолсульфоновую или пара-толуолсульфоновую кислоту.
Если соединения по настоящему изобретению содержат один или более хиральных центров, то в настоящее изобретение включены все конфигурации хирального центра и, прежде всего, энантиомеры или диастереомеры с различными конфигурациями. Примеры хиральных центров, которые присутствуют в соединениях по настоящему изобретению, включают, без ограничения перечисленным, четвертичный атом азота в бициклическом азониевом кольце, атом углерода в бициклическом азониевом кольце, к которому присоединена группа D-COO-, и атом углерода, через который группа D присоединена к сложноэфирной группе.
В предпочтительном варианте осуществления настоящего изобретения соединения формулы (I) являются соединениями, в которых В означает атом водорода или группу, которую выбирают из группы, включающей -R1, -OR1, гидрокси, -O(CO)R1, циано и необязательно замещенный неароматический гетероциклил, содержащий один или более гетероатомов, где
R1 выбирают из группы, включающей атом водорода, необязательно замещенный С1-С8алкил, необязательно замещенный С2-С8алкенил и необязательно замещенный С3-С8циклоалкил,
n равно целому числу от 0 до 4,
А выбирают из группы, включающей -СН2-, -CH=CR3-, -CR3=CH-, -CR3R4-, -O-, -СО-, -O-(СН2)2-O-, где R3 и R4 каждый независимо означает атом водорода или С1-С8алкил,
m равно целому числу от 0 до 8,
р равно целому числу от 1 до 2,
бициклическое кольцо азония содержит заместители в положениях 2, 3 или 4, включая все возможные конфигурации асимметрических центров,
D выбирают из группы, включающей:
 или
или 
где R5 выбирают из группы, включающей фенил, 2-тиенил, 3-тиенил, 2-фуранил, 3-фуранил, причем указанные группы необязательно замещены одним или более заместителями Ra,
R6 выбирают из группы, включающей 2-тиенил, 3-тиенил, 2-фуранил, 3-фуранил, С3-С8циклоалкил, С3-С8циклоалкенил, С1-С8алкил, С2-С8алкенил, С2-С8алкинил, бензил и фенетил, причем указанные группы необязательно замещены одним или более заместителями Rb,
R7 означает атом водорода или группу, которую выбирают из группы, включающей гидроксил, гидроксиметил и метил,
Q означает простую связь или группу, которую выбирают из группы, включающей -СН2-, -СН2СН2-, -O-, -O-СН2-. -S-, -S-СН2- и -СН=СН-,
Ra и Rb независимо выбирают из группы, включающей атомы галогена, необязательно замещенный С1-С8алкил, необязательно замещенный C1-С8алкокси, гидрокси, трифторметил, нитро, циано, -COOR8, -NR8R9, где R8 и R9 независимо означают атом водорода или С1-С8алкил,
у равно целому числу от 0 до 3,
Х- означает фармацевтически приемлемый анион моно- или полиосновной кислоты,
при условии, что группа B-(CH2)n-A-(CH2)m- не означает прямой C1-С4алкил и С1-С8алкил, замещенный группами -OR11, -OCO-R13 или -COO-R14, где R11 означает водород, С1-С8алкил, С1-С8алкилС1-С8алкокси или С1-С8алкил-O-С3-С15карбоциклил, R13 означает С1-С8алкил или С3-С15карбоциклил, а R14 означает водород, С3-С15карбоциклил, С1-С8алкенил или С1-С8алкил, необязательно замещенный С3-С15карбоциклической группой.
В одном варианте осуществления настоящего изобретения соединения формулы (I) предпочтительно являются соединениями, в которых А выбирают из группы, включающей -СН2-, -CH=CR3-, -CR3=CH-, -CR3R4-, -O-, -O-(СН2)2-O-, где R3 и R4 каждый независимо означает атом водорода или С1-С8алкил.
В другом варианте осуществления настоящего изобретения соединения формулы (I) предпочтительно являются соединениями, в которых В выбирают из группы, включающей атомы водорода, гидрокси, необязательно замещенный С1-С8алкил, необязательно замещенный С2-С8алкенил, необязательно замещенный С3-С8циклоалкил и неароматический гетероциклил, замещенный по крайней мере гидроксигруппой.
В еще одном варианте группа азонийбицикло замещена по атому азота группой, которую выбирают из группы, включающей аллил, 4-метилпент-3-енил, изопропил, циклопропилметил, изобутил, гептил, циклогексилметил, 3-циклогексилпропил, 3,7-диметилокта-(Е)-2,6-диенил, 2-гидроксиэтил, 3-гидроксипропил, 4-гидроксибутил, 5-гидроксипентил, 6-гидроксигексил, 2-этоксиэтил, 2-(2-гидроксиэтокси)этил, 2-(2-метоксиэтокси)этил, оксиранилметил, 2-[1,3]диоксолан-2-илэтил, 2-[2-(2-гидроксиэтокси)этокси]этил, 3-[1,3]диоксолан-2-илпропил, 2-этоксикарбонилэтил, 3-этоксикарбонилпропил, 4-этоксикарбонилбутил, 4-ацетоксибутил, 2-цианоэтил, 3-цианопропил, 4-цианобутил, 6-цианогексил, 4,4,4-трифторбутил, 3-(4-гидроксипиперидин-1-ил)пропил и 4-(4-гидроксипиперидин-1-ил)бутил. Более предпочтительно, группа азонийбицикло замещена по атому азота группой, которую выбирают из группы, включающей аллил, 4-метилпент-3-енил, изопропил, циклопропилметил, изобутил, гептил, 2-гидроксиэтил, 3-гидроксипропил, 4-гидроксибутил, 5-гидроксипентил, 6-гидроксигексил, 2-(2-гидроксиэтокси)этил, 2-(2-метоксиэтокси)этил, 4-этоксикарбонилбутил, 4-ацетоксибутил, 3-цианопропил и 4-цианобутил. Еще более предпочтительно, группа азонийбицикло замещена по атому азота группой, которую выбирают из группы, включающей аллил, 4-метилпент-3-енил и н-гептил, наиболее предпочтительно группой, которую выбирают из группы, включающей аллил и н-гептил, и еще более предпочтительно аллил.
В одном варианте p равно 2.
В другом варианте бициклическое кольцо азония содержит заместители в положении 3, включая все возможные конфигурации асимметрического углерода. Более предпочтительно третий атом углерода в азонийбициклическом кольце находится в R конфигурации.
В еще одном варианте R5 означает незамещенный фенил, 2-тиенил, 3-тиенил, 2-фурил или 3-фурил.
В одном варианте R6 означает 2-тиенил, 3-тиенил, 2-фурил, 3-фурил или циклопентил.
В другом варианте группу формулы -O-CO-C(R5)(R6)(R7) выбирают из группы, включающей 2,2-дитиен-2-илацетокси, 2,2-дитиен-2-илпропионилокси, 2-гидрокси-2,2-дитиен-2-илацетокси, 2-гидрокси-2-фенил-2-тиен-2-илацетокси, 2-фур-2-ил-2-гидрокси-2-фенилацетокси, 2-фур-2-ил-2-гидрокси-2-тиен-2-илацетокси, (2*)-2-гидрокси-2,3-дифенилпропионилокси, 2-гидрокси-2-тиен-2-илпент-4-еноилокси, (2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси и (2R)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси. Более предпочтительно группу -O-CO-C(R5)(R6)(R7) выбирают из группы, включающей 2-циклопентил-2-гидрокси-2-тиен-2-илацетокси, 2,2-дитиен-2-илацетокси, 2-гидрокси-2,2-дитиен-2-илацетокси, 2,2-дитиен-2-илпропионилокси, 2-гидрокси-2-фенил-2-тиен-2-илацетокси, 2-фур-2-ил-2-гидрокси-2-тиен-2-илацетокси и 2-фур-2-ил-2-гидрокси-2-фенилацетокси. Еще более предпочтительно группу -O-СО-C(R5)(R6)(R7) выбирают из группы, включающей 2-гидрокси-2,2-дитиен-2-илацетокси и (2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси и наиболее предпочтительно 2-гидрокси-2,2-дитиен-2-илацетокси.
В еще одном варианте группу формулы D-COO- выбирают из группы, включающей 9-метил-9Н-флуорен-9-карбонилокси, 9-гидрокси-9Н-флуорен-9-карбонилокси, 9Н-ксантен-9-карбонилокси, 9-метил-9Н-ксантен-9-карбонилокси, 9-гидрокси-9Н-ксантен-9-карбонилокси, 9,10-дигидроантрацен-9-карбонилокси и 10,11-дигидро-5Н-дибензо[а,d]циклогептен-5-карбонилокси. Более предпочтительно группу формулы D-COO- выбирают из группы, включающей 9-метил-9Н-флуорен-9-карбонилокси, 9-гидрокси-9Н-флуорен-9-карбонилокси, 9Н-ксантен-9-карбонилокси, 9-метил-9Н-ксантен-9-карбонилокси и 9-гидрокси-9Н-ксантен-9-карбонилокси, и наиболее предпочтительно 9-метил-9Н-ксантен-9-карбонилокси и 9-гидрокси-9Н-ксантен-9-карбонилокси.
В одном варианте атом углерода, замещенный группами R5, R6 и R7, находится в R-конфигурации.
В другом варианте атом углерода, замещенный группами R5, R6 и R7, находится в S-конфигурации.
Следующие соединения предназначены для иллюстрации настоящего изобретения без ограничения его объема:
гидробромид (3R)-1-аллил-3-(2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-(2,2-дитиен-2-илацетокси)-1-(4-метилпент-3-енил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(2,2-дитиен-2-илпропионилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(4-метилпент-3-енил)-3-(2,2-дитиен-2-илпропионилокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-изопропил-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-циклопропилметил-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-изобутил-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-гептил-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-циклогексилметил-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(3-циклогексилпропил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-(4-метилпент-3-енил)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(3,7-диметилокта-(Е)-2,6-диенил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-(2-гидроксиэтил)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-(3-гидроксипропил)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(4-гидроксибутил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(2-этоксиэтил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидрохлорид (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-[2-(2-гидроксиэтокси)этил]-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-[2-(2-метоксиэтокси)этил]-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-оксиранилметил-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(2-[1,3]диоксолан-2-илэтил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-{2-[2-(2-гидроксиэтокси)этокси]этил}-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(3-[1,3]диоксолан-2-илпропил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(3-этоксикарбонилпропил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(4-этоксикарбонилбутил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(4-ацетоксибутил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(3-цианопропил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(4-цианобутил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(6-цианогексил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-(4,4,4-трифторбутил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(2-гидрокси-2-фенил-2-тиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(2-фур-2-ил-2-гидрокси-2-фенилацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(2-фур-2-ил-2-гидрокси-2-тиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(9-метил-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-(4-метилпент-3-енил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-гептил-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-оксиранилметил-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-[2-(2-метоксиэтокси)этил]-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(2-[1,3]диоксолан-2-илэтил)-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(4-метилпент-3-енил)-3-(9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(9-метил-9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(9-гидрокси-9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(3-гидроксипропил)-3-(9-гидрокси-9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(10,11-дигидро-5Н-дибензо[а,d]циклогептен-5-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(4-метилпент-3-енил)-3-(10,11-дигидро-5Н-дибензо[а,d]циклогептен-5-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-[(2*)-2-гидрокси-2,3-дифенилпропионилокси]-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-[(2*)-2-гидрокси-2,3-дифенилпропионилокси)]-1-(4-метилпент-3-енил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(2-гидрокси-2-тиен-2-илпент-4-еноилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(4-метилпент-3-енил)-3-(2-гидрокси-2-тиен-2-илпент-4-еноилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(4-метилпент-3-енил)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-[(2R)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-(2-гидроксиэтил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-(3-гидроксипропил)-1 -азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-(4-гидроксибутил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-[2-(2-гидроксиэтокси)этил]-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-(6-гидроксигексил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-(5-гидроксипентил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-[3-(4-гидроксипиперидин-1-ил)пропил]-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-[4-(4-гидроксипиперидин-1-ил)бутил]-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-(9,10-дигидроантрацен-9-карбонилокси)-1-(2-гидроксиэтил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(2-гидроксиэтил)-3-(9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(2-гидроксиэтил)-3-(9-гидрокси-9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(2-гидроксиэтил)-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(2-гидроксиэтил)-3-(9-метил-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана.
(* - конфигурация не определена)
Наибольший инетерес представляют соединения:
гидробромид 1-гептил-(3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид 1-аллил-(3R)-3-(9-метил-9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид 1-аллил-(3R)-3-(9-гидрокси-9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана.
В еще одном варианте осуществления настоящего изобретения предлагаются способы получения соединений формулы (I).
Новые производные четвертичного аммония общей формулы (I) получают, как показано на приведенной ниже схеме, при взаимодействии алкилирующего агента формулы (II) с соединениями общей формулы (III) с использованием двух возможных способов а) или b), подробно описанных в экспериментальной части. Методика b) включает использование твердофазной экстракции, что позволяет одновременно получить нескольких соединений.

В формуле (II) W означает любую пригодную уходящую группу, предпочтительно группу X-, как описано выше для соединений общей формулы (I). Если W означает уходящую группу, отличную от X-, то четвертичную аммонийную соль формулы (I) получают из продукта, полученного по способу (а) или (b) с использованием реакции замещения по стандартной методике замещения аниона W- на требуемый анион X-.
Соединения общей формулы (II), которые не являются коммерческими продуктами, получают по стандартным методикам. Например, некоторые соединения формулы (II), где А означает -O-, -S-, -NR3-, получают по реакции соответствующего спирта, тиола или производного амина или их натриевой или калиевой соли с алкилирующим агентом общей формулы Y-(CH2)m-W, где W имеет значение, определенное выше, более предпочтительно W означает атом галогена, a Y означает атом галогена или сложный эфир сульфоната. В другом варианте соединения общей формулы (II) получают из соответствующих производных спиртов общей формулы (IV) по стандартным методикам.

Соединения формул (I) и (III) содержат один или более асимметрических атомов углерода. В объем настоящего изобретения включены все возможные стереоизомеры, индивидуальные изомеры и смеси изомеров. Диастереомеры соединений разделяют по стандартным методикам, например, хроматографией или кристаллизацией.
Соединения формулы (III) получают тремя различными способами (с), (d) и (е), как показано на приведенной ниже схеме и подробно описано в экспериментальной части.

В соединениях формулы (VI), описанных в способе (с), R10 означает (низш.)алкил.
Следующие соединения формулы (V) описаны в литературе:
4-гидрокси-1-азабицикло[2.2.1]гептан, описанный в заявке WO 93/15080,
4-гидрокси-1-азабицикло[2.2.2]октан, описанный в статье Grob С.А. и др., Helv. Chim. Acta, т.41, сс. 1184-1190 (1958),
(3R)-3-гидрокси-1-азабицикло[2.2.2]октан или (3S)-3-гидрокси-1-азабицикло[2.2.2]октан, описанный в статье Ringdahl R., Acta Pharm Suec., т.16, сс.281-283 (1979) и являющийся коммерческим продуктом фирмы CU Chemie Uetikon GmbH.
Некоторые соединения общей формулы (III), где D означает группу формулы i), R5 и R6 имеют значения, описанные выше, а R7 означает гидроксигруппу, получают также из сложных эфиров глиоксалевой кислоты общей формулы (VII) по реакции с соответствующими металлоорганическими производными, как показано на приведенной ниже схеме и подробно описано в экспериментальной части (способ (f)).

Соединения формулы (VII) получают из сответствующих глиоксиловых кислот с использованием стандартных способов (с), (d) и (е) или как описано в заявках WO 01/04118 и WO 92/04346.
Как показано на приведенной ниже схеме, соединения формулы (III), где R7 означает группу -СН2ОН, получают также из соответствующего соединения формулы (III), где R означает атом Н, по реакции с формальдегидом в основных условиях (см. методику (g), заявки WO 93/06098 и WO 02/053564).

Структуру полученных соединений определяли методами 1Н-ЯМР и МС. Спектры ЯМР регистрировали на приборе Varian 300 МГц, причем величины химических сдвигов указаны в част./млн (δ) по отношению к величине внутреннего стандарта тетраметилсилана. Чистоту соединений определяли методом ЖХВР с использованием обращенно-фазовой хроматографии на приборе фирмы Waters. Соединения анализировали масс-спектрометрией (метод ионизации электроспреем) на приборе фирмы Hewlett Packard.
Величины оптического вращения измеряли на поляриметре PERKIN-ELMER 241 МС.
Приведенные ниже примеры предназначены для иллюстрации и не ограничивают объем изобретения.
Способ (а)
Пример 37
Гидробромид (3R)-1-гептил-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана
250 мг (0,75 ммоля) (3R)-1-азабицикло[2.2.2]окт-3-илового эфира 9-гидрокси-9Н-флуорен-9-карбоновой кислоты (промежуточное соединение I-3) растворяли в 4 мл ацетонитрила и 6 мл CHCl3. В полученный раствор добавляли 0,59 мл (0,67 г, 3,75 ммоля) 1-бромгептана. После перемешивания в атмосфере N2 в течение 72 ч при комнатной температуре растворители упаривали, добавляли эфир и смесь перемешивали. Полученное твердое вещество несколько раз промывали эфиром и отфильтровывали. Выход указанного в заголовке соединения составлял 330 мг (85,5%).
tпл 214,9-216,6°С.
МС: 434 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 0,88 (t, 3 H), 1,12-1,70 (m, 12 H), 1,70-1,93 (m, 2 H), 2,04 (m, 1 H), 2,78 (m, 1 H), 2,96-3,18 (m, 3 H), 3,18-3,48 (m, 3 H), 3,77 (m, 1 H), 5,01 (m, 1 H), 6,84 (s, 1 H, ОН), 7,34 (m, 2 H), 7,45 (m, 2 H), 7,61 (m, 2 H), 7,84 (d, 2 H).
Пример 39
Гидробромид (3R)-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-[2-(2-метоксиэтокси)этил]-1-азонийбицикло[2.2.2]октана
0,5 г (0,0015 моля) (3R)-1-азабицикло[2.2.2]окт-3-илового эфира 9-гидрокси-9Н-флуорен-9-карбоновой кислоты (промежуточное соединение I-3) растворяли в 10 мл ацетонитрила и 15 мл CHCl3. В полученный раствор добавляли 1,02 мл (1,37 г, 0,0075 моля) 1-бром-2-(2-метоксиэтокси)этана и смесь перемешивали при комнатной температуре в течение 96 ч. Затем добавляли еще одну порцию (0,2 мл, 0,27 г, 0,0015 моля) 1-бром-2-(2-метоксиэтокси)этана и смесь перемешивали при комнатной температуре в течение еще 24 ч. Затем растворители упаривали, добавляли эфир и смесь перемешивали, при этом получали твердое вещество, растворитель экстрагировали и добавляли еще одну порцию эфира. Данную процедуру повторяли несколько раз с целью удаления остаточного алкилирующего агента. Затем суспензию отфильтровывали и полученное твердое вещество промывали эфиром и сушили. Выход указанного в заголовке соединения составлял 610 мг (78,2%).
tпл 194°C.
МС: 438 [М-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,44 (m, I H), 1,64 (m, 1 H), 1,85 (m, 2 H), 2,09 (m, 1 H). 2,93 (m, 1 H), 3,18-3,28 (m, 1 H), 3,26 (s, 3 H), 3,30-3,60 (m, 9 H), 3,73 (m, 2 H), 3,88 (m, 1 H), 5,00 (m, 1 H), 6,83 (s, 1 H, ОН), 7,35 (m, 2 H), 7,45 (m, 2 H), 7,61 (m, 2 H), 7,83 (d, 2 H).
Пример 43
Гидробромид (3R)-1-аллил-3-(9-метил-9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана
1,05 г (3 ммоля) (3R)-1-азабицикло[2.2.2]окт-3-илового эфира 9-метил-9Н-ксантен-9-карбоновой кислоты растворяли в 15 мл ТГФ и добавляли 0,544 г (4,5 ммоля) 3-бромпроп-1-ена (аллилбромида). Смесь кипятили с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 15 ч. Затем растворитель концентрировали до 1/4 исходного объема, добавляли эфир и смесь перемешивали в течение 20 мин, при этом получали твердое вещество, растворитель экстрагировали и добавляли еще одну порцию эфира. Данную процедуру повторяли несколько раз с целью удаления остаточного алкилирующего агента. Затем суспензию отфильтровывали и полученное твердое вещество промывали эфиром и сушили. Выход указанного в заголовке вещества составлял 1,04 г (73,8%).
tпл 64,3-67,8°С.
МС: 390 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,35 (m, I H), 1.65 (m, 1 H), 1,73-1,91 (m, 2 H), 1,89 (s, 3 H), 2,11 (m, 1 H), 2,75 (m, 1 H), 3,00 (m, 1 H), 3,15-3,45 (m, 3 H), 3,70-3,90 (m, 3 H), 5,03 (m, 1 H), 5,50-5,65 (m, 2 H), 5,86 (m, 1 H), 7,12-7,19 (m, 4 H), 7,35 (m, 2 H), 7,42 (m, 2 H).
Способ (b)
Пример 29
Трифторацетат (3R)-1-(6-цианогексил)-3-(2-гидрокси-2.2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
60 мг (0,17 ммоля) (3R)-1-азабицикло[2.2.2]окт-3-илового эфира 2-гидрокси-2,2-дитиен-2-илуксусной кислоты растворяли в 0,7 мл ДМСО. В полученный раствор добавляли 161 мг (0,128 мл, 0,85 ммоля) 7-бромгептаннитрила, растворенного в 0,3 мл ДМСО. После перемешивания при комнатной температуре в течение ночи смесь очищали твердофазной экстракцией на картридже, содержащем катионно-обменную смолу фирмы Mega Bond Elut, предварительно промытую буферным раствором 0,1М NaH2PO4, pH 7,5. Реакционную смесь наносили на картридж и промывали 1 раз 2 мл ДМСО и затем 3 раза по 5 мл CH3CN, при этом все исходные материалы содержались в промывных фракциях. Производное аммония элюировали 5 мл 0,03 М раствора ТФУ в смеси CH3CN/CHCl3, 2:1. Полученный раствор нейтрализовали добавлением 300 мг поли(4-винилпиридина), фильтровали и упаривали досуха. Выход указанного в заголовке соединения составлял 19,1 мг (19,6%).
МС: 459 [М-CF3COO]+.
Способ (с)
Производные метилового эфира общей формулы (VI) получали по стандартным методикам этерификации из соответствующих карбоновых кислот или по методикам, описанным в литературе: патент FR 2012964; статьи Larsson L. и др., Acta Pharm. Suec., 11 (3), 304-308 (1974); Nyberg К. и др., Acta Chem. Scand., 24, 1590-1596 (1970); Cohen V.I. и др., J. Pharm. Sciences, 81, 326-329 (1992); заявки WO 01/04118, WO 02/053564 и цитированные в них работы.
Промежуточное соединение I-1
Получение (3R)-1-азабицикло[2.2.2]окт-3-илового эфира 2.2-дитиен-2-илуксусной кислоты
1,67 г (0,007 моля) метилового эфира 2,2-дитиен-2-илуксусной кислоты растворяли в 40 мл толуола. В полученный раствор добавляли 1,04 г (0,0082 моля) (3R)-3-гидрокси-1-азабицикло[2.2.2]октана и 0,14 г (0,0035 моля) HNa (60% дисперсия в минеральном масле). Смесь кипятили с обратным холодильником в течение 10 мин, затем кипятили при непрерывном удалении дистиллята и замене при необходимости на свежий толуол в течение 2 ч. Охлажденную смесь экстрагировали 2н. HCl, водный слой промывали этилацетатом, подщелачивали K2CO3 и экстрагировали CHCl3. Органический слой промывали небольшим количеством воды, сушили над Na2SO4 и упаривали. Полученное вещество в виде масла (2 г) очищали хроматографией на силикагеле (элюент CHCl3/МеОН/NH4OH, 95:5:0,5). Соответствующие фракции объединяли и упаривали, при этом получали указанный в заголовке продукт в виде масла (0,82 г, 35%).
Указанный продукт получали в виде фумарата. Порцию полученного масла 0,43 г (0,00128 моля, в виде свободного основания) обрабатывали фумаровой кислотой в смеси ацетон/диэтиловый эфир, при этом получали твердое вещество, которое отфильтровывали и промывали эфиром. Выход фумарата составлял 0,44 г.
Фумарат (3R)-1-азабицикло[2.2.2]окт-3-илового эфира 2,2-дитиен-2-илуксусной кислоты
tпл 122°С.
МС: 334 [М свободного основания + 1]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,44 (m, 1 H), 1,64 (m, 3 H), 2,03 (m, 1 H), 2,62-2,98 (m, 5 H), 3,30 (m, 1 H), 4,89 (m, 1 H), 5,84 (s, 1 H), 6,54 (s, 2 H), 7,01 (m, 2 H), 7,09 (m, 2 H), 7,48 (m, 2 H).
Метиловый эфир 2,2-дитиен-2-илуксусной кислоты получали восстановлением метилового эфира 2-гидрокси-2,2-дитиен-2-илуксусной кислоты с последующей обработкой по методике, описанной в статье F. Leonard, I. Ehranthal, J. Am. Chem. Soc, т.73, сс.2216-2218 (1951).
Промежуточное соединение I-2
Получение (3R)-1-азабицикло[2.2.2]окт-3-илового эфира 2,2-дитиен-2-илпропионовой кислоты
0,86 г (0,0034 моля) метилового эфира 2,2-дитиен-2-илпропионовой кислоты растворяли в 25 мл толуола. В полученный раствор добавляли 0,51 г (0,004 моля) (3R)-3-гидрокси-1-азабицикло[2.2.2]октана и 0,055 г (0,0014 моля) HNa (60% дисперсия в минеральном масле). Полученную смесь кипятили с обратным холодильником в течение 10 мин, а затем кипятили при непрерывном удалении дистиллята при необходимости с заменой на свежий толуол в течение 1,5 ч. Охлажденную смесь экстрагировали 2н. HCl, водный слой промывали этилацетатом, подщелачивали К2СО3 и экстрагировали CHCl3. Органический слой промывали небольшим объемом воды, сушили над Na2SO4 и упаривали. Выход указанного в заголовке продукта в виде масла составил 1,11 г (94,07%).
ГХ-МС: 347 [M]+
Указанный продукт получали в виде оксалата. 0,25 г свободного основания (0,00072 моля) обрабатывали щавелевой кислотой (0,065 г, 0,00072 моля) в смеси ацетон/диэтиловый эфир. При этом получали твердое вещество, которое отфильтровывали и промывали эфиром. Выход составлял 0,25 г (79,4%).
Оксалат (3R)-1-азабицикло[2.2.2]окт-3-илового эфира 2,2-дитиен-2-илпропионовой кислоты
tпл 126.7-128,6°С.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част/млн: 1,61 (m, 2 Н), 1,83 (m, 2 H), 2,08 (s, 3 H), 2,19 (m, 1 H), 2,88 (m, 1 H), 2,95-3,28 (m, 4 H), 3,61 (m, 1 H), 5,09 (m, 1 H), 7,01 (m, 2 H), 7,07 (m, 2 H), 7,51 (m, 2 H), 9,15 (ушир. s., 2 H).
Метиловый эфир 2,2-дитиен-2-илпропионовой кислоты получали по стандартной методике этерификации из 2,2-дитиен-2-илпропионовой кислоты, полученной, как описано в статье M.Sy и др., Bull. Soc. Chim. Fr., т.7, сс.2609-2611(1957).
Промежуточное соединение I-3
Получение (3R)-1-азабицикло[2.2.2]окт-3-илового эфира 9-гидрокси-9Н-флуорен-9-карбоновой кислоты
1,0 г (0,0042 моля) метилового эфира 9-гидрокси-9Н-флуорен-9-карбоновой кислоты растворяли в 25 мл толуола. В полученный раствор добавляли 0,67 г (0,0053 моля) (3R)-3-гидрокси-1-азабицикло[2.2.2]октана и 0,064 г (0,0016 моля) HNa (60% дисперсия в минеральном масле). Полученную смесь кипятили с обратным холодильником в течение 15 мин, а затем кипятили при непрерывном удалении дистиллята с заменой при необходимости на свежий толуол в течение 1,5 ч. Охлажденную смесь экстрагировали 2н. HCl, водный слой промывали диэтиловым эфиром, подщелачивали K2CO3 и экстрагировали CHCl3. Органический слой промывали водой, сушили над Na2SO4 и упаривали.
Полученное твердое вещество обрабатывали диэтиловым эфиром и фильтровали. Полученный продукт перекристаллизовывали из смеси CHCl3/диизопропиловый эфир, фильтровали и промывали диизопропиловым эфиром. Выход указанного в заголовке продукта составлял 0,75 г (53,2%).
tпл 217°С.
МС: 336 [М+1]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,00 (m, 2 Н), 1,25-1,50 (m, 2 H). 1,60 (m, 1 H), 2,0-2,16 (m, 2 H), 2,37-2,56 (m, 3 H), 2,91 (m, 1 H), 4,57 (m, 1 H), 6.74 (ушир. s, 1 Н, ОН), 7,31 (m, 2 H), 7,42 (m, 2 H), 7,51 (m, 2 H), 7,81 (m, 2 H).
Метиловый эфир 9-гидрокси-9Н-флуорен-9-карбоновой кислоты получали из 9-гидрокси-9Н-флуорен-9-карбоновой кислоты (коммерческий продукт) по стандартной методике этерификации.
Приведенные ниже соединения формулы (III) также получали по способу (с):
(3R)-1-азабицикло[2.2.2]окт-3-иловый эфир 2-гидрокси-2,2-дитиен-2-илуксусной кислоты,
(3R)-1-азабицикло[2.2.2]окт-3-иловый эфир 2-фур-2-ил-2-гидрокси-2-фенилуксусной кислоты,
(3R)-1-азабицикло[2.2.2]окт-3-иловый эфир 2-фур-2-ил-2-гидрокси-2-тиен-2-илуксусной кислоты,
(3R)-1-азабицикло[2.2.2]окт-3-иловый эфир 9-метил-9Н-флуорен-9-карбоновой кислоты,
(3R)-1-азабицикло[2.2.2]окт-3-иловый эфир 9-метил-9Н-ксантен-9-карбоновой кислоты,
(3R)-1-азабицикло[2.2.2]окт-3-иловый эфир 9-гидрокси-9Н-ксантен-9-карбоновой кислоты,
(3R)-1-азабицикло[2.2.2]окт-3-иловый эфир 2-гидрокси-2-тиен-2-илпент-4-еновой кислоты,
(3R)-1-азабицикло[2.2.2]окт-3-иловый эфир (2S)-2-циклопентил-2-гидрокси-2-тиен-2-илуксусной кислоты и
(3R)-1-азабицикло[2.2.2]окт-3-иловый эфир (2R)-2-циклопентил-2-гидрокси-2-тиен-2-илуксусной кислоты,
(2 последних соединения получали также по способу (f)).
Способ (d)
Промежуточное соединение I-4
Получение (3R)-1-азабицикло[2.2.2]окт-3-илового эфира 10.11-дигидро-5Н-дибензо[а,d]циклогептен-5-карбоновой кислоты
2,15 г 10,11-дигидро-5Н-дибензо[а,d]циклогептен-5-карбоновой кислоты (9,0 ммоля) растворяли в 40 мл СНCl3 (не содержащего этанол). Раствор охлаждали до 0°С и добавляли 0,86 мл оксалилхлорида (9,9 ммоля) и каплю ДМФА. Смесь перемешивали и нагревали до комнатной температуры. После выдерживания смеси при данной температуре в течение 1 ч растворители упаривали, остаток растворяли в CHCl3 и растворители снова упаривали. Данную процедуру повторяли 2 раза. Полученное масло растворяли в 20 мл толуола и добавляли в раствор 1,26 г (9,9 ммоля) (3R)-3-гидрокси-1-азабицикло[2.2.2]октана в 40 мл горячего толуола. Реакционную смесь кипятили с обратным холодильником в течение 2 ч. После охлаждения смесь экстрагировали 2н. HCl. Водный слой подщелачивали K2CO3 и экстрагировали CHCl3. Органический слой сушили над Na2SO4 и упаривали досуха. Остаток очищали хроматографией на колонке (силикагель, элюент: CHCl3/MeOH/NH4OH, 95:5:0,5). Выход указанного в заголовке продукта составлял 1,5 г (48%).
tпл 112-113°С.
ГХ-МС: 347 [М]+
1Н-ЯМР (300 МГц, CDCl3) δ част./млн: 1,10-1,35 (m, 2 Н), 1,40-1,52 (m, 1 H), 1,52-1,68 (m, 1 H), 1,90 (m, 1 H), 2,40-2,60 (m, 2 H), 2,60-2,77 (m, 3 H), 2,83-2,96 (m, 2 H), 3,07-3,19 (m, 1 H), 3,25-3,40 (m, 2 H), 4,80 (m, 2 H), 7,10-7,30 (m, 8 H).
10,11-Дигидро-5Н-дибензо[а,d]циклогептен-5-карбоновую кислоту получали, как описано в статье Kumazawa Т. и др., J. Med. Chem., т.37, сс.804-810(1994).
Приведенное ниже соединение формулы (III) также получали по способу (d) из соответствующей карбоновой кислоты:
(3R)-1-азабицикло[2.2.2]окт-3-иловый эфир 9Н-ксантен-9-карбоновой кислоты
Способ (е)
Промежуточное соединение I-5
Получение 1-азабицикло[2.2.2]окт-4-илового эфира (2R)-2-циклогексил-2-гидрокси-2-фенилуксусной кислоты
660 мг (0,00282 моля) (2R)-2-циклогексил-2-гидрокси-2-фенилуксусной кислоты (полученной, как описано в заявке WO 02/053564) растворяли в 9 мл ДМФА. Раствор перемешивали при комнатной температуре и в него добавляли 548 мг (0,00338 моля) 1,1'-карбонилдиимидазола. Ход реакции контролировали ТСХ (элюент: CHCl3/МеОН/АсОН, 70:30:2) по образованию имидазолида. Через 1 ч реакция завершена. Реакционную смесь охлаждали до 0°С и в нее добавляли 394 мг (0,0031 моля) 4-гидрокси-1-азабицикло[2.2.2]октана и 104 мг (0,00259 моля) HNa (60% дисперсия в минеральном масле). После перемешивания в течение 44 ч при комнатной температуре реакционную смесь обрабатывали водой и 3 раза экстрагировали диэтиловым эфиром. Органические слои объединяли, промывали солевым раствором и сушили над безводным сульфатом магния. Растворитель упаривали и остаток очищали хроматографией на силикагеле (элюент: от CHCl3 до CHCl3/МеОН, 15:1). Выход указанного в заголовке продукта составлял 300 мг (31%).
[α]22 D=-27,6° (с 1, CHCl3)
МС: 344 [М+1]+
1Н-ЯМР (300 МГц, CDCl3) δ част./млн: 1,0-1.55 (m, 7H), 1,55-1,75 (m, 2H), 1,75-1,85 (m, 1H), 1,85-2,05 (m, 6H), 2,10-2,22 (m, 1H), 2.90-3,10 (m, 6H), 3,60-3,80 (ушир.з, 1H, ОН), 7,20-7,40 (m, 3H), 7,57-7,67 (m, 2H).
Способ (f)
Промежуточное соединение I-6
Получение (3R)-1-азабицикло[2.2.2]окт-3-илового эфира 2-гидрокси-2.3-дифенилпропионовой кислоты
0,00386 моля хлорида бензилмагния (1,93 мл 2М раствора в ТГФ) добавляли в раствор 1 г (0,00385 моля) (3R)-1-азабицикло[2.2.2]окт-3-илового эфира 2-оксо-2-фенилуксусной кислоты, растворенного в 8 мл ТГФ при -70°С в атмосфере N2. Смесь перемешивали при указанной температуре в течение 10 мин, затем нагревали до комнатной температуры и разбавляли 4 мл ТГФ. Через 1 ч реакционную смесь обрабатывали 10% раствором K2CO3 и 2 раза экстрагировали этилацетатом. Органические фазы объединяли и сушили над Na2SO4. После удаления растворителя полученное маслообразное вещество распределяли между 2н. HCl и диэтиловым эфиром. Водную фазу подщелачивали K2CO3 и экстрагировали CHCl3. Органический раствор промывали водой, сушили над Na2SO4 и растворитель упаривали, при этом получали 1,2 г вещества в виде масла.
Указанную реакцию повторяли с использованием в качестве исходных веществ 2 г (0,0077 моля) (3R)-1-азабицикло[2.2.2]окт-3-илового эфира 2-оксо-2-фенилуксусной кислоты и 0,0077 моля хлорида бензилмагния (3,85 мл 2М раствора в ТГФ), при этом получали 2,91 г конечного продукта в виде масла.
Общее количество продукта (4,11 г) очищали хроматографией на колонке (силикагель, элюент: градиент CHCl3/МеОН/NH4OH, от 99:1:0,1 до 95:5:0,5). Соответствующие фракции объединяли, при этом получали 1,86 г чистого продукта в виде твердой смеси диастереомеров I-6а и I-6b, которую разделяли мацерацией с использованием смеси диэтиловый эфир/диизопропиловый эфир.
Промежуточное соединение I-6а
Получение (3R)-1-азабицикло[2.2.2]окт-3-илового эфира (2*)-2-гидрокси-2.3-дифенилпропионовой кислоты (диастереомер 1, первый полученный диастереомер)
1,86 г смеси диастереомеров (I-6) обрабатывали смесью диэтиловый эфир/диизопропиловый эфир и фильтровали, при этом получали твердое вещество, охарактеризованное как чистый диастереомер.
Выход составлял 0,87 г (42,6% в расчете на индивидуальный изомер).
tпл 132°C.
МС: 352 [M+1]+.
1Н-ЯМР (300 МГц, CDCl3) δ част./млн: 1,30-1,60 (m, 2 H), 1,60-1,90 (m, 2 H), 2,05 (m, 1 H), 2,20-2,35 (m, 1 H), 2,50-2,90 (m, 4 H), 3,0-3,15 (m, 1 H), 3,25 и 3,60 (dd, 2 H), 3,70 (ушир.s, 1 H, ОН), 4,70-4,80 (m, 1 H), 7,15-7,45 (m, 8 H), 7,65-7,75 (m, 2 H).
Промежуточное соединение I-6b
Получение (3R)-1-азабицикло[2.2.2]окт-3-илового эфира (2*)-2-гидрокси-2.3-дифенилпропионовой кислоты (диастереомер 2, второй полученный диастереомер)
Маточные растворы после фильтрования первого диастереомера использовали для получения второго диастереомера. После упаривания растворителей 0,55 г остатка обрабатывали диэтиловым эфиром и фильтровали, при этом получали твердое вещество, охарактеризованное как чистый второй диастереомер. Выход составлял 0,23 г (11,2% в расчете на индивидуальный изомер).
tпл 107°С.
МС: 352 [М+1]+.
1Н-ЯМР (300 МГц, CDCl3) δ част./млн: 1,20-1,35 (m, 1 H), 1,35-1,55 (m, 2 H), 1,55-1,70 (m, 1 H), 1,80-1,95 (m, 1 H), 2,55-2,90 (m, 5 H), 3,10-3,20 (m. 1 H), 3,25 и 3,60 (dd, 2 H), 3,80 (ушир.s, 1 H, ОН), 4,65-4,80 (m, 1 H), 7,20-7,50 (m, 8 H), 7,65-7,75 (m, 2 H).
(*) - конфигурация не определена, в этом случае можно получить (2R)- или (2S)-изомеры описанных выше соединений.
(3R)-1-Азабицикло[2.2.2]окт-3-иловый эфир 2-оксо-2-фенилуксусной кислоты получали, как описано в заявке WO 92/04346.
Приведенные ниже соединения формулы (III) также получали по способу (f):
(3R)-1-азабицикло[2.2.2]окт-3-иловый эфир (2S)-2-циклопентил-2-гидрокси-2-тиен-2-илуксусной кислоты, (3R)-1-азабицикло[2.2.2]окт-3-иловый эфир (2R)-2-циклопентил-2-гидрокси-2-тиен-2-илуксусной кислоты (соединения получали также по способу (с)) и (3R)-1-азабицикло[2.2.2]окт-3-иловый эфир 2-гидрокси-2-фенил-2-тиен-2-илуксуной кислоты.
Другие карбоновые кислоты формулы D-C(O)OH, получение которых (или синтез их метиловых эфиров, гидрохлорида или имидазолида) не описано в способах (с), (d), (e) и которые не являются коммерческими продуктами, можно получить по методикам, описанным в следующих работах:
FR 2012964,
М.А.Davis и др., J. Med. Chem., т.6, сс.513-516 (1963),
Т.Kumazawa и др., J. Med. Chem, т.37(6), сс 804-810 (1994),
M.A.Davis и др., J. Med. Chem., т.7, сс.88-94 (1964),
Sestanj К., Can. J. Chem., т.49, сс.664-665 (1971),
Burtner R., J. Am. Chem. Soc., т.65, сс.1582-1585 (1943),
Heacock R.A. и др., Ann. Appl. Biol, т.46(3), сс.352-365 (1958),
Rigaudy J. и др., Bull. Soc. Chim. France, cc.638-643 (1959),
Ueda I. и др., Bull. Chem. Soc. Jpn, т.48 (8), cc.2306-2309 (1975),
E.L.May и др., J. Am. Chem. Soc., т.70, cc.1077-1079 (1948),
G.W.Moersch и др., Synthesis, cc.647-648 (1971),
A.Waldemar и др., J. Org. Chem., т.42 (1), cc.38-40 (1977).
WO 01/04118 и WO 02/053564.
В объем настоящего изобретения включены также фармацевтические композиции, которые в качестве активного ингредиента включают по крайней мере одно производное хинуклидина общей формулы (I) в комбинации с фармацевтически приемлемым носителем или разбавителем. Предпочтительную композицию получают в форме, предназначенной для перорального введения.
Для получения композиции по настоящему изобретению используют известные фармацевтически приемлемые носители или разбавители, смешанные с активным соединением или соединениями, причем выбор конкретных эксципиентов зависит, помимо других факторов, от способа введения композиции.
Композиции по настоящему изобретению предпочтительно получают в форме для перорального введения. В данном случае композиции для перорального введения получают в виде таблеток, таблеток с пленочным покрытием, жидких препаратов для ингаляции, порошкообразных препаратов для ингаляции и аэрозолей для ингаляции, причем все указанные препараты содержат одно или более соединений по настоящему изобретению. Указанные препараты получают известными способами.
Разбавители, используемые при получении композиций, включают такие жидкие или твердые разбавители, которые являются совместимыми с активным ингредиентом, а также при необходимости с красителями или ароматизаторами. Таблетки или таблетки с пленочным покрытием содержат от 1 до 500 мг, предпочтительно от 5 до 300 мг активного игредиента. Композиции для ингаляции содержат от 1 мкг до 1000 мкг, предпочтительно от 10 мкг до 800 мкг активного ингредиента. При лечении человека доза соединения общей формулы (I) зависит от требуемого эффекта и продолжительности лечения, дозы для взрослых в большинстве случаев составляют от 3 мг до 300 мг в сут в виде таблеток и от 10 мкг до 800 мкг в сут в виде композиции для ингаляции.
Фармакологические свойства
Оценку связывания мускариновых рецепторов человека с соединениями по изобретению и испытания на модели бронхоспазмов у морских свинок проводили, как описано ниже.
Связывание соединений с мускариновыми рецепторами человека
Связывание [3H]-NMS с мускариновыми рецепторами человека проводили по методике, описанной в статье Waelbroek и др., Mol. Pharmacol., т 38, сс. 267-273 (1990). Анализ проводили при 25°С и использовали мембранную фракцию стабильно трансфектированных клеток яичников китайского хомяка K1 (CHO), экспрессирующих гены мускариновых рецепторов человека М3.
Для определения величин IC50 мембранную фракцию суспендировали в буферном растворе DPBS до конечной концентрации 89 мкг/мл для рецепторов подтипа М3. Суспензию мембранной фракции инкубировали в присутствии соединения, меченного тритием, в течение 60 мин. После инкубирования мембранную фракцию отделяли фильтрованием и измеряли связанную радиоактивность. Неспецифическое связывание определяли при добавлении 10-4 М раствора атропина. Для построения кривых замещения использовали по крайней мере 6 различных концентраций в двух повторах.
Результаты испытаний показали, что соединения по настоящему изобретению характеризуются высокой аффинностью к мускариновым рецепторам М3, предпочтительно мускариновым рецепторам человека. Предпочтительные соединения по настоящему изобретению характеризуются величиной IC50 (нМ) в отношении рецепторов М3 менее 50, предпочтительно менее 25, более предпочтительно менее 15 и наиболее предпочтительно менее 10, 8 или 5.
Испытания на модели бронхоспазма у морских свинок
Испытания проводили по методике, описанной в статье Н.Konzett и F.Rössler, Arch. Exp. Path. Pharmacol., т 195, сс. 71-74 (1940). Водные растворы исследуемых агентов распыляли и вводили самцам морских свинок (Dunkin-Hartley) при вдыхании после анестезии с искусственной вентиляции легких. Ответную реакцию бронхов на внутривенное введение ударной дозы ацетилхолина определяли перед введением лекарственного средства и после него по изменению сопротивления легких через определенные периоды времени, а ингибирование бронхоспазма в процентах определяли с использованием указанного изменения сопротивления.
Соединения по настоящему изобретению проявляют высокую и долгосрочную эффективность при ингибировании ответной реакции бронхоспазма на ацетилхолин.
На основании описанных выше данных специалистам в данной области представляется очевидным, что соединения по настоящему изобретению характеризуются высокой антимускариновой активностью (М3) и, следовательно, их можно применять при лечении заболеваний, связанных с мукариновым рецептором М3, включая респираторные заболевания, такие как хроническое обструктивное заболевание легких (COPD), бронхит, повышенная реактивность бронхов, астма, кашель и ринит; урологические заболевания, такие как недержание мочи, поллакиурия, синдром нейрогенного или нестабильного мочевого пузыря, цистоспазм и хронический цистит; заболевания желудочно-кишечного тракта, такие как синдром раздраженной кишки, спастический колит, дивертикулит и пептическая язва, а также сердечно-сосудистые заболевания, такие как синусовая брадикардия, индуцированная блуждающим нервом.
В настоящем изобретении предлагается также соединение формулы (I) или фармацевтически приемлемая композиция, включающая соединение формулы (I), для применения при лечении человека или животных, прежде всего для лечения респираторных, урологических заболеваний или заболеваний желудочно-кишечного тракта.
В настоящем изобретении предлагается также применение соединения формулы (I) или фармацевтически приемлемой композиции, включающей соединение формулы (I), для получения лекарственных средств, предназначенных для лечения респираторных, урологических заболеваний или заболеваний желудочно-кишечного тракта.
В другом варианте соединения формулы (I) и фармацевтически приемлемые композиции, включающие соединения формулы (I), используются для лечения респираторных, урологических заболеваний или заболеваний желудочно-кишечного тракта, причем указанный способ лечения включает введение человеку или животному, нуждающемуся в таком лечении, эффективного нетоксичного количества соединения формулы (I) или фармацевтической композиции, включающей соединение формулы (I).
В еще одном варианте соединения формулы (I) и фармацевтически приемлемые композиции, включающие соединения формулы (I), используются в комбинации с другими лекарственными средствами, эффективными при лечении указанных заболеваний. Соединения формулы I используют, например, в комбинации с агонистами β2, стероидами, противоаллергическими лекарственными средствами, ингибиторами фосфодиэстеразы IV и/или лейкотриена D4 (LTD4), для одновременного, отдельного или последовательного введения при лечении респираторного заболевания.
Примеры соединений формулы I
Пример 1
Гидробромид (3R)-1-аллил-3-(2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а из промежуточного соединения I-1. Выход на конечной стадии составлял 310 мг, 90,9%.
МС: 374 [М-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,72-2,07 (m, 4 H), 2,28 (m, 1 H), 3,07-3,56 (m, 5 H), 3,78-3,99 (m, 3 H), 5,19 (m, 1 H), 5,52-5,68 (m, 2 H), 5,89 (s, 1 H), 5,98 (m, 1 H), 7,01 (m, 2 H), 7,12 (m, 2 H), 7,50 (m, 2 H).
Пример 2
Гидробромид (3R)-3-(2.2-дитиен-2-илацетокси)-1-(4-метилпент-3-енил)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а из промежуточного соединения I-1. Выход на конечной стадии составлял 270 мг, 72,9%.
tпл 163,5-165,1°С.
MC: 416 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,62 (s, 3 Н), 1,67 (s, 3 H), 1,73-2,03 (m, 4 H), 2,20-2,43 (m, 3 H), 3,05-3,46 (m, 6 Н), 3,52 (m, 1 H), 3,92 (m, 1 H), 4,98 (m, 1 H), 5,18 (m, 1 H), 5,89 (s, 1 H), 7,01 (m, 2 H), 7,13 (m, 2 H), 7,50 (m, 2 H).
Пример 3
Гидробромид (3R)-1-аллил-3-(2.2-дитиен-2-илпропионилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а из промежуточного соединения I-2. Выход на конечной стадии составлял 260 мг, 77,2%.
tпл 156-158°С.
МС: 388 [М-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,65 (m, 1 H), 1,80 (m, 1 H), 1,95 (m, 2 H), 2,08 (s, 3 H), 2,28 (m, 1 H), 3,06 (m, 1 H), 3,25-3,52 (m, 4 H), 3,82-4,05 (m, 3 H), 5,20 (m, 1 H), 5,53-5,67 (m, 2 H), 5,97 (m, 1 H), 7,01 (m, 2 H), 7,10 (m, 2 H), 7,51 (m, 2H).
Пример 4
Гидробромид (3R)-1-(4-метилпент-3-енил)-3-(2.2-дитиен-2-илпропионилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а из промежуточного соединения I-2. Выход на конечной стадии составлял 380 мг, 100%.
tпл 130-131°C.
МС: 430 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,57-1,82 (m, 2 Н), 1,62 (s, 3 H), 1,67 (s, 3 H), 1,91 (m, 2 H), 2,07 (s, 3 H), 2,22-2,42 (m, 3 H), 3,10 (m, 1 H), 3,17 (m, 2 H), 3,25-3,42 (m, 3 H), 3,48 (m, 1 H), 3,92 (m, 1 H), 4,98 (m, 1 H), 5,19 (m, 1 H), 7,02 (m, 2 H), 7,09 (m, 2 H), 7,50 (m, 2 H).
Пример 5
Трифторацетат (3R)-3-(2-гидрокси-2.2-дитиен-2-илацетокси)-1-изопропил-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам c и b. Выход на конечной стадии составлял 21,6 мг, 25,2%.
МС: 392 [M-CF3COO]+.
Пример 6
Трифторацетат (3R)-1-циклопропилметил-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам c и b. Выход на конечной стадии составлял 5,5 мг, 6,2%.
МС: 404 [M-CF3COO]+.
Пример 7
Трифторацетат (3R)-3-(2-гидрокси-2.2-дитиен-2-илацетокси)-1-изобутил-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам c и b. Выход на конечной стадии составлял 25,0 мг, 28,3%.
МС: 406 [М-CF3COO]+.
Пример 8
Гидробромид (3R)-1-гептил-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а. Выход на конечной стадии составлял 490 мг, 66,6%.
tпл 134°C
МС: 448 [М-Br]+.
1Н-ЯМР (300 МГц, CDCl3) δ част./млн: 0,86 (t, 3 Н), 1,16-1,32 (m, 8 H). 1,60 (m, 2 H), 1,91 (m, 2 H), 2,05 (m, 2 H), 2,42 (m, 1 H), 3,32-3,48 (m, 2 H), 3,48-3,80 (m, 5 H), 4,24 (m, 1 H), 5,28 (m, 1 H), 5,98 (s, 1 Н, ОН), 6,95 (m, 2 H), 7,17 (m, 1 H), 7,22-7,28 (m, 3 H).
Пример 9
Трифторацетат (3R)-1-циклогексилметил-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам c и b. Выход на конечной стадии составлял 23,4 мг, 24,6%.
МС: 446 [М-CF3COO]+.
Пример 10
Трифторацетат (3R)-1-(3-циклогексилпропил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло [2.2.2]октана
Указанное в заголовке соединение получали по способам с и b. Выход на конечной стадии составлял 12,6 мг, 12,6%.
МС: 474 [M-CF3COO]+.
Пример 11
Гидробромид (3R)-1-аллил-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а. Выход на конечной стадии составлял 400 мг, 70,0%.
tпл 176°C.
МС: 390 [М-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,77 (m, 2 Н), 1,92 (m, 2 H), 2,31 (m, 1 H), 3,15 (m, 1 H), 3,20-3,52 (m, 4 H), 3,81-4,01 (m, 3 H), 5,24 (m, 1 H), 5,53-5,68 (m, 2 H), 5,96 (m, 1 H), 7,02 (m, 2 H), 7,16 (m, 2 H), 7,48 (s, 1 Н, ОН), 7,53 (m, 2H).
Пример 12
Гидробромид (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-(4-метилпент-3-енил)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а. Выход на конечной стадии составлял 260 мг, 36,0%.
tпл 199°C.
МС: 432 [M-Br]+.
1Н-ЯМР (300 МГц, CDCl3) δ част./млн: 1,58 (s, 3 H), 1,64 (m, 3 H), 1,87 (m, 2 H), 2,03 (m, 2 H), 2,26-2,47 (m, 3 H), 3,22-3,45 (m, 2 H), 3,45-3,82 (m, 5 H), 4,23 (m, 1 H), 4,92 (m, 1 H), 5,27 (m, 1 H), 6,07 (s, 1 Н, ОН), 6,93 (m, 2 H), 7,15 (m, 1 H), 7,24 (m, 3 H).
Пример 13
Трифторацетат (3R)-1-(3,7-диметилокта-(Е)-2,6-диенил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и b. Выход на конечной стадии составлял 14,5 мг, 14,2%.
МС: 486 [M-CF3COO]+.
Пример 14
Трифторацетат (3R)-3-(2-гидрокси-2.2-дитиен-2-илацетокси)-1-(2-гидроксиэтил)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам c и b. Выход на конечной стадии составлял 16,6 мг, 19,3%.
МС: 394 [M-CF3COO]+.
Пример 15
Трифторацетат (3R)-3-(2-гидрокси-2.2-дитиен-2-илацетокси)-1-(3-гидроксипропил)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам c и b. Выход на конечной стадии составлял 16,0 мг, 18,0%.
МС: 408 [M-CF3COO]+.
Пример 16
Трифторацетат (3R)-1-(4-гидроксибутил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам c и b. Выход на конечной стадии составлял 6,5 мг, 7,1%.
МС: 422 [M-CF3COO]+.
Пример 17
Гидробромид (3R)-1-(2-этоксиэтил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а. Выход на конечной стадии составлял 220 мг, 31,0%.
tпл 155°С.
МС: 422 [М-Br]+.
1H-ЯМР (300 МГц, CDCl3) δ част./млн: 1,15 (t, 3 H), 1,88 (m, 2 H), 2,03 (m, 2 H), 2,46 (m, 1 H), 3,49 (q, 2 H), 3,54-3,96 (m, 8 H), 4,06 (m, 1 H), 4,31 (m, 1 H), 5,27 (m, 1 H), 5,73 (s, 1 H, ОН), 6,97 (m, 2 H), 7,20 (m, 1 H), 7,22-7,33 (m, 3 H).
Пример 18
Гидрохлорид (3R)-3-(2-гидрокси-2.2-дитиен-2-илацетокси)-1-[2-(2-гидроксиэтокси)этил]-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а. Выход на конечной стадии составлял 580 мг, 14,0%.
tпл 156°С.
МС: 438 [M-Cl]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,72 (m, 2 Н), 1,92 (m, 2 H), 2,27 (m, 1 H), 3,10-3,70 (m, 11 H), 3,79 (m, 2 H), 3,96 (m, 1 H), 4,72 (m, 1 H), 5,21 (m, 1 H), 6,97 (m, 2 H), 7,15 (m, 2 H), 7,51 (m, 3 H).
Пример 19
Гидробромид (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-[2-(2-метоксиэтокси)этил]-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а. Выход на конечной стадии составлял 260 мг, 35,0%.
МС: 452 [M-Br]+.
1Н-ЯМР (300 МГц, CDCl3) δ част./млн: 1,87 (m, 2 H), 2,04 (m, 2 H), 2,44 (m, 1 H), 3,32 (s, 3 H), 3,48 (m, 2 H), 3,54-3,96 (m, 10 H), 3,98-4,08 (m, 1 H), 4,30 (m, 1 H), 5,26 (m, 1 H), 6,0 (ушир.s, 1 H, ОН), 6,97 (m, 2 H), 7,20 (m, 1 H), 7,23-7,32 (m, 3Н).
Пример 20
Гидробромид (3R)-3-(2-гидрокси-2.2-дитиен-2-илацетокси)-1-оксиранилметил-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а. Выход на конечной стадии составлял 240 мг, 35,0%.
МС: 406 [M-Br]+.
Пример 21
Трифторацетат (3R)-1-(2-[1,3]-диоксолан-2-илэтил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и b. Выход на конечной стадии составлял 15,7 мг, 16,4%.
МС: 450 [M-CF3COO]+.
Пример 22
Трифторацетат (3R)-3-(2-гидрокси-2.2-дитиен-2-илацетокси)-1-{2-[2-(2-гидроксиэтокси)этокси]этил}-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и b. Выход на конечной стадии составлял 7,9 мг, 7,8%.
МС: 482 [M-CF3COO]+.
Пример 23
Трифторацетат (3R)-1-(3-[1,3]-диоксолан-2-илпропил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам c и b. Выход на конечной стадии составлял 17,1 мг, 17,4%.
МС: 464 [M-CF3COO]+.
Пример 24
Трифторацетат (3R)-1-(3-этоксикарбонилпропил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и b. Выход на конечной стадии составлял 15,1 мг, 15,4%.
МС: 464 [M-CF3COO]+.
Пример 25
Трифторацетат (3R)-1-(4-этоксикарбонилбутил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и b. Выход на конечной стадии составлял 15,0 мг, 14,9%.
МС: 478 [M-CF3COO]+.
Пример 26
Трифторацетат (3R)-1-(4-ацетоксибутил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и b. Выход на конечной стадии составлял 10,7 мг, 10,9%.
МС: 464 [M-CF3COO]+.
Пример 27
Трифторацетат (3R)-1-(3-цианопропил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и b. Выход на конечной стадии составлял 14,0 мг, 15,5%.
MC: 417 [M-CF3COO]+.
Пример 28
Трифторацетат (3R)-1-(4-цианобутил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и b. Выход на конечной стадии составлял 16,2 мг, 17,5%.
МС: 431 [M-CF3COO]+.
Пример 29
Трифторацетат (3R)-1-(6-цианогексил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и b. Выход на конечной стадии составлял 19,1 мг, 19,6%.
МС: 459 [M-CF3COO]+.
Пример 30
Трифторацетат (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-(4,4,4-трифторбутил)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и b. Выход на конечной стадии составлял 18,4 мг, 18,8%.
МС: 460 [M-CF3COO]+.
Пример 31
Гидробромид (3R)-1-аллил-3-(2-гидрокси-2-фенил-2-тиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали в виде смеси диастереомеров по способам f и a. Выход на конечной стадии составлял 350 мг, 50,0%.
tпл 170°C.
МС: 384 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: (смесь диастереомеров) 1,46-1,79 (m, 2 Н), 1,81-2,02 (m, 2 H), 2,28 (m, 1 H), 3,07 (m, 1 H), 3,17-3,46 (m, 4 H), 3,80-4,0 (m, 3 H), 5,23 (m, 1 H), 5,53-5,67 (m, 2 H), 5,96 (m, 1 H), 7,03 (m, 1 H), 7,12 (m, 1 H), 7,20 (s, 1 Н, ОН), 7,29-7,42 (m, 3 H), 7,42-7,49 (m, 2 H), 7,53 (m, 1 H).
Пример 32
Гидробромид (3R)-1-аллил-3-(2-фур-2-ил-2-гидрокси-2-фенилацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали в виде смеси диастереомеров по способам с и а. Выход на конечной стадии составлял 120 мг, 88,8%.
МС: 368 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: (смесь диастереомеров) 1,45-1,80 (m, 2 Н), 1,80-2,03 (m, 2 H), 2,26 (m, 1 H), 2,95-3,24 (m, 2 H), 3.24-3,47 (m, 3 H), 3,75-3,98 (m, 3 H), 5,20 (m, 1 H), 5.52-5,67 (m, 2 H), 5,96 (m, 1 H), 6,28 (dd, 1 H), 6,46 (m, 1 H), 6,95 (d, 1 H, ОН), 7,31-7,45 (m, 3 H), 7,48 (m, 2 H), 7,68 (m, 1 H).
Пример 33
Гидробромид (3R)-1-аллил-3-(2-фур-2-ил-2-гидрокси-2-тиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали в виде смеси диастереомеров по способам с и а. Выход на конечной стадии составлял 170 мг, 62,9%.
МС: 374 [М-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: (смесь диастереомеров) 1,58-1,83 (m, 2 H), 1,83-2,06 (m, 2 H), 2,28 (m, 1 H), 3,06 (m, 1 H), 3,18 (m, 1 H), 3,25-3,54 (m, 3 H), 3,78-4,02 (m, 3 H), 5,22 (m. 1 H), 5,52-5,68 (m, 2 H), 5,97 (m, 1 H), 6,33 (dd, 1 H), 6,46 (m, 1 H), 7,04 (m, 1 H), 7,15 (m, 1 H), 7,29 (d, 1 H), 7,55 (m, 1 H), 7,69 (m, 1 H).
Пример 34
Гидробромид (3R)-1-аллил-3-(9-метил-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а. Выход на конечной стадии составлял 180 мг, 88,2%.
tпл 75,2-76,8°С.
МС: 374 [М-Br]+.
1Н-ЯМР (300 МГц. ДМСО-d6) δ част./млн: 1,54 (m, 1 H), 1,69 (m, 1 H), 1,76 (s, 3 H), 1,87 (m, 2 H), 2,11 (m, 1 H), 3,00 (m, 1 H), 3,16-3,47 (m, 4 H), 3,79 (m, 1 H), 3,91 (m, 2 H), 4,99 (m, 1 H), 5,52-5,66 (m, 2 H), 5,93 (m, 1 H), 7,30-7,50 (m, 4 H), 7,64 (d, 1 H), 7,72 (d, 1 H), 7,90 (d, 2 H).
Пример 35
Гидробромид (3R)-1-аллил-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а из промежуточного соединения I-3. Выход на конечной стадии составлял 550 мг, 80,3%.
tпл 260°С.
МС: 376 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,40 (m, 1 H), 1,64 (m, 1 H), 1,85 (m, 2 H), 2,08 (m, 1 H), 2,77 (m, 1 H), 3,03 (m, 1 H), 3,17-3.41 (m, 3 H), 3,70-3,94 (m, 3 H), 5,03 (m, 1 H), 5,50-5,68 (m, 2 H), 5,90 (m, 1 H), 6,85 (s, 1 H, ОН), 7,35 (m, 2H), 7,46 (m, 2 H), 7,60 (m, 2 H), 7,83 (d, 2 H).
Пример 36
Гидробромид (3R)-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-(4-метилпент-3-енил)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а из промежуточного соединения I-3. Выход на конечной стадии составлял 490 мг, 65,5%.
tпл 192,4-193,1°С.
МС: 418 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,40 (m, 1 H), 1,55-1,72 (m, 1 H), 1,61 (s, 3 H), 1,66 (s, 3 H), 1,84 (m, 2 H), 2,04 (m, 1 H), 2,26 (m, 2 H), 2,76 (m, 1 H), 2,98-3,16 (m, 3 H), 3,18-3,45 (m, 3 H), 3,79 (m, 1 H), 4,95 (m, 1 H), 5,01 (m, 1 H), 6,82 (s, 1 H, ОН), 7,33 (m, 2 H), 7,44 (m, 2 H), 7,59 (m, 2 H), 7,82 (d, 2 H).
Пример 37
Гидробромид (3R)-1-гептил-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а из промежуточного соединения I-3. Выход на конечной стадии составлял 330 мг, 85,5%.
tпл 214,9-216,6°C.
МС: 434 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 0,88 (t, 3 H), 1,12-1,70 (m, 12 H), 1,70-1,93 (m, 2 H), 2,04 (m, 1 H), 2,78 (m. 1 H), 2,96-3,18 (m, 3 H), 3,18-3,48 (m, 3 H), 3,77 (m, 1 H), 5,01 (m, 1 H), 6,84 (s, 1 H, ОН), 7,34 (m, 2 H), 7,45 (m, 2 H), 7,61 (m, 2H), 7,84 (d. 2 H).
Пример 38
Гидробромид (3R)-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-оксиранилметил-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а из промежуточного соединения I-3. Выход на конечной стадии составлял 270 мг, 38,0%.
МС: 392 [M-Br]+.
Пример 39
Гидробромид (3R)-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-[2-(2-метоксиэтокси)этил]-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а из промежуточного соединения I-3. Выход на конечной стадии составлял 610 мг, 78,2%.
tпл 194°С.
МС: 438 [М-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,44 (m, 1 H), 1,64 (m, 1 H), 1,85 (m, 2 H), 2,09 (m, 1 H), 2,93 (m, 1 H), 3,18-3,28 (m, 1 H), 3,26 (s, 3 H), 3,30-3,60 (m, 9 H), 3.73 (m, 2 H), 3,88 (m, 1 H), 5,00 (m, 1 H), 6,83 (s, 1 H, ОН), 7,35 (m, 2 H), 7,45 (m, 2 H), 7,61 (m, 2 H), 7,83 (d, 2 H).
Пример 40
Гидробромид (3R)-1-(2-[1.3]-диоксолан-2-илэтил)-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а из промежуточного соединения I-3. Выход на конечной стадии составлял 660 мг, 85,7%.
tпл 62°C.
МС: 436 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,43 (m, 1 H), 1,64 (m. 1 H), 1,71-2,15 (m, 5 H), 2,86 (m, 1 H), 3,0-3,64 (m, 8 H), 3,74-3,97 (m, 3 H), 4,89 (m, 1 H), 5,00 (s, 1 H). 7,34 (m, 2 H), 7,45 (m, 2 H), 7,63 (m, 2 H), 7,82 (d, 2 H).
Пример 41
Гидробромид (3R)-1-аллил-3-(9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам d и а. Выход на конечной стадии составлял 170 мг, 51,5%.
tпл 57°C.
МС: 376 [М-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,63-2,00 (m, 4 H), 2,17 (m, 1 H), 3,06-3,56 (m, 5 H), 3,77 (m, 1 H), 3,92 (m, 2 H), 5,03 (m, 1 H), 5,30 (s, 1 H), 5,50-5,70 (m, 2 H), 5,94 (m, 1 H), 7,20 (m, 4 H), 7,38 (m, 2 H), 7,50 (m, 2 H).
Пример 42
Гидробромид (3R)-1-(4-метилпент-3-енил)-3-(9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам d и а. Выход на конечной стадии составлял 270 мг, 72,9%.
tпл 225°C.
МС: 418 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,60-2,0 (m, 4 H), 1,64 (s, 3 H), 1,69 (s, 3 H), 2,16 (m, 1 H), 2,32 (m, 2 H), 3,10-3,46 (m, 6 H), 3,53 (m, 1 H), 3,85 (m, 1 H), 4,93-5,08 (m, 2 H), 5,32 (s, 1 H), 7,19 (m, 4 H), 7,38 (m, 2 H), 7,52 (m, 2 H).
Пример 43
Гидробромид (3R)-1-аллил-3-(9-метил-9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а. Выход на конечной стадии составлял 1,04 г, 73,8%.
tпл 64,3-67,8°С.
МС: 390 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,35 (m, 1 Н), 1,65 (m, 1 H), 1,73-1,91 (m, 2 H), 1,89 (s, 3 H), 2,11 (m, 1 H), 2,75 (m, 1 H), 3,00 (m, 1 H), 3,15-3,45 (m, 3 H), 3,70-3,90 (m, 3 H), 5,03 (m, 1 H), 5,50-5,65 (m, 2 H), 5,86 (m, 1H), 7,12-7,19 (m, 4H), 7,35 (m, 2 H), 7,42 (m, 2 H).
Пример 44
Гидробромид (3R)-1-аллил-3-(9-гидрокси-9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а. Выход на конечной стадии составлял 270 мг, 67,5%.
tпл 232°C.
МС: 392 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,29 (m, 1 H), 1,62 (m, 1 H), 1,70-1,94 (m, 2 H), 2,06 (m, 1 H), 2,62 (m, 1 H), 2,79 (m, 1 H), 3,13-3,42 (m, 3 H), 3,64-3,87 (m, 3 H), 5,02 (m, 1 H), 5,47-5,65 (m, 2 H), 5,81 (m, 1 H), 7,18 (s, 1 H, ОН), 7,25 (m, 4 H), 7,44 (m, 2 H), 7,65 (m, 2 H).
Пример 45
Гидробромид (3R)-1-(3-гидроксипропил)-3-(9-гидрокси-9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а. Выход на конечной стадии составлял 315 мг, 90,5%.
tпл 87,6-89,1°С.
МС: 410 [М-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,28 (m, 1 H), 1,50-1,95 (m, 5 H), 2,05 (m, 1 H), 2,63 (m, 1 H), 2,83 (m, 1 H), 3,10-3,50 (m, 7 H), 3,73 (m, 1 H), 4,76 (t, 1 Н, ОН), 5,0 (m, 1 H), 7,18 (s, 1 H, ОН), 7,18-7,30 (m, 4 H), 7,40-7,50 (m, 2 H), 7,60-7,70 (m, 2 H).
Пример 46
Гидробромид (3R)-1-аллил-3-(10,11-дигидро-5Н-дибензо[а,d]циклогептен-5-карбонилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам d и а из промежуточного соединения I-4. Выход на конечной стадии составлял 260 мг, 95,6%.
tпл 219,5-220,3°C.
МС: 388 [M-Br]+.
1Н-ЯМР (300 МГц, CDCl3) δ част./млн: 1,52 (m, 1 H), 1,71 (m, 1 H), 1,93 (m, 2 H), 2,20 (m, 1 H), 2,79-2,94 (m, 2 H), 3,02 (m, 1 H), 3,11-3,31 (m, 2 H), 3,40-3,52 (m, 1 H), 3,52-3,75 (m, 3 H), 4,06-4,39 (m, 3 H), 5,10 (m, 1 H), 5,21 (s, 1 H), 5,57-5,87 (m, 3 H), 7,16 (m, 6 H), 7,39 (m, 2 H).
Пример 47
Гидробромид (3R)-1-(4-метилпент-3-енил)-3-(10,11-дигидро-5Н-дибензо[а,d]циклогептен-5-карбонилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам d и а из промежуточного соединения I-4. Выход на конечной стадии составлял 290 мг, 97,9%.
tпл 216°C.
МС: 430 [M-Br]+.
1Н-ЯМР (300 МГц, CDCl3) δ част./млн: 1,53 (m, 1 H), 1,62 (s, 3 H), 1,67 (s, 3Н), 1,81 (m, 1 H), 1,98 (m, 2 H), 2,18-2,35 (m, 3 H), 2,75-2,98 (m, 3 H), 3,11-3,46 (m, 5 H), 3,54-3,76 (m, 3 H), 4.20 (m, 1 H), 4,95 (m, 1 H), 5,14 (s, 1 H), 5,10-5,20 (m, 1 H), 7,19 (m, 6 H), 7,36 (m, 2 H).
Пример 48
Гидробромид (3R)-1-аллил-3-[(2*)-2-гидрокси-2.3-дифенилпропионилокси]-1-азонийбицикло[2.2.2]октана (диастереомер 1)
Указанное в заголовке соединение получали по способам f и а из промежуточного соединения I-6а. Выход на конечной стадии составлял 250 мг, 75.7%.
tпл 180°C.
МС: 392 [М-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,72 (m, 2 H), 1,92 (m, 2 H), 2,21 (m, 1 H), 3,02 (m, 1 H), 3,11 (m, 1 H), 3,18-3,52 (m, 5 H), 3,74 (m, 1 H), 3,84 (m, 2 H), 5,04 (m, 1 H), 5,49-5,64 (m, 2 H), 5,90 (m, 1 H), 6,15 (s, 1 H, ОН), 7,14 (m, 5H), 7,23-7,40 (m, 3 H), 7,53 (m, 2 H).
(*) - конфигурация не определена.
Пример 49
Гидробромид (3R)-3-[(2*)-2-гидрокси-2,3-дифенилпропионилокси1-1-(4-метилпент-3-енил)-1-азонийбицикло[2.2.2]октана (диастереомер 1)
Указанное в заголовке соединение получали по способам f и а из промежуточного соединения I-6а. Выход на конечной стадии составлял 280 мг, 77,7%.
tпл 224°C.
МС: 434 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,61 (s, 3 Н), 1,67 (s, 3 H). 1,63-1,75 (m, 2 H), 1,75-2,00 (m, 2 H), 2,21 (m, 1 H), 2,28 (m, 2 H), 2,99-3,20 (m, 4 H), 3,20-3,50 (m, 5 H), 3,77 (m, 1 H), 4,97 (m, 1 H), 5,04 (m, 1 H), 6,14 (s, 1 Н, ОН), 7,14 (m, 5 H), 7,23-7,39 (m, 3 H), 7,54 (m, 2 H).
(*) - конфигурация не определена.
Пример 50
Гидробромид (3R)-1-аллил-3-(2-гидрокси-2-тиен-2-илпент-4-еноилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали в виде смеси диастереомеров по способам с и а. Выход на конечной стадии составлял 210 мг, 61,8%.
tпл 62,6-63,9°С.
МС: 348 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: (смесь диастереомеров) 1,68-2,05 (m, 4 Н), 2,26 (m, 1 H), 2,76 (m, 1 H), 2,95 (m, 1 H), 3,08-3,53 (m, 5 H), 3,74-4,00 (m, 3 H), 5,02-5,21 (m, 3 H), 5,51-5,67 (m, 2 H), 5,78 (m, 1 H), 5,97 (m, 1 H), 6,49 (d, 1 Н, ОН), 7,01 (m, 1 H), 7,15 (m, 1 H), 7,48 (m, 1 H).
Пример 51
Гидробромид (3R)-1-(4-метилпент-3-енил)-3-(2-гидрокси-2-тиен-2-илпент-4-еноилокси)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали в виде смеси диастереомеров по способам с и а. Выход на конечной стадии составлял 290 мг, 78,4%.
tпл 56,2-57,9°С.
МС: 390 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: (смесь диастереомеров) 1,52-2,06 (m, 4 Н), 1,63 (d, 3 H), 1,69 (s, 3 H), 2,16-2,43 (m, 3 H), 2,78 (dd, 1 H), 2,96 (m, 1 Н), 3,07-3,59 (m, 7 H), 3,88 (m, 1 H), 4,92-5,23 (m, 4 H), 5,78 (m, 1 H), 6,48 (d, 1 H, ОН), 7,01 (m, 1 H), 7,15 (m, 1 H), 7,46 (m, 1 H).
Пример 52
Гидробромид (3R)-1-аллил-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам f и а. Выход на конечной стадии составлял 180 мг, 78,3%.
tпл 68,2-70,1°С.
МС: 376 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,26-1,66 (m, 8 H), 1,78-2,08 (m, 4 H), 2,30 (m, 1 H), 2,81 (m, 1 H), 3,14 (m, 1 H), 3.20-3,58 (m, 4 H), 3,78-4,03 (m, 3 H), 5,15 (m, 1 H), 5,52-5,68 (m, 2 H), 5,97 (m, 1 H), 6,18 (s, 1 Н, ОН), 7,01 (m, 1 Н), 7,16 (d, 1 H), 7,45 (d, 1 H).
Пример 53
Гидробромид (3R)-1-(4-метилпент-3-енил)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам f и а. Выход на конечной стадии составлял 290 мг, 71,7%.
tпл 84°C.
МС: 418 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,19-1,76 (m, 8 Н), 1,63 (s, 3 H), 1,68 (s, 3H), 1,77-2,05 (m, 4 H), 2,20-2,42 (m, 3 H), 2,81 (m, 1 H), 3,11-3,24 (m, 3 H), 3,24-3,61 (m, 4 H), 3,89 (m, 1 H), 5,01 (m, 1 H), 5,14 (m, 1 H), 6,19 (s, 1 H, ОН), 7,00 (m, 1 H), 7,16 (d, 1 H), 7,44 (d, 1 H).
Пример 54
Гидробромид (3R)-1-аллил-3-[(2R)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам с и а. Выход на конечной стадии составлял 230 мг, 85,2%.
tпл 65,3-66,0°С.
МС: 376 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: (смесь диастереомеров (3R,2R):(3R,2S), 72:28) 1,30-1,66 (m, 8 Н), 1,67-2,05 (m, 4 Н), 2,23 и 2,30 (m, 1 H), 2,83 (m, 1 Н), 3,06-3,55 (m, 5 Н), 3,74-4,03 (m, 3 Н), 5,14 (m, 1 Н), 5,53-5,68 (m, 2 Н), 5,99 (m, 1 Н), 6,18 и 6,19 (s, 1 Н, ОН), 7,00 (m, 1 Н), 7,16 (m, 1 Н), 7,44 (m, 1 Н).
Пример 55
Гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-(2-гидроксиэтил)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам f и а. Неочищенную смесь очищали обращенно-фазовой хроматографией (элюент: вода). Выход на конечной стадии составлял 148 мг, 66%.
МС: 380 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,25-1,99 (m, 12H), 2,29 (m, 1H), 2,75-2,85 (m, 1H), 3,30-3,60 (m, 7H), 5,13 (m, 1H), 5,29-5,32 (t, 1H), 6,21 (s, 1H), 6,98-7,01 (dd, 1H), 7,13-7,15 (dd, 1H), 7,42-7,44 (dd, 1H).
Пример 56
Гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-(3-гидроксипропил)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам f и а. Неочищенную смесь очищали обращенно-фазовой хроматографией (элюент: вода). Выход на конечной стадии составлял 145 мг, 53%.
МС: 394 [M-Br]+.
Пример 57
Гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-(4-гидроксибутил)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам f и а. Неочищенную смесь очищали обращенно-фазовой хроматографией (элюент: вода). Выход на конечной стадии составлял 40 мг, 20%.
МС: 408 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,25-1,93 (m, 18H), 2,29 (m, 1H), 2,81 (m, 1H), 3,08-3,48 (m, 5H), 3,75-3,90 (m, 1H), 4,61-4,64 (tm, 1H), 5,10-5,20 (m, 1H), 6.23 (s, 1H), 6,99-7,02 (t, 1H), 7,14-7,16 (m, 1H), 7,43-7,45 (d, 1H).
Пример 58
Гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-[2-(2-гидроксиэтокси)этил]-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам f и а. Неочищенную смесь очищали обращенно-фазовой хроматографией (элюент: вода). Выход на конечной стадии составлял 110 мг, 37%.
МС: 424 [M-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,10-1,53 (m, 14H), 1,82-2,04 (m, 3Н), 2,17-2,37 (m, 1H), 2,76-2,87 (m, 1H), 3,23-3,51 (m, 5H). 3,79-3,95 (m, 2H), 4,67-4,71 (t, 1H), 5,09-5,19 (m, 1H), 6,20 (s, 1H), 6,99-7,01 (dd, 1H), 7,14-7,16 (m, 1H), 7,42-7,44 (dd, 1H).
Пример 59
Гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-(6-гидроксигексил)-1-азонийбицикло[2.2.2]октана
Указанное в заголовке соединение получали по способам f и а. Неочищенную смесь очищали обращенно-фазовой хроматографией (элюент: вода). Выход на конечной стадии составлял 90 мг, 35%.
МС: 436 [М-Br]+.
1Н-ЯМР (300 МГц, ДМСО-d6) δ част./млн: 1,20-2,00 (m, 20H), 2,28 (m, 1H), 2,81 (m, 1H), 3,10-3,50 (m, 9H), 3,81 (m, 1H), 4,38-4,41 (t, 1H), 5,12 (m, 1H), 6,20 (s, 1H), 6,69-7,02 (t, 1H), 7,14-7,15 (m, 1H), 7,43-7,46 (m, 1H).
Приведенные ниже примеры предназначены для иллюстрации фармацевтических композиций по настоящему изобретению и способов их получения.
Пример 60
Получение фармацевтической композиции: таблетки
15 г Соединения по настоящему изобретению смешивали с 340,8 г лактозы и 85,2 г микрокристаллической целлюлозы с использованием смесителя. Смесь формовали под давлением с использованием роликового уплотнителя, при этом получали хлопьевидный спрессованный материал. Хлопьевидный компактный материал измельчали с помощью молотковой мельницы и измельченный материал просеивали через сито с размером ячеек 20 меш. В просеянный материал добавляли 4,5 г ангидрида кремниевой кислоты и 4,5 г стеарата магния, затем перемешивали. Из полученной смеси прессовали таблетки на машине для таблетирования, снабженной системой матрица/пуансон диаметром 7,5 мм, при этом получали 3000 таблеток массой 150 мг каждая.
Пример 61
Получение фармацевтической композиции: таблетки с покрытием
15 г Соединения по настоящему изобретению смешивали с 285,6 г лактозы и 122,4 г кукурузного крахмала на устройстве для гранулирования с псевдоожиженным слоем. В отдельном сосуде 22,5 г поливинилпирролидона растворяли в 127,5 г воды, при этом получали связующий раствор. Связующий раствор распыляли в указанной выше смеси на устройстве для гранулирования с псевдоожиженным слоем, при этом получали гранулы, к которым добавляли 4,5 г стеарата магния и смешивали. Из полученной смеси получали таблетки на машине для таблетирования, снабженной двояковогнутой системой матрица/пуансон диаметром 6,5 мм, при этом получали 3000 таблеток массой 150 мг каждая.
Раствор для получения покрытия получали в отдельном сосуде при суспендировании 6,9 г гидроксипропилметилцеллюлозы 2910, 1,2 г полиэтиленгликоля 6000, 3,3 г диоксида титана и 2,1 г очищенного талька в 72,6 г воды. На машине для нанесения покрытий High Coated 3000 полученных таблеток покрывали раствором для получения покрытия, при этом получали таблетки с пленочным покрытием массой 154,4 мг каждая.
Пример 62
Получение фармацевтической композиции: жидкий препарат для ингаляции
40 мг Соединения по настоящему изобретению растворяли в 90 мл физиологического солевого раствора и объем раствора доводили до 100 мл указанным физиологическим раствором, разливали по 1 мл в ампулы объемом 1 мл и затем стерилизовали при 115°С в течение 30 мин, при этом получали жидкий препарат для ингаляции.
Пример 63
Получение фармацевтической композиции: порошок для ингаляции
20 г Соединения по настоящему изобретению перемешивали с 400 г лактозы до гомогенного состояния и порции по 200 мг упаковывали в порошкообразные ингаляторы, выдающие при использовании порошкообразную дозу для ингаляции.
Пример 64
Получение фармацевтической композиции: аэрозоль для ингаляции
Концентрат активного ингредиента получали при растворении 0,0480 г соединения по настоящему изобретению в 2,0160 г этилового спирта. Концентрат помещали в соответствующее устройство для наполнения. Концентратом заполняли контейнеры для аэрозолей, верхнюю часть контейнера продували азотом или парами HFC-134A (ингредиенты для продувания не должны содержать более 1 част./млн кислорода) и закрывали клапаном. Закрытый контейнер заполняли пропеллентом HFC-134A (11,2344 г) под давлением.
Изобретение относится к новым соединениям формулы (I):

где В означает атом водорода или группу, выбранную из -R1, -OR1, гидрокси, -O(CO)R1, циано и неароматического гетероциклила, который представляет собой насыщенное или ненасыщенное С3-С10карбоциклическое кольцо, в котором один или более атомов углерода, предпочтительно 1 или 2 атома углерода, заменены на атомы кислорода в качестве гетероатомов, где R1 выбирают из группы, включающей атомы водорода, C1-С8алкил, С2-С8алкенил и С3-С8циклоалкил, где алкильная группа является незамещенной или замещенной одним или более заместителем, выбранным из атомов галогена и C1-С4алкила, и где алкенильная группа является незамещенной или замещенной одним или более заместителем, выбранным из С1-С4алкила, n равно целому числу от 0 до 4, А выбирают из группы, включающей -СН2-, -CH=CR3-, -CR3=CH-, -CR3R4-, -O-, -СО-, -O-(СН2)2-O-, где R3 и R4 каждый независимо означает атом водорода или С1-С8алкил, m равно целому числу от 0 до 8, p равно 2, и бициклическое кольцо азония содержит заместитель в положении 3, включая все возможные конфигурации асимметрических центров, D выбирают из группы, включающей:
 или
или 
где R5 выбирают из группы, включающей фенил, 2-тиенил, 3-тиенил, 2-фуранил, 3-фуранил, R6 выбирают из группы, включающей 2-тиенил, 3-тиенил, 2-фуранил, 3-фуранил, С3-С8циклоалкил, С1-С8алкил, С2-С8алкенил и фенилэтил, R7 означает атом водорода или группу, выбранную из гидроксила, гидроксиметила и метила, Q означает простую связь или группу, выбранную из -CH2-, -CH2CH2-, -O-, -O-СН2-, у равно целому числу от 0 до 3, X- означает фармацевтически приемлемый анион моно- или полиосновной кислоты, при условии, что группа B-(CH2)n-A-(CH2)m- не означает прямой С1-4алкил, а также что исключены следующие соединения: 1-аллилоксикарбонилметил-3-(2-гидрокси-2,2-дитиофен-2-илацетокси)-1-азонийбицикло[2.2.2]октан и 1-карбоксиметил-3-(2-гидрокси-2,2-дитиофен-2-илацетокси)-1-азонийбицикло[2.2.2]октан. Изобретение также относится к способу получения соединений формулы (I), к фармацевтической композиции, к применению соединений по любому из п.п.1-14, а также к комбинированному продукту. Технический результат - получение новых биологически активных соединений, обладающих антагонистической активностью в отношении мускариновых рецепторов МЗ. 5 н. и 16 з.п. ф-лы.
1. Соединение формулы (I)

где В означает атом водорода или группу, выбранную из -R1, -OR1,
гидрокси, -O(CO)R1, циано и неароматического гетероциклила, который представляет собой насыщенный или ненасыщенный С3-С10карбоциклическое кольцо, в котором один или более атомов углерода, предпочтительно 1 или 2 атома углерода, заменены на атомы кислорода в качестве гетероатомов, где
R1 выбирают из группы, включающей атомы водорода, С1-С8алкил, С2-С8алкенил и С3-С8циклоалкил, где алкильная группа является незамещенной или замещенной одним или более заместителем, выбранным из атомов галогена и С1-С4алкила, и где алкенильная группа является незамещенной или замещенной одним или более заместителем, выбранным из С1-С4алкила,
n равно целому числу от 0 до 4,
А выбирают из группы, включающей -CH2-, -CH=CR3-, -CR3=CH-, -CR3R4-, -O-, -СО-, -O-(СН2)2-O-, где R3 и R4 каждый независимо означает атом водорода или С1-С8алкил,
m равно целому числу от 0 до 8,
p равно 2,
и бициклическое кольцо азония содержит заместитель в положении 3, включая все возможные конфигурации асимметрических центров,
D выбирают из группы, включающей
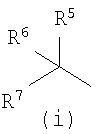 или
или 
где R5 выбирают из группы, включающей фенил, 2-тиенил, 3-тиенил, 2-фуранил, 3-фуранил,
R6 выбирают из группы, включающей 2-тиенил, 3-тиенил, 2-фуранил, 3-фуранил, С3-С8циклоалкил, С1-С8алкил, С2-С8алкенил и фенилэтил,
R7 означает атом водорода или группу, выбранную из гидроксила, гидроксиметила и метила,
Q означает простую связь или группу, выбранную из -СН2-, -СН2СН2-, -O-, -O-СН2-,
у равно целому числу от 0 до 3,
X- означает фармацевтически приемлемый анион моно- или полиосновной кислоты,
при условии, что группа B-(CH2)n-A-(CH2)m- не означает прямой С1-4алкил, а также что исключены следующие соединения:
1-аллилоксикарбонилметил-3-(2-гидрокси-2,2-дитиофен-2-илацетокси)-1-азонийбицикло[2.2.2]октан и
1-карбоксиметил-3-(2-гидрокси-2,2-дитиофен-2-илацетокси)-1-азонийбицикло[2.2.2]октан.
2. Соединение по п.1, в котором В выбирают из группы, включающей атомы водорода, гидрокси, необязательно замещенный С1-С8алкил, необязательно замещенный С2-С8алкенил, необязательно замещенный С3-С8циклоалкил и неароматический гетероциклил.
3. Соединение по п.1, где группа азонийбицикло замещена по атому азота группой, выбранной из аллила, 4-метилпент-3-енила, изопропила, циклопропилметила, изобутила, гептила, циклогексилметила, 3-циклогексилпропила, 3,7-диметилокта-(Е)-2,6-диенила, 2-гидроксиэтила, 3-гидроксипропила, 4-гидроксибутила, 5-гидроксипентила, 6-гидроксигексила, 2-этоксиэтила, 2-(2-гидроксиэтокси)этила, 2-(2-метоксиэтокси)этила, оксиранилметила, 2-[1,3]диоксолан-2-илэтила, 2-[2-(2-гидроксиэтокси)этокси]этила, 3-[1,3]диоксолан-2-илпропила, 2-этоксикарбонилэтила, 3-этоксикарбонилпропила, 4-этоксикарбонилбутила, 4-ацетоксибутила, 3-ацетилсульфонилпропила, 2-карбамоилэтила, 2-цианоэтила, 3-цианопропила, 4-цианобутила, 6-цианогексила и 4,4,4-трифторбутила.
4. Соединение по п.3, в котором группа азонийбицикло замещена по атому азота группой, выбранной из аллила, 4-метилпент-3-енила, изопропила, циклопропилметила, изобутила, гептила, 2-гидроксиэтила, 3-гидроксипропила, 4-гидроксибутила, 5-гидроксипентила, 6-гидроксигексила, 2-(2-метоксиэтокси)этила, 2-(2-гидроксиэтокси)этила, 4-этоксикарбонилбутила, 4-ацетоксибутила, 3-цианопропила и 4-цианобутила.
5. Соединение по п.1, в котором атом углерода в азонийбициклическом кольце в положении 3 находится в R конфигурации.
6. Соединение по п.1, в котором атом углерода в азонийбициклическом кольце в положении 3 находится в S конфигурации.
7. Соединение по любому из предшествующих пунктов, в котором D означает группу формулы (i), а R6 означает 2-тиенил, 3-фурил или циклопентил.
8. Соединение по любому из предшествующих пунктов, в котором D означает группу формулы (i), и где группа формулы -O-CO-C(R5)(R6)(R7) представляет собой группа, выбранная из 2,2-дитиен-2-илацетокси, 2,2-дитиен-2-илпропионилокси, 2-гидрокси-2,2-дитиен-2-илацетокси, 2-гидрокси-2-фенил-2-тиен-2-илацетокси, 2-фур-2-ил-2-гидрокси-2-фенилацетокси, 2-фур-2-ил-2-гидрокси-2-тиен-2-илацетокси, (2*)-2-гидрокси-2,3-дифенилпропионилокси, 2-гидрокси-2-тиен-2-илпент-4-еноилокси, (2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси и (2R)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси.
9. Соединение по п.8, в котором группа -O-CO-C(R5)(R6)(R7) выбрана из 2-циклопентил-2-гидрокси-2-тиен-2-илацетокси, 2,2-дитиен-2-илацетокси, 2-гидрокси-2,2-дитиен-2-илацетокси, 2,2-дитиен-2-илпропионилокси, 2-гидрокси-2-фенил-2-тиен-2-илацетокси, 2-фур-2-ил-2-гидрокси-2-тиен-2-илацетокси и 2-фур-2-ил-2-гидрокси-2-фенилацетокси.
10. Соединение по любому из предшествующих пунктов, в котором D означает группу формулы (ii), и где группа формулы D-COO- представляет собой группа, выбранная из 9-метил-9Н-флуорен-9-карбонилокси, 9-гидрокси-9Н-флуорен-9-карбонилокси, 9Н-ксантен-9-карбонилокси, 9-метил-9Н-ксантен-9-карбонилокси, 9-гидрокси-9Н-ксантен-9-карбонилокси и 10,11-дигидро-5Н-дибензо[а,d]циклогептен-5-карбонилокси.
11. Соединение по п.10, в котором группа формулы D-COO- выбрана из 9-метил-9Н-флуорен-9-карбонилокси, 9-гидрокси-9Н-флуорен-9-карбонилокси, 9Н-ксантен-9-карбонилокси, 9-метил-9Н-ксантен-9-карбонилокси и 9-гидрокси-9Н-ксантен-9-карбонилокси.
12. Соединение по любому из предшествующих пунктов, в котором атом углерода, замещенный группами R5, R6 и R7, находится в R-конфигурации.
13. Соединение по любому из предшествующих пунктов, в котором атом углерода, замещенный группами R5, R6 и R7, находится в S-конфигурации.
14. Соединение по п.1, которое представляет собой
гидробромид (3R)-1-аллил-3-(2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-(2,2-дитиен-2-илацетокси)-1-(4-метилпент-3-енил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(2,2-дитиен-2-илпропионилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(4-метилпент-3-енил)-3-(2,2-дитиен-2-илпропионилокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-изопропил-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-циклопропилметил-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-изобутил-1-азонийбицикло [2.2.2] октана,
гидробромид (3R)-1-гептил-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло [2.2.2] октана,
трифторацетат (3R)-1-циклогексилметил-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1 -азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(3-циклогексилпропил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-(4-метилпент-3-енил)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(3,7-диметилокта-(Е)-2,6-диенил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-(2-гидроксиэтил)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-(3-гидроксипропил)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(4-гидроксибутил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(2-этоксиэтил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидрохлорид (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-[2-(2-гидроксиэтокси)этил]-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-[2-(2-метоксиэтокси)этил]-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-оксиранилметил-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(2-[1,3]диоксолан-2-илэтил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-{2-[2-(2-гидроксиэтокси)этокси]этил}-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(3-[1,3]диоксолан-2-илпропил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(3-этоксикарбонилпропил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(4-этоксикарбонилбутил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(4-ацетоксибутил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(3-цианопропил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(4-цианобутил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-1-(6-цианогексил)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
трифторацетат (3R)-3-(2-гидрокси-2,2-дитиен-2-илацетокси)-1-(4,4,4-трифторбутил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(2-гидрокси-2-фенил-2-тиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(2-фур-2-ил-2-гидрокси-2-фенилацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(2-фур-2-ил-2-гидрокси-2-тиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(9-метил-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-(4-метилпент-3-енил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-гептил-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2] октана,
гидробромид (3R)-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-оксиранилметил-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-[2-(2-метоксиэтокси)этил]-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(2-[1,3]диоксолан-2-илэтил)-3-(9-гидрокси-9Н-флуорен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(4-метилпент-3-енил)-3-(9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(9-метил-9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(9-гидрокси-9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2] октана,
гидробромид (3R)-1-(3-гидроксипропил)-3-(9-гидрокси-9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(10,11-дигидро-5Н-дибензо[а,d]циклогептен-5-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(4-метилпент-3-енил)-3-(10,1-дигидро-5Н-дибензо[a,d]циклогептен-5-карбонилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-[(2*)-2-гидрокси-2,3-дифенилпропионилокси]-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-[(2*)-2-гидрокси-2,3-дифенилпропионилокси)]-1-(4-метилпент-3-енил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-(2-гидрокси-2-тиен-2-илпент-4-еноилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-(4-метилпент-3-енил)-3-(2-гидрокси-2-тиен-2-илпент-4-еноилокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-1-аллил-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-азонийбицикло[2.2,2]октана,
гидробромид (3R)-1-(4-метилпент-3-енил)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид, (3R)-1-аллил-3-[(2R)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-(2-гидроксиэтил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-(3-гидроксипропил)-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-(4-гидроксибутил)-1-азонийбицикло[2.2,2]октана,
гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-[2-(2-гидроксиэтокси)этил]-1-азонийбицикло[2.2.2]октана,
гидробромид (3R)-3-[(2S)-2-циклопентил-2-гидрокси-2-тиен-2-илацетокси]-1-(6-гидроксигексил)-1-азонийбицикло[2.2.2]октана.
15. Способ получения соединений формулы (I)

где В, n, A, m, p и D определены в пп.1-14, причем указанный способ включает кватернизацию атома азота азабициклического кольца в соединении формулы (III)

где p и D определены выше, алкилирующим агентом формулы (II)

где В, n, А и m определены выше, a W означает уходящую группу.
16. Фармацевтическая композиция, обладающая антагонистической активностью в отношении мускариновых рецепторов М3, включающая соединение по любому из пп.1-14 в смеси с фармацевтически приемлемым носителем или разбавителем.
17. Соединение по любому из пп.1-14, обладающее антагонистической активностью в отношении мускариновых рецепторов М3.
18. Фармацевтическая композиция по п.16, для лечения заболеваний при которых может быть полезным применение антагонистов мускариновых рецепторов М3.
19. Применение соединения по любому из пп.1-14 или фармацевтической композиции по п.16 для получения лекарственного средства, предназначенного для лечения респираторных, урологических заболеваний или заболеваний желудочно-кишечного тракта.
20. Применение по п.19, где заболевания или расстройства выбраны из группы, включающей хроническое обструктивное заболевание легких (COPD), бронхит, повышенную бронхиальную реактивность, астму, кашель, ринит, недержание мочи, поллакиурию, нейрогенный или нестабильный мочевой пузырь, цистоспазм, хронический цистит, синдром раздраженного кишечника, спастический колит, дивертикулит и пептическую язву.
21. Комбинированный продукт, включающий
(i) соединение по любому из пп.1-14, и
(ii) агонист β2, стероид, антиаллергическое лекарственное средство, ингибитор фосфодиэстеразы IV и/или антагонист лейкотериана D4 (LTD4) для одновременного, раздельного или последовательного применения при лечении респираторных заболеваний.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| RU 97112907 A, 27.06.1999. | |||
Авторы
Даты
2010-02-20—Публикация
2005-03-10—Подача