Область техники, к которой относится изобретение
Данное изобретение относится к фармацевтическим композициям в виде раствора, содержащим 17-аллиламино-17-деметоксигелданамицин (“17-AAG”), и к способам их получения и применения.
Уровень техники
Гелданамицин принадлежит к ансамициновому семейству природных продуктов, члены которого характеризуются бензольным ядром (как правило, ядром бензохинона или гидрохинона), которое соединено в двух метаположениях, образуя макролактам. Кроме гелданамицина, ансамицины включают макбецины, гербимицины, TAN-420 и ребластатин.
Гелданамицин и его производные представляют собой наиболее широко исследуемые из ансамицинов. Хотя первоначально гелданамицин был выявлен в результате отбора на антибиотическую активность, в настоящее время интерес к нему основан, главным образом, на его цитотоксичности в отношении опухолевых клеток, и, следовательно, его возможностях в качестве противоопухолевого средства. Он представляет собой ингибитор белка теплового шока 90 (“Hsp90”), вовлеченного в укладку, активацию и сборку широкого диапазона белков (“белков-клиентов”), в том числе основных белков, которые вовлечены в передачу сигнала, контроль клеточного цикла и регуляцию транскрипции. Связывание гелданамицина с Hsp90 нарушает взаимодействия Hsp90 с белком-клиентом, препятствуя правильной укладке белков-клиентов и делая их подверженными разрушению, опосредуемому протеасомой. Среди белков-клиентов Hsp90 находятся многие мутантные или сверхэкспрессируемые белки, вовлеченные в развитие злокачественной опухоли: p53, киназа Bcr-Abl, киназа Raf-1, киназа Akt, киназа Npm-Alk, трансмембранная киназа p185ErB2, Cdk4, Cdk6, Wee1 (киназа, зависимая от клеточного цикла), HER2/Neu (ErbB2) и индуцируемый гипоксией фактор-1α (HIF-1α). Однако гепатотоксичность и недостаточная биодоступность гелданамицина привели к прекращению его рассмотрения в качестве клинического кандидата.
Тем не менее, сохраняется интерес к разработке производных гелданамицина или аналогов, обладающих гелданамицинподобной биоактивностью, но с большим фармацевтически приемлемым диапазоном свойств. Положение 17 в гелданамицине являлось главным, представляющим интерес с химической точки зрения положением для синтеза производных гелданамицина, поскольку метоксигруппу в нем легко заменять нуклеофилом, обеспечивающим удобный доступ к 17-замещенным-17-деметоксигелданамицинам. Кроме того, в исследованиях взаимосвязи структуры и активности (SAR) было показано, что введение химически и стерически различных 17-заместителей не приводит к исчезновению противоопухолевой активности. См., например, Sasaki et al., US 4261989 (1981); Schnur et al., US 5932566 (1999); Schnur et al., J. Med. Chem., 38, 3806-3812 (1995); Schnur et al., J. Med. Chem., 38, 3813-3820 (1995); и Santi et al., US 2003/0114450 A1 (2003); описания которых приведены здесь полностью в качестве ссылки. Выводы о SAR подтверждены рентгенографической кристаллической сочетанной структурой комплекса между Hsp90 и производным гелданамицина (17-DMAG, см. ниже), в которой показано, что 17-заместитель выступает наружу из кармана связывания в направлении растворителя (Jez et al., Chemistry & Biology, 10, 361-368 (2003)). Таким образом, положение 17 представляет интерес для введения регулирующих свойств заместителей, таких как группа, придающая растворимость. Наиболее известное 17-замещенное производное гелданамицина представляет собой 17-AAG, впервые описанный в указанном выше Sasaki et al. и подвергающийся в настоящее время клиническим испытаниям. Другим представляющим интерес 17-замещенным производным гелданамицина является 17-(2-диметиламиноэтил)амино-17-деметоксигелданамицин (“17-DMAG”, Snader et al., 2004/0053909 A1 (2004)), также подвергающийся клиническим испытаниям.
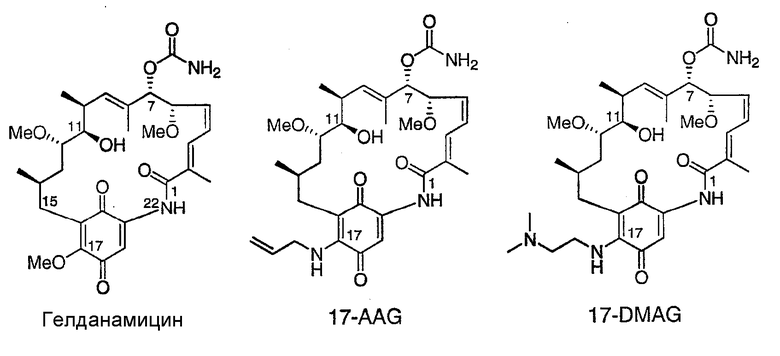
Ограничением в получении фармацевтических композиций, содержащих соединения гелданамицина, такие как сам гелданамицин и 17-AAG, в частности, для парентерального введения, является их очень низкая растворимость в воде, приблизительно только 0,1 мг/мл для 17-AAG при нейтральном pH (17-DMAG, имеющий алкиламиногруппу, более растворим). В отношении этой проблемы в Tabibi et al., US 6682758 B1 (2004) описана композиция нерастворимого в воде лекарственного средства, такого как 17-AAG, содержащая (a) лекарственное средство, (b) водорастворимый органический растворитель для лекарственного средства, (c) поверхностно-активное средство, а также (d) воду. Водорастворимый растворитель может представлять собой диметилсульфоксид (DMSO), диметилформамид, этанол, глицерин, пропиленгликоль или полиэтиленгликоль. Предпочтительно, поверхностно-активное средство представляет собой фосфолипид (особенно фосфолипид яйца). Другим представляющим интерес описанием является Ulm et al., WO 03/086381 (2003), в котором описан способ получения фармацевтических композиций для ансамицинов посредством (a) предоставления растворенного в этаноле ансамицина; (b) смешивания продукта со стадии (a) с триглицеридом со средней длиной цепи для образования первой смеси; (c) удаления, в значительной степени, этанола из первой смеси; (d) объединения продукта со стадии (c) с эмульгатором и стабилизатором для образования второй смеси; и (e) эмульгирования второй смеси. Необязательно, эмульгированную вторую смесь можно лиофилизировать, а затем повторно гидратировать. В конкретном сочетании триглицерид со средней длиной цепи содержит каприловую и/или капроновую кислоту, эмульгатор содержит фосфатидилхолин, а стабилизатор содержит сахарозу. Кроме того, в Ulm et al., WO 2004/082676 A1 (2004) описана фармацевтическая композиция, содержащая ингибитор Hsp90, такой как 17-AAG, эмульгатор и масло, которое включает в себя триглицериды с цепями средней длины и с длинными цепями.
Раскрытие изобретения
В одном из аспектов настоящее изобретение включает улучшенную композицию 17-AAG в виде раствора, пригодную для внутривенного введения. Такая композиция содержит 17-AAG в концентрации вплоть до 15 мг/мл, растворенный в носителе, который включает (i) первый компонент, представляющий собой этанол, в количестве приблизительно от 40 до приблизительно 60 об.%; (ii) второй компонент, представляющий собой полиэтоксилированное касторовое масло, в количестве приблизительно от 15 до приблизительно 50 об.%; и (iii) третий компонент, выбранный из группы, которая состоит из пропиленгликоля, ПЭГ 300, ПЭГ 400, глицерина и их сочетаний, в количестве приблизительно от 0 до приблизительно 35 об.%. Указанные выше проценты представляют собой проценты об./об. на основе взятых вместе объемов первого, второго и третьего компонентов. Нижний предел для третьего компонента, составляющий приблизительно 0 об.%, означает, что это необязательный компонент; что он может отсутствовать.
В другом аспекте это изобретение обеспечивает способ введения пациенту 17-AAG при необходимости этого, предусматривающий стадии:
(a) предоставление фармацевтической композиции в виде раствора, который содержит 17-AAG в концентрации вплоть до 15 мг/мл, растворенный в носителе, содержащем (i) первый компонент, представляющий собой этанол, в количестве приблизительно от 40 до приблизительно 60 об.%; (ii) второй компонент, представляющий собой полиэтоксилированное касторовое масло, в количестве приблизительно от 15 до приблизительно 50 об.%; и (iii) третий компонент, выбранный из группы, которая состоит из пропиленгликоля, ПЭГ 300, ПЭГ 400, глицерина и их сочетаний, в количестве приблизительно от 0 до приблизительно 35 об.%;
(b) разведение фармацевтической композиции в виде раствора со стадии (a) в воде для получения разбавленной композиции, содержащей вплоть до 3 мг/мл 17-AAG; и
(c) внутривенное введение пациенту разбавленной композиции.
Еще один вариант осуществления относится к способу получения фармацевтической композиции в виде раствора, содержащего 17-AAG, предусматривающему стадии:
(a) предоставление количества 17-AAG;
(b) сочетание 17-AAG со стадии (a) с количеством носителя, который содержит (i) первый компонент, представляющий собой этанол, в количестве приблизительно от 40 до приблизительно 60 об.%; (ii) второй компонент, представляющий собой полиэтоксилированное касторовое масло, в количестве приблизительно от 15 до приблизительно 50 об.%; и (iii) третий компонент, выбранный из группы, которая состоит из пропиленгликоля, ПЭГ 300, ПЭГ 400, глицерина и их сочетаний, в количестве приблизительно от 0 до приблизительно 35 об.%;
(c) перемешивание смеси со стадии (b) до по существу полного растворения 17-AAG; и
(d) необязательно, фильтрование перемешанной смеси со стадии (c), с получением фармацевтической композиции в виде раствора, содержащего 17-AAG;
где количество 17-AAG на стадии (a) и количество носителя на стадии (b) являются такими, что концентрация 17-AAG в фармацевтической композиции в виде раствора составляет вплоть до 15 мг/мл.
Подробное описание изобретения
Фармацевтическая композиция в виде раствора по данному изобретению устойчива, образует прозрачный пурпурный раствор, и ее можно легко разводить в воде для инъекций (“WFI”) для образования прозрачной разбавленной композиции, содержащей вплоть до 3 мг/мл 17-AAG (предпочтительно, от 0,2 до 3 мг/мл), которая приемлема для внутривенной инъекции. Разведенная композиция устойчива в течение периода времени, составляющего по крайней мере 10 часов, а обычно, приблизительно от 12 до 24 часов. Длительное хранение разведенной композиции не рекомендовано вследствие проблем со стабильностью и стерильностью. Не рекомендовано введение неразведенной композиции.
В сравнении с композициями предшествующего уровня техники, настоящая фармацевтическая композиция в виде раствора предоставляет множество преимуществ. Ее легко получать и хранить, а также она не требует стадий многократного добавления, удаления и/или повторного добавления растворителя, за исключением конечного разведения в WFI перед использованием. Это позволяет избегать применения растворителя, такого как ДМСО, плохо воспринимаемого пациентом вследствие его запаха (или запаха его метаболита(ов)). Настоящая фармацевтическая композиция в виде раствора позволяет доставлять необходимое количество 17-AAG в течение приемлемого времени инфузии, приблизительно 90 минут.
Предпочтительно, носитель содержит этанол (первый компонент) в количестве приблизительно 50 об.%, полиэтоксилированное касторовое масло (второй компонент) в количестве приблизительно от 20 до приблизительно 30 об.% и пропиленгликоль в качестве третьего компонента в количестве приблизительно от 20 до приблизительно 30 об.%.
Пропиленгликоль можно полностью или частично заменять ПЭГ 300 (поли(этиленгликолем) со средней молекулярной массой 300), ПЭГ 400 (поли(этиленгликолем) со средней молекулярной массой 400), глицерином или их сочетаниями.
Предпочтительно, этанол является дегидратированным, со степенью чистоты USP. Предпочтительно, пропиленгликоль, ПЭГ 300, ПЭГ 400 или глицерин имеют степень чистоты USP.
Полиэтоксилированное касторовое масло действует в качестве придающего растворимость средства/эмульгатора для 17-AAG. Предпочтительно, полиэтоксилированное касторовое масло представляет собой масло, производимое BASF AG под торговым названием кремофор. Особенно предпочтителен кремофор EL, хотя можно использовать другие марки кремофора, такие как кремофор RH 60, кремофор CO 40, кремофор CO 410, кремофор CO 455, кремофор CO 60, кремофор RH 40, кремофор RH 410 и кремофор WO 7. Специалисты в данной области понимают, что препараты на основе кремофора следует применять с определенной степенью осторожности, поскольку некоторые пациенты испытывали неблагоприятные побочные эффекты.
Хотя в отношении фармацевтических средств различные марки кремофора использовали в качестве вспомогательных средств для препаратов, с ансамицинами кремофор ранее не применяли. По существу, использование кремофора в препаратах ансамицина было рекомендовано в Santi et al., US 2003/0114450 A1 (2003). В уровне техники, кремофор-содержащие композиции, которые содержат также фармацевтические средства, иллюстративно раскрыты в документах: Brahm, US 5583153 (1996); Gao et al., US 6121313 (2000); Kuo et al., US 6214803 B1 (2001); Chen et al., US 6555558 B2 (2003); Xiang et al., US 6653319 B1 (2003); Whittle et al., US 2003/0021752 Al (2003); Gao et al., US 2003/0044434 A1 (2003); Jiang et al., US 2003/0091639 A1 (2003); Hauer et al., US 2003/0104990 A1 (2003); Cai et al., US 2003/0114485 A1 (2003); Stanislaus, US 2003/0119909 A1 (2003); Naicker et al., US 2003/0171264 A1 (2003); Dong et al., US 2003/0198619 A1 (2003); Dong et al., US 2003/0232078 A1 (2003); Metcalfe et al., US 2004/0033243 A1 (2004); Namburi et al., US 2004/0052847 A1 (2004); Danishefsky et al., US 2004/0053910 A1 (2004). Описания указанных выше документов приведены здесь полностью в качестве ссылки.
Предпочтительно, при получении носителя первый, второй и третий компоненты сочетают в указанном порядке, как подробно описано ниже. А именно, первый компонент сочетают со вторым компонентом, после чего к сочетанию первого и второго компонентов добавляют третий компонент.
После получения носителя фармацевтическую композицию в виде раствора можно получать следующим образом: предварительно измеренное количество 17-AAG взвешивают в соответствующем контейнере, в который затем добавляют предварительно измеренное количество носителя. Затем 17-AAG и носитель перемешивают до растворения 17-AAG (предпочтительно, в течение по крайней мере 6 часов, более предпочтительно - в течение по крайней мере 10 часов, наиболее предпочтительно - в течение от 12 до 14 часов или в течение ночи) и фильтруют, предпочтительно, через фильтр 0,22 мк для обеспечения фармацевтической композиции в виде раствора по данному изобретению. Перемешивание можно выполнять при температуре окружающей среды или при охлаждении. Предпочтительно, после получения композицию хранят при охлаждении, предпочтительно, при температуре от -20°C до 4°C. Для защиты 17-AAG от света рекомендовано использовать сосуды из коричневого стекла или другие приемлемые контейнеры. Как указано выше, концентрация 17-AAG может составлять вплоть до 15 мг/мл, а предпочтительно, от 2 до 15 мг/мл.
Указание, что носитель содержит первый, второй и третий компоненты, означает, что для него приемлемо включение дополнительных ингредиентов. Однако в предпочтительном варианте осуществления носитель состоит преимущественно из первого, второго и третьего компонентов в указанных выше относительных количествах, что означает, что носитель ограничен указанными выше тремя компонентами и компонентами, которые существенно не влияют на основную и новую характеристику(и) фармацевтической композиции в виде раствора по данному изобретению.
Гелданамицин представляет собой хорошо известный природный продукт, который получают культивированием продуцирующего организма Streptomyces hygroscopicus, вар. geldanus NRRL 3602. 17-AAG получают полусинтетически из гелданамицина посредством реакции гелданамицина с аллиламином, как описано в Sasaki et al., US 4261989 (1981), описание которого приведено здесь полностью в качестве ссылки.
17-AAG, вводимый в составе фармацевтической композиции в виде раствора по данному изобретению, можно использовать для лечения заболеваний, таких как, без ограничения перечисленными, гиперпролиферативные заболевания, в том числе: злокачественные опухоли головы и шеи, включающие опухоли головы, шеи, полости носа, околоносовых пазух, носоглотки, полости рта, ротоглотки, гортани, гортанной части глотки, слюнных желез и параганглиомы; злокачественные опухоли печени и желчных протоков, в частности гепатоцеллюлярная карцинома; злокачественные опухоли кишечника, в частности рак прямой и ободочной кишки; подлежащий лечению рак яичника; мелкоклеточный и немелкоклеточный рак легких; рак молочной железы; саркомы, такие как фибросаркома, злокачественная фиброзная гистиоцитома, эмбриональная рабдомиосаркома, лейомиосаркома, нейрофибросаркома, остеосаркома, синовиальная саркома, липосаркома и альвеолярная саркома мягких тканей; новообразования центральной нервной системы, в частности рак головного мозга; лимфомы, такие как лимфома Ходжкина, лимфоплазмацитоидная лимфома, фолликулярная лимфома, лимфома лимфоидной ткани слизистых оболочек, лимфома из клеток мантийной зоны, крупноклеточная лимфома из клеток B-клеточной линии дифференцировки, лимфома Беркитта и анапластическая T-клеточная лимфома из крупных клеток. Клинически, практическое осуществление способов и применение описанных здесь композиций приводит к снижению размера или количества злокачественных опухолей и/или ослаблению связанных симптомов (где возможно). Патологически, практическое осуществление способа и применение описанных здесь композиций приводит к патологически соответствующей реакции, такой как ингибирование пролиферации опухолевых клеток, снижение размера опухолевого образования или опухоли, предотвращение дальнейшего метастазирования и ингибирование опухолевого ангиогенеза. Способ лечения таких заболеваний предусматривает введение индивидууму терапевтически эффективного количества комбинации по изобретению. Способ можно повторять по мере необходимости.
Также введением 17-AAG по данному изобретению можно лечить заболевания, не относящиеся к злокачественным опухолям, которые характеризуются гиперпролиферацией клеток. Примеры для иллюстрации таких заболеваний включают в себя, без ограничения перечисленными: атрофический гастрит, воспалительную гемолитическую анемию, отторжение трансплантата, воспалительную нейтропению, буллезный пемфигоид, целиакию, демиелинизирующие нейропатии, дерматомиозит, воспалительное заболевание кишечника (язвенный колит и болезнь Крона), рассеянный склероз, миокардит, миозит, носовые полипы, хронический синусит, обыкновенную пузырчатку, первичный гломерулонефрит, псориаз, спайки в результате хирургического вмешательства, стеноз или рестеноз, склерит, склеродермию, экзему (в том числе атопический дерматит, раздражающий дерматит, аллергический дерматит), периодонтальное заболевание (т.е. периодонтит), поликистозное заболевание почек и диабет I типа. Другие примеры включают васкулит (например, гигантоклеточный артериит (височный артериит, артериит Такаясу), узелковый полиартериит, аллергический ангиит и гранулематоз (болезнь Черджа-Стросс), синдром, перекрывающий различные варианты полиангиита, гиперчувствительный васкулит (пурпура Геноха-Шенлейна), сывороточную болезнь, индуцируемый лекарственным средством васкулит, инфекционный васкулит, неопластический васкулит, васкулит, связанный с заболеваниями соединительной ткани, васкулит, связанный с врожденной недостаточностью системы комплемента, гранулематоз Вегенера, болезнь Кавасаки, васкулит центральной нервной системы, болезнь Бюргера и системный склероз); заболевания желудочно-кишечного тракта (например, панкреатит, болезнь Крона, язвенный колит, язвенный проктит, первичный склерозирующий холангит, доброкачественные стриктуры любой этиологии, в том числе идиопатические (например, стриктуры желчных протоков, пищевода, двенадцатиперстной кишки, тонкой кишки или толстой кишки); заболевания дыхательного пути (например, астму, гиперчувствительный пневмонит, асбестоз, силикоз и другие формы пневмокониоза, хронический бронхит и хроническое обструктивное заболевание дыхательных путей); заболевания носослезного протока (например, стриктуры любой этиологии, в том числе идиопатические); а также заболевания евстахиевой трубы (например, стриктуры любой этиологии, в том числе идиопатические).
17-AAG можно вводить в сочетании с другими противоопухолевыми или цитотоксическими средствами, в том числе алкилирующими средствами, ингибиторами ангиогенеза, антиметаболитами, расщепляющими ДНК средствами, сшивающими ДНК средствами, интеркалирующими в ДНК средствами, связывающимися с малой бороздкой в ДНК средствами, ингибиторами белка теплового шока 90, ингибиторами деацетилазы гистонов, стабилизаторами микротрубочек, аналогами нуклеозидов (пурина или пиримидина), ингибиторами протеасомы, ингибиторами топоизомеразы (I или II), ингибиторами тирозинкиназы. Конкретные противоопухолевые или цитотоксические средства включают β-лапакон, 17-DMAG, бикалутамид, блеомицин, бортезомиб, бусульфан, калихеамицин, камптотецин, капецитабин, каллистатин A, CC-1065, цисплатин, криптофицины, даунорубицин, дискодермолид, доцетаксел, доксорубицин, дуокармицин, динемицин A, эпотилоны, этопозид, флоксуридин, флударабин, фторурацил, гефитиниб, гелданамицин, гемцитабин, гидроксимочевину, иматиниб, интерфероны, интерлейкины, иринотекан, лептомицин B, метотрексат, митомицин C, оксалиплатин, паклитаксел, спонгистатины, субероиланилидгидроксамиковую кислоту (SAHA), тиотепу, топотекан, трихостатин A, винбластин, винкристин и виндезин.
Совместно вводимое противоопухолевое или цитотоксическое средство может представлять собой ингибитор протеинкиназы, в том числе: хиназолины, особенно 4-анилинхиназолины, такие как иресса (AstraZeneca; N-(3-хлор-4-фторфенил)-7-метокси-6-[3-(4-морфолинил)пропокси]-4-хиназолинамин) и тарцева (Roche/Genentech; моногидрохлорид N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина); фениламинопиримидины, такие как гливек (Novartis; 4-[(4-метил-1-пиперазинил)метил]-N-[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]фенил]бензамид); пиррол- и пиразолпиримидины, такие как BIBX 1382 (Boehringer Ingelheim; N8-(3-хлор-4-фторфенил)-N-2-(1-метил-4-пиперидинил)пиримидо[5,4-d]пиримидин-2,8-диамин); индолы и оксиндолы, такие как семаксиниб (Pharmacia; 3-[(3,5-диметил-1H-пиррол-2-ил)метилен]-1,3-дигидро-2H-индол-2-он); малононитрилы бензилидена; флавоны, такие как флавопиридол (Aventis; 2-(2-хлорфенил)-5,7-дигидрокси-8-[(3S,4R)-3-гидрокси-1-метил-4-пиперидинил]-4H-1-бензопиран-4-он); стауроспорины, такие как CEP-701 (Cephalon); антитела, такие как герцептин (Genentech); а также рибозимы, такие как ангиозим (Ribozyme Pharmaceuticals).
При использовании фармацевтической композиции в виде раствора по данному изобретению 17-AAG можно вводить в дозе, находящейся в диапазоне приблизительно от 4 мг/м2 до приблизительно 4000 мг/м2 в зависимости от частоты введения. Предпочтительная схема введения доз для 17-AAG представляет собой приблизительно 450 мг/м2 еженедельно (Banerji et al., Proc. Am. Soc. Clin. Oncol., 22, 199 (2003, реферат 797), “A Pharmacokinetically (PK)-pharmacodynamically (PD) Guided Phase I Trial of the Heat Shock Protein 90 (HSP90) Inhibitor 17-Allyl-17-demethoxygeldanamycin (17AAG)”). Альтернативно, можно еженедельно вводить дозу приблизительно 308 мг/м2. См. Goetz et al., Eur. J. Cancer, 38 (Supp.7), S54-S55 (2002), “A phase I trial of 17-Allyl-Amino-Geldanamycin (17-AAG) in patients with advanced cancer.” Другая схема введения доз представляет собой два раза в неделю, где дозы находятся в диапазоне от 220 мг/м2 до 340 мг/м2 (предпочтительно, 220 мг/м2 или 340 мг/м2). Схема введения доз, которую можно использовать для вариантов сочетанного лечения с другим лекарственным средством, таким как доцетаксел, представляет собой введение двух лекарственных средств каждые три недели, где доза 17-AAG составляет вплоть до 650 мг/м2 для каждого введения.
Осуществление этого изобретения на практике можно дополнительно понять из следующих примеров, которые предназначены для иллюстрации, а не для ограничения.
Пример 1
В этом примере описано получение носителя для использования в препаратах по данному изобретению, который состоит из 50 об.% этанола, 20 об.% кремофора EL и 30 об.% пропиленгликоля. Дегидратированный этанол (USP, 500 мл, 394,5 г) смешивали с кремофором EL (BASF Aktiengesellschaft, 200 мл, 210 г). После смешивания указанных выше двух компонентов, образующих гомогенную жидкость, добавляли пропиленгликоль (USP, 300 мл, 310,8 г). Смесь снова смешивали до гомогенного состояния и фильтровали через фильтр 0,22 мк для обеспечения 1 литра носителя.
Пример 2
После общей процедуры из примера 1 получали другую, составляющую 1 л порцию носителя с использованием 450 мл (355,1 г) этанола, 280 мл (294 г) кремофора EL и 270 мл (279,5 г) пропиленгликоля. В результате этого получали носитель, состоящий из 45 об.% этанола, 28 об.% кремофора EL и 27 об.% пропиленгликоля.
Пример 3
После общей процедуры из примера 1 получали дополнительные, составляющие 1 л порции носителя с использованием 500 мл (394,5 г) этанола и от 150 до 500 мл (от 157,5 до 525 г) кремофора EL, а также от 0 до 350 мл пропиленгликоля. В результате этого получали носители, состоящие из 50 об.% этанола, от 15 до 50 об.% кремофора EL и от 0 до 35 об.% пропиленгликоля.
Пример 4
В этом примере описано получение фармацевтической композиции в виде раствора по данному изобретению с использованием носителя, получаемого в предшествующих примерах. 17-AAG (1,0 г) тщательно отвешивали в чистый стеклянный контейнер с использованием аналитических весов. В контейнер добавляли носитель (95 мл) и перемешивали до полного растворения 17-AAG. Конечный объем раствора доводили до 100,0 мл дополнительным носителем. Затем раствор для обеспечения стерильности фильтровали через фильтр 0,22 мк и хранили при 4°C.
Пример 5
Устойчивость фармацевтических композиций в виде раствора по данному изобретению выявляли следующим образом. Два набора образцов препаратов в соответствии с примером 1 хранили при 5°C (“образец A”) и 25°C (“образец B”) соответственно. На сутки 0, сутки 17 и сутки 23 отбирали порцию каждого образца и разводили до конечной теоретической концентрации 400 мкг/мл 17-AAG. Чистоту и концентрацию 17-AAG в каждой порции измеряли посредством HPLC с обращенной фазой. Результаты представлены в таблице A.
Устойчивость композиции 17-AAG
17
23
10,97
10,39
96,93
96,89
17
23
10,88
10,19
96,28
96,10
Данные для длительной устойчивости композиций по данному изобретению представлены в таблице B.
Указанные выше результаты показывают, что композиции по данному изобретению устойчивы в течение периода по крайней мере трех недель или более даже при хранении при температуре окружающей среды (хотя рекомендовано хранение при охлаждении).
Указанное выше подробное описание изобретения содержит разделы, которые главным образом или полностью относятся к конкретным частям или аспектам изобретения. Следует понимать, что это представлено для ясности и удобства, что конкретный признак может относиться более чем к только тому разделу, в котором он описан, и что представленное здесь описание включает в себя все надлежащие сочетания информации, находящейся в различных разделах. Сходным образом, хотя различные представленные здесь фигуры и описания относятся к конкретным вариантам осуществления изобретения, следует понимать, что если конкретный признак описан в контексте конкретной фигуры или варианта осуществления, то такой признак также можно использовать, в соответствующей степени, в контексте другой фигуры или варианта осуществления, в сочетании с другим признаком или в изобретении в целом.
Все указанные в этом описании документы приведены здесь полностью в качестве ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ТАКСОИДОВ | 2011 |
|
RU2603833C2 |
| СУПЕРКРИТИЧЕСКИЙ ЖИДКИЙ ЭКСТРАКТ, СОДЕРЖАЩИЙ СЕРДЕЧНЫЙ ГЛИКОЗИД | 2006 |
|
RU2398591C2 |
| ПЕРОРАЛЬНЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ТАКСАНЫ, И СПОСОБЫ ЛЕЧЕНИЯ С ИХ ПРИМЕНЕНИЕМ | 1999 |
|
RU2236226C2 |
| СТАБИЛЬНЫЕ СОСТАВЫ ТЕСТОСТЕРОНА УНДЕКАНОАТА | 2015 |
|
RU2708238C2 |
| Фармацевтическая противоопухолевая композиция паклитаксела с гистоном Н1.3 в качестве носителя и способ получения композиции | 2017 |
|
RU2669937C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ, СПОСОБ ЛЕЧЕНИЯ НАРУШЕНИЙ, РАЗВИВАЮЩИХСЯ ВСЛЕДСТВИЕ НЕЙРОДЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ | 1992 |
|
RU2125448C1 |
| ПОЛУТВЕРДЫЕ СИСТЕМЫ, СОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ АЗЕТИДИНА | 2004 |
|
RU2343915C2 |
| ЛИОФИЛИЗИРОВАННЫЙ ПРЕПАРАТ ЦИТОТОКСИЧЕСКИХ ДИПЕПТИДОВ | 2012 |
|
RU2597154C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДОСТАВКИ ФАРМАКОЛОГИЧЕСКИХ АГЕНТОВ | 2009 |
|
RU2522977C2 |
| ЭМУЛЬГИРУЮЩИЕ СИСТЕМЫ, СОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ АЗЕТИДИНА | 2004 |
|
RU2348615C2 |
Изобретение относится к области фармацевтики и касается композиции в виде раствора, который содержит 17-AAG в количестве вплоть до 15 мг/мл, растворенный в носителе, содержащем (i) первый компонент, представляющий собой этанол, в количестве приблизительно от 40 до приблизительно 60 об.%; (ii) второй компонент, представляющий собой полиэтоксилированное касторовое масло, в количестве приблизительно от 15 до приблизительно 50 об.%; и (iii) третий компонент, выбранный из группы, которая состоит из пропиленгликоля, ПЭГ 300, ПЭГ 400, глицерина и их сочетаний, в количестве приблизительно от 20 до приблизительно 30 об.% Изобретение позволяет получать устойчивую фармацевтическую композицию в виде раствора, который при разбавлении водой для инъекций («WFI») является приемлемым для внутривенного введения. 3 н. и 21 з.п. ф-лы, 2 табл.
1. Фармацевтическая композиция в виде раствора, содержащая 17-AAG в количестве вплоть до 15 мг/мл, растворенный в носителе, который содержит (i) первый компонент, представляющий собой этанол, в количестве от 40 до 60 об.%; (ii) второй компонент, представляющий собой полиэтоксилированное касторовое масло, в количестве от 15 до 50 об.% и (iii) третий компонент, выбранный из группы, которая состоит из пропиленгликоля, ПЭГ 300, ПЭГ 400, глицерина и их сочетаний, в количестве от 20 до 30 об.%.
2. Фармацевтическая композиция в виде раствора по п.1, где второй компонент представляет собой кремофор EL.
3. Фармацевтическая композиция в виде раствора по п.1, где третий компонент представляет собой пропиленгликоль.
4. Фармацевтическая композиция в виде раствора по п.1, где носитель содержит первый компонент в количестве от 45 до 50 об.%, второй компонент в количестве от 20 до 30 об.% и третий компонент в количестве от 20 до 30 об.%
5. Фармацевтическая композиция в виде раствора по п.4, где второй компонент представляет собой кремофор EL, а третий компонент представляет собой пропиленгликоль.
6. Фармацевтическая композиция в виде раствора по п.1, где носитель содержит 50 об.% этанола, 20 об.% кремофора EL и 30 об.% пропиленгликоля.
7. Фармацевтическая композиция в виде раствора по п.4, где носитель содержит 45 об.% этанола, 28 об.% кремофора EL и 27 об.% пропиленгликоля.
8. Способ введения 17-AAG пациенту при необходимости этого, предусматривающий стадии:
(a) предоставление фармацевтической композиции в виде раствора, которая содержит 17-AAG в концентрации вплоть до 15 мг/мл, растворенный в носителе, содержащем (i) первый компонент, представляющий собой этанол, в количестве от 40 до 60 об.%; (ii) второй компонент, представляющий собой полиэтоксилированное касторовое масло, в количестве от 15 до 50 об.% и (iii) третий компонент, выбранный из группы, которая состоит из пропиленгликоля, ПЭГ 300, ПЭГ 400, глицерина и их сочетаний, в количестве от 20 до 30 об.%;
(b) разведение фармацевтической композиции в виде раствора со стадии (а) в воде для получения разбавленного раствора, содержащего вплоть до 3 мг/мл 17-AAG; и
(c) внутривенное введение пациенту разбавленного раствора со стадии (b).
9. Способ по п.8, где второй компонент представляет собой кремофор EL.
10. Способ по п.8, где третий компонент представляет собой пропиленгликоль.
11. Способ по п.8, где носитель содержит первый компонент в количестве от 45 до 50 об.%, второй компонент в количестве от 20 до 30 об.% и третий компонент в количестве от 20 до 30 об.%
12. Способ по п.11, где второй компонент представляет собой кремофор EL и третий компонент представляет собой пропиленгликоль.
13. Способ по п.8, где носитель содержит 50 об.% этанола, 20 об.% кремофора EL и 30 об.% пропиленгликоля.
14. Способ по п.8, где носитель содержит 45 об.% этанола, 28 об.% кремофора EL и 27 об.% пропиленгликоля.
15. Способ по п.8, где 17-AAG вводят в количестве от 4 до 4000 мг/м2.
16. Способ по п.8, где 17-AAG вводят еженедельно в количестве 450 мг/м2.
17. Способ по п.8, где 17-AAG вводят еженедельно в количестве 308 мг/м2.
18. Способ получения фармацевтической композиции в виде раствора, содержащего 17-AAG, предусматривающий стадии:
(a) предоставление количества 17-AAG в контейнере;
(b) сочетание 17-AAG со стадии (а) с количеством носителя, который содержит (i) первый компонент, представляющий собой этанол, в количестве от 40 до 60 об.%; (ii) второй компонент, представляющий собой полиэтоксилированное касторовое масло, в количестве от 15 до 50 об.% и (iii) третий компонент, выбранный из группы, которая состоит из пропиленгликоля, ПЭГ 300, ПЭГ 400, глицерина и их сочетаний, в количестве от 20 до 30 об.%;
(c) перемешивание смеси со стадии (b) до, по существу, полного растворения 17-AAG; и
(d) необязательно, фильтрование перемешанной смеси со стадии (с) для получения содержащего 17-AAG фармацевтической композиции в виде раствора;
где количество 17-AAG на стадии (а) и количество носителя на стадии (b) являются такими, что концентрация 17-AAG в фармацевтической композиции в виде раствора составляет вплоть до 15 мг/мл.
19. Способ по п.18, где второй компонент представляет собой кремофор EL.
20. Способ по п.18, где третий компонент представляет собой пропиленгликоль.
21. Способ по п.18, где носитель содержит первый компонент в количестве от 45 до 50 об.%, второй компонент в количестве от 20 до 30 об.% и третий компонент в количестве от 20 до 30 об.%.
22. Способ по п.21, где второй компонент представляет собой кремофор EL и третий компонент представляет собой пропиленгликоль.
23. Способ по п.18, где носитель содержит 50 об.% этанола, 20 об.% кремофора EL и 30 об.% пропиленгликоля.
24. Способ по п.18, где носитель содержит 45 об.% этанола, 28 об.% кремофора EL и 27 об.% пропиленгликоля.
| US 6682758 B1, 27.01.2004 | |||
| US 5925776 A, 20.07.1999 | |||
| Скреперная лебедка | 1933 |
|
SU37050A1 |
| US 2004058021 A1, 25.03.2004. | |||
Авторы
Даты
2010-02-27—Публикация
2005-05-06—Подача