Настоящее изобретение относится к фармацевтической композиции, предназначенной для лечения нейродегенеративных заболеваний и содержащей активные ингредиенты в концентрациях, адекватных соответствующему периоду действия и уровню этих ингредиентов как в крови, так и в головном мозге; а также к способу получения указанной композиции.
Известно, что моноаминоксидаза (МАО) является одним из главных ферментов метаболизма (Blaschko H. Pharmacol. Rev. 4, 415, (1951)) биогенных аминов, присутствующих в нервных клетках человека. Вследствие активности указанной оксидазы биогенные амины, играющие важную роль в нейротрансмиссии, разлагаются на неэффективные метаболиты. Установлено, что при некоторых заболеваниях уровень биогенных аминов в человеческом мозге снижается.
Агенты, ингибирующие фермент (ферменты) метаболизма, могут способствовать восстановлению нормального уровня этих аминов. По этой причине ингибиторы МАО использованы для лечения человека. В результате исследований установлено, что МАО-ингибирование может привести к серьезному побочному эффекту, связанному с потенцированием ("сырная реакция") тирамина (структурно-биогенного амина), который поступает в организм из пищи, что влечет за собой повышение кровяного давления и может привести к летальному исходу [Piackar и сотрудники, Psychopharmacolgy 73, 3087 (1981)].
МАО существует в двух формах: МАО-А и МАР-В. При селективном ингибировании B-формы A-форма способна разлагать тирамин, который представляет собой субстрат смешанного типа, в результате чего можно избежать появления опасного побочного эффекта. Такое ингибирование может быть осуществлено с использованием (-)-депренила [(-)N-(1-фенил-изопропил)-N-метил-пропиламин-гидрохлорид] , который селективно и необратимо ингибирует фермент МАО-B [Elsworth et al., Psychopharmacology 57, 33 (1978)]. Благодаря необратимому ингибированию восстановление ферментной активности может быть обусловлено повторным синтезом нового фермента.
Процесс необратимого ингибирования фермента протекает в две стадии. Первая стадия является обратимой, и лишь образование комплекса "второй фермент - ингибитор" становится необратимым. Половина периода регенерации фермента составляет 7-8 дней [Oreland et al., J. Neural. Transm. Suppl. 32, 55-59 (1990)].
Субстратная специфичность ферментов и селективность большинства известных ингибиторов описаны Достером и его коллегами [Medicinal Research Reviews, vol. 9, N 1, 45-89 (1989)]. Известно [Science 219, 979-980 (1980) и Burns Proc. Natl. Acao. Sci 80, 4546-550 (1983)], что MPTP (1-метил-4-фенил-1,2,3,6-тетрагидропиридин) вследствие своей нейротоксичной активности индуцирует синдром Паркинсона у человека и аналогичные симптомы, наблюдаемые у животных. MPTP вызывает селективное разрушение допаминергических нейронов полосатого тела. Гистологические изменения, возникающие при этом, аналогичны тем, которые наблюдаются при посмертном исследовании головного мозга больного, страдавшего болезнью Паркинсона. Известно, что это действие MPTP может быть предотвращено с помощью ингибиторов МАО, таких как депренил. Такая роль (-)-депренила обусловлена ингибированием превращения MPTP в MPP+ [Nature, 311, 467 (1984)]. MPTP-индуцированное разрушение нейронов может быть также замедлено с помощью ингибиторов поглощения допамина (Proc.Natl.Acad.Sci. USA, 82, 2175, 1985), таких как мазиндол, посредством ингибирования активного поглощения MPP+ (ион, метил-фенил-пиридинил) допаминергическими нейронами.
В процессе функционирования MAO образуются пероксид водорода и свободные радикалы кислорода, что приводит к окислительному разрушению нейронов, МАО, которую можно считать нейтротоксичным ферментом, может также образовывать аммиак и некоторые гетероциклические изохинолины [Maret et al., Drug metabolism. Review, 22, 292-332 (1990); P.Riederer et al., Acta Neurol. Scand. 126, 41 (1989); Renedetti and Dostert, Biochem. Pharm. Vol. 38, 555 (1989)].
Известно, что DSP-4[N-(2-хлорэтил)-N-этил-2-бромбензиламин], который является нейротоксическим агентом, индуцирует селективное истощение норадреналина (НА) из норадренергических нейронов центральной и периферической нервной системы [Grzanna et al., J. Histochem. Cytochem., 1435-1442, (1989)].
Известно также, что ингибиторы повторного поглощения, также как дезипрамин (10,11-Дигидро-N-метил-5-H-дибенз(6,7)-азепин-5-пропанамин), ингибируют НА- истощающее действие DSP-4 [Johnsson et al. , Neuroscience, 7, 2895 (1982); Ross Br. J. Pharmacol. 58, 521 (1976)], a MDL 72974A [(E)2 2-4-фтор-бетафторэтиленбензолбутамин], который является в высокой степени селективным ингибитором MAO-B, не обладает свойствами, блокирующими катохоламинергическое повторное поглощение, и не способен предупреждать DSP-4-индуцированную токсичность [Finnegan et al., Eru. J. of Pharmacol., 184, 119-126 (1990)].
(-)-Депренил не может рассматриваться как простой селективный необратимый ингибитор МАО-В. Он ингибирует поглощение допаминара, норадреналина и тирамина нервными окончаниями и периферическими ганглиями, но лишь в исключительно высоких дозах [Kholl Advances in Biochem. Psychopharmacology, vol. 5, 393 (1972)]. При этом помимо своего МАО-ингибирующего действия депренил обладает еще и способностью ингибировать поглощение.
Задачей настоящего изобретения является получение фармацевтической композиции, предназначенной для лечения нейродегенеративных заболеваний и обладающей оптимальными свойствами.
Установлено, что:
1) Продолжительное ингибирование МАО может быть достигнуто лишь при достаточно высокой концентрации (15-40 мП/мг ткани) ингибитора в головном мозге и крови. Однако, если концентрация ингибитора слишком высока (30 мг/день), то концентрация метаболитов также будет достаточно высокой, чтобы вызвать нежелательное психостимулирующее действие и/или привести к потере селективности ингибитора (будет также ингибироваться МАО-А).
2) Депренил и п-фтордепренил [N-(4-фторфенил)-изопропа-1-ил]-N-метилпропиниламин] обладают активностью как родительского (исходного) соединения, так и его метаболитов.
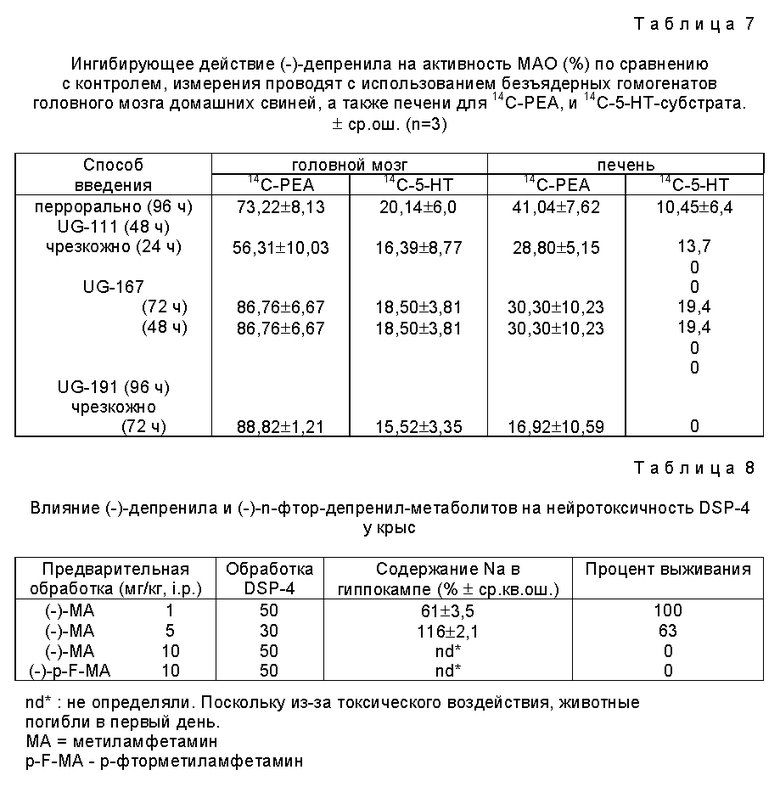
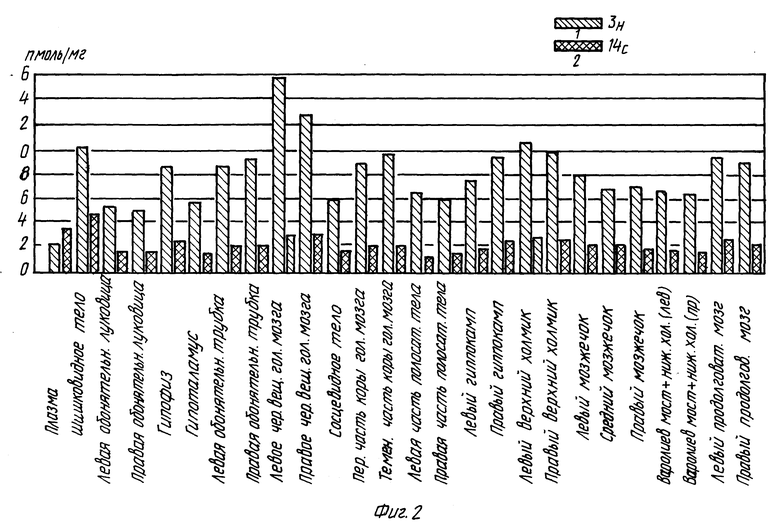
Результаты проиллюстрированы на фиг. 1 и 2.
После перрорального введения крысам меченных депренила и п-фтордепренила (кольцо-3H и пропаргил-14С) (1, 5, 10 мг/кг, соответственно) исследуют распределение соединений в 15 участках головного мозга (парные части головного мозга исследуют отдельно, т.е. всего было исследовано 25 участков головного мозга) и в плазме в течение 96 часов как функцию времени. Установлено, что неизменное соединение быстро абсорбируется (15 мин) и проникает в центральную нервную систему. Неизмененная молекула депренила показывает непродолжительное время пребывания в головном мозга, тогда как метаболиты обнаруживаются в тканях в течение более продолжительного периода времени.
Одновременное присутствие и равные количества двух меток наблюдались для неизмененной молекулы (эти данные относятся к молярным концентрациям, вычисленным для двух меток). Поскольку в проводимых экспериментах наблюдается быстрое изменение отношения 3H/14C в тканях, то можно сделать вывод о значительном образовании метаболитов (амфетамин, метиламфетамин, п-фторометаламфетамин и п-фтороамфетамин) и их присутствии в головном мозге.
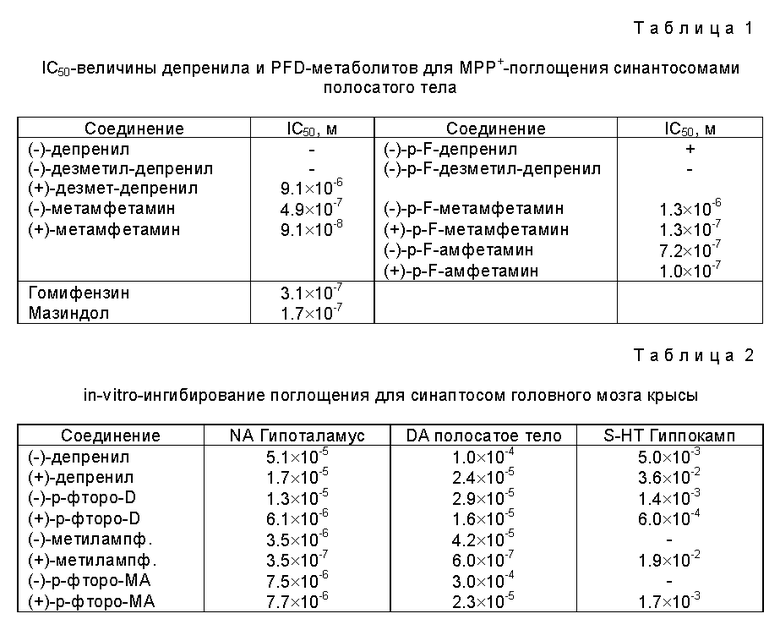
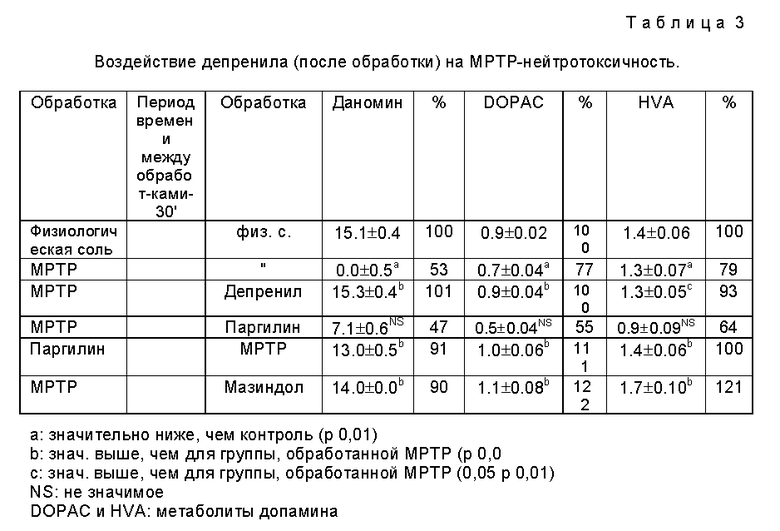
3) Потенциальные метаболиты депренила и п-фтордепренила (метиламфетамин, амфетамин и п-фторметиламфетамин, п-фторамфетамин соответственно) обладают значительной способностью к ингибированию поглощения и обладают способностью к in vivo-предупреждению МРТР-нейротоксичности, не обнаруживая при этом сколь-нибудь значительную степень ингибирования МАО. Результаты экспериментов представлены в таблицах 1, 2 и 3. Описанные испытания проводят по методу Heikilla [Nature, 311, 467-469 (1984)].
4) Потенциальные метаболиты депренила и п-фтордепренила (метиламфетамин, амфетамин и п-фторметаламфетамин, п-фторамфетамин соответственно) обладают способностью к in vivo-предупреждению (в дозах 1-5 мг/кг, i.p.) DSP-4-индуцированной нейротоксичности без ингибирования МАО.
Полученные результаты представлены в таблице 8.
Испытания проводят по методу Finnegan [Finnegan et al., Eur.J.Pharmacol. , 184, 119-126 (1990)].
Метаболиты, используемые в высокой концентрации in vivo (10 мг/кг; i.p. ), способствуют снижению токсического действия DSP-4, приводящего к гибели животных.
5) Таким образом, для предупреждения нейротоксичности либо посредством соответствующей высокой концентрации неизменного соединения, присутствующего в непродолжительный период времени (т. е. концентрации, необходимой для полного необратимого ингибирования МАО-B), либо посредством необратимого ингибирования поглощения необходимо присутствие метаболитов в течение длительного периода времени.
При этом максимальный эффект достигается при выполнении обоих указанных условий.
Таким образом, составленная задача достигается новыми двухфазными фармацевтическими композициями, которые в качестве активного ингредиента содержат соединение, обладающее МАО-ингибирующим действием, и соединение, обладающее действием, ингибирующим поглощение, в сочетании со стандартными вспомогательными материалами.
Композиции настоящего изобретения в качестве активного ингредиента содержат 5-95 мас.% обратимого или необратимого ингибитора МАО; 5-95 мас.% ингибитора поглощения предпочтительно с активностью в течение продолжительного периода времени в отношении 1-19 : 1-19, предпочтительно в отношении 1:1, 1: 2, или 1:3.
Указанная композиция может быть введена в дозе 5-20, а предпочтительно 10, мг/день в зависимости от состояния пациента, тяжести клинической картины заболевания и от индивидуальной восприимчивости пациента.
Поскольку ингибитор поглощения не обладает продолжительной активностью, то этот ингибитор предпочтительно использовать в лекарственной форме с пролонгированным высвобождением.
В качестве ингибитора МАО предпочтительно использовать депренид, п-фтордепренил, их соли и оптически активные изомеры соответственно.
В качестве ингибиторов поглощения могут быть использованы предпочтительно депренил, п-фтордепренил или соединение общей формулы I: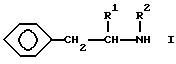
где R1 представляет собой прямую или разветвленную C1-C8-алкильную группу, C7-C10-фенилалкильную группу или фенильную группу, C3-C8-циклоалкильную группу;
R2 представляет собой прямую или разветвленную C1-C8-алкильную группу или C1-C8-алкильную группу, замещенную атомом галогена, гидрокси-C1-C4-алкокси-группой или одной или двумя фенильными группами; фенильную группу или C3-C8-циклоалкильную группу при условии, что R1 и R2 вместе содержат по крайней мере 3 атома углерода,
либо его кислые аддитивные соли, или метаболиты.
В качестве соединения формулы I предпочтительно использовать N-пропил-1-фенил-2-пентиламин или его кислую аддитивную соль; N-пропил-1-фенил-2-бутиламин или его кислую аддитивную соль; или N-пропил-1-фенил-2-гексиламин или его кислую аддитивную соль.
Двухфазные композиции настоящего изобретения получают известными методами в виде шариков; таблеток; покрытых таблеток; композиций для чрезкожного введения; драже; суспензий, содержащих микрокапсулы; капсул; покрытых капсул; суспензий для перрорального введения; суспензий для инъекций с использованием известных дополнительных веществ.
В качестве таких дополнительных веществ могут быть использованы предпочтительно следующие материалы:
a) в качестве наполнителей сахароза, лактоза, маннит, крахмал, крахмал-тальк-сахароза, кальцийфосфат, гидроспиртовой раствор поливидона (полдивинилпирролидон) и т.п.,
b) добавки, замедляющие действие,
- лиофильное основание (стеариновая кислота, пальмитат стеариновой кислоты, глицерин-дитрипальмит-стеарат и т.п.);
- другие добавки, обычно используемые в фармацевтической практике; производные Eudragit и т.п.,
- производные целлюлозы: HPMC, CMC, EC и их соли.
c) гранулирующие жидкости: вода, этанол, этанол - вода, изопропанол, изопропанол - вода,
d) связующие вещества: PVP/VA, Eudragit-производные, производные целлюлозы и их соли.
Фармацевтическая композиция может быть получена in situ, то есть так, чтобы пациент одновременно получал лечение соответствующей дозой ингибитора МАО, необходимой для достижения непрерывного 98%-ного ингибирования МАО, и соответствующей дозой ингибитора поглощения, необходимой для достижения непрерывного ингибирования поглощения.
Получение депренила, п-фтордепренила и соединений общей формулы I приводится в описаниях к патенту США N 4564706, европатенту N 186880 и патенту Португалии 85799.
Примеры
1) Двухфазные таблетки получают известным методом.
Композиция:
Дисперсная фаза: (полученная путем двойного гранулирования)
a) Депренил - 5 мг
Метоцел к 4М (высш. сорт) - 50 мг
Лактоза - 20 мг
Достаточное количество изопропанола для получения гранул;
b) Депренил - 10 мг
Крахмал кукурузный - 40 мг
Авицел PH-101 - 20 мг
PVP K-25 - 10 мг
Достаточное количество изопропанола для получения гранул (может быть также использована дистиллированная вода).
Непрерывная фаза:
Стеарат магния - 8 мг
Тальк - 15 мг
Аэросил-200 - 2 мг
2) Получение таблеток с пролонгированным действием, содержащих 15 мг депренила
Компоненты:
Депренил - 15 мг
Стеариновая кислота - 30 мг
Едрагит (Eudragit) RSPM - 45 мг
Коллидон (Collidon) VA-64 - 47 мг
Карбопол 940 - 35 мг
Стеротекс (Sterotex) - 25 мг
Стеарат магния - 3 мг
Диаметр таблеток 8 мм - 220 мг
Технология изготовления таблеток.
1. Гранулы получают методом сухого гранулирования, хорошо известным по существу.
Подмешивание порошков проводят в следующем порядке: Коллидон VA-64, Карбопол 940, стеариновая кислота, Стеротекс (измельченный) (гидрогенезированное хлопковое масло), Едрагит (Eudragit) RSPM (сополимер сложных эфиров акриловой и метакриловой кислоты), депренил.
2. Изготовление таблеток из порошковой смеси осуществляют на эксцентриковой таблетировочной машине с низким числом оборотов в минуту.
Результаты теста на растворение. Проведены три параллельных измерения. Одна ячейка содержит 15 таблеток.
a) 316,5 сг (сантиграмм)/15 штук
b) 316,0 сг/15 штук
c) 319,0 сг/15 штук
В качестве среды для растворения используют искусственный желудочный сок без пепсина (Ph. Hg. 11).
Разведение = 0
d = 1 см
λ = 256 мм
Результаты:
Время (минуты) - Растворенное активное вещество (%)
10 - 4,5
15 - 9,0
30 - 21,0
60 - 31,2
90 - 47,7
120 - 39,3
150 - 41,1
180 - 48,6
240 - 51,9
300 - 63,0
360 - 69,0
420 (7 часов) - 75,6
3) Получают двухфазные гранулы "быстрого" и "медленного" действия со следующим составом:
Гранулы быстрого действия
- Нейральные гранулы (сахарные сферы) 61,1 мг
- Депренил 16,3 мг
- Лактоза 16,6 мг
- Поливидон (K30) 6,3 мг
Гранулы медленного действия
- Нейтральные гранулы (сахарные сферы) 44,6 мг
- Депренил 11,9 мг
- Лактоза 11,9 мг
- Поливидон (КЗО) 4,6 мг
- Этилцеллюлоза около 8,4 мг
- Тальк около 16,9 мг
- Касторовое масло около 1,7 мг
Способ изготовления.
Кристаллы сахарозы покрывают смесью крахмала и сахарозы и гидроспиртовым раствором поливидона и сахарозы (сахарные сферы).
Смесь гидрохлорида депренила и лактозы наносят на микрогранулы с использованием спиртового раствора поливидона.
В случае получения гранул "замедленного" действия на основе микрогранул используют спиртовой лак из этилцеллюлозы (пластифицированный кастровым маслом) и тальк.
Для получения нужных гранул "быстрого и медленного" действия, необходимое количество гранул "быстрого" и "медленного" действия смешивают в капсуле способом, известным per se.
4) Получение двухфазной композиции для чрезкожного введения (UG-191).
Компоненты
Карбовакс 35000 - 1,0
Карбовакс 4000 - 16,0
Карбовакс 400 - 53,0
1,2-пропиленгликоль - 2,0
Ксантановая камедь - 15,0
Депренил - 7,0
Кремофор (Cremophor EL) - 6,0
Всего - 100,0
Компоненты карбовакса расплавляют, их смесь выливают в сосуд с мешалкой типа Erweka при 50oC и размешивают на стадии 6. Депренил растворяют и суспендируют в смеси пропиленгликоля и Кремофора EL при 50oC, после чего полученную смесь порциями (по 5 г каждая) добавляют в сосуд со смесителем. После добавления каждой порции смесь размешивают в течение 1 минуты. И, наконец, после повышения скорости (до отметки 9) добавляют ксантановую камедь порциямии по 5 г каждая.
После добавления каждой порции смесь размешивают в течение 1 минуты. Затем скорость размешивания снижают до отметки 3,5 и продолжают размешивание до тех пор, пока смесь не охладится (прибл. 1,5 часа). Содержание активного вещества составляет 6,84%, а стабильность композиции соответствует требуемому уровню.
Жидкокристаллическое состояние: 100%, полупрозрачные твердые кристаллы 8-10 мкм (Кремофор EL: глицерин-полиэтиленгликоль-рицинолеат. Ксантановая камедь: полисахарид).
Фармакологические данные.
При планировании экспериментальных условий учитывают следующие факторы:
непосредственные in vivo-измерения поглощение-ингибирующей способности метаболитов являются невозможными из-за их обратимой природы,
способность к ингибированию MAO-B может быть косвенно измерена для свиней с использованием активности MAO-B тромбоцитов в качестве индикатора (тромбоциты, полученные от других видов, не содержат легко измеряемой активности MAO-B-фермента),
измерения нейротоксичности DSP-4 в зависимости от времени (с использованием содержания норадреналина в гиппокампе в качестве индикатора), проведенные для крыс после их предварительной обработки различными дозами депренила, позволяют проиллюстрировать корреляцию между отсутствием нейротоксичности DSP-4 и адекватным, но не слишком высоким уровнем в крови метаболитов депренила.
В серии экспериментов с использованием аналитической техники измеряют постоянный уровень метаболитов депренила в крови домашних свиней, а также определяют MAO-активность тромбоцитов, головного мозга и печени (табл. 1 - 3).
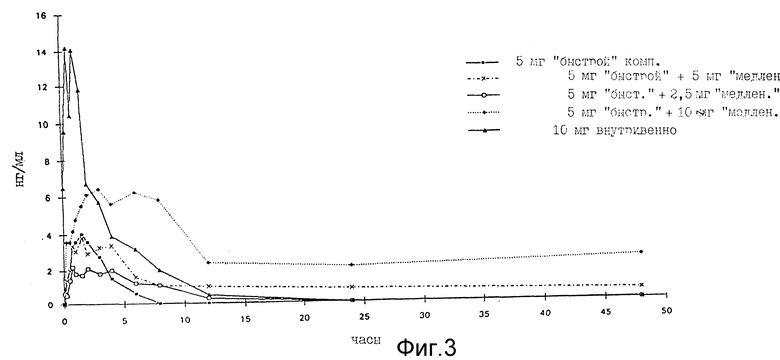
Эксперименты проводят на самках домашних свиней (мелких белых) весом 20-25 кг. Во время экспериментов свиней помещают в отдельные клетки и дают ту же самую пищу, которую они потребляют до этого.
Животным перрорально вводят 5; 7,5; 10; 15 мг (-)-депренила в таблетках и 10 мг внутривенно. Пробы крови (5 мл) берут через 0; 0.08; 0,25; 0.5; 0,75; 1; 1,5; 2; 3; 4; 6; 12; 24 и 48 часов, помещают в центрифужные пробирки, содержащие 500 МЕ гепарина, для проведения аналитических измерений. Эти пробы центрифугируют 10 минут при 1500 об/мин для отделения плазмы. Оценку метаболитов осуществляют методом газовой хроматографии (ГХ) с использованием газового хроматографа Hp-5890 (время элюции для метиламфетамина составляет 21,4 мин).
Результаты анализа представлены на фиг. 3.
Ингибирование нейротоксичности DSP-4 измеряют на крысах. Обработку крыс проводят по схеме Finnegan [Finnegan et al., Eur, J. Pharmacol., 184, 119-126 (1990)].
Для этого используют самцов крыс линии Wistar весом 170-200 г. Животных помещают в клетки (по 6 особей на клетку), в которых поддерживают постоянную температуру (22oC) и которые освещают 12 час в день. Пищу и воду дают по желанию. Крысам предварительно вводят (перрорально) 3 мг/кг композиции примера 3 (1 мг/кг "быстрой" комп. (F) + 2 мг/кг "замедленной" комп. (S)), после чего через 1, 2, 4 и 8 часов животным вводят (внутрибрюшинно) DSP-4 (50 мг/кг).
Перед предварительной обработкой (-)-депренилом животных выдерживают на голодной диете в течение 24 часов. Затем у крыс удаляют гиппокамп и с помощью ВЭЖХ определяют содержание в нем норадреналина.
Результаты измерений представлены на фиг. 4.
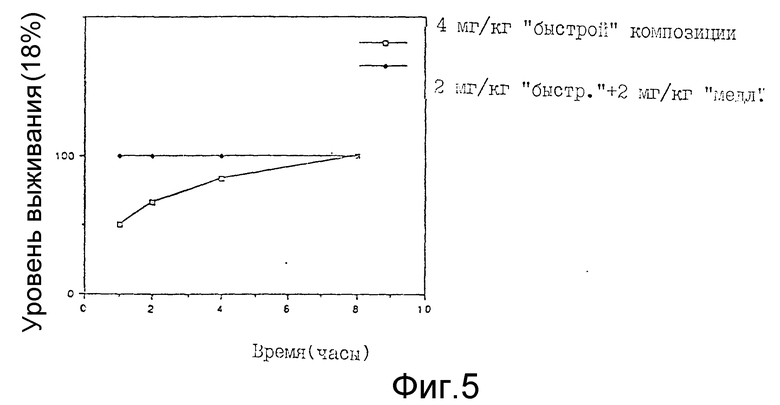
Как видно из фиг. 4, доза депренила 3 мг/кг (p.o.) способна подавлять нейротоксичность 50 мг/кг DSP-4, введенного крысам внутрибрюшинно. В случае контрольной ("быстрой") композиции такое ингибирование в первый период времени достигает высокого уровня (86,1%), но затем оно экспоненциально убывает и через 8 часов падает до уровня DSP-4-обработанного контроля (19,6%). Заявленная композиция достигает уровня ингибирования 58,8%, т.е. уровня, являющегося практически идентичным (54,5%) уровню, который дает контрольная композиция через два часа (51,5%), однако в последующий период времени уровень заявленной композиции значительно превышает (43,31%) уровень контрольной композиции (16%) и остается практически неизменным в течение 8 часов. В случае использования дозы депренила, составляющей 4 мг/кг, обнаружено, что контрольная ("быстрая") композиция стимулирует нейротоксичность DSP-4 в зависимости от времени в противоположность заявленной ("быстрой и замедленной") композиции (см. фиг. 5). Это означает, что дозу "быстрого" компонента нельзя увеличивать беспредельно, не вызывая при этом нежелательные побочные эффекты.
И, напротив, при использовании в заявленной композиции повышенного количества "замедляющего" компонента наблюдается увеличение уровня ингибирования MAO-A, что свидетельствует о снижении селективности депренила.
Результаты эксперимента представлены в таблице 4.
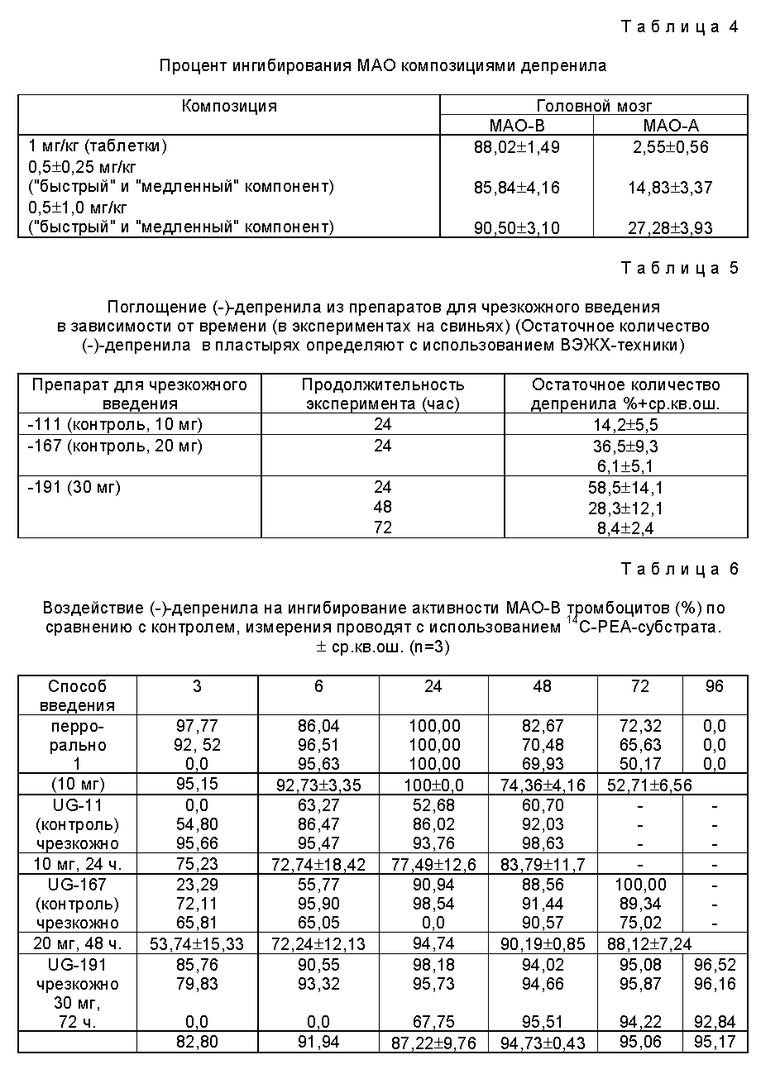
При испытании препаратов для чрезкожного введения контрольной группе перрорально вводят 10 мг (-)-депренила в желатиновой капсуле (см. табл. 5).
Для определения активности MAO-B через 0, 3, 6, 24, 48, 72 и 96 часов берут пробы крови. Через 96 часов после взятия проб крови свиней забивают и определяют активность MAO-B и MAO-A в иссеченном мозге свиней.
Вторую группу, используемую в качестве контрольной, обрабатывают препаратом для чрезкожного введения UG-111, содержащим 10 мг (-)-депренила. Пробы крови берут через 0, 3, 6, 24 и 48 часов. Через 24 часа чрезкожные препараты удаляют. Для определения остаточного содержания (-)-депренила в препаратах используют пластырь и его найлоновое покрытие. Кожу протирают хлопчатобумажной ватой, смоченной в этаноле, которую также используют для ВЭЖХ-анализа. Через 48 часов свиней забивают и определяют активность MAO-A и MAO-B в их мозге.
Третью группу свиней, также используемую в качестве контрольной, обрабатывают препаратом UG-167, содержащим 20 мг (-)-депренила. Образцы крови берут через 0, 3, 6, 24, 48 и 72 часа. Через 48 часов пластыри удаляют и осуществляют процедуру, аналогичную той, которую проводят для второй группы.
Четвертую группу свиней обрабатывают препаратом UG-191, содержащим 30 мг (-)-депренила. Образцы крови берут через 0, 3, 6, 24, 72 и 96 часов. Через 48 часов пластыри удаляют и повторяют процедуру, описанную выше для второй группы.
Кровь берут из черепной полости 20-миллиметровым пластиковым шприцем, содержащим 1,5 мл 7,6%-ного раствора Na-цитрата. Объем взятой крови (для каждого отбора пробы) составляет 18,5 мл.
Активность MAO определяют радиометрически в соответствии с методами Wurtman и Axelrod [Biochem, Pharmacol. 12, 1414-19 (1963)], слегка модифицированными K. Magyar (b: Monoamine Oxidases and their Selective Inhibition. Ed.: K.Magyar, Pergamon Press, Akademial Kiado, Budapest, 11-21 (1980)).
Для получения препаратов тромбоцитов используют метод, описанный Willberg Oreland (Med.Biol., 54; 137-44; 1976).
Результаты ингибирования активности MAO-B тромбоцитов после перрорального и чрезкожного введения показаны в таблице 6.
Результаты определения активности MAO в головном мозге представлены в таблице 7.
Различные контрольные препараты имеют следующие составы, размеры частиц и процентное содержание жидкокристаллической фазы:
UG-111
ПЭГ 4000 - 16,0 г
ПЭГ 400 - 60,0 г
Пропиленгликоль - 8,0 г
Кремофор El - 2,0 г
Депренил HCl - 5,0 г
ПЭГ 400 ad - 100,0 г
Средний размер частиц: 72,7 мкм, жидкокристаллическая фаза: 20%.
UG-167
ПЭГ 4000 - 19,0 г
ПЭГ 400 - 55,0 г
Пропиленгликоль - 8,0 г
Ксантановая камедь - 10,0 г
Депренил HCl - 5,0 г
ПЭг 400 ad - 100,0 г
Средний размер частиц: 91-109 мкм, жидкокристаллическая фаза: 70-80%.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛИПОСОМНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СЕЛЕГИЛИН, СПОСОБ ЕЕ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ МАО-ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ | 1995 |
|
RU2159106C2 |
| ТРАНСДЕРМАЛЬНАЯ БЕЗВОДНАЯ КОМПОЗИЦИЯ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И НАНЕСЕНИЯ | 1992 |
|
RU2088617C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕНИЛАЛКИЛАМИНОВ ИЛИ СОЛЕЙ ЭТИХ СОЕДИНЕНИЙ | 1990 |
|
RU2015960C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕНИЛАЛКИЛАМИНОВ ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1989 |
|
RU2007384C1 |
| ПРОИЗВОДНЫЕ 3,6-ДИЗАМЕЩЕННОГО 1,2,4,5-ТЕТРАЗИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ЛАРВИЦИДНО- И ОВИЦИДНО-АКТИВНАЯ КОМПОЗИЦИЯ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ УМЕНЬШЕНИЯ КОЛИЧЕСТВА ЛИЧИНОК И ЯИЦ КЛЕЩЕЙ | 1994 |
|
RU2142949C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПРОПАРГИЛАММОНИЙХЛОРИДА | 1994 |
|
RU2130450C1 |
| КЛАТРАТ 7-ИЗОПРОПОКСИИЗОФЛАВОНА И ЦИКЛОДЕКСТРИНОВОГО ПОЛИМЕРА, ПРОЯВЛЯЮЩИЙ АКТИВНОСТЬ ПРОТИВ ОСТЕОПОРОЗА И ОСТЕОМАЛЯЦИИ | 1987 |
|
RU2022970C1 |
| АНТИМИКРОБНАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2030913C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ХИНОЛИНКАРБОНОВЫХ КИСЛОТ | 1988 |
|
RU2014331C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ХИНОЛИНКАРБОНОВЫХ КИСЛОТ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1988 |
|
RU2049783C1 |

Изобретение относится к медицине, в частности к двухфазным фармацевтическим композиция для лечения нейродегенеративных заболеваний. Изобретение заключается в том, что двухфазная композиция содержит ингибитор МАО и ингибитор поглощения в качестве активного вещества в сочетании с обычными фармацевтически приемлемыми добавками. Указанные компоненты могут быть использованы для лечения нейродегенеративных заболеваний. В этих композициях в качестве активного компонента, т.е. ингибитора МАО и ингибитора поглощения, могут быть использованы N-(1-фенилизопропил)-N-метилпропиниламин или N-(4-фторфенил)- изопроп-1-ил-1-метилпропиниамин, либо их соли, оптически активные изомеры или метаболиты. Изобретение относится к способам получения фармацевтической композиции, а также к способу лечения клинических нарушений, развивающихся вследствие нейродегенеративных процессов. Изобретение обеспечивает получение фармацевтической композиции для лечения нейродегенеративных заболеваний, обладающей оптимальными свойствами с пролонгированным высвобождением. 3 с. и 14 з.п. ф-лы, 8 табл., 5 ил.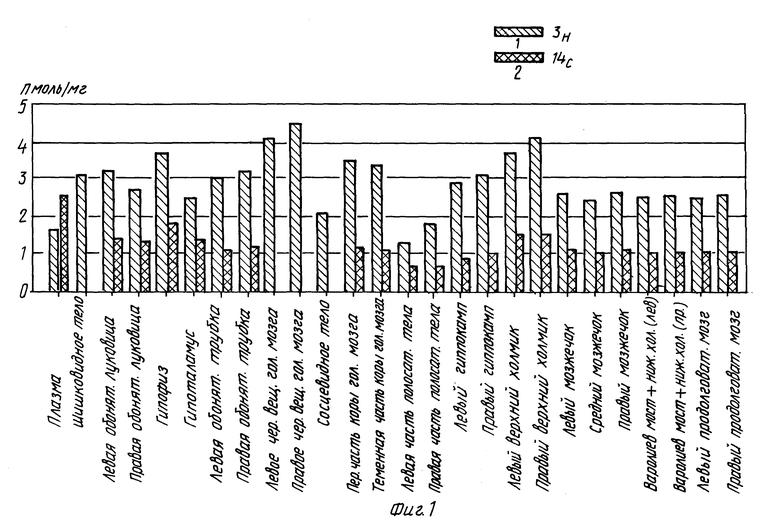
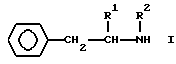
где R1 представляет собой прямую или разветвленную C1 - С18-алкильную группу, C7 - С10-фенилалкильную группу, или фенилгруппу, или C3 - С8-циклоалкильную группу;
R2 представляет собой прямую или разветвленную C1 - С8-алкильную группу или C1 - С8-алкильную группу, замещенную атомом галогена, гидроксигруппой, C1 - С4-алкоксигруппой, либо одной или двумя фенильными группами, фенильную группу или C3 - С8-циклоалкильную группу, при условии, что R1 и R2 вместе содержат по крайней мере 3 атома углерода,
или его кислые аддитивные соли, или метаболиты.
Приоритеты по пунктам:
20.12.91 по пп.1 - 3, 6 - 17;
08.12.92 по пп.4 и 5.
| US 4960797 A, 02.10.90. |
Авторы
Даты
1999-01-27—Публикация
1992-12-18—Подача