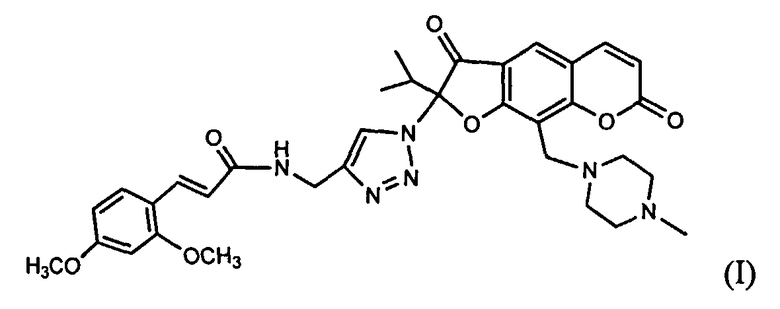
Изобретение относится к новому химическому соединению, конкретно - к (Е)-2-(4-{[3-(2,4-диметоксифенил)акриламидо]метил}-1Н-1,2,3-триазол-1-ил)-2-изопропил-9-(4-метилпиперазин-1-ил)-3,7-диоксо-3,7-дигидро-2H-фуро[3,2-g]хромену формулы (I)
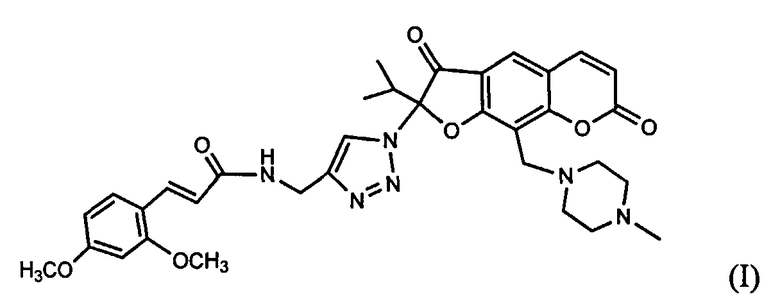
обладающему анальгетической активностью.
Указанные свойства позволяют предполагать возможность использования соединения в медицине в качестве фармацевтического препарата.
Несмотря на наличие большой группы веществ, обладающих анальгетической активностью, изыскание новых соединений подобного действия не ослабевает. Это связано с рядом побочных эффектов, характерных для известных анальгетиков (психическая зависимость, нарушение аккомодации и т.д.). Анализ литературных данных показывает, что синтез и фармакологические испытания новых химических соединений, отличающихся от существующих особенностью и избирательностью действия, избирательностью связывания с определенным типом опиатных рецепторов, пролонгированностью эффекта и отсутствием побочных явлений является актуальной задачей.
Линейные фурокумарины (псоралены) находят применение в PUVA (псорален + УФ-облучение) терапии для лечения аутоиммунных или гипер-пролиферативных кожных заболеваний, включая псориаз и витилиго [Santana, L; Urierte, E.; Roleira, F.; Milhazes, N., Borges F. Furocoumarins in Medicinal Chemistry. Synthesis, Natural Occurrence and Biological Activity. Curr. Med. Chem. 2004, 77,3239-3261; Wu, L.; Wang, X.; Xu, W.; Farzaneh, F.; Xu, R. The structure and pharmacological functions ofcoumarins and their derivatives. Curr. Med. Chem. 2009, 16, 4236-4260]. В последние два десятилетия найдены новые потенциальные терапевтические приложения фурокумаринов. Например, природные фурокумарины бергаптен императорин и изоимператорин [Chen, Y.-F.; Tsai, H.-Y.; Wu, T.-S. Anti-inflammatory and analgesic activities from roots of Angelica pubescens. Planta Med. 1995, 61,2-8], а также содержащие их экстракты [Singh D., Singh В., Goel R.K. Traditional Uses, Phytochemistry and Pharmacology of Ficus religiosa: A review. J. Ethnopharmacol., 2011, 134 565-583; Koriem K.M.M., Asaad G.F., Megahed H.A., Zahran H., Arbid M.S. Evaluation of Antihyperlipedemic, Anti-inflammatory, Analgesic, And Antipyretic Activities of Ethenolic Extract of Ammi Majus Seeds in Albino Rats And Mice, Internat. J. Toxicol., 2012, 31 (3) 294-300] обладают анальгетической активностью in vivo на различных моделях боли (горячая пластинка, уксусные корчи, отведение хвоста). Механизм снятия болевой реакции кумаринами не изучен. Исследование механизмов анальгетической активности свидетельствует о том, что обезболивающий эффект природных и синтетических кумаринов коррелирует с ингибированием нейтрофильной мигрени, цитокинового релиза и продукцией простагландина PGEz [Keri R.S., Hosamani K.M., Shingalapur R.V., Hugar M.H. Analgesic, Anti-pyretic and DNA Cleavage Studies of Novel Pyrimidine Derivatives of Coumarin Moiety. Eur. J. Med. Chem., 2010, 45, 2597-2605; Oliveira de Lima F., Nanato F.R., Couto R.D., Barbosa F.J.M., Nunes X.P., Ribeiro S.R., Scares M.B.P., Villarreal C.F. Mechanisms Involved in the Antinociceptive Effects of 7-Hydroxycoumarin. J. Nat. Prod., 2011, 74, 4, 596-602; Sandhya В., Giles D., Mathev V., Basavarajaswamy G., Abraham R. Synthesis, Phaermacological Evaluation and Doking Studies of Coumarin Derivatives. Eur. J. Med. Chem., 2011, 46, 4696-4701]. N-Замещенные 3-арилакрилоиламиды запатентованы в качестве агентов для лечения ревматоидного артрита и нейрологических нарушений [Патент WO 2005072731. Busch, В.; Johnson, A.T.; Martin, R.; Mohan, R.; Stevens, W.C.]. Арилакриламидозамещенные 1,2,3-триазолы также обладают нейропротекторной активностью [Jiaranaikulwanitch J., Govitrapong P., Fokin V.V., Vajragupta O. From BACE1 Inhibitor to Multifunctionality of Tryptoline and Tryptamine Triazole Derivatives for Alzheimer′s Disease]. Как видно, сочетание в молекуле нескольких фармакофорных фрагментов позволяет получить соединения с расширенным спектром биологического действия (обезболивающей и нейротропной активностью).
Задачей предлагаемого изобретения является разработка нового анальгетического агента на основе доступных соединений: растительного фурокумарина пеуцеданина (II), N-метилпиперазина и (E)-3-(3,5-диметоксифенил)акриловой кислоты.
Поставленная задача решается новым химическим соединением (E)-2-(4-{[3-(2,4-диметоксифенил)акриламидо]метил}-1H-1,2,3-триазол-1-ил)-2-изопропил-9-(4-метилпи-перазин-1-ил)-3,7-диоксо-3,7-дигидро-2H-фуро[3,2-g]хроменом формулы (I), проявляющим выраженную анальгетическую активность
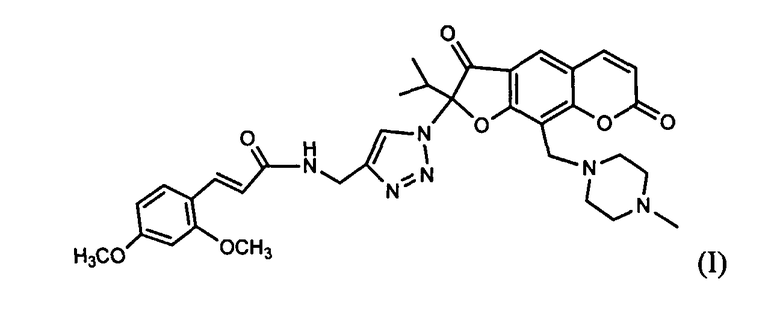
Аналогом по структуре заявляемого соединения является фурокумарин пеуцеданин формулы (II), обладающий противоопухолевой активностью и индуцирующий апоптоз опухолевых клеток человека [Bartnik, M.; Glowniak, К.; Jakubowicz-Gil, J.; Pawlikowska-Pawlega, В.; Gawron, A. Effect of peucedanin and bergapten (5-MOP), furanocoumarins isolated from Peucedanum tauricum Bieb. (Apiaceae) fruits, on apoptosis induction and heat-shock protein expression in HeLa cells. Herba Polomca, 2006, 52(4), 71-78]. Это соединение явилось также исходным веществом для получения анальгетического агента (I). Соединение (II) выделяли экстракцией корней горичника Морисона [Э.Э. Шульц, Т.Н. Петрова, М.М. Шакиров, Е.И. Черняк, Л.М. Покровский, С.А. Нехорошев, Г.А. Толстиков. Кумарины корней горичника Морисона (Peucedanum morisonii Bess.). Химия в интересах устойчивого развития. 2003. Т.11. С.683-688]. Указанное растение широко представлено во флоре Сибири; содержание соединения (II) в корнях горичника Морисона достигает 4% от веса воздушно-сухого сырья. Пеуцеданин легко выделяется из растительного сырья экстракцией органическим растворителем и последующей перекристаллизацией. Таким образом, пеуцеданин (II) является весьма доступным соединением для получения на его основе различных фармакологически ценных производных.
Аналогом по свойствам заявляемого соединения является нестероидный противовоспалительный препарат диклофенак-натрий (ортофен, вольтарен) (III). Основным недостатком фармакологического эффекта указанного препарата является ульцерогенный эффект [М.Д. Машковский. Лекарства XX века. M.: Новая волна. 319 с.].

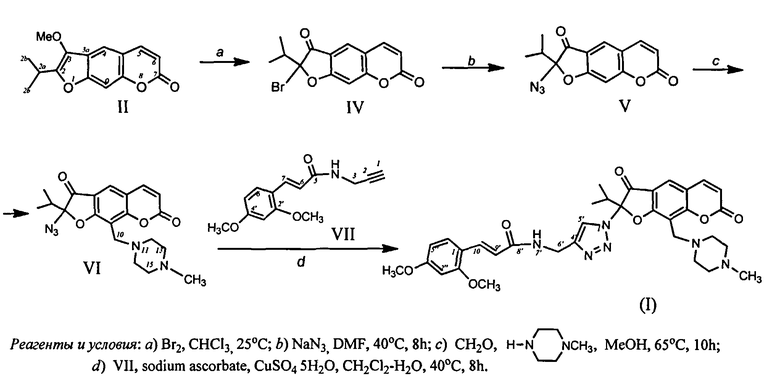
Способ получения соединения (I) из пеуцеданина (II) реализуется по приведенной схеме 1. Бромирование пеуцеданина (II) N-бромсукцинимидом или бромом в хлороформе приводит к 2-бромореозелону (IV) (выход 92%) [С.А. Осадчий, Э.Э. Шульц, М.М. Шакиров, Г.А. Толстиков. Исследование растительных кумаринов. Сообщение 1. Некоторые превращения пеуцеданина. Известия АН. Серия химическая. 2006. №2. С.362-366]. При взаимодействии 2-бромореозелона (IV) с азидом натрия образуется 2-азидоореозелон (V) (выход 81%) [А.В. Липеева, Э.Э. Шульц, Е.А. Махнева, М.М. Шакиров, Г.А. Толстиков. Исследование растительных кумаринов. XII. Синтез 2-(1,2,3-триазолил)модифицированных фурокумаринов. Химия гетероциклических соединений. 2013. №4. С.591-601]. Аминометилирование фурокумарина (V) действием N-метилпиперазина и формалина при кипячении в метаноле приводит к 2-азидо-9-(4-метилпиперазин-1-ил)ореозелону (VI) (выход 65%). При взаимодействии азида (VI) с терминальным алкином (VII) в условиях катализируемой сульфатом меди реакции 1,3-диполярного циклоприсоединения селективно образуется (E)-2-(4-{[3-(2,4-диметоксифенил)акриламидо]метил}-1Н-1,2,3-триазол-1-ил)-2-изопропил-9-(4-метилпиперазин-1-ил)-3,7-диоксо-3,7-дигидро-2H-фуро[3,2-g]хромен (I) в виде желтого кристаллического вещества (выход 70%). Общий выход агента (I) на исходный растительный метаболит пеуцеданин составляет 34%. (E)-3-[2,4-Диметоксифенил-N-(проп-2-инил)]акриламид (VII) также является новым соединением. Его получали при конденсации (E)-3-(2,4-диметоксифенил)акриловой кислоты с пропаргиламином в присутствии N-гидроксибензотриазола и N,N-диизопропилкарбодиимида (выход 90%).
Достоинством изобретения является способ получения соединения (I) путем химической модификации доступного растительного кумарина пеуцеданина (II). Физико-химические константы новых, впервые полученных соединений (VI, VII, I) приведены в примерах 1-3.
Биологическая активность соединения (I) изучалась путем определения токсичности, и анальгетической активности в тесте «уксусные корчи».
3. Острую токсичность определяли на беспородных мышах массой 18-23 г при однократном внутрижелудочном способе введения. Параметры токсичности рассчитывали по методу Кербера. Установлено, что LD50 соединения (I) превышает максимально возможную для разового введения дозу 3000 мг/кг. Соединение относится к 3-ему классу умеренно токсичных соединений. LD50 препарата сравнения диклофенака-натрия (III) составляет 350 мг/кг [A.M. Чернух, Воспаление, Медицина, М., 1979,448 с.].
Анальгетическая активность соединения (I) изучалась на модели висцеральной боли «уксусные корчи» путем однократного введения в дозах 50 и 10 мг/кг. «Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0.1 мл на одно животное. Оценка активности осуществлялась по количеству корчей в течение 3 мин. Обезболивающее действие соединения сравнивали с активностью исходного соединения пеуцеданина (II) и активностью агента сравнения (III), введенных в дозе 50 мг/кг. Результаты представлены в таблице 1. Из данных таблицы видно, что соединение (I) на модели болевой реакции, вызванной введением химического раздражителя, достоверно уменьшает болевую реакцию и в 4-6 раз снижает количество корчей при введении в дозах 50 и 10 мг/кг. Таким образом, соединение обладает выраженной анальгетической активностью. Его активность в дозе 10 мг/кг аналогична активности диклофенака натрия (III), взятого в дозе 50 мг/кг. Пеуцеданин (II) не обладает анальгетической активностью (% уменьшения болевой реакции составил 3.6%).
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение 2-азидо-9-(4-метилпиперазин-1-ил)ореозелона (VI). К горячему раствору (55-60°С) 1.0 г (3.5 ммоль) азида ореозелона (V) и 1.4 г (14 ммоль) N-метилпиперазина в 5 мл метанола добавили 0.6 г (14 ммоль) формальдегида. Реакционную смесь кипятили 10 ч (контроль ТСХ), охладили и добавили 3 мл воды, продукт экстрагировали CH2Cl2 (4×4 мл), объединенные вытяжки высушили над MgSO4 и упаривали. После колоночной хроматографии на силикагеле (элюент - хлороформ) получили 0.9 г (65%) маслообразного соединения (VI). ИК спектр, ν, см-1: 2962, 2935, 2877, 2837, 2792, 2682, 2110, 1753, 1730, 1680, 1614, 1456, 1415, 1365, 1355, 1286, 1168, 1146, 1126, 1095, 1053, 1010, 939, 920, 821, 783. УФ спектр, (EtOH), λмакс., нм (lgε): 258 (3.99), 308 (3.63), 353 (3.83). Спектр ЯМР 1H, CDCl3, δ, м.д. (400 МГц): 0.86 [6Н, д, (СН 3)2СН, J=7 Гц], 1.95 (3Н, с, N-СН 3), 2.10 (4Н, м, H12,13,15,16), 2.37 (4Н, м, H12,13,15,16), 3.18 [1Н, м, (СН3)2СН], 3.72 (2Н, с, Н10), 6.06 (1Н, д, Н6, J=9.8 Гц), 7.45 (1Н, д, Н5, J=9.8 Гц), 7.52 (1Н, с, Н4). Спектр ЯМР 13С, CDCl3, δ, м.д. (400 МГц): 15.81, 16.05 ((СН3)2СН), 29.67 (С10), 30.87 [(СН3)2 СН], 45.85 (N-СН3), 51.11 {С12,16), 52.45 (С13,15), 96.62 (С2), 110.81 (С9), 115.06 (С6), 115.23 (C3a), 116.14 (C4a), 124.17 (С4), 143.44 (С5), 158.81 (C9a), 161.02 (C8a), 171.22 (С=О), 193.44 (С3). Найдено, %: С 59.83; Н 5.20; N 17.88. C20H23N5O4. Вычислено, %: С 60.44; Н 5.83; N 17.62. Масс-спектр, m/z (Ioтн, %): 399 (2), 398 (7), 397 (26), 341 (3), 326 (4), 304 (6), 273 (20), 272 (80), 201 (21), 113 (45), 112 (18), 100 (27), 99 (60), 98 (31), 85 (63), 83 (100), 70 (60), 58 (53), 44 (15), 43 (38), 42 (33). Найдено: [М] 397.1743. C20H23H5O4. Вычислено: 397.1745.
Пример 2. Получение (E)-3-[2,4-диметоксифенил-N-(проп-2-инил)]акриламида (VII). К раствору 0.62 г (3 ммоль) (Е)-3-(2,4-диметоксифенил)акриловой кислоты в 10 мл ДМФА добавили при перемешивании 0.23 г (1.5 ммоль) N-гидроксибензотриазола. К полученному раствору при комнатной температуре добавили 0.31 г (3.1 ммоль) пропаргиламина и 0.303 г (3 ммоль) триэтиламина. Через 5 мин к раствору добавили 0.47 г (3.75 ммоль) N,N-диизопропилкарбодиимида, полученную реакционную смесь перемешивали 18 ч. По окончании реакции добавили 20 мл воды, продукт экстрагировали хлористым метиленом (4×5 мл) и оставили раствор на ночь. Выпавший осадок отфильтровали, раствор высушили и упарили. Получили 0.66 г (90%) соединения (VII). Т.пл. 88-89°С (из эфира). ИК спектр, ν, см-1: 3340, 3066, 2970, 2875, 2115, 1743, 1730, 1620,1571, 1525, 1477, 1390, 1352, 1288,1233, 1170, 1137, 1120, 1097, 914, 827, 742, 509. УФ спектр, (EtOH), λмакс., нм (lgε): 222 (4.17), 255 (4.58), 294 (4.08), 306 (4.02), 350 (4.11). Спектр ЯМР 1H (CDCl3), δ, м.д. (400 МГц): 2.34 с (1Н, H1), 3.78 (3Н, с ОСН 3), 3.80 (3Н, с ОСН 3), 4.10 (2Н, м, Н3), 6.71 (1Н, д, Н6, J=16 Гц), 6.88 (1Н, дд, Н5′, J1=8.1 Гц, J2=1.8 Гц), 6.96 (1Н, д, Н3′, J=1.8 Гц), 7.08 (1Н, д, Н6′, J=8.1 Гц), 7.86 д (1Н, Н7, J 16 Гц), 8.34 (1Н, м, NH). Спектр ЯМР 13С, CDCl3, δ, м.д. (400 МГц): 34.81 (С3), 54.86 (ОСН3), 55.05 (ОСН3), 70.12 (С1), 80.56 (С2), 98.96 (С3′), 105.73 (С5′), 114.14 (С6), 117.83 (С1′), 129.27 (С6′), 142.52 (С2′), 161.07 (С7), 161.48 (С4′), 164.18 (С5). Масс-спектр. Найдено: [М] 245.1045. C14H15NO3. Вычислено: 245.1046.
Пример 3. Синтез (E)-2-(4-{[3-(2,4-диметоксифенил)акриламидо]метил}-1Н-1,2,3-триазол-1-ил)-2-изопропил-9-(4-метилпиперазин-1-ил)-3,7-диоксо-3,7-дигидро-2H-фуро[3,2-g]хромена (I). К раствору 0.4 г (1 ммоль) 2-азидо-9-(4-метилпиперазин-1-ил)ореозелона (VI) в 10 мл CH2Cl2 последовательно добавили раствор 30 мг (15 моль%, 0.15 ммоль) аскорбата натрия, 12 мг (5 mol%, 0.05 ммоль) CuSO4×5H2O в 10 мл воды и 0.29 г. (1.2 ммоль) соединения (VII). Реакционную смесь перемешивали при 40°C 8 ч, затем охладили, добавили 3 мл воды и экстрагировали CH2Cl2 (3×10 мл). Объединенные органические слои промывали водой и сушили над MgSO4. Растворитель упаривали в вакууме, остаток хроматографировали на колонке с силикагелем (элюент - хлороформ, хлороформ-этанол, 50:2). Фракции, содержащие продукт перекристаллизовали из эфира, получили 0.45 г (70%) соединения (I). Т.пл. 112-113°С (диэтиловый эфир). ИК спектр, ν, см-1: 3434, 3060, 2958, 2871, 1731, 1691, 1670, 1631, 1620, 1545, 1481, 1462, 1431, 1365, 1344, 1250, 1213, 1200, 1139, 1118, 1080, 1047, 1028, 933, 883, 810, 723, 696, 620, 602. Спектр ЯМР 1H (CDCl3), δ, м.д. (400 МГц): 1.07 [6Н, д, (СН 3)2СН, J=7 Гц], 2.25 (3Н, с, N-СН 3), 2.35 (4Н, м, H12,13,15,16), 2.57 (4Н, м, H12,13,15,16), 3.08 (1Н, д, Н10, J=7.8 Гц), 3.12 [1Н, м, (СН3)2СН], 3.14 (1Н, д, Н10, J=7.8 Гц), 3.78 (3Н, с ОСН 3), 3.82 (3Н, с ОСН 3), 4.10 (1Н, д, H6′, J=8.3 Гц), 4.18 (1Н, д, Н6′, J=8.3 Гц), 6.33 (1Н, д, Н6, J=9.6 Гц), 6.50 (1Н, д, Н9′, J=15.4 Гц), 6.62 (1Н, д, Н3′′, J=1.8 Гц), 6.97 (1Н, дд, Н5′′, J1=8.2 Гц, J2=1.8 Гц), 6.97 (1Н, м, NH), 7.04 (1Н, д, Н6′′, J=8.2 Гц), 7.65 (1Н, д, Н5, J=9.6 Гц), 7.86 (1Н, д, Н10′, J=15.4 Гц), 7.88 (1Н, с, H4), 7.96 (1Н, с, Н5′). Спектр ЯМР 13С, CDCl3, δ, м.д. (400 МГц): 15.38, 15.73 [(СН3)2СН], 29.39 [(СН3)2СН], 33.50 (С10), 34.65 (С6′), 45.96 (N-СН3), 51.97 (С12,16), 54.03 (С13,15), 54.83 (ОСН3), 55.65 (ОСН3), 95.95 (С3′′), 101.53 (С2), 102.66 (С5′′), 110.84 (С5′), 113.17 (С3), 114.84 (C3a), 115.09 (С9), 115.14 (С9′), 115.64 (C4a), 123.97 (С4′), 128.71 (С6′′), 128.84 (С4), 135.76 (С10′), 141.68 (С1′′), 143.37 (С5), 152.92 (С2′′), 158.48 (C8a), 159.79 (C9a), 165.73 (С5), 166.08 (С4′′), 170.85 (С8′), 192.00 (С3). Найдено, %: С 63.24; Н 5.59; N 12.95. C34H38N6O8. Вычислено, %: С 63.54; Н 5.96; N 13.08.
Пример 4. Исследование анальгетической активности соединения (I) в тесте «уксусные корчи». Эксперимент проводили на беспородных мышах-самцах массой 22-25 г. Экспериментальные группы были сформированы по 8 животных в каждой. «Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0.1 мл на одно животное. Одной группе внутрижелудочно за час до воспроизведения модели вводили исследуемый агент (I) в дозе 50 мг/кг, вторая группа - получала препарат (III) в этой же дозе, третья группа - пеуцеданин (II). Животным контрольной группы вводили 0.2 мл воды на 10 г веса животного. Оценка активности осуществлялась по количеству корчей в течение 3 мин. Как видно, количество корчей в контрольной группе животных составило 7.6±1.1, при введении агента (I) число корчей достоверно снижалось до 1.1±0.4, а при введении диклофенака (III) - до 2.0±0.7 (табл.1).
Пример 5. Исследование анальгетической активности соединения (I) в тесте «уксусные корчи» при введении в дозе 10 мг/кг. Использовали три группы экспериментальных животных. Одной группе внутрижелудочно за час до воспроизведения модели вводили исследуемый агент (I) в дозе 10 мг/кг, вторая группа - получала препарат (III) в эффективной дозе 50 мг/кг, третья группа - (контрольная) - 0.2 мл воды на 10 г веса животного. Оценка активности осуществлялась по количеству корчей в течение 3 мин. Как видно, количество корчей в контрольной группе животных составило 9.1±1.8, при введении агента (I) число корчей достоверно снижалось до 1.9±0.3, а при введении диклофенака (III) - до 2.5±1.2 (табл.1).
Таким образом, в результате исследования установлено, что соединение (I) обладает выраженным анальгетическим действием, причем изменения носят достоверный характер по сравнению с соответствующими показателями у животных в контрольной группе. Агент (I) блокирует развитие болевого эффекта, вызванного введением уксусной кислоты, и проявляет высокую анальгетическую активность. Обезболивающий эффект соединения (I), введенного в дозе 10 мг/кг, сопоставим с анальгетической активностью препарата сравнения «Диклофенак», введенного в эффективной дозе анальгетического действия 50 мг/кг.
Таким образом, предлагаемое изобретение обладает следующими преимуществами, а именно:
- Анальгетическая активность в тесте «уксусные корчи».
- Использование для получения заявляемого соединения доступного растительного сырья - широко распространенного ландшафтного растения горичника Морисона.
Схема. Синтез (E)-2-(4-{[3-(3,5-диметоксифенил)акриламидо]метил}-1H-1,2,3-триазолил)-2-изопропил-9-(4-метилпиперазин-1-ил)-3,7-диоксо-3,7-дигидро-2H-фуро[3,2-g]хромена (I)
| название | год | авторы | номер документа |
|---|---|---|---|
| 3-АРИЛ-4а-ИЗОПРОПИЛ-4аН-ХРОМЕНО[6',7':4,5]ФУРО[3,2-с][1,2]ОКСАЗИН-8-ОНЫ, ОБЛАДАЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ И АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2622768C1 |
| 2-(1,2,3-ТРИАЗОЛИЛ)ЗАМЕЩЕННЫЕ ЛИНЕЙНЫЕ ФУРОКУМАРИНЫ, ОБЛАДАЮЩИЕ АНТИВИРУСНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ГРИППА A/Н1N1 | 2024 |
|
RU2841063C1 |
| (1S,4aR,5S,6R)-МЕТИЛ-5{2-[1-(2-АМИНО-2-ОКСОЭТИЛ)-2-ОКСОПИРРОЛИДИН-3-ИЛ]ЭТИЛ}-1,4a, 6-ТРИМЕТИЛДЕКАГИДРОНАФТАЛИН-1-КАРБОКСИЛАТ, ОБЛАДАЮЩИЙ ПРОТИВОСУДОРОЖНОЙ И АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2385864C2 |
| Применение 5-арил-4-ароил-3-гидрокси-1-карбоксиметил-3-пирролин-2-онов в качестве анальгетических средств | 2023 |
|
RU2816900C1 |
| Применение 4-[1-(4-метилфенил)аминоэтилиден]-5-фенил-1-цианометилтетрагидропиррол-2,3-диона в качестве анальгетического средства | 2023 |
|
RU2806330C1 |
| ПРИМЕНЕНИЕ 2-ГИДРОКСИ-3-МЕТИЛ-6-(1-МЕТИЛЭТЕНИЛ)ЦИКЛОГЕКС-3-ЕНОНА В КАЧЕСТВЕ АНАЛЬГЕЗИРУЮЩЕГО СРЕДСТВА | 2010 |
|
RU2421213C1 |
| 2-(6-АРИЛ-4-АРОИЛ-3-МЕТИЛ-1-ФЕНИЛ-1Н-ПИРАЗОЛО[3,4-b]ПИРИДИН-5-ИЛ)-2-ОКСО-N-АРИЛАЦЕТАМИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2501800C2 |
| 1-ГЕКСАДЕЦИЛ-4,6-ДИМЕТИЛ-2-ОКСОНИКОТИНАМИД, ПРОЯВЛЯЮЩИЙ ПРОТИВОВОСПАЛИТЕЛЬНУЮ И АНАЛЬГЕТИЧЕСКУЮ АКТИВНОСТЬ | 2008 |
|
RU2396258C2 |
| МЕТИЛ 4-ГИДРОКСИ-4-МЕТИЛ-6-ФЕНИЛ-2-ЦИАНОАЦЕТИЛГИДРАЗОНОЦИКЛОГЕКСАН-1-КАРБОКСИЛАТ, ОБЛАДАЮЩИЙ АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2446150C2 |
| Этил 4-(5-бензоил-6-(4-(диэтиламино)фенил)-4-гидрокси-2-тиоксогексагидропиримидин-4-карбоксамино)бензоат, проявляющий анальгетическое и противовоспалительное действие | 2019 |
|
RU2717246C1 |
Изобретение относится к малотоксичному (E)-2-(4-{[3-(2,4-диметоксифенил)акриламидо]метил}-1H-1,2,3-триазол-1-ил)-2-изопропил-9-(4-метилпиперазин-1-ил)-3,7-диоксо-3,7-дигидро-2H-фуро[3,2-g]хромену формулы (I), обладающему анальгетической активностью в тесте "уксусные корчи". Указанное свойство позволяют использовать это соединение в медицине. Cоединение формулы I получают из фурокумарина пеуцеданина, содержащегося в растении горичник Морисона. 1 табл., 5 пр.
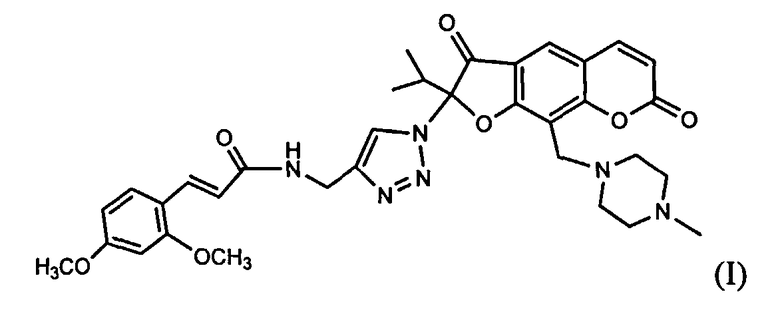
(E)-2-(4-{[3-(2,4-диметоксифенил)акриламидо]метил}-1H-1,2,3-триазол-1-ил)-2-изопропил-9-(4-метилпиперазин-1-ил)-3,7-диоксо-3,7-дигидро-2H-фуро[3,2-g]хромен формулы (I)
обладающий анальгетической активностью.
| US 20100266621 A1 21.10.2010 | |||
| СПОСОБ ПОЛУЧЕНИЯ 1,11-ДИАЛКИЛ-3,5-ДИГИДРОФУРО[2',3':3,4]ЦИКЛОГЕПТА[C]ИЗОХРОМЕНОВ | 2005 |
|
RU2282633C9 |
| Sing Damanpreet et al,J.Ethnjpharmacology,2011,v.134,no.3,p.565-583 | |||
| Bartnic M | |||
| et al, Herba Polonica,v.52,no.4,p.71-78 | |||
Авторы
Даты
2015-04-27—Публикация
2014-03-13—Подача