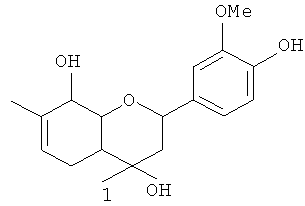
Изобретение относится к области органической химии, а именно к новым органическим соединениям, конкретно к 2-(4-гидрокси-3-метоксифенил)-4,7-диметил-3,4,4а,5,8,8а-гексагидро-2H-хромен-4,8-диолу общей формулы 1 (включая его пространственные изомеры, в том числе оптически активные формы, в том числе в виде солей с катионами металлов по фенольной группе):
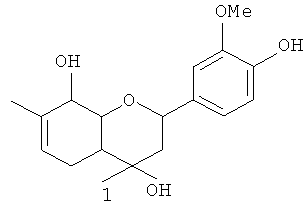
обладающему анальгезирующим действием.
Известны анальгезирующие средства, являющиеся по фармакологическому действию ненаркотическими анальгетиками, такие как ацетилсалициловая кислота, анальгин и другие [1]. Данные по активности на модели «уксусные корчи» (ED50) и острой токсичности (LD50) известных лекарственных средств приведены в [2] и отражены в таблице 1.
Недостатками ацетилсалициловой кислоты являются низкое селективное обезболивающее действие и гастротоксичность; анальгина - возможное угнетение кроветворения, вплоть до полного агранулоцитоза.
Наиболее близким к заявляемому средству по фармакологическому действию - прототипом, является диклофенак натрия [3].
Недостатками диклофенака натрия являются желудочно-кишечные расстройства и гастротоксичность.
Задача, на решение которой направлено изобретение, заключается в создании нового соединения, обладающего анальгезирующей активностью.
Поставленная задача решается 2-(4-гидрокси-3-метоксифенил)-4,7-диметил-3,4,4а,5,8,8а-гексагидро-2H-хромен-4,8-диолом общей формулы 1, включая его пространственные изомеры, в том числе оптически активные формы, в том числе в виде солей с катионами металлов по фенольной группе:
Соединение 1 не было ранее описано в литературе, оно может быть синтезировано в соответствии со схемой 1 взаимодействием эпоксида вербенола 2 или 3-метил-6-(проп-1-ен-2-ил)пиклогекс-3-ен-1,2-диола 3 с ванилином (4-гидрокси-3-метоксибензальдегидом) в присутствие кислотного катализатора, предпочтительно монтмориллонитовой глины, с использованием растворителя, предпочтительно хлористого метилена, или в отсутствие растворителя.
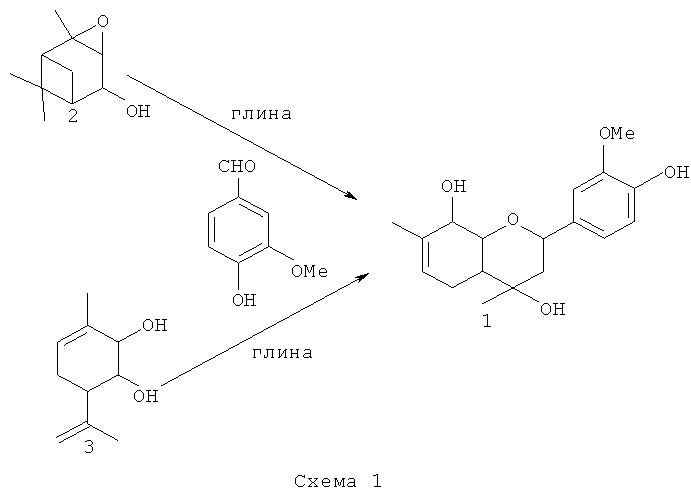
Для получения соединения 1 в виде различных стереоизомеров, в том числе и в оптически активном виде, можно использовать в качестве исходных веществ различные пространственные изомеры соединений 2 и 3, в том числе и обладающие оптической активностью.
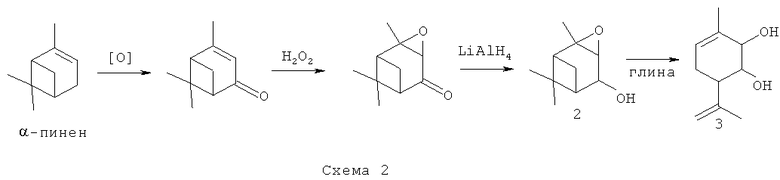
Эпоксид вербенола 2 и соединение 3, в том числе и в оптически активном виде, могут быть синтезированы в соответствии со схемой 2, исходя из монотерпена α-пинена, широко распространенного в отечественном растительном сырье, с использованием доступных реагентов по ранее описанным методикам [4, 5].
Анальгетическая активность соединений общей формулы 1 изучалась на моделях висцеральной боли «уксусные корчи» и термического раздражения «горячая пластинка» путем однократного введения в дозе 10 мг/кг.
«Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0.1 мл на одно животное. Оценка активности осуществлялась по количеству корчей в течение 3 мин.
«Горячая пластинка» - тест, характеризующий термическое раздражение. Животных помещали на медную пластину, Т=54°С. Эффект оценивали по продолжительности нахождения животного на горячей пластине до первой «вокализации» в секундах.
Обнаружено, что соединение (4aR,8R,8aR)-1 обладает в дозе 10 мг/кг высокой анальгетической активностью в тесте «уксусные корчи», не уступая по эффективности диклофенаку натрия (таблица 2). Соединение (4aR,8R,8aR)-1 не проявило существенной анальгетической активности в тесте «горячая пластинка».
Его энантиомер, соединение (4aS,8S,8aS)-1, напротив, проявляет в дозе 10 мг/кг высокую анальгетическую активность в тесте «горячая пластинка» и существенно меньшую - в тесте «уксусные корчи» (таблица 2). Эффективность использования соединения (4aS,8S,8aS)-1 в тесте «горячая пластинка» близка к эффективности применения в этом тесте диклофенака натрия (таблица 2).
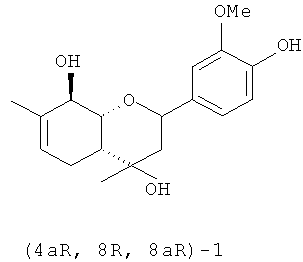
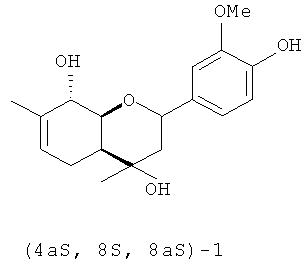
Использование смеси соединений (4aS,8S,8aS)/(4aR,8R,8aR)-1 в соотношении 1:4, соответствующем соотношению стереоизомеров в коммерчески доступном вербеноне и распространенном в отечественном растительном сырье α-пинене, привело к получению агента, сочетающего высокую эффективность в тесте «горячая пластинка» и несколько меньшую эффективность в тесте «уксусные корчи» (таблица 2) с широкой ресурсной базой.
Острую токсичность соединения 1 определяли на белых беспородных мышах массой 20-22 г при однократном внутрижелудочном введении по методу Кербера. Показано, что соединение 1 является умеренно токсичным веществом: LD50 превышает 1000 мг/кг. Таким образом, соединение 1 существенно менее токсично, чем диклофенак натрия (LD50 370 мг/кг).
Исходя из вышесказанного, можно заключить, что соединение 1 сочетает высокую анальгетическую активность и низкую токсичность с возможностью регулирования специфической активности варьированием энантиомерного состава и может, после проведения соответствующих испытаний, использоваться как в чистом виде, так и в качестве основы новых низкотоксичных высокоэффективных анальгезирующих лекарственных форм.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез 2-(4-гидрокси-3-метоксифенил)-4,7-диметил-3,4,4а,5,8,8а-гексагидро-2H-хромен-4,8-диола 1 из эпоксида вербенола 2
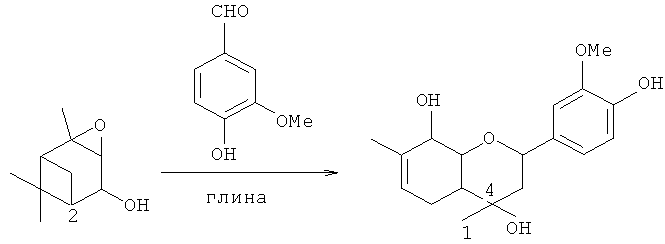
К суспензии 2.5 г глины К-10 в 15 мл СН2Сl2 прибавили раствор 0.5 г 4-гидрокси-3-метоксибензальдегида в 3 мл CH2Cl2, затем раствор 0.5 г эпоксида вербенола 2 в 3 мл СН2Сl2, перемешивали 1 час при комнатной температуре. Добавили по 10 мл диэтилового эфира и ацетона. Катализатор отфильтровали, растворитель отогнали. Полученную реакционную смесь делили на колонке с 10 г силикагеля (60-200 µ, Masherey-Nagel) (элюенты - гексан с градиентом диэтилового эфира от 0 до 100%, ацетон). Выделили 0.052 г (25%) 2-(4-гидрокси-3-метоксифенил)-4,7-диметил-3,4,4а,5,8,8а-гексагидро-H-хромен-4,8-диола 1 в виде смеси двух диастереомеров по положению 4 в соотношении ~2.2:1.
Мажорный диастереомер соединения 1. Спектр ЯМР 1Н (СDCl3+d6-ацетон), δ, м.д.: 1.46 д (С17Н3, J17,4a 0.7 Гц), 1.59 д.д.д (Н4e, 2J 13.3, J4e,3a 2.7, J4e,6 1.2 Гц), 1.74 т.д (С18Н3, J18,7 2.0, J18,8 1.7 Гц), 1.83 ш.т (Н6, J6,7 8.5 Гц), 1.89 д.д (H4a,2J 13.3. J4a,3a 12.0 Гц), 2.14 д.м (2Н7, J7,6 8.5 Гц), 3.76 м (Н1,Н10), 3.76 с (ОСН3), 4.34 д.д (Н3a, J3a,4a 12.0, J3a4e 2.7 Гц), 5.53 т.к (H8, J8,7 3.8, J8,18 1.7 Гц), 6.73 д (Н15, J15,16 8.1 Гц), 6.75 д.д (Н16, J16,15 8.1. J16,12 1.8 Гц), 6.85 д (Н12, J12,16 1.8 Гц). Спектр ЯМР 13С (СОСl3+d6-ацетон), δ. м.д.: 78.93 д (С1), 77.94 д (С3). 43.83 т (С4), 70.57 с (С5), 39.19 д (С6), 23.43 т (С7), 124.40 д (С8), 132.42 с (С9), 70.89 д (С10), 135.03 с (С11), 110.43 д (С12), 147.59 с (С13), 146.31 с (С14), 115.12 д (С15), 119.29 д (С16), 27.36 к (С17), 21.11 к (С18), 56.10 к (С19). Найдено М 320.1608. С18Н24O5. Вычислено М 320.1618.
Минорный диастереомер соединения 1. Спектр ЯМР 1Н (СОСl3+d6-ацетон), δ, м.д.: 1.16 с (С17Н3), 1.55 д.д.д (Н4e, 2J 14.0, J4е,3а 3.0, J4е,6 1.3 Гц), 1.66 д.д (Н4a, 2J 14.0, J4а,3а 11.5 Гц), 1.68 ш.т (Н6, J6,7 8.5 Гц), 1.74 т.д (С18Н3, J18,7 2.0, J18,8 1.7 Гц), 1.93 д.м (2Н7, J7,6 8.5 Гц), 3.77 ш.с (Н10e), 3.78 с (ОСН3), 4.18 д.д (Н1e, J1e,10e 2.5, J1e,6a 2.0 Гц), 4.64 д.д (Н3a, J3a,4a 11.5, J3a,4e 3.0 Гц), 5.47 т.к (Н8, J8,7 3.8, J8,18 1.7 Гц), 6.59 ш.с (С14-ОН), 6.69-6.72 м (Н15, Н16), 6.76 ш.с (Н12). Спектр ЯМР 13С (СОСl3+d6-ацетон), δ, м.д.: 75.71 д (С1), 75.80 д (С3), 42.42 т (С4), 70.27 с (С5), 37.99 д (С6), 24.76 т (С7), 123.44 д (С8), 132.48 с (С9), 70.47 д (С10), 134.98 с (С11), 109.50 д (С12), 146.81 с (С13), 145.36 с (С14), 114.50 д (С15), 118.81 д (С16), 28.24 к (С17), 20.97 к (С18), 55.81 к (С19). Найдено М 320.1608. C18H24O5. Вычислено М 320.1618.
Пример 2. Синтез (4аR,8R,8аR)-2-(4-гидрокси-3-метоксифенил)-4,7-диметил-3,4,4а,5,8,8а-гексагидро-2H-хромен-4,8-диола(4аR,8R,8аR)-1 из соединения 3
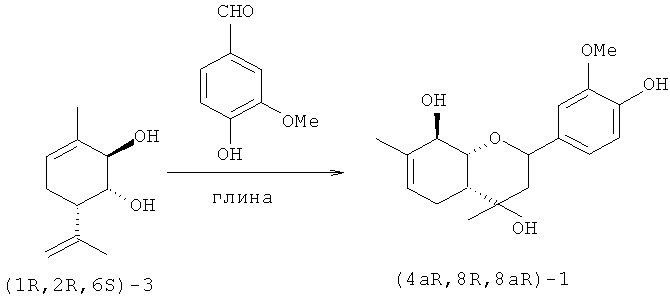
К 0.2 г глины К-10 прибавили раствор 0.1 г 4-гидрокси-3-метоксибензальдегида и 0.085 г (1R,2R,6S)-3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диола 3 в 3 мл CH2Cl2, растворитель отогнали, реакционную смесь выдержали в течение 14 суток при комнатной температуре. К реакционной смеси добавили по 5 мл диэтилового эфира и ацетона. Катализатор отфильтровали, промыли ацетоном. Растворитель отогнали, остаток делили на колонке с 5 г силикагеля (60-200 µ, Masherey-Nagel) (элюенты - гексан с градиентом диэтилового эфира от 5 до 100%, ацетон). Выделили 0.010 г непрореагировавшего соединения 3 (конверсия 88%) и 0.065 г (46%, в расчете на прореагировавшее соединение 3) (4аR,8R,8аR)-2-(4-гидрокси-3-метоксифенил)-4,7-диметил-3,4,4а,5,8,8а-гексагидро-2H-хромен-4,8-диола (4aR,8R,8aR)-1.
Пример 3. Синтез (4аS,8S,8аS)-2-(4-гидрокси-3-метоксифенил)-4,7-диметил-3,4,4а,5,8,8а-гексагидро-2H-хромен-4,8-диола (4аS,8S,8аS)-1 из соединения 3
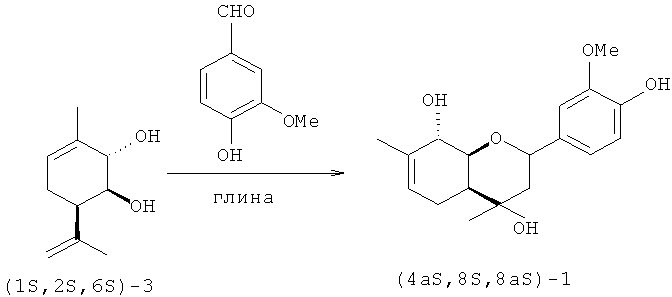
К 0.325 г глины К-10 прибавили раствор 0.13 г 4-гидрокси-3-метоксибензальдегида и 0.100 г (1S,2S,6R)-3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диола 3 в 4 мл СН2Сl2, растворитель отогнали, реакционную смесь выдержали в течение 14 суток при комнатной температуре. К реакционной смеси добавили по 5 мл диэтилового эфира и ацетона. Катализатор отфильтровали, промыли ацетоном. Растворитель отогнали, остаток делили на колонке с 5 г силикагеля (60-200 µ, Masherey-Nagel) (элюенты - гексан с градиентом диэтилового эфира от 5 до 100%, ацетон). Выделили 0.023 г непрореагировавшего соединения 3 (конверсия 77%) и 0.094 г (64%, в расчете на прореагировавшее соединение 3) (4aS,8S,8аS)-2-(4-гидрокси-3-метоксифенил)-4,7-диметил-3,4,4а,5,8,8а-гексагидро-2H-хромен-4,8-диола (4aS,8S,8aS)-1.
Пример 4. Исследование анальгетической активности соединений общей формулы 1 в тесте «уксусные корчи»
Эксперимент проводили на беспородных мышах-самцах массой 22-25 г. Экспериментальные группы были сформированы по 8 животных в каждой. «Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0.1 мл на одно животное. Исследуемые агенты общей формулы 1 вводили однократно внутрижелудочно за час до воспроизведения модели. Контролем являлись животные с введением только уксусной кислоты. Оценка активности осуществлялась по количеству корчей в течение 3 мин.
Результаты приведены в таблице 2.
Установлено, что в данном тесте соединение (4аS,8S,8аS)-1 имеет невысокую (33%), но достоверную, анальгетическую активность, тогда как соединение (4aR,8R,aR)-1 проявило высокую эффективность, не уступая по эффективности диклофенаку натрия. Смесь двух изомеров ((4aS,8S,8aS)-1: (4аR,8R,8аR)-1=1:4) блокирует развитие болевого эффекта, вызванного введением уксусной кислоты, на 37%, проявляя средний обезболивающий эффект. Наибольшей эффективностью в этом тесте обладает соединение (4аR,8R,8аR)-1.
Пример 5. Исследование анальгетической активности соединений общей формулы 1 в тесте «горячая пластинка»
Опыты проводили на беспородных мышах-самцах массой 22-25 г. Экспериментальные группы были сформированы по 8 животных в каждой. Животных помещали на медную пластину Т=54°С. Эффект оценивали по продолжительности нахождения животного на горячей пластине до первой «вокализации», в секундах.
Исследуемые агенты общей формулы 1 вводились однократно внутрижелудочно за час до воспроизведения модели. Контрольным животным вводили соответствующий растворитель. Результаты представлены в таблице 2.
В тесте «горячая пластинка» в дозе 10 мг/кг высокий анальгетический эффект проявили соединение (4aS,8S,8aS)-1 и его смесь с соединением (4aR,8R,8aR)-1 в соотношении 1:4 (увеличение времени до первой «вокализации» на 56 и 66%, соответственно), тогда как индивидуальное вещество (4аR,8R,8аR)-1 оказалось значительно менее эффективно. Эффективность использования соединения (4аS,8S,8аS)-1 в тесте «горячая пластинка» близка к эффективности применения в этом тесте диклофенака натрия.
Источники информации
1. Машковский М.Д. Лекарственные средства. Т.1. М.: Медицина. 2007.
2. Сюбаев Р.Д., Машковский М.Д., Шварц Г.Я., Покрышкин В.И. Сравнительная фармакологическая активность современных нестероидных противовоспалительных препаратов. Хим.-фарм. журн. 1986. Т.20. №1. С.33-39.
3. Справочник Видаль. Лекарственные препараты в России: Справочник. М.: АстраФармСервис. 2002. З-90.
4. Il'ina I.V., Volcho K.P., Korchagina D.V., Barkhash V.A., Salakhutdinov N.F. Helv. Chim. Acta, 2007, V.90, №2, P.353-368.
5. Волчо К.П., Рогоза Л.Н., Салахутдинов Н.Ф., Толстиков А.Г., Толстиков Г.А. Препаративная химия терпеноидов. Часть 1. Бициклические монотерпеноиды. Новосибирск: ГУ Издательство СО РАН, 2006, 280 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| 2-(3-ГИДРОКСИ-4-МЕТОКСИФЕНИЛ)-4,7-ДИМЕТИЛ-3,4,4а,5,8,8а-ГЕКСАГИДРО-2Н-ХРОМЕН-4,8-ДИОЛ В КАЧЕСТВЕ АНАЛЬГЕЗИРУЮЩЕГО СРЕДСТВА | 2013 |
|
RU2506079C1 |
| ПРИМЕНЕНИЕ 4,7-ДИМЕТИЛ-2-(ПРОП-1-ЕНИЛ)-3,4,4a,5,8,8a-ГЕКСАГИДРО-2Н-ХРОМЕН-4,8-ДИОЛА В КАЧЕСТВЕ АНАЛЬГЕЗИРУЮЩЕГО СРЕДСТВА | 2009 |
|
RU2418578C1 |
| 4,7-ДИМЕТИЛ-2-(2,4,5-ТРИМЕТОКСИФЕНИЛ)-3,4,4a,5,8,8a-ГЕКСАГИДРО-2H-4,8-ЭПОКСИХРОМЕН, ОБЛАДАЮЩИЙ АНАЛЬГЕЗИРУЮЩЕЙ АКТИВНОСТЬЮ | 2012 |
|
RU2477283C1 |
| 4,7-ДИМЕТИЛ-3,4,4A,5,8,8A-ГЕКСАГИДРОСПИРО[ХРОМЕН-2,1'-ЦИКЛОГЕКСАН]-4,8-ДИОЛ В КАЧЕСТВЕ АНАЛЬГЕЗИРУЮЩЕГО СРЕДСТВА | 2019 |
|
RU2713946C1 |
| НОВОЕ КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ АМИНОДИГИДРОТИАЗИНА | 2009 |
|
RU2503681C2 |
| ПРОИЗВОДНЫЕ 4,4,7-ТРИМЕТИЛ-2-ФЕНИЛ-4a,5,8,8a-ТЕТРАГИДРО-4Н-БЕНЗО[1,3]ДИОКСИН-8-ОЛА В КАЧЕСТВЕ АНАЛЬГЕЗИРУЮЩИХ СРЕДСТВ | 2009 |
|
RU2409353C1 |
| БИЦИКЛИЧЕСКИЕ АМИНЫ В КАЧЕСТВЕ НОВЫХ ИНГИБИТОРОВ JAK-КИНАЗЫ | 2018 |
|
RU2764980C2 |
| ПРОИЗВОДНЫЕ ГАЛАНТАМИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2241001C2 |
| ТЕРПЕНОИДНЫЕ ПРОИЗВОДНЫЕ, ПОЛЕЗНЫЕ КАК ПРОТИВООПУХОЛЕВЫЕ АГЕНТЫ | 1996 |
|
RU2179441C2 |
| РЕГУЛЯТОРЫ-ПРОИЗВОДНЫЕ СТЕРОИДОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2797408C2 |
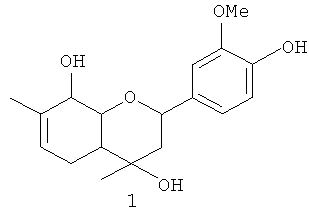
Изобретение относится к 2-(4-гидрокси-3-метоксифенил)-4,7-диметил-3,4,4а,5,8,8а-гексагидро-2Н-хромен-4,8-диолу общей формулы 1, включая его пространственные изомеры, в том числе оптически активные формы, в том числе в виде солей с катионами металлов по фенольной группе:
 .
.
Обнаружено, что такое соединение обладает анальгезирующей активностью и может быть использовано в медицине. Соединение формулы 1 обладает низкой токсичностью и может быть получено из доступного природного соединения α-пинена. 2 табл.
2-(4-Гидрокси-3-метоксифенил)-4,7-диметил-3,4,4а,5,8,8а-гексагидро-2Н-хромен-4,8-диол общей формулы 1, включая его пространственные изомеры, в том числе оптически активные формы, в том числе в виде солей с катионами металлов по фенольной группе:
 ,
,
обладающий анальгезирующей активностью.
| US 4599327 (Chinoin Gyogyszer es Vegyeszeti Termekek Gyara RT) 08.07.1986 | |||
| Kikuch H et al, Tetrahedron Letters, 2004, vol.45, no.2, pp.367-370 | |||
| Bertrand Le Bourdonnec et al, Journal of Medicinal Chemistry, 2008, vol.51, no.19, pp.5893-5896 | |||
| Справочник Видаль | |||
| Лекарственные препараты в России | |||
| Справочник | |||
| - М.: АстраФармСервис, 2002, 3-90. |
Авторы
Даты
2011-09-27—Публикация
2010-02-24—Подача