Область техники, к которой относится изобретение
Данное изобретение относится к мигрирующим в опухоль клеткам, экспрессирующим лиганд (TRAIL), индуцирующий апоптоз с участием фактора некроза опухолей, и их использованию в противоопухолевой терапии.
Уровень техники
Нарушение регуляции механизмов апоптоза играет ключевую роль в патогенезе и прогрессии лимфопролиферативных нарушений, позволяющих неопластическим клеткам выживать дольше периода их обычной продолжительности жизни и, возможно, приобретать химио- и радиорезистентность [1]. Таким образом, пути апоптоза представляют собой привлекательную терапевтическую мишень в восстановлении чувствительности злокачественных клеток к апоптозу или активации агонистов апоптоза [2]. Для модуляции генов и белков апоптоза может быть рассмотрено несколько стратегий, которые нацелены либо на внутренние (Bcl-2, Bcl-XL), либо на внешние (DR4, DR5, FLIP), либо на конвергентные (cIAP2) пути апоптоза [3].
Лиганд (TRAIL), индуцирующий апоптоз с участием фактора некроза опухоли, принадлежит к семейству факторов некроза опухоли (TNF) - лигандов рецепторов гибели [клеток] [4].
Выделенные последовательности ДНК, кодирующие TRAIL, векторы экспрессии, включающие в себя упомянутые последовательности ДНК, и рекомбинантные полипептиды TRAIL описаны в патентной заявке WO 97/01633.
TRAIL связывается с рецептором гибели клеток 4 (DR4) и рецептором гибели клеток 5 (DR5), которые экспрессируются на клеточной поверхности многих раковых клеток [5]. Связывание растворимого TRAIL с DR4 или DR5 ведет к активации каспазы и апоптозу [6].
Liu Zhongyu et al., J Clin Invest. Vol 112, no.9, 9.11.2003, 1332-1341 описывают дендритные клетки, в которые с помощью рекомбинантного аденовируса трансдуцирован TRIAL, и потенциальное медицинское применение в лечении артрита. Никаких упоминаний о возможном применении упомянутых клеток в лечении опухолей сделано не было.
Исследования in vitro и in vivo предполагают, что благодаря высокой специфичности в отношении раковых клеток, так же как и высокой противоопухолевой активности, растворимый рекомбинантный TRAIL должен играть ключевую роль в противораковой терапии [7]. Действительно, TRAIL селективно индуцирует апоптоз во многих трансформированных клетках, не затрагивая нормальные клетки [4]. Кроме того, внесение TRAIL мышам демонстрирует значительную эффективность против опухолевых ксенотрансплантатов карциномы кишечника [8, 9], рака молочной железы [10], множественной миеломы (болезнь Рустицкого-Калера) [11] или глиомы [12, 13].
Изучение токсичности на мышах и нечеловекообразных приматах показало, что нормальные гепатоциты и кератиноциты резистентны к тримеризованной версии TRAIL [14, 15], тогда как они демонстрировали достоверную чувствительность к индукции апоптоза неоптимизированными препаратами TRAIL или сшитыми с антителами вариантами лиганда [16]. Может ли печеночная токсичность представлять собой большую проблему при применении тримеризованной версии TRAIL в высоких дозах, остается неясным.
Дополнительное ограничение применения растворимого TRAIL связано со слабым апоптотическим ответом, наблюдавшимся в достаточном количестве случаев изучения разнообразных линий опухолевых клеток, которые требуют либо продолжительной инкубации, либо очень высоких доз растворимого TRAIL для того, чтобы подвергнуться апоптозу [17, 18]. Полученный после внутривенной инъекции фармакокинетический профиль TRAIL (время полужизни в плазме - 32 минуты, а половина времени элиминации - 4,8 часов), условия продолжительной экспозиции и высокие концентрации неприменимы в стратегии лечения in vivo [10]. Чтобы преодолеть ограничения, связанные с растворимым рекомбинантным TRAIL и в особенности с опухолевыми клетками-мишенями, в настоящее время на различных животных моделях применяется несколько подходов, в которых используется перенос генов TRAIL, опосредованный аденовирусом [19, 20].
Однако эффективность подходов с использованием переноса генов в значительной степени зависит от эффективности инфицирования опухоли и от того, насколько можно избежать эффективного иммунного клиренса [21]. Кроме того, в отношении системных инъекций аденовирусных векторов все еще существует несколько вопросов, связанных с их безопасностью [22]. Например, аденовирусный перенос гена TRAIL преодолевает ослабленный апоптотический ответ клеток гепатомы, но вызывает агрессивный апоптоз в первичных гепатоцитах человека [19]. В настоящее время генно-терапевтические подходы с использованием аденовирусов основаны главным образом на внутриопухолевом высвобождении аденовируса, кодирующего TRAIL [23]. Несмотря на локальную противоопухолевую активность, внутриопухолевое высвобождение TRAIL не имеет системной противоопухолевой активности, утрачивая, таким образом, какое-либо клиническое значение.
Известно, что различные типы клеток мигрируют предпочтительно в опухоли [24], и их можно нагрузить конструкциями, необходимыми для продуцирования противораковых молекул. Благодаря таким миграционным характеристикам клетки CD34+ [25] и природные клетки-киллеры (NK) [26] могут быть использованы в качестве носителей для доставки противораковых молекул.
После внутривенного вливания клетки CD34+ демонстрируют специфические свойства миграции, включающие в себя способность к постоянной колонизации костного мозга и временной колонизации печени и селезенки [27-30]. Эти миграционные свойства строго связаны с экспрессией рецепторов адгезии (например, CXCR-4, VLA-4, VLA-5, CD44 и т.д.), которые взаимодействуют со специфическими лигандами (например, SDF-1, VCAM-1 и т.д.), экспрессируемыми на клетках стромы, присущих микроокружению костного мозга, а также микроокружению
опухоли [31-34].
NK-клетки представляют собой субпопуляцию лимфоцитов, которая играет существенную роль в клеточной иммунной защите против клеток опухоли через механизмы, не ограничивающиеся главным комплексом гистосовместимости [35]. После внутривенного вливания NK-клетки мигрируют в костный мозг и лимфоидные органы и проникают в участки опухоли под действием соответствующих сигнальных цитокинов. Поэтому многие группы [исследователей] пытались использовать NK-клетки для миграции в опухоли с терапевтическими целями [36-38].
Хотя способность NK-клеток к миграции в опухоли известна, генетически модифицированные клетки претерпевают стресс, который зависит от типа перенесенного гена. В результате упомянутого стресса клетки могут утрачивать исходную способность к миграции в опухоль после переноса гена TRIAL. Поэтому нет особых оснований рассчитывать на успех, и в каждом случае необходима экспериментальная проверка для подтверждения того, жизнеспособен ли данный конкретный подход.
Ныне было обнаружено, что клетки CD34+ и NK-клетки, сконструированные, чтобы экспрессировать TRAIL, могут быть с успехом использованы для получения опосредованной клетками противоопухолевой активности in vivo.
Описание изобретения
В соответствии с данным изобретением, путем опосредованного аденовирусом переноса гена мигрирующие в опухоли клетки конструируются для продуцирования лиганда (TRAIL), индуцирующего апоптоз с участием фактора некроза опухоли. Клетки согласно изобретению могут вводиться систематически для выделения TRAIL в месте [нахождения] опухоли, не вызывая указанных выше затруднений.
Соответственно, данное изобретение относится к клеткам, мигрирующим в опухоли и экспрессирующим TRAIL и содержащим их клеточным препаратам. Изобретение также относится к использованию упомянутых клеток в препаратах клеточных композиций для противораковой терапии, в частности для терапии лимфомы у человека.
Клетки согласно изобретению могут быть получены путем трансдукции в мигрирующие в опухоль клетки дефектно реплицируемого аденовируса, кодирующего ген TRAIL человека (Ad-TRAIL) под контролем подходящего промотора, например промотора CMV. Трансдукция может быть выполнена в соответствии со способами, известными молекулярным биологам, предпочтительно следуя процедуре, описанной в примерах.
Термин «мигрирующие в опухоль» клетки используется в соответствии с данным изобретением для обозначения клеток, способных (1) после внутривенной инъекции мигрировать в опухолевую ткань и (2) экспрессировать адекватные количества мембранно-связанного TRAIL (mTRAIL) в течение по меньшей мере нескольких дней.
Примеры мигрирующих в опухоль клеток, способных мигрировать из крови в опухолевые метастазы, включают в себя гемопоэтические клетки, а именно гемопоэтические клетки CD34+ из периферической крови пациентов с раковыми опухолями, леченных фактором роста; NK-клетки из периферической крови; цитокин-индуцированные клетки-киллеры (CIK), полученные из культуры ex vivo одноядерных клеток периферической крови; эндотелиальные клетки и эндотелиальные клетки-предшественники; инфильтрирующие опухоль лимфоциты (TIL); лимфокин-активируемые клетки-киллеры (LAK); макрофаги; мезенхимные стволовые клетки (MSC) (свежевыделенные из периферической крови или тканей человека или выращенные ex vivo) и даже клеточные линии человека, сохраняющие способность обнаруживать опухоль и сконструированные для экспрессии mTRAIL. Чтобы получить адекватную экспрессию mTRAIL, могут быть рассмотрены несколько способов с применением плазмид и вирусных векторов с соответствующими регуляторными генетическими элементами, такими как тканеспецифические промоторы и/или энхансеры.
Клетки CD34+ и NK особенно предпочтительны.
Оптимальная эффективность трансдукции NK-клеток может быть достигнута путем преинкубации NK-клеток в течение 18 часов с N-ацетилцистеином (10 мМ). После преинкубации NK-клетки подвергались градуальной (50-500) множественной трансфекции (MOI) Ad-TRAIL (50-500) в бессывороточных условиях при 37°С. Затем вносили среду с добавлением сыворотки (RPMI-1640/FBS (фетальная бычья сыворотка) 20%), несколько часов спустя к культуре добавляли Gene Booster (1:200), а затем дополнительно инкубировали еще в течение 18 часов.
Сходные условия могут применяться к клеткам CD34+, за исключением преинкубации с N-ацетилцистеином.
Композиции согласно изобретению могут быть получены с применением носителей, пригодных для парентерального, в частности внутривенного введения, такого как указано в REMINGTON'S PHARMACEUTICAL SCIENCES (Mack Pub. Co., N.J. 1991).
Например, наполнители, которые могут быть использованы, включают в себя любые фармацевтические агенты, которые не являются вредными для пациента, получающего композицию, например воду, физиологический раствор, глицерин и этанол, если требуется, в смеси с дополнительными веществами, такими как увлажняющие или эмульгирующие агенты, буферы и пр. Соответствующие дозы зависят, среди прочих факторов, от пола, возраста и состояния пациента, подвергающегося лечению, тяжести заболевания. Соответствующее эффективное количество может быть легко определено любым специалистом, практикующим в данной области, и может быть каким-либо образом определено путем клинических исследований. Терапевтически эффективная доза обычно составляет примерно от 103 до 1015 трансдуцированных клеток. Другие дозировки, несомненно, могут быть установлены путем общепринятых экспериментов, т.е. на основании кривых «доза-ответ», определения максимально переносимой дозы (MTD) или проведения на ограниченном количестве пациентов 1-й фазы клинических исследований. Дозировка при лечении может представлять собой разовую дозу или многодозовый режим. Далее, пациенту можно вводить столько доз, сколько это необходимо. Специалист в данной области легко определит наиболее эффективный режим дозировок.
Далее данное изобретение будет более подробно проиллюстрировано с помощью следующих примеров, представляющих ясные и убедительные доказательства того, что
(i) стволовые клетки CD34+, так же как и NK-клетки, могут быть эффективно трансдуцированы in vitro аденовектором, экспрессирующим TRAIL;
(ii) после трансдукции эти клеточные подтипы временно экспрессируют TRAIL на своей клеточной поверхности;
(iii) такая краткая длительность экспрессии TRAIL связана с мощным апоптотическим эффектом, обнаруживаемым и в TRAIL-чувствительных, и в TRAIL-резистентных опухолевых клетках, культивируемых совместно с трансдуцированными клетками;
(iv) инъекция трансдуцированных клеток [мышам линии] NOD/SCID in vivo на ранней или продвинутой стадии развития опухоли связана с достоверным продлением выживания мышей, что предполагает, что трансдуцированные аденовирусом клетки CD34+ и NK-клетки могут эффективно служить в качестве носителей для системной доставки TRAIL для терапевтических целей.
Эффективность внутривенного введения представляет собой отчетливое преимущество данного изобретения по сравнению с протоколами, основанными на внутриопухолевом введении.
Тогда как механизмом противоопухолевого эффекта mTRAIL-экспрессирующих клеток человека in vitro, наиболее вероятно, является апоптоз, запускаемый непосредственной реакцией между mTRAIL и распознающим его рецептором на клетках опухолей, механизм его противоопухолевой активности in vivo нам неизвестен. Непосредственный цитолиз опухолевых клеток, возможно, связан с косвенными ингибирующими рост эффектами, возникающими вследствие апоптоза расположенных в опухоли неопухолевых клеток, экспрессирующих рецепторы TRAIL (сосудистые, периваскулярные, интерстициальные и другие типы клеток, играющие критическую роль в развитии опухоли и выживании опухолевых клеток). Нижеследующие эксперименты направлены на лучшее понимание механизма наблюдающейся in vivo противоопухолевой активности, однако никоим образом не предназначены для ограничения изобретения какой-либо из гипотез действительного механизма наблюдаемой активности.
Пример 1 - Запуск апоптоза in vitro в клеточных линиях лимфомы, культивируемых совместно с клетками CD34+ или NK-клетками, экспрессирующими TRAIL после опосредованного аденовирусом переноса гена
Оценивали эффекты совместного культивирования клеточных линий лимфомы с клетками CD34+ или NK-клетками, сконструированными с тем, чтобы они экспрессировали TRAIL после опосредованного аденовирусом переноса гена.
В первоначальных экспериментах in vitro аденовирусный вектор, экспрессирующий TRAIL (Ad-TRAIL), использовали для установления оптимальных условий аденовирусного инфицирования клеток CD34+ и NK-клеток. Период действия экспрессии TRAIL на клеточной поверхности клеток CD34+ и NK-клеток затем контролировали с применением конъюгированных с фикоэритрином (PE) анти-TRAIL-моноклональных антител (клон Rik-2). Наконец, способность мембранно-связанного TRAIL индуцировать апоптоз в клеточных линиях лимфомы оценивали при совместном культивировании клеток Ad-TRAIL/CD34+ или Ad-TRAIL/NK-клеток и клеточных линий лимфомы.
Способы
Аденовирус, кодирующий ген TRAIL человека. В этих экспериментах применяли дефектно реплицируемый аденовирус, кодирующий ген TRAIL человека (Ad-TRAIL), экспрессирующийся под промотором CMV [39]. Ad-TRAIL содержит полную кодирующую последовательность TRAIL человека, клонированную в сайтах XhoI и NoiI pAd5CMVK-NpA. Полученную плазмиду и основные аденовирусные последовательности (Ad5) с делецией гена E1 трансфицировали в эмбриональные почечные клетки [линии] 293 человека, выделяли вирусные частицы и амплифицировали для анализа экспрессии TRAIL. Рекомбинантные аденовирусы проверяли на наличие способного к репликации вируса с помощью теста на бляшкообразование A549, а титр вируса определяли бляшкообразованием на клетках [линии] 293. Очищенные вирусы помещали в фосфатный буфер (PBS) с 3% сахарозы и хранили при -80°С до использования. Продукт гена TRAIL экспрессировался на клеточной поверхности трансдуцированных клеток и мог быть обнаружен с помощью проточной цитометрии.
Аденовирусная трансдукция клеток CD34+. Клетки CD34+ для трансдукции Ad-TRAIL были получены из периферической крови давших на это согласие раковых пациентов, получавших химиотерапию и леченных гемопоэтическими факторами роста. Клетки CD34+ из образцов лейкофереза обогащались с помощью иммуномагнитной техники и позитивного отбора (Miltenyi Biotech). Для аденовирусной трансдукции клетки CD34+ наносили [при плотности] 2 × 106/мл на 35 мм чашки Петри в 1 мл бессывороточной среды (IMDM), содержащей соответствующее разведение исходного Ad-TRAIL, позволяющего получить конечный уровень инфицирования в диапазоне от 100 до 1000. После инкубации (37°С, 5% CO2) в течение 2 часов к культурам добавляли 1 мл IMDM/FBS (фетальной телячьей сыворотки) 20%, а 4 часа спустя добавляли GeneBooster (1:200). Затем клетки инкубировали в течение 18 часов, после чего тщательно отмывали (3×) в среде, содержащей сыворотку, и, наконец, оценивали эффективность трансдукции по прямой иммунофлуоресценции с применением PE-конъюгированных анти-TRAIL-антител.
Аденовирусная трансдукция NK-клеток. NK-клетки для трансдукции получали из периферической крови давших на это согласие здоровых доноров. NK-клетки обогащали с помощью иммуномагнитной техники и позитивного отбора (Miltenyi Biotech). Перед трансдукцией NK-клетки инкубировали (18 часов, 37°С) в RPMI-1640 с добавлением 10% FBS и N-ацетилцистеина (10 мМ). Для аденовирусной трансдукции NK-клетки помещали [при плотности] 2 × 106/мл на 35 мм чашки Петри в 1 мл бессывороточной среды (RPMI-1640), содержащей в подходящем разведении исходный Ad-TRAIL, с получением конечной множественности инфицирования (или заражения) (MOI) в диапазоне от 50 до 500. После инкубации (37°С, 5% CO2) в течение 2 часов к культурам добавляли 1 мл RPMI-1640/FBS20%, а 4 часа спустя добавляли GeneBooster (1:200). Клетки дополнительно инкубировали в течение 18 часов, затем тщательно отмывали (3×) в среде, содержащей сыворотку, и, наконец, эффективность трансдукции оценивали по прямой иммунофлуоресценции с помощью PE-конъюгированных анти-TRAIL-антител.
Совместные культуры. Активность клеток CD34+ или NK-клеток, экспрессирующих TRAIL на своей наружной мембране, в запуске апоптоза тестировали in vitro в экспериментах по совместному культивированию. Кратко, клетки Ad-TRAIL/CD34+ или Ad-TRAIL/NK-клетки (эффекторные клетки) культивировали совместно с клетками лимфомы (клетки-мишени). Индукцию апоптоза оценивали через 24 и 48 часов после начала совместного культивирования. В этих экспериментах соотношение «эффекторные клетки: клетки-мишени» рассчитывали на основе эффективности трансдукции эффекторных клеток.
Результаты
Аденовирусная трансдукция клеток CD34+. Предварительные эксперименты показали, что оптимальная эффективность трансдукции клеток CD34+ последовательно достигалась воздействием на клетки CD34+ (2 × 106/мл) градуального MOI Ad-TRAIL (диапазон 100 - 1000) в бессывороточных условиях в течение 2 часов (37°С). Затем добавляли равный объем среды с добавлением сыворотки (IMDM/FBS 20%), а 4 часа спустя к культурам добавляли Gene Booster (1:200), и дополнительно инкубировали в течение 18 часов. В конце клетки тщательно отмывали (3×) в среде, содержащей сыворотку, и оценивали экспрессию трансгена по прямой иммунофлуоресценции с использованием PE-конъюгированных анти-TRAIL-антител.
Тогда как в контрольных клетках фоновый сигнал TRAIL не был обнаружен, в клетках, на которые воздействовал Ad, выявили [определенный] процент TRAIL-позитивных клеток CD34+, который повышался, в зависимости от MOI. В репрезентативном эксперименте процент TRAIL-позитивных клеток CD34+ составлял 25% и 84% при MOI 100 и 1000 соответственно.
Описанный выше протокол инфицирования соответственно приводил к максимальной эффективности переноса гена в клетки CD34+, экспрессирующие TRAIL, при MOI, равной 1000, со средним значением (± стандартное отклонение (SD)) 83 ± 8% (в диапазоне 70 - 95%, n = 5). На жизнеспособность клеток, оцениваемую по тесту на высвобождение красителя трипанового синего, MOI до 1000 не влияла (>85% жизнеспособных клеток).
Чтобы оценить временной характер экспрессии трансгена, клетки CD34+ трансдуцировали MOI 1000 и анализировали на предмет экспрессии TRAIL до 7 дней после трансдукции. В этих экспериментах, чтобы обеспечить выживание клеток CD34+, в культуру добавляли малые дозы (3 нг/мл) гранулоцитарного колониестимулирующего фактора (G-CSF). Как показано в таблице 1, существенный процент клеток CD34+ (25%) продолжал экспрессировать TRAIL до 120 часов после трансдукции.
Дополнительное время экспрессии трансгена клетками CD34+, трансдуцированными Ad-TRAIL
Аденовирусная трансдукция NK-клеток. Предварительные эксперименты показали, что оптимальная эффективность трансдукции NK-клеток соответственно достигается путем преинкубации NK-клеток в течение 18 часов с N-ацетилцистеином (10 мМ). После преинкубации NK-клетки (2 × 106/мл) подвергались градуальной MOI Ad-TRAIL (диапазон 50-500) в бессывороточных условиях в течение 2 часов (37°С). Затем добавляли равный объем среды с добавлением сыворотки (RPMI-1640/FBS 20%), а 4 часа спустя добавляли Gene Booster (1:200) и далее инкубировали в течение 18 часов. Наконец, клетки тщательно отмывали (3×) в среде, содержащей сыворотку, и оценивали экспрессию трансгена по прямой иммунофлуоресценции с использованием PE-конъюгированных анти-TRAIL-антител.
Клетки, на которые воздействовал Ad, демонстрировали процент TRAIL-позитивных NK-клеток, который возрастал в зависимости от MOI. В репрезентативном эксперименте проценты TRAIL-позитивных NK-клеток составляли 30%, 45% и 46% при MOI 50, 100 и 500 соответственно.
Вышеописанный протокол инфицирования стойко давал максимальную эффективность переноса гена при MOI, равной 100, со средним значением (±SD) 61 ± 18% (диапазон 45 - 84%, n = 4) NK-клеток, экспрессирующих TRAIL. На жизнеспособность клеток, оцениваемую по тесту на высвобождение красителя трипанового синего, MOI на уровне 100 не влияла (>85% жизнеспособных клеток).
Чтобы оценить период экспрессии трансгена, NK-клетки трансдуцировали MOI 100 и анализировали на экспрессию TRAIL до 7 дней после трансдукции. Как показано в Таблице 2, трансдуцированные NK-клетки продолжали экспрессировать TRAIL до 168 часов после трансдукции.
Дополнительное время экспрессии трансгена NK-клеток, трансдуцированных Ad-TRAIL
Совместные культуры. В конце оценивали способность мембранно-связанного TRAIL запускать апоптоз в лимфоидных клеточных линиях путем совместного культивирования клеток Ad-TRAIL/CD34+ или Ad-TRAIL/NK-клеток (эффекторные клетки) и опухолевых клеточных линий (клетки-мишени). Для этих экспериментов были избраны две клеточные линии в соответствии с их чувствительностью к растворимому TRAIL. В частности, использовали чувствительную к TRAIL клеточную линию KMS-11 и TRAIL-резистентную клеточную линию JVM-2.
Клетки CD34+ или NK-клетки, трансдуцированные при оптимальных условиях в соответствии с протоколами инфицирования, описанными выше, собирали через 24 часа после первичного воздействия аденовируса, тщательно отмывали и культивировали совместно с клетками KMS-11 или JVM-2.
Когда клетки Ad-TRAIL/CD34+ культивировались совместно в соотношении «эффекторные клетки: клетки-мишени» 0,8:1, существенная часть (81%) апоптотических и некротических клеток обнаруживается среди клеток KMS-11 через 24 часа совместного культивирования. Количество апоптотических клеток затем возрастает после 48 часов совместного культивирования (93% апоптотических клеток).
Когда Ad-TRAIL/NK-клетки совместно культивировались при соотношении «эффекторные клетки: клетки-мишени» 0,6:1, существенная часть (83%) апоптотических и некротических клеток обнаруживается среди клеток KMS-11 через 24 часа совместного культивирования. Количество апоптотических клеток затем возрастает после 48 часов совместного культивирования (85% апоптотических клеток).
Для TRAIL-чувствительной клеточной линии KMS-11 мощность апоптотического эффекта, вызываемого мембрано-связанным TRAIL, было сходным с таковым, вызванным 24 - 48-часовым воздействием большой дозы (100 нг/мл) растворимого TRAIL (Таблица 3). Однако данный фармакокинетический профиль TRAIL после внутривенной инъекции (время полужизни в плазме - 32 минуты и полупериод выведения - 4,8 часа) при непрерывном 48- или даже 24-часовом воздействии при уровне 100 нг/мл не может быть достигнут in vivo.
Влияние растворимого TRAIL на клетки KMS-11
Были также выполнены эксперименты по совместной инкубации клеток Ad-TRAIL/CD34+ или Ad-TRAIL/NK-клеток с резистентной к растворимому TRAIL клеточной линией JVM-2.
Когда клетки Ad-TRAIL/CD34+ культивировались совместно при соотношении «эффекторные клетки: клетки-мишени» 0,8:1, через 48 часов совместного культивирования обнаруживалась существенная часть (51%) апоптотических и некротических клеток TRAIL-резистентной [линии] JVM-2.
Когда Ad-TRAIL/NK-клетки культивировались совместно при соотношении «эффекторные клетки: клетки-мишени» 0,6:1, через 48 часов совместного культивирования обнаруживалась существенная часть (53%) апоптотических и некротических клеток TRAIL-резистентной [линии] JVM-2.
На TRAIL-резистентной клеточной линии JVM-2 мощность апоптотического эффекта, вызванного мембранно-связанным TRAIL, была достоверно выше, чем вызванного 48-часовым воздействием большой дозы (100 нг/мл) растворимого TRAIL (Таблица 4).
Влияние растворимого TRAIL на клетки JVM-2
Для дальнейшего изучения мощности апоптотической активности опосредованного клетками выделения TRAIL эффекторные клетки (клетки Ad-TRAIL/CD34+ или Ad-TRAIL/NK-клетки) культивировали совместно с клетками-мишенями (клеточная линия KMS-11) в течение 24 часов при различных соотношениях «эффектор: мишень».
Как показано в Таблице 5, клетки Ad-TRAIL/CD34+ запускают апоптоз или некроз в значительной доле (66%) клеток KMS-11 при совместном культивировании при соотношении эффектор: мишень 0,4:1.
Индукция апоптоза при совместном культивировании клеток Ad-TRAIL/CD34+ и клеток KMS-11 в течение 24 часов при возрастающих соотношениях «эффектор: мишень» (E:T)
Как показано в Таблице 6, Ad-TRAIL/NK-клетки запускают апоптоз или некроз в значительной доле (64%) клеток KMS-11 при совместном культивировании при соотношении эффектор: мишень, составляющем 0,3:1.
Индукция апоптоза при совместном культивировании Ad-TRAIL/NK-клеток и клеток KMS-11 в течение 24 часов при возрастающих соотношениях E:T
Пример 2 - Оценка противораковой активности клеток CD34+ или NK-клеток, сконструированных для экспрессии TRAIL после опосредованного аденовирусом переноса гена, на мышах NOD/SCID in vivo
Чтобы исследовать терапевтический потенциал клеток Ad-TRAIL/CD34+ или Ad-TRAIL/NK-клеток, мышам NOD/SCID вводили TRAIL-чувствительную клеточную линию множественной миеломы KMS-11. Затем мышам инъецировали клетки Ad-TRAIL/CD34+ или Ad-TRAIL/NK-клетки, и выживание мышей служило показателем противоопухолевой эффективности выделения TRAIL клетками.
Способы
Оценка противоопухолевой активности клеток Ad-TRAIL/CD34+ или Ad-TRAIL/NK-клеток. Самок мышей NOD/SCID в возрасте шести-восьми недель с весом тела 20-25 г приобретали на фирме Charles River (Милан, Италия). Мышей помещали в стандартные лабораторные условия в соответствии с установленными правилами. Экспериментальные процедуры на животных были одобрены Комитетом по этике экспериментов на животных Национального Ракового Института (Istituto Nazionale Tumori) и выполнялись в соответствии с правилами Координационного Комитета по Раковым Исследованиям Соединенного Королевства.
Мышам внутривенно (в/в) вводили клетки KMS-11 (0,5 × 106 на мышь). Лечение клетками Ad-TRAIL/CD34+ или Ad-TRAIL/NK-клетками (1 × 106 на мышь) состояло в еженедельных в/в-инъекциях в течение 4 недель, начиная с 7-го или 17-го дня после введения опухолевых клеток. Средняя эффективность трансдукции повторно вводимых клеток Ad-TRAIL/CD34+ или Ad-TRAIL/NK-клеток составила 83 ± 8% и 61 ± 18% соответственно. Таким образом, каждая мышь получала в среднем 3,32 × 106 экспрессирующих TRAIL клеток CD34+ и 2,44 × 106 экспрессирующих TRAIL NK-клеток за четыре инъекции. Мышей дважды в неделю проверяли на появление опухоли, вес тела и токсичность. Регистрировали срок выживания в каждой группе и оценивали различия между группами с помощью статистического анализа. Соответствующие контрольные группы включали в себя (i) мышей, инъецированных только опухолевыми клетками, (iii) мышей, инъецированных опухолевыми клетками плюс нетрансдуцированными клетками CD34+ или NK-клетками.
Результаты
Клетки Ad-TRAIL/CD34+. Мышей, которым были пересажены клетки KMS-11 (0,5 × 106 на мышь), лечили четырьмя в/в-инъекциями клеток Ad-TRAIL/CD34+ на еженедельной основе в соответствии с двумя разными режимами, т.е. лечение ранней стадии опухоли, которое начиналось на 7-й день, и лечение продвинутой стадии опухоли, которое начиналось на 17-й день после инъекции клеток KMS-11. Так как средняя эффективность трансдукции повторно вводимых клеток Ad-TRAIL/CD34+ составляла 83 ± 8% (среднее ± SD, n = 9), каждая мышь получала в среднем 3,32 × 106 экспрессирующих TRAIL клеток CD34+ за четыре инъекции.
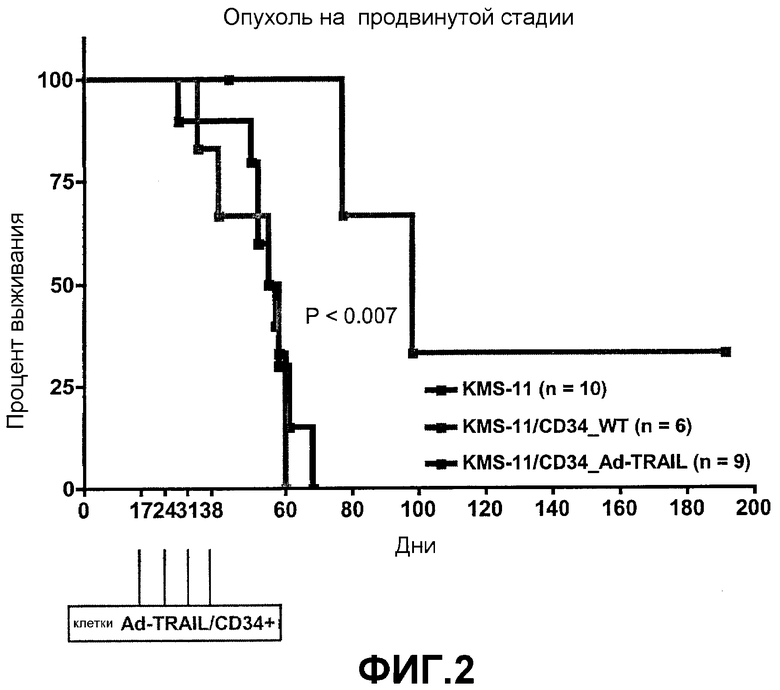
Как показано на фиг.1, средняя выживаемость мышей NOD/SCID, инъецированных только клетками KMS-11, составила 56 дней. Инъекция клеток CD34+ дикого типа не влияла на среднюю выживаемость (56 дней), тогда как мыши NOD/SCID, которых лечили клетками Ad-TRAIL/CD34+ на ранней стадии опухоли, имели среднюю выживаемость в 111 дней (P <0,0001).
Эффект лечения с помощью Ad-TRAIL/CD34+ на продвинутой стадии опухоли изображен на фиг.2. Средняя выживаемость мышей NOD/SCID, инъецированных только клетками KMS-11, составила 56 дней. Инъекция клеток CD34+ дикого типа не влияла на среднюю выживаемость (56 дней), тогда как лечение с помощью клеток Ad-TRAIL/CD34+ на продвинутой стадии опухоли было связано с достоверным возрастанием средней выживаемости (98 дней, P <0,007).
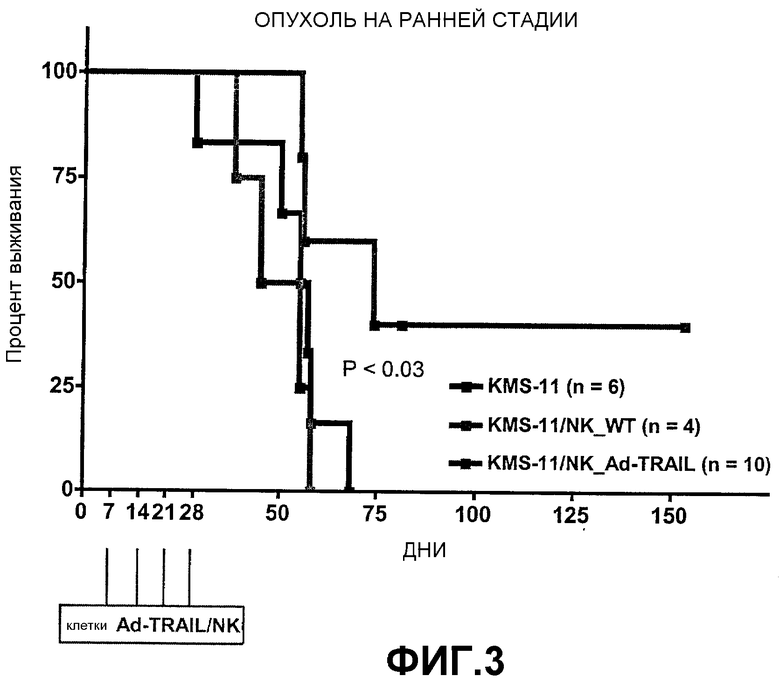
Ad-TRAIL/NK-клетки. Мышей, которым были пересажены клетки KMS-11 (0,5 × 106 на мышь), лечили четырьмя в/в-инъекциями Ad-TRAIL/NK-клеток на еженедельной основе. Повторные вливания NK-клеток начинались на 7-й день после инъекции клеток KMS-11 на ранней стадии роста опухоли. В этих экспериментах средняя эффективность трансдукции вводимых Ad-TRAIL/NK-клеток составила 61 ± 18%. Таким образом, каждая мышь получала в среднем 2,44 × 106 экспрессирующих TRAIL NK-клеток за четыре инъекции.
Как показано на фиг. 3, средняя выживаемость мышей NOD/SCID, инъецированных только клетками KMS-11, составила 56 дней. Инъекция NK-клеток дикого типа не влияла на среднюю выживаемость (50 дней), тогда как лечение Ad-TRAIL/NK-клетками на ранней стадии опухоли было связано с достоверным увеличением средней выживаемости (74 дня, P <0,03).
Пример 3 - Противоопухолевая активность клеток CD34/Ad-TRAIL in vitro против клеточных линий рака молочной железы
Значительная часть клеточных линий рака молочной железы резистентна к индуцированному TRAIL апоптозу в результате действия множества механизмов, включающих в себя секвестрирование TRAIL неспецифическими рецепторами TRAIL, утрату экспрессии рецепторов R1 и R2, сверхпродукцию FLIP и т.д. [40]. Основываясь на своих предшествующих результатах, показывающих, что резистентные к растворимому TRAIL (sTRAIL) клеточные линии лимфомы действительно становятся чувствительными к TRAIL при воздействии мембранно-связанного TRAIL (mTRAIL), авторы исследовали чувствительность двух клеточных линий рака молочной железы к sTRAIL и mTRAIL.
Чувствительность клеточных линий рака молочной железы к уничтожающему эффекту sTRAIL оценивали по сравнению с оценкой запуска апоптоза in vitro в sTRAIL-чувствительных и sTRAIL-резистентных клеточных линиях рака молочной железы, культивируемых совместно с клетками CD34/Ad-TRAIL.
Использовали две клеточные линии рака молочной железы, т.е. MCF-7 и MDA-MB-361. Чтобы оценить чувствительность индивидуальных клеточных линий к уничтожающему эффекту sTRAIL, опухолевые клетки (5-10 × 104/мл) в течение 72 часов подвергали воздействию низкой (10 нг/мл) и высокой (100 нг/мл) доз sTRAIL. Затем апоптоз оценивали по двойному окрашиванию аннексин-V/пропидиум йодидом.
Способы
Клеточные линии. Клеточные линии рака молочной железы MCF-7 и MDA-MB-361 были приобретены на фирмах DSMZ (Брауншвейг, Германия, Евросоюз) и ATCC (Манассас, Вирджиния, США) соответственно. Клетки периодически проверяли полимеразной цепной реакцией на контаминацию микоплазмой. Все эксперименты in vitro выполнялись на экспоненциально растущих клетках.
Экспрессия аннексина-V. Анализ с помощью аннексина V-FITC (флуоресциенизотиоцианат) (PharMingen) использовали для количественного определения процента клеток, претерпевающих ранний или поздний апоптоз и некроз. Кратко, анализируемые клетки отмывали дважды холодным PBS, а затем ресуспендировали в связывающем буфере (10 нМ HEPES, 140 нМ NaCl, 5 нМ CaC12, pH 7,4). После инкубации 0,1 мл клеточной суспензии переносили в 5 мл культуральную пробирку и добавляли 5 мкл аннексин V-FITC и 10 мкл пропидиум йодида. После интенсивного перемешивания образцы инкубировали в течение 15 мин при комнатной температуре в темноте. В конце инкубации добавляли 0,4 мл связывающего буфера и клетки немедленно анализировали с помощью проточной цитометрии.
Результаты
Чтобы исследовать, связана ли инкубация с sTRAIL с запуском апоптоза, клеточные линии MCF-7 и MDA-MB-361 подвергали воздействию sTRAIL (10 - 100 нг/мл, 72 часа), а затем процент апоптотических и некротических клеток определяли с помощью анализа на клеточном сортере с возбуждением флуоресцеции (FACS). Как показано в Таблице 7, воздействие sTRAIL не могло индуцировать апоптотический ответ в клетках MCF-7, тогда как оно проявилось в достоверном ответе в виде гибели клеток MDA-MB-361 при воздействии 100 нг/мл sTRAIL в течение 72 часов. В соответствии с этими результатами MCF-7 является sTRAIL-резистентной клеточной линией, тогда как MDA-MB-361 является sTRAIL-чувствительной клеточной линией.
Чувствительность клеточных линий рака молочной железы к sTRAIL
После этого оценивали запуск апоптоза in vitro в клеточных линиях рака молочной железы, культивируемых совместно с клетками CD34+, экспрессирующими TRAIL после опосредованного аденовирусом переноса гена (CD34/Ad-TRAIL).
Способы
Аденовирус, кодирующий ген TRAIL человека. Для этих экспериментов использовали дефектно реплицируемый аденовирус, кодирующий ген TRAIL человека (Ad-TRAIL), экспрессирующийся под промотором CMV [39]. Ad-TRAIL содержит полную кодирующую последовательность TRAIL человека, клонированную в сайтах XhoI и NotI pAd5CMVK-NpA. Образовавшуюся плазмиду и основные аденовирусные последовательности (Ad5) с делецией гена E1 трансфицировали в эмбриональные почечные клетки человека [линии] 293, выделяли вирусные частицы и амплифицировали для анализа экспрессии TRAIL. Рекомбинантные аденовирусы проверяли на наличие способного к репликации вируса с помощью теста на бляшкообразование A549, а титр вируса определяли бляшкообразованием на клетках [линии] 293. Очищенные вирусы помещали в PBS с 3% сахарозы и хранили при -80°С до использования. Продукт гена TRAIL экспрессировался на клеточной поверхности трансдуцированных клеток и мог быть обнаружен с помощью проточной цитометрии.
Аденовирусная трансдукция клеток CD34+. Клетки CD34+, трансдуцируемые Ad-TRAIL, были получены из периферической крови давших на это согласие раковых больных, получавших химиотерапию и леченных гемопоэтическими факторами роста. Клетки CD34+ из образцов лейкофереза обогащались с помощью иммуномагнитной техники и позитивного отбора (Miltenyi Biotech). Для аденовирусной трансдукции клетки CD34+ наносили [с плотностью] 2 × 106/мл на 35 мм чашки Петри в 1 мл бессывороточной среды (IMDM), содержащей соответствующее разведение исходного Ad-TRAIL, что давало возможность для множественности инфицирования (MOI) - 500. После инкубации (37°С, 5% CO2) в течение 2 часов к культурам добавляли 1 мл IMDM/FBS 20%, а 4 часа спустя добавляли GeneBooster (1:200). Далее, клетки инкубировали в течение 18 часов, затем тщательно отмывали (3×) в среде, содержащей сыворотку, и, наконец, оценивали эффективность трансдукции по прямой иммунофлуоресценции с помощью PE-конъюгированных анти-TRAIL-антител.
Совместные культуры. Активность mTRAIL, запускающую апоптоз, тестировали in vitro с помощью экспериментов по совместному культивированию. Кратко, клетки CD34/Ad-TRAIL (эффекторные клетки) культивировали совместно с клетками рака молочной железы (клетки-мишени). Индукцию апоптоза оценивали через 48 часов после начала совместного культивирования. В этих экспериментах использовались соотношения «эффектные клетки: клетки-мишени», составляющие 1:1 и 4:1.
Результаты
Аденовирусная трансдукция клеток CD34+. Оптимальная эффективность трансдукции клеток CD34+ достигалась последовательным воздействием на клетки CD34+ (2 × 106/мл) Ad-TRAIL при MOI - 500 в бессывороточных условиях в течение 2 часов (37°С). Тогда как в контрольных клетках фонового сигнала TRAIL не обнаруживалось, клетки, экспрессирующие TRAIL, демонстрировали процент TRAIL-позитивных клеток CD34+ 93 ± 8% (среднее ± SD). На жизнеспособность клеток, оцениваемую в тесте на высвобождение красителя трипанового синего, MOI -1,000 не влияла (≥ 85% жизнеспособных клеток).
Совместные культивирования. Авторами оценивалась способность mTRAIL запускать апоптоз в клеточных линиях рака молочной железы путем совместного культивирования клеток CD34/Ad-TRAIL (эффекторные клетки) и опухолевых клеток (клетки-мишени). Клетки CD34/Ad-TRAIL собирали через 24 часа после первоначального воздействия на аденовирус, тщательно отмывали и культивировали совместно с клетками MCF-7 или MDA-MB-361. В этих экспериментах использовали два соотношения «эффекторные клетки: клетки-мишени», т.е. 1:1 и 4:1. Результаты суммированы в Таблице 8.
Уничтожающая опухолевые клетки активность mTRAIL в отношении клеточных линий рака молочной железы
Достоверная доля гибели клеток обнаружилась при совместном культивировании в течение 48 часов клеток CD34/Ad-TRAIL с sTRAIL-чувствительными клетками MDA-MB-361 при соотношении E:T 1:1 (гибель клеток = 28%) и при соотношении E:T 4:1 (гибель клеток = 50%).
В отношении sTRAIL-чувствительной клеточной линии MDA-MB-361 мощность апоптотического эффекта, вызываемого воздействием mTRAIL была сходна с таковой, вызываемой 72-часовым воздействием высокой дозы (100 нг/мл) sTRAIL (Таблица 7).
Чтобы проверить то обстоятельство, что цитотоксический эффект CD34/Ad-TRAIL действительно возникает благодаря mTRAIL, клетки MDA-MB-361 культивировали совместно с ложно трансдуцированными клетками CD34+. Как показано в Таблице 2, совместное культивирование клеток MDA-MB-361 с ложно трансдуцированными клетками CD34+ было связано с умеренным эффектом гибели клеток, обнаруживаемым только при высшем соотношении E:T. Такая умеренная индукция гибели клеток, вероятно, связана с избыточной плотностью культуры.
Чтобы исключить возможность того, что активность CD34/Ad-TRAIL, [приводящая] к гибели клеток, связана со свободными аденовирусными частицами, которые не отмылись в конце инфицирования CD34 Ad-TRAIL, клетки MDA-MB-361 подвергали воздействию в 106 бляшкообразующих единиц (pfu). Никаких доказательств клеточной токсичности не удалось обнаружить при воздействии 106 вирусных частиц на клетки MDA-MB-361 (Таблица 8).
Величину pfu рассчитывали следующим образом.
Чтобы инфицировать 5 × 105 клеток CD34+ при величине MOI, составляющей 500, использовали 250 × 106 pfu, которые добавляли к 1 мл суспензии клеток CD34+.
В конце инфицирования клетки CD34+ 3 раза отмывали в культуральной среде. Для каждой процедуры отмывки использовали разведение 1:20, т.е. культуральную суспензию разбавляли по меньшей мере в 8000 раз.
Исходя из предположения, что в конце процедуры отмывки в суспензионной культуре остается еще 250 × 106 pfu, ее разбавляли в 8000 раз, т.е. ожидали, что к совместной культуре добавлялось <50,000 оставшихся pfu.
Таким образом, чтобы исключить, что активность, вызывающая гибель клеток, обнаруживаемая в совместной культуре, связана со свободными аденовирусными частицами, которые не были отмыты, на клеточные линии рака молочной железы воздействовали количеством pfu, равным теоретическому значению остаточных pfu (см. #3), умноженному на 20 (т.е. 50000 × 20 = 106 pfu).
Затем эксперименты по совместному культивированию выполняли путем инкубации клеток CD34/Ad-TRAIL с sTRAIL-резистентной клеточной линией MCF-7. В этих экспериментах обнаруживалась достоверная доля гибели клеток при совместном культивировании в течение 48 часов клеток CD34/Ad-TRAIL с sTRAIL-резистентными клетками MCF-7 при соотношении E:T, равном 4:1 (клеточная гибель = 64%), тогда как при соотношении E:T, равном 1:1, клеточной гибели обнаружить не удавалось.
В отношении sTRAIL-резистентной клеточной линии MCF-7 мощность апоптотического эффекта, вызываемого 48-часовым воздействием mTRAIL, была достоверно выше, чем таковая, вызываемая 72-часовым воздействием большой дозы (100 нг/мл) sTRAIL (Таблицы 7 и 8).
Чтобы убедиться, что цитотоксический эффект CD34/Ad-TRAIL действительно связан с mTRAIL, клетки MCF-7 культивировали совместно с ложно трансдуцированными клетками CD34+. Как показано в Таблице 8, совместное культивирование клеток MCF-7 с ложно трансдуцированными клетками CD34+ было сопряжено с умеренным эффектом клеточной гибели, который, вероятно, обусловлен избыточной плотностью культуры.
Чтобы исключить возможность того, что активность CD34/Ad-TRAIL, вызывающая клеточную гибель, связана со свободными аденовирусными частицами, которые остались не отмытыми в конце инфицирования CD34 Ad-TRAIL, клетки MCF-7 подвергали воздействию 106 pfu. Доказательств того, что клеточная токсичность наблюдается при воздействии 106 pfu на клетки MCF-7, не обнаружено (Таблица 8).
Список литературы
1. Danial, N.N. and S.J. Korsmeyer, Cell death: critical control points. Cell, 2004. 116(2): p. 205-19.
2. Blagosklonny, M.V., Prospective strategies to enforce selectively cell death in cancer cells. Oncogene, 2004. 23(16): p. 2967-75.
3. Waxman, D.J. and P.S. Schwartz, Harnessing apoptosis for improved anticancer gene therapy. Cancer Res, 2003. 63(24): p. 8563-72.
4. Ashkenazi, A. and V.M. Dixit, Death receptors: signaling and modulation. Science, 1998. 281(5381): p. 1305-8.
5. Ashkenazi, A. and V.M. Dixit, Apoptosis control by death and decoy receptors. Curr Opin Cell Biol, 1999. 11(2): p. 255-60.
6. Wang, S. and W.S. El-Deiry, TRAIL and apoptosis induction by TNF-family death receptors. Oncogene, 2003. 22(53): p. 8628-33.
7. Almasan, A. and A. Ashkenazi, Apo2L/TRAIL: apoptosis signaling, biology, and potential for cancer therapy. Cytokine Growth Factor Rev, 2003. 14(3-4): p. 337-48.
8. LeBlanc, H., et al., Tumor-cell resistance to death receptor-induced apoptosis through mutational inactivation of the proapoptotic Bcl-2 homolog Bax. Nat Med, 2002. 8(3): p. 274-81.
9. Ashkenazi, A., et al., Safety and antitumor activity of recombinant soluble Apo2 ligand. J. Clin. Invest., 1999. 104(2): p. 155-162.
10. Walczak, H., et al., Tumoricidal activity of tumor necrosis factor-related apoptosis-inducing ligand in vivo. Nat Med, 1999. 5(2): p. 157-63.
11. Mitsiades, C.S., et al., TRAIL/Apo2L ligand selectively induces apoptosis and overcomes drug resistance in multiple myeloma: therapeutic applications. Blood, 2001. 98(3): p. 795-804.
12. Fulda, S., et al., Smac agonists sensitize for Apo2L/TRAIL- or anticancer drug-induced apoptosis and induce regression of malignant glioma in vivo. Nature Medicine, 2002. 8(8): p. 808-815.
13. Pollack, I.F., M. Erff, and A. Ashkenazi, Direct stimulation of apoptotic signaling by soluble Apo2L/tumor necrosis factor-related apoptosis-inducing ligand leads to selective killing of glioma cells. Clinical Cancer Research, 2001. 7(5): p. 1362-1369.
14. Lawrence, D., et al., Differential hepatocyte toxicity of recombinant Apo2L/TRAIL versions. Nat Med, 2001. 7(4): p. 383-5.
15. Qin, J., et al., Avoiding premature apoptosis of normal epidermal cells. Nature Medicine, 2001. 7(4): p. 385-386.
16. Jo, M., et al., Apoptosis induced in normal human hepatocytes by tumor necrosis factor-related apoptosis-inducing ligand. Nat Med, 2000. 6(5): p. 564-7.
17. Johnston, J.B., et al., Role of the TRAIL/APO2-L death receptors in chlorambucil- and fludarabine-induced apoptosis in chronic lymphocytic leukemia. Oncogene, 2003. 22(51): p. 8356-69.
18. Yamanaka, Т., et al., Chemotherapeutic agents augment TRAIL-induced apoptosis in human hepatocellular carcinoma cell lines. Hepatology, 2000. 32(3): p. 482-90.
19. Armeanu, S., et al., Adenoviral gene transfer of tumor necrosis factor-related apoptosis-inducing ligand overcomes an impaired response of hepatoma cells but causes severe apoptosis in primary human hepatocytes. Cancer Res, 2003. 63(10): p. 2369-72.
20. Voelkel-Johnson, С., D.L. King, and J.S. Norris, Resistance of prostate cancer cells to soluble TNF-related apoptosis-inducing ligand (TRAIL/Apo2L) can be overcome by doxorubicin or adenoviral delivery of full-length TRAIL. Cancer Gene Ther, 2002. 9(2): p. 164-72.
21. McCormick, F., Cancer gene therapy: fringe or cutting edge? Nat Rev Cancer, 2001. 1(2): p. 130-41.
22. Somia, N. and I.M. Verma, Gene therapy: trials and tribulations. Nat Rev Genet, 2000. g(2): p. 91-9.
23. Griffith, T.S. and E.L. Broghammer, Suppression of tumor growth following intralesional therapy with TRAIL recombinant adenovirus. Mol Ther, 2001. 4(3): p. 257-66.
24. Harrington, К., et al., Cells as vehicles for cancer gene therapy: the missing link between targeted vectors and systemic delivery? Hum Gene Ther, 2002. 13(11): p. 1263-80.
25. Rafii, S. and D. Lyden, Therapeutic stem and progenitor cell transplantation for organ vascularization and regeneration. Nat Med, 2003. 9(6): p. 702-12.
26. Rosenberg, S.A., Karnofsky Memorial Lecture. The immunotherapy and gene therapy of cancer. J Clin Oncol, 1992. 10(2): p. 180-99.
27. Hardy, C.L., The homing of hematopoietic stem cells to the bone marrow. Am J Med Sci, 1995. 309(5): p. 260-6.
28. Lapidot, Т., Mechanism of human stem cell migration and repopulation of NOD/SCID and B2mnull NOD/SCID mice. The role of SDF-1/CXCR4 interactions. Ann N Y Acad Sci, 2001. 938: p. 83-95.
29. Lapidot, T. and I. Petit, Current understanding of stem cell mobilization: the roles of chemokines, proteolytic enzymes, adhesion molecules, cytokines, and stromal cells. Exp Hematol, 2002. 30(9): p. 973-81.
30. Srour, E.F., et al., Homing, cell cycle kinetics and fate of transplanted hematopoietic stem cells. Leukemia, 2001. 15(11): p. 1681-4.
31. Clark, B.R., J.T. Gallagher, and T.M. Dexter, Cell adhesion in the stromal regulation of haemopoiesis. Baillieres Clin Haematol, 1992. 5(3): p. 619-52.
32. Deguchi, T. and Y. Komada, Homing-associated cell adhesion molecule (H-CAM/CD44) on human CD34+ hematopoietic progenitor cells. Leuk Lymphoma, 2000. 40(1-2): p. 25-37.
33. Tavassoli, M. and J.J. Minguell, Homing of hemopoietic progenitor cells to the marrow. Proc Soc Exp Biol Med, 1991. 196(4): p. 367-73.
34. Verfaillie, C.M., Adhesion Receptors as Regulators of the Hematopoietic Process. Blood, 1998. 92(8): p. 2609-2612.
35. Cooper, M.A., T.A. Fehniger, and M.A. Caligiuri, The biology of human natural killer-cell subsets. Trends Immunol, 2001. 22(11): p. 633-40.
36. Basse, P.H., T.L. Whiteside, and R.B. Herberman, Use of activated natural killer cells for tumor immunotherapy in mouse and human. Methods Mol Biol, 2000. 121: p. 81-94.
37. deMagalhaes-Silverman, M., et al., Posttransplant adoptive immunotherapy with activated natural killer cells in patients with metastatic breast cancer. J Immunother, 2000. 23(1): p. 154-60.
38. Rosenberg, S.A., et al., Prospective randomized trial of high-dose interleukin-2 alone or in conjunction with lymphokine-activated killer cells for the treatment of patients with advanced cancer. J. Natl. Cancer Inst, 1993. 85(8): p. 622-32.
39. Griffith, T.S., et al., Adenoviral-mediated transfer of the TNF-related apoptosis-inducing ligand/Apo-2 ligand gene induces tumor cell apoptosis. J Immunol, 2000. 165(5): p. 2886-94.
40. Kazhdan I. and R.A. Marciniak, Death receptor 4 (DR4) efficiently kills breast cancer cells irrespective of ther sensitivity to tumor necrosis factor-related apoptosis-inducing ligand (TRAIL). Cancer Gene Ther, 2004. 11: p.691-698.
Изобретение относится к области биотехнологии, конкретно к получению гемопоэтических клеток из крови, и может быть использовано в медицине. Гемопоэтическую клетку CD34+ выделяют из периферической крови раковых пациентов, прошедших курс лечения фактором роста. Полученную клетку трансдуцируют лигандом, индуцирующим апоптоз с участием фактора некроза опухоли, и используют для лечения опухолей. Изобретение позволяет получить гемопоэтическую клетку CD34+, обладающую противоопухолевой активностью. 2 н. и 4 з.п. ф-лы, 3 ил., 8 табл.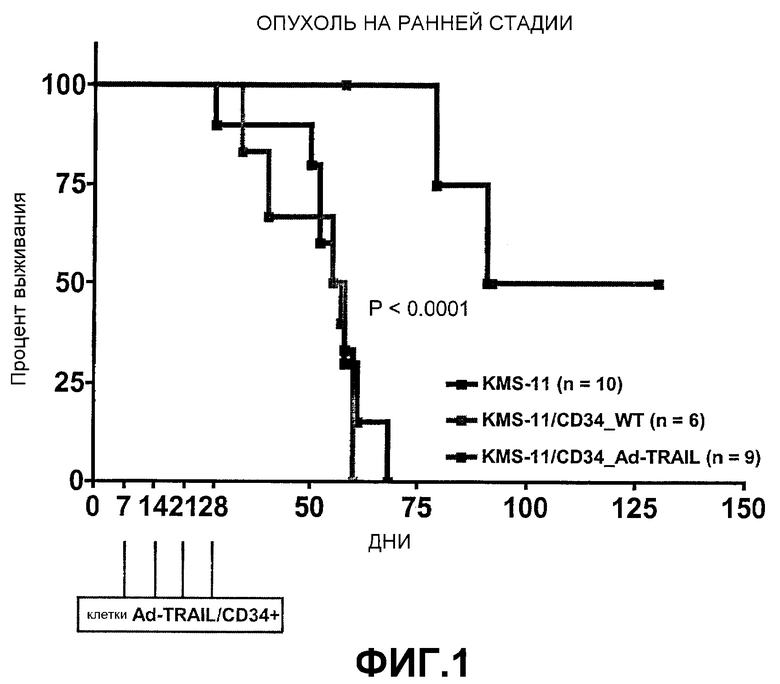
1. Гемопоэтическая клетка CD34+ из периферической крови раковых пациентов, прошедших курс лечения фактором роста, трансдуцированная лигандом, индуцирующим апоптоз с участием фактора некроза опухоли, и обладающая противоопухолевой активностью.
2. Клетка по п.1, которую можно получить путем трансдукции клеток CD34+ аденовирусными векторами, кодирующими лиганд, индуцирующий апоптоз с участием фактора некроза опухоли.
3. Применение клетки по п.1 или 2 для приготовления лекарственного средства для лечения опухолей.
4. Применение по п.3, где опухоль представляет собой лимфому.
5. Применение по п.3, где опухоль представляет собой карциному молочной железы.
6. Применение по пп.3, 4 или 5, где лекарственное средство предназначено для внутривенного введения.
| LEE J | |||
| et al., Cellular and genetic characterization of human adult bone marrow-derived neural stem-like cells: a potential antiglioma cellular vector | |||
| Cancer Res., 2003, v.63, n.24, p.8877-8889 | |||
| UCUR E | |||
| et al., Induction of apoptosis in experimental human В cell lymphomas by conditional TRAIL-expressing Т cells, J | |||
| Br | |||
| J | |||
| Cancer, 2003, Dec 1; |
Авторы
Даты
2010-05-27—Публикация
2005-07-21—Подача