По данной заявке испрашивается приоритет по предварительной заявке США № 60/966052, поданной 23 августа 2007 г., содержание которой включено в настоящий документ в качестве ссылки.
Изобретение, описанное в настоящем документе, было осуществлено при поддержке правительства США по гранту R01 HL62454 от National Institutes of Health и гранту с номером DAMRDCW81XWH-04-1-054 и гранту с номером DAMD17-03-1-0218 от Department of Defense. Таким образом, правительство США имеет определенные права на это изобретение.
По всей заявке различные публикации обозначены арабскими цифрами в скобках или по автору и дате публикации в скобках. Полные ссылки для этих публикаций представлены в конце описания. Описания этих публикаций включены в качестве ссылок в настоящую заявку для более полного описания области, к которой относится это изобретение.
Уровень техники, к которому относится изобретение
Развитие сосудов
В процессе эмбриогенеза млекопитающих образование сосудистой системы является ранним и необходимым процессом. В эмбрионе развитие сосудов начинается с плюрипотентного гемангиобласта, происходящего из мезодермы параксиальной и латеральной пластинки. Гемангиобласт обладает потенциалом к дифференцировке либо в гемопоэтического предшественника, либо в предшественника эндотелиальных клеток, известного как ангиобласт.
Развитие сосудов начинается с процесса, известного как васкулогенез, при котором ангиобласты дифференцируются в эндотелиальные клетки и мигрируют совместно с образованием эмбрионального сосудистого сплетения. Эта начальная сосудистая сеть состоит из сосудов, которые являются однородными по размеру и полностью состоят из эндотелиальных клеток. Затем происходит ремоделирование сосудистого сплетения посредством ангиогенеза.
Ангиогенез вовлекает рост новых сосудов, миграцию этих сосудов в бессосудистые области и привлечение вспомогательных клеток, перицитов и гладкомышечных клеток (Gale and Yancopoulos, 1999). Гладкомышечные клетки, которые дифференцируются и образуют сократительные стенки сосудов, происходят из множества предшественников, включая клетки нервного валика, мезенхимные клетки и даже эндотелиальные клетки (Owens, 1995). У взрослых ангиогенез вовлечен в развитие фолликулов, заживление ран и патологические процессы, такие как ангиогенез в опухоли и болезнь сердца.
Семейство Notch и лиганды Notch
Исследования на Drosophila, C. Elegans, данио-рерио и млекопитающих показали, что каскад Notch является эволюционно консервативным механизмом передачи сигнала, который функционирует, модулируя множество вариантов выбора клеточной судьбы. Передача сигнала Notch требуется для надлежащего структурирования клеток, происходящих из всех трех зародышевых слоев. В зависимости от клеточного окружения, передача сигнала Notch может как ингибировать, так и индуцировать дифференцировку, индуцировать пролиферацию и обеспечивать выживание клеток (Artavanis-Tsakonas et al., 1995; Lewis, 1998; Weinmaster, 1997). У Drosophila, один белок Notch активируется двумя лигандами, Serrate и Delta. У млекопитающих эти семейства расширены до четырех генов Notch (Notch1, Notch2, Notch3 и Notch4) и пяти лигандов, 2 Serrate-подобных (Jagged1-2) и 3 Delta (Dll, 3, 4) (Bettenhausen et al., 1995; Dunwoodie et al., 1997; Gallahan and Callahan, 1997; Lardelli et al., 1994; Lindsell et al., 1995; Shawber et al., 1996a; Shutter et al., 2000a; Uyttendaele et al., 1996; Weinmaster et al., 1992; Weinmaster et al., 1991). В процессе эмбриогенеза рецепторы и лиганды Notch экспрессируются в динамических пространственных и временных профилях. Однако не известно, активируют ли все лиганды все рецепторы.
Передача сигнала и функция Notch
Передача сигнала Notch влияет на множество различных вариантов выбора клеточной судьбы путем предоставления ингибиторных, индуктивных или пролиферативных сигналов, в зависимости от окружающих условий (рассмотрено в Artavanis-Tsakonas et al., 1995; Greenwald, 1998; Robey, 1997; Vervoort et al., 1997). Эта плейотропная функция указывает на то, что Notch модулирует множество каскадов передачи сигнала пространственно-временным образом.
В соответствии с регуляцией Notch выбора клеточной судьбы, как рецепторы, так и лиганды представляют собой белки клеточной поверхности с отдельными трансмембранными доменами (фигура 1). Регуляторный внеклеточный домен белков Notch состоит, главным образом, из последовательно расположенных EGF-подобных повторов, которые требуются для связывания лиганда (Artavanis-Tsakonas et al., 1995; Weinmaster, 1998). Со стороны C-конца EGF-подобных повторов находятся дополнительные три цистеин-богатых повтора, обозначаемых как повторы LIN12/Notch (LNR) (Greenwald, 1994). Ниже LNR находится последовательность протеолитического расщепления (RXRR), которая распознается фурин-подобной конвертазой. В случае Notch1 расщепление в этом участке приводит к внеклеточному пептиду размером 180 килодальтон и внутриклеточному пептиду размером 120 килодальтон, которые удерживаются вместе с образованием гетеродимерного рецептора на поверхности клеток (Blaumueller et al., 1997; Kopan et al., 1996; Logeat et al., 1998).
Внутриклеточный домен Notch (NotchICD, фигура 1) восстанавливает фенотипы после утраты функции Notch, что указывает на то, что эта форма Notch передает сигналы конститутивно (Fortini and Artavanis-Tsakonas, 1993; Lyman and Young, 1993; Rebay et al., 1993; Struhl et al., 1993).
Цитоплазматический домен Notch содержит три идентифицируемых домена: RAM-домен, домен анкиринового повтора и C-концевой PEST-домен (фигура 1). При активации лигандом Notch претерпевает два дополнительных протеолитических расщепления, что приводит к высвобождению цитоплазматического домена (Weinmaster, 1998). Этот пептид Notch переносится в ядро и взаимодействует с репрессорами транскрипции, известными как CSL (CBF, Su (H), Lag-2) и превращает их в активатор транскрипции. Взаимодействие CSL/Notch зависит от наличия RAM-домена Notch; хотя транскрипционная активность также требует присутствия анкириновых повторов (Hsieh et al., 1996; Hsieh et al., 1997; Roehl et al., 1996; Tamura et al., 1995; Wettstein et al., 1997). Исследования как in vivo, так и in vitro указывают на то, что гены HES и Hey являются прямыми мишенями зависимой от Notch/CSL передачи сигнала (Bailey and Posakony, 1995; Eastman et al., 1997; Henderson et al., 2001; Jarriault et al., 1995; Nakagawa et al., 2000; Wettstein et al., 1997). Гены HES и Hey представляют собой репрессор транскрипции bHLH, который связывает ДНК в N-боксах (Nakagawa et al., 2000; Sasai et al., 1992; Tietze et al., 1992). Также было предположено, что Notch осуществляет передачу сигнала путем независимого от CSL каскада. В действительности, экспрессия только домена анкиринового повтора является необходимой и достаточной для некоторых форм передачи сигнала Notch (Lieber et al., 1993; Matsuno et al., 1997; Shawber et al., 1996b).
В заключение, PEST-домен вовлечен в оборот белков через зависимый от SEL-10/убиквитина каскад (Greenwald, 1994; Oberg et al., 2001; Rogers et al., 1986; Wu et al., 1998; Wu et al., 2001). Аналогично рецепторам, внеклеточный домен лигандов Notch также состоит, главным образом, из последовательно расположенных EGF-подобных повторов (фигура 1). Выше этих повторов находится дивергентный EGF-подобный повтор, известный как DSL (Delta, Serrate, Lag-2), который требуется для связывания лиганда и активации рецепторов (Artavanis-Tsakonas et al., 1995).
Передача сигнала Notch и развитие сосудов
Хотя идентифицированы многие из генов, которые выполняют функцию индукции васкулогенеза и ангиогенеза, малоизвестно о том, как происходит выбор судьбы клеток в процессе развития сосудов. Ряд наблюдений указывает на то, что каскад передачи сигнала Notch может участвовать в определении судьбы клетки и формировании сосудистой системы.
Notch1, Notch4, Jagged1 и Dll4 экспрессируются в развивающихся сосудах, а Notch3 экспрессируется во вспомогательных гладкомышечных клетках (Krebs et al., 2000; Shutter et al., 2000b; Uyttendaele et al., 1996; Villa et al., 2001; Xue et al., 1999). Мыши, лишенные Jagged1, являются летальными на эмбриональной стадии и имеют несколько тяжелых сосудистых дефектов (Xue et al., 1999). Мыши, являющиеся нуль-зиготными по Notch1, являются летальными на эмбриональной стадии и погибают от тяжелых нейрональных дефектов, однако также они имеют дефекты ангиогенеза (Krebs et al., 2000; Swiatek et al., 1994). Мыши, лишенные Notch4, рождаются и имеют нормальный внешний вид, однако эмбрионы, у которых утрачен как Notch1, так и Notch4 погибают на стадии E9.5 от тяжелой геморрагии и дефектов структурирования сосудов, что указывает на то, что Notch1 и Notch4 могут функционально дублировать друг друга в ходе развития сосудов (Krebs et al., 2000). Экзогенная экспрессия активированной формы Notch4 в эндотелии также приводит к сосудистым дефектам, сходным с дефектами, наблюдаемым для двойных нуль-зиготных мышей по Notch1/Notch4, указывая на то, что соответствующие уровни передачи сигнала Notch являются критическими для надлежащего развития сосудов эмбриона (Uyttendaele et al., 2001).
Взятые вместе, данные для мышей, мутантных по компонентам передачи сигнала Notch/Notch, объясняют некоторые процессы, зависимые от Notch, включая ремоделирование сосудов, артериально-венозные характеристики, привлечение гладкомышечных клеток сосудов и развитие сосудов сердца/сердечного оттока.
Недавние эксперименты указывают на вовлечение передачи сигнала Notch в характеристику артериальных/венозных эндотелиальных клеток. Анализ in situ эмбрионов E13.5 выявил, что экспрессия Notch1, Notch3, Notch4, D14, Jagged1 и Jagged2 ограничена артериями и отсутствует в венах (Villa et al., 2001). В соответствии с данными об экспрессии, нарушение передачи сигнала Notch у данио-рерио ассоциировано с утратой артериального маркера ephrinB2; а эктопическая экспрессия активированной формы Notch ведет к утрате маркера венозных клеток EphB4 в дорсальной части аорты (Lawson et al., 2001). Эти данные указывают на то, что передача сигнала Notch может способствовать определению судьбы артериальных и венозных клеток в процессе ангиогенеза.
Взятые вместе, данные для мышей, мутантных по компонентам передачи сигнала Notch/Notch, объясняют некоторые процессы, зависимые от Notch, включая ремоделирование сосудов, артериально-венозную характеристику, привлечение гладкомышечных клеток сосудов и развитие сосудов сердца/сердечного оттока.
Также было сделано предположение, что передача сигнала Notch функционирует в сосудистой системе взрослых. У человека миссенс-мутации во внеклеточном домене Notch3 коррелируют с развитием дегенеративного сосудистого заболевания, CADASIL (Caronti et al., 1998; Desmond et al., 1998; Joutel et al., 2000; Joutel et al., 1996). В модели заживления ран повышение экспрессии Jagged1 наблюдали при регенерации эндотелия краев раны, указывая на то, что передача сигнала Notch может функционировать в процессах ангиогенеза у взрослых (Lindner et al., 2001). Взятые вместе, эти данные указывают на функции передачи сигнала Notch на ряде критических стадий в процессе развития сосудов: васкулогенез, формирование сосудов/ангиогенез и артериально/венозная характеристика. Однако молекулярный механизм(ы), посредством которого каскады передачи сигнала Notch влияют на эти различные стадии, еще предстоит выяснить.
Значение
Shimizu et al. (J. Biol. Chem. 274(46): 32961-32969 (1999)) описывают применение Notch1ECD/Fc, Notch2ECD/Fc и Notch3ECD/Fc в исследованиях связывания. Однако Shimizu et al. не упоминают о применении таких белков для ингибирования ангиогенеза.
В патенте США № 6379925, выданном 30 апреля 2002 г., Kitajewski et al., описан Notch4 мыши. Однако в нем не описаны слитые белки на основе Notch, как показано в указанной заявке.
Белки Notch играют ключевую роль в связанных с развитием вариантах выбора, вовлекающих сосуды, гемопоэтическую систему и нервную систему. По существу, понимание их функции является ключом для понимания того, каким образом выбор судьбы клетки и коммитирование контролируются в ходе развития и в тканях взрослых. На сегодняшний день в нескольких сообщениях о нарушении генов лиганда Notch или Notch описаны фенотипы сосудов и обращается внимание на то, что этот каскад является фундаментальной частью аппарата, который направляет развитие сосудов. Аберрантная активность Notch связана с патологиями у человека, включая как злокачественную опухоль, так и сосудистые нарушения (CADASIL). Анализ Notch в ангиогенезе в опухоли начали проводить только недавно; однако открытие авторами изобретения потенциальных мишеней Notch, расположенных ниже в каскаде, указывает на роль в патологических процессах, ассоциированных с ангиогенезом. Например, VEGFR-3 связан как с ангиогенезом опухоли, так и с лимфангиогенезом опухоли. Экспрессия или функция нескольких других потенциальных мишеней Notch также связана с ангиогенезом в опухоли; включая ephrinB2, Id3, ангиопоэтин-1 и PDGF-B.
Выяснение роли этих мишеней в функции гена Notch, очевидно, может облегчить в будущем анализ Notch при патологиях у человека.
Сущность изобретения
Это изобретение относится к слитому белку, содержащему сигнальный пептид, внеклеточный домен рецепторного белка Notch человека и Fc-часть антитела, связанную с ними.
Это изобретение относится к способу лечения субъекта, имеющего опухоль, включающему введение субъекту количества указанного выше слитого белка, эффективного для лечения субъекта, тем самым осуществляя лечение субъекта, имеющего опухоль.
Это изобретение относится к способу ингибирования ангиогенеза у субъекта, включающему введение субъекту количества указанного выше слитого белка, эффективного для ингибирования ангиогенеза у субъекта, тем самым ингибируя ангиогенез у субъекта.
Это изобретение относится к способу лечения субъекта, имеющего рак яичника, включающему введение субъекту количества указанного выше слитого белка, эффективного для лечения субъекта, тем самым осуществляя лечение субъекта, имеющего рак яичника.
Это изобретение относится к способу лечения субъекта, имеющего метаболическое нарушение, включающему введение субъекту количества указанного выше слитого белка, эффективного для лечения субъекта, тем самым осуществляя лечение субъекта, имеющего метаболическое нарушение.
Это изобретение относится к применению указанного выше слитого белка для получения фармацевтической композиции для лечения субъекта, имеющего опухоль.
Это изобретение относится к применению указанного выше слитого белка для получения фармацевтической композиции для ингибирования ангиогенеза у субъекта.
Это изобретение относится к применению указанного выше слитого белка для получения фармацевтической композиции для лечения субъекта, имеющего рак яичника.
Это изобретение относится к применению указанного выше слитого белка для получения фармацевтической композиции для лечения субъекта, имеющего метаболическое нарушение.
Это изобретение относится к способу ингибирования физиологического лимфангиогенеза или патологического лимфангиогенеза у субъекта, включающему введение субъекту количества указанного выше слитого белка, эффективного для ингибирования физиологического лимфангиогенеза или патологического лимфангиогенеза у субъекта.
Это изобретение относится к способу ингибирования метастазирования опухоли у субъекта, включающему введение субъекту количества указанного выше слитого белка, эффективного для ингибирования метастазирования опухоли у субъекта.
Это изобретение относится к способу ингибирования роста вторичной опухоли у субъекта, включающему введение субъекту количества указанного выше слитого белка, эффективного для ингибирования роста вторичной опухоли у субъекта.
Это изобретение относится к способу ингибирования кооптации кровеносных сосудов опухолью у субъекта, включающему введение субъекту количества указанного выше слитого белка, эффективного для ингибирования кооптации кровеносных сосудов опухолью у субъекта.
Это изобретение относится к способу лечения злокачественной опухоли у субъекта, включающему введение субъекту указанного выше слитого белка и ингибитора фактора роста эндотелия сосудов (VEGF), VEGF-A, P1GF, VEGF-B, VEGF-C или VEGF-D, каждого из них в количестве, эффективном для лечения злокачественной опухоли у субъекта.
Это изобретение относится к способу лечения злокачественной опухоли у субъекта, включающему введение субъекту указанного выше слитого белка и антагониста рецептора VEGF, антагониста VEGFR-1, антагониста VEGFR-2 или антагониста VEGFR-3, каждого из них в количестве, эффективном для лечения злокачественной опухоли у субъекта.
Это изобретение относится к способу лечения злокачественной опухоли у субъекта, включающему введение субъекту указанного выше слитого белка и ингибитора тромбоцитарного фактора роста (PDGF), PDGF-A или PDGF-B, каждого из них в количестве, эффективном для лечения злокачественной опухоли у субъекта.
Это изобретение относится к способу лечения злокачественной опухоли у субъекта, включающему введение субъекту указанного выше слитого белка и антагониста рецептора PDGF, каждого из них в количестве, эффективном для лечения злокачественной опухоли у субъекта.
Это изобретение относится к способу лечения злокачественной опухоли у субъекта, включающему введение субъекту указанного выше слитого белка и ингибитора HER2/neu, каждого из них в количестве, эффективном для лечения злокачественной опухоли у субъекта.
Это изобретение относится к способу лечения сосудисто-пролиферативной ретинопатии, включающему введение субъекту указанного выше слитого белка в количестве, эффективном для лечения сосудисто-пролиферативной ретинопатии.
Краткое описание рисунков
Фигура 1
На этой фигуре представлена схематическая структура Notch и лигандов Notch: Notch1, Notch2, Notch3, Notch4, Jagged-1, Jagged-2, Delta-like 1, Delta-like 3, Delta-like 4.
Фигура 2
На этой фигуре показано схематическое представление слитых белков на основе Notch (NotchECD/Fc). Внеклеточный домен Notch1, Notch2, Notch3 или Notch4, содержащий EGF-повторы, является слитым с Fc-частью антитела.
Фигура 3
На этой фигуре представлен анализ кокультуры для тестирования активности слитых белков на основе Notch. Notch и отвечающие на Notch транскрипционные репортеры экспрессируются в "отвечающих на Notch" клетках, HeLa. Лиганды Notch, Jagged-1, Delta-like 1 или Delta-like 4 экспрессируются в "представяющей лиганд" клетке, 293. Осуществляют экспрессию путем трансфекции отдельных клеточных популяций, клетки кокультивируют, а затем анализируют в отношении Notch-зависимой активности репортера.
Фигура 4
На этой фигуре представлена ингибиторная активность слитого белка на основе Notch против активации передачи сигнала Notch путем взаимодействия между Notch и лигандом Notch. Индукция передачи сигнала Notch была выявлена путем кокультивирования клеток, экспрессирующих лиганд Notch обоих типов, Notch1 и 3, и эта индукция ингибировалась котрансфекцией слитого белка на основе экспрессирующего Notch вектора в клетки, экспрессирующие Notch1. Таким образом, исходя из ингибирования взаимодействия между Notch и лигандом Notch, слитые белки на основе Notch можно использовать в качестве ингибитора Notch.
Фигура 5
На этой фигуре представлена экспрессия слитого белка на основе Notch1 (Notch1ECD/Fc) в 293. Панель A: экспрессия в клеточных лизатах (lys) или при секреции в среду (sup). Панель B: экспрессия NECD/Fc в лизатах 293, как указано.
Фигура 6
На этой фигуре представлена активация передачи сигнала Notch в HUVEC, инфицированных аденовирусом, кодирующим VEGF-165. Активация передачи сигнала Notch может быть выявлена с использованием активности промотора CBF1. Транскрипционная активность промотора CBF1 стимулируется путем связывания Notch-IC с CBF1. Авторы настоящего изобретения измерили активность промотора CBF1 в HUVEC, которые были инфицированы аденовирусом, кодирующим VEGF-165 при различной MOI. Индукция промотора CBF1 отчетливо выявлялась в HUVEC, инфицированных Ad-VEGF, по сравнению с инфицированными Ad-LacZ клетками зависимым от MOI образом. Эти данные показали, что сверхэкспрессия VEGF может активировать передачу сигнала Notch в HUVEC.
Фигура 7
На этой фигуре представлен эффект слитых белков на основе Notch на индуцируемую VEGF активацию передачи сигнала Notch. Коинфицирование конструкцией Ad-слитый белок на основе Notch и Ad-VEGF отчетливо снижала стимуляцию активности промотора CBF1, индуцируемую инфицированием только Ad-VEGF. В случае инфицирования с MOI 40 для каждого аденовируса в панели A, было выявлено 60% ингибирование через 24 часа и 90% ингибирование через 48 часов после трансфекции репортерного гена. Эта ингибиторная активность ловушки Notch зависела от MOI конструкции Ad-слитый белок на основе Notch.
Фигура 8
На этой фигуре представлен эксперимент, в котором авторы изобретения оценивали эффект слитых белков на основе Notch на индукцию почкования посредством сверхэкспрессированного VEGF-165 в HUVEC. Когда HUVEC, инфицированные Ad-VEGF, культивировали на геле коллагенового типа в течение 8 суток, в коллагеновом геле индуцировалось почкование. Эта индукция почкования сверхэкспрессированным VEGF отчетливо ингибировалась коинфицированием аденовирусом, кодирующим слитые белки на основе Notch. Самостоятельно конструкция Ad-слитый белок на основе Notch оказывает меньший эффект на морфологию.
Фигура 9
На этой фигуре представлен результат подсчета под микроскопом количества почек на поле. Инфицирование HUVEC посредством Ad-VEGF увеличивало количество почек, в зависимости от используемой MOI. Даже несмотря на то, что использовали половину MOI для слитого белка на основе Notch, по сравнению с Ad-VEGF индуцируемое Ad-VEGF почкование отчетливо ингибировалось. Эти данные указывают на то, что VEGF индуцирует почкование HUVEC путем активации передачи сигнала Notch, и слитый белок на основе Notch может ингибировать индуцируемое VEGF почкование.
Фигура 10
На этой фигуре представлена аминокислотная последовательность внеклеточного домена белка Notch1 крысы (SEQ ID NO:1) и последовательность линкера (SEQ ID NO:2).
Фигура 11
На этой фигуре представлена аминокислотная последовательность внеклеточного домена белка Notch2 крысы (SEQ ID NO:3) и последовательность линкера (SEQ ID NO:2).
Фигура 12
На этой фигуре представлена аминокислотная последовательность внеклеточного домена белка Notch3 мыши (SEQ ID NO:4).
Фигура 13
На этой фигуре представлена аминокислотная последовательность внеклеточного домена белка Notch4 мыши (SEQ ID NO:5) и последовательность линкера (SEQ ID NO:2).
Фигуры 14A и 14B
На этой фигуре представлена последовательность нуклеиновой кислоты внеклеточного домена гена Notch1 крысы (SEQ ID NO:6).
Фигуры 15A и 15B
На этой фигуре представлена последовательность нуклеиновой кислоты внеклеточного домена гена Notch2 крысы (SEQ ID NO:7).
Фигуры 16A и 16B
На этой фигуре представлена последовательность нуклеиновой кислоты внеклеточного домена гена Notch3 мыши (SEQ ID NO:8).
Фигуры 17A и 17B
На этой фигуре представлена последовательность нуклеиновой кислоты внеклеточного домена гена Notch4 мыши (SEQ ID NO:9) и последовательность нуклеиновой кислоты (SEQ ID NO:10) и аминокислотная последовательность (SEQ ID NO:2) линкерной последовательности.
Фигуры 18A и 18B
На этой фигуре представлена последовательность нуклеиновой кислоты внеклеточного домена гена Notch1 человека (SEQ ID NO:11).
Фигуры 19A и 19B
На этой фигуре представлена последовательность нуклеиновой кислоты внеклеточного домена гена Notch2 человека (SEQ ID NO:12).
Фигуры 20A и 20B
На этой фигуре представлена последовательность нуклеиновой кислоты внеклеточного домена гена Notch3 человека (SEQ ID NO:13).
Фигуры 21A и 21B
На этой фигуре представлена последовательность нуклеиновой кислоты внеклеточного домена гена Notch4 человека (SEQ ID NO:14).
Фигуры 22A-22I
На этих фигурах показано, что VEGF активирует передачу сигнала Notch, индуцируя почкование HUVEC. HUVEC трансдуцировали Ad-VEGF при MOI 40 (фиг. 22A, 22H, 22I) или MOI 20 (фиг. 22C, 22G). Ad-LacZ котрансдуцировали в HUVEC так, чтобы общее количество аденовируса составляло MOI 60 (фиг. 22G), MOI 80 (фиг. 22A) и MOI 100 (фиг. 22H, 22I). На фигуре 22A представлен анализ посредством RT-PCR экспрессии Notch и лиганда Notch. Числа указывают на количество циклов PCR. На фигуре 22B представлен эффект трансдуцированного VEGF на репортерную активность CSL. На фигуре 22C представлен эффект SU5416 на репортерную активность CSL, трансактивированного Ad-VEGF. На фигуре 22D представлена конструкция ловушки Notch (N1ECDFc). На фигуре 22E представлена секреция N1ECDFc из HUVEC, трансдуцированных Ad-N1ECDFc. На фигуре 22F представлен эффект N1ECDFc против индуцируемой лигандом репортерной активности CSL в анализе кокультуры (□: (-); ■: 0,33 нг pHyTC-N1ECDFc; ■: 0,67 нг pHyTC-N1ECDFc). На фигурах 22G-I представлен эффект N1ECDFc против HUVEC, трансдуцированных Ad-VEGF. Передача сигнала Notch активировалась при трансдукции Ad-VEGF в HUVEC в отсутствии или при наличии котрансдукции Ad-N1ECDFc в указанной дозировке. На фигуре 22G представлен эффект N1ECDFc на репортерную активность CSL, трансактивированного Ad-VEGF. На фигуре 22H представлено ингибирование почкования HUVEC, трансдуцированных Ad-VEGF, при котрансдукции Ad-N1ECDFc при MOI 40. На фигуре 221 представлено количественное определение эффекта N1ECDFc на почкование HUVEC, трансдуцированных Ad-VEGF (□: почка; ■: число клеток).
Фигуры 23A-23J
На этих фигурах показано, что передача сигнала Notch повышает экспрессию Flt1, индуцируя почкование HUVEC. HUVEC трансдуцировали либо Ad-LacZ, либо Ad-N1IC при MOI 40. На фигурах 23A-23C представлен эффект ингибиторов рецепторных тирозинкиназ на индуцируемое Notch почкование HUVEC. На фигуре 23A представлена фотография почкования HUVEC, трансдуцированных Ad-N1IC, обработанных PD166866, ZD1893 в количестве 1 мкМ и SU5416 в количестве 0,5 мкМ. На фигуре 23B представлено количественное определение эффекта ингибиторов в количестве 1 мкМ (□: почка; ■: число клеток). На фигуре 23C представлена зависимость от дозы эффекта SU5416 (□: почка; ■: число клеток). На фигурах 23D-E представлена индукция экспрессии Flt-1 в HUVEC, трансдуцированных Ad-N1IC. На фигуре 23D представлен анализ посредством RT-PCR экспрессии мРНК Flt-1. На фигуре 23E представлен W.B.-анализ экспрессии белка Flt-1. На фигурах 23F-G представлена стимуляция индуцируемого Notch почкования HUVEC посредством стимуляции P1GF. HUVEC, трансдуцированные Ad-N1IC, культивировали на коллагеновом геле с SFM, вместо полной среды, в отсутствии или в присутствии 50 нг/мл P1GF. На фигуре 23F представлено индуцируемое P1GF почкование HUVEC, трансдуцированных Ad-N1IC (конец стрелки: почки с одной филоподией; стрелки: почки со множеством филоподий). На фигуре 23G представлено количественное определение эффекта P1GF на почкование HUVEC, трансдуцированных Ad-N1IC (□: множество; ■: всего). На фигурах 23H-I представлен эффект трансфекции siRNA для Flt-1 на экспрессию Flt1. HUVEC, трансдуцированные Ad-N1IC, трансфицировали 200 пмоль либо контрольной (CT) siRNA, либо siRNA для Flt-1. На фигуре 23H представлено снижение экспрессии мРНК Flt-1. На фигуре 23I представлено снижение экспрессии белка Flt-1. На фигуре 23J представлен эффект трансфекции siRNA для Flt-1 на индуцируемое Notch почкование HUVEC. HUVEC, трансдуцированные Ad-N1IC, трансфицировали либо 100, либо 200 пмоль siRNA и культивировали на коллагеновом геле в течение 2 суток.
Фигуры 24A-24E
На этих фигурах показано, что VEGF регулирует активность желатиназы через передачу сигнала Notch путем активации как MMP-9, так и MT1-MMP. На фигурах 24A-B представлен анализ желатиназной зимографией активности MMP-9 и MMP-2, стимулированной VEGF в HUVEC. На фигуре 24A представлен эффект N1ECDFc на активность MMP-9. Трансдуцированные HUVEC культивировали на фибриновом геле на указанные сутки (т.е. D2, D4, D6, D8). Сходные результаты также получали с использованием коллагенового геля, хотя индукция MMP-9 была сильнее на фибриновом геле, чем на коллагеновом геле (данные не представлены). На фигуре 24B представлен эффект N1ECDFc на активность MMP-2. HUVEC трансдуцировали Ad-N1ECDFc в указанных дозах и собирали кондиционированную среду от HUVEC, культивированных на коллагеновом геле на 4 сутки. На фигурах 24C-D представлена активация MMP-9 и MT1-MMP посредством передачи сигнала Notch. HUVEC трансдуцировали посредством либо Ad-LacZ, либо Ad-N1IC при MOI 40. Числами указано количество циклов PCR. На фигуре 24C представлен анализ посредством RT-PCR эффекта передачи сигнала Notch на экспрессию MMP-9 и MMP-2. На фигуре 24D представлена индукция экспрессии как транскрипта, так и белка MT1-MMP при передаче сигнала Notch. На фигуре 24E представлен анализ посредством RT-PCR экспрессии MMP-9 и MT1-MMP в Ad-VEGF-HUVEC при котрансдукции Ad-N1ECDFc. HUVEC трансдуцировали Ad-VEGF в отсутствии или при наличии котрансдукции Ad-N1ECDFc при MOI 40 каждого из них. Ad-LacZ котрансдуцировали с получением общего количества аденовируса, составляющего MOI 80.
Фигуры 25A - 25D
На этих фигурах показана роль передачи сигнала Notch в зависимом от VEGF ангиогенезе in vivo. На фигурах 25A-25D представлено ингибирование индуцируемого VEGF ангиогенеза посредством N1ECDFc в анализе DAS у мыши. Представлены репрезентативные фотографии. На фигуре 25A представлен подкожный индуцированный ангиогенез для трансфектанта 293/VEGF против 293/VEGF, экспрессирующего также ловушку Notch (слитый белок на основе Notch) N1ECDFc. На фигуре 25B представлено количественное определение степени васкуляризации, индуцируемой 293/VEGF в контроле против 293, экспрессирующих ловушку Notch (слитый белок на основе Notch) N1ECDFc. На фигуре 25C представлен подкожный индуцированный ангиогенез для инфицированных Ad-LacZ клеток MDA-MB-231 против инфицированных Ad-N1ECDFc (слитый белок на основе Notch) клеток MDA-MB-231. Клетки рака молочной железы MDA-MB-231 продуцируют VEGF (данные не представлены). На фигуре 25D представлено количественное определение степени васкуляризации, индуцированной инфицированными Ad-LacZ клетками MDA-MB-231 против инфицированных Ad-N1ECDFc (слитый белок на основе Notch) клеток MDA-MB-231.
Фигуры 26A и 26B
На этих фигурах показана пролиферация HUVEC, трансдуцированных Ad-VEGF165. HUVEC трансдуцировали Ad-VEGF165 в указанных дозировках. Также проводили коинфекцию Ad-LacZ, чтобы общее количество аденовируса составляло MOI 40 б.о.е./клетка. HUVEC суспендировали в SFM, дополненной 1% FBS, а затем высевали в количестве 1×104 клеток/лунка в 24-луночные многолуночные планшеты с 0,4 мл среды. Через 4 суток определяли число клеток с использованием набора CCK-8, и результаты представлены в качестве соотношения определенных чисел клеток и числа контрольных клеток, которые были трансдуцированы Ad-GFP при MOI 40 б.о.е./клетка. На фигуре 26A представлен эффект трансдуцированного VEGF на пролиферацию. На фигуре 26B представлен ингибиторный эффект SU5416. HUVEC, трансдуцированные Ad-VEGF, обрабатывали SU5416 в указанных дозировках.
Фигуры 27A и 27B
На этих фигурах показана индукция почек HUVEC на коллагеновом геле типа I. HUVEC трансдуцировали либо Ad-VEGF165, либо AD-N1IC в указанных дозировках. Также коинфицировали Ad-LacZ, чтобы общее количество аденовируса составляло MOI 40 б.о.е./клетка. Трансдуцированные HUVEC культивировали на коллагеновом геле с полной средой. Величину почкования оценивали под микроскопом на 7 сутки.
Фигуры 28A и 28B
На этих фигурах показан эффект изменения передачи сигнала Notch на пролиферацию клеток. Клетки трансдуцировали указанными аденовирусами. Также проводили коинфицирование Ad-GFP, чтобы общее количество аденовируса составляло MOI 60 б.о.е./клетка. Через 4 суток определяли числа клеток с использованием набора CCK-8, и результаты представлены в качестве соотношения определенных чисел клеток и числа контрольных клеток, которые были трансдуцированы Ad-GFP при MOI 60 б.о.е./клетка. На фигуре 28A представлен эффект трансдуцированного N1IC и слитого белка Notch на пролиферацию HUVEC. Трансдуцированные HUVEC суспендировали в полной среде, а затем высевали в количестве 1×104 клеток/лунка в 24-луночные многолуночные планшеты с 0,4 мл указанной среды (□: Ad-N1IC; ■: Ad-N1ECDFc). На фигуре 28B представлен эффект слитого белка Notch на пролиферацию трансфектантов KP1/VEGF. Трансдуцированные трансфектанты KP1/VEGF суспендировали в среде RPMI1640, а затем высевали в количестве 2×104 клеток/лунка в 24-луночные многолуночные планшеты с 0,5 мл среды.
Фигура 29
На этой фигуре представлен анализ посредством RT-PCR индукции экспрессии PIGF в HUVEC, трансдуцированных Ad-N1IC. HUVEC инфицировали либо Ad-LacZ, либо Ad-N1IC при MOI 40 б.о.е./клетка. Тотальную РНК выделяли из трансдуцированных HUVEC, культивированных на коллагеновом геле в течение 5 суток с полной средой.
Фигуры 30A-30C
На этих фигурах показано ингибирование почкования HUVEC, трансдуцированных либо Ad-N1IC, либо Ad-VEGF при трансфекции siRNA для Flk-1. На фигуре 30A показано снижение экспрессии мРНК и белка Flk-1 в Ad-VEGF-HUVEC при трансфекции 200 пмоль siRNA для Flk-1. Ad-VEGF-HUVEC при MOI 40 б.о.е./клетка трансфицировали 200 пмоль либо контрольной siRNA (CT), либо siRNA для Flk-1. Через 48 часов после трансфекции выделяли тотальную РНК. Собирали тотальный клеточный лизат от клеток, не подпитываемых сывороткой, с SFM в течение 48 часов после трансфекции. На фигурах 30B и 30C представлен ингибиторный эффект трансфекции siRNA для Flk-1 на почки HUVEC, индуцированные либо VEGF, либо Notch. Либо Ad-N1IC-, либо Ad-VEGF-HUVEC при MOI 40 б.о.е./клетка трансфицировали 200 пмоль siRNA, как указано, и культивировали на коллагеновом геле в течение 5 суток. На фигуре 30B представлен эффект трансфекции siRNA для Flk-1 на почки HUVEC (□: Ad-VEGF; ■: Ad-N1IC). На фигуре 30C представлено количественное определение ингибиторного эффекта трансфекции siRNA для Flk-1.
Фигуры 31A и 31B
На этих фигурах показано ингибирование почкования HUVEC, трансдуцированных Ad-N1IC, при обработке ингибитором матриксной метталопротеиназы GM6001. Либо Ad-LacZ, либо Ad-N1IC-HUVEC при MOI 40 б.о.е./клетка культивировали на коллагеновом геле в течение 5 суток в отсутствии или присутствии GM6001 в количестве 50 мкМ. На фигуре 31A представлен эффект GM6001 на индуцированные Notch почки HUVEC. На фигуре 31B представлено количественное определение ингибиторного эффекта GM6001.
Фигуры 32A-32D
На этих фигурах показано, что ловушка Notch1 ингибирует активацию передачи сигнала Notch, стимулированную лигандами Notch. На фигуре 32A показана схема ловушки Notch1 (N1ECDFc) и вестерн-блоттинг для детекции секретированной ловушки Notch1 в кондиционированной среде. HUVEC трандуцировали аденовирусом, кодирующим ловушку Notch1 (Ad-N1ECDFc), при указанной m.o.i. На фигуре 32B показано, что ловушка Notch1 ингибирует индуцированную лигандом репортерную активность CSL в анализе передачи сигнала в кокультуре. Активацию передачи сигнала Notch измеряли в клетках HeLa, экспрессирующих Notch1, кокультивированных с клетками 293, экспрессирующими лиганды Notch. Данные представлены в качестве среднего значения ± SD. На фигуре 32C показано, что эктопическая экспрессия Notch4 индуцирует морфогенез HUVEC, культивированных на фибриновом геле. HUVEC трансдуцировали аденовирусом, кодирующим Notch4 (Ad-Notch4) при m.o.i. 30 и Ad-GFP m.o.i. при 10, для маркирования инфицированных клеток. Через двое суток HUVEC кокультивировали со стабильными трансфектантами HUVEC на фибриновом геле и документировали морфологические изменения с использованием флуоресцентной микроскопии. Notch 4 индуцирует удлинение клеток (сверху слева, белые стрелки), и обработка 200 нМ соединением E блокирует индуцируемое Notch4 удлинение (сверху справа). Экспрессия ловушки Notch1 блокирует индуцируемое Notch4 удлинение клеток. Трансдуцированные аденовирусом HUVEC кокультивировали на фибриновых гелях со стабильными трансфектантами HUVEC, экспрессирующими либо Fc (снизу слева), либо ловушку Notch1 (сверху справа), и фотографировали через двое суток. Шкала = 200 мкм. На фигуре 32D представлено количественное определение эффекта ингибирования сигнала Notch на индуцированное Notch4 удлинение. Уменьшение прорастания ростков было статистически значимым после обработки соединением E и трансдукции N1ECDFc (p<0,0001, в обоих случаях; данные представлены в качестве среднего значения ± SD).
Фигуры 33A-33D
На этих фигурах показано, что FGF4 индуцирует экспрессию лигандов Notch в клетках карциномы молочной железы мыши Mm5MT. Стабильные трансфектанты Mm5MT получали ретровирусным переносом генов. На фигуре 33A представлен количественный анализ посредством RT-PCR экспрессии лигандов Notch, демонстрирующий индукцию Jagged1 и Dll1 в трансфектантах Mm5MT, экспрессирующих FGF4 (Mm5MT-FGF4), по сравнению с имитирующими трансфектантами (Mm5MT-X). На фигуре 33B показано, что уровень белка Jagged1 повышен в Mm5MT-FGF4 относительно Mm5MT-X, при определении посредством вестерн-блоттинга. На фигуре 33C показано снижение экспрессии лиганда Notch в клетках Mm5MT-FGF4 с помощью PD166866, ингибитора киназы рецептора FGF. На фигуре 33DB показан иммуногистохимический анализ окрашивания Jagged1 в трансфектантах Mm5MT. Шкала = 50 мкм.
Фигуры 34A-34C
На этих фигурах показано, что ловушка Notch1 ингибирует ангиогенез и подкожный рост опухоли для опухолей Mm5MT-FGF4 у мышей. На фигуре 34A показано, что объемы опухолей Mm5MT-FGF4-X и Mm5MT-FGF4-Fc значимо отличаются от трансфектантов Mm5MT-FGF4-N1ECDFC у мышей (сутки 21, P=0,037 и P=0,008, Mm5MT-FGF4-X и Mm5MT-FGF4-Fc против Mm5MT-FGF4-N1ECDFc, соответственно; данные представлены в качестве среднего значения ± SD). На фигуре 34B представлен иммуногистохимический анализ новых сосудов путем окрашивания CD31 в опухолях трансфектантов Mm5MT-FGF4. Верхние панели, шкала = 100 мкм, нижние панели, шкала = 50 мкм. На фигуре 34C представлен количественный анализ, демонстрирующий снижение новых сосудов CD31(+) в трансфектантах Mm5MT-FGF4-N1ECDFc по сравнению с опухолями, трансфицированными Fc или имитацией (P<0,001, как для Mm5MT-FGF4-X, так и для Mm5MT-FGF4-Fc против Mm5MT-FGF4-N1ECDFc; данные представлены в качестве среднего значения ± SD). Ксенотрансплантаты собирали через 22 суток после инокуляции и окрашивали антителом против CD31.
Фигуры 35A-35D
На этих фигурах показано, что экспрессия ловушки Notch1 нарушает ангиогенез и снижает жизнеспособность опухоли в ксенотрансплантатах NGP человека. Авторы изобретения ранее сообщали, что эти ксенотрансплантаты нейробластомы человека у мышей имеют зрелую иерархическую сосудистую сеть, которая является относительно устойчивой к блокаде VEGF (16). Для определения того, приводит ли активация рецептора Notch к ангиогенезу NGP, авторы настоящего изобретения трансфицировали клетки NGP конструкцией ловушки Notch1, которая не влияла на их способность расти в культуре (данные не представлены). Однако существовало выраженное снижение жизнеспособности in vivo (фигура 35A) TUNEL = красная флуоресценция, эритроциты = зеленая флуоресценция, шкала = 100 мкм), со (фигура 35B) значимо повышенным апоптозом опухолевых клеток (P=0,0002, TUNEL-положительные клетки в опухолях NGP-N1ECDFc против NGP-LacZ), и (фигура 35C) повышенной внутриопухолевой геморрагией (p<0,0001, количественное определение сигнала паренхимных эритроцитов). Кроме того, сосудистые сети опухоли в ксенотрансплантатах NGP-N1ECDFc выглядят физически разрушенными по сравнению с контролями NGP-LacZ, с (фигура 35D) иммунологическим окрашиванием на EC и VMC (с использованием антител против CD31 и αSMA, соответственно), демонстрирующим отсутствие целостности этих слоев сосудистых клеток (шкала = 50 мкм). Отдельные клетки сосудов выглядят отделенными друг от друга. Взятые вместе, эти результаты указывают на то, что экспрессия ловушки Notch1 нарушает способность EC и VMC образовывать стабильные сосудистые трубки, вызывая разрушение сосудов, геморрагию и ишемию опухолевых тканей.
Фигура 36
На этой фигуре показано, что опухолевые клетки SKOV3 с запрограммированной экспрессией ловушки Notch1 блокируют рост ксенотрансплантатов рака яичника.
Фигура 37
На этой фигуре показана регуляция дифференцировки миобластов посредством Foxo и Notch. Клетки C2C12 подвергали иммунному окрашиванию антителом против миозина (зеленый) и DAPI (синий). См. текст для описания панели. Каждый эксперимент повторяли ≥ шести раз.
Фигуры 38A-38C
На этих фигурах показан количественный анализ дифференцировки C2C12. На фигуре 38A показан вестерн-блот анализ экспрессии миозина в клетках C2C12. На фигуре 38B представлен морфометрический анализ миозин-положительных клеток. Результаты экспериментов по дифференцировке анализировали путем оценки количества иммунологически окрашенных по миозину клеток в качестве процента от всех DAPI-положительных клеток. На фигуре 38C показаны анализы с репортерным геном DBD-Foxo1ADA. Авторы изобретения провели анализы с репортерным геном с использованием канонического отвечающего на Foxo1 промотора Igfbp1 (левая панель) и промотора Hes1 (правая панель) в клетках, котрансфицированных Foxo1-ADA или DBD-Foxo1ADA. Вестерн-блот демонстрирует (вставка), что уровни экспрессии двух белков являются сходными. Звездочкой указано P<0,01 посредством ANOVA.
Фигура 39A-39E
На этих фигурах показаны коиммунопреципитаты Foxo1 с Csl. a. Коиммунопреципитация эндогенного Foxo1 и Csl в клетках C2C12, кокультивированных с клетками HEK293, экспрессирующими LacZ (обозначенными знаком "-") или Jagged1 (обозначенными знаком "+"). b-c. Эксперименты с коиммунопреципитацией в клетках C2C12, котрансфицированных FLAG-Csl и HA-Foxo1. d-e. Эксперименты с коиммунопреципитацией в клетках C2C12, котрансфицированных FLAG-Csl и трансдуцированных меченным мутантным Myc или HA Δ256 Foxo1.
Фигуры 40A-40D
На этих фигурах показано, что Foxo1 связывается непосредственно с Csl. a. Анализ с "опусканием" GST для слитого белка GST-Foxo1 с Csl, иммунопреципитированным из клеток HEK293. b-c. Связывание GST-Foxo1 и GST-FLAG-Csl в бесклеточной системе и картирование домена взаимодействия Csl. Полноразмерные и укороченные фрагменты GST-Foxo1 и GST-FLAG/Csl очищали из бактерий и коинкубировали. Затем выделяли Csl с использованием антитела против FLAG, и иммунопреципитат анализировали путем иммуноблоттинга с антителами против Foxo1 или против FLAG. d. Промотор Hes1 ChIP, охватывающий участок связывания Csl в клетках C2C12 для детекции эндогенного Foxo1, Csl и Notch1 (Endog) или после трансдукции Foxo1-ADA (Foxo1-ADA) в процессе дифференцировки миобластов. Исходный материал представляет собой ДНК, экстрагированную из хроматина перед иммунопреципитацией. Показана экспрессия Hes1 (полуколичественная RT-PCR) и миозина (вестерн-блот), соответствующая каждому моменту времени. 0 сутки определяются как время, когда клетки лишают сыворотки для индукции слияния миобластов. Сокращения: IP: иммунопреципитация; IB: иммуноблоттинг; TCL: тотальный клеточный лизат.
Фигуры 41A-41B
На этих фигурах показано, что Foxo1 регулирует индуцированную Notch экспрессию Hes1, Hes5 и Hey1. a. Экспрессия Hes1, Hes5 и Hey1, измеренная посредством полуколичественной RT-PCR в клетках C2C12, трансдуцированных Foxo1-ADA или Notch1-IC после трансфекции siRNA Gfp, Foxo1 или Csl, как указано. b. Анализ с репортерным геном Hes1 в клетках HEK293, трансдуцированных siRNA для Foxo1-ADA, Notch1-IC, Foxo1 siRNA, GFP siRNA или контрольной плазмидой. Авторы настоящего изобретения измеряли активность люциферазы и нормализовывали ее по активности β-галактозидазы. Данные представляют собой произвольные единицы относительно контрольного пустого вектора.
Фигуры 42A-42F
На этих фигурах показано, что Foxo1 требуется для связывания Notch с промотором Hes1 и активации генов-мишеней Hes1. a. Анализы ChIP эндогенных Foxo1 и Notch1 в клетках C2C12, кокультивированных с клетками HEK293, экспрессирующими LacZ (обозначенными знаком "-") или Jagged1 (обозначенными знаком "+") в отсутствии (дорожки 1-2) и присутствии (дорожки 3-4) siRNA для Csl. b. Анализы ChIP эндогенного Notch1 в системе кокультуры в отсутствии (дорожки 1-2) и присутствии (дорожки 3-4) siRNA для Foxo1. c. Анализы промотора Hes1 после кокультуры в отсутствии и в присутствии siRNA для Foxo1 или Gfp. d. Анализы ChIP связывания Ncor и Smrt и Maml1 с Hes1 в системе кокультуры в отсутствии (дорожки 1-2) и в присутствии (дорожки 3-4) siRNA для Foxo1. e. Экспрессия MyoD, Myf5 и β-актина в клетках C2C12 посредством полуколичественной RT-PCR. f. Модель регуляции Foxo1 и Notch промотора Hes1.
Фигуры 43A-43D
На этих фигурах показано зависимое от условий устранение Foxo1 в скелетной мышце. a. Вестерн-блот анализ уровней экспрессии Foxo1 и Foxo4 в различных типах мышц. b. Метахроматический и иммуногистохимический анализ камбаловидной и подошвенной мышц от мышей Myog-Foxo1 и контрольных (lox/lox) однопометных животных. c. Анализ экспрессии генов у Myog-Foxo1 (закрашенные столбцы) и контрольных мышей (незакрашенные столбцы); TropC: тропонин-C; TropT: тропонин-T; Mlc: легкая цепь миозина; Myog: миогенин; Mck: креатинкиназа мышечного типа. Данные представляют собой средние значения ± SEM для трех независимых измерений (n=6 для каждого генотипа). Звездочкой указан P<0,05 при ANOVA. d. Функциональный тест на "беговой дорожке" у мышей Myog-Foxo1 в возрасте 8 недель и однопометных животных lox/lox (n=6 для каждого генотипа). Звездочкой указано P<0,05 при ANOVA.
Фигура 44
На этой фигуре представлена эффективность аденовирусной трансдукции в клетках C2C12. Авторы настоящего изобретения трансдуцировали клетки аденовирусом HA-Foxo1-ADA или HA-Notch1-IC и провели иммуногистохимию с антителом против HA (красный) и DAPI (синий).
Фигура 45
На этой фигуре представлено ингибирование экспрессии трансфицированного Foxo1. Авторы настоящего изобретения тестировали способность siRNA для Foxo1 ингибировать экспрессию эндогенного (левая панель) и трансфицированного (правая панель) Foxo1 после аденовирусной трансдукции.
Фигура 46
На этой фигуре представлена специфичность siRNA для Foxo1. Вестерн-блот анализ экспрессии Foxo1, Foxo3 и Foxo4 в клетках C2C12, трансфицированных siRNA для Foxo1.
Фигура 47
На этой фигуре показано, что Foxo1-ADA и Notch1-IC не влияют на пролиферацию клеток. Авторы настоящего изобретения трансдуцировали клетки C2C12 аденовирусом LacZ, Foxo1-ADA или Notch1-IC, провели иммуногистохимию с антителом против Ki67 и DAPI и вычислили индекс мечения Ki67 в качестве процента Ki67-положительных клеток посредством подсчета по меньшей мере 1000 клеток.
Фигура 48
На этой фигуре представлен siRNA-устойчивый Foxo1-ADA. Вестерн-блот Foxo1-ADA и siRNA-устойчивого Foxo1-ADA в клетках, трансфицированных siRNA для Foxo1.
Фигура 49
На этой фигуре представлена специфичность коиммунопреципитации Foxo1-Csl. После трансфекции экспрессирующими векторами Foxo3 или Foxo4, авторы настоящего изобретения провели эксперименты по коиммунопреципитации с Csl.
Фигура 50
На этой фигуре представлен анализ промотора Hes1. Авторы настоящего изобретения использовали синтетический репортерный ген Hes1, содержащий четыре тандемных повтора участка связывания Csl в анализах промотора с Foxo1 и Notch1-IC в клетках C2C12.
Фигура 51
На этой фигуре представлено ингибирование экспрессии Csl посредством siRNA. Авторы настоящего изобретения измерили уровни Csl с помощью вестерн-блота после трансфекции клеток C2C12 посредством siRNA для Csl в различных концентрациях.
Фигура 52
На этой фигуре представлена схема одиннадцати составов ловушек Notch1 человека.
Фигура 53
На этой фигуре представлен анализ сигнальной последовательности Notch1 для определения конца сигнального пептида Notch1. Представлены результаты предсказания в анализе с использованием Signal I 3.0 Server, предоставленного он-лайн Technical Univeristy of Denmark. Результаты предсказывают главный участок расщепления, расположенный между аланином 18 (A19) и A19, и минорный участок расщепления между A19 и аргинином 20 (R20). Эти два участка расщепления указаны с помощью "/" в аминокислотной последовательности 1-20 Notch1 человека: MPPLLAPLLCLALLPALA/A/R (SEQ ID NO:15). Нуклеотидная последовательность, кодирующая аминокислоты 1-23 Notch1 человека, представляет собой atgccgccgc tcctggcgcc cctgctctgc ctggcgctgc tgcccgcgct cgccgcacga ggcccgcga (SEQ ID NO:16).
Фигура 54
На этой фигуре представлен анализ сигнальной последовательности Hc человека для определения конца сигнального пептида Hc человека. MWGWKCLLFWAVLVTATLCTA/R (SEQ ID NO:17). Результаты предсказания в анализе с использованием SignalIP 3.0 Server, предоставленного он-лайн Technical University of Denmark, указаны выше. Эти результаты предсказывают главный участок расщепления, расположенный между аланином 21 (A21) и аргинином 22 (R22). Этот участок расщепления указан посредством "/" в аминокислотной последовательности 1-22 Hc человека (SEQ ID NO:17), предоставленной выше. Нуклеотидная последовательность, кодирующая аминокислоты 1-22 Hc человека, представляет собой atgtggggct ggaagtgcct cctcttctgg gctgtgctgg tcacagccac tctctgcact gccagg (SEQ ID NO:18).
Фигура 55
На этой фигуре представлена слитая последовательность Notch1/Fc человека для всех конструкций, которые кончаются после повтора 36 EGF в Notch1 человека.
Фигура 56
На этой фигуре представлена слитая последовательность Notch1/Fc человека для всех конструкций, которые кончаются после повтора 13 EGF в Notch1 человека.
Фигура 57
На этой фигуре представлена слитая последовательность Notch1/Fc человека для всех конструкций, которые кончаются после повтора 23 EGF Notch1 человека.
Фигура 58
На этой фигуре представлена слитая последовательность Notch1/Fc человека для всех конструкций, которые кончаются после повтора 24 EGF в Notch1 человека.
Фигура 59A и 59B
На этой фигуре представлена полноразмерная аминокислотная (а.к.) последовательность Notch1 человека, состоящая из остатков с а.к. 1 (M = метионин) по а.к. 2555 (K = лизин) (SEQ ID NO:52). Сигнальный пептид и первые 36 EGF-подобных домена присутствуют в а.к. 1-1433 этой последовательности. Аминокислоты 1-1433, или подгруппу этих а.к., использовали для конструирования белков ловушки Notch1 человека, описанных в последующих разделах. Аминокислоты, охватывающие EGF-повторы 1-36, подчеркнуты.
Фигура 60
На этой фигуре представлена аминокислотная последовательность Fc человека, использованная для получения Fc-метки на белках ловушек Notch1 (SEQ ID NO:53). 237 аминокислот Fc человека подвергали слиянию с C-концом всех конструкций ловушек Notch1, непосредственно ниже EGF-подобных повторов Notch1. Эта область Fc человека позволяет детекцию и очистку ловушек Notch и служит для стабилизации секретируемых слитых белков Notch1 человека-Fc человека.
Фигура 61
На этой фигуре представлена аминокислотная последовательность белка ловушки h-Notch1(1-36) (SEQ ID NO:54). Белок ловушки h-Notch1(1-36) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch1 человека, состоящая из аминокислот 1-23 Notch1 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 1-36 Notch1 человека, состоящие из аминокислот 24-1433, а затем (3) аминокислоты 1434-1670, которые содержат HC-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и метка Fc человека подчеркнута и выделена курсивом. Этот состав содержит 1670 аминокислот.
Фигура 62
На этой фигуре представлена аминокислотная последовательность белка ловушки h-Notch1(1-13) (SEQ ID NO:55). Белок ловушки h-Notch1(1-13) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch1 человека, состоящая из аминокислот 1-23 Notch1 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 1-13 Notch1 человека, состоящие из аминокислот 24-531, а затем (3) аминокислоты 532-768, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 768 аминокислот.
Фигура 63
На этой фигуре представлена аминокислотная последовательность белка ловушки h-Notch1(1-24) (SEQ ID NO:56). Белок ловушки h-Notch1(1-24) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch1 человека, состоящая из аминокислот 1-23 Notch1 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 1-24 Notch1 человека, состоящие из аминокислот 24-948, а затем (3) аминокислоты 949-1185, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1185 аминокислот.
Фигура 64
На этой фигуре представлена аминокислотная последовательность белка ловушки h-SpNNotch1(9-23) (SEQ ID NO:57). Белок ловушки h-spNNotch1(9-23) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch1 человека, состоящая из аминокислот 1-23 Notch1 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-23 Notch1 человека, состоящие из аминокислот 24-594, а затем (3) аминокислоты 595-831, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 829 аминокислот.
Фигура 65
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spHCNotch1(9-23) (SEQ ID NO:58). Белок ловушки h-spHCNotch1(9-23) состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 HC человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-23 Notch1 человека, состоящие из аминокислот 23-593, а затем (3) аминокислоты 594-830, которые содержат HC-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 829 аминокислот.
Фигура 66
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spNNotch1(9-36) (SEQ ID NO:59). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch1 человека. Белок ловушки h-spNNotch1(9-36) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch1 человека, состоящая из аминокислот 1-23 Notch1 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-36 Notch1 человека, состоящие из аминокислот 24-1118, а затем (3) аминокислоты 1119-1355, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1355 аминокислот.
Фигура 67
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spHCNotch1(9-36) (SEQ ID NO:60). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека. Белок ловушки h-spHCNotch1(9-36) состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 HC человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-36 Notch1 человека, состоящие из аминокислот 23-1117, а затем (3) аминокислоты 1118-1354, которые содержат HC-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1354 аминокислоты.
Фигура 68
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spNNotch1(13-24) (SEQ ID NO:61). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch1 человека. Белок ловушки h-spNNotch1(13-24) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch1 человека, состоящая из аминокислот 1-23 Notch1 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 13-24 Notch1 человека, состоящие из аминокислот 24-478, а затем (3) аминокислоты 479-715, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 715 аминокислот.
Фигура 69
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spHCNotch1(13-24) (SEQ ID NO:62). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека. Белок ловушки h-spHCNotch1(13-24) состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 HC человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 13-24 Notch1 человека, состоящие из аминокислот 23-477, а затем (3) аминокислоты 478-714, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 714 аминокислот.
Фигура 70
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spNNotch1(25-36) (SEQ ID NO:63). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch1 человека. Белок ловушки h-spNNotch1(25-36) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch1 человека, состоящая из аминокислот 1-23 Notch1 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 25-36 Notch1 человека, состоящие из аминокислот 24-508, а затем (3) аминокислоты 509-745, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 745 аминокислот.
Фигура 71
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spHCNotch1(25-36) (SEQ ID NO:64). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека. Белок ловушки h-spHCNotch1(25-36) состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 HC человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 25-36 Notch1 человека, состоящие из аминокислот 23-507, а затем (3) аминокислоты 508-744, которые содержат HC-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 744 аминокислоты.
Фигура 72A и 72B
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-Notch1(1-36), указанный на фигуре 61 (SEQ ID NO:65).
Фигура 73
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-Notch1(1-13), указанный на фигуре 62 (SEQ ID NO:66).
Фигура 74A и 74B
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-Notch1(1-24), указанный на фигуре 63 (SEQ ID NO:67).
Фигура 75
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spNNotch1(9-23), указанный на фигуре 64 (SEQ ID NO:68).
Фигура 76
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spHCNotch1(9-23), указанный на фигуре 65 (SEQ ID NO:69).
Фигура 77A и 77B
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spNNotch1(9-36), указанный на фигуре 66 (SEQ ID NO:70).
Фигура 78A и 78B
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spHCNotch1(9-36), указанный на фигуре 67 (SEQ ID NO:71).
Фигура 79
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spNNotch1(13-24), указанный на фигуре 68 (SEQ ID NO:72).
Фигура 80
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spHCNotch1(13-24), указанный на фигуре 69 (SEQ ID NO:73).
Фигура 81
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spNNotch1(25-36), указанный на фигуре 70 (SEQ ID NO:74).
Фигура 82
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spHCNotch1(25-36), указанный на фигуре 71 (SEQ ID NO:75).
Фигура 83
На этой фигуре представлена полноразмерная аминокислотная (а.к.) последовательность Notch4 человека, состоящая из остатков с а.к. 1 (M = метионин) по а.к. 2003 (K = лизин) (SEQ ID NO:76). Сигнальный пептид и первые 29 доменов EGF-подобных повторов присутствуют в а.к. 1-1174 этой последовательности. Аминокислоты 1-1174, или подгруппу этих а.к., использовали для конструирования белков ловушек человека Notch4, описанных в последующих разделах. Аминокислоты, охватывающие EGF-повторы 1-29, подчеркнуты.
Фигура 84
На этой фигуре представлена последовательность Fc человека, используемая для получения Fc-метки на белках ловушках Notch4 (SEQ ID NO:77). 237 аминокислот Fc человека, показанные здесь, подвергали слиянию с C-концом конструкций ловушек Notch4, непосредственно ниже EGF-подобных повторов Notch4. Эта область Fc человека позволяет детекцию и очистку ловушек Notch и служит для стабилизации секретируемых слитых белков Notch4 человека-Fc человека.
Фигура 85
На этой фигуре представлена аминокислотная последовательность белка ловушки h-Notch4(1-29) (SEQ ID NO:78). Белок ловушки h-Notch4(1-29) состоит из следующих трех компонентов:(1) сигнальная последовательность Notch4 человека, состоящая из аминокислот 1-27 Notch4 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 1-29 Notch4 человека, состоящие из аминокислот 28-1173, а затем (3) аминокислоты 1174-1410, которые содержат HC-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1410 аминокислот.
Фигура 86
На этой фигуре представлена аминокислотная последовательность белка ловушки h-Notch4(1-13) (SEQ ID NO:79). Белок ловушки h-Notch4(1-13) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch4 человека, состоящая из аминокислот 1-27 Notch4 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 1-13 Notch4 человека, состоящие из аминокислот 28-554, а затем (3) аминокислоты 555-791, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 791 аминокислоту.
Фигура 87
На этой фигуре представлена аминокислотная последовательность белка ловушки h-Notch4(1-23) (SEQ ID NO:80). Белок ловушки h-Notch4(1-23) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch4 человека, состоящая из аминокислот 1-27 Notch4 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 1-23 Notch4 человека, состоящие из аминокислот 28-933, а затем (3) аминокислоты 934-1170, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1170 аминокислот.
Фигура 88
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spNNotch4(9-23) (SEQ ID NO:81). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch4 человека. Белок ловушки h-spNNotch4(9-23) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch4 человека, состоящая из аминокислот 1-27 Notch4 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-23 Notch4 человека, состоящие из аминокислот 28-602, а затем (3) аминокислоты 603-839, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 839 аминокислот.
Фигура 89
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spHCNotch4(9-23) (SEQ ID NO:82). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека. Белок ловушки h-spHCNotch4(9-23) состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 HC человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-23 Notch4 человека, состоящие из аминокислот 23-597, а затем (3) аминокислоты 598-834, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 834 аминокислоты.
Фигура 90
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spNNotch4(9-29) (SEQ ID NO:83). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch4 человека. Белок ловушки h-spNNotch4(9-23) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch4 человека, состоящая из аминокислот 1-27 Notch4 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-29 Notch4 человека, состоящие из аминокислот 28-843, а затем (3) аминокислоты 844-1080, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1080 аминокислот.
Фигура 91
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spHCNotch4(9-29) (SEQ ID NO:84). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека. Белок ловушки h-spHCNotch4(9-29) состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 HC человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-29 Notch4 человека, состоящие из аминокислот 23-838, а затем (3) аминокислоты 839-1075, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1075 аминокислот.
Фигура 92
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spNNotch4(13-23) (SEQ ID NO:85). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch4 человека. Белок ловушки h-spNNotch4(13-23) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch4 человека, состоящая из аминокислот 1-27 Notch4 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 13-23 Notch4 человека, состоящие из аминокислот 28-444, а затем (3) аминокислоты 445-681, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 681 аминокислоту.
Фигура 93
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spHCNotch4(13-23) (SEQ ID NO:86). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека. Белок ловушки h-spHCNotch4(13-23) состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 HC человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 13-23 Notch4 человека, состоящие из аминокислот 23-439, а затем (3) аминокислоты 440-676, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 676 аминокислот.
Фигура 94
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spNNotch4(21-29) (SEQ ID NO:87). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch4 человека. Белок ловушки h-spNNotch4(21-29) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch4 человека, состоящая из аминокислот 1-27 Notch4 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 21-29 Notch4 человека, состоящие из аминокислот 28-392, а затем (3) аминокислоты 393-629, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 629 аминокислот.
Фигура 95
На этой фигуре представлена аминокислотная последовательность белка ловушки h-spHCNotch4(21-29) (SEQ ID NO:88). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека. Белок ловушки h-spHCNotch4(21-29) состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 HC человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 21-29 Notch4 человека, состоящие из аминокислот 23-387, а затем (3) аминокислоты 388-624, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 624 аминокислоты.
Фигура 96A и 96B
На этой фигуре представлена последовательность нуклеиновой кислоты Notch4 человека (SEQ ID NO:89).
Фигура 97
На этой фигуре представлена последовательность сигнального пептида Notch4 человека (SEQ ID NO:90). Подчеркнутая последовательность кодирует сигнальный пептид.
Фигура 98
На этой фигуре представлена последовательность нуклеиновой кислоты сигнального пептида HC человека (н. 1-66) (SEQ ID NO:91).
Фигура 99
На этой фигуре представлена последовательность нуклеиновой кислоты FC-метки человека (SEQ ID NO:92).
Фигура 100
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-Notch4(1-29) (SEQ ID NO:93). Ловушка Notch4 человека (EGF-подобные повторы 1-29) [н. 1-3522].
Фигура 101
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-Notch4(1-13) (SEQ ID NO:94). Ловушка Notch4 человека (EGF-подобные повторы 1-13) [н. 1-1662].
Фигура 102
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-Notch4(1-23) (SEQ ID NO:95). Ловушка Notch4 человека (EGF-подобные повторы 1-23) [н. 1-2799].
Фигура 103
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spNNotch4(9-29) (SEQ ID NO:96). Ловушка Notch4 человека (EGF-подобные повторы 9-29) [н. 1-81, 1075-3522].
Фигура 104
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spHCNotch4(9-29) (SEQ ID NO:97). Ловушка Notch4 человека (EGF-подобные повторы 9-29) [н. 1075-3522] и сигнальный пептид HC [н. 1-66].
Фигура 105
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spNNotch4(9-23) (SEQ ID NO:98). Ловушка Notch4 человека (EGF-подобные повторы 9-23) [н. 1-81, 1075-2799].
Фигура 106
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spHCNotch4(9-23) (SEQ ID NO:99). Ловушка Notch4 человека (EGF-подобные повторы 9-23) [н. 1075-2799] и сигнальный пептид HC [н. 1-66].
Фигура 107
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spNNotch4(13-23) (SEQ ID NO:100). Ловушка Notch4 человека (EGF-подобные повторы 13-23) [н. 1-81, 1549-2799].
Фигура 108
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spHCNotch4(13-23) (SEQ ID NO:101). Ловушка Notch4 человека (EGF-подобные повторы 13-23) [н. 1549-2799] и сигнальный пептид HC [н. 1-66].
Фигура 109
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spNNotch4(21-29) (SEQ ID NO:102). Ловушка Notch4 человека (EGF-подобные повторы 21-29) [н. 1-81, 2428-3522].
Фигура 110
На этой фигуре представлена последовательность нуклеиновой кислоты, которая кодирует белок ловушки h-spHCNotch4(21-29) (SEQ ID NO:103). Ловушка Notch4 человека (EGF-подобные повторы 21-29) [н. 2428-3522] и сигнальный пептид HC [н. 1-66].
Фигура 111
На этой фигуре представлена схема одиннадцати составов ловушек Notch4 человека.
Фигура 112
На этой фигуре представлен анализ сигнальной последовательности Notch4 для определения конца сигнального пептида Notch4.
Фигура 113
На этой фигуре представлена слитая последовательность Notch4/Fc человека для всех конструкций, которые кончаются после EGF-повтора 29 в Notch4 человека.
Фигура 114
На этой фигуре представлена слитая последовательность Notch4/Fc человека для всех конструкций, которые кончаются после EGF-повтора 13 Notch4 человека.
Фигура 115
На этой фигуре представлена слитая последовательность Notch4/Fc человека для всех конструкций, которые кончаются после EGF-повтора 23 Notch4 человека.
Фигура 116
На этой фигуре показано, что недостаточность Notch4 снижает циркулирующие уровни глюкозы и инсулина. Авторы настоящего изобретения в настоящее время анализируют уровни глюкозы и инсулина в крови у мутантных по Notch4 (N4) мышей. При отлучении от матери (P21) множество пометов, полученных в результате скрещиваний N4+/-, кормили либо нормальным рационом, либо рационом с высоким содержанием жиров, содержащим 45% калорий из жира. В возрасте 5 месяцев проводили забор крови и определяли уровни глюкозы и инсулина у мышей с произвольным рационом или у мышей после 6 часов голодания. У самок снижение аллелей N4 коррелировало со значимым снижением циркулирующих уровней глюкозы независимо от рациона. Напротив, недостаточность N4 была ассоциирована со снижением уровней глюкозы только у самцов, которых кормили нормальным рационом. Уровни инсулина у всех самок были неизмененными (данные не представлены). Это может быть следствием того, что самки мышей генетически защищены от устойчивости к инсулину, и, таким образом, метаболические аномалии являются в значительной степени мягкими. При нормальном рационе не было отличий в уровнях инсулина у самцов мышей. Однако устранение N4 коррелировало со значимым снижением уровней инсулина при произвольном рационе у самцов мышей, которых кормили рационом с высоким содержанием жиров. Сходную тенденцию наблюдали для самцов с нокаутом N4, которых подвергали голоданию в течение 6 часов. Таким образом, утрата N4 коррелировала со значимым снижением уровней глюкозы в крови, как у самцов, так и у самок, которых кормили нормальным рационом. У самок это снижение уровней глюкозы, но не уровня инсулина, наблюдали у самок, мутантных по N4, которых кормили рационом с высоким содержанием жиров. Напротив, уровни глюкозы были неизмененными у мышей с нокаутом N4, в то время как уровни инсулина были снижены. Эти результаты согласуются с недостаточностью Notch4, защищающей от генетических и связанных с окружающей средой форм гипергликемии вследствие нарушенной передачи сигнала инсулина.
Фигура 117
На этой фигуре показано, что утрата экспрессии Notch4 подавляла набор массы тела у мышей, которых кормили рационом с высоким содержанием жиров.
Фигура 118
На этой фигуре показано, что ловушка Notch1 крысы присутствует в сыворотке мыши. Тестировали стабильность состава ловушки Notch1 крысы в кровотоке млекопитающих. Вестерн-блот анализ демонстрирует, что полноразмерный белок может экспрессироваться у мышей и присутствует на поддающихся детекции уровнях с небольшими признаками деградации.
Фигура 119
На этой фигуре показано, что ловушка Notch1 человека (ловушка n-Notch(1-36)) и ловушка Notch1 крысы блокируют рост опухоли молочной железы мыши. Кривая роста, представленная здесь, демонстрирует, что как ловушка Notch1 крысы, так и ловушка Notch1 человека снижали рост ксенотрансплантатов опухолей у мышей nude.
Фигура 120
На этой фигуре показано, что ловушка Notch1 крысы ингибирует метастазы SKNEP1 в ткань легких. Клетки саркомы Юинга SKNEP1 программировали для экспрессии контрольного Fc-белка или ловушки Notch1 крысы s1 (тип 2) или ловушки Notch1 крысы s4 (тип 4). Эти клеточные линии SKNEP1 ортотопно имплантировали в почку мышей nude. После роста опухоли в течение 6 недель проводили гистологическую оценку метастазов в легкое. В клетках SKNEP1, экспрессирующих ловушку Notch1 крысы, была показана меньшая часть легких, которая была положительна по метастазам. Авторы настоящего изобретения заключили, что экспрессия ловушки Notch1 крысы у мышей nude снижает способность клеток SKNEP1 метастазировать в легкое.
Фигура 121
На этой фигуре показано, что Notch1 и Notch4 коэкспрессируются с VEGFR-3 и LYVE-1 в лимфатических сосудах кожи мыши. Экспрессию Notch1 и Notch4 анализировали в сосудах кожи спины мыши P4. В этот момент времени лимфатические сосуды кожи активно ремоделируются в лимфатические капилляры вблизи поверхности и собирающих протоков в нижних слоях кожи. Поперечные срезы кожи размером 5 мкм совместно окрашивали антителами против Notch1 или Notch4 (красный) и PECAM, VEGFR-3 или LYVE-1 (зеленый). Notch1 и Notch4 обладают перекрывающимся паттерном экспрессии с маркерами кровяных и лимфатических эндотелиальных клеток, PECAM (верхние панели). Notch1 и Notch4 коэкспрессировались как с VEGFR-3 (средние панели), так и с LYVE-1 в сосудах кожи (нижние панели). Этот паттерн экспрессии демонстрирует, что Notch1 и Notch4 экспрессируются и могут функционировать в лимфатических сосудах неонатальной кожи.
Фигура 122
На этой фигуре показано, что лимфатические капилляры кожи изменены у гомозиготных мышей с нокаутом Notch4. Авторы настоящего изобретения исследовали лимфатические сосуды кожи мышей P4. Секреты мышей дикого типа и мышей, нуль-зиготных по Notch4, подвергали иммунному окрашиванию антителами против PECAM и LYVE-1 (зеленый). Анализ окрашивания PECAM выглядел сходным образом между мутантной кожей и кожей дикого типа (верхние панели). Напротив, положительные по LYVE-1 сосуды в коже мутантов по Notch4 имели морфологию, отличающуюся от морфологии мышей дикого типа (средние панели). Мутантные по Notch4 сосуды LYVE-1 часто были расширенными, и окрашивание LYVE-1 было прерывистым (нижние панели). Эти результаты указывают на то, что передача сигнала Notch4 может быть вовлечена в ремоделирование лимфатического сосудистого сплетения.
Фигура 123
На этой фигуре показано, что утрата Notch4 коррелирует со сниженной экспрессией LYVE1 в лимфатических сосудах кожи мышей. Мышей, гетерозиготных по Notch4 (N4+/-), скрещивали, и кожу спины полученных детенышей удаляли и заливали на 14 сутки после рождения. Поперечные срезы кожи подвергали иммунному окрашиванию на маркер эндотелиальных клеток, PECAM (данные не представлены), или маркер лимфатических эндотелиальных клеток, LYVE1 (A). В каждом случае регистрировали пять областей посредством микроскопии, и окрашивание PECAM и LYVE1 подвергали количественному определению с использованием программного обеспечения для визуализации (B, C). Экспрессия PECAM была снижена приблизительно на 25% в коже N4-/- по сравнению с кожей дикого типа (WT) (B). Окрашивание LYVE-1 было более изменено, чем окрашивание PECAM, причем окрашивание LYVE1 было снижено практически на 50% у мышей N4-/- относительно мышей WT (C). Также происходило снижение интенсивности окрашивания LYVE1 в лимфатических сосудах N4-/- относительно WT (A).
Фигура 124
На этой фигуре показано, что Notch1 и Notch4 экспрессируются в лимфатических сосудах рака молочной железы человека. Авторы настоящего изобретения провели двойную иммуногистохимию с антителами против VEGFR-3 или LYVE-1 (зеленый) и Notch1 или Notch4 (красный) рака молочной железы. Notch1 и Notch4 экспрессировались во внеопухолевом эндотелии кровеносных и лимфатичесих микрокапилляров карцином молочной железы человека. Для определения того, происходит ли активация передачи сигнала Notch1 в лимфатическом эндотелии опухоли, авторы настоящего изобретения провели двойное окрашивание антителом против подопланина (зеленый) и антителом N1Val (красный; клеточная передача сигнала), которое осуществляет специфичную детекцию активированного пептида Notch1. Экспрессию активированного пептида Notch1 наблюдали в большинстве (белые стрелки), но не во всех (желтые стрелки) из ядер лимфатического эндотелия (нижняя панель). Эти результаты демонстрируют, что Notch1 активно передавал сигнал в патологических лимфатических сосудах.
Подробное описание изобретения
Термины
В настоящей заявке, за исключением случаев, явно указанных в настоящем документе, каждый из представленных ниже терминов имеет значение, указанное ниже.
"Введение" можно осуществлять или проводить с использованием любых способов, известных специалисту в данной области. Способы включают, например, внутрираневой, внутримышечный, подкожный, внутривенный, внутрибрюшинный, опосредуемый липосомами, осуществляемый через слизистую оболочку, кишечный, местный, назальный, пероральный, анальный, глазной или ушной способ доставки.
"Фиксированный" означает присоединенный любыми способами. В одном варианте осуществления фиксированный означает присоединенный ковалентной связью. В другом варианте осуществления фиксированный означает присоединенный нековалентно.
Термины "аминокислота", "аминокислотный остаток" и "остаток" используют в настоящем документе взаимозаменяемо, и они относятся к аминокислоте, которая включена в белок, полипептид или пептид. Аминокислота может представлять собой, например, встречающуюся в природе аминокислоту или аналог природной аминокислоты, который может функционировать аналогично функционированию встречающейся в природе аминокислоты.
"Антитело" включает, но не ограничивается ими, (a) молекулу иммуноглобулина, содержащую две тяжелых цепи и две легких цепи, и которое распознает антиген; (b) молекулу поликлонального или моноклонального иммуноглобулина; и (c) их одновалентный или двухвалентный фрагмент. Молекулы иммуноглобулинов могут относиться к любому из широко известных классов, включая, но не ограничиваясь ими, IgA, секреторный IgA, IgG, IgE и IgM. Подклассы IgG хорошо известны специалистам в данной области и включают, но не ограничиваются ими, IgG1, IgG2, IgG3 и IgG4 человека. Антитела могут быть как встречающимися в природе, так и не встречающимися в природе. Более того, антитела включают химерные антитела, полностью синтетические антитела, одноцепочечные антитела и их фрагменты. Антитела могут представлять собой антитела человека и антитела не человека. Антитела не человека могут быть гуманизированы рекомбинантными способами для снижения их иммуногенности у человека. Фрагменты антитела включают, но не ограничиваются ими, Fab- и Fc-фрагменты. "Fc-часть антитела", в одном варианте осуществления, представляет собой кристаллизуемый фрагмент, получаемый расщеплением папаином иммуноглобулина, который состоит из C-концевой половины двух тяжелых цепей, связанных дисульфидными связями, и известной как "эффекторная область" иммуноглобулина. В другом варианте осуществления "Fc-часть антитела" означает всю, или по существу всю, одну C-концевую половину тяжелой цепи.
"Гуманизированный", в отношении антитела, означает антитело, где некоторые, большинство или все из аминокислот вне области CDR заменены соответствующими аминокислотами из молекулы иммуноглобулина человека. Небольшие вставки, делеции, инсерции или замены или модификации аминокислот являются допустимыми, при условии, что они не устраняют способность антитела связывать данный антиген. Пригодные молекулы иммуноглобулина человека включают, но не ограничиваются ими, молекулы IgG1, IgG2, IgG3, IgG4, IgA и IgM. Получение гуманизированных антител описано в различных публикациях, например, в патентах США №№ 4816567, 5225539, 5585089 и 5693761 и международной публикации PCT № WO 90/07861.
В настоящем документе термин "композиция", как в случае фармацевтической композиции, охватывает продукт, содержащий активный ингредиент(ы) и инертный ингредиент(ы), который образует носитель, а также любой продукт, который образуется вследствие, прямо или непрямо, комбинирования, образования комплексов или агрегации двух или более ингредиентов, или вследствие диссоциации двух или более ингредиентов, или вследствие других типов реакций или взаимодействий одного или нескольких ингредиентов.
В настоящем документе "эффективное количество" относится к количеству, которое способно осуществлять лечение субъекта, имеющего опухоль, заболевание или нарушение. Таким образом, эффективное количество варьирует в зависимости от субъекта, подвергаемого лечению, а также от состояния, подлежащего лечению. Специалист в данной области может проводить общепринятые эксперименты по титрованию для определения такого достаточного количества. Эффективное количество соединения может варьировать в зависимости от субъекта и от конкретного используемого способа введения. Исходя из соединения, количество может доставляться непрерывно, например, с помощью непрерывного насоса, или с периодическими интервалами (например, за один или несколько отдельных раз). Требуемые временные интервалы для различных количеств конкретного соединения может определить специалист в данной области без излишнего экспериментирования. В одном варианте осуществления эффективное количество составляет между приблизительно 1 мкг/кг-10 мг/кг. В другом варианте осуществления эффективное количество составляет между приблизительно 10 мкг/кг-1 мг/кг. В следующем варианте осуществления эффективное количество составляет 100 мкг/кг.
"Внеклеточный домен", как используют в связи с рецепторным белком Notch, означает весь Notch или его часть, которая
(i) существует внеклеточно (т.е. не существует ни в качестве трансмембранной части, ни в качестве внутриклеточной части) и
(ii) связывается с внеклеточными лигандами, с которыми связывается интактный рецепторный белок Notch. Внеклеточный домен Notch необязательно может включать сигнальный пептид. "Внеклеточный домен", "ECD" и "эктодомен" являются синонимами.
"Группа, увеличивающая время полужизни" означает группу, которая, когда она функционально связана со второй группой, увеличивает время полужизни in vivo второй группы. Группы, увеличивающие время полужизни, включают, например, Fc-части антител, гликозилирующие метки (т.е. гликозилированные полипептиды), полиэтиленгликоль (PEG), полипептиды, имеющие PEG, связанный с ними, и модифицированные липидами полипептиды.
"Ингибирование" возникновения нарушения или нежелательного биологического процесса означает либо снижение вероятности возникновения нарушения или процесса, либо профилактику возникновения нарушения или процесса полностью.
В предпочтительном варианте осуществления ингибирование возникновения нарушения или процесса означает профилактику его возникновения полностью.
"Notch", "белок Notch" и "рецепторный белок Notch" являются синонимами. Кроме того, термины "слитый белок на основе Notch" и "ловушка Notch" являются синонимами. Следующие аминокислотные последовательности Notch известны и включены в настоящий документ в качестве ссылок: Notch1 (регистрационный номер Genbank № S18188 (крыса)); Notch2 (регистрационный номер Genbank № NP_077334 (крыса)); Notch3 (регистрационный номер Genbank № Q61982 (мышь)); и Notch4 (регистрационный номер Genbank № T09059 (мышь)). Следующие последовательности нуклеиновых кислот Notch известны и включены в качестве ссылок: Notch1 (регистрационный номер Genbank № XM_342392 (крыса) и NM_017617 (человек)); Notch2 (регистрационный номер Genbank № NM_024358 (крыса), M99437 (человек) и AF308601 (человек)); Notch3 (регистрационный номер Genbank № NM_008716 (мышь) и XM_009303 (человек)); и Notch4 (регистрационный номер Genbank № NM_010929 (мышь) и NM_004557 (человек)).
Термины "нуклеиновая кислота", "полинуклеотид" и "последовательность нуклеиновой кислоты" используют в настоящем документе взаимозаменяемо, и все они относятся к полимеру дезоксирибонуклеотидов и/или рибонуклеотидов. Дезоксирибонуклеотиды и рибонуклеотиды могут быть встречающимися в природе, или они могут представлять собой их синтетические аналоги. "Нуклеиновая кислота" означает любую нуклеиновую кислоту, включая, но не ограничиваясь ими, ДНК, РНК и их гибриды. Основания нуклеиновых кислот, которые образуют молекулы нуклеиновых кислот, могут представлять собой основания A, C, G, T и U, а также их производные. Производные этих оснований хорошо известны в данной области и проиллюстрированы в PCR Systems, Reagents and Consumables (Perkin Elmer Catalogue 1996-1997, Roche Molecular Systems, Inc., Branchburg, New Jersey, USA). Нуклеиновые кислоты включают, но не ограничиваются ими, антисмысловые молекулы и каталитические молекулы нуклеиновых кислот, такие как рибозимы и ДНКзимы. Также нуклеиновые кислоты включают нуклеиновые кислоты, кодирующие пептидные аналоги, фрагменты или производные, которые отличаются от встречающихся в природе форм одним или несколькими аминокислотными остатками (аналоги с делецией, содержащие менее чем все из указанных остатков; аналоги с заменой, где один или несколько остатков заменены одним или несколькими остатками; и аналоги со вставкой, где один или несколько остатков добавлены к концевой или средней части пептида), которые обладают некоторыми или всеми свойствами встречающихся в природе форм.
"Функционально связанный" означает, в отношении первой группы, связанной со второй группой, связанный таким образом, который позволяет первой группе функционировать (например, связывающие свойства), как если бы она не была связана.
Термины "полипептид", "пептид" и "белок" используют в настоящем документе взаимозаменяемо, и все они означают полимер из аминокислотных остатков. Аминокислотные остатки могут быть встречающимися в природе, или они могут представлять собой их химические аналоги. Полипептиды, пептиды и белки также могут обладать модификациями, такими как гликозилирование, присоединение липидов, сульфатация, гидроксилирование и ADP-рибозилирование.
В настоящем документе "фармацевтически приемлемый носитель" означает, что носитель совместим с другими ингредиентами состава и не является вредным для его реципиента, и охватывает любой из стандартных фармацевтически приемлемых носителей. Такие носители включают, например, 0,01-0,1 M и предпочтительно 0,05 M фосфатный буфер или 0,8% физиологический раствор. Кроме того, такие фармацевтически приемлемые носители могут представлять собой водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии и суспензии, включая физиологический раствор и буферные среды. Парентеральные носители включают раствор хлорида натрия, раствор декстрозы Рингера, раствор декстрозы и хлорида натрия, лактатный раствор Рингера и жирные масла. Внутривенные носители включают жидкости и компенсирующие растворы питательных веществ, компенсирующие растворы электролитов, такие как растворы на основе раствора декстрозы Рингера и т.п. Также могут присутствовать консерванты и другие добавки, например, такие как противомикробные средства, антиоксиданты, хелатирующие агенты, инертные газы и т.п.
"Субъект" означает любой организм, включая, но не ограничиваясь ими, млекопитающее, такое как мышь, крыса, собака, морская свинка, хорек, кролик и примат. В предпочтительном варианте осуществления субъектом является человек.
"Лечение" означает либо замедление, либо остановку, либо реверсию прогрессирования заболевания или нарушения. В настоящем документе "лечение" также означает смягчение симптомов, ассоциированных с заболеванием или нарушением. Заболевания включают, но не ограничиваются ими, ангиогенез опухоли, атеросклероз, заживление ран, дегенерацию желтого пятна, ретролентальную фиброплазию, преэклампсию, диабетическую ретинопатию, ишемию, инсульт, сердечнососудистое заболевание, псориаз, лимфедему, образование опухоли и лимфангиогенез опухоли.
Ангиогенез встречается в ходе процессов заживления ран, менструального цикла у женщин и ремоделирования эндометрия, а также в процессе эмбрионального развития и роста органов. В патологических условиях ангиогенез играет важную роль при различных заболеваниях, таких как ревматоидный артрит, псориаз, дегенерация желтого пятна, диабетическая ретинопатия и рост опухоли.
Существуют убедительные данные in vivo, включая клинические наблюдения, что аномальный ангиогенез вовлечен в ряд болезненных состояний, которые включают ревматоидный артрит, воспаление, злокачественную опухоль, псориаз, дегенеративные состояния глаз и прочие.
Другие заболевания для применения слитых белков Notch представляют собой метаболические нарушения, такие как, но не ограничиваясь ими, диабет, ожирение, преддиабетическое состояние, атеросклероз, ишемия, инсульт, сердечнососудистое заболевание, регуляция экспрессии инсулина и регуляции функции инсулина.
Применение слитых белков Notch также показано в случае метаболического синдрома, который относится к сочетанию медицинских нарушений, которые увеличивают риск у лица сердечнососудистого заболевания и диабета. Другими известными названиями этого синдрома являются синдром X, синдром устойчивости к инсулину, синдром Ривена. Некоторые признаки синдрома включают: гипергликемию натощак, высокое кровяное давление, ожирение центрального типа (также известное как висцеральное ожирение), снижение уровней липопротеинов высокой плотности (LDL), повышение уровней триглицеридов, повышение уровней мочевой кислоты. Гипергликемия натощак, указанная выше, включает сахарный диабет 2 типа или сниженный уровень глюкозы натощак и сниженную толерантность к глюкозе или устойчивость к инсулину. В дополнение к метаболическому синдрому, ловушка Notch может иметь показания для преддиабетических состояний.
Единицы, приставки и символы могут быть обозначены в их принятой форме SI. Если нет иных указаний, последовательности нуклеиновых кислот представлены слева направо в ориентации от 5' к 3', и аминокислотные последовательности представлены слева направо в ориентации от N- к С-концу. Аминокислоты могут быть обозначены в настоящем документе либо с помощью их широко известных трехбуквенных обозначений, либо с помощью их однобуквенных символов, рекомендованных комиссией по биохимической номенклатуре IUPAC-IUB. Аналогично нуклеотиды могут быть обозначены по их принятым однобуквенным кодам.
В настоящем документе используют следующие сокращения: ECD: внеклеточный домен; IC: внутриклеточный домен; NECD/Fc: слитый белок на основе Notch; N1: Notch1; N2: Notch2; N3: Notch3; N4: Notch4; Dll: Delta-like; EC: эндотелиальные клетки; FGF: фибробластный фактор роста; FGFR: рецептор фибробластного фактора роста; HUVEC: эндотелиальная клетка пупочной вены человека; m.o.i.: множественность инфекции; VMC: клетки стенки сосудов; VEGF: фактор роста клеток эндотелия сосудов; VEGFR: рецептор фактора роста эндотелия сосудов клеток; sp: сигнальный пептид; PDGF: тромбоцитарный фактор роста; PDGFR: рецептор тромбоцитарного фактора роста; P1GF: плацентарный фактор роста.
Варианты осуществления изобретения
Это изобретение относится к слитому белку, содержащему сигнальный пептид, внеклеточный домен рецепторного белка Notch человека и Fc-часть антитела, связанную с ними.
В первом варианте осуществления слитого белка рецепторный белок Notch представляет собой рецепторный белок Notch1. В одном варианте осуществления внеклеточный домен рецепторного белка Notch1 содержит EGF-подобные повторы 1-36. В другом варианте осуществления внеклеточный домен рецепторного белка Notch1 содержит EGF-подобные повторы 1-13. В другом варианте осуществления внеклеточный домен рецепторного белка Notch1 содержит EGF-подобные повторы 1-24. В другом варианте осуществления внеклеточный домен рецепторного белка Notch1 содержит EGF-подобные повторы 9-23. В другом варианте осуществления внеклеточный домен рецепторного белка Notch1 содержит EGF-подобные повторы 9-36. В другом варианте осуществления внеклеточный домен рецепторного белка Notch1 содержит EGF-подобные повторы 13-24. В следующем варианте осуществления внеклеточный домен рецепторного белка Notch1 содержит EGF-подобные повторы 25-36.
Во втором варианте осуществления слитого белка рецепторный белок Notch представляет собой рецепторный белок Notch2.
В третьем варианте осуществления слитого белка рецепторный белок Notch представляет собой рецепторный белок Notch3.
В четвертом варианте осуществления слитого белка рецепторный белок Notch представляет собой рецепторный белок Notch4. В одном варианте осуществления внеклеточный домен рецепторного белка Notch4 содержит EGF-подобные повторы 1-29. В другом варианте осуществления внеклеточный домен рецепторного белка Notch4 содержит EGF-подобные повторы 1-13. В другом варианте осуществления внеклеточный домен рецепторного белка Notch4 содержит EGF-подобные повторы 1-23. В другом варианте осуществления внеклеточный домен рецепторного белка Notch4 содержит EGF-подобные повторы 9-23. В другом варианте осуществления внеклеточный домен рецепторного белка Notch4 содержит EGF-подобные повторы 9-29. В другом варианте осуществления внеклеточный домен рецепторного белка Notch4 содержит EGF-подобные повторы 13-23. В следующем варианте осуществления внеклеточный домен рецепторного белка Notch4 содержит EGF-подобные повторы 21-29.
В одном варианте осуществления слитого белка Fc-часть антитела представляет собой Fc-часть антитела человека.
В одном варианте осуществления слитого белка сигнальный пептид представляет собой сигнальный пептид Notch1, Notch2, Notch3, Notch4 или Hc-часть (HC; тяжелая цепь) антитела.
В одном варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:54. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:55. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:56. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:57. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:58. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:59. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:60. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:61. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:62. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:63. В следующем варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:64.
В одном варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:65. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:66. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:67. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:68. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:69. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:70. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:71. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:72. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:73. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:74. В следующем варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:75.
В одном варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:78. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:79. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:80. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:81. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:82. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:83. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:84. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:85. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:86. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:87. В другом варианте осуществления слитый белок содержит последовательно расположенные аминокислоты, последовательность которых указана в SEQ ID NO:88.
В одном варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:89. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:90. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:91. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:92. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:93. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:94. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:95. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:96. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:97. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:98. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:99. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:100. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:101. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:102. В другом варианте осуществления слитый белок кодируется последовательно расположенными нуклеотидами, последовательность которых указана в SEQ ID NO:103.
Это изобретение относится к способу лечения субъекта, имеющего опухоль, включающему введение субъекту количества указанного выше слитого белка, эффективного для лечения субъекта, тем самым осуществляя лечение субъекта, имеющего опухоль.
Это изобретение относится к способу ингибирования ангиогенеза у субъекта, включающему введение субъекту количества указанного выше слитого белка, эффективного для ингибирования ангиогенеза у субъекта, тем самым ингибируя ангиогенез у субъекта.
Данное изобретение относится к способу лечения субъекта, имеющего рак яичника, включающему введение субъекту количества указанного выше слитого белка, эффективного для лечения субъекта, тем самым осуществляя лечение субъекта, имеющего рак яичника.
Это изобретение относится к способу лечения субъекта, имеющего метаболическое нарушение, включающему введение субъекту количества указанного выше слитого белка, эффективного для лечения субъекта, тем самым осуществляя лечение субъекта, имеющего метаболическое нарушение. В одном варианте осуществления метаболическое нарушение представляет собой диабет, ожирение, атеросклероз, ишемию, инсульт или сердечнососудистое заболевание.
Данное изобретение относится к применению указанного выше слитого белка для получения фармацевтической композиции для лечения субъекта, имеющего опухоль.
Это изобретение относится к применению указанного выше слитого белка для получения фармацевтической композиции для ингибирования ангиогенеза у субъекта.
Это изобретение относится к применению указанного выше слитого белка для получения фармацевтической композиции для лечения субъекта, имеющего рак яичника.
Это изобретение относится к применению указанного выше слитого белка для получения фармацевтической композиции для лечения субъекта, имеющего метаболическое нарушение. В одном варианте осуществления метаболическое нарушение представляет собой диабет, ожирение, атеросклероз, ишемию, инсульт или сердечнососудистое заболевание.
Это изобретение относится к способу ингибирования физиологического лимфангиогенеза или патологического лимфангиогенеза у субъекта, включающему введение субъекту количества указанного выше слитого белка, эффективного для ингибирования физиологического лимфангиогенеза или патологического лимфангиогенеза у субъекта. В одном варианте осуществления патологический лимфангиогенез представляет собой лимфангиогенез опухоли или метастазирование в лимфатические узлы, которое может зависеть от лимфангиогенеза опухоли.
Это изобретение относится к способу ингибирования метастазирования опухоли у субъекта, включающему введение субъекту количества указанной выше слитой молекулы, эффективного для ингибирования метастазирования опухоли у субъекта. В одном варианте осуществления, метастазирование происходит через кровеносный сосуд, лимфатический сосуд или лимфатический узел. Метастазирование опухоли представляет собой распространение злокачественной опухоли от одного органа в другой не являющийся соседним органом.
Данное изобретение относится к способу ингибирования роста вторичной опухоли у субъекта, включающему введение субъекту количества указанного выше слитого белка, эффективного для ингибирования роста вторичной опухоли у субъекта. Ингибирование также может представлять собой ингибирование ангиогенеза опухоли, ассоциированного с вторичной или метастазирующей опухолью. В одном варианте осуществления вторичный рост опухоли ингибируется посредством ингибирования ангиогенеза, ассоциированного с вторичной опухолью.
Это изобретение относится к способу ингибирования кооптации кровеносных сосудов опухолью у субъекта, включающему введение субъекту количества указанного выше слитого белка, эффективного для ингибирования кооптации кровеносных сосудов опухолью у субъекта. Процесс кооптации сосудов представляет собой процесс, при котором опухолевые клетки ассоциируют с имеющимися сосудами и растут при помощи кооптированных сосудов. Этот рост опухолей на кооптированных сосудах может происходить в отсутствии ангиогенеза опухоли, он может предшествовать ангиогенезу опухоли, или он может происходить вместе с ним.
Настоящее изобретение относится к способу лечения злокачественной опухоли у субъекта, включающему введение субъекту указанного выше слитого белка и ингибитора фактора роста эндотелия сосудов (VEGF), каждого из них в количестве, эффективном для лечения злокачественной опухоли у субъекта. В одном варианте осуществления ингибитор VEGF представляет собой ингибитор VEGF-A, ингибитор P1GF, ингибитор VEGF-B, ингибитор VEGF-C или ингибитор VEGF-D. Примеры ингибиторов VEGF включают, но не ограничиваются ими, бевацизумаб, PTK787, Bay43-9006, SU11248, AG013676, ZD6474, ловушку VEGF и антитело против VEGFR2. Примеры таких ингибиторы более полно описаны в Ferrara et al., (2004) Nature Reviews Drug Discovery, Vol. 3:391-400 и Ellis et al. (2008) Nature Reviews Cancer Vol. 8:579-591, содержание каждого из которых включено в настоящий документ в качестве ссылок.
Это изобретение относится к способу лечения злокачественной опухоли у субъекта, включающему введение субъекту указанного выше слитого белка и ингибитора VEGFR-1, VEGFR-2 или VEGFR-3, каждого из них в количестве, эффективном для лечения злокачественной опухоли у субъекта. В одном варианте осуществления ингибитор нацелен на один или несколько из VEGFR.
Это изобретение относится к способу лечения злокачественной опухоли у субъекта, включающему введение субъекту указанного выше слитого белка и ингибитора тромбоцитарного фактора роста (PDGF), каждого из них в количестве, эффективном для лечения злокачественной опухоли у субъекта. В одном варианте осуществления ингибитор тромбоцитарного фактора роста представляет собой ингибитор PDGF-A или ингибитор PDGF-B.
Настоящее изобретение относится к способу лечения злокачественной опухоли у субъекта, включающему введение субъекту указанного выше слитого белка и антагониста рецептора PDGF, каждого из них в количестве, эффективном для лечения злокачественной опухоли у субъекта. В одном варианте осуществления антагонист рецептора PDGF представляет собой антагонист рецептора-B PDGF.
Данное изобретение относится к способу лечения злокачественной опухоли у субъекта, включающему введение субъекту указанного выше слитого белка и ингибитора HER2/neu, каждого из них в количестве, эффективном для лечения злокачественной опухоли у субъекта.
Это изобретение относится к способу лечения сосудисто-пролиферативной ретинопатии, включающему введение субъекту указанного выше слитого белка в количестве, эффективном для лечения сосудисто-пролиферативной ретинопатии.
101. Способ по п.100, где сосудисто-пролиферативная ретинопатия представляет собой диабетическую ретинопатию, дегенерацию желтого пятна или ретролентальную фиброплазию.
Настоящее изобретение также относится к первому способу лечения субъекта, имеющего опухоль, включающему введение субъекту эффективного количества композиции, содержащей внеклеточный домен рецепторного белка Notch, функционально связанный с группой, увеличивающей время полужизни, чтобы тем самым лечить субъекта.
Это изобретение также относится ко второму способу ингибирования ангиогенеза у субъекта, включающему введение субъекту эффективного количества композиции, содержащей внеклеточный домен рецепторного белка Notch, функционально связанный с группой, увеличивающей время полужизни, чтобы тем самым ингибировать ангиогенез у субъекта.
В первом варианте осуществления указанных выше способов рецепторный белок Notch представляет собой рецепторный белок Notch1. В одном варианте осуществления рецепторный белок Notch1 представляет собой рецепторный белок Notch1 человека. В другом варианте осуществления группа, увеличивающая время полужизни, представляет собой Fc-часть антитела. В другом варианте осуществления Fc-часть антитела представляет собой Fc-часть антитела человека. В следующем варианте осуществления внеклеточный домен и группа, увеличивающая время полужизни, находятся в одной полипептидной цепи.
Во втором варианте осуществления указанных выше способов рецепторный белок Notch представляет собой рецепторный белок Notch2. В одном варианте осуществления рецепторный белок Notch2 представляет собой рецепторный белок Notch2 человека. В другом варианте осуществления группа, увеличивающая время полужизни, представляет собой Fc-часть антитела. В другом варианте осуществления Fc-часть антитела представляет собой Fc-часть антитела человека. В следующем варианте осуществления внеклеточный домен и группа, увеличивающая время полужизни, находятся в одной полипептидной цепи.
В третьем варианте осуществления указанных выше способов рецепторный белок Notch представляет собой рецепторный белок Notch3. В одном варианте осуществления рецепторный белок Notch3 представляет собой рецепторный белок Notch3 человека. В другом варианте осуществления группа, увеличивающая время полужизни, представляет собой Fc-часть антитела. В другом варианте осуществления Fc-часть антитела представляет собой Fc-часть антитела человека. В следующем варианте осуществления внеклеточный домен и группа, увеличивающая время полужизни, находятся в одной полипептидной цепи.
В четвертом варианте осуществления указанных выше способов рецепторный белок Notch представляет собой рецепторный белок Notch4. В одном варианте осуществления рецепторный белок Notch4 представляет собой рецепторный белок Notch4 человека. В другом варианте осуществления группа, увеличивающая время полужизни, представляет собой Fc-часть антитела. В другом варианте осуществления Fc-часть антитела представляет собой Fc-часть антитела человека. В следующем варианте осуществления внеклеточный домен и группа, увеличивающая время полужизни, находятся в одной полипептидной цепи.
В пятом варианте осуществления указанных выше способов субъектом является млекопитающее. В одном варианте осуществления млекопитающим является человек.
В шестом варианте осуществления указанных выше способов ангиогенез представляет собой ангиогенез опухоли.
В следующем варианте осуществления второго способа субъект имеет опухоль. В другом варианте осуществления субъект страдает патологической сосудистой гиперплазией. В одном варианте осуществления патологическая сосудистая гиперплазия представляет собой доброкачественную гемангиому. В следующем варианте осуществления субъект страдает лимфатическим сосудисто-пролиферативным заболеванием.
Настоящее изобретение относится к первой композиции, содержащей внеклеточный домен рецепторного белка Notch4, функционально связанный с группой, увеличивающей время полужизни. В одном варианте осуществления внеклеточный домен ковалентно связан с группой, увеличивающей время полужизни. В другом варианте осуществления внеклеточный домен и группа, увеличивающая время полужизни, находятся в одной полипептидной цепи.
Это изобретение также относится ко второй композиции, содержащей внеклеточный домен рецепторного белка Notch4, функционально связанный с группой, увеличивающей время полужизни, и фармацевтически приемлемый носитель.
Кроме того, данное изобретение относится к изделию, содержащему (i) упаковочный материал, имеющий в нем композицию, содержащую внеклеточный домен рецепторного белка Notch, функционально связанный с группой, увеличивающей время полужизни, и (ii) ярлык, на котором указано, что композиция предназначена для применения для лечения субъекта, имеющего опухоль или другое нарушение, поддающееся лечению ингибированием ангиогенеза у субъекта.
В первом варианте осуществления указанного выше изделия рецепторный белок Notch представляет собой рецепторный белок Notch1. В одном варианте осуществления рецепторный белок Notch1 представляет собой рецепторный белок Notch1 человека. В другом варианте осуществления группа, увеличивающая время полужизни, представляет собой Fc-часть антитела. В другом варианте осуществления Fc-часть антитела представляет собой Fc-часть антитела человека. В следующем варианте осуществления внеклеточный домен и группа, увеличивающая время полужизни, находятся в одной полипептидной цепи.
Во втором варианте осуществления указанного выше изделия рецепторный белок Notch представляет собой рецепторный белок Notch2. В одном варианте осуществления рецепторный белок Notch2 рецепторный белок Notch2 человека. В другом варианте осуществления группа, увеличивающая время полужизни, представляет собой Fc-часть антитела. В другом варианте осуществления Fc-часть антитела представляет собой Fc-часть антитела человека. В следующем варианте осуществления внеклеточный домен и группа, увеличивающая время полужизни, находятся в одной полипептидной цепи.
В третьем варианте осуществления указанного выше изделия рецепторный белок Notch представляет собой рецепторный белок Notch3. В одном варианте осуществления рецепторный белок Notch3 представляет собой рецепторный белок Notch3 человека. В другом варианте осуществления группа, увеличивающая время полужизни, представляет собой Fc-часть антитела. В другом варианте осуществления Fc-часть антитела представляет собой Fc-часть антитела человека. В следующем варианте осуществления внеклеточный домен и группа, увеличивающая время полужизни, находятся в одной полипептидной цепи.
В четвертом варианте осуществления указанного выше изделия рецепторный белок Notch представляет собой рецепторный белок Notch4. В одном варианте осуществления рецепторный белок Notch4 представляет собой рецепторный белок Notch4 человека. В другом варианте осуществления группа, увеличивающая время полужизни, представляет собой Fc-часть антитела. В другом варианте осуществления Fc-часть антитела представляет собой Fc-часть антитела человека. В следующем варианте осуществления внеклеточный домен и группа, увеличивающая время полужизни, находятся в одной полипептидной цепи.
В другом варианте осуществления указанного выше изделия композиция смешана с фармацевтическим носителем. В конечном варианте осуществления субъектом является человек.
Настоящее изобретение относится к реплицируемому вектору, который кодирует полипептид, содержащий внеклеточный домен рецепторного белка Notch4, функционально связанный с группой, увеличивающей время полужизни. В одном варианте осуществления группа, увеличивающая время полужизни, представляет собой Fc-часть антитела. В другом варианте осуществления вектор включает, но не ограничивается ими, плазмиду, космиду, ретровирус, аденовирус, фаг лямбда или YAC.
Данное изобретение также относится к системе вектор-хозяин, которая содержит реплицируемый вектор, который кодирует полипептид, содержащий внеклеточный домен рецепторного белка Notch, функционально связанный с группой, увеличивающей время полужизни, и пригодную клетку-хозяина. В одном варианте осуществления клетка-хозяин представляет собой эукариотическую клетку. В другом варианте осуществления эукариотическая клетка представляет собой клетку CHO. В другом варианте осуществления эукариотическая клетка представляет собой клетку HeLa. В следующем варианте осуществления клетка-хозяин представляет собой бактериальную клетку.
В заключение, это изобретение относится к третьему способу получения полипептида, который включает выращивание системы вектор-хозяин, которая содержит реплицируемый вектор, который кодирует полипептид, содержащий внеклеточный домен рецепторного белка Notch, функционально связанный с группой, увеличивающей время полужизни, и пригодную клетку-хозяина, в условиях, позволяющих продукцию полипептида, и выделение полипептида, продуцированного таким образом.
Настоящее изобретение иллюстрируется экспериментальными деталями, которые представлены ниже. Этот раздел указан для облегчения понимания изобретения, но он не предназначен, и не должен быть истолкован, для ограничения изобретения никоим образом, как указано в формуле изобретения, которая представлена ниже.
ЭКСПЕРИМЕНТАЛЬНЫЕ ДЕТАЛИ
Первая серия экспериментов
Слитые белки Notch1 человека (ловушки Notch)
Ловушки Notch1 собирают с использованием последовательностей, кодирующих сигнальный пептид, часть внеклеточного домена Notch1, охватывающую все или подгруппу доменов EGF-подобных повторов, и часть Fc-белка человека (аминокислоты 1-237). Полная полноразмерная последовательность Notch1 человека представлена на фигуре 59.
Используемые сигнальные пептиды представляют собой либо нативный сигнальный пептид Notch1, либо сигнальный пептид Hc человека, каждый из которых является слитым с участком Notch1. Сигнальный пептид обеспечивает секрецию белков ловушек Notch.
Используемые внеклеточные домены Notch1 сконструированы для связывания лигандов Notch и состоят из всех или подгруппы из 36 доменов EGF-подобных повторов белка Notch1 человека.
С C-концом данного EGF-подобного повтора Notch1 человека слита Fc-метка, и она служит для обеспечения очистки, детекции и стабилизации белков ловушек Notch1.
Общая конструкция ловушек Notch1 человека, одиннадцать составов, является такой, чтобы она кодировала; (1) сигнальный пептид, обеспечивающий секрецию белков ловушек Notch1 во внеклеточную среду эукариотических клеток, которые используют для продукции белков, (2) часть внеклеточного домена всех или части EGF-подобных повторов Notch1 человека для обеспечения связывания с лигандами Notch, и (3) часть Fc-белка человека, обеспечивающую детекцию.
Описаны следующие одиннадцать составов ловушек Notch1 человека, и они схематично представлены на фигуре 52.
1) ловушка h-Notch1(1-36) (N1-1 фигуры 52)
2) ловушка h-Notch1(1-13) (N1-2 фигуры 52)
3) ловушка h-Notch1(1-24) (N1-3 фигуры 52)
4) ловушка h-spNNotch1(9-23) (N1-4 фигуры 52)
5) ловушка h-spHCNotch1(9-23) (N1-5 фигуры 52)
6) ловушка h-spNNotch1(9-36) (N1-6 фигуры 52)
7) ловушка h-spHCNotch1(9-36) (N1-7 фигуры 52)
8) ловушка h-spNNotch1(13-24) (N1-8 фигуры 52)
9) ловушка h-spHCNotch1(13-24) (N1-9 фигуры 52)
10) ловушка h-spNNotch1(25-36) (N1-10 фигуры 52)
11) ловушка h-spHCNotch1(25-36) (N1-11 фигуры 52)
Последовательность Notch1 человека
Полноразмерная аминокислотная (а.к.) последовательность Notch1 человека, состоящая из остатков с а.к. 1 (M = метионин) по а.к. 2555 (K = лизин), указана на фигуре 59. Сигнальный пептид и первые 36 доменов EGF-подобных повторов находятся в а.к. 1-1433 этой последовательности. Аминокислоты 1-1433, или подгруппу этих а.к., использовали для конструирования белков ловушек Notch1, описанных в последующих разделах. Аминокислоты, охватывающие EGF-повторы 1-36, подчеркнуты.
Последовательность Fc человека, используемая для создания Fc-метки на белках ловушек Notch1
237 аминокислот Fc человека, представленных на фигуре 60, подвергали слиянию с C-концом всех конструкций ловушек Notch1, непосредственно ниже EGF-подобных повторов Notch1. Этот участок Fc человека позволяет детекцию и очистку ловушек Notch и служит для стабилизации секретируемых слитых белков Notch1 человека-Fc человека.
Сигнальные пептиды, используемые в белках ловушек Notch1
В конструкцию белков ловушек Notch1 человека включали две отличающихся последовательности сигнального пептида. Первым является сигнальный пептид Notch1 человека, который, как предсказано, охватывает аминокислоты 1-20 Notch1 человека. Это определение проводили с использованием программы Signal IP 3.0 Server, предоставляемой Technical University of Denmark. Вторым является сигнальный пептид Hc человека, который, как предсказано, охватывает аминокислоты 1-22 сигнального пептида тяжелой цепи (HC) IgG человека.
1. Сигнальный пептид Notch1 человека (а.к. 1-20)
MPPLLAPLLCLALLPALA/A/R (SEQ ID NO:16)
Аминокислотная последовательность предсказанного сигнального пептида Notch1 человека схематично представлена на фигуре 53. Результаты предсказания в анализе с использованием Signal IP 3.0 Server предоставленного он-лайн Technical University of Denmark, представлены на фигуре 53. Эти результаты предсказывают главный участок расщепления, расположенный между аланином 18 (A18) и аланином 19 (A19), и минорный участок расщепления между A19 и аргинином 20 (R20). Эти два участка расщепления указаны посредством "/" в аминокислотной последовательности 1-20 Notch1 человека, представленной выше.
2. Сигнальный пептид Notch1 человека для слияния (а.к. 1-23), используемый в ловушках Notch1, в которых используется эта сигнальная последовательность.
Для того чтобы убедиться, что сигнальный пептид Notch1 используется эффективно, в ловушках Notch1 человека используются три дополнительных аминокислоты после предсказанного основного участка расщепления. Таким образом, аминокислотная последовательность, используемая в составе ловушки Notch1 человека, которая включает сигнальный пептид Notch1, содержит глицин-пролин-аргинин (GPR - полужирный шрифт/подчеркнут) между участками расщепления предсказанного сигнального пептида и EGF-подобными повторами Notch1, как показано ниже.
MPPLLAPLLCLALLPALAARGPR (SEQ ID NO:130)
3. Сигнальный пептид HC человека (а.к. 1-22)
Аминокислотная последовательность предсказанного сигнального пептида Hc человека представляет собой
MWGWKCLLFWAVLVTATLCTA/R (SEQ ID NO:18)
Результаты предсказания в анализе с использованием Signal IP 3.0 Server, предоставленного он-лайн Technical University of Denmark, указаны выше. Эти результаты предсказывают главный участок расщепления, расположенный между аланином 21 (A21) и аргинином 22 (22). Этот участок расщепления указан посредством "/" в аминокислотной последовательности 1-22 Hc человека, представленной выше.
Ловушка h-Notch1 (1-36)
Ловушка h-Notch1(1-36) обозначает ловушку Notch1 человека, которая охватывает EGF-подобные повторы 1-36 Notch1 (N1-1 фигуры 52).
Белок ловушки h-Notch1(1-36), который представлен на фигуре 61, состоит из следующих трех компонентов: (1) сигнальная последовательность Notch1 человека, состоящая из аминокислот 1-23 Notch1 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 1-36 Notch1 человека, состоящие из аминокислот 24-1433, а затем (3) аминокислоты 1434-1670, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1670 аминокислот.
Ловушка h-Notch1 (1-13)
Ловушка h-Notch1(l-13) обозначает ловушку Notch1 человека, которая охватывает EGF-подобные повторы 1-13 Notch1 (N1-2 фигуры 52).
Белок ловушки h-Notch1(1-13), который представлен на фигуре 62, состоит из следующих трех компонентов: (1) сигнальная последовательность Notch1 человека, состоящая из аминокислот 1-23 Notch1 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 1-13 Notch1 человека, состоящие из аминокислот 24-531, а затем (3) аминокислоты 532-768, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 768 аминокислот.
Ловушка h-Notch1 (1-24)
Ловушка h-Notch1(1-24) обозначает ловушку Notch1 человека, которая охватывает EGF-подобные повторы 1-24 Notch1 (N1-3 фигуры 52).
Белок ловушки h-Notch1(1-24), который представлен на фигуре 63, состоит из следующих трех компонентов: (1) сигнальная последовательность Notch1 человека, состоящая из аминокислот 1-23 Notch1 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 1-24 Notch1 человека, состоящие из аминокислот 24-948, а затем (3) аминокислоты 949-1185, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1185 аминокислот.
Ловушка h-sp N Notch1 (9-23)
Ловушка h-spNNotch1(9-23) обозначает ловушку Notch1 человека, которая охватывает EGF-подобные повторы 9-23 Notch1 (N1-4 фигуры 52). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch1 человека.
Белок ловушки h-spNNotch1(9-23), который представлен на фигуре 64, состоит из следующих трех компонентов: (1) сигнальная последовательность Notch1 человека, состоящая из аминокислот 1-23 Notch1 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-23 Notch1 человека, состоящие из аминокислот 24-593, а затем (3) аминокислоты 594-830, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 830 аминокислот.
Ловушка h-sp HC Notch1 (9-23)
Ловушка h-spHCNotch1(9-23) обозначает ловушку Notch1 человека, которая охватывает EGF-подобные повторы 9-23 Notch1 (N1-5 фигуры 52). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека.
Белок ловушки h-spHCNotch1(9-23), который представлен на фигуре 65, состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 Hc человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-23 Notch1 человека, состоящие из аминокислот 23-592, а затем (3) аминокислоты 593-829, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 829 аминокислоты.
Ловушка h-sp N Notch1 (9-36)
Ловушка h-spNNotch1(9-36) обозначает ловушку Notch1 человека, которая охватывает EGF-подобные повторы 9-36 Notch1 (N1-6 фигуры 52). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch1 человека.
Белок ловушки h-spNNotch1(9-36), который представлен на фигуре 66, состоит из следующих трех компонентов: (1) сигнальная последовательность Notch1 человека, состоящая из аминокислот 1-23 Notch1 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-36 Notch1 человека, состоящие из аминокислот 24-1118, а затем (3) аминокислоты 1119-1355, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1355 аминокислот.
Ловушка h-sp HC Notch1 (9-36)
Ловушка h-spHCNotch1(9-36) обозначает ловушку Notch1 человека, которая охватывает EGF-подобные повторы 9-36 Notch1 (N1-7 фигуры 52). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека.
Белок ловушки h-spHCNotch1(9-36), который представлен на фигуре 67, состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 Hc человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-36 Notch1 человека, состоящие из аминокислот 23-1117, а затем (3) аминокислоты 1118-1354, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1354 аминокислоты.
Ловушка h-sp N Notch1 (13-24)
Ловушка h-spNNotch1(13-24) обозначает ловушку Notch1 человека, которая охватывает EGF-подобные повторы 13-24 Notch1 (N1-8 фигуры 52). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch1 человека.
Белок ловушки h-spNNotch1(13-24), который представлен на фигуре 68, состоит из следующих трех компонентов: (1) сигнальная последовательность Notch1 человека, состоящая из аминокислот 1-23 Notch1 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 13-24 Notch1 человека, состоящие из аминокислот 24-478, а затем (3) аминокислоты 479-715, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 715 аминокислот.
Ловушка h-sp HC Notch1 (13-24)
Ловушка h-spHCNotch1(13-24) обозначает ловушку Notch1 человека, которая охватывает EGF-подобные повторы 13-24 Notch1 (N1-9 фигуры 52). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека.
Белок ловушки h-spHCNotch1(13-24), который представлен на фигуре 69, состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 Hc человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 13-24 Notch1 человека, состоящие из аминокислот 23-477, а затем (3) аминокислоты 478-714, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 714 аминокислот.
Ловушка h-sp N Notch1 (25-36)
Ловушка h-spNNotch1(25-36) обозначает ловушку Notch1 человека, которая охватывает EGF-подобные повторы 25-36 Notch1 (N1-10 фигуры 52). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch1 человека.
Белок ловушки h-spNNotch1(25-36), который представлен на фигуре 70, состоит из следующих трех компонентов: (1) сигнальная последовательность Notch1 человека, состоящая из аминокислот 1-23 Notch1 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 25-36 Notch1 человека, состоящие из аминокислот 24-508, а затем (3) аминокислоты 509-745, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 745 аминокислот.
Ловушка h-sp HC Notch1 (25-36)
Ловушка h-spHCNotch1(25-36) обозначает ловушку Notch1 человека, которая охватывает EGF-подобные повторы 25-36 Notch1 (N1-11 фигуры 52). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека.
Белок ловушки h-spHCNotch1(25-36), который представлен на фигуре 71, состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 Hc человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 25-36 Notch1 человека, состоящие из аминокислот 23-507, а затем (3) аминокислоты 508-744, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 744 аминокислоты.
Способы
Конструирование ловушек Notch1 человека
Для получения вариантов ловушек Notch1 человека использовали тотальную РНК эндотелиальных клеток пупочной вены человека (HUVEC). Тотальную РНК подвергали обратной транскрипции с помощью обратной транскриптазы M-MLV и либо случайных гексамерных праймеров, либо специфичного праймера Notch1. Затем синтезированную кДНК амплифицировали с помощью специфичных к ловушке Notch1 вышележащего (смыслового) и нижележащего (антисмыслового) праймеров.
Нижележащие праймеры кодируют участки рестрикции либо BamHI, либо BglII на 5'-конце, которые лигируются с участком BglII в Fc-последовательности с образованием химеры Notch1/Fc человека в рамке считывания.
В случае ловушек Notch1, которые образуют слитую молекулу после нуклеотидной последовательности, кодирующей EGF-подобный повтор 36, создается участок BglII для образования участка слияния, и эта слитая последовательность предоставлена (Notch1, фигура 4). Это применимо к составам: ловушка h-Notch1(1-36), ловушка h-spNNotch1(9-36), ловушка h-spHCNotch1(9-36), ловушка h-spNNotch1(25-36), ловушка h-spHCNotch1(25-36).
В случае ловушек Notch1, которые образуют слитую молекулу после нуклеотидной последовательности, кодирующей EGF-подобный повтор 13, создается участок BamHI для образования участка слияния, и эта слитая последовательность предоставлена (Notch1, фигура 5). Это применимо к составу ловушки h-Notch1(1-13).
В случае ловушек Notch1, которые образуют слитую молекулу после нуклеотидной последовательности, кодирующей EGF-подобный повтор 23, создается участок BglII для образования участка слияния, и эта слитая последовательность предоставлена (Notch1, фигура 6). Это применимо к составам ловушки h-spNNotch1(9-23), ловушки h-spHCNotch1(9-23).
В случае ловушек Notch1, которые образуют слитую молекулу после нуклеотидной последовательности, кодирующей EGF-подобный повтор 24, создается участок BglII для образования участка слияния, и эта слитая последовательность предоставлена (Notch1, фигура 7). Это применимо к составам ловушки h-Notch1(1-24), ловушки h-spNNotch1(13-24), ловушки h-spHCNotch1(13-24).
Амплифицированный продукт PCR субклонируют в pBluescript SK II Fc для получения различных химер Notch1/Fc человека. Затем последовательности ловушек Notch1/Fc человека встраивают в экспрессирующие векторы млекопитающих (pAd-lox, pCCL, pcDNA3) для экспрессии и очистки белков ловушек Notch1 человека.
Слитые белки Notch4 человека (ловушки Notch)
Ловушки Notch4 собирают с использованием последовательностей, кодирующих сигнальный пептид, часть внеклеточного домена Notch4, охватывающую все или подгруппу доменов EGF-подобных повторов, и часть Fc-белка человека (аминокислоты 1-237). Полная полноразмерная последовательность Notch4 человека представлена на фигуре 83.
Используемые сигнальные пептиды представляют собой либо нативный сигнальный пептид Notch4, либо сигнальный пептид Hc человека, каждый из которых является слитым с участком Notch4. Сигнальный пептид обеспечивает секрецию белков ловушек Notch.
Используемые внеклеточные домены Notch4 сконструированы, чтобы они связывали лиганды Notch, и они состоят из всех или подгруппы из 29 доменов EGF-подобных повторов белка Notch4 человека.
Fc-метка является слитой с C-концом данного EGF-подобного повтора Notch4 человека и служит для обеспечения очистки, детекции и стабилизации белков ловушек Notch4.
Общая конструкция ловушек Notch4 человека, одиннадцать составов, является такой, чтобы она кодировала; (1) сигнальный пептид, обеспечивающий секрецию белков ловушек Notch4 во внеклеточную среду эукариотических клеток, которые используют для продукции белков, (2) часть внеклеточного домена всех или части EGF-подобных повторов Notch4 человека для обеспечения связывания с лигандами Notch, и (3) часть Fc-белка человека, обеспечивающую детекцию.
Описаны следующие одиннадцать составов ловушек Notch4 человека, и они схематично представлены на фигуре 111.
1) ловушка h-Notch4(1-29) (N4-1 фигуры 111)
2) ловушка h-Notch4(1-13) (N4-2 фигуры 111)
3) ловушка h-Notch4(1-23) (N4-3 фигуры 111)
4) ловушка h-spNNotch4(9-23) (N4-4 фигуры 111)
5) ловушка h-spHCNotch4(9-23) (N4-5 фигуры 111)
6) ловушка h-spNNotch4(9-29) (N4-6 фигуры 111)
7) ловушка h-spHCNotch4(9-29) (N4-7 фигуры 111)
8) ловушка h-spNNotch4(13-23) (N4-8 фигуры 111)
9) ловушка h-spHCNotch4(13-23) (N4-9 фигуры 111)
10) ловушка h-spNNotch4(21-29) (N4-10 фигуры 111)
11) ловушка h-spHCNotch4(21-29) (N4-11 фигуры 111)
Последовательность Notch4 человека
Полноразмерная аминокислотная (а.к.) последовательность Notch4 человека, состоящая из остатков с а.к. 1 (M = метионин) по а.к. 2003 (K = лизин), указана на фигуре 83. Сигнальный пептид и первые 29 доменов EGF-подобных повторов находятся в а.к. 1-1174 этой последовательности. Аминокислоты 1-1174, или подгруппу этих а.к., использовали для конструирования белков ловушек Notch4, описанных в последующих разделах. Аминокислоты, охватывающие EGF-повторы 1-29, подчеркнуты.
Последовательность Fc человека, используемая для создания Fc-метки на белках ловушек Notch1
237 аминокислот Fc человека, представленных на фигуре 84, подвергали слиянию с C-концом всех конструкций ловушек Notch4 непосредственно ниже EGF-подобных повторов Notch1. Этот участок Fc человека позволяет детекцию и очистку ловушек Notch и служит для стабилизации секретируемых слитых белков Notch4 человека-Fc человека.
Сигнальные пептиды, используемые в белках ловушек Notch4
В конструкцию белков ловушек Notch4 человека включали две отличающихся последовательности сигнального пептида. Первым является сигнальный пептид Notch4 человека, который, как предсказано, охватывает аминокислоты 1-24 Notch4 человека. Это определение проводили с использованием программы Signal IP 3.0 Server, предоставляемой Technical University of Denmark. Вторым является сигнальный пептид Hc человека, который, как предсказано, охватывает аминокислоты 1-22 сигнального пептида Hc человека.
1. Сигнальный пептид Notch4 человека (а.к. 1-24)
MQPPSLLLLLLLLLLLCVSVVRP/R (SEQ ID NO:104)
Аминокислотная последовательность предсказанного сигнального пептида Notch4 человека схематично представлена на фигуре 112. Результаты предсказания в анализе с использованием Signal IP 3.0 Server, предоставленного он-лайн Technical University of Denmark, представлены на фигуре 112. Эти результаты предсказывают участок расщепления, расположенный между пролином 23 (A23) и аргинином 24 (R24). Участок расщепления указан посредством "/" в аминокислотной последовательности 1-24 Notch4 человека, представленной выше.
2. Сигнальный пептид Notch4 человека для слияния (а.к. 1-27), используемый в ловушках Notch4, в которых используется эта сигнальная последовательность.
Для того чтобы убедиться, что сигнальный пептид Notch4 используется эффективно, в ловушках Notch4 человека используются три дополнительных аминокислоты после предсказанного основного участка расщепления. Таким образом, аминокислотная последовательность, используемая в составе ловушки Notch4 человека, которая включает сигнальный пептид Notch4, содержит глицин-пролин-аргинин (GPR - полужирный шрифт/подчеркнут) между участками расщепления предсказанного сигнального пептида и EGF-подобными повторами Notch4, как показано ниже.
MQPPSLLLLLLLLLLLCVSVVRPR GLL (SEQ ID NO:131)
3. Сигнальный пептид HC человека (а.к. 1-22)
Аминокислотная последовательность предсказанного сигнального пептида Hc человека представляет собой
MWGWKCLLFWAVLVTATLCTA/R (SEQ ID NO:17)
Результаты предсказания в анализе с использованием Signal IP 3.0 Server, предоставленного он-лайн Technical University of Denmark, указаны выше. Эти результаты предсказывают главный участок расщепления, расположенный между аланином 21 (A21) и аргинином 22 (22). Этот участок расщепления указан посредством "/" в аминокислотной последовательности 1-22 Hc человека, предоставленной выше.
Ловушка h-Notch4 (1-29)
Ловушка h-Notch4(1-29) обозначает ловушку Notch4 человека, которая охватывает EGF-подобные повторы 1-29 Notch4 (N4-1 фигуры 111).
Белок ловушки h-Notch4(1-29) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch4 человека, состоящая из аминокислот 1-27 Notch4 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 1-29 Notch4 человека, состоящие из аминокислот 28-1173, а затем (3) аминокислоты 1174-1410, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1410 аминокислот.
Ловушка h-Notch4 (1-13)
Ловушка h-Notch4(1-13) обозначает ловушку Notch4 человека, которая охватывает EGF-подобные повторы 1-13 Notch4 (N4-2 фигуры 111).
Белок ловушки h-Notch4(1-13) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch4 человека, состоящая из аминокислот 1-27 Notch4 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 1-13 Notch4 человека, состоящие из аминокислот 28-554, а затем (3) аминокислоты 555-791, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 791 аминокислоту.
Ловушка h-Notch4 (1-23)
Ловушка h-Notch4(1-23) обозначает ловушку Notch4 человека, которая охватывает EGF-подобные повторы 1-23 Notch4 (N4-3 фигуры 111).
Белок ловушки h-Notch4(1-23) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch4 человека, состоящая из аминокислот 1-27 Notch4 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 1-23 Notch4 человека, состоящие из аминокислот 28-933, а затем (3) аминокислоты 934-1170, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1170 аминокислот.
Ловушка h-sp N Notch4 (9-23)
Ловушка h-spNNotch4(9-23) обозначает ловушку Notch4 человека, которая охватывает EGF-подобные повторы 9-23 Notch4 (N4-4 фигуры 111). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch4.
Белок ловушки h-spNNotch4(9-23) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch4 человека, состоящая из аминокислот 1-27 Notch4 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-23 Notch4 человека, состоящие из аминокислот 28-602, а затем (3) аминокислоты 603-839, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 839 аминокислот.
Ловушка h-sp HC Notch4 (9-23)
Ловушка h-spHCNotch4(9-23) обозначает ловушку Notch4 человека, которая охватывает EGF-подобные повторы 9-23 Notch4 (N4-5 фигуры 111). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека.
Белок ловушки h-spHCNotch4(9-23) состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 Hc человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-23 Notch4 человека, состоящие из аминокислот 23-597, а затем (3) аминокислоты 598-834, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 834 аминокислоты.
Ловушка h-sp N Notch4 (9-29)
Ловушка h-spNNotch4(9-29) обозначает ловушку Notch4 человека, которая охватывает EGF-подобные повторы 9-29 Notch4 (N4-6 фигуры 111). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch4 человека.
Белок ловушки h-spNNotch4(9-29) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch4 человека, состоящая из аминокислот 1-27 Notch4 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-29 Notch4 человека, состоящие из аминокислот 28-843, а затем (3) аминокислоты 844-1080, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1080 аминокислот.
Ловушка h-sp HC Notch4 (9-29)
Ловушка h-spHCNotch4(9-29) обозначает ловушку Notch4 человека, которая охватывает EGF-подобные повторы 9-29 Notch4 (N4-7 фигуры 111). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека.
Белок ловушки h-spHCNotch4(9-29) состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 Hc человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 9-29 Notch4 человека, состоящие из аминокислот 23-838, а затем (3) аминокислоты 839-1075, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 1075 аминокислот.
Ловушка h-sp N Notch4 (13-23)
Ловушка h-spNNotch4(13-23) обозначает ловушку Notch4 человека, которая охватывает EGF-подобные повторы 13-23 Notch4 (N4-8 фигуры 111). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch4 человека.
Белок ловушки h-spNNotch4(13-23) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch4 человека, состоящая из аминокислот 1-27 Notch4 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 13-23 Notch4 человека, состоящие из аминокислот 28-444, а затем (3) аминокислоты 445-681, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 681 аминокислоту.
Ловушка h-sp HC Notch4 (13-23)
Ловушка h-spHCNotch4(13-23) обозначает ловушку Notch4 человека, которая охватывает EGF-подобные повторы 13-23 Notch4 (N4-9 фигуры 111). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека.
Белок ловушки h-spHCNotch4(13-23) состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 Hc человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 13-23 Notch4 человека, состоящие из аминокислот 23-439, а затем (3) аминокислоты 440-676, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 676 аминокислот.
Ловушка h-sp N Notch4 (21-29)
Ловушка h-spNNotch4(21-29) обозначает ловушку Notch4 человека, которая охватывает EGF-подобные повторы 21-29 Notch4 (N4-10 фигуры 111). Сокращение spN обозначает, что в этом составе используется сигнальный пептид Notch4 человека.
Белок ловушки h-spNNotch4(21-29) состоит из следующих трех компонентов: (1) сигнальная последовательность Notch4 человека, состоящая из аминокислот 1-27 Notch4 человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 21-29 Notch4 человека, состоящие из аминокислот 28-392, а затем (3) аминокислоты 393-629, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 629 аминокислот.
Ловушка h-sp HC Notch4 (21-29)
Ловушка h-spHCNotch4(21-29) обозначает ловушку Notch4, человека которая охватывает EGF-подобные повторы 21-29 Notch4 (N4-11 фигуры 111). Сокращение spHC обозначает, что в этом составе используется сигнальный пептид HC человека.
Белок ловушки h-spHCNotch4(21-29) состоит из следующих трех компонентов: (1) сигнальная последовательность HC человека, состоящая из аминокислот 1-22 Hc человека, затем (2) аминокислоты, кодирующие EGF-подобные повторы 21-29 Notch4 человека, состоящие из аминокислот 23-387, а затем (3) аминокислоты 388-624, которые содержат Fc-метку человека. Предсказанная последовательность сигнального пептида подчеркнута, и Fc-метка человека подчеркнута и выделена курсивом. Этот состав содержит 624 аминокислоты.
Способы
Конструирование ловушек Notch4 человека
Для получения вариантов ловушек Notch4 человека использовали тотальную РНК эндотелиальных клеток пупочной вены человека (HUVEC). Тотальную РНК подвергали обратной транскрипции с помощью обратной транскриптазы M-MLV и либо случайных гексамерных праймеров, либо специфичного праймера Notch4. Затем синтезированную кДНК амплифицировали с помощью специфичных к ловушке Notch4 вышележащего (смыслового) и нижележащего (антисмыслового) праймеров.
Нижележащий праймер кодирует участки рестрикции либо BamHI, либо BglII на 5'-конце, которые лигируются с участком BglII в Fc-последовательности с образованием химеры Notch4/Fc человека в рамке считывания.
В случае ловушек Notch4, которые образуют слитую молекулу после нуклеотидной последовательности, кодирующей EGF-подобный повтор 29, создается участок BglII для образования участка слияния, и эта слитая последовательность предоставлена (Notch4, фигура 113). Это применимо к составам: ловушка h-Notch4(1-29), ловушка h-spNNotch4(9-29), ловушка h-spHCNotch4(9-29), ловушка h-spNNotch4(21-29), ловушка h-spHCNotch4(21-29).
В случае ловушек Notch4, которые образуют слитую молекулу после нуклеотидной последовательности, кодирующей EGF-подобный повтор 13, создается участок BamHI для образования участка слияния, и эта слитая последовательность предоставлена (Notch4, фигура 114). Это применимо к составу ловушки h-Notch4(1-13).
В случае ловушек Notch4, которые образуют слитую молекулу после нуклеотидной последовательности, кодирующей EGF-подобный повтор 23, создается участок BglII для образования участка слияния, и эта слитая последовательность предоставлена (Notch4, фигура 115). Это применимо к составам ловушки h-Notch4(1-23), ловушки h-spNNotch4(9-23), ловушки h-spHCNotch4(9-23), ловушки h-spNNotch4(13-23), ловушки h-spHCNotch4(13-23).
Амплифицированный продукт PCR субклонируют в pBluescript SK II Fc для получения различных химер Notch4/Fc человека. Затем последовательности ловушек Notch4/Fc человека встраивают в экспрессирующие векторы млекопитающих (pAd-lox, pCCL) для экспрессии и очистки белков ловушек Notch4 человека.
Вторая серия экспериментов
Материалы и способы
Плазмидные конструкции
Аденовирусные конструкции, кодирующие LacZ, полноразмерный Notch4 или активированную форму Notch4/int3, описаны ранее (Shawber et al., 2003). Активированную форму кДНК Notch1, слитую в рамке считывания с 6 метками myc (Kopan et al., 1994) клонировали в аденовирусный экспрессирующий вектор, pAd-lox. Также в pAd-lox клонировали как VEGF165, так и N1ECDFc. Получали исходные растворы с аденовирусом и титровали, как описано выше (Hardy et al., 1997). Ретровирусный экспрессирующий вектор pHyTc, кодирующий любой из LacZ, активированной формы Notch4/int3, J1, Dll1 и Dll4, описан ранее (Uyttendaele et al., 2000, Shawber et al., 2003, Das et al., 2004 в печати). Плазмиды, кодирующие внутриклеточный домен Notch1 (п.н. 5479-7833, регистрационный номер Genbank # X57405) и внеклеточный домен Dll4 (п.н. 1-1545, регистрационный номер Genbank # AF253468, предоставленный Chiron), слитый в рамке считывания с меткой myc/His, встраивали в pHyTC.
Notch1ECD, Notch2ECD, Notch3ECD и Notch4ECD конструируют с использованием последовательностей Fc, содержащихся в плазмиде pCMX-sFR1-IgG с использованием способов, указанных в Clin. Exp. Immunol. (1992) 87 (1):105-110, для создания слитых белков на основе Notch, т.е. Notch1ECD/Fc, Notch2ECD/Fc, Notch3ECD/Fc и Notch4ECD/Fc.
Аденовирусный перенос генов
7,5×105 клеток HUVEC после 3 пассирований высевали в покрытые коллагеном типа I 6-луночные планшеты за сутки до аденовирусной инфекции. Аденовирусную инфекцию посредством Ad-lacZ, Ad-VEGF165 или Ad-N1ECDFc проводили при указанной m.o.i. и инкубировали при 37°С в течение 1 ч при периодическом вращении планшетов.
Анализы с люциферазным репортером
Для определения индуцируемой лигандом передачи сигнала Notch проводили анализы кокультуры с использованием клеток HeLa и происходящих из 293 клеток Bosc. Временную трансфекцию проводили осаждением с фосфатом кальция. Клетки HeLa, посеянные за 1 сутки в 10-см планшеты в количестве 1,5x106, трансфицировали 333 нг pBOS Notch1, 333 нг pGA981-6 и 83 нг pLNC lacZ с либо 666 нг pCMV-Fc, либо pHyTC-N1ECDFc (333 нг для x1, 666 нг для x2). Клетки Bosc, посеянные за 1 сутки в 10-см планшеты в количестве 4×106, трансфицировали 680 нг либо pHyTc-Jagged1, либо pHyTc-Dll1, либо pHyTc-Dll4, либо pHyTc-x (пустой вектор). Через одни сутки после трансфекции клетки кокультивировали в трех экземплярах (HeLa: Bosc, 1:2) на 12-луночных планшетах в течение 24 часов. Клетки собирали и определяли активность люциферазы через 2 суток после трансфекции с использованием набора для анализа Enhanced Luciferase (BD PharMingen), и активность β-галактозидазы определяли с использованием набора Galacto-Light Plus (PE Biosystems). Все анализы проводили в люминометре с двойной инъекцией Berthold.
Для определения индуцируемой VEGF передачи сигнала Notch, использовали HUVEC, которые были инфицированы аденовирусом. HUVEC, высеянные за 1 сутки в 6-луночные планшеты в количестве 8,0x105, инфицировали либо Ad-LacZ в качестве контроля, либо Ad-VEGF при указанной m.o.i. в присутствии или отсутствии Ad-N1ECD/Fc. Через двое суток после инфекции инфицированные HUVEC пересевали в 24-луночный планшет в количестве 1,5×105 клеток в трех экземплярах и культивировали в течение 24 часов, а затем трансфицировали 12,5 нг pRL-SV40 (Promega) и 137,5 нг pGA981-6 с использованием реагента для трансфекции Effectene (Qiagen). Клетки собирали либо через 1, либо через 2 суток после трансфекции, и определяли активность люциферазы с использованием системы для анализа Dual-Luciferase® Reporter Assay System (Promega).
Анализ прорастания
Для получения коллагеновых гелей ледяной раствор коллагена свиньи I типа (Nitta gelatin, Tokyo, Japan) смешивали с 10x средой RPMI1640 и нейтрализующим буфером в соотношении 8:1:1. Затем в 24-луночные планшеты добавляли 400-мкл аликвоты коллагенового геля и позволяли им образовывать гель в течение по меньшей мере 1 часа при 37°C. После аденовирусной инфекции (выше) HUVEC собирали и высевали в количестве 1,3×105 клеток на лунку сверху коллагенового геля в 24-луночных планшетах в 0,8 мл среды EGM2. HUVEC достигали практически полного смыкания монослоя через 48 часов после высевания. После высевания среду заменяли каждые 2 суток в течение 1 недели. Прорастание наблюдали, и фотографии, полученные через 8 суток с помощью цифровой камеры Olympus, помещали под микроскоп. Для количественного определения количества отростков случайным образом выбирали 5 полей на каждую лунку, и два исследователя подсчитывали прорастание под микроскопом слепым способом.
Результаты и обсуждение
Слитые белки NOTCHECD/Fc функционируют в качестве антагонистов Notch
Антагонисты Notch - слитые белки NotchECD/Fc
Авторы настоящего изобретения получили несколько антагонистов Notch (фигура 2). Стратегия авторов настоящего изобретения состояла в слиянии кодирующей последовательности EGF-повторов Notch во внеклеточном домене (ECD) с Fc-доменом человека или мыши. Эта конструкция приводит к секретируемому белку без функции передачи сигнала, но который сохраняет лиганд-связывающий домен, и, таким образом, должна связываться с лигандом и ингибировать его функцию. Авторы настоящего изобретения обозначают эти белки как "NotchECD/Fc", и были получены все четыре Notch1-4ECD/Fc. Fc-домен облегчает аффинную очистку и детекцию белка посредством иммуноблоттинга или иммуногистохимии.
Тестирование антагонистов Notch
Для измерения транскрипционной активации каскада Notch использовали систему кокультуры in vitro (фигура 3) с лигандами, экспрессированными на одной клетке, и активацией рецептора Notch, оцениваемой в другой клетке. Авторы настоящего изобретения использовали этот анализ кокультуры для того, чтобы показать, что Notch1ECD/Fc функционирует, блокируя лиганд-зависимую передачу сигнала Notch (фигура 4). Экспрессирующий вектор N1ECD/Fc котрансфицировали в различных соотношениях с полноразмерным Notch1 и CSL-люциферазным репортером в клетки HeLa, с последующим кокультивированием с лигандом, экспрессирующим клетки 293. Авторы настоящего изобретения наблюдали, что активация передачи сигнала Notch1 лигандами Notch снижалась посредством экспрессии N1ECD/Fc. Этот эффект проявлял зависимость от концентрации; соотношение 2:1 для N1ECD/Fc и Notch1 было более эффективным в отношении ингибирования передачи сигнала, чем отношение 1:1. Notch1ECD/Fc может блокировать передачу сигнала, опосредуемую Jagged1, Delta-like 1 или Delta-like 4.
Экспрессия и очистка антагонистов Notch
Авторы настоящего изобретения получили клеточные линии CHO и HeLa, экспрессирующие NotchECD/FC с использованием ретровирусных векторов для очистки белка. Белки N1ECD/Fc секретируются (фигура 5), как указано, в кондиционированной среде, собранной от линий HeLa-NotchECD/Fc и очищенной с помощью агарозы с белком-A (pA). Очищенный с помощью pA образец (Sup) и лизаты цельных клеток (Lys) подвергали иммуноблотингу с антителом α-Fc (фигура 5, панель A), демонстрируя, что N1ECD/Fc секретируется в среду. Аденовирусные векторы для NotchECD/Fc использовали для инфицирования клеток HeLa, и лизаты этих клеток подвергали иммуноблоттингу с антителами α-Fc, демонстрируя, что они экспрессируют белки NotchECD/Fc (1, 2, 3, 4) (фигура 5, панель B). Авторы настоящего изобретения в настоящее время очищают N1ECD/Fc из сред, кондиционированных клетками CHO, с использованием аффинной хроматографии с pA.
Определение ингибирования ангиогенеза с использованием слитых белков Notch
Детекцию активации передачи сигнала Notch можно проводить с использованием активности промотора CBF1
Функцию передачи сигнала Notch можно измерять путем измерения транскрипционной активности промотора CBF1, который активируется при связывании Notch-IC с CBF1. Авторы настоящего изобретения измеряли активность промотора CBF1 в HUVEC, которые были инфицированы аденовирусом, кодирующим VEGF-165 при различной MOI (фигура 6). Индукция промотора CBF1 отчетливо выявлялась в HUVEC, инфицированных Ad-VEGF, по сравнению с клетками, инфицированными Ad-LacZ, зависимым от MOI образом. Эти данные показывают, что сверхэкспрессия VEGF может активировать передачу сигнала Notch в HUVEC. Таким образом, VEGF индуцировал активность передачи сигнала Notch.
Авторов настоящего изобретения интересовало, могут ли слитые белки Notch блокировать индуцированную VEGF активацию передачи сигнала Notch. Коинфицирование слитым белком Ad-Notch с Ad-VEGF отчетливо снижало активацию активности промотора CBF1, индуцируемую инфекцией посредством Ad-VEGF отдельно (фигура 7). В случае инфицирования при MOI 40 для каждого аденовируса, как представлено на фигуре 7 (панель A), было выявлено 60% ингибирование через 24 ч и 90% ингибирование через 48 после трансфекции репортерного гена, а также то, что ингибиторная активность ловушки Notch зависела от MOI слитого белка Ad-Notch.
Слитые белки Notch блокируют инициацию ангиогенного прорастания, индуцируемого VEGF
В этом эксперименте авторы настоящего изобретения оценивали эффект ловушки Notch на индукцию почкования (инициации прорастания) сверхэкспрессированным VEGF-165 в HUVEC. Когда HUVEC, инфицированные Ad-VEGF, культивировали на геле коллагенового типа в течение 8 суток, происходила индукция почкования в коллагеновом геле. Эта индукция почкования сверхэкспрессированным VEGF отчетливо ингибировалась коинфицированием аденовирусом, кодирующим слитый белок Notch (фигура 8). Слитый белок Ad-Notch самостоятельно имел меньший эффект на морфологию.
На фигуре 9 приведен подсчет почек на поле с использованием микроскопа. Инфицирование HUVEC посредством Ad-VEGF повышало количество почек, в зависимости от используемой MOI. Индуцируемое Ad-VEGF почкование отчетливо ингибировалось. Эти данные указывают на то, что VEGF индуцирует почкование HUVEC посредством активации передачи сигнала Notch и что слитый белок Notch может ингибировать индуцируемое VEGF почкование.
Ссылки, цитированные во второй серии экспериментов
1. Artavanis-Tsakonas, S., K. Matsuno, and M. E. Fortini. 1995. Notch signaling. Science 268:225-232.
2. Bailey, A.M., and J.W. Posakony. 1995. Suppressor of hairless directly activates transcription of enhancer of split complex genes in response to Notch receptor activity. Genes & Development 9:2609-22.
3. Bettenhausen, B., M. Hrabe de Angelis, D. Simon, J. L. Guenet, and A. Gossler. 1995. Transient and restricted expression during mouse embryogenesis of Dll, a murine gene closely related to Drosophila Delta. Development 121:2407-18.
4. Blaumueller, C. M., H. Qi, P. Zagouras, and S. Artavanis-Tsakonas. 1997. Intracellular cleavage of Notch leads to a heterodimeric receptor on the plasma membrane. Cell 90:281-91.
5. Caronti, B., L. Calandriello, A. Francia, L. Scorretti, M. Manfredi, T. Sansolini, E.M. Pennisi, C. Calderaro, and G. Palladini. 1998. Cerebral autosomal dominant arteriopathy with subcortical infarcts and leucoencephalopathy (CADASIL). Neuropathological and in vitro studies of abnormal elastogenesis. Acta Neurol Scand. 98:259-67.
6. Desmond, D. W., J. T. Moroney, T. Lynch, S. Chan, S. S. Chin, D. C. Shungu, A. B. Naini, and J. P. Mohr. 1998. CADASIL in a North American family: clinical, pathologic, and radiologic findings [see comments]. Neurology 51:844-9.
7. Dunwoodie, S. L., D. Henrique, S. M. Harrison, and R. S. Beddington. 1997. Mouse Dll3: a novel divergent Delta gene which may complement the function of other Delta homologues during early pattern formation in the mouse embryo. Development 124:3065-76.
8. Eastman, D. S., R. Slee, E. Skoufos, L. Bangalore, S. Bray, and C. Delidakis. 1997. Synergy between suppressor of Hairless and Notch in regulation of Enhancer of split m gamma and m delta expression. Mol. Cell. Biol. 17:5620-5634.
9. Fortini, M. E., and S. Artavanis-Tsakonas. 1993. Notch: neurogenesis is only part of the picture. Cell 75:1245-7.
10. Gale, N. W., and G. D. Yancopoulos. 1999. Growth factors acting via endothelial cell-specific receptor tyrosine kinases: VEGFs, Angiopoietins, and ephrins in vascular development. Genes and Development 13:1055-1066.
11. Gallahan, D., and R. Callahan. 1997. The mouse mammary tumor associated gene INT3 is a unique member of the NOTCH gene family (NOTCH4). Oncogene 14:1883-90.
12. Greenwald, I. 1994. Structure/function studies of lin-12/Notch proteins. Current Opinion in Genetics & Development 4:556-62.
13. Greenwald, I. 1998. LIN-12/Notch signaling: lessons from worms and flies. Genes Dev. 12:1751-62.
14. Henderson, A. M., S. J. Wang, A. C. Taylor, M. Aitkenhead, and C. C. W. Hughes. 2001. The basic helix-loop-helix transcription factor HESRl regulates endothelial cell tube formation. J. Biol. Chem. 276:6169-6176.
15. Hicks, C, S. H. Johnston, G. diSibio, A. Collazo, T. F. Vogt, and G. Weinmaster. 2000. Fringe differentially modulates Jaggedl and Deltal signalling through Notchl and Notch2. Nature Cell Biology 2:515-520.
16. Hsieh, J. J., T. Henkel, P. Salmon, E. Robey, M. G. Peterson, and S. D. Hayward. 1996. Truncated mammalian Notchl activates CBFl/RBPJk-repressed genes by a mechanism resembling that of Epstein-Barr virus EBNA2. Molecular & Cellular Biology 16:952-9.
17. Hsieh, J. J., D. E. Nofziger, G. Weinmaster, and S. D. Hayward. 1997. Epstein-Barr virus immortalization: Notch2 interacts with CBFl and blocks differentiation. J. Virol. 71:1938-45.
18. Jarriault, S., C. Brou, F. Logeat, E. H. Schroeter, R. Kopan, and A. Israel. 1995. Signaling downstream of activated mammalian Notch. Nature 377:355-358.
19. Joutel, A., F. Andreux, S. Gaulis, V. Domenga, M. Cecillon, N. Battail, N. Piga, F. Chapon, C. Godfrain, and E. Tournier-Lasserve. 2000. The ectodomain of the Notch3 receptor accumulates within the cerebrovasculature of CADASIL patients [see comments]. J. Clin. Invest. 105:597-605.
20. Joutel, A., C. Corpechot, A. Ducros, K. Vahedi, H. Chabriat, P. Mouton, S. Alamowitch, V. Domenga, M. Cecillion, E. Marechal, J. Maciazek, C. Vayssiere, C. Cruaud, E. A. Cabanis, M. M. Ruchoux, J. Weissenbach, J. F. Bach, M. G. Bousser, and E. Tournier-Lasserve. 1996. Notch3 mutations in CADASIL, a hereditary adult-onset condition causing stroke and dementia. Nature 383:707-10.
21. Kopan, R., E. H. Schroeter, H. Weintraub, and J. S. Nye. 1996. Signal transduction by activated mNotch: importance of proteolytic processing and its regulation by the extracellular domain. Proc Natl Acad Sci U S A 93:1683-8.
22. Krebs, L. T., Y. Xue, C. R. Norton, J. R. Shutter, M. Maguire, J. P. Sundberg, D. Gallahan, V. Closson, J. Kitajewski, R. Callahan, G. H. Smith, K. L. Stark, and T. Gridley. 2000. Notch signaling is essential for vascular morphogenesis in mice. Genes and Development 14:1343-1352.
23. Lardelli, M., J. Dahlstrand, and U. Lendahl. 1994. The novel Notch homologue mouse Notch3 lacks specific epidermal growth factor-repeats and is expressed in proliferating neuroepithelium. Mechanism of Development 46:123-136.
24. Lawson, N. D., N. Scheer, V. N. Pham, C. Kim, A. B. Chitnis, J. A. Campos-Ortega, and B. M. Weinstein. 2001. Notch signaling is required for arterial-venous differentiation during embryonic vascular development. Development 128:3675-3683.
25. Lewis, J. 1998. Notch signaling and the control of cell fate choices in vertebrates. Semin Cell Dev Biol. 9:583-589.
26. Lieber, T., S. Kidd, E. Alcomo, V. Corbin, and M. W. Young. 1993. Antineurogenic phenotypes induced by truncated Notch proteins indicate a role in signal transduction and may point to a novel function for Notch in nuclei. Genes Dev. 7:1949-1965.
27. Lindner, V., C. Booth, I. Prudovsky, D. Small, T. Maciag, and L. Liaw. 2001. Members of the Jagged/Notch gene familites are expressed in injured arteries and regulate cell phenotype via alteration in cell matrix and cell-cell interations. Pathology 159:875-883.
28. Lindsell, C. E., C. J. Shawber, J. Boulter, and G. Weinmaster. 1995. Jagged: A mammalian ligand that activates Notchl. Cell 80:909-917.
29. Logeat, F., C. Bessia, C. Brou, O. LeBail, S. Jarriault, N. G. Seidah, and A. Israel. 1998. The Notchl receptor is cleaved constitutively by a furin-like convertase. Proc Natl Acad Sci USA 95:8108-12.
30. Lyman, D., and M. W. Young. 1993. Further evidence for function of the Drosophila Notch protein as a transmembrane receptor. Proc Natl Acad Sci USA 90:10395-10399.
31. Matsuno, K., M. J. Go, X. Sun, D. S. Eastman, and S. Artavanis-Tsakonas. 1997. Suppressor of Hairless-independent events in Notch signaling imply novel pathway elements. Development 124:4265-4273.
32. Nakagawa, O., D. G. McFadden, M. Nakagawa, H. Yanagisawa, T. Hu, D. Srivastava, and E. N. Olson. 2000. Members of the HRT family of basic helix-loop-helix proteins act as transcriptional repressors downstream of Notch signaling. Proc Natl Acad Sci USA 97:13655-13660.
33. Oberg, C, J. Li, A. Pauley, E. Wolf, M. Gurney, and U. Lendahl. 2001. The Notch intracellular domain is ubiquitinated and negatively regulated by the mammalian Sel-10 homolog. J. Biol. Chem. 276:35847-35853.
34. Owens, G. K. 1995. Regulation of differentiation of vascular smooth muscle cells. Physiol Rev. 75:487-527.
35. Rebay, I., R. G. Fehon, and S. Artavanis-Tsakonas. 1993. Specific truncations of Drosophila Notch define dominant activated and dominant negative forms of the receptor. Cell 74:319-29.
36. Robey, E. 1997. Notch in vertebrates. Curr Opin Genet Dev. 7:551-7.
37. Roehl, H., M. Bosenberg, R. Blelloch, and J. Kimble. 1996. Roles of the RAM and ANK domains in signaling by the C. elegans GLP-I receptor. Embo J. 15:7002-7012.
38. Rogers, S., R. Wells, and M. Rechsteiner. 1986. Amino acid sequences common to rapidly degrade proteins: The PEST hypothesis. Science 234:364-368.
39. Sasai, Y., R. Kageyama, Y. Tagawa, R. Shigemoto, and S. Nakanishi. 1992. Two mammalian helix-loop-helix factors structurally related to Drosophila hairy and Enhancer of split. Genes & Dev. 6:2620-2634.
40. Shawber, C, J. Boulter, C. E. Lindsell, and G. Weinmaster. 1996a. Jagged2: a serrate-like gene expressed during rat embryogenesis. Dev Biol. 180:370-6.
41. Shawber, C, D. Nofziger, J. J. Hsieh, C. Lindsell, O. Bogler, D. Hayward, and G. Weinmaster. 1996b. Notch signaling inhibits muscle cell differentiation through a CBFl-independent pathway. Development 122:3765-73.
42. Shimizu, K., S. Chiba, T. Saito, T. Takahashi, K. Kumano, H. Hamada, and H. Hirai. 2002. Integrity of intracellular domain of Notch ligand is indespensable for cleavage required for the release of the Notch2 intracellular domain. Embo J. 21:294-302.
43. Shutter, J. R., S. Scully, W. Fan, W. G. Richards, J. Kitajewski, G. A. Deblandre, C. R. Kintner, and K. L. Stark. 2000a. D114, a novel Notch ligand expressed in arterial endothelium. Genes Dev. 14:1313-1318.
44. Shutter, J. R., S. Scully, W. Fan, W. G. Richards, J. Kitajewski, G. A. Deblandre, C. R. Kitner, and K. L. Stark. 2000b. D114, a novel Notch ligand expressed in arterial endothelium. Genes and Development 14:1313-1318.
45. Struhl, C., K. Fitzgerald, and I. Greenwald. 1993. Intrinsic activity of the Lin-12 and Notch intracellular domains in vivo. Cell 74:331-45.
46. Swiatek, P. J., C. E. Lindsell, F. Franco del Amo, G. Weinmaster, and T. Gridley. 1994. Notch 1 is essential for postimplantation development in mice. Genes & Development 8:707-719.
47. Tamura, K., Y. Taniguchi, S. Minoguchi, T. Sakai, T. Tun, T. Furukawa, and T. Honjo. 1995. Physical interaction between a novel domain of the receptor Notch and the transcription factor RBP-J kappa/Su (H). Curr Biol. 5:1416-1423.
48. Tietze, K., N. Oellers, and E. Knust. 1992. Enhancer of splitD, a dominant mutation of Drosophila, and its use in the study of functional domains of a helix-loop-helix protein. Proc Natl Acad Sci USA 89:6152-6156.
49. Uyttendaele, H., J. Ho, J. Rossant, and J. Kitajewski. 2001. Vascular patterning defects associated with expression of activated Notch4 in embryonic endothelium. PNAS. 98:5643-5648.
50. Uyttendaele, H., G. Marazzi, G. Wu, Q. Yan, D. Sassoon, and J. Kitajewski. 1996. Notch4/int-3, a mammary proto-oncogene, is an endothelial cell-specific mammalian Notch gene. Development 122:2251-9.
51. Vervoort, M., C. Dambly-Chaudiere, and A. Ghysen. 1997. Cell fate determination in Drosophila. Curr Opin Neurobiol. 7:21-28.
52. Villa, N., L. Walker, C. E. Lindsell, J. Gasson, M. L. Iruela-Arispe, and G. Weinmaster. 2001. Vascular expression of Notch pathway receptors and ligands is restricted to arterial vessels. Mechanisms of Development 108:161-164.
53. Weinmaster, G. 1997. The Ins and Outs of Notch Signaling. Mol. Cel. Neurosci. 9:91-102.
54. Weinmaster, G. 1998. Notch signaling: direct or what? Curr Opin Genet Dev. 8:436-42.
55. Weinmaster, G., V. J. Roberts, and G. Lemke. 1992. Notch 2: a second mammalian Notch gene. Development 116:931-941.
56. Weinmaster, G., V. J. Roberts, and G. A. Lemke. 1991. A homolog of Drosophila Notch expressed during mammalian development. Development 113:199-205.
57. Wettstein, D. A., D. L. Turner, and C. Kintner. 1997. The Xenopus homolog of Drosophila Suppressor of Hairless mediates Notch signaling during primary neurogenesis. Development 124:693-702.
58. Wu, G., E. J. Hubbard, J. K. Kitajewski, and I. Greenwald. 1998. Evidence for functional and physical association between Caenorhabditis elegans SEL-10, a Cdc4p-related protein, and SEL-12 presenilin. Proc Natl Acad Sci USA 95:15787-91.
59. Wu, G., S. A. Lyapina, I. Das, J. Li, M. Gurney, A. Pauley, I. Chui, R. J. Deshaies, and J. Kitajewski. 2001. SEL-10 is an inhibitor of notch signaling that targets notch for ubiquitin-mediated protein degradation. Mol. Cell. Biol. 21:7403-7015.
60. Xue, Y., X. Gao, C. E. Lindsell, C. R. Norton, B. Chang, C. Hicks, M. Gendron-Maguire, E. B. Rand, G. Weinmaster, and T. Gridley. 1999. Embryonic lethality and vascular defects in mice lacking the Notch ligand Jaggedl. Hum Mol. Genet. 8:723-30
Третья серия экспериментов
VEGF инициирует ангиогенез посредством активации передачи сигнала Notch
Каскады передачи сигнала как VEGF, так и Notch важны для развития сосудов. Здесь авторы настоящего изобретения показывают, что VEGF активирует передачу сигнала Notch для инициации ангиогенеза. VEGF повышал экспрессию Delta4 и Notch4, вызывая активацию передачи сигнала Notch и индуцируя филоподии в культивированных первичных эндотелиальных клетках. Исследования с использованием ингибиторов рецептора VEGF показывают, что активация передачи сигнала Notch, в свою очередь, усиливает действие VEGF путем индукции экспрессии VEGFR-1 (Flt-1). Другие элементы действия VEGF, включая индукцию MMP-9 и MT1-MMP, опосредуются Notch. С использованием анализов in vivo для моделирования индуцируемой VEGF неоваскуляризации кожи, авторы настоящего изобретения выявили, что секретируемый ингибитор Notch (слитый белок на основе Notch) блокирует индуцируемую VEGF неоваскуляризацию и индукцию экспрессии VEGFR-1. Таким образом, передача сигнала Notch требуется для ангиогенеза, регулируемого VEGF, вероятно, на уровне инициации.
VEGF является ключевым регулятором процесса ангиогенеза, состоящего из множества процессов, таких как деградация ECM, почкование (образование филоподий), пролиферация, выживание и миграция эндотелиальных клеток. Хотя большинство стадий могут взаимодействовать с находящимися ниже в каскаде молекулами передачи сигнала VEGF, не известно, как эти стадии координационно регулируются, обеспечивая в результате более комплексные морфогенетические события, такие как ангиогенное прорастание. Передача сигнала Notch является эволюционно консервативным механизмом передачи сигнала, который функционирует, регулируя выбор клеточной судьбы (1). При связывании лигандом, таким как Jagged и Delta-like, цитоплазматический домен Notch (NotchIC) высвобождается пресенилин/γ-секретазой, транслоцируется в ядро, взаимодействует с транскрипционным репрессором CSL (CBF1/Su(H)/lag2) и превращает его в транскрипционный активатор (1). Предположение о роли передачи сигнала Notch в развитии сосудов было сделано посредством исследований мышей с направленной мутацией (2). Поскольку активация Notch в эндотелии также прерывает ремоделирование сосудов, надлежащая передача сигнала Notch является необходимой для развития сосудов (3). Хотя было сделано предположение о значении Notch для передачи сигнала VEGF (4-6), все еще неясно, каким образом передача сигнала Notch участвует в регулируемом VEGF ангиогенезе, и то, участвует ли передача сигнала Notch в физиологическом и патологическом ангиогенезе в сосудах взрослых.
Рост HUVEC (эндотелиальные клетки пупочной вены человека) зависит от VEGF (фиг. 26A и 26B) и связанных с дифференцировкой биологических ответов, таких как прорастание, и его можно оценивать на ранней стадии (7). Сначала авторы настоящего изобретения оценивали, индуцирует ли трансдуцированный с помощью аденовируса VEGF экспрессию как Notch, так и лиганда Notch в HUVEC, культивированных с полной средой, содержащей bFGF (фиг. 22A), как описано (5). Анализ посредством RT-PCR показал, что происходила активация РНК как Dl4, так и Notch4 в HUVEC, трансдуцированных VEGF с помощью аденовируса (Ad-VEGF-HUVEC), по сравнению с HUVEC, трансдуцированными LacZ с помощью аденовируса (Ad-LacZ-HUVEC) (фиг. 22A). Трансдуцированный VEGF, как оказалось, не индуцирует экспрессию Jagged1 и Notch1. Трансдуцированный VEGF также активировал передачу сигнала Notch дозозависимым образом при измерении активности CSL-люциферазного репортера (фиг. 22B), который трансактивировался путем передачи сигнала Notch (8). Передача сигнала Notch активировалась при более высокой дозировке Ad-VEGF по сравнению с пролиферацией (фиг. 26A). Поскольку SU5416, который представляет собой ингибитор VEGFR-киназы, снижал индуцируемую VEGF активность CSL-люциферазного репортера (фиг. 22C), VEGF индуцировал передачу сигнала Notch посредством активации рецепторной киназы. Поскольку мутанты Notch, лишенные как трансмембранных, так и цитоплазматических доменов, функционировали в качестве доминантно-негативных ингибиторов передачи сигнала Notch (9), авторы настоящего изобретения получили слитый белок на основе Notch или ловушку Notch (N1ECDFc) для ингибирования передачи сигнала Notch (фиг. 22D). Анализ вестерн-блоттингом кондиционированной среды HUVEC, трансдуцированных Ad-N1ECDFc (Ad-N1ECDFc-HUVEC), показал, что N1ECDFc хорошо экспрессируется и секретируется (фиг. 22E). С использованием анализа в кокультуре, в котором клетки Bosc, экспрессирующие лиганды Notch (любой из J1, D11 или D14), активировали передачу сигнала Notch в клетках HeLa, экспрессирующих Notch1, по сравнению с контрольными клетками Bosc, авторы настоящего изобретения определяли ингибирование передачи сигнала Notch при трансфекции экспрессирующей N1ECDFc плазмиды (фиг. 22F). Затем авторы настоящего изобретения исследовали, ингибирует ли N1ECDFc активацию передачи сигнала Notch посредством трансдуцированного VEGF в HUVEC (фиг. 22G). Котрансдукция Ad-N1ECDFc с Ad-VEGF в HUVEC отчетливо снижала активность CSL-люциферазы, индуцируемую VEGF. Gerhardt et al. описали, что VEGF контролирует ангиогенез в сетчатке в ранний постнатальный период путем управления удлинением филоподий на верхушках отростков сосудов (10). В процессе ангиогенного прорастания образование специализированной эндотелиальной клетки, образующей выступы филоподий, среди покоящихся эндотелиальных клеток, может быть одним из ранних событий. Здесь авторы настоящего изобретения понимают образование одной эндотелиальной клетки, образующей выступ филоподий, как почкование. Почкование первичных эндотелиальных клеток индуцируют их 3-мерным культивированием либо на фибрине, либо на коллагеновом геле (11). В случае, где Ad-VEGF-HUVEC культивировали на коллагеновом геле с полной средой, трансдуцированные HUVEC образовывали удлинения филоподий в коллагеновый гель в течение 5 суток (фиг. 22H), и количество почек возрастало дозозависимым образом (фиг. 27A). Активация передачи сигнала Notch посредством аденовируса, кодирующего активированную форму Notch4 (Ad-Notch4/int3), индуцировала почкование HUVEC (12) и активированную форму Notch1 (Ad-N1IC), также индуцировала почкование HUVEC (фиг. 23A и 27B). Поскольку передача сигнала как VEGF, так и Notch индуцирует почкование HUVEC, авторы настоящего изобретения исследовали, ингибирует ли N1ECDFc индуцируемое VEGF почкование HUVEC (фиг. 22H-I). Почкование Ad-VEGF-HUVEC отчетливо ингибировалось котрансдукцией Ad-N1ECDFc. Ни HUVEC, трансдуцированные Ad-LacZ, ни HUVEC, трансдуцированные Ad-N1ECDFc, не образовывали почки (фиг. 22H). N1ECDFc ингибировал индуцируемое VEGF почкование HUVEC без влияния на число клеток (фиг. 22I). Трансдуцированный N1ECDFc не изменял отчетливо пролиферацию HUVEC, хотя пролиферация трансдуцированных Ad-N1IC HUVEC ингибировалась дозозависимым образом (фиг. 28A), что согласуется с ингибиторной эффективностью передачи сигнала Notch на пролиферацию эндотелия (13).
Для тестирования того, является ли передача сигнала Notch направляемой VEGF, авторы настоящего изобретения оценивали три различных ингибитора рецепторных тирозинкиназ, включая VEGFR, на индуцируемое N1IC почкование HUVEC, поскольку эти три фактора роста находились в полной среде (фиг. 23A-C). В концентрации 1 мкМ каждое соединение показало селективное ингибирование каждой киназы (данные не представлены). Ни PD166866, ни ZD1893 не влияли на почкование Ad-N1IC-HUVEC, а SU5416 отчетливо ингибировал его (фиг. 23A-B). SU5416 селективно ингибировал почкование Ad-N1IC-HUVEC с меньшим снижением жизнеспособности при более низких концентрациях (фиг. 23C). С тех пор, когда Taylor et al. описали, что Notch ингибировал экспрессию Flk1/KDR/VEGFR2 (14), было неправдоподобным, что Notch объединяется с Flk1 для обеспечения почкования. Таким образом, авторы настоящего изобретения исследовали, влияет ли активация передачи сигнала Notch на экспрессию Flt1/VEGFR1 в HUVEC, поскольку SU5416 ингибирует киназную активность как Flt1, так и Flk1 (15). Анализ посредством RT-PCR показал, что экспрессия мРНК Flt1 повышается в Ad-N1IC-HUVEC, а экспрессию маркера эндотелиальных клеток, мРНК CD31, не сравнивали с экспрессией в Ad-LacZ-HUVEC (фиг. 23D). Анализ вестерн-блоттингом также показал, что экспрессия белка Flt1 повышалась в Ad-N1IC-HUVEC (фиг. 23E). Таким образом, авторы настоящего изобретения исследовали, запускает ли P1GF, который является селективным лигандом Flt1, почкование HUVEC, в которых Flt1 активирован путем активации передачи сигнала Notch (фиг. 23F-G). P1GF увеличивал количество почек Ad-N1IC-HUVEC на 150%, по сравнению с отсутствием P1GF (фиг. 23F). Более того, P1GF повышал количество почек HUVEC, содержащих множество филоподий, на 250% (фиг. 23G). В то время как снижение экспрессии Flt1 с использованием малой интерферирующей РНК (siRNA) для Flt1 ингибировало почкование Ad-N1IC-HUVEC (фиг. 23J), его трансфекция селективно снижала экспрессию мРНК Flt1 (фиг. 23H) и белка Flt1 (фиг. 23I). Хотя снижение экспрессии Flk1 посредством siRNA для Flk1 также ингибировало почкование Ad-N1IC-HUVEC (фиг. 30B), ингибиторная эффективность siRNA для Flk1 была меньшей, чем ингибиторная эффективность siRNA для Flt1 (фиг. 23J). Эффекты siRNA для Flk1 были более высокими в отношении почкования Ad-VEGF-HUVEC, чем в отношении Ad-N1IC-HUVEC (фиг. 30B-C). Трансфекция посредством siRNA для Flt1 ингибировала почкование как Ad-N1IC-, так и Ad-VEGF-HUVEC на сходном уровне (данные не представлены).
В некоторых исследованиях было показано, что VEGF регулировал активность желатиназы в эндотелиальных клетках и твердо установлено значение активности желатиназ, таких как MMP-2 и MMP-9, для индукции ангиогенного прорастания (16). Авторы настоящего изобретения исследовали, регулирует ли VEGF активность желатиназы через передачу сигнала Notch в HUVEC.
В желатиназной зимографии кондиционированная среда Ad-VEGF-HUVEC показала как индукцию, так и активацию MMP9, которая начинала выявляться на 6 сутки (фиг. 24A), и активацию MMP2, которая выявлялась на 4 сутки (фиг. 24B), по сравнению с кондиционированной средой Ad-LacZ-HUVEC. Котрансдукция Ad-N1ECDFc с Ad-VEGF показала ингибирование как индукции и активации MMP9 (фиг. 24A), так и активации MMP2 (фиг. 24B). Анализ RT-PCR показал, что экспрессия мРНК MMP9 повышалась в Ad-N1IC-HUVEC, но экспрессия мРНК MMP2 снижалась в Ad-N1IC-HUVEC (фиг. 24C). Поскольку индукция активности MMP2 не выявлялась в желатиназной зимографии (фиг. 24B), этот результат был правдоподобным следствием. В то же время экспрессия MT1-MMP, который способен активировать MMP2 на клеточной поверхности (17), повышалась на уровне как белка, так и транскрипта в Ad-N1IC-HUVEC (фиг. 24D). Поскольку VEGF может регулировать экспрессию как желатиназы, так и MT1-MMP (16), анализ RT-PCR показал, что как MMP9, так и MT1-MMP активировались в Ad-VEGF-HUVEC по сравнению с Ad-LacZ-HUVEC, и эта индукция ингибировалась котрансдукцией Ad-N1ECDFc (фиг. 24E). Инфицирование Ad-N1ECDFc отдельно не влияло на экспрессию как MMP9, так MT1-MMP в HUVEC, инфицированных Ad-LacZ (данные не представлены). Потребность в MMP для ангиогенного прорастания была установлена с помощью синтетических ингибиторов MMP (16). GM6001 представляет собой один широкий ингибитор MMP, включая MMP2, MMP9 и MT1-MMP (18). GM6001 отчетливо снижал почкование Ad-N1IC-HUVEC, как на коллагеновом (фиг. 31A-B), так и на фибриновом геле (данные не представлены).
В анализе дорсального альвеолярного мешочка (DAS) у мышей (19), стабильный трансфектант клеток 293, сверхэкспрессирующих VEGF121 (293/VEGF), значимо индуцировал ангиогенез in vivo (фиг. 25A, левая панель). Этот индуцируемый VEGF ангиогенез отчетливо ингибировался коэкспрессией N1ECDFc, по сравнению с 293/VEGF отдельно (фиг. 25A). Проводили измерение плотности сосудов, и индекс ангиогенеза, приведенный на фиг. 25B, демонстрирует, что индуцируемый 293/VEGF ангиогенез ингибируется путем коэкспрессии 293/N1ECDFc (фиг. 25B).
Также, в анализе дорсального альвеолярного мешочка (DAS) мыши (19), клеточная линия рака молочной железы человека, MDA-MB-231, значимо индуцировала ангиогенез in vivo, предположительно путем секреции VEGF (фиг. 25C, левая панель). Этот индуцированный VEGF ангиогенез отчетливо ингибировался опосредуемой аденовирусом экспрессией N1ECDFc по сравнению с аденовирусом, экспрессирующим LacZ. (фиг. 25C). Плотность сосудов измеряли, и индекс ангиогенеза, приведенный на фиг. 25D, демонстрирует, что индуцируемый MDA-MB-231 ангиогенез ингибируется путем экспрессии N1ECDFc.
Flk1 представляет собой основной положительный передатчик сигнала для ангиогенеза благодаря его выраженной тирозинкиназной активности в эмбрионе, в то время как Flt1, как полагают, является отрицательным передатчиком сигнала для ангиогенеза. Однако положительная роль Flt-1 была продемонстрирована у взрослых мышей, поскольку рост in vivo LLC, сверхэкспрессирующих P1GF2, значительно снижался у мышей, лишенных цитоплазматического киназного домена Flt-1 (20). Notch может функционировать, изменяя передачу сигнала VEGF путем индукции передачи сигнала Flt-1 и снижения передачи сигнала Flk-1, либо для индукции удлинения филоподий, либо для усиления ангиогенного прорастания, поскольку передача сигнала P1GF/Flt-1 изменяет участок фосфорилирования Flk-1 и потенциирует ишемический ангиогенез в миокарде (21). Интересно, что передача сигнала Notch также повышает экспрессию P1GF (фиг. 29). Однако непрерывная активация передачи сигнала Notch ингибирует образование многоклеточных содержащих просвет отростков, как описано ранее (22). Передача сигнала Notch должна выключаться после почкования/образования филоподий, и может требоваться временная активация каскада Notch. В модели канцерогенеза бета-клеток поджелудочной железы у трансгенных мышей (мышей Rip1Tag2), в которой ангиогенез опухоли является зависимым от VEGF, уровень экспрессии VEGF не повышается, однако происходит мобилизация внеклеточного VEGF, находящегося в матриксе, к рецепторам VEGF. MMP-9 отвечает за эту мобилизацию, и прогрессирование опухоли ингибировалось у RiplTag23MMP-9-нуль-двойных трансгенных мышей (23). Notch активировал экспрессию MMP-9, и он может повышать локальный уровень VEGF в области ангиогенного прорастания. Хотя Notch также повышает экспрессию MT1-MMP, внеклеточный MMP-2 может быть нацелен на клеточную мембрану активированных Notch эндотелиальных клеток. Notch может определять участок для ангиогенного прорастания путем регуляции желатиназной активности и концентрации VEGF. Поскольку MMP-9 регулировался посредством Flt-1 в специфичных к легкому метастазах (20), Flt-1 может участвовать в индукции MMP-9 непрямо.
Ссылки, цитированные в третьей серии экспериментов
1. Artavanis-Tsakonas S., Rand M. D., Lake R. J. Notch Signaling: Cell Fate Control and Signal Integration in Development. Science 1999; 284(5415):770-776.
2. Shawber C. J., J. K. Notch function in the vasculature: insights from zebrafish, mouse and man. Bioessays. 2004; 26(3):225-34.
3. Uyttendaele H., Ho J., Rossant J., J. K. Vascular patterning defects associated with expression of activated Notch4 in embryonic endothelium. Proc Natl Acad Sci U S A. 2001; 98(10):5643-8.
4. Lawson N. D., Vogel A. M., B.M. W. sonic hedgehog and vascular endothelial growth factor act upstream of the Notch pathway during arterial endothelial differentiation. Dev Cell 2002; 3(1):127-36.
5. Liu Z. J., Shirakawa T., Li Y., Soma A., Oka M., Dotto G. P., et al. Regulation of Notchl and D114 by vascular endothelial growth factor in arterial endothelial cells: implications for modulating arteriogenesis and angiogenesis. Mol Cell Biol. 2003; 23(1):14-25.
6. Gale N. W., Dominguez M. G., Noguera I., Pan L., Hughes V., Valenzuela D. M., et al. Haploinsufficiency of delta-like 4 ligand results in embryonic lethality due to major defects in arterial and vascular development. Proc Natl Acad Sci U S A. 2004; 101(45):5949-54.
7. Montesano R., L. 0. Phorbol esters induce angiogenesis in vitro from large-vessel endothelial cells. J. Cell. Physiol. 1987; 130 (2):284-91.
8. Jarriault S., Brou C., Logeat F., Schroeter E. H., Kopan R., A. I. Signalling downstream of activated mammalian Notch. Nature. 1995; 377(6547):355-8.
9. Small D., Kovalenko D., Kacer D., Liaw L., Landriscina M., Di Serio C., et al. Soluble Jagged 1 represses the function of its transmembrane form to induce the formation of the Src-dependent chord-like phenotype. J. Biol. Chem. 2001; 276(34):32022-30.
10. Gerhardt H., Golding M., Fruttiger M., Ruhrberg C., Lundkvist A., Abramsson A., et al. VEGF guides angiogenic sprouting utilizing endothelial tip cell filopodia. J. Cell. Biol. 2003; 161(6):1163-77.
11. Koolwijk P., van Erck M. G., de Vree W. J., Vermeer M. A., Weich H. A., Hanemaaijer R., et al. Cooperative effect of TNFalpha, bFGF, and VEGF on the formation of tubular structures of human microvascular endothelial cells in a fibrin matrix. Role of urokinase activity. J. Cell Biol 1996; 132(6):1177-88.
12. Das I., Craig C., Funahashi Y., Jung K. M., Kim T. W., Byers R., et al. Notch oncoproteins depend on gamma-secretase/presenilin activity for processing and function. J. Biol. Chem. 2004; 279(29):30771-80.
13. Noseda M., Chang L., McLean G., Grim J. E., Clurman B. E., Smith L. L., et al. Notch activation induces endothelial cell cycle arrest and participates in contact inhibition: role of p21Cipl repression. Mol. Cell. Biol. 2004; 24(20):8813-22.
14. Taylor K. L., Henderson A. M., CC. H. Notch activation during endothelial cell network formation in vitro targets the basic HLH transcription factor HESR-I and downregulates VEGFR-2/KDR expression. Microvasc Res 2002; 64(3):372-83.
15. Itokawa T., Nokihara H., Nishioka Y., Sone S., Iwamoto Y., Yamada Y., et al. Antiangiogenic effect by SU5416 is partly attributable to inhibition of Flt-1 receptor signaling. Mol. Cancer Ther 2002; 1(5):295-302.
16. Pepper M. S. Role of the matrix metalloproteinase and plasminogen activator-plasmin systems in angiogenesis. Arterioscler Thromb. Vasc. Biol. 2001; 21(7):1104-17.
17. Seiki M., Koshikawa N., I. Y. Role of pericellular proteolysis by membrane-type 1 matrix metalloproteinase in cancer invasion and angiogenesis. Cancer Metastasis Rev 2003; 22(2-3):129-43.
18. Yamamoto M., Tsujishita H., Hori N., Ohishi Y., Inoue S., Ikeda S., et al. Inhibition of membrane-type 1 matrix metalloproteinase by hydroxamate inhibitors: an examination of the subsite pocket. J. Med. Chem. 1998; 41(8):1209-17.
19. Funahashi Y., Wakabayashi T., Semba T., Sonoda J., Kitoh K., K. Y. Establishment of a quantitative mouse dorsal air sac model and its application to evaluate a new angiogenesis inhibitor. Oncol Res. 1999; 11(7):319-29.
20. Hiratsuka S., Nakamura K., Iwai S., Murakami M., Itoh T., Kijima H., et al. MMP9 induction by vascular endothelial growth factor receptor-1 is involved in lung-specific metastasis. Cancer Cell 2002; 2(4):289-300.
21. Autiero M., Waltenberger J., Communi D., Kranz A., Moons L., Lambrechts D., et al. Role of PlGF in the intra- and intermolecular cross talk between the VEGF receptors Fltl and Flkl. Nat Med 2003; 9(7):936-43.
22. Leong K. G., Hu X L.L., Noseda M., Larrivee B., Hull C., Hood L., et al. Activated Notch4 inhibits angiogenesis: role of beta 1-integrin activation. Mol. Cell Biol 2002; 22 (8):2830-41.
23. Bergers G., Brekken R., McMahon G., Vu T. H., Itoh T., Tamaki K., et al. Matrix metalloproteinase-9 triggers the angiogenic switch during carcinogenesis. Nat Cell Biol 2000; 2(10):737-44.
Четвертая серия экспериментов
Новая конструкция, образованная из эктодомена Notch1, ингибирует передачу сигнала Notch, морфогенез эндотелия и ангиогенез опухоли
Передача сигнала Notch требуется для развития сосудов, но также она функционирует в ангиогенезе опухоли. Ингибирование фактора роста эндотелия сосудов (VEGF) является проверенной антиангиогенной терапией, и VEGF может индуцировать экспрессию как Notch, так и лиганда Delta-like 4 (Dll4) для Notch, в эндотелиальных клетках (EC). Хотя ингибирование Dll4 может ограничить рост опухоли и разрушить новые сосуды, эффект ингибирования функции рецептора Notch на ангиогенез опухоли еще предстоит определить. В этом исследовании авторы настоящего изобретения получили растворимый слитый белок рецептора Notch1 (N1ECDFc, или ловушки Notch1) для блокирования этого каскада и оценили его эффект на ангиогенез in vitro и in vivo.
Экспрессия ловушки Notch1 снижала передачу сигнала, стимулируемую связыванием трех различных лигандов Notch с Notch1, а также ингибировала морфогенез EC, сверхэкспрессирующих Notch4. Авторы настоящего изобретения протестировали эффекты экспрессии ловушки Notch1 на ангиогенез опухоли с использованием двух моделей: клетки опухоли молочной железы мыши Mm5MT, сверхэкспрессирующие фибробластный фактор роста 4 (Mm5MT-FGF4), и клетки нейробластомы NGP человека. Экзогенно экспрессируемый FGF4 индуцировал экспрессию лигандов Notch Jagged1 и Delta-like 1 (Dll1) в клетках Mm5MT-FGF4, и Jagged1 экспрессировался в ксенотрансплантатах Mm5MT-FGF4. Сверхэкспрессия ловушки Notch1 не влияла на способность клеток Mm5MT-FGF4 к образованию опухоли in vitro, однако ограничивала рост ксенотрансплантата Mm5MT-FGF4 у мышей, хотя и значительно снижая неоангиогенез. Аналогично экспрессия ловушки Notch1 не влияла на клетки NGP in vitro, однако разрушала сосуды и снижала жизнеспособность опухоли в ксенотрансплантатах NGP. Эти результаты строго указывают на то, что передача сигнала Notch требуется для неоангиогенеза опухоли, и обеспечивают новую мишень для терапии опухоли.
Ангиогенез тонко регулируется множеством каскадов передачи сигнала, включающих VEGF, фибробластные факторы роста (FGF) и фактор роста гепатоцитов (HGF). Среди них VEGF критически влияет практически на все стадии ангиогенеза, включая пролиферацию эндотелия, выживаемость эндотелия и образование трубки (1). В соответствии с этой разносторонней ролью, ингибиторы VEGF снижают ангиогенез в доклинических моделях, и они были клинически проверены в качестве терапии злокачественной опухоли (2). Несмотря на эту установленную эффективность, различные типы опухолей проявляют широко варьирующую восприимчивость к блокаде VEGF (2). Основополагающие причины этой вариабельности не ясны. Одна из возможностей состоит в том, что альтернативные сигналы сохраняют сосуды опухоли, обеспечивая перфузию, несмотря на ингибирование VEGF. Идентификация таких каскадов, таким образом, имеет очевидное терапевтическое значение.
Высоко консервативное семейство генов Notch кодирует трансмембранные рецепторы (Notch1, -2, -3, -4) и лиганды (Jagged1, -2; Delta-like или Dll1, -3, -4), также трансмембранные белки. При связывании лиганда цитоплазматический домен Notch (NotchIC) высвобождается пресенилин/γ-секретазой (3). Дефекты передачи сигнала Notch вызывают тяжелые дефекты сосудов у эмбрионов (4) с гаплонедостаточностью Dll4, вызывающей летальность. Потенциальная роль передачи сигнала Notch в ангиогенезе опухоли, таким образом, недавно вызывала высокий интерес. Мыши, трансгенные по репортерной конструкции Dll4, демонстрируют экспрессию в эндотелиальных клетках опухоли (EC) (5), и повышенная экспрессия Dll4 была выявлена в злокачественных опухолях человека (6, 7). Два недавних сообщения подтверждают, что эта роль является критической, путем демонстрации того, что блокада Dll4 подавляет рост и перфузию в экспериментальных опухолях (8, 9). Интересно, что в этих исследованиях ингибирование Dll4 приводило к дезорганизации сосудов опухоли, а не к простому препятствованию пролиферации сосудов, указывая на то, что Dll4 требуется для функциональной сборки сосудов.
Недавние данные указывают на то, что рецепторы Notch также функционируют в сосудах опухоли. Например, недавно было показано, что в плоскоклеточной карциноме головы и шеи (HNSCC) HGF повышает экспрессию Jagged1 на клетках опухоли, но не на эндотелии. Повышенная экспрессия Jagged1 активировала передачу сигнала Notch в соседних EC, стимулируя ангиогенез и рост опухоли у мышей (10). Таким образом, эти данные указывают на то, что существует по меньшей мере два различных механизма активации передачи сигнала Notch в EC опухоли.
В этих исследованиях авторы настоящего изобретения оценивали роль активации рецептора Notch при ангиогенезе с использованием новой растворимой конструкции на основе внеклеточного домена Notch1 (N1ECDFc, или ловушка Notch1). In vitro, ловушка Notch1 ингибировала как индуцируемую лигандом активацию передачи сигнала Notch, так и морфогенез EC, сверхэкспрессирующих Notch4 с помощью аденовируса. In vivo, экспрессия ловушки Notch1 замедляла рост ксенотрансплантатов Mm5MT мыши, в которых экспрессия Jagged1 повышалась посредством трансдукции FGF4, и нарушала сосуды и жизнеспособность опухоли в опухолях нейробластомы NGP. Эти данные подтверждают потребность в функции рецептора Notch в процессе неоангиогенеза опухоли и указывают на то, что ингибирование этого каскада может обеспечить эффективную новую противоопухолевую стратегию.
Материалы и способы
Реагенты и экспрессирующие векторы
Соединение E приобретали от Calbiochem (San Diego, CA), и PD166866 от Eisai (Tokyo, Japan). Ловушка Notch1 (N1ECDFc) кодирует эктодомен Notch1 крысы (п.н. 241-4229, регистрационный номер Genbank #X57405), слитый в рамке считывания с Fc IgG человека. Ретровирусные pHyTC-Jagged1, -Dll1, -Dll4 и pBos-Notch1 были описаны (11). Ловушку Notch1 и Fc встраивали в ретровирусный вектор pHyTCX, и FGF4 встраивали в pQNCX. Аденовирусные конструкции, кодирующие LacZ и Notch4 мыши и pAdlox-GFP, были описаны (12), (13).
HUVEC, инфицированные аденовирусом и ретровирусом
HUVEC выделяли, как описано (14), и карцинома молочной железы мыши Mm5MT была приобретенной (ATCC, Manassas, VA). Для инфицирования авторы настоящего изобретения использовали аденовирус с указанной множественностью инфекции (m.o.i.) и ретровирусные супернатанты от клеток GP2-293 (BD Biosciences, Bedford, MA). Селекцию HUVEC проводили с использованием 300 мкг/мл гигромицина B (Invitrogen, Carlsbad, CA), и селекцию Mm5MT-FGF4 проводили в 1 мг/мл G418 (Gibco-Invitrogen, Grand Island, NY), с двойными трансфектантами в 300 мкг/мл гигромицина B.
Вестерн-блоттинг
HUVEC, трансдуцированные Ad-N1ECDFc, культивировали в бессывороточной среде для эндотелия (GIBCO-Invitrogen) в течение 48 ч, и трансфектанты Mm5MT-FGF4 культивировали в DMEM. Вестерн-блоты получали с использованием антитела против Fc человека (Pierce, Rockford, IL).
Количественная RT-PCR
Трансфектанты Mm5MT культивировали в течение 7 суток с носителем или 1 мкМ PD166866 (ингибитор киназы рецептора FGF), тотальную РНК выделяли (набор RNeasy mini-kit, Qiagen, Valencia, CA), и синтезировали первую цепь кДНК (SuperscriptTM First-Strand Synthesis System, Invitrogen). Количественную RT-PCR для β-актина, FGF4, Jagged1, Dll1 и Dll4 (SYBER Green PCR Master Mix, 7300 Real Time PCR; Applied Biosystems, Foster City, CA) проводили в трех экземплярах, и значения нормализовывали по β-актину. Значения показаны для кратности индукции по сравнению с контролями (последовательности праймеров доступны по запросу).
Анализ передачи сигнала в кокультуре
Ингибирование ловушкой Notch1 индуцированной лигандом передачи сигнала проводили, как описано (11). Клетки HeLa трансфицировали 333 нг pBOS-Notch1, 333 нг pGA981-6 и 83 нг pLNC-LacZ с либо 666 нг pCMV-Fc, либо pHyTC-N1ECDFc (333 нг для x1, 666 нг для x2). Клетки 293 трансфицировали 680 нг pHyTc-Jagged1, pHyTc-Dll1, pHyTc-Dll4 или pHyTc-X (пустой вектор). Клетки собирали, определяли активность люциферазы через 48 ч после трансфекции (набор для анализа Enhanced Luciferase assay kit, BD PharMingen, San Diego, CA), и определяли активность β-галактозидазы (набор Galacto-Light Plus kit, Applied Biosystems). Анализы проводили в трех экземплярах.
Анализ морфогенеза эндотелия в кокультуре
Морфогенез HUVEC оценивали, как описано (11), с модификацией добавлением кокультивирования HUVEC, трансдуцированных Ad-Notch4, с трансфектантами ловушка Notch1-HUVEC или Fc-HUVEC. Ad-GFP при m.o.i. 10 котрансдуцировали в HUVEC с Ad-LacZ или Ad-Notch4 при m.o.i. 30 и через 48 ч высевали на фибриновые гели (24-луночные планшеты, 1,5×104 клеток/лунка). Стабильные трансфектанты HUVEC-имитация (HUVEC-X), HUVEC-Fc или HUVEC-N1ECDFc высевали в количестве 1,35×105 клеток/лунка, и через 3 ч добавляли носитель или 200 нМ соединения E. Через семь суток морфогенез HUVEC вычисляли как количество GFP-положительных клеток с отростками по сравнению с общим количеством GFP-положительных клеток/поле.
Модель опухоли Mm5MT
Самок мышей C3H в возрасте 6-8 недель (Taconic, Hudson, NY) подвергали подкожной имплантации 106 трансфектантов Mm5MT (N=10 каждого). Диаметры опухолей измеряли штангенциркулями и вычисляли их объем (длина (мм) × ширина (мм)2 × 1/2). Опухоли собирали на 22 сутки и анализировали. Эксперименты проводили по три раза.
Иммуногистохимия
5 мкм свежезамороженных срезов ткани Mm5MT повергали иммунному окрашиванию (15) (см. дополнительные данные для списка антител). Количественное определение CD31 проводили с использованием микроскопа Eclipse E800 и ImagePro Plus v.4.01 (Silver Spring, MD). Проводили измерение 20 различных полей/предметное стекло, и вычисляли плотности как (площадь специфичного окрашивания)/(общая площадь, каждое поле). Данные представлены в качестве отношения среднего значения отношений средних плотностей для каждого трансфектанта Mm5MT относительно имитирующего трансфектанта Mm5MT.
Модель опухоли NGP
Модель опухоли NGP ранее была подробно описана (16). Клетки NGP трансфицировали LacZ или N1ECDFc, как описано выше, и 106 клеток NGP-LacZ или NGP-N1ECDFc имплантировали внутрипочечно мышам NCR nude в возрасте 4-6 недель (Taconic, Germantown, NY; NGP-LacZ n=11, NGP-N1ECDFc n=13). Через 6 недель опухоли собирали для анализа. 5-мкм залитые парафином срезы подвергали иммунному окрашиванию на CD-31/PECAM и α-актина гладких мышц (αSMA). Для детекции апоптоза (анализ TUNEL) авторы настоящего изобретения использовали набор Apoptag Red in situ Kit (Chemicon). Сигнал подвергали количественному определению путем фотографирования 20-23 случайным образом отобранных полей для каждой ткани, исключая области нормальной почки. Каждый кадр фотографировали как в красном (сигнал TUNEL), так и в зеленом каналах. С использованием Adobe Photoshop сигналы зеленых каналов вычитали для устранения аутофлуоресценции эритроцитов. Произвольным образом выбирали единообразный порог красного канала, и общую площадь сигнала измеряли в 4 опухолях NGP-N1ECDFc и 3 опухолях NGP-LacZ. Аналогичным образом проводили количественное определение эритроцитов.
Статистический анализ
Значимость в количественных исследованиях оценивали с использованием тестов Tukey-Kramer (количественное определение CD31) и анализа Kruskal-Wallis (все другие).
Результаты
Ловушка Notch1 ингибирует индуцируемую лигандом передачу сигнала Notch в клетках, экспрессирующих Notch1
Ловушка Notch1 основана на эктодомене Notch1, слитом с Fc IgG человека, и она секретируется, как определено блоттингом среды, кондиционированной HUVEC, инфицированными аденовирусом с ловушкой Notch1 (Ad-N1ECDFc) (фиг. 32A). Авторы настоящего изобретения оценивали активность ловушки Notch1 с использованием анализов передачи сигнала в кокультуре (11). Клетки 293, экспрессирующие лиганды Notch (Jagged1, Dll1, Dll4), активировали передачу сигнала Notch при культивировании с клетками HeLa, экспрессирующими Notch1, что измеряли по активности CSL-люциферазного репортера (фиг. 32B). Экспрессия ловушки Notch1 либо в клетках HeLa (фиг. 32B), либо в клетках 293 (данные не представлены) блокировала передачу сигнала Notch1 в анализах кокультуры, указывая на то, что ловушка Notch1 препятствует активации посредством Jagged1, Dll1 или Dll4.
Ловушка Notch1 блокирует морфогенез HUVEC, индуцированный Notch4
Экспрессия Notch4 индуцировала удлинение клеток HUVEC, культивированных на фибриновых гелях (фиг. 32C), наподобие морфологическим изменениям, индуцируемым VEGF и FGF2 (17, 18). Фибрин может индуцировать Jagged1 в EC (19). Авторы настоящего изобретения тестировали гипотезу, что такое удлинение отражает эндогенную активацию лигандом Notch Notch4, трансдуцированного в HUVEC, с использованием либо соединения E (CE) (-ингибитор секретазы (GSI)), либо ловушки Notch1. По сравнению с носителем обработка 200 нМ CE отчетливо ингибировала удлинение в Notch4-HUVEC, (фиг. 32C, верхние панели, 32D). Снижение прорастания было значимым (фиг. 32D, p<0,0001) как для обработки соединением E, так и для трансдукции N1ECDFc; данные представлены в качестве среднего значения ± SD). Коэкспрессия Notch4 + ловушка Notch1 в HUVEC аналогичным образом блокировала удлинение эндотелия относительно контроля в виде Notch4 + Fc (фиг. 32C, нижние панели; 32D). В совокупности эти данные указывают на то, что активация рецептора Notch является как необходимой, так и достаточной для индукции удлинений HUVEC в этом анализе, и что ловушка Notch1 функционирует сходным образом с GSI, далее подтверждая ее активность в качестве ингибитора рецептора Notch.
FGF4 индуцировал экспрессию лигандов Notch, Jagged1 и Dll1 в клетках опухоли молочной железы мыши Mm5MT
Сверхэкспрессия FGF4 в клетках Mm5MT обеспечивала способность к образованию опухоли в клоногенных анализах и анализах ксенотрансплантатов (данные не представлены). Поскольку передача сигнала HGF/MAPK индуцировала экспрессию Jagged1 в HNSCC (10), авторы настоящего изобретения заинтересовались, стимулирует ли FGF4 экспрессию лигандов Notch в клетках Mm5MT. Авторы настоящего изобретения выявили активацию Jagged1 и Dll1 в трансфектантах Mm5MT-FGF4 с использованием количественной PCR (экспрессия Dll4 была не измененной) (фиг. 33A). Ингибитор FGFR-киназы PD166866 подавлял индукцию как Jagged1, так и Dll1 в трансфектантах Mm5MT-FGF4 (фиг. 33C), указывая на то, что индуцированная FGF4 экспрессия Jagged1 и Dll1 требует передачи сигнала FGFR. Иммуноблоттинг подтвердил активацию белка Jagged1 в клетках Mm5MT-FGF4 (фиг. 33B), и иммунное окрашивание продемонстрировало удивительно повышенные уровни Jagged1 в опухолях Mm5MT-FGF4 (фиг. 33D). Кроме того, Notch4 выявлялся в эндотелии опухоли Mm5MT-FGF4 (не представлено).
Экспрессия ловушки Notch1 ингибировала ангиогенез и рост опухолей Mm5MT-FGF4 у мышей
Авторы настоящего изобретения предположили, что опухоли Mm5MT-FGF4, экспрессирующие Jagged1, запускают ангиогенез путем передачи сигнала через эндотелиальные рецепторы Notch. Таким образом, авторы настоящего изобретения оценивали эффект экспрессии ловушки Notch1 на рост ксенотрансплантата Mm5MT-FGF4 у мышей. Способность к образованию опухолей у Mm5MT-FGF4, стабильно сверхэкспрессирующих либо Fc, либо ловушку Notch1, была неизмененной в клоногенном анализе (данные не представлены). Однако рост ксенотрансплантата Mm5MT-FGF4-N1ECDFc был значительно замедлен по сравнению как с имитирующими трансфектантами Mm5MT-FGF4, так и с Fc-трансфектантами Mm5MT-FGF4, указывая на то, что ингибирование Notch нарушило критический элемент в образовании опухоли (фиг. 34A). Иммунное окрашивание по эндотелиальному маркеру CD31/PECAM показало выраженное ингибирование ангиогенеза в опухолях Mm5MT-FGF4-N1ECDFc (фиг. 34B). В соответствии с потребностью в Notch при сборке сосудов, EC выглядели как открепленные единичные клетки или небольшие группы, с небольшим количеством выявленных организованных сосудов. Количественный анализ окрашивания антителом против CD31 продемонстрировал снижение на 58% плотности микрососудов в опухолях, экспрессирующих ловушку Notch1 (P<0,001, как для Mm5MT-FGF4-X, так и для Mm5MT-FGF4-Fc относительно Mm5MT-FGF4-N1ECDFc; данные представлены в качестве среднего значения ± SD; фиг. 34C).
Экспрессия ловушки Notch1 нарушала ангиогенез в ксенотрансплантатах нейробластомы NGP человека
Ксенотрансплантаты NGP у мышей образуют зрелую упорядоченную сосудистую сеть, которая является сравнительно устойчивой к блокаде VEGF (16). Для определения того, приводит ли активация рецептора Notch к ангиогенезу NGP, авторы настоящего изобретения трансфицировали клетки NGP посредством N1ECDFc, как указано выше. Аналогично результатам, наблюдаемым для клеток Mm5MT-FGF4-N1ECDFc, рост клеток NGP-N1ECDFc не изменялся при трансфекции (не представлено). Однако жизнеспособность ксенотрансплантата в значительной степени нарушалась (фиг. 35A), со значимо повышенным апоптозом опухолевых клеток (P=0,0002, TUNEL-положительные клетки в опухолях NGP-N1ECDFc относительно NGP-LacZ, фиг. 35B). Внутриопухолевая геморрагия значимо повышалась в опухолях NGP-N1ECDFc, указывая на то, что сосуды были физически разрушенными (P<0,0001, фиг. 36C). Иммунное окрашивание компонента базальной мембраны сосудов, коллагена IV, показало общее уменьшение сосудов, с уменьшенным ветвлением, хотя остальные коллагеновые оболочки выглядели гладкими и интактными (не представлено). Однако иммунное окрашивание EC и клеток стенки сосудов (VMC) (с использованием антител против CD31 и антител против αSMA, соответственно) показало нарушение этих в норме непрерывных клеточных слоев. Отдельные клетки сосудов выглядели неправильными, и беспорядочно откреплялись друг от друга, с утратой непрерывности сосудов (фиг. 35D). Взятые вместе, эти результаты указывают на то, что экспрессия ловушки Notch1 нарушала взаимодействия эндотелия и VMC в сосудах опухоли, вызывая нестабильность, геморрагию и дефектную перфузию опухолевых тканей.
Обсуждение
В недавних сообщениях подтверждается критическая роль лиганда Notch Dll4 в ангиогенезе и демонстрируется, что блокада Dll4 может эффективно подавлять рост опухоли путем разрушения сосудистой сети (8, 9). В этом исследовании авторы настоящего изобретения показали, что блокада функции рецептора Notch с использованием новой конструкции, образованной из эктодомена Notch1, также эффективно снижает перфузию опухоли, хотя ее эффекты на сосудистую сеть разнообразны. Ловушка Notch1 ингибировала передачу сигнала, индуцированную связыванием лигандов Jagged1, Dll1 и Dll4 с Notch1. В соответствии с ролью активации рецептора Notch в неоангиогенезе, сверхэкспрессия Notch4 индуцировала удлинение эндотелиальных клеток, которое может быть предотвращено блокированием передачи сигнала Notch посредством либо ловушки Notch1, либо GSI. Хотя ловушка Notch1 не ингибировала рост опухолевых клеток in vitro, экспрессия ловушки Notch1 ингибировала рост и ангиогенез ксенотрансплантатов Mm5MT-FGF4, в которых повышена экспрессия Jagged1. Аналогично экспрессия ловушки Notch1 не оказывала эффекта на пролиферацию опухолевых клеток NGP in vitro, однако нарушала сосуды и жизнеспособность опухоли in vivo.
Сверхэкспрессия Notch4 в HUVEC была достаточной для индукции удлинения эндотелия на фибриновом геле без экзогенной экспрессии лигандов Notch. Поскольку известно, что фибрин индуцирует экспрессию Jagged1 в EC и, таким образом, может функционировать, запуская экспрессию Jagged1 в HUVEC в этом анализе, авторы настоящего изобретения полагают, что это вызывает активацию Notch4. В анализах передачи сигнала в кокультуре HeLa ловушка Notch1 ингибировала передачу сигнала через взаимодействие лиганд-рецептор Notch1. Авторы настоящего изобретения были неспособны аналогичным образом оценить активность Notch4, поскольку Notch4 плохо процессировался и презентировался в клетках HeLa (не представлено). Однако процессированный Notch4 выявляется на HUVEC после аденовирусной трансдукции Notch4 (не представлено), указывая на то, что ловушка Notch1 может блокировать индуцируемую лигандом активацию Notch4.
Множество ролей, недавно продемонстрированных для передачи сигнала Notch в образовании опухоли, повышают привлекательность этого каскада в качестве потенциальной мишени для терапии злокачественной опухоли. Хотя активация Notch, вероятно, функционирует непосредственно при злокачественной трансформации в опухолях человека (20, 21), также она может требоваться для ангиогенеза (8, 9). Интересно, что индукция лиганда Notch может регулироваться сигналами факторов роста. Например, Jagged1 индуцируется в опухолевых клетках посредством HGF (10), и Dll4 индуцируется в EC посредством VEGF (22). Здесь, авторы настоящего изобретения показывают, что FGF4 может сходным образом стимулировать экспрессию Jagged1 и Dll1 в клетках Mm5MT мыши. Ловушка Notch1 снижала рост опухоли Mm5MT-FGF4 и ангиогенез in vivo, но не влияла на способность к образованию опухоли in vitro. Таким образом, эти результаты позволяют предположить, что для неопластического роста в этой системе требуется активация рецептора Notch в сосудах Mm5MT, а не в клетках опухоли.
Хотя ксенотрансплантаты как Mm5MT-FGF4, так и NGP проявляли значительное нарушение сосудистой сети опухоли после экспрессии ловушки Notch1, различия в фенотипе сосудов, наблюдаемые в этих моделях, указывают на то, что опухолеспецифичные паттерны функции Notch могут точно регулировать сборку сосудов. Опухоли Mm5MT-FGF4 пролиферируют быстро и образуют плотные, беспорядочные эндотелиальные сети, относительно лишенные привлеченных VMC. Эти незрелые сосудистые русла экспрессируют Dll4 (данные не представлены) и в значительной степени устраняются путем экспрессии ловушки Notch1, оставляя небольшие группы или отдельные EC в паренхиме опухоли. В соответствии с этой исходной неспособностью образовывать сосудистые сети, экспрессирующие ловушку остатки опухоли не являются некротическими и являются значительно меньшими, чем контроли. Напротив, в опухолях NGP развивается зрелое сосудистое сплетение с практически однородным покрытием эндотелия VMC. Сосуды NGP экспрессируют Notch1 и относительно небольшое количество Dll4 (не представлено). Экспрессия ловушки Notch1 в опухолях NGP вызывает внутриопухолевую геморрагию и некроз с утратой непрерывности сосудов, указывая на то, что перфузируемые сосуды становятся нестабильным после того, как происходит рост опухоли до некоторой степени.
В совокупности, эти данные обеспечивают основание для модели, в которой передача сигнала Notch контролирует множество аспектов ангиогенеза опухоли. Хотя активация Notch широко требуется для неоангиогенеза, отдельные белки Notch могут по-разному регулировать ремоделирование сосудов. Полученные авторами настоящего изобретения результаты подтверждают важность взаимодействий лиганд Notch-рецептор в сосудах опухоли и подтверждают, что нарушение функции рецептора Notch может обеспечить новый и эффективный способ нарушения ангиогенеза опухоли.
Ссылки, цитированные в четвертой серии экспериментов
1. Ferrara, N. Vascular Endothelial Growth Factor: Basic Science and Clinical Progress. Endocr. Rev., 25:581-611, 2004.
2. Jain, R., Duda, D., Clark, J., and Loeffler, J. Lessons from phase III clinical trials on anti-VEGF therapy for cancer. Nat Clin Pract Oncol. 2006 Jan; 3 (1):24-40., 3:24-40, 2006.
3. Kopan, R. Notch: a membrane-bound transcription factor. J. Cell Sci., 115:1095-1097, 2002.
4. Shawber, C. and Kitajewski, J. Notch function in the vasculature: insights from zebrafish, mouse and man. Bioessays., 26:225-234, 2004.
5. Gale, N. W., Dominguez, M. G., Noguera, I., Pan, L., Hughes, V., Valenzuela, D. M., Murphy, A. J., Adams, N. C, Lin, H. C, Holash, J., Thurston, G., and Yancopoulos, G. D. Haploinsufficiency of delta-like 4 ligand results in embryonic lethality due to major defects in arterial and vascular development. Proc Natl Acad Sci 101:15949-15954, 2004.
6. Patel, N. S., Li, J.-L., Generali, D., Poulsom, R., Cranston, D. W., and Harris, A. L. Up-regulation of Delta-like 4 Ligand in Human Tumor Vasculature and the Role of Basal Expression in Endothelial Cell Function. Cancer Res., 65:8690-8697, 2005.
7. Patel, N. S., Dobbie, M. S., Rochester, M., Steers, G., Poulsom, R., Le Monnier, K., Cranston, D. W., Li, J.-L., and Harris, A. L. Up-Regulation of Endothelial Delta-like 4 Expression Correlates with Vessel Maturation in Bladder Cancer. Clin Cancer Res, 12:4836-4844, 2006.
8. Ridgway, J., Zhang, G., Wu, Y., Stawicki, S., Liang, W. C., Chanthery, Y., Kowalski, J., Watts, R. J., Callahan, C., Kasman, I., Singh, M., Chien, M., Tan, C., Hongo, J. A., de Sauvage, F., Plowman, G., and Yan, M. Inhibition of D114 signalling inhibits tumour growth by deregulating angiogenesis. Nature, 444:1083-1087, 2006.
9. Noguera-Troise, I., Daly, C., Papadopoulos, N. J., Coetzee, S., Boland, P., Gale, N. W., Lin, H. C., Yancopoulos, G. D., and Thurston, G. Blockade of D114 inhibits tumour growth by promoting nonproductive angiogenesis. Nature, 444:1032-1037, 2006.
10. Zeng, Q., Li, S., Chepeha, D. B., Giordano, T. J., Li, J., Zhang, H., Polverini, P. J., Nor, J., Kitajewski, J., and Wang, C-Y. Crosstalk between tumor and endothelial cells promotes tumor angiogenesis by MAPK activation of Notch signaling. Cancer Cell, 8:13-23, 2005.
11. Das, I., Craig, C, Funahashi, Y., Jung, K. -M., Kim, T.-W., Byers, R., Weng, A. P., Kutok, J. L., Aster, J. C., and Kitajewski, J. Notch Oncoproteins Depend on {gamma}-Secretase/Presenilin Activity for Processing and Function. J. Biol Chem., 279:30771-30780, 2004.
12. Shawber, C. J., Das, I., Francisco, E., and Kitajewski, J. A. N. Notch Signaling in Primary Endothelial Cells. Ann NY Acad Sci, 995:162-170, 2003.
13. Hardy, S., Kitamura, M., Harris-Stansil, T., Dai, Y., and Phipps, M. L. Construction of adenovirus vectors through Cre-lox recombination. J. Virol., 71:1842-1849, 1997.
14. Jaffe, E., Nachman, R., Becker, C., and Minick, C. Culture of human endothelial cells derived from umbilical veins. Identification by morphologic and immunologic criteria. J. Clin. Invest., 52:2745-2756, 1973.
15. Vorontchikhina, M. A., Zimmermann, R. C., Shawber, C. J., Tang, H., and Kitajewski, J. Unique patterns of Notch1, Notch4 and Jagged1 expression in ovarian vessels during folliculogenesis and corpus luteum formation. Gene Expression Patterns, 5:701-709, 2005.
16. Kim, E. S., Serur, A., Huang, J., Manley, C. A., McCrudden, K. W., Frischer, J. S., Soffer, S. Z., Ring, L., New, T., Zabski, S., Rudge, J. S., Holash, J., Yancopoulos, G. D., Kandel, J. J., and Yamashiro, D. J. Potent VEGF blockade causes regression of coopted vessels in a model of neuroblastoma. Proc Natl Acad Sci U S A, 99:11399-11404, 2002.
17. Montesano R. and L., O. Phorbol esters induce angiogenesis in vitro from large-vessel endothelial cells. J. Cell Physiol., 130:284-291, 1987.
18. Koolwijk P., van Erck M. G., de Vree W. J., Vermeer M. A., Weich H. A., Hanemaaijer R., and V. W., v. H. Cooperative effect of TNFalpha, bFGF, and VEGF on the formation of tubular structures of human microvascular endothelial cells in a fibrin matrix. Role of urokinase activity. J. Cell Biol, 132:1177-1188, 1996.
19. Zimrin, A. B., Pepper, M. S., McMahon, G. A., Nguyen, F., Montesano, R., and Maciag, T. An Antisense Oligonucleotide to the Notch Ligand Jagged Enhances Fibroblast Growth Factor-induced Angiogenesis in Vitro. J Biol Chem, 271:32499-32502, 1996.
20. Nickoloff, B., Osborne, B., and L., M. Notch signaling as a therapeutic target in cancer: a new approach to the development of cell fate modifying agents. Oncogene, 22:6598-6608, 2003.
21. Radtke, F. and Raj, K. THE ROLE OF NOTCH IN TUMORIGENESIS: ONCOGENE OR TUMOUR SUPPRESSOR? Nature Reviews Cancer, 3:756-767, 2003.
22. Liu, Z.-J., Shirakawa, T., Li, Y., Soma, A., Oka, M., Dotto, G. P., Fairman, R. M., Velazquez, O. C., and Herlyn, M. Regulation of Notchl and D114 by Vascular Endothelial Growth Factor in Arterial Endothelial Cells: Implications for Modulating Arteriogenesis and Angiogenesis. Mol. Cell. Biol. 23:14-25, 2003.
Пятая серия экспериментов
Notch в качестве терапевтической мишени при раке яичника
Эпителиальная карцинома яичника является основной причиной смерти от гинекологической злокачественной опухоли в США. Пациенты страдают в результате неспособности диагностировать заболевания на ранней стадии и от отсутствия новых лекарственных средств, направленных против этой опухоли. Фактор роста эндотелия сосудов (VEGF) продуцируется злокачественными эпителиальными клетками рака яичника, и он, в свою очередь, запускает ангиогенез опухоли, который питает опухоль [1]. Недавние клинические испытания демонстрируют, что нацеливание на VEGF терапевтического вмешательства может в некоторых случаях улучшить исход [2]. Таким образом, антиангиогенные лекарственные средства были утверждены в качестве подхода для лечения рака яичника, однако для достижения этой цели требуется проведение большей работы. Авторы настоящего изобретения идентифицировали каскад передачи сигнала Notch в качестве нового ангиогенного каскада как при физиологическом, так и при патологическом ангиогенезе [3, 4]. Notch представляет собой рецептор клеточной поверхности (фигура 1 - Notch1), который обеспечивает определение клеточной судьбы, выживание клеток и пролиферацию. В лаборатории авторов настоящего изобретения разработан ингибитор Notch, называемый ловушкой Notch (схематично представленной на фигуре 1), представляющий собой слитый белок, содержащий внеклеточный домен Notch1, слитый с Fc-меткой (N1ECDFc), который может ингибировать зависимую от лиганда передачу сигнала Notch (данные не представлены). Авторы настоящего изобретения продемонстрировали, что ловушка Notch может блокировать индуцируемый VEGF ангиогенез и ангиогенез опухоли в модели опухоли Вильмса на мышах (данные не представлены). Авторы настоящего изобретения получили клетки рака яичника SKOV3, которые сверхэкспрессируют ловушку Notch, SKOV3-N1ECDFc. Авторы настоящего изобретения выявили, что экспрессия ловушки Notch в клетках SKOV3 значимо ингибировала рост опухоли при ксенотрансплантации мышам (фигура 36). Таким образом, ловушка Notch блокирует рост рака яичника. Авторы настоящего изобретения полагают, что это ингибирование нацелено на ангиогенез в опухоли. Кроме того, авторы настоящего изобретения изучили образцы рака яичника человека и выявили, что некоторые лиганды Notch и рецепторы Notch в высокой степени экспрессируются в сосудах опухоли, ассоциированных с раком яичника, что, таким образом, поддерживает гипотезу о том, что можно проводить нацеливание на Notch в сосудах опухоли яичника человека и, в конечном итоге, блокировать их рост.
В этом исследовании тестируется гипотеза о том, что передача сигнала Notch запускает ангиогенез в опухоли при раке яичника. Кроме того, авторы настоящего изобретения полагают, что ингибирование Notch с использованием "ловушки Notch" будет блокировать рост опухоли. Авторы определят, направлено ли действие ловушки Notch против сосудов опухоли или против роста опухолевых клеток, или против обоих из них. Общей целью является установление ловушки Notch в качестве терапевтического средства для лечения рака яичника.
Конкретные цели:
Конкретная цель 1: Определить, блокирует ли ловушка Notch рост ксенотрансплантата опухоли из клеток SKOV3 или OVCAR3, и определить, нацелена ли ловушка Notch на ангиогенез опухоли.
Конкретная цель 2: Модифицировать конструкцию ловушки Notch для получения вариантов с повышенной эффективностью/стабильностью.
Конкретная цель 3: Использовать очищенные ловушки Notch для блокирования ксенотрансплантатов опухоли яичника у мышей, также в сочетании со стандартными химиотерапевтическими средствами.
Стратегия исследования:
Конкретная цель 1: Определить, блокирует ли ловушка Notch рост ксенотрансплантата опухоли из клеток SKOV3 или OVCAR3, и определить, нацелена ли ловушка Notch на ангиогенез опухоли.
Предварительные результаты авторов настоящего изобретения демонстрируют, что опухолевые клетки SKOV3 с запрограммированной экспрессией ловушки Notch1 блокируют рост ксенотрансплантатов рака яичника (фиг. 36). Воспроизведение этого открытия будет проведено на другой клеточной линии рака яичника, OVCAR3. Ловушка Notch может ингибировать рост клеток опухоли, сосудов опухоли или и тех, и других. Для определения того, нацелена ли ловушка Notch на опухолевые клетки, авторы определят, является ли рост линий рака яичника, экспрессирующих ловушку Notch, более слабым в анализах на мягком агаре. Для определения того, нацелена ли ловушка на ангиогенез опухоли, авторы настоящего изобретения проведут оценку ксенотрансплантированных опухолей в отношении признаков такого ингибирования. Показатели ангиогенеза опухоли для контрольных ксенотрансплантатов будут включать оценку плотности микрососудов, пролиферативный индекс эндотелиальных клеток опухоли и визуализацию сосудов опухоли посредством перфузии лектина. Показатели ингибирования ангиогенеза опухоли в ксенотрансплантатах, экспрессирующих ловушку Notch, будут включать оценку апоптотических эндотелиальных клеток, уменьшение микрососудов опухоли и снижение накопления асцитической жидкости.
Конкретная цель 2: Модифицировать конструкцию ловушки Notch для получения вариантов с повышенной эффективностью/стабильностью.
Существующая ловушка Notch1, хотя и является эффективной в качестве средства, блокирующего Notch, может не легко поддаваться очистке, поскольку она представляет собой относительно крупный белок. Авторы настоящего изобретения предлагают разработать варианты ловушки Notch1, которые охватывают меньшие части внеклеточного домена. Эти варианты будут подвергать скринингу в качестве ингибиторов передачи сигнала Notch в анализах на основе клеточных культур. Ингибиторные варианты также будут подвергать скринингу в отношении: их эффективности секреции из продуцирующих клеток, их стабильности после секреции, их растворимости и простоты очистки с помощью аффинной метки Fc. Очищенные варианты будут инъецировать мышам для оценки потенциальной токсичности.
Конкретная цель 3: Использовать очищенные ловушки Notch для блокирования ксенотрансплантатов опухоли яичника у мышей, также в сочетании со стандартными химиотерапевтическими средствами.
Очищенные ловушки, согласно конкретной цели 2, будут использовать либо в качестве отдельных средств, либо в сочетании с химиотерапией для оценки их эффективности против ксенотрансплантатов рака яичника (SKOV3/OVCAR3). С использованием очищенной ловушки Notch в качестве единственного средства, авторы настоящего изобретения предпримут попытку воспроизвести блок роста ксенотрансплантата опухоли, наблюдаемый в экспериментах согласно конкретной цели 1 и определить оптимальную концентрацию для ингибирования. Для осуществления этого, авторы настоящего определения будут определять оптимальную дозу, схему дозирования и длительность лечения, требуемую для блокирования роста ксенотрансплантата SKOV3/OVCAR3 у мышей. Далее, авторы настоящего изобретения будут использовать ловушку Notch в сочетании с паклитаксолом. Оптимальную дозу ловушки Notch будут использовать с паклитаксолом или без него для определения эффективности блокирования роста ксенотрансплантата.
Эффект: Это исследование нацелено непосредственно на продвижение в области лечения рака яичника. В клинических исследованиях ранее был установлен успех лечения рака яичника блокирующими VEGF средствами. Мало новых лекарственных средств было разработано для дополнения химиотерапевтического лечения. Несмотря на этот успех, нацеливание на VEGF для блокирования роста опухоли может только ограничить рост до некоторой степени. Также оно может привести к росту новых сосудов в опухоли, которые являются устойчивыми к блокаде VEGF. Авторы настоящего изобретения предложили нацеливание на альтернативный ангиогенный каскад в опухоли, вовлеченный в рак яичника, каскад передачи сигнала Notch. Это исследование приведет к продвижению в лечении посредством разработки новой терапевтической молекулы, ловушки Notch. В предварительных исследованиях авторов настоящего изобретения уже было установлено, что ловушка Notch может блокировать рост рака яичника в модели на мышах. Таким образом, эффект разработки ловушки Notch в качестве терапевтической молекулы может быть высоко значимым.
Инновация: Недавняя разработка авторов настоящего изобретения ловушки Notch представляет собой новую и ранее неиспытанную модель для лечения рака яичника. Ни одно другое опубликованное исследование еще не вовлекает этот каскад в лечение рака яичника, и в то же время предварительные данные авторов настоящего изобретения определяют его как ключевую область для исследования. Кроме того, несмотря на недавний успех блокады VEGF в качестве нового терапевтического подхода для лечения рака яичника, авторы настоящего изобретения считают, что этот подход может потребовать дополнения ингибированием других ангиогенных каскадов, таких как Notch.
Ссылки, цитированные в пятой серии экспериментов
1. Abu-Jawdeh, G. M., et al., Strong expression of vascular permeability factor (vascular endothelial growth factor) and its receptors in ovarian borderline and malignant neoplasms. Lab Invest, 1996. 74(6): p. 1105-15.
2. Monk, B. J., et al., Activity of bevacizumab (rhuMAB VEGF) in advanced refractory epithelial ovarian cancer. Gynecol Oncol, 2005. 96(3): p. 902-5.
3. Shawber, C., J. J. Kandel, and J. Kitajewski, Notch: cell fate determination from vascular development to human vasculopathy. Drug Discovery Today: Disease Models, 2004. 1(3): p. 351-8.
4. Zeng, Q., et al., Crosstalk between tumor and endothelial cells promotes tumor angiogenesis by MAPK activation of Notch signaling. Cancer Cell, 2005. 8(1): p. 13-23.
Шестая серия экспериментов
Каскад Foxo/Notch контролирует миогенную дифференцировку и спецификацию по типу волокна
Транскрипционные факторы Foxo регулируют метаболизм и дифференцировку клеток. В отличие от Foxo-зависимых метаболических каскадов и генов-мишеней, механизмы, посредством которых эти белки регулируют дифференцировку, не были изучены. Активация передачи сигнала Notch имитирует эффекты повышения функции Foxo на клеточную дифференцировку. С использованием дифференцировки мышц в качестве модельной системы, авторы настоящего изобретения показали, что Foxo физически и функционально взаимодействует с Notch путем обеспечения устранения корепрессора от эффектора Notch Csl, ведущего к активации генов-мишеней Notch. Ингибирование дифференцировки миобластов конститутивно активным Foxo1 частично сохраняется при ингибировании передачи сигнала Notch, в то время как утрата функции Foxo1 предотвращает ингибирование посредством Notch миогенеза и повышает экспрессию MyoD.
Таким образом, зависимое от условий устранение Foxo1 в скелетных мышцах приводит к повышенному образованию MyoD-содержащих (быстро сокращающихся) мышечных волокон и измененному типу распределения волокон за счет содержащих миогенин (медленно сокращающихся) волокон. Кооперация Notch/Foxo1 может интегрировать внешние стимулы через Notch с метаболическими стимулами через Foxo1 для регуляции поддержания и дифференцировки клеток-предшественников.
Центральным вопросом регенеративной медицины является понимание того, каким образом высокоспециализированные типы клеток появляются из недифференцированных стволовых клеток или клеток-предшественников (1). С этим вопросом тесно связан вопрос о том, как биохимические сигналы, порождаемые сигналами микроокружения и эндокринными/питательными сигналами, транскрипционно интегрируются для активации процессов клеточной дифференцировки.
Подсемейство O белков forkhead (Fox) регулирует ответ на гормоны, питательные вещества и стресс, обеспечивая выживание и метаболизм клеток. Способность к точному регулированию транскрипции Foxo необходима для контроля этих клеточных функций и в большой степени зависит от посттранскрипционных модификаций, включая фосфорилирование и ацетилирование (2). В дополнение к их роли в терминально дифференцированных клетках, белки Foxo также вовлечены в дифференцировку миобластов (3), преадипоцитов (4) и эндотелиальных клеток (5). Более того, Foxo4 регулирует дифференцировку гладкомышечных клеток сосудов посредством взаимодействий с миокардином (6). Мыши с нокаутом Foxo3 проявляют преждевременное угасание функции яичников, что согласуется с ролью этого гена в созревании фолликулов яичника (7). Механизмы, посредством которых белки Foxo контролируют дифференцировку клеток, остаются неясными, и недавние исследования с кондициональным устранением согласуются со значительной степенью функционального перекрывания среди трех изоформ Foxo в гемопоэтическом ростке (8, 9).
Каскад Notch играет важную роль в дифференцировке нервов, сосудов, мышц и эндокринной системы в процессе эмбриогенеза (10). При индуцируемом лигандом расщеплении внутриклеточный домен рецептора Notch перемещается в ядро, где он взаимодействует со связывающим ДНК белком Csl, меняя его транскрипционные свойства с супрессора транскрипции на активатор транскрипции (11). Мишени Csl включают гены Hairy и Enhancer of Split (Hes, Hey). Hes1 контролирует дифференцировку эндодермы кишечника (12), преадипоцитов (13) и нейрогенную дифференцировку (14). Активная передача сигнала Notch, или повышение функции рецептора Notch1, ингибирует дифференцировку миобластов C2C12 и 10T/2 путем супрессии транскрипции MyoD (15-21).
Примечательно, что повышение функции Foxo1 (3-5) фенокопирует активациию Notch1 (13, 17, 22, 23) в каждом контексте клеточной дифференцировки. Более того, устранение Foxo1 (24) фенокопирует устранение Notch1 (25) у мышей. Несмотря на эти интересные сходства, Foxo и Notch передают сигнал через два, по-видимому, отличающихся механизма, каскад фосфатидилинозитол-3-киназы (Foxo) и каскад Hes/Hey (Notch). В этом исследовании авторы настоящего изобретения показали, что Foxo физически и функционально взаимодействует с Notch путем обеспечения устранения корепрессора из Csl, таким образом, контролируя миогенную программу.
Миогенные предшественники происходят из стволовых клеток мезодермы (26) и превращаются в мышечные трубки посредством многостадийного процесса, завершающегося экспрессией миогенных факторов транскрипции семейства MRF (MyoD, миогенин, MRF4 и Myf5) (27). Миогенные факторы транскрипции гетеродимеризуются с белками E и обеспечивают экспрессию специфичных к мышцам генов, действуя в тесном взаимодействии со специфичными к миоцитам факторами усиления MEF2 (28).
Взрослая мышца представляет собой гетерогенную ткань, главным образом, определяемую содержанием в ней мышечных волокон (29). Различные подтипы тяжелых цепей миозина (MyHC) характеризуют различные мышечные волокна. Волокна типа I экспрессируют, главным образом, медленно сокращающиеся MyHC, а волокна типа II экспрессируют быстро сокращающиеся MyHC (29). Процесс спецификации типа волокна контролируется на множестве стадий. Во-первых, по-видимому, существует гетерогенность между миогенными клетками-предшественниками, и данные экспериментов по перекрестной трансплантации эмбрионов птиц указывают на то, что ранние предшественники приводят, главным образом, к медленным мышечным волокнам, а поздние предшественники приводят к быстрым волокнам (29). В постнатальном периоде на спецификацию типа волокна также влияют автономные факторы клеток, включая иннервацию и эндокринные сигналы/сигналы питательных веществ (28). Коактиватор Foxo Pgc1α играет критическую роль в обеспечении образования медленно сокращающихся волокон (30), и недавние данные также показали, что в этот процесс вовлечена деацетилаза Foxo Sirt1 (31). С использованием зависимого от условий мутагенеза у мышей, авторы настоящего изобретения показали, что роль Foxo1 в подавлении зависимого от MyoD миогенеза в клетках C2C12 отражается повышением содержащих MyoD мышечных волокон в дефицитных по Foxo1 скелетных мышцах, что согласуется с ключевой функцией в спецификации ростка миобластов.
Результаты
Взаимодействие передачи сигнала Foxo1 и Notch при дифференцировке C2C12
Для понимания того, взаимодействуют ли Notch и Foxo для контроля развития мышц, авторы настоящего изобретения использовали модель клеточной дифференцировки. Клетки C2C12 претерпевают миогенное превращение и слияние мышечных трубок при устранении факторов роста, процессе, ассоциированном с транслокацией Foxo1 в ядро (3). Таким образом, трансдукция аденовируса, кодирующего конститутивно активный мутант Foxo1 (Foxo1-ADA) (4), блокировала эффект устранения сыворотки на индукцию дифференцировки C2C12, что отражается ингибированием слияния миобластов (фиг. 37a-c). Напротив, ингибирование Foxo1 посредством siRNA не влияло на эти процессы (фиг. 37d).
Аналогично, конститутивно активный Notch (Notch1-IC) фенокопировал Foxo1-ADA в отношении блокирования дифференцировки миобластов (фиг. 37e). Практически все клетки трансдуцировались аденовирусами (фиг. 44). siRNA для Foxo1 эффективно подавляла экспрессию как эндогенного Foxo1, так и трансфицированного FLAG-Foxo1 (фиг. 45) дозозависимым образом, без влияния на контрольные белки или другие изоформы Foxo (фиг. 46). Ни Foxo1-ADA, ни Notch1-IC не влияли на пролиферацию C2C12 (фиг. 47).
Авторы настоящего изобретения заинтересовались, могут ли они устранить эффект Foxo1-ADA посредством ингибирования эндогенной передачи сигнала Notch. В связи с этим, авторы настоящего изобретения использовали укороченный рецептор Notch1, лишенный трансмембранного якоря и внутриклеточного домена, который действует в качестве рецептора ловушки путем связывания лигандов Notch (32, 33) (Y. F. и J. K., неопубликованное наблюдение). Ловушка не влияла на способность C2C12 претерпевать дифференцировку в ответ на устранение факторов роста (фиг. 37f), но частично сохраняла ингибирование посредством Foxo1-ADA дифференцировки миобластов (фиг. 37g). В качестве альтернативного зонда для блокирования передачи сигнала Notch, ингибитор пресенилина (PSI), соединение E (34), также сохранял ингибирование Foxo1-ADA при дифференцировке миобластов (фиг. 37h).
Для исследования эффекта Foxo1 на передачу сигнала Notch авторы настоящего изобретения котрансфицировали siRNA для Foxo1 и Notch-IC. siRNA для Foxo1 сохраняла ингибирование дифференцировки миобластов и экспрессию миозина посредством Notch1-IC (фиг. 37i), в то время как контрольная siRNA не имела эффекта (данные не представлены). Для исключения неспецифических эффектов siRNA для Foxo1 на дифференцировку миобластов, авторы настоящего изобретения создали устойчивый к siRNA для Foxo1-ADA (фиг. 48). siRNA для Foxo1 вызывала реверсию эффектов Foxo1-ADA (фиг. 37j), но не сохраняла ингибирование дифференцировки C2C12, вызываемое устойчивым к siRNA для Foxo1-ADA (фиг. 37k). Авторы настоящего изобретения представили количественный анализ этих данных на фиг. 38a, показывающий, что Foxo1 и Notch1-IC снижали уровни миозина >80%, а ловушка Notch и siRNA для Foxo1 восстанавливали их до ~70% полностью дифференцированных клеток. Авторы настоящего изобретения получили сходные данные путем проведения морфометрического анализа положительных по миозину клеток (фиг. 38b). Эти данные указывают на то, что Foxo1 требуется для эффекта Notch на дифференцировку миобластов.
Далее, авторы настоящего изобретения тестировали, влияет ли Foxo1 на дифференцировку посредством его транскрипционной функции. Для этого авторы настоящего изобретения получили мутант, дефицитный по связыванию ДНК, в каркасе мутанта ADA, путем замен N208A и H212R (DBD-Foxo1ADA) (6, 35). Авторы настоящего изобретения подтвердили, что этот мутант неспособен связывать ДНК, путем измерения активности промотора Igfbp1, канонической мишени Foxo1. Foxo1-ADA повышал активность промотора Igfbp1 в 10 раз, а DBD-Foxo1ADA не был способен к этому (фиг. 38c, левая панель). Удивительно, что в отношении ингибирования дифференцировки этот мутант был настолько же эффективным, как и компетентный в отношении связывания ДНК Foxo1-ADA (фиг. 37l). Эти данные указывают на то, что Foxo1 контролирует дифференцировку независимо от его способности связывать ДНК специфичным к последовательности образом.
Foxo1 связывается с Csl и требуется для промотора Hes1
Notch1-IC связывается с Csl и активирует его, обеспечивая экспрессию Hes и Hey (11). Исходя из результатов для мутанта DBD-Foxo1ADA, авторы настоящего изобретения тестировали, взаимодействует ли Foxo1 с Csl зависимым от Notch образом с использованием кокультуры клеток C2C12, экспрессирующих рецептор Notch1, с клетками HEK293, экспрессирующими лиганд Notch Jagged1 (обозначаемый знаком "+"), или LacZ в качестве отрицательного контроля (обозначаемого знаком "-"). Авторы настоящего изобретения предоставили несколько линий доказательств того, что Foxo1 и Csl взаимодействуют в культивируемых клетках. Авторы настоящего изобретения выявили эндогенный Foxo1 в иммунопреципитатах эндогенного Csl, и коиммунопреципитация значимо усиливалась путем активации передачи сигнала Notch (фиг. 39a). Для подтверждения специфичности взаимодействия авторы настоящего изобретения экспрессировали меченный HA Foxo1 и меченный FLAG Csl в клетках C2C12. После иммунопреципитации с антисывороткой против HA (Foxo1), авторы настоящего изобретения проводили детецию FLAG-Csl в иммуноблотах (фиг. 39b). Напротив, после иммунопреципитации с антисывороткой против FLAG (Csl), авторы настоящего изобретения проводили детекцию HA-Foxo1 в иммуноблотах (фиг. 39c). Способность к коиммунопреципитации с Csl по-видимому является специфичной к Foxo1, поскольку авторы настоящего изобретения не выявили другие изоформы Foxo в иммунопреципитатах Csl (фиг. 42). Укороченный мутант Foxo1 (Δ256, кодирующий аминокислоты 1-256) (36) сохранял способность к взаимодействию с Csl. Авторы настоящего изобретения проводили детекцию FLAG-Csl в иммунопреципитатах Myc-Δ256 (фиг. 39d), и HA-Δ256 в иммунопреципитатах FLAG-Csl (фиг. 39e), указывая на то, что Csl взаимодействует с N-концевым доменом Foxo1.
Для определения того, является ли это белок-белковое взаимодействие прямым, и картирования домена(ов) взаимодействия, авторы настоящего изобретения сначала провели анализы с "опусканием" с аффинно очищенным GST-Foxo1, продуцированным в бактериях и экспрессировали FLAG-Csl в клетках HEK293. Авторы настоящего изобретения провели детекцию ассоциации Csl с полноразмерным и N-концевым Foxo1 (аминокислоты 1-300), но не с C-концевым Foxo1 (а.к. 290-655) или GST (фиг. 40a). Далее, авторы настоящего изобретения картировали домен Csl, который взаимодействует с Foxo1, с использованием бесклеточной системы с GST-Foxo1 и GST-Flag/Csl, очищенным из бактериальных культур. Также авторы настоящего изобретения выделили полноразмерный (1-655) и N-концевой (1-300), но не C-концевой (290-655) Foxo1 в иммунопреципитатах Csl. Напротив, N-концевой Foxo1 взаимодействует с N-концевым Csl (фиг. 40b).
Авторы настоящего изобретения использовали мутанты с делецией Csl для картирования связывающего Foxo1 домена в Csl. Эти исследования указывают на то, что Foxo1 связывается с доменом, охватывающим аминокислоты 172-279 (фиг. 40c), который содержится в домене NTD Csl (37) (фиг. 40c, диаграмма). Интересно, что этот домен требуется для связывания ДНК и корепрессора, но не приводит к связыванию Notch (38, 39).
Csl связывается с консенсусной последовательностью в промоторе Hes1 (40), что, таким образом, обеспечивает пригодный анализ со считыванием данных по взаимодействию Foxo/Csl. Если последнее требуется для регуляции дифференцировки C2C12, должны удовлетворяться три предсказания: (a) Foxo1 должен выявляться в анализах иммунопреципитации с хроматином (ChIP), охватывая элемент Csl в промоторе Hes1, (b) взаимодействие должно быть зависимым от дифференцировки и (c) ингибирование дифференцировки Foxo1-ADA должно сопровождаться конститутивным связыванием с элементом Csl в промоторе Hes1. На фигуре 40d показано, что все предсказания удовлетворяются. Во-первых, авторы настоящего изобретения провели ChIP с использованием праймеров, охватывающих участок связывания Csl Hes1 в дифференцирующихся клетках C2C12. Авторы настоящего изобретения провели детекцию эндогенного Foxo1, Notch1 и Csl в иммунопреципитатах от недифференцированных клеток (фиг. 40d. дорожки Endog, 0 сутки). Поскольку амплифицированная PCR последовательность не содержит участков связывания forkhead, авторы настоящего изобретения заключили, что Foxo1 связывается с этим фрагментом ДНК через Csl. Более того, связывание как Foxo1, так и Notch1 снижалось по мере того, как клетки становились дифференцированными (1 и 2 сутки). Когда авторы настоящего изобретения трансдуцировали клетки конститутивно ядерным Foxo1-ADA, дифференцировка ингибировалась (фиг. 37c) и мутантный Foxo1 устойчиво связывался с промотором Hes1, как и Csl и Notch1 (фиг. 40d, дорожки Foxo1-ADA).
Далее, авторы настоящего изобретения анализировали экспрессию Hes1. Было предсказано, что уровни Hes1 должны коррелировать с оккупацией промотора Hes1 посредством Foxo1 и Notch1. Действительно, экспрессия мРНК Hes1 снижалась по мере того, как снижалось связывание Foxo1 и Notch1 с Csl, в то время как уровни белка миозина повышались (фиг. 40d). Для исключения прямого эффекта Foxo1 на транскрипцию Csl, авторы настоящего изобретения провели анализы репортерных генов с промотором Csl. Foxo1 не активировали экспрессию репортерного гена Csl, несмотря на наличие десяти повторов связывающего forkhead участка в промоторе Csl (41) (данные не представлены). Более того, экспрессия Csl не изменялась в клетках C2C12, экспрессирующих Foxo1-ADA (не представлено). Эти данные указывают на то, что Foxo1 регулирует Notch-зависимую дифференцировку посредством белок/белковых взаимодействий с Csl.
Foxo1 требуется дли индукции посредством Notch генов Hes и Hey через Csl
Авторы настоящего изобретения исследовали способность Foxo1-ADA обеспечивать экспрессию эндогенных Hes1, Hes5 и Hey1 в клетках C2C12. Как Foxo1-ADA, так и Notch1-IC повышали экспрессию этих трех генов, в то время как siRNA для Foxo1 ингибировала экспрессию Hes1, Hes5 и Hey1, индуцируемую Notch1-IC (фиг. 41a). siRNA для Foxo1 не имела эффекта на экспрессию Hes1, Hes5 и Hey1 в клетках, лишенных факторов роста (фиг. 41a).
Авторы настоящего изобретения сфокусировали следующую группу экспериментов на Hes1, как прототипном гене-мишени Notch. Авторы настоящего изобретения тестировали способность Foxo1 регулировать транскрипцию Hes1 с использованием репортерных анализов с промотором Hes1, а также измерений экспрессии Hes1. Foxo1-ADA и Notch1-IC индуцировали активность промотора Hes1 в 1,8 и 2,5 раз, соответственно. Котрансфекция Foxo1-ADA с Notch1-IC вызывала повышение в 2,5 раза (фиг. 41b). Котрансфекция siRNA для Foxo1 подавляла индуцируемую Notch активность Hes1 дозозависимым образом, в то время как контрольная siRNA не имела эффекта (фиг. 41b). Авторы настоящего изобретения получили сходные результаты для синтетического репортера Hes1, содержащего четыре тандемных повтора Csl-связывающего мотива (фиг. 50). Более того, DBD-Foxo1ADA был способен индуцировать активность репортерного гена Hes1 даже в большей степени, чем Foxo1-ADA, подтверждая, что связывание ДНК не требуется для активации Hes1 посредством Foxo1 (фиг. 38c, правая панель).
Неспособность Notch1-IC индуцировать экспрессию Hes1 в клетках, экспрессирующих siRNA для Foxo1, указывает на то, что Foxo1 требуется для взаимодействия Csl/Notch. Таким образом, авторы настоящего изобретения исследовали связывание Foxo1 и Notch1 с промотором Hes1 в системе кокультуры. Авторы настоящего изобретения кокультивировали клетки C2C12, экспрессирующие Notch1 с клетками HEK293, экспрессирующими лиганд Notch Jagged1, для индукции активации эндогенной передачи сигнала Notch. Кокультивирование в присутствии экспрессирующих Jagged1 клеток повышала связывание эндогенного Foxo1 (фиг. 42a, дорожки 1-2) и Notch1 с промотором Hes1 в анализах ChIP (фиг. 42a, b, дорожки 1-2) (42). Эти данные согласуются с наблюдением, что коиммунопреципитация Foxo1 с Csl повышалась при кокультивировании (фиг. 39a). Для тестирования того, является ли связывание Foxo1 с промотором Hes1 зависимым от Csl, авторы настоящего изобретения ингибировали экспрессию Csl посредством siRNA (фиг. 51) Трансфекция siRNA для Csl ингибировала связывание как Foxo1, так и Notch1 с промотором Hes1 (фиг. 42a, дорожки 3-4), указывая на то, что они являются зависимыми от Csl. Более того, Foxo1-ADA не индуцировал экспрессию Hes1 в присутствии siRNA для Csl (фиг. 41a, дорожка 5). Результаты экспериментов ChIP подтверждались анализами промотора Hes1. Экспрессия Jagged1 или Notch1 отдельно не имела эффекта на активность Hes1, однако кокультивирование приводило к повышению в 3,7 раз активности репортерного гена Hes1 (фиг. 42c). siRNA для Foxo1 устраняла связывание Notch с промотором Hes1 в анализах ChIP (фиг. 42b, дорожки 3-4) и индукцию активности промотора Hes1 (фиг. 42c). Эти результаты указывают на то, что Foxo1 требуется для связывания Notch1 с промотором Hes1, и обеспечивают механизм, посредством которого ингибирование экспрессии Foxo1 восстанавливает дифференцировку миобластов, экспрессирующих Notch1-IC. Способность siRNA для Foxo1 ингибировать индукцию посредством Notch Hes1 в системе кокультуры исключает возможность того, что эффекты, наблюдаемые в экспериментах по дифференцировке с Notch1-IC, являются следствием нефизиологической активации передачи сигнала Notch укороченным внутриклеточным мутантом Notch1 (15).
Foxo1 обеспечивает удаление корепрессора и связывание Maml1 с Csl
Для выявления молекулярного механизма зависимой от Foxo1 активации экспрессии Hes1, авторы настоящего изобретения исследовали обмен корепрессора/коактиватора в промоторе Hes1. Активация Notch устраняла корепрессоры Ncor и Smrt (43) и привлекала коактиватор Maml1 (42) к промотору Hes1. siRNA для Foxo1 предотвращала индуцируемый Notch обмен корепрессорами (фиг. 42d). Эти данные согласуются с наблюдением, что Foxo1 связывается с областью 172-279 в Csl (фиг. 40c), который, как было показано, содержит участки связывания Ncor/Smrt (38, 39).
Для того чтобы показать, что наблюдаемые изменения в транскрипционном комплексе приводят к изменениям активности Hes1, авторы настоящего изобретения исследовали экспрессию генов-мишеней Hes1, вовлеченных в миогенез. Было предположено, что Hes1 подавляет дифференцировку миобластов путем ингибирования транскрипционного фактора bHLH MyoD без влияния на Myf5 (16, 17). Анализ экспрессии показал, что Notch1-IC или Foxo1-ADA подавляли MyoD, в то время как Myf5 был неизмененным. Ловушка Notch или siRNA для Foxo1 частично восстанавливали экспрессию MyoD (фиг. 42e).
Измененный тип состава волокон в скелетных мышцах, лишенных Foxo1
На основе клеточных данных авторы настоящего изобретения провели исследование функции Foxo1 в дифференцировке мышц in vivo с использованием зависимой от условий инактивации генов. Предсказанным исходом этого эксперимента является ускоренная дифференцировка содержащих MyoD, но не содержащих Myf5 миобластов. Поскольку MyoD является преобладающим миогенным фактором в быстрых волокнах, в то время как миогенин является преобладающим фактором в медленных волокнах (44), устранение ингибирования Foxo/Notch экспрессии MyoD должно приводить к повышенному образованию быстрых волокон, потенциально за счет медленных волокон.
Существует три изоформы Foxo у мышей: Foxo1, 3 и 4 (8, 9). Последняя преобладает в большинстве типах мышц (45), за исключением камбаловидной, где наиболее распространенным является Foxo1 (фиг. 43a). По совпадению, камбаловидная мышца также физиологически обогащена медленно сокращающимися волокнами, и, таким образом, позволила авторам настоящего изобретения легко тестировать их гипотезу. Авторы настоящего изобретения инактивировали экспрессию Foxo1 в скелетных мышцах посредством скрещивания мышей, гомозиготных по аллелю floxed Foxo1 с трансгенными мышами Myogenin-cre. Анализ мРНК показал, что нокаут происходил, как было запланировано (данные не представлены). Гистологический анализ показал снижение волокон типа I (медленно сокращающихся) в камбаловидной мышце мышей Myog-Foxo1, в то время как мышцы, обогащенные волокнами типа II, были неизмененными (фигура 43b). В соответствии с гистологическими данными, экспрессия маркеров волокон типа I была снижена, в то время как экспрессия маркеров волокон типа II была повышена у мышей Myog-Foxo1 (фигура 43c). Затем авторы настоящего изобретения анализировали экспрессию миогенных факторов транскрипции MyoD, Myf5 и миогенина. MyoD представляет собой преобладающий фактор в быстрых волокнах, а миогенин - в медленных волокнах (44). В соответствии с гистопатологией, авторы настоящего изобретения выявили двукратное повышение экспрессии MyoD и ~80% снижение экспрессии миогенина, в то время как экспрессия Myf5 была неизмененной (фиг. 43c). Более того, экспрессия коактиватора Foxo1 Pgc1α, который регулирует детерминацию волокон типа I (30), была неизмененной, указывая на то, что фенотип мышей Myog-Foxo1 нельзя было объяснить снижением зависимой от Foxo1 транскрипции Pgc1α (фиг. 43c) (46). В качестве функционального коррелята наблюдаемого переключения типа волокон, авторы настоящего изобретения исследовали способность к бегу на "беговой дорожке". Действительно, мыши Myog-Foxo1 проявляли сниженную способность к бегу, как предсказано, исходя из снижения волокон типа I (выносливости) (фиг. 43d).
В заключение, для определения того, отражают ли эти изменения, связанные с развитием, изменения в спецификации типа волокна, в противоположность адаптивным или клеточно-неавтономным факторам, авторы настоящего изобретения определяли экспрессию MyoD в эмбрионах с нокаутом Foxo1 (24) и Notch1 (25) при E9,5. В эмбрионах Foxo1-/- уровни MyoD возрастали в 3,1±1,1 раз, и в эмбрионах Notch1-/- они возрастали в 7,3±2,9 раз по сравнению с контролями (P<0,05 в обоих мутантах против дикого типа, n=4). Повышение экспрессии MyoD, наблюдаемое in vivo, согласуется с физическими и функциональными взаимодействиями между Foxo1 и Notch в этом ключевом звене передачи сигнала при дифференцировке миобластов. Таким образом, авторы настоящего изобретения полагают, что переключение типов волокон у мышей Myog-Foxo1 является результатом ускоренной дифференцировки содержащих MyoD миобластов в процессе эмбрионального развития.
Обсуждение
В этом исследовании предоставлены биохимические, клеточные и генетические доказательства того, что каскады передачи сигнала Foxo и Notch взаимодействуют при регуляции дифференцировки мышц. Данные выявляют новый способ действия Foxo1 для обеспечения обмена корепрессорами на промоторе Hes1 посредством прямого связывания с областью NTD Csl (фиг. 42f). Авторы настоящего изобретения полагают, что связывание Foxo1 с этим доменом стабилизирует комплекс Notch/Csl и запускает удаление корепрессора и привлечение Maml1, что согласуется с предполагаемой ролью NTD, исходя из исследований структуры (37). Также данные обеспечивают механизм, посредством которого два основных биохимических каскада, каскад фосфоинозитол-3-киназы/Akt и каскад Notch/Hes, объединяются синергичным образом для контроля клеточной дифференцировки in vivo.
Предполагаемая роль Foxo1 не зависит от его транскрипционной функции и вовлекает прямое взаимодействие с Csl. В то время как исследования авторов настоящего изобретения сфокусированы на Hes-1 в качестве прототипного эффектора передачи сигнала Notch1, данные авторов настоящего изобретения не следует истолковывать, как указывающие на то, что Hes-1 является единственным медиатором взаимодействия Notch/Foxo. Например, авторы настоящего изобретения наблюдали сходный эпистаз Foxo/Notch в дифференцировке преадипоцитов, PC-12 и HUVEC, что указывает на то, что Foxo взаимодействует с Notch во множестве клеточных контекстов (данные не представлены). Авторы настоящего изобретения полагают, что взаимодействие Notch/Foxo интегрирует сигналы окружающей среды через Notch с метаболическими сигналами через Foxo1, регулируя поддержание и дифференцировку клеток-предшественников. Этот двухъярусный механизм позволяет коммитированным клеткам-предшественникам в различных тканях избегать дифференцировки в ответ на связанные с развитием сигналы (Notch), когда Foxo1 активен, т.е. в отсутствии факторов роста. Эти клетки затем могут поддерживаться в состоянии покоя во взрослых тканях, где они могут подвергаться терминальной дифференцировке в ответ на сочетание сигналов лиганда Notch и гормональных сигналов/сигналов питательных веществ, что ведет к ингибированию Foxo1. Эта интерпретация согласуется с переключением типов волокон, наблюдаемым в дефицитной по Foxo1 мышце, и это наблюдение, по-видимому, устанавливает Foxo1 в качестве фактора, решающего судьбу, в миогенном ростке, в противоположность индуктору миогенной программы. Остается выявить, взаимодействуют ли также изоформы Foxo и Notch, и каким образом они участвуют в этом процессе.
Демонстрация того, что Foxo1 является корегулятором экспрессии генов, обеспечивает потенциальное объяснение разносторонних функций этого транскрипционного фактора. Интересным вопросом, возникающим из исследований авторов настоящего изобретения, является то, каким образом достигается переключение с одной функции на другую, и каким образом комплексные посттрансляционные модификации Foxo1 в ответ на факторы роста, гормоны и питательные вещества связаны с этим процессом. Эти данные играют широкую роль в патофизиологии процессов заболевания, которые вовлекают передачу сигнала Foxo1. Потенциальная роль наблюдения авторов настоящего изобретения состоит в возможности изучения применения средств, которые ингибируют передачу сигнала Notch (47) в качестве способа лечения метаболических нарушений, характеризующихся избыточной функцией Foxo (48).
Материалы и способы
Получение животных и анализ
Мыши Myogenin-cre (49) и Foxo1flox описаны (9). Детекцию аллелей дикого типа, нуль-аллелей и Foxo1flox проводили с использованием PCR с праймерами 5'-GCT TAG AGC AGA GAT GTT CTC ACA TT-3', 5'-CCA GAG TCT TTG TAT CAG GCA AAT AA-3' и 5'-CAA GTC CAT TAA TTC AGC ACA TTG A-3'. Перед тестом эффективности на беговой дорожке мышей тренировали в течение 2 суток (Columbus Instruments). Тест проводили при 15 м/мин в течение первых 30 мин, затем с возрастанием на 1 м/мин с интервалами 10 мин до утомления. Образцы скелетных мышц быстро замораживали в матриксе OCT, и получали 7-мкм серийные срезы. Мышечные волокна типировали с использованием метахроматической АТФазы (50) или иммунного окрашивания антителом против медленного миозина скелетных мышц (Sigma). Для исследований на эмбрионах авторы настоящего изобретения проводили в установленные моменты времени скрещивания гетерозиготных по Foxo1 (24) или Notch1 (25) мышей и выделяли эмбрионы на E9,5. мРНК выделяли из целых эмбрионов и проводили RT-PCR с детекцией в реальном времени, как описано ниже.
Исследования вирусной экспрессии
Клетки C2C12 подвергали дифференцировке, как описано (3, 4). Аденовирусные векторы и экспрессирующие векторы млекопитающих с Foxo1-ADA, Notch1-IC, Jagged1, Csl и ловушкой Notch описаны (36, 51). Авторы настоящего изобретения получили ретровирусы, экспрессирующие Foxo1-ADA и Notch1-IC с использованием вектора pQCXIH. Для получения ловушки Notch (pAdlox Notch1ECD-Fc) внеклеточный домен Notch1 (п.н. 241-4229, регистрационный номер GenBank # X57405) подвергали слиянию в рамке считывания с Fc-меткой IgG человека и клонировали в pAdlox. Получали ретровирусный супернатант из клеток GP2-293 (BD Bioscience), временно котрансфицированных вектором pVSV-G и сконструированным вектором pQCXIH. Для получения Foxo1 с дефектом связывания ДНК авторы настоящего изобретения провели замену N208 и H212 на аланин и аргинин, соответственно, с использованием набора QuikChange Mutagenesis Kit (Stratagene). Затем мутации клонировали в каркас мутанта Foxo1-ADA.
Анализ с люциферазой и анализ в кокультуре
Авторы настоящего изобретения трансфицировали клетки HEK293 репортерными генами Hes1-люциферазы (от -194 до 160 от участка инициации транскрипции) (Hes1/pGL2 основной), синтетической Hes1-люциферазы (содержащей участок связывания 4× Csl, 4× Csl/pGL2 основной) или Csl-люциферазы (от -1536 до 22, Csl/pGL2 основной) вместе с pCMV5, pCMV5-Foxo1-ADA, pQNC-Notch1-IC, ловушкой Notch pHyTc или siRNA для Foxo1. Авторы настоящего изобретения использовали плазмиду pRSV-β-галактозидаза в качестве контроля эффективности трансфекции (51). Для анализа в кокультуре авторы настоящего изобретения экспрессировали Notch1 в клетках C2C12 и Jagged1 или LacZ в клетках HEK293 посредством трансфекции. Затем авторы настоящего изобретения собрали клетки HEK293 и посеяли их на клетки C2C12. После инкубации в течение 1 ч авторы настоящего изобретения кокультивировали клетки для экспериментов.
Вестерн-блоттинг и иммунопреципитация
Авторы настоящего изобретения провели эти анализы в соответствии со стандартными способами с использованием антител против миозина (MF-20), против HA (12CA5, Boehringer Mannheim), против FLAG (M2, Sigma), против Foxo1 (H128 и N20, Santa Cruz), против Notch1 (C-20, Santa-Cruz), против Csl (Chemicon и Santa-Cruz), против NcoR (Santa-Cruz), против SMRT (Santa-Cruz) или против MAML1 (Chemicon). Для коиммунопреципитации Foxo/Csl авторы настоящего изобретения использовали очищенные ядерные фракции (52). Поскольку Csl мигрирует вблизи тяжелой цепи IgG на SDS-PAGE, авторы настоящего изобретения использовали диметилпиримилидат (DMP от Pierce) для поперечного связывания антител с гранулами с белком A и избежания контаминации IgG в элюированных белковых комплексах (52).
Анализы иммунопреципитации с хроматином
Авторы настоящего изобретения провели анализ ChIP в клетках C2C12, как описано ранее (4), и в кокультивированных клетках, как описано Fryer (42). Пары праймеров, используемые для амплификации участка связывания Csl промотора Hes1, представляют собой: 5'-GCAAAGCCCAGAGGAAAGAGTTAG-3' и 5'-AGGAGAGAGGTAGACAGGGGATTC-3'.
Трансфекция siRNA и устойчивый к siRNA Foxo1
Специфичная к Foxo1 последовательность siRNA представляет собой 5'-ACGGAGGATTGAACCAGTATA-3'. Специфичная к Csl последовательность siRNA представляет собой 5'-TAGGGAAGCTATGCGAAATTA-3'. siRNA трансфицировали с использованием реагента Lipofectamin-plus (Invitrogen). Авторы настоящего изобретения получили устойчивый к siRNA Foxo1 посредством замены трех остатков (подчеркнуты) в последовательности 5'-ACGGCGGTCTGAACCAGTATA-3'. Последовательности праймеров, используемые для исследований RT-PCR с детекцией в реальном времени, доступны по запросу.
Рекомбинантные белки и анализы взаимодействия
Авторы настоящего изобретения получили GST-FLAG-Csl, охватывающий фрагменты из аминокислот 1-527, 1-279, 1-172 и 279-527, посредством клонирования в PGEX6P-1. Конструкции GST-Foxo1 были описаны (53). После бактериальной культуры и индукции IPTG, авторы настоящего изобретения очищали слитые белки GST и инкубировали их вместе. После этого авторы настоящего изобретения выделили GST-FLAG/Csl посредством иммунопреципитации с антителом против FLAG, тщательно промыли иммунный осадок и провели иммуноблоттинг с антисывороткой против Foxo1.
Ссылки, цитированные в шестой серии экспериментов
1. Singec, I., Jandial, R., Crain, A., Nikkhah, G., and Snyder, E. Y. 2007. The leading edge of stem cell therapeutics. Annu Rev Med 58:313-328.
2. Accili, D., and Arden, K. C. 2004. FoxOs at the Crossroads of Cellular Metabolism, Differentiation, and Transformation. Cell 117:421-426.
3. Hribal, M. L., Nakae, J., Kitamura, T., Shutter, J. R., and Accili, D. 2003. Regulation of insulin-like growth factor-dependent myoblast differentiation by Foxo forkhead transcription factors. J. Cell. Biol. 162:535-541.
4. Nakae, J., Kitamura, T., Kitamura, Y., Biggs, W. H., Arden, K. C, and Accili, D. 2003. The forkhead transcription factor foxol regulates adipocyte differentiation. Dev Cell 4:119-129.
5. Potente, M., Urbich, C, Sasaki, K. I., Hofmann, W. K., Heeschen, C., Aicher, A., Kollipara, R., Depinho, R. A., Zeiher, A. M., and Dimmeler, S. 2005. Involvement of Foxo transcription factors in angiogenesis and postnatal neovascularization. J Clin Invest 115:2382-2392.
6. Liu, Z. P., Wang, Z., Yanagisawa, H., and Olson, E. N. 2005. Phenotypic modulation of smooth muscle cells through interaction of Foxo4 and myocardin. Dev Cell 9:261-270.
7. Castrillon, D. H., Miao, L., Kollipara, R., Horner, J. W., and DePiriho, R. A. 2003. Suppression of ovarian follicle activation in mice by the transcription factor Foxo3a. Science 301:215-218.
8. Tothova, Z., Kollipara, R., Huntly, B. J., Lee, B. H., Castrillon, D. H., Cullen, D. E., McDowell, E. P., Lazo-Kallanian, S., Williams, I. R., Sears, C., et al. 2007. FoxOs Are Critical Mediators of Hematopoietic Stem Cell Resistance to Physiologic Oxidative Stress. Cell 128:325-339.
9. Paik, J. H., Kollipara, R., Chu, G., Ji, H., Xiao, Y., Ding, Z., Miao, L., Tothova, Z., Horner, J. W., Carrasco, D. R., et al. 2007. FoxOs Are Lineage-Restricted Redundant Tumor Suppressors and Regulate Endothelial Cell Homeostasis. Cell 128:309-323.
10. Shawber, C. J., and Kitajewski, J. 2004. Notch function in the vasculature: insights from zebrafish, mouse and man. Bioessays 26:225-234.
11. Lai, E. C. 2002. Keeping a good pathway down: transcriptional repression of Notch pathway target genes by CSL proteins. EMBO Rep 3:840-845.
12. Jensen, J., Pedersen, E. E., Galante, P., HaId, J., Heller, R. S., Ishibashi, M., Kageyama, R., Guillemot, F., Serup, P., and Madsen, O. D. 2000. Control of endodermal endocrine development by Hes-1. Nat Genet 24:36-44.
13. Ross, D. A., Rao, P. K., and Kadesch, T. 2004. Dual roles for the Notch target gene Hes-1 in the differentiation of 3T3-L1 preadipocytes. Mol. Cell. Biol. 24:3505-3513.
14. Ohtsuka, T., Ishibashi, M., Gradwohl, G., Nakanishi, S., Guillemot, F., and Kageyama, R. 1999. Hesl and Hes5 as notch effectors in mammalian neuronal differentiation. Embo J. 18:2196-2207.
15. Shawber, C., Nofziger, D., Hsieh, J. J., Lindsell, C., Bogler, O., Hayward, D., and Weinmaster, G. 1996. Notch signaling inhibits muscle cell differentiation through a CBFl-independent pathway. Development 122:3765-3773.
16. Sasai, Y., Kageyama, R., Tagawa, Y., Shigemoto, R., and Nakanishi, S. 1992. Two mammalian helix-loop-helix factors structurally related to Drosophila hairy and Enhancer of split. Genes Dev 6:2620-2634.
17. Kuroda, K., Tani, S., Tamura, K., Minoguchi, S., Kurooka, H., and Honjo, T. 1999. Delta-induced Notch signaling mediated by RBP-J inhibits MyoD expression and myogenesis. J. Biol Chem 274:7238-7244.
18. Nofziger, D., Miyamoto, A., Lyons, K. M., and Weinmaster, G. 1999. Notch signaling imposes two distinct blocks in the differentiation of C2C12 myoblasts. Development 126:1689-1702.
19. Wilson-Rawls, J., Molkentin, J. D., Black, B. L., and Olson, E. N. 1999. Activated notch inhibits myogenic activity of the MADS-Box transcription factor myocyte enhancer factor 2C. Mol Cell Biol 19:2853-2862.
20. Hirsinger, E., Malapert, P., Dubrulle, J., Delfini, M. C., Duprez, D., Henrique, D., Ish-Horowicz, D., and Pourquie, O. 2001. Notch signalling acts in postmitotic avian myogenic cells to control MyoD activation. Development 128:107-116.
21. Conboy, I. M., and Rando, T. A. 2002. The regulation of Notch signaling controls satellite cell activation and cell fate determination in postnatal myogenesis. Dev Cell 3:397-409.
22. Shawber, C. J., Das, I., Francisco, E., and Kitajewski, J. 2003. Notch signaling in primary endothelial cells. Ann N Y Acad Sci 995:162-170.
23. Limbourg, F. P., Takeshita, K., Radtke, F., Bronson, R. T., Chin, M. T., and Liao, J. K. 2005. Essential role of endothelial Notchl in angiogenesis. Circulation 111:1826-1832.
24. Hosaka, T., Biggs, W. H., 3rd, Tieu, D., Boyer, A. D., Varki, N. M., Cavenee, W. K., and Arden, K. C. 2004. Disruption of forkhead transcription factor (FOXO) family members in mice reveals their functional diversification. Proc Natl Acad Sci U S A 101:2975-2980.
25. Krebs, L. T., Xue, Y., Norton, C. R., Shutter, J. R., Maguire, M., Sundberg, J. P., Gallahan, D., Closson, V., Kitajewski, J., Callahan, R., et al. 2000. Notch signaling is essential for vascular morphogenesis in mice. Genes Dev 14:1343-1352.
26. McKinsey, T. A., Zhang, C. L., and Olson, E. N. 2001. Control of muscle development by dueling HATs and HDACs. Curr Opin Genet Dev 11:497-504.
27. Rudnicki, M. A., and Jaenisch, R. 1995. The MyoD family of transcription factors and skeletal myogenesis. Bioessays 17:203-209.
28. Bassel-Duby, R., and Olson, E. N. 2006. Signaling pathways in skeletal muscle remodeling. Annu Rev Biochem 75:19-37.
29. Schiaffino, S., and Reggiani, C. 1996. Molecular diversity of myofibrillar proteins: gene regulation and functional significance. Physiol Rev 76:371-423.
30. Lin, J., Wu, H., Tarr, P. T., Zhang, C. Y., Wu, Z., Boss, 0., Michael, L. F., Puigserver, P., Isotani, E., Olson, E. N., et al. 2002. Transcriptional co-activator PGC-I alpha drives the formation of slow-twitch muscle fibres. Nature 418:797-801.
31. Lagouge, M., Argmann, C., Gerhart-Hines, Z., Meziane, H., Lerin, C., Daussin, F., Messadeq, N., Milne, J., Lambert, P., Elliott, P., et al. 2006. Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRTl and PGC-lalpha. Cell 127:1109-1122.
32. Nickoloff, B. J., Osborne, B. A., and Miele, L. 2003. Notch signaling as a therapeutic target in cancer: a new approach to the development of cell fate modifying agents. Oncogene 22:6598-6608.
33. Nickoloff, B. J., Qin, J. Z., Chaturvedi, V., Denning, M. F., Bonish, B., and Miele, L. 2002. Jagged-1 mediated activation of notch signaling induces complete maturation of human keratinocytes through NF-kappaB and PPARgamma. Cell Death Differ 9:842-855.
34. Pan, Y., Lin, M. H., Tian, X., Cheng, H. T., Gridley, T., Shen, J., and Kopan, R. 2004. gamma-seeretase functions through Notch signaling to maintain skin appendages but is not required for their patterning or initial morphogenesis. Dev Cell 7:731-743.
35. Dowell, P., Otto, T. C., Adi, S., and Lane, M. D. 2003. Convergence of peroxisome proliferator-activated receptor gamma and Foxol signaling pathways. J Biol Chem 278:45485-45491.
36. Nakae, J., Kitamura, T., Silver, D. L., and Accili, D. 2001. The forkhead transcription factor Foxol (Fkhr) confers insulin sensitivity onto glucose-6-phosphatase expression. J. Clin Invest 108:1359-1367.
37. Kovall, R. A., and Hendrickson, W. A. 2004. Crystal structure of the nuclear effector of Notch signaling, CSL, bound to DNA. Embo J. 23:3441-3451.
38. Hsieh, J. J., and Hayward, S. D. 1995. Masking of the CBFl/RBPJ kappa transcriptional repression domain by Epstein-Barr virus EBNA2. Science 268:560-563.
39. Kao, H. Y., Ordentlich, P., Koyano-Nakagawa, N., Tang, Z., Downes, M., Kintner, C. R., Evans, R. M., and Kadesch, T. 1998. A histone deacetylase corepressor complex regulates the Notch signal transduction pathway. Genes Dev 12:2269-2277.
40. Tun, T., Hamaguchi, Y., Matsunami, N., Furukawa, T., Honjo, T., and Kawaichi, M. 1994. Recognition sequence of a highly conserved DNA binding protein RBP-J kappa. Nucleic Acids Res 22:965-971.
41. Kawaichi, M., Oka, C., Shibayama, S., Koromilas, A. E., Matsunami, N., Hamaguchi, Y., and Honjo, T. 1992. Genomic organization of mouse J kappa recombination signal binding protein (RBP-J kappa) gene. J. Biol Chem 267:4016-4022.
42. Fryer, C. J., White, J. B., and Jones, K. A. 2004. Mastermind recruits CycC:CDK8 to phosphorylate the Notch ICD and coordinate activation with turnover. Mol. Cell 16:509-520.
43. Liang, Y., Chang, J., Lynch, S. J., Lukac, D. M., and Ganem, D. 2002. The lytic switch protein of KSHV activates gene expression via functional interaction with RBP-Jkappa (CSL), the target of the Notch signaling pathway. Genes Dev 16:1977-1989.
44. Hughes, S. M., Taylor, J. M., Tapscott, S. J., Gurley, C. M., Carter, W. J., and Peterson, C. A. 1993. Selective accumulation of MyoD and myogenin mRNAs in fast and slow adult skeletal muscle is controlled by innervation and hormones. Development 118:1137-1147.
45. Kitamura, T., Nakae, J., Kitamura, Y., Kido, Y., Biggs, W. H., 3rd, Wright, C. V., White, M. F., Arden, K. C., and Accili, D. 2002. The forkhead transcription factor Foxol links insulin signaling to Pdxl regulation of pancreatic beta cell growth. J. Clin Invest 110:1839-1847.
46. Daitoku, H., Yamagata, K., Matsuzaki, H., Hatta, M., and Fukamizu, A. 2003. Regulation of PGC-1 promoter activity by protein kinase B and the forkhead transcription factor FKHR. Diabetes 52:642-649.
47. Miele, L., Miao, H., and Nickoloff, B. J. 2006. NOTCH signaling as a novel cancer therapeutic target. Curr Cancer Drug Targets 6:313-323.
48. Accili, D. 2004. Lilly lecture 2003: the struggle for mastery in insulin action: from triumvirate to republic. Diabetes 53:1633-1642.
49. Knapp, J. R., Davie, J. K., Myer, A., Meadows, E., Olson, E. N., and Klein, W. H. 2006. Loss of myogenin in postnatal life leads to normal skeletal muscle but reduced body size. Development 133:601-610.
50. Ogilvie, R. W., and Feeback, D. L. 1990. A metachromatic dye-ATPase method for the simultaneous identification of skeletal muscle fiber types I, IIA, IIB and IIC Stain Technol 65:231-241.
51. Das, I., Craig, C., Funahashi, Y., Jung, K. M., Kim, T. W., Byers, R., Weng, A. P., Kutok, J. L., Aster, J. C., and Kitajewski, J. 2004. Notch oncoproteins depend on gamma-secretase/presenilin activity for processing and function. J. Biol Chem 279:30771-30780.
52. Chi, T., Yan, Z., Xue, Y., and Wang, W. 2004. Purification and functional analysis of the mammalian SWI/SNF-family of chromatin-remodeling complexes. Methods Enzymol 377:299-316.
53. Puigserver, P., Rhee, J., Donovan, J., Walkey, C. J., Yoon, J. C., Oriente, F., Kitamura, Y., Altomonte, J., Dong, H., Accili, D., et al. 2003. Insulin-regulated hepatic gluconeogenesis through FOXOl-PGC-lalpha interaction. Nature 423:550-555.
Седьмая серия экспериментов
У пациентов с диабетом часто развивается ожирение и сосудистые патологии. Молекулярные механизмы, которые приводят к диабетическим осложнениям, еще предстоит выяснить. За последние два года автор настоящего изобретения оценивал мышей с нокаутом Notch4 в отношении постнатальных дефектов. Эти исследования показали, что у мутантных по Notch4 мышей развиваются признаки диабета: 1) раннее возникновение ожирения, наблюдаемое по значительному увеличению подкожного жира, и 2) сниженное содержание перицитов в сосудах сетчатки, напоминающее диабетическую ретинопатию. Авторы настоящего изобретения выявили, что Notch и Foxo1, транскрипционный регулятор передачи сигнала инсулина, объединяются для регуляции адипогенеза и ангиогенеза. Мыши, дефицитные по Notch1, Notch1/Notch4 или Foxo1, погибают внутриутробно с ангиогенными дефектами. Эти данные привели к тому, что авторы настоящего изобретения предположили, что нарушенная регуляция передачи сигнала Notch приводит к диабетическому ожирению и патологиям сосудов. Предполагаемой задачей является изучение этой гипотезы и определение ролей взаимодействий передачи сигнала Notch и инсулина в адипогенезе и ангиогенезе. Для изменения активности Notch, Foxo1 и рецепторов инсулина посредством генетического манипулирования будут использовать модели на мышах. Адипогенез и метаболическую дисфункцию будут оценивать у мышей с нокаутом Notch4 и рецепторов инсулина и в эмбриональных фибробластах, полученных от этих мышей. Ангиогенез эмбриона и сетчатки будут оценивать у гаплонедостаточных мышей по Notch1, Notch4 и/или Foxo1. В заключение, функцию передачи сигнала Notch и Foxo1 при пролиферативной ретинопатии будут оценивать в модели запускаемого гипоксией ангиогенеза сетчатки на мышах. Цели карьеры автора настоящего - стать независимым научным исследователем в области исследования диабета.
Оценка функции Notch при метаболизме.
Авторы настоящего изобретения выявили, что Notch и Foxo1, транскрипционный регулятор передачи сигнала инсулина, образуют транскрипционный комплекс с CSL для регуляции выбора клеточной судьбы. Утрата одного аллеля Foxo1 сохраняет гипергликемию и гиперинсулинемию у гаплонедостаточных по рецептору инсулина мышей. Аналогично утрата Notch4 у мышей коррелировала с более низкими уровнями глюкозы в крови по сравнению с однопометными животными дикого типа. Foxo1 и Notch4 обладают перекрывающимся паттерном экспрессии в β-клетках поджелудочной железы взрослой мыши, а Notch1 экспрессируется как в α-, так и в β-клетках. В связи с этой задачей, авторы настоящего изобретения будут дополнительно охарактеризовывать метаболизм мутантных по Notch мышей. Также авторы настоящего изобретения определят, имеются ли дефекты в поджелудочной железе мышей, мутантных по Notch и Notch/Foxo1.
Оценка функции Notch4 в адипогенезе.
Авторы настоящего изобретения выявили, что мыши с нокаутом Notch4 имеют более крупные отложения жировой ткани. В коже Notch4 экспрессируется как в адипоцитах, так и в сосудах. Notch4 может регулировать адипогенез посредством либо клеточно-автономного, либо клеточно-неавтономного механизма. В клеточно-автономной модели Notch функционирует в адипоцитах, регулируя дифференцировку из коммитированных преадипоцитов в стромально-сосудистой фракции. Альтернативно Notch может регулировать ангиогенез в жировой ткани, который затем влияет на адипогенез. Авторы настоящего изобретения установили, что Notch и Foxo1 объединяются для ингибирования индуцируемого гормонами адипогенеза культивированных фибробластов. У мутантных по рецептору инсулина мышей адипогенез был нарушен, и дифференцировка частично восстанавливалась при ингибировании Foxo1. Однако неизвестно, могут ли нарушения функции Notch влиять на инсулинзависимую дифференцировку и функцию адипоцитов in vivo. Для начала выяснения этого вопроса, авторы настоящего изобретения дополнительно охарактеризуют жировой фенотип в мутантных по Notch мышей с фокусированием на подкожном и висцеральном жировом депо. Затем авторы настоящего изобретения определят, восстанавливает ли недостаточность по Notch4 подкожный жировой фенотип в мутантных по Insr мышей. В заключение, авторы настоящего изобретения оценят функцию Notch при дифференцировке в адипоциты эмбриональных фибробластов, полученных из мышей, дефицитных по Notch4 и Insr. Целью авторов настоящего изобретения является определение роли взаимодействий передачи сигнала Notch и инсулина в дифференцировке адипоцитов.
Диабет и ожирение
Ожирение является главным фактором риска для устойчивости к инсулину, гипергликемии и развития диабета 2 типа {Eckel, 2005 #769}. Также оно ассоциировано с сердечнососудистой дисфункцией. Жировая ткань имеет важную метаболическую функцию при запасании триацилглицерина во время избытка энергии и высвобождении свободных жирных кислот и глицерина во время истощения энергии. Кроме того, адипоциты регулируют метаболический гомеостаз путем продукции ряда биологически активных веществ, называемых адипокинами. Адипокины состоят из гормонов, цитокинов, факторов роста и других биологически активных соединений. Они включают лептин, фактор некроза опухоли альфа, ангиотензин II, интерлейкин-6, интерлейкин-1, адипонектин, резистин и простагландины. Эти секретируемые факторы играют главную роль в регуляции как метаболической, так и сосудистой биологии и по существу было предположено, что они являются связью между устойчивостью к инсулину и сердечнососудистым заболеванием.
Развитие ожирения, по-видимому, регулируется передачей сигнала инсулина и зависит от ангиогенеза. В адипоцитах передача сигнала инсулина индуцирует фактор роста эндотелия сосудов (VEGF) {Mick, 2002 #767}. VEGF является сильным индуктором ангиогенеза, который может запустить пролиферацию, миграцию и дифференцировку эндотелиальных клеток, а также повышение проницаемости сосудистой стенки {Yancopoulos, 2000 #65}. В моделях ожирения на мышах антагонисты VEGF нарушают не только ангиогенез, но препятствуют адипогенезу {Rupnick, 2002 #766; Fukumura, 2003 #768}. Таким образом, в жировой ткани происходит реципрокная паракринная регуляция дифференцировки адипоцитов и ангиогенеза.
Функция Notch в адипогенезе
Роль Notch в дифференцировке адипоцитов только начинают прояснять. С использованием анализов in vitro было показано, что передача сигнала Notch как запускает, так и ингибирует индуцируемый гормоном адипогенез фибробластов. В стромальных клеточных линиях Notch нарушал дифференцировку остеобластов, что затем приводило к усилению дифференцировки адипоцитов {Sciaudone, 2003 #772}. Напротив, как опосредуемая лигандом передача сигнала Notch, так и эктопическая экспрессия конститутивно активного Notch1 ингибировали адипогенез фибробластов 3T3-L1 {Garces, 1997 #177; Ross, 2004 #773}. Аналогично сверхэкспрессия гена-мишени Notch, HES1, ингибировала дифференцировку в адипоциты фибробластов {Ross, 2004 #773}. Нарушение экспрессии HES1 посредством siRNA также блокировало дифференцировку фибробластов в адипоциты. Таким образом, как ингибирование, так и активация Notch нарушает адипогенез, что указывает на то, что адипогенез является чувствительным к дозе передачи сигнала Notch.
Опосредуемое Notch ингибирование адипогенеза фибробластов коррелировало с утратой адипоцит-специфических генов C/EBPα и PPARγ. Дифференцировка в адипоциты фибробластов, в которых передача сигнала Notch была активирована, восстанавливалась путем экспрессии либо C/EBPα, либо PPARγ, указывая на то, что Notch ингибирует адипогенез путем подавления экспрессии этих двух генов. В соответствии с данными для фибробластов, индуцируемый ретиноевой кислотой адипогенез был немного усилен в тельцах эмбрионов с нокаутом Notch1 {Nichols, 2004 #770}. В заключение, было выявлено, что экспрессия Notch1 является сниженной в жировой ткани, полученной от пациентов с устойчивостью к инсулину относительно чувствительных к инсулину субъектов, указывая на роль Notch в связанной с диабетом дифференцировке адипоцитов {Yang, 2003 #777}.
Сосудистые осложнения при диабете
У пациентов с диабетом возникает множество сосудистых осложнений, включая артериальную гипертензию, инсульты, ишемию, ретинопатию, атеросклероз и сердечные приступы. Однако мало известно о молекулярных механизмах, приводящих к диабетическим сосудистым осложнениям. Слепота является одним из таких осложнений, которые имеют сосудистое происхождение, однако она является мало понятной. В течение 20 лет с момента постановки диагноза у четверти диабетиков развивается пролиферативная ретинопатия, ведущая к слепоте. Диабетическая ретинопатия начинается с повышения проницаемости сосудов, утолщения базальной мембраны и утраты перицитов в микрососудах сетчатки с последующей пролиферативной фазой неоваскуляризации {Cukiernik, 2004 #749}. В развитие диабетической пролиферативной ретинопатии вовлечен сосудистый фактор роста (VEGF). Передача сигнала VEGF может запускать пролиферацию, миграцию, дифференцировку эндотелиальных клеток и повышение проницаемости стенки сосудов {Yancopoulos, 2000 #65}. В моделях на мышах для диабета типа I и типа II выявлено, что уровень чувствительного к гипоксии фактора транскрипции, HIF-1α, и VEGF повышается в глазах {Kondo, 2004 #744}, указывая на то, что гипоксия является инициирующим событием при развитии диабетической ретинопатии. Индукция VEGF, вероятно, опосредуется HIF-1α, поскольку VEGF является прямой транскрипционной мишенью HIF-1α {Yancopoulos, 2000 #65}. В качестве подтверждения роли VEGF в диабетической ретинопатии, эктопическая экспрессия VEGF в глазах приматов ведет к быстрому развитию пролиферативной ретинопатии и отека желтого пятна {Lebherz, 2005 #748}. В модели на крысах с диабетом подкожная инъекция ингибитора передачи сигнала VEGF SU5416 подавляет индуцируемую VEGF проницаемость и сужение микрососудов сетчатки {Cukiernik, 2004 #749}. В заключение, инъекция в стекловидное тело ингибитора всех трех VEGFR, PTK/ZK, снижает неоваскуляризацию сетчатки в модели гипоксии на мышах {Maier, 2005 #750}. Таким образом, нарушение регуляции передачи сигнала VEGF играет критическую роль в развитии пролиферативной ретинопатии и также может приводить к другим диабетическим сосудистым осложнениям.
ОЦЕНКА ФУНКЦИИ NOTCH В МЕТАБОЛИЗМЕ
Авторы выявили, что Notch и Foxo1, транскрипционный регулятор передачи сигнала инсулина, образуют транскрипционный комплекс с CSL для регуляции выбора клеточной судьбы. Утрата одного аллеля Foxo1 восстанавливает гипергликемию и гиперинсулинемию у мышей с дефицитом передачи сигнала инсулина (Nakae 2002 ng). У мышей утрата N4 коррелировала со значимым снижением уровней глюкозы в крови по сравнению с однопометными животными дикого типа. Подобно Foxo1 Notch4 может мешать передаче сигнала инсулина при регуляции метаболизма. Уровни глюкозы и инсулина в циркуляции регулируются продуцирующими глюкозу тканями, такими как печень и продуцирующие инсулин островковые β-клетки поджелудочной железы. Повышенная передача сигнала Foxo1 в β-клетках трансгенных по Foxo1 мышей ведет к недостаточности β-клеток и развитию диабета (Nakea 2002 ng). Foxo1 и Notch4 обладают перекрывающимся паттерном экспрессии в β-клетках поджелудочной железы взрослых мышей, в то время как Notch1 экспрессируется как в α, так и в β-клетках. Таким образом, Notch4 и/или Notch1 могут иметь функцию в эндокринных клетках островков поджелудочной железы. В связи этой задачей авторы дополнительно охарактеризуют метаболизм и поджелудочные железы у мышей, мутантных по Notch. Мутантных по Notch мышей будут скрещивать с мышами L2 Ttr-Insr-/- (фиг. 21) и использовать для определения того, подавляет ли недостаточность N4 и/или N1 диабетические дефекты и дефекты поджелудочной железы, наблюдаемые при этом дефицитном по Insr фоне.
ОЦЕНКА ФУНКЦИИ NOTCH В АДИПОГЕНЕЗЕ
Авторы настоящего изобретения обнаружили, что мыши с нокаутом N4 имеют гипертрофию жировой ткани кожи. Этот фенотип жировой ткани у мутантных по N4 мышей может возникать вследствие клеточно-автономного дефекта в адипоцитах или вследствие не клеточно-автономного ангиогенного дефекта. В противоположность нуль-зиготным по N4 мышам, мыши, дефектные по Insr, проявляют гипертрофию жировой ткани {Cinti, 1998 #774; Kitamura, 2004 #745} (Okamoto JCI 2004). Эктопическая экспрессия доминантно-негативного Foxo1 восстанавливает адипогенез эмбриональных фибробластов Insr-/- {Nakae, 2003 #765}. Авторы настоящего изобретения выявили, что Notch и Foxo1 совместно действуют для ингибирования индуцированного гормоном адипогенеза фибробластов.
Поскольку функции Foxo1 находятся в эпистатических взаимодействиях с передачей сигнала инсулина (фиг. 3), Notch в ангиогенезе также может обладать функцией, противоположной передаче сигнала инсулина. В соответствии с клеточно-автономной функцией жировой ткани для Notch4, Notch4 экспрессируется в подкожных адипоцитах. Таким образом, авторы настоящего изобретения проведут оценку функции Notch в адипогенезе эмбриональных фибробластов, полученных из мышей, дефицитных по Notch и Notch:Insr. Авторы настоящего изобретения проведут дополнительную охарактеризацию дефекта подкожного жира и оценят депо висцерального жира у мутантных по Notch мышей. Наконец, авторы настоящего изобретения определят, восстанавливает ли недостаточность Notch4 дефект жировой ткани кожи у мышей, мутантных по Insr.
В моделях ожирения на мышах антагонисты VEGF блокируют как ангиогенез, так и адипогенез {Rupnick, 2002 #766; Fukumura, 2003 #768}, указывая на то, что существует взаимно-обратная регуляция адипогенеза и ангиогенеза. Поскольку мыши, нуль-зиготные по N4, также проявляют дефекты ангиогенеза сетчатки, наблюдаемое увеличение подкожной жировой ткани может быть следствием дисфункции эндотелиальных клеток. Таким образом, авторы настоящего изобретения также определят, существуют ли отличия в сосудах жировой ткани мышей, мутантных по Notch.
Восьмая серия экспериментов
Ловушка Notch1 крысы, присутствующая в сыворотке мыши
Тестировали стабильность состава ловушки Notch1 крысы в кровотоке млекопитающего. Как представлено на фигуре 118, ловушки Notch являются стабильными в кровеносной системе млекопитающих.
Мышам Nude инъецировали контрольный аденовирус или аденовирус, экспрессирующий ловушку Notch1 крысы (ловушку rN1). Через 2 недели после инъекции сыворотку собирали и 4 микролитра оценивали вестерн-блот анализом. Этот анализ демонстрирует, что полноразмерный белок ловушки Notch1 крысы (см. стрелку на фигуре 118) может экспрессироваться у мышей и присутствует на поддающихся детекции уровнях с небольшими признаками деградации.
Девятая серия экспериментов
Ловушка Notch1 человека (ловушка h-Notch (1-36)) и ловушка Notch 1 крысы блокируют рост опухоли молочной железы мыши
Активность ловушки Notch1 человека и ловушки Notch1 крысы сравнивали в отношении роста клеточной линии опухоли молочной железы Mm5MT-FGF4. Как представлено на фигуре 119, как ловушка hNotch1, так и ловушка rNotchl снижают скорость роста Mm5Mt-FGF4.
Авторы настоящего изобретения разработали модель опухоли, в которой используются клетки Mm5MT-FGF4, выросшие у мышей nude. В этом эксперименте 2×105 клеток Mm5MT-FGF4 имплантировали мышам nude, и через четверо суток аденовирус, кодирующий контроль в виде Fc, ловушку Notch1 крысы или ловушку Notch1 человека, инъецировали в глазную вену. Ловушки Notch продуцируются инфицированной аденовирусом печенью мышей и секретируются в кровоток (пример на фигуре 118). Кривая роста, представленная на фигуре 119, демонстрирует, что как ловушка Notch1 крысы, так и ловушка Notch1 человека снижали рост ксенотрансплантатов опухоли у мышей nude.
Ловушка Notch1 крысы ингибирует метастазы SKNEP1 в легочную ткань
Ловушка Notch1 может блокировать метастазы в модели на мышах. Авторы настоящего изобретения тестировали активность ловушки Notch1 крысы против роста опухоли и метастазов клеточной линии саркомы Юинга, SKNEP. В этой модели опухоли опухолевые клетки SKNEP ортотопно имплантируют в почку, где опухоль растет, а затем метастазирует в легкое. Экспрессия ловушки Notch1 крысы в клетках опухоли SKNEP снижала рост опухоли и метастазирование в легкое, как представлено на фигуре 120.
Клетки саркомы Юинга SKNEP1 программировали для экспрессии контрольного белка Fc или ловушки Notch1 крысы s1 (тип 2) или ловушки Notch1 крысы s4 (тип 4). Эти клеточные линии SKNEP1 ортотопно имплантировали в почку мышей nude. После роста опухоли в течение 6 недель проводили гистологическую оценку метастазов в легкое. Клетки SKNEP1, экспрессирующие ловушку Notch1 крысы, показали меньшую часть легких, которая была положительной по метастазам. Авторы настоящего изобретения сделали заключение, что экспрессия ловушки Notch1 крысы у мышей nude снижает способность клеток SKNEP1 к метастазированию в легкое.
Десятая серия экспериментов
Notch1 и Notch4 коэкспрессируются с VEGFR-3 и LYVE-1 в лимфатических сосудах кожи мыши
Notch1 и Notch4 экспрессируются в лимфатических сосудах кожи мыши
Авторы настоящего изобретения проанализировали экспрессию Notch1 и Notch4 в сосудах кожи спины мыши P4. В этот момент времени лимфатические сосуды кожи активно ремоделируются в лимфатические капилляры вблизи поверхности и собирающие протоки в нижних слоях кожи. Поперечные срезы кожи размером 5 мкм совместно окрашивали антителами против Notch1 или Notch4 (красный), и PECAM, VEGFR-3 или LYVE-1 (зеленый). Notch1 и Notch4 обладают перекрывающимся паттерном экспрессии с маркером эндотелиальных клеток кровеносных и лимфатических сосудов, PECAM (верхние панели, фигура 121). Notch1 и Notch4 коэкспрессировались как с VEGFR-3 (средние панели, фигура 121), так и с LYVE-4 в сосудах кожи (нижние панели, фигура 121). Этот паттерн экспрессии демонстрирует, что Notch1 и Notch4 экспрессируются и могут функционировать в лимфатических сосудах неонатального дермиса.
Лимфатические капилляры дермы изменены у мышей, мутантных по Notch4
Авторы настоящего изобретения оценивали лимфатические сосуды дермы мышей P4. Срезы от мышей дикого типа и нуль-зиготных по Notch4 окрашивали антителами против PECAM и LYVE-1 (зеленый). Анализ окрашивания PECAM выглядел сходно между мутантной кожей и кожей дикого типа (верхние панели, фигура 122). Напротив, положительные по LYVE-1 сосуды в коже мутантов по Notch4 имели морфологию, отличающуюся от сосудов дикого типа (средние панели, фигура 122). Мутантные по Notch4 сосуды LYVE-1 часто были расширенными, и окрашивание LYVE-1 было прерывистым (нижние панели, фигура 122). Эти результаты указывают на то, что передача сигнала Notch4 может быть вовлечена в ремоделирование лимфатического сосудистого сплетения.
Утрата Notch4 приводит к снижению количества положительных по LYVE-1 клеток
Гетерозиготных по Notch4 (N4+/-) мышей скрещивали, и кожу спины полученных детенышей удаляли и заливали на 14 сутки после рождения. Результаты представлены на фигуре 123. Поперечные срезы кожи подвергали иммунному окрашиванию на маркер эндотелиальных клеток, PECAM (данные не представлены), или маркер лимфатических эндотелиальных клеток, LYVE1 (A). В каждом случае регистрировали пять областей посредством микроскопии, и окрашивание PECAM и LYVE1 подвергали количественному определению с использованием программного обеспечения для визуализации (B, C). Экспрессия PECAM была снижена приблизительно на 25% в коже N4-/- по сравнению с кожей дикого типа (WT) (B). Окрашивание LYVE-1 было более изменено, чем окрашивание PECAM, причем окрашивание LYVE1 было снижено практически на 50% у мышей N4-/- относительно мышей WT (C). Также происходило снижение интенсивности окрашивания LYVE1 в лимфатических сосудах N4-/- относительно WT (A).
Утрата функции Notch4 у мышей нарушает развитие лимфатических сосудов кожи, указывая на роль в лимфангиогенезе.
Notch1 и Notch4 экспрессировались при раке молочной железы человека
Авторы настоящего изобретения провели двойную иммуногистохимию с антителами против VEGFR-3 или LYVE-1 (зеленый) и Notch1 или Notch4 (красный) рака молочной железы. Результаты представлены на фигуре 124. Notch1 и Notch4 экспрессировались во внеопухолевой крови и лимфатическом эндотелии микрокапилляров карцином молочной железы человека. Для определения того, происходит ли активация передачи сигнала Notch1 в лимфатическом эндотелии опухоли, авторы настоящего изобретения провели двойное окрашивание антителом против подопланина (зеленый) и антителом N1Val (красный; клеточная передача сигнала), которое осуществляет специфичную детекцию активированного пептида Notch1. Экспрессию активированного пептида Notch1 наблюдали в большинстве (белые стрелки), но не во всех (желтые стрелки) из ядер лимфатического эндотелия (нижняя панель). Эти результаты демонстрируют, что Notch1 активно передавал сигнал в патологических лимфатических сосудах. Эти результаты также демонстрируют, что Notch1 и Notch4 могут функционировать в лимфангиогенезе опухоли.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОСНОВАННЫЕ НА Notch3 ЧЕЛОВЕКА ГИБРИДНЫЕ БЕЛКИ В КАЧЕСТВЕ ЛОВУШЕК-ИНГИБИТОРОВ ПЕРЕДАЧИ СИГНАЛА Notch3 | 2009 |
|
RU2567662C2 |
| НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ, КОДИРУЮЩАЯ СЛИТЫЙ БЕЛОК, СОСТОЯЩИЙ ИЗ РАСТВОРИМОГО ВНЕКЛЕТОЧНОГО ФРАГМЕНТА ЧЕЛОВЕЧЕСКОГО Dll4 И КОНСТАНТНОЙ ЧАСТИ ТЯЖЕЛОЙ ЦЕПИ ЧЕЛОВЕЧЕСКОГО IgG4 | 2021 |
|
RU2787060C1 |
| СПОСОБЫ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ ИНГИБИТОРОВ ПУТИ ПЕРЕДАЧИ СИГНАЛА NOTCH | 2008 |
|
RU2584579C2 |
| АНТИТЕЛА ПРОТИВ NRR Notch1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2476443C2 |
| ПЕПТИДЫ НАПРАВЛЕННОГО ДЕЙСТВИЯ НА VEGFR-1/NRP-1 | 2008 |
|
RU2488592C2 |
| АНТИТЕЛА ПРОТИВ NOTCH2 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2580029C2 |
| АНТИТЕЛА-АНТАГОНИСТЫ ПРОТИВ Notch3 И ИХ ПРИМЕНЕНИЕ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ СВЯЗАННЫХ С Notch3 ЗАБОЛЕВАНИЙ | 2007 |
|
RU2493167C2 |
| ТЕРАПЕВТИЧЕСКИЕ СПОСОБЫ ЛЕЧЕНИЯ ВАСКУЛЯРНЫХ ЗАБОЛЕВАНИЙ ГЛАЗ АНТАГОНИСТАМИ Dll4 | 2007 |
|
RU2429876C2 |
| АНТИТЕЛА ПРОТИВ NOTCH1 | 2011 |
|
RU2622083C2 |
| СЛИТНЫЙ БЕЛОК АНТИАНГИОГЕННОГО ИНДУЦИРУЮЩЕГО ФАКТОРА И ЕГО ПРИМЕНЕНИЕ | 2012 |
|
RU2560589C2 |









































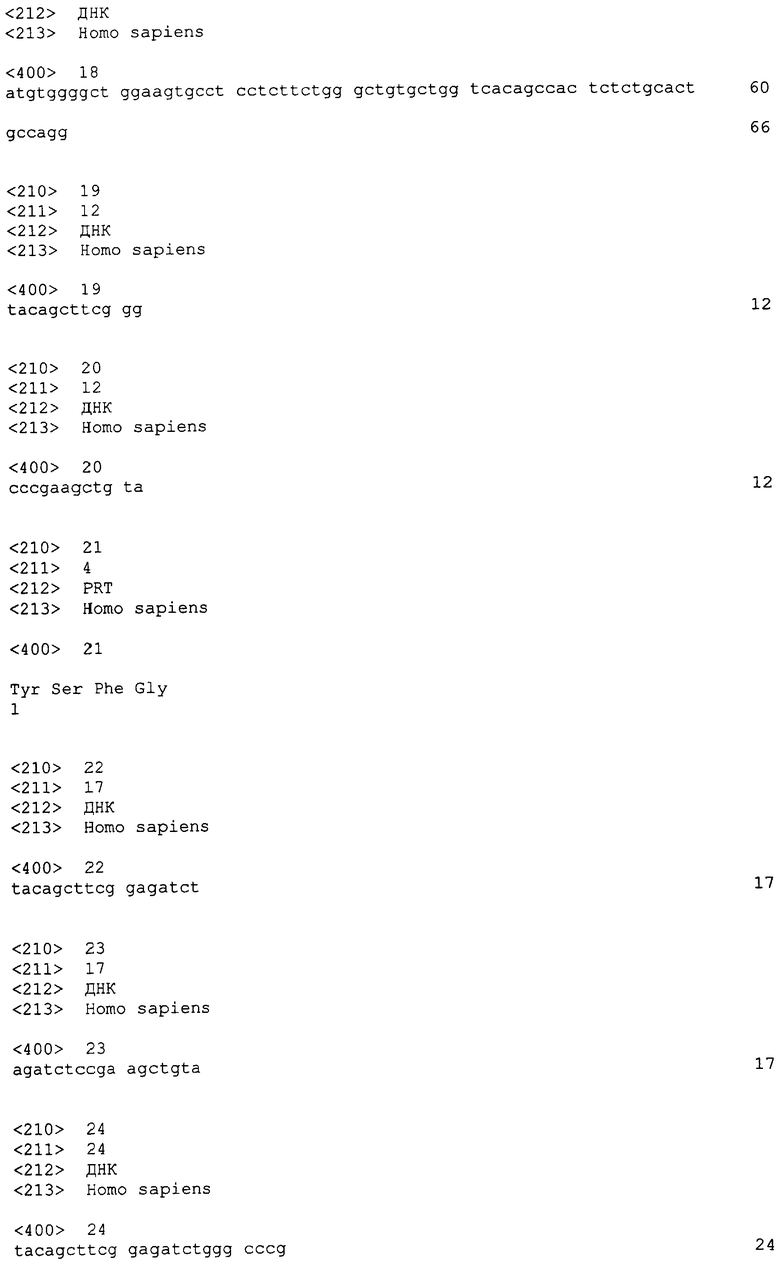


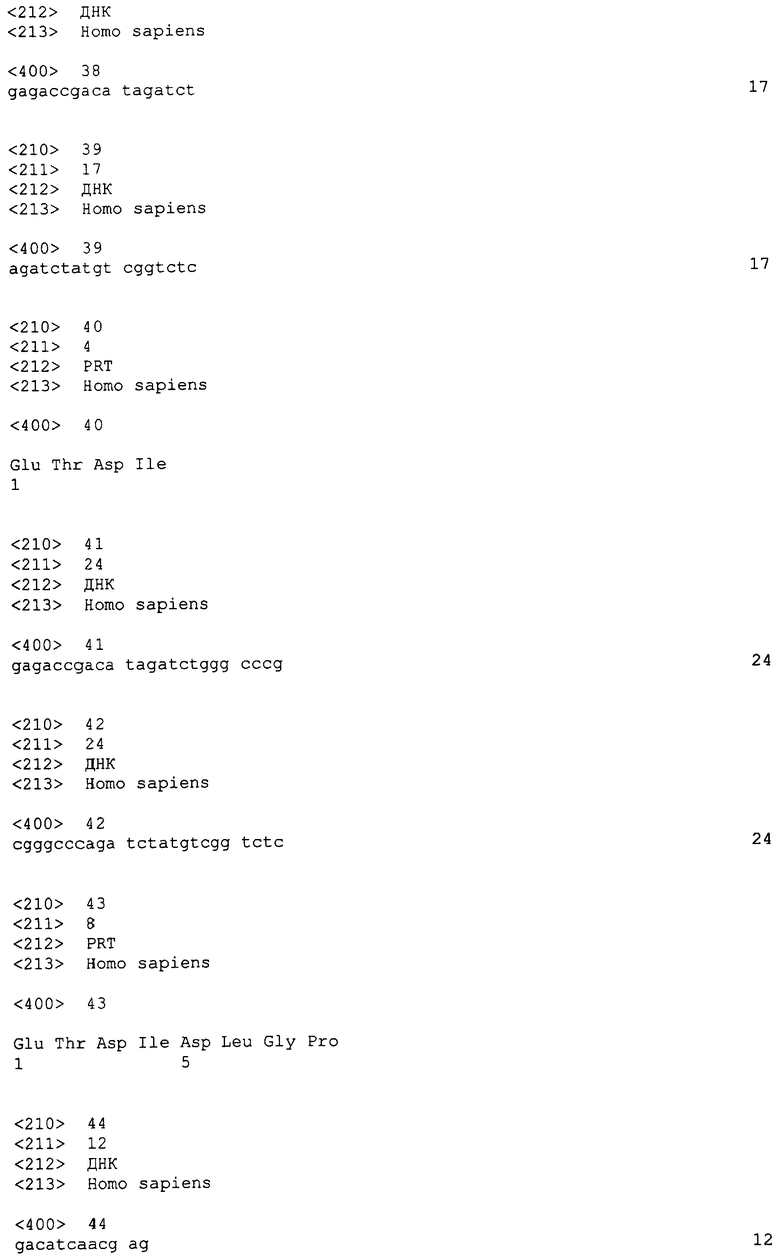

















































































































































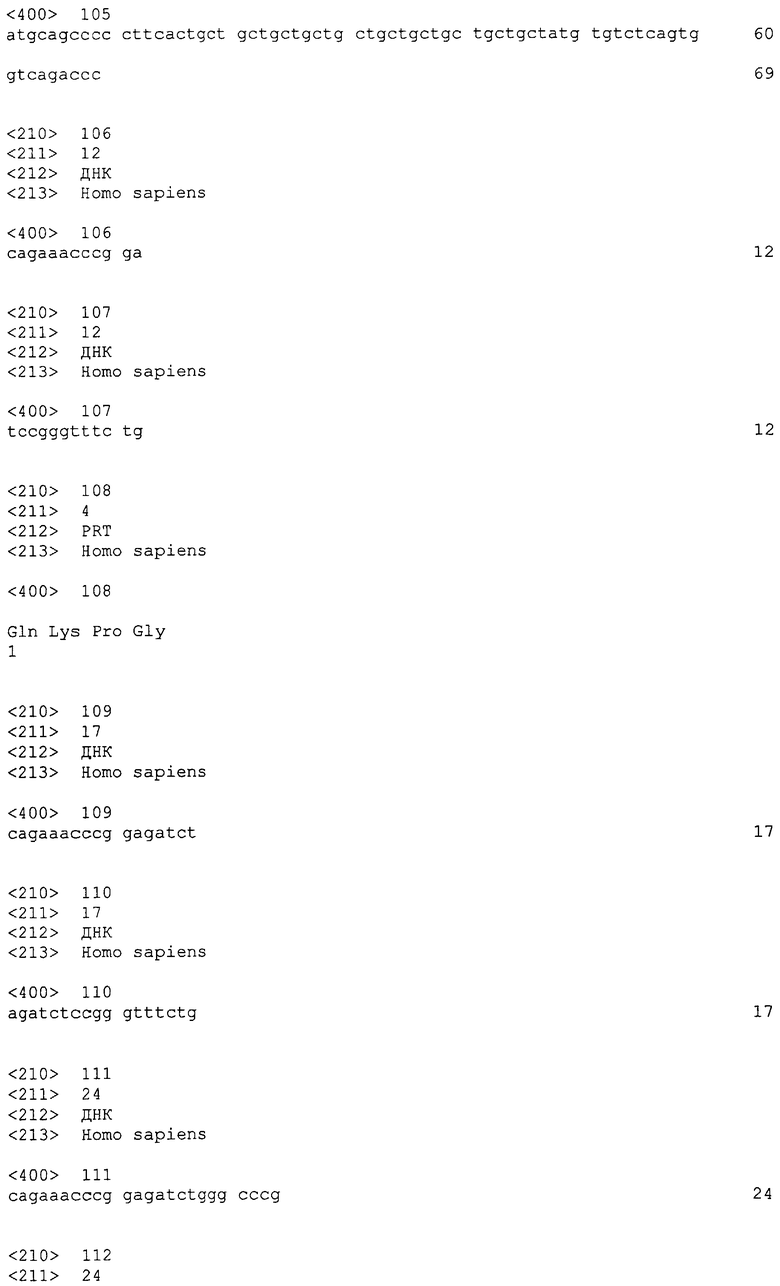




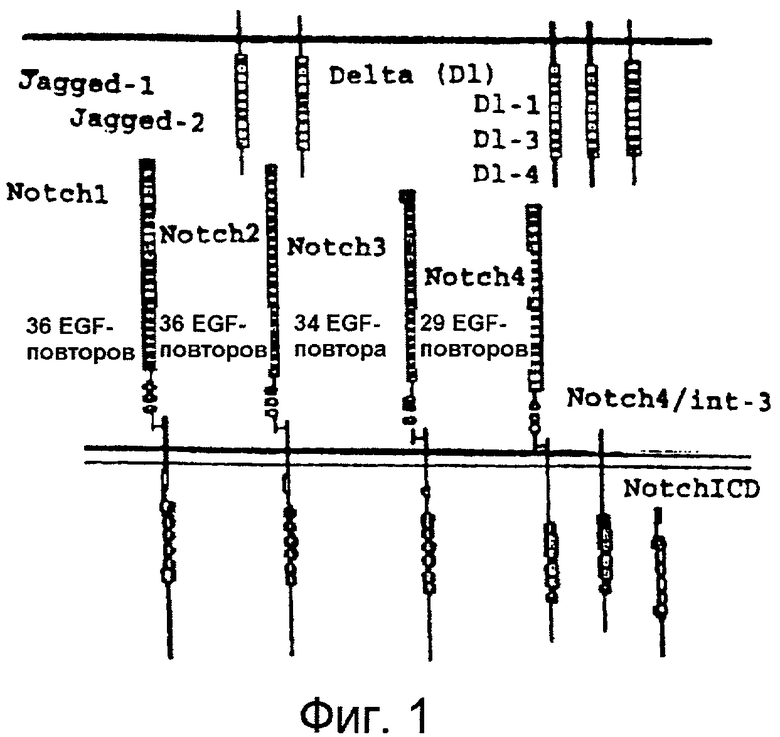
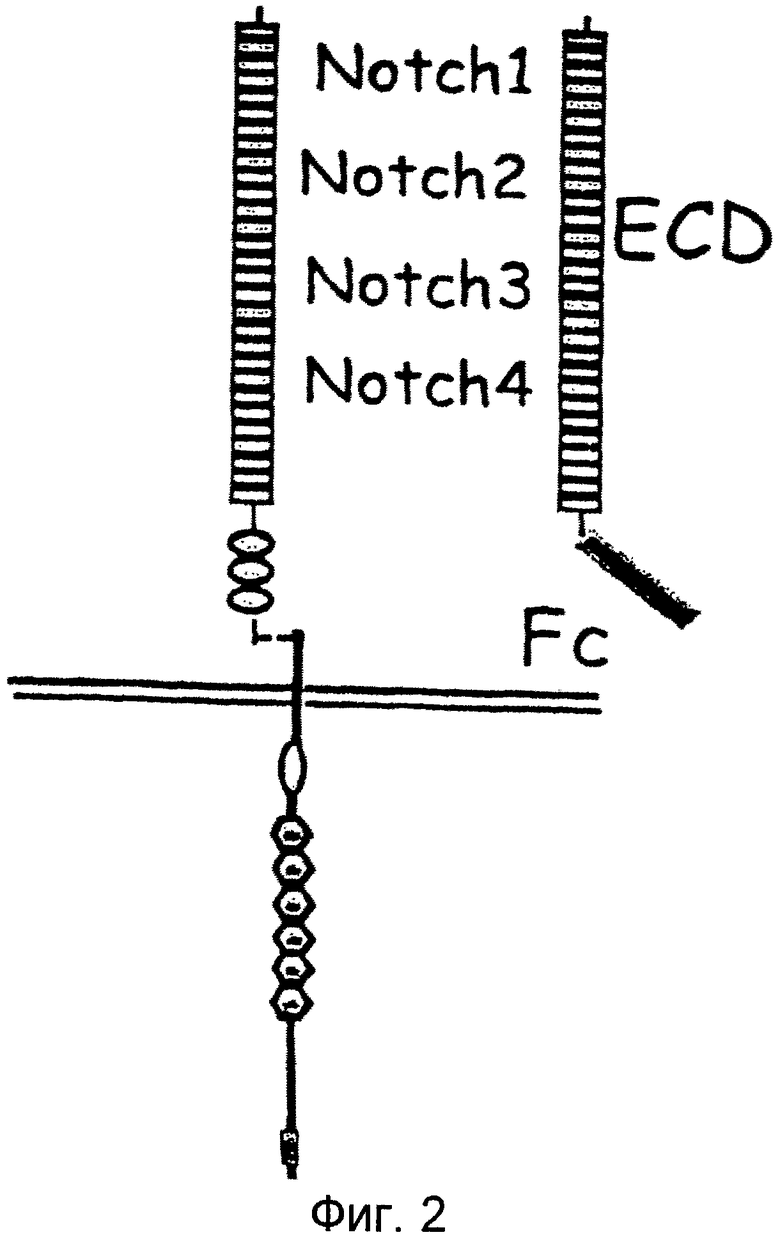
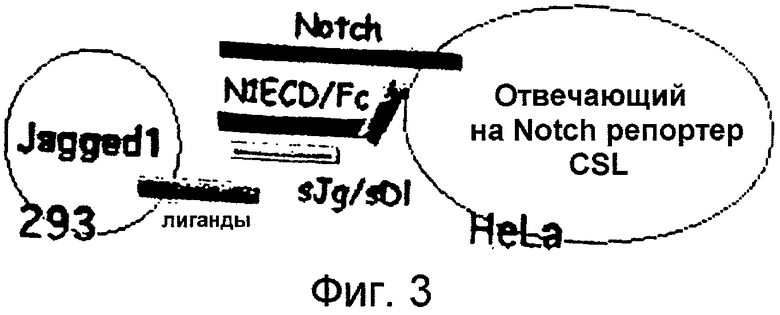
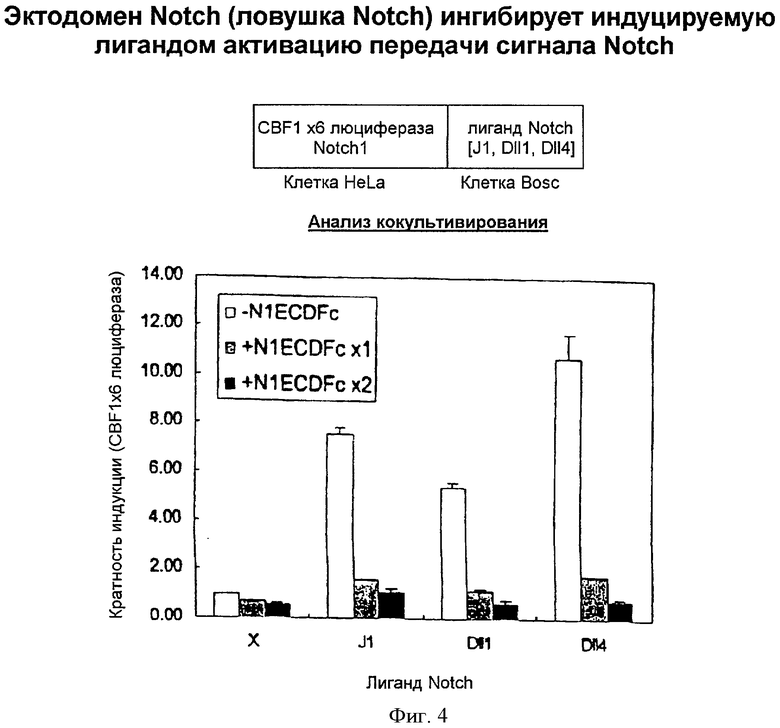
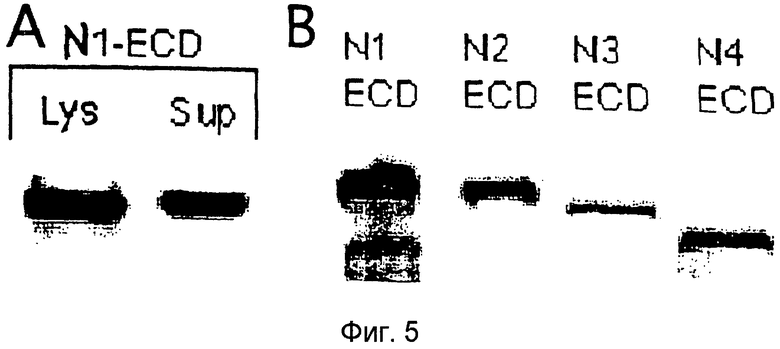
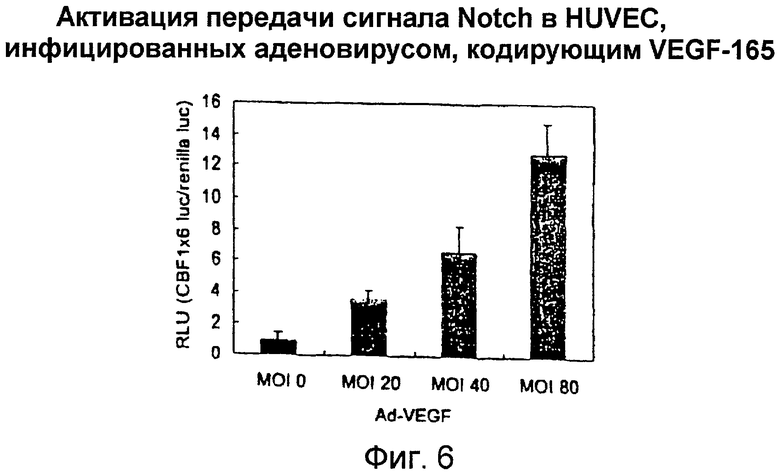
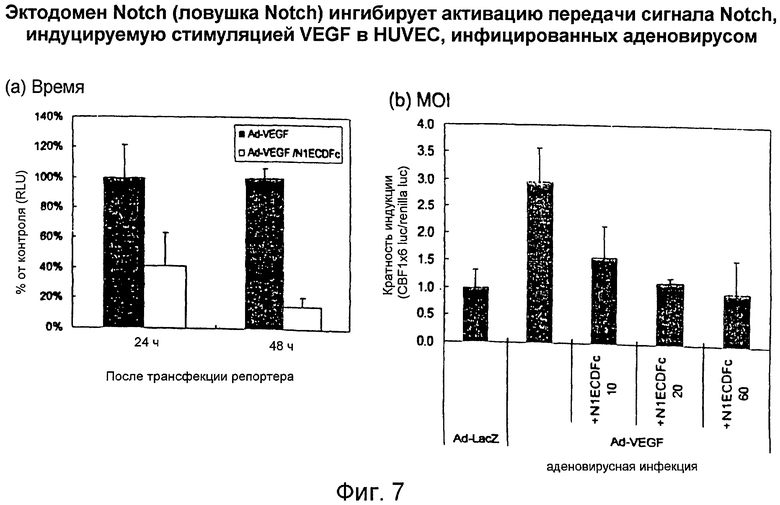
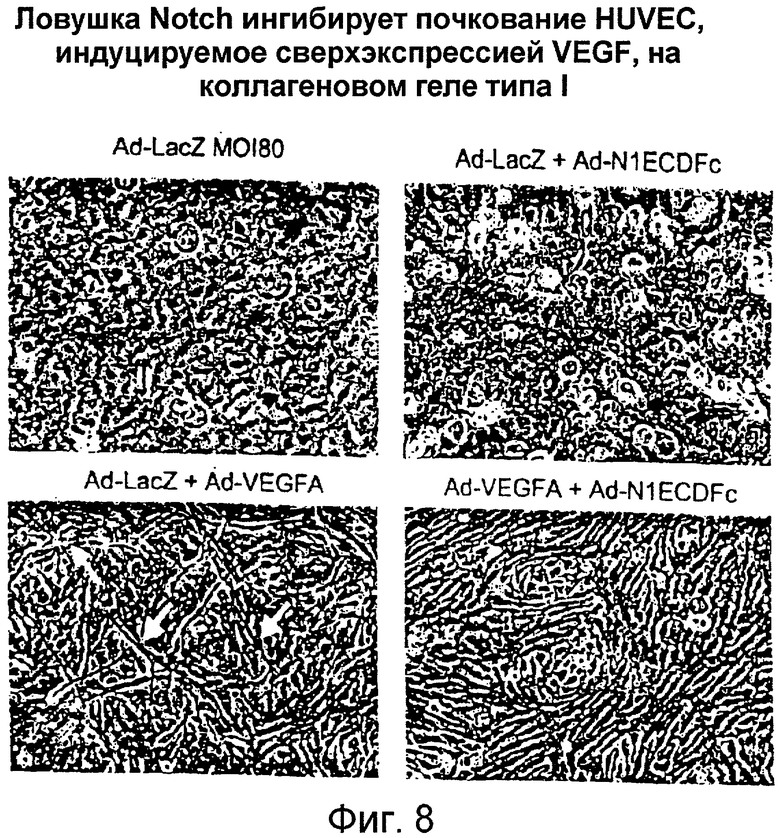
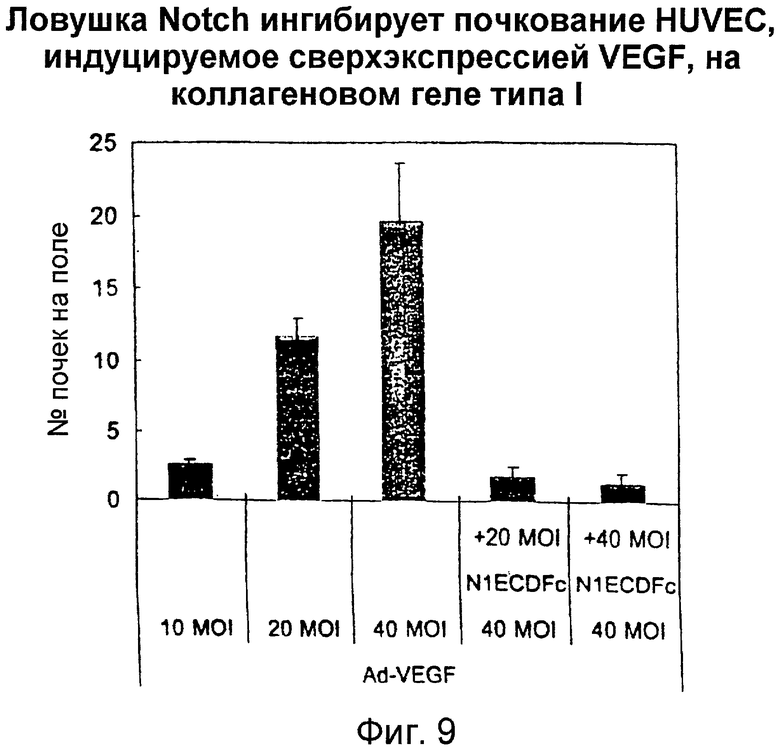













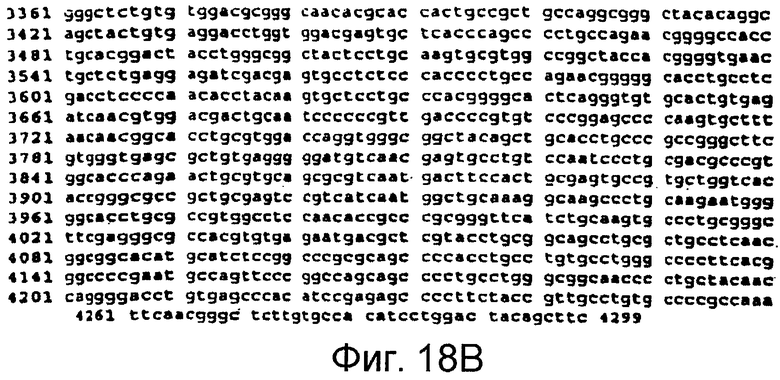



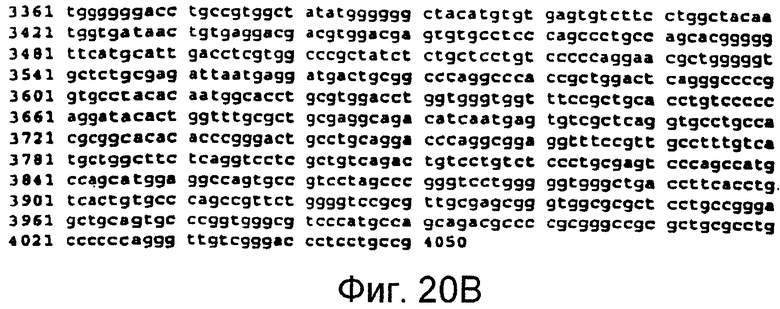


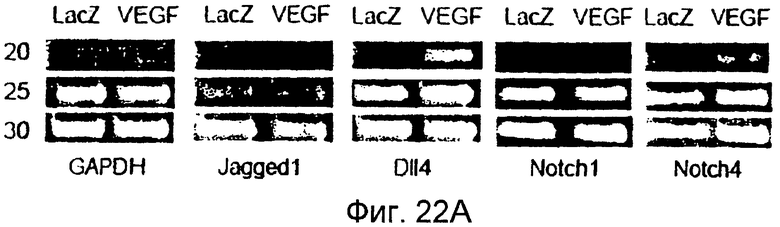
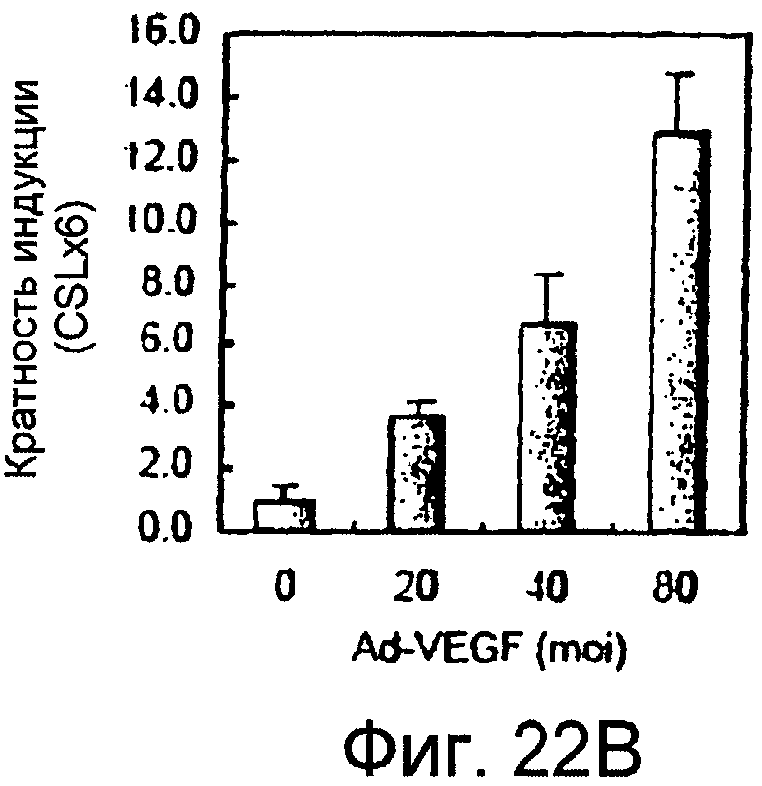
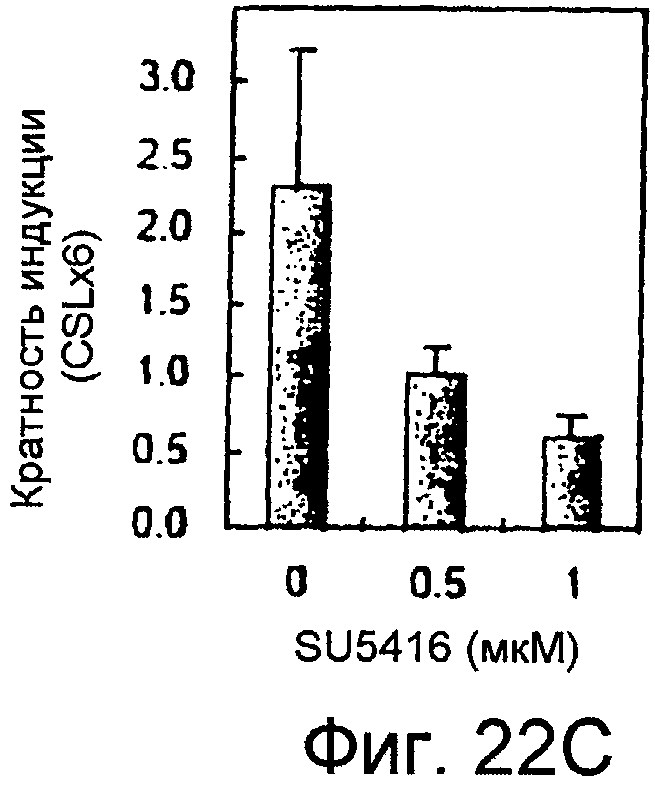
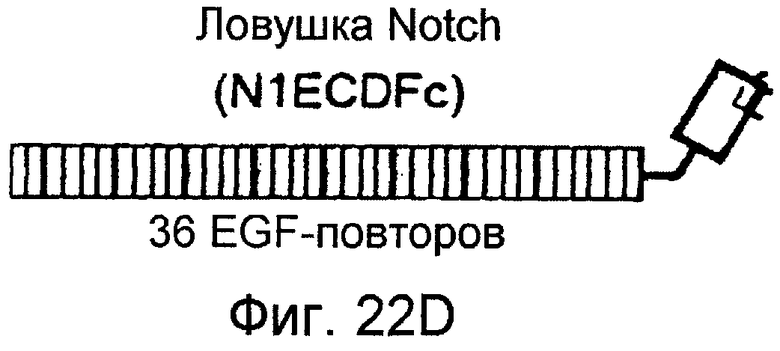
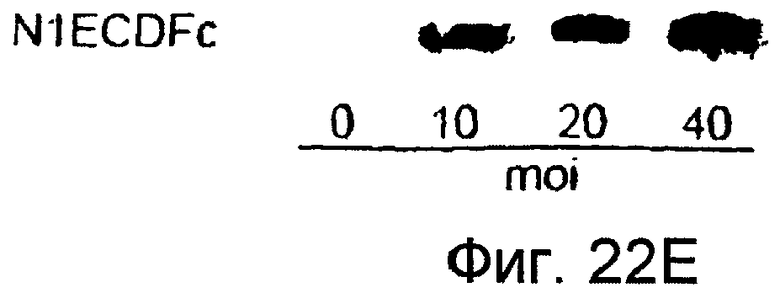
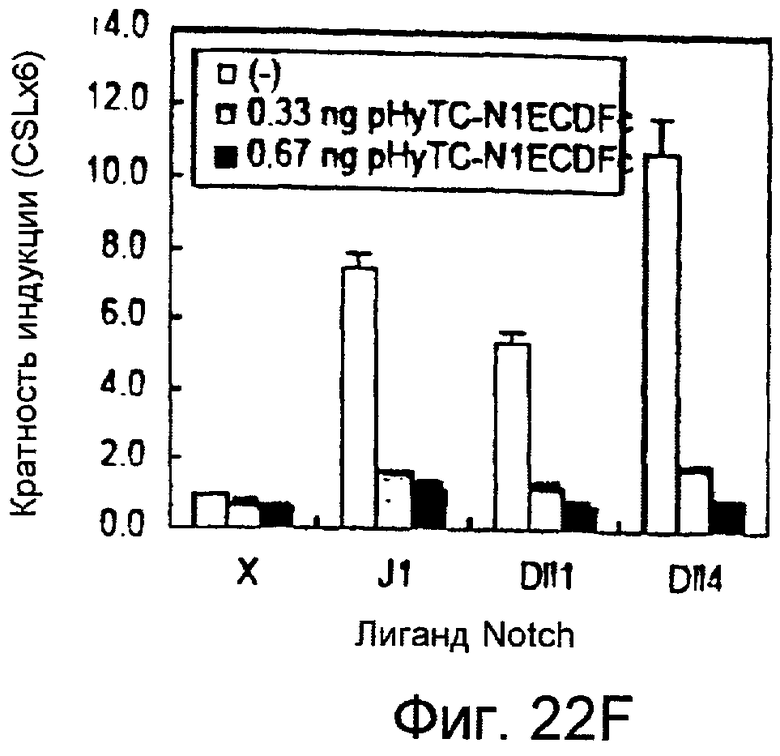
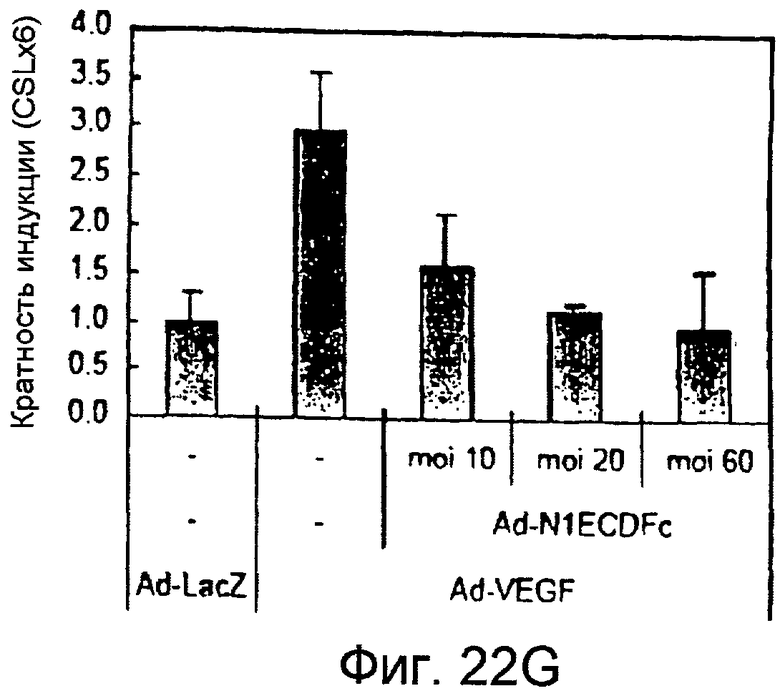
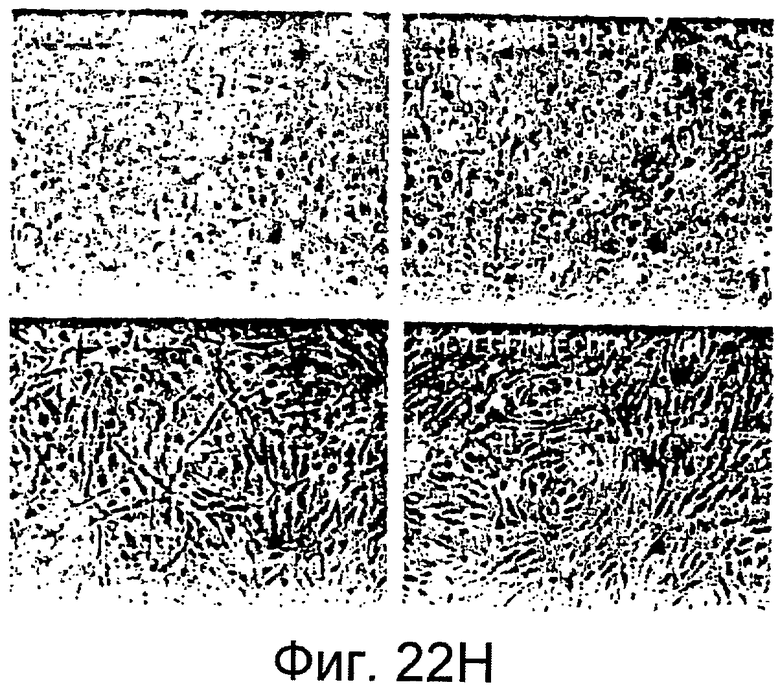
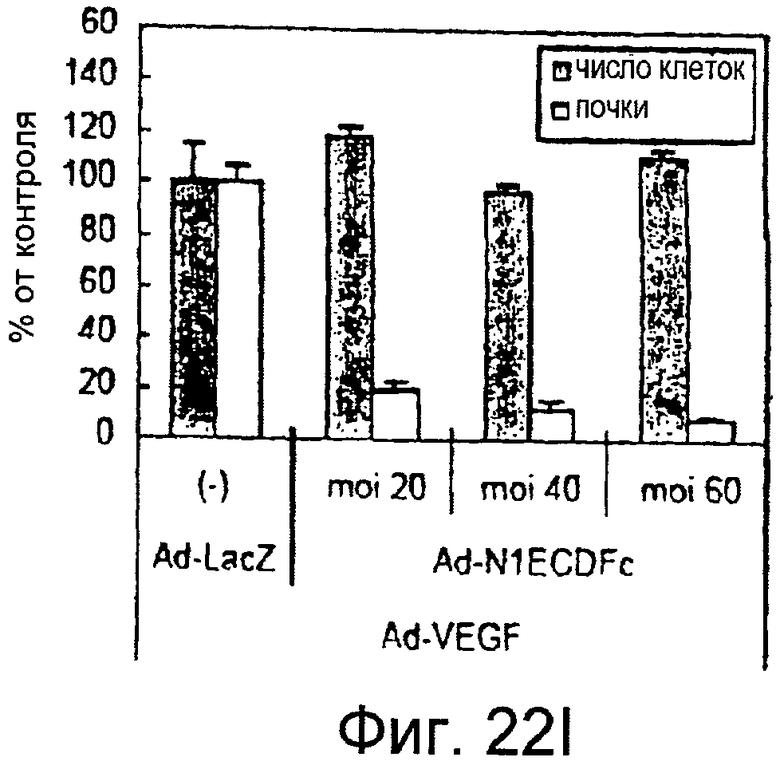

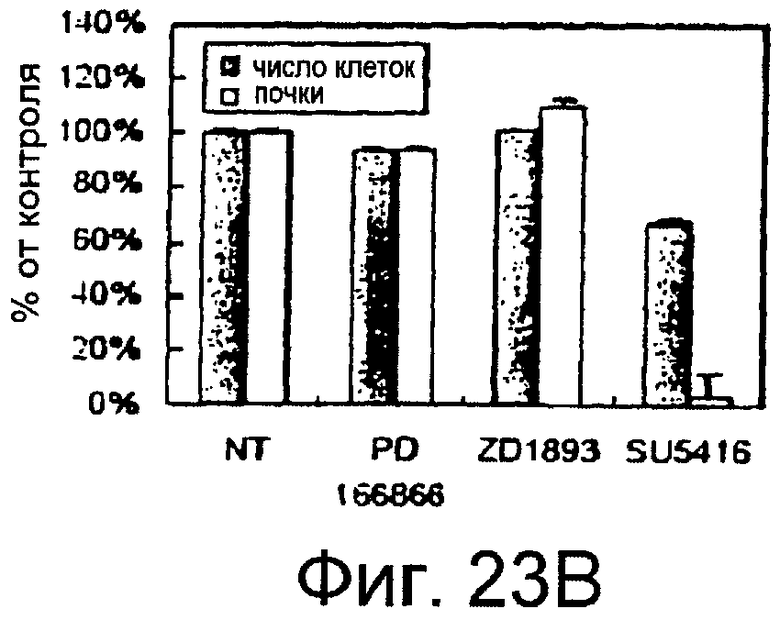
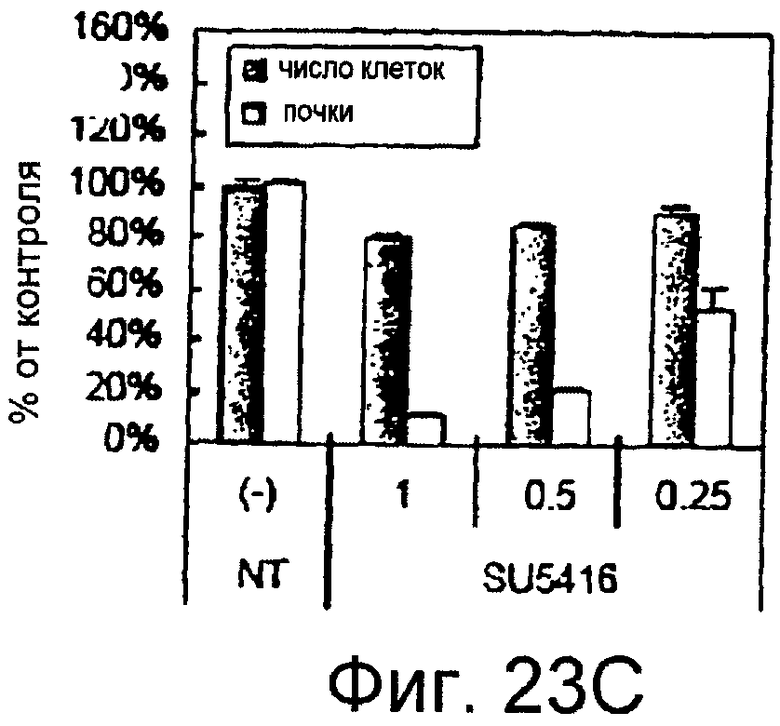
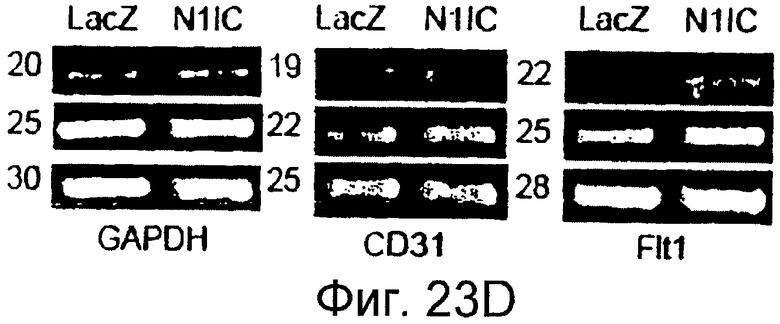
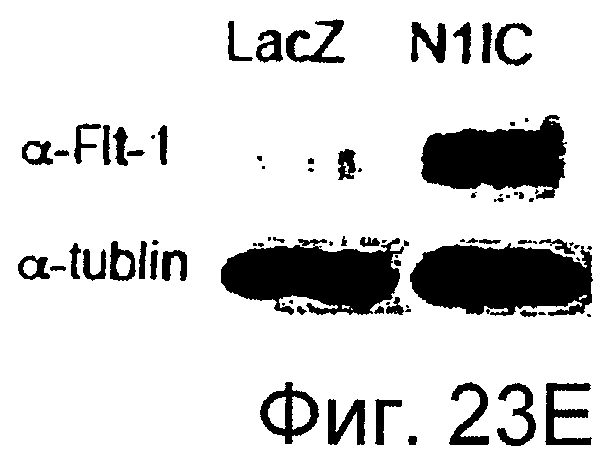
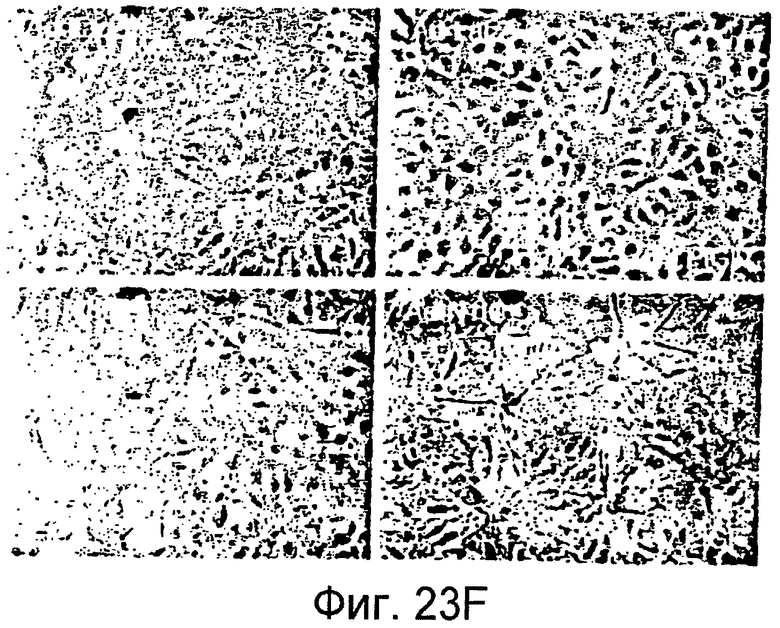

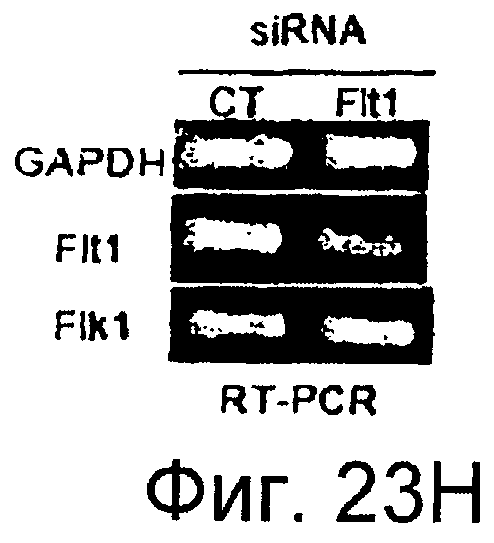
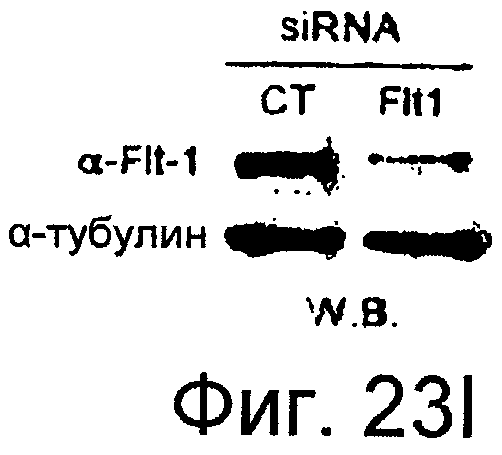
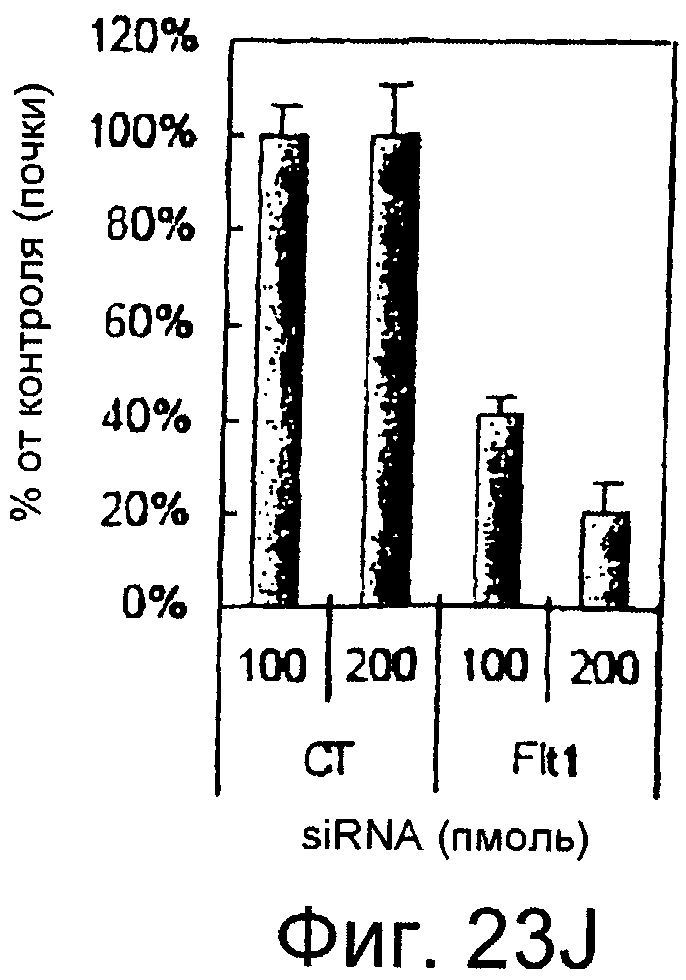

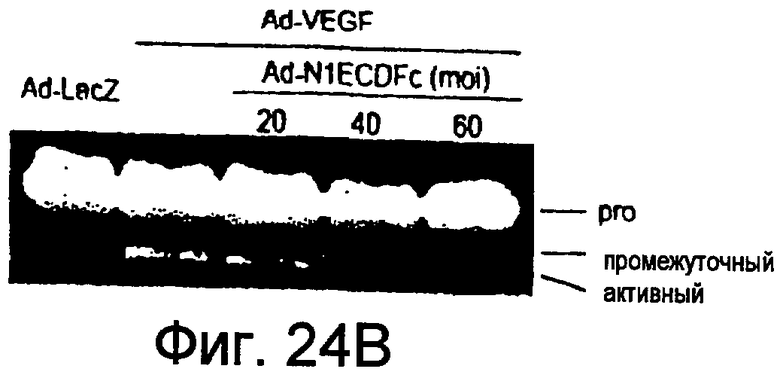
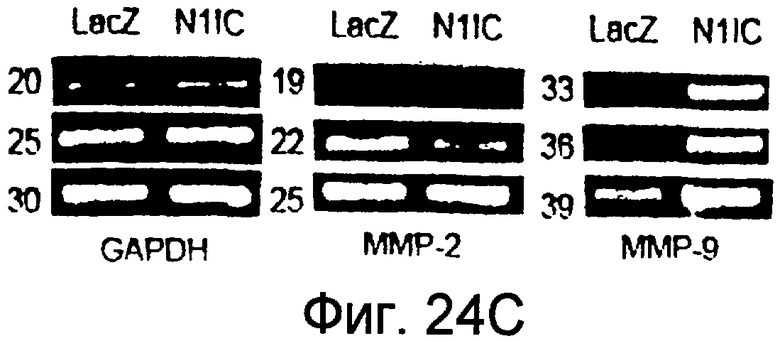
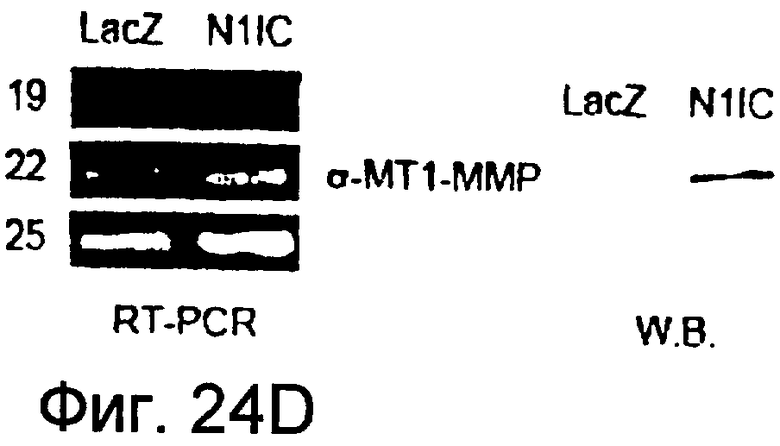
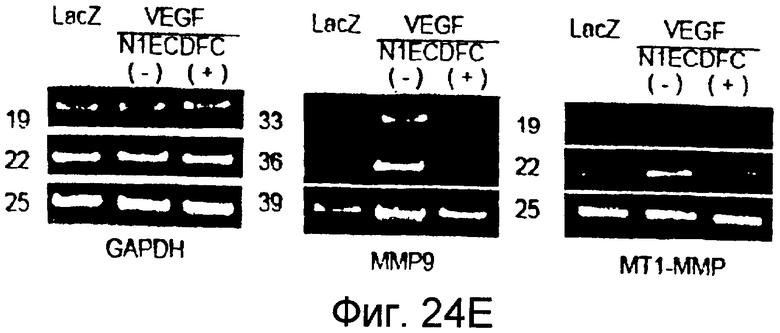
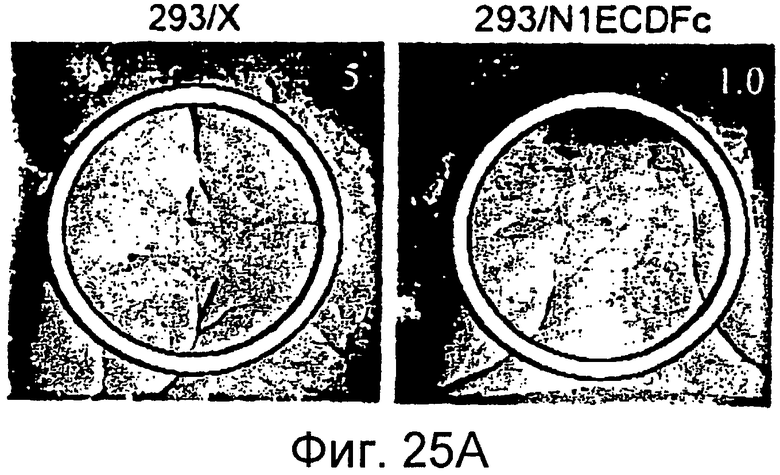
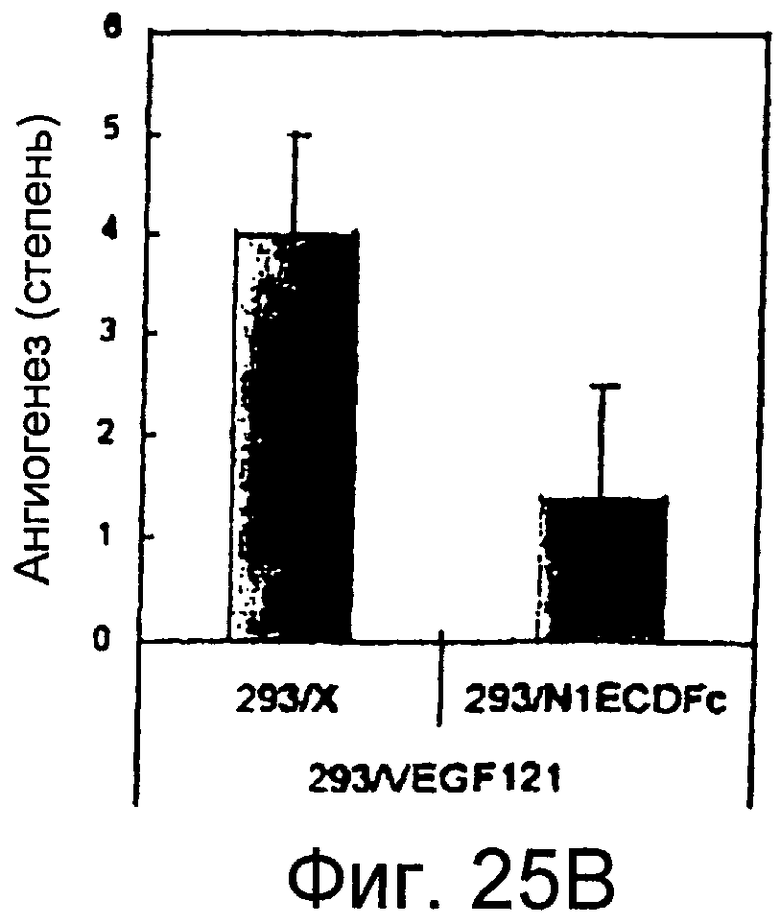

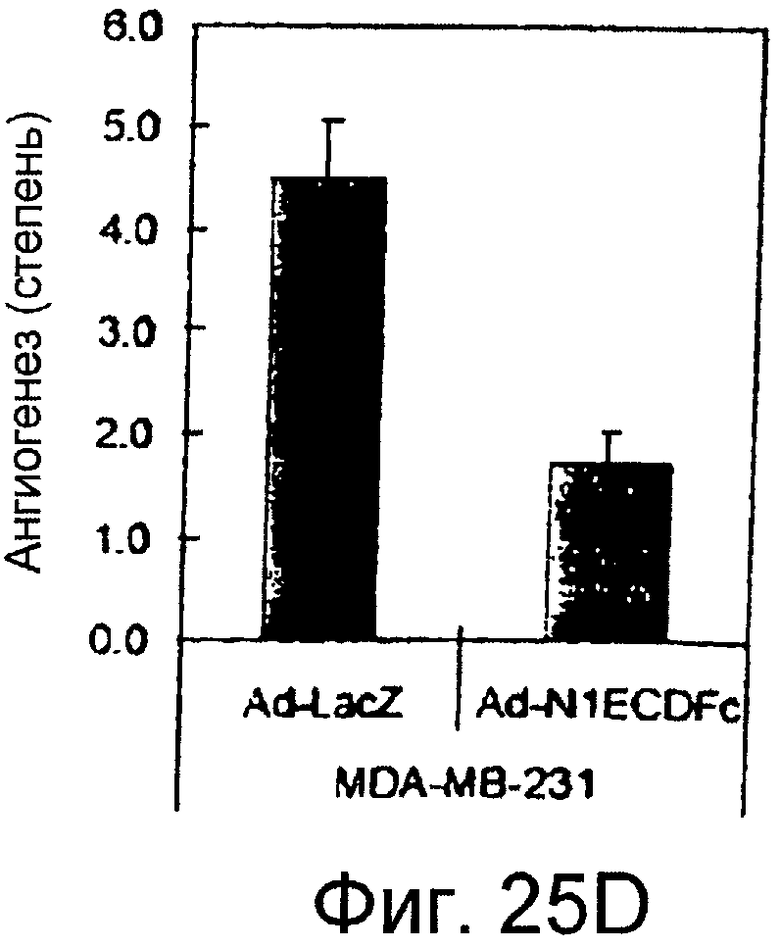
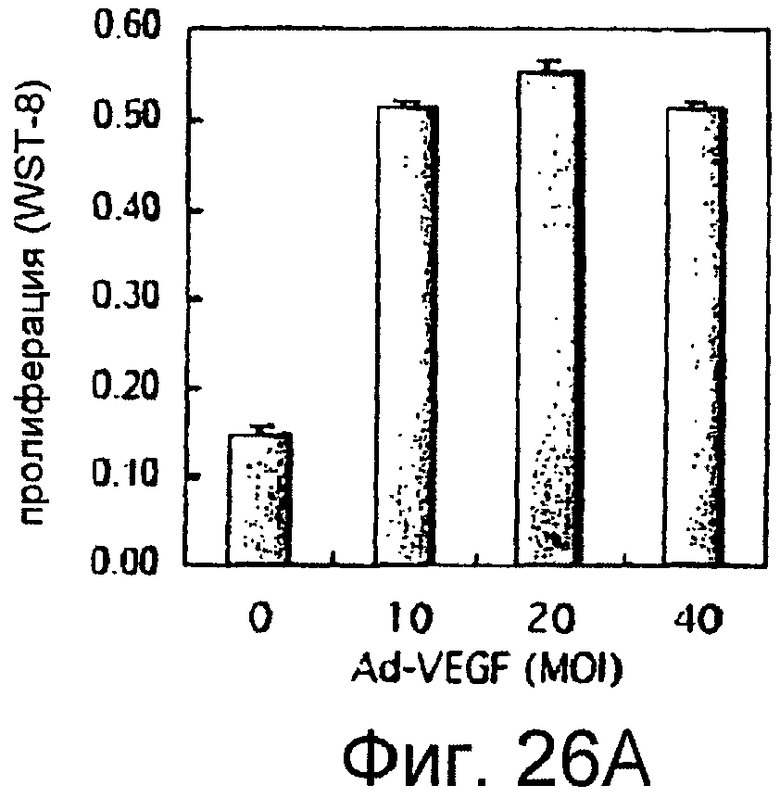
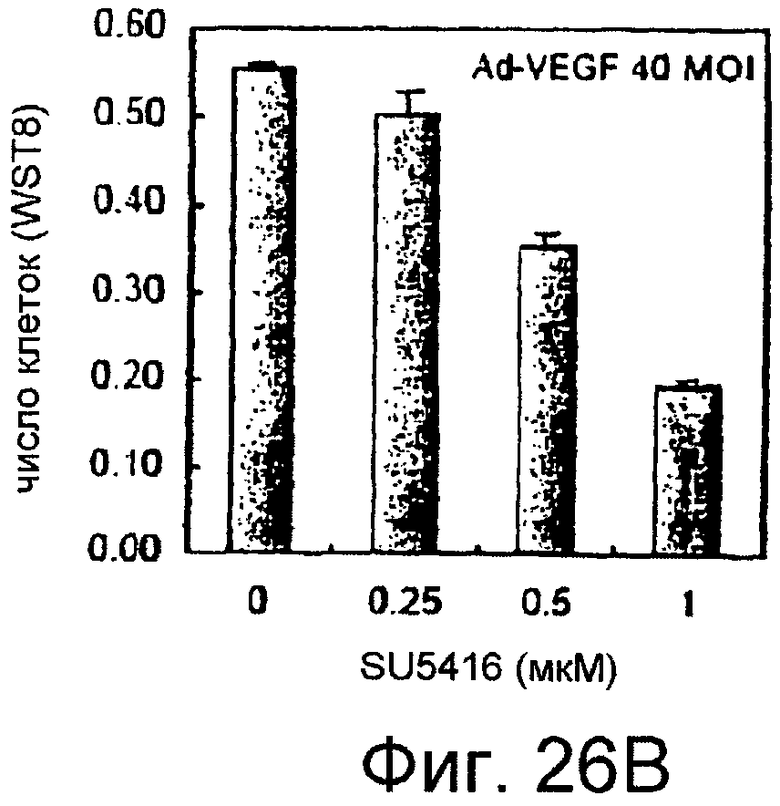
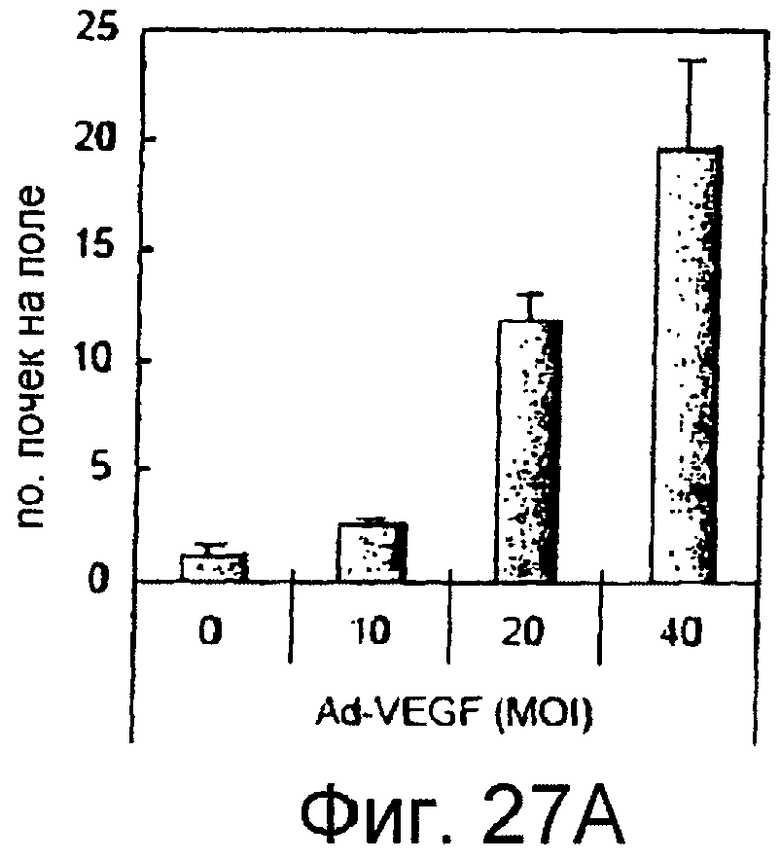
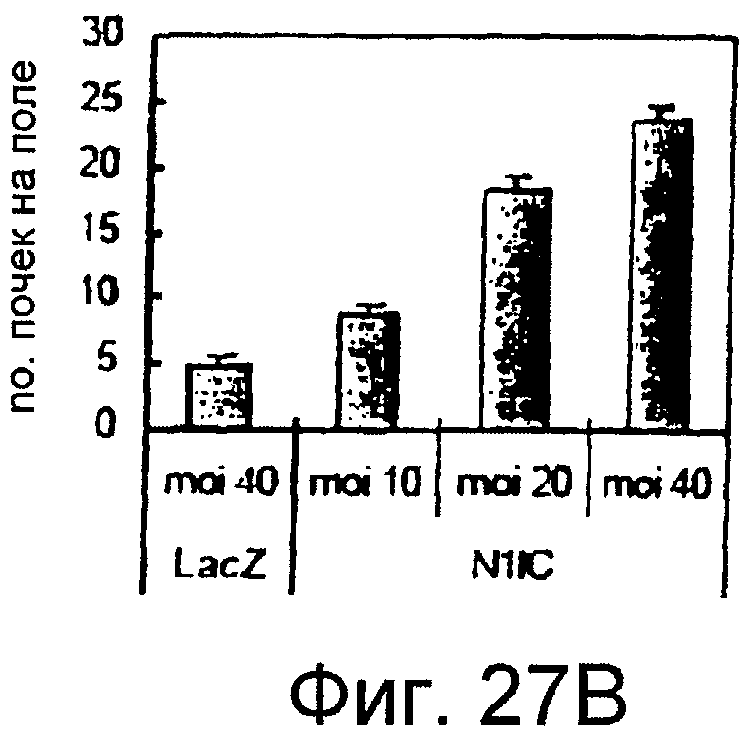
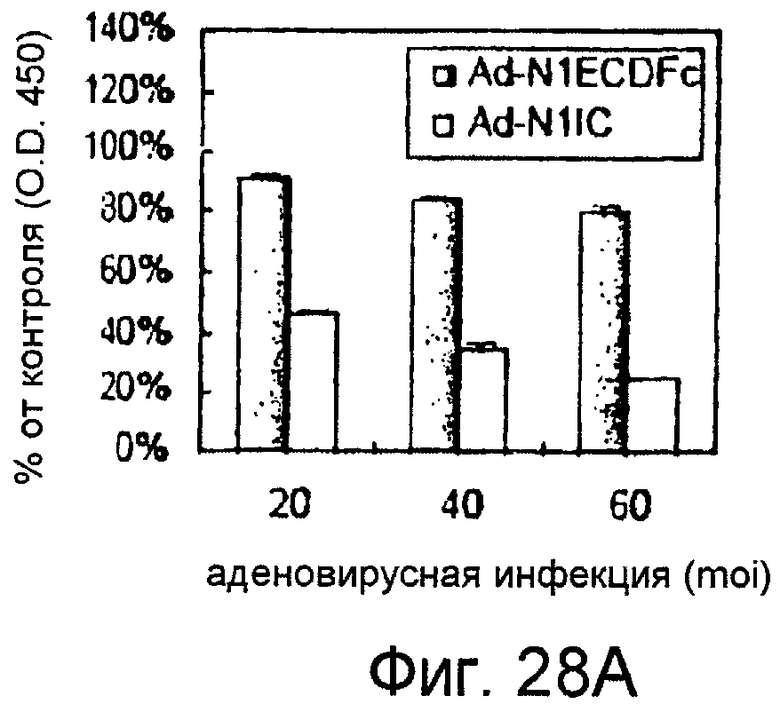
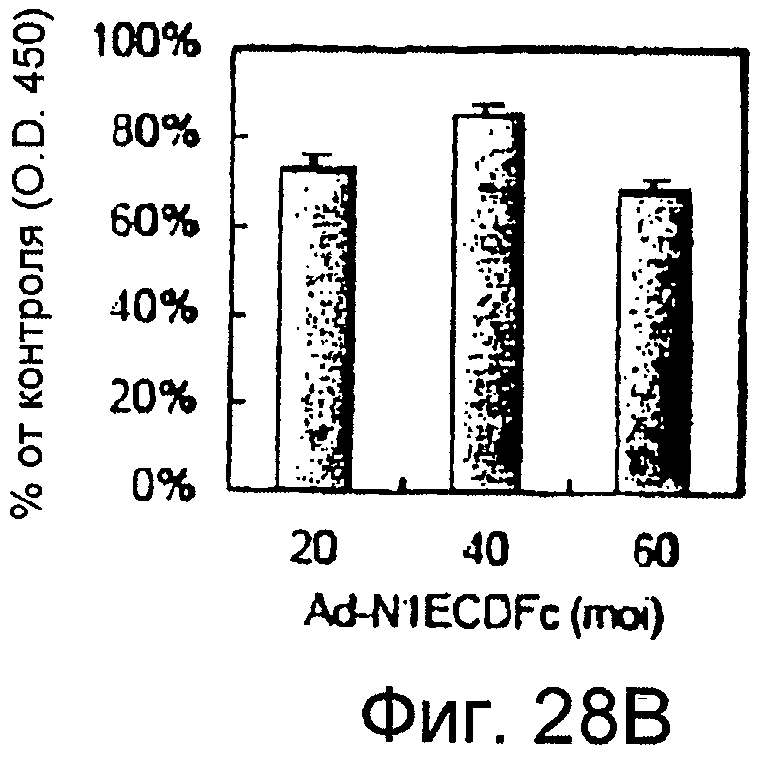
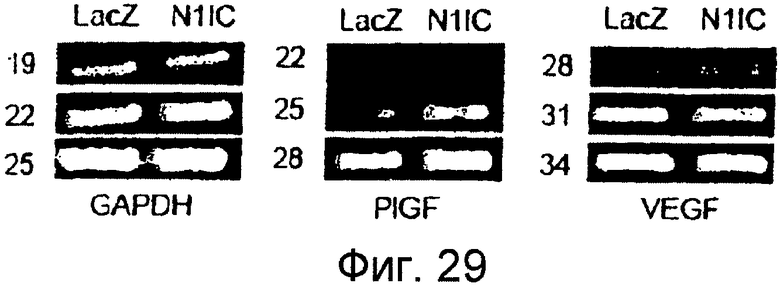
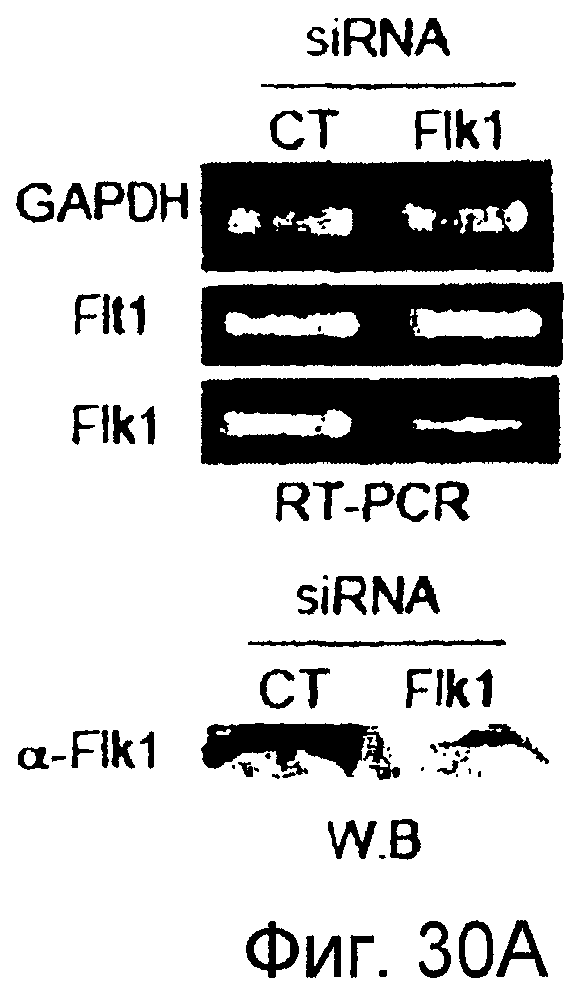
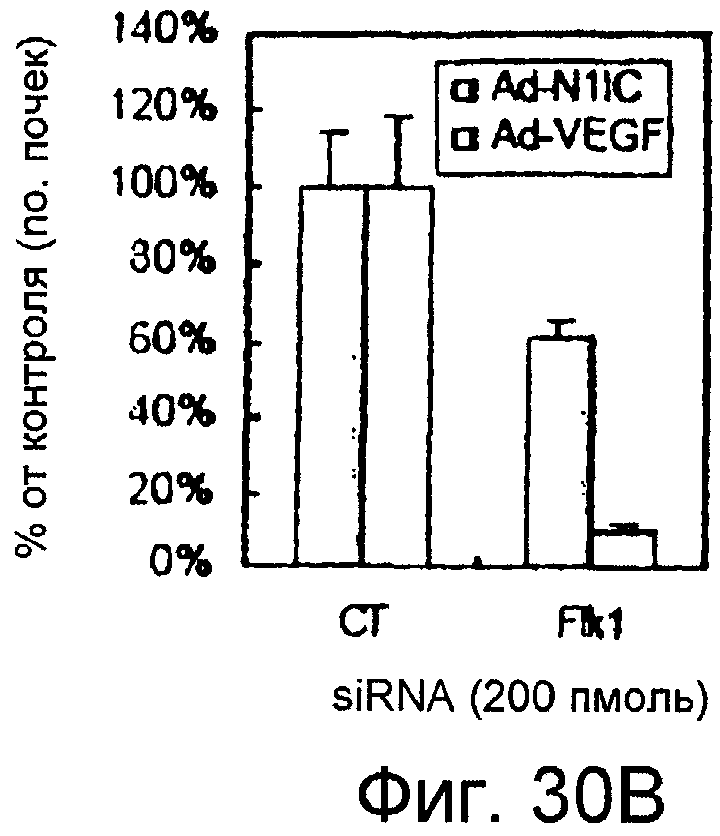

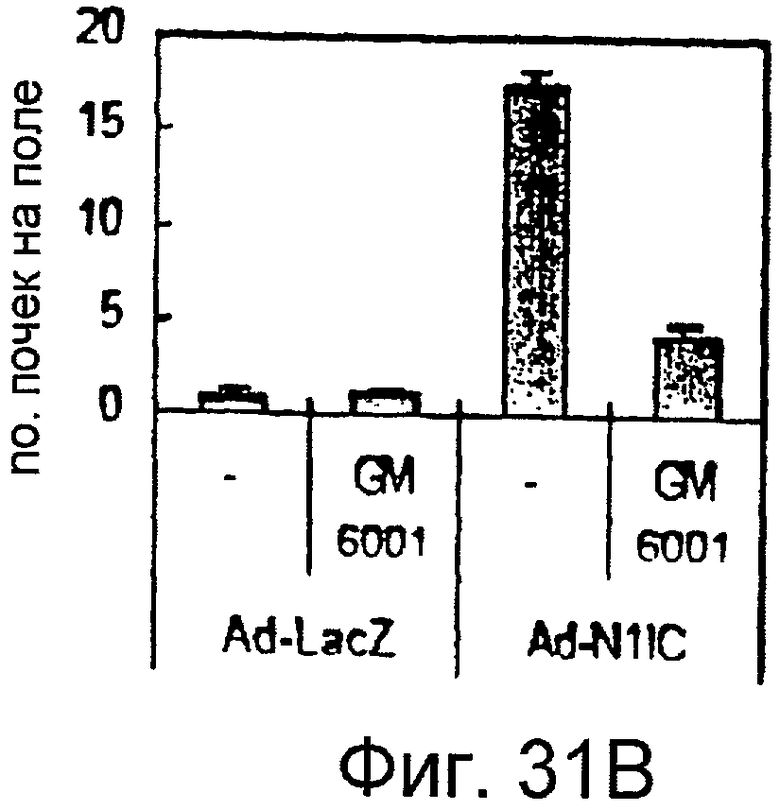
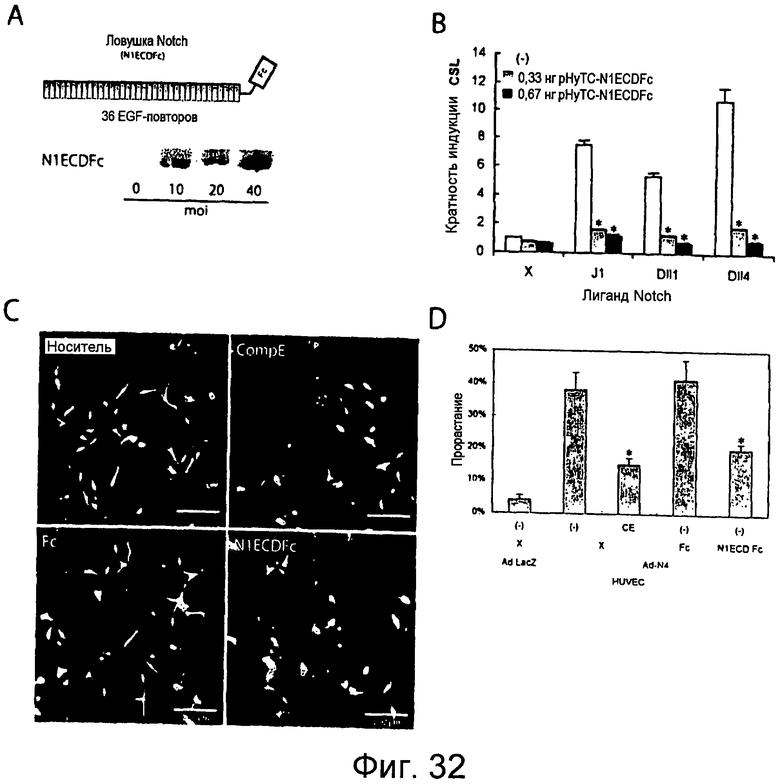
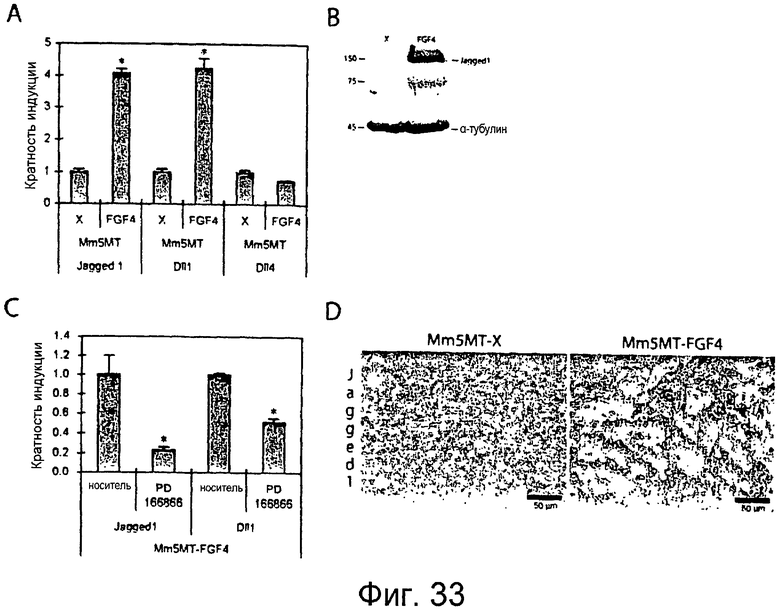
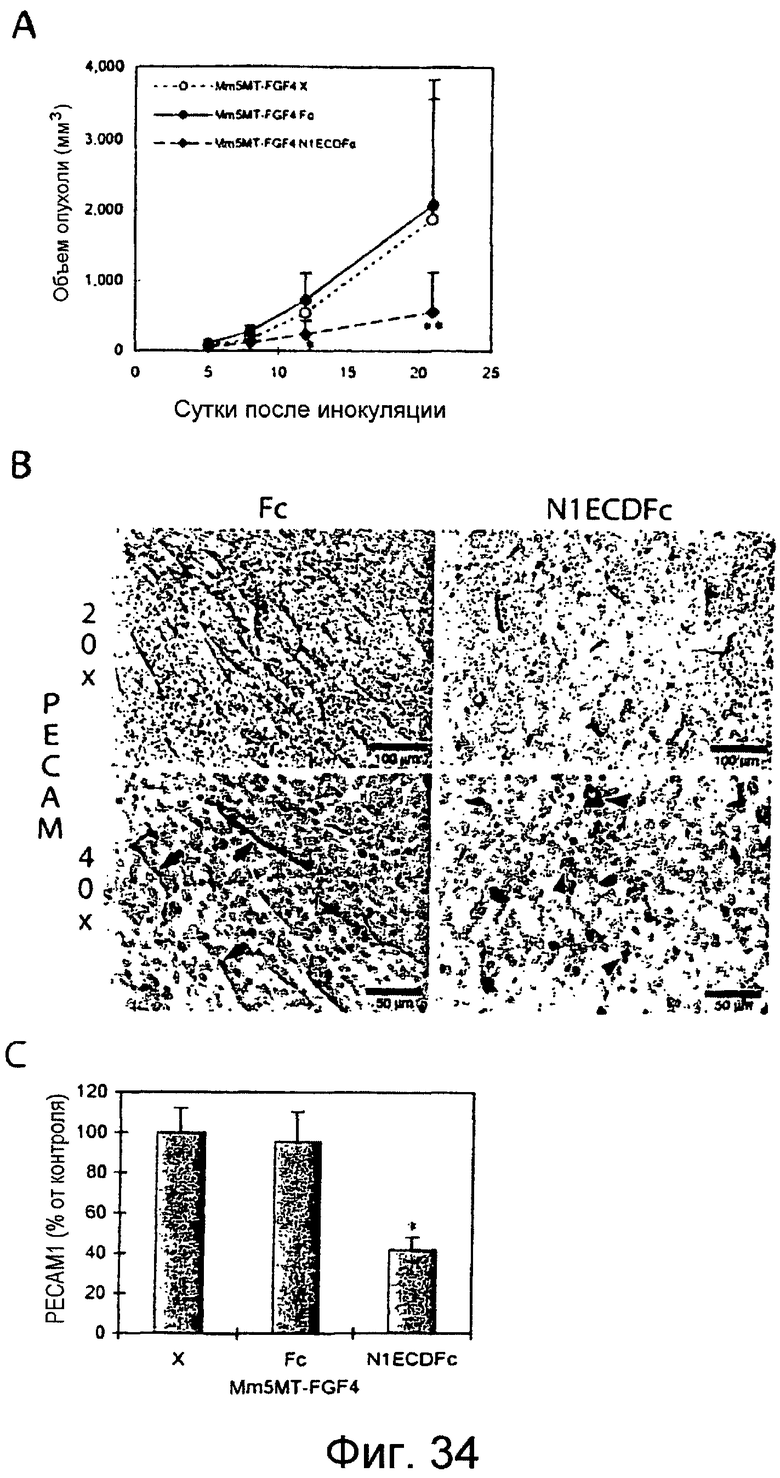
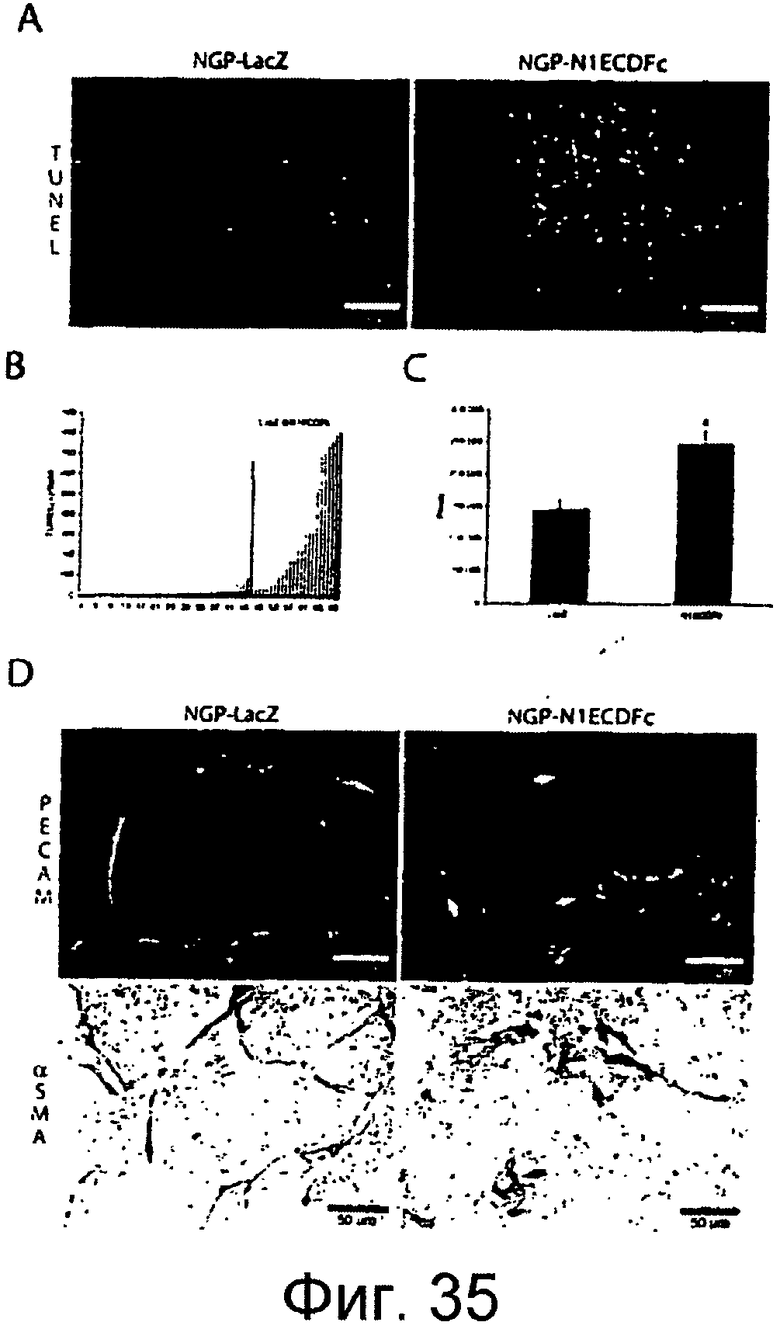
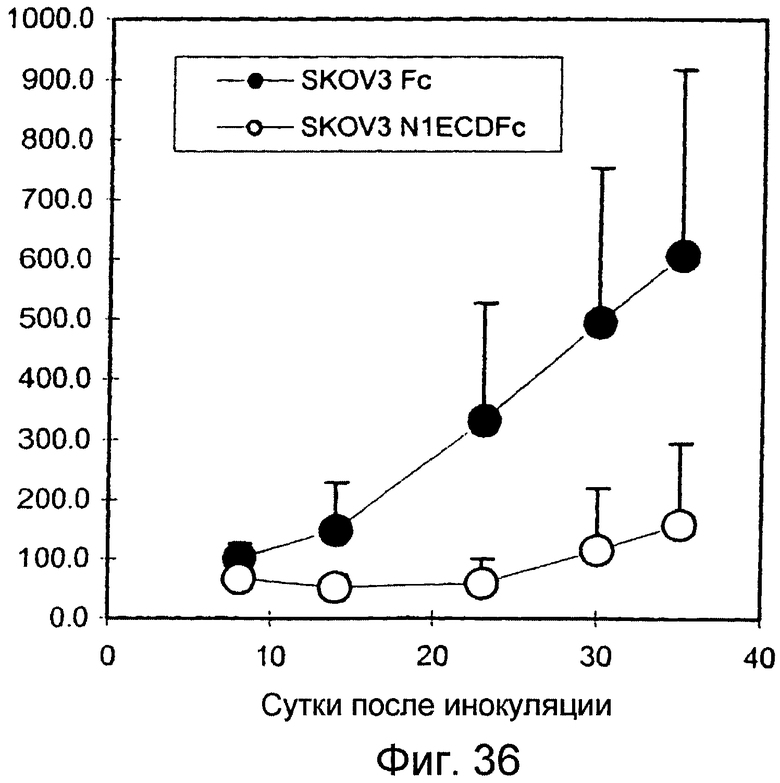
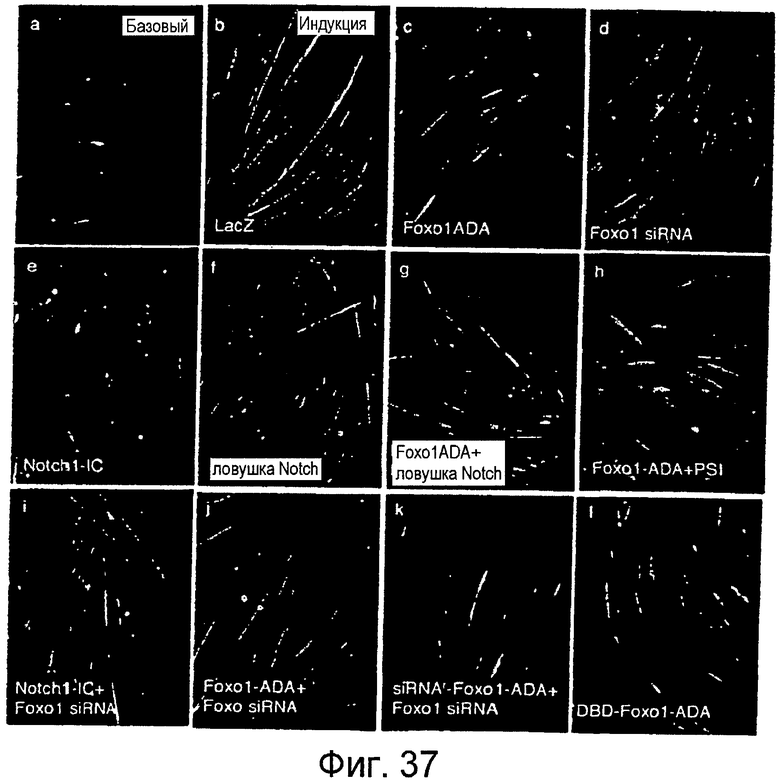
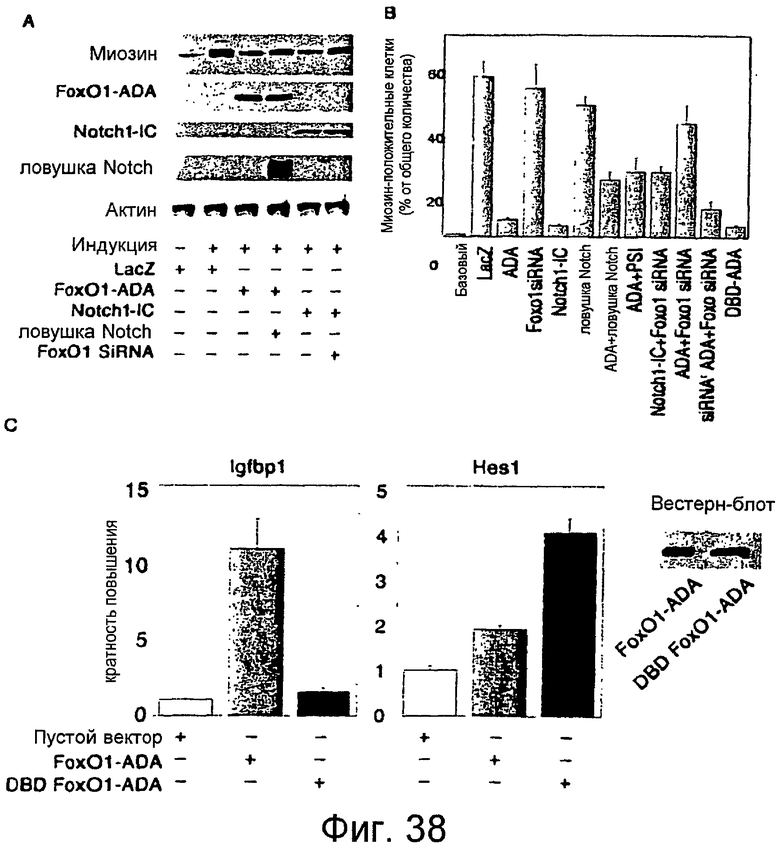
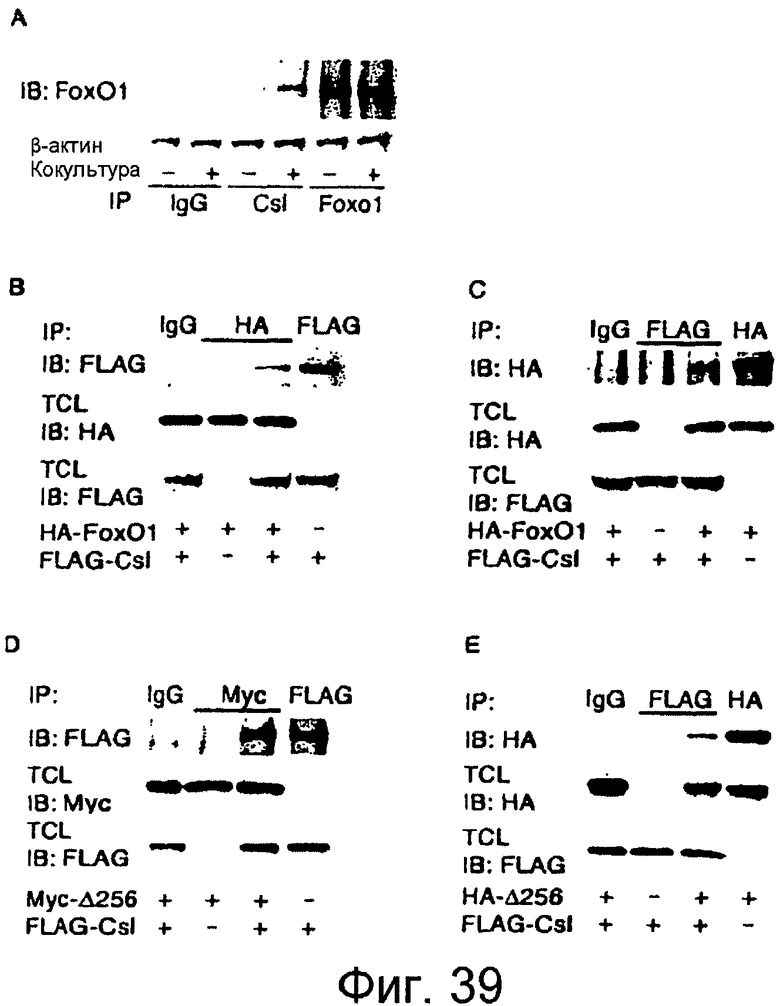
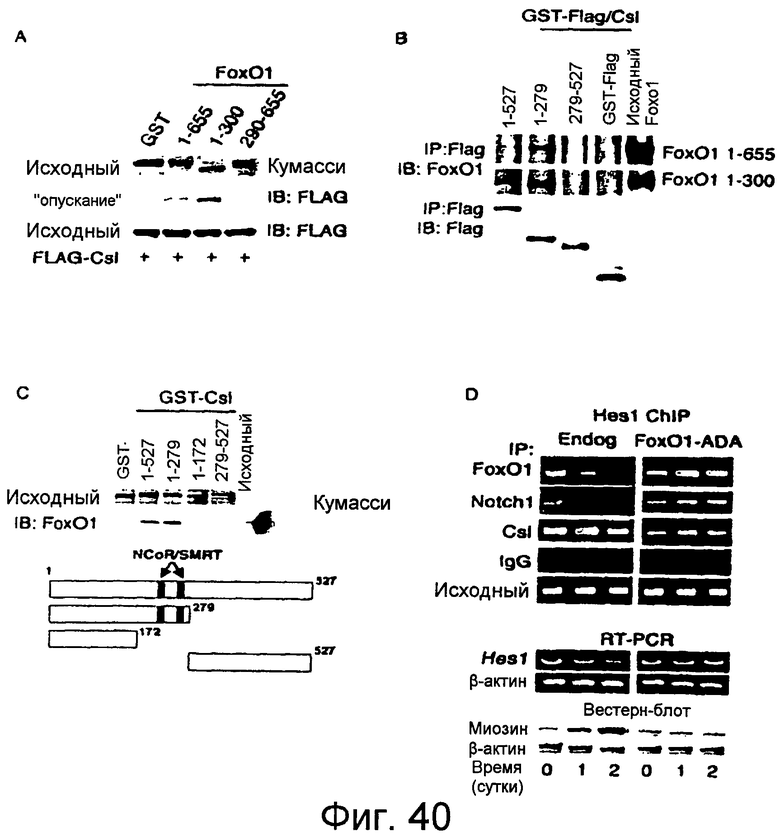
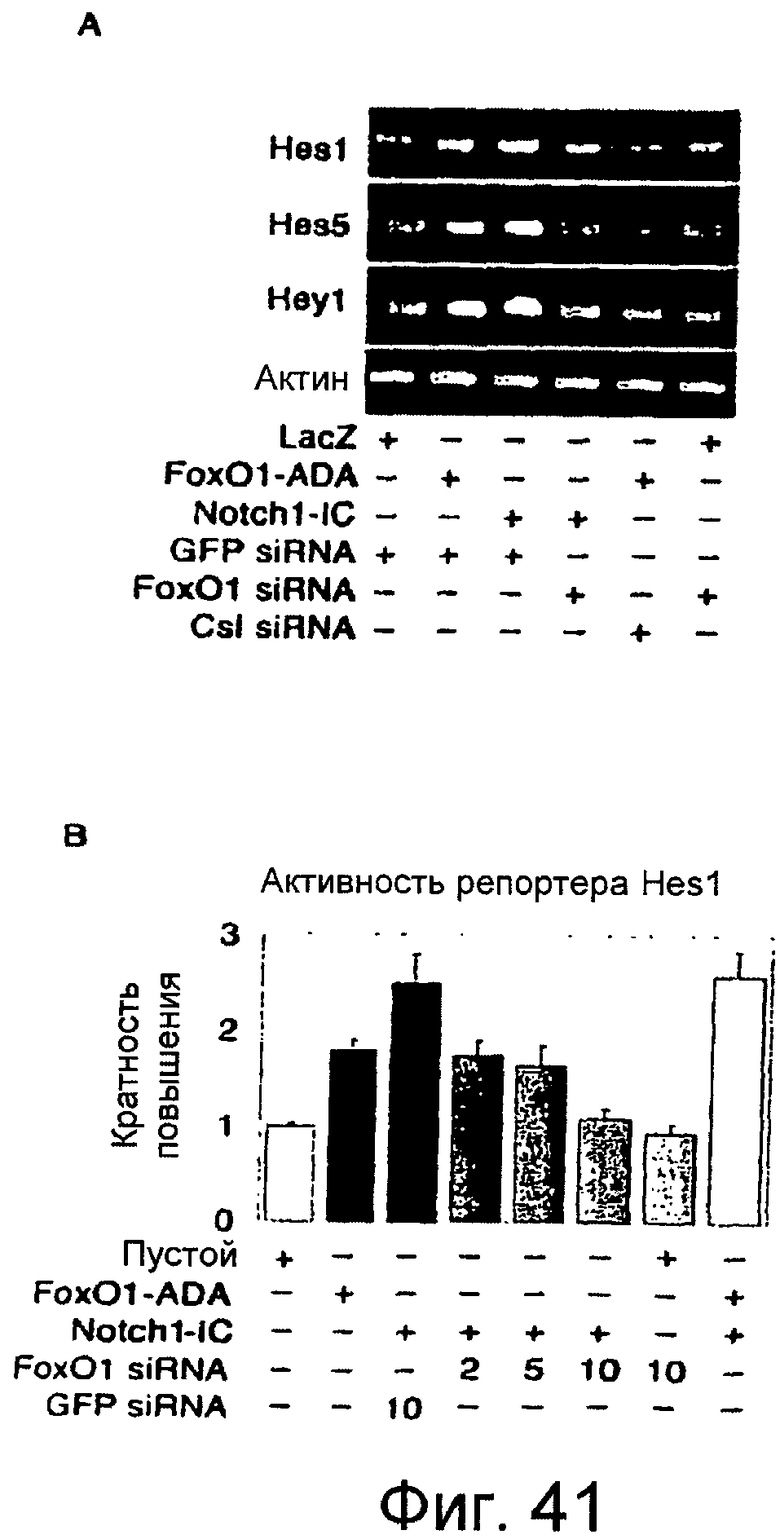
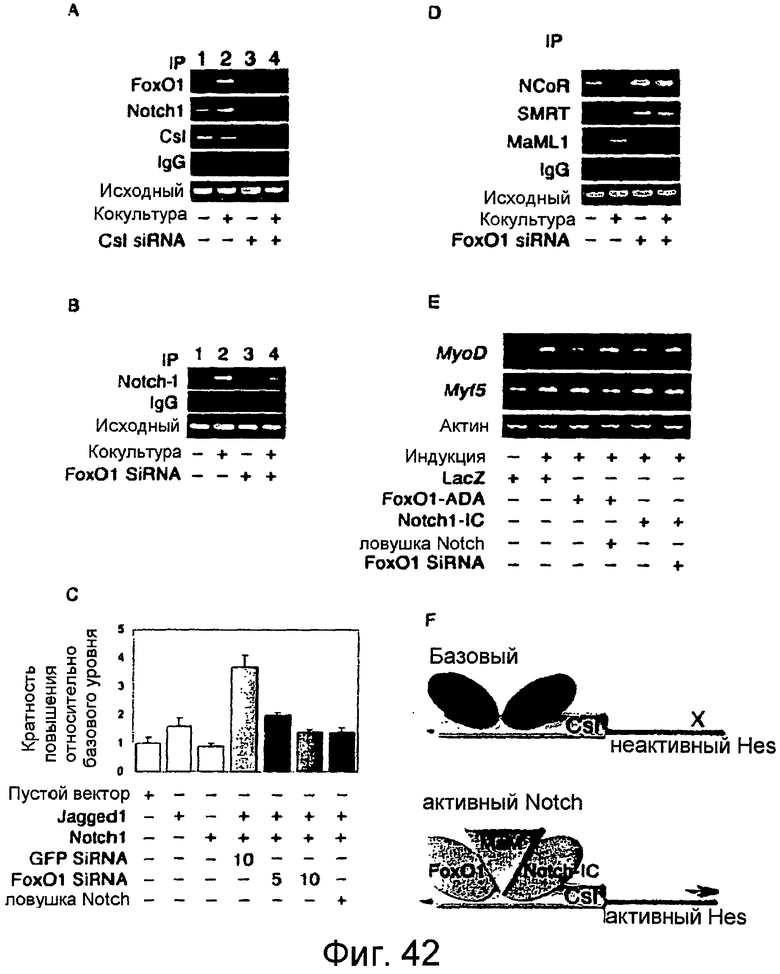
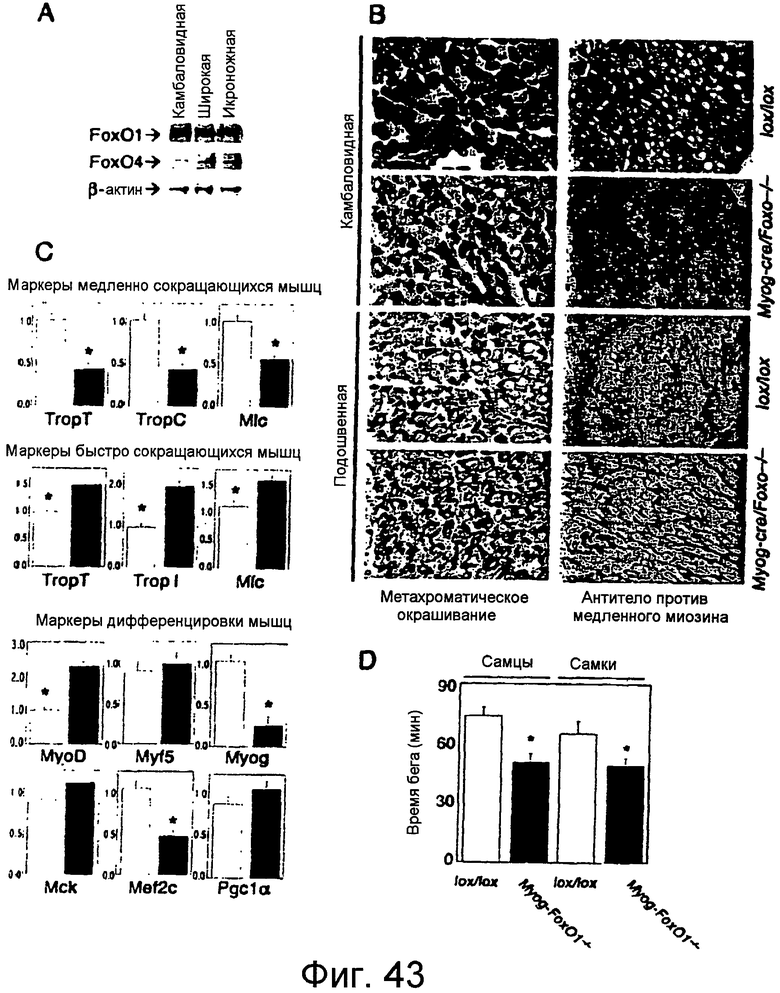
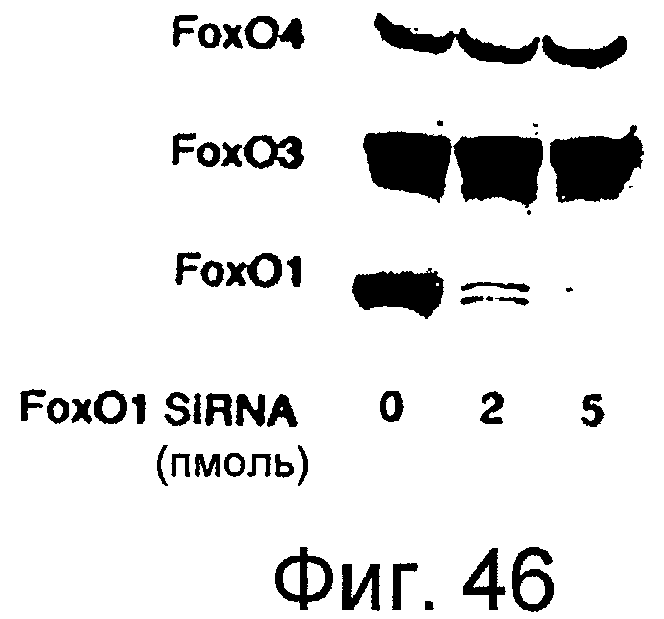

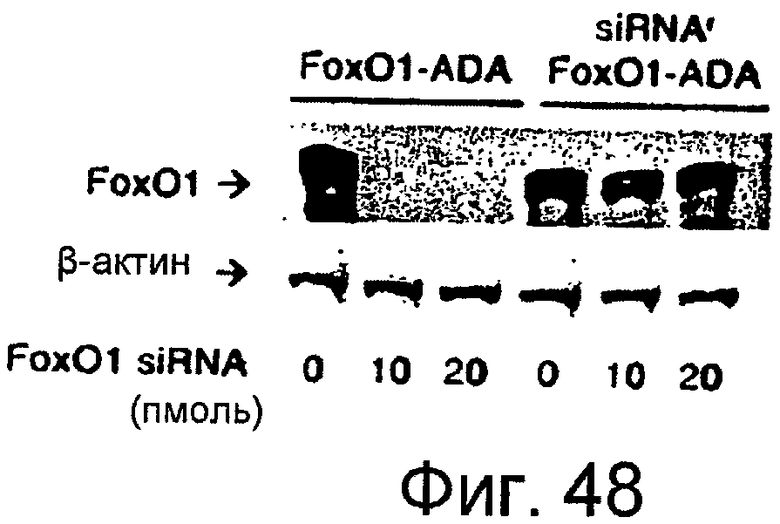
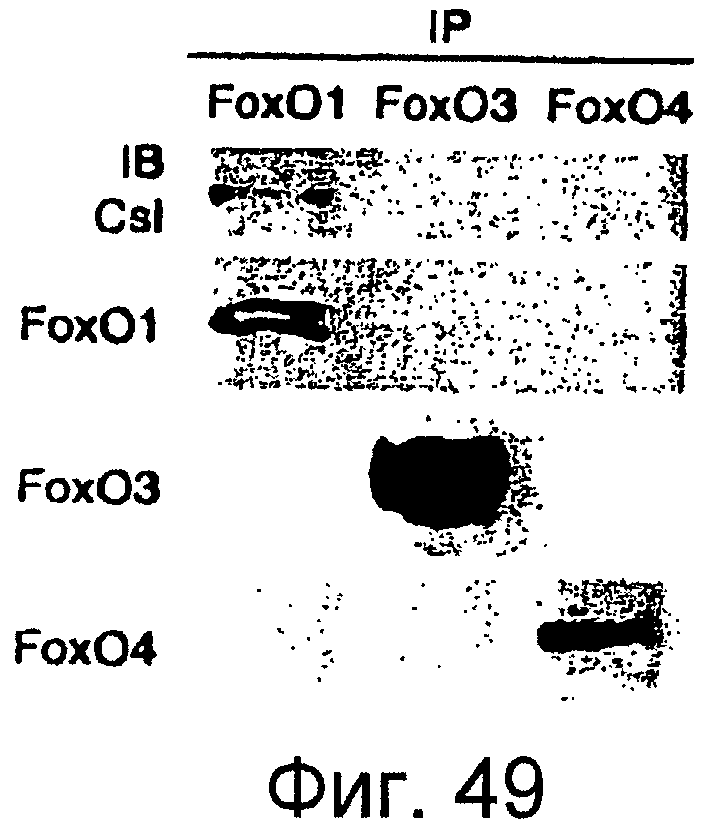
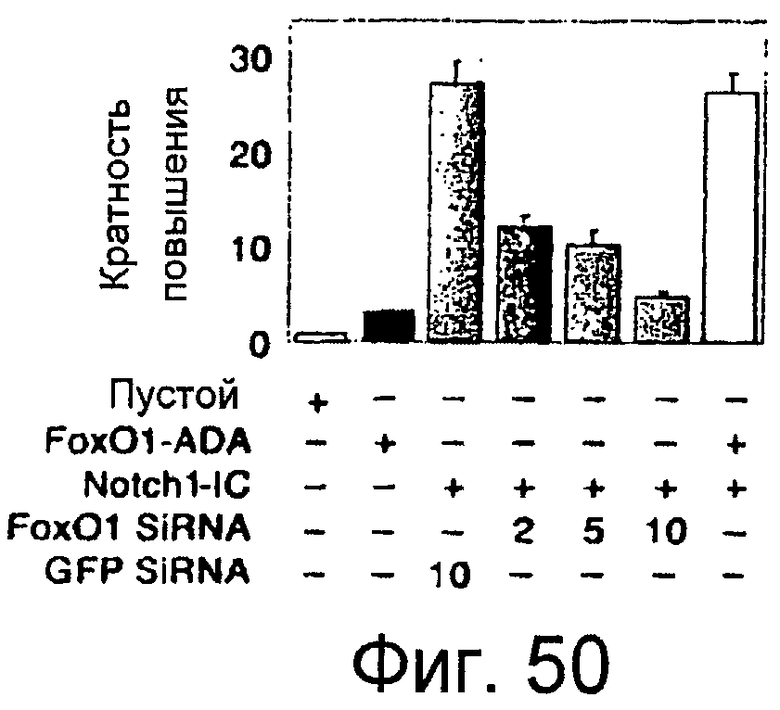
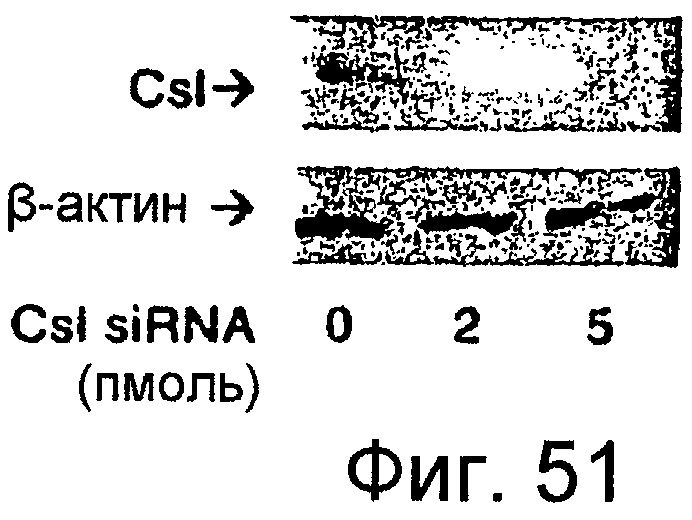

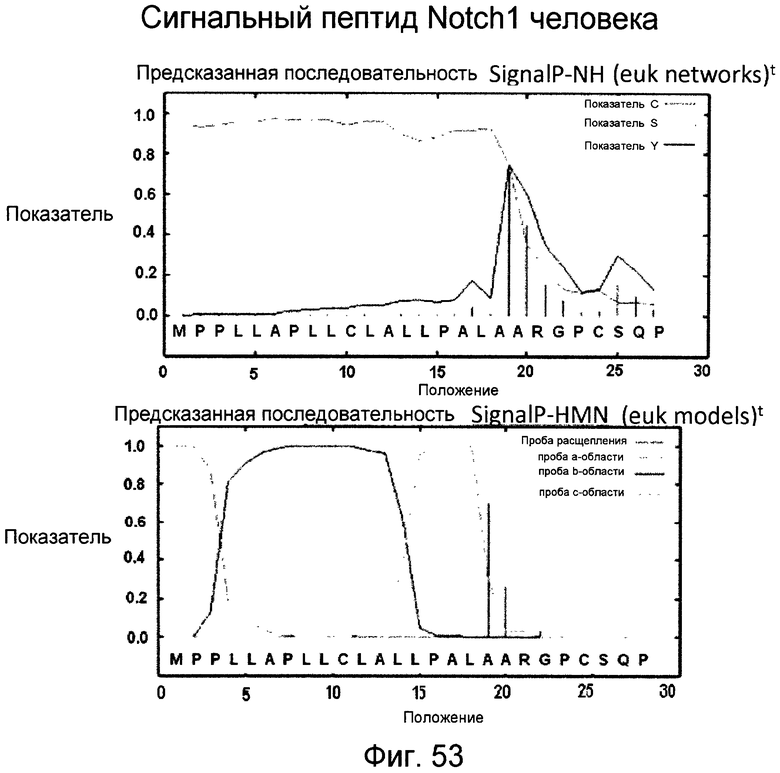
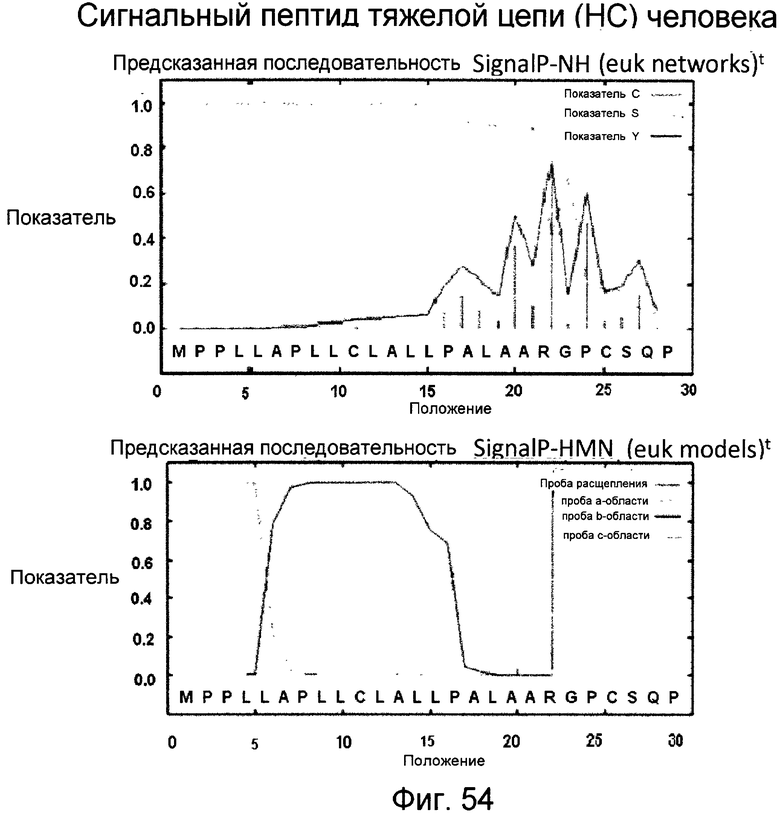









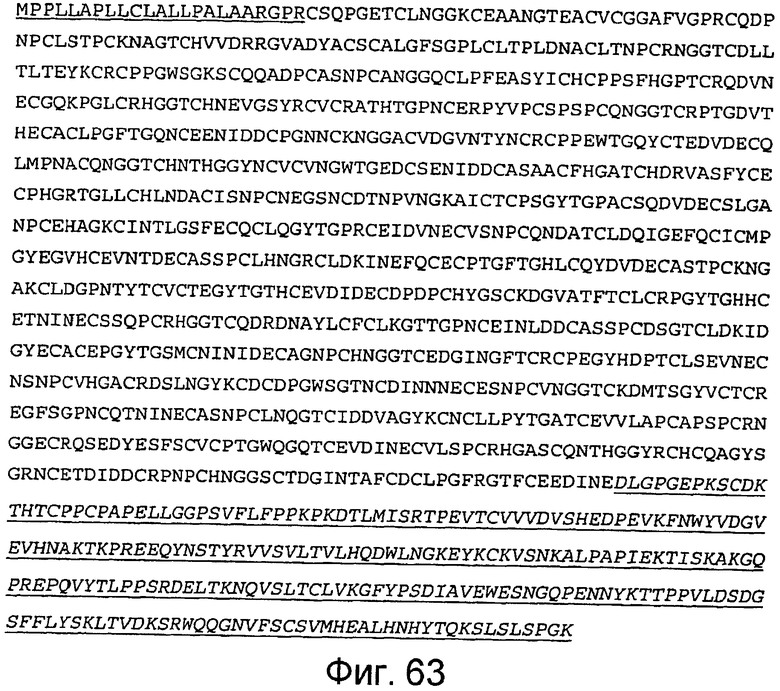
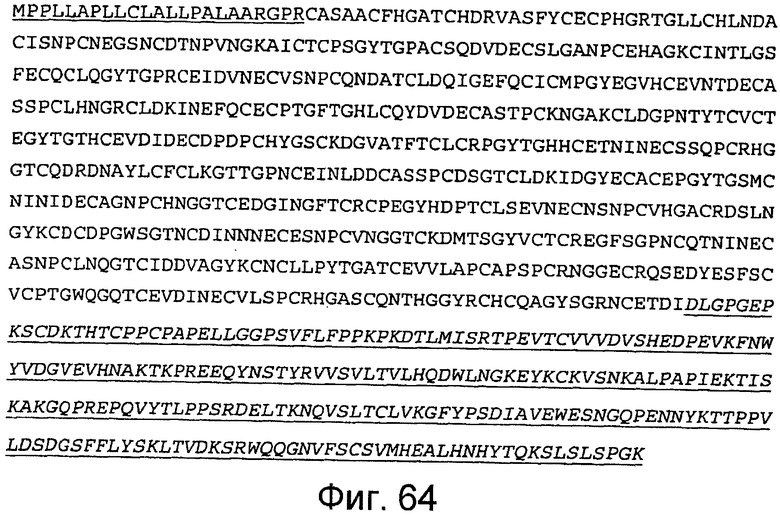


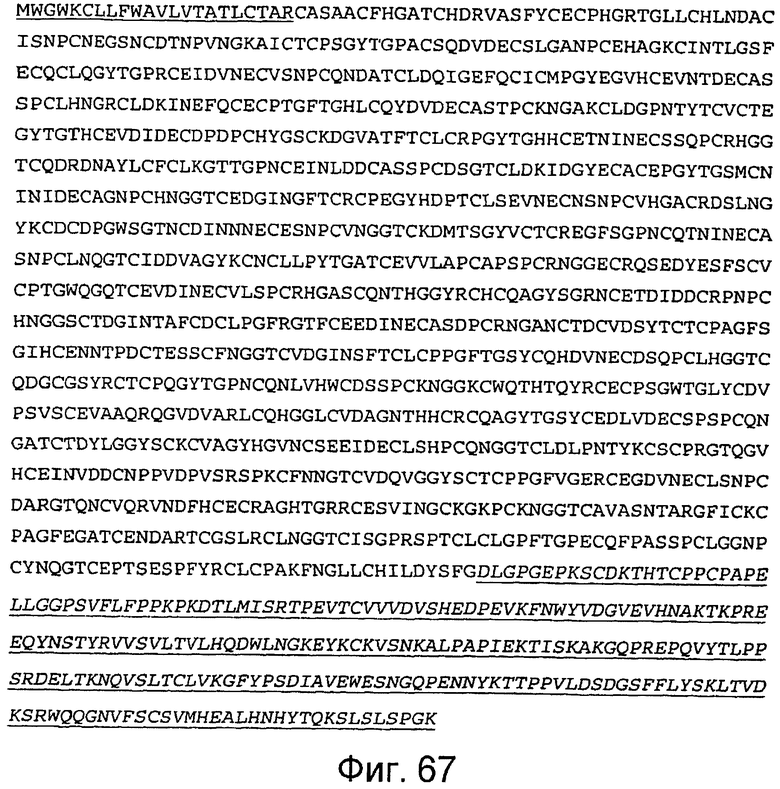








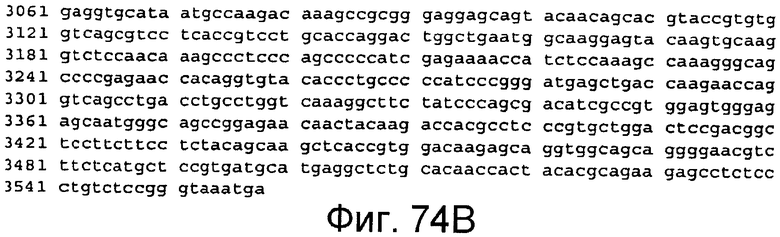





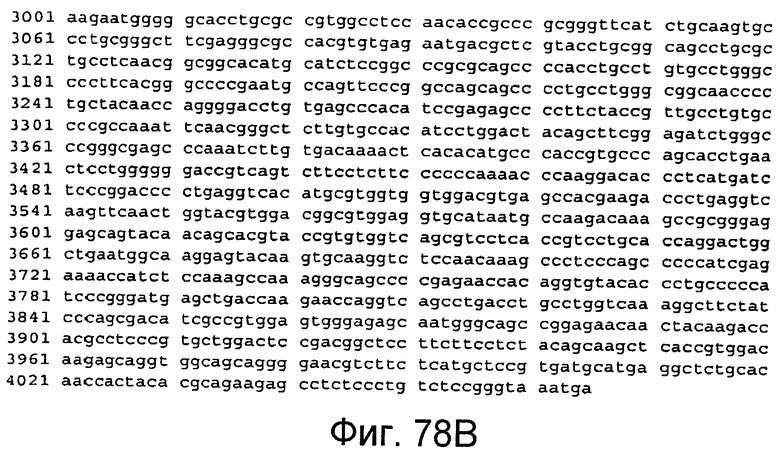







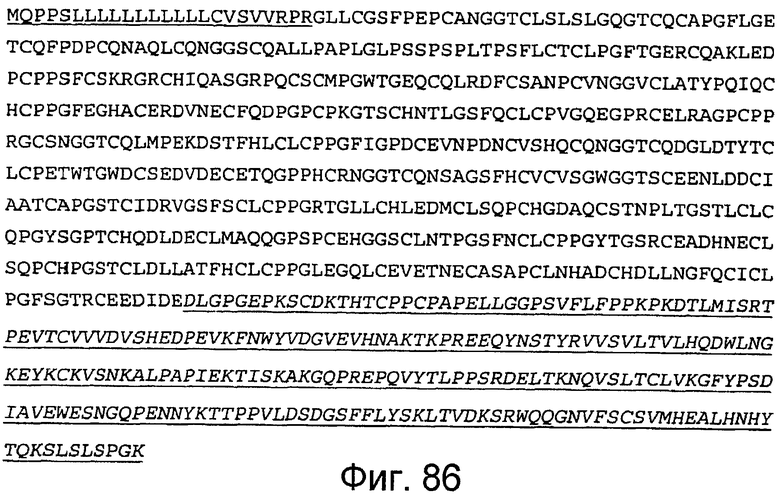
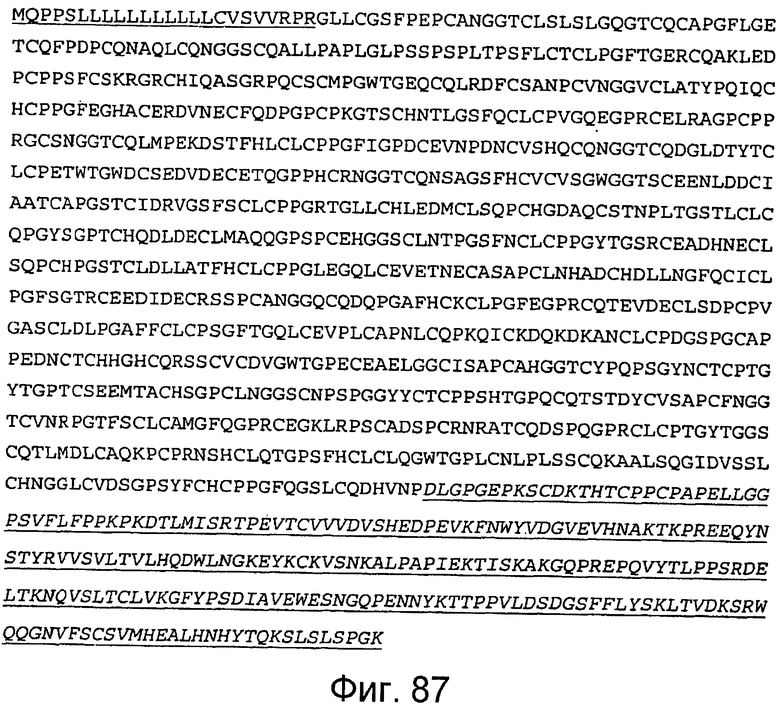

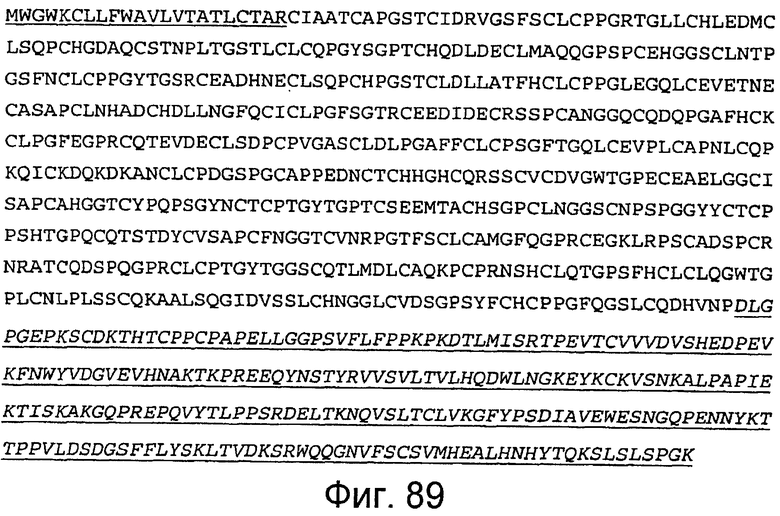
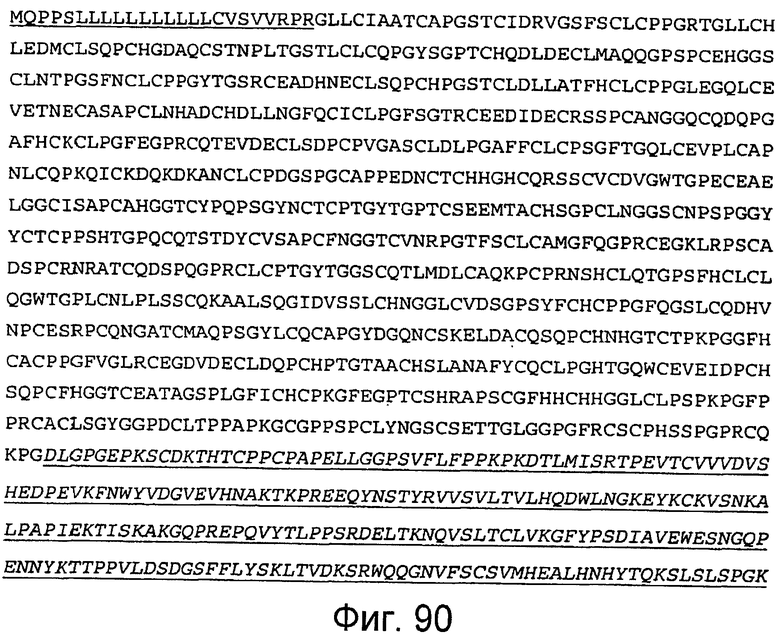



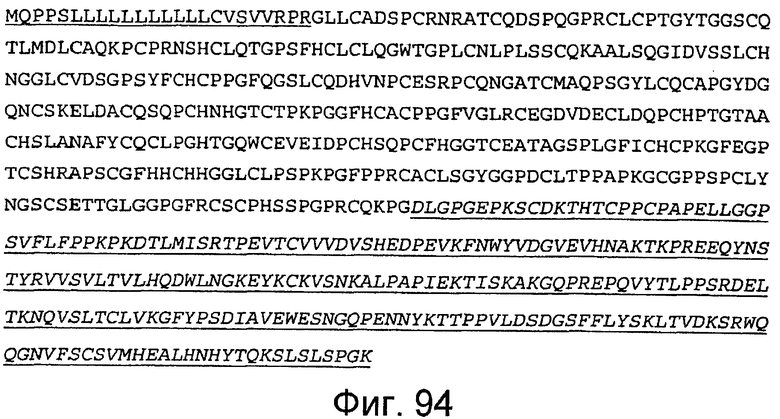
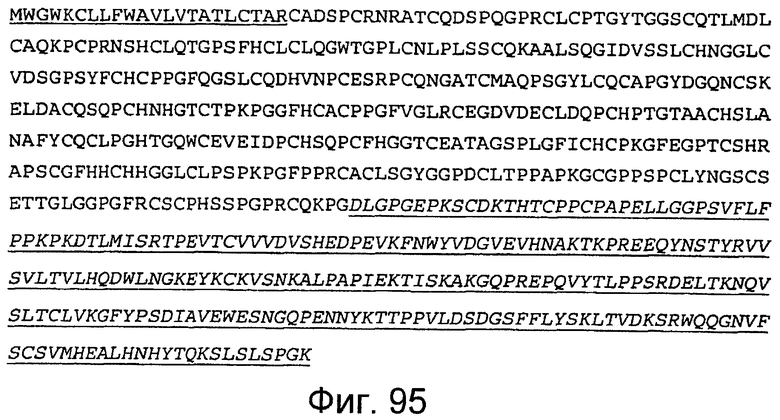



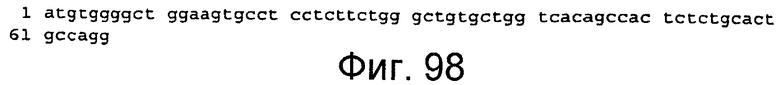













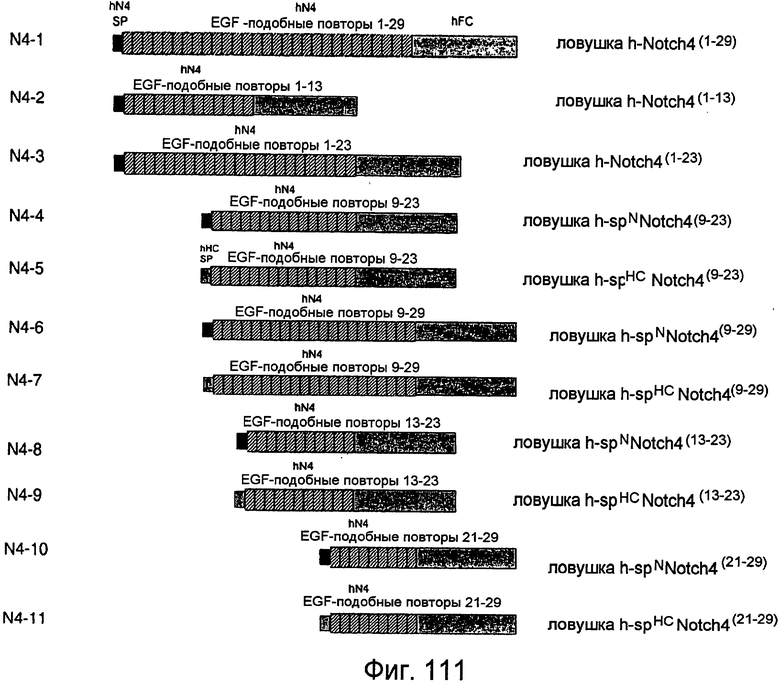
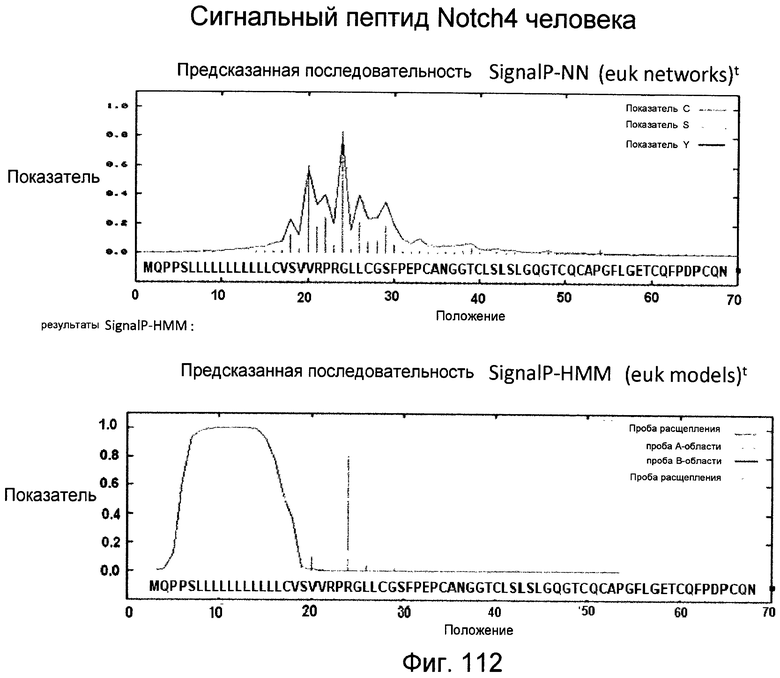



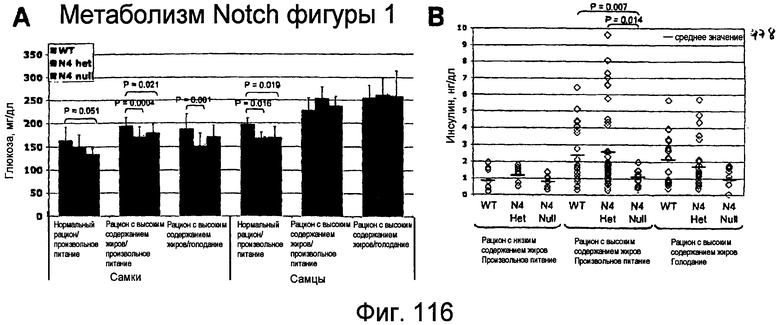
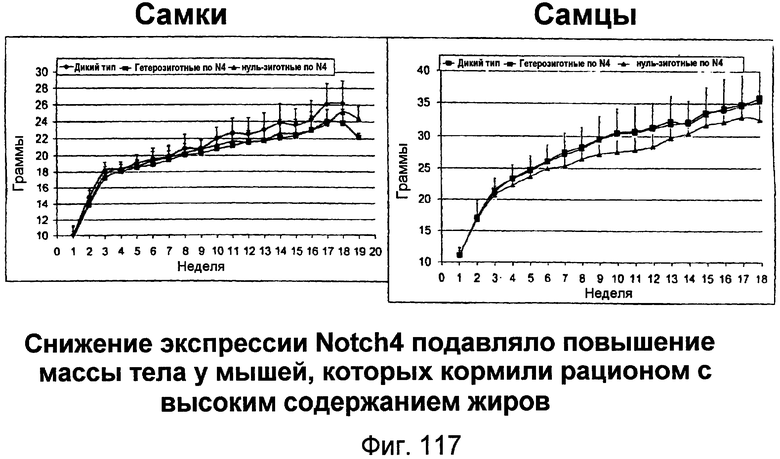
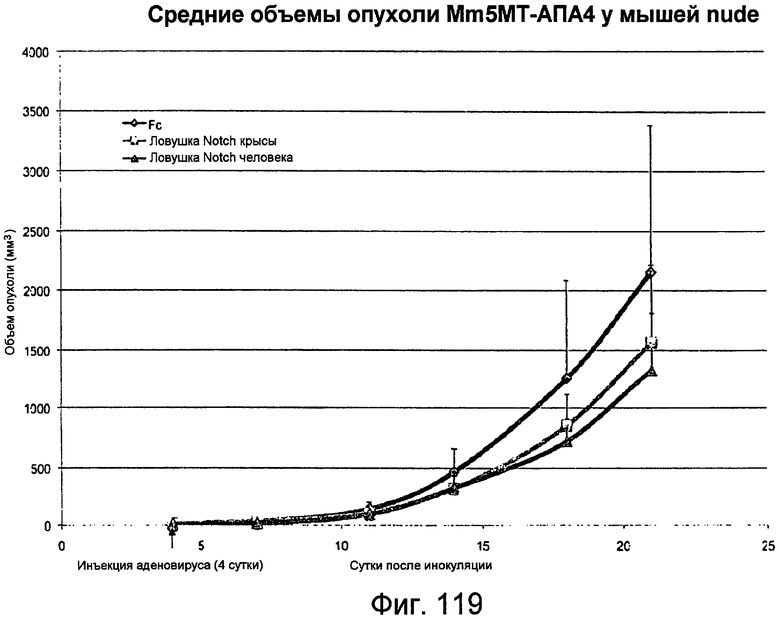
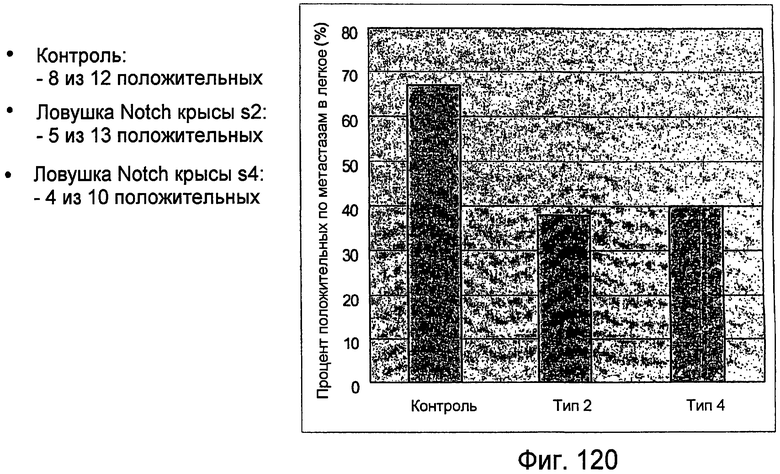
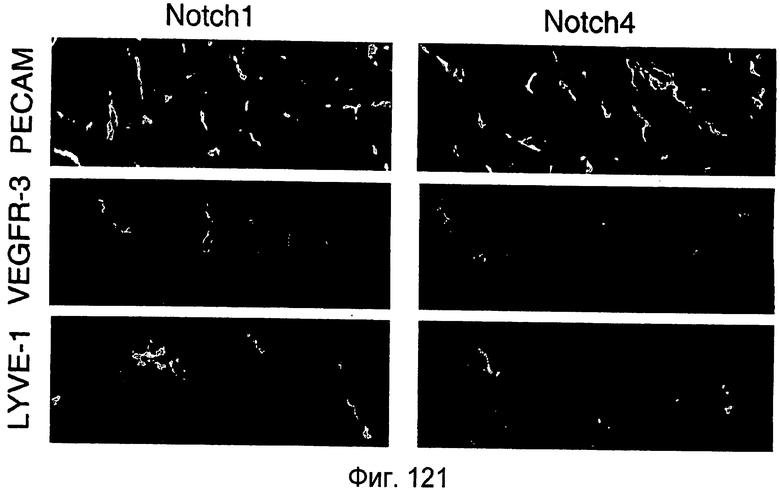
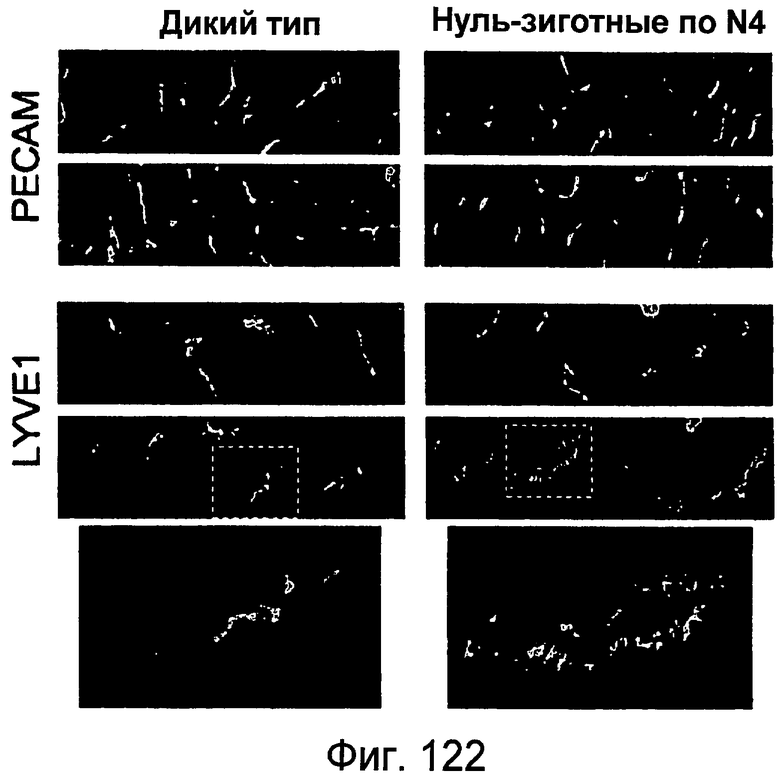
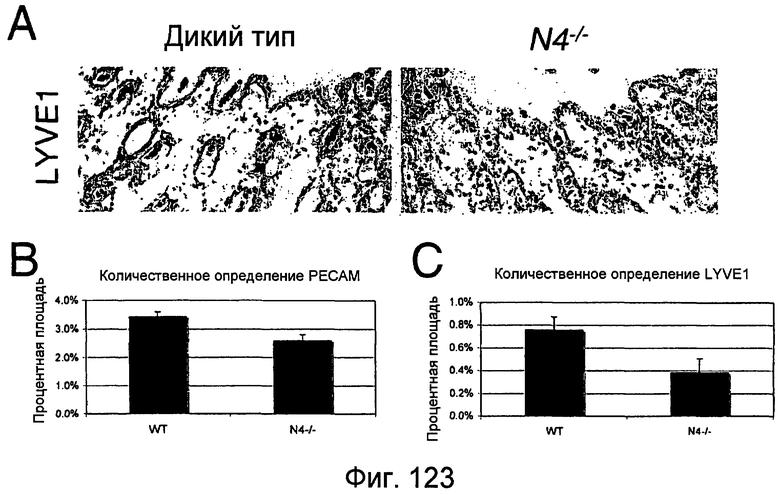
Настоящее изобретение относится к области иммунологии. Предложен слитый белок - антагонист Notch1, который состоит из Fc-области человека, слитой с EGF-подобным повтором 1-13 Notch1 или EGF-подобным повтором 1-24 Notch1. Причём Fc-часть локализована на карбоксиконцевой части EGF-повтора. Описана фармацевтическая композиция для ингибирования передачи сигнала Notch на основе такого белка и его использование для получения фармацевтической композиции для лечения субъекта, имеющего: опухоль; рак яичника; метаболическое нарушение; сосудисто-пролиферативную ретинопатию. Предложено применение слитого белка для получения фармацевтической композиции для ингибирования: ангиогенеза у субъекта; физиологического лимфангиогенеза или патологического лимфангиогенеза у субъекта; метастазов опухоли у субъекта. Использование изобретения обеспечивает белки, которые экспрессируются в супернатант на уровне в несколько раз более высоком, чем слитый белок, содержащий EGF-подобные повторы 1-36 Notch1, лучше проникают в опухоли, сохраняют лиганд-связывающую способность, при этом слитый белок, содержащий повторы 1-24, связывается с DLL4 и JAG1, тогда как слитый белок, содержащий повторы 1-13, связывается только с DLL4, но не c JAG1, что может найти применение в терапии различных заболеваний, связанных с активностью Notch1. 9 н. и 9 з.п. ф-лы, 124 ил., 10 пр.
1. Слитый белок, являющийся антагонистом Notch1, содержащий
(а) аминокислоты, последовательность которых идентична последовательности части внеклеточного домена рецептора Notch человека, и
(b) аминокислоты, последовательность которых идентична последовательности Fc-части антитела, где часть внеклеточного домена рецепторного белка Notch человека выбрана из группы, состоящей из EGF-подобных повторов 1-13 Notch1 и EGF-подобных повторов 1-24 Notch1, где Fc-часть антитела представляет собой Fc-часть антитела человека, где (b) локализованы на карбоксиконцевой части (а) и где (b) присоединен к (а) непосредственно или посредством линкерной последовательности.
2. Слитый белок по п.1, где часть внеклеточного домена рецепторного белка Notch человека представляет собой EGF-подобные повторы 1-13 Notch1.
3. Слитый белок по п.1, где часть внеклеточного домена рецепторного белка Notch человека представляет собой EGF-подобные повторы 1-24 Notch1.
4. Слитый белок по п.1, где (b) присоединен непосредственно к (а).
5. Слитый белок по п.1, где (b) присоединен к (а) посредством линкерной последовательности.
6. Слитый белок по п.1, где часть внеклеточного домена рецепторного белка Notch человека представляет собой последовательно расположенные аминокислоты, последовательность которых представляет собой аминокислоты 24-531, указанные в SEQ ID NO:55, или аминокислоты 24-948, указанные в SEQ ID NO:56.
7. Фармацевтическая композиция для ингибирования передачи сигнала Notch, содержащая эффективное количество слитого белка, являющегося антагонистом Notch, по любому из пп.1-6 и фармацевтически приемлемый носитель.
8. Применение слитого белка по любому из пп.1-6 для получения фармацевтической композиции для лечения субъекта, имеющего опухоль.
9. Применение слитого белка по любому из пп.1-6 для получения фармацевтической композиции для ингибирования ангиогенеза у субъекта.
10. Применение слитого белка по любому из пп.1-6 для получения фармацевтической композиции для лечения субъекта, имеющего рак яичника.
11. Применение слитого белка по любому из пп.1-6 для получения фармацевтической композиции для лечения субъекта, имеющего метаболическое нарушение.
12. Применение по п.11, где метаболическое нарушение представляет собой диабет, ожирение, атеросклероз, ишемию, инсульт или сердечно-сосудистое заболевание.
13. Применение слитого белка по любому из пп.1-6 для получения фармацевтической композиции для ингибирования физиологического лимфангиогенеза или патологического лимфангиогенеза у субъекта.
14. Применение по п.13, где патологический лимфангиогенез представляет собой лимфангиогенез опухоли или метастазов в лимфатических узлах.
15. Применение слитого белка по любому из пп.1-6 для получения фармацевтической композиции для ингибирования метастазов опухоли у субъекта.
16. Применение по п.15, где метастазирование происходит через кровеносный сосуд, лимфатические сосуды или лимфатический узел.
17. Применение слитого белка по любому из пп.1-6 для получения фармацевтической композиции для лечения сосудисто-пролиферативной ретинопатии у субъекта.
18. Применение по п.17, где сосудисто-пролиферативная ретинопатия представляет собой диабетическую ретинопатию, дегенерацию желтого пятна или ретролентальную фиброплазию.
| US2006030694 A1, 09.02.2006 | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| ZLOBIN et al., “Toward The Rational Design of Cell Fate Modifiers: Notch Signaling as a Target for Novel Biopharmaceuticals”, Current Pharmaceutical Biotechnology, 2000, 1, pp | |||
| Пуговица | 0 |
|
SU83A1 |
| NICKOLOFF et al., “Jagged-1 mediated activation of notch signaling induces complete | |||
Авторы
Даты
2014-11-10—Публикация
2008-08-22—Подача