Изобретение относится к плазмидной генетической конструкции pVEAL2-9E2ch-scFv, штамму рекомбинантной клеточной линии СНО-K1-9E2ch и химерному моноклональному одноцепочечному антителу 9E2ch против вируса Западного Нила и может быть использовано в генной инженерии, биотехнологии и медицине.
Уровень техники.
Флавивирусы вызывают у человека болезни от бессимптомных форм и легких лихорадок до геморрагических проявлений и неврологических расстройств в виде энцефалита, менингита, менингоэнцефалита и миелита. Вирус Западного Нила (WNV) принадлежит к антигенному комплексу японского энцефалита, вызывает Лихорадку Западного Нила (ЛЗН). Разработка эффективных вакцин против ряда флавивирусных инфекций до сих пор сталкивается с рядом сложностей. Например, прямая аттенуация большинства флавивирусов невозможна из-за их высокой нейровирулентности для человека. Поэтому создано ограниченное число разрешенных к применению инактивированных вакцин против вирусов японского и клещевого энцефалитов. Но самой большой проблемой является феномен антитело-зависимого усиления инфекции (antybody-dependent enhancement (ADE)), характерный для некоторых флавивирусных инфекций [Nesmeianova V.S., Sherbakov D.N., Kazachinskaia E.I. Using Flavivirus-Specific Monoclonal Antibodies to Study the Antigenic Structure of Flaviviruses and Develop Anti-Flavivirus Drugs // Molecular Genetics, Microbiology and Virology. - 2021. - T. 36. - №. 2. - C. 57-67.]. Эффективная профилактическая вакцина против ЛЗН до сих пор не разработана. В отсутствии вакцины единственным методом противодействия остаются терапевтические подходы.
Предложены подходы на основе: противовирусных препаратов в сочетании с интерфероном-альфа2b и использования специфических человеческих иммуноглобулинов против WNV. Второй подход выглядит привлекательным. Анализ репертуара нейтрализующих антител от трех пациентов, переболевших ЛЗН, показал, что 121 из 125 проверенных антител связываются с белком вирусной оболочки (Е) содержащим нейтрализующие эпитопы [Pai J.С., Sutherland J.N., Maynard J.A. Progress towards recombinant anti-infective antibodies // Recent patents on anti-infective drug discovery. - 2009. - Т. 4. - №. 1. - C. 1-17.].
Разработка технологии создание моноклональных антител (МКА) привела к революции в диагностике и лечении вирусных инфекций. Хорошо разработанная гибридомная технология дала свои первые результаты в этой области. Но этот метод имеет ряд ограничений, главный из которых полученные мышинные антитела имеют высокую иммуногенность при введении человеку. Однако вскоре был разработан подход, значительно уменьшивший их иммуногенность и увеличивший лечебные возможности МКА. С помощью технологии рекомбинантных ДНК константные домены мышиных антител были заменены на соответствующие константные области иммуноглобулинов человека, и только вариабельные домены остались мышиными. Полученные таким способом МКА принято называть химерными. Химерные МКА в своей структуре имеют более 65% аминокислотных последовательностей иммуноглобулина человека. Поскольку большая часть антигенных детерминант иммуноглобулинов находится в их константных доменах и с ними же связаны основные эффекторные функции (взаимодействие с Fc-рецепторами, системой комплемента), иммуногенность химерных иммуноглобулинов мышь/человек значительно снижена [Будчанов Ю.И. Моноклональные антитела: от создания до клинического применения // Клиническая онкогематология. Фундаментальные исследования и клиническая практика. - 2016. - Т. 9. - №.3. - С. 237-244.].
Ближайшие аналоги.
Известна разработка американских исследователей по получению человеческого нейтрализующего антитела против вируса Западного Нила с помощью метода фагового дисплея описанного в патенте (патент США №7244430, МПК А61К 39/42, опубл. 17.07.2007 г.). Выделенное человеческое антитело способно специфически связываться с доменом III белка Е вируса Западного Нила линии I («ВЗН») и обладает нейтрализующей ВЗН активностью, где антитело содержит тяжелую цепь и дополнительно содержит вариабельную область легкой цепи. Авторы сначала с помощью фагового дисплея получили вариабельные домены антител переболевшего человека. Затем, сконструировали на его основе вектор для трансфекции. Для наработки использовали клетки HEK 293 после транзиентной трансфекции. Основным недостатком изобретения является отсутствие описания получения и использования клеточной линии способной стабильно продуцировать антитела.
Известно изобретение, которое относится к универсальному рекомбинантному вектору pBuc и плазмидной генетической конструкции pBuc-7В4, обеспечивающей синтез и секрецию полноразмерных рекомбинантных белков - моноклональных антител, в частности, антитела 7В4 против вируса Западного Нила, в клетках яичника китайского хомяка (СНО) и полученной с использованием указанного вектора pBuc и может быть использовано в медицине и биотехнологии (патент РФ №2757488, МПК C12N 15/00, опубл. 18.10.2021 г.). Данные белки будут обладать терапевтическим потенциалом. Также их можно будет использовать в научно-исследовательских целях. Техническим результатом этого изобретения является создание универсального интеграционного вектора pBuc и плазмидной генетической конструкции pBuc-7В4, обеспечивающей синтез и секрецию антитела 7В4 против вируса Западного Нила в клетках животных и полученной с использованием указанного вектора pBuc.
Наиболее близкий аналог по назначению и достигаемому результату является штамм гибридных клеток Mus musculus L.НИИМБ-280 (9Е2), секретирующий моноклональные антитела к белку Е вируса Западного Нила, описанный в патенте РФ №2265658, опубл. 10.12.2005 г. Авторы создали клеточную линию с помощью гибридомной технологии. Полученное антитело 9Е2, способно вазимодействовать в ИФА с белком Е WNV. Недостатком данного изобретения является то, что гибридомная технология требует больших трудозатрат и много времени на создание штамма-продуцента.
Техническим результатом заявляемого изобретения является создание химерного одноцепочечного антитела 9E2ch против вируса Западного Нила путем конструирования плазмидной генетической конструкции pVEAL2-9E2ch-scFv, создание на ее основе штамма рекомбинантной клеточной линии CHO-K1-9E2ch и получение с использованием указанного штамма химерного одноцепочечного антитела 9E2ch, обладающего высоким сродством к неонатальному рецептору FcRn и характеризующегося функциональной активностью против вируса Западного Нила.
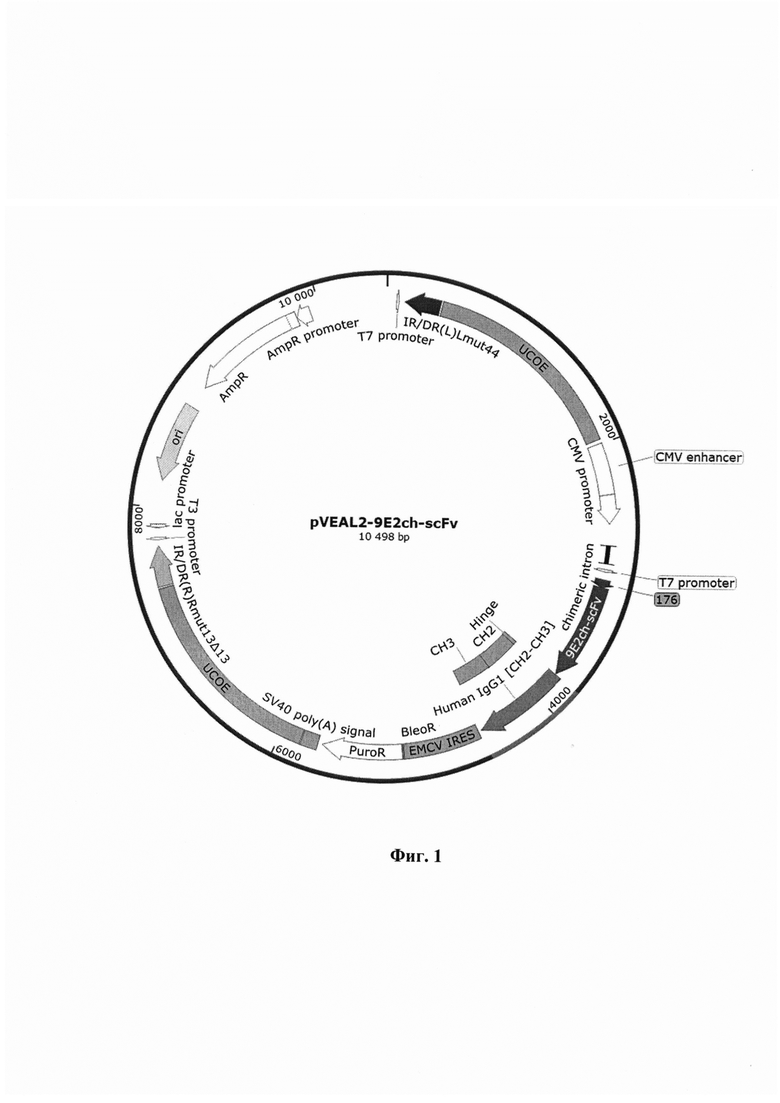
Указанный технический результат достигается созданием интегративного плазмидного вектора pVEAL2-9E2ch-scFv, имеющего нуклеотидную последовательность SEQ ID NO: 1, обеспечивающего экспрессию и секрецию антитела 9E2ch против вируса Западного Нила в клетках млекопитающих, имеющего размер 10498 п.н. и содержащего в соответствии с физической и генетической картой, представленной на фиг. 1, следующие элементы:
- участок начала репликации ori, имеющий координаты с 8200 по 8788 п.н.;
- последовательности прямых и инвертированных повторов IR/DR, содержащие сайты связывания с транспозазой SB100, имеющие координаты с 139 по 403 и с 7416 по 7711 п.н.;
- последовательности UCOE, предотвращающие хромосомное «замалчивание» рекомбинантной экспрессионной кассеты, имеющие координаты с 416 по 1964 и с 5856 по 7404 п.н.;
- CMV энхансер, имеющий координаты с 1995 по 2374 п.н., CMV промотор, имеющий координаты с 2375 по 2586 п.н. - наиболее часто используемые промоторы в генно-терапевтических конструкциях;
- Chimeric intron - химерный интрон для усиления экспрессии целевого гена, имеющий координаты с 2747 по 2879 п.н.;
- лидерный пептид 176 - последовательность, кодирующая гибридный лидерный пептид люциферазы и фиброина, обеспечивающая экспорт белка из клетки и имеющая координаты с 3001 по 3060 п.н.;
- последовательность 9E2ch-scFv, кодирующая вариабельные фрагменты тяжелой и легкой цепи антитела 9E2ch, соединенные пептидным линкером, имеющая координаты с 3061 по 3795 п.н.;
- константная цепь антитела человека IgG1 с мутациями M252Y, S254T, Т256Е, Е333А, H433K/N434F, которая увеличивает период полураспада антитела за счет взаимодействия с неонатальными рецепторами, имеющая координаты с 3796 по 4479 п.н.;
- участок внутренней посадки рибосомы EMCV IRES, имеющий координаты с 4498 по 5072 п.н.;
- последовательность PuroR, кодирующая фактор устойчивости к антибиотику пуромицину, имеющая координаты с 5085 по 5684 п.н.;
- последовательность SV40 poly(A) signal для стабилизации мРНК-транскриптов за счет полиаденилирования, имеющая координаты с 5719 по 5840 п.н.;
- ген устойчивости к антибиотику ампициллину AmpR, позволяющий проводить амплификацию плазмиды в E. coli., имеющий координаты с 8953 по 9813 п.н.
Указанный плазмидный вектор pVEAL2-9E2ch-scFv позволяет осуществить высокую и стабильную экспрессию химерного рекомбинантного антитела 9E2ch в одноцепочечном формате.
Технический результат был также достигнут созданием штамма-продуцента клеток яичника китайского хомячка CHO-K1-9E2ch, продуцирующего антитела 9E2ch против вируса Западного Нила путем трансформации клеток экспрессионным вектором pVEAL2-9E2ch-scFv. Штамм CHO-K1-9E2ch депонирован под номером 324 в коллекции культур клеток ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора (справка о депонировании прилагается). Способ получения штамма клеток яичника китайского хомячка CHO-K1-9E2ch продуцента рекомбинантного антитела 9E2ch против вируса Западного Нила включает введение генетической конструкции SEQ ID NO: 1 в клетки путем липофекции с последующей селекцией клеток при помощи антибиотика Puromycin В.
Указанный технический результат достигается также созданием химерного одноцепочечного антитела 9E2ch против вируса Западного Нила, продуцируемого рекомбинантным штаммом клеточной линии яичника китайского хомячка CHO-K1-9E2ch по п. 2, имеющего аминокислотные последовательности SEQ ID NO: 2 вариабельной части тяжелой цепи, SEQ ID NO: 3 вариабельной части легкой цепи указанного антитела и предназначенного для создания терапевтических препаратов против вируса Западного Нила.
В константную цепь указанного антитела человека IgG1 (СН2-СН3) внесены мутации M252Y, S254T, Т256Е, Е333А, H433K/N434F, которые увеличивают период полураспада антитела за счет более высокого взаимодействия с неонатальным рецептором (FcRn), что защищает их от внутриклеточной деградации через механизм клеточной рециклинга.
На фиг. 1 изображена физическая и генетическая карта универсального рекомбинантного вектора pVEAL2-9E2ch-scFv. На фиг. 2. приведены результаты иммуноферментного анализа взаимодействия моноклонального химерного антитела 9E2ch с вирусом лихорадки Западного Нила.
Ниже приведены примеры его осуществления. Все стандартные генно-инженерные и микробиологические манипуляции, а также амплификацию и секвенирование ДНК проводили по известным методикам [Маниатис Т., Фрич Э, Сэмбрук Дж. Молекулярное клонирование, М.: Мир, 1984; Клонирование ДНК. Методы. Под ред. Д. Гловера, пер. с англ., Москва, Мир, 1988; Saiki R.K. et al. Science. 1988, 239(4839): 487-491; Sanger F. et al. Proc. Nat. Acad. Sci. 1977, 74: 5463-5467].
Пример 1. Конструирование рекомбинантной плазмиды pVEAL2-9E2ch-scFv, обеспечивающей синтез и секрецию химерного антитела 9E2ch против вируса Западного Нила в одноцепочечном формате.
На основе вектора pVEAL2 получали интеграционный вектор pVEAL2-9E2ch-scFv (фиг. 1), содержащий последовательности вариабельных тяжелой и легкой цепей антитела 9E2ch и связывающего их пептидного линкера. Последовательность гена, кодирующего тяжелую цепь 9E2ch (GenBank ABU63295.1) и последовательность гена, кодирующего легкую цепь 9E2ch (GenBank ABU63296.1) извлекали из базы данных GenBank и проводили оптимизацию кодонного состава для клеток СНО при помощи инструмента Gene Optimizer (https://www.thermofisher.com/ru/en/home/life-science/cloning/gene-synthesis/geneart-gene-synthesis/geneoptimizer.html). В итоговую нуклеотидную последовательность (SEQ ID NO: 1) добавили последовательность, кодирующую сигнальный пептид 176 и сайты гидролиза рестрктаз EcoRI и BamHI и синтезировали на заказ в ООО «ДНК-синтез».
Для получения рекомбинантной плазмиды pVEAL2-9E2ch-scFv в вектор pVEAL2 одновременно встраивали синтезированную нуклеотидную последовательность 9E2ch-scFv и PCR-IgG1, нуклеотидную последовательность кодирующая константную область человеческого антитела IgG1 [СН2-СН3] содержащую аминокислотные замены, обеспечивающие увеличение сродства к неонотальному рецептору человека. Последовательности праймеров, использованные для сборки плазмиды pVEAL2-9E2ch-scFv, представлены в таблице 1.
С помощью ПЦР была амплифицирована нуклеотидная последовательность 9E2ch-scFv. ПЦР проводили с использованием ПЦР-амплификатора «БИС» фирмы ООО БИС-Н (Россия). Реакционная смесь объемом 50 мкл, содержащая 2 мкг ДНК (плазмида pGH-9E2), 10 пкМ каждого праймера (9e23-F и 9e23-R) (таблица 1), 10 мкл 5х Q5 реакционного буфера, 10 мкл 5xQ5 High GC Enhancer, смесь дезоксинуклеотидтрифосфатов (дАТФ, дЦТФ, дТТФ, дГТФ по 2,5 мМ) и 0.5 ед. Q5 High-Fidelity ДНК-полимеразы, реакцию осуществляли при следующих параметрах: 10 с - 98°С, 20 с - 61°С, 30 с - 72°С (30 циклов). Готовые ПЦР-продукты были выделены и очищены из геля с помощью набора «Gel Extraction Kit» фирмы Qiagen (Германия) в соответствии с инструкцией производителя.
С помощью ПЦР была амплифицирована последовательность, кодирующая IgG1 [СН2-СН3]. ПЦР проводили с использованием ПЦР-амплификатора «БИС» фирмы ООО БИС-Н (Россия). Реакционная смесь объемом 50 мкл, содержащая 2 мкг ДНК (плазмида GH), 10 пкМ каждого праймера (9E2ch_scFv_BamHI_F и CH3_SalI_R) (таблица 1), 10 мкл 5х Q5 реакционного буфера, 10 мкл 5х Q5 High GC Enhancer, смесь дезоксинуклеотидтрифосфатов (дАТФ, дЦТФ, дТТФ, дГТФ по 2,5 мМ) и 0.5 ед. Q5 High-Fidelity ДНК-полимеразы, реакцию осуществляли при следующих параметрах: 10 с - 98°С, 20 с - 65°С, 30 с - 72°С (30 циклов). Готовые ПЦР-продукты были выделены и очищены из геля с помощью набора «Gel Extraction Kit» фирмы Qiagen (Германия) в соответствии с инструкцией производителя.
Предварительно наработанную и очищенную плазмиду pVEAL2 и готовые ПЦР-продукты обрабатывали эндонуклеазами рестрикции EcoRI, BamHI и Sail. Реакцию гидролиза проводили в условиях, рекомендованных производителем. С целью очистки линеаризованного вектора, плазмидную ДНК наносили на 1%-й агарозный гель и выделяли из геля с использованием набора «Gel Extraction Kit» фирмы Qiagen (Германия). Реакцию лигирования проводили с использованием ДНК-лигазы бактериофага Т4 («СибЭнзим», г. Новосибирск). Реакция проводилась при +4°С в течение ночи. Полученной лигазной смесью трансформировали компетентные клетки Е. coli штамм NebStable.
Первичную проверку на наличие вставки проводили при помощи ПЦР с колонии. Разделение продуктов амплификации проводили в 1%-м агарозном геле с последующим окрашиванием бромистым этидием (0,5 мкг/мл).
Положительные колонии вносили в 5 мл среды LB с ампициллином (50 мкг/мл) и растили в течение ночи при 37°С при 170 об/мин. Затем плазмидную ДНК выделяли из бактериальных клеток с помощью коммерческих наборов DNAminikit фирмы «Qiagen» согласно рекомендациям производителя. Первичную структуру экспрессионного вектора подтверждали секвенированием. Секвенирование проводили по методу Сэнгера в ЦКП «Геномика» СО РАН (г. Новосибирск). В результате была получена рекомбинантная плазмида pVEA12-9E2ch-scFv, имеющая нуклеотидную последовательность SEQ ID NO: 1 и обеспечивающая синтез химерного антитела 9Е2 против вируса Западного Нила в одноцепочечном формате.
Секвенирование плазмидной ДНК положительных клонов в районе встройки позволило отобрать клоны с отсутствием дефектов встраиваемых генов (вставки, делеции, замены), после чего из отобранных клонов была наработана и выделена целевая плазмидная ДНК.
В таблице 1 представлены последовательности синтезированных олигонуклеотидов, использованных для получения плазмиды pVEAL2-9E2ch-scFv.

Пример 2. Трансфекции клеток СНО-K1 плазмидой pVEAL2-9E2ch-scFv, и получение штамма-продуцента клеток яичника китайского хомячка CHO-K1-9E2ch, продуцирующего одноцепочечное химерное антитело 9E2ch против вируса Западного Нила
Штамм клеток яичника китайского хомячка CHO-K1-9E2ch получен на основе клеточной линии яичников китайского хомячка СНО-K1 с использованием разработанной генетической конструкции pVEAL2-9E2ch-scFv. Клетки СНО-K1, растили в инкубаторе при 5% содержания СО2, 80%-ной влажности. При достижении 80% плотности монослоя проводили трансфекцию клеток с помощью Lipofectamine 3000 (ThermoFisher, США) в соответствии с инструкцией производителя. Трансфецировали клетки смесью плазмид pVEAL2-9E2ch-scFv и pCMV(CAT)T7-SB100, взятых в соотношении 1:10. Через 48 часов после трансфекции добавляли селективный антибиотик пуромицин в концентрации 2 мкг/мл. В течении 3-х дней наблюдалось активное отмирание основной массы клеток. На четвертый день клеточный пул был перенесен в 6-луночный культуральный планшет, так же с добавление селективного антибиотика. Через 2 дня достигался монослой. Полученный пул клеток был криоконсервирован, после чего было проведено клонирование с целью отбора индивидуальных клонов с высокой продукцией рекомбинантных антител. Клонирование выполнялось методом лимитирующих разведений в 96-луночных планшетах. Через 14 суток визуально отбирали лунки, содержащие единственный клон, для которых проводили отбор культуральной жидкости с целью оценки продуктивности клонов при помощи ИФА, из которых и получен заявляемый рекомбинантный штамм СНО-K1-9E2ch.
Штамм депонирован 19.05.2022 г. в коллекции ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером 324.
Характеристика рекомбинантного штамма CHO-K1-9E2ch.
Морфология: веретеновидные и эпителиоподобные клетки с круглыми ядрами, содержащими от 1 до 2 ядрышек.
Способ культивирования: монослойный.
Среда для культивирования: питательная среда DMEM/F-12 (1:1) - 90%, сыворотка крови плодов коровы - 10%.
Температура культивирования: 37°С.
Посевная концентрация: 100 тыс. клеток в 1 мл.
Метод снятия: 0,25% трипсин (1/3) и 0,02% версен (2/3).
Кратность рассева: 1:3.
Частота пассирования: 3-4 суток.
Условия криоконсервации: питательная среда DMEM/F-12 (1:1) - 50%, сыворотка крови плодов коровы - 40%, ДМСО - 10%.
Режим замораживания: при температуре 4°С - 1 ч, минус 80°С - 12 ч, минус 196°С.
Условия хранения: в криопробирках в количестве 5 шт. хранится в жидком азоте при температуре минус 196°С.
Номер пассажа в жидком азоте: 3.
Жизнеспособность после криоконсервации: 85-90%.
Маркерый признак: наличие в культуральной среде рекомбинантного антитела 9Е2 размером ~55 кДа, подтверждается с помощью белкового электрофореза и иммуноблотинга. Область применения: биотехнология.
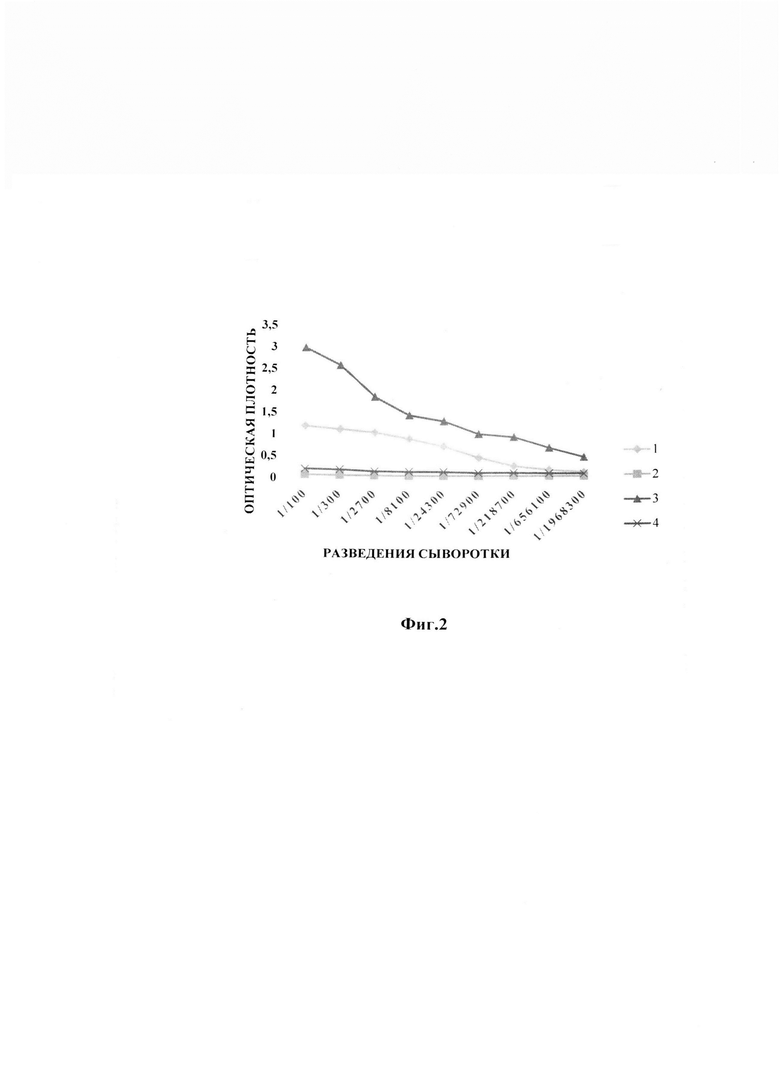
Пример 3. Иммуноферментный анализ взаимодействия моноклонального химерного антитела 9E2ch с вирусом лихорадки Западного Нила
В качестве антигена использовали вирус Западного Нила шт. LEIV-Vlg00-27924-human (Vlg-27924) в концентрации 200 нг/лунка, его сорбировали в лунках 96-луночного планшета в фосфатно-солевом буфере (PBS) (Greiner bio one, Германия) при 4°С в течение ночи. Затем отмывали буфером PBST (0.1% р-р Tween-20 в PBS) и блокировали 1% раствором казеина в буфере PBST в течение 1 часа при комнатной температуре. После этого образцы вносили в последовательном разведении, начиная с 1/100 до 1/1968300, и инкубировали в течение 1 часа при 37°С. Затем добавляли для образцов 1, 2, 3 - конъюгат (Goat a Hum JgG-per Sigma - 1/5000), 4 - конъюгат (Goat a mouse JgG-per Sigma - 1/5000) разбавленные в 1% блокирующем растворе казеина, с пероксидазой хрена (США). После каждого этапа проводили отмывку несвязавшихся белков буфером PBST. Затем вносили раствор субстрата ТМВ (Amresco, США) и инкубировали в течение 10 минут, реакцию терминировали раствором 1Н HCl и сразу измеряли оптическую плотность при длине волны 450 нм на ИФА-ридере (ChroMate Awareness technology inc., США). Результаты ИФА представлены на фиг. 2, где: 1 - рекомбинантное химерное антитело 9E2ch-scFv; 2 - отрицательный контроль (буфер); 3 - мышиный асцит 9Е2; 4 - отрицательный контроль (нмс).
Пример 4. Анализ кинетики межмолекулярных взаимодействий химерного антитела 9E2ch с неонатальным рецептором FcRn.
Аналит (FcRn, Tm (белок сравнения)) разводили до концентрации 30 мкг/мл, антитело (9E2ch) разводили до концентрации 1, 2 и 4 мкг/мл, добавляли в лунку микропланшета по 200 мкл. Далее планшет с образцами и сенсорами устанавливали в Octet K2. Сенсоры промывались в промывочном буфере (PBS) в течение 10 мин при перемешивании 1000 об/мин. Затем 2 сенсора параллельно погружались в лунку с промывочным буфером и инкубировались в течение 60 сек при постоянном перемешивании 1000 об/мин. Затем первый сенсор погружается в лунку с аналитом FcRn, а второй сенсор - в лунку с аналитом Tm, которые инкубировались течение 300 сек при постоянном перемешивании 1000 об/мин. Отмывка от не связавшихся аналитов проводилась в промывочном буфере в течение 30 сек при постоянном перемешивании 1000 об/мин. Для измерения ассоциации оба сенсора погружались в лунку с антителом в концентрации 1 мкг/мл, и инкубировались течение 180 сек при постоянном перемешивании 1000 об/мин. Для измерения диссоциации оба сенсора погружались в промывочный буфер и инкубировались течение 320 сек при постоянном перемешивании 1000 об/мин. Последующая цикличная регенерация проводилась при помощи регенерирующего 50 мМ раствора глицин-HCl рН 1,5 и промывочного буфера на протяжении 3 циклов и на каждом этапе сенсоры инкубировались течение 10 сек при постоянном перемешивании 1000 об/мин. Затем на поверхность сенсоров иммобилизировали ионы никеля, для этого сенсоры погружались в лунку с 10 мМ хлоридом никеля и инкубировались течение 30 сек при постоянном перемешивании 1000 об/мин. Затем процедура повторяется но с увеличением концентрации антитела. Было проведено по три измерения при трех разных концентрациях от 12,8 до 51,3 нМ. В результате были получены значения KD равное 1,3×10-9. Что согласуется с литературными данными.
Пример 5. Анализ нейтрализующей активности химерного антитела 9E2ch против вируса Западного Нила
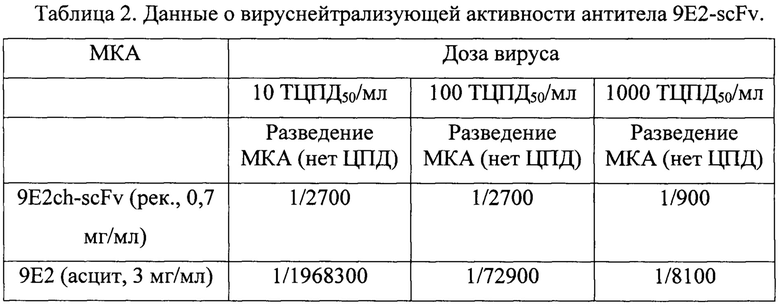
Реакция нейтрализации вируса Западного Нила проводили на культуре клеток Vero (50 мкл/лунка) с препаратом антитела 9E2-scFv. Вирус Западного Нила и антитела 9E2ch-scFv разводили в среде ДМЕМ (2% FBS). Смесь вируса (100 мкл) и антител (100 мкл) выдерживали два часа при комнатной температуре и затем этой смесью заражали клетки Vero. Для проведения реакции нейтрализации использовали вирус Западного Нила шт. LEIV-Vlg00-27924-human (Vlg-27924) - вирус наработан на клетках Vero, титр 106 ТЦПД50/мл, реакция проведена на суточной культуре клеток Vero. Полученные результаты учитывались на 7 сутки по развитию ЦПД (таблица 2). Титром сыворотки считали ее разведение, при котором регистрировали защиту в 50% лунок с культурой клеток от ЦПД вируса.
В таблице 2 представлены результаты вируснейтрализующей активности антитела 9E2-scFv.
Таким образом, группа заявленных изобретений обеспечивает получение иммунологически корректной формы одноцепочечного антитела 9E2ch-scFv более простыми технологическими средствами по сравнению с прототипом. Антитело 9E2ch-scFv может быть использовано как платформа для создания терапевтических препаратов против лихорадки Западного Нила.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3"
fileName="pVEAL2-9E2scFv3.xml" softwareName="WIPO Sequence"
softwareVersion="2.1.2" productionDate="2022-09-28">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>1</ApplicationNumberText>
<FilingDate>2022-08-01</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>ru12345</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>1</ApplicationNumberText>
<FilingDate>2022-08-01</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">Федеральное бюджетное учреждение
науки «Государственный научный центр вирусологии и биотехнологии
«Вектор» Федеральной службы по надзору в сфере защиты прав
потребителей и благополучия человека (ФБУН ГНЦ ВБ «Вектор»
Роспотребнадзора)</ApplicantName>
<ApplicantNameLatin>State Research Center of Virology and
Biotechnology "Vector"</ApplicantNameLatin>
<InventionTitle languageCode="ru">Плазмидная генетическая
конструкция pVEAL2-9E2ch-scFv, штамм рекомбинантной клеточной линии
CHO-K1-9Е2ch и химерное одноцепочечное антитело 9Е2ch против вируса
Западного Нила, продуцируемое указанным штаммом клеточной линии
CHO-K1-9Е2ch, обладающее высоким сродством к неонатальному рецептору
FcRn</InventionTitle>
<SequenceTotalQuantity>3</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>10498</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..10498</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>caaggcgattaagttgggtaacgccagggttttcccagtcacgacgttg
taaaacgacggccagtgagcgcgcgtaatacgactcactatagggcgaattggagctcggttccctatac
agttgaagtcggaagtttacatacacttaagttggagtcattaaaactcgtttttcaactactccacaaa
tttcttgttaacaaacaatagttttggcaagtcagttaggacatctactttgtgcatgacacaagtcatt
tttccaacaattgtttacagacagattatttcacttataattcactgtatcacaattccagtgggtcaga
agtttacatacactaagttgactgtgcctttaaacagcttggaaaattccagaaaatgatgtcatggctt
tagaagcttcattggcgccctccgcgcctacagctcaagccacatccgaagggggagggagccgggagct
gcgcgcggggccgccggggggaggggtggcaccgcccacgccgggcggccacgaagggcggggcagcggg
cgcgcgcgcggcggggggaggggccggcgccgcgcccgctgggaattggggccctagggggagggcggag
gcgccgacgaccgcggcacttaccgttcgcggcgtggcgcccggtggtccccaaggggagggaaggggga
ggcggggcgaggacagtgaccggagtctcctcagcggtggcttttctgcttggcagcctcagcggctggc
gccaaaaccggactccgcccacttcctcgcccgccggtgcgagggtgtggaatcctccagacgctggggg
agggggagttgggagcttaaaaactagtacccctttgggaccactttcagcagcgaactctcctgtacac
caggggtcagttccacagacgcgggccaggggtgggtcattgcggcgtgaacaataatttgactagaagt
tgattcgggtgtttccggaaggggccgagtcaatccgccgagttggggcacggaaaacaaaaagggaagg
ctactaagatttttctggcgggggttatcattggcgtaactgcagggaccacctcccgggttgagggggc
tggatctccaggctgcggattaagcccctcccgtcggcgttaatttcaaactgcgcgacgtttctcacct
gccttcgccaaggcaggggccgggaccctattccaagaggtagtaactagcaggactctagccttccgca
attcattgagcgcatttacggaagtaacgtcgggtactgtctctggccgcaagggtgggaggagtacgca
tttggcgtaaggtggggcgtagagccttcccgccattggcggcggatagggcgtttacgcgacggcctga
cgtagcggaagacgccttagtgggggggaaggttctagaaaagcggcggcagcggctctagcggcagtag
cagcagcgccgggtcccgtgcggaggtgctcctcgcagagttgtttctccagcagcggcagttctcacta
cagcgccaggacgagtccggttcgtgttcgtccgcggagatctctctcatctcgctcggctgcgggaaat
cgggctgaagcgactgagtccgcgatggaggtaacgggtttgaaatcaatgagttattgaaaagggcatg
gcgaggccgttggcgcctcagtggaagtcggccagccgcctccgtgggagagaggcaggaaatcggacca
attcagtagcagtggggcttaaggtttatgaacggggtcttgagcggaggcctgagcgtacaaacagctt
ccccaccctcagcctcccggcgccatttcccttcactgggggtgggggatggggagctttcacatggcgg
acgctgccccgctggggtgaaagtggggcgcggaggcgggacttcttattccctttctaaagcacgctgc
ttcgggggccacggcgtctcctcggggatcccatgtccaatatgaccgccatgttggcattgattattga
ctagttattaatagtaatcaattacggggtcattagttcatagcccatatatggagttccgcgttacata
acttacggtaaatggcccgcctggctgaccgcccaacgacccccgcccattgacgtcaataatgacgtat
gttcccatagtaacgccaatagggactttccattgacgtcaatgggtggagtatttacggtaaactgccc
acttggcagtacatcaagtgtatcatatgccaagtccgccccctattgacgtcaatgacggtaaatggcc
cgcctggcattatgcccagtacatgaccttacgggactttcctacttggcagtacatctacgtattagtc
atcgctattaccatggtgatgcggttttggcagtacaccaatgggcgtggatagcggtttgactcacggg
gatttccaagtctccaccccattgacgtcaatgggagtttgttttggcaccaaaatcaacgggactttcc
aaaatgtcgtaacaactgcgatcgcccgccccgttgacgcaaatgggcggtaggcgtgtacggtgggagg
tctatataagcagagctcgtttagtgaaccgtcagatcactagaagctttattgcggtagtttatcacag
ttaaattgctaacgcagtcagtgcttctgacacaacagtctcgaacttaagctgcagtgactctcttaag
gtagccttgcagaagttggtcgtgaggcactgggcaggtaagtatcaaggttacaagacaggtttaagga
gaccaatagaaactgggcttgtcgagacagagaagactcttgcgtttctgataggcacctattggtctta
ctgacatccactttgcctttctctccacaggtgtccactcccagttcaattacagctcttaaggctagag
tacttaatacgactcactataggctagcctcgagaattcgtcctgctgcgcacgtgggaagccctggccc
cggccgccaccatgatgcggaccctgatcctggctgtgctgctggtgtacttctgtgccaccgtgcattg
cgaggtccagttgcagcaatctggcgccgagcttgtgaagcctggcgcttctgtgaagctgtcctgcaag
gcctccggctacatcttcaccaactacgacatcaactgggtccgacagcggcctgagcaaggcctggaat
ggatcggctggatcttccctgaggacggccggaccaagaacaacgagaagttcaagggcaaagctaccct
gacaaccgacaagtcctcctccaccgcctacatgcagctgtccagactgacctctgaggactccgccgtg
tacttttgcgctagaggcggcggatacggcaactacttcgattattggggccagggcaccctggtcacag
tttctagcggaggcggaggatctggtggtggtggatctggcggcggaggctctgatatcgtgatgacaca
ggcccacaagttcatgtccacctccgtgggcgacagagtgtccatcacatgcaaggcttcccaggacgtg
tccaccgctgtggcttggtatcagcagaagccaggccagtctcctaaggtgctgatctactgggcctcca
ccagacataccggcgtgcacgatagattcaccggctctggctctggcaccgactataccctgaccatcag
ctctgtgcaggccgaggacctggctctgtactactgtcagcagcactacagcaaccctctgacctttggc
gctggcaccaagctggaactgaaaggcggatccggagacaaaactcacacatgcccaccgtgcccagcac
ctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctctacatcacccg
ggaacctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtac
gtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtg
tggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaa
caaagccctcccagcccccatcgcgaaaaccatctccaaagccaaagggcagccccgagaaccacaggtg
tacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggct
tctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcc
tcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcag
caggggaacgtcttctcatgctccgtgatgcatgaggctctgaagttccactacacgcagaagagcctct
ccctgtctccgggtaaatgagtcgaggtcgaccgagcggttcccgcccctctccctcccccccccctaac
gttactggccgaagccgcttggaataaggccggtgtgcgtttgtctatatgttattttccaccatattgc
cgtcttttggcaatgtgagggcccggaaacctggccctgtcttcttgacgagcattcctaggggtctttc
ccctctcgccaaaggaatgcaaggtctgttgaatgtcgtgaaggaagcagttcctctggaagcttcttga
agacaaacaacgtctgtagcgaccctttgcaggcagcggaaccccccacctggcgacaggtgcctctgcg
gccaaaagccacgtgtataagatacacctgcaaaggcggcacaaccccagtgccacgttgtgagttggat
agttgtggaaagagtcaaatggctcacctcaagcgtattcaacaaggggctgaaggatgcccagaaggta
ccccattgtatgggatctgatctggggcctcggtgcacatgctttacatgtgtttagtcgaggttaaaaa
acgtctaggccccccgaaccacggggacgtggttttcctttgaaaaacacgatgataatatggccacaac
catgaccgagtacaagcccacggtgcgcctcgccacccgcgacgacgtccccagggccgtacgcaccctc
gccgccgcgttcgccgactaccccgccacgcgccacaccgtcgatccggaccgccacatcgagcgggtca
ccgagctgcaagaactcttcctcacgcgcgtcgggctcgacatcggcaaggtgtgggtcgcggacgacgg
cgccgcggtggcggtctggaccacgccggagagcgtcgaagcgggggcggtgttcgccgagatcggcccg
cgcatggccgagttgagcggttcccggctggccgcgcagcaacagatggaaggcctcctggcgccgcacc
ggcccaaggagcccgcgtggttcctggccaccgtcggcgtctcgcccgaccaccagggcaagggtctggg
cagcgccgtcgtgctccccggagtggaggcggccgagcgcgccggggtgcccgccttcctggagacctcc
gcgccccgcaacctccccttctacgagcggctcggcttcaccgtcaccgccgacgtcgaggtgcccgaag
gaccgcgcacctggtgcatgacccgcaagcccggtgcctgattcgcatatgggttaatgcttcgagcaga
catgataagatacattgatgagtttggacaaaccacaactagaatgcagtgaaaaaaatgctttatttgt
gaaatttgtgatgctattgctttatttgtaaccattataagctgcaataaacaagttccacggccggccc
tccgcgcctacagctcaagccacatccgaagggggagggagccgggagctgcgcgcggggccgccggggg
gaggggtggcaccgcccacgccgggcggccacgaagggcggggcagcgggcgcgcgcgcggcggggggag
gggccggcgccgcgcccgctgggaattggggccctagggggagggcggaggcgccgacgaccgcggcact
taccgttcgcggcgtggcgcccggtggtccccaaggggagggaagggggaggcggggcgaggacagtgac
cggagtctcctcagcggtggcttttctgcttggcagcctcagcggctggcgccaaaaccggactccgccc
acttcctcgcccgccggtgcgagggtgtggaatcctccagacgctgggggagggggagttgggagcttaa
aaactagtacccctttgggaccactttcagcagcgaactctcctgtacaccaggggtcagttccacagac
gcgggccaggggtgggtcattgcggcgtgaacaataatttgactagaagttgattcgggtgtttccggaa
ggggccgagtcaatccgccgagttggggcacggaaaacaaaaagggaaggctactaagatttttctggcg
ggggttatcattggcgtaactgcagggaccacctcccgggttgagggggctggatctccaggctgcggat
taagcccctcccgtcggcgttaatttcaaactgcgcgacgtttctcacctgccttcgccaaggcaggggc
cgggaccctattccaagaggtagtaactagcaggactctagccttccgcaattcattgagcgcatttacg
gaagtaacgtcgggtactgtctctggccgcaagggtgggaggagtacgcatttggcgtaaggtggggcgt
agagccttcccgccattggcggcggatagggcgtttacgcgacggcctgacgtagcggaagacgccttag
tgggggggaaggttctagaaaagcggcggcagcggctctagcggcagtagcagcagcgccgggtcccgtg
cggaggtgctcctcgcagagttgtttctccagcagcggcagttctcactacagcgccaggacgagtccgg
ttcgtgttcgtccgcggagatctctctcatctcgctcggctgcgggaaatcgggctgaagcgactgagtc
cgcgatggaggtaacgggtttgaaatcaatgagttattgaaaagggcatggcgaggccgttggcgcctca
gtggaagtcggccagccgcctccgtgggagagaggcaggaaatcggaccaattcagtagcagtggggctt
aaggtttatgaacggggtcttgagcggaggcctgagcgtacaaacagcttccccaccctcagcctcccgg
cgccatttcccttcactgggggtgggggatggggagctttcacatggcggacgctgccccgctggggtga
aagtggggcgcggaggcgggacttcttattccctttctaaagcacgctgcttcgggggccacggcgtctc
ctcggggatctagcttgtggaaggctactcgaaatgtttgacccaagttaaacaatttaaaggcaatgct
accaaatactaattgagtgtatgtaaacttctgacccactgggaatgtgatgaaagaaataaaagctgaa
atgaatcattctctctactattattctgatatttcacattcttaaaataaagtggtgatcctaactgacc
taagacagggaatttttactaggattaaatgtcaggaattgtgaaaaagtgagtttaaatgtatttggct
aaggtgtatgtaaacttccgacttcaactgtatagggttcctctagctagagacgacctcgggtacccag
cttttgttccctttagtgagggttaattgcgcgcttggcgtaatcatggtcatagctgtttcctgtgtga
aattgttatccgctcacaattccacacaacatacgagccggaagcataaagtgtaaagcctggggtgcct
aatgagtgagctaactcacattaattgcgttgcgctcactgcccgctttccagtcgggaaacctgtcgtg
ccagctgcattaatgaatcggccaacgcgcggggagaggcggtttgcgtattgggcgctcttccgcttcc
tcgctcactgactcgctgcgctcggtcgttcggctgcggcgagcggtatcagctcactcaaaggcggtaa
tacggttatccacagaatcaggggataacgcaggaaagaacatgtgagcaaaaggccagcaaaaggccag
gaaccgtaaaaaggccgcgttgctggcgtttttccataggctccgcccccctgacgagcatcacaaaaat
cgacgctcaagtcagaggtggcgaaacccgacaggactataaagataccaggcgtttccccctggaagct
ccctcgtgcgctctcctgttccgaccctgccgcttaccggatacctgtccgcctttctcccttcgggaag
cgtggcgctttctcatagctcacgctgtaggtatctcagttcggtgtaggtcgttcgctccaagctgggc
tgtgtgcacgaaccccccgttcagcccgaccgctgcgccttatccggtaactatcgtcttgagtccaacc
cggtaagacacgacttatcgccactggcagcagccactggtaacaggattagcagagcgaggtatgtagg
cggtgctacagagttcttgaagtggtggcctaactacggctacactagaaggacagtatttggtatctgc
gctctgctgaagccagttaccttcggaaaaagagttggtagctcttgatccggcaaacaaaccaccgctg
gtagcggtggtttttttgtttgcaagcagcagattacgcgcagaaaaaaaggatctcaagaagatccttt
gatcttttctacggggtctgacgctcagtggaacgaaaactcacgttaagggattttggtcatgagatta
tcaaaaaggatcttcacctagatccttttaaattaaaaatgaagttttaaatcaatctaaagtatatatg
agtaaacttggtctgacagttaccaatgcttaatcagtgaggcacctatctcagcgatctgtctatttcg
ttcatccatagttgcctgactccccgtcgtgtagataactacgatacgggagggcttaccatctggcccc
agtgctgcaatgataccgcgagacccacgctcaccggctccagatttatcagcaataaaccagccagccg
gaagggccgagcgcagaagtggtcctgcaactttatccgcctccatccagtctattaattgttgccggga
agctagagtaagtagttcgccagttaatagtttgcgcaacgttgttgccattgctacaggcatcgtggtg
tcacgctcgtcgtttggtatggcttcattcagctccggttcccaacgatcaaggcgagttacatgatccc
ccatgttgtgcaaaaaagcggttagctccttcggtcctccgatcgttgtcagaagtaagttggccgcagt
gttatcactcatggttatggcagcactgcataattctcttactgtcatgccatccgtaagatgcttttct
gtgactggtgagtactcaaccaagtcattctgagaatagtgtatgcggcgaccgagttgctcttgcccgg
cgtcaatacgggataataccgcgccacatagcagaactttaaaagtgctcatcattggaaaacgttcttc
ggggcgaaaactctcaaggatcttaccgctgttgagatccagttcgatgtaacccactcgtgcacccaac
tgatcttcagcatcttttactttcaccagcgtttctgggtgagcaaaaacaggaaggcaaaatgccgcaa
aaaagggaataagggcgacacggaaatgttgaatactcatactcttcctttttcaatattattgaagcat
ttatcagggttattgtctcatgagcggatacatatttgaatgtatttagaaaaataaacaaataggggtt
ccgcgcacatttccccgaaaagtgccacctgacgcgccctgtagcggcgcattaagcgcggcgggtgtgg
tggttacgcgcagcgtgaccgctacacttgccagcgccctagcgcccgctcctttcgctttcttcccttc
ctttctcgccacgttcgccggctttccccgtcaagctctaaatcgggggctccctttagggttccgattt
agtgctttacggcacctcgaccccaaaaaacttgattagggtgatggttcacgtagtgggccatcgccct
gatagacggtttttcgccctttgacgttggagtccacgttctttaatagtggactcttgttccaaactgg
aacaacactcaaccctatctcggtctattcttttgatttataagggattttgccgatttcggcctattgg
ttaaaaaatgagctgatttaacaaaaatttaacgcgaattttaacaaaatattaacgcttacaatttcca
ttcgccattcaggctgcgcaactgttgggaagggcgatcggtgcgggcctcttcgctattacgccagctg
gcgaaagggggatgtgctg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>118</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..118</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q9">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>EVQLQQSGAELVKPGASVKLSCKASGYIFTNYDINWVRQRPEQGLEWIG
WIFPEDGRTKNNEKFKGKATLTTDKSSSTAYMQLSRLTSEDSAVYFCARGGGYGNYFDYWGQGTLVTVS<
/INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>111</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..111</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q13">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>DIVMTQAHKFMSTSVGDRVSITCKASQDVSTAVAWYQQKPGQSPKVLIY
WASTRHTGVHDRFTGSGSGTDYTLTISSVQAEDLALYYCQQHYSNPLTFGAGTKLELKGGSG</INSDSe
q_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
Изобретение относится к биотехнологии. Предложена плазмидная генетическая конструкция pVEAL2-9E2ch-scFv, обеспечивающая экспрессию и секрецию антитела 9E2ch против вируса Западного Нила (ВЗН) в клетках млекопитающих, имеющая нуклеотидную последовательность SEQ ID NO: 1, размер 10498 п.н. и содержащая в соответствии с физической и генетической картой, представленной на фиг. 1, последовательность 9E2-scFv, кодирующую вариабельные фрагменты тяжелой и легкой цепей антитела 9Е2, соединенных пептидным линкером. Предложен рекомбинантный штамм клеточной линии яичника китайского хомячка CHO-K1-9E2ch, содержащий плазмидную генетическую конструкцию pVEAL2-9E2ch-scFv и обеспечивающий экспрессию и секрецию одноцепочечного антитела 9E2ch против ВЗН. Указанный штамм депонирован под номером 324 в коллекции культур клеток ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора. Также предложено химерное одноцепочечное антитело 9E2ch против ВЗН, которое продуцируется указанным штаммом. Изобретение обеспечивает химерное одноцепочечное антитело 9E2ch, обладающее высоким сродством к неонатальному рецептору FcRn и характеризующееся функциональной активностью против ВЗН. 3 н.п. ф-лы, 2 ил., 2 табл., 5 пр.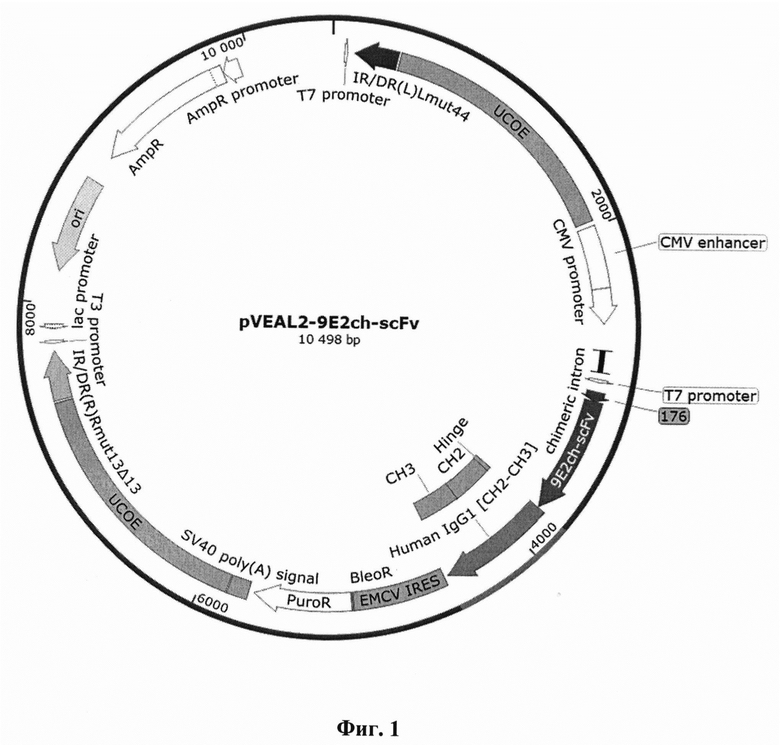
1. Плазмидная генетическая конструкция pVEAL2-9E2ch-scFv, обеспечивающая экспрессию и секрецию антитела 9E2ch против вируса Западного Нила в клетках млекопитающих, имеющая нуклеотидную последовательность SEQ ID NO: 1, размер 10498 п.н. и содержащая в соответствии с физической и генетической картой, представленной на фиг. 1, следующие элементы:
- участок начала репликации ori, имеющий координаты с 8200 по 8788 п.н.;
- последовательности прямых и инвертированных повторов IR/DR, содержащие сайты связывания с транспозазой SB 100, имеющие координаты с 139 по 403 и с 7416 по 7711 п.н.;
- последовательности UCOE, предотвращающие хромосомное «замалчивание» рекомбинантной экспрессионной кассеты, имеющие координаты с 416 по 1964 и с 5856 по 7404 п.н.;
- CMV энхансер, имеющий координаты с 1995 по 2374 п.н., CMV промотор, имеющий координаты с 2375 по 2586 п.н. - наиболее часто используемые промоторы в генно-терапевтических конструкциях;
- Chimeric intron - химерный интрон для усиления экспрессии целевого гена, имеющий координаты с 2747 по 2879 п.н.;
- лидерный пептид 176 - последовательность, кодирующая гибридный лидерный пептид люциферазы и фиброина, обеспечивающая экспорт белка из клетки и имеющая координаты с 3001 по 3060 п.н.;
- последовательность 9E2ch-scFv, кодирующая вариабельные фрагменты тяжелой и легкой цепи антитела 9E2ch, соединенные пептидным линкером, имеющая координаты с 3061 по 3795 п.н.;
- константная цепь антитела человека IgG1 с мутациями M252Y, S254T, Т256Е, Е333А, H433K/N434F, которая увеличивает период полураспада антитела за счет взаимодействия с неонатальными рецепторами, имеющая координаты с 3796 по 4479 п.н.;
- участок внутренней посадки рибосомы EMCV IRES, имеющий координаты с 4498 по 5072 п.н.;
- последовательность PuroR, кодирующая фактор устойчивости к антибиотику пуромицину, имеющая координаты с 5085 по 5684 п.н.;
- последовательность SV40 poly(A) signal для стабилизации мРНК-транскриптов за счет полиаденилирования, имеющая координаты с 5719 по 5840 п.н.;
- ген устойчивости к антибиотику ампициллину AmpR, позволяющий проводить амплификацию плазмиды в E. coli, имеющий координаты с 8953 по 9813 п.н.
2. Рекомбинантный штамм клеточной линии яичника китайского хомячка CHO-K1-9E2ch продуцента рекомбинантного одноцепочечного антитела 9E2ch против вируса Западного Нила, содержащий интегративный плазмидный вектор pVEAL2-9E2ch-scFv по п. 1, обеспечивающий экспрессию и секрецию одноцепочечного антитела 9E2ch и депонированный под номером 324 в коллекции культур клеток ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора.
3. Химерное одноцепочечное антитело 9E2ch против вируса Западного Нила, продуцируемое рекомбинантным штаммом клеточной линии яичника китайского хомячка CHO-K1-9E2ch по п. 2, имеющее аминокислотную последовательность вариабельных фрагментов тяжелой цепи SEQ ID NO: 2 и легкой цепи SEQ ID NO: 3, и предназначенное для создания терапевтических препаратов против вируса Западного Нила.
Авторы
Даты
2023-08-10—Публикация
2022-10-11—Подача