Заявляемая группа изобретений относится к области биомедицины, трансфузиологии, фармакологии, биофизики, в частности к лекарственным средствам на основе эмульсии перфторорганических соединений (ПФОС), предназначенным для лечения системных и локальных нарушений кровотока, гипоксических и ишемических состояний, улучшения массообмена газов и метаболитов между кровью и тканями, поддержания функции изолированных органов и тканей, уменьшения явлений воспаления, проведения инфузионно-трансфузионной терапии при шоке и кровопотере.
ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ, СИМВОЛОВ, ЕДИНИЦ И ТЕРМИНОВ, ИСПОЛЬЗОВАННЫХ В НАСТОЯЩЕЙ ЗАЯВКЕ
Используемые в биологии и медицине ПФОС представляют собой полностью фторированные органические соединения разных классов, включающие перфторуглероды (ПФУ) - соединения, содержащие атомы только фтора и углерода, перфторированные третичные амины (ПФТА), в которых наряду с атомами фтора и углерода имеется атом азота, а также перфторированные эфиры, в структуре которых имеются атомы кислорода. В последние годы используются также бромсодержащие ПФОС. Жидкие ПФОС прозрачные, бесцветные, без запаха, примерно в 2 раза тяжелее воды. Высокая прочность связи C-F (485,6 кДж/моль) обеспечивает химическую стабильность ПФОС и слабые силы межмолекулярного взаимодействия (1, 2). Последнее свойство обеспечивает повышенную способность ПФОС растворять различные газы.
ПФОС практически не растворяются в H2O, однако некоторые ПФОС слаборастворимы в липидах - липофильные ПФОС. Все виды ПФОС не подвергаются метаболическим превращениям в организме человека и животных. Вопрос о стабильности и отщепление атома брома и, следовательно, возможности распада оставшейся без брома молекулы в литературе не обсуждался. Липофильные ПФОС, а среди них наиболее липофильным является перфтороктилбромид (ПФОБ), вследствие физического взаимодействия с биологическими мембранами и гидрофобными участками белковых молекул могут оказывать выраженное влияние на метаболизм и многие функции клеток, тканей организма в целом (3, 4, 5, 6). Согласно данным L.Clark (7), подтвержденным позже А.Н.Склифас и др (8), включение в состав эмульсии наряду с липофильным ПФД других липофильных ПФОС может приводить к гибели животных через несколько месяцев после внутривенного введения таких эмульсий.
Известно, что для ликвидации этого смертельного эффекта к липофильным перфторорганическим соединениям предлагается добавлять липофобное перфторорганическое соединение, например, перфтор-N-(4-метициклогексил)-пиперидин (8, 9). Однако при этом возникает проблема подбора эмульгатора, так как липофильные перфторорганические соединения стабилизируются фосфолипидами, а липофобные перфторорганические соединения - блоксополимерами окисиэтилена и окисипропилена (плюроником F-68 - по западной классификации; проксанолом 268 - по российской номенклатуре). Кроме того, использование смеси резко различающихся по физико-химическим свойствам веществ (липофилильных и липофобных) существенно уменьшает стабильность эмульсии при хранении (замораживании-оттаивании, или длительном хранении в незамороженном виде) и при попадании эмульсии в кровоток. Расчеты и модельные эксперименты (10) дают основание полагать, что это связано с кластеризацией недостаточно однородной смеси веществ внутри частиц эмульсии и постоянным турбулентным движением фторуглеродной фазы вблизи адсорбционного слоя поверхностно-активного компонента - стабилизирующего агента.
Введенные внутривенно в виде эмульсий ПФОС довольно быстро выводятся из кровотока. Основная масса ПФОС выводится через легкие. Поэтому те ПФОС, которые имеют относительно высокую упругость пара (они же, как правило, отличаются большей липофильностью), могут вызывать эмфизему легких вплоть до разрыва отдельных альвеол и нарушения газообмена и кровотока в ткани легких. До 30% введенных в организм в составе эмульсий ПФОС захватываются клетками ретикуло-эндотелиальной системы (РЭС) - преимущественно в печени, селезенке, костном мозге, лимфатических узлах, а также частично растворяются в жировой ткани и фосфолипидах мембран практически всех клеток. Аккумулированные таким образом ПФОС задерживаются в органах и тканях на срок от нескольких дней (ПФОБ, ПФД) до нескольких лет (ПФТБА) в зависимости от физико-химических свойств ПФОС и дозы введенной эмульсии. Скорость выведения ПФОС из органов зависит от ряда связанных между собой физико-химических параметров: структуры, молекулярной массы (ММ), температуры кипения, упругости пара, а главным образом от параметра, определяемого как критическая температура растворения ПФОС в гексане (ТкрГ). ТкрГ - это температура, при которой смешиваются друг с другом равные объемы исследуемого соединения и гексана. ТкрГ рассматривают как меру относительной растворимости ПФОС в липидах, которая характеризует как степень их растворения в липидах мембран, скорость их прохождения через мембраны, так и степень сродства с гидрофобными участками белковых молекул.
Чем ниже ТкрГ, меньше ММ и выше упругость пара, тем лучше данное ПФОС растворимо в липидах, быстрее диффундирует и тем оно легче и быстрее выводится из организма. Прослежена хорошая корреляция между указанными параметрами и периодом полувыведения (t1/2) ПФОС из клеток РЭС. В настоящее время внимание исследователей, занятых разработкой и изучением эмульсий ПФОС, сосредоточено на относительно небольшом числе соединений (таблица 1).
При изготовлении эмульсий для внутрисосудистого введения большинство специалистов отдает предпочтение быстро выводящимся липофильным ПФОС (2, 10, 11, 12, 13, 14), имеющим относительно малую величину ТкрГ, включая высоколипофильный ПФОБ. Однако в состав «Fluosol DA», выпускаемого в 70-80 гг. фирмой Green Cross Corporation (Japan), наряду с быстро выводящимся ПФД входил и относительно медленно выводящийся ПФТПА (12). В состав «Oxygent», разработанного фирмой Alliance Therapeutic (USA), входят высоколипофильный ПФОБ и ПФДБ (13, 14). Коммерческий фармакопейный препарат «Перфторан», разработанный в СССР и выпускаемый в аптечную сеть компанией ОАО НПФ «Перфторан», наряду с быстро выводящимся ПФД содержит ПФМЦП относительно долго задерживающийся в клетках РЭС (6).
Следует отметить, что собственно эмульсии ПФОС, несмотря на химическую и метаболическую инертность входящих в них компонентов, имеют также выраженную биологическую активность, которая определяется не только свойствами собственно компонентов, но в значительной степени зависит от формируемой поверхностно-активным веществом (СА) границы раздела фаз, наличия СА или его дисперсии в водном фазе, от стабильности адсорбционного слоя, а также от степени дисперсности эмульсии, которая может выполнять роль огромной сорбционной и обменной каталитически активной поверхности. Введенная в организм эмульсия фактически привносит в кровоток и в мембраны огромную гидрофобную фазу, которая может выполнять роль среды для осуществления различных реакций между соединениями, имеющими повышенную растворимость в гидрофобной фазе. Иными словами, эмульсия ПФОС может стимулировать явления микрокатализа, протекающие в гидрофобной фазе или на границе раздела фаз.
Поскольку жидкие ПФОС не растворяются в воде и в них не растворяются полярные соединения, играющие важнейшую роль в гомеостазе биологических объектов, постольку ПФОС могут вводиться в кровоток лишь в виде тонко диспергированной эмульсии. Способность ПФОС и эмульсий ПФОС участвовать в газообмене определяется физическим растворением газов, и согласно закону Генри количество растворенного газа прямо пропорционально его парциальному давлению. Количество газа, растворенного в эмульсии ПФОС, зависит от объемного содержания фторуглеродной фазы и не зависит от размера частиц. Так, количество растворенного в эмульсиях ПФОС газа, определяемого экспериментально, практически равно расчетным значениям, получаемым при сложении значений содержания этого газа в каждой фазе в отдельности (количество растворенного кислорода в водной фазе плюс количество растворенного газа в ПФОС) при данной величине парциального давления газа. Таким образом, количество любого газа, содержащегося в эмульсии ПФОС, может быть рассчитано в соответствии с физическими законами их растворимости, исходя из парциального давления газа и объемного соотношения фракций ПФОС/Н2О. Благодаря субмикронному размеру эмульсий ПФОС, при их введении в кровоток более чем на порядок возрастает площадь поверхностей, участвующих в газообмене. Вместе с почти десятикратным по сравнению с гемоглобином в эритроцитах ускорением процессов насыщения и отдачи кислорода это способствует значимому ускорению массобмена по кислороду и углекислому газу, даже в том случае, если доза введенной в кровоток эмульсии, содержащей всего 10 об.% ПФОС, не превышает 1-5% от объема циркулирующей крови.
Лечебная эффективность эмульсий ПФОС, описанная в экспериментальных и клинических исследованиях, выполненных с Fluosol-DA (12) и Перфтораном (6, 15), ограничена их возможным побочным действием. Следующие факторы ограничивают лечебное использование эмульсий ПФОС как лекарственных препаратов. Во-первых, еще в 1971 Fujita (12) установил, что при размере частиц эмульсии более 0,1 мкм резко возрастает их токсичность, что, вероятно, обусловлено тромбоэмболическими осложнениями. При увеличении доли крупных частиц (со средним диаметром, превышающим 0,4 мкм) с 3% до 10% ЛД50 для эмульсий ПФОС снижается более чем в 2 раза. Значимость размера частиц для переносимости эмульсий показал С.И.Воробьев (16), установивший, что увеличение размера частиц, даже если их доля составляет всего 1-2%, приводит к появлению реактогенности, проявляющейся в развитии анафилактоидных реакций уже после введения первых капель эмульсии в кровоток. Проявления анафилактоидной реакций могут быть разными по степени выраженности - легкими, средники и тяжелыми: от покраснения кожи и легких аллергических проявлений вплоть до остановки дыхания.
По результатам исследования жировых эмульсий и Fluosol DA большинство исследователей считают, что реактогенность определяется природой стабилизирующего агента - СА, используемого для диспергирования ПФОС и формирующего адсорбционный слой вокруг частиц. Полагают, что ответственным за реактогенность является неионогенный СА блок-сополимер полиоксиэтилена (ПОЭ) и полиоксипропилена (ПОП) Pluronic F 68, формально являющийся аналогом проксанола 268, и что его замена на природные фосфолипиды может полностью снять проблемы реактогенности. Однако известно, что жировые эмульсии, стабилизированные природными фосфолипидами, обладают в большинстве своем реактогенностью. Следовательно, реактогенность эмульсий ПФОС не может быть ликвидирована только за счет использования фосфолипидов в качестве эмульгатора и стабилизатора частиц ПФОС. Согласно патенту (17) реактогенность эмульсий ПФОС помимо степени дисперсности определяется, прежде всего, свойствами поверхности эмульгированных частиц, то есть состоянием слоя эмульгатора, стабилизирующего частицы. Ведущими параметрами при этом являются прочность связи СА с масляным фторуглеродным «ядром» частиц эмульсии, характер расположения молекул СА на поверхности, плотность их упаковки, устойчивость адсорбционных свойств по отношению к белкам и другим биологически активным молекулам, находящимся в кровотоке. Для получения нужного соответствия в указанном патенте предлагается опытным путем подбирать состав масляного «ядра», композицию ПФОС и взаимодействующего с ним СА. Однако эмпирический подбор и установленные в результате сочетания ПФОС и СА в любом случае оставляют неопределенным широкий диапазон вариаций стабильности эмульсий ПФОС вследствие вариабельности химических технологий получения ПФОС и СА, а также, казалось бы, незначительных отклонений в технологии диспергирования.
Основные причины вариаций состава СА заключаются в самой природе полимерных и фосфолипидных СА. Важным дестабилизирующим фактором является также наличие внутри масляной фазы ПФОС постоянных турбулентных потоков, возникающих при смешивании разнородных ФСПО, включенных в состав масляного «ядра»: из смеси липофильных и липофобных ПФОС, существенно отличающихся по величине ТкрГ.
С целью повышения стабильности и уменьшения реактогенности эмульсий ПФОС согласно патенту РФ №2206319 (18), который выбран в качестве прототипа, было предложено увеличить однородность «маслянного» ядра путем использования добавок ПФОС, близких к основным компонентам ПФД и ПФМЦП по структуре и несколько уменьшающих различия между ПФД и ПФМЦП по величине ТкрГ. Однако диапазон различий в величинах ТкрГ между ПФОС, использованными в составе по патенту РФ № 2206319, остается более 10°С - достаточно большим. Экспериментальный анализ, выполненный с помощью тепловизионого высокочувствительного матричного детектора показал, что при таком разрыве по величине ТкрГ в смеси ПФОС, использованных в эмульсии по патенту РФ № 2206319, наблюдаются весьма интенсивные турбулентные движения во фторуглеродной фазе.
Задачей заявляемой группы изобретений, связанных единым изобретательским замыслом, является создание стабильной эмульсии ПФОС в первую очередь за счет уменьшения различий в величинах ТкрГ внутри фторуглеродной самосборки за счет адсорбционной сепарации, в соответствии с видом используемых ПФОС ядра частиц эмульсии и изменения состава стабилизирующего агента. Решение поставленной задачи достигается с помощью оригинального метода получения эмульсии.
Сущность изобретения в части эмульсии перфторорганических соединений (ПФОС) для биологических и медицинских целей состоит в том, что она содержит смесь перфторуглеродов (ПФУ), основным компонентом которой является перфтордекалин (ПФД) и смесь перфторированных третичных аминов (ПФТА), основным компонентом которой является перфтор-N-(4-метилциклогексил)-пиперидин (ПФМЦП), имеющий меньшие, чем ПФД, скорости выведения из организма, стабилизирующий агент и физиологически приемлемый водно-солевой раствор с субстратами энергетического обмена, причем все компоненты ПФОС имеют значения критической температуры растворения в гексане (ТкрГ), различающиеся не более чем на 2-4°С, а стабилизирующий агент представляет собой смесь блок-сополимеров из группы блок-сополимеров полиоксиэтилена-полиоксипропилена со средним массовым содержанием полиоксипропилена 20%, при этом в смеси ПФД содержатся только полностью фторированные примеси ПФУ, получаемые при синтезе ПФД, а в смеси ПФМЦП - только полностью фторированные примеси ПФТА, а также, по меньшей мере, один компонент из группы: смеси перфтортрипропиламина (ПФТПА) только с полностью фторированными примесями ПФТА, смеси перфтортрибутиламина (ПФТБА) только с полностью фторированными примесями ПФТА, смеси перфтордецилового эфира (ПФДЭ) только с полностью фторированными примесями перфторированных эфиров (ПФЭ).
В частных случаях реализации эмульсия в качестве перфторуглеродов содержит смесь перфторированных копродуктов перфтордекалина, имеющих средний период полувыведения из организма не менее 12 дней и диапазон ТкрГ в пределах 22-29°С, очищенную от водородсодержащих и непредельных примесей, в качестве перфторированных третичных аминов она содержит смесь всех копродуктов перфтортрипропиламина, имеющих средний период полувыведения из организма не менее 60 дней и диапазон ТкрГ в пределах 41-46°С, очищенную от водородсодержащих и непредельных примесей, или в качестве перфорированных третичных аминов она содержит смесь копродуктов перфтор-N-(4-метилциклогексил)-пиперидина, имеющих средний период полувыведения из организма не менее 80 дней и диапазон ТкрГ в пределах 32-40°С, очищенную от водородсодержащих и непредельных примесей, в качестве медленно выводящихся ПФОС она содержит смесь копродуктов перфтордецилового эфира (ПФДЭ), имеющих средний период полувыведения из организма не менее 500 дней и диапазон ТкрГ в пределах 49-53°С, очищенную от водородсодержащих и непредельных примесей, в качестве перфторированных третичных аминов она может содержать смесь копродуктов перфтортрибутиламина, имеющих средний период полувыведения из организма не менее 900 дней, и диапазон ТкрГ в пределах 56-60°С, очищенную от водородсодержащих и непредельных примесей, соотношение содержащихся в ней быстро выводящихся и медленно выводящихся ПФОС составляет от 5:1 до 1:5, в качестве стабилизирующего агента она содержит смесь отобранных методом насыщающей аффинной сепарации (НАС) сополимеров полиоксиэтилена (ПОЭ)-полиоксипропилена (ПОП) с молекулярной массой 5-13 тыс. Да, в качестве стабилизирующего агента она содержит смесь отобранных методом НАС сополимеров ПОЭ и ПОП при соотношении ПОЭ:ПОП в диапазоне от 78:22 до 82:18, содержание стабилизирующего агента в ней составляет 1-5%, для обеспечения вязкости 2-5 сП, а физиологически приемлемый водно-солевой раствор включает NaCl, KCl, MgCl2, NaHCO3, NaH2PO4, Na2HPO4D-глюкозу для обеспечения изоосмотичности в конечной лекарственной форме, при этом поддерживается соотношение ионов Na и К на уровне 10:1-30:1 и величина рН в диапазоне 6,9-8,0, водно-солевая часть готовой конечной лекарственной формы содержит 110-150 мМ NaCl, 4-5 мМ KCl, 1-3 мМ MgCl2 6-20 мМ NaHCO3, 1-2 мМ NaH2PO4, 1-2 мМ Na2HPO4 и 10-15 мМ D-глюкозы, а для использования в качестве противоишемического протектора водно-солевая часть препарата содержит 4-15 мМ KCl, соли три-, ди- и монокарбоновых кислот, в том числе 1-7 мМ цитрата натрия, 1-7 мМ изоцитрата натрия, 1-7 мМ сукцината натрия, 1-7 мМ α-кетоглутарата натрия, 1-7 мМ пирувата натрия, 1-7 мМ β-оксибутирата натрия, 1-7 мМ глутамата натрия, 1-7 мМ аспартата натрия.
Сущность изобретения в части способа приготовления эмульсии ПФОС (в соответствии с вышеизложенной совокупностью признаков эмульсии) для биологических и медицинских целей включает смешивание и диспергирование смеси жидких ПФОС с водным раствором стабилизирующего агента с последующим измельчением в гомогенизаторе высокого давления до субмикронного размера частиц эмульсии, причем:
- смесь ПФОС, имеющую различия по ТкрГ не более 2-3°С, заливают в емкость, содержащую раствор смеси СА в соотношении 10-30 объемных частей ПФОС к 90-70 объемам раствора смеси СА,
- полученную неоднородную смесь подвергают процедуре НАС, проводимой при температуре 50-60°С, включающей получение грубой дисперсии ПФОС в растворе СА путем перемешивания на высокоскоростной мешалке при скорости вращения ротора при 1000-3000 об/мин, полученную грубую дисперсию подвергают экструзии в гомогенизаторе под давлением 100-300 кг/см2, в атмосфере, не содержащей кислород, и отделяют грубую дисперсию ПФОС от водного раствора СА, полученный осадок грубой дисперсии смешивают со свежей порцией раствора СА из такого расчета, чтобы объемная доля ПФОС составляла 10-30%,
- при этом описанная операция НАС повторяется не менее 2 раз,
- после чего эмульсию пропускают многократно через гомогенизатор при давлении 300-700 кг/см2,
- полученную субмикронную эмульсию разбавляют водно-солевым раствором таким образом, чтобы конечная концентрация ПФОС составляла 4-12 об.% и эмульсия имела осмотическое давление в диапазоне 270-330 мОсм.
В частных случаях реализации способа смеси из жидких ПФУ и ПФТА или ПФЭ получают в соотношении от 5:1 до 1:5, подвергают после смешивания промыванию апирогенными водно-спиртовыми растворами и водой, отделяют смеси более плотных жидких ПФОС от водно-спиртового раствора и воды, фильтруют под давлением газа, не содержащего кислород, разливают и укупоривают во флаконы под закатку и осуществляют автоклавирование, СА приготавливают в виде 10-30% водного раствора сополимеров полиоксиэтилена-полиоксипропилена - проксанола 168 и проксанола 268, взятых в соотношении от 10:1 до 1:10 в зависимости от состава композиции смеси ПФОС, очищают раствор СА путем пропускания через угольный сорбент и стерилизующий фильтр под давлением газа, не содержащего кислород, прогревают раствор СА в течение 8-24 часов и охлаждают до 16-20°С для полного восстановления прозрачности раствора, водный раствор смеси сополимеров полиоксиэтилена-полиоксипропилена прогревают при температуре, которая выбирается в диапазоне ±2°С от температуры помутнения, установленной экспериментальным путем для полученной смеси СА.
Сущность изобретения в части способа лечения заболеваний кровеносной системы состоит в том, что осуществляют введение в кровоток или в лимфатический проток быстровыводящихся перфторорганических соединений, отличающийся тем, что в качестве быстровыводящихся перфторорганических соединений в кровоток вводят эмульсию ПФОС (в соответствии с вышеизложенной совокупностью признаков эмульсии).
В частных случаях реализации способа для лечения явлений гипоксии, ишемии, отека, воспаления при шоке, кровопотере, тромбо-эмболических поражениях, функциональных и органических нарушениях проходимости сосудов, повреждении тканей осуществляют внутривенное введение эмульсии ПФОС в дозе 0,5-30 мл на 1 кг массы тела, для подавления вторичной альтерации при воспалении и раневом процессе, а также для ускорения заживления травматических, трофических и операционных ран осуществляют внутривенное введение эмульсии ПФОС в дозах 0.3 - 6 мл на кг массы тела и/или местно порциями по 0,5-50 мл подкожно, внутримышечно, в глубину вокруг поврежденного участка или в окружающие воспаленные и травмированные ткани полости или биологические жидкости, в частности интраплеврально, интраперитонеально, интралюмбально, в общий лимфатический проток в дозе 1-100 мл, а также в качестве очищающей или аппликационной жидкости при обработке открытых раневых поверхностей, а для улучшения системного и локального кровотока, регуляции системного артериального давления и перфузионного регионарного давления, облегчения и ускорения массообмена по газам, субстратам и метаболитам осуществляют внутрисосудистое или местное введение эмульсии ПФОС в ткани, в том числе при перфузионной и бесперфузионной защите изолированных или отключенных от кровотока органов и тканей.
Таким образом, снижение основного процесса разрушения эмульсий ПФОС, вызываемого молекулярной диффузией, достигают в заявляемом составе так же, как и в других патентах (12, 17, 18), введением во фторуглеродную основу компонента с низкой упругостью пара (например, ПФМЦП или ПФТБА) и менее растворимого в воде, имеющего более высокую температуру кипения и замедляющего этот процесс. Но при этом, в отличие от прототипа, в предлагаемом изобретении максимально возможным образом ликвидируются «окна» разрыва между физико-химическими характеристиками различных ПФОС, входящих в ядро капель эмульсии, и адсорбционный слой частиц эмульсии формируется из смеси СА путем самосборки - методом насыщающей адсорбционной сепарации (НАС).
Эмульсия ПФОС для биологических и медицинских целей содержит смесь быстро выводящихся перфторуглеродов (ПФУ) с основным компонентом ПФД и смесь перфторированных третичных аминов (ПФТА) с основным компонентом перфтор-N-(4-метилциклогексил)-пиперидином (ПФМЦП), имеющим меньшие скорости выведения из организма, стабилизирующий агент и физиологически приемлемый водно-солевой раствор с субстратами энергетического обмена, ПФОС содержат дополнительно в смеси ПФД все полностью фторированные примеси ПФУ, получаемые при синтезе ПФД, в смеси ПФМЦП - все полностью фторированные примеси ПФТА, и/или дополнительно содержит перфтортрипропиламин (ПФТПА) со всеми присущими ему при получении полностью фторированными примесями ПФТА, и/или дополнительно содержит перфтортрибутиламин (ПФТБА) со всеми присущими ему при получении полностью фторированными примесями ПФТА, и/или дополнительно содержит перфтордигексиловый эфир (ПФДЭ) со всеми присущими ему при получении полностью фторированными примесями перфторированных эфиров (ПФЭ) и стабилизирующий агент в виде смеси блоксопоримеров, с возможностью образования выбранными смесями ПФОС гомогенной структуры внутри капель эмульсии, за счет того, что компоненты смеси ПФОС имеют малые различия по критической температуры растворения в гексане (ТкрГ) с интервалом не более 2-4°С.
Эмульсия ПФОС характеризуется тем, что в качестве быстро выводящихся ПФУ используется смесь всех перфторированных копродуктов перфтордекалина, имеющих средний период полувыведения из организма не менее 12 дней и диапазон ТкрГ 22-29°С, очищенная от водородсодержащих и непредельных примесей.
Эмульсия ПФОС характеризуется тем, что в качестве ПФТА содержит смесь всех копродуктов ПФТПА, имеющих средний период полувыведения из организма не менее 60 дней и диапазон ТкрГ 41-46°С, очищенная от водородсодержащих и непредельных примесей.
Эмульсия ПФОС характеризуется тем, что в качестве ПФТА содержит смесь копродуктов ПФМЦП, имеющих средний период полувыведения из организма не менее 80 дней и диапазон ТкрГ 32-40°С, очищенная от водородсодержащих и непредельных примесей.
Эмульсия ПФОС характеризуется тем, что в качестве медленно выводящихся ПФОС содержит смесь копродуктов ПФДЭ, имеющих средний период полувыведения из организма не менее 500 дней и диапазон ТкрГ 49-53°С, очищенная от водородсодержащих и непредельных примесей.
Эмульсия ПФОС характеризуется тем, что в качестве ПФТА содержит смесь копродуктов перфтортрибутиламина (ПФТБА), имеющих средний период полувыведения из организма не менее 900 дней, и диапазон ТкрГ 56-60°С, очищенная от водородсодержащих и непредельных примесей.
Эмульсия ПФОС характеризуется тем, что соотношение быстро выводящихся и медленно выводящихся ПФОС составляет 5:1 или 1:5.
Эмульсия ПФОС характеризуется тем, что в качестве стабилизирующего агента содержит смесь сополимеров полиоксиэтилена (ПОЭ)-полиоксипропилена (ПОП) с молекулярной массой 5-13 тыс. Да, формируемую (отобранных) методом насыщающей аффинной сепарации (НАС).
Эмульсия ПФОС характеризуется тем, что в качестве стабилизирующего агента содержит смесь отобранных методом НАС сополимеров ПОЭ и ПОП при массовом соотношении ПОЭ:ПОП в диапазоне от 78:22 до 82:18.
Эмульсия ПФОС характеризуется тем, что содержание стабилизирующего агента в водной фазе составляет 1-5% для обеспечения вязкости 2-5 сПуаз.
Эмульсия ПФОС характеризуется тем, что физиологически приемлемый водно-солевой раствор включает NaCl, KCl, MgCl2, NaHCO3, NaH2PO4, Na2HPO4 и D-глюкозу для обеспечения изоосмотичности в конечной лекарственной форме, при этом поддерживается соотношение ионов Na и К на уровне 8:1-30:1 и величина рН в диапазоне 6,9 - 8,0.
Эмульсия ПФОС характеризуется тем, что водно-солевая часть готовой конечной лекарственной формы содержит 110-150 мМ NaCl, 4-5 мМ KCl, 1-3 мМ MgCl2, 6-20 мМ NaHCO3, 1-2 мМ NaH2PO4, 1-2 мМ Na2HPO4 и 10-15 мМ D-глюкозы.
Эмульсия ПФОС характеризуется тем, что в случае использования в качестве противоишемического протектора водно-солевая часть содержит 4-15 мМ KCl, 10-20 мМ D-глюкозы и соли три-, ди- и монокарбоновых кислот, в том числе 1-7 мМ цитрата натрия, 1-7 мМ изоцитрата натрия, 1-7 мМ сукцината натрия, 1-7 мМ α-кетоглутарата натрия, 1-7 мМ пирувата натрия, 1-7 мМ β-оксибутирата натрия, 1-7 мМ глутамата натрия, 1-7 мМ аспартата натрия.
Способ приготовления эмульсии ПФОС для биологических и медицинских целей реализуется путем смешивания и диспергирования смеси жидких ПФОС с водным раствором стабилизирующего агента с последующим измельчением в гомогенизаторе высокого давления до субмикронного размера частиц эмульсии, причем:
- смесь ПФОС, содержащую компоненты, различающиеся по ТкрГ не более чем на 4°С, заливают в емкость, содержащую раствор смеси СА в соотношении 10-30 объемных частей ПФОС к 90-70 объемам раствора смеси СА,
- полученную неоднородную смесь подвергают процедуре НАС, проводимой при температуре 50-60°С, включающей получение грубой дисперсии ПФОС в растворе смеси СА путем перемешивания на высокоскоростной мешалке при скорости вращения ротора 1000-3000 об/мин; полученную грубую дисперсию подвергают экструзии в гомогенизаторе под давлением 100-300 кг см2, в атмосфере, не содержащей кислород, и отделяют грубую дисперсию ПФОС от водного раствора СА; полученный осадок грубой дисперсии смешивают со свежей порцией раствора СА из такого расчета, чтобы объемная доля ПФОС составляла 10-30%,
- при этом описанная операция НАС повторяется не менее 2 раз,
- после чего эмульсию пропускают многократно через гомогенизатор при давлении 300-700 кг/см2,
- полученную субмикронную эмульсию разбавляют водно-солевым раствором таким образом, чтобы конечная концентрация ПФОС составляла 4-12 об.% и эмульсия имела осмотическое давление в диапазоне 270-330 мОсм на л.
Способ приготовления эмульсии ПФОС реализуется таким образом, что смеси из жидких ПФУ и ПФТА или ПФЭ получают в соотношении от 5:1 до 1:5, подвергают после смешивания промыванию апирогенными водно-спиртовыми растворами и водой, отделяют смеси более плотных жидких ПФОС от водно-спиртового раствора и воды, фильтруют под давлением газа, не содержащего кислород, разливают и укупоривают во флаконы под закатку и осуществляют автоклавирование.
Способ приготовления эмульсии ПФОС реализуется таким образом, что смесь СА приготавливают в виде 10-30% водного раствора блоксополимеров полиоксиэтилена-полиоксипропилена - смеси проксанола 168 и проксанола 268, взятых в соотношении от 10:1 до 1:10 в зависимости от состава композиции смеси ПФОС, очищают раствор СА путем пропускания через угольный сорбент и стерилизующий фильтр под давлением газа, не содержащего кислород, прогревают раствор СА в течение 8-24 часов и охлаждают до 16-20°С для полного восстановления прозрачности раствора.
Способ приготовления эмульсии ПФОС реализуется таким образом, что водный раствор смеси блоксополимеров полиоксиэтилена-полиоксипропилена прогревают при температуре, которая выбирается в диапазоне ±2°С от температуры помутнения, установленной экспериментальным путем для полученной смеси СА.
Способ применения эмульсии ПФОС для уменьшения явлений гипоксии, ишемии, отека, воспаления при шоке, кровопотере, тромбо-эмболических поражениях, функциональных и органических нарушениях проходимости сосудов, повреждении тканей реализуется путем внутривенного введения в дозе 0,5-30 мл на 1 кг массы тела.
Способ применения эмульсии ПФОС для подавления вторичной альтерации при воспалении и раневом процессе, а также для ускорения заживления травматических, трофических и операционных ран реализуется путем внутривенного введения в дозах 0.3-6 мл на кг массы тела и/или местно порциями по 0,5-50 мл подкожно, внутримышечно, в глубину вокруг поврежденного участка или в окружающие воспаленные и травмированные ткани полости или биологические жидкости, в частности интраплеврально, интраперитонеально, интралюмбально, в общий лимфатический проток в дозе 1-100 мл, а также в качестве очищающей или аппликационной жидкости при обработке открытых раневых поверхностей.
Способ применения эмульсии ПФОС для улучшения системного и локального кровотока, регуляции системного артериального давления и перфузионного регионарного давления, облегчения и ускорения массообмена по газам, субстратам и метаболитам реализуется путем внутрисосудистого или местного введения в ткани, а также при перфузионной и бесперфузионной защите изолированных или отключенных от кровотока органов и тканей.
Снижение основного процесса разрушения эмульсий ПФОС, вызываемого молекулярной диффузией, достигают обычно путем введения во фторуглеродную основу компонента ПФОС с низкой упругостью пара (например, ПФМЦП или ПФТБА) и менее растворимого в воде, имеющего более высокую температуру кипения и замедляющего этот процесс. Однако это приводит к появлению неоднородностей во фторуглеродной фазе, уменьшающих стабильность эмульсий. С целью повышения стабильности эмульсий ПФОС в предлагаемом изобретении используются такие смеси ПФОС, которые существенным образом повышают однородность «масляной фазы» и способствуют формированию адсорбционного слоя из смеси СА методом насыщающей аффинной сепарации, когда происходит физическая самосборка и обогащение адсорбционного слоя частиц эмульсии наиболее подходящими для данной композиции ПФОС молекулами СА, содержащимися в неоднократно обновляемой в процессе приготовления эмульсии общей смеси СА.
Судя по диаграммам ТкрГ для ПФОС по патенту РФ № 2206319, между ними имеется зазор более чем в 10°С, что свидетельствует о наличии довольно значимых различий в физико-химических свойствах компонентов «масляного» ядра, а следовательно, оно не является физически однородным, что проявляется в кластеризации фторуглеродной фазы и в постоянном турбулентном перемещении кластеров внутри этой фазы. С целью повышения однородности фторуглеродной фазы в предлагаемом нами изобретении используются составы ПФОС, которые практически образуют почти непрерывный ряд значений ТкрГ и тем самым существенно повышают однородность «масляной» фазы, повышают стабильность эмульсий ПФОС. При этом несколько изменяются скорости выведения ПФОС из клеток РЭС и липидов: период полувыведения ПФД при введении его в составе предлагаемых смесей возрастает в среднем на 10-15%, то есть составляет не 12-13 дней (характерных для ПФД вне указанных смесей), а 14-15 дней, тогда как, напротив, первоначальная скорость выведения ПФТА и ПФДЭ возрастает на 10-15%, а следовательно и период полувыведения уменьшается на 5-7%.
Повышение однородности масляной фазы достигается на этапе отбора ПФОС. Как известно, получение индивидуальных ПФОС в индустриальных масштабах является наиболее дорогостоящим этапом процесса превращения органических соединений в ПФОС. Проведенные В.А.Архиповым и К.Н.Макаровым исследования показали, что токсичность ПФОС для клеток человека зависит лишь от примесей водородсодержащих и непредельных соединений, то есть от наличия неполностью фторированных веществ, даже если при этом остается всего лишь один атом водорода или одна непредельная связь. Примеры формул таких соединений, встречающихся в недостаточно очищенных от примесей ПФОС, приведены ниже в виде структурной схемы некоторых токсических примесей недофторированных молекул ПФОС и их радикалов.
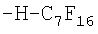
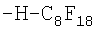
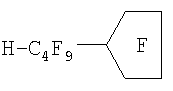
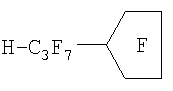

Самым важным моментом с точки зрения безопасности является то, что при вариации примесей полностью фторированных субстанций в ПФД не изменяется токсичность препарата, если в нем не было недофторированных ПФОС-смесь остается полностью безопасной для животных клеток (таблица 2).
Аналогичные исследования были выполнены и для других видов ПФОС, в частности для ПФТА и ПФЭ, и были получены такие же выводы. Отсюда возникло предложение не выделять индивидуальные соединения ПФД, ПФМЦП, ПФТПА, ПФТБА, ПФДЭ и их копродукты (близкие гомологи, изомеры и примеси), а получать эти ПФОС в окружении синтезируемых вместе с ними минорных примесей, изомеров и гомологов, близких по ТкрГ, но при этом жестко обеспечивать и контролировать освобождение получаемых субстанций от недофторированных примесей так, чтобы уровень недофторированных примесей не превышал 1 часть на миллионов (1 ррм). В такой ситуации резко возрастает и эффективность производства ПФОС по выходу полезного продукта, соответственно падает стоимость процесса получения ПФОС без ущерба для их биологической безопасности. Более того, близкие гомологи, изомеры и примеси (назовем их копродуктами) образуют вокруг основных компонентов расширенное поле по значениям ТкрГ, что позволяет сформировать более однородные по физико-химическим свойствам с заданной шириной поля ТкрГ композиции ПФОС. При этом возрастает стабильность эмульсий (табл.3).
Для примера в таблице 3 показано сравнение вклада уменьшения величины ΔТкрГ в стабильность эмульсий ПФОС с вкладом уменьшения упругости пара ПФОС. В том случае, когда использовалась смесь ПФТБА и ПФД, стабильность эмульсии ПФОС достигается за счет в 10 раз меньшей упругости пара ПФТБА (по сравнению с ПФД), поскольку ПФТБА сам диффундирует слабо и препятствует диффузии ПФД (пример 4, табл.3), несмотря на большую величину ΔТкрГ. Если в этой ситуации уменьшить величину ΔТкрГ путем добавления других ПФТА, имеющих примеси копродуктов (согласно заявляемому изобретению) то, несмотря на проигрыш в упругости пара (котрая в несколько раз выше у ПФМЦП и ПФТПА, чем у ПФТБА) происходит дополнительное повышение стабильности эмульсий ПФОС (пример 5, табл.3). В примере 5, несмотря на замену части ПФТБА на ПФТА с более высокой упругостью пара, вместо ожидаемого уменьшения стабильности эмульсий наблюдалось значимое увеличение стабильности новой композиции благодаря уменьшению величины ΔТкрГ внутри ядра ПФОС.
На фиг.1 изображены диаграммы критических температур растворения различных ПФОС в гексане.
Использование таких ПФОС с расширенными границами ТкрГ привело к неожиданному биологическому эффекту: изменилась скорость выведения индивидуальных компонентов из клеток РЭС. Так, если индивидуальный ПФД имел Т/2, равную 12-13 дней, то в присутствии ПФМЦП и ПФТБА эта величина для ПФД удлинялась до 14-15 дней. Напротив, если индивидуальный ПФМЦП выводился с Т/2 порядка 90 дней, то в присутствии ПФД величина Т/2 для ПФМЦП уменьшалась до 80 дней, что позволяет понять ранее полученные данные для вариаций Т/2 для ПФМЦП, приведенные раньше в научной литературе без учета того, что данные получались в случае с Т/2, равным 90 дням для индивидуальной субстанции, а Т/2 порядка 65 дней (по нашим данным это резко заниженная оценка) было получено для смеси ПФД/ПФМЦП при соотношении компонентов 2:1.
Сравнивали дисперсности и стабильности эмульсий ПФОС, полученных по предыдущим патентам (пример 1 по патенту РФ № 2070033), по прототипу (пример 2 по патенту РФ № 2206319) с эмульсиями ПФОС, полученными по заявленному изобретению (группы 3, 5 - таблицы 3). Стабильность проверяли при хранении, замораживании-оттаивании и при смешивании с растворами декстрана (полиглюкин) со средней молекулярной массой 60000 Да. Результаты приведены в таблице 3.
P1<0,05
P1<0.01
P1<0.01
P1<0.05
P1<0,05
P1<0.01
Р<0.01 Р2<0.05
P1<0.01
P1<0.05
P1<0,05
P1<0,05
P1<0.01 P2<0.05
P1,2<0.01 Р3,4<0.05
Pi показывает уровень достоверности отличий при сравнении с соответствующей номеру индекса группой при (n=9-10).
Соответствие вида стабилизирующего агента (СА) композиции ПФОС играет ключевую роль в диспергировании ПФОС, поддержании стабильности и биологической активности эмульсий ПФОС.
Для получения эмульсий ПФОС используются главным образом два вида СА:
1) неионогенный блок-сополимер полиоксиэтилена (ПОЭ) с полиоксипропиленом (ПОП) в виде Проксанол-268 или его аналога Pluronic F-68, а также фосфолипиды (ФЛ), выделенные из яичного желтка или сои и т.п.
У проксанола 268 центрально расположенная гидрофобная ПОП цепь соединяется своими концами с двумя ПОЭ цепями. Согласно принятой номенклатуре названий блок-сополимеров, цифра 8 в названии проксанола 268, соответствует тому, что средняя суммарная масса ПОЭ блоков в молекуле составляет 80%, а цифра 26 обозначает, что средняя ММ ПОП, составляющего в среднем 20% от массы молекулы проксанола, равна 2600 Да. Таким образом, средняя ММ блок-сополимера проксанол 268 в целом составляет 13000 Да, при соотношении блоков ПЭО и ПОП в среднем 80% и 20% соответственно. Напомним, что при синтезе блок-сополимера, как и при синтезе всякого полимера, получаются далеко не одинаковые по ММ и по соотношению отдельных блоков молекулы. Поэтому их характеризуют средней ММ, наличием варьирующего даже в одной партии молекулярно-массового распределения и средним соотношением ПОП и ПОЭ блоков.
Проксанол взаимодействует гидрофобной частью, то есть посредством ПОП с ПФОС, а с водой - гидрофильной частью - ПОЭ блоком. Стабилизирующее действие проксанола и Pluronic обусловлено стерическим эффектом защитной пленки, образуемой молекулами СА вокруг частиц ПФОС. При этом наряду с СА, связанным в адсорбционном слое, значительная часть (до 50%) молекул СА образует в водной фазе разнообразные мицеллярные структуры, свободные от ПФОС. Между молекулами СА, находящимися в адсорбционном слое частиц эмульсии и в водной фазе в мицеллах, устанавливается динамическое равновесие, необходимое для стабилизации адсорбционного слоя, с одной стороны, а с другой, нарушающее плотность упаковки молекул СА в адсорбционном слое при длительном хранении. Вследствие различий в составах СА, связанного в адсорбционном слое частиц ПФОС, и свободного мицеллярного СА замещение в результате обмена молекул адсорбционного слоя на молекулы из мицелл водной фазы неблагоприятно для поддержания стабильности адсорбционного слоя. При наличии резких различий достижение эффективного (поддерживающего стационарные уровень и вид СА в адсорбционном слое частиц) динамического равновесия между молекулами СА в частицах и в водной фазе практически недостижимо.
Заметим, что при использовании в качестве стабилизатора эмульсии ПФОС природных ФЛ также возникают проблемы неоднородности используемой субстанции как по составу, так и по качеству (наличие полярных компонентов, свободных жирных кислот, лизоформ).
При выборе и определении качества взятых в качестве СА блок-сополимеров мы исходили из оценки двух критериев: стабильности эмульсий ПФОС и степени повреждения биологических мембран. Оказалось, что проксанол 268 обеспечивает при одной и той же композиции выбранных нами ПФОС существенно большую стабильность эмульсий, чем проксанол 168, очевидно, благодаря более выраженным детергентным (амфифильным) свойствам у проксанола 268: в среднем эмульсия из смеси ПФД с ПФМЦП с копродуктами обоих компонентов, взятых в соотношении 2:1, стабилизированная с помощью проксанола 268 без замораживания хранилась дольше, чем в случае использования проксанола 168: средний период удвоения среднего размера частиц (при 0,07 мкм в исходной эмульсии) составил 45±4 дней с проксанолом 268 и только 30±3 дней с проксанолом 168 (р<0.02). Однако проксанол 168 не повреждает биологические мембраны в силу слабых детергентных свойств, в частности не вызывает разобщения реакций окислительного фосфорилирования при добавлении к изолированным митохондриям, падения трансмембранного электрохимического потенциала ионов водорода на внутренней мембране и подавление фосфорилирующего дыхания митохондрий печени. Напротив, проксанол 268 вызывает заметное снижение параметров как окислительного фосфорилирования при добавлении к изолированным митохондриям и падения скорости фосфорилирующего дыхания - свидетельство повреждения мембраны. Еще более выражена повреждающая активность в отношении биологических мембран у Pluronic F68, несмотря на то, что формально это должен быть просто аналог проксанола 268.
На фиг.2 приведено влияние различных добавок (по 50 мкл) к митохондриям печени крысы на сохранность фосфорилирующего дыхания при окислении сукцината (5 мМ). Добавки: недофторированный ПДФ (Н-ПФД), очищенный от недофторированных примесей ПДФ с копродуктами (ПДФ) и 4% водные растворы Pluronic F68 (Pl F68), проксанола 268 (Пр 268) и проксанола 168 (Пр 168). Среда инкубации 250 мМ сазарозы, 3 мМ KH2PO4 (рН 7.4), 1 мМ MgCl2, 15 мМ KCl, 200 мкм ADP. Концентрация MX 3 мг белка на мл. Объем ячейки 2 мл. Температура инкубации 26°С.
Поскольку при синтезе проксанолов соотношение блоков ПОЭ и ПОП лишь в среднем составляет 80:20, а в промышленных партиях сырья это отношение может отличаться в ту или иную сторону, мы провели исследование, в котором определили влияние вариаций этого отношения на стабильность эмульсий и повреждение биологических мембран. Оказалось, что увеличение доли ПОП выше 18% абсолютно необходимо для получения более стабильных эмульсий, уменьшение доли ПОП ниже 18% снижает время сохранения эмульсий с проксанолом 268 на треть, а спосанолом 168 в 2 раза. Повышение доли ПОП блока выше 22% недопустимо вследствие усиления повреждения биологических мембран, и тогда оба проксанола приближаются по своим повреждающим свойствам к Pluronic F68. Таким образом, был определен диапазон допустимых вариаций в выбранных видах проксанола. Для того чтобы сочетать достаточно высокую стабильность эмульсий с уменьшенной повреждающей способность в отношении биологических объектов, представленных мембранными структурами на большинстве уровней организации организма, мы использовали смесь проксанолов 268 и 168. При этом выяснилось, что эмульсии, содержащие ПФТБА наряду с ПФД и другими ПФОС можно стабилизировать без существенной потери в стабильности с увеличением доли проксанола 168, и эти эмульсии имеют пониженную повреждающую способностью относительно биологических объектов, таких как изолированные перфузируемые органы: сердце и почка, по сравнению с эмульсиями с высоким содержанием проксанола 268. Но эти эмульсии едва ли можно вводить в организм, так как ПФТБА имеет слишком большой период задержки в клетках РЭС (Т/2 составляет 900 дней). Для эмульсии ПФОС, содержащих более липофильные, чем ПФТБА компоненты, более приемлем в качества СА проксанол 268, однако при этом, как указывалось, повышается повреждение биологических мембран. В конечном счете, мы пришли к заключению, что для каждой композиции ПФОС следует подбирать свою смесь проксанолов 168 и 268, что весьма трудоемко, так как требует каждый раз проведения дополнительных испытаний по подбору смеси проксанолов. Выход из этого затруднения достигается путем использования процедуры самосборки, основанной на использовании физико-химического сродства между взятой композицией ПФОС и смесью проксанолов 168 и 268. В процессе повторяющейся самосборки происходит последовательное насыщение адсорбционного слоя частиц дисперсии ПФОС тем составом СА, который имеет наибольшее сродство к взятой композиции ПФОС, важно лишь ускорить процесс насыщения, что достигается подъемом температуры в смесителе до 50-60°С (в зависимости от взятой смеси проксанолов и ее температуры помутнения), а также повторностью процедуры с обновлением водной фазы СА, не прореагировавшего с частицами дисперсии ПФОС.
Итак, для повышения стабильности эмульсии при хранении в заявляемом изобретении применяется способ насыщающей аффинной сепарации (НАС), позволяющий оптимизировать состав адсорбционного слоя частиц эмульсии в соответствии с составом композиции ПФОС - «масляного» ядра частиц и уменьшить различия между СА, находящимся в адсорбционном слое частиц эмульсии, и мицеллярным СА водной фазы. НАС производится несколькими последовательными сеансами, включающими механическое перемешивание взятой для диспергирования композиции ПФОС в объеме 10-30 частей с 90-70 частями раствора 20-30% СА, представляющего смесь проксанола 168 (средняя ММ порядка 8000 Да) и проксанола 268 (средняя ММ порядка 13000 Да). Неоднородная смесь, имеющая два слоя жидкостей: тяжелый нижний слой жидких ПФОС и верхний слой - мицеллярный раствор СА, перемешивается на высокоскоростной мешалке при скорости вращения ротора 1-3 тыс. об/мин с погружением вращающейся лопасти, турбины или пестика магнитной мешалки в плотную фазу ПФОС с последующей экструзией грубой дисперсии с помощью гомогенизатора под давлением 100-300 кг/см2 при поддуве в гомогенизатор газа, не содержащего кислорода. Полученная грубая дисперсия ПФОС осаждается под действием сил тяжести или центрифугированием. Затем на делительной воронке и/или с помощью центробежного сепаратора отделяется собственно дисперсия ПФОС от водного раствора мицеллярного не связавшегося с ПФОС состава СА, который в дальнейшем отбрасывается. Отделенная грубая дисперсия ПФОС смешивается со свежей порцией водного раствора СА из такого расчета, чтобы объемная доля ПФОС вновь составляла 10-30%. Процедура диспергирования и отделения дисперсии ПФОС от водного раствора СА повторяется вновь 1-3 раза. Полученную предэмульсию пропускают многократно через гомогенизатор при давления 300-700 кг/см2 до получения среднего размера частиц эмульсии в диапазоне от 0,05 до 0,1 мкм при выходе эмульсии по размеру частиц на плато.
Таким образом, в процессе получения эмульсии именно ПФОС вследствие физико-химического сродства сами отбирают из раствора смеси сополимеров ПОЭ-ПОП те молекулы СА, которые имеют к ним наибольшее сродство. Повторная замена отработанного раствора СА свежим раствором позволяет не только оптимизировать состав адсорбционного слоя, но и минимизировать отличия между составами СА в адсорбционном слое и в мицеллярной водной части эмульсии. Благодаря этому достигается дополнительная по сравнению с прототипом стабилизация адсорбционного слоя и повышение стабильности эмульсии ПФОС в целом (табл.3 и 4).
Полученную субмикронную эмульсию ПФОС сразу же смешивают с водно-солевым раствором, наличие в котором ионов солей способствует образованию относительного отрицательного заряда на радикалах молекул блок-сополимера, обращенных в водную фазу, тем самым обеспечивает дополнительную стабилизацию адсорбционного слоя, так как при этом образуется своеобразный двойной электрический слой из диполей молекул воды у поверхности частиц эмульсии ПФОС. В результате дополнительно замедляется диффузия молекул неполярных ПФОС через заряженный адсорбционный слой и тем самым уменьшается молекулярная перегонка «масляной» фазы из мелких частиц в более крупные (Оствальдово созревание эмульсий), а также появляются дополнительные электростатические силы отталкивания частиц друг от друга (электрический «распор»), что препятствует слипанию частиц эмульсии.
Влияние процедуры НАС при использовании смеси проксанола 168 с проксанола 268 в различных рецептурах ПФОС на время (сутки) удвоения среднего размера частиц при исходном размере частиц 0,06±0,01 мкм иллюстрирует таблица 4.
р - указано при сравнении с прототипом.
В заявляемом изобретении водно-солевой раствор содержит в 1,5-2 раза повышенные концентрации солей, по сравнению с прототипом, для того чтобы после смешивания субмикронной эмульсии с водно-солевым раствором, когда конечная концентрация ПФОС уменьшается до 4-12 об.%, водная часть эмульсии была изоосмотична внеклеточной жидкости, в частности плазме крови и лимфе, и содержала ионы натрия, калия, бикарбоната, хлора, фосфата и магния, а также необходимые для поддержания энергетического и пластического обмена субстраты. В лекарственной форме используются соли NaCl, KCl, MgCl2, NaHCO3, NaH2PO4, Na2HPO4, D-глюкоза, карбоновые кислоты и аминокислоты. Водно-солевой раствор обеспечивает поддержание осмотического давления на уровне 270-330 мОсм в конечной лекарственной форме, соотношение ионов Na и К на уровне от 10:1 до 30:1 и величину рН в диапазоне от 6,9 до 8,0. При этом водно-солевая часть готовой конечной лекарственной формы содержит 110-150 мМ NaCl, 4-5 мМ KCl, 1-3 мМ MgCl2, 6-20 мМ NaHCO3, 1-2 мМ NaH2PO4, 1-2 мМ Na2HPO4 и 10-15 мМ D-глюкозы и может дополняться субстратами, выполняющими одновременно противоишемическую протекторную роль, в частности солями три-, ди- и монокарбоновых кислот, в том числе 1-7 мМ цитрата натрия, 1-7 мМ изоцитрата натрия, 1-7 мМ сукцината натрия, 1-7 мМ β-оксибутирата натрия; а также способными превращаться в сукцинат при гипоксии и ишемии - 1-7 мМ α-кетоглутарат натрия, 1-7 мМ пируват натрия, 1-7 мМ малат натрия, 1-7 мМ глутамат натрия, 1-7 мМ аспартат натрия.
Процедура получения эмульсии ПФОС после осуществления НАС завершается гомогенизацией под высоким давлением, которая может приводить к повреждению, разрушению и перекисному окислению молекул стабилизирующего агента. Поэтому необходимо предпринимать меры защиты от «окислительного стресса». Это достигается тем, что процесс подготовки компонентов и диспергирования - НАС и гомогенизацию проводят в бескислородной среде.
Предложенный способ позволяет за счет обновления раствора СА отобрать из смеси СА, имеющих широкое молекулярно-массовое распределение и вариации в соотношении полиоксиэтиленового и полиоксипропиленового блоков, молекулы СА, которые имеют наибольшее сродство используемой композицией ПФОС, независимо от вариаций состава смеси ПФОС и СА, что повышает стабильность, химическую однородность и калиброванность получаемых эмульсий ПФОС, а также уменьшает вероятность появления перекисей СА и тем самым повышает безопасность эмульсий. Полученная предложенным способом эмульсия ПФОС более стабильная при хранении и при попадании в кровоток, а также имеет вязкость, близкую к вязкости крови, благодаря чему обеспечивается поддержание сдвиговых напряжений в пристеночном кровотоке и нормализация тонуса кровеносных сосудов, что необходимо для улучшения массобмена между внутрисосудистой жидкостью и тканями как по кислороду и углекислому газу, так и по субстратам и метаболитам. Предлагается использовать эмульсию ПФОС в качестве средства для внутрисосудистого и внутритканевого введения с целью лечения системных и локальных нарушений кровотока, гипоксических и ишемических состояний, улучшения массообмена газов и метаболитов между кровью и тканями, поддержания функции изолированных органов и тканей, уменьшения явлений воспаления, проведения инфузионно-трансфузионной терапии при шоке и кровопотере, а также для гидрофобной противоишемической модификации мембран и поддержания микрокатализа, протекающего в гидрофобной фазе и на границе раздела фаз.
Так же, как и прототип, полученная готовая лекарственная форма хранится в замороженном состоянии для замедления молекулярной перегонки, стабилизации адсорбционного слоя и предотвращения слипания частиц. После размораживания, несмотря на сохранение размера частиц в течении 2- 3 недель, рекомендуется в случае внутрисосудистого введения использовать размороженный препарат, хранящийся при 2-4 С в течение 2-3 суток. При внутритканевом или внутриполостном введении размороженный препарат может использоваться в течение 2-3 недель.
Более конкретные примеры в части состава эмульсии и реализации способа ее изготовления, а также способа применения даны ниже.
Пример 1
Эмульсия состоит из смеси ПФД (быстровыводящегося ПФОС), содержащей наряду с ПФД все полностью фторированные примеси, которые сопутствуют основное вещество при синтезе, и смеси медленно выводящегося ПФОС-ПФТА или ПФЭ, например ПФМЦП (№1 общее соотношение компонентов 2 части ПФД:1 часть ПФМЦП) или смесь ПФМЦП и ПФТПА (№2 общее соотношение компонентов 2:0.5:0,5), или смесь ПФМЦП, ПФТПА и ПФДЭ (№3 общее соотношение компонентов 1:1:0.5), или смесь ПФМЦП и ПФДЭ (№4 общее соотношение компонентов 1:1:1), или ПФМЦП и ПФТБА (№5 общее соотношение компонентов 1:1:2), содержащей наряду с основным ПФТА и ПФЭ все полностью фторированные примеси, сопутствующие основному веществу при синтезе. Приготовленные смеси ПФОС после стерилизации и апирогенизации смешивают с СА, представляющим смесь сополимеров проксанола 268 и проксанола 168, взятых в разных соотношениях, в частности для композиции №1 в соотношении 5:1, для №2 -5:2, для №3 - 2:1, для №4 - 1:1, для №5 - 1:2. Получение дисперсии осуществляется методом НАС с 4 повторами процедуры НАС и с последующей экструзией при давлении 400 кг на см2 - 6 циклов, затем 3 цикла при 700 кг на см2 и затем 2 цикла при 500 кг на см2. Получаются эмульсии со средним размером частиц от 0.6 до 0.8 мкм.
Пример 2
Описанная в примере 1 эмульсия ПФОС содержит одну части смеси ПФД (быстровыводящихся ПФОС) и две части смеси 1 медленно выводящихся ПФОС №1, или №2, или №3, или №4 или №5, стабилизированных смесью сополимеров проксанола 268 и проксанола 168, взятых в разных соотношениях, в частности для композиции №1 в соотношении 1:1, для №2 - 1:2, для №3 - 1:4, для №4 1:6, для №5 - 1:10. Получение дисперсии осуществляется методом НАС. Получение дисперсии осуществляется методом НАС с 2 повторами процедуры НАС, включающими экструзию под давлением 100 кг на см2 и затем 200 кг на см с последующей экструзией продукта НАС при давлении по 400 кг на см2 - 3 цикла, затем 2 цикла при по 600 кг на см2 и затем 2 цикла при 500 кг на см2. Получаются эмульсии со средним размером частиц от 0.50 до 0.75 мкм. Величина LD50 таких эмульсий достигает 165-200 мл на кг массы тела мыши при внутрибрюшинном введении.
Пример 3
Описанные в примере 1 или 2 эмульсии содержат компоненты ПФОС, имеющие период полувыведении из клеток РЭС животных от 12 до 900 дней после внутривенного введения в дозе по 30 мл на кг массы тела. При этом дапазон ΔТкрГ для компонентов ядра ПФОС в эмульсиях по примерам 1 и 2 составляет для №1 менее 2°С в диапазоне от 22°С до 41°С и период полувыведения порядка 85 дней, для №2 ΔТкрГ не превышает 3°С в диапазоне от 22°С до 47°С и период полувыведения порядка 74 дней, для №3 и №4 ΔТкрГ не превышает 4°С в диапазоне от 22°С до 56°С и период полувыведения порядка 450 дней, для №5 максимальная величина ΔТкрГ составляет 4°С в диапазоне от 22°С до 60°С и период полувыведения порядка 850 дней.
Пример 4
Описанная в примере 1 эмульсия содержит быстровыводящиеся ПФОС и медленно выводящиеся ПФОС в соотношении 5:1 (образец А) или в соотношении 1:5 (образец Б) и стабилизирующий агент, в котором для образца А имеет соотношение ПОЭ к ПОП 78:22 и для образца Б - 82:18. Средний размер частиц в эмульсиях 0.08 мкм, длительность перфузии изолированного сердца крысы по Лангедорфу с использованием в качестве субстрата 11 мМ глюкозы составляет без потери исходной спонтанной частоты (на уровне 250 сокращений в мин) для образца А (с высоким содержанием ПОП блока в СА) 3 часа, а для образца Б (с пониженным содержанием ПОП) - 9 часов. Вывод: для сохранения изолированного сердца предпочтительнее эмульсия, в которой в качестве стабилизирукющего агента используется смесь проксанолов с пониженным содержанием ПОП блока до уровня 18%.
Пример 5
При разведении эмульсии ПФОС по примерам 1,2,3,4 водно-солевым раствором содержание ПФОС составляло 4, 10 или 12 об.% в зависимости от количества добавленного водно-солевого раствора, при этом содержание стабилизирующего агента в водной фазе составляло соответственно 1%. 4% и 5%, а вязкость готового препарата на основе эмульсии ПФОС достигала 1,5 сПуаз, 2,6 сПуаз и 5 сПуаз соответственно. При замещении крысе 30% объема циркулирующей (ОЦК) крови этими эмульсиями у ненаркотизированных крыс Wistar (масса животных 290-320 г) с вживленными телеметрическими датчиками наблюдалась следующая динамика среднего артериального давления (таблица 5).
АД* указаны средние величины по 3 животным.
Как видно из представленных в таблице данных, увеличение объемного содержания ПФОС и вязкости эмульсии способствует более долгому удержанию АД после кровезамещения.
Пример 6
Готовый препарат на основе эмульсии ПФОС по примерам 1-5 содержит 110 мМ NaCl, 5 мМ KCl, 2 мМ MgCl2 8 мМ NaHCO3, 2 мМ NaH2PO4, 1 мМ Na2HPO4 и 20 мМ D-глюкозы при содержании 12 объемных % ПФОС. При массивном кровеземещении 55% объема циркулирующей крови у собак эмульсией №1 (5 животных) и №2 (6 животных) по примеру 1 все собаки выживают, несмотря на существенное различие в величинах сдвига буферных оснований вплоть до дефицита - 12, и росте отношения лактат/пируват в крови до 20.
Пример 7
Готовый препарат на основе эмульсии ПФОС по примерам 1-5 содержит 120 мМ NaCl, 5 мМ KCl, 1 мМ MgCl2 6 мМ NaHCO3, 1,2 мМ NaH2PO4, 1 мМ Na2HPO4 и 10 мМ D-глюкозы при содержании 4 объемных % ПФОС. Эмульсии с низким содержанием ПФОС вводили крысам внутривенно и проверяли их влияние в дозе 1-2 мл на регионарный кровоток. Показано, что, несмотря на малые дозы вводимого ПФОС, такие дозы эмульсии достаточны для активации кровотока в случае наличия отека или травмы у животных (см. подробно пример 16). Приращение кровотока, определяемое лазерным допплерометром, составляет в среднем от 30% до 90% в зависимости от степени исходного нарушения кровотока.
Пример 8
Готовый препарат на основе эмульсии ПФОС по примерам 1-5 содержит 120 мМ NaCl, 5 мМ KCl, 3 мМ MgCl2 6 мМ NaHCO3, 1,2 мМ NaH2PO4, 1 мМ Na2HPO4 и 20 мМ D-глюкозы, 1 мМ цитрата натрия, 1 мМ изоцитрата натрия, 1 мМ сукцината натрия, 1 мМ α-кетоглутарата натрия, 1 мМ пирувата натрия, 1 мМ β-оксибутирата натрия, 1 мМ глутамата натрия, 1 мМ аспартата натрия при содержании 8 объемных % ПФОС. Полученную эмульсию использовали для сохранения перфузируемого по Лангендорфу сердца кролика на специальном перфузионном стенде: 3 сердца - группа сравнения (эмульсия по прототипу), 3 сердца - опыт (эмульсия №2 и №3 по примеру 1 с солевой и субстратной композицией, полученной по данному примеру), 3 сердца - контроль с водно-солевым раствором с композицией солей и субстратов, как в данном примере. Время сохранения исходной частоты сердцебиений без стимуляции в контрольной группе - 1,5-2 часа, в группе сравнения (по прототипу) - 4-5 часа; в опытной группе по заявляемому изобретению - 6-7 часов.
Пример 9
Готовый препарат на основе эмульсии ПФОС по примерам 1-5 содержит 150 мМ NaCl, 15 мМ KCl, 3 мМ MgCl2 12 мМ NaHCO3, 1,2 мМ NaH2PO4 1 мМ Na2HPO4 и 20 мМ D-глюкозы, 7 мМ цитрата натрия, 7 мМ изоцитрата натрия, 7 мМ сукцината натрия, 7 мМ α-кетоглутарата натрия, 7 мМ пирувата натрия, 7 мМ β-оксибутирата натрия, 7 мМ глутамата натрия, 7 мМ аспартата натрия при содержании 4 объемных % ПФОС. Использовали для кардиоплегии изолированного сердца крысы при температуре 18-20°С. Показано, что в отличие от обычной водно-солевой и фармакохолодовой кардиоплегии, когда через час после остановки сердца электрическая и сократительная способности восстанавливаются не более чем в 50% случаев и величина восстановления сократительной активности не превышает 75-80% (10 животных), при использовании эмульсий ПФОС состава №4 и №5 из примера 1 с указанной субстратно-солевой композицией электрическая и сократительная способности восстанавливаются более чем в 70% случаев и величина восстановления сократительной активности не ниже 90% (10 животных, р<0.02)
Пример 10
Полученную эмульсию №4 по примеру 1 с субстратно-солевой композицией по примеру 8 использовали как перфузионный состав и по примеру 9 использовали как кардиоплегический состав на изолированном сердце кролика в следующем режиме: нормотермическая перфузия с эмульсией по примеру 8 в течение 30 минут при температуре 37°С (процедура перфузионного сохранения), затем смена перфузата на эмульсию кардиоплегического состава с субстратно-солевой композицией по примеру 9 и перфузия при 20°С до остановки сердца (процедура кардиоплегии), затем на 1 час сердце отключалось от кровотока и помещалось в ванночку с эмульсией кардиоплегического состава, через час сердце вновь перфузировали эмульсией с субстратно-солевой композицией по примеру 8. В группе сравнения использовали эмульсию по прототипу в качестве перфузионного состава и кардиоплегического состава с полной субстратно-солевой композицией по прототипу, дополняя в последнем случае концентрацию ионов калия до 15 мМ. Измеряли величину исходного диастолического и систолического давления, степень восстановления пульсового давления и уровень АТФ и креатинфосфата в ткани сердца через 30 минут после восстановительной перфузии при 37°С. В опыте и в группе сравнения по 5 экспериментов. Оказалось, что в группе сравнения (прототип) диастолическое давление выше на 20% (свидетельство остаточной контрактуры), а систолическое давление на 10% ниже (свидетельство меньшего восстановления сократительной способности миокарда), соответственно величина пульсового давления ниже в среднем на 30±10% (р<0.05), чем в группе с заявляемой рецептурой эмульсий ПФОС. Суммарное содержание адениловых нуклеотидов упало в опытной группе (заявляемая рецептура) на 30±5%, а в группе сравнения (по прототипу) на 40±6% (различия недостоверные), при этом в группе сравнения (прототип) отношение АТФ/АМФ=4.2±0.5, тогда как в группе с заявляемой композицией отношение АТФ/АМФ=6.5±0.7 (р<0.05), соответственно в группе с заявленными композициями эмульсии ПФОС выше концентрация креатинфосфата в ткани сердца на 25±7% (р<0.02). Таким образом, заявленная композиция улучшает на 30% восстановление сократительной функции сердца после кардиоплегической остановки и способсвтует сохранению энергетического статуса ткани судя по отношению АТФ/АМФ и по уровню креатинфосфата.
Пример 11 (способ получения эмульсии ПФОС и готового препарата). В стерилизованный термостатируемый реактор (1) объемом 20 л с поддувом азота во время заполнения реактора и с встроенной мешалкой заливают при легком перемешивании (200-300 об/мин) 11 л водного стерильного апирогенного раствора поверхностно-активных веществ (СА), содержащего 10% проксанола 168 и 20% проксанола 268 (общая концентрация СА составляет 30%) и 4 л очищенной от недофторированных примесей стерилизованной апирогенной смеси ПФОС, содержащей 2 л перфтордекалина (ПФД) с присущим ему при получении набором перфторорганических примесей, 1,5 л перфтор-N-(4-метилциклогексил)-пиперидина с присущим ему при получении набором перфторорганических примесей и 0,5 л смеси перфторированных третичных аминов, содержащих в качестве основных веществ до 40% перфтор-1-пропил-3,4-диметилпирролидина, до 16% перфтор-1-пропил-3-метипиперидина, до 40% перфтортрипропиламина с присущими им при получении набором перфторорганических примесей. Далее осуществляется процедура НАС. Залитую смесь ПФОС и стабилизирующего агента интенсивно перемешивают со скоростью мешалки порядка 1000 оборотов в минуту, нагревают до температуры 50°С, продолжают перемешивание в течение 10 минут. Затем мешалку останавливают и дают отстояться - осесть на дно грубой дисперсии ПФОС. Надосадочную жидкость в объеме 9 л выкачивают из реактора и добавляют 9 л свежего раствора исходной смеси СА. Вновь включают мешалку со скоростью до 2000 об/минуту и нагревают содержимое реактора до 50°С, продолжают перемешивание в течение 10 минут. Затем мешалку вновь останавливают, дают осесть на дно грубой дисперсии ПФОС. Надосадочную жидкость в объеме 6 л выкачивают из реактора и добавляют 6 л свежего раствора исходной смеси СА. Вновь повторяют цикл интенсивного перемешивания с нагреванием в течение 10 мин и полученную дисперсию направляют в приемную емкость гомогенизатора высокого давления (2), в котором проводят экструзию, под давлением в диапазоне 100-200 кг/см2, поддерживая температуру в области клапана экструзера не выше 60°С. Полученную по выходе из гомогенизатора эмульсию отделяют в центробежном сепараторе (3) от раствора СА, не связанного с частицами ПФОС. Надосадочную жидкость сливают, а эмульсионный концентрат вновь заливают в термостатируемый реактор 1 и затем доводят объем жидкой фазы в реакторе до 15 л свежим раствором исходного раствора СА (объем добавляемого раствора порядка 4 л). Полученную смесь предэмульсии и раствора СА интенсивно перемешивают при скорости мешалки 3000 об/мин при температуре 50°С и подают в рециркуляторный контур гомогенизатора, в котором проводят экструзию под давлением 400-600 кг/см2, поддерживая температуру в области клапана экструзера не выше 60°С. Эмульсия пропускается через экструзер не менее 6 раз под контролем светопропускания до выхода его на плато. После выхода светопропускания на плато эмульсия проходит еще один цикл гомогенизации под давлением 400 кг/см2 и температуре экструзера не выше 50°С. Полученная субмикронная эмульсия сливается в стерильный термостатируемый реактор (сборную емкость 4) с мешалкой, одновременно 1 мл субмикронной эмульсии берется для оперативного контроля (5-7 мин) с помощью лазерного наносайзера (тип N5, фирма Berlin Coulter) и для определения объема фторуглеродной фазы с помощью гематокритной центрифуги. В случае, если средний размер частиц превышает 100 нм, эмульсию из реактора 4 вновь подвергают 3-4 циклам экструзии до тех пор, пока средний размер частиц в свежеприготовленной субмикронной эмульсии не снизится до 60-80 нм. Затем субмикронную эмульсию заливают в сборную емкость 4 в объеме порядка 14 л. В 14 л субмикронной эмульсии содержится порядка 26,6 объемных процентов фторуглеродной фазы. К полученной субмикронной эмульсии добавляют при слабом перемешивании (100 оборотов минуту) 23,24 л стерильного апирогенного концентрата водно-солевой композиции так, чтобы после получения окончательной лекарственной формы в водной фазе препарата содержалось 110 мМ NaCl, 5 мМ KCl, 1 мМ MgCl2, 6 мМ NaHO3, 1,2 мМ NaH2PO4, 1 мМ Na2HPO4 и 10 мМ D-глюкозы. Полученный препарат разливается с помощью автомата под давлением через фильтр с размером пор 0.4 мкм в тангенциальном потоке в стерилизованные флаконы, укупоривают резиновыми пробками с колпачками под обкатку и оставляют на 6-8 часов при температуре 2÷4°С. После измерения среднего размера частиц (64 нм) и их распределения (см. фиг.2), содержания ПФОС (10 об%), пирогенности (суммарная Δ<0,6°С у трех кроликов за 3 часа) и осмотичности (300 мОсм) флаконы маркируют и помещают в морозильную камеру на хранение при минусовой температуре -17-20°С. Величина LD50 для полученных по данному примеру эмульсии ПФОС составила 165-170 мл на кг массы тела мыши. В таких же условиях введения эмульсия, полученная по прототипу, имела величину LD50 140-150 мл на кг массы тела мыши. После внутривенного введения кроликам полученной по данному примеру эмульсии ПФОС в дозе 20 мл на кг, в том числе при 2-3-кратном повторном введении с интервалом в 2 недели, все кролики выжили в течение 4 месяцев наблюдений.
Пример 12
Способ по примеру 11, характеризующийся тем, что исходно смесь ПФОС, содержащая 2 части смеси ПФД, 0.8 частей смеси ПФТБА и 0,2 части смеси ПФМЦП, после смешивания промывают апирогенным водно-спиртовым раствором (ВСР): смешивают смесь ПФОС и ВСР в равных объемах, встряхивают в течение 5 минут и затем отделяют фазу ВСР. Оставшуюся смесь ПФОС промывают апирогенной водой: смешивают смесь ПФОС и воды в равных объемах, встряхивают в течение 5 минут и затем отделяют водную фазу. Затем повторяют промывание апирогенной водой еще раз. Отмытую смесь ПФОС фильтруют через фильтр с размером пор 0,4 мкм под давлением азота, не содержащего кислород, и разливают по стеклянным флаконам. В каждый флакон наливают ПФОС не более 2/3 общего объема флакона. Флаконы укупоривают резиновыми пробками под обкатку и осуществляют стерилизующее автоклавирование при 120°С. Стабилизирующий агент для данного состава смеси ПФОС готовят смешиванием 1 части проксанола 268 и 1 части проксанола 268 в виде 20% раствора в апирогенной воде. Полученный раствор СА пропускают через колонку с активированным гранулированным углем и затем через ацетатно-целлюлозный фильтр с размером пор 1-2 мкм по давлением азота, не содержащего кислород. С помощью турбидиметра определяют температуру помутнения полученного раствора стабилизирующего агента при нагревании от комнатной температуры со скоростью 1 градус в минуту. Зарегистрированная точка помутнения в данном случае составила 70°С. Эта температура используется для прогрева в реакторе для раствора проксанола, где точность удержания температуры составляет ±2°С. Раствор прогревают в течение 8 часов, затем медленно охлаждают до 18°С в течение 6 часов и проверяют степень прозрачности на нефелометре. Полностью остывший раствор должен иметь такое же светорассеивание, как и исходный раствор до прогревания. Затем осуществляют процедуру НАС, как описано в примере 10, при том, что полученная субмикронная эмульсия разделяется на две порции. Первая порция разводится водно-солевым составом, полученным согласно примеру 8 таким образом, что содержание ПФОС составляет 10 объемных % (препарат для перфузионнного сохранения органов). Вторая порция эмульсии разводится водно-солевым раствором по примеру 9 таким образом, что концентрация ПФОС составляет 4 объемных % (препарат для кардиоплегии - временного сохранения отключенного от кровотока сердца).
Полученный препарат на основе эмульсии ПФОС предназначен для лечения системных и локальных нарушений кровотока, гипоксических и ишемических состояний, улучшения массообмена газов и метаболитов между кровью и тканями, поддержания функции изолированных органов и тканей, уменьшения явлений воспаления, проведения инфузионно-трансфузионной терапии при шоке и кровопотере.
Применяется эмульсия ПФОС для уменьшения явлений гипоксии, ишемии, отека, воспаления при шоке, кровопотере, тромбо-эмболических поражениях, функциональных и органических нарушениях проходимости сосудов, повреждении тканей путем внутривенного введения в дозе 0,5-30 мл на 1 кг массы тела.
Применяется эмульсия ПФОС для подавления вторичной альтерации при воспалении и раневом процессе, а также для ускорения заживления травматических, трофических и операционных ран путем внутривенного введения в дозах 0.3-6 мл на кг массы тела и/или местно порциями по 0,5-50 мл подкожно, внутримышечно, в глубину вокруг поврежденного участка или в окружающие воспаленные и травмированные ткани полости или биологические жидкости, в частности интраплеврально, интраперитонеально, интралюмбально, в общий лимфатический проток в дозе 1-100 мл, а также в качестве очищающей или аппликационной жидкости при обработке открытых раневых поверхностей.
Применяется эмульсия ПФОС для улучшения системного и локального кровотока, регуляции системного артериального давления и перфузионного регионарного давления, облегчения и ускорения массообмена по газам, субстратам и метаболитам путем внутрисосудистого или местного введения в ткани, а также при перфузионной и бесперфузионной защите изолированных или отключенных от кровотока органов и тканей.
Пример 13 (способ использования эмульсии для перфузионного сохранения почек)
Эмульсии ПФОС составов №4 и №5 по примеру 1 (способ получения по примеру 11 и 12, соответственно) и эмульсию, полученную по прототипу, использовали в качестве перфузионных составов для сохранения изолированных почек собаки в рециркуляторном режиме при нормотермической перфузии со сменой перфузата каждые 10 часов. Эксперимент выполнен на 6 собаках в каждой группе, всего 18 собак весом от 10 до 22 кг. В качестве субстратов в эмульсии №4 использовались 10 мМ D-глюкоза, 1 мМ цитрат натрия, 1 мМ изоцитрата натрия, 1 мМ сукцината натрия, 1 мМ α-кетоглутарата натрия, 1 мМ пирувата натрия, 1 мМ β-оксибутирата натрия, 7 мМ глутамата натрия, 7 мМ аспартата натрия. Время сохранения почки до подъема перфузионного давления (до развития тканевого отека) составило 38±3 часов (эмульсия №4) и 40±3 часов (эмульсия №5), тогда как при использовании эмульсии ПФОС по прототипу составило 34±2 часа. В процессе перфузии эмульсию меняли каждые 9 часов. Проверка функционирования сохраняемых почек проходила в каждом случае путем подсадки перфузируемой почки в момент окончания перфузии (через 30 минут после начала экспоненциального прироста префузируемого давления) собаке-реципиенту (находящейся под ингаляционным наркозом с премедикацией промедолом и гамма-оксибутиратом натрия) к бедренной артерии и бедренной вене. Регистрировали восстановление кровотока, эластичность почки и восстановление диуреза. В опыте с прототипом восстановление кровотока и диуреза наблюдалось в 4 случаях из 6, с эмульсией №4 у 5 собак из 6, с эмульсией №5 у всех 6 собак трансплантат начал давать мочу сразу по восстановлении кровотока.
Пример 14.
Применение эмульсии ПФОС по примеру 12 для подавления воспаления путем внутривенного введения в дозах или местно порциями внутримышечно, в глубину вокруг поврежденного участка. Эксперимент выполнялся на 48-наркотизированных тиопенталом и оксибутиратом крысах-самцах линии Wistar, которым с помощью зубоврачебного бура наносилась калиброванная рана на мягкие и костные ткани бедра. Затем костная рана заполнялась костной крошкой, а мягкие ткани мышц, фасции и кожа ушивались стягивающими швами. В контрольной группе животным вводили физраствор в хвостовую вену в дозе 1, 5 мл на кг массы тела (группа 1), или внутримышечно по 0,3 мл выше и ниже нанесенной раны (группа 2), в группе 3 и 4 вводили эмульсию ПФОС соответственно в группе 3 - внутривенно, в группе 4 - внутримышечно. Во всех группах животных забивали на 3, 5 и 7 сутки по 4 животных в обозначенные сроки в каждой группе. Ткани бедра фиксировали в формалине и затем в канадском бальзаме, после чего подвергали патоморфологическому исследованию мягкие ткани и костную ткань. В контрольных группах (введение физ. раствора внутривенно и местно) на 3 сутки наблюдались выраженные явления лейкоцитарной инфильтрации, лейкоцитарные инфильтраты пронизывали толстыми слоями мягкие, в том числе окружающие исходно не поврежденные ткани, увеличивался очаг поражения за счет вторичной альтерации с огромным количеством остеокластов по периферии костной раны; лейкоцитарная инфильтрация уменьшалась существенно на 5 сутки, появлялись первые признаки регенерации соединительной ткани и уменьшалось количество остеокластов, появлялись первые остеобластные элементы; на 7 сутки сохранялись признаки лимфоидной и эпителиоидной инфильтрации, увеличивалось количество остеобластов и элементы проколлагенового каркаса соединительной ткани. В группе 3 с внутривенным введением эмульсии уже на 3 сутки слабо выражено влияние лейкоцитарной инфильтрации, повсеместно лимфоидная инфильтрации, отсутствуют явления вторичной альтерации; на 5 сутки в мягких и костной тканях признаки эпителиоидной инфильтрации и выраженные признаки начала регенерации соединительно-тканных элементов; на 7 сутки на фоне повсеместной регенерации соединительно-тканных элементов появляются отдельные дифференцирующиеся клетки со структурами, характерными для исходной ткани. В 4 группе с внутримышечным введением эмульсии ПФОС патоморфологическая картина ближе к таковой в 3 группе, несмотря на то, что эмульсия вводилась не в системный кровоток, а местно. Таким образом, введение эмульсии ПФОС оказывает выраженное противовоспалительное действие, уменьшает лейкоцитарную инфильтрацию и практически ликвидирует явления вторичной альтерации при воспалении и раневом процессе, благодаря чему раньше не происходит увеличения зоны повреждения и раньше начинаются регенераторные процессы заживления. Указанные противовоспалительные и ранозаживляющие процессы более выражены при внутривенном введении эмульсии ПФОС, но эти явления имеют неожиданно яркий характер и при местном введении эмульсии ПФОС.
Пример 15. Лечение жировой и воздушной эмболии у кроликов.
Эмульсию ПФОС, полученную по примеру 11, использовали для лечения жировой и воздушной эмболии у кроликов, особенно чувствительных к нарушению проходимости сосудов мозга. Кроликам массой 3-4 кг вводили через ушную вену 10 мл грубодисперсной эмульсии кукурузного масла в воде со средним размером частиц 100-200 мкм и видимыми пузырьками воздуха. Через 3-5 минут у животных закатывались глаза, они падали на бок, у одного кролика наблюдалось нарушение ритма дыхания по Чейн-Стоксу и у одного животного развивалось апноэ - прекратилось дыхание. Через 20 минут после потери кроликом сознания или через 3-4 минуты после появления Чейн-Стоксова дыхания, или сразу же после остановки дыхания с помощью катетера, предварительно закрепленного в ушной вене, кроликам вводили эмульсию ПФОС в дозе 4 мл на кг массы тела. Лечебный эффект в виде выведения животных из коматозного состояния и состояния клинической смерти (в результате остановки дыхания) развивался практически сразу же «на игле»: восстанавливалось ритмичное дыхание, кролики приходили в сознание, открывали глаза, восстанавливались зрачковые рефлексы. В контрольном эксперименте с введением физ. раствора лечебного эффекта не наблюдалось: кролики с Чейн-Стоксовым дыханием и с апноэ погибали.
Пример 16. Регуляция регионарного кровотока и улучшение кровотока в пораженной области. У крыс после травматизации бедра по примеру 13 на 1-3 сутки наблюдался отек тканей и нарушение локального кровотока на поврежденном бедре. Эмульсию ПФОС или физ. раствор вводили внутривенно в дозе 2 мл на кг массы тела или местно по 0.2 мл в 4 точки вокруг раны, отступив на 5-8 мм. Через 30 минут измеряли с помощью ультразвукового доплерометра системный кровоток в области крупных сосудов проксимальнее раны и местный кровоток непосредственно над ушитой раной, а также в противоположной неповрежденной конечности. Внутривенное введение эмульсии ПФОС. Эксперимент выполнен на 40 крысах-самцах линии «Wistar» весом 250-300 г. Контролем служили крысы, которым вводился 0,9% раствор натрия хлорида внутривенно (3 группа, n=10) и внутримышечно (4 группа, n=10). У всех крыс до введения препаратов было дополнительно оценено состояние кровотока в исходном состоянии. Доплерографическое исследование проводили на ультразвуковом диагностическом аппарате «Biomedical AU-5» (Италия) с помощью линейного датчика частотой 10-13 мГц по общепринятой методике. Выполнено доплеровское картирование на основании анализа направления и энергии потока в бедренных артериях и в тканях бедра до и после введения эмульсии ПФОС и физ. раствора.
При внутривенном введении эмульсии ПФОС максимальная систолическая скорость кровотока в бедренной артерии превышала исходную более чем в 3 раза (р<0,05), минимальная диастолическая линейная скорость кровотока вдоль сосуда возрастала в 2,5 раза (р<0,05), средняя скорость - в 4,5 раза (р<0,05). Одновременно снижался индекс резистентности на 26,0% (р<0,05), что свидетельствует о снижении общего периферического сосудистого сопротивления. Пульсовый индекс достоверно превышал фоновое значение в 2,02 раза. При картировании отмечено значительное увеличение артериального и венозного кровотока по сравнению с исходным как в бедренной артерии, так и в пораженных тканях бедра, тогда как на непораженной конечности наблюдалась четкая тенденция к уменьшению кровотока после внутривенного введения эмульсии ПФОС. После внутримышечного введения эмульсии ПФОС возрастали скорости кровотока, но отличия от контроля (физ. раствор) были несущественными. При картировании визуально отмечено значительное увеличение артериального и венозного кровотока по сравнению с исходным в бедренной артерии и в тканях пораженного бедра крыс. Энергетическое доплеровское картирование показало увеличение массы эритроцитов как в зоне инфильтрации тканей эмульсией ПФОС, так и при внутривенном введении.
После внутривенного введения физ. раствора максимальная систолическая скорость кровотока в бедренной артерии составляла 139,9%, минимальная диастолическая линейная скорость кровотока вдоль сосуда - 161,1%, средняя скорость - 191,8% от исходного значения (р<0,05). Однако эти изменения скоростей кровотока наблюдались при практически неизменном индексе резистентности, что свидетельствует о сохранении спастического тонуса сосудов в системе микроциркуляции. Пульсовой индекс, характеризующий состояние кровенаполнения в раневой области, превышал фоновое значение на 26,8% (р>0,05). Различий скоростей кровотока и индексов резистентности и пульсового при внутримышечном введении физ. раствора по сравнению с исходным фоном не выявлено. При картировании визуально отмечено незначительное увеличение артериального кровотока по сравнению с исходным в бедренной артерии и в пораженных тканях бедра. Энергетическое доплеровское картирование показало незначительное увеличение массы эритроцитов в зоне инфильтрации тканей физ. раствором и после его внутривенного введения.
Таким образом, внутривенное введение эмульсии ПФОС в малых дозах существенно улучшает системный и местный кровоток в области раны, тогда как на непораженной конечности происходило даже некоторое уменьшение локального кровотока, что хорошо согласуется с гипотезой О. Rafikova et al. (2004) о роли явлений гидрофобного NO-зависимого микрокатализа, проявляющегося в улучшении кровотока, и о возможности уменьшения кровотока при секвенировании NO эмульсией ПФОС, что может вызвать уменьшение кровотока (как это происходило в нашем эксперименте на здоровой стороне). Весьма показательно в связи с этим оказалось обнаружение значимого эффекта на локальный кровоток после местного введения эмульсии ПФОС.
Пример 17
Внутриполостное введение эмульсии ПФОС для уменьшения воспаления.
Крысам-самцам массой 250-280 г под тиопенталовым наркозом производили лапаротомию и последующее ушивание раны брюшной полости чистым но не стерилизованным инструментом - без соблюдения правил асептики (5 животных - контроль, 10 животных - опыт, по 5 на каждую эмульсию ПФОС). В результате у животных контрольной группы, которым внутрибрюшинно вводили по 3 мл физ. раствора через 24 и 48 часов после операции, через 72 часа наблюдались выраженные инфильтративные изменения в брюшной полости и выпот в виде нейтрофильных активированных лейкоцитов. При этом выделенные лейкоциты обладали 3-5-кратно повышенной способностью генерировать активные формы кислорода, регистрируемые с помощью хемолюминометра в присутствии люминола после добавки формилмиристилацетата. При введении в брюшную полость через 24 и 48 часов по 3 мл эмульсии ПФОС, полученной по заявляемому изобретению (образцы №2 и №3 по примеру 1), у животных резко уменьшались явления воспаления в брюшной полости, величина выпота была столь мала, что трудно было получить суспензию лейкоцитов, а полученные лейкоциты усиливали продукцию активных форм кислорода после добавки формилмиристилацетата лишь в 1,5-2 раза. Патоморфологический анализ органов ни в одном случае - ни контроле, ни в опыте - не выявил появления септических очагов. Таким образом, внутриполостное введение эмульсии способствовало уменьшению воспалительного процесса в брюшной полости без использования антибиотиков, подавляло гиперактивность лейкоцитов, не вызывая при этом каких-либо септических осложнений, которые можно было бы ожидать в связи с подавлением эмульсией ПФОС активности проникающих в брюшную полость лейкоцитов. Последующее заживление протекало в контроле с образованием довольно выраженного гипертрофического рубца, тогда как у животных, которым дважды внутрибрюшинно вводили эмульсию ПФОС, шов был мягкий, ровный, без рубцовых изменений.
В результате создана стабильная эмульсия ПФОС, эффективный способ ее получения и эффективный способ ее применения.
Источники информации
1. К.Н.Макаров и др., Журн. Всесоюзного химического общества им. Д.И.Менделеева, 1985, т.30, №4, с.387-394.
2. J.G.Riess // Chem. Rev., 2001,v.l01, №9, с.2797-2914.
3. Е.Маевский, Биологическая активность перфторированных углеродов и их эмульсий. В Сб. Перфторированные углерода в биологии и медицине, под ред Ф.Ф.Белоярцева. 1980, Пущино, с.121-125.
4. Образцов В.В. и др. Биофизические механизмы токсичности фторуглеродных эмульсий//. Биофизика, 1994, т.39, вып.4, с.732-737.
5. О.Rafikova at al.. Circulation. 2004;v. 110: p.3573-3580.
6. Maevsky E.I. et al., in "Blood Substitutes" Ed. by R.M. Winslow Amsterdam, L, N.Y. T, Acad. Press Elsevier, 2006, Chapter 26, p.288-297.
7. Clark L.C.Jr, et al., in. Mat. Res. Soc. Symp. Proc. 1989, V.110, P.129-134.
8. А.Н.Склифас и др. Исследование механизма токсичности эмульсий перфтордекалина для кроликов. // В сб. «Перфторуглеродные активные среды для медицины и биологии (новые аспекты исследования)». 1993, Пущино, с.129-135.
9. Капцов В.В.; Образцов В.В.; Кукушкин Н.И. и др.; Патент РФ №2088217, 1997.08.27.
10. Иваницкий Г.Р., Воробьев С.И., Деев А.А. «Жизнь» перфторуглеродной эмульсии. // В сб. «Физиологическая активность фторсодержащих соединений (эксперимент и клиника).» 1995, Пущино, с.5-32;
11. Иваницкий Г.Р. // Биофизика на пороге нового тысячелетия: перфторуглеродные среды и газотранспортные кровезаменители. // Российские биомедицинские технологии - 2000, т.1, ноябрь, с.9-54.
12. Love K.C. in "Blood Substitutes" Ed. by R.M.Winslow Amsterdam, L, N.Y. T, Acad. Press Elsevier, 2006, Chapter 25, p.276-287.
13. Keipert P.E. in Adv. Exp.Med. Biol. Oxygen transport to Tissue XXV. Ed T. Harrison and J. Kluver. Academic/Plenum Publishers, 2003, v. 530, Chapter 29, p.207-213.
14. Keipert P.E. in "Blood Substitutes" Ed. by R.M. Winslow Amsterdam, L, N.Y. T, Acad. Press Elsevier, 2006, Chapter 28, p.312-324.
15. Сборник «Перфторуглеродные соединения в медицине и биологии» под ред. Г.Р.Иваницкого, Е.Б.Жибурта, Е.И.Маевского, Пущино, 2004, 267 с.
16. Воробьев С.И., Кутышенко С.И., Склифас А Н. и др. Комплетентактивирующее действие префторуглеродных эмульсий: обзор. // Биосовместимость, 1995, т.3, №1-2, с.51-62.
17. Кузнецова И.Н., Маевский Е.И. Патент РФ 2259819, дата публикации 2005.09.10.
18. Маевский Е.И., Иваницкий Г.Р., Макаров К.Н. и др. Патент РФ №2206319, дата публикации 2003.06.20, прототип.
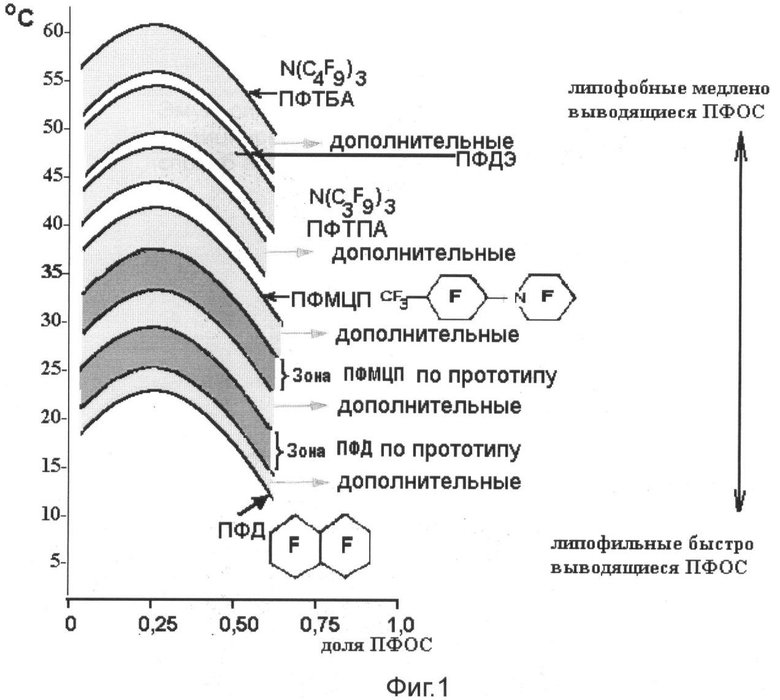
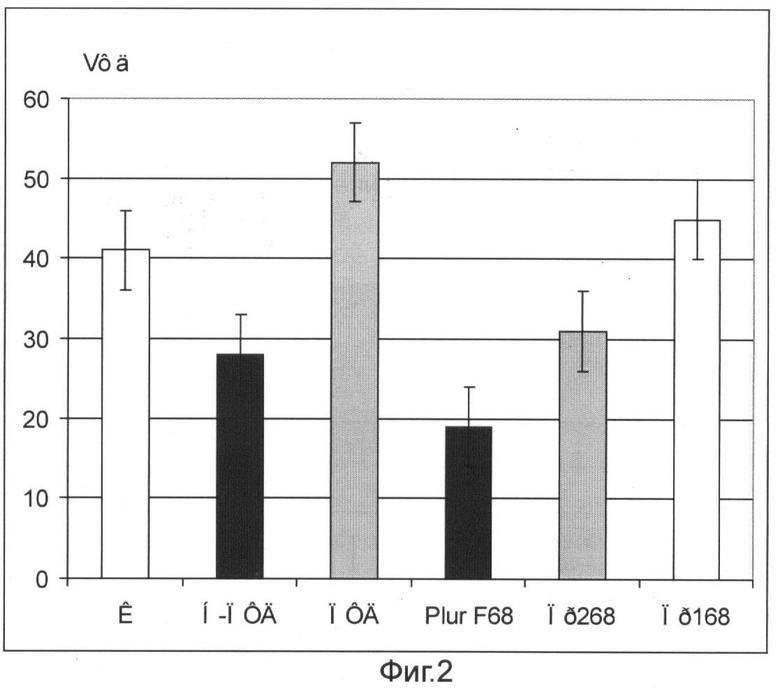
Заявленное изобретение относится к химико-фармацевтической промышленности и касается эмульсии перфторорганических соединений (ПФОС) для биологических и медицинских целей, содержащей смесь перфторуглеродов (ПФУ), основным компонентом которой является перфтордекалин (ПФД) и смесь перфторированных третичных аминов (ПФТА), основным компонентом которой является перфтор-N-(4-метилциклогексил)-пиперидин (ПФМЦП), имеющий меньшие, чем ПФД, скорости выведения из организма, стабилизирующий агент и физиологически приемлемый водно-солевой раствор с субстратами энергетического обмена, отличающейся тем, что все компоненты ПФОС имеют значения критической температуры растворения в гексане (ТкрГ), различающиеся не более чем на 2-4°С, а стабилизирующий агент представляет собой смесь блок-сополимеров из группы блок-сополимеров полиоксиэтилена-полиоксипропилена со средним массовьм содержанием полиоксипропилена 20%. Изобретение также касается способа получения эмульсии и способа лечения с применением заявленной эмульсии. Эмульсии обладают высокой стабильностью и нетоксичны. 3 н. и 18 з.п. ф-лы, 5 табл., 2 ил.
1. Эмульсия перфторорганических соединений (ПФОС) для биологических и медицинских целей, содержащая смесь перфторуглеродов (ПФУ), основным компонентом которой является перфтордекалин (ПФД) и смесь перфторированных третичных аминов (ПФТА), основным компонентом которой является перфтор-N-(4-метилциклогексил)-пиперидин (ПФМЦП), имеющий меньшие, чем ПФД, скорости выведения из организма, стабилизирующий агент и физиологически приемлемый водно-солевой раствор с субстратами энергетического обмена, отличающаяся тем, что все компоненты ПФОС имеют значения критической температуры растворения в гексане (ТкрГ), различающиеся не более чем на 2-4°С, а стабилизирующий агент представляет собой смесь блок сополимеров из группы блок-сополимеров полиоксиэтилена-полиоксипропилена, со средним массовым содержанием полиоксипропилена 20%, при этом в смеси ПФД содержатся только полностью фторированные примеси ПФУ, получаемые при синтезе ПФД, а в смеси ПФМЦП - только полностью фторированные примеси ПФТА, а также, по меньшей мере, один компонент из группы: смеси перфтортрипропиламина (ПФТПА) только с полностью фторированными примесями ПФТА, смеси перфтортрибутиламина (ПФТБА) только с полностью фторированными примесями ПФТА, смеси перфтордецилового эфира (ПФДЭ) только с полностью фторированными примесями перфторированных эфиров (ПФЭ).
2. Эмульсия ПФОС по п.1, отличающаяся тем, что в качестве перфторуглеродов она содержит смесь перфторированных копродуктов перфтордекалина, имеющих средний период полувыведения из организма не менее 12 дней и диапазон ТкрГ в пределах 22-29°С, очищенную от водородсодержащих и непредельных примесей.
3. Эмульсия ПФОС по п.1, отличающаяся тем, что в качестве перфторированных третичных аминов она содержит смесь всех копродуктов перфтортрипропиламина, имеющих средний период полувыведения из организма не менее 60 дней и диапазон ТкрГ в пределах 41-46°С, очищенную от водородсодержащих и непредельных примесей.
4. Эмульсия ПФОС по п.1, отличающаяся тем, что в качестве перфорированных третичных аминов она содержит смесь копродуктов перфтор-N-4-(метилциклогексил)-пиперидина, имеющих средний период полувыведения из организма не менее 80 дней и диапазон ТкрГ в пределах 32-40°С, очищенную от водородсодержащих и непредельных примесей.
5. Эмульсия ПФОС по п.1, отличающаяся тем, что в качестве медленно выводящихся ПФОС она содержит смесь копродуктов перфтордецилового эфира (ПФДЭ), имеющих средний период полувыведения из организма не менее 500 дней и диапазон ТкрГ в пределах 49-53°С, очищенную от водородсодержащих и непредельных примесей.
6. Эмульсия ПФОС по п.1, отличающаяся тем, что в качестве перфторированных третичных аминов она содержит смесь копродуктов перфтортрибутиламина, имеющих средний период полувыведения из организма не менее 900 дней, и диапазон ТкрГ в пределах 56-60°С, очищенную от водородсодержащих и непредельных примесей.
7. Эмульсия ПФОС по п.1, отличающаяся тем, что соотношение содержащихся в ней быстро выводящихся и медленно выводящихся ПФОС составляет от 5:1 до 1:5.
8. Эмульсия ПФОС по п.1, отличающаяся тем, что в качестве стабилизирующего агента она содержит смесь отобранных методом насыщающей аффинной сепарации (НАС) сополимеров полиоксиэтилена (ПОЭ)-полиоксипропилена (ПОП) с молекулярной массой 5-13 тыс.Да.
9. Эмульсия ПФОС по любому из пп.1, 8, отличающаяся тем, что в качестве стабилизирующего агента она содержит смесь отобранных методом НАС сополимеров ПОЭ и ПОП при соотношении ПОЭ:ПОП в диапазоне от 78:22 до 82:18.
10. Эмульсия ПФОС по любому из пп.1, 8, отличающаяся тем, что содержание стабилизирующего агента в ней составляет 1-5%, для обеспечения вязкости 2-5 сП.
11. Эмульсия ПФОС по любому из пп.1-8, отличающаяся тем, что физиологически приемлемый водно-солевой раствор включает NaCl, KCl, MgCl2, NaHCO3, NaH2PO4, Na2HPO4,D-глюкозу для обеспечения изоосмотичности в конечной лекарственной форме, при этом поддерживается соотношение ионов Na и К на уровне 10:1-30:1 и величина рН в диапазоне 6,9-8,0.
12. Эмульсия ПФОС по п.1, отличающаяся тем, что водно-солевая часть готовой конечной лекарственной формы содержит 110-150 мМ NaCl, 4-5 мМ KCl, 1-3 мМ MgCl2 6-20 мМ NaHCO3, 1-2 мМ NaH2PO4 1-2 мМ Na2HPO4 и 10-15 мМ D-глюкозы.
13. Эмульсия ПФОС по любому из пп.1, 12, отличающаяся тем, что для использования в качестве противоишемического протектора водно-солевая часть препарата содержит 4-15 мМ KCl, соли три-, да- и монокарбоновых кислот, в том числе 1-7 мМ цитрата натрия, 1-7 мМ изоцитрата натрия, 1-7 мМ сукцината натрия, 1-7 мМ α-кетоглутарата натрия, 1-7 мМ пирувата натрия, 1-7 мМ β-оксибутирата натрия, 1-7 мМ глутамата натрия, 1-7 мМ аспартата натрия.
14. Способ приготовления эмульсии ПФОС по п.1 для биологических и медицинских целей, включающий смешивание и диспергирование смеси жидких ПФОС с водным раствором стабилизирующего агента с последующим измельчением в гомогенизаторе высокого давления до субмикронного размера частиц эмульсии, отличающийся тем, что
смесь ПФОС, имеющую различия по ТкрГ не более 2-3°С, заливают в емкость, содержащую раствор смеси СА в соотношении 10-30 объемных частей ПФОС к 90-70 объемам раствора смеси СА,
полученную неоднородную смесь подвергают процедуре НАС, проводимой при температуре 50-60°С, включающей получение грубой дисперсии ПФОС в растворе СА путем перемешивания на высокоскоростной мешалке при скорости вращения ротора при 1000-3000 об./мин, полученную грубую дисперсию подвергают экструзии в гомогенизаторе под давлением 100-300 кг/см2, в атмосфере, не содержащей кислород, и отделяют грубую дисперсию ПФОС от водного раствора СА, полученный осадок грубой дисперсии смешивают со свежей порцией раствора СА из такого расчета, чтобы объемная доля ПФОС составляла 10-30%,
при этом описанная операция НАС повторяется не менее 2 раз,
после чего эмульсию пропускают многократно через гомогенизатор при давлении 300-700 кг/см2,
полученную субмикронную эмульсию разбавляют водно-солевым раствором таким образом, чтобы конечная концентрация ПФОС составляла 4-12 об.% и эмульсия имела осмотическое давление в диапазоне 270-330 мОсм.
15. Способ приготовления эмульсии ПФОС по п.14, отличающийся тем, что смеси из жидких ПФУ и ПФТА или ПФЭ получают в соотношении от 5:1 до 1:5, подвергают после смешивания промыванию апирогенными водно-спиртовыми растворами и водой, отделяют смеси более плотных жидких ПФОС от водно-спиртового раствора и воды, фильтруют под давлением газа, не содержащего кислород, разливают и укупоривают во флаконы под закатку и осуществляют автоклавирование.
16. Способ приготовления эмульсии ПФОС по п.14, отличающийся тем, что смесь СА приготавливают в виде 10-30%-ного водного раствора сополимеров полиоксиэтилена-полиоксипропилена - проксанола 168 и проксанола 268, взятых в соотношении от 10:1 до 1:10 в зависимости от состава композиции смеси ПФОС, очищают раствор СА путем пропускания через угольный сорбент и стерилизующий фильтр под давлением газа, не содержащего кислород, прогревают раствор СА в течение 8-24 ч и охлаждают до 16-20°С для полного восстановления прозрачности раствора.
17. Способ приготовления эмульсии ПФОС по п.14, отличающийся тем, что водный раствор смеси сополимеров полиоксиэтилена-полиоксипропилена прогревают при температуре, которая выбирается в диапазоне ±2°С от температуры помутнения, установленной экспериментальным путем для полученной смеси СА.
18. Способ лечения заболеваний кровеносной системы, при котором осуществляют введение в кровоток или в лимфатический проток быстровыводящихся перфторорганических соединений, отличающийся тем, что в качестве быстровыводящихся перфторорганических соединений в кровоток вводят эмульсию ПФОС по п.1.
19. Способ по п.18, отличающийся тем, что для лечения явлений гипоксии, ишемии, отека, воспаления при шоке, кровопотере, тромбо-эмболических поражениях, функциональных и органических нарушениях проходимости сосудов повреждении тканей осуществляют внутривенное введение эмульсии ПФОС в дозе 0,5-30 мл на 1 кг массы тела.
20. Способ по п.18, отличающийся тем, что для подавления вторичной альтерации при воспалении и раневом процессе, а также для ускорения заживления травматических, трофических и операционных ран осуществляют внутривенное введение эмульсии ПФОС в дозах 0,3-6 мл на кг массы тела и/или местно порциями по 0,5-50 мл подкожно, внутримышечно, в глубину вокруг поврежденного участка, или в окружающие воспаленные и травмированные ткани полости или биологические жидкости, в частности интраплеврально, интраперитонеально, интралюмбально, в общий лимфатический проток в дозе 1-100 мл, а также в качестве очищающей или аппликационной жидкости при обработке открытых раневых поверхностей.
21. Способ по п.18, отличающийся тем, что для улучшения системного и локального кровотока, регуляции системного артериального давления и перфузионного регионарного давления, облегчения и ускорения массообмена по газам, субстратам и метаболитам осуществляют внутрисосудистое или местное введение эмульсии ПФОС в ткани, в том числе при перфузионной и бесперфузионной защите изолированных или отключенных от кровотока органов и тканей.
| Масленников И.А., Пушкин С.Ю., к.б.н | |||
| Бондарь О.Г | |||
| Обзор технологий создания перфторуглеродных эмульсий | |||
| Опубликовано в Интернет-журнале "Коммерческая биотехнология" http://www.cbio.ru/, дата публикации: 01.12.06, найдено в сети Интернет по адресу http://www.cbio.ru/modules/news/article.php?storyid=2454 | |||
| ЭМУЛЬСИЯ ПЕРФТОРОРГАНИЧЕСКИХ СОЕДИНЕНИЙ ДЛЯ МЕДИЦИНСКИХ ЦЕЛЕЙ, СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ И СПОСОБЫ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2000 |
|
RU2206319C2 |
| ЭМУЛЬСИЯ ПЕРФТОРОРГАНИЧЕСКИХ СОЕДИНЕНИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ И СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2004 |
|
RU2259819C1 |
Авторы
Даты
2010-07-10—Публикация
2006-12-28—Подача