Область техники
Данное изобретение относится к биомаркерам и к применению биомаркеров для прогнозирования и предсказания рака, а также применению биомаркеров для мониторинга эффективности противораковой терапии. Более конкретно данное изобретение относится к применению VEGF-165 в качестве биомаркера для мультикиназных ингибиторов.
Предшествующий уровень техники
Рецепторы сосудистого эндотелиального фактора роста (VEGFR) и их лиганды, сосудистые эндотелиальные факторы роста (VEGF) играют критические роли в миграции и пролиферации эндотелиальных клеток. Система VEGFR/VEGF включает три рецептора (VEGFR-1, VEGFR-2 и VEGFR-3) и четыре лиганда (VEGF-A, В, С, D и Е и плацентарный фактор роста). VEGF-A дополнительно состоит из четырех изоформ VEGF-121, VEGF-165, VEGF-185 и VEGF-204, полученных при альтернативной транскрипции гена VEGF-A. Рецепторы представляют собой белки, связанные с плазматической мембраной (plasma membrane-spanning proteins) с внутриклеточными тирозинкиназными доменами. Как и для других протеинкиназ, активация VEGFR является ключевым механизмом при регулировании сигналов для пролиферации эндотелиальных клеток, и считается, что аномалии VEGFR/VEGF вносят вклад в аномальный ангиогенез во множестве заболеваний человека, таких как псориаз и злокачественные образования.
В эмбриогенезе система VEGFR/VEGF является необходимой для правильного развития сосудистой системы. У взрослых VEGFR/VEGF важна при заживлении ран, воспалении и ангиогенезе.
Неинвазивный анализ уровней циркулирующего VEGF-165 у пациентов до лечения лекарственными средствами является потенциально важным дополнением к принятию терапевтического решения. Хотя анализ общего VEGF-A применяют у человека в качестве прогностического индикатора результата заболевания, до настоящего описания не сообщалось о сопоставлении между уровнями VEGF-165 у пациентов до химиотерапии и результатом лечения. Поэтому VEGF-165 может служить ценным прогностическим индикатором и биомаркером для мониторинга эффективности лечения мультикиназным ингибитором.
Краткое содержание изобретения
Данное изобретение относится к биомаркерам и к применению биомаркеров для прогнозирования и предсказания рака, а также применению биомаркеров для мониторинга эффективности противораковой терапии. Более конкретно данное изобретение относится к применению VEGF-165 в качестве биомаркера для мультикиназных ингибиторов (например, Сорафениба).
В одном варианте осуществления данное изобретение относится к применению количественных иммуноанализов для измерения уровней белка VEGF-165 в жидкостях человеческого тела до лечения мультикиназным ингибитором (например, Сорафенибом). Указанные уровни особенно полезны в качестве индикатора потенциала для страдающих раком пациентов, подвергающихся лечению мультикиназным ингибитором (например, Сорафенибом), преимуществ такой терапии.
Измерение уровней VEGF-165 до лечения могут применяться клинически в качестве терапевтического вспомогательного средства для выбора терапии пациента, для мониторинга состояния пренеопластического/неопластического заболевания у пациента, и/или для мониторинга того, как пациент, страдающий пренеопластическим/неопластическим заболеванием, реагирует на терапию. В одном варианте осуществления уровни VEGF-165 могут применяться для помощи в выборе терапии пациента и при принятии решений, касающихся оптимального способа терапии пациента.
Уровни VEGF-165 могут быть измерены во взятых у пациента образцах, таких как, но не ограниченных ими, кровь, сыворотка, плазма, моча, слюна, семенная жидкость, экссудат из молочной железы, спинномозговая жидкость, слеза, мокрота, слизь, лимфа, цитозоли, асциты, плевральные выпоты, околоплодные воды, промывочные жидкости мочевого пузыря и бронхоальвеолярные лаважи.
В другом варианте осуществления данное изобретение относится к применению иммуноанализа в качестве способа отбора пациентов, которые вероятно получат пользу от лечения мультикиназным ингибитором (например, Сорафенибом), через измерение уровней VEGF-165 до лечения в полученных у пациента образцах, и оценку возможного результата на основе номограммы возможного результата у пациента к уровням VEGF-165.
Способ мониторинга состояния заболевания, связанного с активированным путем VEGF-165 у пациента, может быть также прогностическим для заболевания, где уровни общего белка VEGF-165 в полученных у пациента образцах являются показательными для лучшего или худшего результата лечения у пациента. Прогнозом может быть клинический результат, выбранный из группы, включающей скорость реакции (СР), полную реакцию (ПР), частичную реакцию (ЧР), стабильное заболевание (СЗ), клиническую пользу [включая полную реакцию (ПР), частичную реакцию (ЧР) и стабильное заболевание (СЗ)], время до прогрессирования заболевания (ВДПЗ), выживаемость без прогрессирования (ВБП) и общая выживаемость (ОВ).
Эти способы могут иметь стандартные форматы, например, иммуноанализ в виде сэндвич-иммуноанализа, такого как сэндвич-метод твердофазного иммуноферментного анализа (ELISA), или эквивалентный анализ. В таких иммуноанализах могут применяться моноклональные антитела, такие как анти-VEGF-165 моноклональные антитела. Кроме того, моноклональное антитело может быть биотинилировано.
Другой вариант осуществления изобретения относится к количественному иммуноанализу для измерения последовательных изменений в уровнях общего белка VEGF-165 в полученных у пациента образцах, в качестве способа выбора терапии для пациента, страдающего заболеванием, например, пренеопластическим/неопластическим заболеванием.
В качестве примера, один из таких способов выбора терапии может включать стадии:
(а) иммунологического обнаружения и количественного анализа уровня общего белка VEGF-165 в образце, взятом у контрольной группы;
(b) иммунологического обнаружение и количественного анализа уровня общего белка VEGF-165 в образце, взятом у пациента с течением времени; и
(c) определения того, необходимо ли применение обычной терапии и/или терапии мультикиназным ингибитором (например, Сорафенибом) для лечения пациента на основе уровня белка VEGF-165 во взятых у пациента образцах.
Например, если обнаружено, что уровень белка VEGF-165 во взятом у пациента образце составляет свыше 70 пг/мл, может быть сделан вывод, что пациент страдает заболеванием, управляемым VEGF, и может быть принято решение о применении терапии мультикиназным ингибитором (например, Сорафенибом) для лечения пациента либо отдельно, либо в сочетании с одной или более другими терапиями.
Терапия, направленная на путь VEGF-165, может включать мультикиназные ингибиторы, ингибиторы тирозинкиназы, бис-арилмочевины, антисмысловые ингибиторы VEGFR-2 или терапии моноклональными антителами, или т.п. Например, терапия, направленная на путь VEGF-165, может включать бис-арилмочевину Сорафениб, который является ингибитором ангиогенеза, а также ингибитором тирозинкиназы, или ингибитор тирозинкиназы STI571 (также известный как иматиниб мезилат или Gleevec®).
Другой вариант осуществления данного изобретения относится к применению количественного иммуноанализа для определения изменений уровней VEGF-165 в сочетании с уровнями одного или более другого белка(ов). Такой дополнительный белок(и) может включать, например, ингибиторы (например, тканевый ингибитор металлопротеиназы-1 (TIMP-1)), онкобелки (например, HER-2/neu, ras p21), рецепторы фактора роста (например, рецептор эпидермального фактора роста (EGFR), альфа рецептор тромбоцитарного фактора роста (PDGFR-α)), белки местастазов (например, активатор плазминогена урокиназного типа (uРА)), опухолевые маркеры (например, карциноэмбриональный антиген (СЕА)) и опухолевые супрессоры (например, р53). Такие способы могут применяться, например, в качестве диагностических/прогностических средств, выбора терапии для пациентов, страдающих заболеванием, мониторинга состояния заболевания у пациента и мониторинга того, как пациент, страдающий заболеванием, реагирует на направленную на путь VEGF или другую терапию. Предпочтительно тестировать пациентов (например, пациентов с раком) на последовательные изменения как в общем VEGF-165, так и в дополнительных белках, таких как белки, которые активируют путь VEGF-165, в качестве средства для расширения клинической перспективы, терапевтических ресурсов и диагностических/прогностических параметров для выбора оптимальных терапевтических сочетаний для получения наиболее многообещающих результатов лечения.
В другом варианте осуществления в данном изобретении представлен аналитический набор для мониторинга эффективности терапии на взятом у пациента образце, содержащий специфическое к белку антитело. В некоторых вариантах осуществления набор также включает инструкции по применению набора. В определенных вариантах осуществления набор также может включать растворы для суспендирования или фиксирования клеток, обнаруживаемые таги или метки, растворы для визуализации полипептида, чувствительного к связыванию антитела, растворы для лизирования клеток или растворы для очистки полипептидов. В еще одном варианте осуществления антитело является специфическим к VEGF-165.
Описание чертежей
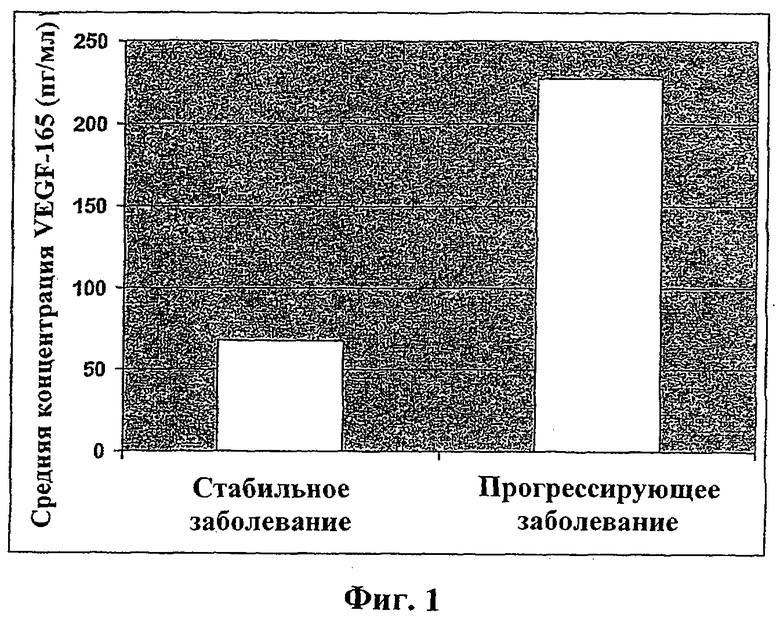
На Фиг.1 показаны средние уровни VEGF-165 у групп пациентов для стабильного и прогрессирующего заболевания.
На Фиг.2 показано среднее уменьшение опухоли, измеренное у групп пациентов для стабильного и прогрессирующего заболевания.
Подробное описание изобретения
Должно быть понятно, что данное изобретение не ограничено описанными конкретной методологией, протоколами, колониями клеток, видами или родами животных, конструктами и реагентами, которые, как таковые, могут варьироваться. Также должно быть понятно, что применяемая здесь терминология дана для целей описания только конкретных вариантов осуществления и не предназначена для ограничения объема данного изобретения, который ограничивается только формулой изобретения.
Необходимо отметить, что в данном описании и формуле изобретения единственное число включает ссылки на множественное число, если контекст однозначно не указывает на обратное. Таким образом, например, ссылка на «ген» является ссылкой на один или более генов и включает их эквиваленты, известные специалистам в данной области техники, и так далее.
Если не указано иначе, все технические и научные термины, применяемые в данном описании, имеют те же значения, которые общеприняты и понятны специалистам в данной области техники, к которой принадлежит данное изобретение. Хотя на практике или тестировании данного изобретения могут применяться любые способы, устройства и материалы, похожие или эквивалентные тем, которые описаны, далее описаны предпочтительные способы, устройства и материалы.
Все публикации и патенты, упомянутые здесь, включены сюда путем ссылок в целях описания и раскрытия, например, конструктов и методологии, которые описаны в публикациях, которые могут применяться в связи с описанным здесь изобретением. Публикации, указанные выше и далее по тексту, предоставлены исключительно ради их описания до даты подачи данной заявки. Ничто здесь не должно быть истолковано, как допущение того, что авторы данного изобретения не имеют право датировать такое описание на основании предшествующего изобретения.
Определения
Для удобства значение определенных терминов и фраз, применяемых в описании, примерах и формуле изобретения, представлено ниже.
Термин «взятый у пациента образец» в данном описании означает образец, взятый у пациента. Образцом может быть любая биологическая ткань или жидкость. Образцом может быть образец, который получают у пациента. Такие образцы включают, но не ограничены ими, кровь, сыворотку, плазму, мочу, слюну, семенную жидкость, экссудат из молочной железы, спинномозговую жидкость, слезу, мокроту, слизь, лимфу, цитозоли, асциты, плевральные выпоты, околоплодные воды, промывочные жидкости мочевого пузыря и бронхоальвеолярные лаважи, клетки крови (например, лейкоциты), образцы ткани или биопсии (например, биопсию опухоли), или клетки из них. Биологические образцы также могут включать срезы тканей, таких как замороженные срезы, взятые для гистологических целей.
Термин «биомаркер» охватывает широкий спектр внутри- и внеклеточных событий, а также физиологические изменения во всем организме. Биомаркеры могут быть представлены практически любым аспектом клеточной функции, например, но не ограничиваясь ими, уровнями или скоростью образования сигнальных молекул, факторами транскрипции, метаболитами, генными транскриптами, а также посттрансляционными модификациями белков. Биомаркеры могут включать полный геномный анализ уровней транскрипта или полный протеомный анализ уровней белка и/или модификации.
Термин биомаркер также может относиться к гену или генному продукту с повышающей или понижающей регуляцией в обработанной соединением больной клетке пациента, страдающего заболеванием, по сравнению с не подвергающейся лечению больной клеткой. То есть ген или генный продукт является достаточно специфичным по отношению к обработанной клетке, что он может применяться, при необходимости с другими генами или генными продуктами, для идентификации, прогнозирования или определения эффективности небольшой молекулы. Таким образом, биомаркером является ген или генный продукт, который является характеристикой эффективности соединения в больной клетке или реакции указанной больной клетки на обработку соединением.
Термин «рак» включает, но не ограничен ими, солидные опухоли, такие как рак молочных желез, дыхательных путей, мозга, репродуктивных органов, пищеварительного тракта, мочевыводящих путей, глаз, печени, кожи, головы и шеи, щитовидной железы, околощитовидной железы, и их отдаленные метастазы. Термин также включает лимфомы, саркомы и лейкемии.
Примеры рака молочных желез включают, но не ограничены ими, инвазивную дук-тальную карциному, инвазивную дольковую карциному, дуктальную карциному in situ и дольковую карциному in situ.
Примеры рака дыхательных путей включают, но не ограничены ими, мелкоклеточную и немелкоклеточную карциному легких, а также бронхиальную аденому и плевролегочную бластому.
Примеры рака мозга включают, но не ограничены ими, глиому ствола мозга и гипоталамуса, мозжечковую и церебральную астроцитому, медуллобластому, эпендимому, а также нейроэктодермальную опухоль и опухоль пинеальной области.
Опухоли мужских репродуктивных органов включают, но не ограничены ими, рак простаты и яичников. Опухоли женских репродуктивных органов включают, но не ограничены ими, рак эндометрия, шейки матки, яичников, влагалища и вульвы, а также саркому матки.
Опухоли пищеварительного тракта включают, но не ограничены ими, рак прямой кишки, толстой кишки, ободочной и прямой кишки, пищевода, желчного пузыря, желудка, поджелудочной железы, прямой кишки, тонкого кишечника и слюнных желез.
Опухоли мочевыводящих путей включают, но не ограничены ими, рак мочевого пузыря, пениса, почек, почечной лоханки, мочеточника и мочеиспускательного канала.
Рак глаз включает, но не ограничен ими, внутриглазную меланому и ретинобластому.
Примеры рака печени включают, но не ограничены ими, гепатоцеллюлярный рак (карциномы клеток печени с или без фиброламеллярного варианта), холангиокарциному (карциному внутрипеченочных желчных протоков) и смешанную гепатоцеллюлярную холангиокарциному.
Рак кожи включает, но не ограничен ими, плоскоклеточную карциному, саркому Капоши, злокачественную меланому, рак клеток Меркеля и немеланомный рак кожи.
Рак головы и шеи включает, но не ограничен ими, рак гортани/гипоглотки/носоглотки/ротоглотки и рак губ и ротовой полости.
Лимфомы включают, но не ограничены ими, связанную со СПИД лимфому, неходжкинскую лимфому, кожную Т-клеточную лимфому, болезнь Ходжкина и лимфому центральной нервной системы.
Саркомы включают, но не ограничены ими, саркому мягких тканей, остеосаркому, злокачественную фиброзную гистиоцитому, лимфосаркому и рабдомиосаркому.
Лейкемии включают, но не ограничены ими, острую миелоидную лейкемию, острую лимфобластную лейкемию, хроническую лимфоцитарную лейкемию, хроническую миелогенную лейкемию и волосато-клеточный лейкоз.
Термин «пациент» или «объект» в данном описании включает млекопитающих (например, человека и животных).
Данное изобретение относится к количественным иммуноанализам, в которых измеряют уровни белка VEGF-165 в полученных у пациента образцах. Такие анализы могут быть полезны при выборе терапии для пациента, страдающего заболеванием, связанным с путем VEGF-165. В данном описании «путь VEGF-165» определяется как путь VEGF-165, активированный либо чрезмерной экспрессией, либо мутацией белка VEGF-165 и, как таковой, охватывает пути VEGF-165 с повышающей регуляцией и/или стимулированные мутацией.
Примерами неопластических заболеваний, связанных с активированным путем VEGF-165, а также предраковых состояний, приводящих к неопластическим заболеваниям, являются следующие: метастатическая медуллобластома, желудочно-кишечные стромальные опухоли (ЖКСО), дерматофибросаркома выбухающая (ДФСВ), хронические миелопролиферативные заболевания (ХМПЗ), рак прямой и ободочной кишки, рак толстой кишки, рак легких, немелкоклеточный рак легких, мелкоклеточный рак легких, острая миелогенная лейкемия, рак щитовидной железы, рак поджелудочной железы, рак мочевого пузыря, рак почек, меланома, рак молочных желез, рак простаты, рак яичников, рак шейки матки, рак головы и шеи, опухоли мозга, гепатоцеллюлярная карцинома и гематологические злокачественные образования. Таким образом, уровни белка VEGF-165, отдельно или в сочетании с уровнями других белков (например, других онкобелков), могут применяться для прогнозирования клинического результата и/или в качестве вспомогательного средства при выборе терапии.
Таким образом, в данном изобретении описано и заявлено применение иммуноанализа для количественного измерения уровней VEGF-165 в полученных у пациентов образцах (например, уровни циркулирующего VEGF-165) для оценки вероятности того, что страдающий раком пациент получит пользу от лечения мультикиназным ингибитором (например, Сорафенибом).
В одном варианте осуществления данного изобретения белок VEGF-165 количественно оценивают в полученных у пациента образцах, взятых во время диагностики или до лечения. Такими полученными у пациента образцами могут быть кровь, сыворотка, плазма, моча, слюна, семенная жидкость, экссудат из молочной железы, спинномозговая жидкость, слеза, мокрота, слизь, лимфа, цитозоли, асциты, плевральные выпоты, околоплодные воды, промывочные жидкости мочевого пузыря и бронхоальвеолярные лаважи, среди прочих жидкостей тела. Полученные у пациента образцы могут быть свежими или замороженными и могут быть обработаны гепарином, цитратом или ЭДТК.
Примером иммуноанализа, который может применяться в способах в соответствии с данным изобретением, является сэндвич-ELISA. Однако должно быть понятно, что другие способы, в дополнение к описанным здесь, могут применяться для количественного анализа белка VEGF-165 в полученных у пациента образцах. Кроме того, множество способов обнаружения может применяться для визуализации белка VEGF-165, такие как люминесцентные метки.
Множество форматов могут быть адаптированы для применения в соответствии со способами данного изобретения. Например, обнаружение и количественный анализ белка VEGF-165 в полученных у пациента образцах могут проводиться с применением твердофазных иммуноферментных анализов, радиоиммуноанализов, сэндвич-анализов с применением двойного антитела, агглютинационных анализов, флуоресцентных иммуноанализов, иммуноэлектронной и сканирующей микроскопии, среди прочих анализов, широко известных в данной области техники. Количественный анализ белка VEGF-165 в таких анализах может быть адаптирован обычными методами, известными в данной области техники. В одном варианте осуществления последовательные изменения в уровнях циркулирующего белка VEGF-165 могут быть определены и количественно проанализированы с применением сэндвич-анализа, в котором иммобилизованное антитело иммобилизуют с применением обычных методик на поверхности подложки.
Подходящие подложки включают, например, синтетические полимерные подложки, такие как полипропилен, полистирол, замещенный полистирол, полиакриламиды (такие как полиамиды и поливинилхлорид), стеклянные шарики, агарозу и нитроцеллюлозу.
В примере сэндвич-иммуноанализа ELISA, который может применяться в способах в соответствии с данным изобретением, могут применяться очищенное мышиное моноклональное антитело против человеческого VEGF-165 в качестве иммобилизованного антитела, и биотинилированное козье поликлональное антитело против человеческого VEGF-165 в качестве детекторного антитела. Иммобилизованное моноклональное антитело иммобилизуют в лунках микротитровального планшета. Разведенные образцы человеческой сыворотки/плазмы или стандарты VEGF-165 (например, рекомбинантный белок VEGF-165 дикого типа) инкубируют в лунках для связывания антигена VEGF-165 с иммобилизованным моноклональным антителом. После промывания лунок иммобилизованный антиген VEGF-165 обрабатывают биотинилированным детекторным антителом, после чего лунки опять промывают. Затем добавляют конъюгат стрептавидина - пероксидазы хрена. После конечной промывки в лунки добавляют субстрат ТМБ Blue Substrate для определения связывающей активности пероксидазы. Реакцию останавливают добавлением 2,5 н. серной кислоты и оптическую плотность измеряют при 450 нм. Корреляция значений оптической плотности образцов со стандартами VEGF-165 позволяет определить количественное значение VEGF-165 в пг/мл сыворотки или плазмы.
Должно быть понятно, что другие белки (например, ингибиторы, онкобелки, рецепторы фактора роста, ангиогенные факторы, метастатические белки, опухолевые маркеры, опухолевые супрессоры, белки, связанные с путем VEGF) могут применяться для обнаружения и количественного анализа в сочетании с VEGF-165. Например, другие белки, подходящие для тестирования вместе с VEGF-165, включают тканевый ингибитор металлопротеиназы-1 (TIMP-1), HER-2/neu, ras p21, рецептор эпидермального фактора роста (EGFR), альфа рецептор тромбоцитарного фактора роста, сосудистый эндотелиальный фактор роста (VEGF), активатор плазминогена урокиназного типа (uРА), карциноэмбриональный антиген (СЕА) и р53. Такие другие белки могут быть определены с применением анализов, которые известны специалистам в данной области техники. Например, иммуноанализы для количественного анализа HER-2/neu и TIMP-1 коммерчески доступны, например, Oncogene Science TIMP-1 ELISA (Oncogene Science, Cambridge, MA (USA)), который может определять нг/мл значения уровней TIMP-1 в человеческой сыворотке или плазме.
Мониторинг уровней VEGF-165 до лечения может быть показателем клинического результата после лечения мультикиназным ингибитором (например, Сорафенибом).
Одним из способов оценки клинического результата является оценка скорости реакции (СР), полной реакции (ПР), частичной реакции (ЧР), стабильного заболевания (СЗ), клинической пользы (включая полную реакцию (ПР), частичную реакцию (ЧР) и стабильное заболевание (СЗ)), время до прогрессирования заболевания (ВДПЗ), выживаемость без прогрессирования (ВБП) и общая выживаемость (ОВ).
Термин «антитело» в данном описании применяют в его широчайшем смысле, и более конкретно он охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител. Антитела, применяемые в способах в соответствии с данным изобретением, могут быть получены с применением обычной методологии и/или методами генной инженерии. Например, антитела в соответствии с данным изобретением включают антитела, которые связываются с VEGF-165.
"Фрагменты антител" включают часть полноразмерного антитела, обычно его антигенсвязывающий участок или вариабельный домен. Примеры фрагментов антитела включают Fab, Fab', F(ab')2 и Fv фрагменты; диатела; линейные антитела; одноцепочечные молекулы антител; биспецифические антитела; и мультиспецифические антитела, полученные из фрагментов антител.
Термин «моноклональное антитело» в данном описании относится к антителу, полученному из популяции по существу гомогенных антител, то есть отдельных антител, составляющих идентичную популяцию, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, то есть направлены против одного антигенного участка. Кроме того, в отличие от препаратов обычных (поликлональных) антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты антигена. Определение «моноклональное» указывает на характер антитела, как полученного из практически гомогенной популяции антител, и не должно истолковываться как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, применяемые в соответствии с данным изобретением, могут быть получены гибридомной технологией, впервые описанной Kohler, et al., (Nature 256: 495, 1975), или могут быть получены методами рекомбинантных ДНК (см., например, патент США №4816567). Моноклональные антитела также могут быть выделены из фаговых библиотек антител с применением методик, описанных, например, Clackson, et al., (Nature 352: 624-628,1991) и Marks, et al., (J. Mol. Biol. 222: 581-597, 1991).
Моноклональные антитела в данном описании также включают «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретных видов или принадлежащих к конкретному классу или подклассу антител, в то время как остаток цепи(ей) идентичен или гомологичен соответствующим последовательностям в антителах, полученных из других видов, или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они обладают желаемой биологической активностью (см., например, патент США №4816567; и Morrison, et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855, 1984).
"Гуманизированные" формы нечеловеческих (например, мышиных) антител представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. Большей частью гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентные антитела), в которых остатки гипервариабельных областей реципиента заменены остатками гипервариабельных областей из нечеловеческих видов (донорное антитело), таких как мыши, крысы, кролики или приматы кроме человека, обладающими желаемыми специфичностью, сродством и способностью. В некоторых случаях, остатки каркасной области (КО) человеческого иммуноглобулина могут быть заменены соответствующими нечеловеческими остатками. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются в реципиентном антителе или в донорном антителе. Такие модификации проводят для дальнейшего улучшения эффективности антитела. В общем, гуманизированное антитело может содержать практически все из, по меньшей мере, одного или, обычно, двух вариабельных доменов, в которых все или практически все из гипервариабельных областей соответствуют таковым в нечеловеческом иммуноглобулине, и все или практически все из КО являются таковыми из последовательности человеческого иммуноглобулина. Гуманизированное антитело при необходимости может также содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно человеческого иммуноглобулина. Обзор представлен в Jones, et al., (Nature 321:522-525, 1986); Reichmann, et al., (Nature 332:323-329,1988); и Presta, (Curr. Op. Struct. Biol. 2: 593-596, 1992).
"Одноцепочечные Fv" или "sFv" фрагменты антител содержат VH и VL домены антитела, где указанные домены присутствуют в единственной полипептидной цепи. Обычно Fv полипептид также включает полипептидный линкер между доменами VH и VL, который позволяет sFv образовывать желаемую структуру для связывания с антигеном. Обзор представлен в Pluckthun (The Pharmacology of Monoclonal Antibodies, Vol.113, Rosenburg and Moore eds. Springer-Veriag, New York, pp.269-315, 1994).
Термин "диатела" ("diabodies") относится к небольшим фрагментам антител с двумя антигенсвязывающими участками, где фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL). Благодаря применению линкера, который слишком короткий, чтобы позволить спаривание между двумя доменами на одной и той же цепи, домены вынуждены спариваться с комплементарными доменами другой цепи и образовывать два антигенсвязывающих участка. Диатела более подробно описаны, например, в ЕР 404097; WO 93/11161; и Hollinger, et al., (Proc. Natl. Acad. Sci. USA 90: 6444-6448, 1993).
Выражение «линейные антитела» относится к антителам, описанным у Zapata, et al., (Protein Eng. 8(10): 1057-1062, 1995). Коротко, такие антитела содержат пару тандемных Fd сегментов (VH-СH1-VH-СH1), которые образуют пару антигенсвязывающих участков. Линейные антитела могут быть биспецифическими или моноспецифическими.
Типовые моноклональные антитела, применяемые в соответствии с данным изобретением, включают мышиные моноклональные антитела против человеческого общего VEGF-165, такие как находятся в наборе для сэндвич-ELISA от Oncogene Sciences, предназначенные для измерения человеческого VEGF-165. Моноклональные антитела, применяемые в соответствии с данным изобретением, служат для идентификации белков VEGF-165 в различных лабораторных прогностических тестах, например в клинических образцах.
Общие источники, в которых описаны дополнительные молекулярные биологические методики, применяемые здесь, включая получение антител, включают Berger and Kimmel (Guide to Molecular Cloning Techniques, Methods in Enzymology, Vol.152, Academic Press, Inc.); Sambrook, et al., (Molecular Cloning: A Laboratory Manual, (Second Edition, Cold Spring Harbor Laboratory Press; Cold Spring Harbor, N.Y.; 1989) Vol.1-3); Current Protocols in Molecular Biology (F. M. Ausabel et al. [Eds.], Current Protocols, a joint venture between Green Publishing Associates, Inc. and John Wiley & Sons, Inc. (дополненные в 2000)); Harlow et al., (Monoclonal Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press (1988), Paul [Ed.]); Fundamental Immunology, (Lippincott Williams & Wilkins (1998)); и Harlow, et al., (Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press (1998)).
Антитела, применяемые в соответствии с данным изобретением для идентификации белков VEGF-165, могут быть помечены любым стандартным способом. Примером метки является пероксидаза хрена, и примером способа мечения антител является применение комплексов биотина-стрепавидина.
Подходящим образом, антитела, применяемые в иммуноанализах в соответствии с данным изобретением, которые применяют в качестве индикаторов, могут быть помечены любым способом, прямо или опосредовано, что дает сигнал, который может быть видим или воспроизведен визуально. Определяемые маркирующие вещества включают радионуклиды, такие как 3Н, 125I и 131I; флуоресцирующие вещества, такие как изотиоцианат флуоресцеина и другие флуорохромы, фикобилипротеины, фико-эритин, хелаты редкоземельных металлов, техасовый красный, дансил и родамин; колориметрические реагенты (хромогены); непрозрачные для электронов материалы (electron-opaque materials), такие как коллоидное золото; биолюминофоры; хемилюминофоры; красители; ферменты, такие как пероксидаза хрена, щелочные фосфатазы, глюкозооксидаза, глюкоза-6-фосфатдегидрогеназа, ацетилхолинэстераза, альфа-, бета-галактозидаза, среди прочих; коферменты; ферментные субстраты; ферментные кофакторы; ингибиторы ферментов; ферментные субъединицы; ионы металлов; свободные радикалы; или любые другие иммунологически активные или инертные вещества, которые обеспечивают средства для обнаружения или измерения присутствия или количества образованного иммунокомплекса. Примерами комбинаций ферментных субстратов являются пероксидаза хрена и тетраметилбензидин (ТМБ), и щелочные фосфатазы и паранитрофенилфосфат (пНФФ).
Другие системы обнаружения и количественного анализа в соответствии с данным изобретением дают люминесцентные сигналы, биолюминесцетные (БЛ) или хемилюминесцентные (ХЛ). В хемилюминесцентных (ХЛ) или биолюминесцетных (БЛ) анализах интенсивность общего светового излучения измеряют и соотносят с концентрацией неизвестного аналита. Свет может быть измерен количественно с применением люминометра (в качестве детектора фотоэлектронный умножитель) или на устройстве с зарядовой связью, или качественно с применением фотографической или рентгеновской пленки. Основными преимуществами применения таких анализов являются их простота и аналитическая чувствительность, позволяющая обнаружение и/или количественный анализ очень незначительных количеств аналита.
Примеры люминесцентных меток включают сложные эфиры акридиния, сульфонил-карбоксамиды акридиния, люминол, умбеллиферон, производные изолюминола, фотобелки, такие как экворин, и люциферазы светляков, морских бактерий, Vargulla и Renilla. Люминол может применяться при необходимости с молекулами усиливающего агента, такого как 4-йодфенол или 4-гидроксикоричная кислота. Обычно сигнал ХЛ получают обработкой окислителем в щелочных условиях.
Дополнительные люминесцентные системы обнаружения включают такие, в которых сигнал (обнаруживаемый маркер) производится ферментной реакцией на субстрате. Схемы определения ХЛ и БЛ разработаны для анализа меток в виде щелочных фосфатаз (ЩФ), глюкозооксидазы, глюкоза-6-фосфатдегидрогеназы, пероксидазы хрена (ПХ) и ксантиноксидазы, среди прочих. ЩФ и ПХ являются двумя ферментными метками, которые могут быть количественно определены с применением ряда реакций ХЛ и БЛ. Например, ЩФ может применяться с субстратом, таким как адамантил 1,2-диоксетанарил4юсфатный субстрат (например AMPPD или CSPD; Kricka, L.J., "Chemiluminescence and Bioluminescence, Analysis by, "Molecular Biology and Biotechnology: A Comprehensive Desk Reference (ed. R.A. Meyers) (VCH Publishers; N.Y., N.Y.; 1995)); например, динатриевая соль 4-метокси-4-(3-фосфатфенил)спиро[1,2-диоксетан-3,2'-адамантана], с или без молекулы усиливающего агента, такого как дихлорид 1-(триоктилфосфония метил)-4-(трибутлфосфония метил)бензола. ПХ может применяться с субстратами, такими как 2',3',6'-трифторфенилметокси-10-метилакридан-9-карбоксилат.
ХЛ и БЛ реакции могут быть адаптированы для анализа не только ферментов, но и других субстратов, кофакторов, ингибиторов, ионов металлов и подобных. Например, реакции люминола, люциферазы светляков и люциферазы морских бактерий являются индикаторными реакциями для вырабатывания или поглощения пероксида, АТФ и НАДФН соответственно. Они могут сочетаться с другими реакциями, включающими оксидазы, киназы и дегидрогеназы, и могут применяться для измерения любого компонента сопряженной реакции (фермента, субстрата, кофактора).
Обнаруживаемый маркер может быть прямо или опосредованно связан с антителом, применяемым в анализе в соответствии с данным изобретением. Примером опосредованной связи обнаруживаемой метки является применение связующей пары между антителом и маркером, или применение системы усиления сигнала.
Примеры связующих пар, которые могут применяться для связи антител с обнаруживаемыми маркерами, включают биотин/авидин, стрептавидин или антитела против биотина; авидин/антитела против авидина; тироксин/тироксин-связывающий глобулин; антиген/антитело; антитело/антиантитело; углевод/лектины; гаптен/антигаптеновое антитело; красители и гидрофобные молекулы/гидрофобные связывающие участки белка; ферментный ингибитор, кофермент или кофактор/фермент; полинуклеиновая кислота/гомологичная последовательность полинуклеиновой кислоты; флуоресцеин/антитела против флуоресцеина; динитрофенол/антитела против динитрофенола; витамин В 12/внутренний фактор; кортизон, кортизол/кортизол-связывающий белок; и лиганды для специфического белка рецептора/специфические белки рецептора, связанные с мембраной.
Различные методы связывания меток, прямо или опосредованно, с антителами известны в данной области техники. Например, метки могут быть связаны либо ковалентно, либо нековалентно. Примеры методов конъюгации антитела описаны в Avarmeas, et al.. Scan. J. Immunol. 8 (Suppl.7): 7, 1978); Bayer, et al., Meth. Enzymol. 62: 308. 1979; Chandler, et al., J. Immunol. Meth. 53: 187. 1982; Ekeke and Abuknesha, J. Steroid Biochem. 11: 1579, 1979; Engvall and Perlmann, J. Immunol. 109: 129, 1972; Geoghegan, et al., Immunol. Comm. 7:1, 1978; и Wilson and Nakane, Immunofluorescence and Related Techniques, Elsevier/North Holland Biomedical Press; Amsterdam (1978).
В зависимости от природы метки различные методики могут применяться для обнаружения и количественного анализа метки. Для флуоресцирующих веществ применяется множество флуорометров. Для хемилюминофоров применяются люминометры или пленки. Для ферментов флуоресцентный, хемилюминесцентный или окрашенный продукт может быть определен или измерен флуорометрически, люмино-метрически, спектрофотометрически или визуально.
Различные типы хемилюминесцентных соединений, имеющие акридиниевый, бен-закридиниевый или акридановый тип гетероциклических кольцевых систем, являются другими примерами меток. Примеры сложных эфиров акридиния включают соединения, имеющие гетероциклические кольца или кольцевые системы, которые содержат гетероатом в положительной степени окисления, включая такие кольцевые системы, как катион акридиния, бенз[а]акридиния, бенз[b]акридиния, бенз[с]акридиния, бензимидазола, хинолиния, изохинолиния, хинолизиния, циклического замещенного хинолиния, фенантридиния и хиноксалиния.
Индикатор может быть получен присоединением к выбранному антителу, прямо или опосредованно, реакционно-способной функциональной группы, присутствующей в сложном эфире акридиния или бензакридиния, как хорошо известно специалистам в данной области техники (см., например. Weeks, et al., Clin. Chem. 29 (8): 1474-1479, 1983). Примеры соединений включают сложные эфиры акридиния и бензакридиния с уходящей арильной кольцевой группой и реакционно-способной функциональной группой, находящейся либо в пара-, либо в метаположении арильного кольца (см., например, патент США №4745181 и WO 94/21823).
В данном описании «направленные на путь VEGF терапии» включают любые терапии, которые нацелены на путь VEGF, включая ингибирование экспрессии белка VEGF (например, антисмысловые олигонуклеотиды), предупреждение мембранной локализации, существенной для активации VEGFR, или ингибирование следующих далее эффекторов VEGFR (например, Rafcерин/треонинкиназы). Направленные на путь VEGF терапии включают мультикиназные ингибиторы, тирозинкиназные ингибиторы, моноклональные антитела и бис-арилмочевины.
Примером ингибитора киназы является бис-арилмочевина Сорафениб, низкомолекулярный и новый ингибитор двойного действия как Raf (протеин-серин/треонинкиназа), так и VEGFR (рецептор сосудистого эндотелиального фактора роста, рецепторная тирозинкиназа), и, следовательно, ингибитор и пролиферации опухолевых клеток, и ангиогенеза (Onyx Pharmaceuticals, Richmond, СА, и Вауеr Pharmaceuticals Corporation, West Haven, CT (USA); Lyons, et al., Endocrine-Related Cancer 8: 219-225, 2001). Кроме того, было обнаружено, что Сорафениб ингибирует некоторые другие рецепторные тирозинкиназы, вовлеченные в развитие опухоли и неоваскуляризацию, включая PDGFR-β, Flt-3 и c-KIT. PD 166285 (Pfizer, Groton, CT), общий тирозинкиназный ингибитор, может вызывать противодействие и PDGF, и FGF-2-опосредованным ответам (Bansai, et al., J. Neuroscience Res.74 (4): 486-493, 2003).
Другие примеры терапий, которые направлены на путь VEGF, включают: Сутент/SUl 1248, РТК 787, MLN518, РКС-412, CDP860 и XL9999. Сутент/SUl1248 (сунитиниб малат; индолин-2-он) (Pfizer, Groton, CT) направлен на рецепторную тиро-зинкиназу (РТК), включая PDGFR, с антиангиогенным и противоопухолевым действием. PDGFR играет значительную роль в ангиогенезе через регулирование пролиферации и миграции перицитов, клеток, которые поддерживают кровеносные сосуды и полагают, что Сутент/SU11248 ингибирует ангиогенное действие PDGFR.
РТК 787 (Novartis, Basel, Switzerland and Schering AG, Berlin, Germany) представляет собой пероральный низкомолекулярный антиангиогенезный агент (анилинофталазин), активный против PDGFR, а также против VEGFR и c-Kit тирозинкиназных рецепторов (см., например, Garcia-Echevera and Fabbro, Mini Reviews in Medicinal Chemistry 4(3):273-283, 2004).
MLN518 (ранее известный как СТ53518; Millenium Pharmaceuticals, Cambridge, MA) представляет собой пероральное низкомолекулярное соединение, созданное для ин-гибирования III типа рецепторных тирозинкиназ (РТК), включая PDGFR, FLT3 и с-Kit.
РКС-412 [мидостаурин; N-бензоилстауроспорин (производное стауроспорина, продукта бактерий Streptomyces); Novartis, Basel, Switzerland) ингибирует PDGFR, VEGF-165R и многочисленные протеинкиназы С, "что делает его особенно привлекательным для пациентов, имеющих дикий тип KIT с мутациями в PDGFR" (РКС 412-An Interview with Charles Blanke, MD, FACP (www.gistsupport.org/pkc412.html); см. также Reichardt, et al., J. Clin. Oncol. 23 (16S): 3016, 2005).
XL999 (один из нескольких Spectrum Selective Kinase Inhibitors™ (SSKI) от Exelixis (South San Francisco, CA, USA) ингибирует VEGF-165R, а также другие РТК, такие как PDGFR-бета, FGFR1 и FLT3.
ПРИМЕРЫ
Структуры, материалы, композиции и способы, описанные здесь, являются типовыми примерами данного изобретения, и необходимо понимать, что объем данного изобретения не ограничен объемом примеров. Специалисты в данной области техники поймут, что данное изобретение может осуществляться с вариациями описанных структур, материалов, композиций и способов, и такие вариации предполагаются включенными в объем данного изобретения.
Пример 1. Твердофазный микротитровальный сэндвич-ELISA препаратов образцов человеческой сыворотки и плазмы
Подходящие образцы для анализа VEGF-165 ELISA включают человеческую плазму, обработанную гепарином, цитратом или ЭДТК, и человеческую сыворотку. Из-за возможных мешающих факторов, особое внимание должно уделяться приготовлению и анализу человеческой сыворотки и плазмы. Любой коагулирующий материал должен быть удален из образцов микроцентрифугированием до разведения. Исходная концентрация исследуемого образца сыворотки или плазмы должна быть около 12-13% (1:8 разведение образца в разбавителе образца). Например, 40 мкл образца могут быть разведены в 280 мкл разбавителя образца, и 100 мкл добавляют в лунки микропланшета.
Методика анализа
Следующий протокол ELISA применяют для сэндвич-ELISA (Oncogene Science, Cambridge, MA) для измерения человеческого VEGF-164 в человеческой плазме или сыворотке.
1. Получить рабочий раствор (IX) Platewash (предоставляется как часть набора для анализа).
2. Добавить предварительно разведенные образцы и контроль, и каждый из шести стандартов растворимого VEGF-165 (от 0 до 8000 пг/мл) в двух экземплярах пипеткой по 100 мкл в соответствующие лунки с применением чистых наконечников для пипеток для каждого образца и стандарта. Добавить стандарт 0 в одну дополнительную лунку, которая будет использоваться для определения контрольной пробы субстрата.
3. Накрыть лунки чистой пластиковой оберткой или приспособлением для заклеивания планшетов. Инкубировать микротитровальный планшет в течение 1,5 часов при температуре 37°С.
4. Осторожно удалить пластиковую обертку или приспособление для заклеивания планшетов. Промыть лунки с применением 300 мкл на лунку буфера Platewash (промывать три цикла, повернуть планшет на 180° и промывать еще три цикла).
5. Пипеткой добавить 100 мкл детекторного антитела во все лунки за исключением лунки с контрольной пробой субстрата, которую оставляют пустой. Накрыть лунки новым куском пластиковой обертки. Инкубировать микротитровальный планшет в течение 1 часа при температуре 37°С.
6. Приготовить рабочий конъюгат разведением подходящего объема концентрата конъюгата (разбавление 1:50) в разбавителе для конъюгата.
7. Промыть лунки как на стадии 4. Сразу же перейти к стадии 8.
8. Пипеткой добавить 100 мкл рабочего конъюгата во все лунки за исключением лунки с контрольной пробой субстрата, которую оставляют пустой. Накрыть лунки новым куском пластиковой обертки. Инкубировать микротитровальный планшет при комнатной температуре (20-27°С) в течение 1 часа.
9. Приготовить рабочий субстрат комбинированием равных частей раствора А и раствора В. Шесть мл каждого раствора субстрата дадут 12 мл рабочего субстрата, достаточные для обработки одного микротитровального планшета. Довести объем рабочего субстрата на основе количества применяемых стрипов. Тщательно перемешивать.
10. Распределить рабочий субстрат в кювете с чистым реагентом и довести до комнатной температуры.
11. Промыть лунки как на стадии 5. ВНИМАНИЕ: не позволяйте планшетам высохнуть. Сразу же перейти к стадии 12.
12. Пипеткой добавить 100 мкл рабочего субстрата во все лунки и накрыть планшет пластиковой оберткой или приспособлением для заклеивания планшетов. Инкубировать микротитровальный планшет при комнатной температуре (20-27°С) в течение 45 минут.
13. Пипеткой добавить 100 мкл стопреагента во все лунки.
14. Измерить оптическую плотность в каждой лунке с применением спектрофотометрического планшет-ридера при длине волны 650 нм. Лунки необходимо считывать в течение 30 минут после добавления стопреагента.
Стандартные кривые
Количественный анализ проводят построением стандартной кривой с применением стандарта VEGF-165 (рекомбинантного человеческого VEGF-165) в 6 различных концентрациях 0, 150, 1000, 3000, 5000 и 8000 пг/мл.
Образцы человеческой сыворотки и плазмы
Замороженные образцы плазмы получают у пациентов с подтвержденным немелко-клеточным раком легких до лечения Сорафенибом.
Пример 2. Плазма пациентов, страдающих немелкоклеточной карциномой легких
Двойные образцы применяют для измерения уровня VEGF-165 с применением Oncogene Science VEGF-165 ELISA (Oncogene Science, Cambridge; MA) согласно инструкциям производителя. Среднее значение для двух измерений определяют для каждого пациента. Средний уровень VEGF-165 для 31 пациента в данном анализе представлен в таблице 1. В таблице 2 показано среднее уменьшение опухоли, измеренное радиологически, у соответствующей группы пациентов. Результаты показывают, что средний уровень VEGF-165 у пациентов, которые затем в ответ на лечение Сорафенибом показали стабильное заболевание, составляет 67,9 пг/мл. Пациенты, которые показывают прогрессирующее заболевание, несмотря на лечение Сорафенибом, имели средний уровень VEGF-165 227,2 пг/мл. Пациенты, демонстрирующие стабильное заболевание, имели среднее уменьшение опухоли на 5,1%, а пациенты с прогрессирующим заболеванием имели средний рост опухоли на 20,6%. Эти результаты представлены графически на Фиг.1 и 2.
Описание представленного выше варианта осуществления данного изобретения представлено с целью иллюстрации и описания. Оно не является исчерпывающим и не ограничивает данное изобретение до конкретной описанной формы, и множество возможных модификаций и вариаций очевидны в свете представленного описания. Варианты осуществления выбраны и описаны для того, чтобы объяснить принцип данного изобретения и его практическое применение, что позволит другим специалистам в данной области техники применять изобретение в различных вариантах осуществления и с различными модификациями, необходимыми для конкретного предполагаемого применения. Все упомянутые здесь ссылки включены посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ И ДИАГНОСТИКИ РЕЗИСТЕНТНОГО К ХИМИОТЕРАПИИ РАКА | 2015 |
|
RU2710735C2 |
| БИОМАРКЕРЫ В ПЛАЗМЕ КРОВИ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ КОМБИНИРОВАННЫХ ТЕРАПИЙ С ИСПОЛЬЗОВАНИЕМ БЕВАЦИЗУМАБА ПРИ ЛЕЧЕНИИ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 2011 |
|
RU2582964C2 |
| ЛЕЧЕНИЕ РАКА | 2015 |
|
RU2651469C1 |
| БИОМАРКЕРЫ ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ, ВКЛЮЧАЮЩЕЙ ЛЕНВАТИНИБ И ЭВЕРОЛИМУС | 2016 |
|
RU2745060C2 |
| БИОМАРКЕРЫ НА ОСНОВЕ ОПУХОЛЕВОЙ ТКАНИ ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ БЕВАЦИЗУМАБОМ | 2011 |
|
RU2605282C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ БОЛЬНЫХ РАКОМ ЛЕГКОГО | 2011 |
|
RU2526120C2 |
| ВЫБОР ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ТЕРАПИИ РАКА ЛЕГКИХ С ПОМОЩЬЮ МАТРИЦ НА ОСНОВЕ АНТИТЕЛ | 2008 |
|
RU2519647C2 |
| БИОМАРКЕР ДЛЯ ПРОГНОЗИРОВАНИЯ И ОЦЕНКИ ЧУВСТВИТЕЛЬНОСТИ СУБЪЕКТОВ С РАКОМ ЭНДОМЕТРИЯ К СОЕДИНЕНИЯМ ЛЕНВАТИНИБА | 2014 |
|
RU2658601C2 |
| СПОСОБЫ ДИАГНОСТИКИ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2666627C2 |
| АНТИ-VEGF/DLL4-ИММУНОГЛОБУЛИНЫ С ДВОЙНЫМИ ВАРИАБЕЛЬНЫМИ ДОМЕНАМИ И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2636043C2 |

Данное изобретение относится к области медицины, в частности к биомаркерам и применению биомаркеров для прогнозирования рака, а также применению биомаркеров для мониторинга эффективности противораковой терапии. Более конкретно данное изобретение относится к применению VEGF-165 в качестве биомаркера для мультикиназных ингибиторов. Проводят иммунологическое обнаружение и количественный анализ последовательных изменений уровней белка VEGF-165 в полученных у пациента образцах, взятых с течением времени, где увеличивающиеся уровни белка VEGF-165 с течением времени указывают на развитие болезни или отрицательную реакцию на указанную терапию и где снижающиеся уровни белка VEGF-165 с течением времени указывают на ремиссию болезни или положительную реакцию на указанную терапию. Способ позволяет провести неинвазивный анализ уровней циркулирующего VEGF-165, который служит ценным прогностическим индикатором результата заболевания. 3 н. и 19 з.п. ф-лы, 2 ил., 2 табл.
1. Способ мониторинга состояния заболевания, связанного с путем VEGF-165, активированным либо чрезмерной экспрессией, либо мутацией белка VEGF-165 у пациента, и/или мониторинга того, как пациент с указанным заболеванием реагирует на терапию, предусматривающий иммунологическое обнаружение и количественный анализ последовательных изменений уровней белка VEGF-165 в полученных у пациента образцах, взятых с течением времени, где увеличивающиеся уровни белка VEGF-165 с течением времени указывают на развитие болезни или отрицательную реакцию на указанную терапию и где снижающиеся уровни белка VEGF-165 с течением времени указывают на ремиссию болезни или положительную реакцию на указанную терапию.
2. Способ по п.1, где указанную терапию выбирают из мультикиназных ингибиторов, тирозинкиназных ингибиторов, моноклональных антител и бис-арилмочевин.
3. Способ по п.1, где указанной терапией является направленная на путь VEGF-165 терапия.
4. Способ по п.3, где указанной направленной на путь VEGF-165 терапией является тирозинкиназный ингибитор иматиниб мезилат или бис-арилмочевина Сорафениб.
5. Способ по п.1, где указанные взятые у пациента образцы представляет собой жидкость организма, выбранную из группы, включающей кровь, сыворотку, плазму, мочу, слюну, семенную жидкость, экссудат из молочной железы, спинномозговую жидкость, слезу, мокроту, слизь, лимфу, цитозоли, асциты, плевральные выпоты, околоплодные воды, промывочные жидкости мочевого пузыря и бронхоальвеолярные лаважи.
6. Способ по п.5, где указанной жидкостью организма является сыворотка или плазма.
7. Способ по п.1, где указанное иммунологическое обнаружение и количественный анализ проводят с применением иммуноанализа в виде сэндвич-ELISA или эквивалентного анализа.
8. Способ по п.7, где сэндвич-ELISA или эквивалентный анализ предусматривает применение одного или более моноклональных антител, которые селективно связывают белок VEGF-165.
9. Способ выбора терапии для человека-пациента, страдающего заболеванием, предусматривающий:
(a) иммунологическое обнаружение и количественный анализ среднего уровня белка VEGF-165 в контрольных образцах, взятых у индивидуумов контрольной группы;
(b) иммунологическое обнаружение и количественный анализ последовательных изменений уровней белка VEGF-165 в эквивалентных взятых у пациента образцах, полученных у пациента с течением времени;
(c) сравнение уровней белка VEGF-165 во взятых у пациента образцах со средним уровнем белка VEGF-165 в контрольных образцах и
(d) определение необходимости применения обычной терапии и/или терапии, направленной на путь VEGF-165, активированный либо чрезмерной экспрессией, либо мутацией белка VEGF-165, для лечения пациента на основании разницы между уровнями белка VEGF-165 в полученных у пациента образцах и средним уровнем белка VEGF-165 в контрольных образцах и учитывая последовательные изменения уровней белка VEGF-165 в полученных у пациента образцах.
10. Способ по п.9, в котором взятые у пациента образцы получают у пациента, страдающего раком, у которого отсутствует реакция на лечение.
11. Диагностический способ обнаружения заболевания, связанного с путем VEGF-165, активированный либо чрезмерной экспрессией, либо мутацией белка VEGF-165, у пациента, предусматривающий:
(a) иммунологическое обнаружение и количественный анализ среднего уровня белка VEGF-165 в контрольных образцах, взятых у индивидуумов из контрольной группы;
(b) иммунологическое обнаружение и количественный анализ последовательных изменений белка VEGF-165 в эквивалентных взятых у пациента образцах с течением времени и
(c) сравнение уровней белка VEGF-165 в полученных у пациента образцах со средним уровнем белка VEGF-165 в контрольных образцах;
где уровень белка VEGF-165 в полученных у пациента образцах, превышающий средний уровень белка VEGF-165 в контрольных образцах, является показателем активированного VEGF-165 пути и присутствия заболевания, связанного с активированным путем VEGF-165, у пациента.
12. Способ по п.11, где указанные стадии (а) и (b) иммунологического обнаружения и количественного анализа проводят с применением иммуноанализа в виде сэндвич-ELISA или эквивалентного анализа.
13. Способ по любому из пп.1, 9 и 11, который также является прогностическим для указанного заболевания, где указанные уровни белка VEGF-165 во взятых у пациента образцах являются показателем лучшего или худшего прогноза для указанного пациента.
14. Способ по п.13, где указанным прогнозом является клинический результат, выбранный из группы, включающей: скорость реакции (СР), полную реакцию (ПР), частичную реакцию (ЧР), стабильное заболевание (СЗ), время до прогрессирования заболевания (ВДПЗ), выживаемость без прогрессирования (ВБП), общую выживаемость (OВ) и клиническую пользу, которая включает полную реакцию (ПР), частичную реакцию (ЧР) и стабильное заболевание (СЗ).
15. Способ по п.13, где повышение уровней VEGF-165 является показателем большей вероятности раннего рецидива или метастазов.
16. Способ по любому из пп.1,9 или 11, где указанным заболеванием является пренеопластическое/неопластическое заболевание.
17. Способ по п.16, где указанное пренеопластическое/неопластическое заболевание выбирают из группы, состоящей из метастатической медуллобластомы, желудочно-кишечных стромальных опухолей, дерматофибросаркомы выбухающей, рака прямой и ободочной кишок, рака толстой кишки, рака легких, немелкоклеточного рака легких, мелкоклеточного рака легких, хронических миелопролиферативных заболеваний, острой миелогенной лейкемии, рака щитовидной железы, рака поджелудочной железы, рака мочевого пузыря, рака почек, меланомы, рака молочных желез, рака простаты, рака яичников, рака шейки матки, рака головы и шеи, опухолей мозга, гепатоцеллюлярной карциномы, гематологических злокачественных образований и предраковых состояний, ведущих к указанным выше раковым заболеваниям.
18. Способ по любому из пп.1,9 или 11, также предусматривающий применение иммуноанализа для обнаружения или обнаружения и количественного анализа уровней одного или более других белков во взятых у пациента образцах.
19. Способ по п.18, где указанным другим белком является или указанные другие белки выбирают из группы, состоящей из ингибиторов, онкобелков, рецепторов факторов роста, ангиогенных факторов, метастатических белков, опухолевых маркеров и опухолевых супрессоров.
20. Способ по п.19, где указанным ингибитором является тканевый ингибитор металлопротеиназы-1 (TIMP-1), указанные онкобелки выбирают из группы, состоящей из HER-2/neu и ras p21, указанные рецепторы факторов роста выбирают из группы, состоящей из рецептора эпидермального фактора роста (EGFR) и альфа-рецептора тромбоцитарного фактора роста (PDGFR-α), указанным ангиогенным фактором является сосудистый эндотелиальный фактор роста (VEGF), указанным метастатическим белком является активатор плазминогена урокиназного типа (uРА), указанным опухолевым маркером является карциноэмбриональный антиген (СЕА) и указанным опухолевым супрессором является р53.
21. Способ по пп.9 и 11, где указанные взятые у пациента образцы представляет собой жидкость организма, выбранную из группы, включающей кровь, сыворотку, плазму, мочу, слюну, семенную жидкость, экссудат из молочной железы, спинномозговую жидкость, слезу, мокроту, слизь, лимфу, цитозоли, асциты, плевральные выпоты, околоплодные воды, промывочные жидкости мочевого пузыря и бронхоальвеолярные лаважи.
22. Способ по пп.9 и 11, где указанной жидкостью организма является сыворотка или плазма.
| US 6635421 B1, 21.10.2003 | |||
| GOTTFRIED E | |||
| KONECNY et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| НОВАК О.Э | |||
| и др | |||
| Ангогенез у розитку злоякiсних пухлин: теоретичнi i практичнi аспекти | |||
| Онкология | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
Авторы
Даты
2010-07-20—Публикация
2006-10-20—Подача