Перекрестная ссылка на родственные заявки
Эта заявка претендует на приоритет предварительной заявки на патент США № 61/823034, поданной 14 мая 2013 года, раскрытие которой включено в данный документ с помощью ссылки во всей своей полноте.
Область техники
Настоящее изобретение в целом относится к биомаркерам и раку эндометрия.
Предшествующий уровень техники
Ряд ингибиторов киназ был разработан в качестве противоопухолевых средств. Например, группа соединений, имеющих ингибирующую активность против рецепторных тирозинкиназ, таких как рецептор фактора роста эндотелия сосудов (VEGFR), как известно, ингибирует ангиогенез и рассматривается как новый класс противоопухолевых средств. Ленватиниба мезилат (также известный как E7080) является пероральным ингибитором тирозинкиназ, направленным на VEGFR1-3, рецептор фактора роста фибробластов (FGFR) 1-4, реаранжированный во время трансфекции рецептор (RET), KIT и рецептор тромбоцитарного фактора роста (PDGFR). В фазе I клинических исследований ленватиниба мезилата ответ на лечение наблюдали в различных типах опухолей, например, при различных формах рака эндометрия.
К сожалению, большинство методов противоопухолевого лечения связано с нежелательными побочными эффектами, такими как сильная тошнота, рвота или тяжелая усталость. Кроме того, хотя методы противоопухолевого лечения были успешными, они не вызывают значимых клинических ответов у всех пациентов, которые их получали, приводя к нежелательным побочным эффектам, задержкам и расходам, связанным с неэффективным лечением. Таким образом, биомаркеры, которые можно использовать для прогнозирования ответа субъекта на противоопухолевое средство до его введения, являются крайне необходимыми.
В WO 2012/157672 раскрыто, что в подгруппе пациентов с меланомой, имеющих либо B-raf дикого типа и PTEN, или мутированные B-raf и PTEN, высокие уровни Ang2, IL6, CXCR4, COL4A3, MEIS1, FGF9, FGFR1, FGFR2, FGFR3, FGFR4 или VEGFR1 и низкие уровни SHC1, NRP2, ARHGAP22, SCG2 или PML являются прогностическими относительно чувствительности к соединениям ленватиниба.
В WO 2012/166899 раскрыто, что у субъектов, имеющих рак щитовидной железы или почки, низкие уровни Ang2, VEGFA, IFNG или растворимого KDR или высокие уровни IL-6, IL-13, PDGFAB, CSF3, CCL3, CCL4, FLT4 или FGF2 являются прогностическими относительно чувствительности к соединениям ленватиниба. Однако в WO 2012/166899 не раскрыто или не предложено, что Ang2 можно использовать как прогностический фактор относительно чувствительности к соединениям ленватиниба у пациентов с раком эндометрия.
Llovet и соавт. Clin. Cancer Res., 18(8):2290-2300 (2012) сообщают, что у пациентов с распространенной гепатоцеллюлярной карциномой в то время, как биомаркеры ангиогенеза Ang2 и VEGF являлись прогностическими относительно выживаемости, эти биомаркеры не являлись прогностическими относительно чувствительности к ингибитору ангиогенеза сорафенибу.
Таким образом, биомаркер ангиогенеза, такой как Ang2, не предполагается для использования в качестве биомаркера чувствительности к ингибиторам ангиогенеза при всех формах рака.
Краткое описание изобретения
Настоящая заявка основана, по меньшей мере частично, на идентификации биомаркеров, которые являются прогностическими относительно чувствительности субъекта с раком эндометрия к терапии, включающей ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат). Уровень экспрессии определенных генов (например, белков и иРНК генов, перечисленных в Таблице 1) до лечения идентифицируют в качестве полезного прогностического фактора чувствительности (например, выживаемости и/или ответа опухоли) к терапии, включающей ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат). Таким образом, биомаркеры и композиции, описанные в данном документе, являются полезными, например, для идентификации, стратификации и/или отбора пациента или подгруппы пациентов, имеющих рак эндометрия, которые могут иметь пользу от лечения с ленватинибом или его фармацевтически приемлемой солью (например, ленватиниба мезилатом). Кроме того, способы, описанные в данном документе, пригодны, например, при выборе подходящих терапевтических средств (например, терапии, включающей ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат) или альтернативной терапии рака эндометрия) для субъекта, страдающего от, предположительно имеющего или с риском развития рака эндометрия.
В одном аспекте настоящее раскрытие обеспечивает способ прогнозирования ответа субъекта, имеющего, предположительно имеющего, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль. Способ включает количественный анализ биологического образца, полученного от субъекта, и определение того, что концентрация белка Ang2 в биологическом образце является низкой по сравнению с контролем. Субъекта, имеющего низкую концентрацию белка Ang2 в биологическом образце, идентифицируют как склонного отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль.
Кроме того, настоящее раскрытие обеспечивает способ прогнозирования ответа субъекта, имеющего, предположительно имеющего, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль. Способ включает количественный анализ биологического образца, полученного от субъекта, и определение того, что концентрация белка HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA в биологическом образце является низкой по сравнению с контролем. Субъекта, имеющего низкую концентрацию белка HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA в биологическом образце, идентифицируют как склонного отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль.
Во втором аспекте настоящее раскрытие обеспечивает способ прогнозирования ответа субъекта, имеющего, предположительно имеющего, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль. Способ включает количественный анализ биологического образца, полученного от субъекта, и определение того, что концентрация белка Ang2 в биологическом образце является высокой по сравнению с контролем. Субъекта, имеющего высокую концентрацию белка Ang2 в биологическом образце, идентифицируют как не склонного отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль.
Кроме того, настоящее раскрытие обеспечивает способ прогнозирования ответа субъекта, имеющего, предположительно имеющего, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль. Способ включает количественный анализ биологического образца, полученного от субъекта, и определение того, что концентрация белка HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA в биологическом образце является высокой по сравнению с контролем. Субъекта, имеющего высокую концентрацию белка HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA в биологическом образце, идентифицируют как не склонного отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль.
В третьем аспекте настоящее раскрытие обеспечивает способ отбора субъекта, имеющего, предположительно имеющего, или с риском развития рака эндометрия, для терапии, включающей ленватиниб или его фармацевтически приемлемую соль. Данный способ включает количественный анализ биологического образца, полученного от человека, и определение того, что концентрация белка Ang2 в биологическом образце является низкой по сравнению с контролем. Способ дополнительно включает в себя отбор человека, имеющего низкую концентрацию белка Ang2 в биологическом образце, для терапии, включающей ленватиниб или его фармацевтически приемлемую соль.
Кроме того, настоящее раскрытие обеспечивает способ отбора субъекта, имеющего, предположительно имеющего, или с риском развития рака эндометрия, для терапии, включающей ленватиниб или его фармацевтически приемлемую соль. Данный способ включает количественный анализ биологического образца, полученного от человека, и определение того, что концентрация белка HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA в биологическом образце является низкой по сравнению с контролем. Способ дополнительно включает в себя отбор человека, имеющего низкую концентрацию белка HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA в биологическом образце, для терапии, включающей ленватиниб или его фармацевтически приемлемую соль.
В четвертом аспекте настоящее раскрытие обеспечивает способ лечения рака эндометрия. Способ включает предоставление биологического образца, полученного от субъекта, который имеет рак эндометрия; измерение в биологическом образце уровня экспрессии белка Ang2, который является низким по сравнению с контролем; и введение указанному субъекту терапевтически эффективного количества ленватиниба или его фармацевтически приемлемой соли.
Кроме того, способ включает предоставление биологического образца, полученного от субъекта, который имеет рак эндометрия; измерение в биологическом образце уровня экспрессии белка HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA, который является низким по сравнению с контролем; и введение указанному субъекту терапевтически эффективного количества ленватиниба или его фармацевтически приемлемой соли.
В пятом аспекте настоящее раскрытие обеспечивает способ лечения рака эндометрия. Способ включает введение субъекту, который имеет рак эндометрия, терапевтически эффективного количества ленватиниба или его фармацевтически приемлемой соли, где субъект был идентифицирован как имеющий уровень экспрессии белка Ang2, который является низким по сравнению с контролем. В определенных вариантах осуществления субъект был идентифицирован как имеющий низкую концентрацию белка Ang2 в биологическом образце, полученном от человека.
Кроме того, способ включает введение субъекту, который имеет рак эндометрия, терапевтически эффективного количества ленватиниба или его фармацевтически приемлемой соли, где субъект был идентифицирован как имеющий уровень экспрессии белка HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA, который является низким по сравнению с контролем. В определенных вариантах осуществления субъект был идентифицирован как имеющий низкую концентрацию белка HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA в биологическом образце, полученном от человека.
Следующие варианты осуществления предусмотрены для всех указанных выше аспектов.
В одном варианте осуществления ленватиниб или его фармацевтически приемлемая соль представляет собой ленватиниба мезилат.
В одном варианте осуществления рак эндометрия представляет собой распространенный рак эндометрия. В другом варианте осуществления рак эндометрия представляет собой рецидивирующий рак эндометрия. В одном варианте осуществления рак эндометрия представляет собой рак эндометрия III стадии. В одном варианте осуществления рак эндометрия представляет собой рак эндометрия IV стадии. В одном варианте осуществления рак эндометрия представляет собой неоперабельную форму рака эндометрия стадии III или стадии IV.
В некоторых вариантах осуществления биологический образец выбран из группы, состоящей из образца крови, образца сыворотки, образца плазмы, образца жидкости матки, образца мочи, архивного образца опухоли эндометрия и образца биопсии эндометрия.
В некоторых вариантах осуществления контроль представляет собой предварительно установленное пороговое значение. В одном варианте осуществления предварительно установленное пороговое значение представляет собой концентрацию белка Ang2, которую определили на основании анализа характеристических кривых обнаружения (ROC), прогнозируя ответ опухоли с более высокой положительной прогностической ценностью по сравнению с отсутствием порога, и где концентрация белка Ang2, равная или ниже предварительно установленного порогового значения, является низкой концентрацией Ang2, и значение выше, чем предварительно установленное пороговое значение, является высокой концентрацией Ang2. Ответ опухоли представляет собой частоту объективных ответов (ORR), частоту клинической эффективности (CBR) или % максимального уменьшения размеров опухоли. В другом варианте осуществления предварительно установленное пороговое значение представляет собой концентрацию белка Ang2, которая определена на основе имитационных моделей прогнозирования выживаемости, где концентрация белка Ang2, равная или ниже предварительно установленного порогового значения, является низкой концентрацией Ang2, и значение выше, чем предварительно установленное пороговое значение, является высокой концентрацией Ang2. В этом контексте выживаемость представляет собой выживаемость без прогрессирования заболевания (PFS) или общую выживаемость (OS). В специфическом варианте осуществления предварительно установленное пороговое значение представляет собой концентрацию белка Ang2, которая находится в пределах от 1866,5 до 6024,5 (например, 2082,5 пг/мл), и где концентрация белка Ang2, равная или ниже предварительно установленного порогового значения, является низкой концентрацией Ang2, и значение выше, чем предварительно установленное пороговое значение, является высокой концентрацией Ang2.
В некоторых вариантах осуществления способ дополнительно включает в себя передачу результатов тестирования субъекта поставщику медицинских услуг. В определенных вариантах осуществления способ дополнительно включает в себя корректирование медицинской карты субъекта с указанием того, что субъект склонен или не склонен ответить на терапию, включающую ленватиниб или его фармацевтически приемлемую соль. В конкретных вариантах осуществления запись создают на машиночитаемом носителе. В определенных вариантах осуществления способ дополнительно включает в себя предписание терапии, включающей ленватиниб или его фармацевтически приемлемую соль, субъекту, если профиль экспрессии биомаркеров прогнозирует то, что субъект будет отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль. В определенных вариантах осуществления способ дополнительно включает в себя предписание терапии, не включающей ленватиниб или его фармацевтически приемлемую соль, субъекту, если профиль экспрессии биомаркеров прогнозирует то, что субъект не будет отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль. В некоторых вариантах осуществления способ дополнительно включает в себя введение субъекту терапии, включающей ленватиниб или его фармацевтически приемлемую соль, если профиль экспрессии биомаркеров прогнозирует то, что субъект будет отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль. В некоторых вариантах осуществления способ дополнительно включает в себя введение субъекту терапии, которая не включает ленватиниб или его фармацевтически приемлемую соль, если профиль экспрессии биомаркеров прогнозирует то, что субъект не будет отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль.
В одном варианте осуществления концентрацию белка измеряют иммунологическим способом. В некоторых вариантах осуществления иммунологический способ выбран из группы, состоящей из иммуноферментного анализа, радиоиммунологического анализа, хемилюминесцентного иммунологического анализа, электрохемилюминесцентного иммунологического анализа, латексного турбидиметрического иммунологического анализа, латексного фотометрического иммунологического анализа, иммунохроматографического анализа и вестерн-блоттинга. В другом варианте осуществления концентрацию белка измеряют с помощью масс-спектрометрии.
В шестом аспекте данное изобретение обеспечивает ленватиниб или его фармацевтически приемлемую соль для применения в лечении рака эндометрия у человека, где человека идентифицируют с помощью способов, описанных выше, как субъекта, который склонен отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль. В некоторых вариантах осуществления фармацевтически приемлемая соль ленватиниба представляет собой ленватиниба мезилат. В одном варианте осуществления рак эндометрия представляет собой распространенный рак эндометрия. В другом варианте осуществления рак эндометрия представляет собой рецидивирующий рак эндометрия. В одном варианте осуществления рак эндометрия представляет собой рак эндометрия III стадии. В одном варианте осуществления рак эндометрия представляет собой рак эндометрия IV стадии. В одном варианте осуществления рак эндометрия представляет собой неоперабельную форму рака эндометрия стадии III или стадии IV.
В седьмом аспекте настоящее раскрытие обеспечивает средство обнаружения белка Ang2 для применения в прогнозировании ответа человека, имеющего, предположительно имеющего или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль. В одном варианте осуществления средство обнаружения белка Ang2 представляет собой антитело против Ang2.
Кроме того, настоящее раскрытие обеспечивает средство обнаружения белка HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA для применения в прогнозировании ответа человека, имеющего, предположительно имеющего, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль. В одном варианте осуществления средство обнаружения белка HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA представляет собой антитело против HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA.
В восьмом аспекте настоящее раскрытие отличается набором, включающим средство обнаружения белка Ang2, для применения в прогнозировании ответа человека, имеющего, предположительно имеющего, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль. В определенных вариантах осуществления средство обнаружения белка Ang2 представляет собой антитело против Ang2. В определенных вариантах осуществления антитело против Ang2 представляет собой моноклональное антитело. В других вариантах осуществления антитело против Ang2 представляет собой поликлональное антитело. В определенных вариантах осуществления антитело конъюгируют с обнаруживаемым средством. В одном варианте осуществления обнаруживаемое средство представляет собой пероксидазу хрена, биотин, флуоресцентныей фрагмент, радиоактивный фрагмент, гистидиновую метку или пептидную метку. В одном варианте осуществления поддающееся обнаружению меченое антитело наносят на микропланшет. В определенных вариантах осуществления микропланшет представляет собой 96-луночный микропланшет. В определенных вариантах осуществления набор факультативно включает один или несколько стандартов концентрации, один или несколько буферов (например, промывочные буферы), один или несколько разбавителей (например, аналитические и/или калибровочные разбавители) и один или несколько реагентов, которые облегчают обнаружение того, связывается ли специфически средство обнаружения белка Ang2 с Ang2 в биологическом образце, полученном от субъекта (например, цветные реагенты, стоп-реагенты).
Кроме того, настоящее раскрытие отличается набором, включающим средство обнаружения белка HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA для применения в прогнозировании ответа человека, имеющего, предположительно имеющего, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль. В определенных вариантах осуществления средство обнаружения белка HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA представляет собой антитело против HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA. В определенных вариантах осуществления антитело представляет собой моноклональное антитело. В других вариантах осуществления антитело представляет собой поликлональное антитело. В определенных вариантах осуществления антитело конъюгируют с детектируемым средством. В одном варианте осуществления детектируемое средство представляет собой пероксидазу хрена, биотин, флуоресцентныей фрагмент, радиоактивный фрагмент, гистидиновую метку или пептидную метку. В одном варианте осуществления поддающееся обнаружению меченое антитело наносят на микропланшет. В определенных вариантах осуществления микропланшет представляет собой 96-луночный микропланшет. В определенных вариантах осуществления набор факультативно включает один или несколько стандартов концентрации, один или несколько буферов (например, промывочные буферы), один или несколько разбавителей (например, аналитические и/или калибровочные разбавители) и один или несколько реагентов, которые облегчают обнаружение того, связывается ли специфически средство обнаружения белка с HGF, IL-8, IP-10, MCP-1, MIP-1б, PGF, sIL-2Rб, Tie-2, TNF-б или VEGFA в биологическом образце, полученном от субъекта (например, цветные реагенты, стоп-реагенты).
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимается специалистом с обычной квалификацией в данной области техники, к которой принадлежит данное изобретение. Хотя способы и материалы, подобные или эквивалентные описанным в данном документе, могут быть использованы в практике или тестировании настоящего изобретения, примерные способы и материалы описаны ниже. Все публикации, заявки на патенты, патенты и другие ссылки, упомянутые в данном документе, включены с помощью ссылки во всей своей полноте. В случае конфликта настоящая заявка, включая определения, будет руководством. Материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из следующего подробного описания и из формулы изобретения.
Краткое описание графических материалов
Фиг. 1 представляет собой графическое изображение изменения уровней биомаркеров в крови после лечения с E7080.
Фиг. 2 представляет собой серию графиков, показывающих корреляцию исходных цитокиновых, хемокиновых и ангиогенных факторов (CAF) с ответом опухоли.
Фиг. 3 представляет собой серию графиков, показывающих, что отсутствует значимая корреляция веса, возраста и гистологии с выживаемостью без прогрессирования заболевания (PFS) и общей выживаемостью (OS).
На Фиг. 4 показаны результаты многофакторного анализа, который не выявил потенциальных факторов комбинации с Ang-2 для улучшения прогнозов клинического результата.
Фиг. 5 включает в себя два графика, показывающих среднюю PFS и среднюю OS подгрупп пациентов с раком эндометрия, сгруппированных по исходным уровням Ang-2.
Фиг. 6 включает в себя два графика, показывающих увеличение популяций пациентов с лучшей частотой объективных ответов (ORR) на основе исходного уровня Ang-2.
Описание вариантов осуществления
Это раскрытие обеспечивает способы и композиции для прогнозирования ответа субъекта (такого как больной человек) с раком эндометрия на терапию, включающую ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат). Настоящее раскрытие обеспечивает прогностические биомаркеры (например, уровни экспрессии белка или РНК) для выявления тех субъектов, которые имеют, предположительно имеют, или с риском развития рака эндометрия (например, распространенного или рецидивирующего рака эндометрия), для которых введение терапии, включающей ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат), вероятно, будет эффективным или неэффективным. Биомаркеры, композиции и способы, описанные в данном документе, являются полезными при выборе подходящих терапевтических средств (например, терапии с ленватинибом или его фармацевтически приемлемой солью (например, ленватиниба мезилатом) или альтернативной терапии) для субъектов, страдающих от, предположительно имеющих, или с риском развития рака эндометрия. Кроме того, данная заявка обеспечивает способы отбора пациентов, имеющих, предположительно имеющих, или с риском развития рака эндометрия, которые могут получить пользу от терапии, включающей ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат), а также способы лечения.
Определения
Термин «уменьшенный/сниженный уровень экспрессии» означает уровень экспрессии (количество), который ниже, чем уровень экспрессии в контроле.
Термин «повышенный уровень экспрессии» означает уровень экспрессии (количество), который выше, чем уровень экспрессии в контроле.
Термин «уровень экспрессии гена» означает уровень экспрессии (количество) белка, кодируемого геном, или РНК, транскрибированной с гена.
Термин «низкая концентрация» означает концентрацию анализируемого вещества, которая ниже, чем концентрация этого вещества в контроле.
Термин «высокая концентрация» означает концентрацию анализируемого вещества, которая выше, чем концентрация этого вещества в контроле.
Термин «ленватиниб» относится к 4-(3-хлор-4- (циклопропиламинокарбонил)аминофенокси)-7-метокси-6-хинолинкарбоксамиду. Это соединение раскрыто в Примере 368 (см. колонку 270) патента США № 7253286. Патент США № 7253286 включен с помощью ссылки во всей своей полноте в данный документ. Термин «соединение ленватиниба» относится к «ленватинибу или его фармацевтически приемлемой соли». Примером фармацевтически приемлемой соли ленватиниба является ленватиниба мезилат. Ленватиниба мезилат также упоминается как E7080.
Термин «фармацевтически приемлемая соль» не ограничен специфически в отношении типа соли. Примеры таких солей включают, но без ограничения, аддукт соли неорганической кислоты, такой как соль соляной кислоты, соль серной кислоты, соль угольной кислоты, бикарбонатная соль, соль бромистоводородной кислоты и соль йодистоводородной кислоты; аддукт соли органической кислоты, такой как соль уксусной кислоты, соль малеиновой кислоты, соль молочной кислоты, соль винной кислоты и соль трифторуксусной кислоты; аддукт соли органической сульфокислоты, такой как соль метансульфоновой кислоты, соль гидроксиметансульфоновой кислоты, соль гидроксиэтансульфоновой кислоты, соль бензолсульфоновой кислоты, соль толуолсульфоновой кислоты и тауриновая соль; аддукт соли амина, такой как соль триметиламина, соль триэтиламина, соль пиридина, соль прокаина, соль пиколина, соль дициклогексиламина, соль N,N'-дибензилэтилендиамина, соль N-метилглюкамина, соль диэтаноламина, соль триэтаноламина, соль трис(гидроксиметиламино)метана и соль фенэтилбензиламина; и аддукт соли аминокислоты, такой как соль аргинина, соль лизина, соль серина, соль глицина, соль аспарагиновой кислоты и соль глутаминовой кислоты. В одном варианте осуществления фармацевтически приемлемая соль представляет собой соль метансульфоновой кислоты («мезилат»). Формула соли метансульфоновой кислоты (т.е. мезилата) 4-(3-хлор-4-(циклопропиламинокарбонил)аминофенокси)-7-метокси-6-хинолинкарбоксамида раскрыта в патенте США № 7612208, который включен с помощью ссылки в данный документ во всей своей полноте.
«Полипептид» и «белок» используются взаимозаменяемо в данном документе и означают любую цепь аминокислот, соединенных пептидной связью, независимо от длины или пост-трансляционной модификации. Как правило, полипептид, описанный в данном документе, является «выделенным», если он составляет по меньшей мере 60% по весу от общего белка в препарате, например, 60% от общего белка в образце. В некоторых вариантах осуществления полипептид, описанный в данном документе, составляет по меньшей мере 75%, по меньшей мере 90% или по меньшей мере 99% по весу от общего белка в препарате.
Термин «отвечает/чувствительный к терапии» означает, что субъект, которому ввели терапию, показывает положительный ответ на предоставленную терапию. Неограничивающими примерами такого положительного ответа являются: уменьшение размера опухоли, уменьшение метастазирования опухоли или увеличенный период выживаемости после лечения.
Термин «субъект» означает млекопитающее, включая, но без ограничения, человека, шимпанзе, орангутана, гориллу, бабуина, мартышку, мышь, крысу, свинью, лошадь, собаку и корову.
Рак эндометрия
Рак эндометрия относится к нескольким типам злокачественных опухолей, которые возникают из эндометрия, или выстилки, матки. Большинство форм рака эндометрия представляют собой карциномы (обычно аденокарциномы). Другими словами, они происходят из одного слоя эпителиальных клеток, которые выстилают эндометрий и образуют железы эндометрия. Карциномы эндометрия иногда классифицируют на две группы: тип I включает формы рака, найденные у пред- и перименопаузальных женщин и, как правило, являющиеся минимально инвазивными; тип II включает в себя формы рака, которые возникают у более пожилых, постменопаузальных женщин и имеют менее благоприятный прогноз, чем тип I. В отличие от карцином эндометрия редко встречающиеся саркомы стромы эндометрия представляют собой формы рака, возникающие в нежелезистой соединительной ткани эндометрия.
Для того, чтобы выбрать план лечения для пациентов, врачи должны определить, как рак эндометрия распространился у пациента, или, другими словами, «стадию» рака эндометрия. Рак эндометрия разделяют на стадии на основе изучения ткани, удаленной во время операции (хирургическое стадирование). Система стадирования рассматривает, как далеко распространился данный рак. Рак эндометрия может распространяться локально в шейку матки и другие части матки. Он также может распространяться регионально в близлежащие лимфатические узлы. Кроме того, этот рак может метастазировать в отдаленные лимфатические узлы, в верхнюю часть брюшной полости, сальник или другие органы, такие как легкие, печень, кости и мозг.
Две системы, используемые для разделения рака эндометрия на стадии, это система FIGO (Международная федерация гинекологии и акушерства) и система стадирования Американского объединенного комитета по раку (AJCC). Эти системы в основном одинаковы; различие между системой AJCC и системой FIGO заключается в том, что система FIGO не включает в себя стадию 0. Обе системы стадирования классифицируют рак эндометрия на основании трех факторов: объем опухоли (T), распространился ли рак на лимфатические узлы (N) и распространился ли в отдаленные участки (M). Информацию об опухоли, лимфатических узлах и любом распространении рака затем объединяют для определения стадии заболевания, процесс, названный классификацией стадии. Стадии описывают с помощью цифры 0 и римских цифр от I до IV. Некоторые стадии разделяют на подстадии, указанные буквами и цифрами.
Стадия 0: Tis, N0, M0 - Эта стадия также известна как карцинома in situ. Раковые клетки обнаружены только в поверхностном слое клеток эндометрия без прорастания в слои клеток ниже. Рак не распространился на близлежащие лимфатические узлы или отдаленные участки. Это представляет собой предраковое поражение. Данная стадия не включена в систему стадирования FIGO.
Стадия I: T1, N0, M0 - Рак прорастает только в тело матки. Он также может прорастать в железы шейки матки, но не прорастает в опорную соединительную ткань шейки матки. Рак не распространился на лимфатические узлы или отдаленные участки.
Стадия IА: T1a, N0, M0 - При этой ранней форме стадии I рак находится в эндометрии и может прорасти менее чем наполовину через расположенный ниже мышечный слой матки (миометрий). Он не распространился на лимфатические узлы или отдаленные участки.
Стадия IВ: T1b, N0, M0 - Рак пророс из эндометрия в миометрий, прорастая более чем наполовину через миометрий. Рак не распространился за пределы тела матки.
Стадия II: T2, N0, M0 - Рак распространился из тела матки и прорастает в опорную соединительную ткань шейки матки (цервикальная строма). Рак не распространился на внешнюю поверхность матки. Рак не распространился на лимфатические узлы или отдаленные участки.
Стадия III: T3, N0, M0 - Рак либо распространился на внешнюю поверхность матки, или в близлежащие ткани в тазовой области.
Стадия IIIА: T3a, N0, M0 - Рак распространился на внешнюю поверхность матки (так называемую серозную) и/или в маточные трубы или яичники (придатки). Рак не распространился на лимфатические узлы или отдаленные участки.
Стадия IIIВ: T3b, N0, M0 - Рак распространился во влагалище или в ткани вокруг матки (параметрий). Рак не распространился на лимфатические узлы или отдаленные участки.
Стадия IIIC1: T1 до T3, N1, M0 - Рак прорастает в тело матки. Он может распространяться в некоторые близлежащие ткани, но не прорастает во внутреннюю часть мочевого пузыря или прямой кишки. Рак распространился на тазовые лимфатические узлы, но не на лимфатические узлы вокруг аорты или отдаленные участки.
Стадия IIIC2: T1 до T3, N2, M0 - Рак прорастает в тело матки. Он может распространяться в некоторые близлежащие ткани, но не прорастает во внутреннюю часть мочевого пузыря или прямой кишки. Рак распространился на лимфатические узлы вокруг аорты (периаортальные лимфатические узлы), но не на отдаленные участки.
Стадия IV: Рак распространился на внутреннюю поверхность мочевого пузыря или прямой кишки, на лимфатические узлы в паху и/или отдаленные органы, такие как кости, сальник или легкие.
Стадия IVА: T4, любой N, M0 - Рак распространился на внутреннюю выстилку прямой кишки или мочевого пузыря (так называемую слизистую). Он может распространиться или не распространиться на близлежащие лимфатические узлы, но не распространился на отдаленные участки.
Стадия IVB: любой T, любой N, M1 - Рак распространился на отдаленные лимфатические узлы, верхний отдел брюшной полости, сальник или органы вдали от матки, такие как кости, сальник или легкие. Рак может быть любого размера и может распространиться или не распространиться на лимфатические узлы.
Способы прогнозирования чувствительности к терапии, включающей соединение ленватиниба
Был идентифицирован ряд генов, уровни экспрессии которых (например, уровни экспрессии иРНК или белка) пригодны для прогнозирования чувствительности субъекта, имеющего рак эндометрия, к терапии, включающей соединение ленватиниба (например, ленватиниба мезилат). Эти гены, как они определены с помощью ID гена, соответствующий указатель URL, ID белка и инвентарных номеров UniProtKB, перечислены в Таблице 1.
Таблица 1: Перечень биомаркеров
ID
Инвентарный номер
ANG290/ ANGPT2
VMCM/VMCM1
Ангиопоэтины представляют собой белковые факторы роста, которые способствуют ангиогенезу (формированию кровеносных сосудов из ранее существовавших кровеносных сосудов) и созреванию кровеносных сосудов опухоли. Исследования на нокаутных мышах показали, что ангиопоэтин 2 (Ang2) необходим для формирования зрелых кровеносных сосудов. Экспрессия Ang2 в эндотелиальных клетках является достаточной для привлечения миелоидных клеток и индукции воспаления даже в отсутствии предшествующих провоспалительных стимулов.
Фактор роста гепатоцитов (HGF) представляет собой паракринный фактор клеточного роста, подвижности и морфогенеза. Он секретируется мезенхимальными клетками и направляется и действует главным образом на эпителиальные клетки и эндотелиальные клетки, но также действует на гемопоэтические клетки-предшественники. Он играет важную роль в развитии эмбриональных органов, в регенерации взрослых органов и в заживлении ран. HGF регулирует рост клеток, подвижность клеток и морфогенез посредством активации тирозинкиназного каскада передачи сигнала после связывания с протоонкогенным рецептором c-Met.
Интерлейкин 8 (IL-8) представляет собой хемокин, производимый макрофагами и другими типами клеток, такими как эпителиальные клетки и эндотелиальные клетки. IL-8 может связывать несколько рецепторов, в том числе CXCR1 и CXCR2.
Интерфероном гамма индуцируемый белок 10 (IP-10) представляет собой небольшой цитокин, принадлежащий к семейству хемокинов CXC. Он секретируется несколькими типами клеток (например, моноцитами, эндотелиальными клетками и фибробластами) в ответ на IFN-γ. Этому белку приписано несколько ролей, таких как хемоаттракция для моноцитов/макрофагов, Т-клеток, NK-клеток и дендритных клеток, содействие адгезии Т-клеток к эндотелиальным клеткам, противоопухолевая активность и ингибирование колониеобразования в костном мозге и ангиогенеза.
Белок хемотаксиса моноцитов 1 (MCP-1) представляет собой небольшой цитокин, принадлежащий к семейству хемокинов CC. Он играет роль в привлечении моноцитов, Т-клеток памяти и дендритных клеток в участки воспаления, производимого либо повреждением ткани, или инфекцией.
Воспалительный белок макрофагов 1a (MIP-1a) принадлежит к семейству хемотаксических цитокинов. Этот белок имеет решающее значение для иммунных ответов на инфекцию и воспаление. Он активирует гранулоциты (нейтрофилы, эозинофилы и базофилы), что может привести к острому нейтрофильному воспалению. Кроме того, он индуцирует синтез и высвобождение других провоспалительных цитокинов, таких как интерлейкин 1 (IL-1), IL-6 и TNF-б из фибробластов и макрофагов.
Плацентарный фактор роста (PGF) является членом подсемейства факторов роста эндотелия сосудов. Экспрессия плацентарного фактора роста внутри атеросклеротических поражений у человека ассоциирована с воспалением бляшек и неоваскулярным ростом.
Растворимый рецептор альфа интерлейкина-2 (sIL-2Ra) представляет собой секретируемый внеклеточный домен IL-2R альфа и экспрессируется клетками лейкемии, клетками лимфомы, фракцией NK-клеток, а также недавно активированными T и B-клетками.
Tie-2 представляет собой рецептор тирозинкиназы на клеточной поверхности, который связывается и регулируется ангиопоэтинами (Ang1, Ang2, Ang3, Ang4). Этот рецептор экспрессируют в основном эндотелиальные клетки человека. Он обладает уникальным внеклеточным доменом, содержащим две иммуноглобулин-подобных петли, разделенных тремя подобными эпидермальному фактору роста повторами, которые соединены с тремя подобными фибронектину типа III повторами. Сигнальный путь TIE-2 имеет решающее значение для коммуникации между эндотелиальными клетками и гладко-мышечными клетками при морфогенезе вен. Дефекты в TIE-2 ассоциированы с врожденными пороками развития вен.
Фактор некроза опухоли альфа (TNF-α) представляет собой цитотоксин моноцитарного происхождения, который вовлечен в регрессию опухоли, септический шок и кахексию.
Фактор роста эндотелия сосудов A (VEGF-A) представляет собой гликозилированный митоген, который специфически воздействует на эндотелиальные клетки и обладает различными эффектами, включая опосредование повышенной проницаемости сосудов, индукцию ангиогенеза, васкулогенеза и роста эндотелиальных клеток, способствование миграции клеток и ингибирование апоптоза.
Низкий по сравнению с контролем уровень экспрессии (например, экспрессии белка или иРНК) одного или нескольких (например, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11) генов, перечисленных в Таблице 1, является признаком/прогнозирующим, что субъект будет отвечать на терапию, включающую соединение ленватиниба (например, ленватиниба мезилат). Например, низкие концентрации (по сравнению с контролем) белка Ang2 в биологическом образце, полученном от субъекта до лечения терапией, включающей соединение ленватиниба, являются прогностическими относительно того, что субъект будет отвечать на терапию, включающую соединение ленватиниба (например, ленватиниба мезилат).
В определенных вариантах осуществления субъект установлен как отвечающий на терапию, включающую соединение ленватиниба (например, ленватиниба мезилат), если субъект показывает частичный ответ после лечения с данной терапией. «Частичный ответ» означает по меньшей мере 30% уменьшение суммы наибольшего диаметра (LD) целевых поражений, принимая в качестве стандарта исходный суммированный LD. В некоторых вариантах осуществления субъект установлен как отвечающий на терапию, включающую соединение ленватиниба, если субъект показывает уменьшение размеров опухоли после лечения с данной терапией. «% максимального уменьшения размеров опухоли» (MTS) означает процент изменения суммы диаметров целевых поражений, принимая в качестве стандарта исходную сумму диаметров. В других вариантах осуществления субъект установлен как отвечающий на терапию, включающую соединение ленватиниба, если субъект показывает выживаемость без прогрессирования заболевания. «Выживаемость без прогрессирования заболевания» (PFS) относится к периоду от даты начала лечения до последней даты перед входом в состояние прогрессирующего заболевания (PD). PD означает по меньшей мере 20% увеличение суммы LD целевых поражений, принимая в качестве стандарта наименьший суммированный LD, записанный с начала лечения, или появление одного или нескольких новых поражений. В некоторых вариантах осуществления субъект установлен как отвечающий на терапию, включающую соединение ленватиниба, если субъект показывает как выживаемость без прогрессирования заболевания, так и уменьшение размеров опухоли.
Данное раскрытие обеспечивает способы идентификации субъекта, имеющего рак эндометрия, который склонен иметь как преимущества в выживаемости (например, PFS), так и уменьшение размеров опухоли после терапии, включающей соединение ленватиниба (например, ленватиниба мезилат). В данном способе биологический образец субъекта, полученный до лечения с терапией, включающей соединение ленватиниба, количественно оценивают и измеряют уровень белка Ang2. Низкая концентрация белка Ang2 по сравнению с контролем указывает, что данный субъект будет склонен иметь как преимущества в выживаемости (например, PFS), так и уменьшение размеров опухоли после терапии, включающей соединение ленватиниба. С другой стороны, высокая концентрация белка Ang2 по сравнению с контролем указывает, что субъект не будет склонен иметь как преимущества в выживаемости (например, PFS), так и уменьшение размеров опухоли после терапии, включающей соединение ленватиниба.
Способы, описанные в данном документе, также позволяют идентификацию субъекта, имеющего рак эндометрия, который иметь преимущества в выживаемости (например, PFS) после терапии, включающей соединение ленватиниба (например, ленватиниба мезилат). В данном способе биологический образец субъекта, полученный до лечения с терапией, включающей соединение ленватиниба, количественно оценивают и измеряют уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти, по меньшей мере десяти или одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти или одиннадцати белков из Ang2, HGF, IL-8, IP-10, MCP-1, MIP-1a, PGF, sIL-2Ra, Tie-2, TNFб и VEGFA. Низкая концентрация любого из этих белков (одного или в комбинации с другими перечисленными выше) по сравнению с контролем указывает, что субъект будет склонен иметь преимущества в выживаемости (например, PFS) после терапии, включающей соединение ленватиниба. С другой стороны, высокая концентрация любого из этих белков (одного или в комбинации с другими перечисленными выше) по сравнению с контролем указывает, что субъект будет не склонен иметь преимущества в выживаемости (например, PFS) после терапии, включающей соединение ленватиниба. В определенных вариантах осуществления субъект с низкой концентрацией одного или нескольких белков, перечисленных выше, склонен иметь выживаемость без прогрессирования заболевания длительностью один, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать, двадцать один, двадцать два или двадцать три месяца, или двадцать четыре месяца.
Это раскрытие также обеспечивает способ идентификации субъекта, имеющего рак эндометрия, который склонен к уменьшению размеров опухоли после терапии, включающей соединение ленватиниба (например, ленватиниба мезилат). В данном способе биологический образец субъекта количественно оценивают и измеряют концентрацию белка Ang2 и/или IL-8. Низкая концентрация Ang2 и/или IL-8 по сравнению с контролем указывает, что субъект будет склонен иметь уменьшение размеров опухоли. С другой стороны, высокая концентрация Ang2 и/или IL-8 по сравнению с контролем указывает, что субъект будет не склонен показывать уменьшение размеров опухоли.
В одном варианте осуществления субъект имеет, предположительно имеет, или подвергается риску развития рака эндометрия. В некоторых вариантах осуществления рак эндометрия представляет собой распространенный рак эндометрия. В других вариантах осуществления рак эндометрия представляет собой рецидивирующий рак эндометрия. В определенных вариантах осуществления рак эндометрия представляет собой рак III стадии. В некоторых вариантах осуществления рак эндометрия представляет собой рак IV стадии. В определенных вариантах осуществления рак эндометрия представляет собой неоперабельный рак III стадии или IV стадии.
Концентрацию белка или белков, представляющих интерес, можно измерить с помощью любого способа, известного в данной области техники, такого как иммунологический анализ. Неограничивающие примеры таких способов включают иммуноферментный анализ, радиоиммунологический анализ, хемилюминесцентный иммунологический анализ, электрохемилюминесцентный иммунологический анализ, латексный турбидиметрический иммунологический анализ, латексный фотометрический иммунологический анализ, иммунохроматографический анализ и вестерн-блоттинг. В определенных вариантах осуществления концентрацию белка или белков, представляющих интерес, измеряют с помощью масс-спектрометрии.
Контроли
Как описано выше, способы по настоящему изобретению могут включать измерение уровня экспрессии (например, концентрацию иРНК или белка) одного или нескольких генов (например, одного или нескольких генов, описанных в Таблице 1) в биологическом образце субъекта, имеющего, предположительно имеющего, или с риском развития рака эндометрия, где уровень экспрессии одного или нескольких генов по сравнению с контролем прогнозирует ответ субъекта на лечение, включающее соединение ленватиниба (например, ленватиниба мезилат). В определенных вариантах осуществления, когда концентрация белка из Таблицы 1 в биологическом образце субъекта, имеющего, предположительно имеющего, или с риском развития рака эндометрия, ниже, чем контроль, субъекта идентифицируют как склонного к ответу на терапию, включающую соединение ленватиниба. В данном контексте термин «контроль» включает в себя образец (из той же ткани), полученный от субъекта, который известен, как не отвечающий на терапию, включающую соединение ленватиниба (например, ленватиниба мезилат). Термин «контроль» также включает образец (из той же ткани) полученный в прошлом от субъекта, который известен, как не отвечающий на терапию, включающую соединение ленватиниба, и использованный в качестве стандарта для будущих сравнений с тестируемыми образцами, взятыми у субъектов, для которых терапевтическая чувствительность должна быть спрогнозирована. «Контрольный» уровень экспрессии /концентрации для специфического белка в специфическом типе клеток или в ткани можно предварительно установить с помощью анализа экспрессии белка у одного или нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, 10, 15, 20, 25, 30, 35 или 40 или более) субъектов того же вида, которые не ответили на лечение с соединением ленватиниба (например, ленватиниба мезилатом). Это предварительно установленное контрольное значение (которое может быть средним или медианой уровня экспрессии/концентрации, взятой у множества субъектов, которые не ответили на терапию) можно затем использовать для «контрольной» концентрации/уровня экспрессии белка или нуклеиновой кислоты при сравнении с тестируемым образцом. При таком сравнении субъекта прогнозируют как отвечающего на терапию, включающую соединение ленватиниба (например, ленватиниба мезилат), если уровень экспрессии анализируемого гена ниже, чем предварительно установленный стандарт.
«Контрольную» концентрацию для специфического белка в специфическом типе клеток или в ткани можно альтернативно предварительно установить с помощью анализа экспрессии гена у одного или нескольких субъектов, которые ответили на терапию с соединением ленватиниба (например, ленватиниба мезилатом). Это предварительно установленное контрольное значение (которое может быть средним или медианой уровня экспрессии, взятого у множества субъектов, которые ответили на терапию) можно затем использовать для «контрольного» уровня экспрессии при сравнении с тестируемым образцом. При таком сравнении субъекта прогнозируют как отвечающего на терапию, включающую соединение ленватиниба (например, ленватиниба мезилат), если концентрация анализируемого белка является такой же или сопоставимой (по меньшей мере 85%, но менее чем 100%) с предварительно установленным стандартом.
В определенных вариантах осуществления «контроль» представляет собой предварительно установленное пороговое значение.
Пороговые значения
В некоторых вариантах осуществления способы, описанные в данном документе, включают в себя определение того, попадает ли концентрация представляющего интерес белка (белков) (например, одного или нескольких из белков, перечисленных в Таблице 1) выше или ниже предварительно установленного порогового значения.
Пороговое значение представляет собой, как правило, концентрацию белка, значение выше или ниже которой рассматривается как прогнозирующее чувствительность субъекта к представляющей интерес терапии. Таким образом, в соответствии со способами и композициями, описанными в данном документе, контрольную концентрацию (например, белка из Таблицы 1) идентифицируют как пороговое значение, выше или ниже которого значение является прогнозирующим чувствительность к терапии, включающей соединение ленватиниба (например, ленватиниба мезилат). Некоторые пороговые значения не являются абсолютными в том, что клинические корреляции еще могут оставаться значительным в диапазоне значений по обе стороны от порога; однако, можно выбрать оптимальное пороговое значение (например, различные H-баллы) концентрации белков для специфического типа образца. Пороговые значения, определенные для применения в способах, описанных в данном документе, можно сравнить, например, с опубликованными диапазонами концентраций, но можно индивидуализировать для используемой методологии и популяции пациентов. Понятно, что улучшение оптимальных пороговых значений можно определить в зависимости от сложности используемых статистических методов и от количества и источника образцов, используемых для определения значений контрольного уровня для различных генов и типов образцов. Таким образом, установленные пороговые значения можно отрегулировать вверх или вниз на основе периодических переоценок или изменения в методологии или распределении популяции.
Контрольную концентрацию одного или нескольких белков можно определить с помощью различных способов. Контрольный уровень можно определить путем сравнения концентрации представляющего интерес белка в, например, популяциях субъектов (например, пациентов), которые отвечают на терапию, включающую соединение ленватиниба (например, ленватиниба мезилат), или не отвечают на терапию, включающую соединение ленватиниба. Это можно выполнить, например, путем анализа гистограммы, в которой вся когорта пациентов представлена графически, где первая ось представляет собой концентрацию представляющего интерес белка, и вторая ось представляет собой количество субъектов в когорте, образец которых содержит одну или несколько концентраций. Определение контрольной концентрации белка можно выполнить на основе количества или концентрации, которая наилучшим образом характеризует эти отдельные группы. Контрольный уровень может быть одним числом, в равной степени применимым к каждому субъекту, или контрольный уровень может меняться в зависимости от конкретных субпопуляций субъектов. Например, более пожилые субъекты могут иметь другой контрольный уровень, чем более молодые субъекты, для одной и той же формы рака. Кроме того, субъект с более распространенным заболеванием (например, с более распространенной формой рака эндометрия) может иметь другое контрольное значение, чем субъект с более легкой формой заболевания.
Предварительно установленное пороговое значение может быть концентрацией белка, которую определили на основе анализа характеристических кривых обнаружения (ROC). ROC-кривые используют для определения порогового значения при клиническом тестировании. Рассмотрим ситуацию, когда есть две группы пациентов и с помощью утвержденной стандартной методики установлено, что одна группа отвечает на соединение ленватиниба, а другая, как известно, не отвечает на соединение ленватиниба. Измерение с использованием биологического образца от всех членов обеих групп используют для тестирования на чувствительность к соединению ленватиниба. При тестировании обнаружат некоторых, но не всех отвечающих субъектов с ответом на соединение ленватиниба. Отношение отвечающих субъектов, обнаруженных при тестировании, к общему числу отвечающих субъектов (установленному с помощью утвержденной стандартной методики), представляет собой долю истинно положительных (также известную как чувствительность). При тестировании обнаружат некоторых, но не всех не отвечающих субъектов без ответа на соединение ленватиниба. Отношение не отвечающих субъектов, обнаруженных при тестировании, к общему числу не отвечающих субъектов (установленному с помощью утвержденной стандартной методики), представляет собой долю истинно отрицательных (также известную как специфичность). Есть надежда, что анализ ROC-кривых теста чувствительности к ленватинибу обнаружит пороговое значение, которое сведет к минимуму количество ложно положительных и ложно отрицательных результатов. ROC представляет собой графический чертеж, иллюстрирующий эффективность системы бинарной классификации по мере того, как меняют ее порог дискриминации. Его создают путем нанесения доли истинно положительных из положительных против доли ложно положительных из отрицательных при различных пороговых установках.
В одном варианте осуществления концентрацию белка определяют на основе ROC-анализа прогнозирования ответа опухоли с положительной прогностической ценностью, где концентрация представляющего интерес белка (например, Ang2), равная или ниже предварительно установленного порогового значения, является низкой концентрацией представляющего интерес белка, и значение выше, чем предварительно установленное пороговое значение, является высокой концентрацией представляющего интерес белка. Положительная прогностическая ценность представляет собой долю положительных результатов теста, которые являются истинно положительными; она отражает вероятность того, что положительные результаты теста отражают основное состояние, на наличие которого происходит тестирование. Способы конструирования ROC-кривых и определения положительной прогностической ценности хорошо известны в данной области техники. В определенных вариантах осуществления ответ опухоли представляет собой частоту объективных ответов (ORR), частоту клинической эффективности (CBR) или % максимального уменьшения размеров опухоли.
В другом варианте осуществления предварительно установленное пороговое значение может быть концентрацией белка, которую определяют на основе имитационных моделей прогнозирования выживаемости, и где концентрация представляющего интерес белка (например, Ang2), равная или ниже предварительно установленного порогового значения, является низкой концентрацией представляющего интерес белка, и значение выше, чем предварительно установленное пороговое значение, является высокой концентрацией представляющего интерес белка. В некоторых вариантах осуществления выживаемость представляет собой выживаемость без прогрессирования заболевания (PFS). В других вариантах осуществления выживаемость представляет собой общую выживаемость (OS).
В определенных вариантах осуществления предварительно установленное пороговое значение для белка Ang2 находится в диапазоне концентраций от 1866,5 до 6024,5 пг/мл. В некоторых вариантах осуществления предварительно установленное пороговое значение для белка Ang2 находится в диапазоне концентраций от 1866,5 до 2500 пг/мл. В некоторых вариантах осуществления предварительно установленное пороговое значение для белка Ang2 находится в диапазоне концентраций от 1866,5 до 3000 пг/мл. В некоторых вариантах осуществления предварительно установленное пороговое значение для белка Ang2 находится в диапазоне концентраций от 1866,5 до 3500 пг/мл. В других вариантах осуществления предварительно установленное пороговое значение для белка Ang2 находится в диапазоне концентраций от 2000 до 3000 пг/мл. В других вариантах осуществления предварительно установленное пороговое значение для белка Ang2 находится в диапазоне концентраций от 2000 до 4000 пг/мл. В других вариантах осуществления предварительно установленное пороговое значение для белка Ang2 находится в диапазоне концентраций от 2000 до 5000 пг/мл. В других вариантах осуществления предварительно установленное пороговое значение для белка Ang2 находится в диапазоне концентраций от 3000 до 4000 пг/мл. В определенных вариантах осуществления предварительно установленное пороговое значение для белка Ang2 находится в диапазоне концентраций от 3000 до 5000 пг/мл. В других вариантах осуществления предварительно установленное пороговое значение для белка Ang2 находится в диапазоне концентраций от 3000 до 6000 пг/мл. В других вариантах осуществления предварительно установленное пороговое значение для белка Ang2 находится в диапазоне концентраций от 4000 до 5000 пг/мл. В других вариантах осуществления предварительно установленное пороговое значение для белка Ang2 находится в диапазоне концентраций от 4000 до 6000 пг/мл. В некоторых вариантах осуществления предварительно установленное пороговое значение для белка Ang2 представляет собой диапазон концентраций от 5000 до 6000 пг/мл. В конкретном варианте осуществления предварительно установленное пороговое значение для белка Ang2 составляет приблизительно 2082,5 пг/мл. Во всех этих вариантах осуществления концентрация белка Ang2, равная или ниже предварительно установленного порогового значения, является низкой концентрацией Ang2 и значение выше, чем предварительно установленное пороговое значение, является высокой концентрацией Ang2. В данном контексте «приблизительно» означает ±10%.
Биологические образцы
Подходящие биологические образцы для способов, описанных в данном документе, включают любую биологическую жидкость, клетку, ткань или их фракцию, которая включает представляющую интерес биомолекулу, определяемую при анализе, такую как белок или нуклеиновая кислота (например, ДНК или иРНК). Биологический образец может быть, например, образцом, полученным от субъекта (например, млекопитающего, такого как человек) или может быть извлечен из такого субъекта. Например, образец может быть срезом ткани, полученным путем биопсии, архивной опухолевой тканью или клетками, которые помещены в или адаптированы к культуре ткани. Биологический образец может также быть биологической жидкостью, такой как кровь, плазма, сыворотка, моча, или таким образцом, который абсорбирован на субстрат (например, стекло, полимер, бумага). Биологический образец может также включать образец ткани эндометрия. В конкретных вариантах осуществления биологический образец представляет собой опухолевую клетку (клетки) или опухолевую ткань, полученную из области субъекта, предположительно содержащей опухоль или предраковое поражение. Например, биологический образец может быть образцом опухоли эндометрия. Биологический образец можно дополнительно фракционировать, при желании, до фракции, содержащей специфические типы клеток. Например, образец крови можно фракционировать на сыворотку или на фракции, содержащие специфические типы клеток крови, такие как красные кровяные клетки или белые кровяные клетки (лейкоциты). При желании образец может быть комбинацией образцов субъекта, такой как комбинация образца ткани и жидкости.
Биологические образцы можно получить от субъекта, имеющего, предположительно имеющего, или с риском развития рака эндометрия. В определенных вариантах осуществления субъект имеет распространенный рак эндометрия. В некоторых вариантах осуществления субъект имеет рецидивирующий рак эндометрия. В других вариантах осуществления субъект имеет рак эндометрия III стадии. В определенных вариантах осуществления субъект имеет рак эндометрия IV стадии. В других вариантах осуществления субъект имеет неоперабельную форму рака эндометрия III стадии или IV стадии.
Любые подходящие способы получения биологических образцов можно использовать, хотя типичные способы включают в себя, например, флеботомию, процедуру тонкоигольной аспирационной биопсии. Образцы также могут быть собраны, например, с помощью микродиссекции (например, лазерной захватывающей микродиссекции (LCM) или лазерной микродиссекции (LMD).
Способы получения и/или хранения образцов, которые сохраняют активность или целостность молекул (например, нуклеиновых кислот или белков) в образце, хорошо известны специалистам в данной области техники. Например, биологический образец может дополнительно контактировать с одним или несколькими дополнительными средствами, такими как буферы и/или ингибиторы, включая один или несколько из ингибиторов нуклеаз, протеаз и фосфатаз, которые предохраняют от или сводят к минимуму изменения в молекулах (например, нуклеиновых кислотах или белках) в образце. Такие ингибиторы включают, например, хелаторы, такие как этилендиаминтетрауксусную кислоту (EDTA), этиленгликоль-бис(бета-аминоэтиловый эфир) N,N,N',N'-тетрауксусной кислоты (EGTA), ингибиторы протеаз, такие как фенилметилсульфонилфторид (PMSF), апротинин, лейпептин, антипаин и тому подобные, и ингибиторы фосфатаз, такие как фосфат, фторид натрия, ванадат и тому подобные. Подходящие буферы и условия для выделения молекул хорошо известны специалистам в данной области техники и могут меняться в зависимости от, например, типа молекулы в образце, которую необходимо охарактеризовать (см., например, Ausubel и соавт. Current Protocols in Molecular Biology (Supplement 47), John Wiley & Sons, New York (1999); Harlow и Lane, Antibodies: A Laboratory Manual (Cold Spring Harbor Laboratory Press (1988); Harlow и Lane, Using Antibodies: A Laboratory Manual, Cold Spring Harbor Press (1999); Tietz Textbook of Clinical Chemistry, 3rd ed. Burtis и Ashwood, eds. W.B. Saunders, Philadelphia, (1999)). Образец также можно обработать для удаления или сведения к минимуму наличия мешающих веществ. Например, биологический образец можно фракционировать или очистить с удалением одного или нескольких материалов, которые не представляют интерес. Способы фракционирования или очистки биологического образца включают, но без ограничения, хроматографические способы, такие как жидкостная хроматография, ионообменная хроматография, эксклюзионная хроматография или аффинная хроматография. Для применения в способах, описанных в данном документе, образец может находиться в различных физических состояниях. Например, образец может быть жидким или твердым, может быть растворен или суспендирован в жидкости, может быть в эмульсии или геле, или может быть абсорбирован на материале.
Определение уровней экспрессии/концентраций биомаркеров
Генную экспрессию можно определить, например, как экспрессию белка или РНК целевого гена. То есть присутствие или уровень экспрессии (количество) гена можно определить путем обнаружения и/или измерения уровня экспрессии иРНК или белка данного гена. В некоторых вариантах осуществления экспрессию гена можно определить как активность белка, кодируемого геном, таким как ген, описанный в Таблице 1.
В одном варианте осуществления экспрессию гена можно определить путем обнаружения и/или измерения уровня экспрессии или концентрации белка, кодируемого геном. Способы определения экспрессии/концентрации белка хорошо известны в данной области техники. Обычно используемые способы включают применение антител, специфических для представляющего интерес целевого белка. Например, способы определения экспрессии белка включают, но без ограничения, анализ вестерн блот или дот-блот, иммуногистохимию (например, количественную иммуногистохимию), иммуноцитохимию, твердофазный иммуноферментный анализ (ELISA), анализ иммуносорбентных пятен с иммобилизованными ферментами (ELISPOT; Coligan J. E. и соавт., eds. (1995) Current Protocols in Immunology. Wiley, New York), радиоиммунологический анализ, хемилюминесцентный иммунологический анализ, электрохемилюминесцентный иммунологический анализ, латексный турбидиметрический иммунологический анализ, латексный фотометрический иммунологический анализ, иммунохроматографический анализ и анализ микроматрицы антител (см., например, публикации патентов США № 20030013208 и 2004171068, раскрытия которых включены в данный документ с помощью ссылки во всей полноте). Дополнительное описание многих из способов, указанных выше, и дополнительные способы обнаружения экспрессии белков можно найти, например, в Sambrook и соавт. (supra).
В одном примере присутствие или количество экспрессии белка гена (например, гена, описанного в Таблице 1), можно определить с помощью методики вестерн блоттинга. Например, лизат, который можно получить из биологического образца, или биологический образец сам по себе, можно привести в контакт с буфером Лэммли и подвергнуть гель-электрофорезу в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE). SDS-PAGE-разделенные белки, разделенные по размеру, можно затем перенести на фильтровальную мембрану (например, из нитроцеллюлозы) и подвергнуть методам иммуноблоттинга с использованием поддающегося обнаружению меченого антитела, специфичного к представляющему интерес белку. Присутствие и количество связанного поддающегося обнаружению меченого антитела указывает на присутствие или количество белка в биологическом образце.
В другом примере иммунологический анализ можно использовать для обнаружения и/или измерения экспрессии белка гена (например, гена, описанного в Таблице 1). Как указано выше, для целей обнаружения иммунологический анализ можно выполнить с антителом, которое несет фрагмент для обнаружения (например, флуоресцентное средство или фермент). Белки из биологического образца можно конъюгировать непосредственно с твердофазной матрицей (например, многолуночным аналитическим планшетом, нитроцеллюлозой, агарозой, сефарозой, закодированными частицами или магнитными гранулами), или их можно конъюгировать с первым членом специфически связывающей пары (например, биотином или стрептавидином), который прикрепляется к твердофазной матрице при связывании со вторым членом специфически связывающей пары (например, стрептавидином или биотином). Такое прикрепление к твердофазной матрице позволяет очистить белки от других мешающих или посторонних компонентов биологического образца перед контактом с обнаруживающим антителом, а также позволяет в последующем отмыть несвязанное антитело. Здесь, как и выше, присутствие или количество связанного поддающегося обнаружению меченого антитела указывает на присутствие или количество белка в биологическом образце.
Нет никаких специфических ограничений в отношении формы антитела и настоящее раскрытие включает в себя поликлональные антитела, а также моноклональные антитела. Антисыворотка, полученная путем иммунизации животных, таких как кролики, белком или его фрагментом по настоящему изобретению (т.е. белком или его иммунологическим фрагментом из Таблицы 1), а также поликлональные и моноклональные антитела всех классов, человеческие антитела и гуманизированные антитела, полученные посредством генетической рекомбинации, также включены.
Интактный белок или его частичный пептид можно использовать в качестве антигена для иммунизации. В качестве частичных пептидов белков могут быть предоставлены, например, амино (N)-концевой фрагмент белка и карбокси (C)-концевой фрагмент.
Ген, кодирующий представляющий интерес белок или его фрагмент (например, иммунологический фрагмент), вставляют в известный вектор экспрессии и путем трансформации клеток-хозяев вектором, описанным в данном документе, нужный белок или его фрагмент извлекают с внешней поверхности или изнутри клетки-хозяина с использованием стандартных способов. Этот белок можно использовать в качестве сенсибилизирующего антигена. Кроме того, клетки, экспрессирующие белок, клеточные лизаты или химически синтезированный белок по настоящему изобретению также можно использовать в качестве сенсибилизирующего антигена.
Выбор млекопитающих, которых иммунизируют сенсибилизирующим антигеном, не ограничен; однако предпочтительно выбирать животных, рассматривая совместимость с родительскими клетками, используемыми при слиянии клеток. Как правило, используют животных, принадлежащих к отрядам Rodentia, Lagomorpha или приматов. Примеры животных, относящихся к отряду Rodentia, которых можно использовать, включают, например, мышей, крыс и хомячков. Примеры животных, относящихся к отряду Lagomorpha, которых можно использовать, включают, например, кроликов. Примеры животных, относящихся к отряду приматов, которых можно использовать, включают, например, обезьян. Примеры обезьян для использования включают парвотряд Сatarrhini (обезьяны Старого Света), например, Macaca fascicularis, макаки резус, гамадрилы и шимпанзе.
Общеизвестные способы можно использовать для иммунизации животных сенсибилизирующим антигеном. Например, сенсибилизирующий антиген вводят внутрибрюшинно или подкожно млекопитающим. В частности, сенсибилизирующий антиген надлежащим образом разводят и суспендируют в физиологическом растворе, фосфатном буферном растворе (PBS) и так далее, и смешивают при желании с подходящим количеством обычного адъюванта, например, с полным адъювантом Фрейнда. Затем раствор эмульгируют и вводят млекопитающему. После этого сенсибилизирующий антиген, надлежащим образом смешанный с неполным адъювантом Фрейнда, предпочтительно вводят несколько раз каждые 4 - 21 день. Подходящий носитель также можно использовать при иммунизации животного сенсибилизирующим антигеном. После иммунизации повышение уровня сывороточных антител обнаруживают обычными способами.
Поликлональные антитела против белков по настоящему раскрытию можно получить следующим образом. После проверки того, что желаемый уровень антител в сыворотке был достигнут, отбирают кровь у млекопитающего, сенсибилизированного антигеном. Сыворотку выделяют из крови с использованием обычных способов. Сыворотку, содержащую поликлональные антитела, можно использовать в качестве поликлонального антитела или, в соответствии с потребностями, фракцию, содержащую поликлональное антитело, можно дополнительно выделить из сыворотки. Например, фракцию антител, которые специфически распознают белок по настоящему изобретению, можно получить с использованием аффинной колонки, к которой присоединен белок. Затем фракцию можно дополнительно очистить с использованием колонки с белком A или белком G для того, чтобы получить иммуноглобулин G или M.
Для получения моноклональных антител после проверки того, что желаемый уровень антител в сыворотке млекопитающего, сенсибилизированного вышеописанным антигеном, был достигнут, у млекопитающего берут иммуноциты и используют для слияния клеток. Для этой цели спленоциты можно упомянуть в качестве предпочтительных иммуноцитов. В качестве родительских клеток, слитых с вышеупомянутыми иммуноцитами, предпочтительно используют клетки миеломы млекопитающих. Более предпочтительно, клетки миеломы, получившие особенность, которую можно использовать для разделения средствами слитых клеток, используют в качестве родительской клетки.
Слияние клеток между вышеупомянутыми иммуноцитами и клетками миеломы можно провести согласно известным способам, например, способом по Galfre и Milstein (Methods Enzymol. 73:3-46, 1981).
Гибридому, полученную при слиянии клеток, выбирают посредством культивирования клеток в стандартной селективной среде, например, культуральной среде HAT (среда, содержащая гипоксантин, аминоптерин и тимидин). Культивирование в этой среде HAT продолжают в течение периода, достаточного для того, чтобы клетки (не слитые клетки), кроме целевой гибридомы, погибли, как правило, от нескольких дней до нескольких недель. Затем выполняют обычный метод серийных разведений и гибридому, продуцирующую целевое антитело, отбирают и клонируют.
Помимо указанного выше способа для получения гибридом путем иммунизации животного, но не человека, антигеном, гибридому, продуцирующую целевые человеческие антитела с активностью связывания с белками, можно получить способом сенсибилизации лимфоцитов человека, например, лимфоцитов человека, инфицированных вирусом ЕВ, белками, белок-экспрессирующими клетками или их лизатами in vitro и слияния сенсибилизированных лимфоцитов с клетками миеломы человека, полученными из, например, U266 со способностью к постоянному клеточному делению.
Моноклональные антитела, полученные посредством трансплантации полученных гибридом в брюшную полость мыши и экстрагирования асцита, можно очистить, например, путем осаждения сульфатом аммония, на колонке с белком А или белком G, ионообменной хроматографией DEAE, на аффинной колонке, к которой присоединен белок по настоящему раскрытию, и так далее.
Моноклональные антитела можно также получить в виде рекомбинантных антител, производимых с помощью метода генной инженерии (см., например, Borrebaeck C.A.K. и Larrick J.W., THERAPEUTIC MONOCLONAL ANTIBODIES, опубликованное в Соединенном Королевстве MACMILLAN PUBLISHERS LTD (1990)). Рекомбинантные антитела получают путем клонирования кодирующей ДНК из иммуноцитов, таких как гибридома или антителообразующие сенсибилизированные лимфоциты, встраивания в подходящий вектор и введения этого вектора в хозяина для производства антитела. Настоящее раскрытие также охватывает такие рекомбинантные антитела.
Антитела или фрагменты антител, специфичные для белка, кодируемого одним или несколькими биомаркерами, также можно создать с помощью способов in vitro, таких как фаговый дисплей.
Кроме того, антитело по настоящему раскрытию может быть фрагментом антитела или модифицированным антителом до тех пор, пока оно связывается с белком, кодируемым биомаркером по настоящему изобретению. Например, Fab, F (ab’) 2, Fv или одноцепочечный Fv (scFv), в котором Fv H-цепи и Fv L-цепи соответствующим образом связаны линкером (Huston и соавт., Proc. Natl. Acad. Sci. USA, 85:5879-5883, (1988)), можно предоставить в качестве фрагментов антитела. В частности, фрагменты антитела создают обработкой антитела ферментами, например, папаином или пепсином. В качестве альтернативы, их можно создать посредством конструирования гена, кодирующего фрагмент антитела, введения его в вектор экспрессии и экспрессирования этого вектора в подходящих клетках-хозяевах (см., например, Co и соавт., J. Immunol., 152:2968-2976, 1994; Better и соавт., Methods Enzymol., 178:476-496, 1989; Pluckthun и соавт., Methods Enzymol., 178:497-515, 1989; Lamoyi, Methods Enzymol., 121:652-663, 1986; Rousseaux и соавт., Methods Enzymol., 121:663-669, 1986; Bird и соавт., Trends Biotechnol., 9:132-137, 1991).
Антитела можно конъюгировать с различными молекулами, такими как флуоресцентные вещества, радиоактивные вещества и люминесцентные вещества. Способы присоединения таких фрагментов к антителу уже установлены и являются общепринятыми в данной области (см., например, патент США № 5057313 и № 5156840).
Примеры способов, которыми анализируют антиген-связывающую активность антител, включают, например, измерение оптической плотности, твердофазный иммуноферментный анализ (ELISA), иммуноферментный анализ (EIA), радиоиммунологический анализ (RIA) и/или иммунофлуоресценцию. Например, при использовании ELISA белок, кодируемый биомаркером по настоящему изобретению, добавляют на планшет, покрытый антителами по настоящему раскрытию, и затем добавляют образец антител, например, культуральные супернатанты клеток, продуцирующих антитела, или очищенные антитела. Затем добавляют вторичное антитело, распознающее первичное антитело, которое помечено щелочной фосфатазой, и определенные ферменты, планшет инкубируют и промывают и измеряют оптическую плотность для оценки антиген-связывающей активности после добавления субстрата фермента, такого как p-нитрофенилфосфат. В качестве белка можно использовать фрагмент белка, например, фрагмент, содержащий С-конец, или фрагмент, содержащий N-конец. Для оценки активности антитела по настоящему изобретению можно использовать BIAcore (GE Healthcare).
При использовании этих способов антитело по настоящему изобретению и образец, предположительно содержащий белок по настоящему изобретению, вводят в контакт и белок, кодируемый биомаркером по настоящему изобретению, выявляют или количественно анализируют путем обнаружения или количественного анализа иммунного комплекса, образованного между вышеупомянутым антителом и белком.
Способы количественного анализа на основе масс-спектрометрии, например, но без ограничения, подходы на основе мониторинга множественных реакций в комбинации с внутренними стандартами, мечеными стабильными изотопами, являются альтернативой иммунологическим анализам для количественного определения белков. Эти подходы не требуют применения антител и поэтому данные анализы можно выполнить экономически и по времени более эффективным образом (см., например, Addona и соавт., Nat. Biotechnol., 27:633–641, 2009; Kuzyk и соавт, Mol. Cell Proteomics, 8:1860–1877, 2009; Paulovich и соавт., Proteomics Clin. Appl., 2:1386-1402, 2008). Кроме того, MRM предлагает превосходные возможности мультиплексирования, позволяя одновременное количественное определение многочисленных белков в параллелях. Основная теория этих способов была хорошо обоснована и широко использована для метаболизма лекарственных средств и фармакокинетического анализа малых молекул.
В другом варианте осуществления уровень экспрессии представляющего интерес гена определяют путем измерения уровней РНК. Множество подходящих способов можно использовать для обнаружения и/или измерения уровня экспрессии иРНК гена. Например, экспрессию иРНК можно определить с помощью анализа нозерн-блот или дот-блот, PCR с обратной транскриптазой (RT-PCR; например, количественной RT-PCR), гибридизацией in situ (например, количественной гибридизацией in situ) или анализа полинуклеотидной матрицы (например, олигонуклеотидные матрицы или генные чипы). Подробности таких способов описаны ниже и в, например, Sambrook и соавт., Molecular Cloning: A Laboratory Manual Second Edition vol. 1, 2 и 3. Cold Spring Harbor Laboratory Press: Cold Spring Harbor, New York, USA, Nov. 1989; Gibson и соавт. (1999) Genome Res., 6(10):995-1001; и Zhang и соавт. (2005) Environ. Sci. Technol., 39(8):2777-2785; публикация заявки на патент США № 2004086915; Европейский патент № 0543942 и патент США № 7101663; раскрытие каждого из которых включено в данный документ с помощью ссылки во всей своей полноте.
В одном примере присутствие или количество одной или нескольких отдельных популяций иРНК в биологическом образце можно определить путем выделения общей иРНК из биологического образца (см., например, Sambrook и соавт. (supra) и патент США № 6812341) и подвергая выделенную иРНК электрофорезу в агарозном геле для разделения иРНК по размеру. Разделенную по размеру иРНК затем переносят (например, путем диффузии) на твердую подложку, такую как нитроцеллюлозная мембрана. Присутствие или количество одной или нескольких популяций иРНК в биологическом образце можно затем определить с помощью одного или нескольких поддающихся обнаружению меченых полинуклеотидных зондов, комплементарных представляющей интерес последовательности иРНК, которые связываются и таким образом делают обнаруживаемыми их соответствующие популяции иРНК. Поддающиеся обнаружению метки включают, например, флуоресцентные (например, умбеллиферон, флуоресцеин, флуоресцеина изотиоцианат, родамин, дихлортриазиниламина флуоресцеин, дансилхлорид, аллофикоцианин (АРС) или фикоэритрин), люминесцентные (например, европий, тербий, наночастицы Qdot™, поставляемые Quantum Dot Corporation, Palo Alto, Калифорния), радиологические (например, 125I, 131I, 35S, 32P, 33P или 3H) и ферментативные (пероксидаза хрена, щелочная фосфатаза, бета-галактозидаза или ацетилхолинэстераза) метки.
В другом примере присутствие или количество отдельных популяций иРНК (например, иРНК, кодируемой одним или несколькими генами, описанными в Таблице 1) в биологическом образце можно определить с помощью полинуклеотидных (или олигонуклеотидных) матриц (например, матрицы, описанной ниже в разделе «Матрицы»). Например, выделенную иРНК из биологического образца можно амплифицировать с помощью RT-PCR с, например, опосредованным случайным гексамером или олиго(dT)-праймером синтезом первой цепи. Ампликоны можно фрагментировать на более короткие сегменты. Этап RT-PCR можно использовать для снабжения ампликона поддающейся обнаружению меткой или, факультативно, ампликоны можно снабдить поддающейся обнаружению меткой после этапа RT-PCR. Например, поддающуюся обнаружению метку можно ферментативно (например, посредством ник-трансляции или киназы, такой как Т4-полинуклеотидкиназа) или химически конъюгировать с ампликонами, используя любую из множества подходящих методик (см., например, Sambrook и соавт., supra). Поддающиеся обнаружению меченые ампликоны можно затем приводить в контакт с совокупностью наборов полинуклеотидных зондов, при этом каждый набор содержит один или более полинуклеотидный (например, олигонуклеотидный) зонд, специфичный для (и способный связываться с) соответствующим ампликоном, и где совокупность содержит множество наборов зондов, каждый из которых соответствует отдельному ампликону. В целом, наборы зондов связывают с твердой подложкой и положение каждого набора зондов заранее определено на твердой подложке. Связывание поддающегося обнаружению меченого ампликона с соответствующим зондом из набора зондов указывает на присутствие или количество целевой иРНК в биологическом образце. Дополнительные способы для обнаружения экспрессии иРНК с помощью полинуклеотидных матриц описаны в, например, патентах США №№ 5445934; 6027880; 6057100; 6156501; 6261776 и 6576424; раскрытие каждого из которых включено в данный документ с помощью ссылки во всей своей полноте.
Способы обнаружения и/или количественной оценки поддающейся обнаружению метки зависят от природы метки. Продукты реакций, катализируемых соответствующими ферментами (где поддающаяся обнаружению метка представляет собой фермент; см. выше) могут быть, без ограничения, флуоресцентными, люминесцентными или радиоактивными, или они могут поглощать видимый или ультрафиолетовый свет. Примеры детекторов, подходящих для обнаружения таких поддающихся обнаружению меток включают, без ограничения, рентгеновскую пленку, счетчики радиоактивности, сцинтиляционные счетчики, спектрофотометры, колориметры, флуориметры, люминометры и денситометры.
Способы обнаружения или измерения экспрессии гена (например, экспрессии белка или иРНК) можно факультативно выполнить в форматах, которые позволяют быструю подготовку, обработку и анализ множества образцов. Это возможно выполнить, например, в многолуночном аналитическом планшете (например, 96 лунок или 386 лунок) или на матрицах (например, полинуклеотидных чипах или белковых чипах). Исходные растворы для различных реагентов могут быть получены вручную или роботизированно, и последующая подготовка образцов (например, RT-PCR, снабжение меткой или фиксация клеток), пипетирование, разведение, смешивание, распределение, промывка, инкубирование (например, гибридизация), считывание образца, сбор данных (оптические данные) и/или анализ (компьютерный анализ изображения) можно выполнить роботизированно с помощью доступного для приобретения аналитического программного обеспечения и измерительного оборудования, способного обнаруживать сигнал, генерируемый в результате анализа. Примеры таких детекторов включают, без ограничения, спектрофотометры, люминометры, флуориметры и устройства, которые измеряют радиоизотопный распад. В примерных высокопродуктивных анализах на клеточной основе (например, обнаружение присутствия или уровня целевого белка в клетке) можно использовать считывающее устройство ArrayScan® VTI HCS или технологию считывающего устройства KineticScan® HCS (Cellomics Inc., Питтсбург, Пенсильвания).
В некоторых вариантах осуществления уровень экспрессии двух генов, трех генов, четырех генов, пяти генов, шести генов, семи генов, восьми генов, девяти генов, 10 генов, 11 генов, или по меньшей мере двух генов, по меньшей мере трех генов, по меньшей мере четырех генов, по меньшей мере пяти генов, по меньшей мере шести генов, по меньшей мере семи генов, по меньшей мере восьми генов, по меньшей мере девяти генов, или по меньшей мере 10 генов из Таблицы 1 можно количественно оценить и/или измерить.
С целью обнаружения присутствия или уровня одного или нескольких генов, описанных в Таблице 1, любую часть последовательности нуклеиновой кислоты гена можно использовать, например, в качестве гибридизационных полинуклеотидных зондов или праймеров (например, для амплификации или обратной транскрипции). Зонды и праймеры могут быть олигонуклеотидами достаточной длины для обеспечения специфической гибридизации с РНК, ДНК, кДНК или их фрагментами, выделенными из биологического образца. В зависимости от конкретного применения различные условия гибридизации можно использовать для достижения различной степени селективности зонда или праймера по отношению к целевой последовательности. Праймеры и зонды можно снабдить поддающейся обнаружению меткой с помощью реагентов, которые облегчают обнаружение (например, флуоресцентные метки, химические метки (см. например, патенты США №№ 4582789 и 4563417) или модифицированные основания).
Стандартные условия жесткости описаны в Sambrook и соавт. (supra) и Haymes и соавт. Nucleic Acid Hybridization, A Practical Approach, IRL Press, Washington, D.C. (1985). Для того, чтобы молекула нуклеиновой кислоты служила в качестве праймера или зонда, ей только необходимо быть в достаточной степени комплементарной по последовательности, чтобы иметь возможность образовывать стабильную двухцепочечную структуру при используемых специфических условиях гибридизации (например, концентраций соли и растворителя).
Гибридизацию можно использовать для количественной оценки гомологии между двумя последовательностями нуклеиновых кислот. Последовательность нуклеиновой кислоты, описанной в данном документе, или ее фрагмент, можно использовать в качестве гибридизационного зонда согласно стандартным методам гибридизации. Гибридизация представляющего интерес зонда (например, зонда, содержащего участок нуклеотидной последовательности, описанной в данном документе, или ее комплементарную последовательность) с ДНК, РНК, кДНК или их фрагментом из тестируемого источника указывает на присутствие ДНК или РНК, соответствующей зонду, в тестируемом источнике. Условия гибридизации известны специалистам в данной области и могут быть обнаружены в Current Protocols in Molecular Biology, John Wiley & Sons, N.Y., 6.3.1-6.3.6, 1991. Условия гибридизации средней жесткости определяют как гибридизацию в 2Х хлорид натрия/цитрат натрия (SSC) при 30°C с последующей промывкой в 1X SSC, 0,1% SDS при 50°C. Очень жесткие условия определяют как гибридизацию в 6Х SSC при 45°C с последующей промывкой в 0,2 X SSC, 0,1% SDS при 65°C
Праймеры можно использовать в различных способах по типу PCR. Например, методы полимеразной цепной реакции (PCR) можно использовать для амплификации конкретных последовательностей из ДНК, а также РНК, в том числе, из общей геномной ДНК или общей клеточной РНК. Праймеры в PCR предназначены для фланкирования области, амплификация которой представляет интерес. Праймеры могут быть расположены рядом с 5'-концом, 3'-концом или в любом месте в пределах нуклеотидной последовательности, которая должна быть амплифицирована. Длина ампликона диктуется экспериментальными задачами. Для qPCR целевая длина ближе к 100 п.о. и для стандартной PCR она составляет около 500 п.о. Как правило, информация о последовательности на концах представляющей интерес области или за ней используют для конструирования олигонуклеотидных праймеров, которые являются идентичными или аналогичными по последовательности противоположным цепям матрицы, которая должна быть амплифицирована. Праймеры в PCR можно синтезировать химическим путем либо в виде одной молекулы нуклеиновой кислоты (например, с использованием автоматизированного синтеза ДНК в направлении 3'-5' с помощью фосфорамидитной технологии), или в виде серии олигонуклеотидов. Например, можно синтезировать одну или несколько пар длинных олигонуклеотидов (например, > 100 нуклеотидов), которые содержат необходимую последовательность, при этом каждая пара содержит короткий сегмент комплементарности (например, около 15 нуклеотидов), так что образуется двойная спираль, когда олигонуклеотидную пару отжигают. ДНК-полимеразу используют для удлинения олигонуклеотидов, получая одну двухцепочечную молекулу нуклеиновой кислоты на олигонуклеотидную пару.
Кроме того, последовательности нуклеиновых кислот или их фрагменты (например, олигонуклеотидные зонды) можно использовать в полинуклеотидных матрицах (таких как полинуклеотидные матрицы, описанные ниже в разделе «Матрицы»)) для обнаружения и/или количественной оценки экспрессии гена.
Создание профиля ответа
Способы, описанные в данном документе, можно также использовать для создания профиля ответа на терапию соединением ленватиниба (например, ленватиниба мезилата) для субъекта, имеющего рак эндометрия. Профиль может включать в себя, например, информацию, которая указывает на уровень экспрессии одного или нескольких генов (например, одного или нескольких генов, описанных в Таблице 1) до и после лечения с ленватинибом или его фармацевтически приемлемой солью; и/или гистологический анализ любых опухолей эндометрия. Профили ответа, описанные в данном документе, могут содержать информацию об экспрессии или уровне экспрессии по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере 10 генов, перечисленных в Таблице 1. Полученную информацию (профиль ответа на терапию ленватинибом) можно использовать для прогнозирования ответа субъекта (например, больного человека), имеющего, предположительно имеющего, или с риском развития рака эндометрия, на лечение, включающее соединение ленватиниба (например, ленватиниба мезилат).
Понятно, что профиль ответа на соединение ленватиниба (например, ленватиниба мезилат) может быть записан в электронной форме (например, электронная запись пациента, сохраненная на компьютере или другом электронном (машиночитаемом) носителе, таком как DVD, CD или дискета) или в письменной форме. Профиль ответа на соединение ленватиниба (например, ленватиниба мезилат) может также включать информацию для нескольких (например, двух, трех, четырех, пяти, 10, 20, 30, 50 или 100 или более) субъектов (например, больных людей). Такие мульти-субъектные профили ответа можно использовать, например, в анализе (например, статистическом анализе) специфических характеристик когорт субъектов.
Чувствительность субъекта к терапии, включающей ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат), можно классифицировать несколькими способами и классификация зависит от заболевания субъекта (например, распространенный или рецидивирующий рак эндометрия), тяжести заболевания и специфического лекарства, которое вводят субъекту. В простейшем смысле чувствительность представляет собой любое уменьшение в течении заболевания по сравнению с состоянием до лечения, и нечувствительность представляет собой отсутствие любых изменений в течении заболевания по сравнению с состоянием до лечения. Чувствительность субъекта (например, человека) с раком эндометрия можно классифицировать на основе одного или нескольких из числа объективных клинических признаков, таких как, но без ограничения, размер опухоли, клиническая эффективность (CB), выживаемость без прогрессирования заболевания (PFS), общая выживаемость (OS), % максимального уменьшения размеров опухоли (MTS) или частота объективных ответов (ORR).
«Клиническая эффективность» относится к наличию одного из следующих состояний-полный ответ (CR), частичный ответ (PR) или стабильное заболевание (SD) с 6 месяцами или более выживаемости без прогрессирования заболевания (PFS). «Полный ответ» означает полное исчезновение всех целевых поражений. «Частичный ответ» означает по меньшей мере 30% уменьшение суммы наибольшего диаметра (LD) целевых поражений, принимая в качестве стандарта исходный суммированный LD. «Прогрессирующее заболевание» (PD) означает по меньшей мере 20% увеличение суммы LD целевых поражений, принимая в качестве стандарта наименьший суммированный LD, записанный с начала лечения, или появление одного или нескольких новых поражений. «Стабильное заболевание» означает как недостаточное уменьшение размеров целевых поражений для определения PR, так и недостаточное увеличение для определения прогрессирующего заболевания (PD), принимая в качестве стандарта наименьший суммированный LD с начала лечения.
«Общую выживаемость» (OS) определяют как время от рандомизации до смерти по любой причине. «Рандомизация» означает рандомизацию пациента в тестируемую группу или контрольную группу при определении плана лечения для пациента.
«Выживаемость без прогрессирования заболевания» (PFS) относится к периоду от даты начала лечения до последней даты перед входом в состояние PD.
«% максимального уменьшения размеров опухоли» (MTS) означает процент изменения суммы диаметров целевых поражений, принимая в качестве стандарта исходную сумму диаметров.
«Частота объективных ответов» (ORR) сравнивает субъектов с полным ответом (CR) или частичным ответом (PR) с субъектами со стабильным заболеванием (SD) или прогрессирующим заболеванием (PD).
Способы лечения
Способы, раскрытые в данном документе, позволяют оценить, является или нет субъект, имеющий, предположительно имеющий, или с риском развития рака эндометрия, склонным отвечать на терапию, включающую соединение ленватиниба (например, ленватиниба мезилат). Субъекту, имеющему, предположительно имеющему, или с риском развития рака эндометрия, который склонен отвечать на соединение ленватиниба, могут ввести ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат). С другой стороны, субъекту, имеющему, предположительно имеющему, или с риском развития рака эндометрия, который не склонен отвечать на соединение ленватиниба, могут ввести другую терапию, которая подходит для лечения рака эндометрия.
Способы по данному раскрытию также делают возможным стратификацию субъектов, имеющих, предположительно имеющих, или с риском развития рака эндометрия, на группы субъектов, которые более склонны к пользе, и группы субъектов, которые менее склонны к пользе от терапии, включающей соединение ленватиниба (например, ленватиниба мезилат). Возможность выбора таких субъектов из пула субъектов с раком эндометрия, которых рассматривают для лечения с соединением ленватиниба, является полезной для введения эффективного курса лечения субъектам.
Ленватиниб или его фармацевтически приемлемая соль (например, ленватиниба мезилат) показывает мощные противоопухолевые эффекты, в частности, путем ингибирования ангиогенеза. Субъекты, которых рассматривают для лечения, включающего соединение ленватиниба (например, ленватиниба мезилат), включают, но без ограничения, субъектов, имеющих, предположительно имеющих, или склонных к развитию рака эндометрия. В одном варианте осуществления субъект, подлежащий лечению с ленватинибом или его фармацевтически приемлемой солью (например, ленватиниба мезилатом), имеет, предположительно имеет, или склонен к развитию распространенного рака эндометрия. В определенных вариантах осуществления субъект, подлежащий лечению с терапией, включающей соединение ленватиниба (например, ленватиниба мезилат), имеет, предположительно имеет, или склонен к развитию рецидивирующего рака эндометрия. В других вариантах осуществления субъект, подлежащий лечению с терапией, включающей соединение ленватиниба, имеет, предположительно имеет, или склонен к развитию рака эндометрия I стадии. В одном варианте осуществления субъект, подлежащий лечению с терапией, включающей соединение ленватиниба, имеет, предположительно имеет, или склонен к развитию рака эндометрия II стадии. В другом варианте осуществления субъект, подлежащий лечению с терапией, включающей соединение ленватиниба, имеет, предположительно имеет, или склонен к развитию рака эндометрия III стадии. В другом варианте осуществления субъект, подлежащий лечению с терапией, включающей соединение ленватиниба, имеет, предположительно имеет, или склонен к развитию рака эндометрия IV стадии. В некоторых вариантах осуществления рак эндометрия представляет собой неоперабельный рак III стадии или IV стадии.
Если субъект, имеющий рак эндометрия, является более склонным к ответу на терапию, включающую ленватиниб или его фармацевтически приемлемую соль (на основе концентраций одного или нескольких биомаркеров, описанных выше (например, белка Ang2), субъекту могут затем ввести эффективное количество соединения ленватиниба (например, ленватиниба мезилата). Эффективное количество соединения практикующий врач может соответствующим образом определить с учетом, например, характеристик пациента (возраст, пол, вес, раса и т.д.), прогрессирования заболевания и предшествующего воздействия лекарственного средства. Если субъект является менее склонным к ответу на терапию, включающую соединение ленватиниба, субъекту могут затем факультативно ввести терапию, которая не включает ленватиниб. Эти методы лечения включают, но без ограничения, радиоактивный йод, доксорубицин, карбоплатин, цисплатин, паклитаксель, сорафениб, доцетаксель, трастумаб, интерлейкин-2, интерферон, эверолимус, сунитиниб, пазораниб, вандетаниб и лечение «стандарт ухода» (т.е. преобладающей стандарт ухода, определенный практикующим врачом, или как указано в клиническом исследовании), такое как исследовательские лекарственные препараты и химиотерапия.
Субъекты всех возрастов могут страдать нарушениями, поддающимися лечению ленватинибом или его фармацевтически приемлемой солью (например, ленватиниба мезилатом). Таким образом, биологический образец, используемый в способах, описанных в данном документе, можно получить от субъекта (например, человека) любого возраста, в том числе ребенка, подростка или взрослого, такого как взрослый, имеющий, предположительно имеющий, или с риском развития рака эндометрия.
Способы также можно применить к лицам с риском развития рака эндометрия, поддающимся лечению ленватинибом или его фармацевтически приемлемой солью (например, ленватиниба мезилатом). Такие лица включают в себя тех, кто имеет (i) семейную историю (генетическую предрасположенность) к таким нарушениям или (ii) один или несколько факторов риска развития таких нарушений.
После стратификации или выбора субъекта на основе того, будет ли субъект более склонен к ответу на ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат), практикующий врач (например, доктор) может применить соответствующее терапевтическое средство к субъекту. Способы применения методов лечения с ленватинибом хорошо известны в данной области техники.
Понятно, что любая терапия, описанная в данном документе (например, терапия, включающая ленватиниб, или терапия, которая не включает ленватиниб), может включать в себя одно или несколько дополнительных терапевтических средств. То есть, любую терапию, описанную в данном документе, можно совместно вводить (вводить в комбинации) с одним или несколькими дополнительными терапевтическими средствами, такими как, но без ограничения, доксорубицин, карбоплатин, цисплатин, паклитаксель, доцетаксель, трастумаб и эверолимус. Кроме того, любая терапия, описанная в данном документе, может включать в себя одно или несколько средств для лечения, например, боли, тошноты и/или одного или нескольких побочных эффектов терапии, включающей ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат).
Комбинированные методы терапии (например, совместное введение терапии, включающей ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат), и одного или нескольких дополнительных терапевтических средств) может быть, например, одновременным или последовательным. Например, ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат) и одно или несколько дополнительных терапевтических средств можно ввести в одно время или соединение ленватиниба (например, ленватиниба мезилат) можно ввести первым по времени и одно или несколько дополнительных терапевтических средств ввести вторым по времени. В некоторых вариантах осуществления одно или несколько дополнительных терапевтических средств можно ввести первыми по времени и ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат) ввести вторым по времени.
В случаях, когда к субъекту, имеющему рак эндометрия и прогнозированному как отвечающий на терапию с соединением ленватиниба (например, ленватиниба мезилатом), ранее применили один или несколько не включающих ленватиниб методов лечения, терапия, включающая соединение ленватиниба, может заместить или усилить ранее или в настоящее время вводимую терапию. Например, при лечении с терапией, включающей ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат), применение одного или нескольких не включающих ленватиниб методов лечения можно прекратить или уменьшить, например, вводить на более низких уровнях. Введение предшествующей терапии можно продолжать во время ввода терапии, включающей ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат). В некоторых вариантах осуществления предшествующую терапию можно сохранить до тех пор, пока уровень терапии, включающей ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат), не достигнет уровня, достаточного для обеспечения терапевтического эффекта.
Матрицы
Полинуклеотидные матрицы, в том числе полинуклеотидные биомаркеры, раскрытые в данном документе, пригодны, например, для обнаружения экспрессии гена и/или измерения уровней экспрессии гена. Матрицы также пригодны для, например, прогнозирования ответа субъекта, имеющего рак эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат), для идентификации субъектов, имеющих рак эндометрия, которые могут получить пользу от терапии, включающей ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат), и для направления субъектов, имеющих рак эндометрия, которые не склонны получить пользу от терапии, включающей ленватиниб или его фармацевтически приемлемую соль (например, ленватиниба мезилат), на другие методы лечения рака.
Матрица представляет собой упорядоченное расположение образцов, где совмещение известных и неизвестных образцов ДНК осуществляют на основе правил спаривания оснований (например, аденозин образует пару с тимином или урацилом; гуанозин образует пару с цитозином). Типичный эксперимент с микроматрицей включает гибридизацию молекулы иРНК, кДНК или их фрагментов с ДНК-матрицей, из которой она произошла или получена. Множество образцов ДНК используют для конструирования матрицы. ДНК из по меньшей мере одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, или одиннадцати генов в Таблице 1 можно использовать для конструирования матрицы. В эксперименте с матрицей используют общеизвестные аналитические системы, такие как микропланшеты или стандартные мембраны для блоттинга. Размер пятна образца составляет как правило менее чем 200 микрометров в диаметре и матрица обычно содержит тысячи пятен. Тысячи нанесенных образцов, известных как зонды (с известной идентичностью), иммобилизуют на субстрате (например, предметные стекла для микроскопа, кремниевые чипы, нейлоновая мембрана). Пятна могут быть ДНК, кДНК или олигонуклеотидами. Их используют для определения комплементарного связывания неизвестных последовательностей, делая возможным, таким образом, параллельный анализ экспрессии генов и обнаружения генов. Эксперимент с одним ДНК-чипом может предоставить информацию о тысячах генов одновременно. Упорядоченное расположение зондов на носителе является важным, поскольку местоположение каждого пятна на матрице используют для идентификации гена. Количество иРНК, связанной с каждым сайтом на матрице, указывает уровень экспрессии различных генов, которые включены в матрицу. При использовании матрицы, содержащей множество образцов ДНК, можно определить в одном эксперименте уровни экспрессии сотен или тысяч генов путем измерения количества иРНК, связанной с каждым сайтом на матрице. С помощью компьютера количество иРНК, связанной с пятнами на микроматрице, можно точно измерить, создавая профиль экспрессии генов в клетке.
Две основные платформы ДНК-микроматриц, которые обычно используют, представляют собой кДНК- и олигонуклеотидные микроматрицы. кДНК-микроматрицы изготавливают с длинными молекулами двухцепочечной ДНК, образованными с помощью ферментативных реакций, таких как PCR (Schena M. и соавт., Science, 270:467–470 (1995)), в то время как олигонуклеотидные микроматрицы используют олигонуклеотидные зонды, наносимые либо с помощью роботизированного осаждения или синтеза in situ на субстрате (Lockhart D.J. и соавт., Nat. Biotechnol., 14, 1675–1680 (1996)).
Наборы
Данная заявка также предусматривает наборы. В определенных вариантах осуществления набор может включать в себя антитело или антитела, которые можно использовать для обнаружения одного или нескольких биомаркеров, перечисленных в Таблице 1, или их концентрации или уровней экспрессии. Например, набор может включать в себя антитело, которое специфически связывает Ang2. Антитела в наборе могут быть моноклональными или поликлональными и могут быть дополнительно конъюгированы с обнаруживаемой меткой. В некоторых вариантах осуществления набор включает в себя зонды, которые можно использовать для идентификации или обнаружения любого из биомаркеров из Таблицы 1. В некоторых вариантах осуществления набор включает в себя любую из полинуклеотидных матриц, описанных в данном документе. В некоторых вариантах осуществления набор включает в себя зонды и антитела, которые можно использовать для идентификации или обнаружения любого из биомаркеров из Таблицы 1, или их экспрессии или уровней экспрессии. Набор может факультативно содержать инструкции для обнаружения и/или измерения концентрации одного или нескольких белков или уровней иРНК в биологическом образце.
Набор может факультативно включать в себя, например, контроль (например, концентрационный стандарт для анализируемого белка) или контрольный набор меченых ампликонов, содержащий известные количества одного или нескольких ампликонов, распознаваемых полинуклеотидными зондами матрицы. В некоторых случаях, контроль может быть вкладышем (например, бумажным вкладышем или электронным носителем, таким как CD, DVD или дискета), содержащим уровень экспрессии или диапазоны уровня экспрессии одного или нескольких белков или РНК, являющихся прогностическими относительно ответа на терапию, включающую соединение ленватиниба (например, ленватиниба мезилат).
В некоторых вариантах осуществления набор может включать в себя один или несколько реагентов для обработки биологического образца (например, калибровочные реагенты, буферы, растворители, цветные реагенты, реагенты для остановки реакции). Например, набор может включать в себя реагенты для выделения белка из биологического образца и/или реагенты для обнаружения присутствия и/или количества белка в биологическом образце (например, антитело, которое связывается с белком, являющимся субъектом анализа на обнаружение и/или антитело, которое связывается с антителом, связывающимся с белком).
В определенных вариантах осуществления набор включает в себя по меньшей мере один микропланшет (например, 96-луночный планшет, т.е. 12 полосок по 8 лунок). Микропланшет может быть предоставлен с соответствующей ему крышкой планшета. Микропланшет может быть из полистирола или из любого другого подходящего материала. На микропланшете может быть антитело, которое используют для идентификации присутствия специфического биомаркера, покрывающее изнутри каждую лунку. Антитело может быть конъюгировано с обнаруживаемой меткой. Набор может также включать по меньшей мере одну липкую ленту.
В некоторых вариантах осуществления набор может включать пакет программ для анализа результатов, например, профиля экспрессии или анализа микроматриц.
Набор может также включать одно или несколько антител для обнаружения экспрессии белка любого из генов, описанных в данном документе. Например, набор может включать в себя (или в некоторых случаях состоять из) одно или множество антител, способных специфически связываться с одним или несколькими белками, кодируемыми любым из генов, описанных в Таблице 1, и, факультативно, инструкции для обнаружения и/или измерения концентрации одного или нескольких белков и/или обнаружения антитела, включающего поддающееся обнаружению меченое антитело, которое способно связываться с по меньшей мере одним антителом из множества. В некоторых вариантах осуществления набор может включать в себя антитела, которые распознают один, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере восемь, по меньшей мере девять, по меньшей мере 10 или 11 белков, кодируемых генами, перечисленными в Таблице 1.
В определенных вариантах осуществления набор может также включать в себя одну или несколько стандартных доз соединения ленватиниба (например, ленватиниба мезилата).
Набор, описанный в данном документе, может также факультативно включать в себя инструкции по применению терапии, включающей соединение ленватиниба, где концентрация одного или нескольких белков или уровень экспрессии одной или нескольких РНК прогнозирует, что субъект, имеющий, предположительно имеющий, или с риском развития рака эндометрия будет отвечать на терапию, включающую соединение ленватиниба (например, ленватиниба мезилат).
В конкретном варианте осуществления набор включает в себя одно или более из следующего:
(i) микропланшет (например, 96-луночный планшет). Микропланшет может быть покрыт антителом против Ang2, которое конъюгировано с обнаруживаемой меткой. Антитело против Ang2 может быть моноклональным или поликлональным. Антитело может быть, например, получено, из мыши, кролика, крысы или морской свинки. Обнаруживаемая метка может представлять собой, например, пероксидазу хрена, биотин, флуоресцентный фрагмент, радиоактивный фрагмент, гистидиновую метку или пептидную метку. Микропланшет может быть предоставлен с крышкой и, факультативно, одной или несколькими липкими лентами.
(ii) флакон, содержащий антитело против Ang2, конъюгированное с обнаруживаемой меткой. Обнаруживаемая метка может представлять собой, например, пероксидазу хрена, биотин, флуоресцентныей фрагмент, гистидиновую метку, пептидную метку. Флакон может также включать в себя консервант.
(iii) флакон, содержащий стандарт Ang2 с известной концентрацией. Ang2 может быть рекомбинантным человеческим Ang2.
(iv) флакон, содержащий аналитический растворитель.
(v) флакон, содержащий калибровочный растворитель.
(vi) флакон, содержащий промывочный буфер. Буфер может быть обеспечен в виде концентрата.
(vii) один или несколько флаконов, содержащих цветные реагенты.
(viii) флакон, содержащий стоп-реагент для остановки колориметрической реакции.
Ниже приведены примеры осуществления на практике настоящего изобретения. В любом случае они не должны быть истолкованы как ограничение объема настоящего изобретения.
ПРИМЕРЫ
Пример 1: Идентификация прогностических биомаркеров для отбора пациентов с раком эндометрия для лечения с E7080 (ленватиниба мезилат)
Цель: Ангиогенез регулируется посредством передачи сигнала через множество рецепторов факторов роста, таких как рецептор VEGF и рецептор FGF. Передача сигнала рецептора VEGF также ассоциирована с функцией иммунных клеток. E7080 представляет собой пероральный ингибитор ангиогенеза, направленный на множество рецепторных тирозинкиназ; VEGFR1-3, FGFR1-4, RET, KIT и PDGFRв. Фазу II исследования выполнили на пациентах с распространенным или рецидивирующим раком эндометрия (EC) после 1 или 2 предшествующих курсов лечения на основе платины (Tx). Важность ангиогенеза при ЕС подчеркивает необходимость понимания клинических механизмов ухода от антиангиогенной терапии. Этот анализ клинических биомаркеров провели для выявления прогностических маркеров клинической эффективности у пациентов с ЕС при лечении Е7080. Циркулирующие цитокины и ангиогенные факторы (CAF) можно измерить в образцах крови с помощью ELISA и мультиплексных аналитических платформ. CAF, проверенные в данном исследовании, перечислены ниже в Таблице 2. Число в скобках указывает область гранулы для каждого аналита.
Таблица 2: Перечень проверенных CAF
Целью данного анализа было измерение цитокинов, хемокинов и ангиогенных факторов в образцах крови, таких как плазма и сыворотка, полученных от пациентов в клинических испытаниях как до, так и после лечения с Е7080, и для выявления биомаркеров крови, которые можно использовать для прогнозирования того, будут ли пациенты отвечать на терапию с Е7080. Для этих анализов использовали следующие критерии ответа, а именно:
(a) Ответ опухоли: частота объективных ответов (ORR) и % максимального уменьшения размеров опухоли (MTS); и
(b) Преимущества в выживаемости: выживаемость без прогрессирования заболевания (PFS) / общая выживаемость (OS).
Критерии ответа определены ниже.
«Полный ответ» означает полное исчезновение всех целевых поражений.
«Частичный ответ» означает по меньшей мере 30% уменьшение суммы наибольшего диаметра (LD) целевых поражений, принимая в качестве стандарта исходный суммированный LD.
«Прогрессирующее заболевание» (PD) означает по меньшей мере 20% увеличение суммы LD целевых поражений, принимая в качестве стандарта наименьший суммированный LD, записанный с начала лечения, или появление одного или нескольких новых поражений.
«Стабильное заболевание» означает как недостаточное уменьшение размеров целевых поражений для определения PR, так и недостаточное увеличение для определения прогрессирующего заболевания (PD), принимая в качестве стандарта наименьший суммированный LD с начала лечения.
«Частота объективных ответов» (ORR) сравнивает субъектов с «полным ответом» (CR) или «частичным ответом» (PR) с субъектами или со стабильным заболеванием (SD) или прогрессирующим заболеванием (PD).
«% максимального уменьшения размеров опухоли» (MTS) означает процентное изменение суммы диаметров целевых поражений, принимая в качестве стандарта исходную сумму диаметров, корреляцию генной мутации с TS анализируют с помощью коэффициента корреляции по смешанным моментам Пирсона и критерия с коэффициентом ранговой корреляции Спирмана.
«Выживаемость без прогрессирования заболевания» (PFS) относится к периоду от начальной даты лечения до последней даты перед входом в состояние PD, и корреляцию генной мутации с PFS анализируют с помощью логарифмического рангового критерия и модели пропорциональных рисков Кокса.
«Общая выживаемость» (OS) относится ко времени от рандомизации до смерти по любой причине. «Рандомизация» означает рандомизацию пациента в тестируемую группу или контрольную группу при определении плана лечения для пациента.
Материалы и способы: Пациенты, которые имели метастатический/неоперабельный рак эндометрия после 1 или 2 предшествующих курсов лечения на основе платины, получали ленватиниб до прогрессирования заболевания или развития неконтролируемых токсических эффектов. Пациенты получали Е7080 в начальной дозе 24 мг перорально один раз в день циклами по 28 дней. 133 пациента прошли лечение и у них оценили эффективность и молекулярный корреляционный анализ. Данное исследование представляло собой часть многоцентрового исследования ленватиниба Фазы 2 (идентификатор на ClinicalTrial.gov: NCT01111461). Исходные и после лечения образцы плазмы собрали для молекулярных анализов. Образцы плазмы собрали в День 1 Цикла 1 (до лечения) и в День 1 Цикла 2 (т.е. 39-й день после лечения). Шесть мл венозной крови втянули в вакуумные контейнерные пробирки с EDTA .Пробирки осторожно перевернули 6-8 раз и затем центрифугировали при 3000 об./мин в течение 10 минут, чтобы отделить плазму от слоя красных клеток. Плазму собрали из пробирки и распределили по 3,5 мл криопробиркам с помощью пипетки для переноса и затем сохранили незамедлительно при -20oC. Образцы плазмы были транспортированы на сухом льду и в конечном счете перенесены на хранение при -80oC. Образцы плазмы от 122 пациентов использовали для анализа биомаркеров крови. Сыворотку дня 1 цикла 1 (исходная) и дня 1 цикла 2 использовали в этом анализе. Проанализировали ассоциацию выживаемости без прогрессирования заболевания (PFS) и общую выживаемость (OS). Образцы плазмы протестировали в пакетном формате, так что все временные точки от одного субъекта проанализировали в один день. В день анализа образцы извлекли из -80oC и дали им растаять и достичь комнатной температуры. Образцы плазмы протестировали на панели ELISA и мультиплексном наборе в соответствии с инструкциями производителя. В Таблице 3 описаны аналитические наборы, использованные в анализе. Планшеты ELISA измерили с помощью кинетического считывающего устройства для микропланшетов Molecular Devices UVmax с программным обеспечением SoftMax Pro 5.2 .Мультиплексные анализы выполнили с помощью системы Bio-Rad Bio-Plex с программным обеспечением Bio-Plex Manager 4.1. Конечные концентрации белка (пг/мл) рассчитали по стандартной кривой для каждого анализа. В зависимости от анализа образцы плазмы могли быть разведены в аналитическом буфере перед тестированием. В этих случаях концентрации белка умножили на коэффициент разведения.
Таблица 3. Аналитические наборы
Число в скобках указывает область гранулы для каждого аналита.
Результаты и обсуждение: Из образцов 133 пациентов образцы от 122 пациентов использовали для анализов. Существенные изменения уровней 19 CAF из 50 протестированных CAF наблюдали после лечения (день 1 цикла 2) в плазме пациентов, подвергнутых лечению с Е7080 по сравнению с уровнями до лечения (день 1 цикла 1) (исходный) (Фиг. 1).
Выполнили модель пропорциональных рисков Кокса для выявления биомаркеров крови, которые прогнозируют выживаемость без прогрессирования заболевания по исходным уровням CAF. Исходные уровни ANG2(90), Ang-2, HGF(86), IL-8(40), MCP-1(58), MIP-1a(58), PGF(91), sIL-2Ra(76), Tie-2, TNFa(80) и VEGFA(100) были значимо ассоциированы с более длинной OS, указывая, что эти факторы можно использовать в качестве биомаркеров для прогноза заболевания или прогноза ответа на терапию с E7080 (Таблица 4).
Таблица 4. Исходные уровни биомаркеров крови, ассоциированных с OS
(58)
(76)
(100)
OS: одномерная модель пропорциональных рисков Кокса, HRperSD: отношение рисков для увеличения S.D. на 1
OOR = вне диапазона
Анализ квартильных подгрупп на основе исходных уровней CAF показал, что самые низкие исходные группы ANG2(90), Ang-2, HGF(86), IL-8(40), MCP-1(58), MIP-1a(58), PGF(91), sIL-2Ra(76), Tie-2, и TNFa(80) имели самую длинную среднюю OS, в то время как самые высокие исходные группы Ang-2, HGF(86), IL-8(40), MCP-1(58), MIP-1a(58), PGF(91), sIL-2Ra(76), Tie-2, TNFa(80) и VEGFA(100) имели самую короткую среднюю OS (Таблица 5).
Таблица 5. Средняя OS с 4 подгруппами на основе исходного CAF

Выполнили модель пропорциональных рисков Кокса для выявления биомаркеров крови, которые прогнозируют выживаемость без прогрессирования заболевания по исходным уровням CAF. Низкие исходные уровни ANG2(90), Ang-2, HGF(86), IL-8(40), IP-10(56), MCP-1(58), MIP-1a(64), PGF(91), sIL-2Ra(76), Tie-2, TNFa(80), VEGFA(100) были значимо ассоциированы с более длинной PFS (Таблица 6).
Таблица 6. Исходные уровни биомаркеров крови, ассоциированных с PFS
PFS: одномерная модель пропорциональных рисков Кокса, HRperSD: отношение рисков для увеличения S.D. на 1
OOR = вне диапазона
Анализ квартильных подгрупп на основе исходных уровней CAF показал, что самые низкие исходные группы ANG2(90), Ang-2, HGF(86), IL-8(40), MCP-1(58), MIP-1a(64), PGF(91), sIL-2Ra(76), Tie-2, и TNFa(80) имели самую длинную среднюю PFS, в то время как самые высокие исходные группы ANG2(90), Ang-2, HGF(86), IL-8(40), IP-10(56), MCP-1(58), PGF(91), sIL-2Ra(76), Tie-2, TNFa(80), VEGFA(100) имели самую короткую среднюю PFS (Таблица 7).
Таблица 7. Средняя PFS с 4 подгруппами на основе исходного CAF

Затем оценили, ассоциированы ли исходные уровни CAF с ответом опухоли (ORR и MTS). Точный критерий Вилкоксона показал, что средние исходные уровни Ang-2 и ANG-2(90) значимо отличались у пациентов, которые ответили на лечение с E7080 (CR или PR группа), по сравнению с группой «других» (пациенты с SD или PD) (Таблица 8 и Фиг. 2).
Таблица 8. Исходные уровни биомаркеров крови, ассоциированных с ORR
N; число, NN(ORR+:ORR-); медиана.разница. (diff) (ORR+ : ORR-); OOR = вне диапазона
Критерий ранговой корреляции Спирмана показал, что медианные исходные уровни Ang-2, ANG-2 и IL-8 значимо ассоциировали с MTS (Таблица 9 и Фиг. 2).
Таблица 9. Исходные уровни биомаркеров крови, ассоциированных с MTS
MTS: Критерий ранговой корреляции Спирмана
Модель пропорциональных рисков Кокса и анализ квартильных подгрупп на основе возраста, веса и гистологии продемонстрировали, что не было ассоциации между этими переменными и преимуществами в выживаемости (Фиг. 3).
В Таблице 10 суммирован корреляционный анализ исходных CAF с клиническими результатами для ответа опухоли и преимуществ в выживаемости. Исходные уровни 11 CAF (Ang-2, IL-8, HGF, VEGFA, PlGF, Tie-2, MCP-1, MIP1a, sIL2Ra, TNFa, IP-10) значимо ассоциированы с преимуществами в выживаемости. Однако только исходный уровень ангиопоэтина-2 был ассоциирован как с ответом опухоли (ORR и MTS), так и с преимуществами в выживаемости (OS и PFS). Эти данные указывают, что исходный уровень ангиопоэтина-2 прогнозирует клинические результаты лечения с E7080, и другие исходные уровни других CAF были ассоциированы с прогнозом при EC.
Таблица 10. Исходные уровни CAF ассоциированы с клиническими результатами
OS: общая выживаемость - одномерная модель пропорциональных рисков Кокса; PFS: выживаемость без прогрессирования заболевания - одномерная модель пропорциональных рисков Кокса; ORR: частота объективных ответов - точный критерий Вилкоксона; %MTS: % максимального уменьшения размеров опухоли - тест ранговой корреляции Спирмана.
Многофакторный анализ выполнили для проверки того, улучшает ли комбинирование двух или более факторов прогнозы клинических результатов. Все факторы (т.e. вес, возраст, Ang-1, Ang-2, ANG2(90), FGF-2(6), FGF4(75), HGF(86), IL-8(40), PDGF-AA, PDGFAB(68), PDGFBB(73), PGF(91), Tie-2, VEGF(86), VEGFA(100), VEGFD(78)) использовали в качестве представляющих интерес независимых переменных, то есть в качестве кандидатов в биомаркеры. Модели идентифицировали с помощью модели пропорциональных рисков Кокса методом ускоренного отбора, используя переменные, выявленные при одномерном анализе и с пониманием биологии. PFS и OS в данном анализе использовали в качестве зависимых переменных, то есть в качестве одного из клинических результатов. Во-первых, все факторы проверили согласно р-значениям, рассчитанным с помощью модели пропорциональных рисков Кокса с одним фактором. Во-вторых, все комбинации проверенных факторов протестировали с помощью модели пропорциональных рисков Кокса, чтобы найти значимые факторы во всех комбинациях факторов. В модели с PFS выявили Ang-2 как единственный фактор. В модели с OS выявили FGF-2, PGF и HGF как дополнительные факторы, хотя Ang-2 был отобран как намного более значимый фактор (Фиг. 4).
Пороговое значение Ang-2 использовали для проверки того, имеют ли пациенты с исходными уровнями Ang-2 лучшие клинические результаты, такие как ORR, PFS и OS. В случае использования ORR можно применить анализ характеристической кривой обнаружения (ROC). При данных коэффициентах в ROC положительная прогностическая ценность (PPV) дает эффективность в подгруппе, имеющей лучшие клинические результаты. Вероятное пороговое значение можно выбрать из диапазона Ang-2, определенного путем установки целевой PPV, например, 30% или более. Кроме того, в случае использования PFS разделение кривых Kaplan-Meier двух групп, разделенных порогом, например, р-значением из логарифмического рангового критерия, можно использовать в качестве меры. Вероятное пороговое значение можно выбрать из диапазона Ang-2, определенного путем установки целевого р-значения, например, P=0,001. Кроме того, диапазон Ang-2 можно определить путем комбинирования двух способов для ORR и PFS. Первый способ для ORR выявил верхний предел Ang-2 как 6024,5 пг/мл и второй способ для PFS выявил нижний предел Ang-2 как 1866,5 пг/мл. В данном диапазоне ROC-анализ с последующим индексом Youden и MCC может предоставить оптимальное пороговое значение Ang-2 для прогноза подгруппы, имеющей лучшую ORR, как 2082,5 пг/мл (Таблица 11).
Таблица 11. Анализ характеристических кривых обнаружения с последующим логарифмическим ранговым критерием для OS
корреляция
порог
.OS.N
OS. N высок. Gr
OS.% высок. Gr
OS.p.logrank
OS.HR
OS.HR.CI
24 пациентов с низкими исходными уровнями Ang-2 в плазме (т.e. <2082 пг/мл) сравнили с 98 пациентами с высоким исходным Ang-2 (т.e. > 2082 пг/мл). Логарифмический ранговый критерий, используя определенные пороговые значения, продемонстрировал улучшенную среднюю PFS (9,5 против 3,7 месяцев) и среднюю OS (23 против 8,9 месяцев) в подгруппе с низкими исходными уровнями Ang-2 по сравнению с подгруппой с высокими исходными уровнями Ang-2 (Фиг. 5). Улучшенную ORR (61% против 18%) также продемонстрировали в подгруппе с низким исходным Ang-2 по сравнению с подгруппой с высоким исходным Ang-2 (Фиг. 6). Данные анализы указывают, что исходный уровень Ang-2 идентифицирует пациентов с ЕС, которые имеют явную пользу от курсов лечения с Е7080. В данном контексте следует отметить, что ORR, mPFS и mOS без стратификации на основе уровней Ang-2 составляют 21,1%, 5,4 месяцев и 10,6 месяцев, соответственно (Таблица 12).
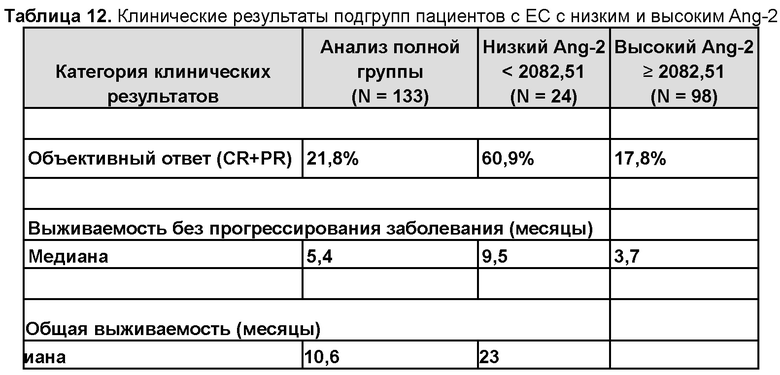
Заключение: Исходные уровни 11 CAF были ассоциированы одновременно с OS и PFS. Только исходные уровни Ang-2 были ассоциированы как с преимуществами в выживаемости (OS и PFS), так и с ответом опухоли (ORR). Таким образом, низкие исходные уровни Ang-2 играют независимую роль в прогнозировании чувствительности к лечению с Е7080 среди пациентов с раком эндометрия.
Пример 2: Подтверждение Ang2 в качестве специфического прогностического биомаркера для отбора пациентов с раком щитовидной железы и раком эндометрия для лечения с E7080 (ленватиниба мезилатом)
Цель: Прогностическая роль Ang2 была продемонстрирована для рака щитовидной железы и рака эндометрия. Прогностическая роль других признаков рака не была оценена. Не подтверждено, что Ang2 представляет собой надежный биомаркер для рака или специфический биомаркер для определенных форм рака. Целью данного анализа было подтвердить, что Ang2 является специфическим биомаркером при раке щитовидной железы и раке эндометрия для выбора пациентов для лечения с Е7080. Для этого анализа использовали следующие критерии ответа, а именно:
(a) Ответ опухоли: частота объективных ответов (ORR) и
(b) Преимущества в выживаемости: общая выживаемость (OS).
Критерии ответа определены ниже.
«Полный ответ» означает полное исчезновение всех целевых поражений.
«Частичный ответ» означает по меньшей мере 30% уменьшение суммы наибольшего диаметра (LD) целевых поражений, принимая в качестве стандарта исходный суммированный LD.
«Прогрессирующее заболевание» (PD) означает по меньшей мере 20% увеличение суммы LD целевых поражений, принимая в качестве стандарта наименьший суммированный LD, записанный с начала лечения, или появление одного или нескольких новых поражений.
«Стабильное заболевание» означает как недостаточное уменьшение размеров целевых поражений для определения PR, так и недостаточное увеличение для определения прогрессирующего заболевания (PD), принимая в качестве стандарта наименьший суммированный LD с начала лечения.
«Частота объективных ответов» (ORR) сравнивает субъектов с «полным ответом» (CR) или «частичным ответом» (PR) с субъектами со стабильным заболеванием (SD) или прогрессирующим заболеванием (PD).
«Общая выживаемость» (OS) относится ко времени от рандомизации до смерти по любой причине. «Рандомизация» означает рандомизацию пациента в тестируемую группу или контрольную группу при определении плана лечения для пациента.
Материалы и способы: Пациенты получали ленватиниб до прогрессирования заболевания или развития неконтролируемых токсических эффектов. Данное исследование представляло собой часть следующих исследований ленватиниба Фазы 2:
Оценка безопасности и эффективности перорального E7080 при медуллярных и невосприимчивых к йоду-131 неоперабельных дифференцированных формах рака щитовидной железы, стратифицированных по гистологии (идентификатор на ClinicalTrial.gov: NCT00784303)
Исследование Е7080 у пациентов с распространенной гепатоцеллюлярной карциномой (HCC) (идентификатор на ClinicalTrials.gov: NCT00946153)
Исследование субъектов с рецидивирующей злокачественной глиомой (идентификатор на ClinicalTrials.gov: NCT01137604)
Исследование Е7080 у субъектов с распространенным раком эндометрия и прогрессированием заболевания (идентификатор на ClinicalTrials.gov: NCT01111461)
Открытое 2-когортное многоцентровое исследование Е7080 у ранее леченых субъектов с неоперабельной меланомой стадии III или стадии IV (идентификатор на ClinicalTrials.gov: NCT01136967)
Исходные и после лечения образцы плазмы или сыворотки собрали для молекулярного анализа и исходные образцы использовали в данном анализе. Образцы протестировали в ELISA и мультиплексном наборе в соответствии с инструкциями производителя. В Таблице 13 описаны аналитические наборы, использованные в анализе. Планшеты ELISA измерили с помощью кинетического считывающего устройства для микропланшетов Molecular Devices UVmax с программным обеспечением SoftMax Pro 5.2. Мультиплексные анализы выполнили с помощью системы Bio-Rad Bio-Plex с программным обеспечением Bio-Plex Manager 4.1. Конечные концентрации Ang2 (пг/мл) рассчитали по стандартной кривой для каждого анализа. В зависимости от анализа образцы могли быть разведены в аналитическом буфере перед тестированием. В этих случаях концентрации умножили на коэффициент разведения. Проанализировали ассоциацию исходной концентрации Ang2 с частотой объективных ответов (ORR) и общей выживаемостью (OS).
Таблица 13. Аналитические наборы
Число в скобках указывает область гранулы для каждого аналита.
Результаты и обсуждение: Из проанализированных пяти исследований фазы 2 (7 когорт) для анализов были использованы образцы 483 пациентов. Значимые ассоциации исходного Ang2 с ORR, а также с OS наблюдали для рака щитовидной железы (как дифференцированного рака щитовидной железы (DTC), так и медуллярного рака щитовидной железы (MTC)) и рака эндометрия (Таблица 14). Уровень Ang2 при гепатоцеллюлярной карциноме (HCC) и глиобластоме (GBM) не показал значимых ассоциаций ни с ORR, ни с OS. При меланоме (как с дикого типа (wt) BRAF, так и с мутированным (mut)), исходный уровень Ang2 ассоциирует не с ORR, а с OS.
Таблица 14. Ассоциация исходного уровня Ang2 с ORR и OS
(ORR-другие)
стандартное отклонение
(95% CI)
ORR: Знаковый ранговый критерий Уилкоксона
OS: одномерная модель пропорциональных рисков Кокса
Заключение: Исходные уровни Ang2 ассоциировали как с ORR, так и с OS при формах рака щитовидной железы и эндометрия. Другие протестированные типы рака (HCC, GBM и меланома) не показали значимой ассоциации как с ORR, так и с OS. Наблюдение предполагает, что Ang2 является специфическим маркером для определенных форм рака, таких как рак щитовидной железы и рак эндометрия.
Конкретные варианты осуществления
Конкретными вариантами осуществления настоящего изобретения являются следующими:
[1] Способ лечения рака эндометрия, при этом способ включает введение человеку, который имеет рак эндометрия, терапевтически эффективного количества ленватиниба или его фармацевтически приемлемой соли, где человек был идентифицирован как имеющий уровень экспрессии белка Ang2, который является низким по сравнению с контролем.
[2] Способ по [1], где человек был идентифицирован как имеющий низкую концентрацию белка Ang2 в биологическом образце, полученном от человека.
[3] Способ лечения рака эндометрия, при этом способ включает:
предоставление биологического образца, полученного от человека, который имеет рак эндометрия;
измерение в биологическом образце уровня экспрессии белка Ang2, который является низким по сравнению с контролем; и
введение человеку терапевтически эффективного количества ленватиниба или его фармацевтически приемлемой соли.
[4] Способ прогнозирования ответа человека, имеющего, предположительно имеющего, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль, при этом способ включает:
количественный анализ биологического образца, полученного от человека, и определение того, что концентрация белка Ang2 в биологическом образце является низкой по сравнению с контролем; и идентификацию человека, имеющего низкую концентрацию белка Ang2 в биологическом образце, как склонного отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль.
[5] Способ прогнозирования ответа человека, имеющего, предположительно имеющего, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль, при этом способ включает:
количественный анализ биологического образца, полученного от человека, и определение того, что концентрация белка Ang2 в биологическом образце является высокой по сравнению с контролем; и идентификацию человека, имеющего высокую концентрацию белка Ang2 в биологическом образце, как не склонного отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль.
[6] Способ содействия прогнозированию ответа человека, имеющего, предположительно имеющего, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль, при этом способ включает:
количественный анализ биологического образца, полученного от человека, и определение того, что концентрация белка Ang2 в биологическом образце является низкой по сравнению с контролем; и идентификацию человека, имеющего низкую концентрацию белка Ang2 в биологическом образце, как склонного отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль.
[7] Способ содействия прогнозированию ответа человека, имеющего, предположительно имеющего, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль, при этом способ включает:
количественный анализ биологического образца, полученного от человека, и определение того, что концентрация белка Ang2 в биологическом образце является высокой по сравнению с контролем; и идентификацию человека, имеющего высокую концентрацию белка Ang2 в биологическом образце, как не склонного отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль.
[8] Способ по любому из [2] до [7], где биологический образец выбран из группы, состоящей из образца крови, образца сыворотки, образца плазмы, архивного образца опухоли эндометрия и образца биопсии эндометрия.
[9] Способ по любому из [2] до [7], где биологический образец представляет собой образец плазмы.
[10] Способ по любому из [1] до [9], где рак эндометрия представляет собой распространенный рак эндометрия.
[11] Способ по любому из [1] до [9], где рак эндометрия представляет собой неоперабельный рак эндометрия стадии III или стадии IV.
[12] Способ по любому из [1] до [9], где рак эндометрия представляет собой рецидивирующий рак эндометрия.
[13] Способ по любому из [1] до [12], где контроль представляет собой предварительно установленное пороговое значение.
[14] Способ по [13], где предварительно установленное пороговое значение представляет собой концентрацию белка Ang2, которую определили на основании анализа характеристических кривых обнаружения, прогнозируя ответ опухоли с более высокой положительной прогностической ценностью по сравнению с отсутствием порога, и где концентрация белка Ang2, равная или ниже предварительно установленного порогового значения, является низкой концентрацией Ang2, и значение выше, чем предварительно установленное пороговое значение, является высокой концентрацией Ang2.
[15] Способ по [14], где ответ опухоли представляет собой частоту объективных ответов, частоту клинической эффективности или % максимального уменьшения размеров опухоли на по меньшей мере 30%.
[16] Способ по [13], где предварительно установленное пороговое значение представляет собой концентрацию белка Ang2, которую определили на основании прогнозирования выживаемости с помощью имитационных моделей для разделения двух групп, разделенных порогом, и где концентрация белка Ang2, равная или ниже предварительно установленного порогового значения, является низкой концентрацией Ang2, и значение выше, чем предварительно установленное пороговое значение, является высокой концентрацией Ang2.
[17] Способ по [16], где выживаемость представляет собой выживаемость без прогрессирования заболевания или общую выживаемость.
[18] Способ по [13], где предварительно установленное пороговое значение представляет собой концентрацию белка Ang2 в диапазоне от 1866,5 до 6024,5 пг/мл, и где концентрация белка Ang2, равная или ниже предварительно установленного порогового значения, является низкой концентрацией Ang2, и значение выше, чем предварительно установленное пороговое значение, является высокой концентрацией Ang2.
[19] Способ по любому из [1] до [18], где концентрацию белка измеряют иммунологическим способом.
[20] Способ по [19], где иммунологический способ выбран из группы, состоящей из иммуноферментного анализа, радиоиммунологического анализа, хемилюминесцентного иммунологического анализа, электрохемилюминесцентного иммунологического анализа, латексного турбидиметрического иммунологического анализа, латексного фотометрического иммунологического анализа, иммунохроматографического анализа и вестерн-блоттинга.
[21] Способ по любому из [1] до [18], где концентрацию белка измеряют с помощью масс-спектрометрии.
[22] Способ по любому из [1] до [21], где фармацевтически приемлемая соль ленватиниба представляет собой ленватиниба мезилат.
[23] Ленватиниб или его фармацевтически приемлемая соль для применения в лечении рака эндометрия у человека, где человека идентифицируют с помощью способа по [4] как субъекта, который склонен отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль.
[24] Средство обнаружения белка Ang2 для применения в прогнозировании ответа человека, имеющего, предположительно имеющего, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль.
[25] Средство обнаружения белка Ang2 по [24], где средство обнаружения белка Ang2 представляет собой антитело против Ang2.
[26] Фармацевтическая композиция для лечения рака эндометрия у человека, включающая ленватиниб или его фармацевтически приемлемую соль, где человека идентифицируют с помощью способа по [4] как субъекта, который склонен отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль.
Другие варианты осуществления
Несмотря на то, что настоящее изобретение было описано в сочетании с его подробным описанием, предшествующее описание предназначено для иллюстрации и не ограничивает объем настоящего изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в пределах объема нижеследующей формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОМАРКЕРЫ ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ, ВКЛЮЧАЮЩЕЙ ЛЕНВАТИНИБ И ЭВЕРОЛИМУС | 2016 |
|
RU2745060C2 |
| КОМБИНАЦИЯ АНТАГОНИСТА PD-1, ИНГИБИТОРА ТИРОЗИНКИНАЗЫ VEGFR/FGFR/RET И ИНГИБИТОРА CBP/БЕТА-КАТЕНИНА ДЛЯ ЛЕЧЕНИЯ РАКА | 2020 |
|
RU2838452C1 |
| КОМБИНАЦИЯ АНТАГОНИСТА PD-1 И ЭРИБУЛИНА ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2737216C2 |
| ПРИМЕНЕНИЕ ЭРИБУЛИНА ДЛЯ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2013 |
|
RU2689977C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА ШЕЙКИ МАТКИ ПУТЕМ ВВЕДЕНИЯ ИНИБИТОРА PD-1 | 2021 |
|
RU2833461C1 |
| Фармацевтические комбинации | 2017 |
|
RU2759669C2 |
| ИНГИБИТОР RET ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ РАКА, ИМЕЮЩЕГО RET-АЛЬТЕРАЦИЮ | 2019 |
|
RU2800951C2 |
| БИОМАРКЕРЫ И СПОСОБЫ ЛЕЧЕНИЯ СВЯЗАННЫХ С PD-1 И PD-L1 СОСТОЯНИЙ | 2014 |
|
RU2820869C1 |
| КОМБИНАЦИЯ АНТАГОНИСТА PD-1 И ИНГИБИТОРА IDO1 ДЛЯ ЛЕЧЕНИЯ РАКА | 2015 |
|
RU2744880C1 |
| M2-ДЕФЕКТНЫЙ ПОКСВИРУС | 2019 |
|
RU2819245C2 |
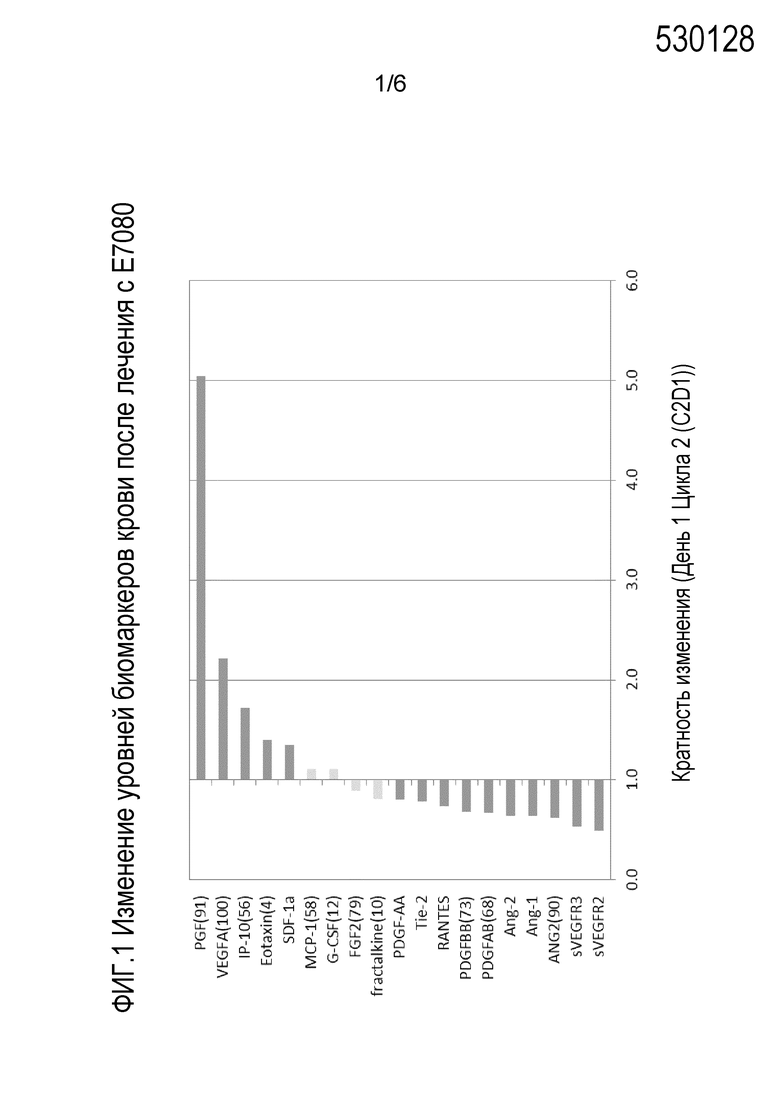
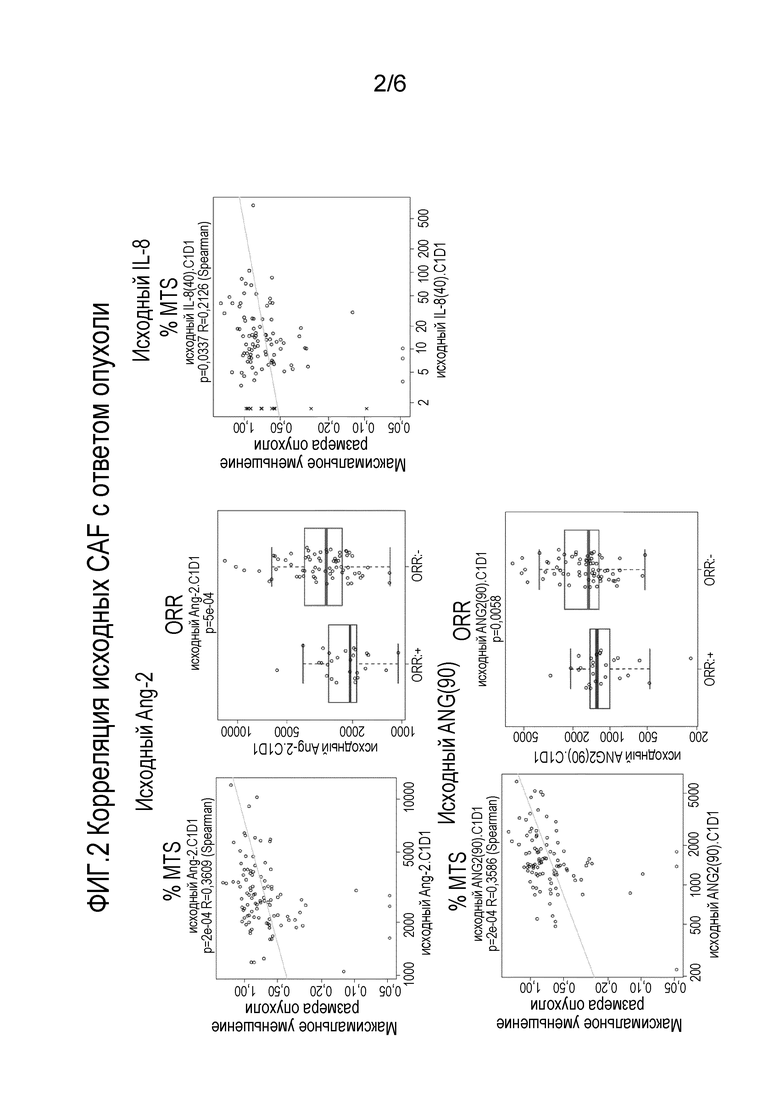
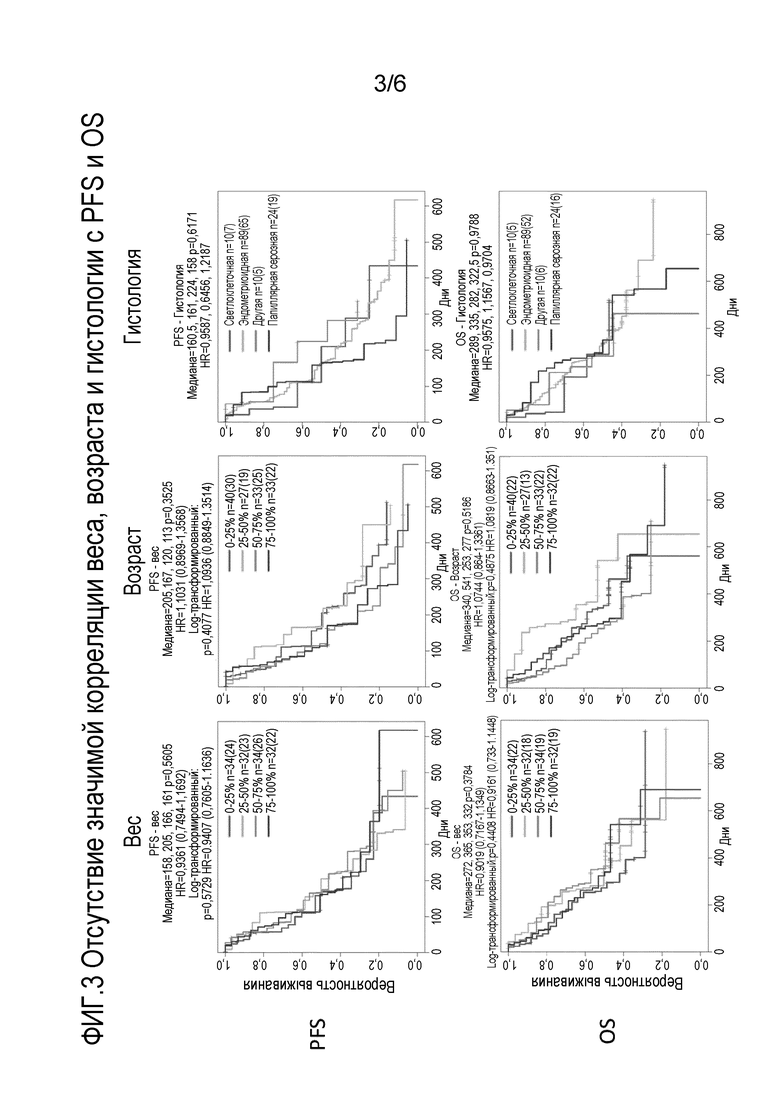

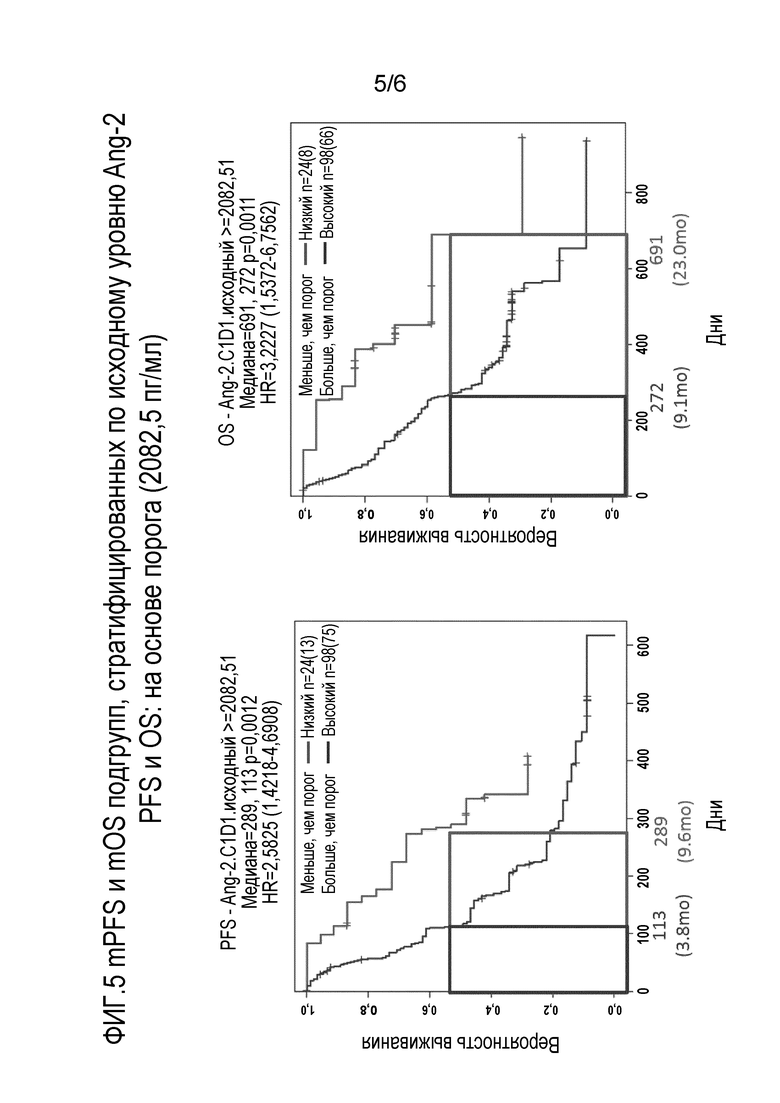
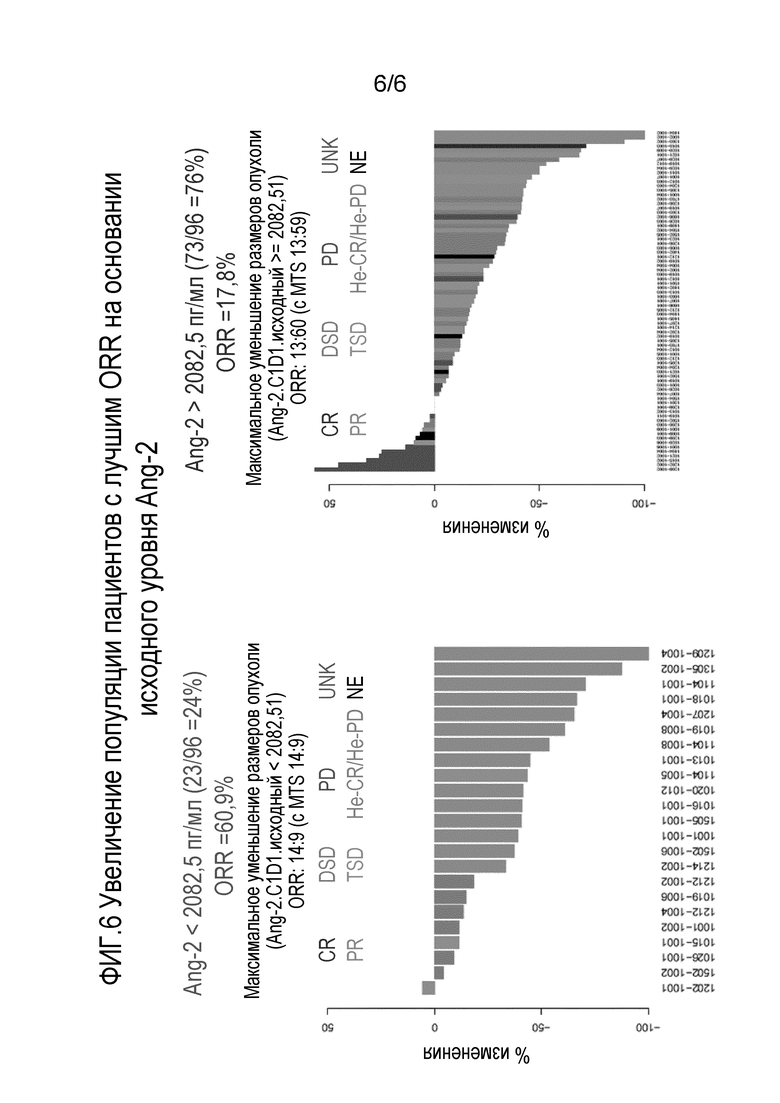
Группа изобретений относится к биотехнологии и медицине. Предложены способы прогнозирования ответа субъекта-человека, страдающего, предположительно страдающего раком эндометрия, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль (варианты). Осуществляют анализ биологического образца, полученного от субъекта-человека, и определяют концентрацию белка ангиопоэтина 2 (Ang2) в биологическом образце. Сравнивают концентрацию Ang2 с контролем, где контроль представляет собой предварительно установленное пороговое значение из диапазона от 1866,5 до 6024,5 пг/мл. Идентифицируют субъекта-человека как склонного отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль, при низкой концентрации белка Ang2 в биологическом образце. При высокой концентрации белка Ang2 в биологическом образце идентифицируют субъекта-человека как не склонного отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль. Изобретение позволяет осуществлять идентификацию, стратификацию и/или отбор пациентов, имеющих рак эндометрия, которые могут иметь пользу от лечения с ленватинибом или его фармацевтически приемлемой солью. 2 н. и 15 з.п. ф-лы, 6 ил., 14 табл., 2 пр.
1. Способ прогнозирования ответа субъекта-человека, страдающего, предположительно страдающего раком эндометрия, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль, при этом способ включает:
анализ биологического образца, полученного от субъекта-человека, и определение того, что концентрация белка ангиопоэтина 2 (Ang2) в биологическом образце является низкой по сравнению с контролем; и
идентификацию субъекта-человека, имеющего низкую концентрацию белка Ang2 в биологическом образце, как склонного отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль.
2. Способ прогнозирования ответа человека, страдающего, предположительно страдающего раком эндометрия, или с риском развития рака эндометрия, на терапию, включающую ленватиниб или его фармацевтически приемлемую соль, при этом способ включает:
анализ биологического образца, полученного от субъекта-человека, и определение того, что концентрация белка Ang2 в биологическом образце является высокой по сравнению с контролем; и
идентификацию субъекта-человека, имеющего высокую концентрацию белка Ang2 в биологическом образце, как не склонного отвечать на терапию, включающую ленватиниб или его фармацевтически приемлемую соль.
3. Способ по п. 1 или 2, где биологический образец выбран из группы, состоящей из образца крови, образца сыворотки, образца плазмы, архивного образца опухоли эндометрия и образца биопсии эндометрия.
4. Способ по п. 1 или 2, где биологический образец представляет собой образец плазмы.
5. Способ по п. 1 или 2, где рак эндометрия представляет собой распространенный рак эндометрия.
6. Способ по п. 1 или 2, где рак эндометрия представляет собой неоперабельный рак эндометрия стадии III или стадии IV.
7. Способ по п. 1 или 2, где рак эндометрия представляет собой рецидивирующий рак эндометрия.
8. Способ по п. 1 или 2, где контроль представляет собой предварительно установленное пороговое значение.
9. Способ по п. 8, где предварительно установленное пороговое значение представляет собой концентрацию белка Ang2, которая определяется на основании анализа характеристических кривых обнаружения, прогнозирующего ответ опухоли с более высоким положительным прогностическим значением по сравнению с отсутствием порога, и где концентрация белка Ang2, равная или ниже предварительно установленного порогового значения, является низкой концентрацией Ang2, и значение выше предварительно установленного порогового значения является высокой концентрацией Ang2.
10. Способ по п. 9, где ответ опухоли представляет собой частоту объективных ответов, частоту клинической эффективности или % максимального уменьшения размеров опухоли по меньшей мере на 30%.
11. Способ по п. 8, где предварительно установленное пороговое значение представляет собой концентрацию белка Ang2, которая определяется на основании прогнозирования выживаемости с помощью имитационных моделей для разделения двух групп, разделенных порогом, и где концентрация белка Ang2, равная или ниже предварительно установленного порогового значения, является низкой концентрацией Ang2, и значение выше предварительно установленного порогового значения является высокой концентрацией Ang2.
12. Способ по п. 11, где выживаемость представляет собой выживаемость без прогрессирования заболевания или общую выживаемость.
13. Способ по п. 8, где предварительно установленное пороговое значение представляет собой концентрацию белка Ang2 в диапазоне от 1866,5 до 6024,5 пг/мл, и где концентрация белка Ang2, равная или ниже предварительно установленного порогового значения, является низкой концентрацией Ang2, и значение выше предварительно установленного порогового значения является высокой концентрацией Ang2.
14. Способ по п.8, где концентрацию белка измеряют иммунологическим способом.
15. Способ по п. 14, где иммунологический способ выбран из группы, состоящей из ферментного иммуноанализа, радиоиммуноанализа, хемилюминесцентного иммуноанализа, электрохемилюминесцентного иммуноанализа, латексного турбидиметрического иммуноанализа, латексного фотометрического иммуноанализа, иммунохроматографического анализа и вестерн-блоттинга.
16. Способ по п.8, где концентрацию белка измеряют с помощью масс-спектрометрии.
17. Способ по п.8, где фармацевтически приемлемая соль ленватиниба представляет собой ленватиниба мезилат.
| СТЕКЛОКЕРАМИКА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2001 |
|
RU2293071C2 |
| US 7253286 B2, 07.08.2007 | |||
| WO 2012154935 A1, 15.11.2012 | |||
| WO 2010048304 A2, 29.04.2010 | |||
| EMOTO M | |||
| et al | |||
| "Localization of the VEGF and angiopoietin genes in uterine carcinosarcoma", Gynecologic Oncology, 2004, v.95, p.474-482 | |||
| BOSS D | |||
| S | |||
| et al | |||
| СПОСОБ ПОЛУЧЕНИЯ ПОБОЧНЫХ ПРОДУКТОВ ПИРОГЕНЕТИЧЕСКОГО РАЗЛОЖЕНИЯ УГЛЯ ПРИ КОТЕЛЬНЫХ ТОПКАХ С ШАХТОЙ, РАСПОЛОЖЕННОЙ МЕЖДУ ЗАГРУЗОЧНЫМ ЛЮКОМ И РЕШЕТКОЙ | 1926 |
|
SU7080A1 |
| АНГИОПОЭТИН-2-СПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ АГЕНТЫ | 2005 |
|
RU2404992C2 |
Авторы
Даты
2018-06-21—Публикация
2014-05-12—Подача