Область техники, к которой относится изобретение
Настоящее изобретение относится к стимулятору желудочно-кишечной функции, такому как агент для профилактики или лечения функциональных желудочно-кишечных расстройств. Конкретнее, настоящее изобретение относится к агенту для профилактики или лечения функциональных желудочно-кишечных расстройств (FGIDs), в частности дисфункций верхнего желудочно-кишечного тракта, таких как функциональная диспепсия (FD) (например, боль в животе, тяжесть в желудке, изжога и т.п.), гастроэзофагеальная рефлюксная болезнь (GERD) и т.п. Кроме того, настоящее изобретение относится к регулятору аппетита. Настоящее изобретение дополнительно относится к способу отбора вещества, способного к стимулированию желудочно-кишечной функции.
Уровень техники
Даже с продвижением в области эндоскопической диагностики существует множество случаев, когда нельзя полностью объяснить жалобу на симптомы верхнего желудочно-кишечного тракта, такие как боль в верхней части живота, дискомфорт, возникающая после приема пищи тяжесть в желудке, тошнота, рвота и т.п. Такое состояние, когда есть жалоба на симптом желудочно-кишечного тракта, но общей проверкой, включая эндоскопическую экспертизу, не обнаружено никакого органического заболевания, и нет заключения для объяснения симптома, называется FD (функциональная диспепсия: неязвенная диспепсия (NUD): верхняя брюшная диспепсия). Согласно Американской гастроэнтерологической ассоциации FD определена как патология, где органические заболевания, такие как язвенная болезнь и симптомы рака, не наблюдаются, но верхняя брюшная диспепсия продолжается в течение 4 недель или более, такая как ощущения вздутия живота, тошнота, рвота, боль в верхней части живота, анорексия, патологическое испражнение и т.п., основанная на задержании содержимого в желудке. С другой стороны, в Японии такой случай был определен как “желудочно-кишечное заболевание в верхней части брюшной полости, связанное с хроническим гастритом” независимо от органических заключений и в клинических ситуациях традиционно диагностируемое как "гастрит" или "хронический гастрит". В настоящее время подтип FD включает язвенный тип, тип с расстройством желудочно-кишечной моторики и неспецифичный тип, которые включают обычную атонию желудка, нервную диспепсию и желудочно-кишечный невроз.
Даже в случаях, в которых явно наблюдается органическое заболевание (рефлюксный эзофагит, пептическая язва, острый гастрит, желудочно-кишечный рак, заболевание поджелудочной железы, желчного пузыря и т.д.), также обнаруживается боль в животе, дискомфорт в животе, возникающая после приема пищи тяжесть в желудке, тошнота, рвота и т.п. Соответственно существует безотлагательная потребность в лечении такого некомфортного ощущения для обеспечения лучшего качества жизни пациентов. Согласно оценкам, когда FD сопутствует диспепсии в нижней части брюшной полости, такой как затрудненная дефекация, отсутствие чувства облегчения после дефекации, боль в животе, чувство вздутия живота и т.п., связанной с запором, приблизительно 30%-50% всего населения Японии испытывали некоторую диспепсию, одна треть из которых, как указывают, фактически посетили медицинские учреждения. Считается, что на начало брюшной диспепсии влияет пол, возраст, стресс и избыточный вес, связанный с режимом питания в западном стиле, и брюшная диспепсия также является характерным заболеванием современного общества наряду с заболеваниями, связанными с образом жизни. Будучи такой серьезной медицинской проблемой, этиология диспепсии представляет собой лишь предполагаемую связь с различными заболеваниями (хронический гастрит, диабет, избыточный вес, запор и т.д.), где механизм ее развития представляет собой не больше, чем простое предположение о функции подвижности нижнего желудочно-кишечного тракта. С учетом факта, что функция подвижности желудочно-кишечного тракта ухудшена только у 30% всего числа фактических пациентов с FD, ясно, что механизм развития FD не был полностью объяснен.
Кроме того, у многих из пациентов, страдающих от прогрессирующих мозговых дегенеративных заболеваний, таких как болезнь Паркинсона, хорея Хантингтона, оливомостомозжечковая атрофия и т.п., кровоизлияние в мозг и т.п., одновременно развивается дисфункция подвижности желудочно-кишечного тракта. Таким образом, считается, что качество жизни должно быть улучшено за счет увеличения функции подвижности желудочно-кишечного тракта. Считается, что данные пациенты включают многих, кто не может сообщить о диспепсии в силу нарушения речи, расстройства сознания и т.п. В связи с этим забота об устранении сенсорного расстройства, такого как диспепсия и т.п., которая проводится одновременно с заботой, связанной с органической дисфункцией, должна привести к улучшению качества жизни в реальном смысле.
Для лечения FD использовали стимуляторы подвижности, такие как агонисты рецептора 5-HT 4 и т.п. Например, цизаприд и метоклопрамид стимулируют желудочно-кишечную подвижность, и их использовали для лечения симптомов, таких как хронический гастрит, чувство вздутия живота, рефлюксный эзофагит, брюшная диспепсия и ложная кишечная непроходимость и т.п. Однако было выяснено, что метоклопрамид проявляет побочные эффекты, включая экстрапирамидальные симптомы, связанные с действием на допаминовый рецептор D2 в центральной нервной системе, и цизаприд не только проявляет симптомы Паркинсона, но также и побочные эффекты на кровеносную систему, такие как удлинение интервала QT и т.п. При использовании мозаприда и т.п. эффект иногда недостаточен. Кроме того, появляются побочные эффекты, такие как чувство вздутия живота, боль в желудке и т.п. Для лечения типа гастроэзофагеальной рефлюксной болезни (GERD) используют антагонисты H2 и ингибиторы протонной помпы. Для длительного введения необходима регулярная проверка, так как его безопасность не уточнена. В связи с этим поиск эффекта лечения от данных существующих фармацевтических агентов с гарантией достаточной безопасности является трудным.
В качестве регуляторов аппетита известны фенфлурамин и фентермин, которые действуют на центральную нервную систему, сибутрамин, мазиндол и т.п. Однако в качестве побочных эффектов могут быть отмечены ксеростомия, запор, усиленное потоотделение, усиленное сердцебиение и т.п., и существует потребность в регуляторе аппетита с меньшим количеством побочных эффектов.
Тем временем в последние годы было уточнено, что трансдукция сигнала вкуса осуществляется через различные рецепторы. В качестве рецепторов вкуса у млекопитающих были обнаружены два семейства рецепторов G-белок-связывающего типа, названные T1R и T2R (WO2003/001876, WO2005/015158, WO2005/041684). Они специфично экспрессируются во вкусовых клетках в языке человека и грызуна и участвуют в ощущении сладкого, юмами и горького из пяти базовых вкусовых ощущений. T1R представляет собой рецептор, который распознает сладкое и юмами, и T2R формирует семейство, имеющее отношение к ощущению горького вкуса. Что касается T1R, известными субъединицами являются T1R1, T1R2 и T1R3. Когда T1R2 и T1R3 образуют гетеродимер, он реагирует на естественные и искусственные подсластители и функционирует как рецептор сладкого. Когда T1R1 и T1R3 связаны, они реагируют на вещества юмами, такие как аминокислоты и т.п. За счет активации данных рецепторов вкуса из вкусовой клетки высвобождается неизвестный трансмиттер, который стимулирует вкусовой нерв, и вкусовой сигнал передается мозгу. Однако их наличие и функция в пищеварительной системе не известны.
Раскрытие изобретения
Целью настоящего изобретения является обеспечение более эффективного стимулятора желудочно-кишечной функции, в частности агента для профилактики или лечения функциональных желудочно-кишечных расстройств, регулятора аппетита, содержащей их композиции и т.п. Кроме того, целью настоящего изобретения является обеспечение способа отбора вещества, способного к стимулированию желудочно-кишечной функции.
Настоящее изобретение было создано в свете описанных выше проблем. Авторы настоящего изобретения обратили внимание на рецептор T1R и изучили его. В результате они обнаружили, что рецептор T1R присутствует в слое внутрижелудочной слизистой оболочки и слое слизистой оболочки тонкой кишки и что рецептор T1R экспрессируется в желудочно-кишечных гормонпродуцирующих клетках, в частности в клетках, продуцирующих гастрин. Точнее, в желудке и тонкой кишке эндокринные клетки желудочно-кишечного гормона являются положительными. В частности, клетка, продуцирующая гастрин, который представляет собой желудочно-кишечный гормон, является положительной в пилорической преддверной части желудка. В образце слизистой оболочки желудка тонкой кишки для функциональной экспрессии при наблюдении за рецептором вкуса T1R1+3 необходима экспрессия не только мРНК T1R1, но также и мРНК T1R3. На основании данных открытий авторы настоящего изобретения обнаружили, что они могут обеспечить способ для отбора агониста и т.п. рецептора T1R и дополнительно способ отбора для вещества, способного к стимулированию желудочно-кишечной функции и т.п., с использованием желудочно-кишечных гормонопродуцирующих клеток, полученных от человека или животного, которые экспрессируют рецептор T1R. Кроме того, в результате исследования с использованием агониста для рецептора T1R (в некоторых случаях ниже называемого просто “агонистом T1R”) было обнаружено, что агонист рецептора T1R стимулирует выведение содержимого желудка (в некоторых случаях ниже называемого просто “опорожнением желудка”). Опорожнение желудка контролируется не только подвижностью желудка но также и реагирует на легкость переваривания в двенадцатиперстной кишке и после нее, в которую доставляется содержимое. Это становится очевидно при возникновении задержанного опорожнения желудка в случае пищи, содержащей много жира, которая препятствует перевариванию и всасыванию. Соответственно авторы настоящего изобретения обнаружили, что стимулирующий эффект на переваривание и всасывание, то есть действие, стимулирующие желудочно-кишечную функцию, может быть получен за счет агониста T1R, оказывающего действие опорожнения-стимулирования на желудок. Стимулирование опорожнения желудка уменьшает ощущение патологического вздутия живота в ранний период после приема пищи и повышает анорексию. Кроме того, стимулирование опорожнения желудка облегчает переваривание и всасывание, что в свою очередь быстро увеличивает концентрацию питательных веществ в крови. Таким образом, можно также ожидать эффект усиления чувства удовлетворения в ранний период после приема пищи. На основании описанных выше находок авторы настоящего изобретения обнаружили, что агонист T1R эффективен для стимулирования желудочно-кишечной функции и регуляции аппетита, и завершили настоящее изобретение. Таким образом, настоящее изобретение относится к стимулятору желудочно-кишечной функции и регулятору аппетита, содержащему агонист T1R в качестве активного ингредиента, способу отбора вещества, способного к стимулированию желудочно-кишечной функции и т.п.
Соответственно настоящее изобретение включает, по меньшей мере, следующее.
[1] Агент, стимулирующий желудочно-кишечную функцию, содержащий агонист T1R в качестве активного ингредиента.
[2] Агент по описанному выше [1], в котором стимулирование желудочно-кишечной функции представляет собой профилактику или лечение функционального желудочно-кишечного расстройства.
[3] Агент по описанному выше [2], в котором функциональное желудочно-кишечное расстройство представляет собой дисфункцию верхнего желудочно-кишечного тракта.
[4] Агент по описанному выше [2], в котором функциональное желудочно-кишечное расстройство представляет собой функциональную диспепсию или гастроэзофагеальную рефлюксную болезнь.
[5] Агент, регулирующий аппетит, содержащий агонист T1R в качестве активного ингредиента.
[6] Агент по любому из описанных выше [1]-[5], в котором агонист T1R представляет собой производное амида или цикламат.
[7] Агент по описанному выше [6], в котором производное амида представляет собой соединение, представленное следующей формулой (I):
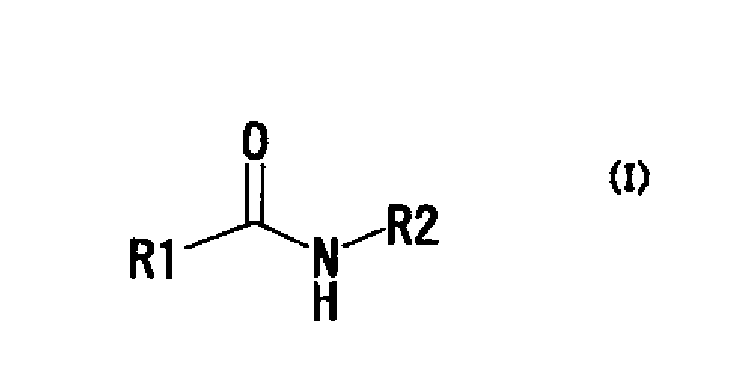
в котором R1 представляет собой арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), гетероарилалкенильную группу, необязательно содержащую заместитель (заместители), R3-NH-CO- или R3-NH- (R3 представляет собой арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), или гетероарилалкенильную группу, необязательно содержащую заместитель (заместители), и
R2 представляет собой C2-25 алкильную группу, необязательно содержащую заместитель (заместители), C3-25 циклоалкильную группу, необязательно содержащую заместитель (заместители) (указанная циклоалкильная группа необязательно конденсирована с бензолом), арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), или гетероарилалкенильную группу, необязательно содержащую заместитель (заместители),
или его фармакологически приемлемую соль.
[8] Агент по описанному выше [6] или [7], в котором производное амида представляет собой соединение, выбранное из группы, состоящей из:
(1) 3,6-дихлор-N-(4-этоксифенил)-2-метоксибензамида,
(2) 2,5-дихлор-N-(4-этоксифенил)бензамида,
(3) N-(1-этилпропил)-бензофуран-2-карбоксамида,
(4) N-(1,2,3,4-тетрагидронафталин-1-ил)-бензо[1,3] диоксол-5-карбоксамида,
(5) 4-этокси-N-(1-пропилбутил)бензамида и
(6) 3-(4-метоксифенил)-N-(1-пропилбутил)акриламида.
[9] Фармацевтическую композицию, содержащую агент по любому из описанных выше [1]-[8].
[10] Продукт питания или напиток, содержащий агент по любому из описанных выше [1]-[8], в котором активный ингредиент в указанном агенте содержится в пропорции 0,01-100000 весовых частей на миллион продукта питания или напитка.
[11] Способ отбора вещества, способного к стимулированию желудочно-кишечной функции, в котором используют клетку, экспрессирующую рецептор T1R.
[12] Способ по описанному выше [11], в котором вещество, способное к стимулированию желудочно-кишечной функции, представляет собой агонист T1R или модулятор T1R.
[13] Способ отбора вещества, способного к стимулированию желудочно-кишечной функции, который включает следующие стадии (a), (b) и (c):
(a) введение тестируемого вещества в контакт с клеткой, экспрессирующей рецептор T1R,
(b) определение активации G-белка в клетке, введенной в контакт с тестируемым веществом, и сравнение активации с активацией в контрольной клетке, не введенной в контакт с тестируемым веществом,
(c) отбор вещества, способного к стимулированию желудочно-кишечной функции, на основании результатов сравнения, описанного выше (b).
[14] Способ по описанному выше [13], в котором показатель для определения активации G-белка выбран из внутриклеточной концентрации кальция, внутриклеточного количества цАМФ, внеклеточного количества протонов и внутриклеточного секреторного количества желудочно-кишечного гормона.
[15] Способ отбора вещества, способного к стимулированию желудочно-кишечной функции, который включает следующие стадии (a), (b) и (c):
(a) введение тестируемого вещества и лиганда, действующего на рецептор T1R, в контакт с клеткой, экспрессирующей рецептор T1R,
(b) измерение количества лиганда, связанного с клеточной мембраной клетки, и сравнение количества с количеством в контрольной клетке, не введенной в контакт с тестируемым веществом,
(c) отбор вещества, способного к стимулированию желудочно-кишечной функции, основанный на результатах сравнения, описанного выше (b).
[16] Способ стимулирования желудочно-кишечной функции, который включает введение эффективного количества агониста T1R млекопитающему.
[17] Способ по описанному выше [16], в котором стимулирование желудочно-кишечной функции представляет собой профилактику или лечение функционального желудочно-кишечного расстройства.
[18] Способ по описанному выше [17], в котором описанное выше функциональное желудочно-кишечное нарушение представляет собой дисфункцию верхнего желудочно-кишечного тракта.
[19] Способ по описанному выше [17], в котором описанное выше функциональное желудочно-кишечное нарушение представляет собой функциональную диспепсию или гастроэзофагеальную рефлюксную болезнь.
[20] Способ регулирования аппетита, который включает введение эффективного количества агониста T1R млекопитающему.
[21] Способ по любому из описанных выше [16]-[20], в котором агонист T1R представляет собой производное амида или цикламат.
[22] Способ по описанному выше [21], в котором производное амида представляет собой соединение, представленное следующей формулой (I):

в котором R1 представляет собой арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), гетероарилалкенильную группу, необязательно содержащую заместитель (заместители), R3-NH-CO- или R3-NH- (R3 представляет собой арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), или гетероарилалкенильную группу, необязательно содержащую заместитель (заместители), и
R2 представляет собой C2-25 алкильную группу, необязательно содержащую заместитель (заместители), C3-25 циклоалкильную группу, необязательно содержащую заместитель (заместители) (указанная циклоалкильная группа необязательно конденсирована с бензолом), арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), или гетероарилалкенильную группу, необязательно содержащую заместитель (заместители),
или его фармакологически приемлемую соль.
[23] Способ по описанному выше [21] или [22], в котором производное амида представляет собой соединение, выбранное из группы, состоящей из:
(1) 3,6-дихлор-N-(4-этоксифенил)-2-метоксибензамида,
(2) 2,5-дихлор-N-(4-этоксифенил)бензамида,
(3) N-(1-этилпропил)-бензофуран-2-карбоксамида,
(4) N-(1,2,3,4-тетрагидронафталин-1-ил)-бензо[1,3]диоксол-5-карбоксамида,
(5) 4-этокси-N-(1-пропилбутил)бензамида и
(6) 3-(4-метоксифенил)-N-(1-пропилбутил)акриламида.
[24] Способ по любому из описанных выше [16]-[23], который включает введение фармацевтической композиции, содержащей описанный выше агонист T1R и носитель, млекопитающему.
[25] Способ по любому из описанных выше [16]-[23], который включает введение продукта питания или напитка, содержащего описанный выше агонист T1R в пропорции 0,01-100000 весовых частей на миллион, млекопитающему.
[26] Применение агониста T1R для получения композиции для стимулирования желудочно-кишечной функции.
[27] Применение по описанному выше [26], в котором стимулирование желудочно-кишечной функции представляет собой профилактику или лечение функционального желудочно-кишечного расстройства.
[28] Применение по описанному выше [27], в котором описанное выше функциональное желудочно-кишечное нарушение представляет собой дисфункцию верхнего желудочно-кишечного тракта.
[29] Применение по описанному выше [27], в котором описанное выше функциональное желудочно-кишечное нарушение представляет собой дисфункцию функциональную диспепсию или гастроэзофагеальную рефлюксную болезнь.
[30] Применение агониста T1R для получения композиции для регуляции аппетита.
[31] Применение по любому из описанных выше [26]-[30], в котором агонист T1R представляет собой производное амида или цикламат.
[32] Применение по описанному выше [31], в котором производное амида представляет собой соединение, представленное следующей формулой (I):

в котором R1 представляет собой арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), гетероарилалкенильную группу, необязательно содержащую заместитель (заместители), R3-NH-CO- или R3-NH- (R3 представляет собой арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), или гетероарилалкенильную группу, необязательно содержащую заместитель (заместители), и
R2 представляет собой C2-25 алкильную группу, необязательно содержащую заместитель (заместители), C3-25 циклоалкильную группу, необязательно содержащую заместитель (заместители) (указанная циклоалкильная группа необязательно конденсирована с бензолом), арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), или гетероарилалкенильную группу, необязательно содержащую заместитель (заместители),
или его фармакологически приемлемую соль.
[33] Применение по описанному выше [31] или [32], в котором производное амида представляет собой соединение, выбранное из группы, состоящей из:
(1) 3,6-дихлор-N-(4-этоксифенил)-2-метоксибензамида,
(2) 2,5-дихлор-N-(4-этоксифенил)бензамида,
(3) N-(1-этилпропил)-бензофуран-2-карбоксамида,
(4) N-(1,2,3,4-тетрагидронафталин-1-ил)-бензо[1,3]диоксол-5-карбоксамида,
(5) 4-этокси-N-(1-пропилбутил)бензамида и
(6) 3-(4-метоксифенил)-N-(1-пропилбутил)акриламида.
[34] Применение по любому из описанных выше [26]-[33], в котором описанная выше композиция представляет собой фармацевтический продукт.
[35] Применение по любому из описанных выше [26]-[33], в котором описанная выше композиция представляет собой продукт питания или напиток, содержащий агонист T1R в пропорции 0,01-100000 весовых частей на миллион.
[36] Композицию для стимулирования желудочно-кишечной функции, содержащую агонист T1R в качестве активного ингредиента.
[37] Композицию по описанному выше [36], в которой стимулирование желудочно-кишечной функции представляет собой профилактику или лечение функционального желудочно-кишечного расстройства.
[38] Композицию по описанному выше [37], в которой описанное выше функциональное желудочно-кишечное нарушение представляет собой дисфункцию верхнего желудочно-кишечного тракта.
[39] Композицию по описанному выше [37], в которой описанное выше функциональное желудочно-кишечное нарушение представляет собой функциональную диспепсию или гастроэзофагеальную рефлюксную болезнь.
[40] Композицию для регуляции аппетита, содержащую агонист T1R в качестве активного ингредиента.
[41] Композицию по любой из описанных выше [36]-[40], в которой агонист T1R представляет собой производное амида или цикламат.
[42] Композицию по описанному выше [41], в которой производное амида представляет собой соединение, представленное следующей формулой (I):

в котором R1 представляет собой арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), гетероарилалкенильную группу, необязательно содержащую заместитель (заместители), R3-NH-CO- или R3-NH- (R3 представляет собой арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), или гетероарилалкенильную группу, необязательно содержащую заместитель (заместители), и
R2 представляет собой C2-25 алкильную группу, необязательно содержащую заместитель (заместители), C3-25 циклоалкильную группу, необязательно содержащую заместитель (заместители) (указанная циклоалкильная группа необязательно конденсирована с бензолом), арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), или гетероарилалкенильную группу, необязательно содержащую заместитель (заместители),
или его фармакологически приемлемую соль.
[43] Композицию по описанному выше [41] или [42], в которой производное амида представляет собой соединение, выбранное из группы, состоящей из:
(1) 3,6-дихлор-N-(4-этоксифенил)-2-метоксибензамида,
(2) 2,5-дихлор-N-(4-этоксифенил)бензамида,
(3) N-(1-этилпропил)-бензофуран-2-карбоксамида,
(4) N-(1,2,3,4-тетрагидронафталин-1-ил)-бензо[1,3]диоксол-5-карбоксамида,
(5) 4-этокси-N-(1-пропилбутил)бензамида и
(6) 3-(4-метоксифенил)-N-(1-пропилбутил)акриламида.
[44] Композицию по любому из описанных выше [36]-[43], которая представляет собой фармацевтический продукт.
[45] Композицию по любому из описанных выше [36]-[43], которая представляет собой пищу или напиток, содержащие активный ингредиент в пропорции 0,01-100000 весовых частей на миллион.
Краткое описание графического материала
На фиг.1 показаны результаты иммунного окрашивания с использованием антитела против-T1R1, где стрелка указывает на окрашенные клетки, (A) представляет собой желудок, пилорическую преддверную часть, (B) представляет собой тонкую кишку, и (C) представляет собой вкусовую клетку вкусового сосочка.
На фиг.2 показаны результаты двойного иммунного окрашивания в той же самой области с использованием антитела против-T1R1 и антитела анти-гастрина, где (A) представляет собой изображение окрашивания T1R1, (B) представляет собой изображение окрашивания гастрина, и (C) представляет собой изображение, полученное наложением (A) и (B).
На фиг.3 показаны результаты электрофореза продукта ПЦР, полученного из каждой ткани, где с левого края представлен РНК-маркер, дорожки 2-5 от левого края представляют собой продукты реакции амплификации в присутствии обратной транскриптазы, и дорожки 6-7 представляют собой продукты реакции в отсутствие обратной транскриптазы (левый край: РНК-маркер, дорожка 2: язык, грибовидные сосочки, дорожка 3: язык, ткань невкусового сосочка, дорожка 4: желудок, слизистая оболочка железистого желудка, дорожка 5: желудок, слизистая оболочка пилорической преддверной части).
На фиг.4 показаны степени опорожнения желудка при введении цикламата и MSG.
На фиг.5 показаны степени опорожнения желудка при введении соединения 1 (1 весовая часть на миллион и 10 весовых частей на миллион).
На фиг.6 показаны результаты теста желудочно-кишечного движения, в котором вводили соединения 4, 5 и 6 (10 весовых частей на миллион соответственно).
На фиг.7 показаны степени опорожнения желудка при введении соединения 2, 3, 4 и 5 (10 весовых частей на миллион соответственно).
Наилучший способ осуществления изобретения
Настоящее изобретение подробно объяснено ниже.
В настоящем изобретении “стимулирование желудочно-кишечной функции” обозначает стимулирование подвижности желудочно-кишечного тракта или стимулирование переваривания и всасывания, которое может представлять собой любое функциональное стимулирование за счет непосредственного воздействия на желудочно-кишечный тракт и вторичного функционального стимулирования посредством стимулирования секреции (гормона и т.д.) в эндокринной системе, улучшения кровотока и т.п. Например, оно включает лечение различных симптомов, при которых желудочно-кишечный тракт проявляет пониженную функцию по причине желудочно-кишечной дисфункции, улучшение желудочно-кишечной функции здорового индивида, профилактики или лечения расстройств, профилактики или лечения функциональных желудочно-кишечных расстройств и т.п. Таким образом, агент для стимулирования желудочно-кишечной функции в соответствии с настоящим изобретением и композиция, содержащая агент (композиция для стимулирования желудочно-кишечной функции), могут быть использованы для стимулирования желудочно-кишечной функции и также могут быть использованы в качестве агента для профилактики или лечения диспепсии, указанной ниже, независимо от наличия или отсутствия органического заболевания.
В используемом в настоящей заявке смысле “функциональное желудочно-кишечное нарушение” обозначает патологию, в которой органические заболевания, такие как язвенная болезнь и симптомы рака, не наблюдаются, но продолжается брюшная диспепсия, такая как ощущение вздутия живота, тошнота, рвота, боль в животе, анорексия, рефлюкс желудочной кислоты, патологическое движение кишечника (запор, диарея и т.п.) и т.п., основанная на задержке и т.п. содержимого в желудочно-кишечном тракте, в частности в желудке. Оно обозначает состояние без органического заболевания желудочно-кишечного тракта, но с воспроизводимым желудочно-кишечным симптомом, который понижает качество жизни пациентов. Например, оно включает функциональную диспепсию, гастроэзофагеальную рефлюксную болезнь, диабетический парез желудка, рефлюксный эзофагит, послеоперационную желудочно-кишечную дисфункцию и т.п. “Желудочно-кишечный тракт” в настоящем изобретении обозначает ряд внутриполостных органов, участвующих в пищеварении от пищевода до заднего прохода, и, например, может быть указан пищевод, желудок, тонкий кишечник (двенадцатиперстная кишка, тощая кишка, подвздошная кишка) и толстый кишечник.
“Верхний желудочно-кишечный тракт” обозначает пищевод, желудок и двенадцатиперстную кишку, и “дисфункция верхнего желудочно-кишечного тракта” обозначает указанную выше дисфункцию в верхнем желудочно-кишечном тракте и включает функциональную диспепсию, диабетический парез желудка, рефлюксный эзофагит, послеоперационную желудочно-кишечную дисфункцию и т.п.
В используемом в настоящей заявке смысле “функциональная диспепсия” обозначает патологию, в которой органические заболевания, такие как язвенная болезнь и симптомы рака, не наблюдаются, но продолжается диспепсия верхней части брюшной полости, такая как ощущение вздутия живота, тошнота, рвота, боль в верхней части живота, анорексия и т.п., основанная на задержке и т.п. содержимого в желудке и т.п. Она обозначает состояние без органического заболевания желудочно-кишечного тракта, но с воспроизводимым желудочно-кишечным симптомом, который понижает качество жизни пациентов. Диспепсия включает заболевания, диагностируемые на настоящий момент как хронический гастрит и гастрит, и часто проявляет симптомы боли в животе, тяжести в желудке, изжоги и т.п. Как указывают, в последние годы 40-60% амбулаторных больных страдают от функциональной диспепсии, и терапия по устранению Helicobacter pylori способствует увеличению числа функциональной диспепсии.
Кроме того, "гастроэзофагеальная рефлюксная болезнь" включает рефлюксный эзофагит, развивается за счет рефлюкса желудочной кислоты и, в общем, проявляет характерные симптомы изжоги, подъема желудочной кислоты ко рту и т.п. Кроме того, в то время как "проглатывание" обозначает заглатывание воды и пищи, оно тесно связано не только с ротовой полостью и глоткой, но также и с подвижностью желудочно-кишечного тракта, например пищевода и т.п., о чем свидетельствует затрудненное заглатывание и рвота по причине застревания комка пищи и т.п. в пищеводе и т.п.
В настоящем изобретении, например, излечимые конкретные симптомы диспепсии в функциональных желудочно-кишечных расстройствах включают без ограничений характерную диспепсию верхнего желудочно-кишечного тракта, такую как тошнота, рвота, тошнотное ощущение, изжога, ощущение вздутия живота, тяжесть в желудке, отрыжка, давящее ощущение в груди, боль в груди, дискомфорт в желудке, анорексия, дисфагия, рефлюкс желудочной кислоты и т.п., диспепсию нижнего желудочно-кишечного тракта, такую как боль в животе, запор, диарея и т.п., и связанную с ними жалобу, такую как одышка, ощущение удушья, слабый позыв, фарингеальная обструкция, ощущение чужеродной субстанции (“baikakuki” в китайской медицине), легкая утомляемость, ригидность затылочных мышц, миотония, сухость во рту (ксеростомия, жажда), тахипноэ, ощущение жжения, ощущение холода в конечностях, затруднение концентрации, нетерпеливость, нарушение сна, головная боль, общее недомогание, учащенное сердцебиение, ночной пот, тревога, головокружение, вертиго, ощущение жжения, приступообразное ощущение жара, потоотделение, боль в животе, запор, депрессия и т.п.
Кроме того, в настоящем изобретении “регуляция аппетита” обозначает усиление аппетита индивида с анорексией и приведение индивида со склонностью к перееданию к нормальной приверженности в питании.
Стимулятор желудочно-кишечной функции, агент для профилактики или лечения функциональных желудочно-кишечных расстройств и регулятор аппетита в соответствии с настоящим изобретением используются в качестве агентов для профилактики или лечения функциональных желудочно-кишечных расстройств, обладающих воспроизводимостью в отношении понижения качества жизни пациентов, в частности дисфункции верхнего желудочно-кишечного тракта, такой как функциональная диспепсия, гастроэзофагеальная рефлюксная болезнь и т.п. Они в некоторых случаях ниже просто называются агентами в соответствии настоящим изобретением. Предполагается, что в настоящем изобретении "положительная динамика" включает "лечение".
Агент в соответствии с настоящим изобретением содержит агонист T1R в качестве активного ингредиента. В настоящем изобретении “агонист T1R” обозначает вещество, которое усиливает активность рецептора T1R, которое представляет собой понятие, включающее не только вещество, которое связывается рецептором T1R для непосредственной активации рецептора T1R, но также и модулятор T1R, который усиливает действие агониста T1R. В качестве агониста T1R могут быть использованы различные известные агонисты рецептора T1R и любое соединение, которое активирует рецептор T1R. Такое соединение может быть получено путем проведения отбора с применением клетки, экспрессирующей рецептор T1R. В настоящей заявке рецептор T1R обозначает субъединицы T1R1, T1R2 и T1R3 и любую субъединицу или сочетания двух или более субъединиц, выбранных из данных вариантов, и может быть использован любой агонист любой из данных субъединиц или множества субъединиц. T1R1, T1R2 и T1R3 могут представлять собой белок, полученный из млекопитающего, такого как человек, обезьяна, мышь, собака, корова и кролик, или любого животного, такого как птица, рыба и т.п., или могут являться их вариантом. Каждая последовательность T1R1, T1R2 и T1R3 зарегистрирована в банке генов как
T1R1: мРНК Tas1r1, NM_031867 мыши, XM_342986 крысы, NM_138697 человека;
T1R2: мРНК Tas1R2, NM_031873 мыши, AF127390 крысы, NM_152232 человека;
T1R3: мРНК Tas1r3, NM_031872 мыши, NM_130818 крысы, XM_371210 человека.
В качестве известного агониста T1R может быть отмечен цикламат (N-циклогексилсульфаминовая кислота) и, например, соединения, описанные в WO 2005/041684.
“Агонист T1R” включает производное амида (соединение, содержащее частичную структуру амида), конкретно, например, соединение, имеющее частичную структуру амида, представленное следующей формулой (I), и его фармакологически приемлемые соли:

в котором R1 представляет собой арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), гетероарилалкенильную группу, необязательно содержащую заместитель (заместители), R3-NH-CO- или R3-NH- (R3 представляет собой арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), или гетероарилалкенильную группу, необязательно содержащую заместитель (заместители), и
R2 представляет собой C2-25 алкильную группу, необязательно содержащую заместитель (заместители), C3-25 циклоалкильную группу, необязательно содержащую заместитель (заместители) (указанная циклоалкильная группа необязательно конденсирована с бензолом), арильную группу, необязательно содержащую заместитель (заместители), аралкильную группу, необязательно содержащую заместитель (заместители), арилалкенильную группу, необязательно содержащую заместитель (заместители), гетероарильную группу, необязательно содержащую заместитель (заместители), гетероаралкильную группу, необязательно содержащую заместитель (заместители), или гетероарилалкенильную группу, необязательно содержащую заместитель (заместители).
В настоящей заявке “алкильная группа, содержащая от 2 до 25 атомов углерода” представляет собой алкильную группу с неразветвленной цепью или разветвленной цепью, содержащую от 2 до 25, предпочтительно от 3 до 10, атомов углерода, и, например, может быть отмечена метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, сек-бутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа, неопентильная группа, 1-метилбутильная группа, 2-метилбутильная группа, 2-этилпропильная группа, 1,1-диметилпропильная группа, 1,2-диметилпропильная группа, гексильная группа, изогексильная группа, 1-метилпентильная группа, 2-метилпентильная группа, 3-метилпентильная группа, 1-этилбутильная группа, 2-этилбутильная группа, гептильная группа, 1-метилгексильная группа, 2-метилгексильная группа, 3-метилгексильная группа, 4-метилгексильная группа, 5-метилгексильная группа, 1-этилпентильная группа, 2-этилпентильная группа, 3-этилпентильная группа, 1-пропилбутильная группа, октильная группа, нонильная группа, децильная группа, нонадецильная группа, додецильная группа, тридецильная группа, тетрадецильная группа, пентадецильная группа, гексадецильная группа, гептадецильная группа, октадецильная группа, нонадецильная группа, икосильная группа, геникосильная группа, докосильная группа, трикосильная группа, тетракосильная группа, пентакосильная группа и т.п., предпочтительными являются 1-этилпропильная группа, 1-пропилбутильная группа и т.п.
В настоящей заявке “циклоалкильная группа, содержащая от 3 до 25 атомов углерода” представляет собой циклоалкильную группу, содержащую от 3 до 25, предпочтительно от 5 до 10, атомов углерода, и, например, может быть отмечена циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа, циклогептильная группа, циклооктильная группа, циклононильная группа, циклодецильная группа, циклоундецильная группа, циклододецильная группа, циклотридецильная группа, циклотетрадецильная группа, циклопентадецильная группа, циклогексадецильная группа, циклогептадецильная группа, циклооктадецильная группа, циклононадецильная группа, циклоикосильная группа, циклогеникосильная группа, циклодокосильная группа, циклотрикосильная группа, циклотетракосильная группа, циклопентакосильная группа и т.п., предпочтительной является циклогексильная группа и т.п.
Циклоалкильная группа может быть конденсирована с бензольным циклом в любом положении. В качестве циклоалкильной группы, конденсированной с бензолом, предпочтительными являются 1,2,3,4-тетрагидронафталин-1-ил, 1,2,3,4-тетрагидронафталин-2-ил и т.п.
В настоящей заявке “арильная группа” предпочтительно содержит от 6 до 14 атомов углерода и представляет собой моноциклическую или полициклическую ароматическую углеводородную группу. Конкретно, например, может быть отмечена фенильная группа, нафтильная группа и т.п.
В настоящей заявке “аралкильная группа” представляет собой группу, в которой один или более атомов водорода алкильной группы замещены арильной группой, где арильная группа и алкильная группа соответствуют определению выше. Алкильная группа предпочтительно содержит от 1 до 3 атомов углерода. В качестве конкретной аралкильной группы, например, может быть отмечена бензильная группа, фенилэтильная группа, 2-нафтилметильная группа и т.п.
В настоящей заявке “арилалкенильная группа” представляет собой группу, в которой один или более атомов водорода алкенильной группы замещены арильной группой, где арильная группа, которая должна быть включена, соответствует определению для описанной выше арильной группы. Алкенильная группа предпочтительно содержит 2 или 3 атома углерода, и, например, может быть отмечен винил, аллил и т.п. В качестве арилалкенильной группы, например, может быть отмечена стирильная группа, циннамильная группа и т.п.
В настоящей заявке “гетероарильная группа” обозначает предпочтительно 5-10-членные моноциклические или полициклические ароматические гетероциклические группы, предпочтительно содержащие в качестве атома (атомов) в цикле от 1 до 4 гетероатомов, выбранных из атома кислорода, атома серы и атома азота. Конкретно, например, в качестве 6-членной циклической группы может быть отмечена пиридильная группа, пиридазинильная группа, пиримидильная группа (=пиримидинильная группа) и пиразинильная группа; в качестве 5-членной циклической группы может быть отмечена фурильная группа, тиенильная группа, пирролильная группа, изоксазолильная группа, оксазолильная группа, изотиазолильная группа, тиазолильная группа, пиразолильная группа, имидазолильная группа, оксадиазолильная группа, тиадиазолильная группа, триазолильная группа и тетразолильная группа; в качестве 6-5-членной циклической группы может быть отмечена бензофуранильная группа, бензотиенильная группа, индолильная группа, изоиндолильная группа, бензоксазолильная группа (=бензооксазолильная группа), бензотиазолильная группа, бензимидазолильная группа (=бензоимидазолильная группа), индазолильная группа, бензизоксазолильная группа, бензизотиазолильная группа, бензофуразанильная группа, бензотиадиазолильная группа, пуринильная группа и бензодиоксолил; в качестве 6-6-членной циклической группы может быть отмечена хинолильная группа (=хинолинильная группа), изохинолильная группа, циннолинильная группа, фталазинильная группа, хиназолинильная группа, хиноксалинильная группа, птеридинильная группа, и в качестве 5-5-членной циклической группы может быть отмечена имидазооксазолильная группа, имидазотиазолильная группа, имидазоимидазолильная группа и т.п.
В настоящей заявке “гетероаралкильная группа” представляет собой группу, в которой один или более атомов водорода алкильной группы замещены гетероарильной группой, и гетероарильная группа и алкильная группа, которая должна быть включена, соответствуют определению выше. Алкильная группа предпочтительно содержит от 1 до 3 атомов углерода. Конкретно, например, может быть отмечена 2-пиридилэтильная группа, бензофуранилметильная группа и т.п.
В настоящей заявке “гетероарилалкенильная группа” представляет собой группу, в которой один или более атомов водорода алкенильной группы замещены гетероарильной группой, и гетероарильная группа и алкенильная группа, которая должна быть включена, соответствуют определению выше. Конкретно, например, может быть отмечена 2-пиридилэтиленовая группа и т.п.
Данные группы могут иметь один или более, предпочтительно от 1 до 3, заместителей в замещаемых положениях. Когда включены два или более заместителей, заместители могут быть идентичными или различными. В качестве заместителя, например, может быть отмечен атом галогена, включая фтор, хлор, бром и йод, гидроксильная группа, оксогруппа, аминогруппа, алкильная группа, содержащая от 1 до 6 атомов углерода, такая как метильная группа, этильная группа и т.п., алкокси группа, содержащая от 1 до 7 атомов углерода, такая как метокси группа, этокси группа, метилендиокси группа и т.п., ацильная группа, содержащая от 2 до 7 атомов углерода, такая как карбоксильная группа, ацетильная группа, пропионильная группа и т.п., алкоксикарбонильная группа, содержащая от 2 до 7 атомов углерода, такая как карбамоильная группа, алкилкарбамоильная группа, содержащая от 2 до 10 атомов углерода, арилкарбамоильная группа, содержащая от 7 до 11 атомов углерода, гетероарилкарбамоильная группа, содержащая от 5 до 11 атомов углерода, арилалкилкарбамоильная группа, содержащая от 8 до 15 атомов углерода, гетероарилалкилкарбамоильная группа, содержащая от 6 до 15 атомов углерода и т.п.
Заместитель может дополнительно иметь заместитель в замещаемом положении, такой как описанные выше заместители.
В качестве R1 предпочтительными являются “арильная группа, необязательно содержащая заместитель (заместители)”, “арилалкенильная группа, необязательно содержащая заместитель (заместители)”, “гетероарильная группа, необязательно содержащая заместитель (заместители)”, и т.п.
В качестве “арильной группы, необязательно содержащей заместитель (заместители)”, для R1 предпочтительной является фенильная группа, необязательно содержащая заместители и т.п. В качестве заместителя предпочтительными являются атом галогена, алкокси группа, содержащая от 1 до 7, предпочтительно от 1 до 3, атомов углерода и т.п., в частности, предпочтительными являются хлор, метокси группа, этокси группа, метилендиокси группа и т.п.
В качестве “арилалкенильной группы, необязательно содержащей заместитель (заместители)”, для R1 предпочтительной является стирильная группа, необязательно содержащая заместители, и т.п. В качестве заместителя предпочтительной является алкокси группа, содержащая от 1 до 7, предпочтительно от 1 до 3, атомов углерода, и т.п., и, в частности, предпочтительной является метокси группа и т.п.
В качестве “гетероарильной группы, необязательно содержащей заместитель (заместители)”, для R1 предпочтительной является бензофуранильная группа, необязательно содержащая заместители, и т.п.
Конкретно в качестве R1 предпочтительными являются 3,6-дихлор-2-метоксифенил, 2,5-дихлорфенил, 5-бензо[1,3]диоксол, 4-этоксифенил, 2-(4-метоксифенил)винил, бензофуранил и т.п.
В качестве R2 предпочтительными являются “арильная группа, необязательно содержащая заместитель (заместители)”, “C2-25 алкильная группа, необязательно содержащая заместитель (заместители)”, “C3-25 циклоалкильная группа, необязательно содержащая заместитель (заместители) (указанная циклоалкильная группа, необязательно конденсирована с бензолом)”, и т.п.
В качестве “арильной группы, необязательно содержащей заместитель (заместители)”, для R2 предпочтительной является фенильная группа, необязательно содержащая заместитель (заместители), и т.п. В качестве заместителя предпочтительной является алкокси группа, содержащая от 1 до 7, предпочтительно от 1 до 3, атомов углерода и т.п., и, в частности, предпочтительной является этокси группа и т.п.
Конкретно в качестве R2 предпочтительными являются 4-этоксифенил, 1-этилпропил, 1-пропилбутил, 1,2,3,4-тетрагидронафталин-1-ил и т.п.
Агонист T1R для использования в настоящем изобретении, в частности соединение, представленное формулой (I), может быть в форме соли. В качестве такой соли могут быть отмечены соли с неорганическим основанием, соли с неорганической кислотой, соли с органической кислотой, соли с органическим основанием и т.п., и она особым образом не ограничена, если она является фармакологически приемлемой. В качестве соли с неорганическим основанием могут быть отмечены соли щелочных металлов, таких как натрий, калий, литий и т.п., соли щелочноземельных металлов, таких как кальций, магний и т.п., соль аммония и т.п. В качестве соли с неорганической кислотой могут быть отмечены соли с галогенводородной кислотой (хлористоводородной кислотой, бромистоводородной кислотой, иодистоводородной кислотой и т.д.), серной кислотой, азотной кислотой, фосфорной кислотой и т.п. В качестве соли с органической кислотой могут быть отмечены соли с муравьиной кислотой, уксусной кислотой, пропионовой кислотой, щавелевой кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, лимонной кислотой, глутаминовой кислотой, аспарагиновой кислотой, гистидином и т.п. В качестве соли с органическим основанием могут быть отмечены соли с основной аминокислотой (аргинином, лизином, орнитином и т.п.), нуклеотидом (производным пурина, производным пиримидина и т.п.), алкалоидом и т.п.
Кроме того, в качестве активного ингредиента в соответствии с настоящим изобретением, который может стимулировать желудочно-кишечную функцию, может быть использовано вещество (соединение), которое активирует рецептор T1R, из известного или нового соединения, полученное способом отбора в соответствии с настоящим изобретением, который будет описан подробно ниже, и т.п.
Способ отбора в соответствии с настоящим изобретением разъяснен ниже.
Способ отбора в соответствии с настоящим изобретением характеризуется отбором “вещества, способного к стимулированию желудочно-кишечной функции”, за счет изучения наличия или отсутствия активации рецептора T1R тестируемым веществом с использованием клетки, экспрессирующей рецептор T1R. В качестве “вещества, способного к стимулированию желудочно-кишечной функции”, может быть отмечен агонист или модулятор рецептора T1R, который представляет собой вещество, которое регулирует активность рецептора T1R в направлении повышения. Модулятор рецептора T1R содержит вещество, которое повышает активность агониста рецептора T1R.
Наличие или отсутствие активации рецептора T1R могут быть исследованы путем измерения количества вещества, связывающегося с ним (лиганда), вещества, которое ингибирует реакцию сигнала, который регулирует активность рецептора T1R, вещества (вторичный мессенджер и т.д.), которое передает сигнал, продуцированный связыванием лиганда с рецептором T1R, и т.п. Например, активация рецептора T1R может быть исследована путем обнаружения вторичного мессенджера, продуцированного связыванием лиганда, такого как глутаминовая кислота и т.п., с рецептором T1R. Кроме того, активация рецептора T1R может также быть обнаружена за счет измерения связи между меченым лигандом и рецептором T1R с использованием известного меченого лиганда.
В настоящей заявке рецептор T1R действует на ГТФ-связывающий белок (также называемый G-белком: Gs, Gi, Gq, Ggust и т.д.) за счет связывания лиганда и контролирует различные функции клетки через вторичный мессенджер, такой как цАМФ и т.п. Из них внутриклеточная концентрация кальция увеличивается за счет активации Gq. Кроме того, как результат увеличения внутриклеточной концентрации кальция за счет трансдукции сигнала может быть отмечена активация внутриклеточных ферментов, таких как кальмомодулин, протеинкиназа C, аденилатциклаза и т.п., и функциональная регуляция в острой стадии за счет фосфорилирования цитоплазматического мембранного белка. Активация данных внутриклеточных ферментов изменяет функцию канала, находящегося в мембране клетки. Авторами настоящего изобретения было также обнаружено, что рецептор T1R экспрессируется в желудочно-кишечных продуцирующих гормон клетках, в частности в продуцирующих гастрин клетках. В связи с этим наличие или отсутствие активации рецептора T1R за счет тестируемого вещества могут быть зарегистрированы путем введения тестируемого вещества в контакт с клеткой, экспрессирующей рецептор T1R, и определения активации G-белка с использованием в качестве показателя измеренного значения внутриклеточной концентрации кальция, внутриклеточного накопления цАМФ, функции канала (например, количества внеклеточного продуцирования протонов), секреции желудочно-кишечного гормона и т.п.
Клетка, экспрессирующая рецептор T1R, которая будет использована в способе отбора в соответствии с настоящим изобретением, может, например, представлять собой клетку, полученную из млекопитающего, такого как мышь, крыса, хомяк, морская свинка, кролик, собака, обезьяна, человек и т.п., птицы, такой как курица и т.п., и т.п. Предпочтительно используют клетку продуцирующую желудочно-кишечный гормон, полученный из указанного выше животного и т.п.
Тестируемое вещество для способа отбора в соответствии с настоящим изобретением может представлять собой любое известное соединение или новое соединение. Например, могут быть отмечены нуклеиновая кислота, углевод, липид, белок, пептид, органическое низкомолекулярное соединение, библиотека соединений, созданная с применением методики комбинаторной химии, библиотека случайных пептидов, созданная с применением способа твердофазного синтеза или фагового дисплея, или природный компонент, полученный из микроорганизма, растения или животного, морского организма и т.д., и т.п.
Таким образом, способ отбора в соответствии с настоящим изобретением включает, например, следующие стадии (a), (b) и (c):
(a) введение тестируемого вещества в контакт с клеткой, экспрессирующей рецептор T1R,
(b) определение активации G-белка в клетке, введенной в контакт с тестируемым веществом, и сравнение активации за счет него в контрольной клетке, не введенной в контакт с тестируемым веществом,
(c) отбор вещества, способного к стимулированию желудочно-кишечной функции, основанный на результатах сравнения, описанного выше (b).
На стадии (a) описанного выше способа отбора (ниже также называемого способом A) клетку, экспрессирующую рецептор T1R, вводят в контакт с тестируемым веществом. Тестируемое вещество вводят в контакт с клеткой в питательной среде. Питательная среда надлежащим образом выбрана в соответствии типом и т.п. используемой клетки.
На стадии (b) описанного выше способа отбора активацию G-белка в клетке, экспрессирующей рецептор T1R, сначала оценивают в присутствии тестируемого вещества. Затем активацию сравнивают с активацией в отсутствие тестируемого вещества. В качестве показателя для определения активации G-белка может быть отмечена внутриклеточная концентрация кальция, внутриклеточное количество цАМФ, внеклеточное количество протонов, внутриклеточное количество секреции желудочно-кишечного гормона и т.п.
На стадии (c) описанного выше способа отбора активацию сравнивают, например, на основании наличия или отсутствия значительного различия. В результате оценки, когда увеличение или продление активации может быть подтверждено в присутствии тестируемого вещества по отношению к его отсутствию, тестируемое вещество может быть оценено как вещество, способное к стимулированию желудочно-кишечной функции.
При отборе модулятора T1R возможно, что тестируемое вещество и агонист T1R войдут в контакт с клеткой, экспрессирующей рецептор T1R, на описанной выше стадии (a), активацию G-белка, когда агонист T1R вводят в контакт с клеткой в присутствии тестируемого вещества, и активацию G-белка, когда агонист T1R вводят в контакт с клеткой в отсутствие тестируемого вещества, сравнивают на стадии (b), и вещество, которое продлевало активацию G-белка, отбирают как вещество, способное к стимулированию желудочно-кишечной функции (модулятор T1R) на стадии (c).
Кроме того, другой способ отбора в соответствии с настоящим изобретением включает, например, следующие стадии (a), (b) и (c):
(a) введение тестируемого вещества и лиганда, действующего на рецептор T1R, в контакт с клеткой, экспрессирующей рецептор T1R,
(b) измерение количества лиганда, связанного с мембраной клетки, и сравнение количества с количеством в контрольной клетке, не введенной в контакт с тестируемым веществом,
(c) отбор вещества, способного к стимулированию желудочно-кишечной функции, на основании результатов сравнения, описанного выше (b).
На стадии (a) описанного выше способа отбора клетку, экспрессирующую рецептор T1R, вводят в контакт с тестируемым веществом и лигандом, действующим на рецептор T1R. Тестируемое вещество и лиганд, действующий на рецептор T1R, вводят в контакт с клеткой в питательной среде. Питательную среду надлежащим образом выбирают в соответствии с типом и т.п. используемой клетки.
На стадии (b) описанного выше способа отбора количество лиганда, связанного с клеточной мембраной клетки, экспрессирующей рецептор T1R, сначала оценивают в присутствии тестируемого вещества. Затем активацию сравнивают с активацией в отсутствие тестируемого вещества. Количество связанного лиганда может быть, например, измерено с применением радиоактивно меченного лиганда и т.п.
На стадии (c) описанного выше способа отбора количество лиганда сравнивают, например, на основании наличия или отсутствия значительного различия. В результате оценки, когда уменьшение в количестве связанного лиганда может быть подтверждено в присутствии тестируемого вещества по отношению к его отсутствию, тестируемое вещество может быть оценено как вещество, способное к стимулированию желудочно-кишечной функции.
Кроме того, может быть подтверждено, что вещество, для которого уменьшение в количестве связывания лиганда могло быть подтверждено, является агонистом T1R, с помощью указанного выше способа отбора A.
В то время как лиганд, действующий на T1R, особым образом не ограничен, например, может быть отмечена глутаминовая кислота, нуклеиновая кислота и т.п.
Ниже показаны конкретные способы (1)-(6) для обнаружения вещества, способного к стимулированию желудочно-кишечной функции, в которых используют клетку, экспрессирующую рецептор T1R (клетку, функционально поддерживающую рецептор T1R).
(1) Способ, включающий следующие стадии (a), (b) и (c):
(a) введение тестируемого вещества в контакт с клеткой, экспрессирующей рецептор T1R, в которую была введена чувствительная к кальцию краска (например, Fura-2, Indo-1, Fluo-3 и т.д.), в течение заданного периода,
(b) определение интенсивности флуоресценции (внутриклеточной концентрации кальция) в клетке, введенной в контакт с тестируемым веществом, и сравнение интенсивности с интенсивностью для контрольной клетки, не введенной в контакт с тестируемым веществом,
(c) отбор вещества, способного к стимулированию желудочно-кишечной функции, на основании результатов сравнения, описанного выше (b).
На стадии (a) описанного выше способа отбора клетка, экспрессирующая рецептор T1R, которую вводят в контакт с тестируемым веществом, предпочтительно представляет собой клетку, продуцирующую желудочно-кишечный гормон, которая экспрессирует рецептор T1R. Например, можно производить поиск целевого вещества на основании изменений в интенсивности флуоресценции (внутриклеточной концентрации кальция), когда тестируемое вещество вводят в контакт с клеткой, продуцирующей желудочно-кишечный гормон, в которую был введен чувствительный к кальцию краситель, в течение заданного периода. При отборе модулятора T1R возможно, что с тестируемое вещество и агонист T1R войдут в контакт с клеткой, экспрессирующей рецептор T1R, в которую был введен чувствительный к кальцию краситель (например, Fura-2, Indo-1, Fluo-3 и т.д.).
На стадии (b) описанного выше способа отбора оценивают, изменяется ли интенсивность флуоресценции (внутриклеточная концентрация кальция) клетки, экспрессирующей рецептор T1R, в присутствии тестируемого вещества. Таким образом, делают оценку, сравнивая измеренную интенсивность флуоресценции (внутриклеточную концентрацию кальция) с интенсивностью флуоресценции в отсутствие тестируемого вещества. Интенсивность флуоресценции может быть измерена способом, известным по существу. При отборе модулятора T1R интенсивность флуоресценции, когда агонист T1R вводят в контакт с клеткой, экспрессирующей рецептор T1R, в присутствии тестируемого вещества, может быть сравнена с интенсивностью флуоресценции, когда агонист T1R вводят в контакт с клеткой в отсутствие тестируемого вещества.
На стадии (c) описанного выше способа отбора интенсивность флуоресценции сравнивают, например, на основании наличия или отсутствия значительного различия. В результате оценки интенсивности флуоресценции, когда увеличение внутриклеточной концентрации кальция может быть подтверждено, тестируемое вещество может быть оценено как вещество, способное к стимулированию желудочно-кишечной функции. При отборе модулятора T1R вещество, увеличивающее диапазон изменения интенсивности флуоресценции, может быть выбрано в качестве вещества, способного к стимулированию желудочно-кишечной функции (модулятора T1R).
(2) Способ, включающий следующие стадии (a), (b) и (c):
(a) введение тестируемого вещества в контакт с клеткой, экспрессирующей рецептор T1R, в течение заданного периода,
(b) измерение количества цАМФ в клетке, введенной в контакт с тестируемым веществом, и сравнение с количеством в контрольной клетке, не введенной в контакт с тестируемым веществом,
(c) отбор вещества, способного к стимулированию желудочно-кишечной функции, основанной на результатах сравнения, описанного выше (b).
Описанные выше стадии (a) и (b) могут быть выполнены, например, на основании описания Chaudhari N, Nat Neurosci 2000 Feb; 3 (2): 113-9; Flor PJ, Neuropharmacology 1995 Feb; 34 (2): 149-55.
Количество цАМФ может быть измерено с применением коммерчески доступного набора для анализа.
На стадии (a) описанного выше способа отбора при отборе модулятора T1R тестируемое вещество и агонист T1R могут быть введены в контакт с клеткой, экспрессирующей рецептор T1R.
На стадии (b) описанного выше способа отбора при отборе модулятора T1R количество цАМФ, когда агонист T1R вводят в контакт с клеткой, экспрессирующей рецептор T1R, в присутствии тестируемого вещества, может быть сравнено с количеством цАМФ, когда агонист T1R вводят в контакт с клеткой в отсутствие тестируемого вещества.
На стадии (c) описанного выше способа отбора количество цАМФ сравнивают, например, на основании наличия или отсутствия значительного различия. В результате оценки количества цАМФ, когда увеличение количества цАМФ может быть подтверждено, тестируемое вещество может быть оценено как вещество, способное к стимулированию желудочно-кишечной функции. При отборе модулятора T1R вещество, которое стимулировало увеличение количества цАМФ, может быть выбрано в качестве вещества, способного к стимулированию желудочно-кишечной функции (модулятора T1R).
(3) Способ, включающий следующие стадии (a), (b) и (c):
(a) Введение тестируемого вещества и известного лиганда (например, глутаминовой кислоты, нуклеиновой кислоты и т.д.), действующего на рецептор T1R, в контакт с клеткой, экспрессирующей рецептор T1R, в течение заданного периода,
(b) измерение количества лиганда, связанного с клеточной мембраной клетки, и сравнение количества с количеством в контрольной клетке, не введенной в контакт с тестируемым веществом,
(c) отбор вещества, способного к стимулированию желудочно-кишечной функции, на основании результатов сравнения, описанного выше (b).
Описанные выше стадии (a) и (b) могут быть выполнены, например, на основании описаний Naples MA, Neuropharmacology 2001; 40(2): 170-7; Thomsen C, Neuropharmacology 1997 Jan; 36(1): 21-30.
Количество известного лиганда может быть измерено, с помощью радиоактивного мечения части вещества и измерения количества радиоактивности, связанной с мембраной клетки.
На стадии (c) описанного выше способа отбора количество лиганда сравнивают, например, на основании наличия или отсутствия значительного различия. В результате оценки количества лиганда, когда увеличение количества связанного лиганда может быть подтверждено, тестируемое вещество может быть оценено как вещество, способное к стимулированию желудочно-кишечной функции.
(4) Способ, включающий следующие стадии (a), (b) и (c):
(a) введение тестируемого вещества в контакт с клеткой, экспрессирующей рецептор T1R, в которую был введен флуоресцентный белок, чувствительный к цАМФ (например, FlCRhR и т.д.), в течение заданного периода,
(b) определение интенсивности флуоресценции (внутриклеточной концентрации цАМФ) в клетке, которую вводят в контакт с тестируемым веществом, и сравнение с интенсивностью флуоресценции в контрольной клетке, не введенной в контакт с тестируемым веществом,
(c) отбор вещества, способного к стимулированию желудочно-кишечной функции, основанной на результатах сравнения, описанного выше (b).
Описанные выше этапы (a) и (b) могут быть выполнены, например, на основании Adams SR, Nature 1991 Feb 21; 349(6311): 694-7.
В данном контексте клетка, экспрессирующая рецептор T1R, предпочтительно представляет собой клетку, продуцирующую желудочно-кишечный гормон, экспрессирующую рецептор T1R.
На стадии (a) описанного выше способа отбора при отборе модулятора T1R тестируемое вещество и агонист T1R могут быть введены в контакт с клеткой, экспрессирующей рецептор T1R, в которую был введен флуоресцентный белок, чувствительный к цАМФ (например, FlCRhR и т.д.).
На стадии (b) описанного выше способа отбора при отборе модулятора T1R интенсивность флуоресценции (внутриклеточная концентрация цАМФ), когда агонист T1R вводят в контакт с клеткой в присутствии тестируемого вещества, можно сравнивать с интенсивностью флуоресценции, когда агонист T1R вводят в контакт с клеткой в отсутствие тестируемого вещества.
На стадии (c) описанного выше способа отбора интенсивность флуоресценции сравнивают, например, на основании наличия или отсутствия значительного различия. В результате оценки интенсивности флуоресценции, когда увеличение интенсивности флуоресценции может быть подтверждено, тестируемое вещество может быть оценено как вещество, способное к стимулированию желудочно-кишечной функции. При отборе модулятора T1R вещество, которое стимулировало увеличение интенсивности флуоресценции, может быть выбрано в качестве вещества, способного к стимулированию желудочно-кишечной функции (модулятора T1R).
(5) Способ, включающий следующие стадии (a), (b) и (c):
(a) введение тестируемого вещества в контакт с клеткой, экспрессирующей рецептор T1R, в течение заданного периода,
(b) измерение количества продуцирования внеклеточных протонов в клетке, введенной в контакт с тестируемым веществом, и сравнение количества продуцирования протонов с количеством в контрольной клетке, не введенной в контакт с тестируемым веществом,
(c) отбор вещества, способного к стимулированию желудочно-кишечной функции, на основании результатов сравнения, описанного выше (b).
Описанные выше стадии (a), (b) и (c) могут быть выполнены на основании, например, описания McConnell HM, Science 1992 Sep 25; 257(5078): 1906-12.
В данном контексте клетка, экспрессирующая рецептор T1R, предпочтительно представляет собой клетку, продуцирующую желудочно-кишечный гормон, которая экспрессирует рецептор T1R, и, например, измеряют количество продуцирования внеклеточных протонов, когда агонист рецептора T1R и тестируемое вещество вводят в контакт с желудочно-кишечной гормональной клеткой, которая экспрессирует рецептор T1R, в течение заданного периода, и целевое вещество может быть обнаружено с применением в качестве показателя количества продуцирования протонов. Количество продуцирования протонов измеряют сенсором сайта.
На стадии (a) описанного выше способа отбора при отборе модулятора T1R тестируемое вещество и агонист T1R могут быть введены в контакт с клеткой, экспрессирующей рецептор T1R.
На стадии (b) описанного выше способа отбора при отборе модулятора T1R количество продуцирования внеклеточных протонов, когда агонист T1R вводят в контакт с клеткой, экспрессирующей рецептор T1R, в присутствии тестируемого вещества, можно сравнить с количеством продуцирования внеклеточных протонов, когда агонист T1R вводят в контакт с клеткой в отсутствие тестируемого вещества.
На стадии (c) описанного выше способа отбора количество продуцирования протонов сравнивают, например, на основании наличия или отсутствия значительного различия. В результате оценки количества продуцирования протонов, когда увеличение внеклеточного количества продуцирования протонов может быть подтверждено, тестируемое вещество может быть оценено как вещество, способное к стимулированию желудочно-кишечной функции. При отборе модулятора T1R вещество, которое стимулировало увеличение внеклеточного количества продуцирования протонов, может быть выбрано в качестве вещества, способного к стимулированию желудочно-кишечной функции (модулятора T1R).
(6) Способ, включающий следующие стадии (a), (b) и (c):
(a) введение тестируемого вещества в контакт с клеткой, экспрессирующей рецептор T1R, в течение заданного периода,
(b) измерение количества секреции желудочно-кишечного гормона в клетке, введенной в контакт с тестируемым веществом, и сравнение количества секреции желудочно-кишечного гормона с количеством в контрольной клетке, не введенной в контакт с тестируемым веществом,
(c) отбор вещества, способного к стимулированию желудочно-кишечной функции, на основании результатов сравнения, описанного выше (b).
В данном контексте клетка, экспрессирующая рецептор T1R, предпочтительно представляет собой клетку, продуцирующую желудочно-кишечный гормон, которая экспрессирует рецептор T1R, и, например, измеряют количество секреции желудочно-кишечного гормона, когда агонист рецептора T1R и тестируемое вещество вводят в контакт с клеткой, продуцирующей желудочно-кишечный гормон, экспрессирующей рецептор T1R, в течение заданного периода, и можно производить поиск целевого вещества с применением в качестве показателя количества секреции желудочно-кишечного гормона.
Количество секреции желудочно-кишечного гормона может быть измерено с применением коммерчески доступного набора для анализа.
На стадии (a) описанного выше способа отбора при отборе модулятора T1R тестируемое вещество и агонист T1R могут быть введены в контакт с клеткой, экспрессирующей рецептор T1R.
На стадии (b) описанного выше способа отбора при отборе модулятора T1R количество секреции желудочно-кишечного гормона, когда агонист T1R вводят в контакт с клеткой, экспрессирующей рецептор T1R, в присутствии тестируемого вещества, можно сравнивать с количеством секреции желудочно-кишечного гормона, когда агонист T1R вводят в контакт с клеткой в отсутствие тестируемого вещества.
На стадии (c) описанного выше способа отбора количество секреции желудочно-кишечного гормона сравнивают, например, на основании наличия или отсутствия значительного различия. В результате оценки количества секреции желудочно-кишечного гормона, когда изменение количества секреции желудочно-кишечного гормона может быть подтверждено, тестируемое вещество может быть оценено как вещество, способное к стимулированию желудочно-кишечной функции. При отборе модулятора T1R вещество, которое увеличивало диапазон изменения количества секреции желудочно-кишечного гормона, может быть выбрано в качестве вещества, способного к стимулированию желудочно-кишечной функции (модулятора T1R).
Агент в соответствии с настоящим изобретением полезен в виде фармацевтического агента, пищи, напитка и т.п., и индивид, которому его вводят, например, представляет собой млекопитающее (например, человека, мышь, крысу, хомяка, кролика, кошку, собаку, корову, овцу, обезьяну и т.д.) и т.п.
Кроме того, в соответствии с настоящим изобретением обеспечено применение агониста T1R для получения композиции для стимулирования желудочно-кишечной функции и контролирования аппетита и способ стимулирования желудочно-кишечной функции и контролирования аппетита, который включает введение эффективного количества агониста T1R млекопитающему.
Когда агент в соответствии настоящим изобретением содержится в фармацевтической композиции, фармацевтическая композиция по существу содержит агонист T1R и носитель. Носитель особым образом не ограничен, если он является приемлемым в качестве фармацевтического агента, и, например, могут быть отмечены указанные ниже вещества (например, эксципиент, растворитель и т.д.) для получения.
В используемом в настоящей заявке смысле, несмотря на то что способ введения агента или фармацевтической композиции в соответствии с настоящим изобретением (ниже также просто называемого фармацевтическим агентом) особым образом не ограничен, могут быть использованы общие пути введения, такие как оральное введение, ректальное введение, введение путем инъекции или переливания и т.п.
Дозированная форма орального введения включает гранулу, мелкую гранулу, порошок, покрытую оболочкой таблетку, таблетку, суппозиторий, порошок, (микро) капсулу, жевательную таблетку, сироп, сок, жидкость, суспензию, эмульсию и т.п. Для инъекции могут быть использованы обычные дозированные формы фармацевтических препаратов, такие как прямая внутривенная инъекция, капельная инфузия, препарат, продлевающий высвобождение активности вещества, и т.п.
Данные фармацевтические агенты могут быть получены в соответствии с обычным способом. Когда необходимо для препарата, могут быть добавлены различные фармакологически приемлемые вещества (как вспомогательные средства) для препаратов. В то время как вещество для препарата может быть надлежащим образом выбрано в соответствии с дозированной формой препарата, оно включает, например, эксципиент, разбавитель, добавку, дезинтегрант, связующее вещество, вещество для покрытия, лубрикант, глидант, ароматизатор, подсластитель, солюбилизатор, растворитель и т.п. Конкретные примеры вещества для получения включают карбонат магния, диоксид титана, лактозу, маннит и другие сахариды, тальк, молочный белок, желатин, крахмал, целлюлозу и ее производные, животное и растительное масло, полиэтиленгликоль и растворитель, такой как стерильная вода и одноатомный или многоатомный спирт (например, глицерин и т.п.).
В то время как доза фармацевтического агента в соответствии с настоящим изобретением для орального введения изменяется в зависимости от симптомов и возраста пациентов, которым вводят агент и к которым применяют способ введения, суточная доза активного ингредиента для взрослого (вес тела 60 кг) по существу составляет приблизительно 0,001 мг - 1 г, предпочтительно приблизительно 0,01 мг - 1 г и более предпочтительно приблизительно 0,1 мг - 1 г.
Доза парентерального введения (приема) посредством капельной инфузии, инъекции (введения через вену) и т.п. составляет приблизительно от 1/10 до 1/20 указанной выше предпочтительной дозы (количества приема) путем орального введения.
Фармацевтический агент в соответствии с настоящим изобретением может быть использован в комбинации с другими фармацевтическими агентами, и в качестве таких фармацевтических агентов, например, могут быть использованы ингибиторы кислотной секреции, такие как антагонист рецептора H2, ингибитор протонной помпы и т.п., агенты, улучшающие функцию подвижности, такие как агонист рецептора 5-HT, антагонист D2 и т.п., антацидные агенты, такие как антагонист мускаринового рецептора, антигастриновое средство, антихолинергическое средство и т.п., агенты, защищающие слизистую оболочку, такие как тепренон, плаунотол, орнопростил, энпростил, мизопростол, ребамипид, сукралфат, полапрецинк, азулен, эгуален натрий, глутамин, алдиокс, гефарнат, экабет натрий и т.п., агенты для лечения воспалительного колита, такие как сульфасалазин, препарат 5-ASA, стероид, ремикад и т.п. Могут содержаться один или более типов из них.
Агент в соответствии с настоящим изобретением может содержаться в продукте питания или напитке. При содержании в продукте питания или напитке может быть использована любая обычная форма диеты, если она содержит активный ингредиент в соответствии с настоящим изобретением. Например, может быть добавлен подходящий ароматизатор для получения напитка, такого как освежающий напиток и напиток в порошке. Конкретно, например, он может быть смешан с соком, молоком, кондитерским изделием, гелем и т.п. и сохранен. Также может быть обеспечен такой продукт питания и напиток, как продукт питания с утверждением о полезности для здоровья, как определено министерством здравоохранения, департаментом труда и социальной защиты, который включает продукт питания и напиток, в частности продукт питания, специально используемый для поддержания здоровья, продукт питания с утверждением о питательной функции и т.п., указывающий на применение настоящего изобретения для стимулирования желудочно-кишечной функции и регуляции аппетита и т.п.
Кроме того, также возможно добавление агента в соответствии с настоящим изобретением в конденсированный жидкий рацион или применение его в качестве добавки к рациону. Для применения в качестве добавки к рациону ему, например, может быть придана форма таблетки, капсулы, порошка, гранулы, суспензии, жевательной таблетки, сиропа и т.п. Добавка к рациону в настоящем изобретении включает, в дополнение к принимаемым в виде продукта питания, принимаемые в виде добавочного питания, которые включают пищевую добавку, добавку (в частности, диетическую добавку) и т.п.
Когда агент в соответствии с настоящим изобретением содержится в продукте питания или напитке, количество введения активного ингредиента для взрослого человека в сутки по существу составляет приблизительно 0,001 мг - 1 г, предпочтительно приблизительно 0,01 мг - 1 г и более предпочтительно приблизительно 0,1 мг - 1 г. Когда агент настоящего изобретения содержится в продукте питания или напитке, содержание активного ингредиента в пище или напитке по существу составляет приблизительно 0,01-100 000 весовых частей на миллион, предпочтительно приблизительно 0,01-10 000 весовых частей на миллион и более предпочтительно приблизительно 0,01-1000 весовых частей на миллион.
Примеры
Настоящее изобретение подробно объяснено ниже путем обращения к примерам и экспериментальным примерам, которые не следует рассматривать как ограничивающие.
Пример 1. Идентификация местоположения рецептора T1R1 за счет иммунного окрашивания
<1> Приготовление образца в разрезе желудка и тонкой кишки крысы
Крысу (Sprague-Dawley, самец, 350-400 г) умерщвляли путем обескровливания после рассечения правого ушка предсердия под эфирным наркозом и после этого немедленно извлекали желудок и тонкую кишку. Из желудка была извлечена пилорическая преддверная часть, где находится множество клеток, продуцирующих желудочно-кишечный гормон, и из тонкой кишки была извлечена часть приблизительно 5 см от пилорической части желудка. Когда большое количество продукта пищеварения оставалось в желудочно-кишечном тракте, кишку промывали солевым раствором.
Удаленный желудок и кишку рассекали, прикрепляли булавками к пробковой пластине и встряхивали в 4% параформальдегиде (4°C) в течение одного дня иммерсионого связывания. После этого их подвергали криопротекции с помощью иммерсии в 20% сахарозе-PBS в течение 3-4 дней, заливали заливочным агентом (соединение OCT, коммерческое название: Tissue-Tek, Sakura Seiki Co., Ltd.) и срезали слоями в 5-7 мкм с помощью криостата. Срез сушили при комнатной температуре и хранили при 4°C до применения для различных окрашиваний.
<2> Иммунное окрашивание с применением антитела анти-T1R1 рецептора
Срез подвергали иммунному окрашиванию в соответствии со способом, описанным в известной публикации (Drengk et al., J. Auto. Nerv. Sys. 78: 109-112, 2000; Miampamba & Sharkey, J. Auto. Nerv. Sys. 77: 140-151, 1999).
Срез промывали PBS и обрабатывали 3% перекисью водорода/метанолом в течение 15 минут для предотвращения реакции за счет эндогенной пероксидазы. Затем срез промывали PBS и блокировали в течение 1 часа с применением 1% PBS с добавленным бычьим сывороточным альбумином (1% BSA-PBS), содержащим 10% нормальную сыворотку лошади. Срез повторно промывали PBS и подвергали реакции с первичным антителом (таблица 1), разбавленным 1% BSA-PBS, содержащим 1% нормальную сыворотку лошади, при 4°C в течение 2 ночей. Затем срез промывали PBS и подвергали реакции со вторичным антителом (таблица 1), разбавленным 1% BSA-PBS, при комнатной температуре в течение 1 часа. В конечном итоге была проведена реакция ABC (авидин-биотиновый комплекс) с применением набора Vectorstain elite (вектор) с обработкой 0,025% диаминобензидином для обеспечения проявления цвета. После завершения реакции срез промывали PBS, дегидратировали этанолом/ксилолом, вставляли и наблюдали с помощью микроскопа. Срез, не содержащий первичное антитело, использовали в качестве отрицательного контроля. Тип и степень разбавления используемых первичных и вторичных антител показаны в таблице 1.
Alpha Diagnostic International, США, кат. № TR11-A
<3> Гематоксилиновое окрашивание
Срез промывали водой, окрашивали ядро гематоксилином Мейера (Wako Pure Chemical Industries, Ltd.) и после проявления цвета использовали дегидратацию/включение.
<4> Результаты
Результаты иммунного окрашивания показаны на фиг.1. В желудке (фиг.1, A) и тонком кишечнике (фиг.1, B) клетки, рассеянные в желудочно-кишечной слизистой оболочке были окрашены с помощью антитела анти-T1R1 рецептора. Из морфологической характеристики, согласно которой верхняя сторона положительной клетки направлена в сторону просвета кишечника как в желудке, так и в тонком кишечнике, было сделано предположение, что данные клетки представляли собой клетки, продуцирующие желудочно-кишечный гормон. До этого экспрессия рецептора T1R1 в клетках, продуцирующих желудочно-кишечный гормон, не была известна. Так как рецептор T1R1 экспрессировался в клетках, продуцирующих желудочно-кишечный гормон, была предложена функциональная зависимость с эндокринной регуляцией желудочно-кишечного гормона. Было подтверждено, что антитело анти-T1R1 рецептора окрашивало вкусовую клетку вкусового сосочка (фиг.1, C).
Пример 2. Идентификация местоположения рецептора T1R1 и гастрина двойным иммунным окрашиванием
<1> Двойная окраска антителом анти-T1R1 рецептора и антигастриновым антителом
Срез желудка был подвергнут двойному окрашиванию антителом анти-T1R1 рецептора и антигастриновым антителом. Срез сначала промывали PBS и блокировали в течение 1 часа с применением 1% PBS с добавленным бычьим сывороточным альбумином (1% BSA-PBS), содержащим 10% нормальную сыворотку лошади. Срез снова промывали PBS и смесь (таблица 2) первичного антитела, разбавленного 1% BSA-PBS, содержащим 1% нормальную сыворотку лошади, подвергали реакции при 4°C в течение двух ночей. Затем срез промывали PBS и подвергали реакции со вторичным антителом (таблица 2), разбавленным 1% BSA-PBS, при комнатной температуре в течение 2 часов. После завершения реакции срез промывали PBS, дегидратировали этанолом/ксилолом, вставляли и наблюдали с помощью микроскопа (LSM 510; Zeiss, Германия). Срез, не содержащий первичное антитело, использовали в качестве отрицательного контроля. Тип и степень разбавления используемых первичных и вторичных антител показаны в таблице 2.
(1)+(2)
(1)+(2)
(Alpha Diagnostic International, США, кат. № TR11-A)
(Santa Cruz Biotechnology Inc., CA)
или
400
<2> Результаты
Результаты иммунного окрашивания, наблюдаемые в одной и той же области с помощью конфокального микроскопа, показаны на фиг.2. Клетки, рассеянные в слизистой оболочке желудка, были окрашены с помощью антитела анти-T1R1 рецептора (фиг.2, A) и анти-гастринового антитела (фиг.2, B). В наложенном изображении (фиг.2, C) из фиг.2, A, и фиг.2, B, изображения окрашивания совпали друг с другом. Из этого стало ясно, что положительные клетки T1R1 в желудке представляли собой клетки, продуцирующие гастрин (один из желудочно-кишечных гормонов). Так как T1R1 экспрессировался в клетках, продуцирующих гастрин, была предложена функциональная зависимость с эндокринной гастриновой регуляцией.
Пример 3. Обнаружение экспрессии мРНК T1R1 в желудке молекулярным биологическим способом
<1> Амплификация частичной последовательности мРНК T1R1
Слизистые оболочки железистого желудка и пилорической преддверной части были взяты из желудка крысы (Sprague-Dawley). Из языка были взяты грибовидные сосочки, включающие вкусовой сосочек и ткань без вкусового сосочка. С использованием полной РНК, извлеченной из образца каждой части желудка и языка, в качестве матрицы и фермента обратной транскриптазы SuperScrip (Invitrogen, CA, США) была выполнена обратная транскрипция. С использованием полученной кДНК в качестве матрицы T1R1 был амплифицирован с применением следующего ген-специфичного праймера и LA taq (TaKaRa).
Используемые ген-специфичные праймеры показаны ниже.
SEQ ID NO: 1: T1R1-824 Прямой 5 '-AGGACCACCGTGGTCGTGGTCTT-3'
SEQ ID NO: 2: T1R1-2163 Обратный 5 '-GCACTCAAGAATCACCAGATGGG-3'
<2> Результаты
Из образцов, полученных из желудка слизистой оболочки пилорической преддверной части (фиг.3, дорожка 5) и языка грибовидных сосочков (фиг.3, дорожка 2), были получены продукты ПЦР с одинаковым размером. Анализ последовательности позволил обнаружить, что данные продукты ПЦР имеют ту же последовательность, что и последовательность T1R1, полученная из вкусовой клетки. С другой стороны, продукты ПЦР не были получены из желудка/слизистой оболочки железистого желудка (фиг.3, дорожка 4) и языка или ткани не из вкусового сосочка (фиг.3, дорожка 3). Кроме того, продукт ПЦР не был получен из образцов (фиг.3, дорожки 6, 7), которые претерпевали операцию реакции амплификации без обратной транскриптазы. Желудок/слизистая оболочка пилорической преддверной части, в частности, известна как часть, где находятся клетки, продуцирующие гастрин. С помощью данного примера была установлена экспрессия T1R1 в желудке/слизистой оболочке пилорической преддверной части не только химическим методом тканевого иммунитета, но также и молекулярным биологическим способом.
Пример 4. Тест на опорожнение содержимого желудка с использованием агониста T1R
<Способ эксперимента>
Способ опорожнения желудка мыши
Использовали самца мыши ICR. Перорально вводили жидкий рацион 5% казеина (0,5 мл), содержащий 0,05% феноловый красный и тестируемое лекарственное средство (3,5 мМ цикламат, 3,7 мМ MSG (глутамат мононатрия), соединение 1 (1 весовая часть на миллион и 10 весовых частей на миллион) следующего примера получения 1), и через 30 минут вскрывали грудную клетку и извлекали желудок. Желудок помещали в 0,1 н гидроксид натрия (14 мл), гомогенизировали и оставляли на 1 час при комнатной температуре. К 5 мл супернатанта добавляли 20% трихлоруксусную кислоту (0,5 мл) и смесь центрифугировали (3000 об/мин, 20 минут). К супернатанту добавляли 0,5 н гидроксид натрия (4 мл) и абсорбционным спектрометром измеряли поглощение света (560 нм). Скорость опорожнения желудка была определена по следующей вычислительной формуле:
скорость опорожнения желудка (%)=(1-поглощение света тестируемым образцом/поглощение света стандартным образцом)×100.
Для получения поглощения света стандартным образцом использовали желудок, извлеченный сразу после введения 0,05% раствора фенолового красного.
Пример 5. Тест подвижности желудочно-кишечного тракта с использованием агониста T1R
<Способ эксперимента>
Способ для измерения движения желудочно-кишечного тракта с использованием собаки в состоянии бодрствования
Самку гончей, которую не кормили в течение одной ночи, подвергли операции на брюшной полости под анестезией 1,0% изофлюраном; датчик для измерения движения желудочно-кишечного тракта зашили на желудке в направлении, позволяющем измерение сокращения кольцевой мышцы; и зашили брюшную полость. Спустя не меньше чем две недели после хирургической операции движение желудочно-кишечного тракта измеряли после голодания в течение одной ночи и перорально назначали 300 мл конденсированного жидкого рациона (Ajinomoto Co. Inc., ”MEDIEF BAG”), содержащего тестируемое соединение (агонист T1R) 4, 5 или 6, описанное в следующем примере получения (10 весовых частей на миллион соответственно), через 10-20 минут после завершения III фазы движения сильного сокращения при голодании (n=1 для каждой проверенной группы). Показатель подвижности рассчитывали как площадь между базовым уровнем и волнистой линией сокращения спустя 60-90 минут после орального введения и представляли как процент по отношению к контрольной группе, которой орально назначали только конденсированный жидкий рацион без соединения.
<Результаты эксперимента>
Результаты показаны на фиг.6. Как показано в данных, тестируемая группа продемонстрировала увеличение движения желудочно-кишечного тракта по сравнению с контрольной группой.
Пример 6. Тест на опорожнение содержимого желудка с использованием агониста T1R
<Способ эксперимента>
Способ опорожнения желудка мыши
Использовали самца мыши ICR. Орально вводили жидкий рацион 5% казеина (0,5 мл), содержащий 0,05% феноловый красный и тестируемое лекарственное средство (3,5 мМ цикламат, 3,7 мМ MSG (глутамат мононатрия), соединение 2, 3, 4 или 5 (10 весовых частей на миллион соответственно) следующего примера получения), и через 30 минут вскрывали грудную клетку и извлекали желудок. Желудок помещали в 0,1 н гидроксид натрия (14 мл), гомогенизировали и оставляли на 1 час при комнатной температуре. К 5 мл супернатанта добавляли 20% трихлоруксусную кислоту (0,5 мл) и смесь центрифугировали (3000 об/мин, 20 минут). К супернатанту добавляли 0,5 н гидроксид натрия (4 мл) и абсорбционным спектрометром измеряли поглощение света (560 нм). Скорость опорожнения желудка была определена по следующей вычислительной формуле:
скорость опорожнения желудка (%)=(1-поглощение света тестируемым образцом/поглощение света стандартным образцом)×100.
Для получения поглощения света стандартным образцом использовали желудок, извлеченный сразу после введения 0,05% раствора фенолового красного.
<Результаты эксперимента>
Результаты показаны на фиг.7, где вертикальная ось представляет скорость опорожнения желудка (%). Как видно из фиг.7, соединения 2-5 стимулировали опорожнение желудка.
Примеры получения
Соединения 1-6, описанные в таблице 3 ниже, синтезировали способом, описанным в следующих примерах. Однако способы синтеза данных соединений не ограничены способами синтеза в следующих примерах. Структура соединений, синтезируемых в следующих примерах, была идентифицирована с помощью спектра магнитного резонанса (Bruker AVANCE400 (400 МГц)) и массового анализа (Thermo Quest TSQ700).
Пример получения 1. Синтез 3,6-дихлор-N-(4-этоксифенил)-2-метоксибензамида (соединения 1)
К ацетонитрилу (30 мл) добавляли 3,6-дихлор-2-метоксибензойную кислоту (1,68 г, 7,60 ммоль) и п-фенетидин (1,04 г, 7,60 ммоль). К данной реакционной смеси добавляли гексафторфосфат 1H-бензотриазол-1-илокситрис(диметиламино)фосфония (BOP, 3,21 г, 7,60 ммоль) и N, N-диизопропилэтиламин (DIEA, 4,0 мл, 23,5 ммоль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, к остатку добавляли этилацетат (100 мл) и смесь перемешивали. Органический слой промывали водой (50 мл), водным 2 н раствором хлористоводородной кислоты (50 мл × 2), насыщенным соляным раствором (50 мл), насыщенным водным раствором гидрокарбоната натрия (50 мл × 2) и насыщенным соляным раствором (50 мл) и сушили над безводным сульфатом магния. Сульфат магния отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток дважды перекристаллизовывали из этилацетата-н-гексана для получения соединения в соответствии с заголовком (1,11 г, 3,26 ммоль, 42,9%) в виде белых кристаллов.
1H-ЯМР (CDCl3, δ): 1,44(т, J=7,0 Гц, 3H), 3,99(c, 3H), 4,03(кв, J=7,0 Гц, 2H), 6,90(д, J=9,0 Гц, 2H), 7,15(д, J=8,6 Гц, 1H), 7,40(уш.с, 1H), 7,36(д, J=8,6 Гц, 1H), 7,50(д, J=9,0 Гц, 2H).
ESI-MS: 340,2, 342,2(M+H)+.
Пример получения 2. Синтез 2,5-дихлор-N-(4-этоксифенил)бензамида (соединения 2)
Аналогичным примеру получения 1 способом, за исключением того что вместо 3,6-дихлор-2-метоксибензойной кислоты использовали 2,5-дихлорбензойную кислоту, соединение в соответствии с заголовком получали в виде белых кристаллов (выход 66,8 %).
1H-ЯМР (CDCl3, δ): 1,42(т, J=7,0 Гц, 3H), 4,04(кв, J=7,0 Гц, 2H), 6,90(д, J=10,2 Гц, 2H), 7,38(с, 2H), 7,51(д, J=10,2 Гц, 2H), 7,74(c, 1H), 7,78(уш.с, 1H).
ESI-MS: 310,2, 312,2(M+H)+.
Пример получения 3. Синтез N-(1-этилпропил)-бензофуран-2-карбоксамида (соединения 3)
Аналогичным примеру получения 1 способом, за исключением того что вместо 3,6-дихлор-2-метоксибензойной кислоты использовали бензофуран-2-карбоновую кислоту и вместо п-фенетидина использовали 3-аминопентан, соединение в соответствии с заголовком получали в виде белых кристаллов (выход 75,1 %).
1H-ЯМР (CDCl3, δ): 1,03(т, J=7,4 Гц, 6H), 1,48-1,59(м, 2H), 1,64-1,75(м, 2H), 3,98-4,07(м, 1H), 6,35(уш.д, 1H), 7,26-7,31(м, 1H), 7,38-7,43(м, 1H), 7,46(c, 1H), 7,50(д, J=8,4 Гц, 1H), 7,68(д, J=8,4 Гц, 1H).
ESI-MS: 232,0(M+H)+.
Пример получения 4. Синтез N-(1,2,3,4-тетрагидронафталин-1-ил)-бензо[1,3]диоксол-5- карбоксамида (соединения 4)
Аналогичным примеру получения 1 способом, за исключением того что вместо 3,6-дихлор-2-метоксибензойной кислоты использовали пиперониловую кислоту и вместо п-фенетидина использовали 1,2,3,4-тетрагидро-1-нафтиламин, соединение в соответствии с заголовком получали в виде белых кристаллов (выход 74,7%).
1H-ЯМР (CDCl3, δ): 1,84-1,96(м, 3H), 2,10-2,17(м, 1H), 2,76-2,88(м, 2H), 5,33-5,37(м, 1H), 6,01(с, 2H), 6,20(уш.д, 1H), 6,80(д, J=8,5 Гц, 1H), 7,12-7,33(м, 6H).
ESI-MS: 296,0(M+H)+.
Пример получения 5. Синтез 4-этокси-N-(1-пропилбутил) бензамида (соединения 5)
К метиленхлориду (30 мл) добавляли 4-этоксибензойную кислоту (1,66 г, 10,0 ммоль) и 4-гептиламин (1,15 г, 10,0 ммоль) и раствор поддерживали при 0°C в ванне со льдом. К реакционной смеси добавляли 1-гидроксибензотриазол (HOBt, 1,68 г, 11,0 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC, 2,11 г, 11,0 ммоль) и смесь удаляли из ванны со льдом и перемешивали в течение ночи при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, к остатку добавляли этилацетат (100 мл) и перемешивали смесь. Органический слой промывали водой (50 мл), 5% водным раствором лимонной кислоты (50 мл × 2), насыщенным солевым раствором (50 мл), 5% водным раствором гидрокарбоната натрия (50 мл × 2) и насыщенным солевым раствором (50 мл) и сушили над безводным сульфатом магния. Сульфат магния отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток дважды перекристаллизовывали из этилацетата для получения соединения в соответствии с заголовком (663 мг, 2,52 ммоль, 25,2%) в виде белых кристаллов.
1H-ЯМР (CDCl3, δ): 0,90(т, J=7,1 Гц, 6H), 1,33-1,65(м, 15H), 4,07(кв, J=7,0 Гц, 2H), 4,10-4,20(м, 1H), 5,65-5,75(м, 1H), 6,90(д, J=8,8 Гц, 2H), 7,71(д, J=8,8 Гц, 2H).
ESI-MS: 264,0(M+H)+.
Пример получения 6. Синтез 3-(4-метоксифенил)-N-(1-пропилбутил)акриламида (соединения 6)
Аналогичным примеру получения 5 способом, за исключением того что вместо 4-этоксибензойной кислоты использовали 4-метоксикоричную кислоту, соединение в соответствии с заголовком получали в виде белых кристаллов (выход 41,4%).
1H-ЯМР (CDCl3, δ): 0,90(т, J=7,0 Гц, 6H), 1,30-1,55(м, 12H), 3,82(c, 3H), 4,05-4,15(м, 1H), 5,35-5,55(м, 1H), 6,27(д, J=15,5 Гц, 1H), 6,87(д, J=8,8 Гц, 2H), 7,43(д, J=8,8 Гц, 2H), 7,58(д, J=15,5 Гц, 1H).
ESI-MS: 276,1(M+H)+.
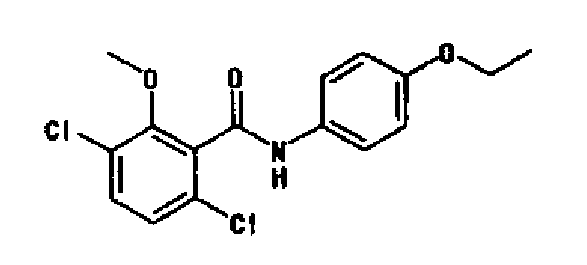


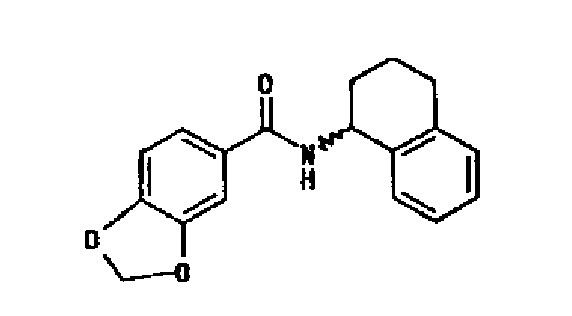
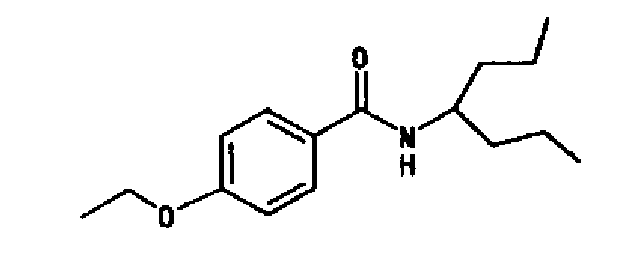
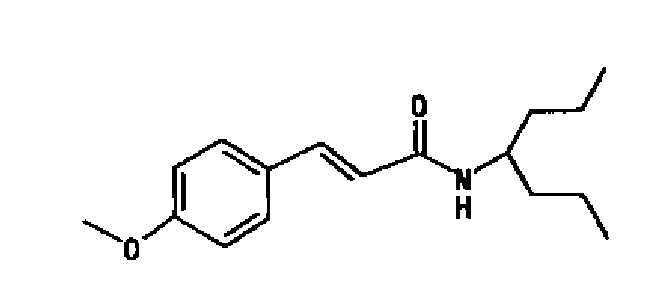
Промышленная применимость
В соответствии с настоящим изобретением возможно обеспечение фармацевтического агента, продукта питания или напитка для стимулирования желудочно-кишечной функции, который полезен для профилактики или лечения, например, функциональных желудочно-кишечных расстройств, в частности дисфункций верхнего желудочно-кишечного тракта, таких как функциональная диспепсия, гастроэзофагеальная рефлюксная болезнь и т.п. С применением композиции в соответствии с настоящим изобретением могут быть безопасно и эффективно достигнуты профилактика или лечение диспепсии, связанной с желудочно-кишечной дисфункцией, такой как FD и т.п., не вызывая побочных эффектов. Кроме того, способ отбора в соответствии с настоящим изобретением используют для обнаружения активного ингредиента, который добавляют к описанному выше фармацевтическому агенту, продукту питания или напитку в соответствии с настоящим изобретением, а также для экспериментов в областях физиологии биохимии.
Данная заявка основана на заявке на патент №2005-320827, поданной в Японии, и на заявке на патент №60/738,561, поданной в США, содержание которых включено полностью в настоящей заявке посредством данной ссылки.


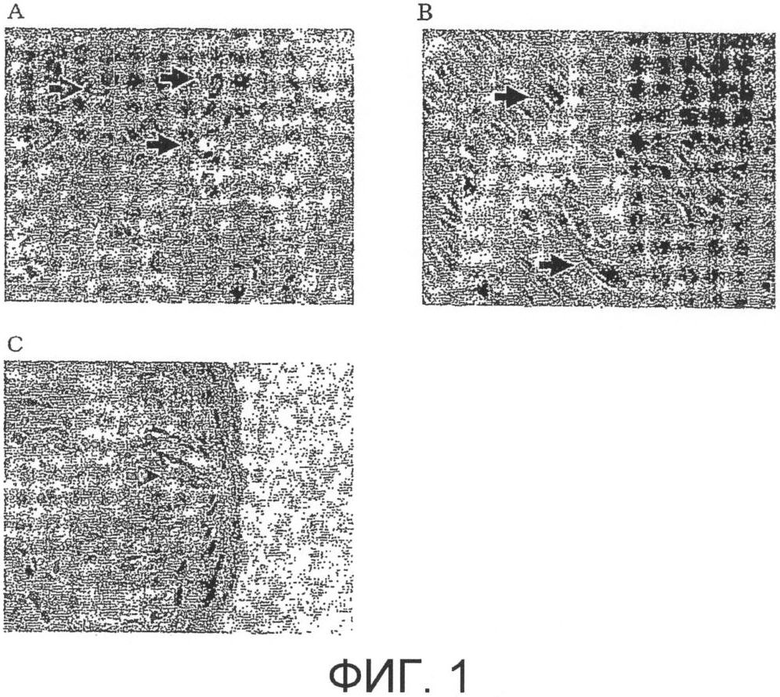
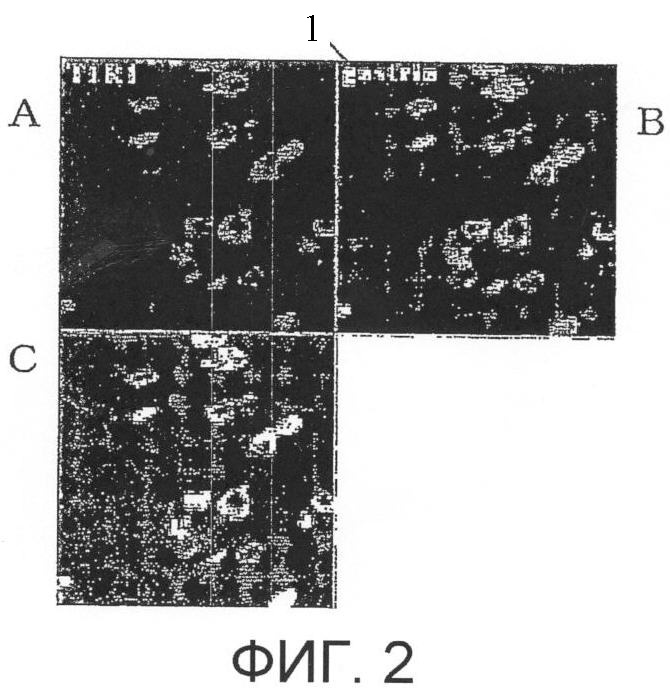

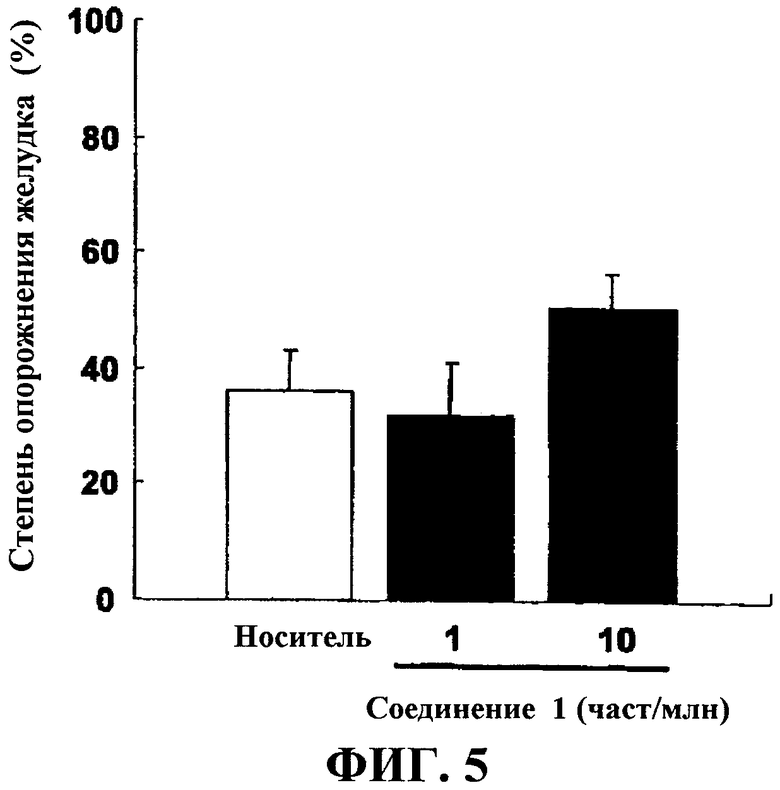

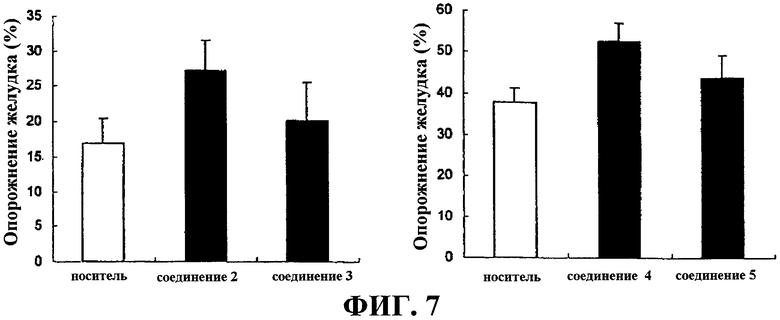
Изобретение относится к области медицины и фармацевтики и касается агента для стимуляции желудочно-кишечной фукции, конкретно для профилактики или лечения функциональных желудочно-кишечных расстройств, регулирования аппетита и т.д., содержащего в качестве активного агента агонист TIR, представляющего собой цикламат или производное амида формулы (1), фармацевтической композиции или продукта питания на его основе и способа стимулирования желудочно-кишечной функции. Настоящее изобретение обеспечивает улучшение качества жизни пациентов. 6 н. и 21 з.п. ф-лы, 7 ил., 3 табл.
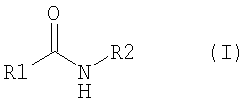
1. Агент, стимулирующий желудочно-кишечную функцию, содержащий агонист T1R в качестве активного ингредиента, где агонист T1R представляет собой цикламат или производное амида, представленное следующей формулой (I):

в котором R1 представляет собой С6-С14арильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, C1-С6алкильной группы, C1-С7алкоксигруппы, метилендиоксигруппы; С6-С14арилС2-С3алкенильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и представляют собой С1-С7алкоксигруппу; 5-10-членную моноциклическую или полициклическую гетероарильную группу, содержащую 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, гидроксильной группы, аминогруппы, С1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, карбоксильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы; R3-NH-CO- или R3-NH- (R3 представляет собой С6-С14арильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, С1-С6алкильной группы, C1-С7алкоксигруппы, метилендиоксигруппы; С6-С14арилС2-С3алкенильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и представляют собой С1-С7алкоксигруппу; или 5-10-членную моноциклическую или полициклическую гетероарильную группу, содержащую 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, C1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы); и
R2 представляет собой С2-25 алкильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, гидроксильной группы, оксогруппы, аминогруппы, С1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, карбоксильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы, 5-10-членной моноциклической или полициклической гетероарильной группы, содержащей 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, необязательно содержащей заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из С1-С6алкильной группы; С3-25 циклоалкильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, гидроксильной группы, оксогруппы, аминогруппы, С1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, карбоксильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы (указанная циклоалкильная группа необязательно конденсирована с бензолом); С6-С14арильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и представляют собой C1-С7алкоксигруппу; или 5-10-членную моноциклическую или полициклическую гетероарильную группу, содержащую 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, гидроксильной группы, аминогруппы, С1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, карбоксильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы,
или его фармакологически приемлемую соль.
2. Агент по п.1, в котором стимулирование желудочно-кишечной функции представляет собой профилактику или лечение функционального желудочно-кишечного расстройства.
3. Агент по п.2, в котором функциональное желудочно-кишечное расстройство представляет собой дисфункцию верхнего желудочно-кишечного тракта.
4. Агент по п.2, в котором функциональное желудочно-кишечное расстройство представляет собой функциональную диспепсию или гастроэзофагеальную рефлюксную болезнь.
5. Агент, регулирующий аппетит, содержащий агонист T1R, определенный в п.1, в качестве активного ингредиента.
6. Агент по любому из пп.1-5, в котором агонист T1R представляет собой цикламат или производное амида, представленное формулой (I).
7. Агент по любому из пп.1-5, в котором производное амида представляет собой соединение, выбранное из группы, состоящей из:
(1) 3,6-дихлор-N-(4-этоксифенил)-2-метоксибензамида,
(2) 2,5-дихлор-N-(4-этоксифенил)бензамида,
(3) N-(1-этилпролил)-бензофуран-2-карбоксамида,
(4) N-(1,2,3,4-тетрагидронафталин-1-ил)-бензо[1,3]диоксол-5-карбоксамида,
(5) 4-этокси-N-(1-пропилбутил)бензамида и
(6) 3-(4-метоксифенил)-N-(1-пропилбутил)акриламида.
8. Фармацевтическая композиция для стимулирования желудочно-кишечной функции и/или регулирования аппетита, содержащая агент по любому из пп.1-5.
9. Продукт питания или напиток, содержащий агент по любому из пп.1-5, в котором активный ингредиент в указанном агенте содержится в пропорции 0,01-100000 вес.ч. на миллион продукта питания или напитка.
10. Способ стимулирования желудочно-кишечной функции, который включает введение эффективного количества агониста T1R млекопитающему, где агонист T1R представляет собой цикламат или производное амида, представленное следующей формулой (I):

в котором R1 представляет собой С6-С14арильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, C1-С6алкильной группы, C1-С7алкоксигруппы, метилендиоксигруппы; С6-С14арилС2-С3алкенильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и представляют собой С1-С7алкоксигруппу; 5-10-членную моноциклическую или полициклическую гетероарильную группу, содержащую 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, гидроксильной группы, аминогруппы, С1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, карбоксильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы; R3-NH-CO- или R3-NH- (R3 представляет собой С6-С14арильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, С1-С6алкильной группы, C1-С7алкоксигруппы, метилендиоксигруппы; С6-С14арилС2-С3алкенильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и представляют собой С1-С7алкоксигруппу; или 5-10-членную моноциклическую или полициклическую гетероарильную группу, содержащую 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, С1-С6алкильной группы, C1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы); и
R2 представляет собой С2-25 алкильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, гидроксильной группы, оксогруппы, аминогруппы, С1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, карбоксильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы, 5-10-членной моноциклической или полициклической гетероарильной группы, содержащей 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, необязательно содержащей заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из C1-С6алкильной группы; С3-25 циклоалкильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, гидроксильной группы, оксогруппы, аминогруппы, C1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, карбоксильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы (указанная циклоалкильная группа необязательно конденсирована с бензолом); С6-С14арильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и представляют собой С1-С7алкоксигруппу; или 5-10-членную моноциклическую или полициклическую гетероарильную группу, содержащую 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, гидроксильной группы, аминогруппы, С1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, карбоксильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы,
или его фармакологически приемлемую соль.
11. Способ по п.10, в котором стимулирование желудочно-кишечной функции представляет собой профилактику или лечение функционального желудочно-кишечного расстройства.
12. Способ по п.11, в котором описанное выше функциональное желудочно-кишечное расстройство представляет собой дисфункцию верхнего желудочно-кишечного тракта.
13. Способ по п.11, в котором описанное выше функциональное желудочно-кишечное расстройство представляет собой функциональную диспепсию или гастроэзофагеальную рефлюксную болезнь.
14. Способ регулирования аппетита, который включает введение млекопитающему эффективного количества агониста T1R, определенного в п.10.
15. Способ по любому из пп.10-14, в котором агонист T1R представляет собой цикламат или производное амида, представленное формулой (I).
16. Способ по любому из пп.10-14, в котором производное амида представляет собой соединение, выбранное из группы, состоящей из:
(1) 3,6-дихлор-N-(4-этоксифенил)-2-метоксибензамида,
(2) 2,5-дихлор-N-(4-этоксифенил)бензамида,
(3) N-(1-этилпропил)-бензофуран-2-карбоксамида,
(4) N-(1,2,3,4-тетрагидронафталин-1-ил)-бензо[1,3]диоксол-5-карбоксамида,
(5) 4-этокси-N-(1-пропилбутил)бензамида и
(6) 3-(4-метоксифенил)-N-(1-пропилбутил)акриламида.
17. Способ по любому из пп.10-14, который включает введение фармацевтической композиции, содержащей описанный выше агонист T1R и носитель, млекопитающему.
18. Способ по любому из пп.10-14, который включает введение продукта питания или напитка, содержащего описанный выше агонист T1R в пропорции 0,01-100000 вес.ч. на миллион, млекопитающему.
19. Применение агониста T1R для получения композиции для стимулирования желудочно-кишечной функции, где агонист T1R представляет собой цикламат или производное амида, представленное следующей формулой (I):

в котором R1 представляет собой С6-С14арильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, С1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы; С6-С14арилС2-С3алкенильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и представляют собой С1-С7алкоксигруппу; 5-10-членную моноциклическую или полициклическую гетероарильную группу, содержащую 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, гидроксильной группы, аминогруппы, С1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, карбоксильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы; R3-NH-CO- или R3-NH- (R3 представляет собой С6-С14арильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, С1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы; С6-С14арилС2-С3алкенильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и представляют собой С1-С7алкоксигруппу; или 5-10-членную моноциклическую или полициклическую гетероарильную группу, содержащую 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, С1-С6алкильной группы, C1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы); и
R2 представляет собой С2-25 алкильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, гидроксильной группы, оксогруппы, аминогруппы, С1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, карбоксильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы, 5-10-членной моноциклической или полициклической гетероарильной группы, содержащей 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, необязательно содержащей заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из С1-С6алкильной группы; С3-25 циклоалкильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, гидроксильной группы, оксогруппы, аминогруппы, С1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, карбоксильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы (указанная циклоалкильная группа необязательно конденсирована с бензолом); С6-С14арильную группу, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и представляют собой С1-С7алкоксигруппу; или 5-10-членную моноциклическую или полициклическую гетероарильную группу, содержащую 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, необязательно содержащую заместитель (заместители), которые могут быть идентичными или различными и выбраны из группы, состоящей из атома галогена, гидроксильной группы, амино группы, С1-С6алкильной группы, С1-С7алкоксигруппы, метилендиоксигруппы, С2-С7ацильной группы, карбоксильной группы, С2-С7алкоксикарбонильной группы, карбамоильной группы, С2-С7алкилкарбамоильной группы, С7-С11арилкарбамоильной группы,
или его фармакологически приемлемую соль.
20. Применение по п.19, в котором стимулирование желудочно-кишечной функции представляет собой профилактику или лечение функционального желудочно-кишечного расстройства.
21. Применение по п.20, в котором описанное выше функциональное желудочно-кишечное расстройство представляет собой дисфункцию верхнего желудочно-кишечного тракта.
22. Применение по п.20, в котором описанное выше функциональное желудочно-кишечное расстройство представляет собой функциональную диспепсию или гастроэзофагеальную рефлюксную болезнь.
23. Применение агониста T1R для получения композиции для регуляции аппетита, где агонист T1R является таким, как определено в п.19.
24. Применение по любому из пп.19-23, в котором агонист T1R представляет собой цикламат или производное амида, представленное формулой (I).
25. Применение по любому из пп.19-23, в котором производное амида представляет собой соединение, выбранное из группы, состоящей из:
(1) 3,6-дихлор-N-(4-зтоксифенил)-2-метоксибензамида,
(2) 2,5-дихлор-M-(4-этоксифенил)бензамида,
(3) N-(1-этилпропил)-бензофуран-2-карбоксамида,
(4) N-(1,2,3,4-тетрагидронафталин-1-ил)-бензо[1,3]диоксол-5-карбоксамида,
(5) 4-этокси-M-(1-пропилбутил)бензамида и
(6) 3-(4-метоксифенил)-N-(1-пропилбутил)акриламида.
26. Применение по любому из пп.19-23, в котором описанная выше композиция представляет собой фармацевтический продукт.
27. Применение по любому из пп.19-23, в котором описанная выше композиция представляет собой продукт питания или напиток, содержащий агонист T1R в пропорции 0,01-100000 вес.ч. на миллион.
Приоритет по пунктам и признакам:
04.11.2005 по пп.1-5, 8-14, 17-23, 26 и 27; 22.11.2005 по пп.1-5,8-14,17-23,26 и 27,за исключением признака "фармацевтически приемлемая соль производного амида формулы (I)";
04.11.2005 и 22.11.2005 по пп.6, 7, 15, 16, 24 и 25;
02.11.2006 по пп.1-5, 8-14, 17-23, 26 и 27 в отношении признака "фармацевтически приемлемая соль производного амида формулы (I)".
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| ПРОИЗВОДНЫЕ N-(3-ГИДРОКСИ-4-ПИПЕРИДИНИЛ)-(ДИГИДРОБЕНЗОФУРАН, ДИГИДРО-2Н-БЕНЗОПИРАН ИЛИ ДИГИДРОБЕНЗОДИОКСИН)-КАРБОКСАМИДА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2108332C1 |
| Состав пищевого продукта | 1988 |
|
SU1834647A3 |
Авторы
Даты
2010-07-27—Публикация
2006-11-02—Подача