Изобретение относится к получению новых соединений - полихлоралюминатов лития в среде диэтилового эфира общей формулы LiCl·nAlCl3·2Et2O, где n=1, 2, которые могут быть использованы в качестве реагентов для очистки нефтепродуктов и природного газа от сероводорода и меркаптанов, катализаторов в процессах хлорметилирования и алкилирования ароматических углеводородов, исходных веществ при получении гидридов металлов.
В литературе отсутствуют сведения о хлоридных комплексах лития с хлоридами алюминия, получаемых в среде диэтилового эфира.
Задачей настоящего изобретения является получение новых соединений - полихлоралюминатов лития в среде диэтилового эфира общей формулы LiCl·nAlCl3·2Et2O, где n=1, 2, которые могут быть использованы в качестве реагентов для очистки нефтепродуктов и природного газа от сероводорода и меркаптанов, катализаторов в процессах хлорметилирования и алкилирования ароматических углеводородов, исходных веществ при получении гидридов металлов.
Поставленная задача достигается тем, что для получения вышеназванных соединений проводят взаимодействие хлорида алюминия с хлоридом лития в среде диэтилового эфира.
Типичный опыт заключается в следующем. К взвеси LiCl в диэтиловом эфире добавляют эфират хлорида алюминия (AlCl3·Et2O) при перемешивании в соотношении реагентов (AlCl3·Et2O):(LiCl·Et2O)=1:1 и 1:2 и общим объемом эфира 200 мл.
Взаимодействие реагентов проводят в трехгорлой колбе вместимостью 500 мл при комнатной температуре и обычном перемешивании в течение 60-140 мин по схеме:
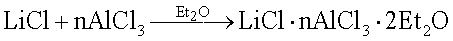
Признаком взаимодействия служит небольшое разогревание (до 30°С) реакционной массы, при этом происходит уменьшение объема осадка и появление в растворе ионов лития, хлорид которого нерастворим в диэтиловом эфире. Процесс ведут до постоянства элементов в растворе. Из прозрачного эфирного послереакционного раствора путем испарения 3/4 части растворителя в вакууме при 25°С с последующим вымораживанием насыщенного раствора азотом выделяют соединения состава: LiCl·nAlCl3·2Et2O, где n=1, 2.
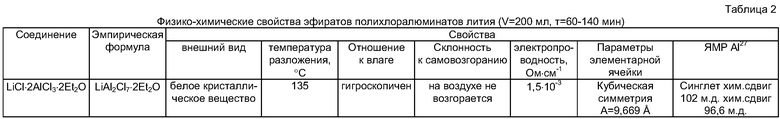
В таблице 1 приведены результаты взаимодействия хлоридов лития с хлоридом алюминия в среде диэтилового эфира. Полученные соединения представляют собой кристаллические порошки, со временем расплывающиеся на воздухе, поэтому рекомендовано хранить их в эксикаторе или закрытой посуде. В таблице 2 приведены физико-химические характеристики одного из полученных соединений. Выделенные из раствора комплексные соединения реакционноспособны и легко подвержены диссоциации в растворе при обработке большим количеством диэтилового эфира. Полученные соединения стабилизированы молекулами диэтилового эфира, которые в комплексе координированы по донорно-акцепторному механизму и относятся к оксониевым соединениям.
Новые соединения были идентифицированы совокупностью физико-химических методов: рентгенографией, термографией, ИК-спектроскопией, хроматографией и методом химического анализа, построены изотермы растворимости. Установлено, что полихлоралюминаты лития в среде диэтилового эфира отвечают индивидуальным соединениям.
При изучении термической устойчивости эфиратов полихлоралюминатов лития установлено, что термические кривые имеют сложный характер разложения, отличный от составляющих: АlСl3 и LiCl. Обнаружено, что частичная десольватация происходит при температуре 50-200°С, а разложение комплексов происходит ступенчато с предварительным плавлением.
Полученные экспериментальные данные по термической устойчивости эфиратов полихлоралюминатов лития позволяют предположить следующие схемы их распада:
I LiCl·AlCl3·2Et2O→LiCl·AlCl3+2Et2O↑
II LiCl·AlCl3→LiCl+AlCl3
Рентгенографические исследования исходных веществ АlСl3, LiCl и эфиратов полихлоралюминатов лития показывают, что наборы рефлексов отражения отличаются от составляющих. Исследование полученных соединений методом ИК-спектроскопии установило, что колебательные частоты эфиратов полихлоралюминатов лития отличны от спектров составляющих хлоридов лития и алюминия. Так, в ИК-спектре эфиратов полихлоралюминатов лития встречается полоса с частотой 400 см-1, которая характерна для иона 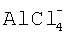 . Следует также отметить, что имеются сдвиги полос, отвечающих за валентные колебания связи С-О-С.
. Следует также отметить, что имеются сдвиги полос, отвечающих за валентные колебания связи С-О-С.
Эфираты полихлоралюминатов лития брутто-формулы LiCl·nAlCl3·2Et2O, где n=1, 2, нашли применение в качестве реагентов для очистки нефти и природного газа от серы и меркаптанов. Например,
LiCl·AlCl3·2Et2O+4,5H2S=LiCl·AlCl3·2H2S+2Et2O↑
LiCl·AlCl3·2Et2O+2RSH=LiCl·AlCl3·2RSH+2Et2O↑
Реакцию проводят при температуре 25±5°С при мольном соотношении реагентов (LiCl·nAlCl3·nEt2O):nH2S (nRSH)=l:n, в котором n=1, 2; R - углеводородный радикал.
В таблице 3 приведены условия протекания взаимодействия комплексных соединений с молекулами сероводорода и меркаптанов на примере метил-, этил- и пропилмеркаптанов. Так, например, использование в качестве реагента эфирата полихлоралюмината лития LiCl·AlCl3·2Et2O при вышеназванных условиях обеспечивает связывание сероводорода до 86,1%, метил-, этил- и пропилмеркаптанов до 80,0%; 76,7% и 72,5% соответственно.
Для очистки газов от серосодержащих примесей используют фильтры, содержащие в себе гранулы, состоящие из мелкодисперсных комплексных соединений на субстрате (оксидах металлов d-элементов). Поверхность гранулы реагента эффективно сорбирует из потока газа серосодержащие соединения. Газы, не содержащие в своем составе серы, на поверхности гранул не задерживаются и с комплексным соединением не реагируют. Сероводород и меркаптаны, проходя через фильтр, в процессе комплексообразования активно конкурируют с кислородсодержащими соединениями, вытесняя их из комплексного соединения.
Важным направлением очистного действия комплексными соединениями алюминия заключается в связывании или переработке сернистых соединений дистиллата. Так, сероводород, почти всегда присутствующий в крекинг-дистиллате, реагирует с соединениями алюминия с образованием соответствующих комплексных соединений. Очистка нефтяных дистиллатов необходима перед проведением каталитических процессов дегидрирования и парциального окисления, ибо сера и ее соединения являются одними из самых сильных ядов, отравляющих поверхность катализаторов.
Кроме того, при наличии небольших количеств воды в дистиллате и даже в водных растворах полихлоралюминаты лития в среде диэтилового эфира будут давать также комплексные соединения типа аквакислот, способных диссоциировать с выделением иона водорода, например,
LiCl·AlCl3·2Et2O+2H2O↔[AlCl3OH]H+[LiClOH]H+2Et2O.
Эти аквакислоты имеют сильные кислотные свойства, но при разбавлении водой разрушаются. Зато в концентрированных водных растворах, а также в твердом виде с содержанием небольших количеств влаги эти аквакислоты реагируют, подобно минеральной кислоте, например серной, обладая к тому же рядом преимуществ перед ней. Так, известную в литературе очистку дистиллата серной кислотой во избежание разрушения отдельных ценных частей дистиллата приходится вести при низких температурах. Очистку же комплексными соединениями алюминия можно проводить при повышенных температурах, усиливая тем самым ее эффективность.
Эфираты полихлоралюминатов лития используют в качестве катализаторов в процессах хлорметилирования и алкилирования ароматических углеводородов. Так, непредельные углеводороды, входящие в состав нефти, легко конденсируются с бензолом и его гомологами в присутствии полихлоралюминатов лития в среде диэтилового эфира, при этом образуются гомологи бензола предельного характера, например, с амиленом - амилбензол:
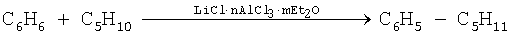
В таблице 4 приведены условия протекания данной реакции. Так, например, использование 5%-ного содержания эфирата полихлоралюмината лития, взятого от массы бензола, приводит к образованию хлористого бензила с выходом 80%. Увеличение его содержания до 10% и более приводит к повышению выхода продукта до 90%. Таким образом, наиболее оптимальным количеством используемого катализатора является его 10%-ное содержание, взятое от массы бензола.
При взаимодействии бензола с муравьиным альдегидом в присутствии соляной кислоты и использовании в качестве катализатора эфиратов полихлоралюминатов лития получают хлористый бензил:
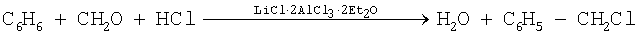
Реакцию проводят при 60°С, пропуская хлористый водород через смесь бензола, параформальдегида и эфиратов полихлоралюминатов лития до прекращения абсорбции газов. В таблице 5 приведены условия проведения реакции. Согласно полученным данным наиболее оптимальным количеством данного катализатора является его 10%-ное содержание, взятое от массы бензола, которое приводит к образованию хлорбензила с выходом 88%.
Значение этой реакций велико, особенно если учитывать особенность легкого превращения группы -CH2Cl в другие, например в группы -СН3, -CH2CN, -CHO, -CH2NH2, -CH2OH.
Кроме того, эфираты полихлоралюминатов лития используют как исходные вещества для получения гидридных соединений металлов, например:
LiCl·AlCl3·2Et2O+4NaAlH4→LiAlH4+4AlH3+4NaCl+2Et2O↑
Реакцию проводят при температуре 25°С в среде диэтилового эфира при соотношении реагентов (LiCl·AlCl2·2Et2O):LiAlH4=1:4, а в случае LiCl·2AlCl2·2Et2O - 1:7.
В таблице 6 приведены условия проведения данной реакции. Согласно полученным данным при использовании в качестве реагентов эфиратов полихлоралюминатов лития LiCl·AlCl2·2Et2O и LiCl·2AlCl2·2Et2O выход гидрида алюминия составляет 84 и 89% соответственно.
Таким образом, по совокупности физико-химических свойств полученные соединения - полихлоралюминаты лития - являются новыми соединениями.
Получение полихлоралюминатов лития в среде диэтилового эфира, Et2O=(C2H5)2O (V=200 мл, τ=60-140 мин)
Условия взаимодействия эфиратов полихлоралюминатов щелочноземельных металлов с серосодержащими соединениями
Условия получения амилбензола с участием эфиратов полихлоралюминатов лития (V=200 мл, τ=60-140 мин)
Условия получения хлористого бензила с участием эфиратов полихлоралюминатов лития (V=200 мл, τ=60-140 мин)
Условия получения гидридов металлов с участием полихлоралюминатов лития в среде диэтилового эфира, Et2O=(C2H5)2O (V=200 мл, τ=60-140 мин)
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИХЛОРЦИНКАТ ЛИТИЯ | 2008 |
|
RU2395453C2 |
| ПОЛИХЛОРЦИНКАТЫ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ | 2008 |
|
RU2395458C2 |
| КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ МОНОЦИКЛОПЕНТАДИЕНИЛА С ПЕРЕХОДНЫМИ МЕТАЛЛАМИ, СПОСОБ ИХ ПОЛУЧЕНИЯ И КАТАЛИТИЧЕСКАЯ СИСТЕМА ДЛЯ ПОЛУЧЕНИЯ ПОЛИОЛЕФИНОВ | 1990 |
|
RU2067981C1 |
| КАТАЛИТИЧЕСКАЯ СИСТЕМА В ПРОЦЕССЕ ТЕРМОЛИЗА ТЯЖЕЛОГО НЕФТЯНОГО СЫРЬЯ И ОТХОДОВ ДОБЫЧИ И ПЕРЕРАБОТКИ НЕФТИ | 2013 |
|
RU2524211C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-МЕТОКСИКАРБОНИЛ-1,3-ДИТИАНА, ОБЛАДАЮЩЕГО ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2536205C2 |
| Способ получения гелевой структурированной системы для хранения и транспортировки диэтилового эфира | 2017 |
|
RU2637804C1 |
| СПОСОБ ПОЛУЧЕНИЯ КРИСТАЛЛИЧЕСКОГО ЛИТИЙАЛЮМИНИЙГИДРИДА В СРЕДЕ Н-ДИБУТИЛОВОГО ЭФИРА | 2018 |
|
RU2680491C1 |
| СПОСОБ ГОМО- ИЛИ СОПОЛИМЕРИЗАЦИИ СОПРЯЖЕННЫХ ОЛЕФИНОВ | 2004 |
|
RU2348653C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(5-БЕНЗОИЛ-1,3-ДИТИАН-5-ИЛ)-1-ЭТАНОНА | 2007 |
|
RU2368607C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-ИЗОБОРНИЛАНИЛИНА | 2022 |
|
RU2785185C1 |
Изобретение может быть использовано в химической промышленности. Полихлоралюминаты лития получены взаимодействием хлорида лития с хлоридом алюминия в среде диэтилового эфира и соответствуют общей химической формуле LiCl·nAlCl3·2Et2O, где n=1, 2. Указанные химические соединения пригодны для использования в качестве реагентов для очистки нефтепродуктов и природного газа от меркаптанов и сероводорода, катализаторов в процессах хлорметилирования и алкилирования ароматических углеводородов, исходных веществ при получении гидридов металлов. 6 табл.
Полихлоралюминаты лития в среде диэтилового эфира общей формулы LiCl·nAlCl3·2Et2O, где n=1, 2,
полученные взаимодействием хлорида лития с хлоридом алюминия в среде диэтилового эфира, в качестве реагентов для очистки нефтепродуктов и природного газа от сероводорода, катализаторов в процессах хлорметилирования и алкилирования ароматических углеводородов, исходных веществ при получении гидридов металлов.
| HVISTENDAHL J | |||
| et al., Infrared Emission Spectra of Alkali Chloroaluminates and Related Melts, Inorganic Chemistry, 1984, vol | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| EINARSRUD M.A, ERLING R., Infrared reflection spectra of AlCl-MCl (М=Mg, Ca, Sr, Ba, Mn and Zn) and oxochloroaluminate melts, Proceeding-Electrochemical Society, Proc | |||
| Jt | |||
| Int. | |||
Авторы
Даты
2010-07-27—Публикация
2008-08-07—Подача