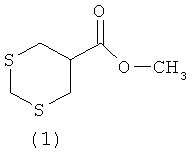
Предлагаемое изобретение относится к области органической химии, в частности к способу получения 5-метоксикарбонил-1,3-дитиана общей формулы (1), обладающего фунгицидной активностью
Известен четырехстадийный способ (Е. Juaristi, L. Valle, В.А. Valenzuela and М.А. Aguilar. S-C-P Anomeric Interactions. 4. Conformational Analysis of 2-(Diphenylphosphinoyl)-1,3-ditiane. J. Am. Chem. Soc, 1986, p.2000-2005) получения производных 1,3-дитиана, в частности 5-метил-1,3-дитиана (5), взаимодействием диэтилового эфира 2-метилмалоновой кислоты (2) с алюмогидридом лития в присутствии диэтилового эфира, затем с p-TsCl в пиридине с образованием тозилата 3-метилпропан-1,3-диола (3), который под действием калиевой соли ацетилмеркаптана в этаноле и этилендиамине превращается в 3-метилпропан-1,3-дитиол (4). На последней стадии соединение (4) под действием диметилацеталь формаля и эфирата трехфтористого бора образует 5-метил-1,3-дитиан (5) по схеме
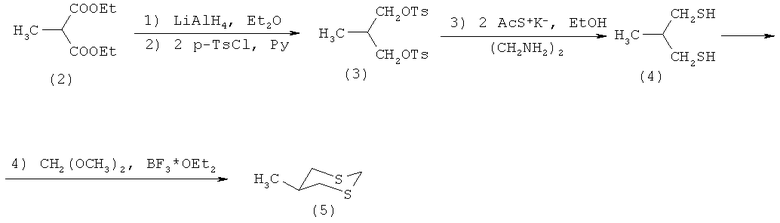
Известный способ не позволяет получать 5-метоксикарбонил-1,3-дитиан (1).
Известен четырехстадийный способ (Е. Yuaristt, J. Tarta and R. Mendes. Study of anomeric effect in 2-substituted 1,3-dithianes. Tetrahedron, 1986, vol.24, №5, p.1253-1264) получения 4,6-диметил-1,3-дитиана (8) взаимодействием ацетилацетона (6) с гидроборатом натрия, затем с p-TsCl в пиридине с образованием тозилата пентан-2,4-диола (7), который под действием калиевой соли ацетилмеркаптана в этаноле и этилендиамине превращается в дитиол, а затем под действием диметилацеталь формаля и эфирата трехфтористого бора образуется 4,6-диметил-1,3-дитиан (8) по схеме
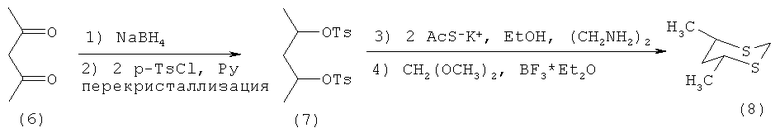
Известным способом не может быть получен 5-метоксикарбонил-1,3-дитиан (1).
Таким образом, в литературе отсутствуют сведения по получению 5-метоксикарбонил-1,3-дитиана формулы (1).
Предлагается однореакторный способ получения 5-метоксикарбонил-1,3-дитиана формулы (1), обладающего фунгицидной активностью.
Сущность способа заключается в предварительном насыщении водного раствора формальдегида (37%) сероводородом (H2S) при температуре 0°С с последующим добавлением диметилового эфира малоновой кислоты (ДМЭМК) и катализатора СоСl2, взятыми в мольном соотношении СН2O:H2S:ДМЭМК:СоСl2=3:2:1:(0,03-0,07), предпочтительно 3:2:1:0,05. Смесь перемешивают при атмосферном давлении и комнатной температуре (~20°С) в течение 4-6 ч, предпочтительно 5 ч. Выделяют 5-метоксикарбонил-1,3-дитиан общей формулы (1) с выходом 76-85%. Реакция протекает по схеме
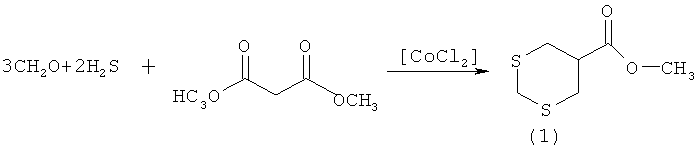
5-Метоксикарбонил-1,3-дитиан формулы (1) образуется только лишь с участием формальдегида, сероводорода и диметилового эфира малоновой кислоты, взятыми в стехиометрическом соотношении 3:2:1. При другом соотношении исходных реагентов снижается селективность реакции. В присутствии других альдегидов (например, алкил-, арилзамещенные альдегиды), других диметиловых эфиров α,ω-дикарбоновых кислот (например, эфиры щавелевой, адипиновой кислоты) целевой продукт (1) не образуется. Без катализатора не наблюдается образование целевого продукта (1).
Проведение указанной реакции в присутствии катализатора СоСl2 больше 7 мол.% не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора СоСl2 менее 3 мол.% снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакцию проводили при комнатной температуре (~20°С). При температуре выше 20°С (например, 60°С) снижается селективность реакции и увеличиваются энергозатраты, а при температуре ниже 20°С (например, -10°С) снижается скорость реакции.
Существенные отличия предлагаемого способа.
В предлагаемом однореакторном способе в качестве исходных соединений используется диметиловый эфир малоновой кислоты, формальдегид и сероводород. В известном четырехстадийном способе в качестве исходных реагентов при получении 5-метил-1,3-дитиана (5) из диэтилового эфира 2-метилмалоновой кислоты (2) применяют алюмогидрид лития, диэтиловый эфир, p-TsCl, пиридин, калиевую соль ацетилмеркаптана, этанол, этилендиамин, диметилацеталь формаля, эфират трехфтористого бора. При получении 4,6-диметил-1,3-дитиана (8) из ацетилацетона (6) в реакцию вовлекают вышеуказанные исходные реагенты, применяемые в синтезе 5-метил-1,3-дитиана (5), однако вместо алюмогидрида лития используют гидроборат натрия.
Способ поясняется следующими примерами.
Пример 1. В стеклянный реактор, снабженный механической мешалкой, газоподводящей трубкой и капельной воронкой, при температуре 0°С помещают 30 ммоль формальдегида (37% водный раствор), насыщают сероводородом (20 ммоль) в течение 20 минут, добавляют 10 ммоль диметилового эфира малоновой кислоты и 0.5 ммоль СоСl2, перемешивают при комнатной температуре (~20°С) в течение 5 часов, экстрагируют этилацетатом, выделяют 5-метоксикарбонил-1,3-дитиан (1) с выходом 81%.
Другие примеры, подтверждающие способ, приведены в таблице 1.
Все опыты проводили при комнатной температуре (~20°С) и атмосферном давлении.
Спектральные характеристики 5-метоксикарбонил-1,3-дитиана (1).
ИК-спектр (ν, см-1): 686-721 (C-S), 1024 (С-О), 1439 (СН2-), 1739 (С=O).
Спектр ЯМР 1Н (δ, м.д., J, Гц): 3.32-3.35 (м, 4Н, СН2 (4,6)); 3.67 (с, 3Н, СН3 (10)); 3.68 (с, 2Н, СН2(2)); 3.89-3.91 (м, Н, СН(5)).
Спектр ЯМР 13С (δ, м.д.): 32.22 (С-2); 40.98 (С-5); 52.88 (С-4,6); 64.43 (С-10); 167.68 (С-7).
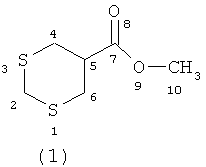
Масс-спектр, m/z (Iотн, (%)): 179 [М+Н]+ (3); 178 [М]+ (20); 145 [M-SH]+ (39); 132 [M-CH2S]+ (21); 119 [М-СООСН3]+ (21); 118 [M-CH2SCH2]+ (43); 113 (22); 101 [M-SCHS]+ (43); 87 [СН2СН2СООСН3]+ (100); 86 [СН2СНСООСН3]+ (78); 69 (35); 59 [СООСН3]+ (83); 55 (92). Найдено (%): С, 39.35; Н, 6.04; S, 35.19. C6H10O2S2. Вычислено (%): С, 40.43; Н, 5.65; S, 35.96.
Оценку фунгицидной активности проводили методом диффузии в агар (Н.С.Егорова. Практикум по микробиологии. М.: МГУ, 1976, 307 с.). Поверхность питательных сред КГА (картофельно-глюкозный агар), среда Чапека, разлитых по 20-25 мл в стандартные чашки Петри d 90 мм, засевали суспензией спор тест-культур грибов. Затем в среде сверлом диаметром 10 мм вырезали 3 лунки, в которые помещали по 100 мкл испытываемых растворов. Фунгицидную активность оценивали по диаметру зоны подавления роста микромицетов, а также наблюдая за развитием тест-культур с использованием светового микроскопа «Amplival» (Carl Zeiss, JENA). Контролем служило развитие грибов на питательной среде. Время инкубации 7 суток при 28°С.
В качестве тест-культур были использованы Bipolaris sorokiniana, Fusarium oxysporum и Aspergillus niger, которые вызывают различные заболевания сельскохозяйственных растений, в том числе и корневые гнили зерновых культур (В.И.Билай. Микроорганизмы - возбудители болезней растений. Киев: Наукова думка, 1988, 552 с.). Aspergillus niger является распространенным контаминантом различных материалов, способен вызывать аллергические реакции и микозы у людей с ослабленной иммунной системой (Д.Саттон, А.Фотергилл, М. Ринальди. Определитель патогенных и условно патогенных грибов. М.: Мир, 2001, 486 с.). Микроскопические грибы поддерживаются в коллекции микроорганизмов Института биологии УНЦ РАН. Результаты оценки фунгицидной активности соединения (1) приведены в таблице 2.
Соединение 5-метоксикарбонил-1,3-дитиан (1) полностью подавляет развитие Bipolaris sorokiniana. Минимальная ингибирующая концентрация - 0.01. В то же время 5-метоксикарбонил-1,3-дитиан (1) обладает слабым фунгистатическим (задерживающим развитие) действием по отношению к Fusarium oxysporum, не влияет на рост и развитие Aspergillus niger.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-КООРДИНИРОВАННЫЙ МЕТИЛИОДИДОМ 3,7-ДИТИА-1,5-ДИАЗАБИЦИКЛО[3.3.0]ОКТАН - ВОДОРАСТВОРИМОЕ СРЕДСТВО С ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2442329C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3,3-ДИ(МЕТОКСИКАРБОНИЛ)-1,5-ДИТИАЦИКЛОАЛКАНОВ | 2012 |
|
RU2529503C2 |
| СРЕДСТВО ДЛЯ БОРЬБЫ С ГРИБКОВЫМИ ЗАБОЛЕВАНИЯМИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР | 2011 |
|
RU2483539C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3,3'-БИ-1,5,3-ДИТИАЗЕПИНАНА И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ СРЕДСТВА С ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2448107C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3,7-ДИТИА-1,5-ДИАЗАБИЦИКЛО[3.3.1]НОНАНА, ОБЛАДАЮЩЕГО ФУНГИЦИДНЫМИ СВОЙСТВАМИ | 2011 |
|
RU2489438C2 |
| 3,7-ДИТИА-1,5-ДИАЗАБИЦИКЛО[3.3.0]ОКТАН - СРЕДСТВО С ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2448971C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1,6-БИС-(1,5,3-ДИТИАЗЕПАН-3-ИЛ)-2,5-ДИСУЛЬФАНИЛГЕКСАНА, ОБЛАДАЮЩЕГО ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2547266C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3,3'-(3,6-ДИОКСАОКТАН-1,8-ДИИЛ)БИС-1,5,3-ДИТИАЗЕПИНАНА И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ СРЕДСТВА С ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2547267C2 |
| СПОСОБ ПОЛУЧЕНИЯ N, N'-БИС-(2-ГИДРОКСИЭТИЛ)ТЕТРАТИАДИАЗАЦИКЛОАЛКАНОВ, ПРОЯВЛЯЮЩИХ ФУНГИЦИДНУЮ АКТИВНОСТЬ | 2013 |
|
RU2541793C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(5-БЕНЗОИЛ-1,3-ДИТИАН-5-ИЛ)-1-ЭТАНОНА | 2007 |
|
RU2368607C2 |
Изобретение относится к области органической химии, в частности к способу получения 5-метоксикарбонил-1,3-дитиана формулы (1), заключающемуся в том, что насыщенный сероводородом водный раствор формальдегида (37%) подвергают взаимодействию с диметиловым эфиром малоновой кислоты в присутствии катализатора СоСl2 при мольном соотношении формальдегид:сероводород:диметиловый эфир малоновой кислоты:СоСl2, равном 3:2:1:(0,03-0,07), при комнатной температуре (~20°С) и атмосферном давлении в течение 4-6 ч. Также изобретение относится к применению 5-метоксикарбонил-1,3-дитиана в качестве фунгицида по отношению к Bipolaris sorokiniana. Технический результат: получено новое соединение, обладающее фунгицидной активностью. 2 н.п. ф-лы, 2 табл., 1 пр.

1. Способ получения 5-метоксикарбонил-1,3-дитиана общей формулы (1), обладающего фунгицидной активностью,

отличающийся тем, что насыщенный сероводородом водный раствор формальдегида (37%) подвергают взаимодействию с диметиловым эфиром малоновой кислоты в присутствии катализатора СоСl2 при мольном соотношении формальдегид:сероводород:диметиловый эфир малоновой кислоты:СоСl2, равном 3:2:1:(0,03-0,07), при комнатной температуре (~20°С) и атмосферном давлении в течение 4-6 ч.
2. Применение 5-метоксикарбонил-1,3-дитиана в качестве фунгицида по отношению к Bipolaris sorokiniana.
| WO 1992011254 A1, 09.07.01992 | |||
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2000 |
|
RU2221792C2 |
| Способ получения 1,3-дитиациклоалканов | 1976 |
|
SU586174A1 |
Авторы
Даты
2014-12-20—Публикация
2012-09-27—Подача