Изобретение касается указанных в формуле изобретения пунктов, а именно [F-18] меченной L-глютаминовой кислоты и [F-18] меченного L-глютамина общей формулы I, их производных, а также их применения и способа их получения.
Ранний диагноз злокачественных опухолевых заболеваний играет очень важную роль для прогноза выживания онкологического больного. При этом диагнозе неинвазивные, позволяющие получить изображение диагностические методы являются важным вспомогательным средством. Для этой цели в последние годы оказалась особенно полезной прежде всего технология ПЭТ (позитрон-эмиссионная томография). Чувствительность и специфичность технологии ПЭТ зависит существенным образом от используемой дающей сигнал субстанции (радиоактивного индикатора) и ее распределения в организме. При поиске подходящих радиоактивных индикаторов пытаются использовать определенные свойства опухолей, отличающих опухолевую ткань от здоровых близлежащих тканей. Предпочитают использовать коммерчески доступный изотоп 18F, который применяется для ПЭТ. Из-за его короткого периода полураспада, составляющего менее 2 часов, 18F ставит особые требования к получению подходящих радиоактивных индикаторов. Дорогостоящие, длинные пути синтеза и очистки не возможны с этим изотопом, так как значительная часть радиоактивности изотопа уже затухнет, прежде чем радиоактивных индикатор сможет использоваться для диагностики. Поэтому часто не возможно применить стандартные пути синтеза, используемые для нерадиоактивного фторирования, по отношению к синтезу 18F-радиоактивных индикаторов. В дальнейшем высокая специфическая активность 18F (примерно 80 ГБк/нмоль) приводит к слишком низким количествам субстанции в [18F]-фториде для синтеза радиоактивного индикатора, что снова обуславливает чрезмерный избыток прекурсора и делает успех стратегии радиохимического синтеза, базирующийся на нерадиоактивной реакции фторирования, непредсказуемым.
ФДГ ([18F]2-фтордезоксиглюкоза)- ПЭТ - это широко применяемое и распространенное вспомогательное средство в диагностике и последующем клиническом наблюдении опухолевых заболеваний. Злокачественные опухоли конкурируют с организмом за обеспечение глюкозой для получения питательного вещества (Warburg О.Über den Stoffwechsel der Carcinomzelle. Biochem. Zeitschrift 1924; 152: 309-339; Kellof G. Progress and Promise of FDG-PET Imaging for Cancer Patient Management and Oncologic Drug Development. Clin Cancer Res. 2005; 11(8): 2785-2807). При этом у опухолевых клеток по сравнению с близлежащими клетками нормальной ткани обычно повышен метаболизм глюкозы. Это используется при применении фтордезоксиглюкозы (ФДГ), производного глюкозы, которое усиленно транспортируется в клетки, однако, накапливается в них метаболическим путем после фосфорилирования в виде ФДГ-6-фосфата ("эффект Варбурга"). Поэтому 18F-меченая ФДГ является эффективным радиоактивным индикатором для обнаружения опухолевых заболеваний у пациента посредством технологии ПЭТ. В поисках новых радиоактивных индикаторов для ПЭТ в последнее время также все больше применяются аминокислоты для 18F ПЭТ визуализации (например, обзор: Eur J Nucl Med Mol Imaging. 2002 May; 29 (5):681-90). При этом некоторые из 18F-меченых аминокислот подходят для измерения скорости синтеза белка, большинство других производных - для определения прямого поглощения клетками в опухоли. К наиболее известным 18F-меченым аминокислотам относятся, например, тирозин, фенилаланин, пролин, аспарагиновая кислота и синтетические аминокислоты (например, J. Nucl Med 1991; 32:1338-1346, J Nucl Med 1996; 37:320-325, J Nucl Med 2001:42:752-754 bzw. J Nucl Med 1999; 40:331-338.). Глютаминовая кислота и глютамин не известны в качестве 18F-меченых производных, тогда как нерадиоактивные фторированные производные глютамина и глютаминовой кислоты распространены; так, например, содержащие фтор в α-положении (например, (review): Amino Acids. (2003) Apr; 24(3):245-61) или в β-положении (например, Tetrahedron Lett.; 30; 14; 1989; 1799-1802, J. Org. Chem.; 54; 2; 1989; 498-500, Tetrahedron: Asymmetry; 12; 9; 2001; 1303-1312).
О производных глютаминовой кислоты, содержащих химически функциональные защитные группы и уходящие группы в β- или γ- положении, уже сообщалось в прошлом. Таким образом, сообщалось о глютамате как мезилате и соответственно бромиде в γ-положении, выполняющих функции кислоты и амина с помощью эфирной группы и соответственно Z-защитной группы (J. Chem. Soc. Perkin Trans. 1; 1986; 1323-1328) или, например, о γ-хлорглютаминовой кислоте без защитных групп (Synthesis; (1973); 44-46). О похожих производных, в которых, однако, группа бегства расположена в β-положении, также сообщалось неоднократно: например, Chem. Pharm. Bull.; 17; 5; (1969); 879-885, J. Gen. Chem. USSR (Engl. Transl.); 38; (1968); 1645-1648; Tetrahedron Lett.; 27; 19; (1986); 2143-2144, Chem. Pharm. Bull.; EN; 17; 5; 1969; 873-878, Patent FR 1461184, Patent JP 13142.)
Современные радиоактивные индикаторы для ПЭТ, применяемые для диагностики опухолей, имеют несколько неоспоримых недостатков: хотя ФДГ предпочитает накапливаться в клетках с повышенным метаболизмом глюкозы, однако, повышенный обмен глюкозы существует также при других патологических и физиологических состояниях в задействованных клетках и тканях, например очаги инфекции или заживление ран (обобщено в J. Nucl. Med. Technol. (2005), 33, 145-155). Часто все еще трудно решать задачу, имеет ли обнаруженное посредством ФДГ-ПЭТ поражение на самом деле опухолевое происхождение или его можно отнести на счет других физиологических или патологических состояний ткани. В целом постановка диагноза посредством ФДГ-ПЭТ в онкологии имеет чувствительность, составляющую 84%, и специфичность, равную 88% (Gambhir et al., «A tabulated summary of the FDG PET literature» J. Nucl. Med. 2001, 42, 1-93S). Например, опухоли головного мозга очень сложно выявлять из-за высокого накопления ФДГ в здоровой ткани головного мозга. Известные на данный момент 18F-меченые производные аминокислоты в нескольких случаях хорошо подходят для обнаружения опухолей в головном мозге (обзор: Eur J Nucl Med Mol Imaging. 2002 Мау; 29(5):681-90), однако, они не могут конкурировать при выявлении других опухолей с характеристиками визуализации "золотого стандарта" [18F] 2-ФДГ. Метаболическое накопление и удерживание F-18 меченных аминокислот в опухолевой ткани, как правило, ниже, чем для ФДГ. Исходя из этого доступность изомерно чистых F-18 меченных неароматических аминокислот максимально востребована с химической точки зрения.
Подобным образом как для глюкозы повышенный метаболизм в пролиферирующих опухолевых клетках описывался также для глютаминовой кислоты и глютамина (Medina, J Nutr. 1131:25398-25428, 2001; Souba, Ann Surg 218: 715-728, 1993). Повышенная скорость синтеза белков и нуклеиновых кислот, а также выработка энергии сами по себе являются причинами для усиленного потребления глютамина опухолевыми клетками. Синтез соответственно С-11 и С-14 меченных, идентичных природному веществу соединений уже описывался в литературе (например, Antoni, Enzyme Catalyzed Synthesis of L-[4-C-11]Aspartate and L-[5-C-11]Glutamate. J. Labelled Compd. Radiopharm. 44; (4) 2001: 287-294) и Buchanan, The biosynthesis of showdomycin: studies with stable isotopes and the determination of principal precursors. J. Chem. Soc. Chem. Commun.; EN; 22; 1984; 1515-1517). Первые ссылки с С-11 меченным соединением не указывают на какую-либо значительную аккумуляцию в опухоли.
Задание данного изобретения состоит в создании новых соединений, подходящих для [18F]-меченой формы для базирующейся на ПЭТ диагностике.
Задание решается путем предоставления согласно изобретению [18F]-меченой L-глютаминовой кислоты и [18F]-меченого L-глютамина, а также их производных согласно общей формулы (I), включая их диастереомеры и энантиомеры:
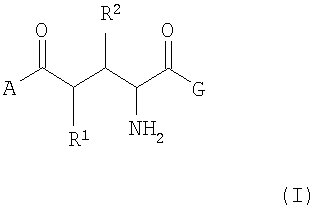
где А -
a) гидрокси,
b) разветвленная или неразветвленная С1-С5алкокси,
c) разветвленная или неразветвленная гидрокси C1-С5алкокси,
d) разветвленный или неразветвленный O-C1-С5 алкил-(O-С1-С4алкил)n-O-С1-С4алкил,
e) N(C1-С5алкил)2,
f) NH2,
g) N(H)-L,
h) O-L или
i) O-Z,
G -
a) гидроксил,
b) разветвленный или неразветвленный O-C1-С5алкил,
c) разветвленный или неразветвленный O-С2-С6алкенил,
d) разветвленный или неразветвленный O-C1-С5алкил-(O-С1-С4алкил)n-O-C1-C4 алкил или
e) разветвленный или неразветвленный O-С2-С6алкинил,
R1 и R2 -
a) водород,
b) 18F,
c) разветвленный или неразветвленный 18F C1-С5алкокси,
d) разветвленный или неразветвленный 18F-C1-С5алкил,
e) разветвленный или неразветвленный 18F-гидрокси-С1-С5алкил,
f) разветвленный или неразветвленный 18F-C2-С5алкенил или
g) разветвленный или неразветвленный 18F-C2-С5алкинил,
h) гидроксил,
i) разветвленный или неразветвленный C1-С5алкил или
j) разветвленный или неразветвленный C1-С5алкокси
при условии, что точно один из заместителей R1 или R2 содержит 18F изотоп и соответственно другой заместитель не содержит 18F изотопа,
L -
a) разветвленный или неразветвленный С1-С5алкил,
b) разветвленный или неразветвленный C2-С5алкенил,
c) разветвленный или неразветвленный C1-С5алкил-(O-С1-С4алкил)n-O-С1-С4алкил или
d) разветвленный или неразветвленный C2-С5алкинил,
и
Z является ионом металла,
причем n=0, 1, 2 или 3, и причем все возможные диастереомеры и энантиомеры являются частью предмета данного изобретения.
Предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что
А -
a) гидроксил
b) метокси,
c) этокси,
d) пропокси,
e) NMe2,
f) NEt2,
g) NH2,
h) N(H)-L или
i) O-L,
j) O-Z.
Следующие предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что
А -
a) гидроксил,
b) метокси,
c) этокси,
d) NMe2,
e) NH2 или
f) NHL.
Особенно предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что
А -
a) гидроксил,
b) метокси или
c) NH2.
Предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что
А является
ОН.
Предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что
А является
NH2.
Предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что
G -
a) гидроксил,
b) метокси,
c) этокси,
d) пропокси,
e) изо-пропокси или
f) O-C2H4-OMe.
Следующие предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что
G -
a) гидроксил,
b) метокси, или
c) этокси.
Особенно предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что
G -
a) гидроксил или
b) метокси.
Предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что
R1R2 -
a) водород,
b) 18F,
c) 18F-метокси,
d) 18F-этокси,
e) 18F-пропокси,
f) 18F-метил,
g) 18F-этил, или
h) 18F-пропил
при условии, что точно один из заместителей R1 или R2 точно содержит изотоп 18F, а второй соответственно является водородом.
Следующие предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что
R1 и R2 -
a) водород,
b) 18F,
c) 18F-метокси,
d) 18F-метил или
e) 18F-этил,
при условии, что точно один из заместителей R1 или R2 точно содержит изотоп 18F, а второй соответственно является водородом.
Особенно предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что
R1 и R2 -
a) водород,
b) 18F или
c) 18F-метил
при условии, что точно один из заместителей R1 или R2 точно содержит изотоп 18F, а второй соответственно является водородом.
Особенно предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что R1 выбирается из группы, состоящей из ОН, СН3, С2Н5, и С3Н7, а R2 является 18F.
Особенно предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что R2 выбирается из группы, состоящей из ОН, СН3, С2Н5, С3Н7, а R1 является 18F.
Особенно предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что R1 является Н, а R2 является 18F.
Особенно предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что R1 является 18F, а R2 является Н.
Предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что
L -
a) метил,
b) этил,
c) пропил,
d) изо-пропил,
e) -С2Н4-ОМе или О-С2Н4-O-С2Н4-ОМе.
Особенно предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что
L -
a) метил или
b) этил.
Также предпочитаемые соединения согласно формуле (I), соответствующие данному изобретению, отличаются тем, что
Z является ионом щелочного и щелочноземельного металла.
Все возможные диастереомеры и энантиомеры предпочитаемых соединений формулы (I) являются частью предмета данного изобретения.
В дальнейшем особое предпочтение отдается каждому отдельному соединению из следующей группы, причем все возможные диастереомеры и энантиомеры являются частью предмета данного изобретения:
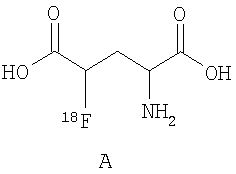
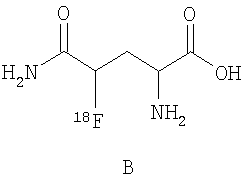
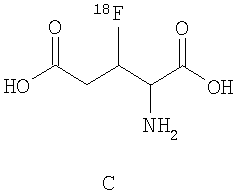
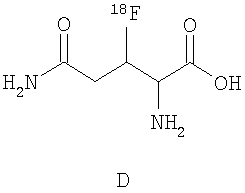
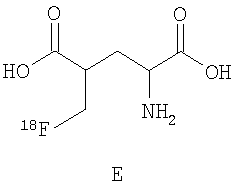
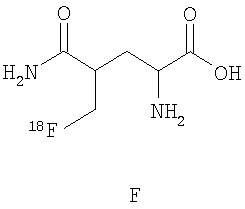 .
.
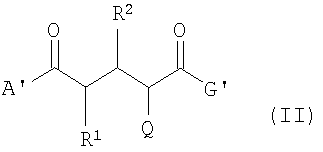
Способ получения соединений общей формулы (I) согласно изобретению отличается тем, что соединение по формуле (I) образуется из предшествующего соединения по формуле (II) после введения 18F изотопа. Таким образом, во втором аспекте данное изобретение касается соединений формулы (II):
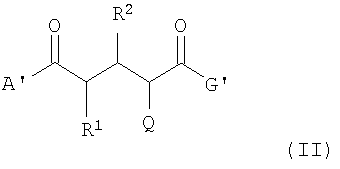
где А' -
а) гидрокси,
b) разветвленный или неразветвленный C1-С5алкокси,
c) разветвленный или неразветвленный гидрокси C1-С5алкокси,
d) разветвленный или неразветвленный О-С1-С5алкил-(O-С1-С4алкил)n-O-C1-С4алкил,
e) N(С1-С5алкил)2,
f) NH2,
g) N(H)-U,
h) N(Н)-L', или
i) O-L',
G -
a) гидроксил,
b) O-Z',
c) разветвленный или неразветвленный O-C1-С5алкил,
d) разветвленный или неразветвленный O-С2-С5алкенил,
e) разветвленный или неразветвленный О-С1-С5алкил-(O-С1-С4алкил)n-O-С1-С4алкил или
f) разветвленный или неразветвленный O-C2-С5алкинил.
R1 и R2 -
a) водород,
b) 18F,
c) разветвленный или неразветвленный 18F C1-С5алкокси,
d) разветвленный или неразветвленный 18F-C1-С5алкил,
e) разветвленный или неразветвленный 18F-C1-С5гидрокси-алкил,
f) разветвленный или неразветвленный 18F-С2-С5алкенил, или
g) разветвленный или неразветвленный 18F-C2-С5алкинил,
h) гидрокси,
i) разветвленный или неразветвленный C1-С5алкил, или
j) разветвленный или неразветвленный C1-С5алкокси
при условии, что один из заместителей R1 или R2 точно содержит 18F изотоп, и соответственно второй заместитель не содержит 18F изотоп.
Q -
a) N(Н)-трет-бутоксикарбонил,
b) N(Н)-аллилоксикарбонил,
c) N(Н)-бензилоксикарбонил,
d) N(Н)-этоксикарбонил,
e) N(Н)-метоксикарбонил,
f) N(Н)-пропоксикарбонил,
e) N(Н)-2,2,2-трихлорэтоксикарбонил,
f) N(Н)-1,1-диметилпропинил,
g) N(H)-1-метил-1-фенил-этоксикарбонил,
h) N(H)-1-метил-1-(4-бифенилил)-этоксикарбонил,
i) N(Н)-циклобутилкарбонил,
j) N(Н)-1-метилциклобутилкарбонил,
k) N(Н)-винилкарбонил,
l) N(Н)-аллилкарбонил,
m) N(Н)-адамантилкарбонил,
n) N(Н)-дифенилметилкарбонил,
о) N(Н)-циннамилкарбонил,
р) N(Н)-формил,
q) N(Н)-бензоил,
r) N(Н)-тритил,
s) N(Н)-п-метоксифенил-дифенилметил,
t) N(Н)-ди-(п-метоксифенил)-фенилметил или
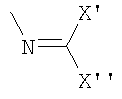
u)
v) N-(трет-бутоксикарбонил)2.
L' -
a) разветвленный или неразветвленный C1-С5алкил,
b) разветвленный или неразветвленный C2-С5алкенил,
c) разветвленный или неразветвленный C1-С5алкил-(O-С1-С4алкил)n-O-С1-С4 алкил или
d) разветвленный или неразветвленный С2-С5алкинил.
U -
a) трет-бутоксикарбонил,
b) аллилоксикарбонил,
c) бензилоксикарбонил,
d) метоксикарбонил,
e) пропоксикарбонил или
d) этокси карбонил.
Х и X' независимо друг от друга являются
a) разветвленным или неразветвленным C1-С5алкилом,
b) замещенным или незамещенным арилом
c) арилалкилом или
d) гетероарилом
и
Z' является катионом металла,
причем n=0, 1, 2 или 3 и все возможные диастереомеры и энантиомеры являются частью предмета данного изобретения.
Предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
А' -
a) гидроксил,
b) метокси,
c) этокси,
d) трет-бутокси,
e) NMe2,
f) NEt2
g) NH2,
h) N(H)-U,
i) N(H)-L' или
J) O-L'.
Следующие предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
А' -
a) гидроксил,
b) метокси,
c) этокси,
d) NMe2,
e) N(H)-U
f) NH2 или
g) N(H)-L'.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
А' -
a) гидроксил,
b) этокси,
b) метокси,
c) N(H)-U или
d) NH2.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
А' -
a) ОН,
b) разветвленный или неразветвленный C1-С5алкокси,
c) -NH-трет-бутоксикарбонил или
d) NH2.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что А' является этокси.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
А' является NH2.
Предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
G'
a) гидроксил,
b) OZ'
c) метокси,
d) этокси,
e) трет-бутокси,
f) изо-пропокси или
g) O-С2Н4-ОМе.
Следующие предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
G' -
a) гидроксил,
b) OZ',
c) метокси или
d) этокси.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
G' -
a) гидроксил
b) OZ'
c) метокси.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
G' является этокси.
Предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
R1 и R2 -
a) водород,
b) 18F,
c) 18F-метокси,
d) 18F-этокси,
e) 18F-пропокси,
f) 18F-метил,
g) 18F-этил или
h) 18F-пропил
при условии, что один из заместителей R1 или R2 точно содержит 18F-изотоп, а второй заместитель является соответственно водородом.
Следующие предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
R1R2 -
a) водород,
b) 18F,
c) 18F-метокси,
d) 18F-метил или
e) 18F-этил
при условии, что один из заместителей R1 или R2 точно содержит 18F-изотоп, а второй заместитель является соответственно водородом.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
R1 и R2 -
a) водород,
b) 18F или
c) 18F-метил
при условии, что один из заместителей R1 или R2 точно содержит 18F-изотоп, а второй заместитель является соответственно водородом.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что R1 выбирается из группы, состоящей из ОН, СН3, С2Н5 и С3Н7, а R2 является 18F.
Особенно предпочитаемые связи соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что R2 выбирается из группы, состоящей из ОН, СН3, C2H5 и С3Н7, а R1 является 18F.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что R1 является Н, а R2 - 18F.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что R1 является 18F, а R2 - Н.
Предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
Q -
a) N(Н)-трет-бутоксикарбонил,
b) N(Н)-бензилоксикарбонил,
c) N-(трет-бутоксикарбонил)2 или
d) 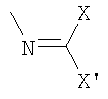 .
.
Следующие предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
Q -
a) N(Н)-трет-бутоксикарбонил,
b) N(Н)-бензилоксикарбонил,
c) N-(трет-бутоксикарбонил)2 или
d) 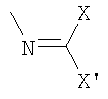 .
.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
Q -
a) N(Н)-бутоксикарбонил или
b) 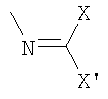 .
.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что Q является N(Н)-трет-бутоксикарбонилом.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что Q - это
 .
.
Предпочитаемые соединения согласно формуле (II), соответствующие данному
изобретению, отличаются тем, что
L' -
a) метил,
b) этил,
c) пропил,
d) изо-пропил,
e) -C2H4-OMe или
f) -C2H4-O-C2H4-OMe.
Следующие предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
L' -
a) метил или
b) этил.
Предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
U -
a) трет-бутоксикарбонил,
b) аллилоксикарбонил или
c) этоксикарбонил.
Следующие предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
U -
a) трет-бутоксикарбонил или
b) этоксикарбонил.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что U является трет-бутоксикарбонилом.
Предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
Х и X' независимо друг от друга являются
a) разветвленным или неразветвленным С1-С5алкилом,
b) замещенным или незамещенным арилом или
c) алкиларилом.
Следующие предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что Х и X' независимо друг от друга являются
a) разветвленным или неразветвленным C1-С5алкилом или
b) арилом.
Особенно предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что
Х и X' являются фенилом и соответственно замещенным во 2 положении фенилом.
Предпочитаемые соединения согласно формуле (II), соответствующие данному изобретению, отличаются тем, что Z' является ионом Ni2+.
Причем все возможные диастереомеры и энантиомеры предпочитаемых соединений согласно формуле (II), описанных в данном изобретении, являются частью предмета данного изобретения.
В дальнейшем особое предпочтение отдается каждому отдельному соединению из следующей группы, причем все возможные диастереомеры и энантиомеры являются частью предмета данного изобретения:
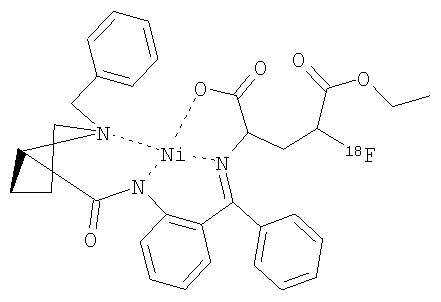
,
Способ получения соответствующих изобретению соединений общей формулы (II) отличается тем, что большинство соединений согласно формулы (II) может образовываться из предшествующего соединения согласно формулы (III) после введения 18F-изотопа.
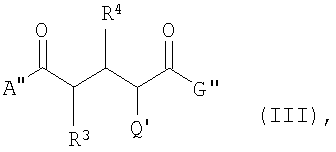
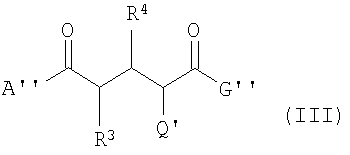
В еще одном аспекте данное изобретение касается соединений формулы (III):
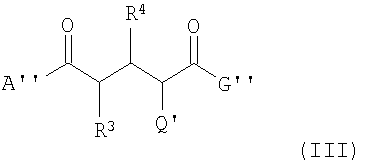
где А'' -
a) гидрокси,
b) разветвленный или неразветвленный С1-С5алкокси,
c) разветвленный или неразветвленный гидрокси С1-С5алкокси,
d) разветвленный или неразветвленный О-С1-С5 алкил-(O-С1-С4алкил)n-O-С1-С4 алкил,
е) N(C1-С5алкил)2,
f) NH2,
g) N(H)-U',
h) N(H)-L'' или
i) O-L''.
G'' -
a) гидроксил,
b) O-Z'',
c) разветвленный или неразветвленный O-C1-С5алкил,
d) разветвленный или неразветвленный O-С2-С5алкенил,
e) разветвленный или неразветвленный O-C1-С5алкил-(O-С1-С4алкил)n-O-C1-С4алкил,
f) разветвленный или неразветвленный O-C2-С5алкинил или
g) трифенилметокси
R3 и R4 -
a) водород,
b) разветвленный или неразветвленный Е-С1-С5алкокси,
c) разветвленный или неразветвленный Е-С1-С5алкил,
d) разветвленный или неразветвленный Е-С1-С5гидроксиалкил,
e) разветвленный или неразветвленный E-C2-С5алкенил,
f) разветвленный или неразветвленный E-C2-С5алкинил,
g) гидрокси,
h) разветвленный или неразветвленный C1-С5алкил или
i) разветвленный или неразветвленный С1-С5алкокси,
при условии, что один из заместителей R1 или R2 точно содержит Е, а второй заместитель соответственно не содержит Е,
Е -
a) хлоро,
b) бромо,
c) мезилокси,
d) трифтормезилокси,
e) нонафторбутилокси или
f) тозилокси,
Q' -
a) N(Н)-трет-бутоксикарбонил,
b) N(Н)-аллилоксикарбонил,
c) N(Н)-бензилоксикарбонил,
d) N(Н)-этоксикарбонил,
e) N(Н)-метоксикарбонил,
f) N(Н)-пропоксикарбонил,
e) N(Н)-2,2,2-трихлорэтоксикарбонил,
f) N(Н)-1,1-диметилпропинил,
g) N(H)-1-метил-1-фенил-этоксикарбонил,
h) N(H)-1-метил-1-(4-бифенилил)-этоксикарбонил,
i) N(Н)-циклобутилкарбонил,
j) N(Н)-1-метилциклобутилкарбонил,
k) N(Н)-винилкарбонил,
l) N(Н)-аллилкарбонил,
m) N(Н)-адамантилкарбонил,
n) N(Н)-дифенилметилкарбонил,
о) N(Н)-циннамилкарбонил,
р) N(Н)-формил,
q) N(Н)-бензоил,
r) N(Н)-тритил,
s) N(Н)-п-метоксифенил-дифенилметил,
t) N(Н)-ди-(п-метоксифенил)-фенилметил или
u) 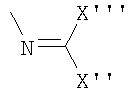
v) N-(трет-бутоксикарбонил)2,
L'' -
a) разветвленный или неразветвленный C1-С5алкил,
b) разветвленный или неразветвленный C2-С5алкенил,
c) разветвленный или неразветвленный C1-С5алкил-(O-С1-С4алкил)n-O-С1-С4алкил или
d) разветвленный или неразветвленный С2-С5алкинил,
U' -
a) трет-бутоксикарбонил,
b) аллилоксикарбонил,
c) бензилоксикарбонил или
d) этоксикарбонил,
X'' и X''' независимо друг от друга являются
a) разветвленным или неразветвленным C1-С5алкилом,
b) замещенным или незамещенным арилом,
c) алкиларилом или
d) гетероарилом, и
Z'' является катионом металла,
причем n=0, 1 или 2 и все возможные диастереомеры и энантиомеры являются частью предмета данного изобретения.
Предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
А'' -
a) гидроксил,
b) метокси,
c) этокси,
d) трет-бутокси,
e) NMe2,
f) NEt2
g) NH2,
h) N(H)-U'
i) N(H)-L'' или
j) O-L''.
Следующие предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
А'' -
a) гидроксил,
b) метокси,
c) этокси,
d) NMe2,
e) N(H)-U'
f) NH2 или
g) N(H)-L''.
Особенно предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
А'' -
а) гидроксил,
b) этокси,
b) метокси,
c) N(H)-U или
d) NH2.
Предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
G'' -
a) гидроксил,
b) OZ'',
c) метокси,
d) этокси,
e) трет-бутокси,
f) изо-пропокси или
g) O-C2H4-OMe.
Следующие предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
G'' -
a) гидроксил,
b) OZ'',
c) метокси или
d) этокси.
Особенно предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
G'' -
a) гидроксил,
b) OZ'',
c) метокси.
Предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
R3 и R4 -
a) водород,
b) Е-метокси,
c) Е-этокси,
d) Е-пропокси,
e) Е-метил,
f) Е-этил или
g) Е-пропил,
при условии, что один из заместителей R3 или R4 точно содержит Е, а второй заместитель соответственно является водородом.
Следующие предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
R3 и R4 -
a) водород,
b) Е-метокси,
c) Е-метил или
d) Е-этил,
при условии, что один из заместителей R3 или R4 точно содержит Е, а второй заместитель соответственно является водородом.
Особенно предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
R3 и R4 -
a) водород или
b) Е-метил
при условии, что один из заместителей R3 или R4 точно содержит Е, а второй заместитель соответственно является водородом.
Предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
Е -
a) хлоро,
b) бромо,
c) мезилокси,
d) трифтормезилокси или
e) тозилокси.
Следующие предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
Е -
a) хлоро,
b) бромо,
c) мезилокси,
d) трифтормезилокси или
e) тозилокси.
Особенно предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
Е -
a) бромо или
b) мезилокси.
Предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
Q' -
a) N(Н)-трет-бутоксикарбонил,
b) N(Н)-бензилоксикарбонил или
c)  .
.
Следующие предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
Q'-
a) N(Н)-трет-бутоксикарбонил или
b)
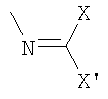 .
.
Предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
L'' -
a) метил,
b) этил,
c) пропил,
d) изо-пропил,
e) -C2H4-ОМе или
f) -C2H4-O-C2H4-OMe.
Следующие предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
L'' -
a) метил или
b) этил.
Предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
U' -
a) трет-бутоксикарбонил,
b) аллилоксикарбонил или
c) этоксикарбонил.
Следующие предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
U' -
a) трет-бутоксикарбонил или
b) бензилоксикарбонил.
Особенно предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
U' -
трет-бутоксикарбонил.
Предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
X'' и X''' независимо друг от друга являются
a) разветвленным или неразветвленным С1-С5алкилом,
b) замещенным или незамещенным арилом, или
c) алкиларилом.
Следующие предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что X'' и X''' независимо друг от друга являются
a) разветвленным или неразветвленным C1-С5алкилом, и
b) арилом.
Особенно предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
X'' и X''' являются фенилом и соответственно замещенным во 2 положении фенилом.
Предпочитаемые соединения согласно формуле (III), соответствующие изобретению, отличаются тем, что
Z'' является Ni2+.
Причем все возможные диастереомеры и энантиомеры предпочитаемых соединений согласно формуле (III) являются частью предмета данного изобретения.
Термин "Арил", применяемый в контексте данного изобретения самостоятельно или как часть другой группы, относится к ароматическим группам с одним или двумя циклами, которые могут содержать от 6 до 12 атомов углерода в кольце, как, например, фенил или нафтил, и какой-либо заместитель в положении 2.
Изобретение охватывает также комплекс Ni(II), содержащий основание Шиффа соединения согласно формулы (I) и соединения (S)-2-[N-(N-бензилпролил)амино]бензофенон, как таковой и способ получения соединения формулы (I).
Кроме того, изобретение охватывает также комплекс Ni(II), содержащий основание Шиффа соединения-предшественника соединения формулы (I) и соединения (S)-2-[N-(N-бензилпролил)амино]бензофенон, как таковой и способ получения соединения формулы (I).
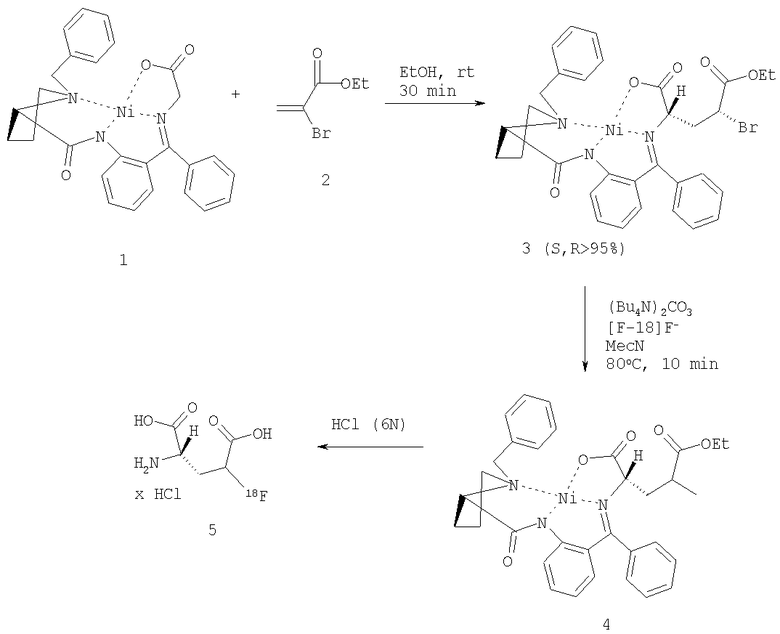
Соответствующие изобретению соединения, такие как, например, 4-фтор-L-глютаминовая кислота и 4-фтор-L-глютамин, можно получить, например, как представлено в схеме 1 путем асимметричного синтеза в присутствии металлического катализатора с помощью комплекса Ni(II) и глицина, содержащего основание Шиффа и (3)-2-[N-(N-бензилпролил)амино]бензофенон (ВРВ) (1)3, а также этиловый эфир этил-α-бромакриловой кислоты или α-бромакриламид (2):
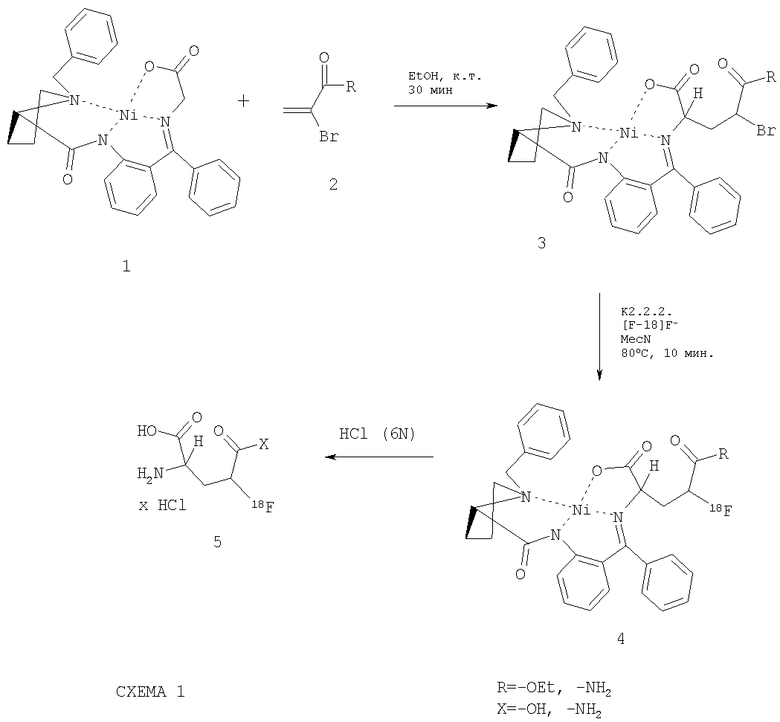
При этом связывание С-С может происходить как в протонном, так и в апротонном растворителе. Реакция может проводиться при мягких условиях, например при комнатной температуре или при нагревании.
При этом положительно влияет добавление основания. Для этой цели может использоваться, например, диизопропиламин, диизопропилэтиламин, триэтиламин или похожее основание. Реакционную смесь перемешивают подходящим способом в течение 1-3 ч и затем снова восстанавливают с помощью этил-α-бромоакрилата или α-бромакриламида. Реакцию можно контролировать посредством тонкослойной хроматографии. Для этого подходит система силикагель/уксусный эфир/хлороформ. После добавления этил-α-бромоакрилата или α-бромакриламида и минимум 1-часового перемешивания реакция практически заканчивается. Реакционную смесь нейтрализуют путем добавления органической или минеральной кислоты (или комбинации обеих кислот), таких, как например: уксусная кислота, муравьиная кислота, трифторуксусная кислота, трихлоруксусная кислота, пропионовая кислота, соляная кислота, серная кислота, перхлоратная кислота, фосфорная кислота и т.д. Комплекс Ni с этиловым эфиром 4-бромглютаминовой кислоты можно отделить от реакционной смеси путем экстракции. Для этого подходят, например, органические галогенированные или негалогенированные растворители, как например: хлороформ, метилен хлорид, диалкилэфир, уксусный эфир, алканы и т.д. После высушивания органической фазы с помощью сушильных агентов (например, сульфата натрия, сульфата кальция и т.п.) она упаривается в вакууме досуха.
Путем препаративной ТСХ (например, в силикагеле со смесью растворителей AcOEt/CHCl3 1:1) можно определить смесь стереоизомерных комплексов, как 3 (S, S, S) и 3 (S, R, S/R). Комплекс 3 (S, S, R) можно разделить, например, в вышеуказанной разделительной системе со значением Rf, равным 0.49. Комплексы 3 можно, например, элюировать из силикагеля с помощью МеОН, EtOH и т.д., а затем очистить посредством хроматографии на колонке, например, в Sephadex со смесью EtOH/C6H6.
Полученный комплекс можно применять затем для следующих реакций замещения при участии замещенного на бром атома углерода.
Соответствующее изобретению соединение-предшественник 3 можно превратить посредством нуклеофильного замещения с [18F]F в соответствующее фторированное соединение-предшественник 4. Для этого комплексы 3 можно преобразовать в присутствии основания, такого как, например, NBu4OH, (NBu4)2CO3, К2СО3 и т.д. с помощью соответствующего раствора фторида. Реакция протекает более предпочтительно при повышенных температурах. Добавление краун-эфиров, как, например, криптофикса (К2.2.2), может положительно повлиять на протекание реакции, особенно в комбинации с К2СО3 в качестве катализирующего основания.
Фторированные соединения - 4-фторглютаминовую кислоту или 4-фторглютамин можно выделить из соответствующих комплексов 3 путем обработки кислотой, как например: соляной кислотой, фосфорной кислотой, перхлоратной кислотой, серной кислотой и т.д. При этом происходит как отделение производного аминокислоты, так и расщепление сложного эфира в 5 положении при применении 5-метилового эфира 4-фторглютаминовой кислоты.
Кроме того, 4-фторглютамин может также быть выделен из соответствующих комплексов 3 путем обработки кислотой, такой как, например, соляная кислота, фосфорная кислота, перхлорная кислота, серная кислота и т.д., причем отделение сложного эфира в 5 позиции при использовании 5-метилового эфира 4-фторглютаминовой кислоты также происходит с применением щелочей, например гидрокарбоната натрия, раствора едкого калия, гироксида лития или похожих субстанций. 4-Фторглютаминовую кислоту можно предочистить в картридже (например, QMA (Waters). LiChrolut (VWR/Merck) или WHAT6803-2005 SPE COLSAX (VWR/Merck)). Отделение примесей (комплексного соединения 3, 4, 4-бромглютаминовой кислоты и т.д.) может происходить посредством ВЭЖХ. К подходящим ВЭЖХ системам, например, относятся: колонка: содержащий аминогруппы силикагель (например, Zorbax-NH2); Элюент: 20 мМ раствор NaH2PO4 в воде. Поток: 4 мл/минуту. Очищенное соединение 5 можно сконцентрировать с помощью подходящего способа удаления растворителей для ВЭЖХ и применять согласно этому изобретению. Удаление растворителей для ВЭЖХ можно производить различным путем. Подходит упаривание в роторе под уменьшенным давлением, нагрев пробы в сушильном шкафу под потоком азота и т.д. или нанесение на картридж концентратора (например, С-18 SepPack и т.д.), а затем элюирование с помощью небольшого количества смеси EtOH/водного раствора натрия хлорида или похожей с последующей концентрацией вышеупомянутыми методами.
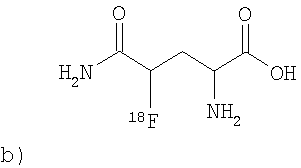
Соответствующие изобретению соединения, в которых изотоп 18F находится в β-положении, как например, в (2S)-3-фтор-глютаминовой кислоте (6), можно получить как представлено на схеме 2. Таким образом удается, к примеру, осуществить отделение в кислой среде защитных групп соединения 7, чтобы получить соответствующее изобретению соединение (2S)-3-фтор-глютаминовую кислоту (6):
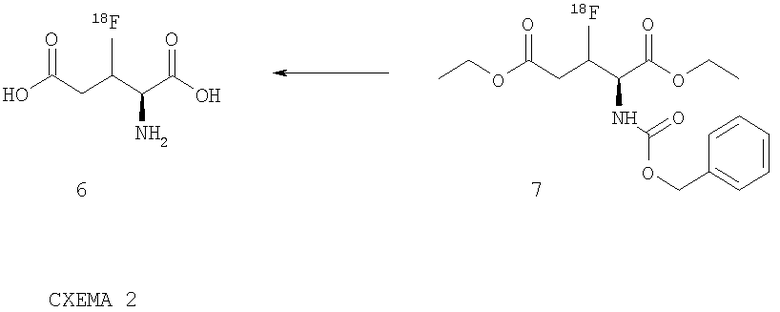
При этом могут применяться различные органические, но прежде всего неорганические кислоты, такие как, например, бромистоводородная кислота, соляная кислота, серная кислота, перхлоратная или фосфорная кислота. Отделение защитных групп в сильно основной среде, например, с помощью раствора гидроксида натрия или гидроксида калия менее благоприятно, но в принципе может быть применено и выполнено. Очистка соответствующего изобретению соединения 6 согласно формуле (I) возможна посредством ВЭЖХ, причем в принципе можно присоединить и включить различные этапы очистки, как например, очистка в картридже RP-C18 или с помощью других средств для разделения.
Радиохимическое фторирование тозилата 8, синтез которого описан в литературе (Chem. Pharm. Bull., 17, 5, (1969), 879-885), для получения 18F-меченого производного глютаминовой кислоты 7 выполняется с помощью методов, известных специалисту в данной области (см. Схема 3):
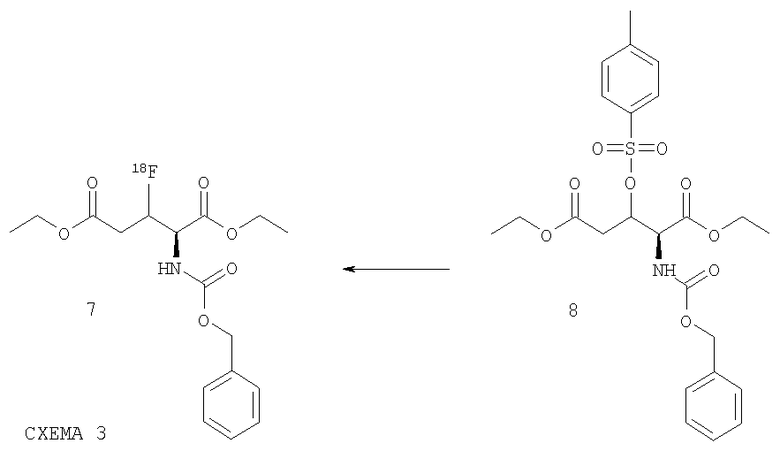
При этом соединение 8 можно преобразовать в присутствии основания, как например: тетраалкиламмония, карбоната тетраалкилфосфония и карбоната калия и т.д. с помощью соответствующего раствора [18F]-фторида. Реакция протекает предпочтительно при повышенных температурах. Добавление краун-эфиров, как, например, криптофикса (К2.2.2), может положительно повлиять на протекание реакции, особенно в комбинации с К2СО3 в качестве катализирующего основания. К возможным растворителям относятся предпочтительно апротонные растворители, но также могут применяться и протонные растворители или же добавляться апротонный растворитель, как например, вода. Как правило, для радиохимического фторирования с помощью [18F]-фториданионов как оптимальные растворители применяются ацетонитрил, диметилсульфоксид или диметилформамид. Соединение 7, как правило, не должно подвергаться очистке, а может сразу использоваться для преобразования 7 в 6 с помощью описанных методов. Однако очистка соединения 7 принципиально возможна предпочтительно посредством препаративной ВЭЖХ с неполярной фазой, как например, С-18 RP.
Соответствующие изобретению соединения, в которых изотоп 18F расположен над метиленовой группой в положении 4 цепи глютаминовой кислоты, как например, в [18F](2S)-4-фторметилглютаминовой кислоте (9), можно получать как представлено на схеме 4. Таким образом удается, к примеру, отделить защитные группы соединения 10 в кислой среде, чтобы получить соответствующее изобретению соединение (2S)-4-фторметилглютаминовую кислоту (9):
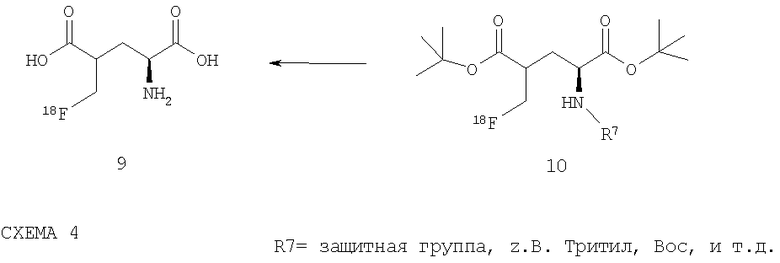
СХЕМА 4
При этом могут применяться, прежде всего, различные органические кислоты (например, трифторуксусная кислота), однако также и неорганические кислоты, как например: бромистоводородная кислота, соляная кислота, серная кислота, перхлоратная кислота или фосфорная кислота. Очистка соответствующего изобретению соединения 9 согласно формуле (I) возможна посредством ВЭЖХ, причем, в принципе, можно присоединить и включить различные этапы очистки, как например, очистка в картридже RP-C18 или с помощью других средств для разделения.
Радиохимическое фторирование тозилата 11, синтез которого происходил аналогично описанному в литературе методу (Chem. Pharm. Bull., 17, 5, (1969), 879-885) из соединения 12 (Tetrahedron, 45, 5, (1989) 1453-1464), для получения 18F-меченого производного глютаминовой кислоты 10 выполняется с помощью методов, известных специалисту в данной области (см. Схему 5):
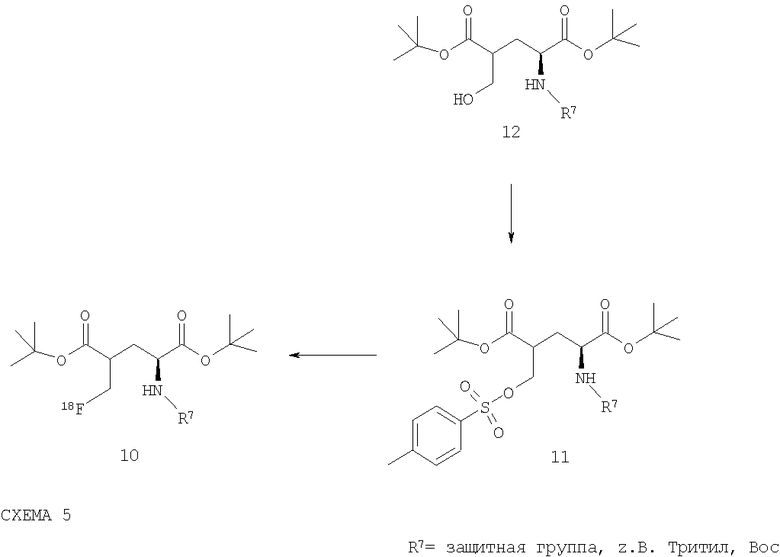
При этом соединение 11 можно преобразовать в присутствии основания, как например: тетраалкиламмония, карбоната тетраалкилфосфония и карбоната калия и т.д. с помощью соответствующего раствора [18F]-фторида. Реакция протекает предпочтительно при повышенных температурах. Добавление краун-эфиров, как например, криптофикса (К2.2.2), может положительно повлиять на протекание реакции, особенно в комбинации с К2СО3 в качестве катализирующего основания. К возможным растворителям относятся предпочтительно апротонные растворители, но также могут применяться и протонные растворители или же добавляться апротонный растворитель, как например, вода. Как правило, для радиохимического фторирования с помощью [18F]-фториданионов как оптимальные растворители применяются ацетонитрил, диметилсульфоксид или диметилформамид. Соединение 10, как правило, не должно подвергаться очистке, а может сразу использоваться для преобразования 10 в 9 с помощью описанных методов. Однако очистка соединения 10 принципиально возможна, предпочтительно посредством препаративной ВЭЖХ с неполярной фазой, как например, RP C-18.
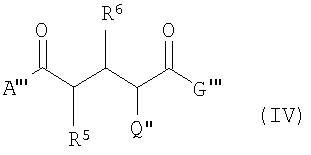
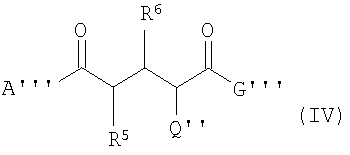
В четвертом аспекте данного изобретения соединения формулы (IV) используются для получения соединений формулы (I) или (II):
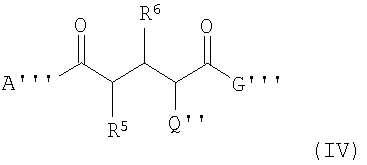
где А''' -
a) гидрокси,
b) разветвленный или неразветвленный С1-С5алкокси,
c) разветвленный или неразветвленный гидрокси C1-С5алкокси,
d) разветвленный или неразветвленный O-C1-С5алкил-(O-С1-С4алкил)n-O-С1-С4алкил
e) N(С1-С5алкил)2,
f) NH2,
g) N(H)-U''
h) N(H)-L''' или
i) O-L'''.
G''' -
a) гидроксил,
b) O-Z'',
c) разветвленный или неразветвленный O-C1-С5алкил,
d) разветвленный или неразветвленный O-С2-С5алкенил,
e) разветвленный или неразветвленный O-C1-С5алкил-(O-С1-С4алкил)n-O-С1-С4алкил или
f) разветвленный или неразветвленный О-С2-С5алкинил,
g) трифенилметокси,
R5 и R6 -
а) водород или
b) E'
при условии, что один из заместителей R5 или R6 точно содержит Е, а соответственно второй заместитель не содержит Е,
Е' -
a) хлоро,
b) бромо,
c) мезилокси
d) трифтормезилокси
e) нонафторбутилокси или
f) тозилокси,
Q'' -
a) N(Н)-трет-бутоксикарбонил,
b) N(Н)-аллилоксикарбонил,
c) N(Н)-бензилоксикарбонил,
d) N(Н)-этоксикарбонил,
e) N(Н)-метоксикарбонил,
f) N(Н)-пропоксикарбонил,
e) N(Н)-2,2,2-трихлорэтоксикарбонил,
f) N(Н)-1,1-диметилпропинил,
g) N(H)-1-метил-1-фенил-этоксикарбонил,
h) N(H)-1-метил-1-(4-бифенилил)-этоксикарбонил,
i) N(Н)-циклобутилкарбонил,
j) N(Н)-1-метилциклобутилкарбонил,
k) N(Н)-винилкарбонил,
l) N(Н)-аллилкарбонил,
m) N(Н)-адамантилкарбонил,
n) N(Н)-дифенилметилкарбонил,
о) N(Н)-циннамилкарбонил,
р) N(Н)-формил,
q) N(Н)-бензоил,
r) N(Н)-тритил,
s) N(Н)-п-метоксифенилдифенилметил,
t) N(Н)-ди-(п-метоксифенил)фенилметил или
u) 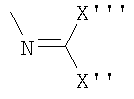 ,
,
v) N-(трет-бутоксикарбонил)2,
L''' -
a) разветвленный или неразветвленный C1-С5алкил,
b) разветвленный или неразветвленный С2-С5алкенил,
c) разветвленный или неразветвленный С1-С5алкил-(O-С1-С4алкил)n-O-С1-С4 алкил, или
d) разветвленный или неразветвленный С2-С5алкинил,
U'' -
a) трет-бутоксикарбонил,
b) аллилоксикарбонил,
c) бензилоксикарбонил или
d) этоксикарбонил,
X'' и X''' независимо друг от друга являются
a) разветвленным или неразветвленным С1-С5алкилом,
b) замещенным или незамещенным арилом
c) алкиларилом или
d) гетероарилом,
и
Z'' является катионом металла,
причем n=0, 1, 2 или 3, и все возможные диастереомеры и энантиомеры являются частью предмета данного изобретения.
Если в соединении формулы (I), формулы (II), формулы (III) или (IV) предмета данного изобретения присутствует один или несколько хиральных центров, то все
формы этих изомеров, включая энантиомеры и все возможные диастереомеры, должны быть включены в контекст данного изобретения. Соединения, которые содержат минимум один хиральный центр, могут применяться как рацемическая смесь, в данном случае как смесь диастереомеров или обогащенная диастереомерами смесь, или как обогащенная энантиомерами смесь. Рацемическую, обогащенную энантиомерами смесь или смесь диастереомеров, можно разделить при необходимости с помощью известных специалисту в данной области методов таким образом, что энантиомеры или диастереомеры можно применять по отдельности. В тех случаях, когда присутствует двойная связь углерод-углерод, оба изомера „цис" и „транс" являются частью данного изобретения. В случаях, когда могут существовать таутомерные формы, как например, при кето-энольной таутомерии, все таутомерные формы включены в данное изобретение, причем эти формы могут существовать в равновесии или предпочтительно в виде одной формы.
Соединения общей формулы I и их предпочитаемые формы существования используются как лекарственное средство. Соответствующие изобретению соединения общей формулы 1 и их предпочитаемые формы, такие как фармацевтически приемлемые соли и комплексы, используются при диагностике физиологических или патологических состояний.
Предпочтительно эти соединения находят применение в неинвазивной базирующейся на РЭТ диагностике для организма человека или животного. Особое предпочтение отдается применению соответствующих изобретению соединений общей формулы I и их предпочитаемых форм существования при диагностике опухолевых заболеваний. Примерами таких опухолевых заболеваний являются злокачественные опухоли желудочно-кишечного тракта или толстой и прямой кишки, печени, поджелудочной железы, почки, мочевого пузыря, щитовидной железы, предстательной железы, эндометрия, яичника, яичек, меланома, мелкоклеточный и немелкоклеточный рак легких, диспластический рак слизистой оболочки рта, инвазивный рак ротовой полости; рак молочной железы, включая гормонозависимый и гормононезависимый рак молочной железы, плоскоклеточный рак, нейрологические раковые заболевания, включая нейробластому, глиома, астроцитому, остеосаркому, менингиому, саркому мягких тканей; гемангиома и эндокринные опухоли, включая аденому гипофиза, хромоцитому, параганглиому, гематологические опухолевые заболевания, включая лимфому и лейкемии; или метастазы какой-либо из вышеназванных опухолей.
Соответствующие изобретению соединения общей формулы I и их предпочитаемые формы существования используются для получения лекарственных средств для диагностики опухолевых заболеваний. Примерами таких опухолевых заболеваний являются злокачественные опухоли желудочно-кишечного тракта или толстой и прямой кишки, печени, поджелудочной железы, почки, мочевого пузыря, щитовидной железы, предстательной железы, эндометрия, яичника, яичек, меланома, мелкоклеточный и немелкоклеточный рак легких, диспластический рак слизистой оболочки рта, инвазивный рак ротовой полости; рак молочной железы, включая гормонозависимый и гормононезависимый рак молочной железы, плоскоклеточный рак, нейрологические раковые заболевания, включая нейробластому, глиома, астроцитому, остеосаркому, менингиому; саркому мягких тканей; гемангиома и эндокринные опухоли, включая аденому гипофиза, хромоцитому, параганглиому, гематологические опухолевые заболевания, включая лимфому и лейкемии; или метастазы какой-либо из вышеназванных опухолей.
ПРИМЕРЫ
Пример 1
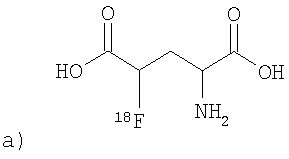
Синтез [F-18]4-фторглютаминовой кислоты:
Синтез соединения 3:
Диизопропиламин (0.031 мл, 0.22 ммоль) прибавляют к суспензии комплекса 1 (0,1 г, 0,2 ммоль) (J. Am. Chem. Soc., 1985, 107, 4252 Oder Tetrahedron Asymmetry, 1998, 9, 4249) в EtOH (0,4 мл) при комнатной температуре (КТ). Реакционную смесь перемешивают в течение 30 мин, затем обрабатывают свежеперегнанным сложным эфиром 2 (0,04 мл, 0,33 ммоль) (Gazz. Chim. Ital., в 1981, 111, 249). Реакцию контролируют методом ТСХ (SiO2, AcOEt/CHCl3, 1:1). После окончания реакции (~2,5 ч) реакционную смесь нейтрализуют, добавляя АсОН (1,5 мл; 2%). Затем прибавляют CHCl3 (15 мл), промывают водой (3×15 мл), отделяют органическую фазу, сушат над Na2SO4 и упаривают досуха в вакууме. Препаративной ТСХ (SiO2, AcOEt/CHCl3, 1:1) получают смесь комплексов 3 (S, S, S) и 3 (S, R, S/R) в соотношении 11: 1 с выходом 28% (Rf 0,52). Значение Rf комплекса 3 (S, S, R) составляло 0.49. Комплекс 3 (S, S, R) элюируют из силикагеля метанолом (3×40 мл), а затем очищают колоночной хроматографией на Sephadex, используя смесь EtOH/С6Н6 (1:3). После очистки получают 0,052 г (52%) продукта. Элементный анализ: найдено (%): С, 56,79; Н, 4,85; Br, 12,14; N. 6,10; Ni, 8,17. C32H32BrN3NiO5. Вычислено (%): С, 56,75; Н, 4.76; Br, 11,80; N, 6,20; Ni, 8,67.
4[F-19]-Фтор-L-глютаминовая кислота (нерадиоактивный стандарт для идентификации [F-18]-фтор-L-глютаминоврй кислоты методом ВЭЖХ)
Конденсация Ni-BPB-Gly с метиловым эфиром 2-фторакриловой кислоты
К суспензии 3 г (6 ммоль) Ni-BPB-Gly в 15 мл МеОН прибавляют 1 мл (7,2 ммоль) i-Pr2NH при комнатной температуре. Реакционную смесь перемешивают в течение 30 мин, затем обрабатывают метиловым эфиром 2-фторакриловой кислоты 3,7 мл (30 ммоль). Ход реакции контролируют методом ТСХ на SiO2 (AcOEt/CHCl3 (2:3)). Реакция заканчивается примерно через 250 ч. Затем смесь нейтрализуют, прибавляя 42 мл 2%-ного водного раствора АсОН, смешанного с 25 мл МеОН. Образовавшаяся смесь диастереоизомерных комплексов Ni-BPB-4-F-GluOMe осаждается. Осадок отфильтруют и промывают водой (3×30 мл). Полученный твердый комплекс суспендируют в CCl4 и упаривают досуха в вакууме. Эту процедуру повторяют 3 раза для удаления воды из смеси. Комплексы очищают хроматографией на колонке (SiO2, 3×20 см, AcOEt/CHCl2, 3:2). Основная фракция (2,66 г, (4,.4 ммоль, 74%)) содержит смесь Ni-BPB-(2S,4R)-4-F-GluOMe и Ni-BPB-(2S,4S)-4-F-GluOMe в соотношении 1,5/1. Температура плавления: 191-193°С. [α]D 25 +2 477 (с 0,5, CHCl3). Элементный анализ: найдено (%): С, 61,76; Н, 5,02; N, 6,94; Ni 9,20. C31H30FN3NiO5 Вычислено (%): С, 61,82; Н, 5,02; N, 6,98; Ni, 9,74.
Разделение комплексов достигалось колоночной хроматографией на Toyopearl HW-55F (колонка 2×50 см. THF/C6H6 (2:7))
Комплекс Ni-BPB-(2S,4R)-4-F-GluOMe: температура плавления: 207-208°С, [α]D 25 +2 617 (с 0,035, МеОН). Элементный анализ: найдено (%): С, 61,79; Н, 4,95; N, 6,88. C31H30FN3NiO5. Вычислено (%): С, 61,82; Н, 5,02; N, 6,98.
Комплекс Ni-BPB-(2S,4S)-4-F-GluOMe. Температура плавления: 233-235°С, [α]D 25 +2 641 (с 0,039, МеОН). Элементный анализ: найдено (%): С, 61,63; Н, 4,86; N, 6,84. C31H30FN3NiO5. Вычислено: (%) С, 61,82; Н, 5,02; N, 6,98.
Разложение комплекса и отделение аминокислоты. В круглодонной колбе растворяют 2,75 г (4,57 ммоль) комплекса Ni-BPB-4-F-GluOMe в 30 мл МеОН и обрабатывают 5,5 мл HCl (6N) при перемешивании. Реакционную смесь нагревают с обратным холодильником в течение 15-20 мин, упаривают досуха, разбавляют водой (50 мл), отфильтровывают гидрохлорид ВРВ и тщательно промывают водой (3×30 мл). Объединенные фильтраты содержат аминокислоту, остатки ВРВ и соли Ni2+. Величину рН доводят до 5 водным раствором NH3. Остатки ВРВ удаляют экстрагированием хлороформом (3×30 мл). Объединенные водные фазы упаривают досуха, обрабатывают 3 мл HCl (6N) и нагревают с обратным холодильником в течение 1 ч. Затем раствор упаривают досуха, растворяют в 5 мл H2O и 5%-ным водным раствором NH3 доводят рН до 4. Аминокислоту отделяют ионообменной хроматографией на колонке Dowex 50w×8 в Н+-форме (элюент: 5%-ный водный NH3).
(2S,4R)-4-фторглютаминовая кислота: температура плавления: >300°С (разложение до температуры плавления).
(2S,4S)-4-фторглютаминовая кислота: температура плавления: >300°С (разложение до температуры плавления).
Радиохимический синтез F-18:
Мишень: малообъемная серебряная мишень низкого давления (1 мл), наполненная водой [O-18] для реакции 18O(р, n)18F; циклотрон: Scanditronix МС 17; бомбардировка протонами при 17 МэВ.
[F-18]Фторид концентрируют в картридже с QMA-смолой (Waters, Sep Pak Light QMA Part. No. WAT023525) путем нанесения полученного раствора [F-18]/[O-18]. Картридж предварительно обрабатывают раствором К2СО3 (10 мл; 0,5 М), а затем деионизированной водой (15 мл).
[F-18] радиоактивный комплекс: [F-18]фторид (15-300 милликюри) элюируют из картриджа QMA промывочным раствором (2 мл, MeCN (2 мл)/карбонат тетрабутиламмония (ТВАС.0,015 мл. 20% водный. рН 8)). Элюат помещают в сосуд объемом 5 мл и удаляют растворители азеотропной перегонкой при 130°С в токе азота.
Нуклеофильное замещение. Реакционный сосуд с сухим [F-18]фторидом тетрабутиламмония охлаждают до 80°С (после предшествующей стадии) и прибавляют раствор предшественника 3 (S,S,R) (5 мг в MeCN (0,5 мл)). Температуру реакционной смеси 80°С поддерживают в течение 5-10 мин. Образец реакционной смеси исследуют методом радио-ТСХ (пластинка из силикагеля (Merck), элюент: этилацетат/хлороформ/уксусная кислота (4/1/1). На основании данных радио-ТСХ установлено, что введение [F-18] в 4 имеет место на 40-60%.
Разложение 18F-фторированного комплекса Ni и высвобождение 4-[18F]-фторглютаминовой кислоты. (А) Соляную кислоту (6N) (0,3-0,5 мл) прибавляют к раствору предшественника комплекса [F-18]-глютамат-никель в MeCN и смесь обрабатывают при 140°С в течение 5 мин. Образец полученной реакционной смеси анализируют методом радио-ТСХ (силикагель, элюент: н-бутанол/уксусная кислота/вода (12/3/5). ТСХ-анализ проводят на MiniGita ТСХ-сканнере (Raytest, Германия).
Предварительная очистка. Неочищенный продукт после обработки HCl (на предшествующей стадии) растворяют в 1 мл воды и помещают в анионообменный картридж (Waters, SAX-OH форма). На картридже удерживается 80% радиоактивных продуктов. Радиоактивные продукты элюируют из картриджа водным раствором хлорида натрия NaCl (0,4 М, 2 мл). Пробу анализируют методом ВЭЖХ.
Определение посредством радио-ВЭЖХ. Насос: Gilson 305, инжектор:
Rheodyne (петлевой дозатор 20 мкп), колонка: Zorbax-NH2; 4,6×150 мм, подвижная фаза: NaH2PO4 (10 мм)/фосфорная кислота, рН 3, поток: 1 мл/мин, УФ-детектор Gilson 116, соединенный последовательно с радиодетектором Beckman 170. УФ-детектирование: 210 нм. Rt: F-19 стандарт (rac)-4-F-Clu-гидрохлорид (смесь диастереомеров: 1/5; как описано выше)): 12,22 мин (УФ); детектирование по радиоактивности (Beckman): 12,64 мин. Получен одиночный радиоактивный пик, который элюируется вместе с соединением-стандартом.
Очистка ВЭЖХ. Насос: Gilson 305, инжектор: Rheodyne (петлевой дозатор 20 мкл), колонка: Zorbax-NH2; 4.6×150 мм, подвижная фаза: NaH2PO4 (10 мм)/фосфорная кислота, рН 3, поток: 1 мл/мин, УФ-детектор: Gilson 116, соединенный последовательно с радиодетектором Beckman 170. УФ-детектирование: 210 нм. Получают индивидуальный радиоактивный пик, который элюируется вместе с соединением-стандартом. Если полученный продукт очищают методом ВЭЖХ, можно не проводить предварительную очистку в анионообменном картридже. Продукт можно получать с радиохимической чистотой >90% и радиоактивностью 15-200 милликюри (с поправкой на распад).
Пример 2:
Синтез [18F]-(R)-2-амино-3-фторпентандикарбоновой кислоты
К смеси 60 мкл 20%-ного водного раствора карбоната тетрабутиламмония в 1,5 мл ацетонитрила (1,0 мл) прибавляют раствор, содержащий [18F]фторид (33 мкп, 789 МБк). Растворитель удаляют упариванием в токе азота при температуре термостата 120°С. Прибавляют 1 мл безводного ацетонитрила и снова удаляют растворитель упариванием. Этот последний этап повторяют еще раз. Раствор 3 мг диэтилового эфира (S)-2-бензилоксикарбониламино-3-(толуолсульфонилокси)пентандикарбоновой кислоты (Chem. Pharm. Bull., 17, 5, (1969), 879-885) в 0,3 мл безводного ацетонитрила прибавляют к остатку и хорошо перемешивают. После нагревания при 90°С в течение 15 мин прибавляют 2 мл 40%-ного водного раствора бромистого водорода. Реакционную смесь перемешивают в течение 30 мин при температуре термостата 130°С и избыточном давлении.
Неочищенный продукт анализируют радиоаналитически методом ВЭЖХ: насос: Gilson 305, инжектор: Rheodyne (петлевой дозатор 20 мкл), колонка: Zorbax-NH2; 4,6×150 мм, подвижная фаза: NaH2PO4 (10 мм)/фосфорная кислота, рН 3, поток: 1 мл/мин, УФ-детектор: Gilson 116, соединенный последовательно с радиодетектором Beckman 170. УФ-детектирование: 210 нм. F-19-стандарт (J. Org. Chem.; 50; 17; (1985); 3163-3167). (УФ); детектирование по радиоактивности (Beckman). Получен одиночный радиоактивный пик, который элюируется вместе с соединением-стандартом.
Очистку 18F-меченого соединения проводят методом ВЭЖХ: Насос: Gilson 305, инжектор; Rheodyne (петлевой дозатор 20 мкл), колонка: Zorbax-NH2; 4,6×150 мм, подвижная фаза: NaH2PO4 (10 мм)/фосфорная кислота, рН 3, поток: 1 мл/мин, УФ-детектор: Gilson 116, соединенный последовательно с радиодетектором Beckman 170, УФ-детектирование: 210 нм. Получен одиночный радиоактивный пик, который элюируется одновременно с 19F-соединением-стандартом (J. Org. Chem.; 50; 17; (1985); 3163-3167). Если полученный продукт очищают методом ВЭЖХ, можно не проводить предварительную очистку в анионообменном картридже.
Продукт может быть получен с радиохимической чистотой около 92% и радиоактивностью 103 МБк.
Пример 3. Ди-трет-Бутил-N-тритил-(S)-глютамат
К гидрохлориду ди-трет-бутил-(8)-глютаминовой кислоты (20,0 г, 68 ммоль, SIGMA, каталожный № G-7501), растворенному в CH2Cl2 (100 мл), прибавляют триэтиламин (40 мл) и тритилхлорид (19,0 г, 68,5 ммоль). Раствор перемешивают в течение 24 ч при комнатной температуре и затем промывают насыщенным водным раствором карбоната натрия (3 х) и воды (3 х). Органическую фазу сушат над MgSO4, растворитель упаривают в вакууме и полученное оранжевое масло очищают флэш-хроматографией на силикагеле в смеси гексан/CH2Cl2 (30/70). Полученное белое твердое вещество представляет собой продукт с остатками тритил-ОН. Тритиловый спирт кристализуют, растворяя его смесь с продуктом в минимальном количестве CH2Cl2 и прибавляя гексан. После фильтрования и удаления смеси растворителей получают бесцветное масло. Выход: 6,0 г, (18%). ТСХ: Rf=0,5 (CH2Cl2). Элементный анализ: найдено С: 76,4; Н: 7,6; N: 2,9; вычислено для: С: 76,6; Н: 7,8; N: 2,8.
трет-Бутил-2-тритиламино-4-трет-бутоксикарбонил-5-гидрокси-(2S)-пентаноат
н-Бутилитий (5,0 мл, 11 ммоль) прибавляют при 0°С к раствору циклогексилизопропиламина (3,0 мл, 15 ммоль) в гексане (50 мл) в трехгорлой колбе. Раствор перемешивают в течение 30 мин при 0°С, затем охлаждают до -78°С и обрабатывают ди-трет-бутил-N-тритил-(S)глютаматом (5,0 г, 10 ммоль) в гексане (50 мл). Колба снабжена газоподводящей трубкой и соединена с сосудом, содержащим параформальдегид, и трубкой для подачи аргона. После образования карбаниона параформальдегид нагревают до 180°С и образующиеся пары формальдегида поступают в реакционный сосуд в токе аргона в течение более 30 мин. При этом поддерживают температуру бани -78°С. Затем удаляют охлаждающую баню, реакционную смесь медленно нагревают до комнатной температуры и фильтруют для удаления остатков параформальдегида. Фильтрат прибавляют к насыщенному водному раствору хлорида аммония и экстрагируют диэтиловым эфиром (3×250 мл). Объединенные органические фазы сушат сульфатом магния, затем удаляют растворитель в вакууме. Полученное желтоватое масло очищают флэш-хроматографией (этилацетат/CH2Cl2 (10/90)). После удаления смеси растворителей получают бесцветное масло. Выход: 1,2 г, (25%). ТСХ; Rf=0,3 (CH2Cl2). Элементный анализ: найдено С: 74,5; Н: 7,6; N: 2,8. Вычислено для: C33H41NO5: С: 74,6; Н: 7,8; N: 2,6.
трет-Бутил-2-тритиламино-4-трет-бутоксикарбонил-5-(4-толуолсульфонилокси)-(2S)-пентаноат
трет-Бутил-2-тритиламино-4-трет-бутоксикарбонил-5-гидрокси-(2S)-пентаноат (532 мг, 1,00 ммоль) растворяют в CH2Cl2 (6 мл) и пиридине (1,2 мл). Затем прибавляют п-толуолсульфонилхлорид (118 мг, 0,62 ммоль) и диметиламинопиридин (13,4 мг, 0.11 ммоль) и реакционную смесь перемешивают в атмосфере азота в течение ночи при комнатной температуре. Реакционную смесь экстрагируют этилацетатом (3 х), объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворители удаляют на роторном испарителе. Неочищенный продукт растворяют в небольшом количестве CH2Cl2, абсорбируют на NH2-материале и очищают колоночной хроматографией, используя смесь этилацетат/гексан (8:2). Выход: 339 мг, (70%). Элементный анализ: найдено С: 70,3; Н: 7,1; N: 2,2; S: 5,0. Вычислено для C40H47NO7: С: 70,1; Н: 6,9; N: 2.0; S: 4,7.
трет-Бутил-2-тритиламино-4-трет-бутоксикарбонил-5-фтор-(2S)-пентаноат (ВЭЖХ-стандарт)
Безводный фторид тетрабутиламмония (102 мг, 0,4 ммоль) прибавляют к раствору трет-бутил-2-тритиламино-4-трет-бутоксикарбонил-5-(4-толуолсульфонилокси)-(23)-пентаноата (54 мг, 0,08 ммоль) в безводном THF (3 мл). Смесь нагревают 4 ч с обратным холодильником. Затем реакционную смесь охлаждают до комнатной температуры, обрабатывают CH2Cl2 и экстрагируют водой (3 х). Препаративной тонкослойной хроматографией (CH2Cl2/MeOH (90/10)) получают продукт в виде желтоватого масла. Выход: 22 мг, (51%). Элементный анализ: найдено С: 74,4; Н: 7.7; N: 2,8. Вычислено для C33H40NO4: С: 74,3; Н: 7,6; N: 2,6.
[F-18]-трет-Бутил-2-тритиламино-4-трет-бутоксикарбонил-5-фтор-(2S)-пентаноат
[F-18]фторид получают по реакции 18O(р,n)18F в циклотроне. Раствор изотопов помещают на картридж Sep-Pack Light QMA и сушат в потоке воздуха. [F-18]фторид элюируют из картриджа смесью Криптофикс 2.2.2/раствор К2СО3 (22 мг К2.2.2, 4,6 мг К2СО3, 2 мл, MeCN (1,77 мл), вода (0,23 мл)). Растворители удаляют при 120°С в токе аргона. Остаток дважды подвергают азеотропной перегонке с 1 мл безводного MeCN при 120°С в токе аргона. Раствор предшественника - тозилата трет-бутил-2-тритиламино-4-трет-бутоксикарбонил-5-(4-толуолсульфонилокси-(2S)-пентаноата (4 мг) - в MeCN (0,2 мл) прибавляют в сосуд с сухим [F-18]фторидом. Реакционную смесь нагревают при 120°С в течение 10 мин. Затем растворитель удаляют в токе аргона. Растворитель (MeCN) удаляют в токе азота, а осадок обрабатывают HCl (6 N, 0,3-0,5 мл) при 140°С в течение 5 мин. Образец полученной реакционной смеси анализируют радио-ТСХ (силикагель, элюент: н-бутанол/уксусная кислота/вода (12/3/5). ТСХ-анализ проводят на MiniGita ТСХ-сканнере (Raytest, Германия).
Предварительная очистка. Неочищенный продукт после обработки HCl (предшествующий этап) растворяют в 1 мл воды и помещают на анионообменный картридж (Waters, SAX-OH форма). На картридже сохранялось 80% радиоактивных продуктов. Радиоактивные продукты элюируют из картриджа водным раствором хлорида натрия NaCl (0,4 М, 2 мл). Пробу анализировают методом ВЭЖХ.
Определение посредством радио-ВЭЖХ. Насос: Gilson 305, инжектор: Rheodyne (петлевой дозатор 20 мкл), колонка: Zorbax-NH2; 4,6×150 мм, подвижная фаза: NaH2PO4 (10 мм)/фосфорная кислота, рН 3, поток: 1 мл/мин, УФ-детектор Gilson 116, соединенный последовательно с радиодетектором Beckman 170, УФ-детектирование: 210 нм. Rt: F-19-стандарт сравнения (гидрохлорид (rac)-4-F-Glu): 14,53 мин. (УФ); детектирование по радиоактивности (Beckman): 14,68 мин. Получен одиночный радиоактивный пик, который элюируется вместе с соединением-стандартом.
Очистка методом ВЭЖХ. Насос: Gilson 305, инжектор: Rheodyne (петлевой дозатор 20 мкл), колонка: Zorbax-NH2; 4.6×150 мм, подвижная фаза: NaH2PO4 (10 мм) / фосфорная кислота, рН 3, поток: 1 мл/мин, УФ-детектор: Gilson 116, соединенный последовательно с радиодетектором Beckman 170. УФ-детектирование: 210 нм. Получен одиночный радиоактивный пик, который элюируется вместе с соединением-стандартом. Если полученный продукт очищают ВЭЖХ, можно не проводить предварительную очистку с помощью анионообменного картриджа. Продукт можно получать с радиохимической чистотой >90% и радиоактивностью 20 - 200 милликюри (с поправкой на распад).
Пример 4. Биологическая характеристика
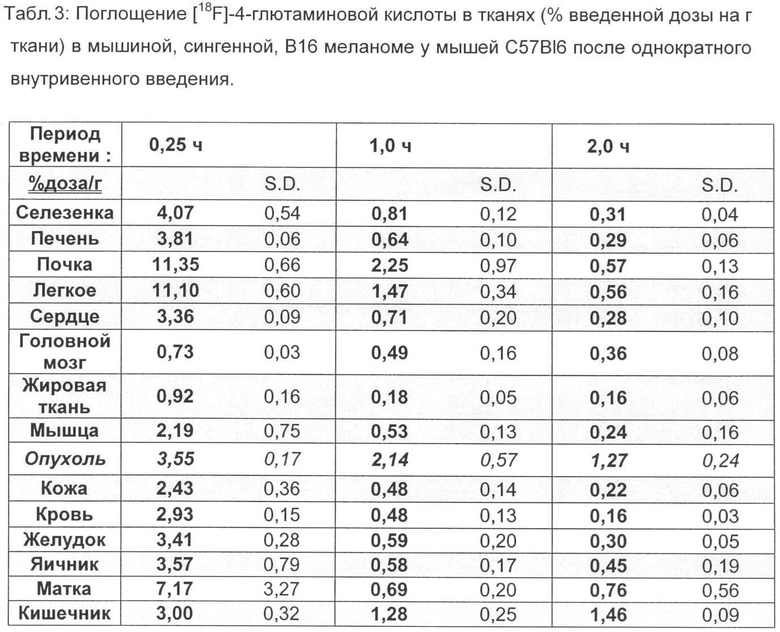
Для оценки накопления [18F]-4-глютаминовой кислоты в опухоли и ее распределения в тканях подопытных животных [18F]-4-глютаминовую кислоту испытывают на мышиной модели Р9-тератокарциномы у «голых» мышей NMRI и мышиной модели B16F1-меланомы у C57BI6-мышей.
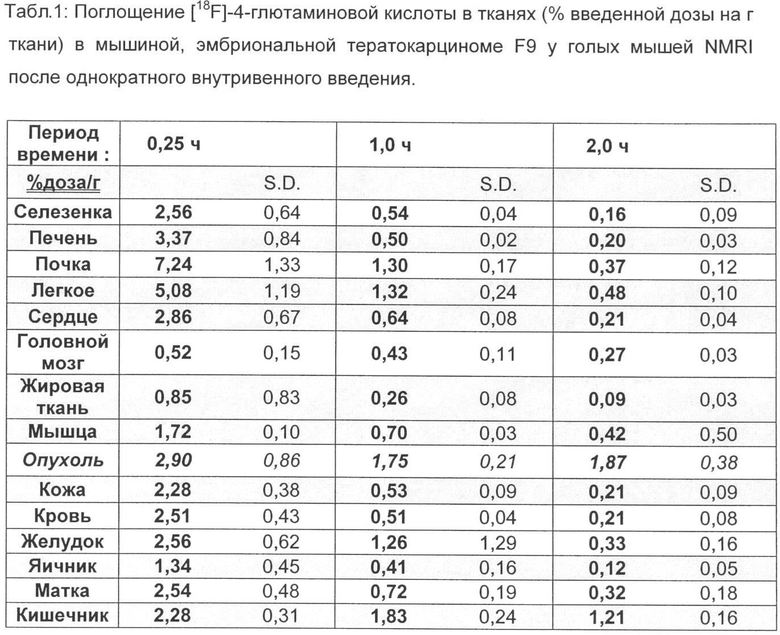
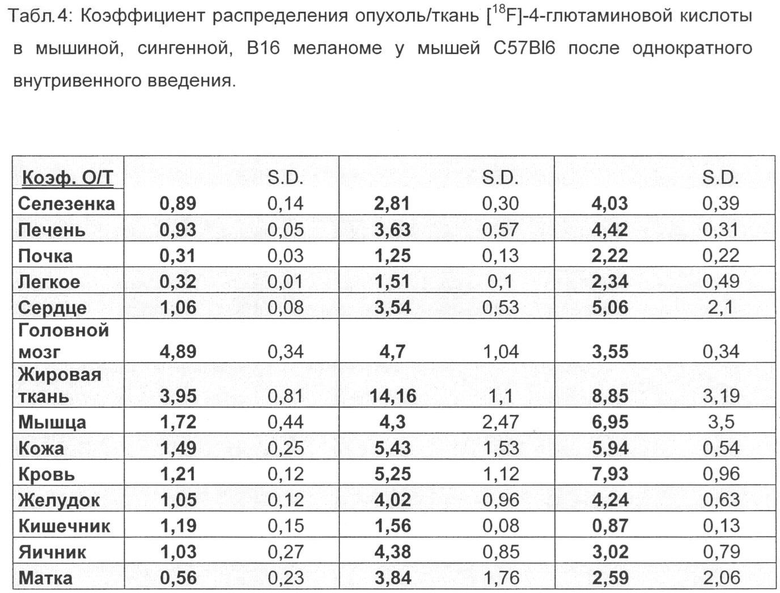
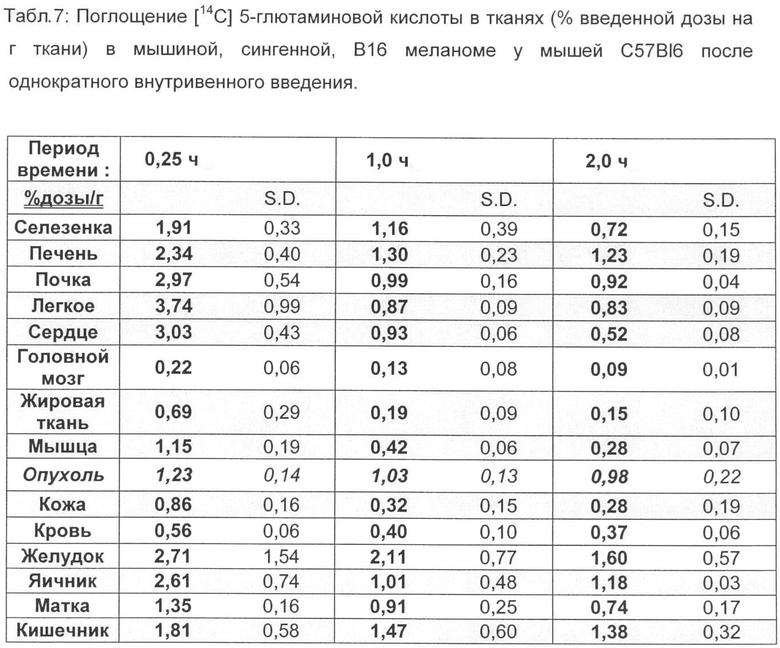
Для этого суспендируют 1×106 клеток (F9) и 5×105 клеток (B16F1) соответственно в 100 мкл забуференного фосфатом физиологического раствора хлорида натрия и инокулируют подкожно в правый задний бок подопытного животного соответствующего вида (NMRI для F9 и C57-BI6 для B16F1) (Berndorff et al. Clin. Cancer Res. 2005, 11, 2005). Через 14 дней (F9) и через 10 дней (В16) соответственно опухоли достигают размера примерно 80-100 мм2. [18F]-4-глютаминовую кислоту (370 КБк, в 100 мкл физиологического раствора хлорида натрия) вводят внутривенно в вену хвоста. Через 15; 60 и 120 мин животных, ткани органов и опухолевые ткани соответственно извлекают, взвешивают и определяют содержание радиоактивного вещества. Соответствующие данные приведены в таблицах 1-4.
Распределение [18F]-4-глютаминовой кислоты в тканях сравнивают с С-14 меченной глютаминовой кислотой на тех же моделях опухолей, причем внутривенно вводят 111 КБк [14С] 5-глютаминовой кислоты и животных умерщвляют через 30, 60 и 240 мин (F9), а также через 15, 60 и 120 мин (B16F1) и проводят анализ (таблицы 5-8).
По сравнению с этими результатами C-14 меченную глютаминовую кислоту исследовали на обеих моделях опухолей. Соответствующие результаты распределения в органах приведены в табл.5-9.
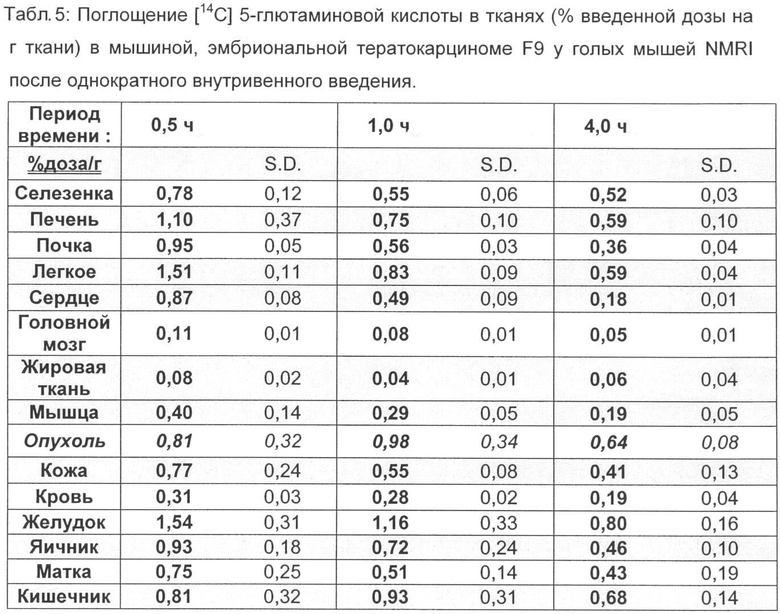
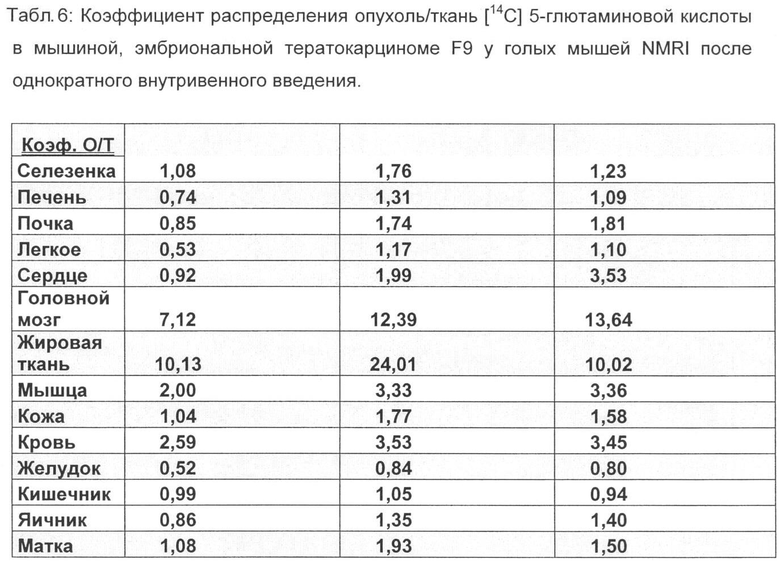
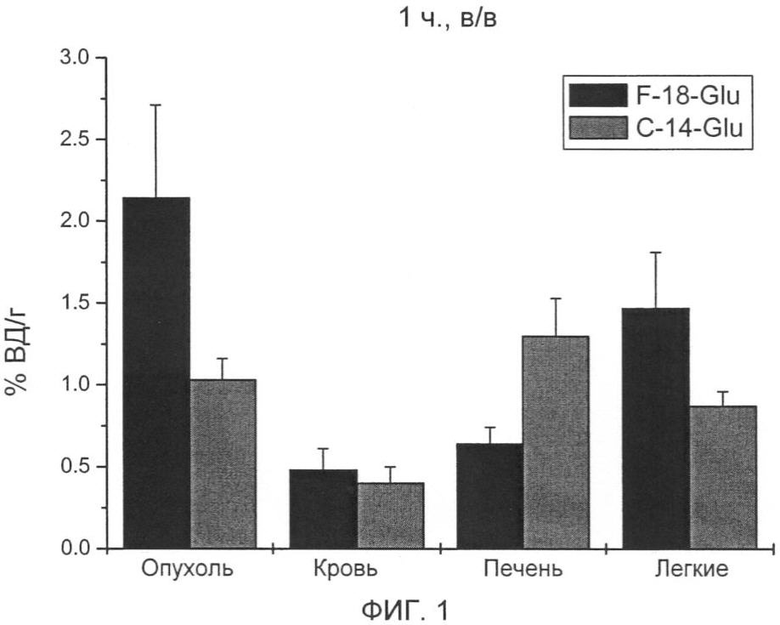
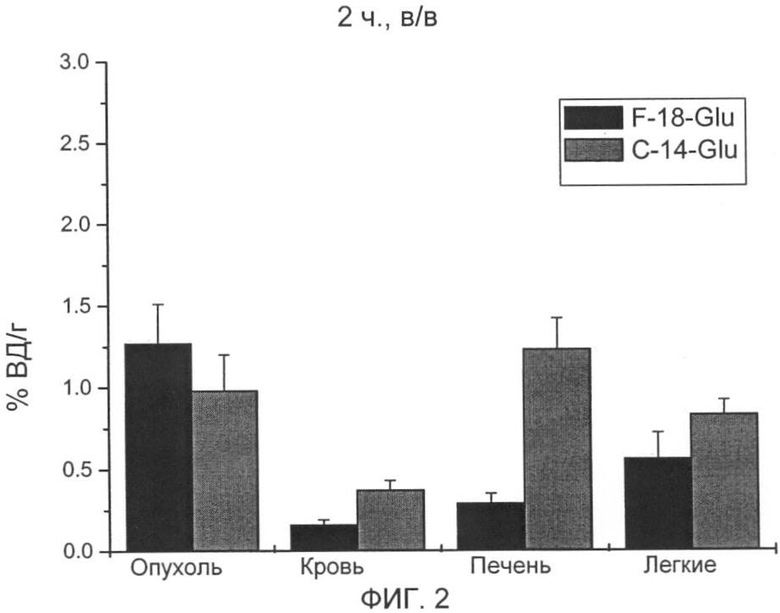
Неожиданно максимальное накопление в опухоли, равное 2,90% ВД/г (F9 тератокарцинома) и соответственно 3,55% ВД/г (В16 меланома), показывает [18F] 4-глютаминовая кислота после внутривенной инъекции (15 мин) во время максимального накопления в опухоли, что составляет для природного субстрата [14С] 5-глютаминовой кислоты только 0,81% ВД/г при F9 тератокарциноме за сходный короткий период (30 мин) и 1,23 при B16F1 меланоме за тот же период.
Также через 1 ч после внутривенного введения значения 1,75% ВД/г при F9 тератокарциноме и соответственно 2,14% ВД/г при B16F1 меланоме лежат значительно выше, чем для [14С] 5-глютаминовой кислоты, только 0,98% ВД/г (F9 тератокарцинома) и соответственно 1,03% ВД/г (B16F1 меланома).
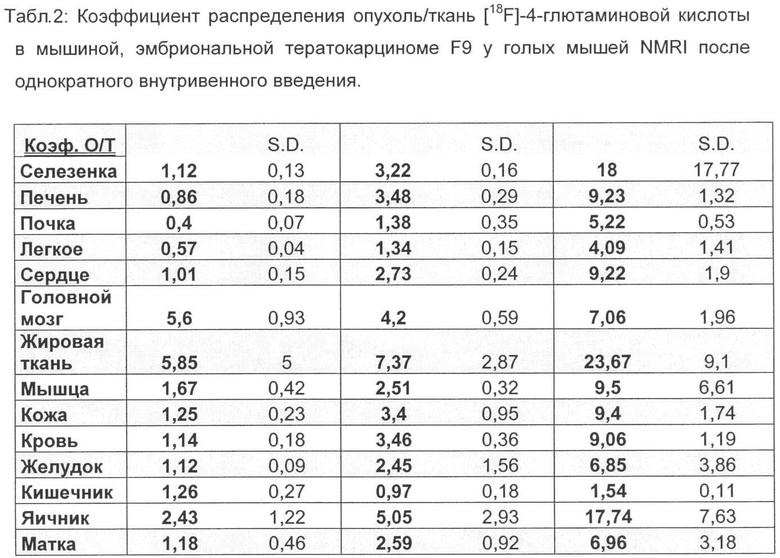
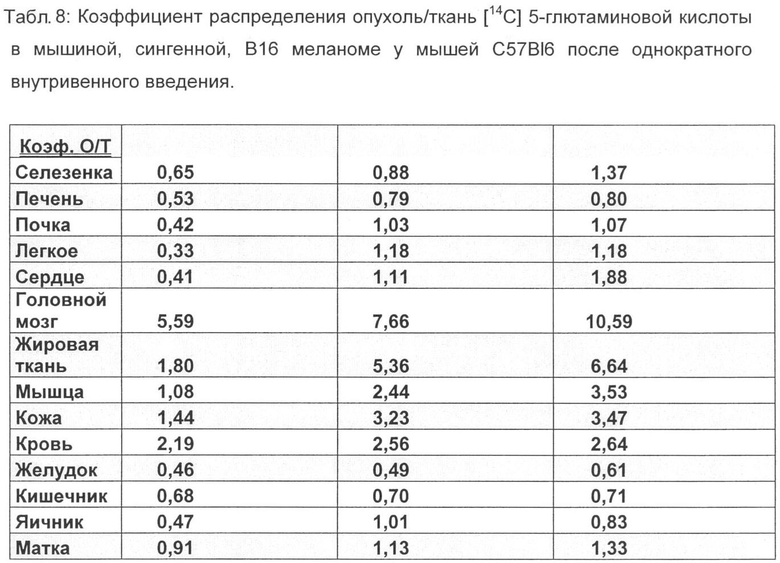
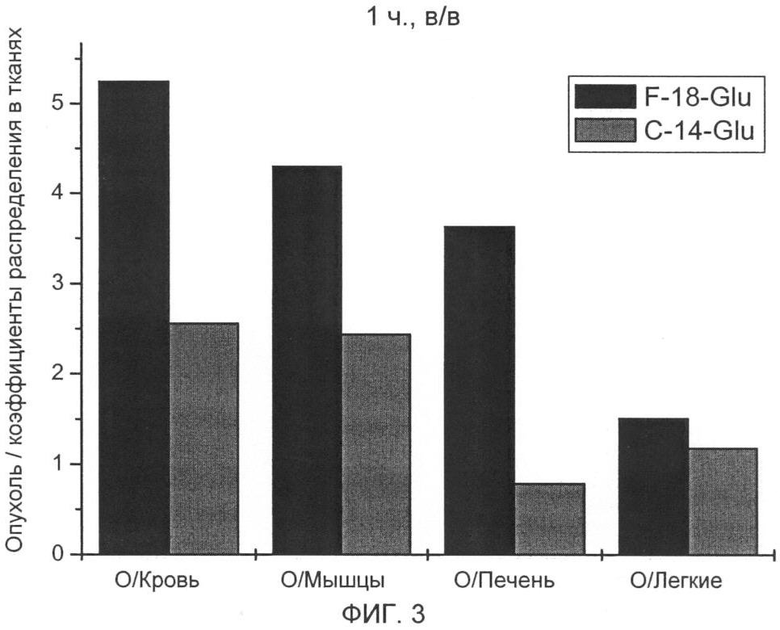
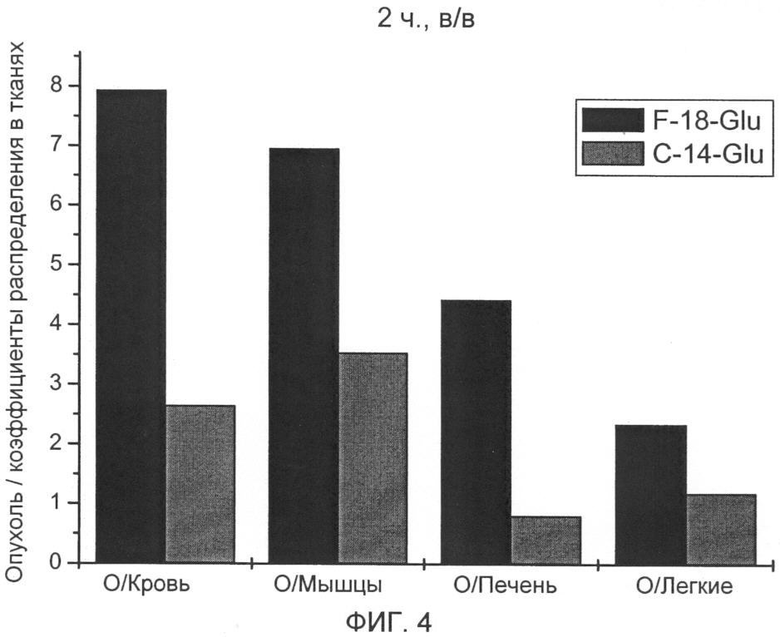
Более высокое накопление в опухоли фторированного соединения, связанное с быстрым выделением из физиологической, витальной ткани/органа, ведет к значительно улучшенной визуализации опухоли при применении [18F] 4-глютаминовой кислоты по сравнению с [14С] 5-глютаминовой кислотой. Коэффициент распределения опухоль/кровь в модели B16F1 меланомы составляет для фторированного соединения 5,3 (1 ч в/в) и 7,9 (2 ч в/в) и выше в 2 раза и соответственно в 3,5, чем для [14С]-глютаминовой кислоты. Коэффициент распределения опухоль/печень - важный параметр для оценки пригодности радиоактивных индикаторов для ПЭТ, составляет для фторированного соединения в модели B16F1 меланомы 3,6 (1 ч, в/в) и 4,4 (2 ч, в/в) и выше в 4,6 раза и соответственно в 5,5, чем для [14С] 5-глютаминовой кислоты.
[18F]-4-глютаминовая кислота обладает значительно лучшими фармакокинетическими свойствами по сравнению с С-14 замещенным природным субстратом [14С]5-глютаминовой кислотой.
На фиг.1-4 в общем представлены поглощение и накопление в опухоли в выбранных релевантных органах через 1 ч (а) и соответственно 2 ч (b).
При этом аккумуляция F-18-Glu и C-14-Glu в опухоли, крови, печени и легких указывается после внутривенного введения мышам C57BI6 с подкожной В16 меланомой.
На фиг.1 показано распределение через 1 ч.
На фиг.2 распределение представлено через 2 ч.
На фиг.3 показаны полученные коэффициенты распределения в тканях, включая опухоль/мышечную ткань через 1 ч.
На фиг.4 показаны полученные коэффициенты распределения в тканях, включая опухоль/мышечную ткань через 2 ч.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПРЕКУРСОРНЫЕ МОЛЕКУЛЫ ДЛЯ МЕЧЕННЫХ F-18 ПЭТ РАДИОАКТИВНЫХ ИНДИКАТОРОВ | 2010 |
|
RU2538276C2 |
| СПИРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ЦИКЛОГЕКСАНА СО СРОДСТВОМ К ORL1-РЕЦЕПТОРУ | 2004 |
|
RU2383544C2 |
| СОЕДИНЕНИЯ ДИБЕНЗО[b,f][1,4]ОКСАЗАПИНА | 2008 |
|
RU2469033C2 |
| СПИРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ЦИКЛОГЕКСАНА | 2003 |
|
RU2354656C2 |
| ХИРАЛЬНОЕ 4-БОРОНОФЕНИЛАЛАНИНОВОЕ (ВРА) ПРОИЗВОДНОЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ F-МЕЧЕННОГО ВРА С ИСПОЛЬЗОВАНИЕМ УКАЗАННОГО ПРОИЗВОДНОГО | 2013 |
|
RU2660433C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАДИОАКТИВНОГО ФТОР-МЕЧЕННОГО ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ | 2007 |
|
RU2434846C2 |
| СОЕДИНЕНИЕ-ПРЕДШЕСТВЕННИК ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ, МЕЧЕННОГО РАДИОАКТИВНЫМ ГАЛОГЕНОМ | 2006 |
|
RU2428415C2 |
| БИЦИКЛИЧЕСКИЕ АГОНИСТЫ СТИМУЛЯТОРА ГЕНОВ ИНТЕРФЕРОНА STING | 2020 |
|
RU2800072C1 |
| ЗАМЕЩЕННЫЕ ПИРАЗИНОПИРИМИДИНОНЫ КАК БЛОКАТОРЫ TRPA1 КАНАЛОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2014 |
|
RU2603770C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ БИАРИЛМОЧЕВИН И ИХ АНАЛОГОВ | 2006 |
|
RU2431630C2 |
Изобретение относится к новым соединениям формулы (I), которые могут найти применение в диагностике опухолевых заболеваний. В формуле (I)
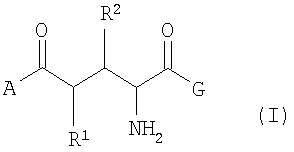
А представляет собой ОН, C1-C5 алкокси, N(C1-С5 алкил)2, NH2; G представляет собой ОН, O-C1-C5 алкил; R1 и R2 независимо друг от друга представляют собой Н, 18F, 18F-C1-C5 алкокси, 18F-C1-C5 алкил, при условии, что если один из заместителей R1 или R2 содержит изотоп 18F, то другой его не содержит. Изобретение относится также к соединениям формул
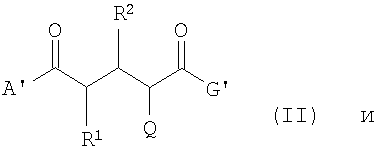
которые используются в синтезе соединений формулы (I), a также к применению соединений формулы
для получения соединений формул (I) или (II). 5 н.з. и 24 з.п. ф-лы, 8 табл., 4 ил.
1. Соединения общей формулы I

где A-
a) гидрокси,
b) разветвленная или неразветвленная C1-C5 алкокси,
e) N(С1-С5алкил)2,
f) NH2.
G-
a) гидроксил,
b) разветвленный или неразветвленный O-C1-C5 алкил,
R1 и R2 - независимо друг от друга представляют собой
а) водород,
b) 18F,
c) разветвленный или неразветвленный 18F C1-C5 алкокси,
d) разветвленный или неразветвленный 18F-C1-C5 алкил,
при условии, что если один из заместителей R1 или R2 точно содержит изотоп 18F, соответственно другой заместитель не содержит изотопа 18F.
2. Соединения по п.1, отличающиеся тем, что А является ОН, метокси или NH2.
3. Соединение по п.1, отличающееся тем, что А является ОН.
4. Соединение по п.1, отличающееся тем, что А является NH2.
5. Соединения по п.1, отличающиеся тем, что R1 и R2 выбраны из группы, состоящей из водорода, 18F, 18F-метокси, 18F-этокси, 18F-пропокси, 18F-метил, 18F-этил и 18F-пропил, при условии, что один из заместителей R1 или R2 точно содержит изотоп 18F, второй заместитель является соответственно водородом.
6. Соединение по п.1, отличающееся тем, что R1 является 18F, a R2 является H.
7. Соединение по п.1, отличающееся тем, что R2 является 18F, a R1 является Н.
8. Соединение по п.1, отличающееся тем, что G выбран из группы, состоящей из ОН, метокси или этокси.
9. Соединение по п.1, выбранное из группы, состоящей из соединений формулы:
 ,
,
 ,
,
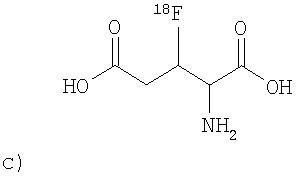 ,
,
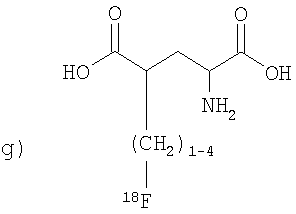 ,
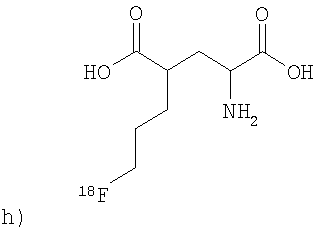
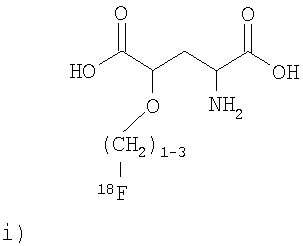
,
10. Соединения общей формулы (II):
где А'-
a) гидрокси,
b) разветвленный или неразветвленный С1-С5 алкокси,
e) N(C1-C5 алкил)2,
f) NH2,
G'-
a) гидрокси,
b) O-Z',
c) разветвленный или неразветвленный O-C1-С5 алкил,
R1 и R2 независимо друг от друга представляют собой
а) водород,
b) 18F,
с) разветвленный или неразветвленный 18F-C1-С5 алкокси,
d) разветвленный или неразветвленный 18F-C1-C5 алкил,
при условии, что один из заместителей R1 или R2 точно содержит изотоп 18F и, соответственно, второй заместитель не содержит изотопа 18F,
Q-
a) N(Н)-трет-бутоксикарбонил,
с) N(Н)-бензилоксикарбонил,
г) N(Н)-тритил
или
u) группа
 ,
,
Z' является катионом металла, выбранным из группы Ni2+, Na+, K+, Са2+ и Mg2+.
11. Соединение по п.10, отличающееся тем, что А' является ОН, разветвленным или неразветвленным C1-C5 алкокси или NH2.
12. Соединение по п.10, отличающееся тем, что А' является этокси.
13. Соединение по п.10, отличающееся тем, что А' является NH2.
14. Соединения по п.10, отличающиеся тем, что R1 и R2 выбраны из группы, состоящей из водорода, 18F, 18F-метокси, 18F-этокси, 18F-пропокси, 18F-метил, 18F-этил и 18F-пропил, при условии, что один из заместителей R1 или R2 точно содержит изотоп 18F, второй заместитель является соответственно водородом.
15. Соединение по п.10, отличающееся тем, что R1 является 18F, а R2 является Н.
16. Соединение по п.10, отличающееся тем, что R2 является 18F, а R1 является Н.
17. Соединение по п.10, отличающееся тем, что G' выбран из группы, состоящей из ОН, этокси, метокси и OZ'.
18. Соединение по п.10, отличающееся тем, что G' является этокси.
19. Соединение по п.10, отличающееся тем, что Z' выбран из группы, состоящей из Na+, K+, Са2+ и Mg2+.
20. Соединение по п.10, отличающееся тем, что Z' является Ni2+.
21. Соединение по п.20, отличающееся тем, что Q выбран из группы, состоящей из N(H)-трет-бутоксикарбонила, N(Н)-бензилоксикарбонила и группы
 .
.
22. Соединение по п.10, отличающееся тем, что Q является N(Н)-трет-бутоксикарбонилом.
23. Соединение по п.10, отличающееся тем, что Q является
 .
.
24. Соединение по п.10, выбранное из группы соединений формулы:
a) 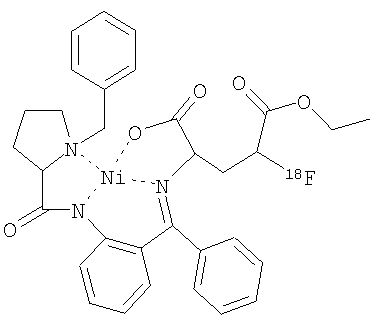 ,
,
b) 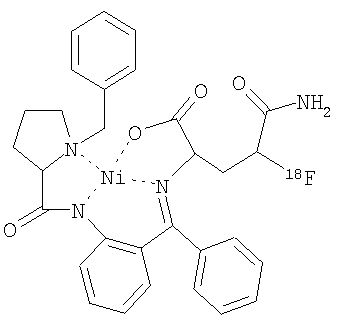 .
.
25. Соединения по п.1, предназначенные для применения в диагностике опухолевых заболеваний.
26. Соединения формулы (III):
где А'' -
a) гидрокси,
b) разветвленный или неразветвленный C1-C5 алкокси,
е) N(С1-С5алкил)2,
f) NH2,
G''-
a) гидроксил,
b) O-Z'',
c) разветвленный или неразветвленный O-C1-C5 алкил,
R3 и R4 -
a) водород,
b) разветвленный или неразветвленный E-C1-C5 алкокси,
c) разветвленный или неразветвленный E-C1-C5 алкил, при условии, что один из заместителей R3 или R4 точно содержит Е, а второй заместитель, соответственно, не содержит Е,
Е-
b) бром,
c) мезилокси
или
f) тозилокси,
Q'-
а) N(Н)-трет-бутоксикарбонил,
с) N(Н)-бензилоксикарбонил,
r) N(Н)-тритил
или
u) группа

и Z'' является катионом металла, выбранным из группы Ni2+, Na+, К+, Са2+ и Mg2+.
27. Применение соединений формулы (IV) для получения соединений формулы (I) или (II):
где А''' -
a) гидрокси,
b) разветвленный или неразветвленный C1-C5 алкокси,
G'''-
a) гидроксил,
b) O-Z'',
c) разветвленный или неразветвленный O-C1-C5 алкил,
R5 и R6 -
a) водород или
b) Е',
при условии, что один из заместителей R5 или R6 точно содержит Е', а соответственно второй заместитель не содержит Е',
Е'-
a) хлор,
b) бром,
c) мезилокси
или
f) тозилокси,
Q''-
а) N(Н)-трет-бутоксикарбонил,
с) N(Н)-бензилоксикарбонил,
r) N(Н)-тритил
и Z'' является катионом металла, выбранным из группы Ni2+, Na+, К+, Са2+ и Mg2+.
28. Соединения по п.1, отличающиеся тем, что они применимы для ПЭТ-диагностики в интервале доз от 37 до 600 МБк.
29. Соединения по п.1, отличающиеся тем, что они применимы для ПЭТ-диагностики в интервале доз от 150 до 370 МБк.
| F.WU et al, Uptake of 14C- and 11C-labeled glutamate, glutamine and aspartate in vitro and in vivo, ANTICANCER RESEARCH, 2000, vol.20, no.1A | |||
| Способ модулирования для радиотелефона | 1921 |
|
SU251A1 |
| P.LAVERMAN et al, Fluorinated amino acids for tumor imaging with positron emission tomography, EUROPEAN JOURNAL OF NUCLEAR MEDICINE, 2002, vol.29, no.5, 681-690 | |||
| M.POHLMAN et al, Efficient | |||
Авторы
Даты
2010-07-27—Публикация
2006-11-01—Подача