[0001] По данной заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США №62/889,679, поданной 21 августа 2019 года.
Предшествующий уровень техники настоящего изобретения
[0002] Сигнальный путь cGAS-STING играет ключевую роль во врожденном иммунном ответе, который формируется клетками млекопитающего-хозяина для элиминации разнообразных ДНК- и РНК-вирусов. STING (стимулятор генов интерферона) представляет собой резидентный сигнальный белок эндоплазматического ретикулума (ER), частично локализованный на митохондриально-ассоциированных мембранах, который широко экспрессируется как в иммунных, так и в неиммунных типах клеток. В ответ на циклические динуклеотиды (CDN), включая 2'-3' цГАМФ, продуцируемый в ответ на цитозольную ДНК посредством циклической ГМФ-АМФ-синтазы (cGAS), STING перемещается в перинуклеарную область, где он быстро индуцирует продукцию интерферона I типа (IFN) и провоспалительного цитокина TBK1-IRF3-зависимым образом. Также было обнаружено, что STING связывается непосредственно с цитозольной ДНК, хотя физиологическая значимость непосредственного обнаружения ДНК пока полностью не охарактеризована.
[0003] В недавней работе продемонстрировано, что STING играет ключевые роли в иммунных ответах на опухолевые клетки. Инициированный опухолью эффективный прайминг Т-клеток в границах микроокружения опухоли требует продукции интерферона-бета (IFN-β) резидентными дендритными клетками, и было продемонстрировано, что экспрессия IFN-β зависит от активации пути STING (1). Действительно, было продемонстрировано, что интратуморальная доставка агонистов STING на основе нуклеотидов индуцирует выраженную регрессию развившихся опухолей в моделях на сингенных мышах (1). Кроме того, было продемонстрировано, что активация пути STING вносит существенный вклад в противоопухолевый эффект облучения посредством IFN-β-опосредованного иммунного ответа в облученном микроокружении опухоли.
Краткое изложение сущности изобретения
[0004] Согласно различным вариантам осуществления, настоящее раскрытие относится к агонисту стимулятора генов интерферона (STING), которые могут применяться в лечении опухолей.
[0005] Согласно различным вариантам осуществления, настоящее раскрытие относится к соединению формулы (I) или формулы (II), или его фармацевтически приемлемой соли:
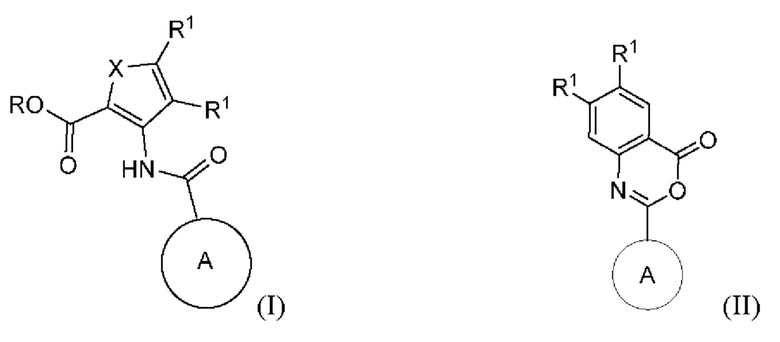
где
X представляет собой S, -N=С(R1)- или -C(R1)=C(R1)-;
каждый R1 независимо представляет собой Н, F, Cl, C1-С6-алкил, этенил или этинил (каждый из которых может быть замещенным), циано, алкоксил, галогеналкил или С3-С6-циклоалкил;
или оба R1 вместе с атомами углерода, к которым они присоединены, формируют конденсированный фенил;
R представляет собой Н, алкил, необязательно замещенный -((С1-С6-алкил)ОС(O)ОС1-С6-алкил), или бензил, где бензил может быть незамещенным или замещенным метоксилом или изостером кислоты или сложного эфира; и
кольцо А представляет собой бициклическую полностью ароматическую или частично восстановленную гетероарильную кольцевую систему, содержащую 3, 4 или 5 атомов N, замещенную 0, 1, 2, 3 или 4 заместителями, каждый из которых независимо выбран из группы, состоящей из NH2, циано, NHC(=O)O-tBu,OH, карбоксамидо, C1-С6-алкила, -S(O)2(С1-С6-алкил), -S(O)(С1-С6-алкил), алкилнитрила, алкоксила и галогеналкила; при условии, что частично восстановленная гетероарильная кольцевая система может быть замещена оксогруппой.
[0006] Согласно различным вариантам осуществления, настоящее раскрытие относится к соединению формулы (I) или его фармацевтически приемлемой соли:
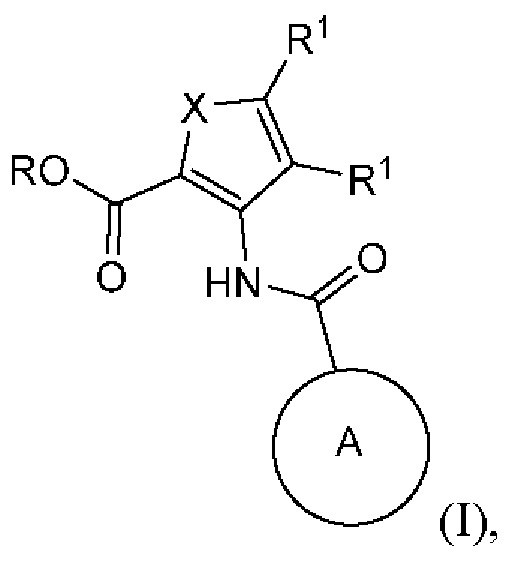
где
X представляет собой S, -N=C(R1)- или -С(R1)=С(R1)-;
каждый R1 независимо представляет собой Н, F, Cl, C1-С6-алкил, этенил или этинил (каждый из которых может быть замещенным), циано, алкоксил, галогеналкил или С3-С6-циклоалкил;
или оба R1 вместе с атомами углерода, к которым они присоединены, формируют конденсированный фенил;
R представляет собой Н, алкил, необязательно замещенный -((С1-С6-алкил)ОС(O)С1-С6-алкил), или бензил, где бензил может быть незамещенным или замещенным метоксилом или изостером кислоты или сложного эфира; и
кольцо А представляет собой бициклическую полностью ароматическую или частично восстановленную гетероарильную кольцевую систему, содержащую 3, 4 или 5 атомов N, замещенную 0, 1, 2, 3 или 4 заместителями, каждый из которых независимо выбран из группы, состоящей из NH2, циано, NHC(=O)O-tBu,OH, карбоксамидо, C1-С6-алкила, -S(O)2(С1-С6-алкил), -S(O)(С1-С6-алкил), алкилнитрила, алкоксила и галогеналкила; при условии, что частично восстановленная гетероарильная кольцевая система может быть замещена оксогруппой.
Более конкретно, согласно иллюстративным вариантам осуществления, соединение согласно настоящему раскрытию включает в себя любое из конкретных соединений, представленных ниже в Таблице 1.
[0007] Согласно варианту осуществления, настоящее раскрытие также относится к способу стимулирования экспрессии генов интерферона, включающему в себя введение пациенту эффективной дозы агониста стимулятора генов интерферона (STING), содержащего описанное в настоящем документе соединение, и к способу лечения опухоли у пациента, включающему в себя введение пациенту эффективной дозы агониста стимулятора генов интерферона (STING), содержащего соединение формулы (I).
[0008] Дополнительно, способ согласно настоящему раскрытию может быть осуществлен с использованием эффективной дозы любого из конкретных соединений, раскрытых в настоящем документе (см., например, Таблицу 1).
[0009] Согласно различным вариантам осуществления, способ лечения опухоли может дополнительно включать в себя введение эффективной дозы соединения, раскрытого в настоящем документе, посредством перорального или интратуморального введения, или и того и другого.
[0010] Согласно различным вариантам осуществления, способ лечения опухоли может дополнительно включать в себя введение эффективной дозы соединения, раскрытого в настоящем документе, причем введение включает в себя введение соединения пациенту в виде конъюгата антитело-лекарство или в липосомальной лекарственной форме.
[0011] Согласно различным вариантам осуществления, способ лечения опухоли может дополнительно включать в себя введение эффективной дозы соединения, раскрытого в настоящем документе, дополнительно включая в себя введение эффективной дозы лекарственного средства, нацеленного на контрольную точку иммунного ответа. Например, лекарственное средство, нацеленное на контрольную точку иммунного ответа, может представлять собой анти-PD-L1 антитело, анти-PD-1 антитело, анти-CTLA-4 антитело или анти-4-1ВВ антитело.
[0012] Согласно различным вариантам осуществления, способ лечения опухоли может дополнительно включать в себя введение эффективной дозы соединения, раскрытого в настоящем документе, дополнительно включая в себя применение ионизирующего облучения или введение противораковых лекарственных средств.
[0013] Согласно различным вариантам осуществления, настоящее раскрытие также относится к фармацевтической композиции, содержащей соединение или его фармацевтически приемлемую соль, раскрытые в настоящем документе, и фармацевтически приемлемый носитель.
Подробное раскрытие настоящего изобретения
[0014] Существует значительный интерес к разработке агонистов пути STING для различных иммуноонкологических применений. Что особенно важно, агонисты пути STING обладают значительным потенциалом применения в качестве части комбинированных видов терапии с использованием лекарственных средств, нацеленных на контрольную точку иммунного ответа, у пациентов, у которых отсутствует ответ на блокаду контрольной точки в отдельности.
[0015] Авторы разработали надежную платформу для определения отличных от нуклеотидов низкомолекулярных агонистов STING. Платформа была разработана с использованием первичного метода анализа с использованием линии клеток человека ТНР-1, несущую IRF-индуцируемый репортер с 5 копиями элемента, отвечающего на передачу сигнала IFN. Предварительные скрининговые исследования, включая альтернативные репортерные конструкты, методы анализа на клетках грызунов, а также клеточные линии, нокаутные по cGAS и STING, использовали для устранения артефактов люциферазы и для подтверждения межвидовой перекрестной реактивности у людей и грызунов, а также селективности сигнального пути. Биохимические методы анализа, включая методы анализа ферментативной активности cGAS и связывания белка STING, использовали для определения специфических мишеней выявленных соединений.
[0016] Термин «проведение лечения» или «лечение» в контексте настоящего документа относится к облегчению симптомов, ассоциированных с нарушением или заболеванием, или к ингибированию дальнейшего прогрессирования или ухудшения таких симптомов, или к предупреждению или профилактике заболевания или нарушения, или к излечению заболевания или нарушения. По аналогии, в контексте настоящего документа «эффективное количество» или «терапевтически эффективное количество» соединения согласно настоящему раскрытию относится к количеству соединения, которое полностью или частично облегчает симптомы, ассоциированные с заболеванием или состоянием, или останавливает или замедляет дальнейшее прогрессирование или ухудшение таких симптомов, или предупреждает или обеспечивает профилактику заболевания или состояния. В частности, термин «терапевтически эффективное количество» относится к количеству, которое при необходимых дозировках и продолжительности эффективно для достижения требуемого терапевтического результата. Терапевтически эффективное количество также представляет собой количество, при котором благоприятные терапевтические эффекты превосходят любые токсичные или неблагоприятные эффекты соединений согласно настоящему раскрытию.
[0017] Выражение «эффективное количество», используемое для описания терапии для страдающего от заболевания индивидуума, относится к количеству или концентрации соединения согласно настоящему раскрытию, которая эффективна для ингибирования или иного воздействия на STING в тканях индивидуума, при котором STING вовлечен в нарушение, причем такое ингибирование или иное воздействие происходит в объеме, достаточном для получения благоприятного терапевтического эффекта.
[0018] Как правило, начально вводимое терапевтически эффективное количество соединения, описанного в настоящем документе, или его соли, находится в диапазоне приблизительно от 0,01 приблизительно до 200 мг/кг, или приблизительно от 0,1 приблизительно до 20 мг/кг, массы тела пациента в сутки, с обычным начальным диапазоном, составляющим приблизительно от 0,3 приблизительно до 15 мг/кг/сутки. Пероральные стандартные лекарственные формы, такие как таблетки и капсулы, могут содержать приблизительно от 0,1 мг приблизительно до 1000 мг соединения или его фармацевтически приемлемой формы. Согласно другому варианту осуществления, такие лекарственные формы содержат приблизительно от 50 мг приблизительно до 500 мг соединения или его фармацевтически приемлемой формы. Согласно еще одному варианту осуществления, такие лекарственные формы содержат приблизительно от 25 мг приблизительно до 200 мг соединения или его фармацевтически приемлемой формы. Согласно еще одному другому варианту осуществления, такие лекарственные формы содержат приблизительно от 10 мг приблизительно до 100 мг соединения или его фармацевтически приемлемой формы. Согласно дополнительному варианту осуществления, такие лекарственные формы содержат приблизительно от 5 мг приблизительно до 50 мг соединения или его фармацевтически приемлемой формы. Согласно любому их представленных выше вариантов осуществления, лекарственная форма может вводиться один раз в сутки или два раза в сутки.
[0019] Термин «фармацевтически приемлемые соли» относится к нетоксичным солям добавления органических или неорганических кислот и/или оснований (см., например, документ Lit, et al., Salt Selection for Basic Drugs (1986), Int J. Pharm., 33, 201-217, включенный в настоящий документ посредством ссылки). Характерные фармацевтически приемлемые соли включают в себя, например, соли щелочных металлов, соли щелочноземельных металлов, соли аммония, растворимые в воде и нерастворимые в воде соли, такие как ацетаты, амсонаты (4,4-диаминостильбен-2,2-дисульфонат), бензолсульфонаты, бензонаты, бикарбонаты, бисульфаты, битартраты, бораты, бромид, бутираты, соли кальция, кальцийэдетаты, камзилаты, карбонаты, хлориды, цитраты, клавулариаты, дигидро хлориды, эдетаты, эдизилаты, эстоляты, эзилаты, fiunarate, глуцептаты, глюконаты, глутаматы, гликоллиларсанилаты, гексафторфосфаты, гексилрезорцинаты, гидрабамины, гидробромиды, гидрохлориды, гидроксинафтоаты, йодиды, изотионаты, лактаты, лактобионаты, лаураты, малаты, малеаты, манделаты, мезилаты, метилбромиды, метилнитраты, метилсульфаты, мукаты, напзилаты, нитраты, соли N-метилглюкамин-аммония, 3-гидрокси-2-нафтоаты, олеаты, оксалаты, пальмитаты, памоаты (1,1-метен-бис-2-гидрокси-3-нафтоаты, эйнбонаты), пантотенаты, фосфаты/дифосфаты, пикраты, полигалактуронаты, пропионаты, пара-толуолсульфонаты, салицилаты, стеараты, субацетаты, сукцинаты, сульфаты, сульфосалицилаты, сураматы, таннаты, тартраты, теоклаты, тозилаты, триэтиодиды и валераты. Фармацевтически приемлемая соль может содержать более одного заряженного атома в своей структуре. В этом случае фармацевтически приемлемая соль может содержать множество противоионов. Таким образом, фармацевтически приемлемая соль может содержать один или несколько заряженных атомов и/или один или несколько противоионов.
[0020] Используются стандартные сокращения для химических групп, такие как хорошо известные из уровня техники; например, Me = метил, Et = этил, i-Pr = изопропил, Bu = бутил, t-Bu = трет-бутил, Ph = фенил, Bn = бензил, Ас = ацетил, Bz = бензоил, и т.п.
[0021] Термин «алкил» относится к неразветвленному или разветвленному углеводородный радикал, содержащий от 1 приблизительно до 20 атомов углерода. Например, алкил может содержать от 1 до 10 атомов углерода или от 1 до 6 атомов углерода. Иллюстративный алкил включает в себя неразветвленные алкильные группы, такие как метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, и т.п., и также включает в себя разветвленные изомеры неразветвленных алкильных групп, например без ограничения -СН(СН3)2, СН(СН3)(СН2СН3), -СН(СН2СН3)2, -С(СН3)3, -С(СН2СН3)3, -СН2СН(СН3)2, -СН2СН(СН3)(СН2СН3), -СН2СН(СН2СН3)2, -СН2С(СН3)3, -СН2С(СН2СН3)3, СН(СН3)СН(СН3)(СН2СН3), -СН2СН2СН(СН3)2, -СН2СН2СН(СН3)(СН2СН3), СН2СН2СН(СН2СН3)2, -СН2СН2С(СН3)3, -СН2СН2С(СН2СН3)3, -СН(СН3)СН2СН(СН3)2, -СН(СН3)СН(СН3)СН(СН3)2, и т.п.. Таким образом, алкильные группы включают в себя первичные алкильные группы, вторичные алкильные группы и третичные алкильные группы. Алкильная группа может быть незамещенной или необязательно замещена одним или несколькими заместителями, описанными в настоящем документе.
[0022] Термин «алкокси» или «алкоксил» относится к -О-алкильной группе, содержащей указанной число атомов углерода. Например, (С1-С6)-алкоксигруппа включает в себя -О-метил, -О-этил, -О-пропил, -О-изопропил, -О-бутил, -О-втор-бутил, -O-трет-бутил, -О-пентил, -О-изопентил, -О-неопентил, -О-гексил, -О-изогексил и -О-неогексил.
[0023] Если не указано иное, то термины «галоген-» или «галоген» или «галоид», самостоятельно или как часть другого заместителя, означаю атом фтора, хлора, брома или йода, предпочтительно, фтор, хлор или бром.
[0024] «Галогеналкильная» группа включает в себя моногалогеналкильные группы, полигалогеналкильные группы, где все атомы галогенов могут быть одинаковыми или разными, и пергалогеналкильные группы, где все атомы водорода заменены одинаковыми или различающимися атомами галогена, такими как атомы фтора и/или хлора. Примеры галогеналкила включают в себя трифторметил, 1,1-дихлорэтил, 1,2-дихлорэтил, 1,3-дибром-3,3-дифторпропил, перфторбутил, и т.п.
[0025] Арильные группы представляют собой циклические ароматические углеводороды, которые не содержат гетероатомов в кольце. Как хорошо известно из уровня техники, ароматическое соединение представляет собой множественно ненасыщенную кольцевую систему, которая содержит 4n+2π электронов, где n равен целому числу. Таким образом, арильные группы включают в себя без ограничения фенильные, азуленильные, гепталенильные, бифенильные, индаценильные, флуоренильные, фенантренильные, трифениленильные, пиренильные, нафтаценильные, хризенильные, бифениленильные, антраценильные и нафтильные группы. Согласно некоторым вариантам осуществления, арильные группы содержат приблизительно от 6 приблизительно до 14 атомов углерода в кольцевых частях групп. Арильные группы могут быть незамещенными или замещенными, как определено выше. Характерные замещенные арильные группы могут быть монозамещенными или могут быть замещены более одного раза, как то без ограничения 2-, 3-, 4-, 5- или 6-замещенные фенильные или 2-8-замещенные нафтильные группы, которые могут быть замещены углеродными или отличными от углеродных группами, таким как группы, перечисленные выше.
[0026] Гетероциклильные группы или термин «гетероциклил» включают в себя ароматические и не ароматические кольцевые соединения, содержащие 3 или более кольцевых атома, из которых один или несколько кольцевых атомов представляют собой гетероатом, такой как без ограничения N, О и S. Таким образом, гетероциклил может представлять собой циклогетероалкил или гетероарил, или любую их комбинацию в том случае, если он является полициклическим. Согласно некоторым вариантам осуществления, гетероциклильные группы содержат от 3 приблизительно до 20 кольцевых атомов, тогда как другие подобные группы содержат от 3 приблизительно до 15 кольцевых атомов. Гетероциклильная группа, обозначаемая как С2-гетероциклил, может представлять собой 5-кольцо с 2 атомами углерода и тремя гетероатомами, 6-кольцо с 2 атомами углерода и четырьмя гетероатомами, и т.п. По аналогии, С4-гетероциклил может представлять собой 5-кольцо с одним гетероатомом, 6-кольцо с двумя гетероатомами, и т.п. Число атомов углерода и число гетероатомом в сумме равны общему числу кольцевых атомов. Размер колец также может выражаться общим числом атомов в кольце, например, 3-10-членная гетероциклильная группа, содержащая как углеродные, так и отличные от углеродных кольцевые атомы. Гетероциклильное кольцо может также содержать одну или несколько двойных связей. Гетероарильное кольцо представляет собой вариант осуществления гетероциклильной группы. Термин «гетероциклильная группа» включает в себя группы из конденсированных колец, включая группы, содержащие конденсированные ароматические неароматические группы. Например, диоксаланильная кольцевая система и бенздиоксаланильная кольцевая система (метилендиоксифенильная кольцевая система) обе являются гетероциклильными группами в рамках представленного в настоящем документе значения. Указанный термин также включает в себя полициклические, например, бициклические или трициклические кольцевые системы, содержащие один или несколько гетероатомов, такие как без ограничения хинуклидинил. Гетероциклильные группы могут быть незамещенными или могут быть замещенными.
[0027] Гетероарильные группы представляют собой гетероциклические ароматические циклические соединения, содержащие 5 или более кольцевых атомов, из которых один или несколько атомов представляют собой гетероатом, такой как без ограничения N, О и S; например, гетероарильные кольца могут содержать от 5 приблизительно до 8-12 кольцевых атомов. Гетероарильная группа представляет собой целый ряд гетероциклильных групп, которые обладают ароматической электронной структурой, которая представляет собой множественно замещенную циклическую систему, которая содержит 4n+2π электронов, где n равен целому числу. Гетероарильная группа, обозначаемая как С2-гетероарил, может представлять собой 5-кольцо (т.е. 5-членное кольцо) с 2 атомами углерода и тремя гетероатомами, 6-кольцо (т.е. 6-членное кольцо) с 2 атомами углерода и четырьмя гетероатомами, и т.п. По аналогии, С4-гетероарил может представлять собой 5-кольцо с одним гетероатомом, 6-кольцо с двумя гетероатомами, и т.п. Число атомов углерода и число гетероатомом в сумме равны общему числу кольцевых атомов. Подразумевается, что гетероарил включает в себя окисленные атомы S или N, такие как сульфинил, сульфонил и N-оксид третичного кольцевого атома азота. Атом углерода или гетероатом представляют собой точку присоединения гетероарильной кольцевой структуры, вследствие чего получается стабильное соединение. Примеры гетероарильных групп включают в себя без ограничения пиридинил, пиридазинил, пиразинил, хинаоксалинил, индолизинил, бензо[b]тиенил, хиназолинил, пуринил, индолил, хинолинил, пиримидинил, пирролил, пиразолил, оксазолил, тиазолил, тиенил, изоксазолил, оксатиадиазолил, изотиазолил, тетразолил, имидазолил, триазолил, фуранил, бензофурил и индолил. Гетероарильная группа может быть незамещенной или может быть замещенной одним или несколькими заместителями, описанными в настоящем документе.
[0028] По аналогии, другие арильные (например, фенил) и гетероарильные (например, пир ид ил) кольцевые системы, описанные в настоящем документе, могут быть изображены либо с четко обозначенными двойными связями, либо с «циклической» номенклатурой арилов, но значения являются одними и теми же.
[0029] Циклоалкильные группы представляют собой группы, содержащие одно или несколько карбоциклических колец, включая без ограничения циклопропильную, циклобутильную, циклопентильную, циклогексильную, циклогептильную и циклооктильную группы. Согласно некоторым вариантам осуществления, циклоалкильная группа может содержать от 3 приблизительно до 8-12 кольцевых атомов, тогда как согласно другим вариантам осуществления число кольцевых атомов углерода варьирует от 3 до 4, 5, 6 или 7. Циклоалкильные группы дополнительно включают в себя полициклические циклоалкильные группы, такие как без ограничения норборнильная, адамантильная, борнильная, камфенильная, изокамфенильная и каренильная группы, и конденсированные кольца, такие как без исключения декалинил, и т.п. Циклоалкильные группы также включают в себя кольца, которые замещены неразветвленными и разветвленными алкильными группами, определенными выше.
[0030] Циклоалкенильные группы включают в себя собой циклоалкильные группы, содержащие по меньшей мере одну двойную связь между 2 атомами углерода. Таким образом, например, Циклоалкенильные группы включают в себя без ограничения циклогексенильную, циклопентенильную и циклогексадиенильную группы. Циклоалкенильные группы могут содержать от 3 приблизительно до 8-12 кольцевых атомов, тогда как согласно другим вариантам осуществления число кольцевых атомов углерода варьирует от 3 до 5, 6 или 7. Циклоалкильные группы дополнительно включают в себя полициклические циклоалкильные группы, такие как без ограничения норборнильная, адамантильная, борнильная, камфенильная, изокамфенильная и каренильная группы, и конденсированные кольца, такие как без исключения декалинил, и т.п., при условии, что они содержат по меньшей мере одну двойную связь в составе кольца. Циклоалкенильные группы также включают в себя кольца, которые замещены неразветвленными и разветвленными алкильными группами, определенными выше.
[0031] Один или несколько дополнительных заместителей на любой группе, описанной в настоящем документе, независимо выбраны из группы, состоящей из RA, ORA, галогена, -N=N-RA, NRARB, -(C1-C6-алкил)NRARB, -C(O)ORA, -C(O)NRARB, -OC(O)RA и -CN. RA и RB независимо выбраны из группы, состоящей из Н, -CN, -гидрокси, оксо, C1-С6-алкила, C1-С6-алкокси, С2-С6-алкенила, С2-С6-алкилнила, NH2, -S(O)0-2-(С1-С6-алкил), -S(O)0-2-(С6-С10-арил), -С(O)(С1-С6-алкил), -С(O)(С3-С14-карбоциклил), -С3-С14-карбоциклила, -(С1-С6-алкил)(С3-С14-карбоциклил), С6-С10-арила, 3-14-членного гетероциклоалкила и -(С1-С6-алкил)-(3-14-членный гетероциклоалкил) (где 1-4 атомов гетероциклоалкила независимо выбраны из N, О и S), и 5-10-членного гетероарила (где 1-4 атома гетероарила независимо выбраны из N, О и S). Каждый алкильный, алкокси, алкенильный, алкинильный, арильный, карбоциклильный, гетероциклоалкильный и гетероарильный фрагмент RA и RB необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси, галогена, -NR'2 (где каждый R' независимо выбран из группы, состоящей из C1-С6-алкила, С2-С6-алкенила, С2-С6-алкинила, С6-С10-арила, 3-14-членного гетероциклоалкила и -(С1-С6-алкил)-(3-14-членный гетероциклоалкил) (где 1-4 атомов кольца независимо выбраны из N, О и S), и 5-10-членного гетероарила (где 1-4 атомов гетероарила независимо выбраны из N, О и S), -NHC(O)(ОС1-С6-алкил), -NO2, -CN, оксо, -С(O)ОН, -С(O)O(С1-С6-алкил), -С1-С6-алкил(С1-С6-алкокси), -C(O)NH2, C1-C6-алкил, -С(O)С1-С6-алкила, -OC1-С6-алкила, -Si(C1-C6-алкил)3, -S(O)0-2-(С1-С6-алкил), С6-С10-арила, -(С1-С6-алкил)(С6-С10-арил), 3-14-членного гетероциклоалкила и -(С1-С6-алкил)-(3-14-членный гетероцикл) (где 1-4 атомов гетероцикла независимо выбраны из N, О и S), и -O(С6-С14-арил). Каждый алкил, алкенил, арил и гетероциклоалкил, описанный выше, необязательно замещены одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси, -OC1-C6-алкила, галогена, -NH2, -(С1-С6-алкил)NH2, -С(O)ОН, CN и оксо.
[0032] Соединения, описанные в настоящем документе, могут существовать в различных изомерных формах, включая конфигурационные, геометрические и конформационные изомеры, включая например цис- или транс- конформации. Указанные соединения могут также существовать в одной или нескольких таутомерных формах, включая как отдельные таутомеры, так и смеси таутомеров. Подразумевается, что термин «изомер» охватывает все изомерные формы соединения согласно настоящему раскрытию, включая таутомерные формы указанного соединения. Соединения согласно настоящему раскрытию могут существовать в открытой и циклизованной формах. В некоторых случаях, одна или несколько циклизованных форм могут являться результатом потери воды. Конкретная композиция открытой и циклизованной форм может зависеть от того, как соединение выделялось, хранилось и вводилось. Например, соединение может существовать преимущественно в открытой форме в кислых условиях, но циклизоваться в нейтральных условиях. Все формы включены в настоящее раскрытие.
[0033] Заместитель -CO2H может быть заменен биоизостерными заменами, такими как:
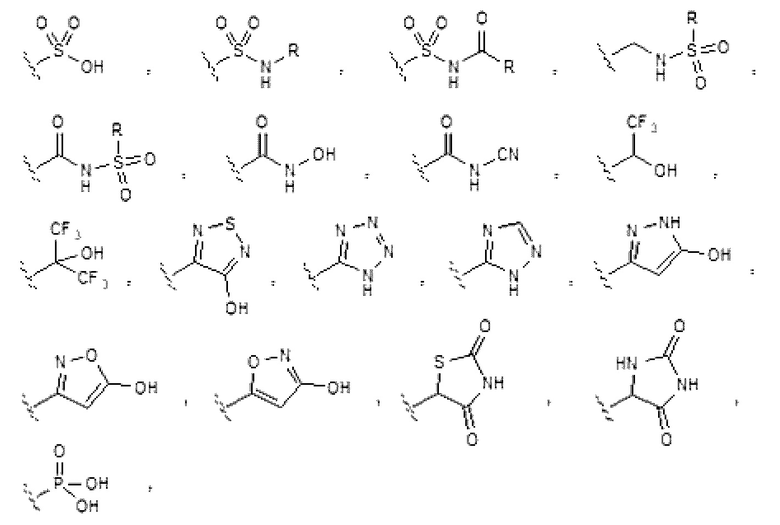
и т.п., где R имеет то же определение, что и определенный в настоящем документе RA (см., например, The Practice of Medicinal Chemistry (Academic Press: New York, 1996), стр. 203).
[0034] Некоторые соединения, описанные в настоящем документе, могут содержать асимметрические центры, а потому существовать в различных энантиомерных и диастереоизомерных формах. Описанное в настоящем документе соединение может находиться в форме оптического изомера или диастереоизомера. Соответственно, настоящее раскрытие охватывает соединения и их применения, описанные в настоящем документе, в форме их оптических изомеров, диастереоизомеров и их смесей, включая рацемическую смесь. Оптические изомеры соединений согласно настоящему раскрытию могут быть получены известными методиками, такими как асимметрический синтез, хиральная хроматография, технология псевдодвижущегося слоя, или посредством химического разделения стереоизомеров путем использования оптически активных расщепляющих агентов.
[0035] Если не указано иное, то термин «стереоизомер» означает один стереоизомер соединения, который по существу свободен от других стереоизомеров этого соединения. Таким образом, стереоизомерно чистое соединение, содержащее один хиральный центр, будет по существу свободно от противоположного энантиомера этого соединения. Стереоизомерно чистое соединение, содержащее два хиральных центра, будет по существу свободно от других диастереоизомеров этого соединения. Типичное стереоизомерно чистое соединение содержит более чем приблизительно 80 масс. % одного стереоизомер а соединения и менее чем приблизительно 20 масс. % других стереоизомеров соединения, например, более чем приблизительно 90 масс. % одного стереоизомера соединения и менее чем приблизительно 10 масс. % других стереоизомеров соединения, или более чем приблизительно 95 масс. % одного стереоизомера соединения и менее чем приблизительно 5 масс. % других стереоизомеров соединения, или более чем приблизительно 97 масс. % одного стереоизомера соединения и менее чем приблизительно 3 масс. % других стереоизомеров соединения, или более чем приблизительно 99 масс. % одного стереоизомера соединения и менее чем приблизительно 1 масс. % других стереоизомеров соединения. Описанный выше стереоизомер может рассматриваться как композиция, содержащая два стереоизомера, которые присутствуют в соответствующих массовых долях, описанных в настоящем документе.
[0036] Если между изображенной структурой и названием, присвоенным данной структуре, существует расхождение, то изображенная структура имеет преимущественную силу. В дополнение, если стереохимия структуры или части структуры не указана, например, жирными или пунктирными линиями, то структуру или часть структуры следует интерпретировать как охватывающую все ее стереоизомеры. Тем не менее в некоторых случаях, когда существует более одного хирального центра, структуры и названия могут быть представлены как отдельные энантиомеры для помощи в описании относительной стереохимии. Специалистам в области органического синтеза будет известно, если соединения получаются в виде отдельных энантиомеров с применением способов, использованных для их получения.
[0037] Если обратное не указано особо, то в контексте настоящего документа термин «соединение» является охватывающим в том смысле, что он охватывает соединение или его фармацевтически приемлемую соль, стереоизомер и/или таутомер. Так, например, соединение формулы (I) или формулы (II) включает в себя фармацевтически приемлемую соль таутомера указанного соединения.
[0038] Соединения
[0039] Согласно различным вариантам осуществления, настоящее раскрытие относится к соединению формулы (I) или формулы (II), или его фармацевтически приемлемой соли:
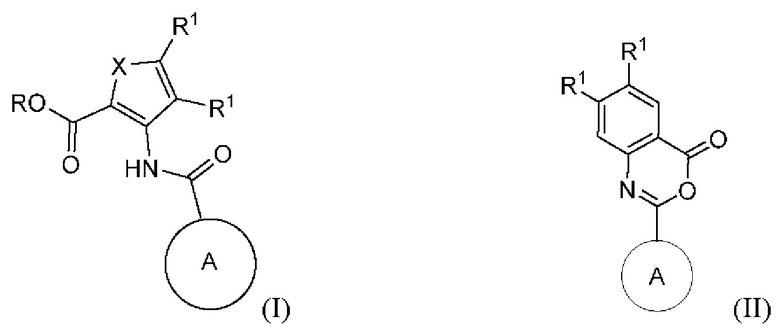
[0040] X представляет собой S, -N=C(R1)- или -C(R1)=C(R1)-.
[0041] Каждый R1 независимо представляет собой Н, F, Cl, C1-С6-алкил, этенил или этинил (каждый из которых может быть замещенным), циано, алкоксил, галогеналкил или С3-С6-циклоалкил.
[0042] Согласно варианту осуществления, оба R1, присоединенных к содержащему X кольцу, вместе с атомами углерода, к которым они присоединены, формируют конденсированный фенил.
[0043] R представляет собой Н, алкил, необязательно замещенный -((C1-C6-алкил)ОС(O)ОС1-С6-алкил), или бензил, где бензил может быть незамещенным или замещенным метоксилом или изостером кислоты или сложного эфира.
[0044] Кольцо А представляет собой бициклическую полностью ароматическую или частично восстановленную гетероарильную кольцевую систему, содержащую 3, 4 или 5 атомов N, замещенную 0, 1, 2, 3 или 4 заместителями, каждый из которых независимо выбран из группы, состоящей из NH2, циано, NHC(=O)O-tBu, ОН, карбоксамидо, C1-C6-алкила, -S(O)2(С1-С6-алкил), -S(O)(С1-С6-алкил), алкилнитрила, алкоксила и галогеналкила. Согласно различным вариантам осуществления, частично восстановленная гетероарильная кольцевая система может быть замещена оксогруппой.
[0045] Согласно дополнительным вариантам осуществления, настоящее раскрытие относится к соединению формулы (I), где X представляет собой S, -N=C(R1)-или -C(R1)=C(R1)-. Каждый R1 независимо представляет собой Н, F, Cl, этенил или этинил (каждый из которых может быть замещенным), циано, алкоксил или галогеналкил. R представляет собой Н, алкил или бензил, где бензил может быть незамещенным или замещенным метоксилом или изостером кислоты или сложного эфира. Кольцо А представляет собой бициклическую полностью ароматическую или частично восстановленную гетероарильную кольцевую систему, содержащую 3, 4 или 5 атомов N, замещенную 0, 1, 2, 3 или 4 заместителями, каждый из которых независимо выбран из группы, состоящей из NH2, циано, NHC(=O)O-tBu,OH, карбоксамидо, алкилнитрила, алкоксила и галогеналкила; при условии, что частично восстановленная гетероарильная кольцевая система может быть замещена оксогруппой.
[0046] Согласно другим вариантам осуществления, настоящее раскрытие относится к соединению формулы (II), описанному выше.
[0047] Согласно различным вариантам осуществления, необязательно в комбинации с любым другим описанным в настоящем документе вариантом осуществления, кольцо А является незамещенным или замещенным, как описано в настоящем документе, и представляет собой кольцо, выбранное из групп, состоящей из:
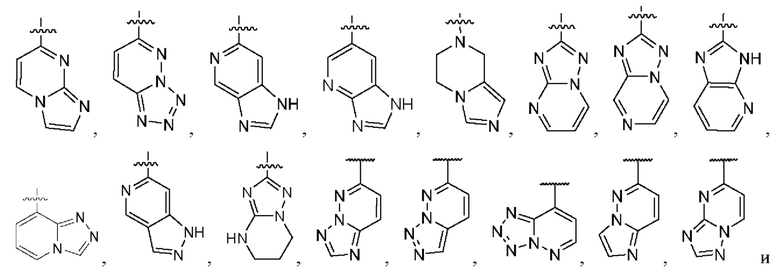
 где волнистая линия указывает на положение связывания.
где волнистая линия указывает на положение связывания.
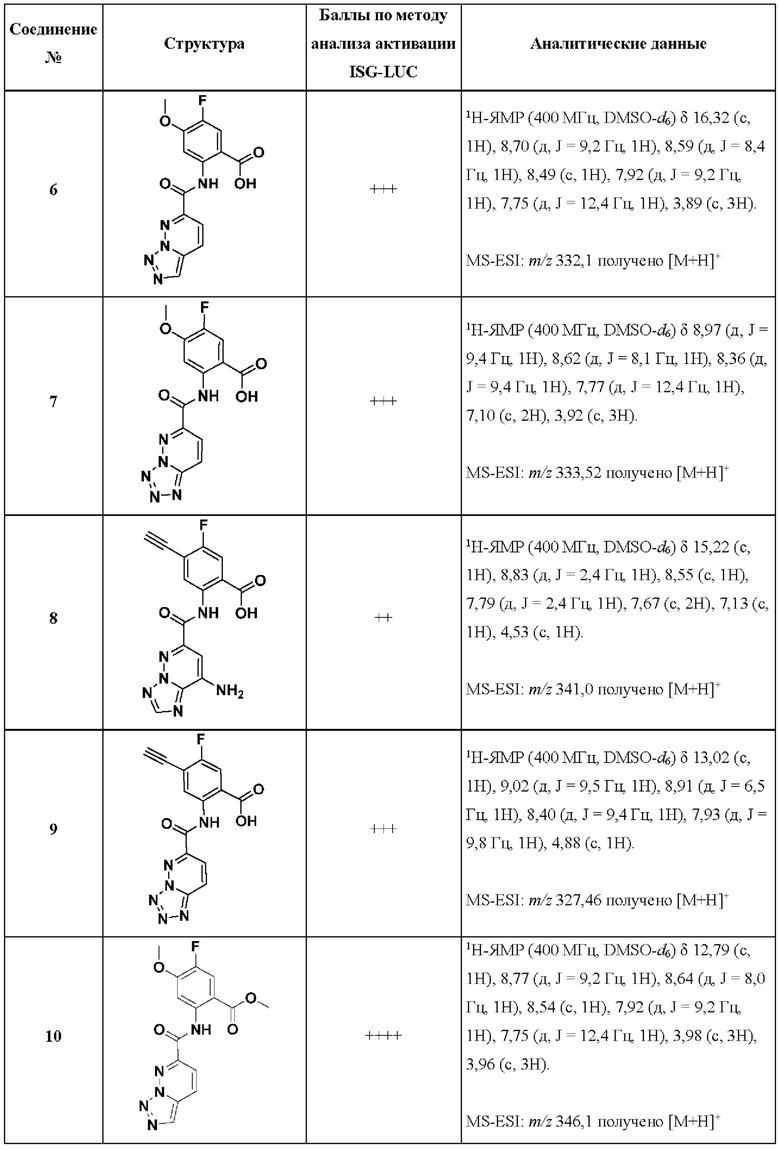
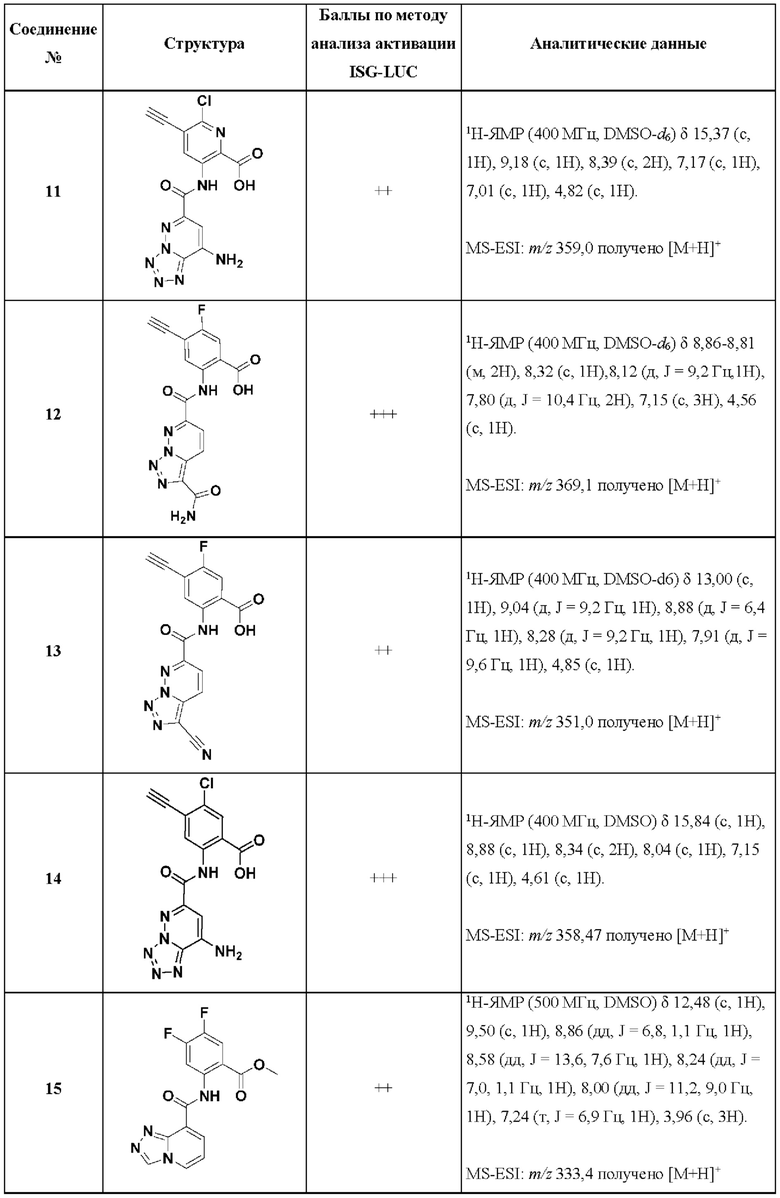
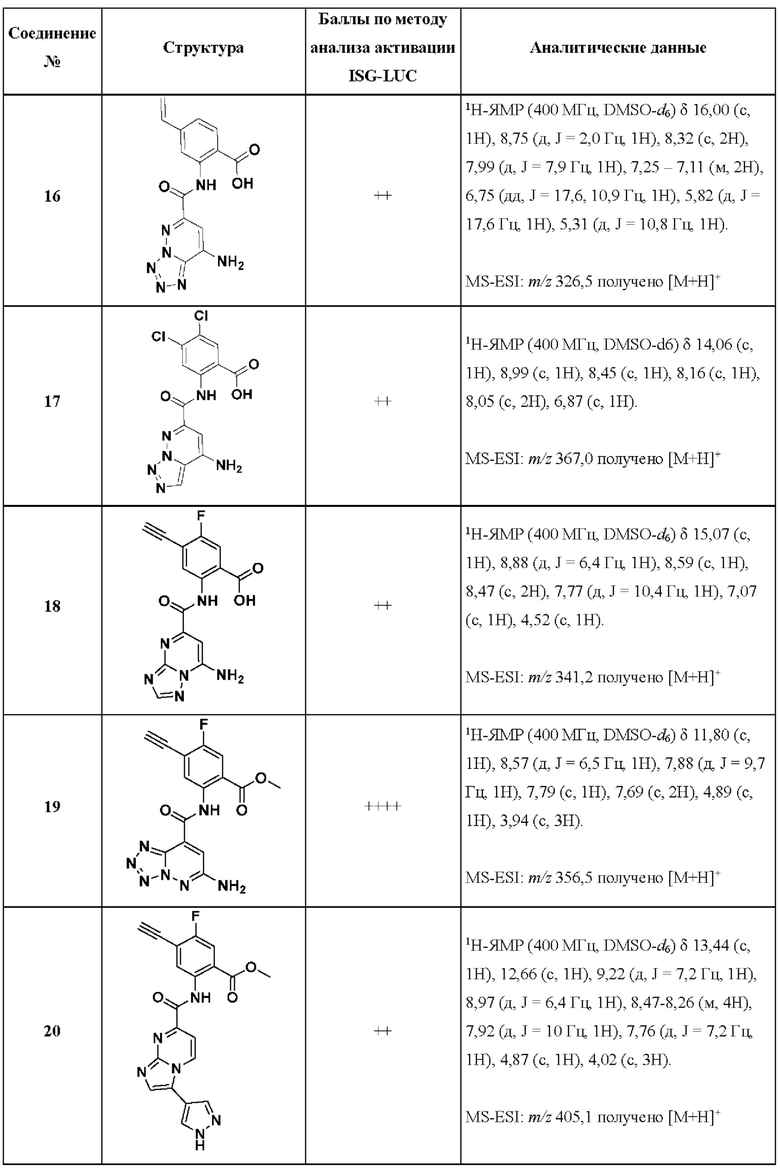
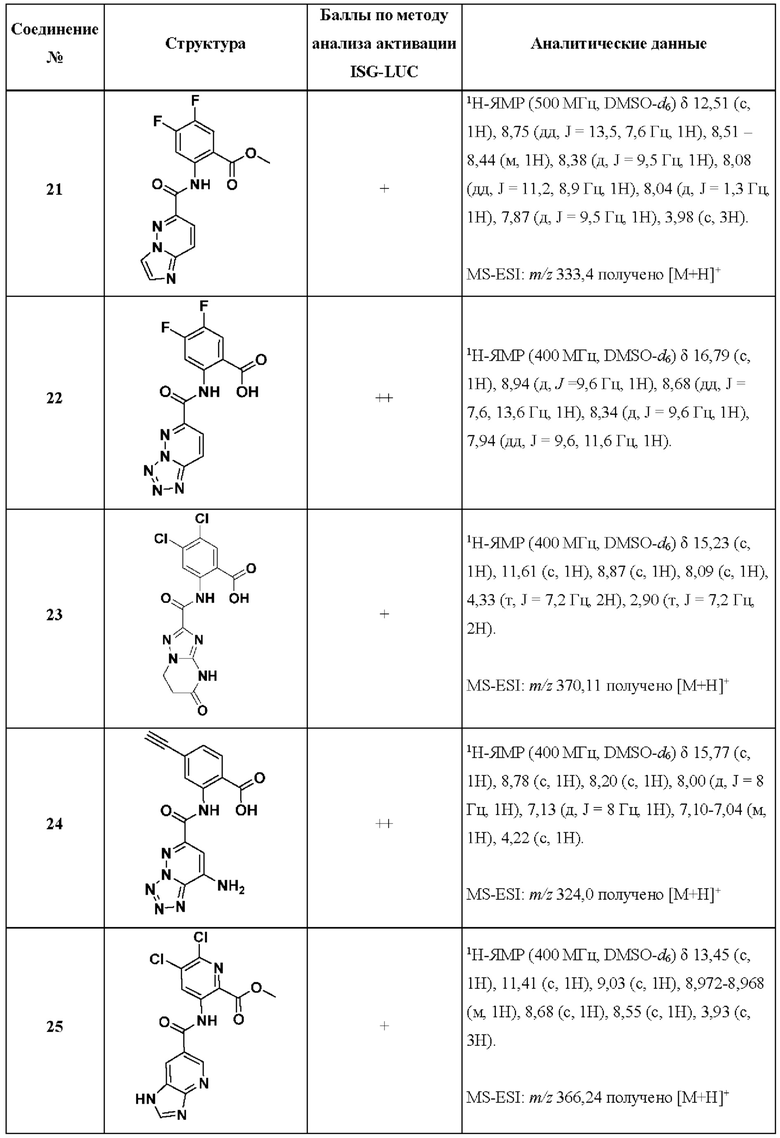
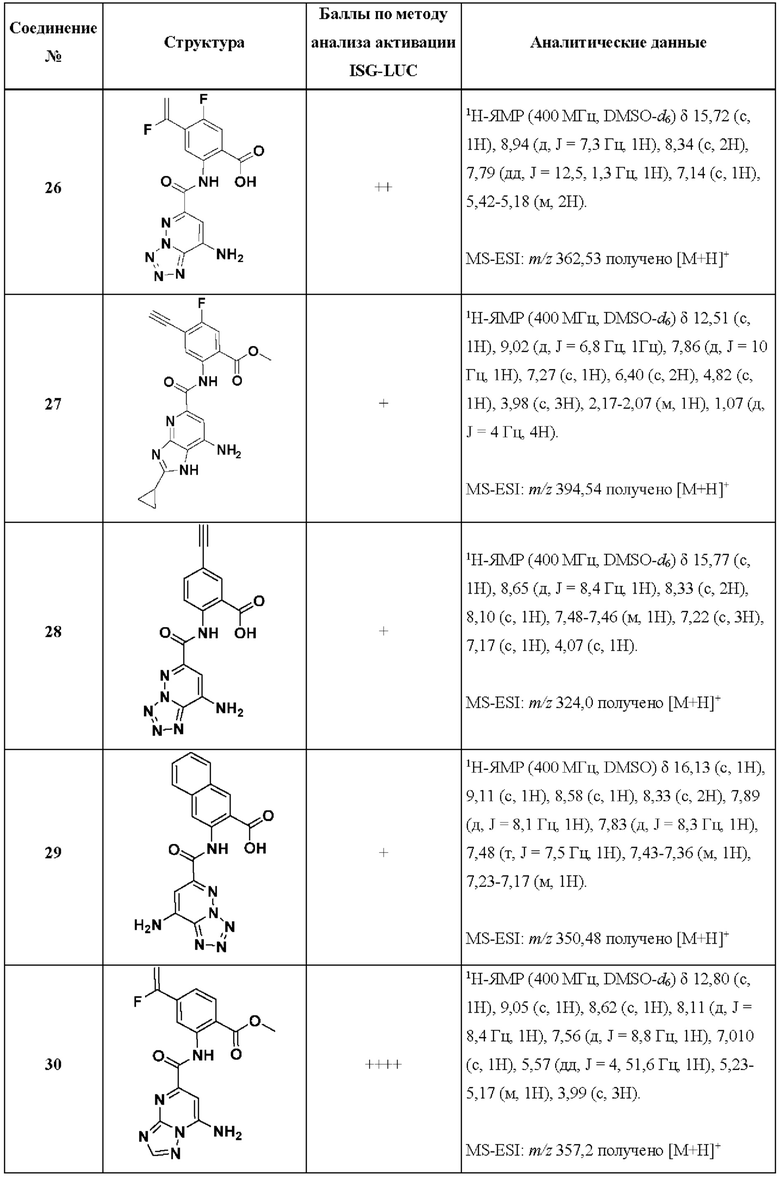
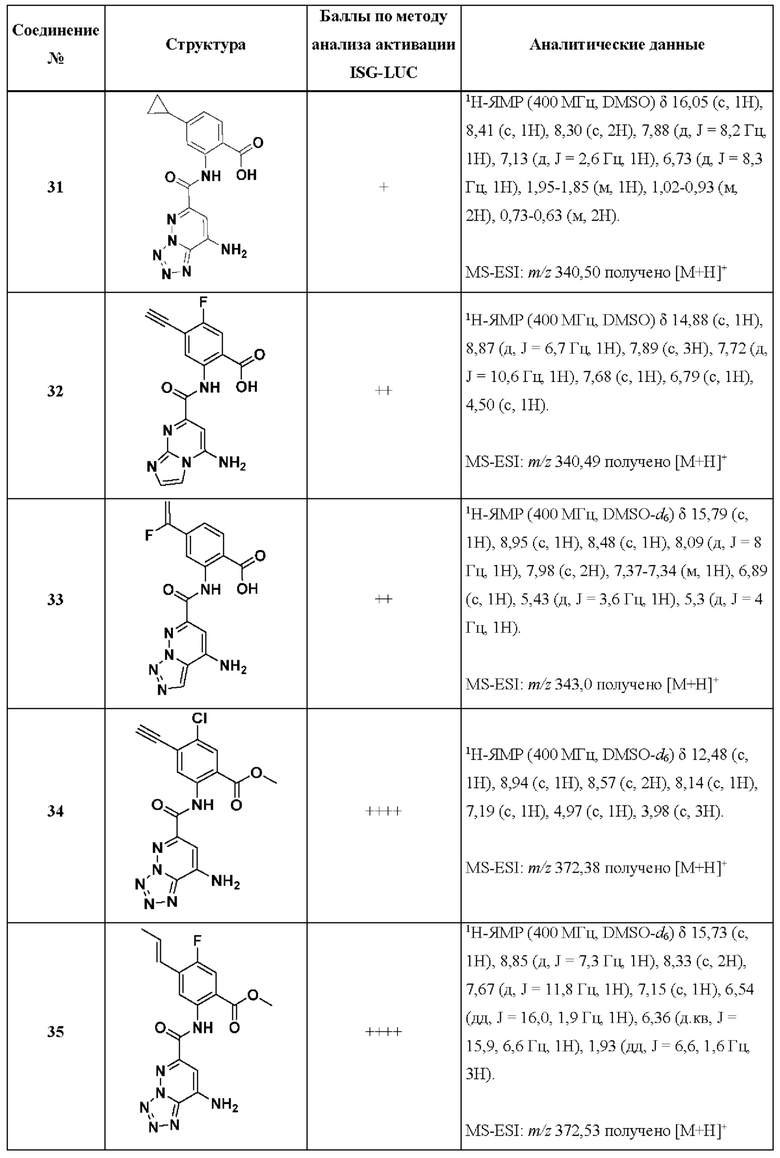
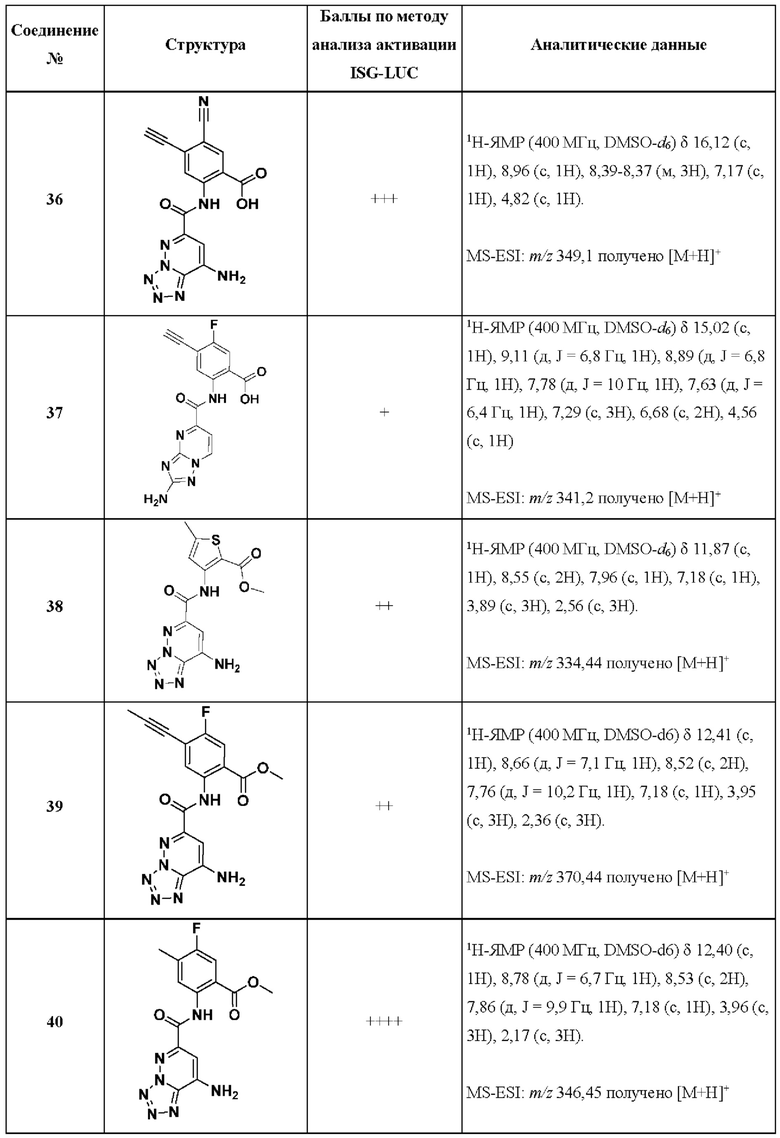
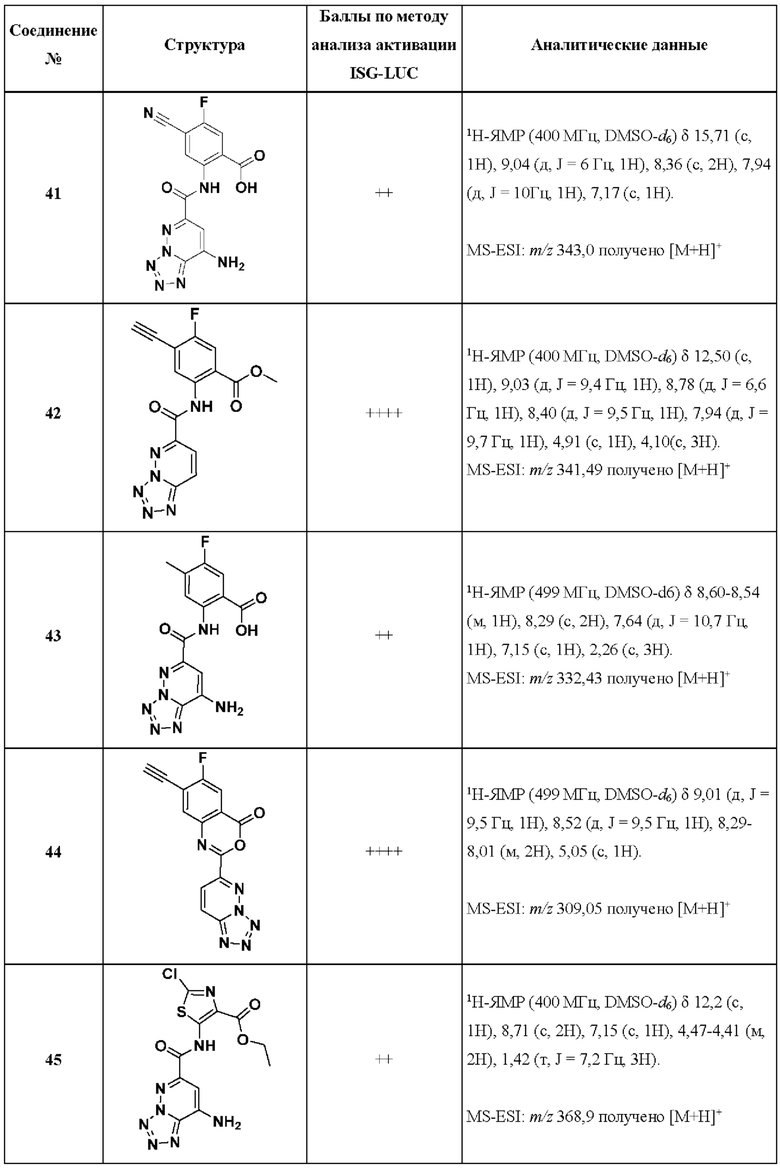
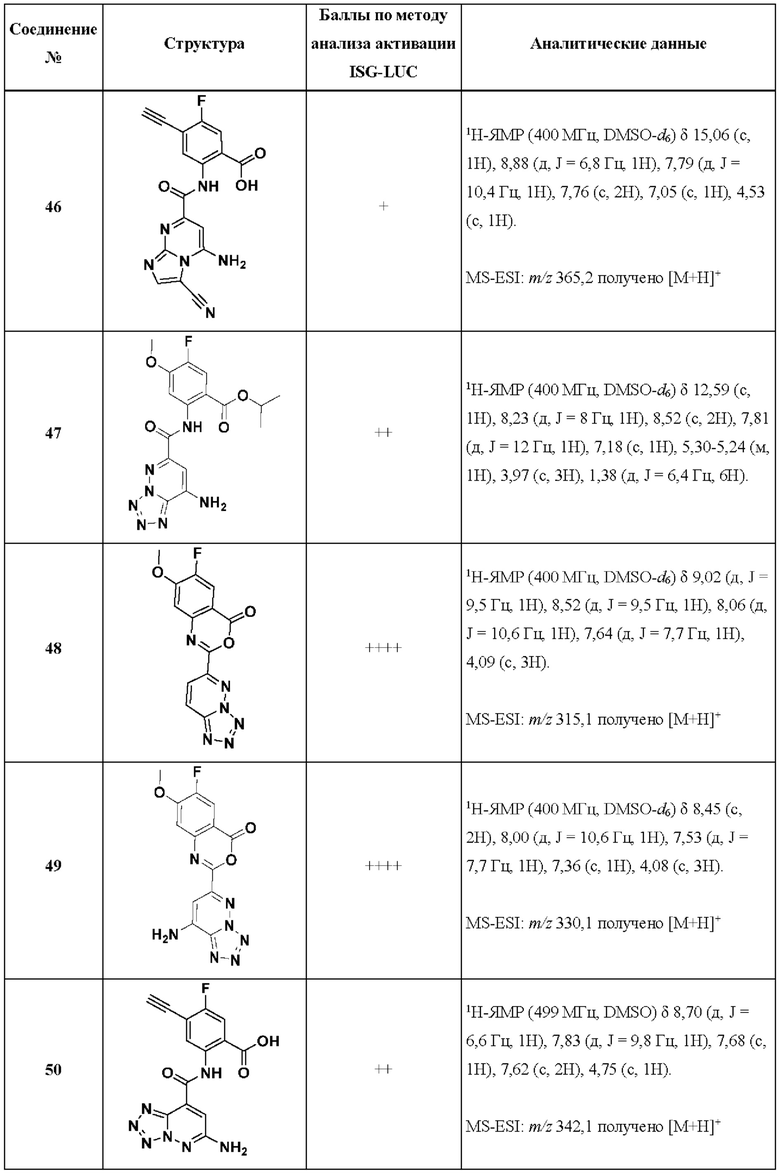
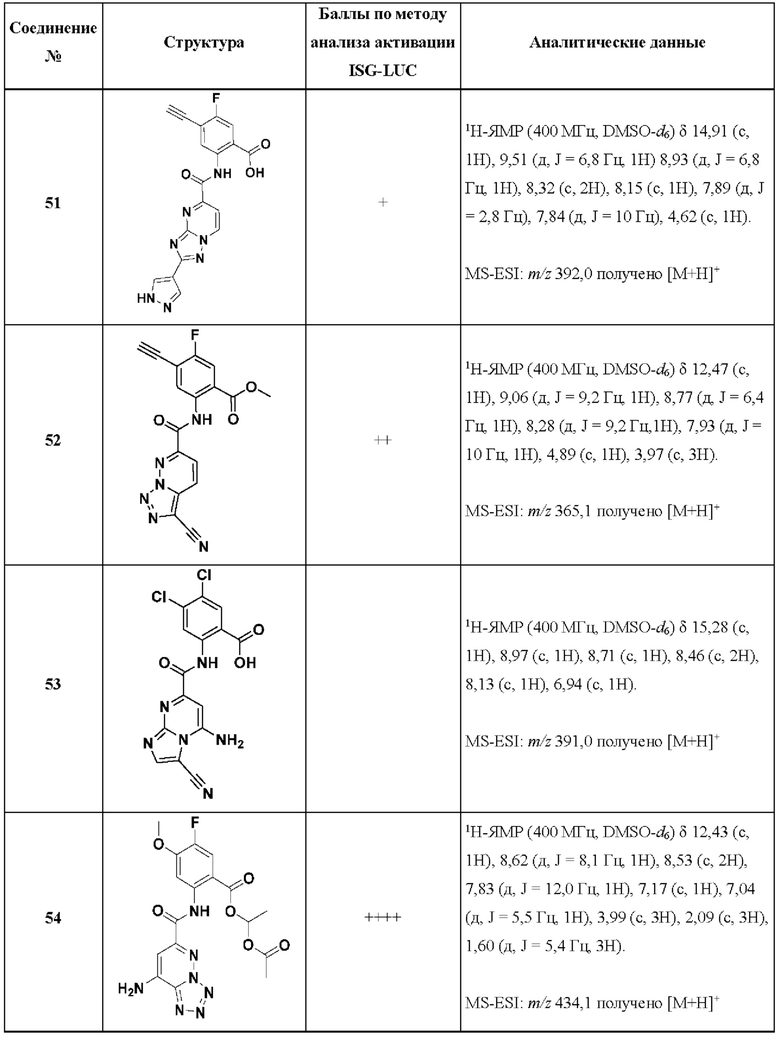
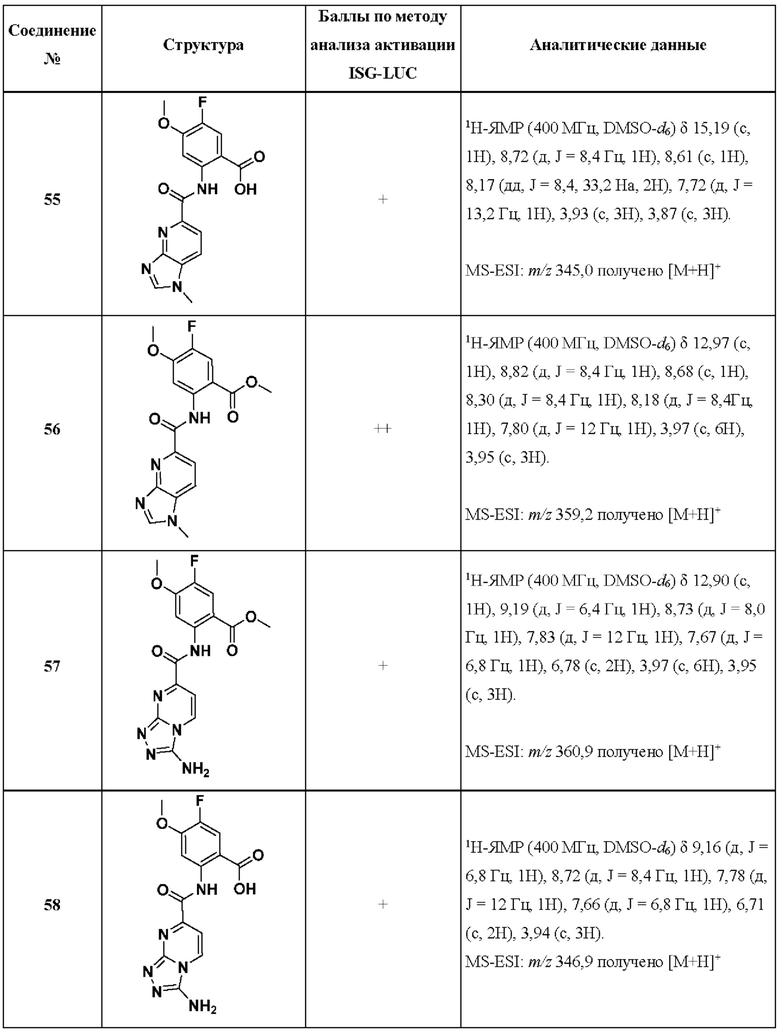
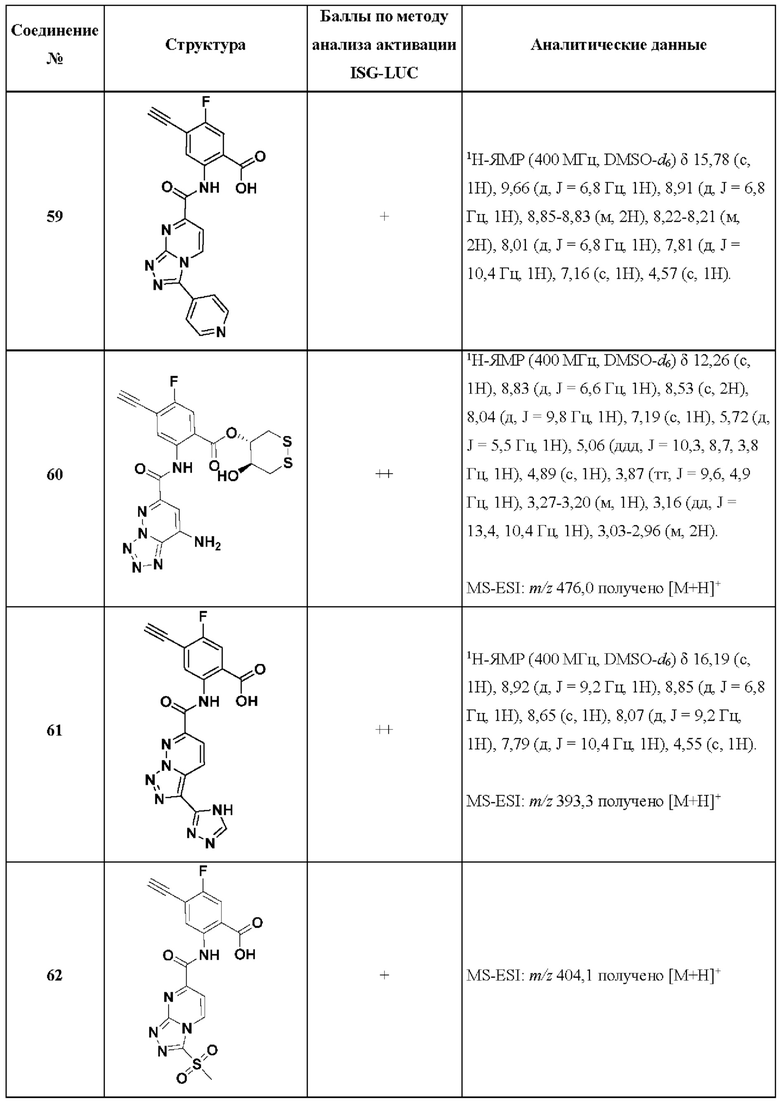
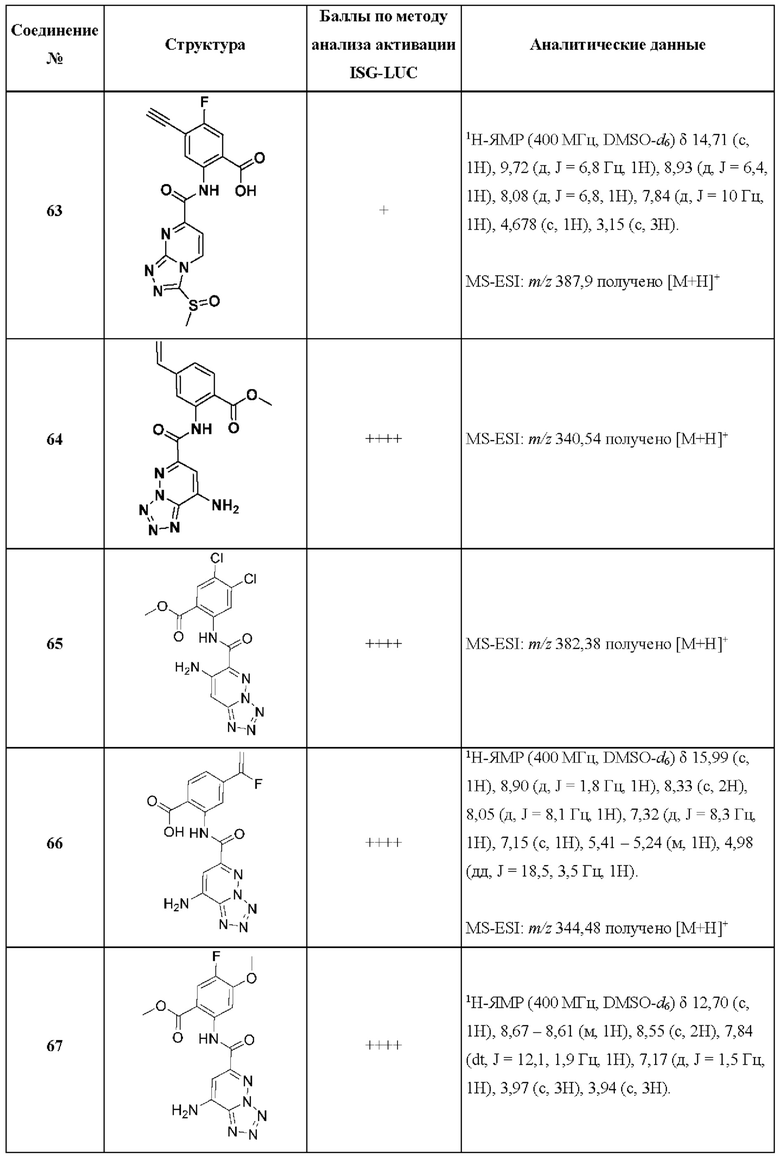
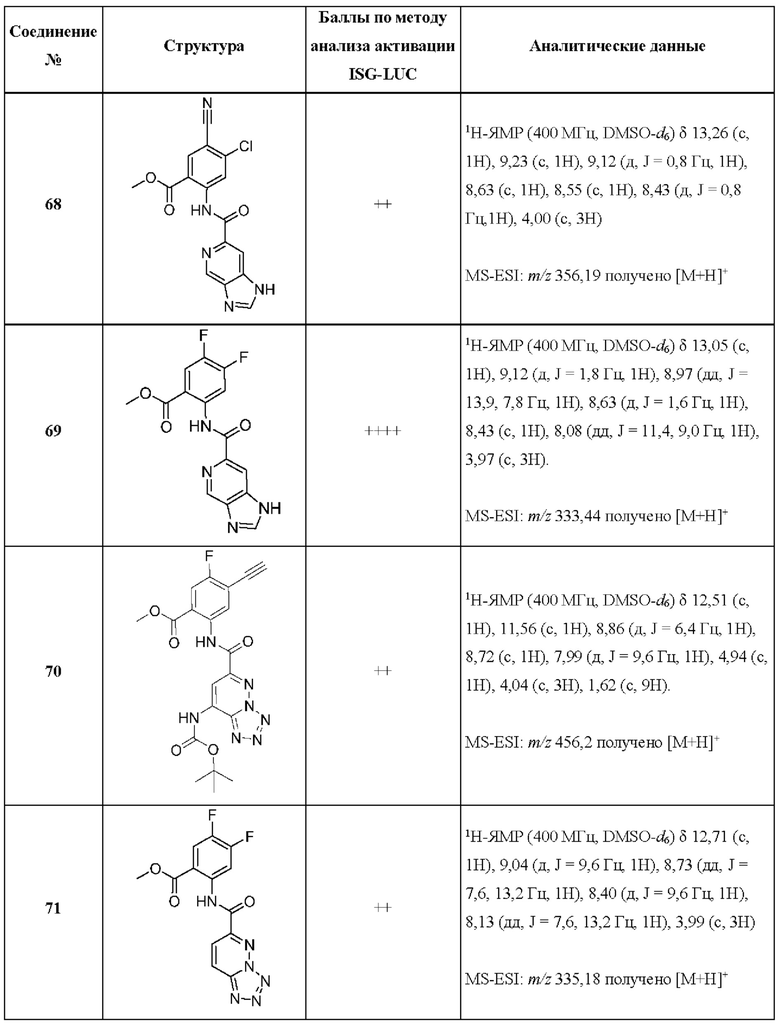
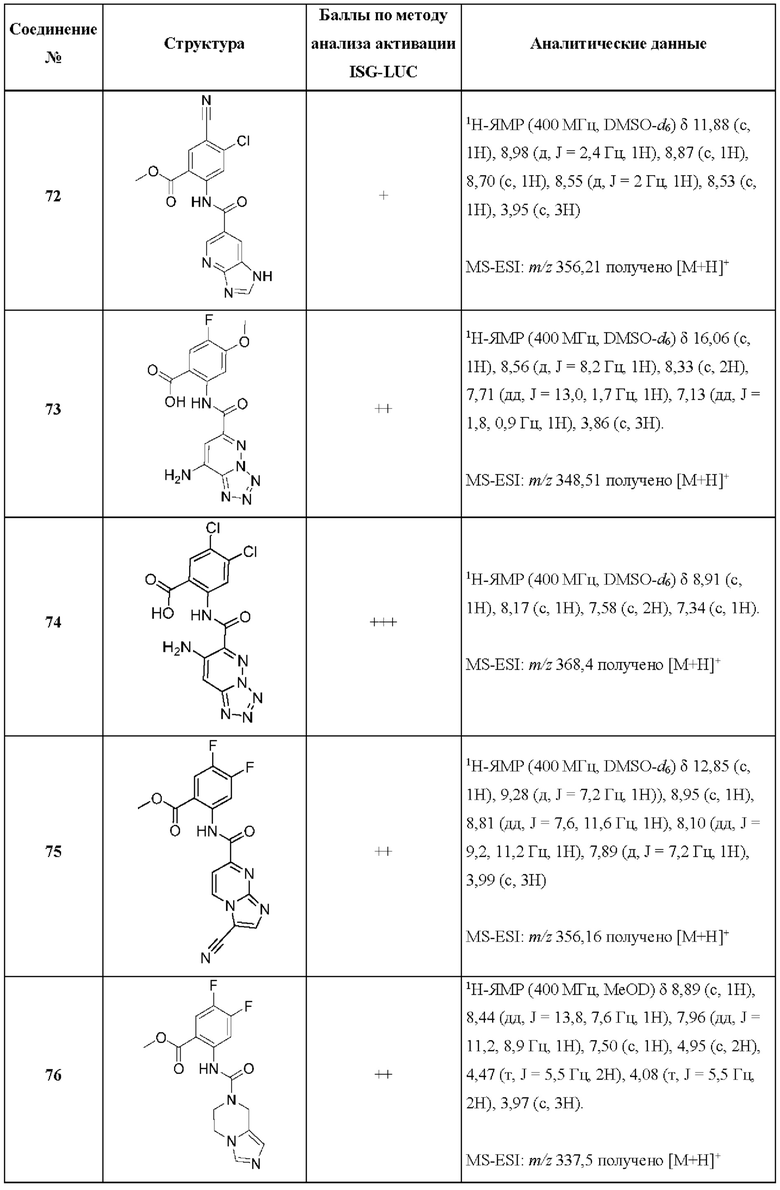
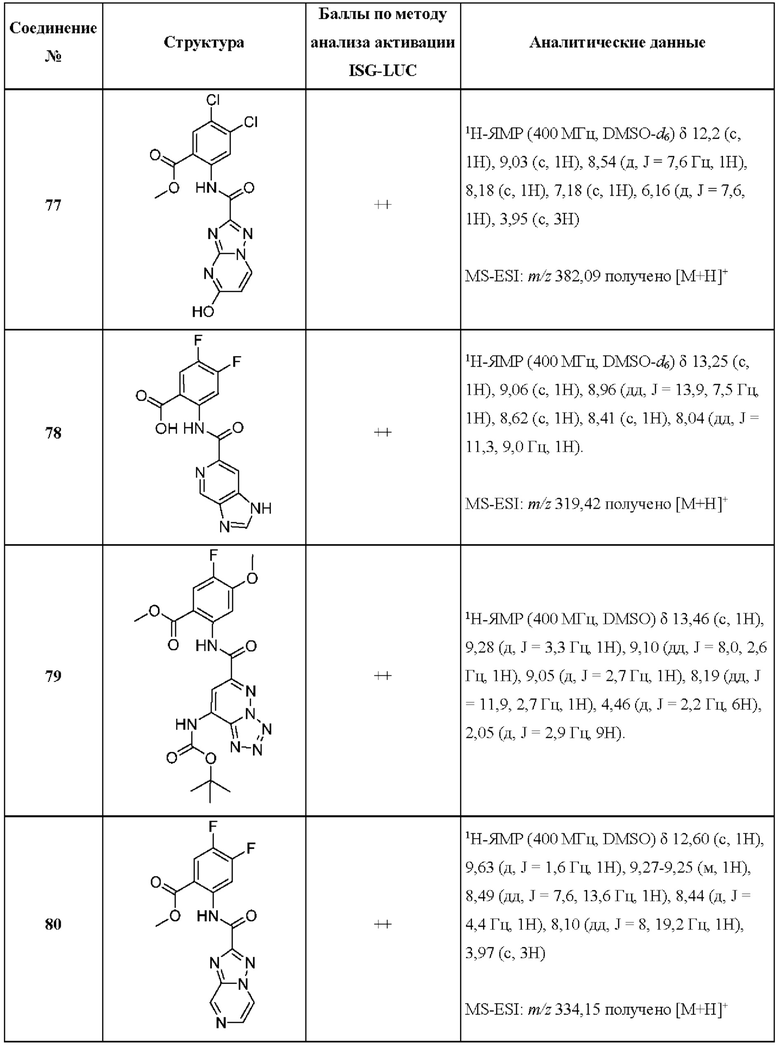
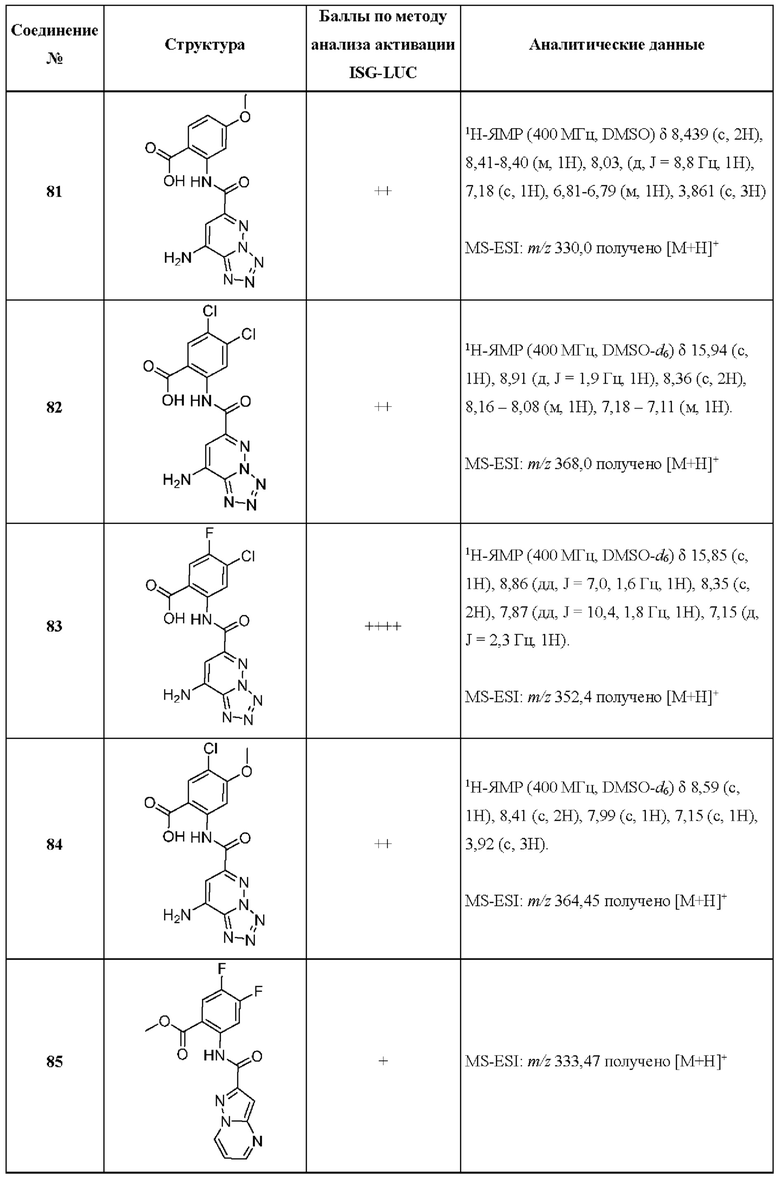
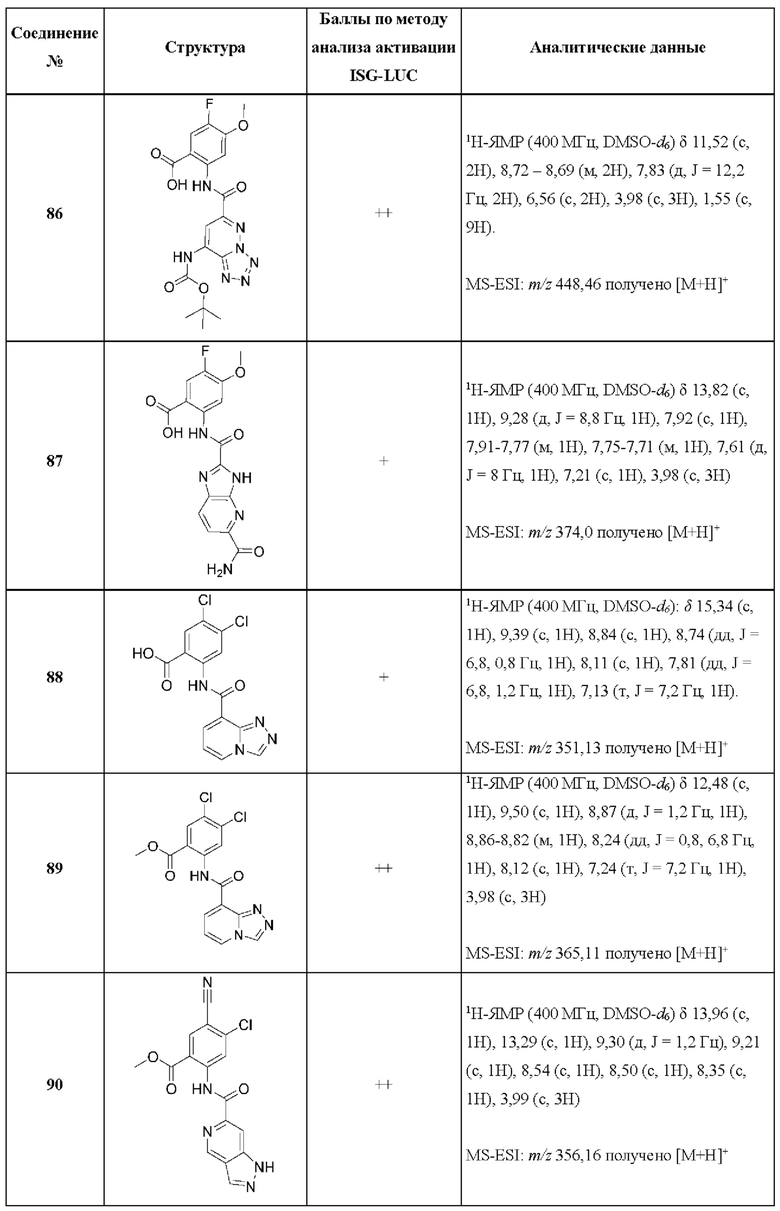
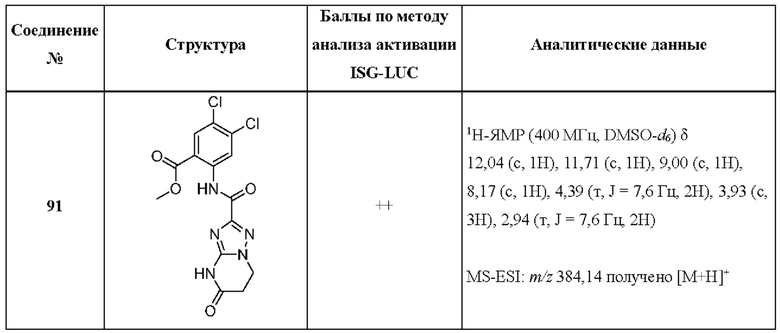
[0048] Согласно дополнительным вариантам осуществления, настоящее раскрытие относится к конкретным примерам соединений формулы (I) и формулы (II), и их фармацевтически приемлемым солям, представленным ниже в Таблице 1. Соединения представлены с указанием бальной оценки активности, отчасти полученной на основании данных анализа активации ISG-LUC, описанного в настоящем документе, и физико-химических данных охарактеризации.
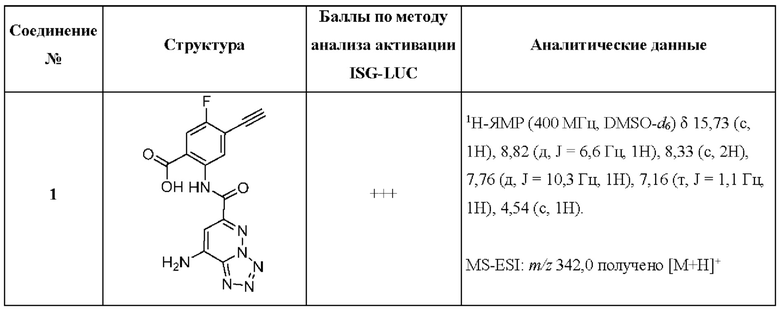
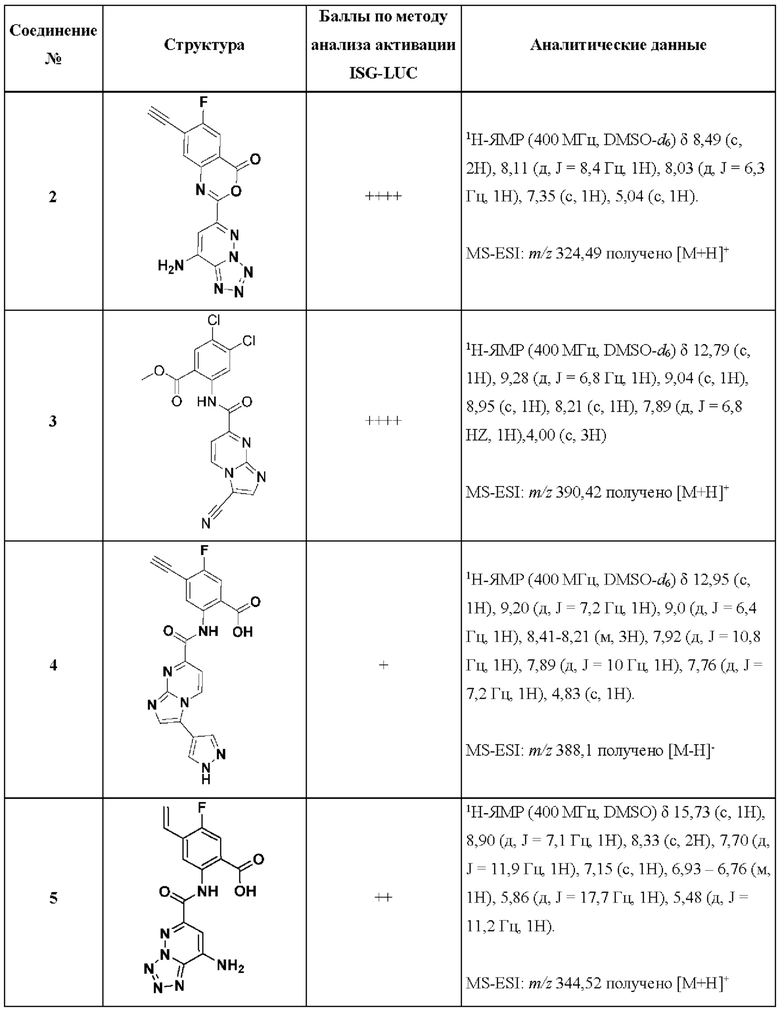
[0049] Таблица 1: Конкретные соединения и бальные оценки. Бальные оценки основаны на данных по действенности и эффективности (+ = ЕС50>20000 нМ; ++ = активно, но менее действенно и эффективно, чем соединение сравнения (ЕС50>1000 нМ); +++ = активность сравнима с соединением сравнения (ЕС50<3000 нМ); ++++ = более действенно и/или эффективно, чем соединение сравнения (ЕС50<900 нМ)).
[0050] Документы по теме:
[1] Corrales L, Glickman LH, McWhirter SM, Kanne DB, Sivick KE, Katibah GE, Woo SR, Lemmens E, Banda T, Leong JJ, Metchette K, Dubensky TW Jr, Gajewski TF. (2015) Direct Activation of STING in the Tumor Micro environment Leads to Potent and Systemic Tumor Regression and Immunity. CellRep.11: 1018-30.
[2] Deng, L. et al. (2014) STING-Dependent Cytosolic DNA Sensing Promotes Radiation-Induced Type I Interferon-Dependent Antitumor Immunity in Immunogenic Tumors, Immunity. 41: 843.
[3] Corrales L, Matson V, Flood B, Spranger S, Gajewski TF. (2017) Innate immune signaling and regulation in cancer immunotherapy. Cell Res. 27: 96-108.
[4] Corrales L, McWhirter SM, Dubensky TW Jr, Gajewski TF. (2016) The host STING pathway at the interface of cancer and immunity. J Clin Invest. 126: 2404-11.
[0051] Способы применения
[0052] Согласно варианту осуществления, настоящее раскрытие также относится к способу стимулирования экспрессии генов интерферона у пациента-человека. Указанный способ включает в себя введение пациенту эффективной дозы соединения или его фармацевтически приемлемой соли, описанных в настоящем документе.
[0053] Согласно другому варианту осуществления, настоящее раскрытие относится к способу лечения опухоли у пациента. Указанный способ включает в себя введение пациенту эффективной дозы соединения или его фармацевтически приемлемой соли.
[0054] Применительно к комбинированным видам терапии, включающим в себя введение соединения согласно настоящему раскрытию и лекарственного средства, нацеленного на контрольную точку иммунного ответа, или к комбинированным видам терапии для потенциирования терапевтических подходов на основе применения ионизирующего облучения и существующих видов химиотерапии, таких как химиотерапия на основе повреждения ДНК, агонисты STING согласно настоящему раскрытию могут дополнять и потенциировать эффекты указанных известных терапевтических подходов. Это основывается на недавних документах, указывающих на ключевую роль STING-зависимого опосредованного микроядрами устранения опухоли с использованием указанных подходов (см., например:
[5] Mackenzie, K.F., et al., (2017), cGAS surveillance of micronuclei links genome instability to innate immunity, Nature, 548, 461.
[6] Wang, W. et al., (2016), Effector T Cells Abrogate Stroma-Mediated Chemoresistance in Ovarian Cancer, Cell, 165, 1092-1105.
[7] Charlotte E. Ariyan, et al., January 16, 2018; DOI: 10.1158/2326-6066, Robust antitumor responses result from local chemotherapy and CTLA-4 blockade, cancerimmunolres.aacrjournals.org on January 31, 2018.
[8] Chung Kil Song, et al., www.moleculartherapy.org vol. 15 no. 8 aug. 2007, Chemotherapy Enhances CD8+ T Cell-mediated Antitumor Immunity Induced by Vaccination With Vaccinia Virus).
[0055] Соединения согласно настоящему раскрытию могут применяться в терапевтических комбинациях с введением эффективной дозы лекарственного средства, нацеленного на контрольную точку иммунного ответа. Например, лекарственное средство, нацеленное на контрольную точку иммунного ответа, может представлять собой анти-PD-L1 антитело, анти-PD-1 антитело, анти-CTLA-4 антитело или анти-4-1ВВ антитело (см., например:
[9] Ager, CR, et al., (2017) Cancer Immunol Res; 5(8), 676.
[10] Fu, J. et al. (2015) Sci Transl Med. 2015 April 15; 7(283): 283ra52. doi: 10.1126/scitranslmed.aaa4306.
[11] Wang, H., et al. (2017) PNAS, February 14, 2017, vol. 114, no. 7, 1637-1642).
[0056] Фармацевтическая композиция
[0057] Согласно другому варианту осуществления, настоящее раскрытие относится к фармацевтический композиции, содержащей соединение или его фармацевтически приемлемую соль, описанные в настоящем документе, в сочетании с фармацевтически приемлемым носителем или вспомогательным веществом.
[0058] Композиции согласно настоящему раскрытию могут вводиться перорально, местно, парентерально, посредством ингаляции или спрея или ректально в виде стандартных лекарственных форм. В контексте настоящего документа термин «парентерально» включает в себя подкожные инъекции, внутривенные, внутримышечные, интрастернальные инъекции или инфузионные методики.
[0059] Подходящие пероральные композиции, описанные в настоящем документе, включают в себя без ограничения таблетки, пастилки, леденцы, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсию, твердые или мягкие капсулы, сиропы или эликсиры.
[0060] Композиции согласно настоящему раскрытию, которые подходят для перорального применения, могут быть приготовлены в соответствии с любым способом, известным в области производства фармацевтических композиций. Например, жидкие лекарственные формы соединений согласно настоящему раскрытию содержат одно или несколько средств, выбранных из группы, состоящей из подсластителей, вкусоароматизаторов, красителей и консервантов, с целью обеспечения фармацевтически приемлемых препаратов соединения или его фармацевтически приемлемой соли.
[0061] Для таблетированных композиций, соединение или его фармацевтически приемлемую соль в смеси с нетоксичными фармацевтически приемлемыми вспомогательными веществами используют для производства таблеток. Примеры таких вспомогательных веществ включают в себя без ограничения инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция и фосфат натрия; гранулирующие средства и разрыхлители, например, кукурузный крахмал или альгиновая кислота; связующие вещества, например, крахмал, желатин или акация, и лубриканты, например, стеарат магния, стеариновая кислота или тальк. Таблетки могут не иметь покрытия, или на них может быть нанесено покрытие посредством известных методик нанесения покрытия для отсрочивания разрыхления и всасывания в желудочно-кишечном тракте, а потому для обеспечения замедленного терапевтического действия в течение желаемого периода времени. Например, может быть использовано вещество для задержки во времени, такое как глицерилмоностеарат или глицерилдистеарат.
[0062] Составы для перорального применения могут быть представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например, с карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой, например, с арахисовым маслом, жидким парафином или оливковым маслом.
[0063] Для водных суспензий соединение или его фармацевтически приемлемую соль смешивают с вспомогательными веществами, подходящими для поддержания стабильной суспензии. Примеры таких вспомогательных веществ включают в себя без ограничения карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидропропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и камедь акации.
[0064] Пероральные суспензии также могут содержать средства, способствующие диспергированию, или увлажнители, такие как встречающийся в природе фосфатид, например, лецитин, или продукты конденсирования алкиленоксида с жирными кислотами, например, полиоксиэтиленстеарат, и продукты конденсирования этиленоксида с длинноцепочечными алифатическими спиртами, например, гептадекаэтиленоксицетанол, или продукты конденсирования этиленоксида с неполными сложными эфирами, полученными из жирных кислот и гексита, такие как полиоксиэтиленсорбитмоноолеат, или продукты конденсирования этиленоксида с неполными сложными эфирами, полученными из жирных кислот и ангидридов гексита, например полиэтиленсорбитан-моноолеат. Водные суспензии также могут содержать один или несколько консервантов, например, этил- или н-пропил- пара-гидроксибензоат, один или несколько красителей, один или несколько вкусоароматизаторов и один или несколько подсластителей, таких как сахароза или сахарин.
[0065] Масляные суспензии могут быть составлены путем суспендирования соединения или его фармацевтически приемлемой соли в растительном масле, например, в арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например, пчелиный воск, твердый парафин или цетиловый спирт.
[0066] Для получения приятных на вкус пероральных препаратов могут быть добавлены подсластители, такие как представленные выше, и вкусоароматизаторы. Указанные композиции могут быть сохранены путем добавления антиоксиданта, такого как аскорбиновая кислота.
[0067] Диспергируемые порошки и гранулы, подходящие для приготовления водной суспензии путем добавления воды, предоставляют соединение или его фармацевтически приемлемую соль в смеси со средством, способствующим диспергированию, или увлажнителем, средством, способствующим суспендированию, и одним или несколькими консервантами. Подходящие средства, способствующие диспергированию, или увлажнители и средства, способствующие суспендированию, проиллюстрированы средствами, уже упомянутыми выше. Также могут присутствовать дополнительные вспомогательные вещества, например, подсластители, вкусоароматизаторы и красители.
[0068] Фармацевтические композиции согласно настоящему раскрытию также могут быть в форме эмульсий типа «масло-в-воде». Масляная фаза может представлять собой растительное масло, например, оливковое масло или арахисовое масло, или минеральное масло, например, жидкий парафин, или их смеси. Подходящие эмульгаторы могут представлять собой встречающиеся в природе камеди, например, камедь акации или трагакантовую камедь, встречающиеся в природе фосфатиды, например, сою, лецитин и сложные эфиры или неполные сложные эфиры, полученные из жирных кислот и гексита, ангидридов, например, сорбитанмоноолеат, и продукты реакции конденсации упомянутых неполных сложных эфиров с этиленоксидом, например, полиоксиэтиленсорбитан-моноолеат. Эмульсии также могут содержать подсластители и вкусоароматизаторы.
[0069] Сиропы и эликсиры могут быть составлены с подсластителями, например, с глицерином, пропиленгликолем, сорбитом или сахарозой. Такие составы также могут содержать успокаивающее средство, консерванты и вкусоароматизаторы, и красители. Фармацевтические композиции могут находиться в форме стерильной инъекции, водной суспензии или масляной суспензии. Такая суспензия может быть составлена в соответствии с известным уровнем техники применения подходящих средств, способствующих диспергированию, или увлажнителей и средств, способствующих суспендированию, которые были упомянуты выше. Стерильный инъекционный препарат также может представлять собой стерильный инъекционный раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. В числе приемлемых несущих сред и растворителей, которые могут быть использованы, присутствуют вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или среды для суспендирования традиционно используются стерильные жирные масла. С этой целью может быть использовано любое легкое жирное масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, находят свое применение в приготовлении инъекционных препаратов.
[0070] Соединение или его фармацевтически приемлемую соль также может вводиться в форме суппозиториев для ректального введения. Такие композиции могут быть приготовлены путем смешивания соединения с подходящим не вызывающим раздражения вспомогательным веществом, которое является твердым при обычных температурах, но жидким при ректальной температуре, а потому будет разжижаться в прямой кишке с высвобождением соединения. Иллюстративные вспомогательные вещества включают в себя масло какао и полиэтиленгликоли.
[0071] Композиции для парентерального введения вводят в стерильной среде. В зависимости от используемой несущей среды и концентрации соединения или его фармацевтически приемлемой соли в составе, парентеральный состав может находиться как в виде суспензии, так и раствора, содержащего растворенное соединение. В парентеральные композиции также могут быть добавлены адъюванты, такие как местные анестетики, консерванты и буферные средства.
[0072] Примеры
[0073] Культура тканей. Если не указано иное, то клетки THP-l-Lucia ISG дикого типа (кат. № thpl-isg) и STING КО (кат. № thpd-kostg) приобретали у Invivogen и поддерживали в питательной среде, состоящей из RPMI 1640, 2 мМ L-глутамина, 25 мМ HEPES, 10% термоинактивированной фетальной бычьей сыворотки (FBS), 1000 ед/мл пенициллина, 1000 мкг/мл стрептомицина, 0,25 мкг/мл амфотерицина В и 100 мкг/мл зеоцина.
[0074] Вещества, стимулирующие интерферон 1 типа. Poly(dA:dT) и 2'3'-cGAMP приобретали у Invivogen и ресуспендировали в соответствии с инструкциями пр оиз водителя.
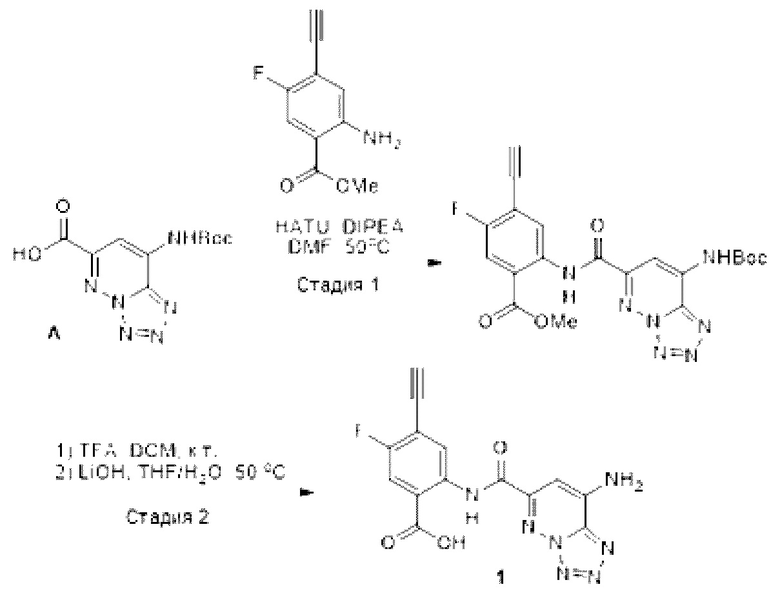
[0075] ISRE-люциферазный метод анализа. Клетки ТНР-1 Lucia ISG ресуспендировали в питательной среде с низким содержанием сыворотки (2% FBS) с плотностью 5×105 клеток на мл, и обрабатывали тестируемым соединением или несущей средой (DMSO). В каждую лунку 384-луночных планшетов производства Greiner высевали 50 мкл клеток, и инкубировали в течение 24 часов. Для оценки экспрессии люциферазного репортера в каждую лунку добавляли 30 мкл реагента для выявления Quanti-luc (Invivogen), и считывали люминесценцию с использованием планшетного ридера Envision (Perkin Elmer) с установленным временем интегрирования в 0,1 секунды.
[0076] Анализ жизнеспособности. Клетки ресуспендировали в питательной среде с низким содержанием сыворотки с плотностью 5×105 клеток на мл, и обрабатывали тестируемым соединением или несущей средой (DMSO). В каждую лунку 384-луночных планшетов производства Greiner высевали 50 мкл клеток, и инкубировали в течение 24 часов. Для оценки экспрессии люциферазного репортера в каждую лунку добавляли 30 мкл реагента для выявления CellTiter-Glo (Promega), и определяли люминесценцию с использованием планшетного ридера Envision с установленным временем интегрирования в 0,1 секунды.
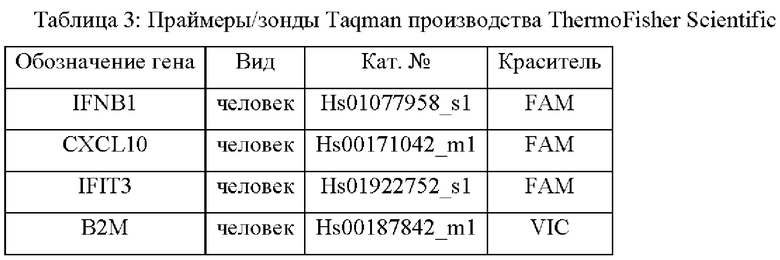
[0077] Вестерн-блот. Клетки солюбилизировали в 1× протеолитическом буфере (25 мМ HEPES, рН 7,4, 300 мМ NaCl, 1,5 мМ MgCl2, 1 мМ EGTA, 1% Р-40, 1% дезоксихолат натрия, 2,5 мМ пирофосфат натрия, 1 мМ глицерофосфат) со свежедобавленными ингибиторами протеаз и фосфатаз (Cell Signaling). Вестерн-блоттинг проводили с использованием гелей Bolt™ 4-12% Бис-Трис и мини-системы для переноса Bolt™, следуя инструкциям производителя (ThermoFisher Scientific). Антитела к STING и γ-тубулину приобретали у Cell Signaling, разбавляли содержащим 5% BSA 1× буфером TBS-T (Таблица 3). Антитело к HRP кролика разбавляли содержащим 5% обезжиренное сухое молоко 1× буфером TBS-T, и визуализировали сигнал люминесценции с использованием ChemiDoc Imager (BioRad).
[0078] Полуколичественная PCR в режиме реального времени (qPCR). Клетки ТНР-1 ресуспендировали в питательной среде с низким содержанием сыворотки с плотностью 5×105 клеток на мл, и обрабатывали тестируемым соединением или несущей средой (DMSO). В каждую лунку 6-луночного планшета высевали 2,5 мл клеток, и инкубировали в течение 24 часов. RNA изолировали с использованием набора RNeasy Plus Mini (Qiagen), и подвергали 1 мкг очищенной RNA обратной транскрипции с получением cDNA (VILO, кат. №11755050, ThermoFisher Scientific). Экспрессию генов оценивали с использованием праймеров Taqman и зондов, перечисленных в Таблице 4, на Taqman Universal Mix II (кат. №4440038, ThermoFisher), следуя инструкциям производителя. Экспрессию генов нормировали с использованием метода дельта-дельта-Ct, и приводили в виде кратности изменения экспрессии.
[0079] Анализ теплового сдвига STING (TSA). Экспрессировали с-концевые домены (CTD) STING человека и мыши и очищали их, как подробно описано ранее (Ouyang, S., Song, X., Wang, Y., Ru, FL, Shaw, N., Jiang, Y., Niu, F., Zhu, Y., Qiu, W., Parvatiyar, K., et al. (2012). Structural analysis of the STING adaptor protein reveals a hydrophobic dimer interface and mode of cyclic di-GMP binding. Immunity 36, 1073-1086.). К белку STING (0,22 мг/мл), разбавленному 1× буфером Protein Thermal Shift, представленном в наборе Protein Thermal Shift Dye (кат. №4461146, ThermoFisher Scientific), добавляли тестируемое соединение или контроль с несущей средой. Добавляли краситель Thermal Shift, и проводили регистрацию кривой плавления, следуя параметрам, описанным для набора красителя. Температуры плавления (Tm) рассчитывали с использованием метода производных с использованием программного обеспечения Protein Thermal Shift v1.3 (кат. №4466038, ThermoFisher Scientific).
[0080] Анализ связывания STING дикого типа (Cisbio, кат. №64BDSTGPEH). Формат метода анализа оптимизировали для демонстрации связывания рекомбинантного 6× His-меченого белка STING человека, меченого криптатом тербия, природным лигандом 2'3'cGAMP, меченым d2 (акцептор). После сближения двух красителей, возбуждение донора импульсной лампой в планшетном ридере PHERAstar FSX инициирует резонансный перенос энергии флуоресценции (FRET) на акцептор, который, в свою очередь, флуоресцирует при 665 нм. Для оценки способности синтетических низкомолекулярных лигандов STING связываться с STING человека проводили анализа в конкурентном формате. Образцы для титрования по 10 точкам для каждого из синтетических лигандов в 5 мкл перемещали в 384-луночный планшет с последующим добавлением 20 мкл аналитического буфера, содержащего 6× His-меченый белка STING человека и меченый 2'3'cGAMP лиганд, и инкубировали в течение 3 часов при комнатной температуре. Исходные значения, полученные на PHERAstar, использовали для расчета полученных значений IC50 (сигнал обратно пропорционален связыванию синтетического лиганда) путем аппроксимации кривой в Genedata. Выраженное в процентах ингибирование рассчитывали, исходя из отношения максимальной величины связывания синтетическим соединением к максимальному связыванию немеченого 2'3' cGAMP, который использовали в качестве контроля при каждом анализе.
[0081]
[0082]
[0083] Соединения, применимые для осуществления способа согласно настоящему раскрытию, могут быть получены в соответствии со следующими методиками в сочетании со средними знаниями и опытом в области органического синтеза, заменяя соответствующие реагенты, очевидные практикующему специалисту.
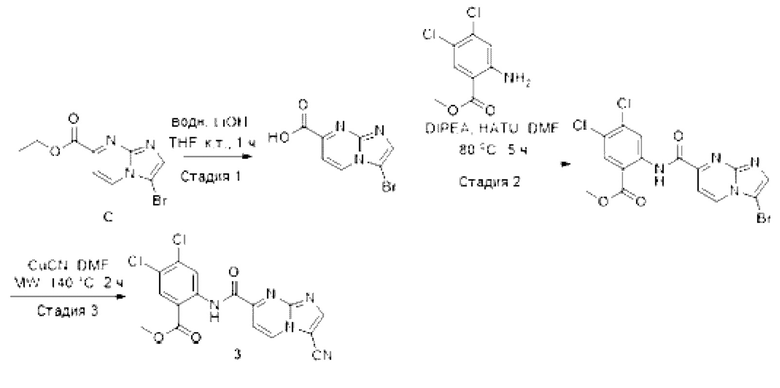
[0084] Экспериментальные методики
[0085] Сокращения. Использовали следующие сокращения: тетрагидрофуран (THF), дихлорметан (DCM), N,N-диметилформамид (DMF), диметилацетамид (DMA), диметилсульфоксид (DMSO), трифторуксусная кислота (TFA), триэтиламин (TEA), диизопропилэтиламин (DIPE А), (1-циано-2-этокси-2-оксоэтилиденаминоокси)диметил-аминоморфолинокарбения гексафторфосфат (COMU), 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний-3-оксида гексафторфосфат, N-[(диметиламино)-1Н-1,2,3-триазоло[4,5-b]пиридин-1-илметилен]-N-метилметанаминия гексафторфосфата N-оксид (HATU).
[0086] Общие примеры для получения соединений согласно настоящему раскрытию. Исходные вещества и промежуточные соединения для получения соединений согласно настоящему раскрытию могут быть получены путем применения или адаптации описанных ниже способов, их очевидных химических эквивалентов, или, например, как описано в литературе, такой как The Science of Synthesis, Volumes 1-8. Editors E.M. Carreira et al. Thieme publishers (2001-2008). Подробности касательно дополнительных реагентов и условий также доступны из поисковых данных по структуре и реакциям с использованием коммерческих компьютерных поисковых систем, таких как Scifinder (www.cas.org) или Reaxys (www.reaxys.com).
[0087] Частъ I: Получение промежуточных соединений
[0088] Схема 1: Синтез промежуточного соединения А:
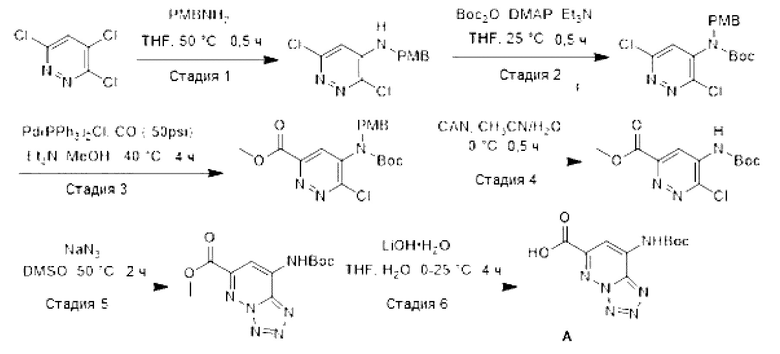
[0089] Стадия 1: Синтез 3,б-дихлор-N-(4-метоксибензил)пиридазин-4-амина: К раствору 3,4,6-трихлорпиридазина (45,0 г, 245 ммоль) в THF (450 мл) добавляли (4-метоксифенил)метанамин (101 г, 736 ммоль), а затем перемешивали смесь при 50°С в течение 0,5 часа. Смесь разбавляли водой (1000 мл) и экстрагировали EtOAc (1000 мл × 3). Объединенные органические слои промывали солевым раствором (300 мл × 2), сушили над безводным Na2SO4, фильтровали и концентрировали в условиях вакуума. Остаток очищали методом колоночной хроматографии с получением 3,6-дихлор-N-(4-метоксибензил)пиридазин-4-амина (70,0 г, чистота 97%, выход 97%) в виде белого твердого вещества. LCMS (ESI): m/z 283,9 [М+Н]+.
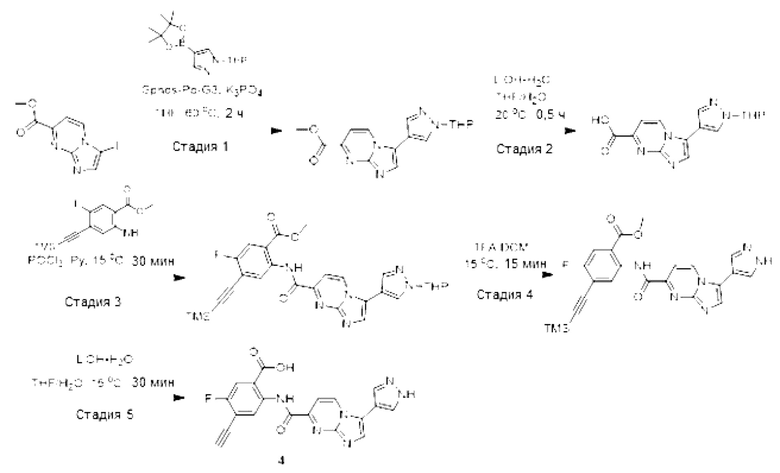
[0090] Стадия 2: Синтез трет-бутил-(3,6-дихлорпиридазин-4-ил)(4-метоксибензил)-карбамата: К раствору 3,6-дихлор-N-(4-метоксибензил)пиридазин-4-амина (70,0 г, 246 ммоль) в THF (700 мл) добавляли Et3N (49,9 г, 492 ммоль), DMAP (15,0 г, 123 ммоль) и Boc2O (79,2 мл, 345 ммоль). После перемешивания при 25°С в течение 0,5 часа, смесь разбавляли водой (1000 мл), а затем экстрагировали EtOAc (1000 мл × 3). Объединенные органические слои промывали солевым раствором (500 мл × 2), сушили над безводным Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии с получением трет-бутил-(3,6-дихлорпиридазин-4-ил)(4-метоксибензил)карбамата (77 г, выход 67%) в виде белого твердого вещества. LCMS (ESI): m/z 384,1 [М+Н]+.
[0091] Стадия 3: Синтез метил-5-((трет-бутоксикарбонил)(4-метоксибензил)амино)-6-хлорпиридазин-3-карбоксилата: К раствору трет-бутил-(3,6-дихлорпиридазин-4-ил)(4-метоксибензил)карбамата (36,5 г, 95,0 ммоль) в метаноле (500 мл) добавляли Et3N (39,7 мл, 285 ммоль) и Pd(PPh3)2Cl (6,95 г, 9,50 ммоль). Смесь перемешивали при 40°С в течение 4 часов под давлением монооксида углерода (50 фунт/кв. дюйм). Смесь разбавляли водой (500 мл) и экстрагировали EtOAc (500 мл × 3). Объединенные органические слои промывали солевым раствором (300 мл × 2), сушили над безводным Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии с получением метил-5-((трет-бутоксикарбонил)(4-метоксибензил)амино)-6-хлорпиридазин-3-карбоксилата (22,9 г, выход 47%) в виде белого твердого вещества. LCMS (ESI): m/z 408,1 [М+Н]+.
[0092] Стадия 4: Синтез метил-5-((трет-бутоксикарбонил)амино)-6-хлорпиридазин-3-карбоксилата: К раствору 5-((трет-бутоксикарбонил)(4-метоксибензил)амино)-6-хлорпиридазин-3-карбоксилата (15,0 г, 36,7 ммоль) в ацетонитриле (75,0 мл) и воде (75,0 мл) при 0°С добавляли CAN (40,3 г, 73,6 ммоль), а затем перемешивали смесь в течение 0,5 часа. Смесь разбавляли водой (200 мл) и экстрагировали EtOAc (100 мл × 3). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии с получением метил-5-((трет-бутоксикарбонил)амино)-6-хлорпиридазин-3-карбоксилата (7,20 г, выход 65%) в виде белого твердого вещества. LCMS (ESI): m/z 288,0 [М+Н]+.
[0093] Стадия 5: Синтез метил-8-((трет-бутоксикарбонил)амино)тетразоло[1,5-b]пиридазин-6-карбоксилата: К раствору 5-((трет-бутоксикарбонил)амино)-6-хлор-пиридазин-3-карбоксилата (4,30 г, 13,6 ммоль) в DMSO (43,0 мл) добавляли азид натрия (2,65 г, 40,8 ммоль). После перемешивания при 50°С в течение 2 часов, смесь разбавляли водой (200 мл) и экстрагировали EtOAc (200 мл × 3). Объединенные органические слои промывали водой (200 мл × 3) и солевым раствором (200 мл × 2), сушили над безводным Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии с получением метил-8-((трет-бутоксикарбонил)амино)тетразоло[1,5-b]пиридазин-6-карбоксилата (2,80 г, выход 66%) в виде белого твердого вещества. 1H-ЯМР (400 МГц, DMSO-d6) δ 11,44 (с, 1Н), 8,51 (с, 1Н), 4,00 (с, 3Н), 1,53 (с, 9Н). LCMS (ESI): m/z 294,7 [М+Н]+.
[0094] Стадия б: Синтез 8-((трет-бутоксикарбонил)амино)тетразоло[1,5-b]пиридазин-6-карбоновой кислоты (А): К раствору метил-8-((трет-6утоксикарбонил)амино)-тетразоло[1,5-b]пиридазин-6-карбоксилата (250 мг, 0,85 ммоль) в THF (5 мл) при 0°С добавляли раствор моногидрата гидроксида лития (143 мг, 3,4 ммоль) в воде (5 мл). Смесь перемешивали при 25°С в течение 4 часов. После завершения реакции, для нейтрализации реакционной смеси добавляли 3М HCl, осадок фильтровали и промывали холодной водой (1 мл × 2) с получением соединения А (191 мг, выход 80%) в виде белого твердого вещества. 1H-ЯМР (400 МГц, DMSO) δ 8,60 (с, 1Н), 8,32 (с, 1Н), 8,22 (с, 1Н), 1,58 (с, 9Н).
[0095] Схема 2: Синтез промежуточного соединения В:
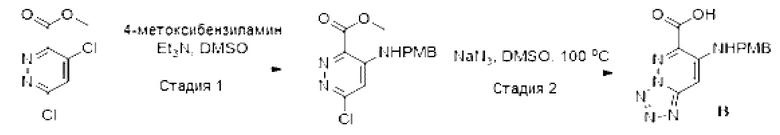
[0096] Стадия 1: Синтез метил-6-хлор-4-((4-метоксибензил)амино)пиридазин-3-карбоксилата: К раствору метил-4,6-дихлорпиридазин-3-карбоксилата (207 мг, 1 ммоль) и Et3N (279 мкл, 2 ммоль) в DMSO (2 мл) добавляли 4-метокси бензил амин (144 мкл, 1,1 ммоль), и перемешивали реакционную смесь при комнатной температуре в течение ночи. После завершения реакции, добавляли воду (10 мл), и формировался белый осадок. Смесь фильтровали и промывали водой с получением метил-6-хлор-4-((4-метоксибензил)амино)-пиридазин-3-карбоксилата (257 мг, выход 84%) в виде белого твердого вещества. LCMS (ESI): m/z 308,0 [М+Н]+.
[0097] Стадия 2: Синтез 7-((4-метоксибензил)амино)тетразоло[1,5-b]пиридазин-6-карбоновой кислоты: К раствору метил-6-хлор-4-((4-метоксибензил)амино)пиридазин-3-карбоксилата (257 мг, 0,84 ммоль) в DMSO (3 мл) добавляли азид натрия (109 мг, 1,68 ммоль), и перемешивали при 100°С в течение 16 часов. После завершения реакции, добавляли воду (5 мл), и формировался желтый осадок. Смесь поддерживали при 0°С в течение 10 минут, фильтровали и промывали водой (2 мл × 2) с получением желтого твердого вещества. Твердое вещество суспендировали в воде (10 мл) и нейтрализовали добавлением HCl (3М). Суспензию фильтровали с получением соединения В (183 мг, выход 13%) в виде желтого твердого вещества. 1H-ЯМР (400 МГц, DMSO-d6): δ 8,43 (с, 1Н), 7,42-7,32 (м, 2Н), 7,22 (с, 1Н), 6,96-6,88 (м, 2Н), 4,48 (д, J=5,0 Гц, 2Н), 3,73 (с, 3Н). LCMS (ESI): m/z 300,8 [М+Н]+.
[0098] Схема 3: Синтез промежуточного соединения С:
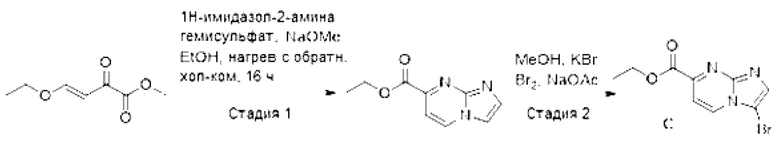
[0099] Стадия 1: Синтез этилимидазо[1,2-а]пиримидин-7-карбоксилата: К суспензии 1H-имидазол-2-амина гемисульфата (8,5 г, 64,33 ммоль) в EtOH (100 мл) добавляли мет оксид натрия (4,4 г, 82,2 ммоль), и перемешивали полученную смесь при 90°С в течение 30 мин. Затем, ее до комнатной температуры, и добавляли раствор метил-(Е)-4-этокси-2-оксобут-3-еноата (10 г, 63,29 ммоль) в EtOH (40 мл). Реакционную смесь медленно нагревали до появления конденсата и перемешивали в течение 16 ч. После завершения реакции, реакционную смесь охлаждали до комнатной температуры, и удаляли летучие вещества в условиях пониженного давления. Остаток очищали методом колоночной хроматографии (0-4% MeОН в DCM) с получением этилимидазо[1,2-а]пиримидин-7-карбоксилата (5,2 г, 43% выход) в виде не совсем белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3): δ 8,64 - 8,61 (м, 1Н), 8,06 - 8,04 (м, 1Н), 7,74-7,67 (м, 2Н), 4,51 (кв, J=7,2 Гц, 2Н), 1,47 (т, J=7,2 Гц, 3Н). LCMS(ESI): m/z 192,1 [М+Н]+.
[0100] Стадия 2: Синтез этил-3-бромимидазо[1,2-а]пиримидин-7-карбоксилата (С): К суспензии этилимидазо[1,2-а]пиримидин-7-карбоксилата (5,2 г, 27,2 ммоль) в MeОН (52 мл) при 0°С в атмосфере азота добавляли KBr (3,24 г, 27,2 ммоль) и ацетат натрия (3,43 г, 40,8 ммоль). В течение 10-15 мин к смеси добавляли бром (4,78 г, 29,9 ммоль). После завершения реакции, реакционную смесь гасили добавлением 1М водного раствора Na2SO3 (10 мп). Затем, летучие вещества удаляли в условиях пониженного давления, и добавляли к остатку насыщенный раствор NaHCO3 (30 мл). Полученное твердое вещество собирали путем фильтрования и очищали методом колоночной хроматографии (0-2%) MeOH в DCM) с получением соединения С (5,3 г, 72%) выход) в виде не совсем белого твердого вещества. 1H-ЯМР (400 МГц, DMSO-d6): δ 8,97 (м, 1Н), 8,18 (с, 1Н), 7,71 (д, J=7,2 Гц, 1Н), 4,42 (кв, J=7,2 Гц, 2Н), 3,95 (с, 3Н), 1,38 (т, J=7,2 Гц, 3Н). LCMS (ESI): m/z 270,2 [М+Н]+.
[0101] Часть II: Получение примеров соединений
[0102] Все соединения согласно настоящему раскрытию получали с использованием методик, проиллюстрированных ниже.
[0103] Пример 1
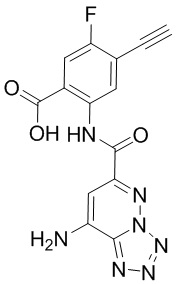
[0104] Схема 4: Синтез соединения 1:
[0105] Стадия 1: Синтез метил-2-(8-((трет-6утоксикар6онил)амино)тетразоло[1,5-b]пиридазин-6-карбоксамидо)-4-этинил-5-фторбензоата: К раствору соединения А (27,8 мг, 0,1 ммоль) добавляли HATU (48 мг, 0,15 ммоль), метил-2-амино-4-этинил-5-фторбензоат (19,4 мг, 0,11 ммоль) и DIPEA (35 мкл, 0,2 ммоль), и перемешивали реакционную смесь при 50°С в течение ночи. Неочищенную смесь очищали методом препаративной HPLC с получением метил-2-(8-((трет-бутоксикарбонил)амино)-тетразоло[1,5-b]пиридазин-6-карбоксамидо)-4-этинил-5-фторбензоата в виде белого твердого вещества (28 мг, выход 51%). 1H-ЯМР (400 МГц, DMSO-d6) δ 12,47 (с, 1Н), 11,54 (с, 1Н), 8,80 (д, J=6,1 Гц, 1Н), 8,67 (с, 1Н), 7,93 (д, J=9,2 Гц, 1Н), 4,90 (с, 1Н), 3,97 (с, 3Н), 1,55 (с, 9Н). LCMS (ESI): m/z 456,6 [М+Н]+.
[0106] Стадия 2: Синтез 2-(8-аминотетразоло[1,5-b]пиридазин-6-карбоксамидо)-4-этинил-5-фторбензоата лития (1): К раствору метил-2-(8-((трет-бутоксикарбонил)-амино)тетразоло[1,5-b]пиридазин-6-карбоксамидо)-4-этинил-5-фторбензоата (28 мг, 0,061 ммоль) в CH2Cl2 (0,8 мл) добавляли TFA (0,4 мл), и перемешивали реакционную смесь при комнатной температуре в течение 1 ч. После завершения реакции, смесь концентрировали в условиях пониженного давления. Затем, неочищенную смесь растворяли в THF (2 мл), добавляли водный раствор гидр оксида лития (310 мкл, 0,31 ммоль, 1М) и перемешивали при 50°С в течение 6 часов. После завершения реакции, THF удаляли в условиях пониженного давления, и суспендировали остаток в воде (1 мл). Суспензию фильтровали и промывали холодной водой (0,5 мл × 2) и ацетонитрилом (0,5 мл) с получением соединения 1 (соль лития, 14,5 мг, выход 68%) в виде белого твердого вещества. 1H-ЯМР (400 МГц, DMSO-d6) δ 15,71 (с, 1Н), 8,82 (дд, J=7,0, 1,8 Гц, 1Н), 8,33 (с, 2Н), 7,76 (дд, J=10,4, 2,0 Гц, 1Н), 7,15 (дд, J=2,2, 1,0 Гц, 1Н), 4,54 (д, J=2,0 Гц, 1Н). LCMS (ESI): m/z 342,46 [M+H]+.
[0107] Следующие соединения синтезировали с использованием методик, аналогичных описанным выше для получения соединения 1: 5, 6, 7, 8, 9, 10, 11, 14, 15, 16, 17, 18, 19, 21, 22, 24, 25, 26, 28, 29, 30, 31, 32, 33, 34, 35, 36, 38, 39, 40,41,42,43, 45, 47, 50, 55, 56, 58, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 79, 80, 77, 78, 81, 82, 83, 84, 85 и 86 и т.д.
[0108] Пример 2
[0109] Схема 5: Синтез соединения 2:

[0110] Синтез 2-(8-аминотетразоло[1,5-b]пиридазин-6-ил)-7-этинил-6-фтор-4Н-бензо[d][1,3]оксазин-4-она (2): Суспензию соединения 1 (20 мг, 0,06 ммоль) в 0,6 мл тионилхлорида, и нагревали смесь с обратным холодильником в течение 2 ч. Затем, избыток тионилхлорида удаляли в условиях вакуума. Твердое вещество растворяли в 1 мл безводного ацетонитрила, и при комнатной температуре добавляли раствор DIPEA (20 мкл, 0,12 ммоль) в 1 мл безводного ацетонитрила. После перемешивания в течение 30 минут, полученный осадок выделяли и промывали ацетонитрилом с получением продукта (15 мг, выход 77%). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,49 (с, 2Н), 8,11 (д, J=8,4 Гц, 1Н), 8,03 (д, J=6,3 Гц, 1Н), 7,35 (с, 1Н), 5,04 (с, 1Н). MS-ESI: m/z 324,49 наблюдали (М+Н)+
[0111] Соединения 44, 48 и 49 получали с использованием методики, аналогичной описанной для получения соединения 2.
[0112] Пример 3
[0113] Схема 6: Синтез соединения 3:
[0114] Стадия 1: Синтез 3-бромимидазо[1,2-а]пиримидин-7-карбоновой кислоты: Водный раствор гидроксида лития (0,327 г, 7,8 ммоль, 2 мл воды) добавляли к раствору соединения С (1,4 г, 5,2 ммоль) в THF (8 мл) при комнатной температуре. Реакционную смесь перемешивали при той же температуре в течение 1 ч. После завершения реакции, растворитель удаляли в условиях пониженного давления, и подкисляли водные слои добавлением 2н HCl при 0°С. Полученное твердое вещество собирали путем фильтрования, промывали холодной водой (3 мл × 2) и сушили с получением 3-бромимидазо[1,2-а]пиримидин-7-карбоновой кислоты (1,0 г, 79% выход) в виде не совсем белого твердого вещества. 1Н-ЯМР (400 МГц, DMSO-d6): δ 9,07 (д, J=6,8 Гц, 1H), 8,29 (с, 1H), 7,65 (д, J=6,8 Гц, 1H). LCMS (ESI): m/z 243,06 [М+Н]+.
[0115] Стадия 2: Синтез метил-2-(3-бромимидазо[1,2-а]пиримидин-7-карбоксамидо)-4,5-дихлорбензоата: К раствору 3-бромимидазо[1,2-а]пиримидин-7-карбоновой кислоты (1,4 г, 5,8 ммоль) в DMF (14 мл) при 0°С в атмосфере азота добавляли DIPEA (3,8 г, 29,2 ммоль) и HATU (3,3 г, 8,7 ммоль). Смесь перемешивали в течение 10 мин, после чего добавляли метил-2-амино-4,5-дихлорбензоат (1,9 г, 8,7 ммоль). Реакционную смесь перемешивали при 80°С в течение 5 ч. После завершения реакции, реакционную смесь охлаждали до комнатной температуры, и добавляли насыщенный раствор NaHCO3 (30 мл). Полученное твердое вещество собирали путем фильтрования и очищали методом колоночной хроматографии с получением метил-2-(3-бромимидазо[1,2-а]пиримидин-7-карбоксамидо)-4,5-дихлорбензоата (1,0 г, выход 39%) в виде не совсем белого твердого вещества. 1Н-ЯМР (400 МГц, DMSO-d6): δ 13,09 (с, 1H), 9,17 (с, 1H), 8,59 (д, J=6,8, 1H), 8,22 (с, 1H), 7,92 (д, J=6,8, 1Н), 7,76 (с, 1H), 3,89 (с, 3Н). LCMS (ESI): m/z 441,0 [М-Н]-.
[0116] Стадия 3: Синтез метил-4,5-дихлор-2-(3-цианоимидазо[1,2-а]пиримидин-7-карбоксамидо)бензоата 3: К раствору метил-2-(3-бромимидазо[1,2-а]пиримидин-7-карбоксамидо)-4,5-дихлорбензоата (0,220 г, 0,5 ммоль) в DMF (4 мл) добавляли CuCN (0,157 г, 1,75 ммоль), и облучали смесь в микроволновом реакторе при 140°С в течение 2 ч (интервалами 1 ч + 1 ч). Реакционную смесь разбавляли EtOAc (25 мл), промывали насыщенным раствором NaHCO3 (10 мл), водой (10 мл × 2), солевым раствором (10 мл), сушили над безводным Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии (0-30% EtOAc в РЕ) с получением 0,11 г неочищенного продукта, который дополнительно очищали методом препаративной HPLC с получением соединения 3 (11 мг, выход 6%) в виде не совсем белого твердого вещества. 1Н-ЯМР (400 МГц, DMSO-d6): δ 12,79 (с, 1H), 9,28 (д, J=6,8 Гц, 1H), 9,04 (с, 1H), 8,95 (с, 1H), 8,21 (с, 1H), 7,89 (д, J=6,8 Гц, 1H), 4,00 (с, 3Н). LCMS (ESI): m/z 388,1 [М-Н]-.
[0117] Соединения 13, 46, 52 и 75 получали с использованием методики, аналогичной описанной для получения соединения 3.
[0118] Пример 4
[0119] Схема 7: Синтез соединения 4:
[0120] Стадия 1: Синтез метил-3-(1-(тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-ил)имидазо[1,2-а]пиримидин-7-карбоксилата: Смесь 1-(тетрагидро-2Н-пиран-2-ил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразола (413 мг, 1,48 ммоль, 1,5 экв), метил-3-йодимидазо[1,2-а]пиримидин-7-карбоксилат (0,3 г, 989 мкмоль, 1 экв), K3PO4 (315 мг, 1,48 ммоль, 1,5 экв) и SPhos Pd G3 (154 мг, 197 мкмоль, 0,2 экв) в THF (3 мл) трижды дегазировали и продували N2. Смесь перемешивали при 60°С в течение 2 часов в атмосфере N2. Неочищенную реакционную смесь очищали методом обращенно-фазовой Combi-flash (с добавлением 0,1% FA) с получением метил-3-(1-(тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-ил)имидазо[1,2-а]пиримидин-7-карбоксилата (120 мг, 366 мкмоль, выход 31%) в виде желтого твердого вещества. LCMS (ESI): m/z 328,1 [М+Н]+.
[0121] Стадия 2: Синтез 3-(1-(тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-ил)имидазо[1,2-а]пиримидин-7-карбоновой кислоты: К смеси метил-3-(1-(тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-ил)имидазо[1,2-а]пиримидин-7-карбоксилата (100 мг, 305 мкмоль, 1 экв) в THF (0,5 мл) и Н2О (0,5 мл) при 20°С добавляли LiOH⋅H2O (12,8 мг, 305 мкмоль, 1 экв). Смесь перемешивали при 20°С в течение 0,5 часа, а затем концентрировали с получением 3-(1-(тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-ил)имидазо[1,2-а]пиримидин-7-карбоновой кислоты (85 мг, неочищенное вещество) в виде желтого твердого вещества. LCMS (ESI): m/z 314,1 [М+Н]+.
[0122] Стадия 3: Синтез метил-5-фтор-2-(3-(1-(тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-ил)имидазо[1,2-а]пиримидин-7-карбоксамидо)-4-((триметилсилил)этанил)бензоата: К смеси 3-(1-(тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-ил)имидазо[1,2-а]пиримидин-7-карбоновой кислоты (50 мг, 159 мкмоль, 1 экв) и метил-2-амино-5-фтор-4-((триметилсилил)этанил)бензоата (42,3 мг, 159 мкмоль, 1 экв) в пиридине (0,5 мл) при 15°С добавляли POCl3 (73,4 мг, 478 мкмоль, 44,4 мкл, 3 экв). Смесь перемешивали при 15°С в течение 30 мин, а затем разбавляли H2O (20 мл) и экстрагировали ЕА (10 мл × 3). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением остатка. Остаток очищали методом препаративной HPLC с получением метил-5-фтор-2-(3-(1-(тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-ил)имидазо [1,2-а] пиримидин-7-карбоксамидо)-4-((триметилсилил)этанил)-бензоата (75 мг, 133 мкмоль, выход 74% после двух стадий) в виде желтого твердого вещества. 1H-ЯМР (400 МГц, DMSO-d6) δ=12,63 (с, 1H), 9,21 (д, J=7,2 Гц, 1Н), 8,91 (д, J=6,8 Гц, 1H), 8,61 (с, 1H), 8,28 (с, 1H), 8,13 (с, 1H), 7,88 (д, J=10,0 Гц, 1H), 7,75 (д, J=7,2 Гц, 1H), 5,51 (дд, J=2,0, 10,0 Гц, 1H), 4,05-3,95 (м, 4Н), 3,70 - 3,65 (м, 1H), 2,24 - 2,12 (м, 1Н), 2,03 - 1,93 (м, 2Н), 1,78 - 1,66 (м, 1Н), 1,62 - 1,53 (м, 2Н), 0,31 - 0,27 (м, 9Н).
[0123] Стадия 4: Синтез метил-2-(3-(1Н-пиразол-4-ил)имидазо[1,2-а]пиримидин-7-карбоксамидо)-5-фтор-4-((триметилсилил)этанил)бензоата: К смеси метил-5-фтор-2-(3-(1-(тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-ил)имидазо[1,2-а]пиримидин-7-карбоксамидо)-4-((триметилсилил)этанил)бензоата (15 мг, 26,7 мкмоль, 1 экв) в DCM (1 мл) при 15°С одной порцией добавляли TFA (462 мг, 4,05 ммоль, 0,3 мл, 151 экв). Смесь перемешивали при 15°С в течение 15 мин., а затем концентрировали с получением остатка. Остаток очищали методом препаративной HPLC (колонка: Shim-pack С18 150×25×10 мкм; подвижная фаза: [вода (0,225% FA)-ACN]; В%: 62%-82%, 10 мин) с получением метил-2-(3-(1Н-пиразол-4-ил)имидазо[1,2-а]пиримидин-7-карбоксамидо)-5-фтор-4-((триметилсилил)этанил)бензоата (8 мг, 16,7 мкмоль, 62% выход) в виде желтого твердого вещества. LCMS (ESI): m/z 411,0 [М+Н]+.
[0124] Стадия 5: Синтез 2-(3-(1Н-пиразол-4-ил)имидазо[1,2-а]пиримидин-7-карбоксамидо)-4-этинил-5-фторбензойная кислота (4): К смеси метил-2-(3-(1Н-пиразол-4-ил)имидазо[1,2-а]пиримидин-7-карбоксамидо)-5-фтор-4-((триметилсилил)этанил)бензоата (15 мг, 31,4 мкмоль, 1 экв) в THF (0,1 мл) и H2O (0,1 мл) при 15°С одной порцией добавляли LiOH⋅H2O (1,45 мг, 34,62 мкмоль, 1,1 экв). Смесь перемешивали при 15°С в течение 30 мин. Смесь гасили до рН=6 добавлением 1н HCl, а затем концентрировали в условиях вакуума для удаления. Осадок фильтровали, и сушили осадок на фильтре в условиях вакуума с получением 2-(3-(1Н-пиразол-4-ил)имидазо[1,2-а]пиримидин-7-карбоксамидо)-4-этинил-5-фторбензойной кислоты (4,28 мг, 10,9 мкмоль, выход 34%, чистота 100%) в виде желтого твердого вещества. 1H-ЯМР (400 МГц, DMSO-d6) δ=12,95 (с, 1H), 9,21-9,19 (д, J=7,2 Гц, 1Н), 9,01-8,99 (д, J=6,4 Гц, 1H), 8,36-8,33 (м, 3Н), 7,90-7,87 (д, J=10,0 Гц, 1H), 7,77-7,75 (д, J=7,2 Гц, 1H), 4,83 (с, 1H). LCMS (ESI): m/z 391,3 [М+Н]+.
[0125] Соединения 51, 59 и 61 получали с использованием методики, аналогичной описанной для получения соединения 4.
[0126] Хотя настоящее раскрытие было более детально описано и проиллюстрировано на примерах для специалистов в данной области техники с целью его осуществления и применения, различные альтернативы, модификации и улучшения будут очевидны специалистам в данной области техники без отступления от существа и объема формулы изобретения.
[0127] Все патенты и публикации, на которые приведены ссылки в настоящем документе, включены в настоящий документ посредством ссылки в равной мере, как если бы каждая отдельная публикация была конкретно и индивидуально определена, как подлежащая включению в настоящий документ посредством ссылки во всей ее полноте.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОНОЦИКЛИЧЕСКИЕ АГОНИСТЫ СТИМУЛЯТОРА ГЕНОВ ИНТЕРФЕРОНА STING | 2020 |
|
RU2813691C2 |
| МАКРОЦИКЛИЧЕСКИЕ АНТИБИОТИКИ ШИРОКОГО СПЕКТРА | 2018 |
|
RU2779477C2 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ TRPA 1 | 2014 |
|
RU2675792C2 |
| МАКРОЦИКЛИЧЕСКИЕ АНТИБИОТИКИ ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ | 2016 |
|
RU2761476C2 |
| МАКРОЦИКЛИЧЕСКИЕ АНТИБИОТИКИ ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ | 2016 |
|
RU2766543C2 |
| Гетероциклические соединения в качестве ингибиторов киназы RET | 2017 |
|
RU2742115C2 |
| Бензотиофены и родственные соединения в качестве агонистов STING | 2019 |
|
RU2806274C2 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ | 2020 |
|
RU2830113C2 |
| ИНГИБИТОРЫ MAGL НА ОСНОВЕ ПИРАЗОЛА | 2018 |
|
RU2789157C2 |
| Соединения 6, 7-дигидро-5H-пиразоло[5,1-b][1,3]оксазин-2-карбоксамида | 2017 |
|
RU2719599C2 |
Группа изобретений относится к области медицины, а именно к терапии, и предназначена для лечения опухолей у страдающих ими пациентов. Представлены соединения формулы (I) или (II), где значения различных заместителей определены в настоящем документе. В другом воплощении обеспечивается фармацевтическая композиция, содержащая данные соединения. Также обеспечивается способ лечения опухоли у пациента с использованием указанных соединений, которые могут быть доставлены посредством пероральной доставки для системного воздействия или интратуморально. Также обеспечивается применение указанных соединений для лечения опухоли у пациента. Противоопухолевая терапия с применением данных соединений может дополнительно включать в себя введение эффективной дозы лекарственного средства, нацеленного на контрольную точку иммунного ответа. Группа изобретений обеспечивает новые соединения формулы (I) или (II), обладающие агонистической биоактивностью в отношении стимулятора генов интерферона (STING), которые могут применяться при лечении опухолей у страдающих ими пациентов. 5 н. и 4 з.п. ф-лы, 3 табл., 4 пр.
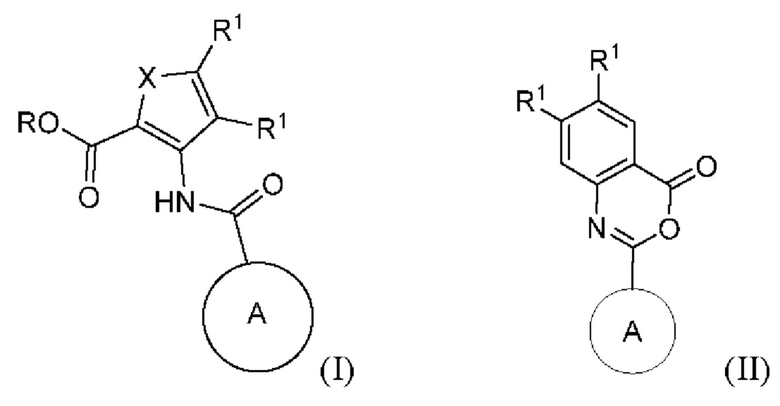
1. Соединение формулы (I)
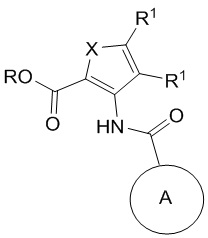 (I),
(I),
где
X представляет собой S, -N=C(R1)- или -C(R1)=C(R1)-;
каждый R1 независимо представляет собой H, F, Cl, C1-C6-алкил, этенил, который может быть замещен F или C1-C6 алкилом, этинил, который может быть замещен C1-C6-алкилом, циано, C1-C6 алкоксилом или C3-C6-циклоалкилом;
где по меньшей мере один R1 представляет собой F, Cl, C1-C6-алкил, необязательно замещенный этенил или этинил, циано, C1-C6-алкоксил или C3-C6-циклоалкил;
или оба R1 вместе с атомами углерода, к которым они присоединены, формируют конденсированный фенил;
R представляет собой H или C1-C6-алкил; и
кольцо A представляет собой бициклическую полностью ароматическую или частично восстановленную гетероарильную кольцевую систему, содержащую 3, 4 или 5 атомов N, замещенную 0, 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из NH2, циано, NHC(=O)O-tBu,OH, карбоксамидо, C1-C6-алкила, -S(O)2(C1-C6-алкил) и -S(O)(C1-C6-алкил); при условии, что частично восстановленная гетероарильная кольцевая система может быть замещена оксогруппой;
или его фармацевтически приемлемая соль,
или формулы (II)
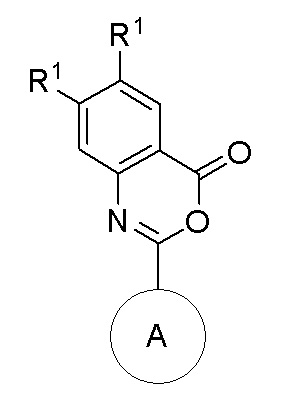
где
каждый R1 независимо представляет собой H, F, Cl, этенил, который может быть замещен F или C1-C6 алкилом, этинил, который может быть замещен C1-C6 алкилом, циано, C1-C6-алкоксил или C3-C6-циклоалкилом;
где по меньшей мере один R1 представляет собой F, Cl, необязательно замещенный этенил или этинил, циано, C1-C6-алкоксил или C3-C6-циклоалкил;
или оба R1 вместе с атомами углерода, к которым они присоединены, формируют конденсированный фенил; и
кольцо A представляет собой бициклическую полностью ароматическую или частично восстановленную гетероарильную кольцевую систему, содержащую 3, 4 или 5 атомов N, замещенную 0, 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из NH2, циано, NHC(=O)O-tBu, OH, карбоксамидо, C1-C6-алкила, -S(O)2(C1-C6-алкил) и -S(O)(C1-C6-алкил); при условии, что частично восстановленная гетероарильная кольцевая система может быть замещена оксогруппой;
или его фармацевтически приемлемая соль.
2. Соединение по п. 1, где соединение представляет собой соединение формулы (I), где
X представляет собой S, -N=C(R1)- или -C(R1)=C(R1)-;
каждый R1 независимо представляет собой H, F, Cl, этенил, который может быть замещен F или C1-C6-алкилом, этинил, который может быть замещен C1-C6-алкилом, циано или C1-C6-алкоксилом;
R представляет собой H или C1-C6-алкил; и
кольцо A представляет собой бициклическую полностью ароматическую или частично восстановленную гетероарильную кольцевую систему, содержащую 3, 4 или 5 атомов N, замещенную 0, 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из NH2, циано, NHC(=O)O-tBu,OH и карбоксамидо; при условии, что частично восстановленная гетероарильная кольцевая система может быть замещена оксогруппой.
3. Соединение по п. 1, где соединение представляет собой соединение формулы (II).
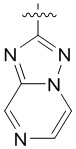
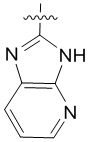
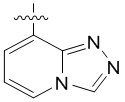
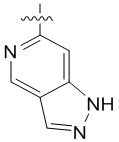
4. Соединение любому из пп. 1-3, где кольцо A является незамещенным или замещенным и представляет собой кольцо, выбранное из группы, состоящей из:
 ,
,  ,
, 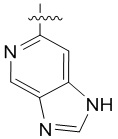 ,
, 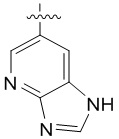 ,
, 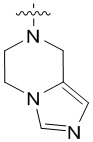 ,
, 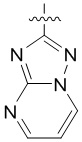 ,
,  ,
,  ,
,  ,
,  ,
, 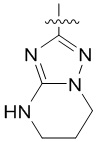 ,
, 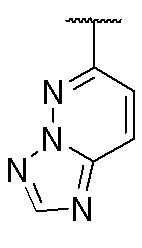 ,
, 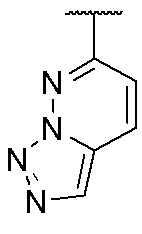 ,
, 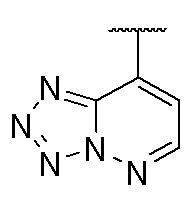 ,
, 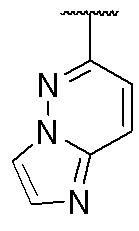 ,
, 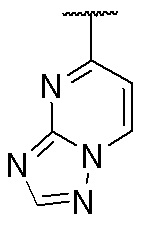 и
и 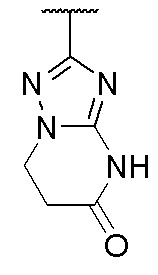 , где волнистая линия указывает на положение связывания.
, где волнистая линия указывает на положение связывания.
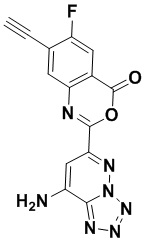
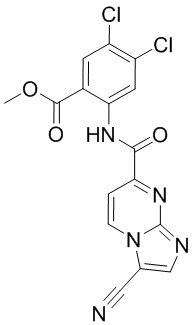
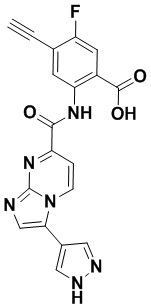
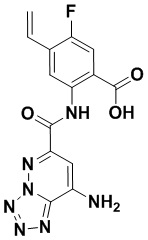
5. Соединение, выбранное из следующей таблицы:
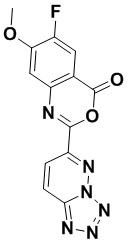
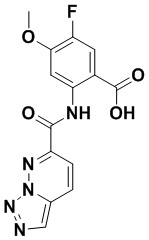
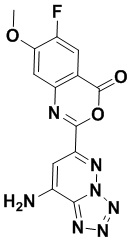
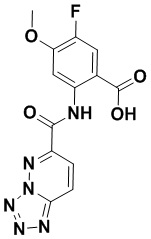
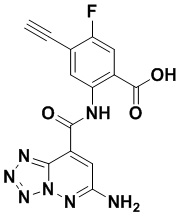
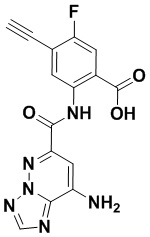
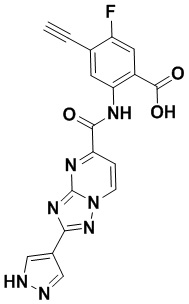
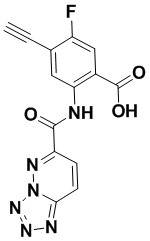
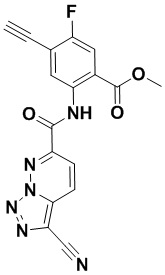
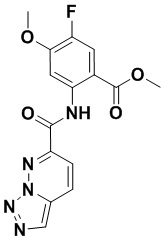
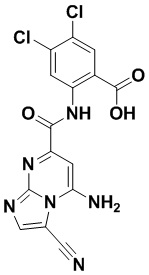
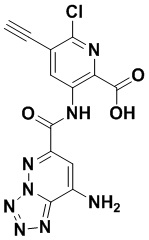
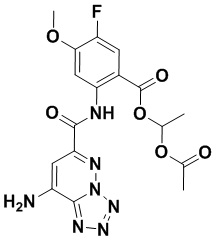
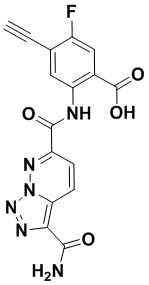
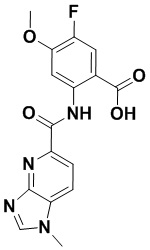
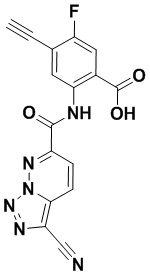
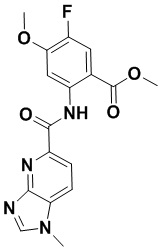
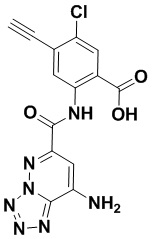
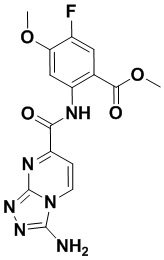
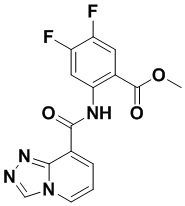
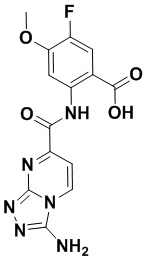
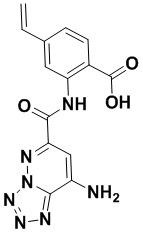
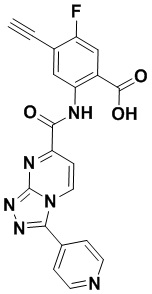
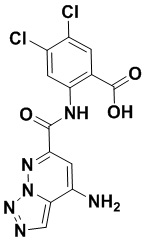
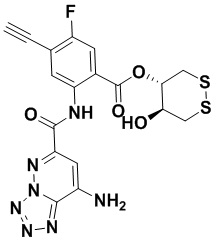
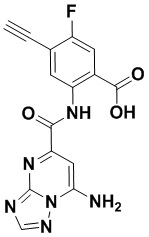
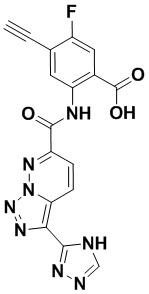
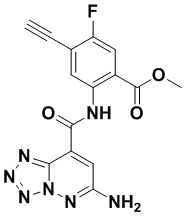
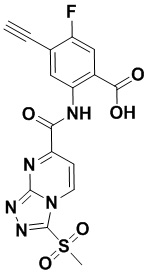
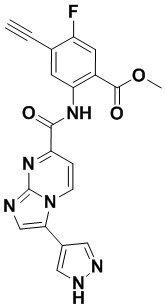
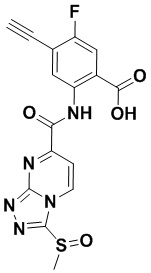
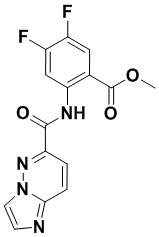
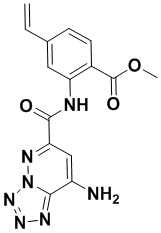
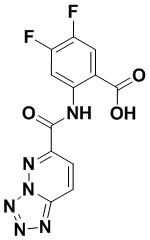
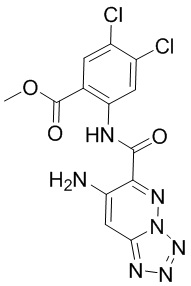
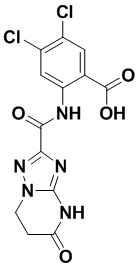
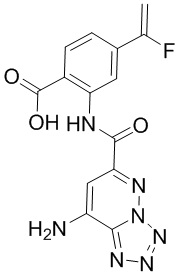
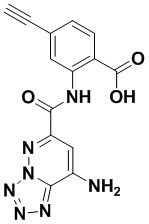
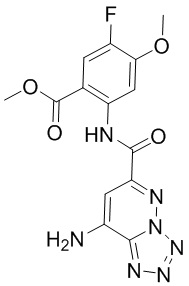
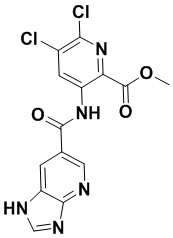
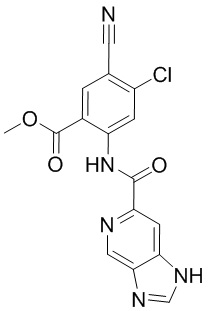
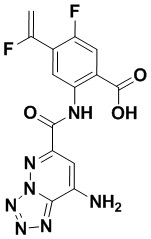
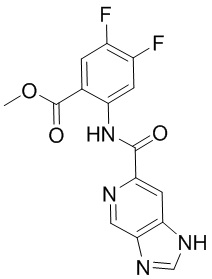
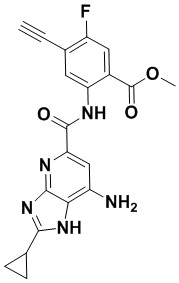
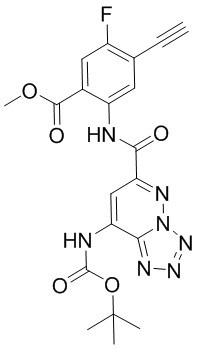
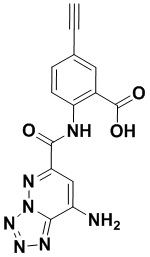
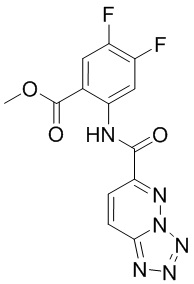
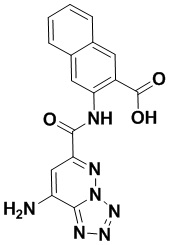
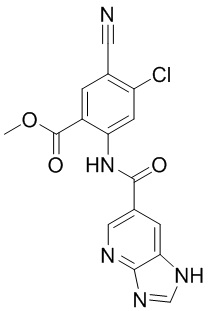
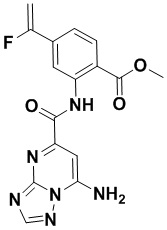
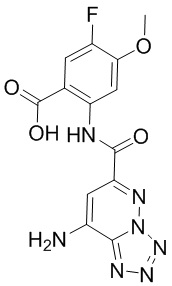
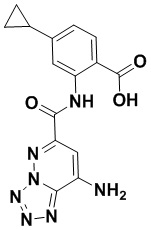
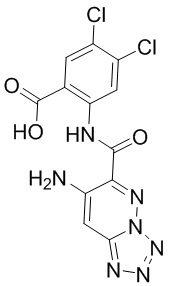
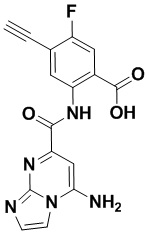
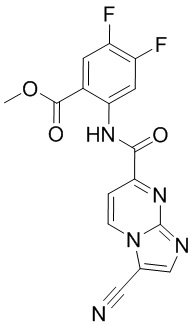
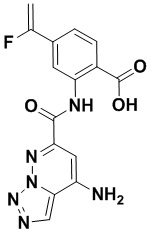
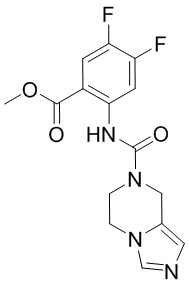
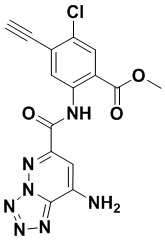
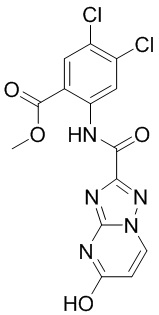
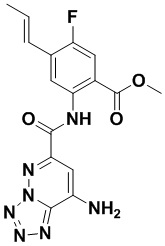
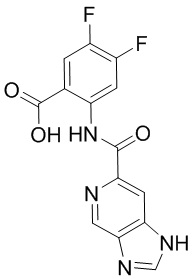
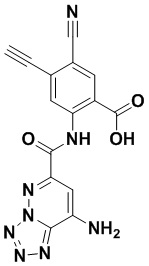
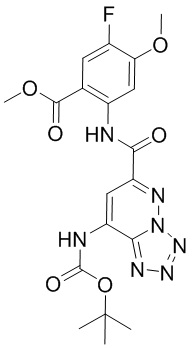
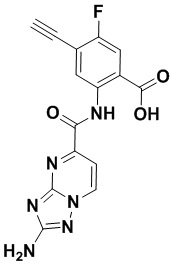
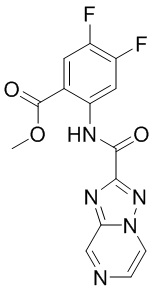
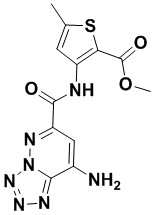
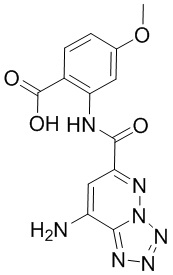
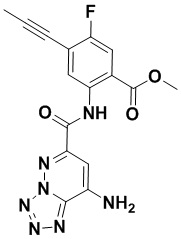
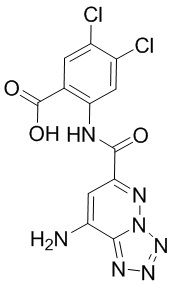
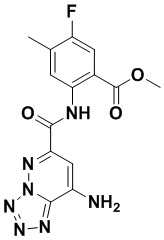
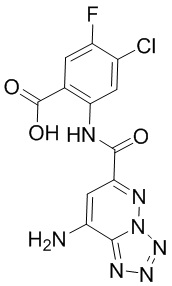
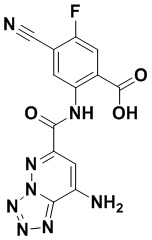
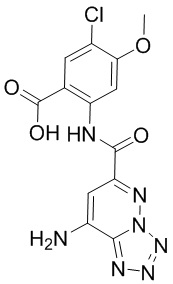
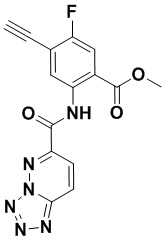
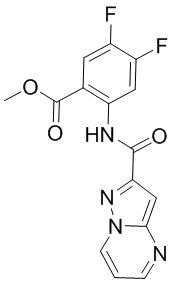
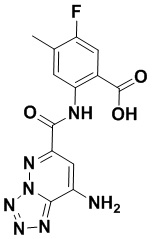
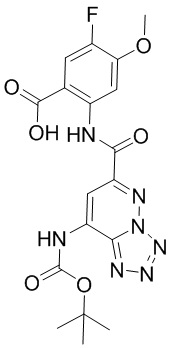
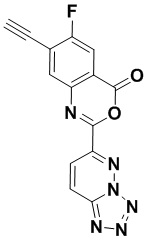
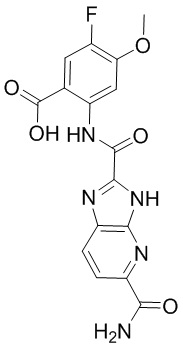
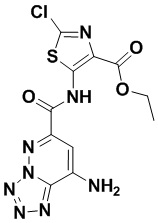
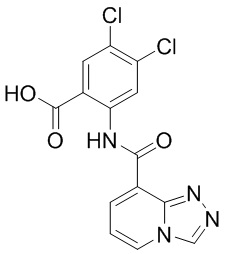
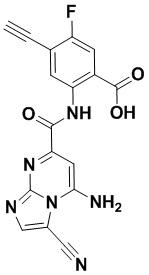
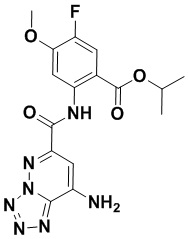
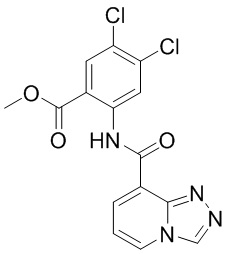
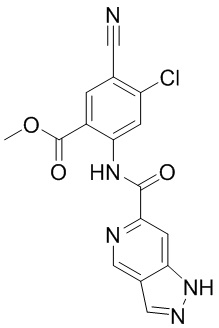
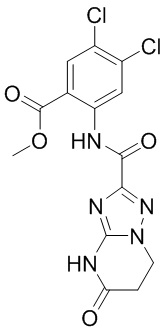
6. Способ лечения опухоли у пациента, включающий в себя введение пациенту эффективной дозы соединения или его фармацевтически приемлемой соли по любому из пп. 1-5.
7. Способ по п. 6, где введение включает в себя пероральное или интратуморальное введение, или и то и другое.
8. Фармацевтическая композиция для лечения опухоли, содержащая эффективное количество соединения или его фармацевтически приемлемой соли по любому из пп. 1-5 и фармацевтически приемлемый носитель.
9. Применение соединение или его фармацевтически приемлемой соли по любому из пп. 1-5 для лечения опухоли у пациента.
| US 5262537 A, 16.11.1993 | |||
| WO 2012078855 A1, 14.06.2012 | |||
| WO 9616954 A1, 06.06.1996 | |||
| US 4657893 A, 14.04.1987 | |||
| US 2009239982 A1, 24.09.2009 | |||
| ЕА 201692119 А1, 30.06.2017 | |||
| СПОСОБ ДОБЫЧИ НЕФТИ С ПРИМЕНЕНИЕМ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ НА ОСНОВЕ СОДЕРЖАЩИХ БУТИЛЕНОКСИД АЛКИЛАЛКОКСИЛАТОВ | 2011 |
|
RU2563642C2 |
| US 2017146519 A1, 25.05.2017. | |||
Авторы
Даты
2023-07-17—Публикация
2020-08-21—Подача