Изобретение относится к области медицины, в частности к биомедицине, которая включает принципы и методы клеточной биологии и клеточной инженерии, т.е. культивирование клеток на субстратах, модифицированных микроструктурами, содержащими полимерные микросферы и природные катионные белки, а именно гистоны из ткани тимуса телят, и такие субстраты могут быть использованы для культивирования зависимых от прикрепления клеток для получения трехмерных тканеподобных структур.
Создание тканеподобных клеточных структур необходимо для восстановления целостности тканей и органов человека путем их имплантации в зону повреждения. При использовании разных модифицирующих субстратов биологически активных молекул создают матрицы, на которых получают сложные клеточные композиции, специфичные для каждой конкретной ткани. Наряду с этим пространственная структура матрицы имеет большое значение для правильной укладки нанесенных на нее клеток, входящих в формируемую ткань. Покрытие субстрата микросферами с иммобилизованными на их поверхности гистонами может способствовать этому процессу.
Для пояснения свойства белков, в частности гистонов, используемых в изобретении, заявитель считает целесообразным дать их характеристику в приложении к данному описанию (Приложение).
В настоящее время разработаны специальные технологии для конструирования поверхности субстрата с определенной микроконфигурацией (1). Такие поверхности используются, например, при сокультивировании клеток для целей тканевой инженерии (2).
Для конструирования культуральной поверхности с определенной микроконфигурацией используют технику фотолитографии с целью создания желаемой топографии поверхности, содержащей адгезивные и неадгезивные области для клеток (3, 4). Показано, что на такой поверхности субстрата скорость пролиферации и выживание клеток коррелируют с доступностью, количеством и распределением адгезивных островков, а не с фактической адгезивной областью. Для применения данного способа необходима специальная подготовка субстрата.
Наряду с топографической модификацией поверхности широко используют различные полимерные материалы и составы для покрытия поверхности субстрата с целью иммобилизации белков и пептидов, которые способствуют высокоспецифическому взаимодействию клеток с лигандом на носителе.
Известен состав (5) для покрытия, включающий водорастворимый полимер, химически связанный с адгезивным для клеток пептидом, который предназначен для покрытия поверхности культурального сосуда или носителей для культивирования животных клеток в суспензии в бессывороточной среде. Однако он не обеспечивает получения надежной структуры.
Известен состав (6), содержащий адгезивные для клеток белки, ковалентно связанные с поверхностью субстрата для клеточного культивирования с целью улучшения клеточного прикрепления и стабилизации клеточного роста. Однако такой состав дорогостоящий.
Известен состав (7) для покрытия субстратов ростовыми факторами для стимуляции роста эукариотических клеток. Однако данный состав не позволяет получить стабильный белковый слой.
Известен состав (8) для покрытия, содержащий поли-L-лизин в солевом растворе для покрытия поверхности таких субстратов, как пластик, стекло или микропористые волокна. Данный способ, как и способ (7), не позволяет получить стабильный белковый слой, что является необходимым условием для создания тканеподобных структур.
Известен способ покрытия культуральной поверхности положительно заряженными белками (9), который является наиболее близким по технической сущности к предлагаемому изобретению и выбран в качестве прототипа. В известном способе на поверхность культурального сосуда наносят суммарный гистон из ткани тимуса телят (Sigma IIA). На такой культуральной поверхности субстрата, содержащей адсорбированные белки, клетки клонируют в среде с минимальным количеством сыворотки.
Недостатками известного способа являются ненадежность структуры и нестабильность белкового слоя, что не позволяет эффективно и надежно создавать тканеподобную структуру. Указанные недостатки обусловлены тем, что использование субстрата с адсорбированным белковым слоем не обеспечивает стерического соответствия адгезивных белков и адгезионных рецепторов на поверхности клетки и имеется вероятность открепления от субстрата адсорбированных пистонов и их переход в культуральную среду и интернализации гистона клетками, прикрепленными к субстрату.
Предлагаемое изобретение лишено указанных недостатков благодаря осуществлению топографической модификации поверхности при нанесении на нее биосовместимых полимерных микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм с иммобилизованными на их поверхности адгезивными для клеток положительно заряженными гистонами.
Техническим результатом предлагаемого изобретения являются повышение надежности структуры и стабильности белкового слоя трехмерной матрицы, упрощение и удешевление способа ее получения на поверхности субстрата, используемого в дальнейшем в качестве основы для получения тканеподобных клеточных структур, за счет адсорбции биосовместимых полимерных микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм, с иммобилизованными на их поверхности гистонами, на поверхности субстрата, что обеспечивает эффективное прикрепление клеток к микросферам и имеет ряд преимуществ, которые обусловлены, в основном, тем, что:
- физическая адсорбция микросфер - менее сложный процесс, чем химическая модификация поверхности;
- получение микросфер с модифицированной поверхностью дешевле и может иметь промышленный масштаб по сравнению с химическим присоединением белков к поверхности;
- требуется небольшое количество микросфер для покрытия достаточно большой поверхности субстрата по сравнению с традиционными сферическими микроносителями, диаметр которых от 100 до 250 мкм.
- предотвращается переход чужеродного белка из субстрата в культуральную среду, что исключает возможность ингибирования роста клеток.
- микросферы могут быть использованы для топографической модификации поверхности субстрата с целью создания трехмерных матриц, которые с нанесенными на них клетками являются основой для формирования тканеподобных клеточных структур, а также могут быть использованы для сокультивировании клеток для целей тканевой инженерии и в качестве моделей in vitro для масштабного скрининга лекарственных средств и биологически активных веществ.
Технический результат достигается тем, что известном способе клонирования клеток, который включает известные и общие с заявленным новым способом признаки, используют иммобилизацию гистонов из ткани тимуса телят на поверхности субстрата, адсорбцию гистонов на поверхности субстрата, удаление неадсорбированного белка, оценку способности прикрепления, распластывания, морфологического состояния и скорости роста клеток при культивировании на модифицированной гистонами поверхности субстрата, в предлагаемом способе поверхность субстрата топографически модифицируют микросферами, покрытыми гистонами, причем используемые гистоны предварительно ковалентно связывают с поверхностью биосовместимых полимерных микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм, причем перед ковалентным связыванием гистонов проводят активацию микросфер, которую осуществляют добавлением к водной суспензии микросфер сшивающего агента, в качестве которого используют бромциан при концентрации не более 0,42 моль/л, при температуре не более 4°С и времени инкубации не более 2 мин, затем активированные микросферы осаждают при центрифугировании и осадок промывают дистиллированной водой и повторно центрифугируют, после чего проводят повторное суспензирование микросфер в растворе гистона при весовом соотношении белка и микросфер, равном 1:100, а реакцию ковалентного связывания осуществляют при рН 7,5-8,0, температуре не более 4°С, времени инкубации не более 2 ч, затем микросферы с ковалентно связанными гистонами осаждают центрифугированием, после чего микросферы, содержащие от 160 до 200 мкг белка на 1,0 г, наносят на поверхность субстрата в количестве от 0,5 до 1,0 мг на 1,0 см2 и высушивают при комнатной температуре, затем промывают буферным раствором рН 7,5 для удаления не связанного с субстратом материала, а полученный слой микросфер на поверхности субстрата с нанесенными на него клетками используют в качестве основы для получения тканеподобных клеточных структур. Помимо этого требуемое количество иммобилизованного белка определяют аминокислотным анализом. При этом за оптимальное количество иммобилизованного гистона принимают 180 мкг белка на 1,0 г микросфер. Для иммобилизации выбирают комбинации различных типов гистонов и их ковалентные конъюгаты. В частности, выбирают суммарный гистон, коровые гистоны и их ковалентные конъюгаты. При этом клетки культивируют в бессывороточной среде с ростовыми добавками.
В предлагаемом изобретении для топографической модификации поверхности культуральных сосудов используют биосовместимые полимерные микросферы, приготовленные из кристаллизованного декстрана диаметром не более 1,0 мкм, и положительно заряженные белки, выбранные из группы, содержащей гистоны H1, Н2А, Н2В, Н3, Н4, комбинации различных типов гистонов, перекрестно сшитые конъюгаты различных типов гистонов.
Заявленный способ был апробирован в лабораторных условиях на базе Санкт-Петербургского государственного университета и Института цитологии РАН СПб. Результаты проведенных исследований поясняются следующими примерами (более подробные пояснения лабораторных испытаний с описанием прилагаемых фигур приведены в приложении к данному описанию):
Пример 1.
Получение гистонов и микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм и химическое связывание гистонов с микросферами осуществляют следующим образом. Препараты суммарного гистона сернокислого из ткани тимуса телят получают известным способом (10). Препараты коровых гистонов, содержащие в своем составе гистоны Н2А, Н2В, Н3, Н4, получают из суммарного гистона (11). Препараты отдельных фракций гистонов получают при хроматографическом разделении препарата коровых гистонов (11).
Электрофоретический анализ препаратов гистонов проводят в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН) по методу Томаса и Коррнберга (12). Электрофорез в полиакриламидном геле в присутствии ДСН при высоком значении рН системы позволяет фракционировать белки в зависимости от их молекулярной массы. В присутствии ДСН фракции гистонов могут быть разделены в порядке их возрастающей подвижности: H1, Н3, Н2В, Н2А, Н4. Растворимые ковалентные конъюгаты суммарного и коровых гистонов получают при использовании метода перекрестного связывания (13). Получение растворимых ковалентных конъюгатов суммарного гистона осуществляют следующим образом.
Суммарный гистон конъюгируют при использовании метода перекрестного связывания. Образец суммарного гистона в количестве 20 мг растворяют в фосфатно-солевом буферном растворе рН 7,5 до конечной концентрации 2 мг/мл и диализуют против 0,2 М натрия тетраборнокислого, подкисленного до рН 9,0 концентрированной соляной кислотой. Диализ проводят в течение 18 ч при температуре 4°С. Реакцию конъюгирования проводят при использовании в качестве сшивающего агента диметилсуберимидат гидрохлорида до конечной концентрации 5 мг/мл и реакцию проводят в течение 30 мин при температуре 23°С при перемешивании раствора на магнитной мешалке. Реакцию останавливают добавлением равного объема 1,0 М моноэтаноламина, рН 8,0. Раствор инкубируют в течение 2 ч при температуре 23°С, подвергают диализу против дистиллированной воды, как описано выше, замораживают и высушивают сублимацией.
Перекрестно сшитые конъюгаты суммарного гистона анализируют электрофорезом в ДСН - 15% ПААГ, рН 8,8.
Электрофоретический анализ перекрестно сшитых конъюгатов суммарного гистона показывает, что ковалентные конъюгаты суммарного гистона содержат в своем составе димеры и олигомеры гистонов.
Традиционные сферические микроносители, полученные на основе полистирола, сефадекса, полиакриламида, коллагена и желатина, используются для размножения адгезивных клеток в суспензии и в качестве компонента структурной матрицы для прикрепления клеток в монослойной культуре. К таким сферическим микроносителям, в частности, относятся перекрестно сшитые декстрановые гранулы, покрытые коллагеном (Cytodex 3; Pharmacia, Uppsala, Sweden) диаметром от 100 до 250 мкм (14). Рост клеток на их поверхности происходит так же, как в монослое, который модифицирован только радиусом кривизны сферических поверхностей различного диаметра. Микроносители на основе перекрестно сшитого декстрана имеют крупные поры и подвержены сжатию, что затрудняет сбор продуктов, которые секретируются в культуральную среду (15).
Кроме того, ковалентная сшивка цепей декстрана в значительной мере изменяет структуру и химическую стабильность микроносителей. Поэтому перекрестно сшитые биодеградируемые микроносители при их распаде образуют продукты, токсичные для жизнедеятельности клеток. Сферические микроносители, площадь поверхности которых значительно превышает размер распластанной клетки, не обеспечивают стерического соответствия для взаимодействия адгезивных для клеток белков с адгезионными клеточными рецепторами. Получение микросфер на основе кристаллического декстрана осуществляют по способу Шредера (16). Этот способ основан на кристаллизации полисахаридов в эмульсионной среде под действием осадителя - ацетона. Для получения микросфер 500 мг декстрана с молекулярной массой 500000 и 500 мг декстрана с молекулярной массой 10000 растворяют в 0.5 мл воды и добавляют 5 мл эмульсионной среды (хлопковое масло). Эмульсию обрабатывают ультразвуком при мощности 50 Вт в течение 30 сек. Затем гомогенную суспензию по порциям вносят в ацетон (300 мл), содержащий 0.1% Твин-80, при перемешивании на магнитной мешалке. Полученные микросферы промывают ацетоном (3×50 мл) и дистиллированной водой (4×50 мл) при центрифугировании и высушивают при комнатной температуре.
Образцы микросфер из кристаллизованного декстрана анализируют с использованием электронной микроскопии при их нанесении на поверхность стекла.
Для этого стандартные образцы стекла обрабатывают смесью этанол-эфир (в равных объемах) в течение 1 ч и выдерживают при 500°С в течение 1 ч.
Поверхность стекла покрывают водной суспензией микросфер и высушивают при комнатной температуре.
Результаты электронной микроскопии представлены на фиг.1-3. Показано, что микросферы имеют средний диаметр 1,0 мкм и формируют однородный слой на поверхности стекла. Слой микросфер на поверхности стекла устойчив к действию культуральной среды при длительном хранении.
В предпочтительном варианте осуществления предлагаемого изобретения топографическую модификацию поверхности культуральных сосудов проводят полимерными микросферами из кристаллизованного декстрана диаметром 1,0 мкм, ковалентно связанными с суммарным гистоном.
Ковалетное связывание суммарного гистона с микросферами осуществляют следующим образом.
Образец микросфер из кристаллизованного декстрана в количестве 100 мг промывают ацетоном и осаждают центрифугированием. После центрифугирования микросферы суспензируют в 1.0 мл дистиллированной воды и помещают в ледяную баню. Перед иммобилизацией гистона на поверхности микросфер проводят предварительную активацию микросфер сшивающим агентом, в качестве которого выбирают бромциан. Активацию проводят в присутствии триэтиламина для связывания выделяющейся в ходе активации бромисто-водородной кислоты. Для этого к суспензии микросфер добавляют 50 мг бромциана до конечной концентрации 0,42 моль/л и 0.1 мл триэтиламина до конечной концентрации 0,64 моль/л при интенсивном перемешивании и выдерживают в течение двух минут. Активированные микросферы промывают ацетоном шесть раз (6×12 мл) и два раза дистиллированной водой (2×12 мл) при центрифугировании. После последнего центрифугирования к активированным микросферам добавляют 1.0 мл 0,1% раствора суммарного гистона в фосфатно-солевом буфере рН 7,5. Полученную вторичную суспензию микросфер при весовом соотношении белка и микросфер, равном 1:100, инкубируют при 4°С в течение 2 ч для связывания гистоновых белков с активированными микросферами. Микросферы со связанным белком осаждают из суспензии при повторном центрифугировании и промывают дистиллированной водой шесть раз (6×12 мл), замораживают и высушивают сублимацией.
Ковалентное связывание обусловлено реакцией между ε-аминогруппой лизиновых остатков гистонов и активными группами в цепях полисахаридов.
Определение количества белка, связанного с микросферами, осуществляют с помощью аминокислотного анализа (17). Декстрановые микросферы (50 мг), ковалентно связанные с суммарным гистоном, высушивают до постоянного веса при 50°С. В качестве стандарта используют препарат суммарного гистона (10 мг). Оба образца гидролизуют 6 н. хлористо-водородной кислотой в герметических пробирках в течение 24 ч при 110°С. После высушивания образцов до постоянного веса проводят аминокислотный анализ и рассчитывают количество белка.
Количество белка оценивают на основании данных по содержанию в гидролизатах устойчивых к гидролизу аминокислот, таких как аспарагиновая кислота, глицин, глутаминовая кислота.
Например, в анализируемых образцах по данным аминокислотного анализа содержание аспарагиновой кислоты составляет 200 мкг в 10 мг образца суммарного гистона и 0,18 мкг в 50 мг образца декстрановых микросфер. Следовательно, в образце микросфер массой 50 мг содержится 9 мкг суммарного гистона. Отсюда количество ковалентно связанного суммарного гистона с поверхностью микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм составляет 180 мкг белка на 1,0 г микросфер или 5,73 пикомоля на 1,0 см2 поверхности микросфер (расчетная величина).
Расчет количества суммарного гистона, ковалентно связанного с 1,0 см2 поверхности микросфер, проводят следующим образом. Плотность микросфер из кристаллизованного декстрана близка к 1,0 г на 1,0 см3, а их диаметр равен 1,0 мкм (0,0001 см), отсюда количество микросфер в 1,0 см3 составляет 1012 единиц. Площадь сферы выражается формулой: Sсф.=4πR2, отсюда площадь поверхности каждой микросферы равна 314·10-10 см2, а площадь всех микросфер в 1,0 см3 составляет 314·102 см2. Содержание суммарного гистона в 1,0 см3 составляет 180 мкг (180000 нг), а в пересчете на 1,0 см2 эта величина составляет 573 мг (180000: 314·102=573 нг) или 5,73 пикомоля суммарного гистона с молекулярной массой 100 кДа.
Культивирование клеток проводят на топографически модифицированной микросферами, ковалентно связанными с гистонами, поверхности культуральных сосудов. Используют 6-луночные культуральные сосуды фирмы Corning Costar. Каталоговый №3506. Для этого на поверхность культурального сосуда диаметром 35 мм наносят 10-20-кратный избыток микросфер, что составляет от 1,5 до 2,0 мг на 1,0 см2 водной суспензии микросфер, содержащих микросферы из кристаллизованного декстрана диаметром около 1,0 мкм, ковалентно связанные с суммарным гистоном.
По расчету объемное количество микросфер, необходимое для формирования слоя толщиной 1,0 мкм на поверхности субстрата площадью 10 см2, составляет 10-3 см3. Учитывая, что объем шара (идеальной микросферы) составляет 52% от объема описываемого куба, а плотность микросфер близка к 1,0 г на 1,0 см3, тогда объем величиной 10-3 см3 будет вмещать 520 мкг микросфер или 52 мкг на 1,0 см2.
Культуральные сосуды выдерживают в ламинарном боксе в течение ночи для полного высушивания субстрата и затем промывают фосфатно-солевым буфером рН 7,5 для удаления не связанного с субстратом материала и повторно высушивают, как описано выше. На поверхности субстрата формируется однородный слой микросфер, который имеет повышенную устойчивость к действию культуральной среды.
Пример 2.
В этом варианте осуществления предлагаемого изобретения для топографической модификации поверхности культуральных сосудов используют перекрестно сшитые конъюгаты суммарного гистона, ковалентно связанные с полимерными микросферами из кристаллизованного декстрана диаметром не более 1,0 мкм. Получение микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм осуществляют, как в примере 1. Получение перекрестно сшитых конъюгатов суммарного гистона проводят на поверхности микросфер и осуществляют следующим образом. К образцу микросфер в количестве 10 мг с первично ковалентно связанным суммарным гистоном добавляют 2,5 мг диметилсуберимидат гидрохлорида в качестве сшивающего агента. Реакцию ковалентного связывания проводят в течение 30 мин при 23°С при перемешивании суспензии на магнитной мешалке. Реакцию ковалентного связывания инициируют доведением рН суспензии до 9,1 при добавлении 0,2 мл насыщенного раствора натрия тетраборнокислого. Реакцию ковалентного связывания останавливают добавлением равного объема 1,0 М моноэтаноламина, рН 8,0. Суспензию инкубируют в течение 2 ч при температуре 23°С и затем подвергают диализу против дистиллированной воды в течение 18 ч, замораживают и высушивают сублимацией.
Ковалентное связывание обусловлено реакцией между ε-аминогруппами лизиновых остатков в молекулах первично связанных с микросферами гистонов и вторично добавленных гистонов к суспензии микросфер.
Количество белка, ковалентно связанного с микросферами, определяют, как описано в примере 1. Количество ковалентно связанных перекрестно сшитых конъюгатов суммарного гистона с поверхностью микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм составляет 200 мкг белка на 1,0 г микросфер.
Топографическую модификацию поверхности культуральных сосудов полимерными микросферами из кристаллизованного декстрана диаметром не более 1,0 мкм, ковалентно связанными с перекрестно сшитыми конъюгатами суммарного гистона, осуществляют, как описано в примере 1.
Пример 3.
В этой серии экспериментов оценивают способность клеток распластываться на субстратах, покрытых разными типами гистонов. Для этого проводят анализ изменения структуры актинового цитоскелета и формы клеток, распластанных на субстратах, покрытых гистонами разных типов. Используют постоянную линию клеток почки эмбриона человека (НЕК 293) и постоянную линию клеток эмбриональных фибробластов мыши (3T3/BALB clone A31), полученные из Российской коллекции клеточных культур (Институт цитологии. Российская академия наук, Санкт-Петербург). Клетки культивируют на среде Дальбекко (ДМЕМ, Биолот) с добавлением 10%-ной эмбриональной бычьей сыворотки крови (Биолот).
Анализируют следующие типы гистоновых белков: H1, H2B, Н3, Н2А+Н4, суммарный гистон, коровые гистоны, перекрестно сшитые конъюгаты суммарного гистона, перекрестно сшитые конъюгаты коровых гистонов.
Окрашивание актинового цитоскелета проводят следующим образом. На силиконизированное стекло (Reppel-Silane, Pharmacia) наносят раствор белка (гистоновые белки растворяют в дистиллированной воде до концентрации 20 мкг/мл) и инкубируют в течение 18 ч при 4°С. После чего инкубируют в течение 1 ч при 37°С в 2% растворе бычьего сывороточного альбумина (БСА) в фосфатно-солевом буфере рН 7,5 (ФСБ) для того, чтобы исключить неспецифическое связывание клеток с субстратом. На субстрат наносят клетки (100 мкл, 105 клеток в 1,0 мл) и инкубируют в течение 1 ч в СO2-инкубаторе. Прикрепившиеся клетки фиксируют в течение 10 мин 4%-ным раствором формальдегида в ФСБ, инкубируют в течение 10 мин при комнатной температуре с 0,1%-ным раствором Тритона Х-100 в ФСБ и затем окрашивают родамином-фаллоидином в течение 10 мин при 37°С. Препараты в пропилгалате анализируют с помощью микроскопа Opton ICM (Zeiss).
Клетки демонстрируют различную структуру цитоскелета после распластывания на субстратах, покрытых разными типами гистонов, которые изображены на фиг.4а-ж; фиг.5а-д; фиг.6а-г.
Через 4 ч инкубации клетки линии НЕК 293 прикрепляются к субстрату, но не распластываются. Под флуоресцентным микроскопом видно диффузное окрашивание актина. Через 20 ч инкубации степень распластывания клеток зависит от типа гистонового белка, покрывающего подложку (фиг.4а-ж). Все изучаемые гистоновые белки можно разделить на три группы по способности клеток распластываться на субстратах, покрытых гистонами разных типов.
Первая группа. Эту группу представляет гистон H1. Показано, что распластывание клеток на субстрате, покрытом гистоном H1, очень слабое, клетки практически не вытянутые, актиновые олигомеры без какой-либо регулярной структуры. Эти результаты демонстрируют, что гистон H1 не является подходящим субстратом для культивирования клеток НЕК 293 и 3T3/BALB.
Вторая группа. Эта группу составляют суммарный гистон, коровые гистоны и гистон Н2А. Показано, что распластывание клеток лучше, чем в первой группе. Клетки поляризованы, актин концентрируется на концах вытянутых клеток, однако формирования структур, содержащих актин, не наблюдается. Суммарный гистон, коровые гистоны и гистон Н2А, составляющие эту группу, могут быть лучшими субстратами для культивирования клеток линии НЕК 293 и 3T3/BALB. Отсутствие организованной структуры цитоскелета может подавлять пролиферацию клеток. Из данных литературы известно, что формирование стресс-фибрилл является важным фактором для стимуляции пролиферации.
Третья группа. Эту группу составляют перекрестно сшитые конъюгаты суммарного гистона и гистон Н2В. Клетки НЕК 293 и 3T3/BALB хорошо распластаны на этих субстратах, сильно поляризованы, имеют широкую ламеллу на ведущем крае и много микроворсинок и филлоподий, ориентированных в разных направлениях. Длинные выросты отдельных клеток имеют тенденцию контактировать с другими клетками, распластанными на субстрате. Наблюдается формирование фибриллярных актиновых структур. Эти результаты позволяют предполагать, что перекрестно сшитые конъюгаты суммарного гистона и гистон Н2В, которые составляют эту группу, являются наилучшими субстратами для культивирования клеток НЕК 293 и 3T3/BALB. Хорошо известно, что гистоны отличаются по общему содержанию гидрофобных и гидрофильных групп. Наибольшее количество гидрофильных групп имеет гистон Н2В (18). Вполне вероятно, что именно гистон Н2В, содержащийся в суммарном гистоне, отвечает за взаимодействие клеток с суммарным гистоном и стимулирует пролиферацию.
Известно, что клетки уже через 30 мин инкубации на субстрате начинают вырабатывать собственный внеклеточный матрикс и использовать эти белки для прикрепления и распластывания. Поэтому в отдельной серии экспериментов исследуют прикрепление и распластывание клеток на субстратах, покрытых гистонами в присутствии ингибитора синтеза белка циклогексимида. Клетки НЕК 293, распластанные на субстратах, покрытых гистонами различных типов, в присутствии циклогексимида, представлены на фиг.5а-д. Как и в уже описанных экспериментах, клетки, распластанные на перекрестно сшитых конъюгатах суммарного гистона и на гистоне Н2В, демонстрируют наибольшее распластывание и наилучшую структуру актинового цитоскелета. Клетки на этих субстратах демонстрируют мобильный фенотип и формируют ламеллоподии. В присутствии циклогексемида клетки используют для прикрепления и распластывания только гистоновую подложку, а не собственный внеклеточный матрикс. Таким образом, результаты вышеописанных экспериментов показывают, что клетки могут использовать для прикрепления, распластывания и роста субстраты, покрытые гистонами.
Пример 4.
В этой серии экспериментов оценивают прикрепление и распластывание адгезивных клеток на топографически модифицированной микросферами, ковалентно связанными с гистонами, поверхности культуральных сосудов. Используют 6-луночные культуральные сосуды фирмы Corning Costar.
Для этого поверхность 6-луночных культуральных сосудов топографически модифицируют полимерными микросферами из кристаллизованного декстрана диаметром не более 1,0 мкм, ковалентно связанными с положительно заряженными гистонами.
В этих экспериментах исследуют следующие типы субстратов.
Субстрат 1. Поверхность культуральных сосудов покрывают микросферами, ковалентно связанными с суммарным гистоном.
Субстрат 2. Поверхность культуральных сосудов покрывают микросферами, ковалентно связанными с перекрестно сшитыми конъюгатами суммарного гистона.
Субстрат 3. Поверхность культуральных сосудов покрывают микросферами, ковалентно связанными с коровыми гистонами.
Субстрат 4. Поверхность культуральных сосудов покрывают микросферами, ковалентно связанными с перекрестно сшитыми конъюгатами коровых гистонов.
В качестве контроля используют не покрытую микросферами поверхность культуральных сосудов.
Используют следующие культуры клеток.
(а) Постоянная линия клеток почки эмбриона человека (НЕК 293).
Клеточная линия НЕК 293 обычно поддерживается в среде ДМЕМ (среда ИГЛА в модификации Дальбекко), которая содержит 10% эмбриональную бычью сыворотку.
В каждую лунку 6-луночных культуральных сосудов, содержащую ДМЕМ и эмбриональную бычью сыворотку, вносят клетки НЕК 293. Клетки культивируют в СО2-инкубаторе при 37°С в течение 10-14 сут. Клетки снимают с помощью трипсина и оценивают количество клеток.
В каждую лунку 6-луночных культуральных сосудов вносят 5×105 клеток НЕК 293 и выдерживают 4.5 ч в бессывороточной среде и 24 ч при добавлении 10% эмбриональной бычьей сыворотки крови при 37°С в СО2-инкубаторе. После инкубации клетки фиксируют с помощью метанола и окрашивают кристаллическим фиолетовым.
Прикрепление и распластывание клеток анализируют под инвертированным микроскопом (ув. 10×10). Число клеток НЕК 293, прикрепившихся к субстрату, покрытому микросферами, ковалентно связанными с комбинациями различных типов гистонов, одинаково во всех вариантах опытов и в контроле. Клетки прикрепляются к микросферам через 4.5 ч. Не обнаруживается заметных различий в степени прикрепления клеток к исследуемым различным субстратам (субстраты 1-4). Распластывание клеток на субстрате начинается после 4 ч инкубации. После 24 ч инкубации в присутствии сыворотки клетки хорошо распластываются.
Морфологический анализ окрашенных распластанных клеток с помощью инвертированного микроскопа показывает, что характер распластывания клеток на поверхности субстрата, покрытой микросферами из кристаллизованного декстрана диаметром не более 1,0 мкм, ковалентно связанных с гистонами, отличается от распластывания клеток на контрольной поверхности субстрата и имеет свои особенности.
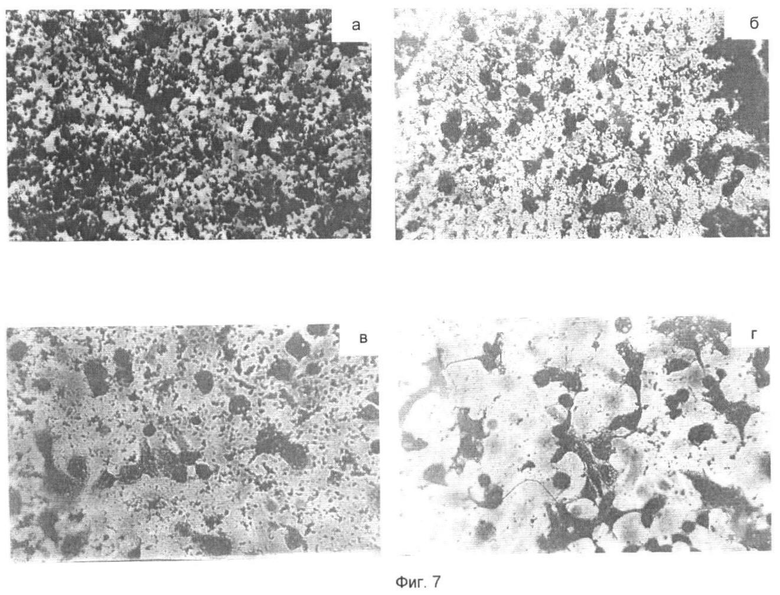
На однородном слое микросфер, где микросферы расположены на оптимальном расстоянии друг от друга, клетки в процессе прикрепления к нескольким микросферам подвергаются функциональному растяжению с формированием длинных отростков, которые соединяют клетки друг с другом, формируя трехмерные сетеобразные клеточные структуры (фиг.7а-г).
Распределение микросфер на поверхности субстрата принимают за оптимальное в том случае, если максимальное расстояние между микросферами не превышает размер распластанной клетки.
На монослое микросфер клетки в процессе прикрепления взаимодействуют с большим количеством микросфер и хорошо распластываются, но без формирования длинных отростков. Клетки контактируют между собой и объединяются в плотные слои, образуя сетеобразные клеточные структуры.
На контрольной поверхности субстрата клетки в процессе распластывания также образуют большие кластеры и сеть, однако единичных распластанных клеток наблюдается гораздо больше.
(б) Постоянная линия клеток эмбриональных фибробластов мыши (BALB/3T3 clone A31).
В этой серии экспериментов используются те же субстраты, что и в разделе (а).
Наблюдается одинаковое число прикрепившихся клеток 3Т3 BALB к субстрату во всех вариантах экспериментов. Наибольшее количество клеток прикрепляется к микросферам через 4.5 ч (фиг.8а-в). Распластывание 3Т3 BALB клеток на субстратах начинается после 4.5 ч и происходит лучше, чем в случае НЕК 293 клеток. После 24 ч инкубации в присутствии сыворотки крови клетки хорошо распластываются. Клетки в процессе прикрепления к нескольким микросферам, расположенным на оптимальных расстояниях друг от друга, формируют длинные отростки, которые соединяют клетки друг с другом, образуя трехмерные сетеобразные клеточные структуры. Распластывание на микросферах лучше, чем в контроле.
Пример 5.
В этой серии экспериментов оценивают морфологическое состояние клеток после длительного культивирования на топографически модифицированной микросферами, ковалентно связанными с суммарным гистоном, поверхности культуральных сосудов.
В этой серии экспериментов используют 6-луночные культуральные сосуды, топографически модифицированные микросферами из кристаллизованного декстрана диаметром не более 1,0 мкм, ковалентно связанными с суммарным гистоном. В опытах используют клеточную линию НЕК 293 почки эмбриона человека.
Культивирование клеток осуществляют, как описано в примере 4. Клетки культивируют как в среде с сывороткой, так и в бессывороточной среде.
Для оценки состояния клеток НЕК 293 в течение 6 сут культивирования клетки фиксируют метанолом и окрашивают кристаллическим фиолетовым. Проводят анализ препаратов, полученных через 1 и 6 сут культивирования в среде с 10% эмбриональной бычьей сывороткой (вариант 1) и в бессывороточной среде с ростовыми добавками (вариант 2). После 1 сут культивирования наблюдают хорошее распластывание клеток на исследуемых субстратах и образование контактов между соседними клетками (фиг.9а-д). Между распластанными клетками наблюдают много свободных микросфер без клеток. Через 6 сут культивирования число распластанных клеток значительно увеличивается в обоих вариантах. Они растут в виде колоний, образуют большие кластеры и объединяются в плотный слой клеток, образуя сетеобразные клеточные структуры. На этой стадии культивирования наблюдается очень мало свободных микросфер. Рост культуры сопровождается образованием монослойности клеток в кластерах. Существенных различий между клетками, культивируемыми в среде с сывороткой и в бессывороточной среде, не наблюдают. На контрольных поверхностях клетки также образуют большие кластеры и сеть, однако единичных распластанных клеток наблюдается гораздо больше, чем в опытных вариантах.
Пример 6.
В этой серии экспериментов оценивают скорости роста адгезивных клеток на топографически модифицированной микросферами, ковалентно связанными с гистонами, поверхности культуральных сосудов.
Для этого 6-луночные культуральные сосуды покрывают микросферами, ковалентно связанными с суммарным гистоном.
Как показано в примере 4, на такой поверхности субстрата клетки хорошо прикрепляются и распластываются.
В этом исследовании используют две клеточные линии: постоянная линия клеток почки эмбриона человека (НЕК 293) и постоянная линия эмбриональных фибробластов мыши (3T3/BALB clone A31). В этой серии экспериментов культивирование клеток проводят как в среде, содержащей сыворотку, так и в среде, не содержащей сыворотку.
Культивирование клеток обычно осуществляют в среде, содержащей сыворотку. Сыворотка содержит в своем составе различные компоненты, которые позволяют клеткам адгезировать и расти на поверхности субстрата. Однако необходимо отметить, что сыворотка содержит в своем составе смесь многочисленных субстанций с физиологической активностью, которые высвобождаются из клеток крови и эндотелиальных клеток сосудов. Поэтому анализ и использование продуктов культивируемых клеток в среде, содержащей сыворотку, требуют использования определенных методов их очистки. Поэтому создание бессывороточного способа культивирования адгезивных клеток человека и животных является необходимым.
А. Постоянная линия клеток почки эмбриона человека (НЕК 293).
(а) Культивирование клеток в среде с сывороткой или в бессывороточной среде.
Клетки высевают на поверхность культуральных сосудов, покрытую микросферами, ковалентно связанными с суммарным гистоном, и культивируют в среде с сывороткой или в бессывороточной среде с ростовыми добавками.
Суспензию клеток (3×105 клеток на лунку диаметром 35 мм) высевают на указанные субстраты на 4 ч в бессывороточной среде ДМЕМ (среда ИГЛА в модификации Дальбекко). В течение этого времени большая часть клеток прикрепляется к субстрату. Затем бессывороточная среда заменяется либо средой с 10% эмбриональной бычьей сывороткой, либо бессывороточной средой с ростовыми добавками (трансферрин 10 мкг/мл, инсулин 25 мкг/мл, гидрокортизон 0,5 мкг/мл и ретиноидная кислота 0,1 мкг/мл).
Клетки культивируют в этих средах в течение 6 сут при 37°С и 5% СО2. Индекс пролиферации клеток определяют через 1, 3 и 6 сут. Каждый вариант повторяют по 3 раза. Таким образом, индекс пролиферации определяют в следующих вариантах:
- культивирование клеток на поверхности субстрата в среде с 10% эмбриональной бычьей сывороткой (контроль);
- культивирование клеток на поверхности субстрата, покрытой микросферами, ковалентно связанными с суммарным гистоном в среде с 10% эмбриональной бычьей сывороткой;
- культивирование клеток на поверхности субстрата, покрытой микросферами, ковалентно связанными с суммарным гистоном, в бессывороточной среде с ростовыми добавками.
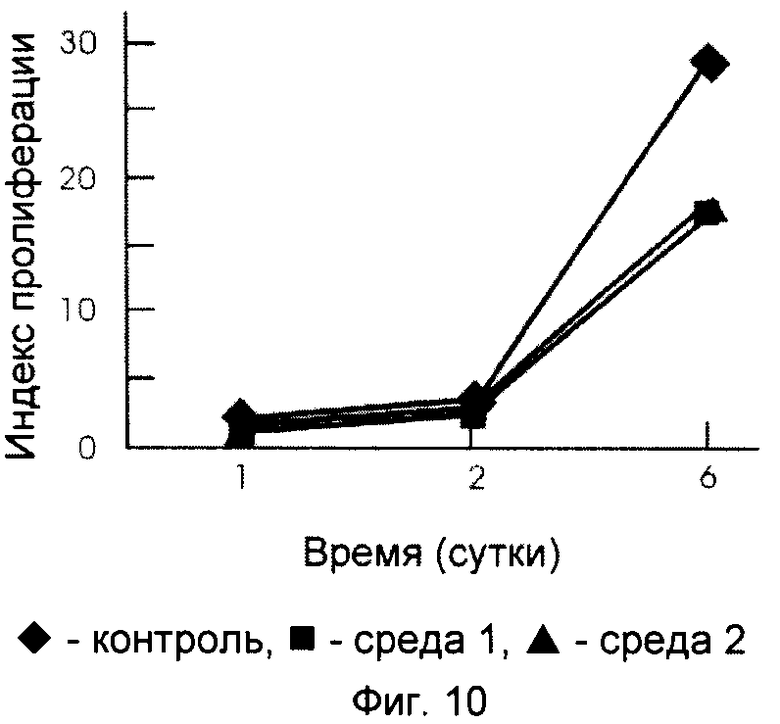
Морфологический анализ клеток на разных стадиях культивирования в указанных условиях проводят при микроскопировании фиксированных и окрашенных кристаллическим фиолетовым препаратов. Полученные результаты свидетельствуют, что при культивировании в течение 6 сут клетки хорошо распластываются и пролиферируют как на поверхности, покрытой микросферами, ковалентно связанными с суммарными гистонами, так и на поверхности в контроле. Наиболее интенсивный рост наблюдается через 3-6 сут культивирования (фиг.10). На всех исследованных сроках число клеток на тестируемых субстратах ниже, чем на контрольном субстрате, но индекс пролиферации практически одинаков. Наблюдаемое меньшее количество клеток на опытных субстратах объясняется более сильным взаимодействием их с данным субстратом и в связи с этим недостаточной эффективностью действия, обычно применяемого для снятия клеток реагента (Трипсин/ЭДТА). Эти эксперименты показывают, что скорость роста клеток одинакова как в среде с 10% эмбриональной бычьей сывороткой, так и в бессывороточной среде с ростовыми добавками.
(б) Культивирование в среде с сывороткой.
В этих экспериментах исследуют следующие типы субстратов:
- культивирование клеток на поверхности субстрата (контроль);
- культивирование клеток на поверхности субстрата, покрытой микросферами, ковалентно связанными с суммарным гистоном;
- культивирование клеток на поверхности субстрата, покрытой микросферами, ковалентно связанными с перекрестно сшитыми конъюгатами суммарного гистона.
Суспензию клеток (3,0×105 клеток на лунку диаметром 35 мм) высевают на указанные субстраты на 4 ч в бессывороточной среде ДМЕМ. Затем бессывороточная среда заменяется средой с 10% эмбриональной бычьей сывороткой. Клетки культивируют в этой среде в течение 11 сут при 37°С и 5% СО2. Индекс пролиферации определяют через 2, 4, 7, 11 суток после высева клеток на указанные поверхности. Каждый вариант повторяют по 3 раза. Прижизненный морфологический анализ клеток на разных стадиях культивирования в указанных условиях проводят под инвертированным микроскопом (ув. 10×10). Результаты анализа состояния клеток в течение 11 сут демонстрируют, что клетки распластываются как на микросферах, ковалентно связанных с суммарным гистоном, так и с перекрестно сшитыми конъюгатами суммарного гистона. Клетки пролиферируют с почти одинаковой скоростью в течение первых 7 сут культивирования (фиг.11). С 7 до 11 сут индекс пролиферации контрольных клеток не изменяется, то есть кривая роста выходит на плато, наступает стадия насыщения. Напротив, клетки на микросферах, ковалентно связанных с суммарным гистоном, только начинают входить в стадию насыщения. Наиболее интенсивный рост клеток от 4 до 11 сут наблюдается при культивировании их на микросферах, ковалентно связанных с перекрестно сшитыми конъюгатами суммарного гистона. Более длинная лаг-фаза в течение первых 4 суток связана с относительно низкой посевной концентрацией клеток и необходимостью кондиционирования субстрата белками внеклеточного матрикса. Эти эксперименты демонстрируют, что микросферы, ковалентно связанные с суммарным гистоном или с перекрестно сшитыми конъюгатами суммарного гистона, обеспечивают интенсивный рост клеток НЕК 293 в культуре.
Б. Постоянная линия эмбриональных фибробластов мыши (3T3/BALB clone A31).
В этих экспериментах исследуют пролиферацию клеток при их культивировании на субстратах, покрытых микросферами, ковалентно связанными с суммарным гистоном или с перекрестно сшитыми конъюгатами суммарного гистона.
Суспензию клеток (3×105 клеток на лунку диаметром 35 мм) высевают на указанные субстраты на 4 ч в бессывороточной среде ДМЕМ. В течение этого времени большая часть клеток прикрепляется к субстрату. Затем бессывороточную среду заменяют средой с 10% эмбриональной бычьей сывороткой. Количество клеток оценивают на 2 и 3 сут культивирования. В течение этого времени наблюдается очень интенсивная пролиферация, и через 3 сут образуется полный монослой клеток. Рост клеток на микросферах, ковалентно связанных с суммарным гистоном, интенсивнее (индекс пролиферации через двое суток - 5), чем на микросферах, ковалентно связанных с перекрестно сшитыми конъюгатами суммарного гистона (индекс пролиферации через 2 сут - 3). Окончательное количество клеток через 3 суток было в 7 раз выше первоначально посеянного.
Данное изобретение может быть использовано при создании заменителей ткани для имплантации и при сокультивировании клеток для целей тканевой инженерии, а также в качестве моделей in vitro для масштабного скрининга лекарственных средств и биологически активных веществ.
Список используемой литературы.
1. Nakanishi J, Takarada T, Yamaguchi К., Maeda M. 2008. Recent advances in cell micropatterning techniques for bioanalytical and biomedical sciences. Anal Sci. 24:67-72.
2. Khademhosseini A, Suh KY, Yang JM, Eng G, Yeh J, Levenberg S, Langer R. 2004. Layer-by-layer deposition of hyaluronic acid and poly-L-lysine for patterned cell co-cultures. Biomaterials. 25: 3583-92.
3. К.Y.Suh, J.Seong, A.Khademhosseini, P.E.Laibinis and R.Langer. 2004. A simple soft lithographic route to fabrication of poly(ethylene glycol) microstroctures for protein and cell patterning. Biomaterials. 25: 557-563.
4. Chen CS, Mrksich M, Huang S, Whitesides GM, Ingber DE. 1997. Geometric control of cell life and death. Science. 276(5317): 1425-8.
5. Katsuen S., Ohshima К, Kawamura S, Yamamoto R., Nishino T. 1997. Coating composition for culturing animal cells and method for culturing of the cells in serum-free condition. U.S. Patent 5,643,561.
6. Clapper DL, Hu WS, 1996. Cell culture support containing a cell adhesion factor and a positively-charged molecule. U.S. Patent 5, 512,474.
7. Cima LG, Merrill EW, Kuhl PR. 2000. Cell growth substrates with tethered cell growth effector molecules. U.S. Patent 6,045, 818.
8. Swiderek MS, Mannuzza FJ, Ilsley SR, Myles A. 1999. Preparation of a cell culture substrate coated with poly-D-lysine. U.S. Patent 5,932,473.
9. McKeehan WL, Ham RG. 1976. Stimulation of clonal growth of normal fibroblasts with substrata coated with basic polymers. J Cell Biol. 71(3):727-734 (прототип).
10. Горюхина О.А., Миглиниец М.П., Криева М.А. 1981. Способ получения суммарного гистона из животного сырья. Патент на изобретение №843915. Российская Федерация.
11. Горюхина О.А., Мюльберг А.А., Криева М.А., Тишкина Т.Е. 1989. Способ очистки препарата гистона Н4 из ткани тимуса телят.Патент на изобретение №1319352. Российская Федерация.
12. Thomas JO, Kornberg RD. 1975. An octamer of histones in chromatin and free in solution. Proc Natl Acad Sci USA. 72(7):2626-2630.
13. Горюхина О.А. 2001. Комплекс природных катионных белков и способ его получения. Патент на изобретение №2176517. Российская Федерация.
14. Bardouille С, Lehmann J, Heimann P, Jockusch H. 2001. Growth and differentiation of permanent and secondary mouse myogenic cell lines on microcarriers. Appi Microbiol Biotechnol. 55: 556-62.
15. Bulter M. 1987. Growth limitations in microcarder cultures. Adv.Biochem.Eng.Biotech. 4:57-84.
16. Schröder U. 1985. Crystallized carbohydrate spheres for slow release and targeting. Methods Enzymol. 112:116-128.
17. Lundblad R.L. 1995. Techniques in protein modification. CRC Press.
18. Добрецов Г.Е., Горюхина О.А., Борщевская Т.А. 1969. Состояние полярных групп и агрегация гистонов в водных растворах. Биохимия. 34:806-809.
Приложение
К описанию заявки на изобретение «Способ получения тканеподобных структур из клеток животного происхождения для использования их при создании заменителей ткани» (заявитель Федеральное государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный университет)
Известно, что гистоны - это катионные (основные) белки, которые содержатся в клеточных ядрах всех тканей животных и растений. В клеточном ядре гистоны в значительной степени ответственны за компактизацию ДНК. Гистоны легко образуют комплексы с негистоновыми белками ядра и цитоплазмы, а также между собой.
Всего известно пять классов гистонов, которые различаются между собой по содержанию в их молекуле основных аминокислот - лизина и аргинина (H1, H2A, Н2В, Н3 и Н4). Гистоны гетерогенны и по молекулярному весу. Наибольшую молекулярную массу имеет гистон H1 - 21500 Да, следующие по величине гистоны Н3, H2A, Н2В, Н4 - 15320, 14000, 13774, 11280 Да соответственно (1).
Общей характерной чертой эукариотических клеток является поступление определенного белка в специфический компартмент клетки. Однако имеются наблюдения, что некоторые белки встречаются также в иных компартментах клетки и могут выходить во внеклеточное пространство помимо их традиционных мест локализации, т.е. встречаются многокомпартментные изоформы белков (2-3).
Одним из примеров многокомпартментной локализации белков является наличие ядерных белков, таких как гистоновые и негистоновые хромосомальные белки с высокой электрофоретической подвижностью HMG (high mobility group) во внеклеточном пространстве (4-7). Благодаря возможности выхода гистонов в межклеточную среду они могут проявлять биологическую активность, вызывая различные биохимические и функциональные изменения в клетках.
Экзогенные гистоны известны как антимикробные и антивирусные агенты (8, 9).
Кроме того, экзогенные гистоны известны как биоактивные агенты, которые за счет их высокого положительного заряда способны увеличивать проницаемость биологических мембран и проникать через них (10-13).
Поэтому экзогенные гистоны привлекают внимание в плане практической реализации полезных свойств гистонов в биотехнологии, в частности, по двум направлениям:
- с точки зрения реализации полезных свойств гистонов в биомедицине [так, например, в патенте RU №2045278 описано потенцирующее влияние суммарного гистона на противотуберкулезное действие изониазида при лечении экспериментального туберкулеза животных (14); в патентах US 6,884,423; US 4,818,763 и US 5,182,257 описано использование гистона H1 и димеров гистонов Н2А:Н2В в терапевтических целях (9, 15, 16)];
- с точки зрения использования природных полимеров, содержащих в своем составе большое количество основных групп в технологии культивирования и клонирования клеток, представляется особенно перспективным с точки зрения его широкой практической реализации.
Культура тканей - метод или процесс размножения и/или поддержания метаболизма тканей или отдельных клеток, полученных из организма в искусственной питательной среде. Для пролиферации большинства типов нетрансформированных клеток необходимо их предварительное прикрепление к поверхности твердого субстрата.
Природа субстрата определяется в основном типом используемых клеток и характером проводимых исследований. Почти повсеместное распространение получил в настоящее время полистирол, специально обработанный так, чтобы увеличить смачиваемость и придать поверхности отрицательный заряд. В особых случаях (культура нейронов, мышечные клетки, некоторые эпителиальные культуры) пластиковая поверхность предварительно покрывается желатином, коллагеном или полилизином для придания ей положительного заряда. Клетки большинства культур, включая первичные, прикрепившись к стеклу или пластиковому субстрату, размножаются до образования монослоя.
Адгезия клеток к поверхности субстрата - многоступенчатый процесс. Взаимодействие зависимых от прикрепления клеток с адгезивной поверхностью включает стадии, которые предшествуют пролиферации: контакт клетки с субстратом, прикрепление клеток к субстрату, образование адгезивных контактов и распластывание клеток.
При культивировании клеток взаимодействие между клетками и субстратом опосредуется белками, которые либо были преиммобилизованы на материале поверхности, либо адсорбированы из культуральной среды или секретированы самими клетками в процессе культивирования.
Белки внеклеточного матрикса неспецифически адсорбируются на поверхности субстрата, и клетки взаимодействуют с материалом поверхности не прямо, а за счет взаимодействия с адсорбированными белками внеклеточного матрикса, такими как фибронектин, ламинин и коллаген (17).
Приспособление клеток к субстрату проявляется в формировании прочных адгезивных контактов (от 1,0 мкм2 и выше), где происходит молекулярное взаимодействие между адгезионными рецепторами и их белками внеклеточного матрикса (лигандами) с образованием фокальных контактов (18, 19).
Контроль клеточной адгезии определяется специфическим взаимодействием между рецепторами клеточной поверхности и их лигандами.
Взаимодействие между клеткой и внеклеточным матриксом опосредуется поверхностными рецепторами и протеогликанами, которые взаимодействуют с белками внеклеточного матрикса, такими как коллаген, фибронектин, витронектин и ламинин. Эти белки имеют специфические связывающие домены для соответствующих рецепторов (20, 21).
Например, у фибронектина имеется домен, который содержит специфическую последовательность из трех аминокислотных остатков (Arg-Gly-Asp) триплет RGD, где R - агинин, G - глицин, D - аспарагиновая кислота, которые узнают интегрины (22-24).
Другой класс доменов в белках адгезивных для клеток известен как гепарин-связывающий домен (термин получил свое название в силу того, что хроматография, основанная на сродстве к гепарину, используется для очистки белков). Эти домены связываются с протеогликанами клеточной поверхности, содержащими сульфированные гликозаминогликаны, такие как хондроитинсульфат и гепарансульфат (20).
Пептидная последовательность в гепарин-связывающих белках, которая связывается с протеогликанами клеточной поверхности, обогащена катионными остатками основных аминокислот, такими как аргинин, лизин, также содержит гидрофобные аминокислотные остатки: аланин, изолейцин, лейцин, пролин и валин (25-27).
Белки, содержащие в своем составе гепарин-связывающие домены, также используются для покрытия поверхности субстрата.
Известно, что гистоны наряду с кластерами катионных аминокислот (поликатионные домены) содержат в своем составе гепарин-связывающие домены (27).
Клеточная адгезия контролируется не только биохимическими сигналами, как описано выше. На прикрепление клеток к субстрату оказывают влияние и неспецифические факторы. К ним относятся такие факторы, как топография поверхности субстрата (19).
Такие субстраты аналогичны трехмерным матрицам, которые более широко известны в литературе как скаффолды (28, 29). Такие матрицы используют в качестве субстратов для тканевой инженерии с целью образования сложных композиций клеток для формирования тканеподобных структур. Клетки прикрепляются, пролиферируют и дифференцируются на таких трехмерных матрицах.
Одним из вариантов получения биосовместимых нетоксичных для клеток носителей является приготовление микросфер на основе кристаллизованного декстрана (30). За счет кристаллической структуры такие микросферы диаметром не более 1,0 мкм имеют очень маленькие поры и не подвержены сжатию. На фиг.1-3 представлены микросферы из кристаллизованного декстрана по данным электронной микроскопии, получают которые по способу Шредера (30). Для иммобилизации гистонов на поверхности микросфер проводят реакцию ковалентного связывания (примеры 1, 2).
Полученные микросферы используют для топографической модификации субстрата (пример 1). Расчет необходимого количества микросфер для покрытия поверхности субстрата поясняется в примере 1. Распределение микросфер на поверхности субстрата принимают за оптимальное в том случае, если максимальное расстояние между микросферами не превышает размер распластанной клетки. Результаты проведенных сравнительных исследований в отношении способности клеток прикрепляться и распластываться на субстратах, покрытых разными типами гистоновых белков, приведены в примере 3. На фиг.4-6 представлен анализ изменения структуры актинового цитоскелета и формы клеток, распластанных на субстратах, покрытых гистонами разных типов. На фиг.4 демонстрируется организация актинового цитоскелета постоянной линии клеток почки эмбриона человека (НЕК 293), распластанных на субстратах, покрытых разными типами гистоновых белков (×100), где а - суммарный гистон; б - перекрестно сшитые конъюгаты суммарного гистона; в - коровые гистоны; г - гистон Н2В; д - гистон H1; е - гистон Н2А; ж - гистон Н3. На фиг.5 показана организация актинового цитоскелета постоянной линии клеток почки эмбриона человека (НЕК 293), распластанных на субстратах, покрытых разными типами гистоновых белков в присутствии циклогексимида, где а - суммарный гистон; б - перекрестно сшитые конъюгаты суммарного гистона; в - коровые гистоны; г - гистон Н2В; д - гистон H1. Организация актинового цитоскелета постоянной линии клеток эмбриональных фибробластов мыши (3T3/BALB clone A31), распластанных на субстратах, покрытых разными типами гистоновых белков, изображена на фиг.6, где а - суммарный гистон; б - перекрестно сшитые конъюгаты суммарного гистона; в - коровые гистоны; г - гистон H1.
Показано, что гистон Н2В, суммарный гистон, коровые гистоны, перекрестно сшитые конъюгаты суммарного гистона и перекрестно сшитые конъюгаты коровых гистонов являются лучшими субстратами для культивирования клеток.
Топографически модифицированную микросферами, ковалентно связанными с суммарным гистоном, поверхность субстрата используют для анализа процессов прикрепления, распластывания и скорости роста адгезивных клеток животного происхождения. В качестве субстрата используют поверхность 6-луночных культуральных сосудов фирмы Corning Costar. Клетки животного происхождения культивируют на такой топографически модифицированной однородным слоем микросфер, ковалентно связанных с суммарным гистоном, поверхности в среде с сыворотокой или в бессывороточной среде с ростовыми добавками. На топографически модифицированную однородным слоем микросфер, ковалентно связанных с суммарным гистоном, поверхность субстрата наносят клетки с плотностью от 3×104 до 5×104 на 1,0 см2.
Результаты проведенных сравнительных исследований по характеристике субстратов, покрытых микросферами, ковалентно связанных с суммарным гистоном, коровыми гистонами и их перекрестно сшитыми ковалентными конъюгатами, в отношении их эффективности для прикрепления и распластывания клеток в присутствии сыворотки или в бессывороточной среде с ростовыми добавками приведены в примерах 4 и 5. На фиг.7 показано прикрепление и распластывание постоянной линии клеток почки эмбриона человека (НЕК 293) на субстрате, покрытом микросферами, ковалентно связанными с различными комбинациями гистоновых белков. Где:
(7а) Субстрат покрыт микросферами, ковалентно связанными с суммарным гистоном. На фигуре виден однородный монослой микросфер (маленькие темные точки). Клетки хорошо распластаны, но без длинных отростков. Клетки находятся в контакте между собой и объединены в плотный слой клеток.
(7б) Субстрат покрыт микросферами, ковалентно связанными с перекрестно сшитыми конъюгатами суммарного гистона. На фигуре можно видеть однородный слой микросфер, расположенных на оптимальных расстояниях друг от друга. Клетки формируют длинные отростки и объединены в хорошо развитую сеть.
(7в) Субстрат покрыт микросферами, ковалентно связанными с коровыми гистонами. На фигуре виден однородный монослой микросфер. Клетки хорошо распластаны, но без длинных отростков. Клетки находятся в контакте между собой и объединены в плотный слой клеток.
(7г) Субстрат покрыт микросферами, ковалентно связанными с перекрестно сшитыми конъюгатами коровых гистонов. На фигуре можно видеть однородный слой микросфер, расположенных на оптимальных расстояниях друг от друга. Клетки формируют длинные отростки и объединены в хорошо развитую сеть.
На фиг.8 показано прикрепление и распластывание постоянной линии эмбриональных фибробластов мыши (3T3/BALB clone A31) на субстрате, покрытом микросферами, ковалентно связанными с различными типами гистоновых белков. Где:
(8а) Субстрат покрыт микросферами, ковалентно связанными с коровыми гистонами. На фигуре виден однородный монослой микросфер (маленькие темные точки). Клетки хорошо распластаны, но без длинных отростков. Клетки находятся в контакте между собой и объединены в плотный слой клеток.
(8б) Субстрат покрыт микросферами, ковалентно связанными с перекрестно сшитыми конъюгатами суммарного гистона. На фигуре можно видеть однородный слой микросфер, расположенных на оптимальных расстояниях друг от друга. Клетки формируют длинные отростки и объединены в хорошо развитую сеть.
(8в) Субстрат покрыт микросферами, ковалентно связанными с суммарным гистоном. На фигуре виден однородный монослой микросфер. Клетки хорошо распластаны, но без длинных отростков. Клетки находятся в контакте между собой и объединены в плотный слой клеток.
Морфологический анализ окрашенных распластанных клеток с помощью инвертированного микроскопа показывает, что характер распластывания клеток на поверхности субстрата, покрытой микросферами из кристаллизованного декстрана диаметром не более 1,0 мкм, ковалентно связанных с гистонами, отличается от распластывания клеток на контрольной поверхности субстрата и имеет свои особенности.
На однородном слое микросфер, где микросферы расположены на оптимальном расстоянии друг от друга, клетки в процессе прикрепления к нескольким микросферам подвергаются функциональному растяжению с формированием длинных отростков, которые соединяют клетки друг с другом, формируя трехмерные сетеобразные клеточные структуры.
На монослое микросфер клетки в процессе прикрепления взаимодействуют с большим количеством микросфер и хорошо распластываются, но без формирования длинных отростков. Клетки контактируют между собой и объединяются в плотные слои, образуя сетеобразные клеточные структуры.
На контрольной поверхности субстрата клетки в процессе распластывания также образуют большие кластеры и сеть, однако единичных распластанных клеток наблюдается гораздо больше.
В другой серии экспериментов оценивают морфологическое состояние клеток НЕК 293 после длительного культивирования на топографически модифицированной микросферами, ковалентно связанными с суммарным гистоном, поверхности культуральных сосудов. Результаты этих экспериментов приведены в примере 5. На фиг.9 показано состояние постоянной линии клеток почки эмбриона человека (НЕК 293) в процессе длительного культивирования на субстрате, покрытом микросферами, ковалентно связанными с суммарным гистоном. Где:
(9а) Клетки после 1-го дня культивирования в среде, содержащей 10% эмбриональную сыворотку телят. На фигуре виден однородный монослой микросфер. Клетки хорошо распластаны и находятся в контакте между собой. Между распластанными клетками наблюдается много свободных микросфер.
(9б) Клетки после 1-го дня культивирования в бессывороточной среде с ростовыми добавками. Клетки хорошо распластаны и находятся в контакте между собой. Между распластанными клетками наблюдается много свободных микросфер.
(9в) Клетки после 6-го дня культивирования в среде, содержащей 10% эмбриональную сыворотку телят. На фигуре видно, что число распластанных клеток значительно увеличилось. Клетки растут в виде колоний с образованием кластеров и объединены в хорошо развитую сеть. Свободных микросфер не наблюдается.
(9г) Клетки после 6-го дня культивирования в бессывороточной среде с ростовыми добавками. На фигуре видно, что число распластанных клеток значительно увеличилось. Клетки растут в виде колоний с образованием кластеров и объединены в хорошо развитую сеть. Свободных микросфер не наблюдается.
(9д) Клетки после 6-го дня культивирования в среде, содержащей 10% эмбриональную сыворотку телят. На фигуре видно, что число распластанных клеток значительно увеличилось. Клетки растут в виде колоний с образованием кластеров и объединены в хорошо развитую сеть. Свободных микросфер не наблюдается.
В отдельной серии экспериментов исследуют скорость роста адгезивных клеток на топографически модифицированной микросферами, ковалентно связанными с гистонами, поверхности культуральных сосудов (пример 6). На фиг.10 представлена зависимость роста клеток от времени культивирования клеток на субстрате, покрытом микросферами, ковалентно связанными с суммарным гистоном. Культивирование постоянной линии клеток почки эмбриона человека (НЕК 293) проводят в среде, содержащей сыворотку (среда 1), или в бессывороточной среде с ростовыми добавками (среда 2). Индекс пролиферации отложен против времени инкубации. Индекс пролиферации - это отношение числа пролиферирующих клеток (в тестируемый день культивирования) к общему числу засеянных клеток.
На фиг.11 представлена зависимость роста клеток от времени культивирования клеток на субстрате, покрытом микросферами, ковалентно связанными либо с перекрестно сшитыми конъюгатами суммарного гистона (субстрат 1), или с суммарным гистоном (субстрат 2). Культивирование постоянной линии клеток почки эмбриона человека (НЕК 293) проводят в среде, содержащей сыворотку.
Полученные результаты показали, что при культивировании в течение 6 суток клетки пролиферируют с одинаковой скоростью как на обоих тестируемых субстратах, так и на контрольной поверхности. Скорость роста клеток на тестируемых субстратах одинакова как в среде с сывороткой, так и в бессывороточной среде с ростовыми добавками.
На топографически модифицированной микросферами, ковалентно связанными с гистонами, поверхности субстрата формируется трехмерная матрица, которая с нанесенными на нее клетками является основой для формирования тканеподобных клеточных структур при культивировании клеток животного происхождения. На такой поверхности субстрата клетки растут, как в монослойной культуре, но при топографически стерическом соответствии адгезивных для клеток белков и адгезионных рецепторов, которые вступают в прямое электростатическое взаимодействие. Клетки прикрепляются к микросферам диаметром не более 1,0 мкм, площадь поверхности которых соответствует площади поверхности фокальных контактов. Фокальные контакты формируются между адгезивными для клеток гистонами, имеющими в своем составе гепарин-связывающие домены, и протеогликанами клеточной поверхности, которые выступают в качестве рецепторов для гистонов.
При культивировании клеток на топографически модифицированной микросферами поверхности субстрата характер распластывания клеток имеет свои особенности. Отдельные клетки в процессе прикрепления взаимодействуют с несколькими микросферами, расположенными на оптимальных расстояниях друг от друга, что обеспечивает функциональное растяжение клеток с формированием длинных отростков, за счет которых клетки объединяются друг с другом, образуя трехмерные сетеобразные клеточные структуры. Такие тканеподобные клеточные структуры предназначены для их использования при создании заменителей ткани из клеток животного происхождения.
Прикрепление клеток к топографически модифицированной поверхности культуральных сосудов, как описано в предлагаемом изобретении, может быть либо рецептор-опосредованным, то есть осуществляться за счет факторов прикрепления для клеток, и/или зависимым от заряда.
Все это позволяет рассматривать гистоны как новую группу адгезивных для клеток белков наряду с известными адгезивными для клеток белками, такими как фибронектин, ламинин и коллаген.
Список используемой литературы
1. Isenberg I. 1979. Histones. Ann Rev Biochem. 48:159-191.
2. Smalheiser NR. 1996. Proteins in unexpected locations. Mol Biol Cell. 7(7): 1003-1014.
3. Jeffery CJ. 2003. Moonlighting proteins: old proteins learning new tricks. Trends Genet. 19(8):415-417.
4. Zlatanova JS, Srebreva LN, Banchev ТВ, Tasheva ВТ, Tsanev RG. 1990. Cytoplasmic pool of histone H1 in mammalian cells. J Cell Sci. 96 (Pt 3):461-468.
5. Brix K, Summa W, Lottspeich F, Herzog V.1998. Extracellularly occurring histone H1 mediates the binding of thyroglobulin to the cell surface of mouse macrophages. J Clin Invest. 102(2):283-293.
6. Henriquez JP, Casar JC, Fuentealba L, Carey DJ, Brandan E. 2002. Extracellular matrix histone H1 binds to perlecan, is present in regenerating skeletal muscle and stimulates myoblast proliferation. J Cell Sci. 115:2041-2051.
7. Müller S, Scaffidi P, Degryse B, Bonaldi T, Ronfani L, Agresti A, Beltrame M, Bianchi ME. 2001. The double life of HMGB1 chromatin protein: architectural factor and extracellular signal. EMBO J. 20(16):4337-4340.
8. Ашмарин И.П., Ждан-Пушкина С.М., Кокряков В.И., Самедов А.Ш., Антонова С.Н. 1972. Антибактериальные и антивирусные функции основных белков клетки и перспективы практического их использования. Изв. Акад. Наук СССР. Сер. биол. №4: 502-508.
9. Class R. Zeppezauer M. 2005. Antimicrobial histone H1 compositions, kits, and methods of use thereof. U.S. Patent 6,884,423.
10. Горюхина О.А. 1999. Способ получения растворимых ковалентных конъюгатов. Патент на изобретение №2127606. Российская Федерация.
11. Горюхина О.А., Илюк Р.Д., Мищенко И.В. 2000. Сравнительное исследование поступления экзогенного гистона в паренхиму головного мозга крыс. Бюл. экспер. биол. мед. 130(7):63-66.
12. Мищенко В.А., Горюхина О.А. 1996. Структура, проницаемость гематоэнцефалического барьера и перспективы доставки через него лекарственных средств. Журн. невропатол. и психиатр. 96(4): 116-120.
13. Горюхина О.А. 2004. Перспективы применения катионных белков для транспорта лекарственных средств в ткань мозга. Нервная система. Выпуск 37:168-175. Изд. С.-Петербургского университета.
14. Ашмарин И.П., Перельман А.Е., Горюхина О.А., Вишневский Б.И., Вавилин Г.И., Габер И.Э. 1995. Средство, потенциирующее противотуберкулезное действие изониазида. Патент на изобретение №2045278. Российская Федерация.
15. Rusch V., Reichhart R., Zeppezauer M., Jornvall H. 1989. Biologically active substance with hormonal properties, production process thereof and utilization of histones for medical purposes. U.S. Patent 4,818,763.
16. Zeppezauer M., Reichhart R. 1993. Use of pure histones HI and H2A:H2B dimmers in therapeutic methods. U.S. Patent 5,182,257.
17. Kleinman HK, Luckenbill-Edds L, Cannon FW, Sephel GC. 1987. Use of extracellular matrix components for cell culture. Anal Biochem. 166(1):1-13.
18. Vitte J, Benoliel AM, Pierres A, Bongrand P. 2004. Is there a predictable relationship between surface physical-chemical properties and cell behaviour at the interface? Eur Cell Mater. 7:52-63; discussion 63.
19. Pierres A, Benoliel AM, Bongrand P. 2002. Cell fitting to adhesive surfaces: A prerequisite to firm attachment and subsequent events. Eur Cell Mater. 3:31-45.
20. Minuth WW, Strehl R, Schumacher K. 2005. Tissue engineering: essentials for daily laboratory work. Wiley-VCH Verlag GmbH&Co.
21. Hubbell JA. 2000. Matrix effects. In: Priciples of tissue engineering. Lanza RP, Langer R, Vacanti J., editors. Academic Press, pp.237-250.
22. Saltzman W.M. 2000. Cell interaction with polymers. In: Priciples of tissue engineering. Lanza RP, Langer R, Vacanti J., editors. Academic Press, pp.221-236.
23. Olsen BR. 2000. Matrix molecules and their ligands. 2000. In: Priciples of tissue engineering. Lanza RP, Langer R, Vacanti J., editors. Academic Press, pp.57-72.
24. Ikada Y. 2006. Tissue engineering: fundamentals and applications. Interface science and technology, 8. Japan Academic Press.
25. Massia SP, Hubbell JA. 1992. Immobilized amines and basic ammo acids as mimetic heparin-binding domains for cell surface proteoglycan-mediated adhesion. J Biol Chem. 267: 10133-41.
26. Dee КС, Puleo DA, Bizios R. 2002. Tissue-biomateral interactions. Wiley-Liss.
27. Cardin AD, Weintraub HJ. 1989. Molecular modeling of protein-glycosaminoglycan interactions. Arteriosclerosis. 9: 21-32.
28. Vunjak-Novakovic G. 2003. The fundamentals of tissue engineering: scaffolds and bioreactor. Tissue engineering of cartilage and bone. (Novartis Foundation Symposium 249). Bock G., Goode J. ed. Wiley. Chicbester. Landon, pp.34-51.
29. Jaklenec A, Wan E, Murray ME, Mathiowitz E. 2008. Novel scaffolds fabricated from protein-loaded microspheres for tissue engineering. Biomaterials. 29:185-92.
30. Schröder U. 1985. Crystallized carbohydrate spheres for slow release and targeting. Methods Enzymol. 112:116-128.








Изобретение относится к области биотехнологии, в частности к способу получения трехмерных матриц для тканеподобных структур из клеток животного происхождения. Данный способ предусматривает ковалентное связывание гистонов с поверхностью предварительно активированных биосовместимых полимерных микросфер из кристаллизованного декстрана. Затем проводят осаждение центрифугированием микросфер с ковалентно связанными гистонами. После чего микросферы, содержащие от 160 до 200 мкг белка на 1,0 г, наносят на поверхность субстрата в количестве от 0,5 до 1,0 мг на 1,0 см2 и высушивают при комнатной температуре. Далее промывают буферным раствором рН 7,5 для удаления несвязанного с субстратом материала. Полученный слой микросфер на поверхности субстрата с нанесенными на него клетками используют в качестве основы для получения тканеподобных клеточных структур. Представленное изобретение позволяет повысить надежность структуры и стабильность белкового слоя трехмерной матрицы, а также упростить и удешевить способ получения трехмерных матриц для тканеподобных структур из клеток животного происхождения. 5 з.п. ф-лы, 11 ил.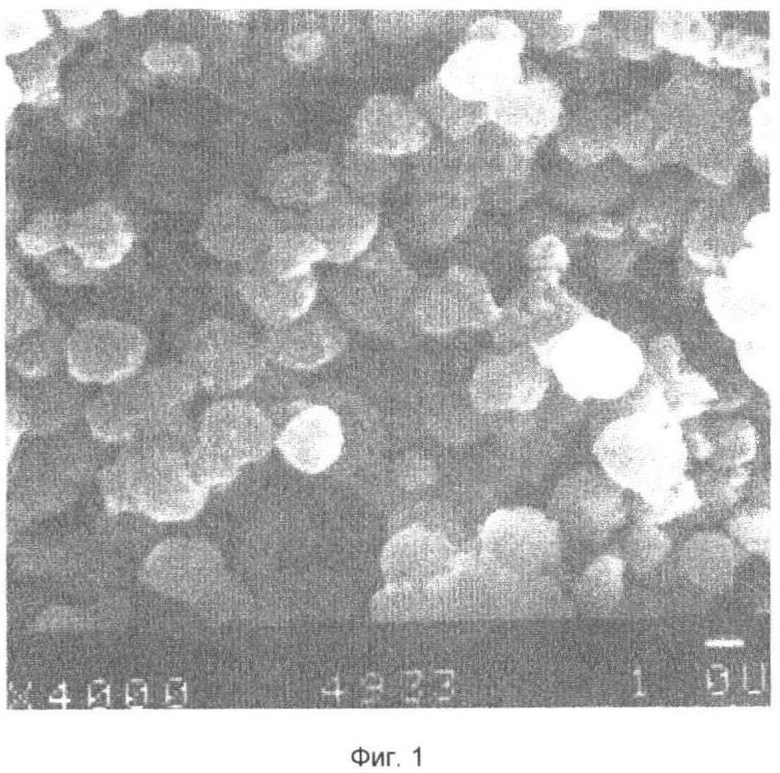
1. Способ получения трехмерных матриц для тканеподобных структур из клеток животного происхождения, включающий иммобилизацию гистонов из ткани тимуса телят на поверхности субстрата, адсорбцию гистонов на поверхности субстрата, удаление неадсорбированного белка, оценку способности прикрепления, распластывания, морфологического состояния и скорости роста клеток при культивировании на модифицированной гистонами поверности субстрата, отличающийся тем, что поверхность субстрата топографически модифицируют микросферами, покрытыми гистонами, причем используемые гистоны предварительно ковалентно связывают с поверхностью биосовместимых полимерных микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм, причем перед ковалентным связыванием гистонов проводят активацию микросфер, которую осуществляют добавлением к водной суспензии микросфер сшивающего агента, в качестве которого используют бромциан при концентрации не более 0,42 моль/л, при температуре не более 4°С и времени инкубации не более 2 мин, затем активированные микросферы осаждают при центрифугировании, и осадок промывают дистиллированной водой, и повторно центрифугируют, после чего проводят повторное суспензирование микросфер в растворе гистона при весовом соотношении белка и микросфер равном 1:100, а реакцию ковалентного связывания осуществляют при рН 7,5-8,0, температуре не более 4°С, времени инкубации не более 2 ч, затем микросферы с ковалентно связанными гистонами осаждают центрифугированием, после чего микросферы, содержащие от 160 до 200 мкг белка на 1,0 г, наносят на поверхность субстрата в количестве от 0,5 до 1,0 мг на 1,0 см2 и высушивают при комнатной температуре, затем промывают буферным раствором рН 7,5 для удаления несвязанного с субстратом материала, а полученный слой микросфер на поверхности субстрата с нанесенными на него клетками используют в качестве основы для получения тканеподобных клеточных структур.
2. Способ по п.1, отличающийся тем, что требуемое количество ковалентно связанного белка определяют аминокислотным анализом.
3. Способ по п.2, отличающийся тем, что за оптимальное количество ковалентно связанного гистона принимают 180 мкг белка на 1,0 г микросфер.
4. Способ по п.1, отличающийся тем, что для ковалентного связывания выбирают комбинации различных типов гистонов и их ковалентные конъюгаты.
5. Способ по п.4, отличающийся тем, что выбирают суммарный гистон, коровьи гистоны и их ковалентные конъюгаты.
6. Способ по п.1, отличающийся тем, что клетки культивируют в бессывороточной среде с ростовыми добавками.
| Mckeehan W.L | |||
| ET AL, Stimulation of clonal growth of normal fibroblasts with substrata coated with basic polymers, J Cell Biol., 1976, v.71, n.3, p.727-34 | |||
| NAKANISHI J | |||
| ET AL, Recent advances in cell micropatterning techniques for bioanalytical and biomedical sciences, Anal Sci., 2008, v.24, n.1, p.67-72 | |||
| SUH K.Y | |||
| ET AL, A simple soft lithographic |
Авторы
Даты
2010-08-10—Публикация
2008-12-25—Подача