Изобретение относится к области медицины, точнее к способам для доставки в ткань мозга лекарственных веществ, слабо проходящих через гематоэнцефалический барьер.
Известно, что поступление ряда лекарственных веществ в ткань мозга ограничивается гематоэнцефалическим барьером - барьером между нервными клетками и элементами микроциркуляторного русла. Капилляры мозга характеризуются избирательной проницаемостью до прохождения определенных молекул, что связано с наличием так называемых плотных контактов, формируемых эндотелиальными клетками в большинстве мозговых капилляров, что отличает их от других капилляров.
Существуют различные способы целенаправленной доставки лекарственных веществ в мозг: инвазивные, фармакологические и физиологичные. Развитие последних основано на использовании специфических транспортных систем, в которых нетранспортируемые через гематоэнцефалический барьер вещества ковалентно связывают с транспортируемым белком (далее "белок-носитель"), и этот комплекс подвергается трансцитозу через гематоэнцефалический барьер.
Известны соединения, которые проходят через эндотелий капилляров мозга, то есть через гематоэнцефалический барьер.
К белкам, которые проходят гематоэнцефалический барьер, относят инсулин, трансферрин и инсулиноподобные факторы роста [I]. Транспорт этих белков осуществляется посредством рецепторов-опосредованного трансцитоза. Показана проницаемость гематоэнцефалического барьера для катионных белков [2, 3] и катионизированных белков, таких, как альбумин и иммуноглобулин G, транспорт которых опосредован адсорбционным пиноцитозом [4, 5]. Поликатионные полимеры типа полилизина, лизинбогатого гистона и протамин сульфата оказывают на биологические мембраны прямое действие, изменяя их структуру, и в итоге увеличивают общую проницаемость гематоэнцефалического барьера [2, 6 - 8].
Однако не любые природные белки могут быть использованы в качестве белков-носителей. Так, препятствием к использованию может служить собственная биологическая активность белков, таких, как инсулин, инсулиноподобные факторы роста или трансферрин. Столь же негативным моментом является отмеченная выше токсичность полилизина, протамин сульфата и лизинбогатого гистона, связанная с нарушением структуры мембран. Кроме того, нежелательно использование белков, являющихся сильными иммуногенами наподобие катионизированного альбумина и катионизированного иммуноглобулина G, а также белков, которые модулируют (усиливают или ослабляют) иммунный ответ организма.
В настоящее время ведется поиск белков, проникающих через гематоэнцефалический барьер, не обладающих специфической активностью и не оказывающих влияния на иммунную систему организма.
Известен способ использования суммарного гистона в качестве белка-носителя лекарственных веществ, слабо проходящих через гематоэнцефалический барьер, взятый в качестве ближайшего аналога (прототипа) и заключающийся в следующем [9].
В качестве белка-носителя используют препарат суммарного гистона сернокислого из ткани тимуса телят (НПО "Биолар" номенклатурный N 040554). Препарат суммарного гистона содержит в своем составе пять основных классов гистонов - HI (лизинбогатый гистон), H2A и H2B (гистоны, умеренно обогащенные лизином), H3 и H4 (гистоны, обогащенные аргинином) и минорный класс негистоновых белков, которые соэкстрагируются с гистонами при прямом их выделении их хроматина клеток животных тканей. В качестве гептена используют антибиотик канамицин. Растворимые конъюгаты суммарного гистона с канамицином получают с помощью сшивающего агента - глутарового альдегида. Перед проведением реакции ковалентного связывания устанавливают соотношение реагирующих компонентов, исходя из данных количеств аминогрупп в препарате суммарного гистона, доступных для модификации. Молярное содержание аминогруппы в препарате определяют в реакции с 2, 4, 6-тринитробензолсульфокислотой. Для стандартного образца суммарного гистона оно составляет (8,3 ± 0,1) • 10-4 моль/г. Образец суммарного гистона растворяют в 0,1 М фосфатном буфере pH 7,0. К раствору белка добавляют глутаровый альдегид и через 2 мин pH реакционной смеси доводят до pH 7,8. Спустя 5 мин в раствор активированного белка-носителя вносят избыток канамицина. После 60-минутной экспозиции инкубата при комнатной температуре реакцию связывания суммарного гистона с канамицином останавливают добавлением боргидрата натрия. Затем реакционную смесь дважды диализируют при 10oC против 0,1 М фосфатного буфера pH 7,0 - последовательно в течение 3-х и 15 ч. После диализа раствор конъюгата суммарного гистона с канамицином подвергают лиофилизации. Количество канамицина в конъюгате рассчитывают на основании данных материального баланса в процессе синтеза. Установлено, что количество связанного канамицина составляет 0,5 ± 0,1 мг на 1 мг препарата суммарного гистона и пропорционально количеству доступных для модификации аминогрупп в препарате.
Таким образом, в описанном способе суммарный гистон используют для получения растворимых ковалентных конъюгатов с низкомолекулярными соединениями (далее "гаптенами"), т.е. в качестве транспортного средства для переноса веществ, блокируемых гематоэнцефалическим барьером.
Однако применение препарата суммарного гистона в качестве белка-носителя ограничивается тем, что при этом способе получения растворимых ковалентных конъюгатов гаптенов используется белок-носитель, который после освобождения гаптена в тканях и в средах организма может оказывать влияние на иммунную систему. Это проявляется в изменении спонтанной и индуцированной митогеном пролиферативной активности лимфоцитов под влиянием суммарного гистона. Учитывая это, а также данные о том, что гистон H1 и негистоновые белки, которые в минорных количествах содержатся в препаратах суммарного гистона, обладают антигенной активностью [10], была проведена очистка белка-носителя от гистона H1 и негистоновых белков с целью получения комплекса гистонов, содержащем в своем составе гистоны H2A, H2B, H3, H4 (далее "комплекс гистонов").
Решаемой задачей и техническим результатом изобретения является создание транспортного средства для переноса веществ через тканевые барьеры на основе природных катионных белков, которые обладают инертностью в отношении иммунной системы. В качестве такого белка-носителя выбран комплекс гистонов, содержащий в своем составе гистоны H2A,. H2B, H3, H4.
Целевой продукт в конкретных условиях представляет собой растворимые ковалентные конъюгаты гаптена с комплексом гистонов, содержащие в своем составе белки, которые обладают инертностью в отношении пролифератированной активности лимфоцитов.
Это достигается тем, что в качестве белка-носителя используется комплекс гистонов, не содержащий в своем составе гистона H1 и негистоновые белки.
В частном конкретном случае способ получения растворимых ковалентных конъюгатов низкомолекулярных полярных соединений с природными катионными белками заключается в следующем.
1. Получение комплекса гистонов, содержащего в своем составе гистоны H2A, H2B, H3, H4, как описано [13]. Для этого проводят первичное растворение суммарного гистона сернокислого из ткани тимуса телят и из первичного раствора осаждают гистоны H2A, H2B, H3, H4 раствором неорганической кислоты (хлорной кислотой до конечной концентрации 0,5 М), затем остаток вторично растворяют в растворе средней ионной силы.
При физиологическом значении pH и ионной силы гистоны H2A, H2B < H3, H4 взаимодействуют между собой и существуют в виде белкового комплекса с высоким положительным зарядом на поверхности всей молекулы [11]. В таком комплексе индивидуальные свойства отдельных классов гистонов не суммируются, а взаимодополняются. Так, известно, что гистоны H3 и H4 взаимодействуют с рядом рецепторов, включая инсулиновые рецепторы [12]. Это особенно важно, поскольку в физиологическом плане значимым для преодоления гематоэнцефалического барьера может оказаться присутствие каждого класса гистонов.
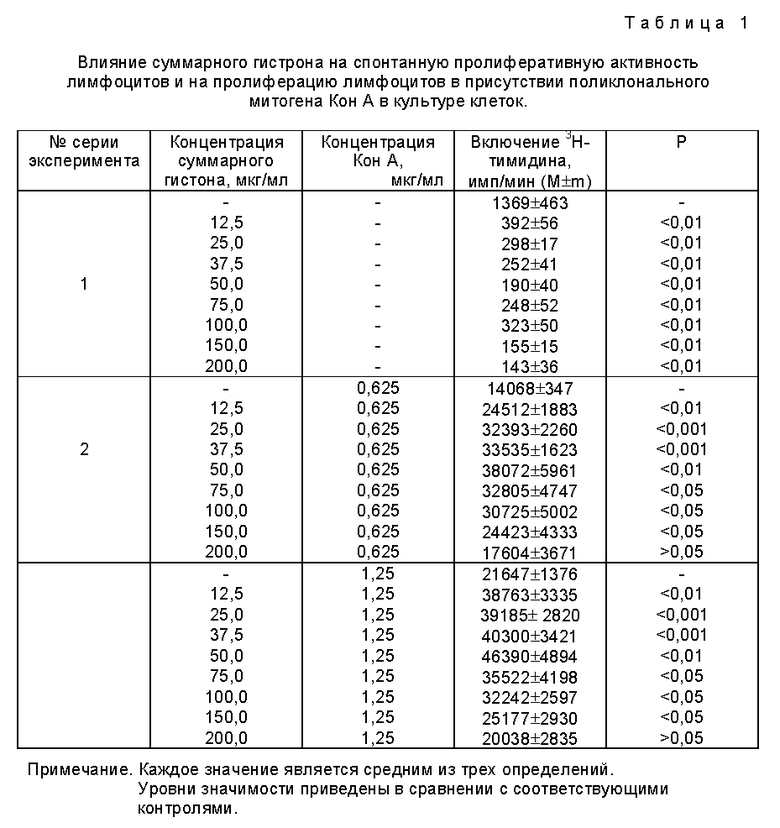
2. Проведение сравнительного анализа по влиянию суммарного гистона и комплекса гистонов на пролиферативную активность лимфоцитов в культуре клеток. С помощью этого теста исследуют собственную митогенную активность препаратов, а также их влияние на пролиферацию лимфоцитов в культуре клеток в присутствии Т-клеточного митогена конканавалина А (Кон А). Результаты проведенных сравнительных исследований по характеристике препаратов суммарного гистона и комплекса гистонов в отношении их действия на пролиферацию лимфоцитов в культуре клеток приведены в примерах 1 и 3.
3. Использование комплекса гистонов в реакции ковалентного связывания с низкомолекулярными полярными соединениями с образованием растворимых конъюгатов. Синтез растворимых ковалентных конъюгатов комплекса гистонов с канамицином поясняется в примере 3.
В настоящем исследовании проведен сравнительный анализ влияния суммарного гистона и комплекса гистонов на пролиферативную активность лимфоцитов в культуре клеток. С помощью этого теста исследуют собственную митогенную активность препаратов, а также их влияние на пролиферацию лимфоцитов в присутствии Т-клеточного митогена конканавалина А (Кон А).
Результаты проведенных сравнительных исследований по характеристике препаратов суммарного гистона и комплекса гистонов в отношении их действия из пролиферацию лимфоцитов в культуре клеток приведены в примерах 1 и 2. Способ использования комплекса гистонов в качестве белка-носителя поясняется в примере 3.
Пример 1.
В опытах используют спленоциты мышей (СВА х С57 Bl) F1. Концентрация клеток в смешанной культуре лимфоцитов составляет 0,5 • 106 на 1 мл. Препарат суммарного гистона используют в диапазоне концентраций 12,5 - 200,0 мкг на 1 мл культуры клеток, которые являются терапевтическими. Включение 3H-тимидина в смешенную культуру лимфоцитов после 72 часового культивирования в присутствии Т-клеточного митогена Кон А, примененного в оптимальной и субоптимальной концентрации, определяют радиометрическим методом. Концентрации Кон А оптимальная и субоптимальная составляет 1,25 и 0,625 мкг/мл соответственно. Исследования проводят в круглодонных планшетах завода "Медполимер", в среде RPMI 1640 с 10% сывороткой плода коровы (СПК) и добавками: 2-меркаптоэтанол, L-глутамин, HEPES, гентамицин. Все реактивы фирмы "Gibco" или "Flow Labs".
Как видно из данных, представленных в табл. 1 (серия экспериментов 1), исследуемый препарат не обладает собственной митогенной активностью. Напротив, при всех исследованных концентрациях препарат проявляет супрессивную активность, подавляя спонтанную пролиферацию лимфоцитов. При этом включении 3H-тимидина в культуру клеток снижается на 77-90%.
При исследовании комитогенной активности препарата показано, что при всех испытанных концентрациях препарат суммарного гистона не подавляет стимулирующего действия Кон А в отношении Т-лимфоцитов (таблица 1, серия экспериментов 2). Напротив, препарат усиливает эффект митогена, примененного как в оптимальной, так и субоптимальной концентрации. Включение 3H-тимидина в культуру лимфоцитов увеличивается (табл. 1, серия экспериментов 2).
Таким образом показано, что препарат суммарного гистона изменяет пролиферативную активность лимфоцитов в культуре клеток. При этом, препарат суммарного гистона проявляет разнонаправленные эффекты, наряду с усилением митоген-стимулированной пролиферативной активности, выявлена и супрессивная активность в отношении спонтанной пролиферации лимфоцитов в культуре клеток, что обусловлено присутствием в препарате разных классов белков.
Пример 2.
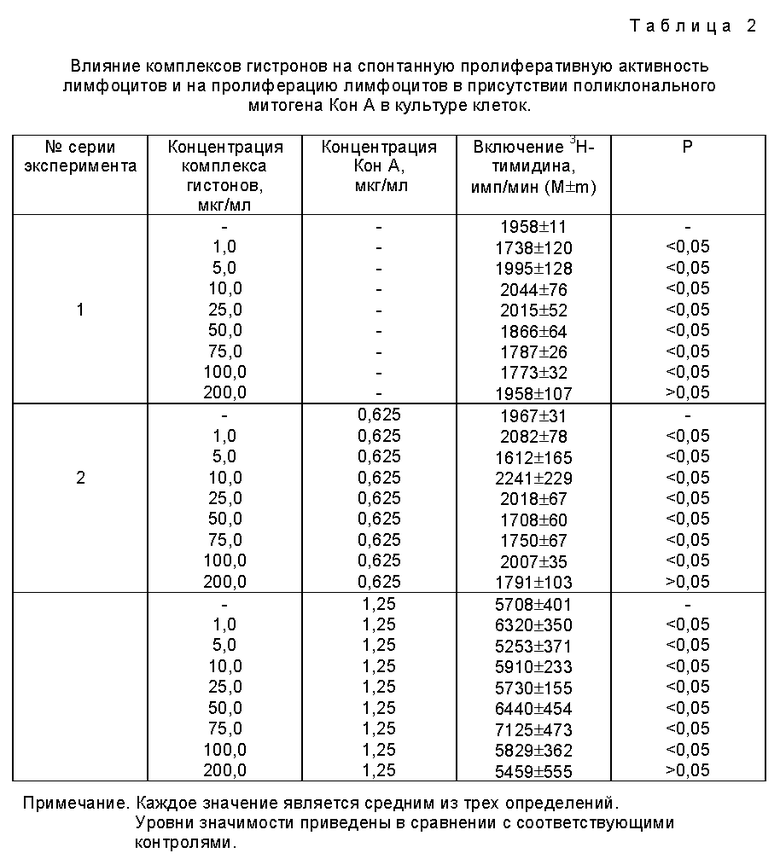
Исследование влияния препарата комплекса гистонов на пролиферацию лимфоцитов в культуре клеток проводят так же, как в примере 1, но в более широком диапазоне концентраций: 1,0 - 200,0 мкг на 1 мл культуры клеток.
Как видно из данных, представленных в табл. 2 (серия экспериментов 1), исследованный препарат не обладает собственной митогенной активностью при всех исследованных концентрациях, а собственная супрессивная активность проявляется только при высоких концентрациях в незначительной степени. При концентрации препарата выше 75 мкг/л включение 3H-тимидина в культуру лимфоцитов снижается лишь на 10%. Препарат не оказывает влияния на пролиферацию лимфоцитов и в присутствии митогена. При всех исследованных концентрациях препарата не происходит усиления или подавления стимулирующего действия Кон А, примененного как в оптимальной, так и субоптимальной концентрации (табл. 2, серия экспериментов 2).
Пример 3.
Синтез растворимых ковалентных конъюгатов комплекса гистонов с канамицином.
В предлагаемом способе получения растворимых ковалентных конъюгатов низкомолекулярных полярных соединений с белком-носителем реакцию ковалентного связывания проводят так же, как описано в прототипе [9], за исключением того, что в качестве белка-носителя используют комплекс гистонов, содержащий в своем составе инертные в отношении пролиферативной активности лимфоцитов белки.
В качестве гаптена используют канамицин - антибиотик группы аминогликозидов (мол. м. 620). Молярное содержание аминогрупп в молекуле канамицина, способных к ковалентному взаимодействию, составляет 1,8 моль/моль.
Перед проведением реакции ковалентного связывания устанавливают соотношение реагирующих компонентов. Для этого определяют содержание свободных аминогрупп в препарате комплекса гистонов в реакции с 2,4,6-тринитробензолсульфокислотой. Установлено, что содержание аминогрупп в препарате комплекса гистонов, доступных для модификации составляет 6,7 ± 0,1 • 10-4 моль/г. На основании этих данных рассчитывают соотношение реагирующих компонентов - канамицина и белка-носителя. Для того, чтобы сдвинуть реакцию в сторону образования растворимых конъюгатов используют трехкратный молярный избыток канамицина по отношению к NH2-группам белка. По расчету это количество канамицина составляет 1,25 мг на 1 мг комплекса гистонов.
Содержание канамицина в полученных конъюгатах рассчитывают на основании данных материального баланса в процесса синтеза. Установлено, что количество связанного канамицина составляет 0,4 ± 0,1 мг на 1 мг препарата комплекса гистонов и пропорционально количеству доступных для модификации аминогрупп в препарате.
Как показывают данные сравнительного анализа, препарат суммарного гистона подавляет спонтанную пролиферацию лимфоцитов и усиливает пролиферативную активность лимфоцитов в присутствии митогена. Специфическая активность препарата суммарного гистона обусловлена присутствием в его составе минорного класса негистоновых белков и гистона HI. Напротив, использованный в предлагаемом способе белок-носитель обладает высокой инертностью в отношении спонтанной и индуцированной митогеном пролиферативной активности лимфоцитов в культуре клеток. Необходимо отметить, что отдельные классы гистонов, как это показано для гистона H4 (15), при высоких концентрациях подавляют спонтанную пролиферацию лимфоцитов в культуре клеток. Однако, когда отдельные классы гистонов связаны в комплекс, их супрессивная активность не проявляется за счет того, что определенные области молекул взаимодействующих гистонов маскируются при образовании ди-, тетра- и олигомерных белковых комплексов в растворах низкой ионной силы (II).
Таким образом, полученные в настоящем исследовании результаты о высокой инертности препарата комплекса гистонов в отношении пролиферативной активности лимфоцитов в культуре клеток и данные с его низкой антигенной активности (10), позволяют сделать заключение о том, что препарат не оказывает модулирующего влияния на клетки, обеспечивающие иммунологическую защиту организма. В этом отношении, предложенный в способе препарат комплекса гистонов имеет преимущественно по сравнению с препаратом суммарного гистона в плане его практического использования в качестве потенциального белка-носителя лекарственных веществ через гематоэнцефалический барьер или другие мембранные структуры.
Возможность получения конъюгатов комплекса гистонов с фармакологическими агентами, слабо проникающими через тканевые барьеры, заложит основу для создания нового класса лекарственных средств, позволяющих повысить эффективность терапии ряда тяжелых заболеваний, включая заболевания центральной нервной системы.
Литература
1. Pardriage W.M. Recent advances in blood-brain barrier transport//Ann. Rev. Pharmacol. Toxicol. - 1988. - Vol. 28. - P. 25-39.
2. Pardridge W.M., Triguero D., Buciak J. Transport of histone through the blood-brain barrier // J. Pharmacol. Exp., Therap. - 1989. - Vol. 251, N 3. - P. 821-826.
3. Аль-Суфи Д., Горюхина О.А., Демьяненко Г.П., Бобрышев Ю.В. Изучение поступления экзогенного гистона из русла крови в различные отделы мозга // Вестник ЛГУ. - 1991. - Сер. 3, вып. 3, N 17. - С. 129-132.
4. Kumagal A.K., Eisenberg J., Fardridge W.M. Abacrptive-mediated endocytosis of cationised albumin and a B-endorphin-cationized albumin chimeric peptide by isclated brain capillaries. Model system of blood-brain barrier transport // J. Biol. Chem. - 1987, - Vol. 262, - P. 15214 - 15219.
5. Triguero D., Buciak J.B., Nang J. et al. Blood-brain barrier transport of cationizes immynoglobulin G: enhanced delivory compared to native protein // Proc. Natl. Acad. Sci. USA. - 1989. - Vol. 86, N 12. - P. 4761-4765.
6. Hardebo J.E., Kahrstrom J. Endothelial negative surface charge areas and blood-brain function // Acta Fhysiol. Scand. - 1985. - Vol. 125, N 3. - P. 495-499.
7. Shen W.C., Ryser H.J.P. Conjugation of poly-L-lysine to albumin and horserradisn peroxidase: a novel method of enhancing the cellular uptake of proteins // Proc. Natl. Acad. Sci. USA. - 1978. - Vol. 75. - P. 1872 - 1876.
8. Starausbaugh L.J. Intracarotid infusions of protamine sulfate disrupts the blood-brain barrier of rabbita // Brain Res. - 1987. - Vol. 409. N 12. - P. 221-226.
9. Аль-Суфи Д. Изучение проникновения в ткань мозга экзогенного гистона как потенциального белка-носителя лекарственных веществ // Автореф. дис. ... канд. биол. наук. - СПб., 1992.
10. Горюхина О.А., Леонтьева Г.Ф., Кашкин А.П. Изучение некоторых антигенных свойств препарата тотального гистона тимуса теленка // Журн. микробиол. - 1978. - N 11. - С. 91-98.
11. Thomas J. , Koraberg R. An octamer of histones in chromatin and in aolution // Proc. Natl. Acad. Sci. USA. - 1975. - Vol. 72, N 7 - P. 2626 - 2630.
12. Louters L.L., Henriksen E.J., Tipton C.M. Histone H4 ctimulates glucosr transport activity in rat akeletal muscle // Bioch. J. - 1993. - Vol. 295. - P. 549-553.
13. Oliver D., Sommer K.R., Panyim S., Chalkley R. A modified procedura for fractionating histones // Biochem. J. - 1972. - Vol. 129, N 2. - P. 349 - 353.
14. Горюхина О.А., Гончарева В.П., Степанова И.С., Резнова В.В. Протеиназная активность ядер различных тканей в отношении эндогенных гистонов // Биохимия. - 1979. - Т. 44, N 3. - С. 504-513.
15. Горюхина О.А. Влияние гистона H4 на клетки, обеспечивающие реализацию иммунных реакций: T- и B-лимфоциты и макрофаги // В кн.: Материалы Внутривузовской конференции "Доминантные механизмы поведенческих адаптаций". - Л. , 1990. - Вып. 1. - С. 26.
Способ получения растворимых ковалентных конъюгатов низкомолекулярных соединений с природными катионными белками из хроматина клеток животных тканей, заключающийся в том, что из первичного раствора катионного белка осаждают белки, не растворимые в неорганической кислоте, после чего осадок вторично растворяют в растворе средней ионной силы, затем в раствор вводят сшивающий агент и низкомолекулярное полярное соединение и осуществляют ковалентное связывание с образованием растворимых ковалентных конъюгатов, содержащих в своем составе инертные в отношении пролиферативной активности лимфоцитов белки. Способ пригоден для получения конъюгатов, которые могут быть использованы в качестве транспортного средства для переноса веществ, бловируемых гематоэнцефалическим барьером. 2 табл.
Способ получения растворимых ковалентных конъюгатов низкомолекулярных полярных соединений с природными катионными белками из хроматина клеток животных тканей, заключающийся в первичном растворении катионного белка и введении в раствор сшивающего агента и низкомолекулярного полярного соединения, отличающийся тем, что из первичного раствора катионного белка осаждают белки, не растворимые в неорганической кислоте, после чего осадок вторично растворяют в растворе средней ионной силы, затем в раствор вводят сшивающий агент и низкомолекулярное полярное соединение и осуществляют ковалентное связывание с образованием растворимых ковалентных конъюгатов, содержащих в своем составе инертные в отношении пролиферативной активности лимфоцитов белки.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Аль-Суфи Д | |||
| Изучение проникновения в ткань мозга экзогенного гистона, как потенциального белка-носителя лекарственных веществ | |||
| Автореф.канд.дисс.С.-Петербург, 1992 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Горюхина О.А | |||
| и др | |||
| Протеиназная активность ядер различных тканей в отношении эндогенных гистонов | |||
| - Биохимия, т.44, N 3, с.504-513 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ЭЛЕКТРОМАГНИТНЫЙ КЛАПАН | 1972 |
|
SU453525A1 |
Авторы
Даты
1999-03-20—Публикация
1994-12-23—Подача