Область техники, к которой относится изобретение
Настоящее изобретение относится к области ветеринарии и прежде всего касается Lawsonia intracellularis. В частности, изобретение относится к способу диагностики инфекции, вызываемой Lawsonia intracellularis, и диагностическому тест-набору, содержащему специфические для Lawsonia intracellularis антитела. Изобретение относится также к применению способа или тест-набора для диагностики инфекций, вызываемых Lawsonia intracellularis.
Предпосылки создания изобретения
L. intracellularis, возбудитель пролиферативной энтеропатии свиней («ПЭС»), поражает практически всех животных, включая человека, кроликов, хорьков, хомяков, лис, лошадей и различных представителей других классов животных, таких как страусы и эму. L. intracellularis является наиболее распространенной причиной потерь поголовья свиней в Европе, а также в Соединенных Штатах.
Характерной особенностью ПЭС является присутствие интрацитоплазматических несвязанных с мембраной изогнутых бацилл внутри энтероцитов в инфицированных областях кишечника. Бактерии, связанные с ПЭС, были названы «Campylobacter-подобными организмами» (S. McOrist и др., Vet. Pathol., том 26, 1989, с.260-264). Затем бактерии-возбудители были охарактеризованы в качестве нового таксономического рода и видов под общеупотребительным названием Ileal symbiont (IS) intracellularis (C. Gebhart и др., Int'l. J. of Systemic Bacteriology, том. 43(3), 1993, с.533-538). В последние годы эти новым бактериям было дано таксономическое название Lawsonia (L.) intracellularis (S. McOrist и др., Int'l. J. of Systemic Bacteriology, том 45 (4), 1995, с.820-825). Эти три названия можно использовать взаимозаменяемо для обозначения одного и того же организма, как он идентифицирован и описан далее в настоящем описании.
L. intracellularis является облигатной внутриклеточной бактерией, которую нельзя культивировать с помощью обычных бактериологических методов на стандартных бесклеточных средах, и предполагается, что для своего роста они должны прикрепляться к эпителиальным клеткам. У S. McOrist и др., Infection and Immunity, том 61 (19), 1993, c.4286-4292 и G. Lawson и др., J. of Clinical Microbiology, том 31 (5), 1993, c.1136-1142 описано культивирование L. intracellularis с использованием монослоев эпителиальных клеток кишечника крыс линии IEC-18 в стандартных колбах для культуры ткани. Кроме того, у Н. Stills, Infection and Immunity, том 59 (9), 1991, c.3227-3236 описано применение монослоев человеческих эмбриональных клеток кишечника линии Intestine 407 и монослоев клеток аденокарциномы ободочной кишки линии GPC-16 морских свинок для культивирования в стандартных колбах для культуры ткани.
В частности, L. intracellularis можно культивировать известными в данной области методами, предпочтительно описанными в US 5714375 и 5885823. Можно, например, сначала инокулировать культуру клеток с помощью инокулята, содержащего бактерии L. intracellularis, таким образом, чтобы инфицировать клетки бактериями. Для воплощения изобретения на практике можно применять многие линии клеток, включая (но не ограничиваясь ими) крысиные эпителиальные клетки кишечника линии IEC-18 (АТСС 1589), клетки человеческой эпидермоидной карциномы линии Нер-2 (АТСС 23), мышиные (неспецифические) клетки линии McCoys (АТСС 1696), клетки почки зеленой обезьяны буффало линии BGMK (Biowhittaker №71-176) и эпителиальные клетки кишечника свиньи. Предпочтительными культурами клеток являются клетки линии Нер-2, McCoys или IEC-18.
Если применяют культуру клеток, то перед инокуляцией клетки могут находиться в форме монослоя. Для формирования монослоя клетки можно высевать в обычные колбы. В каждую колбу, как правило, высевают от примерно 1×105 до примерно 10×105 клеток на колбу площадью 25, 75, 150, 850 см2 или роллерный флакон в смеси со средой для роста. Среды для роста могут представлять собой любые среды для культивирования клеток, которые содержат источник азота, необходимые факторы роста для рассматриваемых клеточных культур и источник углерода, такой как глюкоза или лактоза. Предпочтительной средой является среда DMEM, дополненная средой Хэма F12 и 1-5% фетальной телячьей сыворотки, хотя можно использовать также другие поступающие в продажу среды, получая при этом хорошие результаты.
Улучшение культивирования L. intracellularis достигают путем поддерживания культуры клеток на стадии постоянного роста. Поэтому конфлюэнтность монослоя культуры клеток в момент инокуляции должна составлять от примерно 20 до примерно 50%. Предпочтительно конфлюэнтность клеток в момент инокуляции должна составлять от примерно 30 до примерно 40%, наиболее предпочтительно примерно 30%.
В альтернативном варианте клетки перед осуществлением инокуляции можно выращивать в суспензии, как это описано ниже. Предпочтительно клетки сначала выращивают до достижения 100%-ной конфлюэнтности в форме монослоя в системе адгезионного типа, например в системе с использованием роллерных флаконов, а затем переносят и выращивают в суспензии объемом 3-3000 л.
В качестве инокулята можно применять культуру L. intracellularis, полученную от инфицированных свиней или других животных.
Инокулят может представлять собой кишечный гомогенат, полученный путем соскабливания слизистой оболочки подвздошной кишки свиньи или другого животного, зараженного ПЭС. Когда приготавливают кишечный гомогенат, срезы подвздошной кишки, выбранные для получения культуры, должны иметь серьезные повреждения, характеризующиеся значительным утолщением кишки. Вследствие недолговечности бактерий образцы после осуществления аутопсии предпочтительно следует как можно быстрее помещать на хранение при -70°С. К инокуляту добавляют антибиотик, к которому L. intracellularis обладает устойчивостью, такой как ванкомицин, амфотерицин В или представитель антибиотиков, несущих аминогликозидную группу, включая указанные в качестве примера гентамицин и неомицин, для подавления загрязняющих бактерий при сохранении роста L. intracellularis. Независимо от того, является ли инокулят чистой культурой или кишечным гомогенатом, инокуляцию клеточных культур можно осуществлять различными методами, известными в данной области, с использованием указаний, приведенных в настоящем описании.
Затем бактерии и/или инокулированные клеточные культуры инкубируют при пониженной концентрации растворенного О2. При концентрации растворенного кислорода выше 10% рост L. intracellularis происходит с меньшей скоростью по сравнению с оптимальной, причем в конце концов прекращается, когда концентрация кислорода выходит из указанного диапазона. Предпочтительно бактерии и/или инокулированные клеточные культуры инкубируют при концентрации растворенного кислорода, составляющей от примерно 0 до примерно 10%. Более предпочтительно бактерии и/или клетки инкубируют при концентрации кислорода, составляющей от примерно 0 до примерно 8%, причем наиболее предпочтительной является концентрация кислорода от примерно 0 до примерно 3,0%.
Оптимальная концентрация диоксида углерода также является важной для оптимального роста L. intracellularis. При концентрации диоксида углерода выше 0 и ниже 4% происходит рост, не соответствующий оптимальному, причем рост в конце концов прекращается, когда концентрация диоксида углерода выходит из указанного диапазона. Предпочтительно концентрация диоксида углерода составляет от примерно 6 до примерно 10%, причем наиболее предпочтительной является концентрация диоксида углерода примерно 8,8%.
Кроме того, клетки предпочтительно инкубируют при концентрации водорода, составляющей от примерно 73 до примерно 96%. Можно применять азот для замены части или всего присутствующего водорода. Наиболее предпочтительно клетки инкубируют при концентрации O2 от примерно 0 до примерно 8,0%, концентрации СО2 примерно 8,8% и концентрации Н2 примерно 83,2%.
Инокулированные клетки можно инкубировать в двойном газовом инкубаторе или иных газовых камерах, которые содержат необходимые концентрации водорода, кислорода и диоксида углерода и которые позволяют поддерживать клетки в суспендированном состоянии в процессе инкубации. Камера должна иметь устройства для поддержания инокулированных клеток в суспензии и газовый монитор и источник питания для подачи и поддержания необходимых концентраций газа. Температура инкубации должна составлять от 30 до примерно 45°С и более предпочтительно от примерно 36 до примерно 38°С. Наиболее предпочтительно температура составляет примерно 37°С. Необходимое оборудование для культивирования и ослабления вирулентности микроорганизмов хорошо известно и доступно специалистам в данной области, и оно указано в настоящем описании. Одним из примеров оборудования, пригодного для осуществления настоящего изобретения, является двойной газовый инкубатор, например модель 480 (Lab-Line, Мелрозе Парк, шт. Иллинойс) в сочетании с вращающимися колбами для поддержания клеток в суспензии. Предпочтительное согласно настоящему изобретению оборудование включает содержащие среды ферментер, биореактор, шейкер с перемешивающей пластиной или роторный шейкер и способные поддерживать клеточную культуру в суспензии посредством продувки газом соответствующей концентрации или с помощью иных средств механического перемешивания и позволяющие осуществлять непрерывный мониторинг уровней растворенного O2 в средах. Фирма New Brunswick, Braun и другие компании изготавливают пригодные для этой цели ферментеры и биореакторы.
Максимального роста клеток и, следовательно, L. intracellularis достигают путем поддержания инокулированных клеток в суспендированном состоянии в процессе инкубации за счет увеличения контакта отдельных клеток с питательными средами и присутствия необходимой смеси водорода, кислорода и диоксида углерода. Клеточные культуры можно перемешивать и поддерживать в суспензии разнообразными методами, известными в данной области, с использованием, например, колб для культур, роллер-флаконов, мембранных культур, биоконтейнеров, биореакторных систем WAVE™ и вращающихся колб. Клетки можно поддерживать в суспензии в процессе инкубации путем инкубации клеток во вращающейся колбе внутри двойного газового инкубатора или аналогичного устройства. Понятие «вращающаяся колба» в контексте настоящего изобретения обозначает колбу или иной контейнер, в котором для перемешивания культуры и поддержания ее в суспензии используется лопастная мешалка, пропеллерная мешалка или иные средства.
В альтернативном варианте осуществления изобретения инокулированные клетки инкубируют до достижения конфлюэнтности клеток и затем клетки помещают во вращающуюся колбу, содержащую питательные среды, и инкубируют в двойном газовом инкубаторе при вращении колбы. Предпочтительно инокулированные клетки соскабливают или трипсинизируют и пересевают во вращающуюся колбу. Это можно осуществлять различными методами, известными в данной области, например с использованием скребка для клеток для отделения клеток. После внесения клеток во вращающуюся колбу лопасть вращающейся колбы, как правило, вращается со скоростью от примерно 30 до примерно 60 об/мин на магнитной перемешивающей пластине для поддержания инфицированных клеток в суспензии.
Затем часть культивированных L. intracellularis пересевают на свежую культуру для увеличения производства бактерий L. intracellularis. Понятие «пересев» или его варианты в контексте настоящего описания обозначает процесс переноса части культивируемых L. intracellularis на свежие клеточные культуры для осуществления заражения свежих клеток бактерией. Понятие «свежий», в контексте настоящего описания обозначает клетки, которые еще не были заражены L. intracellularis. Предпочтительно возраст таких клеток в среднем составляет не более примерно одного дня.
Пересев L. intracellularis в суспензионных культурах можно осуществлять путем изъятия части исходной культуры и внесения ее в новую колбу, содержащую свежую культуру клеток. Если исходная культура имеет большое количество бактерий/мл, например более примерно 104 бактерий/мл, ее предпочтительно добавляют из зараженной колбы в количестве от примерно 1 до 10 об.% культуры по отношению к культуре свежих клеток, находящихся в новой колбе. Это предпочтительно осуществляют, когда заражено 50-100% клеток. Если заражено менее 50% клеток, то пересев предпочтительно осуществляют путем разделения культуры в соотношении 1:2 в новой колбе и увеличения объема с помощью добавления свежих сред. В любом случае в отличие от пересева монослойных культур, известного из существующего уровня техники, не требуется осуществлять лизис клеток и другие стадии.
После достижения достаточного увеличения культуры клеток и последующего заражения L. intracellularis, что определяют с помощью окрашивания согласно методу непрямой иммунофлуоресценции (антител) (ИФА), оценки значения TCID50 или с помощью любого сопоставимого метода, собирают по меньшей мере часть культивируемых бактерий L. intracellularis. Стадию сбора можно осуществлять путем отделения бактерий от суспензии с помощью различных методов, известных обычным специалистам в данной области, с использованием указаний, приведенных в настоящем описании. Предпочтительно бактерии L. intracellularis собирают путем центрифугирования всего содержимого или части суспензии с образованием дебриса клеточной культуры, ресуспендирования образовавшихся дебрисов и лизиса инфицированных клеток. Как правило, по меньшей мере часть содержимого центрифугируют примерно при 3000×g в течение примерно 20 мин для того, чтобы получить дебрис клеток и бактерий. Затем дебрис можно ресуспендировать, например, в сахарозо-фосфат-глутаматном (СФГ) растворе и пропускать примерно 20 раз через иглу 25-го размера для осуществления лизиса клеток. Если требуется дополнительная очистка, то образцы можно центрифугировать примерно при 145×g в течение примерно пяти минут для удаления клеточных ядер и дебриса. Затем супернатант можно центрифугировать примерно при 3000xg в течение примерно двадцати минут и образовавшийся дебрис ресуспендировать в соответствующем разбавителе, таком как СФГ, дополненный фетальной бычьей сывороткой (чтобы сделать собранные бактерии пригодными для лиофилизации, замораживания или использования в качестве инокулята), или в питательных средах (чтобы сделать собранные бактерии более пригодными для пересева на свежие клетки).
Как указывалось ранее, эффективный рост L. intracellularis для полупромышленного производства усиливают путем поддержания активного роста тканевых клеток. Использование суспензионных культур значительно облегчает поддержание активного роста клеток и позволяет осуществлять непрерывное увеличение объема культуры и повышение масштаба производства. При использовании ферментера и концентрации растворенного O2 примерно от 0 до 3%, как это указано выше, оказывается возможным достигать концентрации вплоть до 108 бактерий/мл.
Когда используют клетки линии McCoys или IEC-18, то наряду с питательными средами предпочтительно добавляют желатин, агарозу, коллаген, акриламид или кремниевые гранулы, такие как пористые микроносители типа Cultisphere-G (фирма HyClone Laboratories, Логан, шт. Юта). Однако для клеток линии НЕр-2 и других линий клеток не требуются микроносители при использовании способов, предлагаемых в изобретении.
При использовании культур клеток линии НЕр-2 для поддержания культуры предпочтительно 25-50% культуры с недельными интервалами удаляют и заменяют свежими средами. Для клеточных культур с микроносителями или гранулами предпочтительно удаляют 25-50% культуры и заменяют свежими средами 1-2 раза в неделю. Для повышения масштаба производства к культуре можно дополнительно добавлять 25-50% сред или сред с микроносителями.
В зависимости от скорости, с которой происходит заражение культуры клеток, пересев на свежие клетки, как правило, осуществляют с интервалом времени от примерно 2 до примерно 7 дней. Принимая во внимание, что культура клеток становится зараженной по меньшей мере на 70% в течение 2-7 дней, пересев предпочтительно осуществляют примерно через каждые 5-7 дней.
Диагностику антигена L. intracellularis осуществляют в настоящее время с помощью прямого метода иммунофлуоресценции и ПЦР. Диагностику антител, специфических в отношении L. intracellularis, в настоящее время осуществляют с использованием иммунофлуоресценции. Эти методы являются трудоемкими и требующими больших затрат времени, и они не пригодны для крупномасштабного скрининга.
Эффективная диагностика ПЭС затрудняется также вследствие значительного времени, которое требуется для культивирования бактерий-возбудителей. В настоящее время на основе результатов настоящего изобретения можно разрабатывать диагностические средства, позволяющие осуществлять быстрые и точные анализы присутствия L. intracellularis в биологических образцах, взятых из организма свиньи или других животных, чувствительных к ПЭС.
Таким образом, в основу настоящего изобретения была положена задача разработать усовершенствованные способы диагностики заболевания, вызываемого L. intracellularis.
Краткое изложение сущности изобретения
Настоящее изобретение относится к области ветеринарии и прежде всего касается Lawsonia intracellularis. В частности, изобретение относится к способу диагностики инфекции, вызываемой Lawsonia intracellularis, и диагностическому тест-набору с использованием специфических для Lawsonia intracellularis антител. Изобретение относится также к применению способа или диагностического тест-набора для диагностики инфекций, вызываемых Lawsonia intracellularis.
Краткое описание чертежей
На чертежах показано:
на фиг.1 - результаты, полученные с помощью блокирующего ELISA, предлагаемого в изобретении;
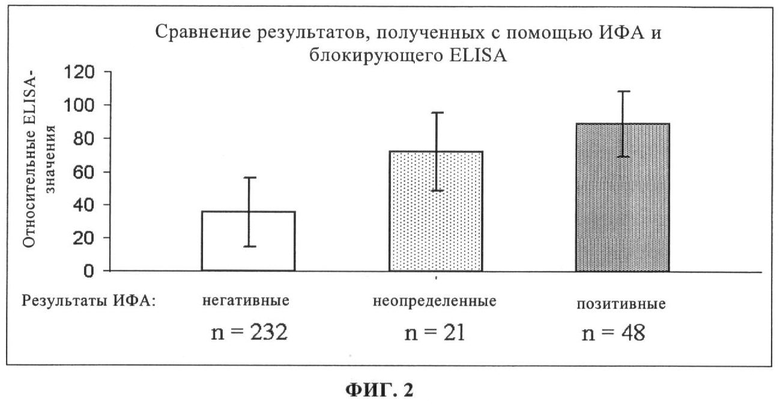
на фиг.2 - сравнение результатов, полученных методом ИФА и ELISA для 301 образца сыворотки, полученной в полевых условиях;
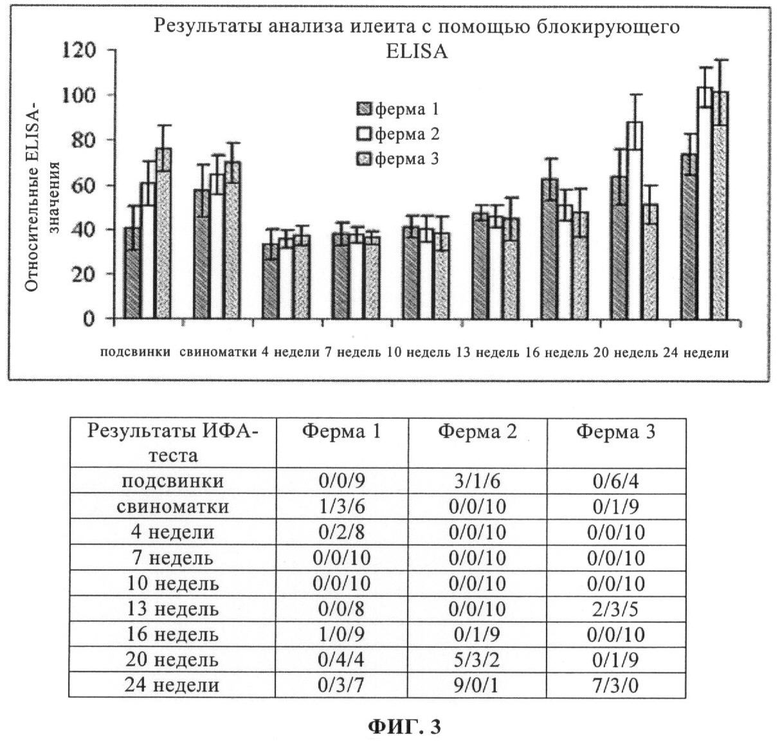
на фиг.3 - результаты кросс-секционных скринингов (скринингов с использованием данных, полученных для разных объектов) с использованием блокирующего ELISA, полученные на 3 фермах, зараженных илеитом;
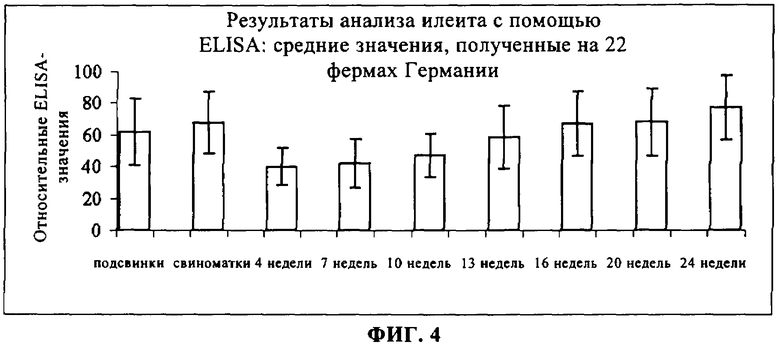
на фиг.4 - результаты, полученные с помощью ELISA, на 22 зараженных илеитом немецких фермах;
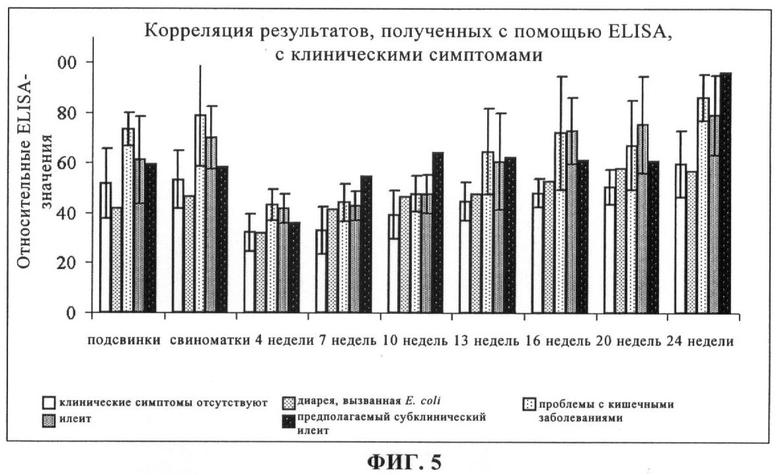
на фиг.5 - корреляция результатов, полученных с помощью ELISA, с клиническими симптомами.
Подробное описание изобретения
Определение понятий, используемых в описании
Перед изложением вариантов осуществления настоящего изобретения необходимо отметить, что в контексте настоящего описания и прилагаемой формуле изобретения понятия, употребляемые в единственном числе, включают также и множественное число, если в контексте ясно не указано иное. Так, например, понятие «бактерия» включает множество таких бактерий, понятие «клетка» включает одну или большее количество клеток и их эквивалентов, известных специалистам в данной области, и т.д. Если не указано иное, все технические и научные термины, используемые в настоящем описании, имеют значения, общепринятые в области техники, к которой относится изобретение. Хотя при воплощении на практике или при тестировании настоящего изобретения можно применять любые методы и материалы, аналогичные или эквивалентные указанным в настоящем описании, в настоящем описании представлены предпочтительные методы, устройства и материалы. Все указанные в описании публикации включены в настоящее описание в качестве ссылки для цели описания и раскрытия клеточных линий, векторов и методологий, представленных в публикациях, которые можно применять согласно изобретению. В данном описании ничто не следует истолковывать как признание того, что в изобретении не указаны такие документы, полученные задним числом, в качестве прототипов изобретения.
В контексте настоящего описания понятие «L. intracellularis» обозначает внутриклеточные изогнутые грамотрицательные бактерии, подробно описанные у Gebhart и др., Int'l. J. of Systemic Bacteriology, том. 43 (3), 1993, c.533-538 и S. McOrist и др., Int'l. J. of Systemic Bacteriology, том 45 (4), 1995, с.820-825, каждая публикация включена в настоящее описание в качестве ссылки во всей полноте; бактерии-возбудители, которые можно получать из зараженной ПЭС свиньи или других животных, обитающих во всем мире, на основе знаний в данной области и указаний, приведенных в настоящем описании; и варианты или мутанты любых из указанных выше бактерий, полученные спонтанно или искусственным путем, и ДНК, РНК и бактериальные белки, специфические для L. intracellularis, включая белки, экспрессируемые в векторах или после введения in vivo, а также фрагменты или антигенные производные L. intracellularis. Это понятие включает также адаптированные изоляты и ослабленные изоляты, которые описаны ниже.
В контексте настоящего описания понятие «адаптированный изолят» обозначает любой изолят L. intracellularis, полученный с помощью методов культивирования и пересева в культуре клеток или любых других методов, приведенных в настоящем описании, для репликации L. intracellularis с целью получения антигена.
В контексте настоящего описания понятие «ослабленный изолят» обозначает любой изолят L. intracellularis, полученный с помощью методов культивирования и пересева, приведенных в настоящем описании, для достижения авирулентности при сохранении иммуногенных свойств при введении животному-хозяину.
В контексте настоящего изобретения понятие «полупромышленное культивирование» обозначает уровень культивирования L. intracellularis, превышающий примерно 2,0-3,0 л, и включает производство в масштабе 100 л или более. «Культивирование» в контексте настоящего описания обозначает процесс стимуляции роста, репродукции и/или пролиферации L. intracellularis.
Описание изобретения
Решение указанных выше технических задач достигается с помощью настоящего описания и вариантов осуществления, представленных в формуле изобретения.
Задачей настоящего изобретения является разработать способ диагностики преклинического или клинического заражения L. intracellularis. Кроме того, задачей являлось разработать способы обнаружения иммунного ответа на L. intracellularis и средство для выявления эпидемиологии L. intracellularis.
Эта задача решается согласно настоящему изобретению с помощью способа диагностики преклинического или клинического заболевания, вызываемого L. intracellularis, представленного в описании и формуле изобретения.
Изобретение относится также к обнаружению антител к L. intracellularis и к обнаружению самой L. intracellularis. К таким антителам относятся антитела любого типа, известные специалисту в данной области, в частности иммуноглобулины, включающие подтипы IgA, растворимый IgA, IgM, IgG (IgG1, IgG2a, IgG2b, IgG3), а также IgD, IgE.
Для обнаружения антител, специфических в отношении L. intracellularis, способ, предлагаемый в изобретении, заключается в том, что:
а) берут жидкий образец (образец жидкости) из организма млекопитающего,
б) выявляют специфическое связывание этого жидкого образца с антигеном L. intracellularis,
в) сравнивают полученный результат с контролем.
Как указано выше, понятие L. intracellularis относится также к фрагментам или антигенным производным L. intracellularis, которые можно применять согласно описанному выше способу.
Аналогично этому для обнаружения L. intracellularis способ, предлагаемый в изобретении, заключается в том, что:
а) берут жидкий образец из организма млекопитающего,
б) выявляют специфическое связывание этого жидкого образца с антителами к L. intracellularis,
в) сравнивают полученный результат с контролем.
Жидкий образец может представлять собой любую жидкость, содержащуюся в организме, включая слюну, пот, мочу, кровь, секреты, выделения или образцы других жидкостей, содержащихся в организме, которые известны эксперту в данной области. В предпочтительном варианте осуществления изобретения жидкий образец собирают с использованием либо контейнера для сбора (для мочи или другой жидкости), шприца/пробирки для сбора (для крови), либо определенного типа тампона для сбора (для слюны, пота и т.д.). Предпочтительно, если образец, указанный на стадии а), представляет собой кровь, то из этого образца выделяют сыворотку или плазму и стадию б) осуществляют с использованием сыворотки или плазмы вместо жидкого образца. Затем осуществляют стадию в), как описано выше.
В предпочтительном варианте осуществления изобретения способ заключается в проведении иммунного анализа. В иммунном анализе используют моноклональные антитела или поликлональную антисыворотку, специфическую для L. intracellularis. В иммунных анализах, предлагаемых в изобретении, применяют методы обнаружения, известные в данной области, такие как ELISA (твердофазный иммуноферментный анализ) или так называемый сэндвич-ELISA, дот-блоттинги, иммуноблоттинги, радиоиммунные тесты (радиоиммунные анализы (РИА)), основанный на оценке диффузии анализ по методу Оухтерлони или реактивные иммунофлуоресцентные анализы. Другими иммунными анализами являются тест на основе непрямого или прямого иммунофлюоресцентного метода (с использованием антител) (ИФА). Еще одним иммунным анализом является так называемый Вестерн-блот (также называемый методом Вестерн-переноса или Вестерн-блоттингом). Вестерн-блот позволяет переносить белки или полипептиды, разделенные с помощью гель-электрофореза в полиакриламидном геле, на нитроцеллюлозный фильтр или другой пригодный носитель и в то же время сохранять относительные положения белков или полипептидов, полученных с помощью гель-электрофореза. Затем Вестерн-блот инкубируют с антителом, которое специфически связывается с рассматриваемым белком или полипептидом. Эти методы обнаружения обычные специалисты могут применять для осуществления на практике описанного изобретения. Ниже даны литературные ссылки, в которых специалист может найти описания указанных выше методов и других методов обнаружения: An Introduction to Radioimmunoassay and related techniques, изд-во Elsevier Science Publishers, Amsterdam, The Netherland, 1986; Bullock и др., Techniques in Immunocytochemistry, изд-во Academic Press, Orlando, Fl том 1 (1982), том 2, 1983, том 3 (1985); Tijssen, Practice and Theory of Enzyme Immunoassays: Laboratory Techniques in Biochemistry and Molecular Biology, изд-во Elsevier Science Publishers, Amsterdam, The Netherland, 1985. В качестве других иммунных анализов, применяемых согласно изобретению, можно использовать технологии на основе твердых и жидких белковых чипов или технологии на основе микроматриц с применением меченых или немеченых реагентов. Такие анализы описаны, например, у Kozak К. R. и др. Identification ofbiomarkers for ovarian cancer using strong anion-exchange ProteinChips: potential use in diagnosis and prognosis, Proc. Natl. Acad. Sci. USA, 14, 100(21), октябрь 2003, с. 12343-12348, или у Fulton R. J. и др., Advanced multiplexed analysis with the FlowMetrix™ system, Clinical Chemistry, 43(9), 1997, с.1749-1756.
Изобретение относится также к диагностическому тест-набору для обнаружения инфекции, вызываемой L. intracellularis, который содержит все элементы, необходимые для осуществления на практике описанного выше способа диагностики преклинического или клинического заболевания, вызываемого L. intracellularis.
Кроме того, изобретение относится, в частности, к диагностическому тест-набору, который содержит антитела, специфические для L. intracellularis.
Кроме того, изобретение относится, в частности, к диагностическому тест-набору, который отличается тем, что антитела, предлагаемые в изобретении, являются поликлональными.
Кроме того, изобретение относится, в частности, к диагностическому тест-набору, который отличается тем, что антитела, предлагаемые в изобретении, являются моноклональными.
Диагностический тест-набор представляет собой набор всех компонентов, необходимых для осуществления способа диагностики, предлагаемого в изобретении. Конкретными примерами (перечень не является исчерпывающим) других компонентов, необходимых для осуществления способа диагностики, предлагаемого в изобретении, являются контейнеры, такие как 96-луночные планшеты или титрационные микропланшеты, лабораторные пробирки, другие пригодные контейнеры, поверхности и субстраты, мембраны, такие как нитроцеллюлозный фильтр, реагенты для отмывки и буферы. Диагностический тест-набор может содержать также реагенты, которые позволяют обнаруживать связанные антитела, такие, например, как меченые «вторичные» антитела, хромофоры, ферменты (например, конъюгированные с антителами) и их субстраты или другие субстанции, которые обладают способностью связываться с антителами.
Представленные в настоящем описании или известные в данной области бактерии L. intracellularis или компоненты, полученные из таких бактерий, можно применять в качестве антигена при проведении ELISA или другого иммунного анализа, такого как иммунофлуоресцентный метод («ИФА»), для обнаружения антител к L. intracellularis в сыворотке или другой общей воде организма животных, в отношении которых имеется предположение, что они заражены бактериями. В настоящее время предпочтительным методом анализа является ИФА, описанный ниже в примере. В альтернативном варианте бактерии, предлагаемые в настоящем изобретении, можно анализировать с помощью Вестерн-блоттинга.
Предпочтительным протоколом Вестерн-блоттинга является следующий протокол:
1. Осуществляют электрофорез антигена на ДСН-ПААГ, предпочтительно 12% ДСН-ПААГ, и переносят на нитроцеллюлозную мембрану.
2. Помещают мембрану в блокирующий буфер на 2 ч.
3. Удаляют блокирующий буфер и промывают ЗФР в течение 1 мин.
4. Разводят сыворотку блокирующим буфером и наносят на мембрану. Инкубируют в течение 2 ч при комнатной температуре.
5. Отмывают 3 раза буфером для отмывки (5 мин для каждой отмывки).
6. Разводят конъюгированное специфическое для L. intracellularis антитело, предпочтительно моноклональное антитело, блокирующим буфером и наносят на мембрану. Инкубируют в течение 1 ч при комнатной температуре.
7. Отмывают 3 раза буфером для отмывки.
8. Добавляют субстрат на 10 мин или до тех пор, пока не возникает выраженный бэндинг.
9. Отмывают с помощью ЗФР.
10. Сушат на воздухе и помещают на хранение в темноту.
Конъюгат, сшитый с антителом, может представлять собой, например, фермент, такой как пероксидаза из хрена (HRP) или щелочная фосфатаза (АР). В альтернативном варианте в качестве конъюгата можно применять хромофор или любую другую обнаруживаемую субстанцию, которую можно количественно оценивать в присутствии субстрата.
Согласно изобретению наиболее предпочтительным иммунным анализом является ELISA. Наиболее предпочтительно такой ELISA представляет собой сэндвич-ELISA (т.е. ELISA с использованием захвата). Такой ELISA обладает большей специфичностью, поскольку с его помощью обнаруживают два антитела, специфические для двух различных эпитопов на одном антигене. При использовании сэндвич-ELISA титрационные микропланшеты сенсибилизируют немечеными антителами. Затем добавляют в качестве антигена L. intracellularis. После стадии отмывки связанный антиген L. intracellularis обнаруживают с помощью второго меченого специфического для L. intracellularis антитела, распознающего другой эпитоп L. intracellularis.
Примером процедуры сенсибилизации может служить следующая процедура.
Планшеты сенсибилизируют с помощью немеченого антитела, например, в смеси 10% сахарозы/10% нормальной лошадиной сыворотки в ddH2O и инкубируют с антигеном L. intracellularis. Затем планшеты сушат и запечатывают и хранят при 37°С. В альтернативном варианте сенсибилизированные антителом планшеты помещают на хранение, а антиген добавляют при проведении ELISA.
Предпочтительным протоколом ELISA, предлагаемым в изобретении, является следующий протокол (при использовании сенсибилизированных антителом планшетов):
1. Добавляют антиген в количестве 0,1 мл/лунку, разведенный в буфере для сенсибилизации. Инкубируют в течение 18 ч при 4°С.
2. Промывают 3 раза ЗФР.
3. В каждую лунку планшета добавляют 0,25 мл блокирующего буфера. Инкубируют в течение 1-2 ч при 37°С.
4. Отмывают 3 раза буфером для отмывки.
5. Разводят сыворотку блокирующим буфером и добавляют по 0,1 мл в первые лунки планшета. Осуществляют серийные разведения в соотношении 1:2 в следующих лунках планшета. Инкубируют в течение 1 ч при 37°С.
6. Отмывают 3-5 раз буфером для отмывки.
7. Разводят конъюгированное специфическое для L. intracellularis антитело блокирующим буфером и добавляют по 0,1 мл в лунки планшета и инкубируют в течение 1 ч при 37°С.
8. Отмывают 3-5 раз буфером для отмывки.
9. Добавляют субстрат.
10. Измеряют абсорбцию света с помощью спектрофотометра.
11. Лунки, в которые не добавляли антиген, используют в качестве контролей.
12. В каждом тесте следует использовать также свиную сыворотку в качестве положительного и отрицательного контроля.
Предпочтительно ELISA осуществляют следующим образом.
Планшеты сенсибилизируют с помощью немеченого антитела, например, в смеси 10% сахарозы/10% нормальной лошадиной сыворотки в ddH2O и инкубируют с антигеном Lawsonia intracellularis. Затем планшеты сушат и запечатывают и хранят при 37°С.
1. Добавляют по 90 мкл буфера во все лунки.
2. Добавляют по 10 мкл сыворотки в выбранные лунки.
3. Инкубируют планшет в течение 1 ч при 37°С.
4. Отмывают планшет 3 раза ЗФРТ (ЗФР-Твин).
5. Добавляют конъюгированное с HRP специфическое антитело к L. intracellularis, предпочтительно моноклональное антитело, разведенное в CDS-C (стандартный буфер для лиофилизации конъюгатов) + 0,5М NaCl, 100 мкл/лунку.
6. Инкубируют в течение 1 ч при 37°С.
7. Отмывают планшет 3 раза ЗФРТ.
8. Добавляют субстрат из расчета 100 мкл/лунку и инкубируют при комнатной температуре в течение 10 мин.
9. Добавляют по 50 мкл/лунку стоп-раствора для прекращения реакции.
10. Считывают планшет при 450 нм в спектрофотометре.
Наиболее предпочтительным протоколом сэндвич-ELISA, предлагаемым в изобретении, является следующий протокол:
1. Добавляют по 0,1 мл/лунку МАт, разведенного в буфере для сенсибилизации. Инкубируют в течение 18 ч при 4°С.
2. Отмывают 3 раза ЗФР.
3. Добавляют по 0,1 мл/лунку антигена, разведенного в буфере, в каждую лунку планшета. Инкубируют в течение 1-2 ч при 37°С.
4. Отмывают 3 раза буфером для отмывки и/или непосредственно добавляют в каждую лунку планшета по 0,25 мл блокирующего буфера. Инкубируют в течение 1-2 ч при 37°С.
5. Отмывают 3 раза буфером для отмывки.
6. Разводят сыворотку блокирующим буфером и добавляют по 0,1 мл в первые лунки планшета. Осуществляют серийные разведения в соотношении 1:2 в следующих лунках планшета. Инкубируют в течение 1 ч при 37°С.
7. Отмывают 3-5 раз буфером для отмывки.
8. Разводят конъюгированное специфическое антитело к L. intracellularis, предпочтительно моноклональное антитело, блокирующим буфером и добавляют по 0,1 мл в лунки планшета и инкубируют в течение 1 ч при 37°С.
9. Отмывают 3-5 раз буфером для отмывки.
10. Добавляют субстрат.
11. Измеряют абсорбцию света с помощью спектрофотометра.
12. Лунки, в которые не добавляли антиген, используют в качестве контролей.
13. В каждом тесте следует использовать также свиную сыворотку в качестве положительного и отрицательного контроля.
Применяемый согласно настоящему описанию антиген представляет собой L. intracellularis, как указано выше. МАт представляет собой моноклональное антитело, специфическое для L. intracellularis. Предпочтительно такое антитело представляет собой описанное ниже антитело.
При создании изобретения неожиданно были созданы обладающие высокой активностью антитела, которые можно применять в ELISA согласно изобретению. Антителам для удобства осуществления ссылок присвоили следующие номера: 301:39, 287:6, 268:29, 110:9, 113:2 и 268:18. Все антитела обладают специфичностью в отношении антигенов бактерий L. intracellularis. В качестве иммобилизованных антител в сэндвич-ELISA применяют 110:9, 113:2 или 268:18, а в качестве конъюгированных антител применяют 268:18, 268:29 или 287:6. Наиболее предпочтительным иммобилизованным антителом является антитело 110:9, а конъюгированным антителом является антитело 268:29. Предпочтительными являются также антитела, обладающие всеми характеристиками указанных выше антител, что означает, что они обладают практически такими же характеристиками связывания, которые присущи указанным выше антителам, и/или которые направлены на те же самые антигены L. intracellularis, которые указаны выше, и/или направлены или распознают те же самые эпитопы, что и указанные выше антитела.
Антитела, предлагаемые в изобретении, продуцируются клетками гибридомы. Клетки гибридом, предлагаемых в изобретении, депонированы с целью патентования в соответствии с Будапештским договором в Научно-производственном центре микробиологии (CAMR) и Европейской коллекции клеточных культур (ЕСАСС), Солсбери, Уилтшир SP4 OJG, Великобритания. Дата депонирования - 11 мая 2004. Линия клеток гибридомы 110:9 успешно депонирована под регистрационным номером ЕСАСС 04092204. Линия клеток гибридомы 113:2 успешно депонирована под регистрационным номером ЕСАСС 04092201. Линия клеток гибридомы 268:18 успешно депонирована под регистрационным номером ЕСАСС 04092202. Линия клеток гибридомы 268:29 успешно депонирована под регистрационным номером ЕСАСС 04092206. Линия клеток гибридомы 287:6 успешно депонирована под регистрационным номером ЕСАСС 04092203. Линия клеток гибридомы 301:39 успешно депонирована под регистрационным номером ЕСАСС 04092205.
Ниже изобретение более подробно проиллюстрировано на примерах, которые представлены только с целью иллюстрации и не направлены на ограничение объема изобретения. В частности, обычному специалисту в данной области должны быть очевидны другие варианты осуществления изобретения.
Все цитированные в настоящем описании публикации и патенты включены в описание в качестве ссылки во всей их полноте.
Пример 1
1.0 Материал
Клеточная линия гибридомы, секретирующая антитела к Lawsonia: 372:13, 113:2, 268:18, 287:6, 110:9, 268:29, 301:39.
Оборудование и среды для культивирования клеток гибридомы.
Оборудование и буферы для очистки и конъюгации с HRP моноклональных антител (МАт).
Оборудование и растворы для ELISA.
Антиген Lawsonia SF1289 N343 12/20/00.
Позитивная в отношении Lawsonia сыворотка: лот №052902pig №26 (инфицированный экспериментально), лот №052902pig №69 (вакцинатный).
Негативная в отношении Lawsonia сыворотка: р 25.8 №273 день 52 6-30-95, 116705.
1.1. Методы
Получение моноклональных антител осуществляли согласно стандартным методам на фирме Svanova Biotech.
1.1.1. Культивирование клеток гибридомы и получение конъюгированных с HRP моноклональных антител.
- Для сохранения линий клеток гибридомы отбирали по 15 пробирок для каждой линии и помещали на хранение при -135°С.
- Одну пробирку для каждой линии клеток гибридомы подвергали оттаиванию и клетки выращивали в колбах для клеточных культур.
- Для каждой линии клеток очищали от 500 до 1000 мл супернатанта и подвергали конъюгации с пероксидазой из хрена.
1.1.2. Блокирующий ELISA
Очищенные и конъюгированные с HRP МАт тестировали с помощью ELISA в отношении их способности блокироваться позитивной в отношении Lawsonia свиной сывороткой.
Планшеты для ELISA сенсибилизировали антигеном Lawsonia при разведении 1/200, 100 мкл/лунку.
Свиную сыворотку разводили в соотношении 1/10, 100 мкл/лунку.
Разводили и добавляли конъюгированные с HRP МАт, 100 мкл/лунку.
Результаты выражали в виде процента ингибирования (ПИ) согласно следующей формуле:
ПИ=1-(ОП образца/ОП МАт)×100.
1.2 Результаты
1.2.1 Культивирование клеток гибридомы и получение конъюгированных с HRP моноклональных антител.
- Для всех МАт, кроме одного, была проведена успешная очистка и конъюгация с HRP. Они обладали высокой способностью образовывать продукт.
- МАт 372:13 обладало слабой способностью образовывать продукт. Для этого МАт не удалось осуществить успешную конъюгацию с HRP, и поэтому его не тестировали с помощью блокирующего ELISA.
1.2.2 Блокирующий ELISA
- В экспериментах использовали образцы двух позитивных (№26, №69) и двух негативных (25.8 №273, 116705) сывороток.
- Экспериментальная зараженная сыворотка (№26) ингибировала все шесть конъюгированных с HRP МАт, но в различной степени. Сыворотка из вакцинированных свиней обладала существенно меньшей ингибирующей способностью.
- Негативная сыворотка не обладала никакой или обладала очень слабой ингибирующей способностью.
Результаты представлены на приведенной ниже таблице и на фиг.1.
1.3. Обсуждение
Результаты данного исследования ясно свидетельствуют о том, что одно или несколько тестированных моноклональных антител пригодны для анализа с помощью блокирующего ELISA с использованием Lawsonia intracellularis. При использовании МАт 268:29, 287:6 и 268:18 было выявлено существенное различие между позитивной и негативной сывороткой, т.е. они являются перспективными кандидатами для разработки блокирующего ELISA.
Пример 2
2.0 Краткое описание
Разработка и утверждение прототипа сэндвич-b (блокирующего)-ЕLISА для обнаружения антител к Lawsonia intracellularis.
После расчета чувствительности и специфичности с использованием иммунофлуоресцентного анализа ИФА в качестве «золотого» стандарта можно сделать следующие выводы:
- Иммобилизованное МАт 110:9 позволяет осуществлять четкое различие между позитивными и негативными образцами.
- Идентифицирующее МАт 268:29-HRP позволяет четко определять различие между позитивной и негативной сывороткой с чувствительностью и специфичностью, составляющей 100%.
Рекомендуемым прототипом является следующий:
- МАт 110:9 в качестве иммобилизованного МАт, которым сенсибилизируют стрипы (полоски) типа Nunc maxi-sorp C-8
- Антиген (АГ): культура Lawsonia intracellularis (предпочтительно в виде концентрированного продукта, поставляемого фирмой R&D при BI).
- Образцы сыворотки, разведенные в соотношении 1/10 в 0,5М NaCl/ЗФРТ. Инкубация в течение 1 ч при 37°С.
- Конъюгированное с HRP МАт 268:29, лиофилизированное в CDS-C-буфере, содержащем 0,5М NaCl. Инкубация в течение 1 ч при 37°С.
- Субстрат K-Blue Max, инкубация в течение 10 мин при комнатной температуре.
- Стоп-раствор фирмы Svanova.
2.1 Материалы и методы
ELISA осуществляли согласно следующей процедуре:
2.1.0 Процедура ELISA
- Добавляют по 90 мкл буфера во все лунки.
- Добавляют по 10 мкл сыворотки в выбранные лунки.
- Инкубируют планшет в течение 1 ч при 37°С.
- Отмывают планшет 3 раза с помощью ЗФРТ.
- Добавляют конъюгат HRP с МАт, разведенный CDS-C-буфером + 0,5М NaCl, 100 мкл/лунку.
- Инкубируют планшет в течение 1 ч при 37°С.
- Отмывают планшет 3 раза ЗФРТ.
- Добавляют субстрат по 100 мкл/лунку и инкубируют при комнатной температуре в течение 10 мин.
- Добавляют 50 мкл стоп-раствора/лунку.
- Считывают планшет при 450 нм с помощью спектрофотометра.
Результаты представляли в виде 1 - значений ОП или 2 - ПИ (процент ингибирования), т.е. 100 - ОП образца/ ОП МАт×100
2.1.1 Тест 1 (ELISA 030922, 030923×2)
Стрипы типа C-8 сенсибилизировали МАт 110:9, 113:2, 301:39, 287:6 из расчета 300 нг/лунку. Стрипы блокировали 10% 2251HÄS (нормальная лошадиная сыворотка), 10% сахарозы/H2О UHP, 150 мкл/лунку, инкубировали в течение 30 с при комнатной температуре.
АГ №030619 разводили ЗФРТ в соотношении 1/10, 100 мкл/лунку, инкубировали в течение 3 ч при 4°С.
Стрипы сушили в течение 3 ч при 37°С. Хранили при 4°С.
Сыворотка: ИФА-позитивная №26, №69. ИФА-негативная: №6, C1, B1, E1. Разведенная в соотношении 1/10 0,5М NaCl/ЗФРТ. Конъюгат: 268:18-, 113:2-, 301:39-, 110:9-, 287:6-, 268:29-HRP, разведенные в 0,5М NaCl/ЗФРТ.
Все иммобилизованные МАт тестировали путем сравнения со всеми конъюгированными с HRP МАт за исключением их самих.
2.1.2 Тест 2 (ELISA 030924)
Стрипы сенсибилизировали с помощью 110:9, 113:2 и 287:6 согласно методу, описанному выше в тесте 1.
Сыворотка: ИФА-позитивная №26, №69. ИФА-негативная: №6, C1, B1, Е1. Разведенная в соотношении 1/10 0,5М NaCl/ЗФРТ.
Конъюгированные с HRP МАт: 268:18, 268:29, 287:6, разведенные в 0,5М NaCl/CDS-C (стандартный буфер для лиофилизации конъюгатов, поступающий в продажу от фирмы Svanova).
2.1.3 Тест 3 (ELISA 030925)
Стрипы сенсибилизировали с помощью антител 110:9, 113:2 и 287:6 согласно методу, описанному выше в тесте 1.
Сыворотка: тестировали 24 сыворотки (10 ИФА-позитивных, 10 ИФА-негативных и 4 неопределенной специфичности). Разведение 1/10 в 0,5М NaCl/ЗФРТ.
Конъюгат: 268:18-HRP, разведенный в 0,5М NaCl/CDS-C.
2.1.4 Тест 4 (ELISA 030930, 031002, 031008)
Стрипы, сенсибилизированные антителом 110:9 согласно методу, описанному в тесте 1.
Сыворотка: 21 ИФА-позитивная, 69 ИФА-негативных. Разведение 1/10 в 0,5М NaCl/ЗФРТ.
Конъюгат: 268:18, конъюгированный с HRP, разведенный в 0,5М NaCl/CDS-C.
2.2. Результаты
2.2.1 Тест 1 (ELISA 030922, 030923×2)
Иммобилизованные МАт 110:9, 113:2 и 287:6 и конъюгированные МАт 268:18 и 268:29 и 287:6, по-видимому, являются наиболее перспективными кандидатами для сэндвич-b-ELISA, поскольку эти комбинации обладали наибольшей блокирующей способностью при использовании позитивной сыворотки. В большинстве тестов сыворотка №6 была оценена как позитивная. Это и предполагалось, поскольку эта сыворотка была оценена как позитивная с помощью разработанного ранее прототипа b-ELISA.
2.2.2 Тест 2 (ELISA 030924)
Этот тест осуществляли в основном для того, чтобы удостовериться, что можно использовать стандартный буфер, применяемый для лиофилизации конъюгата. Результаты свидетельствуют о том, что блокирование достигалось при использовании позитивной сыворотки. Наибольший блокирующий эффект был выявлен при обнаружении с помощью МАт 268:18 или 268:29.
2.2.3 Тест 4 (ELISA 030925)
Было установлено, что иммобилизованное МАт 110:9 является наиболее предпочтительным, поскольку позволяет наиболее четко различать позитивные и негативные образцы.
2.2.4 Тест 4 (ELISA 030930, 031002, 031008)
Полученные значения ОП и ПИ приведены в приложении 5. На графике зависимости значений ОП от полученных с помощью ИФА результатов с использованием конъюгированного с HRP МАт 268:29 видно четкое различие между позитивными и негативными образцами со 100%-ной чувствительностью и специфичностью. МАт 268:18 также обладает 100%-ной чувствительностью и специфичностью, но различие между позитивными и негативными образцами невелико. Из графика, на котором представлены значения ПИ, следует, что МАт 268:18 обладает чувствительностью 95,7 и специфичностью 100% при частоте среза 20,9, в то время как МАт 268:29 обладает 100%-ной чувствительностью и специфичностью при частоте среза 28,6.
2.3. Обсуждение
На основе расчета чувствительности и специфичности при осуществлении иммунофлуоресцентного анализа ИФА можно сделать следующие заключения:
- Иммобилизованное МАт 110:9 является наиболее предпочтительным, поскольку позволяет четко различать позитивные и негативные образцы.
- Идентифицирующее МАт 268:29, конъюгированное с HRP, является наиболее предпочтительным, поскольку позволяет четко различать со 100%-ной чувствительностью и специфичностью позитивную и негативную сыворотку.
Рекомендуется применять следующие прототипы:
- МАт 110:9 в качестве иммобилизированного МАт 110:9, которым сенсибилизируют Nunc maxi-sorp-стрипы типа С-8.
- АГ: культура Lawsonia intracellularis (предпочтительно в виде концентрированного продукта, поставляемого фирмой R&D при BI).
- Образцы сыворотки, разведенные в соотношении 1/10 в 0,5М NaCl/ЗФРТ. Инкубация в течение 1 ч при 37°С.
- Конъюгированное с HRP МАт 268:29, лиофилизированное в CDS-C-буфере, содержащем 0,5М NaCl. Инкубация в течение 1 ч при 37°С.
- Субстрат K-Blue Max, инкубация в течение 10 мин при комнатной температуре.
- Стоп-раствор фирмы Svanova.
Пример 3
3.1. Резюме
Проведенные ускоренные исследования стабильности свидетельствуют о том, что антиген Lawsonia intracellularis, иммобилизованный на планшете для ELISA, обладает стабильностью по меньшей мере в течение одного года и что антитело к Lawsonia, конъюгированное с HRP 268:29, в лиофилизированной форме обладает стабильностью в течение периода времени от 6 до 12 месяцев.
3.2. Введение
Для оценки стабильности компонентов перспективного ELISA-набора для Lawsonia intracellularis были проведены ускоренные тесты для исследования стабильности. Предназначенный для исследования стабильности компонент хранили в течение 4 недель при 37°С и затем тестировали с помощью ELISA и сравнивали с компонентом, который хранили при 4°С. Стабильность в течение 4 недель при 37°С соответствует сроку годности примерно 12 месяцев. В данном отчете описаны ускоренные исследования стабильности, проведенные с использованием иммобилизованного антигена на планшете для ELISA и конъюгата с HRP.
3.3. Материалы и методы
Ускоренное исследование стабильности на планшетах (ELISA 031024)
Планшеты сенсибилизировали МАт 110:9 к Lawsonia, блокировали 10% сахарозы/нормальной лошадиной сыворотки в ddH2O и инкубировали с антигеном Lawsonia. Планшеты сушили и запечатывали и хранили при +37°С. Планшеты брали после хранения при +37°С через 1, 2, 3 и 4 недели и помещали на хранение в холодильник. В качестве контроля хранили также планшеты в течение всего периода тестирования при 4°С.
Для оценки характеристик сэндвич-ELISA использовали позитивные сыворотки №26, №69 и №06 и негативные сыворотки С2, D1 и Е2.
Использовали конъюгированное с HRP МАт 268:29, лот №030120.
Ускоренное исследование стабильности на лиофилизированном конъюгате (ELISA 031027)
Конъюгированное с HRP МАт 268:29, лот №030120 разводили в соотношении 1/1000 в CDS-C-буфере, распределяли в стеклянные флаконы и лиофилизировали согласно стандартным процедурам. Четыре флакона с лиофилизированным продуктом хранили при +37°С в течение 1, 2, 3 и 4 недель. Флаконы хранили также при 4°С. Содержимое различных флаконов тестировали с помощью сэндвич-ELISA. В качестве позитивной сыворотки использовали №26 и в качестве негативной сыворотки использовали сыворотку 030926.
Было установлено, что разведение 1/1000 конъюгированного антитела («разведение конъюгата») приводит в тесте к слишком большим величинам ОП. Поэтому конъюгированное антитело титровали на планшете для получения находящегося в нужном диапазоне сигнала для теста.
3.4. Результаты
Ускоренное исследование стабильности на планшетах
Через 1 неделю было выявлено сильное уменьшение величин ОП по сравнению с величинами ОП, полученным с использованием стрипов, которые хранили при 4°С. Не было выявлено больших различий при сравнении результатов, полученных через 1 и 4 недели.
При анализе значений ПИ не было выявлено существенных различий при сравнении результатов, полученных в период между 1-й и 4-й неделей при хранении при 4°С.
Ускоренное исследование стабильности лиофилизированного конъюгата
При «разведении конъюгата» 1/8000 для сыворотки №26 было выявлено уменьшение от 0,547 до 0,398 по истечении 4 недель, а для сыворотки 030926 уменьшение от 1,654 до 0,99 по истечении 4-недельного периода.
3.5. Обсуждение
Результаты проведенных исследований свидетельствуют о том, что планшет для ELISA с Lawsonia intracellularis обладает стабильностью по меньшей мере в течение одного года. При использовании антитела 268:29 к Lawsonia, конъюгированного с HRP, обнаружено уменьшение ОП на 40% по сравнению с негативной сывороткой после 4-х недель. Это может свидетельствовать о некоторой нестабильности конъюгата. При расчете величин ОП уменьшение сигнала на 40% соответствует величине 1,5, и величина ОП 0,9 по истечении 1 года все еще находится в приемлемом диапазоне (соответствует критериям приемлемости).
Пример 4
4.1. Резюме
Проверку прототипа (партия планшетов 040107) осуществляли путем тестирования 50 образцов сыворотки, которые ранее использовали при разработке прототипа. Результаты проверочного исследования продемонстрировали 100%-ное выявление позитивной сыворотки, в то время как в проверяемой партии 2 из 25 образцов негативной сыворотки были оценены как позитивные.
Установлено, что в CDS-C-буфере можно применять нормальную лошадиную сыворотку вместо свиной сыворотки, используемой в настоящее время.
Было установлено, что при использовании ЗФРТ, содержащего 0,042% ПВП, были получены такие же результаты, что и при использовании ЗФРТ-таблеток (которые содержат ПВП).
4.2. Введение
Для проверки прототипа сэндвич-ELISA необходимо тестировать большее количество образцов сыворотки для более крупной партии планшетов, приготовленных для полупромышленного производства.
Это исследование проводили на партии планшетов 040107, которые тестировали путем исследования 50 образцов сыворотки, ранее применяемых для создания прототипа.
При лиофилизации конъюгата с HRP в качестве консерванта применяли CDS-C-буфер. Этот буфер содержит свиную сыворотку. Поскольку в перспективе может оказаться проблематичным найти негативную в отношении Lawsonia сыворотку, предназначенную для использования в CDS-C-буфере, то оценивали другие варианты. В этом исследовании тестировали нормальную лошадиную сыворотку и фетальную телячью сыворотку.
Основная часть лабораторных исследований для этого ELISA была проведена с использованием ЗФРТ-таблеток. Установлено, что 20×ЗФРТ, который входит в наборы фирмы Svanovir, нельзя применять, поскольку при этом тест не позволяет точно различать позитивные и негативные образцы. При сравнении составов таблеток и 20×ЗФРТ было установлено, что все компоненты были идентичными за исключением того, что в таблетки в качестве стабилизатора был включен ПВП (поливинилпирролидон К25). В результате экспериментов было установлено, что при добавлении ПВП в 20×ЗФРТ достигаются такие же результаты, что и для таблеток.
4.3. Материалы и методы
Проверка прототипа (ELISA 040312)
50 образцов сывороток (полученных от фирмы Bioscreen), которые ранее оценивали при разработке ELISA, применяемого в качестве прототипа, тестировали с использованием крупномасштабной партии №0400107 планшетов. Применяли 20×ЗФРТ, содержащий 0,042% ПВП. Применяли партию 040308 лиофилизированного конъюгата.
CDS-C-буфер, содержащий нормальную лошадиную сыворотку.
Тест ELISA 040203
CDS-C-буфер получали с использованием: 1 - свиной сыворотки (согласно TJ4/05F), 2 - нормальной лошадиной сыворотки и 3 - фетальной телячьей сыворотки. Буферы тестировали в качестве буферов для конъюгации в ELISA. Тестируемые образцы сыворотки представляли собой gris 2, 4, 13 и 17, 1-29664, 3-29664, А-27239, В-27239, № 26 и С2. Использовали конъюгированное с HRP МАт 268:29, лот №030318. Использовали 20×ЗФРТ-буфер, дополненный 0,042% ПВП.
Тест ELISA 040311
CDS-C-буфер, содержащий нормальную лошадиную сыворотку, использовали для получения лиофилизированного конъюгата для двух вариантов опытов (040211, 040308). Конъюгат получали для приготовления конечных разведении 1/20k, 1/25k и 1/30k. Свежеприготовленные конъюгаты тестировали параллельно. Использовали сыворотку №26, 1-29664, 3-29664, А-27239, В-27239, позитивный пул 030926 и негативный пул 030926. Использовали конъюгированное с HRP МАт 268:29, лот №030318. Использовали 20×ЗФРТ-буфер, содержащий 0,042% ПВП.
ЗФРТ, содержащий ПВП (ELISA 040301)
20×ЗФРТ буфер разводили в соотношении 1/20 и добавляли ПВП в конечной концентрации 0,042%. Этот буфер тестировали параллельно с ЗФРТ-таблетками (уже содержащими ПВП) и 20×ЗФРТ-буфером, разведенным в соотношении 1/20. Буферы использовали на всех стадиях, т.е. в качестве буфера для образца и буфера для разведения конъюгата, а также в качестве буфера для отмывки.
Использовали образцы сыворотки №26, E1, 1-29664, 3-29664, А-27239, B-27239 и gris 13. Использовали конъюгированное с HRP МАт 268:29, лот №030318. В качестве буфера для конъюгации использовали CDS-C-буфер со свиной сывороткой.
4.4. Результаты
Проверка прототипа
Результаты свидетельствуют о том, что в партии, предназначенной для проверки, все 25 позитивных, как установлено ранее, сывороток были оценены как позитивные. 2 из 25 сывороток, ранее оцененных как негативные, были оценены как позитивные.
CDS-C-буфер с нормальной лошадиной сывороткой
Для буфера, содержащего нормальную лошадиную сыворотку, были получены результаты, аналогичные результатам, полученным для свиной сыворотки.
Значения ОП для иммобилизованного с HRP МАт уменьшались не более чем на 0,4 по сравнению со свежеприготовленным конъюгатом. Это уменьшение зафиксировано в обеих партиях лиофилизированного конъюгата. Это обстоятельство не влияет на эффективность теста, поскольку рассчитанные значения ПИ согласуются вне зависимости от полученных значений ОП.
ЗФРТ, содержащий ПВП
Данные исследований свидетельствуют о том, что результаты, полученные при использовании 20хЗФРТ-буфера, разведенного в соотношении 1/20, дополненного 0,042%-ным ПВП, аналогичны результатам, полученным при использовании ЗФРТ-таблеток, в то время как при использовании 20×ЗФРТ-буфера, разведенного в соотношении 1/20 без добавления ПВП, были получены ложные негативные результаты.
4.5. Обсуждение
Проверку прототипа (партия планшетов 040107) осуществляли путем тестирования 50 образцов сыворотки, которые использовали ранее при создании прототипа. Проверочное исследование продемонстрировало, что для позитивной сыворотки оценка была правильной на 100%, в то время как в проверяемой партии из 25 негативных сывороток 2 были оценены как позитивные. «Ошибочные» оценки негативной сыворотки являются приемлемыми, поскольку основной смысл данного теста заключается в обнаружении позитивных образцов. Не доказано также, что результаты предыдущего тестирования действительно являются верными.
Установлено, что при использовании ЗФРТ, содержащего 0,042% ПВП, результаты аналогичны результатам, полученным при использовании ЗФРТ-таблеток (которые содержат ПВП). Следовательно, перспективные наборы должны содержать этот буфер. Для гарантии пригодности наборов необходимо осуществлять исследование стабильности 20хЗФРТ, содержащего ПВП.
Пример 5
5.1 Введение и цели
Обнаружение сывороточных антител к Lawsonia intracellularis до настоящего времени осуществляли с помощью ИФА-тестов (1). Эти тесты основаны на индивидуальной и в высшей степени субъективной оценке результатов. При создании изобретения разработан блокирующий сэндвич-ELISA, основанный на применении обладающих высокой специфичностью моноклональных антител к L. intracellularis. Данные, полученные с помощью этого теста, можно измерять и оценивать объективно, что улучшает их воспроизводимость, повторяемость и сопоставимость.
В данном исследовании впервые представлены сравнения с данными ИФА-теста, которые демонстрируют пригодность и эффективность нового теста.
5.2. Материалы и методы
Антиген L. intracellularis, выращенный в культуре клеток линии МсСоу и иммобилизированный с помощью специфического моноклонального антитела на титрационных микропланшетах, использовали для обнаружения антител к L. intracellularis в образцах свиной сыворотки. Сыворотку тестировали при разведениях от 1 до 10. После инкубации в течение 1 ч при 37°С планшеты промывали раствором ЗФР-Твин, добавляли меченное с помощью пероксидазы из хрена моноклональное антитело (отличное от антитела, применяемого в качестве иммобилизованного антитела). Планшеты инкубировали в течение еще одного часа при 37°С. Несвязанные антитела удаляли путем отмывки. После инкубации с ТМВ-субстратом в течение 10 мин при комнатной температуре реакцию прекращали путем добавления стоп-раствора. Для каждой лунки определяли значение ОП450 с помощью фотометра. Результаты рассчитывали в виде процента ингибирования по отношению к контролю без добавления сыворотки.
Для оценки нового ELISA использовали 301 образец сыворотки, полученной в полевых условиях, тестированные с помощью утвержденного ИФА-теста (2) для определения антител к L. intracellularis. Кроме того, для демонстрации диагностической эффективности ELISA по сравнению с ИФА использовали кросс-секционные образцы (по 10 образцов из 9 возрастных групп), полученные на двух фермах, для которых было известно, что на них обнаружен илеит, и на одной ферме, в отношении которой имелось предположение о наличии илеита.
5.3 Результаты
Для большого количества негативных сывороток были получены негативные значения ингибирования. Поэтому наименьшую измеренную величину принимали за 0, а все остальные величины соотносили с ней. Эти данные обозначали как «относительные величины, полученные с помощью ELISA (относительные ELISA-значения)».
Результаты для 301 образца сыворотки, полученной в полевых условиях, обобщены на фиг.2. ELISA позволяет четко различать негативную (среднее значение по данным ELISA 36) и позитивную сыворотку (среднее значение по данным ELISA 86). Большинство образцов, которые были оценены как сомнительные по данным ИФА, по данным ELISA оказались позитивными.
Результаты кросс-секционного скрининга, проведенного на 3 фермах, представлены на фиг.3. Оба теста позволяли четко выявлять антитела к L. intracellularis на животных 3 фермах.
5.4. Обсуждение
По сравнению с результатами ИФА-теста ELISA обладает более высокой чувствительностью. Для некоторых групп из 3 тестируемых ферм результаты, которые были получены с помощью ELISA, являются намного более достоверными, чем результаты ИФА-теста, которые во многом являются спорными, что обусловлено неспецифической флуоресценцией. Серологические профили для 3 стад находятся в хорошем соответствии с опубликованными ранее данными для стад европейских животных (3, 4). Увеличение ELISA-значений для группы свиней возрастом 10 и 16 недель по сравнению с результатами, полученными с помощью ИФА-теста, свидетельствует о том, что сыворотка, характеризующаяся по данным ELISA значениями более 55, может быть оценена как позитивная.
Рассматриваемый новый тест может позволить улучшать диагноз илеита при использовании стандартных образцов. Новый метод выявления илеита с помощью блокирующего ELISA представляет собой быстрый и чувствительный метод скрининга больших количеств образцов на объективной основе.
Ссылки
1. Guedes RMC и др. Can J. Vet. Res., 66, 2002, c.99-107.
2. Knittel J.P. и др., AJVR, 59, 1998, c.722-726.
3. Biksi и др., Proc. 17th IPVS, 2002, Ames, Iowa, USA.
4. van Aken N. и др., 17th IPVS, 2002, Ames, Iowa, USA.
Пример 6
6.1 Введение и цели
До настоящего времени специфическую диагностику илеита осуществляли с помощью ИФА-тестов для обнаружения антител (1, 2) или с помощью ПЦР (3, 4), гистологических методов и методов с использованием иммунного окрашивания (2, 5, 6) для обнаружения антигена в фекалиях или образцах ткани кишечника. Все эти методы имеют определенные недостатки, связанные со специфичностью, риском загрязнения или трудоемкостью, и не пригодны для проведения крупномасштабных стандартных скринингов стада. Таким образом, основные диагностические тесты осуществляют только для нескольких свиней из стада. При применении разработанного при создании настоящего изобретения блокирующего ELISA серологическое тестирование становится более легким, более надежным и его можно применять для получения профиля для целого стада. Для демонстрации диагностической эффективности нового теста были проведены кросс-секционные исследования на 22 фермах в Германии.
6.2. Материалы и методы
Кросс-секционные образцы, полученные на 22 фермах Германии, тестировали с помощью ELISA. На каждой ферме получали образцы из организма подсвинков, свиноматок и свиней возрастом 4, 7, 10, 13, 16, 20 и 24 недели (по 10 образцов в каждой возрастной группе). ELISA осуществляли, как описано в примере 5.
6.3. Результаты
На фиг.4 обобщены средние относительные данные, полученные с помощью ELISA, для всех 22 ферм. Сыворотка, полученная от подсвинков и свиноматок, обладала высокой реактивностью при исследовании с помощью ELISA, в то время как результаты, полученные для вялых поросят 4-10-недельного возраста, были низкими. Для животных, находящихся на откорме, значения, полученные с помощью ELISA, возрастали в течение периода от 13 до 24 недель.
На фиг.5 приведена корреляция средних значений, полученных с помощью ELISA, с клиническими симптомами, выявленными на фермах. На фермах 5, 6 и 15 в момент взятия образцов не было выявлено никаких проблем с кишечными заболеваниями, имеющими клиническое значение. На ферме 3 у поросят возрастом от 4 до 13 недель имелись проблемы с кишечным заболеваниями, которые были диагностированы как диарея, вызванная Е. coli. На ферме 18 предварительные серологические тесты выявили присутствие Lawsonia intracellularis без клинических симптомов. На фермах 1, 2, 7, 8, 9, 10, 11, 12, 19, 21 и 22 перед взятием образцов для данного исследования был выявлен илеит. С ферм 4, 13, 14, 16 и 20 поступили сведения о проблемах с кишечным трактом у молодняка и животных, находящихся на откорме, при этом на фермах 4 и 13 предполагался клинический илеит. На ферме 17 не обнаружено клинических признаков диареи, но на этой ферме применяли антибиотики для молодняка и при начале откорма.
6.4 Обсуждение
Обобщенные профили сыворотки, полученные на 22 фермах, свидетельствуют о высокой реактивности свиноматок и подсвинков и о том, что вызывается реакция на антитело, в период, начиная с 13-недель и вплоть до 24-недельного возраста. Эти данные находятся в соответствии с опубликованными в настоящее время данными серологических исследований, касающихся илеита (7, 8, 9). У свиней, которых содержали на фермах, где не было диареи (5, 6, 15 и 18), и на ферме, на которой была обнаружена диарея, вызванная Е. coli (3), с помощью ELISA не было выявлено существенной сероконверсии. На фермах, где был выявлен илеит (1, 2, 7, 8, 9, 10, 11, 12, 19, 21 и 22), была выявлена существенная сероконверсия в период от 7-й до 13-й недели.
Представляет интерес, что образцы, взятые из организма большинства групп свиноматок и подсвинков, обладали высокой реактивностью при оценке с помощью ELISA, хотя у большинства из этих свиней не было выявлено проблем, связанных с кишечными заболеваниями. Это может быть обусловлено субклиническим заражением Lawsonia intracellularis. Результаты, полученные на ферме 17, по-видимому, свидетельствуют о наличии субклинического илеита.
Новый ELISA, предлагаемый в настоящем изобретении, представляет собой эффективный способ диагноза илеита, который можно применять для стандартного анализа образцов большого размера и кросс-секционных скринингов стад.
Ссылки
1. Knittel JP и др., AJVR 59: 722-726.
2. Guedes RCM и др., Can. J. Vet. Res., 66, 2002, c.99-107.
3. Jones GF., J. Clin. MicrobioL, 31, 1993, c.2611-2615.
4. Suh-DK и др., J. Vet. Sci., 1, 2000, c.33-37.
5. McOrist S и др., Vet Pathol, 26, 1989, c.260-264.
6. Huerta В и др., J. Соmр. Path., 129, 2003, c.179-185.
7. Biksi I и др., Proc. 17th IPVS, 2002, Ames, Iowa, USA.
8. van Aken N. и др., 17th IPVS, 2002, Ames, Iowa, USA.
9. Holyoake PK и др., J. Clin. MicrobioL, 32, 1994, c.1980-1985.

Изобретение относится к области ветеринарии и касается способа диагностики инфекции, вызываемой Lawsonia intracellularis. Сущность изобретения включает контактирование жидкого образца, взятого из организма млекопитающего, с одним или несколькими моноклональными антителами к антигену Lawsonia intracellularis, секретируемыми линиями клеток гибридом ЕСАСС, имеющими регистрационные номера. Изобретение также включает диагностический тест-набо, содержащий специфические для Lawsonia intracellularis антитела. Преимущество изобретения заключается в повышении специфичности выявления антигена. 8 н. и 3 з.п. ф-лы, 5 ил., 1 табл.
1. Способ диагностики преклинической или клинической инфекции, вызываемой Lawsonia intracellularis, заключающийся в том, что
а) берут жидкий образец из организма млекопитающего,
б) выявляют специфическое связывание этого жидкого образца с L. intracellularis, с использованием одного или нескольких моноклональных антител, выбранных из группы, включающей антитело 301:39, которое продуцируется линией клеток гибридомы ЕСАСС, регистрационный номер 04092205, антитело 287:6, которое продуцируется линией клеток гибридомы ЕСАСС, регистрационный номер 04092203, антитело 268:29, которое продуцируется линией клеток гибридомы ЕСАСС, регистрационный номер 04092206, антитело 110:9, которое продуцируется линией клеток гибридомы ЕСАСС, регистрационный номер 04092204, антитело 113:2, которое продуцируется линией клеток гибридомы ЕСАСС, регистрационный номер 04092201, и антитело 268:18, которое продуцируется линией клеток гибридомы ЕСАСС, регистрационный номер 04092202,
в) сравнивают полученный результат с контролем.
2. Способ по п.1, в котором указанный способ представляет собой иммунный анализ.
3. Способ по п.1, в котором указанный способ представляет собой ELISA.
4. Способ по п.1, в котором указанный способ представляет собой блокирующий ELISA.
5. Линия клеток гибридомы ЕСАСС, регистрационный номер 04092204, секретирующая антитело к антигену Lawsonia intracellularis.
6. Линия клеток гибридомы ЕСАСС, регистрационный номер 04092201, секретирующая антитело к антигену Lawsonia intracellularis.
7. Линия клеток гибридомы ЕСАСС, регистрационный номер 04092202, секретирующая антитело к антигену Lawsonia intracellularis.
8. Линия клеток гибридомы ЕСАСС, регистрационный номер 04092206, секретирующая антитело к антигену Lawsonia intracellularis.
9. Линия клеток гибридомы ЕСАСС, регистрационный номер 04092203, секретирующая антитело к антигену Lawsonia intracellularis.
10. Линия клеток гибридомы ЕСАСС, регистрационный номер 04092205, секретирующая антитело к антигену Lawsonia intracellularis.
11. Набор компонентов диагностики преклинической или клинической инфекции, вызываемой L. intracellularis, содержащий одно или несколько моноклональных антител, выбранных из группы, включающей антитело 301:39, которое продуцируется линией клеток гибридомы ЕСАСС, регистрационный номер 04092205, антитело 287:6, которое продуцируется линией клеток гибридомы ЕСАСС, регистрационный номер 04092203, антитело 268:29, которое продуцируется линией клеток гибридомы ЕСАСС, регистрационный номер 04092206, антитело 110:9, которое продуцируется линией клеток гибридомы ЕСАСС, регистрационный номер 04092204, антитело 113:2, которое продуцируется линией клеток гибридомы ЕСАСС, регистрационный номер 04092201, и антитело 268:18, которое продуцируется линией клеток гибридомы ЕСАСС, регистрационный номер 04092202 и любой другой компонент, необходимый для осуществления способа по одному из пп.1-4.
| KNITTEL JP | |||
| еt al | |||
| Evaluation of antemortem polimarase chain reaction and serological methods of Lawsonia intracellularis-exposed pigs, Am | |||
| J | |||
| Vet | |||
| Res., 1998 Jun, v.59, №6, pp722-726 | |||
| US 5714375 A, 03.02.1998 | |||
| ЕР 1403643 А1, 31.03.2004 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
Авторы
Даты
2010-09-27—Публикация
2005-06-23—Подача