ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым дипиразольным соединениям, составам и способам лечения и профилактики психоневрологических заболеваний, являющихся следствием, прежде всего, дисфункции рецепторов глутамата AMPA и NMDA.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Глутамат является одним из наиболее распространенных возбуждающих нейромедиаторов в центральной нервной системе (ЦНС) млекопитающих. Он опосредует быструю и медленную нейротрансмиссию таких нормальных нейрофизиологических процессов, как запоминание и обработка памяти и синаптическая пластичность. Результаты посмертных и фармакологических исследований явно указывают на нарушение нейротрансмиссии глутамата в патофизиологии нескольких психоневрологических расстройств, в том числе шизофрении, болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, эпилепсии, синдрома дефицита внимания с гиперактивностью, слабоумия, вызванного СПИДом, нейрогенных болей, депрессии, умеренного когнитивного нарушения, нарушения запоминания и памяти и прочих (Lehohla, et al., Metab Brian Dis, 2004; Coyle, et al., Ann. NY Acad. Sci., 2003; Coyle, et al., Curr. Drug Targets CNS Neurol. Disord., 2002; Krystal, et al., Arch Gen Psychiatry, 2002; Dingledine et al., Pharmacol. Rev., 1999; and Ozawa, et al., Prog. Neurobiol., 1998).
Нейротрансмиссия глутамата опосредуется тремя ионотропными рецепторами глутамата. Эти рецепторы представляют собой катион-избирательные ионные каналы, которые регулируют синаптическую нейротрансмиссию. Ионотропные рецепторы глутамата можно разделить на три типа: рецепторы альфа-амино-3-гидрокси-5-метилизоксазол-4-пропионовой кислоты (AMPA), рецепторы каиновой кислоты (KA) и рецепторы N-метил-D-аспартата (NMDA), имеющие уникальные фармакологические, электрофизиологические и биохимические свойства (Nakanishi, Science, 1992). Кроме того, каждый из этих ионотропных рецепторов глутамата состоит из многих гетеромерных субъединиц, которые вносят вклад в гетерогенность рецептора в различных тканях (Ozawa, et al., Prog Neurobiol, 1998). Тем не менее каждый из ионотропных рецепторов глутамата содержит доминирующие субъединицы, в том числе необходимые для функциональности, которые, как считается, играют основную роль в регуляции функции.
Регуляция ионотропных рецепторов глутамата отчасти достигается фосфорилированием определенных остатков тирозина, треонина и серина несколькими киназами и, наоборот, дефосфорилированием этих остатков определенными фосфатазами. (Carvalho, et al., Neurochem. Res., 2000 and Swope, et al., Adv Second Messenger Phosphoprotein Res. 1999). От того, находятся ли субъединицы рецептора в фосфорилированном состоянии, в большой степени зависит активность рецептора. Например, рецепторы NMDA регулируются несколькими киназами и фосфатазами, действующими на его субъединицу NR1. Было показано, что протеинкиназа C (PKC) и цАМФ-зависимая протеинкиназа (PKA) фосфорилируют остатки серина 896 и 897 субъединицы NR1, соответственно (Tingley, et al., J. Biol. Chem., 1997 и Snyder, et al., Neuropharmacology, 2003). Аналогичным образом, рецепторы AMPA регулируются несколькими киназами и фосфатазами, действующими на субъединицу GluR1; PKA фосфорилирует остаток серина 845 (Roche, et al., Neuron 16: 1179-1188, 1999; Wang, et al., Science 253: 1132-1135, 1991). Протеинфосфатаза I (PP1) дефосфорилирует эти остатки серина, вызывая переключение молекулы на рецепторную активность.
Спинофилин (также называемый нейрабином II) - это вспомогательный белок, способствующий взаимодействию белков, обогащенный дендритными шипиками из нейронов ЦНС, которые служат основным местом глутаматергических синапсов в мозге (Allen, et al., Proc. Natl. Acad. Sci. USA, 1997; Hsieh-Wilson, et al., Biochemistry, 1999). Спинофилин был изначально идентифицирован по его способности связывать F-актин и протеинфосфатазу I (PP1). Взаимодействие спинофилина с PP1 наиболее важно для функционирования ионотропных рецепторов глутамата, так как спинофилин выступает в роли модулятора глутаматергической синаптической нейротрансмиссии за счет регулирования способности PP1 дефосфорилировать ионотропные рецепторы глутамата через локализацию. Свидетельства такой функции были продемонстрированы методом фиксации потенциала всей клетки AMPA при пропускании индуцированных каиновой кислотой токов AMPA в отдельных остро диссоциированных префронтальных кортикальных нейронах (Yan, et al., Nature Neurosci. 1999). В этих экспериментах индуцированное агонистом протекание вызванных каиновой кислотой токов ингибировалось пептидом, соответствующим связывающему домену PP1 спинофилина, а не тем же пептидом, который содержит точечную мутацию, что свидетельствует о том, что когда спинофилин больше не взаимодействует с PP1, рецепторы AMPA (в данном примере) больше не дефосфорилируются с уменьшением функции и потому остаются более активными.
Чтобы найти соединения с небольшим размером молекул, которые имитировали бы описанное выше действие пептида спинофилина, использовался новый анализ взаимодействия белков между PP1 и спинофилина для выявления ингибиторов связывания. Затем методом фиксации напряжений всей клетки исследовалась способность этих соединений ингибировать индуцированное агонистом протекание токов AMPA и модулировать токи, вызванные NMDA.
Таким образом, описанные в данном патенте соединения могут находить применение в лечении нескольких психоневрологических нарушений, связанных с дисфункцией нейротрансмиссии глутамата.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Предметом данного изобретения является соединение формулы I:
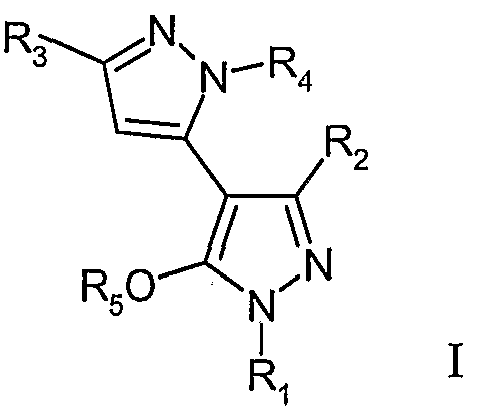
или его стереоизомер или фармацевтически приемлемая соль, где:
R1 выбирают из группы, включающей арил, бензил, C3-8циклоалкил, C1-10алкил, C3-8циклоалкилC1-6алкил, гетероарил, арилкарбонил, арилC1-6алкилC3-8циклоалкилкарбонил, C1-10алкилкарбонил, гетероарилкарбонил и
где X представляет собой водород, бензил, арилC2-6алкил, C3-8циклоалкил, C1-10алкил, или C3-8циклоалкилC1-6алкил;
где указанные арил, бензил или гетероарил необязательно замещены одним или более заместителями, каждый из которых независимо выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро или арила;
R2 выбирают из группы, включающей C1-6алкил, C3-8циклоалкил или арил, где арил необязательно замещен одним или более заместителями, каждый из которых независимо выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро, арила или алкокси;
R3 выбирают из группы, включающей арил, C3-8циклоалкил, C1-6алкил или гетероарил, где арил или гетероарил необязательно замещены одним или более заместителями, каждый из которых независимо выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро, арила или алкокси;
R4 выбирают из группы, включающей водород, арил, арилC2-6алкил, бензил, гидроксиC2-6алкил C1-6перфторалкил, C3-8циклоалкил или C1-6алкил, где арил или бензил необязательно замещены одним или более заместителями, каждый из которых независимо выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро, арила или алкокси;
R5 означает H, C1-6алкил или C3-8циклоалкил; и
при условии, что
а) когда R1 и R4 выбирают из группы, включающей фенил или 4-хлорфенил, а R5 означает водород, то R2 и R3 оба не могут быть метилами;
b) когда R1 выбирают из группы, включающей фенил или 4-хлорфенил, а R4 и R5 означает водород, то R2 и R3 оба не могут быть метилами;
Настоящее изобретение также направлено на фармацевтические композиции, содержащие соединения формулы (I).
Другой аспект данного изобретения описывает способ лечения психоневрологических нарушений, поддающихся коррекции модуляцией рецепторов AMPA и NMDA, состоящий во введении млекопитающему, нуждающемуся в лечении такого нарушения, терапевтически эффективного количества соединения формулы I

или его стереоизомера или фармацевтически приемлемой соли, где:
R1 выбирают из группы, включающей арил, бензил, C3-8циклоалкил, C1-10алкил, C3-8циклоалкилC1-6алкил, гетероарил, арилкарбонил, арилC1-6алкилC3-8циклоалкилкарбонил, C1-10алкилкарбонил, гетероарилкарбонил и

где X представляет собой водород, бензил, арилC2-6алкил, C3-8циклоалкил, C1-10алкил, или C3-8циклоалкилC1-6алкил;
где указанные арил, бензил или гетероарил необязательно замещены одним или более заместителями, каждый из которых независимо выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро или арила;
R2 выбирают из группы, включающей C1-6алкил, C3-8циклоалкил или арил, где арил необязательно замещен одним или более заместителями, каждый из которых независимо выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро, арила или алкокси;
R3 выбирают из группы, включающей арил, C3-8циклоалкил, C1-6алкил или гетероарил, где арил или гетероарил необязательно замещены одним или более заместителями, каждый из которых независимо выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро, арила или алкокси;
R4 выбирают из групп, включающей водород, арил, арилC2-6алкил, бензил, гидроксиC2-6алкил C1-6перфторалкил, C3-8циклоалкил или C1-6алкил, где арил или бензил необязательно замещены одним или более заместителями, каждый из которых независимо выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро, арила или алкокси;
R5 означает H, C1-6алкил или C3-8циклоалкил.
ПОЛНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Используемые в данном патенте термины имеют следующие значения:
В данном патенте выражение «C1-6алкил», используемое само по себе или вместе с другими терминами, означает алкил (или алкилен в соответствующих случаях) с линейной или разветвленной цепью, имеющий в своем составе метильные и этильные группы, а также пропильные, бутильные, пентильные или гексильные группы с линейной или разветвленной цепью. К алкильным группам относятся метил, этил, н-пропил, изопропил и трет-бутил. В соответствии с этим следует понимать выражения «C1-6алкокси», «C1-6алкоксиC1-6алкил», «гидроксиC1-6алкил», «C1-6алкилкарбонил», «C1-6алкоксикарбонилC1-6алкил», «C1-6алкоксикарбонил», «аминоC1-6алкил», «C1-6алкилкарбамоилC1-6алкил», «C1-6диалкилкарбамоилC1-6алкил», «моно- или ди-C1-6алкиламиноC1-6алкил», «аминоC1-6алкилкарбонил», «дифенилC1-6алкил», «фенилC1-6алкил», «фенилкарбонилC1-6алкил» и «феноксиC1-6алкил».
В данном патенте выражение «C2-6алкенил» может означать этенильную или имеющую прямую или разветвленную цепь пропенильную, бутенильную, пентенильную или гексенильную группы. Аналогично, выражение «C2-6алкинил» может означать этинильную, пропинильную, имеющую прямую или разветвленную цепь бутинильную, пентинильную и гексинильную группы.
В данном патенте выражение «C1-6 перфторалкил» означает, что все атомы водорода в названной алкильной группе замещены атомами фтора. Примерами таких групп являются трифторметильная и пентафторэтильная, а также имеющие линейную или разветвленную цепь гептафторпропильная, нонафторбутильная, ундекафторпентильная и тридекафторгексильная группы. В соответствии с этим следует понимать производное выражение «C1-6 перфторалкокси».
В данном патенте выражение «C3-8циклоалкил» означает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил.
В данном патенте выражение «C3-8циклоалкилC1-6алкил» означает, что соответствующий приведенному здесь определению C3-8циклоалкил присоединен к соответствующему приведенному здесь определению C1-6алкилу. Характерными примерами являются циклопропилметил, 1-циклобутилэтил, 2-циклопентилпропил, циклогексилметил, 2-циклогептилэтил и 2-циклооктилбутил и подобные им группы.
В данном патенте «галоген» или «гало» означает хлор, фтор, бром или йод.
В данном патенте выражение «карбамоил» означает --NC(O)-- группу, где радикал связан по двум положениям с двумя отдельными дополнительными группами.
В данном патенте термин «арил» означает карбоциклическую ароматическую кольцевую систему, такую как фенил, бифенил, нафтил, антраценил, фенантренил, флуоренил, инденил, пенталенил, азуленил, бифениленил и подобные им группы. К арилам также относятся частично гидрированные производные перечисленных выше карбоциклических ароматических систем. Частными примерами таких частично гидрированных производных являются 1,2,3,4-тетрагидронафтил, 1,4-дигидронафтил и подобные им группы.
В данном патенте «гетероарил» означает гетероциклическую ароматическую кольцевую систему, содержащую один или несколько гетероатомов, которыми могут быть азот, кислород и сера, такую как фуранил, тиофенил, пирролил, оксазолил, тиазолил, имидазолил, изоксазолил, изотиазолил, 1,2,3-триазолил, 1,2,4-триазолил, пиранил, пиридил, пиридазинил, пиримидинил, пиразинил, 1,2,3-триазинил, 1,2,4-триазинил, 1,3,5-триазинил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тетразолил, тиадиазинил, индолил, изоиндолил, бензофуранил, бензотиофенил (тианафтенил), индазолил, бензимидазолил, бензтиазолил, бензизотиазолил, бензоксазолил, бензизоксазолил, пуринил, хиназолинил, хинолизинил, хинолинил, изохинолинил, хиноксалинил, нафтиридинил, птеридинил, карбазолил, азепинил, диазепинил, акридинил и подобные им группы. К гетероарилам также относятся частично гидрированные производные перечисленных выше гетероциклических систем. Частными примерами таких частично гидрированных производных являются 2,3-дигидробензофуранил, пирролинил, пиразолинил, индолинил, оксазолидинил, оксазолинил, оксазепинил и подобные им группы.
В данном патенте «гетероциклил» означает насыщенное кольцо из 3-8 атомов с одним или несколькими гетероатомами, которыми могут быть азот, кислород и сера. Типичными примерами являются пирролидил, пиперидил, пиперазинил, морфолинил, тиоморфолинил, азиридинил, тетрагидрофуранил и подобные им группы.
В данном патенте «таутомер» или «таутомеризм» означают совместное существование двух (или более) соединений, отличающихся друг от друга только положением одного (или более) подвижных атомов и распределением электронной плотности, например, кето-енольные таутомеры и таутомеризм.
В данном патенте «лечением» или «терапией» называется любое лечение, в частности, ослабляющее симптомы, устраняющее, на время или постоянно, причину симптомов и предотвращающее или замедляющее появление симптомов и развитие заболевания, нарушения и расстройства.
«Терапевтически эффективное количество» означает количество соединения, эффективного в лечении указанного заболевания или расстройства.
В данном патенте под «пациентом» понимается теплокровное животное, например крыса, мышь, собака, кошка, морская свинка, а также примат, например человек.
В данном патенте выражение «фармацевтически приемлемый носитель» означает нетоксичный растворитель, диспергатор, носитель, адъювант или другое вещество, которое смешивают с соединением, составляющим предмет настоящего изобретения, чтобы получить лекарственный препарат, т.е. лекарственную форму, пригодную для введения пациенту. Одним из примеров такого носителя является фармацевтически приемлемое масло, часто используемое для парентерального введения.
Термин «фармацевтически приемлемые соли» в данном патенте означает соли соединений, составляющих предмет данного изобретения, которые могут использоваться в медицинских препаратах. Тем не менее и другие соли могут быть полезны в получении соединений, составляющих предмет данного изобретения, или их фармацевтически приемлемых солей. К подходящим фармацевтически приемлемым солям соединений, составляющих предмет данного изобретения, относятся соли, образованные путем присоединения кислоты, образующиеся, например, при смешивании раствора соединения, составляющего предмет данного изобретения, с раствором фармацевтически приемлемой кислоты, такой как соляная кислота, бромистоводородная кислота, серная кислота, метансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, пара-толуолсульфоновая кислота, фумаровая кислота, малеиновая кислота, гидроксималеиновая кислота, яблочная кислота, аскорбиновая кислота, янтарная кислота, глутаровая кислота, уксусная кислота, салициловая кислота, коричная кислота, 2-феноксибензойная кислота, гидроксибензойная кислота, фенилуксусная кислота, бензойная кислота, щавелевая кислота, лимонная кислота, винная кислота, гликолевая кислота, молочная кислота, пировиноградная кислота, малоновая кислота, углекислота или фосфорная кислота. Могут также получаться кислые соли металлов, например, моногидроортофосфат натрия и гидросульфат калия. Кроме того, получаемые таким образом соли могут представлять собой моно- или дизамещенные кислые соли и могут существовать в форме гидратов или быть в значительной степени обезвоженными. Более того, если соединения настоящего изобретения включают кислотную функцию, то к подходящим фармацевтически приемлемым их солям могут быть отнесены соли щелочных металлов, например, соли натрия или калия, соли щелочноземельных металлов, например, соли кальция или магния, и соли, образованные с подходящими органическими лигандами, например, четвертичные аммониевые соли.
Выражение «стереоизомеры» является общим термином, используемым для всех изомеров индивидуальных молекул, которые отличаются только пространственной ориентацией своих атомов. К ним, как правило, относятся зеркальные изомеры, которые обычно существуют при наличии по крайней мере одного центра асимметрии (энантиомеры). Если соединения в соответствии с настоящим изобретением обладают двумя или более центрами асимметрии, они могут также существовать в форме диастереоизомеров, кроме того, некоторые индивидуальные молекулы могут существовать в форме геометрических изомеров (цис/транс). Следует понимать, что все такие изомеры и их смеси в любой пропорции также являются предметом настоящего изобретения.
В приведенных далее примерах и описаниях синтеза используемые термины следует понимать в следующих значениях: «кг» - килограммы, «г» - граммы, «мг» - миллиграммы, «мкг» - микрограммы, «пг» - пикограммы, «моль» - моли, «ммоль» - миллимоли, «нмоль» - наномоли, «л» - литры, «мл» - миллилитры, «мкл» - микролитры, «°C» - градусы Цельсия, «Rf» - коэффициент удерживания, «т.пл.» - точка плавления, «расп.» - распад, «т.к.» - точка кипения, «мм рт. ст.» - давление в миллиметрах ртутного столба, «см» - сантиметры, «нм» нанометры, «[α]20 D» - удельное вращение D-линии натрия при 20°C, полученное в 1-дециметровой кювете, «c» - концентрация в г/мл, «THF» - тетрагидрофуран, «DMF» - диметилформамид, «NMP» - 1-метил-2-пирролидинон, «MP-карбонат» - макропористая полистирольная анионообменная смола, то есть связанный смолой эквивалент карбоната тетраалкиламмония, «солевой раствор» - насыщенный водный раствор хлорида натрия, «M» - молярный, «мМ» - миллимолярный, «мкМ» - микромолярный, «нМ» - наномолярный, «ТСХ» - тонкослойная хроматография, «ВЭЖХ» - высокоэффективная жидкостная хроматография, «МСВР» - масс-спектр высокого разрешения, «МСХИ» - масс-спектрометрия с химической ионизацией, «tR» - время удерживания, «фунт» фунты, «галл.» - галлоны, «п.выс.» - потери при высушивании, «мкКи» - микрокюри, «i.p.» - интраперитонеально, «i.v.» внутривенно.
Один из аспектов данного изобретения - растворенные соединения, имеющие общую структуру, представленную формулой I:

или его стереоизомер или фармацевтически приемлемая соль, где:
R1 выбирают из группы, включающей арил, бензил, C3-8циклоалкил, C1-10алкил, C3-8циклоалкилC1-6алкил, гетероарил, арилкарбонил, арилC1-6алкилC3-8циклоалкилкарбонил, C1-10алкилкарбонил, гетероарилкарбонил и

где X представляет собой водород, бензил, арилC2-6алкил, C3-8циклоалкил, C1-10алкил или C3-8циклоалкилC1-6алкил;
где указанные арил, бензил или гетероарил необязательно замещены одним или более заместителями, каждый из которых независимо выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро или арила;
R2 выбирают из группы, включающей C1-6алкил, C3-8циклоалкил или арил, где арил необязательно замещен одним или более заместителями, каждый из которых независимо выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро, арила или алкокси;
R3 выбирают из группы, включающей арил, C3-8циклоалкил, C1-6алкил или гетероарил, где арил или гетероарил необязательно замещены одним или более заместителями, каждый из которых независимо выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро, арила или алкокси;
R4 выбирают из группы, включающей водород, арил, арилC2-6алкил, бензил, гидроксиC2-6алкил C1-6перфторалкил, C3-8циклоалкил или C1-6алкил, где арил или бензил необязательно замещены одним или более заместителями, каждый из которых независимо выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро, арила или алкокси;
R5 означает H, C1-6алкил или C3-8циклоалкил; и
при условии, что
a) когда R1 и R4 представляют собой фенил или 4-хлорфенил, а R5 означает водород, то R2 и R3 оба не могут быть метилами;
b) когда R1 представляет собой фенил или 4-хлорфенил, а R4 и R5 означают водород, то R2 и R3 оба не могут быть метилами;
В следующем осуществлении соединения формулы I, составляющего предмет данного изобретения, R1 выбирают из группы, включающей арил, бензил, C3-8циклоалкил, C1-10алкил, арилC1-6алкил и  , где X означает бензил, R2 и R3 означают C1-6алкил и R5 означает водород или C1-6алкил.
, где X означает бензил, R2 и R3 означают C1-6алкил и R5 означает водород или C1-6алкил.
В другом осуществлении соединения формулы I, составляющего предмет данного изобретения, R1 означает арил, R2 и R3 означают C1-6алкил, R4 означает водород, R5 означает водород или C1-6алкил.
К типичным примерам соединений, представляющих данную реализацию соединения формулы I, относятся: 2'-(2-фторфенил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол, 2'-(4-изопропилфенил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол, 2'-(4-фторфенил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол, 5,5'-диметил-2'-(4-трифторметилфенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол, 5,5'-диметил-2'-(4-метоксифенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол, 2'-(3-фторфенил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол, 2'-(2-метилфенил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол, 5,,5'-диметил-2'-(4-трифторметоксифенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол, 5,5'-диметил-2'-(4-метилфенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол, 5,5'-диметил-2'-(3-метилфенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол, 5,5'-диметил-2'-(2-этилфенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол, 5,5'-диметил-2'-(3,4-дихлорфенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол, 5,5'-диметил-2'-(3-хлорфенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол, 2'-(4-трет-бутилфенил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол, 5,5'-диметил-2'-(3-трифторметилфенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол и 5'-метокси-5,3'-диметил-1'-фенил-2H,1'H-[3,4']бипиразолил.
В следующем осуществлении соединения формулы I, составляющего предмет данного изобретения, R1 представляет собой арил, R2 и R3 означают C1-6алкил, R4 означает арилC2-6алкил или бензил, R5 означает водород или C1-6алкил.
К типичным примерам соединений, представляющих данную реализацию соединения формулы I, относятся: 5,5'-диметил-2-фенилэтил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол, 2-бензил-5,5'-диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол и 2-бензил-5'-метокси-5,3'-диметил-1'-фенил-2H,1'H-[3,4']бипиразол, и 2-(3-гидроксибензил)-5,5'-диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол.
В другом осуществлении соединения формулы I, составляющего предмет данного изобретения, R1 представляет собой арил или бензил, R2 и R3 означают C1-6алкил, R4 означает гидроксиC1-6алкил, C1-6перфторалкил, C3-8циклоалкил или C1-6алкил, и R5 означает водород.
К типичным примерам соединений, представляющих данную реализацию соединения формулы I, относятся: 5,5'-диметил-2'-фенил-2-(2,2,2-трифторэтил)-2H, 2'H-[3,4'] бипиразолил-3'-ол, 2-циклогексил-5,5'-диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол, 2-(2-гидроксиэтил)-5,5'-диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол и 2,5,5'-триметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол.
В другом осуществлении соединения формулы I, составляющего предмет данного изобретения, R1 представляет собой арил, R2 и R3 означает C1-6алкил, R4 означает арил, а R5 означает водород.
К типичным примерам соединений, представляющих данную реализацию соединения с формулой I, относятся: 2-(4-метоксифенил)-5,5'-диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол и 2-(4-фторфенил)-5,5'-диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол.
В другом осуществлении соединения формулы I, составляющего предмет данного изобретения, R1 выбирают из групп, включающей арилC2-6алкил или бензил, R2 и R3 представляют собой C1-6алкил, а R4 и R5 означает водород.
К типичным примерам соединений, представляющих данную реализацию соединения с формулой I, относятся: 5,5'-диметил-2'-фенэтил-2H, 2'H-[3,4'] бипиразолил-3'-ол, 2'-(3-гидроксибензил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол и 2'-бензил-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол.
В следующем осуществлении соединения формулы I, составляющего предмет данного изобретения,
R1 обозначает  , где X означает бензил, R2 и R3 означают C1-6алкил, а R4 и R5 означают водород.
, где X означает бензил, R2 и R3 означают C1-6алкил, а R4 и R5 означают водород.
Типичным примером данной реализации соединения формулы I является 2'-(1-бензилпиперидин-4-ил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол.
В другом осуществлении соединения формулы I, составляющего предмет данного изобретения, R1 представляет собой C3-8циклоалкил, R2 и R3 обозначают C1-6алкил, а R4 и R5 обозначают водород.
Типичным примером данной реализации соединения формулы I является 2'-циклогексил-5,5'-диметил-2H, 2'H-[3,4]бипиразолил-3'-ол.
В другом осуществлении настоящего изобретения раскрывается соединение 5,1',5'-триметил-2'-фенил-1', 2'-дигидро-2H-[3,4']бипиразолил-3'-он.
В другом осуществлении настоящего изобретения раскрывается лекарственный препарат, состоящий из эффективного количества соединения формулы I и фармацевтически приемлемого носителя.
Другой аспект данного изобретения описывает способ лечения психоневрологических нарушений, поддающихся коррекции модуляцией рецепторов AMPA и NMDA, включающий введение млекопитающему, нуждающемуся в лечении такого нарушения, терапевтически эффективного количества соединения формулы I
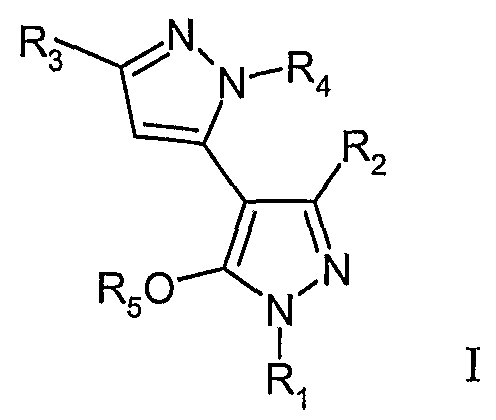
или его стереоизомера или фармацевтически приемлемой соли, где:
R1 выбирают из группы, включающей арил, бензил, C3-8циклоалкил, C1-10алкил, C3-8циклоалкилC1-6алкил, гетероарил, арилкарбонил, арилC1-6алкилC3-8циклоалкилкарбонил, C1-10алкилкарбонил, гетероарилкарбонил и

где X представляет собой водород, бензил, арилC2-6алкил, C3-8циклоалкил, C1-10алкил, или C3-8циклоалкилC1-6алкил;
где указанные арил, бензил или гетероарил необязательно замещены одним или более заместителями, каждый из которых независимо выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро или арила;
R2 выбирают из группы, включающей C1-6алкил, C3-8циклоалкил или арил, где арил необязательно замещен одним или более заместителями, каждый из которых независимо выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро, арил или алкокси;
R3 выбирают из группы, включающей арил, C3-8циклоалкил, C1-6алкил или гетероарил, где арил или гетероарил необязательно замещены одним или более заместителями, каждый из которых выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро, арил или алкокси;
R4 выбирают из группы, включающей водород, арил, арилC2-6алкил, бензил, гидроксиC2-6алкил C1-6перфторалкил, C3-8циклоалкил или C1-6алкил, где арил или бензил необязательно замещены одним или более заместителями, каждый из которых выбирают из C1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы, CnHxFy-6алкокси, где n имеет значения 1-4, x имеет значения 0-8, y имеет значения 1-9, а x+y имеет значения 2n+1, C1-C6алкокси, нитро, арил или алкокси; и
R5 означает H, C1-6алкил или C3-8циклоалкил.
В другом осуществлении способа, составляющего предмет данного изобретения, названным психоневрологическим заболеванием, может быть депрессия, эпилепсия, шизофрения, болезнь Альцгеймера, нарушения запоминания и памяти, умеренное когнитивное расстройство.
В другом осуществлении способа, составляющего предмет данного изобретения, названным нарушением является шизофрения.
В еще одном осуществлении способа, составляющего предмет данного изобретения, названным нарушением является депрессия.
В еще одном осуществлении способа, составляющего предмет данного изобретения, названным нарушением является нарушение запоминания и памяти.
Соединения, составляющие предмет данного изобретения, можно получить при помощи методов синтеза, показанных на приведенных ниже схемах, или другими методами, известными специалистам в данной области. Заместители R - такие же, что были определены выше для формулы (I), если не указано иное. В случае необходимости на приведенных далее схемах синтеза имеющие высокую реакционную способность функциональные группы соединений, описанных в данном изобретении, могут быть защищены подходящими защитными группами. Защитные группы можно удалить на одной из последующих стадий синтеза. Описание методов защиты, обладающих высокой реакционной способностью функциональных групп и последующего удаления защитных групп, можно найти в работе T. W. Greene and P. G. M. Wuts, Protective Groups in Organic Synthesis, Wiley and Sons, 1991.
Схема A
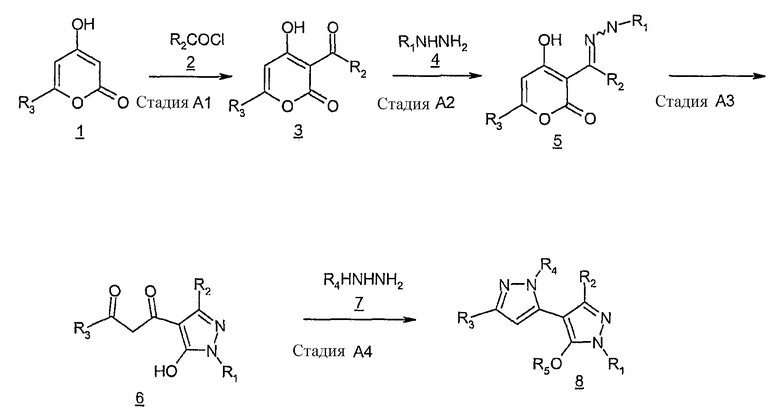
На схеме A показан синтез соединения формулы I, где R4 и R5 означает водород. В стадии A1 6-замещенный пирон 1, соединение, имеющееся в продаже или синтезируемое при помощи хорошо известных методов (Lokot, et al, Tetrahedron, 55, 4783-4792, 1999), реагирует с хлоридом карбоновой кислоты, соединение 2, в присутствии сильной органической кислоты, в результате чего образуется 3-ацилированное производное 3. Примерами сильных органических кислот, которые можно использовать в реакции, являются тригалогенуксусная кислота, такая как трифторуксусная кислота, и трифторалкилсульфоновая кислота. Эту реакцию обычно проводят при температурах от 50°C до температуры кипения кислоты с обратным холодильником.
В стадии А2 соединение 3 реагирует с гидразином 4 с образованием гидразона, соединения 5. Реакцию обычно проводят в инертном органическом растворителе, таком как спирт, в некоторых случаях в присутствии подходящего основания, если в качестве реагента используют соль гидразина. Среди подходящих спиртов: метанол, этанол, изопропанол или этиленгликоль, а среди подходящих оснований - щелочные карбонаты, такие как карбонаты натрия, калия или цезия, либо карбонаты, связанные со смолой, например, МР-карбонат. Температура, при которой можно проводить реакцию, - от комнатной до температуры кипения органического растворителя с обратным холодильником.
Как показано в стадии A3, гидразон, соединение 5, можно превратить в пиразолилдион 6 посредством внутримолекулярной циклизации 5 в присутствии подходящей органической кислоты, такой как уксусная, пропионовая или трифторуксусная кислота. Эту реакцию обычно проводят при повышенных температурах от 50°C до температуры кипения органической кислоты с обратным холодильником.
В стадии A4 реакция диона 6 с гидразином 7 дает искомый бипиразол 8. Реакцию обычно проводят в инертном органическом растворителе, таком как спирт при температуре кипения растворителя с обратным холодильником или близкой температуре.
Схема B
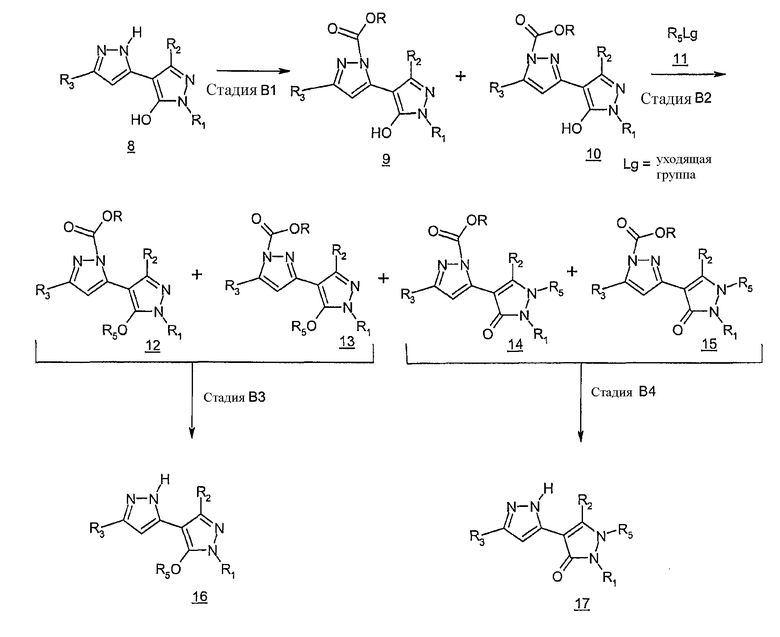
Схема B иллюстрирует метод, который можно использовать для синтеза соединений формулы I, где R5 представляет собой C1-6алкил, C3-8циклоалкил. В стадии B1 не имеющий заместителей атом азота в кольце бипиразола 8 защищают алкоксикарбонильной группой, получая смесь позиционных изомеров, соединения 9 и 10. Реакцию проводят при помощи методов, хорошо известных специалистам в данной области; например, обработка 8 трет-бутилкарбазатом может дать соединение 9. См. Kashuma, et al, Tetrahedron, 54, 14679, 1998.
В стадии B2 проводят реакцию смеси изомеров 9 и 10 алкилирующим/циклоалкилирующим веществом 11, где Lg - уходящая группа, такая как галоген, алкилсульфонат или арилсульфонат, в результате чего получается смесь O-алкилированных соединений 12 и 13 и N-алкилированных соединений 14 и 15. Реакцию можно проводить в полярном апротонном растворителе, таком как DMF, DMSO или ацетонитрил в присутствии подходящего основания. К подходящим основаниям относятся карбонаты и бикарбонаты щелочных металлов, такие как карбонат и бикарбонат калия и натрия. Эта реакция проводится при температуре от комнатной до температуры кипения органического растворителя с обратным холодильником. После завершения реакции методом хроматографии на силикагеле получают две разные смеси. Одна смесь состоит из O-алкилированных соединений 12 и 13, а другая - из N-алкилированных соединений 14 и 15.
O-алкилированное искомое соединение 16 можно получить, как показано в стадии B3, посредством отщепления N-алкоксикарбонила от позиционных изомеров 12 и 13. Отщепление можно выполнить методами, хорошо известными специалистам в данной области, например, обработкой 12 и 13 кислотой или основанием.
Аналогично, в стадии B4 используются такие же условия, что и в стадии B3, для получения N-алкилированного соединения 17.
БИОЛОГИЧЕСКИЕ ПРИМЕРЫ
Для проверки биологических свойств соединений, составляющих предмет данного изобретения, используются следующие протоколы испытаний. Приведенные далее примеры представлены для дополнительной иллюстрации изобретения. Тем не менее не следует считать, что они каким-либо образом ограничивают изобретение.
Анализ взаимодействия спинофилина/протеинфосфатазы-I
Материалы
Стандартный раствор 10X фосфатного физиологического трис-буфера (Tris-Buffered Saline) производства Bio-Rad. Спинофилин (6xHis) и протеины GST-PP1 клонируют, экспрессируют и очищают в лаборатории методами белкового синтеза. Антитела Eu-anti-GST, аналитический буфер DELFIA и стимулирующий раствор DELFIA - производства Wallac (теперь Perkin Elmer). 384-луночные планшеты с высокой степенью связывания производства Greiner.
Методы времяразрешенного флуоресцентного 384-луночного анализа ИФА:
Планшеты покрывают 50 мкл раствора спинофилин/TBS (50 мкг/мл) или 50 мкл буфера TBS (контроль 0) и инкубируют в течение ночи при 4°C. Готовят тестовые соединения и разбавляют в 96-луночной полипропиленовой планшете при помощи дозатора жидкости Labsystems Wellpro. После 3-кратного промывания планшет фосфатным физиологическим трис-буфером TBS при помощи устройства для промывки планшет Elx-405 (Biotek) соединения переносят из 96-луночной планшеты в 384-луночную планшету при помощи дозатора жидкостей Multimek (Beckman). Затем в планшету добавляют GST-PP1, 50 мкл (2,5 мкг/мл). Планшеты инкубируют в течение 36 ч при комнатной температуре. Планшеты трижды промывают, как описано выше, добавляют 50 мкл антитела Eu-anti-GST (~50 нг/мл) при помощи модуля Multidrop (Titertek) и инкубируют в течение 30 минут при комнатной температуре. Планшеты трижды промывают, как описано выше, добавляют 100 мкл стимулирующего раствора при помощи модуля Multidrop и инкубируют в течение 1 ч при комнатной температуре. Планшеты считывают при помощи флюориметра Farcyte (Tecan) с настройкой европия. По измерению ослабления сигнала флюоресценции оценивают способность соединений ингибировать взаимодействие спинофилина (6xHis) и GST-PP1.
Фиксация потенциала токов AMPA и NMDA всей клетки в префронтальных кортикальных нейронах
Метод острой диссоциации нейронов
Префронтальные кортикальные (ПФК) нейроны молодых взрослых (3-5 недель после рождения) крыс подвергают острой диссоциации при помощи описанных ранее методов (Feng, et al., J Neurosci, 2001; Chen, et al., Proc Natl Acad Sci USA, 2004). После инкубирования срезов мозга в NaHCO3-буферном физиологическом растворе ПФК извлекают и помещают в камеру с кислородом, содержащую папаин (Sigma, 0,8 мг/мл) в сбалансированном солевом растворе Хэнкса с буфером HEPES (HBSS, Sigma) при комнатной температуре. После 40 минут обработки ферментом ткань трижды промывают в слабом Ca+2, HEPES-забуференном физиологическом растворе и механически диссоциируют при помощи набора мерных пипеток из стекла огневой полировки Pasteur. Суспензию клеток затем переносят на 35-мм чашку Петри Lux, которую помещают на столик инвертированного микроскопа Nikon.
Фиксация потенциалов всей клетки AMPA и NMDA
Измерения для всей клетки по фиксации токов ионных каналов выполняют с использованием стандартных методов фиксации потенциалов (Yan et al., Nat Neuroscience, 1999; Wang et al., J Neurosci, 2003; Tyszkiewicz et al., J Physiol., 2004). В состав внутреннего раствора (внутри пробной пипетки) входят (в мМ): 180 N-метил-d-глюкамин (NMG), 40 HEPES, 4 MgCl2, 0,1 BAPTA, 12 креатинфосфат, 3 Na2ATP, 0,5 Na2GTP, 0,1 лейпептин, pH=7,2-7,3, 265-270 мОсм/л. В состав внешнего раствора входят (в мМ): 127 NaCl, 20 CsCl, 10 HEPES, 1 CaCl2, 5 BaCl2, 12 глюкоза, 0,001 TTX, 0,02 глицин, pH=7,3-7,4, 300-305 мОсм/л. Измерения проводят на усилителе для фиксации потенциала Axon Instruments 200B, управляемом с IBM PC с программным обеспечением pCLAMP (версия 8) с последовательным интерфейсом DigiData 1320 (Axon instruments). Сопротивление электродов, как правило, составляет 2-4 МОм в бане. После разрушения герметизации для достижения условий измерения для всей клетки, последовательное сопротивление (4-10 МОм) компенсируют (70-90%) и периодически измеряют. Потенциал мембраны клетки поддерживают равным -60 мВ.
Применение KA (200 мкМ) или NMDA (100 мкМ, в растворе, не содержащем Mg2+) вызывает частично десенсибилизирующий ток, направленный внутрь. KA или NMDA вводят на 2 секунды каждые 30 секунд для минимизации вызванного десенсибилизацией снижения амплитуды тока. Лекарства вводят при помощи «сливной» системы, подающей вещества самотеком. Массив аппликационных капилляров (внутренний диаметр около 150 мкм) располагают на расстоянии в несколько сотен микронов от изучаемой клетки. Изменения раствора выполняют при помощи быстродействующего устройства для введения стимулов в раствор SF-77B (Warner Instruments). Данные собирают при помощи программы PCLAMP и анализируют в AXOGRAPH, KALEIDOGRAPH и STATVIEW.
Описанные в данном патенте соединения ингибируют KA-индуцированное протекание тока AMPA либо посредством стабилизации вызванного агонистом тока, либо посредством повышения тока. Аналогично, описанные в данном патенте соединения увеличивают вызванный NMDA ток. Минимальная эффективная доза (МЭД) определялась измерением минимальной концентрации ингибитора, при которой наблюдался эффект в каждом функциональном анализе.
Результаты этих анализов приведены в таблице I и таблице II.
Ингибирование KA-индуцированного тока AMPA
Увеличение вызванного NMDA тока
(n=3 нейрона)
(n=4 нейрона)
Тест принудительного плавания Порсолта
Эффекты, измеренные в этой модели, сопоставляли с эффективностью лекарств в качестве антидепрессантов. Принцип этой модели состоит в том, что под действием соединения, которое представляет собой эффективный антидепрессант, крыса приложит больше усилий к тому, чтобы выбраться из наполненного водой цилиндра, чем крыса, получившая только растворитель.
Использовавшиеся в этом исследовании животные - неинтактные самцы крысы Sprague Dawley весом 225-350 граммов. Тестовый аппарат представляет собой 6 прозрачных плексигласовых цилиндров высотой 40 см и шириной 19 см. В цилиндры наливают 18 см воды температурой 25°C. Каждую крысу помещают в цилиндр на 15 минут для привыкания. После субхронической или острой дозировки растворителя (0,5% метилцеллюлозы) или соединения животных спустя 24 часа снова помещают в воду на 5 минут для проведения теста. Эти тестовые погружения записывают на видео для последующего подсчета.
Субхроническая дозировка представляет собой введение препарата три раза за 24 часа между привыканием и анализом. Препарат вводят за 24 часа, за 5 часов и за 1 час до проведения теста. Острая дозировка представляет собой однократное введение препарата за 1 час до проведения теста. Подсчет производят по временным интервалам при помощи компьютерной программы. Каждые пять секунд животных оценивают по демонстрации одного из трех типов поведения: неподвижности, спокойного плавания и попытки выбраться из сосуда. Затем результаты подсчета преобразуют в процентные показатели сеанса тестирования.
Настоящее изобретение дополнительно иллюстрируется следующими примерами, которые приводятся для целей пояснения и никоим образом не ограничивают сферу охвата настоящего изобретения.
Тест распознавания объекта
Тест распознавания объекта - это тест памяти. В нем измеряется способность мышей (и крыс) различать известный и неизвестный объекты, поэтому он подходит для определения способности соединений, составляющих предмет данного изобретения, улучшать память.
В целом, тест можно выполнять, как описано в литературе. (Blokland et al. NeuroReport 1998, 9, 4205-4208; Ennaceur, A., Delacour, J., Behav. Brain Res. 1988, 31, 47-59; Ennaceur, A., Meliani, K., Psychopharmacology 1992, 109, 321-330; Prickaerts, et al. Eur. J. Pharmacol. 1997, 337, 125-136).
Во время первого прохода перед мышью на большой наблюдательной арене, где больше ничего нет, помещают два одинаковых объекта. Мышь тщательно изучает оба предмета, обнюхивая и касаясь их. Учитывается время, которое мышь проводит с каждым из объектов. Во время второго прохода, через 24 часа, мышь снова тестируют на наблюдательной арене. В этот раз один из известных объектов заменен другим, неизвестным объектом. Когда мышь узнает знакомый объект, она более тщательно изучает неизвестный объект. Через 24 часа мышь, тем не менее, обычно забывает, который из объектов она уже изучила во время первого прохода, и одинаково подробно изучает оба объекта. Применение вещества, способного улучшать способность к обучению и память, приведет к тому, что мышь опознает объект, который она уже видела 24 часа назад, во время первого прохода, как известный. Она будет изучать новый, неизвестный объект более подробно, чем уже известный. Эта способность памяти выражается в виде дискриминационного индекса. Дискриминационный индекс, равный нулю, означает, что мышь изучает оба объекта - старый и новый - в течение одинакового времени, т.е. она не опознала старый объект и воспринимает оба объекта так, как если бы они были оба незнакомыми и новыми. Дискриминационный индекс больше нуля означает, что мышь исследует новый объект в течение более длительного времени, чем старый, т.е. мышь опознала старый объект.
Модель MK-801-индуцированного психоза
Неконкурентный антагонист NMDA рецептора MK-801 индуцирует стереотипии и гиперактивность у грызунов (Contreras et al., Synapse 2: 240-243, 1988), взаимодействуя с ионным каналом, связанным с NMDA рецептором. Фенциклидин, также влияющий на NMDA рецептор, вызывает у человека психотические проявления, во многих отношениях аналогичные шизофрении. Эти факты указывают на то, что недостаточность трансмиссии глутамата может быть ответственна за патологию шизофрении (Javitt & Zukin, Am. J. Psychiatr., 48: 1301-1308, 1991). Нейролептики галоперидол, клозапин и раклоприд способны обратить изменения в поведении, вызванные MK-801 у крыс (Carlsson et al., Biol. Psychiatr. 46: 1388-1395, 1999). Поэтому вызванные MK-801 активность и стереотипии у крыс могут представлять собой подходящую модель на животных для тестирования эффективности антипсихотических лекарственных средств.
Порядок проведения эксперимента
Самцы крыс Wistar весом 250-300 г помещаются в клетки по 2 с циклом смены света и темноты 12 ч/12 ч (свет включается в 7.00) при комнатной температуре 21±0,2 градуса Цельсия на минимум 5 дней перед проведением анализа. Все животные имеют неограниченный доступ к обычной пище и воде.
В день проведения эксперимента крысам вводят контрольный лекарственный раствор, контрольные вещества галоперидол и клозапин, раствор анализируемого соединения или анализируемые соединения. После введения крыс возвращают в клетки на 15 минут. Животные, которым был введен галоперидол, клозапин, анализируемое соединение или контрольный раствор, получают интраперитонеальную инъекцию 0,3 мг/кг MK-801. Остальные крысы, получившие плацебо, получают вторую инъекцию контрольного раствора. Стандартный объем инъекции составляет 2,0 мл/кг. После 10 минут содержания в своих клетках крыс перемещают в аналитический бокс (плексиглас, 29х12х12 см) за 5 минут до проведения анализа для привыкания. Перед каждым анализом аналитический бокс моют 70% этанолом. В течение 5-минутных периодов оцениваются стереотипии, определяемые как контакты носом со стенками и двигательная активность, определяемая как развороты на 180 градусов.
Анализ потенцирования метразола
Используются самцы мышей CD-1 (20-30 граммов). В день проведения анализа животных приносят в лабораторию и произвольно распределяют на группы. Для первичного отбора анализируемое соединение вводится интраперитонеально (i.p., 10 мл/кг) группам из 10 мышей за 60 минут до стимуляции метразолом (55 мг/кг подкожно). После введения метразола животных помещают по одному в прозрачные пластмассовые цилиндры (12×5 дюймов), а затем наблюдают их на наличие клонических судорог. Клоническая судорога определяется как единичный эпизод клонических спазмов длительностью не менее 3 секунд. Мыши, которым был введен метразол, считаются «потенцированными», если происходят такие клонические судороги.
Когда 50% животных демонстрируют потенциацию в первичном отборе, необходимо применять диапазон дозировок. Анализируемые соединения испытываются при времени до введения препарата равном 60 минут с использованием 3 или более доз, в то время как контрольная группа получает контрольный раствор. Величину ED50 определяют методом линейной регрессии.
Сверхмаксимальный электрошоковый анализ
Используются самцы мышей CD-1 (18-30 г). Лекарства готовят с использованием дистиллированной воды, в случае их нерастворимости применяют поверхностно-активное вещество. Контрольные животные получают контрольный раствор. Как правило, лекарства вводят интраперитонеально. Способ введения может варьироваться (перорально, подкожно). Объем доз составляет 10 мл/кг.
Стимулятор постоянного тока, аналогичный аппарату, описанному в работе Woodbury и Davenport (Arch. Int. Pharmacodyn. 92: 97-107, 1952) выдает 60 Гц удар, силу тока и длительность которого можно менять, через корнеальные электроды. Удар 0,3 с, 25 мА (50 В) достаточен, чтобы вызвать тонус разгибателя у 95% контрольных мышей.
Соединение считается способным обеспечить защиту, если мышь не демонстрирует тонус разгибателей. Защита выражается как нормализованное процентное отношение по сравнению с контрольной группой. Временная характеристика определяется по 6 мышам на группу. Животные испытываются через 30, 60 и 120 минут после введения лекарства. Проводятся испытания с дополнительными периодами, если это необходимо по результатам предыдущих тестов. После определения пиковой активности выполняется анализ зависимости эффекта от дозы с использованием 10 животных на группу в данном временном периоде. Величина ED50 и 95% доверительный интервал вычисляются методом компьютерного пробит-анализа.
Примеры синтеза
Общая информация
Имеющиеся в продаже реагенты и растворители используют без дополнительной обработки. 1H ЯМР спектры записывают на спектрометре Varian MercuryPlus-300 (300 МГц) или Varian Unity Inova (400 МГц), как указано. Величины протонного химического сдвига указаны в δ м.д. относительно внутреннего стандарта тетраметилсилана (0,0 м.д.). Данные МС (ЖХ/МС) получают на времяпролетном масс-спектрометре с ионизацией электрораспылением Micromass LCT со временем регистрации 5 минут для m/z от 100 до 1000. ЖХ (ЖХ/МС) выполняют на колонке Hypersil C18 (4,6×50 мм, 3,5 мкм с подвижной фазой 0,1% TFA в H2O (A) и 0,1% TFA в ACN (B) и с градиентом от 5% до 100% B в течение 3 минут, а затем 2 минуты при 100% B. Также может использоваться платформа ЖХ/МС с источником электрораспыления с системой ЖХ HP1100 с расходом 2,0 мл/мин, с подачей 200 мкл/мин на источник ионизации электрораспылением со встроенным детектированием при помощи диодно-матричного детектора (DAD) HP1100 и спектроскопии энергетических потерь электронов (ELS) SEDEX. Колонка Luna C18(2) (30×4,6 мм 3 мкм используется с градиентом от 5% до 95% B в течение 4,5 минут с подвижной фазой 0,1% муравьиной кислоты в H2O и 0,1% муравьиной кислоты в ACN (B). Очистка ВЭЖХ выполняется в системе Varian ProStar с использованием колонки для обращенно-фазовой хроматографии C18 с линейным градиентом ACN /H2O с содержанием 0,1% трифторуксусной кислоты.
Пример 1
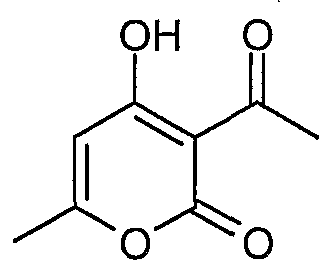
3-Ацетил-4-гидрокси-6-метилпиран-2-он
4-Гидрокси-6-метилпиран-2-он (12,6 г, 100 ммоль) растворяют в трифторуксусной кислоте (50 мл) и добавляют по каплям 7,8 г (100 ммоль) ацетилхлорида. Эту смесь нагревают с обратным холодильником в течение 5 часов. Реакционную смесь выпаривают при пониженном давлении. Добавляют 50 мл воды, экстрагируют этилацетатом (50 мл х 3) и смешивают органические слои. Промывают солевым раствором и сушат (сульфат натрия). Хроматографируют на силикагеле с элюированием хлороформом и получают 5,8 г (34,5 ммоль) 3-ацетил-4-гидрокси-6-метилпиран-2-она.
ЖХ/МС (M+H): m/z 169, время удерживания 3,24 мин.
Пример 2
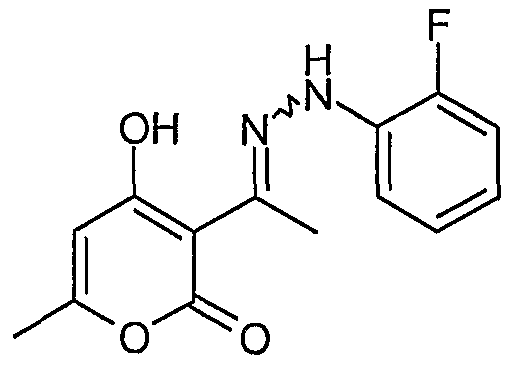
3-{1-[(2-Фторфенил)гидразоно]этил}-4-гидрокси-6-метилпиран-2-он
В гидрохлорид 2-фторфенилгидразина (0,16 г, 1,0 ммоль) в метаноле (8 мл) добавляют MP-карбонат (1,0 г, 3,3 эквивалента). Смесь встряхивают при комнатной температуре в течение 1 часа. Смолу отфильтровывают и промывают метанолом. В фильтрат добавляют (2-фторфенил)-гидразин (0,134 г, 0,80 ммоль). Реакционную смесь встряхивают при комнатной температуре в течение 2 часов, а затем выпаривают растворитель при пониженном давлении. Твердое вещество перекристаллизуют из минимального количества метанола и получают 0,185 г (0,67 ммоль) 3-{1-[(2-фторфенил)гидразоно]этил}-4-гидрокси-6-метилпиран-2-она.
ЖХ/МС (M+H): m/z 277, время удерживания 2,74 мин.
Пример 3
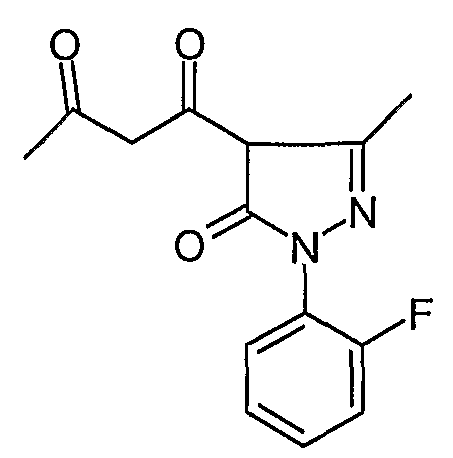
1-[1-(2-Фторфенил)-3-метил-5-оксо-4,5-дигидро-1H-пиразол-4-ил]бутан-1,3-дион
В течение 1 часа нагревают 3-{1-[(2-фторфенил)-гидразоно]этил}-4-гидрокси-6-метилпиран-2-он (0,045 г, 0,163 ммоль) с обратным холодильником в уксусной кислоте (0,3 мл). Добавляют гептан (3 мл) и выпаривают смесь до сухого состояния, получая 1-[1-(2-фторфенил)-3-метил-5-оксо-4, 5-дигидро-1H-пиразол-4-ил]бутан-1,3-дион (0,045 г, 0,163 ммоль). Это вещество используют в следующей стадии без дополнительной очистки.
ЖХ/МС (M+H): m/z 277, время удерживания 2,05 мин.
Пример 4
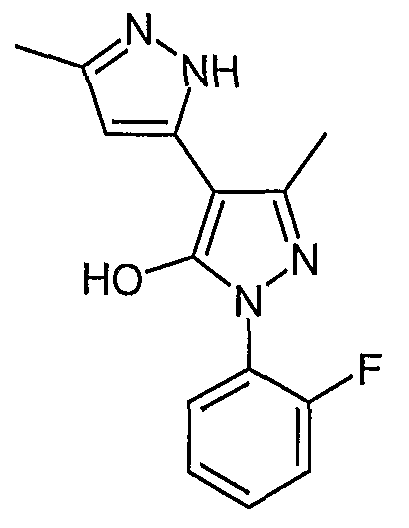
2'-(2-Фторфенил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол
В 1-[1-(2-фторфенил)-3-метил-5-оксо-4,5-дигидро-1H-пиразол-4-ил]бутан-1,3-дион (0,045 г, 0,163 ммоль) добавляют гидразингидрат (0,016 г, 0,32 ммоль) в этаноле (1,6 мл). Реакционную смесь нагревают с обратным холодильником в течение 1,5 часа, а затем выпаривают этанол. Остаток промывают дихлорметаном и получают 2'-(2-фторфенил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол (0,028 г, 0,102 ммоль).
ЖХ/МС (M+H): m/z 273, время удерживания 2,16 мин.
Пример 5
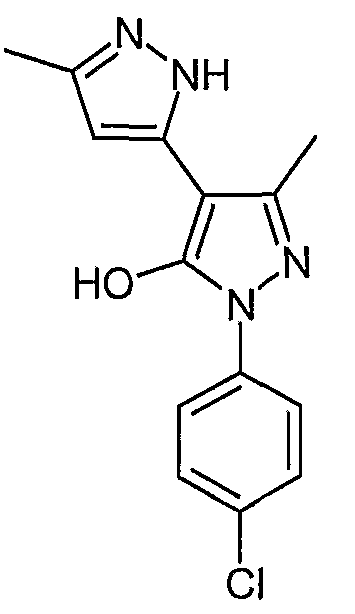
2'-(4-Хлорфенил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида 4-хлорфенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 289, время удерживания 2,72 мин.
Пример 6
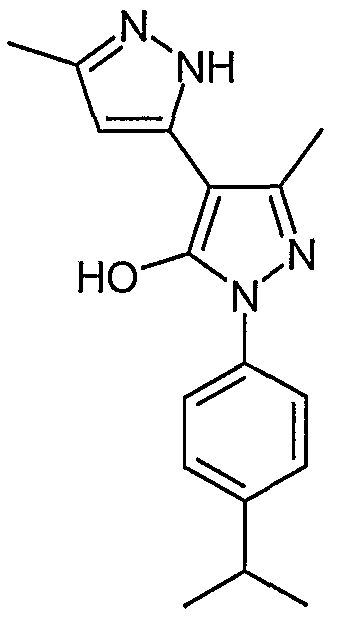
2'-(4-Изопропилфенил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида 4-изопропилфенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 297, время удерживания 2,85 мин.
Пример 7
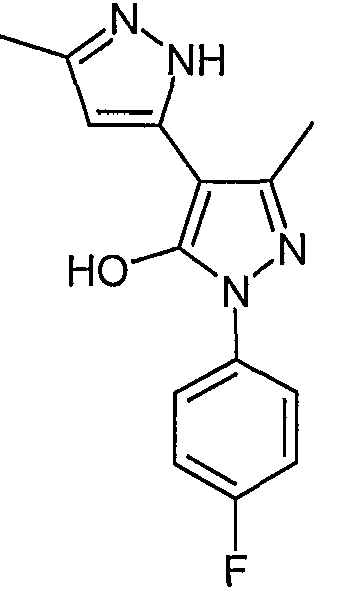
2'-(4-Фторфенил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида 4-фторфенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 273, время удерживания 2,00 мин.
Пример 8
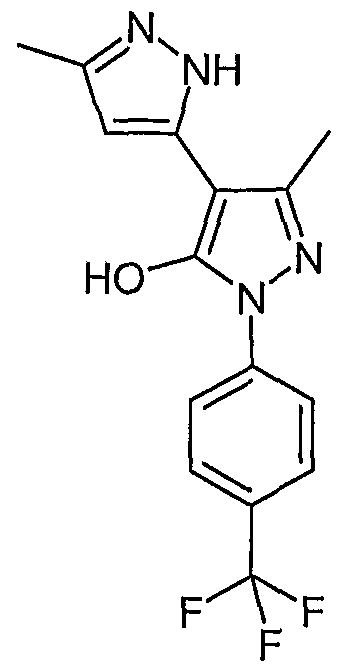
5,5'-Диметил-2'-(4-трифторметилфенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и 4-трифторметилфенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 323, время удерживания 2,88 мин.
Пример 9
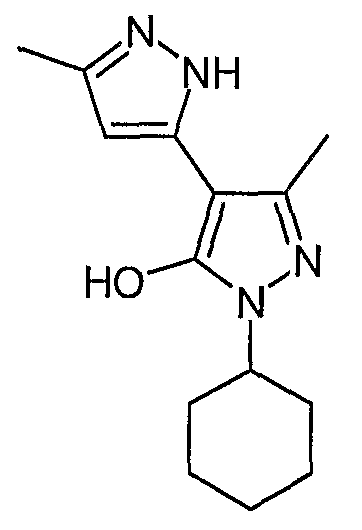
2`-Циклогексил-5,5`-диметил-2H, 2`H-[3,4]бипиразолил-3`-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида циклогексилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 261, время удерживания 1,80 мин.
Пример 10
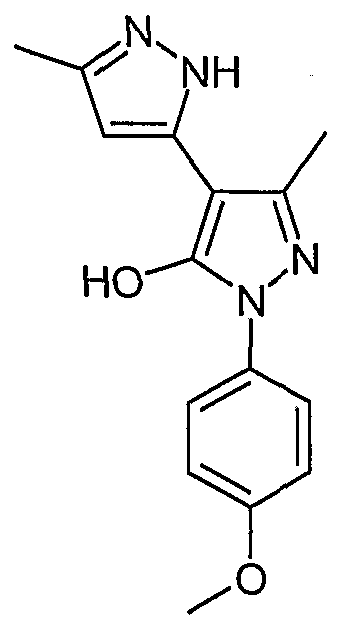
5,5'-Диметил-2'-(4-метоксифенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида 4-метоксифенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 285, время удерживания 1,96 мин.
Пример 11
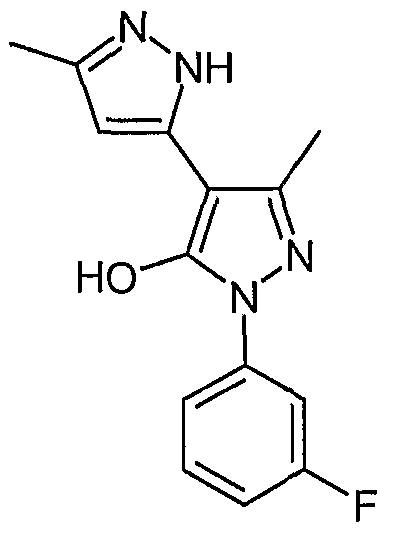
2'-(3-Фторфенил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида 3-фторфенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 273, время удерживания 2,45 мин.
Пример 12
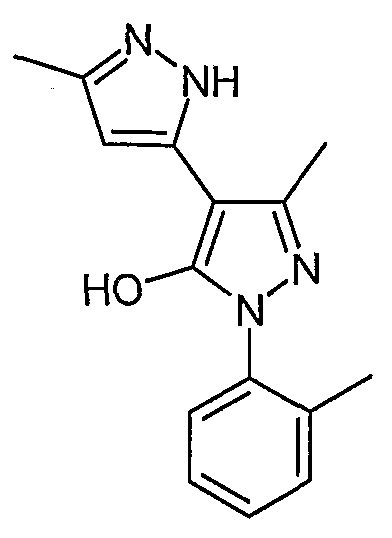
2'-(2-Метилфенил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида 2-метилфенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 269, время удерживания 1,70 мин.
Пример 13
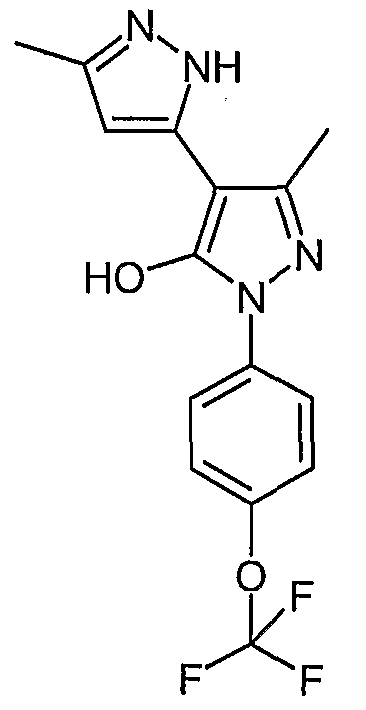
5,5'-Диметил-2'-(4-трифторметоксифенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида 4-трифторметоксифенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 339, время удерживания 3,02 мин.
Пример 14
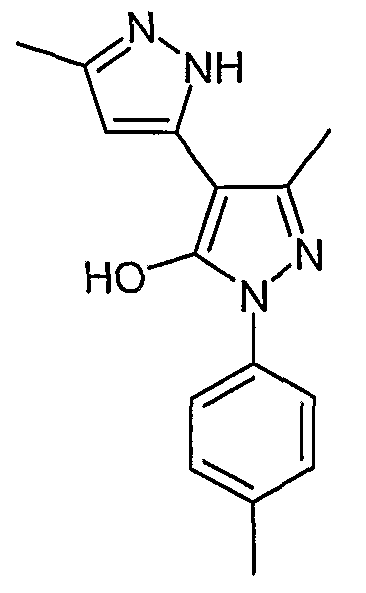
5,5'-Диметил-2'-(4-метилфенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида 4-метилфенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 269, время удерживания 2,44 мин.
Пример 15
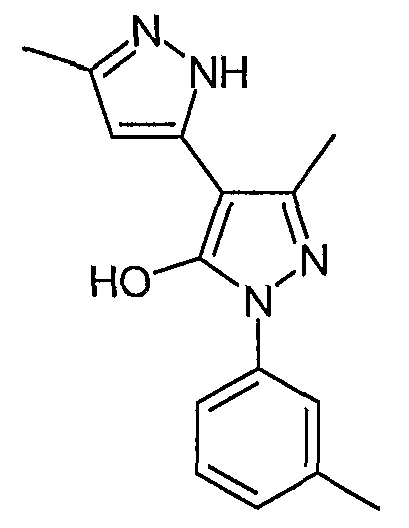
5,5'-Диметил-2'-(3-метилфенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида 3-метилфенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 269, время удерживания 2,46 мин.
Пример 16
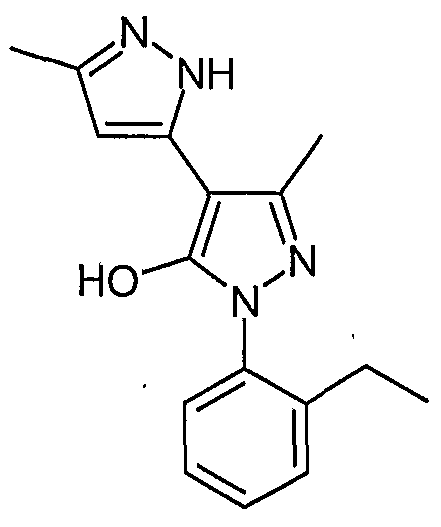
5,5'-Диметил-2'-(2-этилфенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида 2-этилфенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 283, время удерживания 2,32 мин.
Пример 17
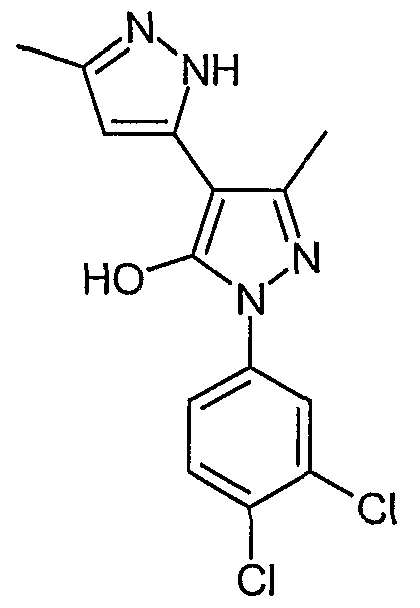
5,5'-Диметил-2'-(3,4-дихлорфенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида 3,4-дихлорфенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 323, время удерживания 3,04 мин.
Пример 18
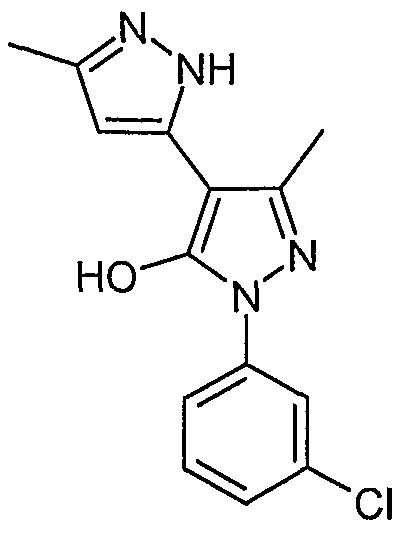
5,5'-Диметил-2'-(3-хлорфенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида 3-хлорфенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 289, время удерживания 2,28 мин.
Пример 19
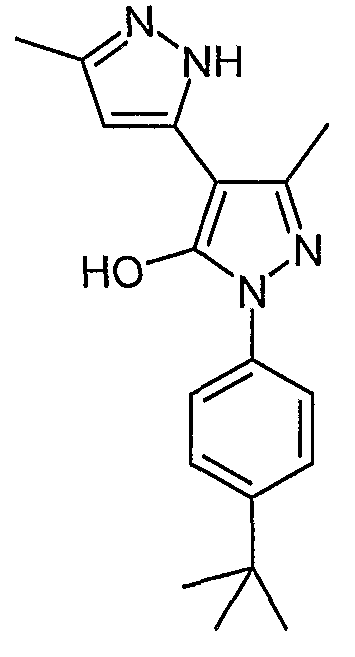
2'-(4-трет-Бутилфенил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида 4-трет-бутилфенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 311, время удерживания 2,62 мин.
Пример 20
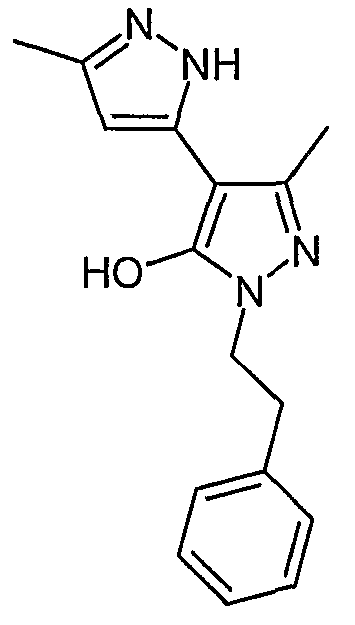
5,5'-Диметил-2'-фенэтил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и сульфата фенэтилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 283, время удерживания 2,07 мин.
Пример 21
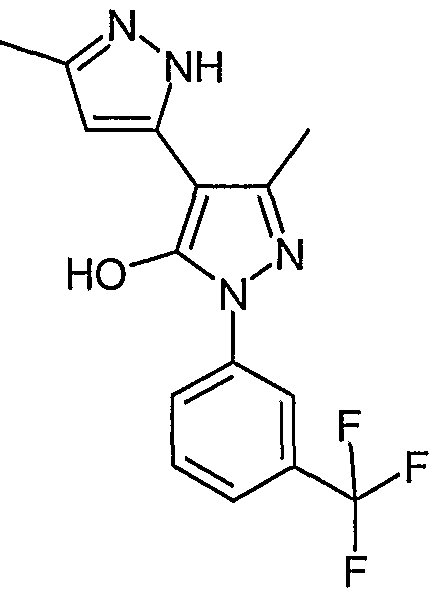
5,5'-Диметил-2'-(3-трифторметилфенил)-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и гидрохлорида 3-трифторметилфенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 323, время удерживания 2,62 мин.
Пример 22
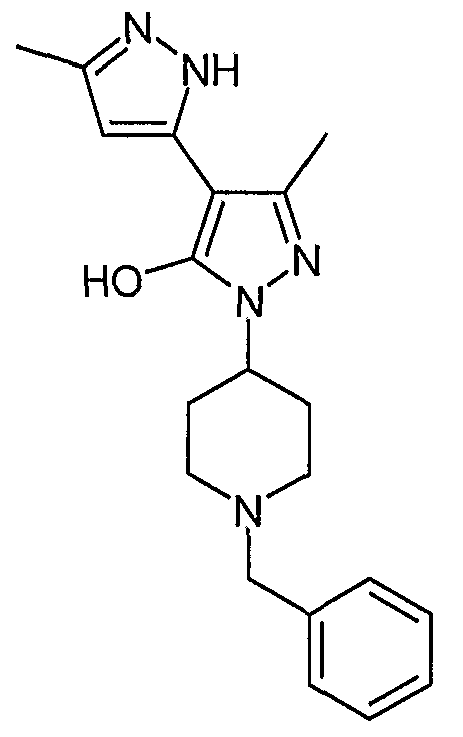
2'-(1-Бензилпиперидин-4-ил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и дигидрохлорида 1-бензилпиперидин-4-илгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 352, время удерживания 1,52 мин.
Пример 23
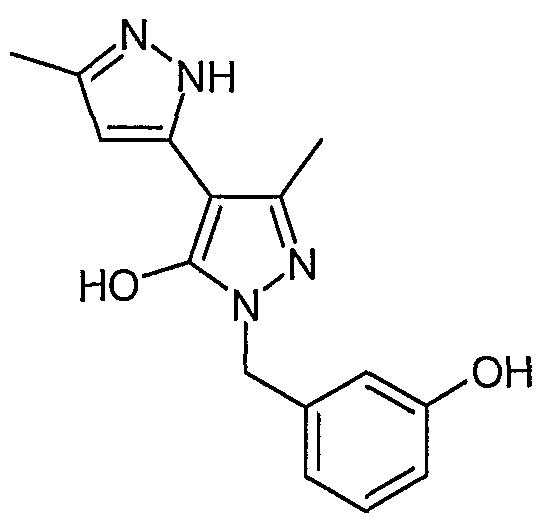
2'-(3-Гидроксибензил)-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и дигидрохлорида 3-гидразинометилфенола методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 285, время удерживания 1,57 мин.
Пример 24
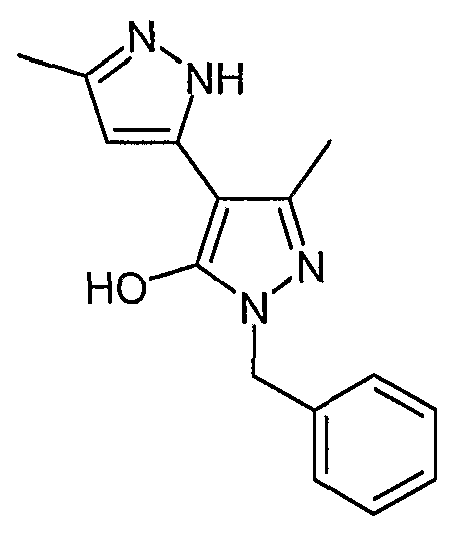
2'-Бензил-5,5'-диметил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и дигидрохлорида бензилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 269, время удерживания 1,95 мин.
Пример 25
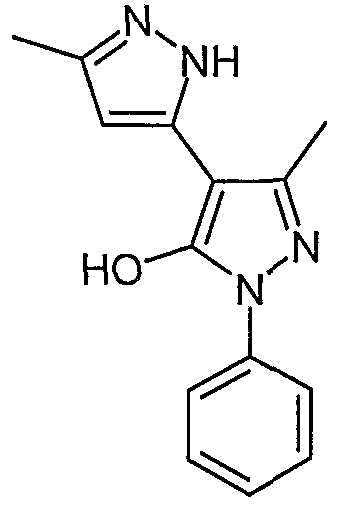
5,5'-Диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 3-ацетил-4-гидрокси-6-метилпиран-2-она и фенилгидразина методами, описанными в примерах 2, 3 и 4.
ЖХ/МС (M+H): m/z 255, время удерживания 1,77 мин.
Пример 26
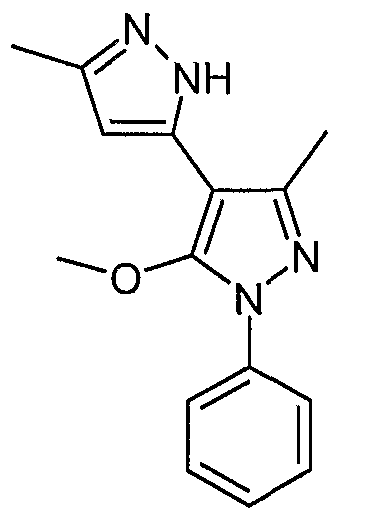
5'-Метокси-5, 3'-диметил-1'-фенил-2H, 1'H-[3,4']бипиразолил
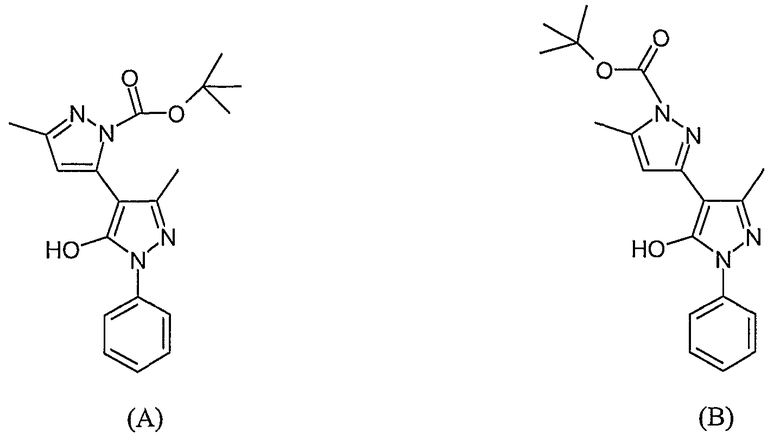
(A) трет-Бутиловый эфир 5'-гидрокси-5,3'-диметил-1'-фенил-1'H-[3,4']бипиразолил-2-карбоновой кислоты
(B) трет-Бутиловый эфир 5'-гидрокси-5,3'-диметил-1'-фенил-1'H-[3,4']бипиразолил-1-карбоновой кислоты
К 5,5'-диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-олу (0,118 г, 0,457 ммоль) (пример 25) в этаноле (4 мл) добавляют трет-бутилкарбазат (0,120 г, 0,914 ммоль). Нагревают с обратным холодильником в течение 1,5 часа, а затем выпаривают этанол. После хроматографии на силикагеле с элюированием смесью 50% этилацетат/гептан получают 0,101 г смеси позиционных изомеров A и B. Эта смесь используется в следующей стадии.
ЖХ/МС (M+H): m/z 355, время удерживания 1,97 мин и 3,24 мин, соответственно.
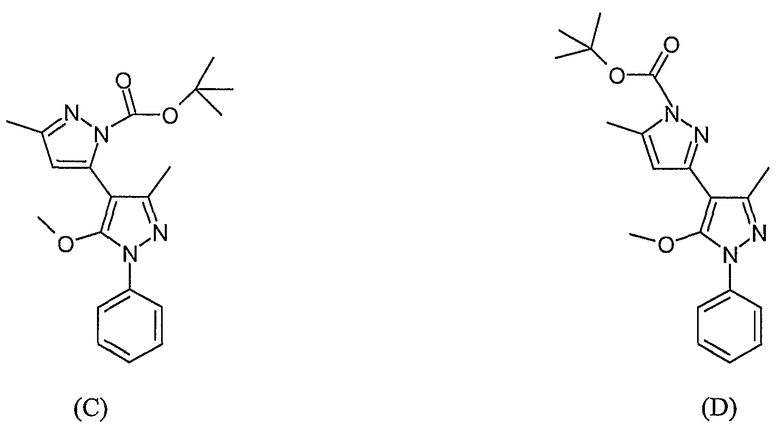
(C) трет-Бутиловый эфир 5'-метокси-5,3'-диметил-1'-фенил-1'H-[3,4']бипиразолил-2-карбоновой кислоты
(D) трет-Бутиловый эфир 5'-метокси-5,3'-диметил-1'-фенил-1'H-[3,4']бипиразолил-1-карбоновой кислоты
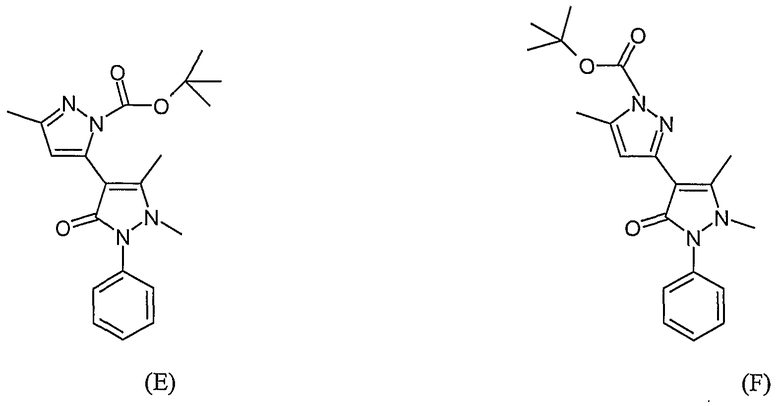
(E) трет -Бутиловый эфир 5,1',5'-триметил-3'-оксо-2'-фенил-2',3'-дигидро-1'H-[3,4']бипиразолил-2-карбоновой кислоты
(F) трет -Бутиловый эфир 5,1',5'-триметил-3'-оксо-2'-фенил-2',3'-дигидро-1'H-[3,4']бипиразолил-1-карбоновой кислоты
В смесь соединений (A) и (B) (0,100 г, 0,282 ммоль) в DMF (5 мл) добавляют NaHCO3 (0,071 г, 0,845 ммоль) и йодметан (0,40 г, 2,82 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют этилацетатом (25 мл), промывают водой (30 мл х 5) и сушат (сульфат натрия). После хроматографии на силикагеле с элюированием смесью 50% этилацетат/гептан получают 0,013 г O-метилированных продуктов ((C) и (D); ЖХ/МС (M+H): m/z 369, время удерживания 3,30 мин) и 0,012 г N-метилированных продуктов ((E) и (F), ЖХ/МС (M+H): m/z 369, время удерживания 2,63 мин). В следующей стадии используются O-метилированные продукты.
5'-Метокси-5, 3'-диметил-1'-фенил-2H,1'H-[3,4']бипиразолил
В смесь O-метилированных продуктов, соединения (C) и (D) (0,013 г, 0,035 ммоль), в дихлорметане (1 мл) добавляют трифторуксусную кислоту (1 мл). Эту смесь перемешивают при комнатной температуре в течение 1 часа, а затем выпаривают досуха. Остаток растворяют в дихлорметане, последовательно промывают водой, водным раствором бикарбоната натрия и водой. Органический слой сушат (сульфат натрия) и концентрируют, получая 0,006 г (0,022 ммоль) искомого соединения.
ЖХ/МС (M+H): m/z 269, время удерживания 2,83 мин.
Пример 27
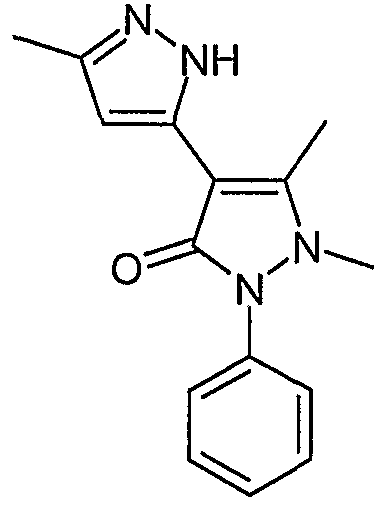
5,1',5'-Триметил-2'-фенил-1',2'-дигидро-2H-[3,4']бипиразолил-3'-он
В смесь N-метилированных изомеров, соединения (E) и (F) примера 26 (0,012 г, 0,035 ммоль), в дихлорметане (1 мл) добавляют трифторуксусную кислоту (1 мл). Эту смесь перемешивают при комнатной температуре в течение 1 часа, а затем выпаривают досуха. Остаток растворяют в дихлорметане, последовательно промывают водой, водным раствором бикарбоната натрия и водой. Органический слой сушат (сульфат натрия) и концентрируют, получая 0,009 г (0,035 ммоль) искомого соединения.
ЖХ/МС (M+H): m/z 269, время удерживания 2,06 мин.
Пример 28
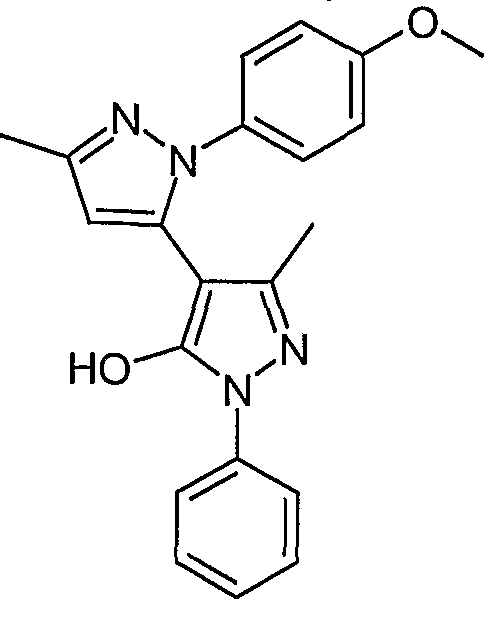
2'-(4-Метоксифенил)-5,5'-диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол
В гидрохлорид (4-метоксифенил)гидразина (0,083 г, 0,48 ммоль) в этаноле (5 мл) добавляют бикарбонат натрия (0,067 г, 0,80 ммоль), после чего перемешивают смесь в течение 10 минут. Добавляют 1-[1-фенил-3-метил-5-оксо-4,5-дигидро-1H-пиразол-4-ил]-бутан-1,3-дион (0,103 г, 0,40 ммоль). Смесь нагревают с обратным холодильником в течение 1,5 часа, а затем выпаривают досуха. После хроматографии на силикагеле с элюированием смесью от 50 до 100% этилацетат/гептан получают 0,071 г искомого соединения.
ЖХ/МС (M+H): m/z 361, время удерживания 2,43 мин.
Пример 29
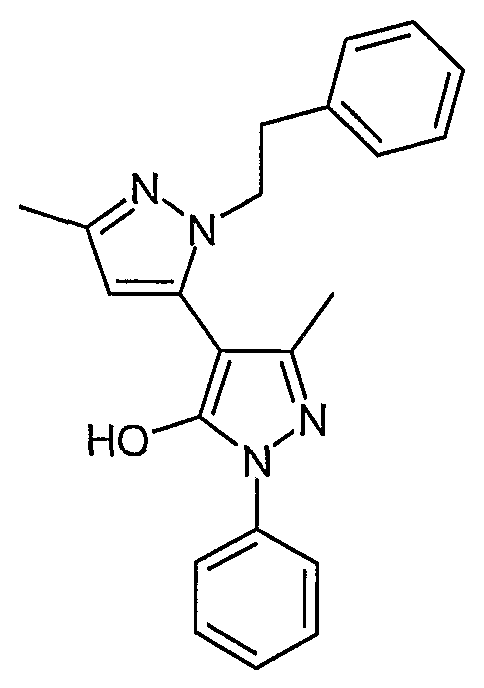
5,5'-Диметил-2-фенэтил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 1-[1-фенил-3-метил-5-оксо-4, 5-дигидро-1H-пиразол-4-ил]-бутан-1,3-диона и сульфата фенэтилгидразина методами, описанными в примере 28.
ЖХ/МС (M+H): m/z 359, время удерживания 2,55 мин.
Пример 30
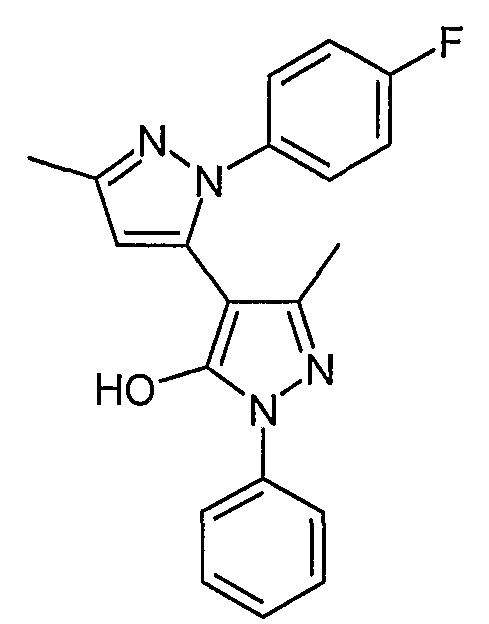
2-(4-Фторфенил)-5,5'-диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 1-[1-фенил-3-метил-5-оксо-4, 5-дигидро-1H-пиразол-4-ил]-бутан-1, 3-диона и гидрохлорида 4-фторфенилгидразина методами, описанными в примере 28.
ЖХ/МС (M+H): m/z 349, время удерживания 2,48 мин.
Пример 31
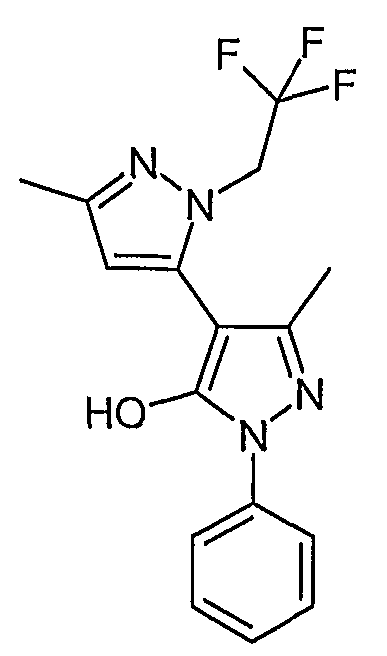
5,5'-Диметил-2'-фенил-2-(2,2,2-трифторэтил)-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 1-[1-фенил-3-метил-5-оксо-4, 5-дигидро-1H-пиразол-4-ил]бутан-1,3-диона и 2,2,2-трифторэтилгидразина (70% в воде) методами, описанными в примере 28.
ЖХ/МС (M+H): m/z 337, время удерживания 2,35 мин.
Пример 32
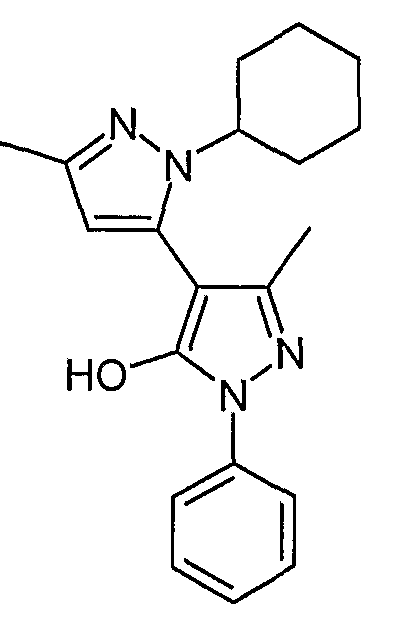
2-Циклогексил-5,5'-диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 1-[1-фенил-3-метил-5-оксо-4, 5-дигидро-1H-пиразол-4-ил]-бутан-1,3-диона и гидрохлорида циклогексилгидразина методами, описанными в примере 28.
ЖХ/МС (M+H): m/z 337, время удерживания 2,50 мин.
Пример 33
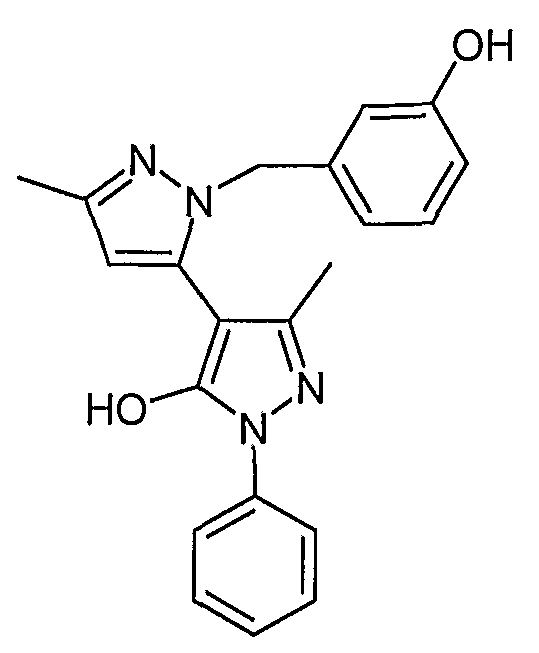
2-(3-Гидроксибензил)-5,5'-диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 1-[1-фенил-3-метил-5-оксо-4, 5-дигидро-1H-пиразол-4-ил]бутан-1,3-диона и дигидрохлорида 3-гидроксибензилгидразина методами, описанными в примере 28.
ЖХ/МС (M+H): m/z 361, время удерживания 2,18 мин.
Пример 34
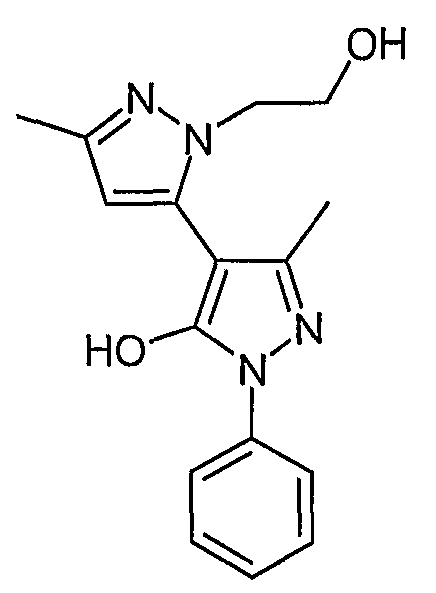
2-(2-Гидроксиэтил)-5,5'-диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 1-[1-фенил-3-метил-5-оксо-4, 5-дигидро-1H-пиразол-4-ил]бутан-1,3-диона и 2-гидроксиэтилгидразина методами, описанными в примере 28.
ЖХ/МС (M+H): m/z 299, время удерживания 1,83 мин.
Пример 35
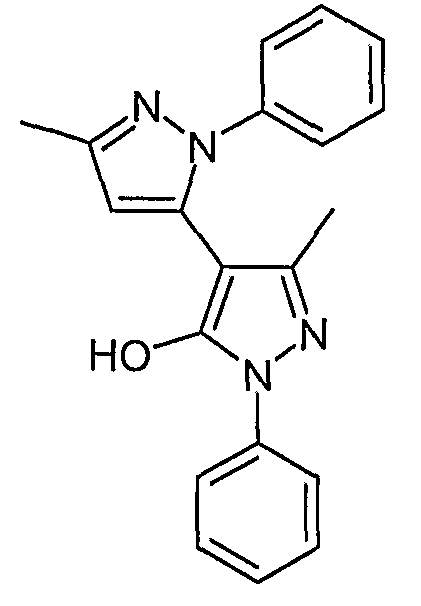
5,5'-Диметил-2,2'-дифенил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 1-[1-фенил-3-метил-5-оксо-4, 5-дигидро-1H-пиразол-4-ил]бутан-1,3-диона и фенилгидразина методами, описанными в примере 28.
ЖХ/МС (M+H): m/z 331, время удерживания 2,42 мин.
Пример 36
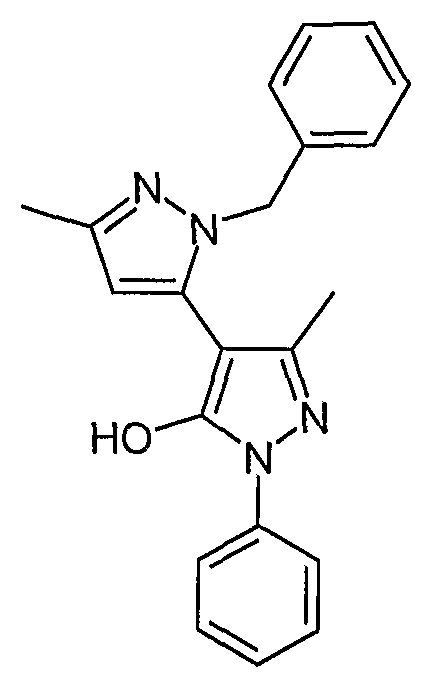
2-Бензил-5, 5'-диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 1-[1-фенил-3-метил-5-оксо-4, 5-дигидро-1H-пиразол-4-ил]бутан-1,3-диона и гидрохлорида бензилгидразина методами, описанными в примере 28.
ЖХ/МС (M+H): m/z 345, время удерживания 2,69 мин.
Пример 37
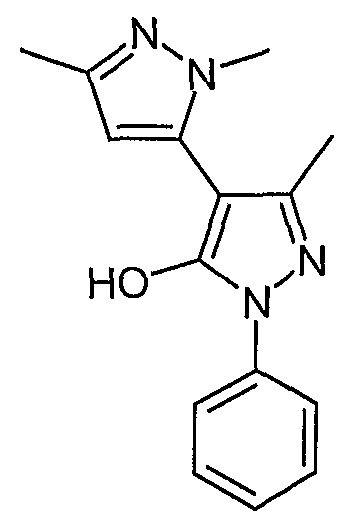
2,5,5'-Триметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол
Искомое соединение получают из 1-[1-фенил-3-метил-5-оксо-4, 5-дигидро-1H-пиразол-4-ил]бутан-1,3-диона и метилгидразина методами, описанными в примере 28.
ЖХ/МС (M+H): m/z 269, время удерживания 2,10 мин.
Пример 38
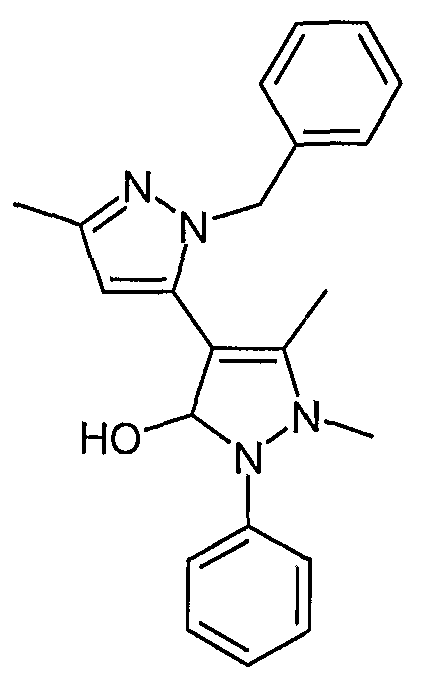
2-Бензил-5,1',5'-триметил-2'-фенил-1',2'-дигидро-2H-[3,4'] бипиразолил-3'-он
В 2-бензил-5,5'-диметил-2'-фенил-2H, 2'H-[3,4'] бипиразолил-3'-ол (пример 36, 0,200 г, 0,58 ммоль) в DMF добавляют карбонат цезия (0,944 г, 2,90 ммоль), а затем йодметан (0,823 г, 5,8 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют этилацетатом, промывают водой (25 мл х 5) и сушат (сульфат натрия). После хроматографии на силикагеле с элюированием смесью от 50 до 100% этилацетат/гептан получают 0,045 г искомого соединения.
ЖХ/МС (M+H): m/z 359, время удерживания 2,84 мин.
Данная реакция также позволяет получить O-метилированное соединение. См. пример 39 ниже.
Пример 39
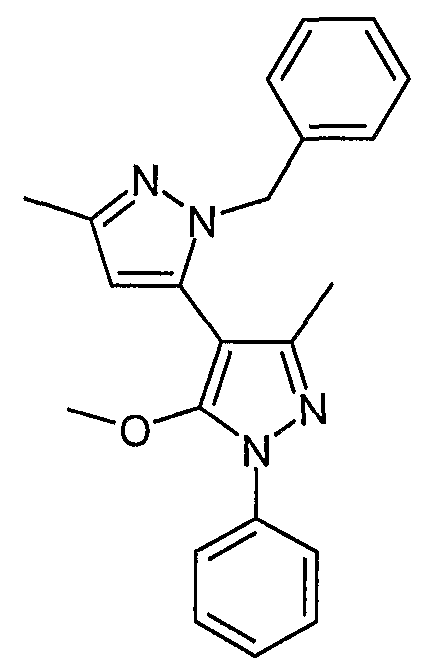
2-Бензил-5'-метокси-5,3'-диметил-1'-фенил-2H,1'H-[3,4']бипиразол
Искомое соединение выделяют методом хроматографии, как описано в примере 38, и получают 0,033 г O-метилированного изомера.
ЖХ/МС (M+H): m/z 359, время удерживания 3,51 мин.
Хотя данное изобретение проиллюстрировано приведенными выше примерами, их не следует рассматривать как какое-либо ограничение данного изобретения. Наоборот, данное изобретение охватывает всю описанную выше область в целом. Можно реализовать различные модификации и осуществления данного изобретения без отступления от его объема и сущности.
| название | год | авторы | номер документа |
|---|---|---|---|
| (3-ЦИКЛОАЛКИЛ-2,3,4,5-ТЕТРАГИДРО-1Н-БЕНЗО[d]АЗЕПИН-7-ИЛОКСИ)ПРОИЗВОДНЫЕ, ИХ ПРИМЕНЕНИЕ ДЛЯ ИНГИБИРОВАНИЯ Н3 РЕЦЕПТОРОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПОЛУЧЕНИЯ | 2003 |
|
RU2388752C2 |
| НОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ОПИОИДНЫХ РЕЦЕПТОРОВ | 2003 |
|
RU2332411C2 |
| ТЕТРАЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2010 |
|
RU2585622C2 |
| ТЕТРАЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2010 |
|
RU2725140C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПЕРВИЧНЫХ АМИНДИАЗЕНИУМДИОЛАТОВ | 2012 |
|
RU2596867C2 |
| 1,3,4-ОКСАДИАЗОЛ-2-ОНЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ PPAR-ДЕЛЬТА, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 2005 |
|
RU2365589C2 |
| СОЛИ ТРИАЗОЛИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PAR1, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2009 |
|
RU2494100C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,4-ДИФЕНИЛАЗЕТИДИНОНА | 2005 |
|
RU2380361C2 |
| Аналоги сплицеостатина | 2013 |
|
RU2618523C2 |
| АНАЛОГИ НОЦИЦЕПТИНА | 2002 |
|
RU2426730C2 |
Настоящее изобретение направлено на дипиразольные соединения формулы I и их фармацевтически приемлемые соли, где радикалы и группы имеют значения, определенные в п.1 формулы изобретения. Соединения, составляющие предмет данного изобретения, модулируют функцию рецепторов АМРА и NMDA, и поэтому могут использоваться в качестве фармацевтических средств, главным образом, для лечения психоневрологических заболеваний. Объектами изобретения также являются фармацевтическая композиция на основе соединений формулы I и отдельные дипиразольные соединения. 4 н. и 12 з.п. ф-лы, 2 табл.

1. Соединение формулы (I)
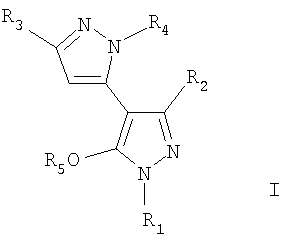
или его фармацевтически приемлемая соль, где
R1 выбирают из группы, включающей фенил, бензил, фенилС2-6алкил, С3-8циклоалкил, С1-10алкил, С3-8циклоалкилС1-6алкил, и
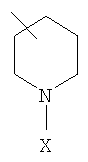
где Х представляет собой бензил;
где указанные фенил, бензил, необязательно замещены одним или двумя заместителями, каждый из которых независимо выбирают из С1-6алкила, C1-6перфторалкила, галогена, перфторС1-4алкокси, C1-С6алкокси;
R2 представляет собой С1-6алкил;
R3 представляет собой С1-6алкил;
R4 выбирают из группы, включающей водород, фенилС2-6алкил, бензил, СF3СН2, С3-8циклоалкил или С2-6алкил, где фенил или бензил необязательно замещен заместителем, выбранным из С1-6алкила, C1-6перфторалкила, галогена, гидроксильной группы и C1-С6алкокси;
R5 означает Н, C1-6алкил; и
при условии, что
а) когда R1 представляет собой фенил или 4-хлорфенил, a R4 и R5 означают водород, то R2 и R3 оба не могут быть метилами.
2. Соединение по п.1, где
R1 выбирают из группы, включающей фенил, бензил, С1-6циклоалкил,
С1-10алкил, фенилС2-6алкил и

где Х означает бензил;
R2 и R3 означают C1-6алкил; и
R5 представляет собой водород или С1-6алкил.
3. Соединение по п.1, где
R1 означает фенил;
R2 и R3 означают С1-6алкил;
R4 означает водород; и
R5 представляет собой водород или С1-6алкил.
4. Соединение по п.1, которое выбирают из группы, включающей
2'-(2-фторфенил)-5,5'-диметил-2Н,2'Н-[3,4']бипиразолил-3'-ол, 2'-(4-изопропилфенил)-5,5'-диметил-2Н, 2'Н-[3,4']бипиразолил-3'-ол, 2'-(4-фторфенил)-5,5'-диметил-2Н,2'Н-[3,4']бипиразолил-3'-ол, 5,5'-диметил-2'-(4-трифторметилфенил)-2Н,2'Н-[3,4']бипиразолил-3'-ол, 5,5'-диметил-2'-(4-метоксифенил)-2Н,2'Н-[3,4']бипиразолил-3'-ол, 2'-(3-фторфенил)-5,5'-диметил-2Н,2'Н-[3,4']бипиразолил-3'-ол, 2'-(2-метилфенил)-5,5'-диметил-2Н,2'Н-[3,4'] бипиразолил-3'-ол, 5,5'-диметил-2'-(4-трифторметоксифенил)-2Н,2'Н-[3,4']бипиразолил-3'-ол, 5,5'-диметил-2'-(4-метилфенил)-2Н,2'Н-[3,4']бипиразолил-3'-ол, 5,5-диметил-2'-(3-метилфенил)-2Н,2'Н-[3,4']бипиразолил-3'-ол, 5,5'-диметил-2'-(2-этилфенил)-2Н,2'Н-[3,4']бипиразолил-3'-ол, 5,5'-диметил-2'-(3,4-дихлорфенил)-2Н,2'Н-[3,4']бипиразолил-3'-ол, 5,5'-диметил-2'-(3-хлорфенил)-2Н,2'Н-[3,4']бипиразолил-3'-ол, 2'-(4-трет-бутилфенил)-5,5'-диметил-2Н,2'Н-[3,4']бипиразолил-3'-ол, 5,5'-диметил-2'-(3-трифторметилфенил)-2Н,2'Н-[3,4']бипиразолил-3'-ол и 5'-метокси-5,3'-диметил-1'-фенил-2Н,1'Н-[3,4']бипиразолил.
5. Соединение по п.1, где
R1 означает фенил;
R2 и R3 означают C1-6алкил;
R4 означает фенилС2-6алкил или бензил; и
R5 представляет собой водород или С1-6алкил.
6. Соединение по п.1, которое выбирают из группы, включающей
5,5'-диметил-2-фенэтил-2'-фенил-2Н,2'Н-[3,4'] бипиразолил-3'-ол, 2-бензил-5,5'-диметил-2'-фенил-2Н,2'Н-[3,4']бипиразолил-3'-ол, 2-бензил-5'-метокси-5,3'-диметил-1'-фенил-2Н,1'Н-[3,4']бипиразол и 2-(3-гидроксибензил)-5,5'-диметил-2'-фенил-2Н,2'Н-[3,4']бипиразолил-3'-ол.
7. Соединение по п.1, где
R1 означает фенил;
R2 и R3 означают C1-6алкил;
R4 означает С3-8циклоалкил или С2-6алкил; и
R5 означает водород.
8. Соединение, которое выбирают из группы, включающей
5,5'-диметил-2'-фенил-2-(2,2,2-трифторэтил)-2Н,2'Н-[3,4']бипиразолил-3'-ол, 2-циклогексил-5,5'-диметил-2'-фенил-2Н,2'Н-[3,4']бипиразолил-3'-ол, и 2,5,5'-триметил-2'-фенил-2Н,2'Н-[3,4']бипиразолил-3'-ол.
9. Соединение, которое выбирают из группы, включающей
2-(4-метоксифенил)-5,5'-диметил-2'-фенил-2Н,2'Н-[3,4']бипиразолил-3'-ол и 2-(4-фторфенил)-5,5'-диметил-2'-фенил-2Н,2'Н-[3,4']бипиразолил-3'-ол.
10. Соединение по п.1, где
R1 означает фенилС2-6алкил или бензил;
R2 и R3 означают С1-6алкил; и
R4 и R5 означают водород.
11. Соединение по п.1, которое выбирают из группы, включающей
5,5'-диметил-2'-фенилэтил-2Н,2'Н-[3,4'] бипиразолил-3'-ол, 2'-(3-гидроксибензил)-5,5'-диметил-2Н,2'Н-[3,4']бипиразолил-3'-ол и 2'-бензил-5,5'-диметил-2Н,2'Н-[3,4']бипиразолил-3'-ол.
12. Соединение по п.1, где
R1 означает  ;
;
где Х означает бензил;
R2 и R3 означают С1-6алкил; и
R4 и R5 означают водород.
13. Соединение по п.12, представляющее собой 2'-(1-бензилпиперидин-4-ил)-5,5'-диметил-2Н,2'Н-[3,4']бипиразолил-3'-ол.
14. Соединение по п.1, где
R1 означает С3-8циклоалкил;
R2 и R3 означают С1-6алкил; и
R4 и R5 означают водород.
15. Соединение по п.14, представляющее собой 2'-циклогексил-5,5'-диметил-2Н,2'Н-[3,4']бипиразолил-3'-ол.
16. Фармацевтическая композиция для модуляции рецепторов АМРА и NMDA, содержащая эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
| ACS on STN, соединения, имеющие регистрационные номера RN: 321998-06-5, RN: 245039-21-8, RN: 246021-97-6, RN: 246021-98-7, RN:245039-27-4, RN: 245039-40-1, RN: 318949-54-1, RN: 245039-44-5 и RN:303997-19-5 | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Homo and Heteronuclear Selective NOE | |||
Авторы
Даты
2010-10-10—Публикация
2006-03-15—Подача