Изобретение относится к получению производных 1,4-дифенилазетидинона путем циклизации β-замещенных аминоамидов в присутствии агентов силилирования и катализаторов циклизации.
Эзетимиб как известный представитель этих соединений блокирует резорбцию холестерина из кишечника, так что у пациентов наблюдаются пониженные уровни как LDL, так и триглицеридов. При этом речь идет о 1-(4-фторфенил)-3(R)-[3-(4-фторфенил)-3(S)-гидроксипропил]-4(S)-(4-гидроксифенил)-2-азетидиноне следующей формулы (см. пункт 8 формулы изобретения документа EP 0720599 B1).
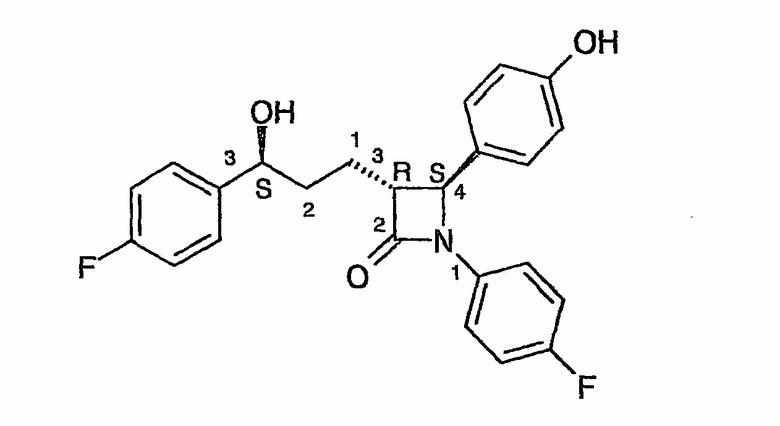
Что касается самого этого соединения, некоторых химических модификаций, их получения по различным вариантам способа и их терапевтического применения для лечения гиперлипидемии, а также артериосклероза и гиперхолестеринемии, появились, в том числе, следующие публикации, причем, например, предпринимались попытки найти химические модификации со сравнимым терапевтическим действием, но с меньшим всасыванием в кишечнике.
В документе EP 0524595A1 описаны химические модификации эзетимиба общей формулы
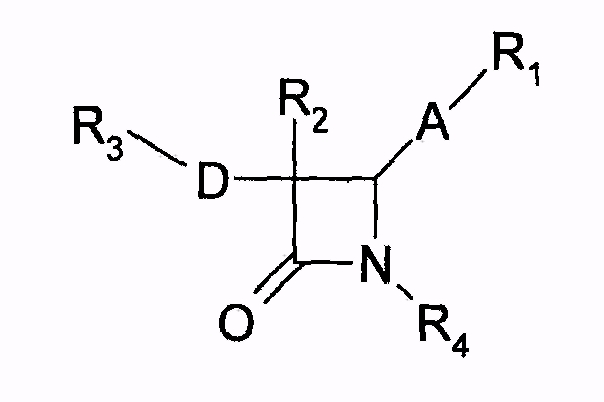
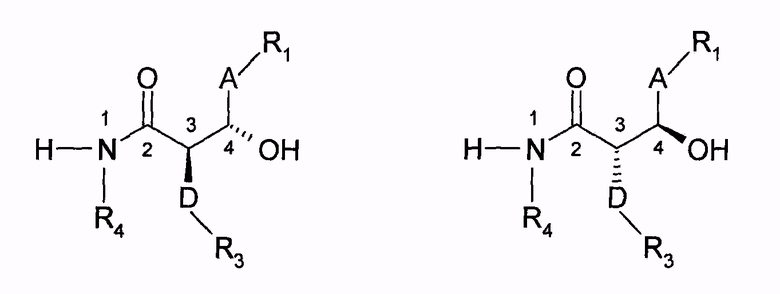
которые, в частности, в положении 3 кольца азетидинона могут иметь второй заместитель (R2) между фенильным кольцом в положении 4 азетидинонового цикла и частью молекулы (А), пока еще связанной с циклом, и не иметь никаких заместителей или других заместителей вместо групп фтора на фенильных кольцах (R3,R4). Синтез соединения, например при R2=H, протекает путем циклизации гидроксиамидов общих формул
===например, со смесью триалкилфосфин/диалкилазодикарбоксилат, диалкилхлорфосфат/катализатор фазового перехода, ди- или трихлорбензоилхлорид/тетра-н-бутиламмонийгидросульфат или дихлорбензоилхлорид/NaH.
Однако этот путь синтеза не подходит для промышленного процесса, так как, например, диалкилазодикарбоксилаты являются взрывоопасными, а диалкилхлорфосфаты чрезвычайно ядовитыми. При синтезе с помощью ди- или трихлорбензоилхлоридов должен использоваться или тетра-н-бутиламмонийгидросульфат в стехиометрических количествах, или NaH, который в больших количествах труден в обращении, которые оба не подходят для промышленного процесса.
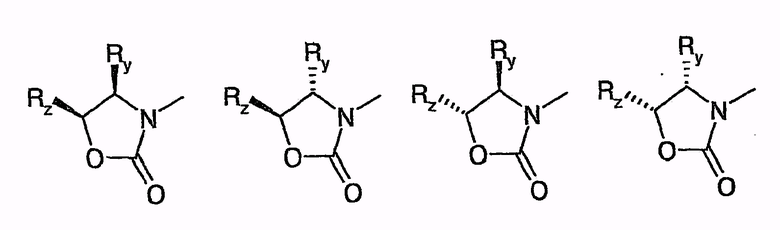
Другой синтез, описанный в документе EP 0524595 A1, протекает путем взаимодействия карбоновых кислот нижеследующей общей формулы
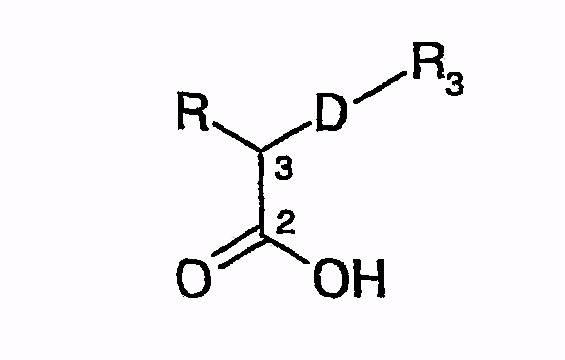
или путем аналогичного превращения, но производного карбоновой кислоты, например, хлорида кислоты или смешанного ангидрида кислоты, с хиральными оксазолидинонами, с получением соединений общей формулы
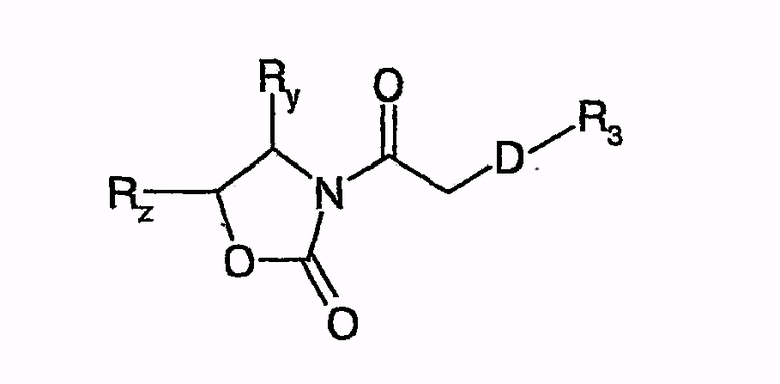
причем, например, Ry, Rz независимо друг от друга являются H, C1-C6-алкилом, фенилом, бензилом.
В отличие от получения вышеуказанных гидроксиамидов соединения вышеуказанной общей формулы конденсируют с иминами в присутствии TiCl4 и TMEDA (тетраметилэтилендиамин)
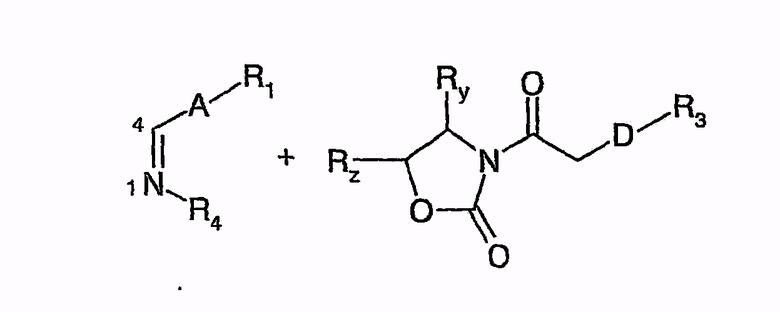
с получением соединений следующей общей формулы
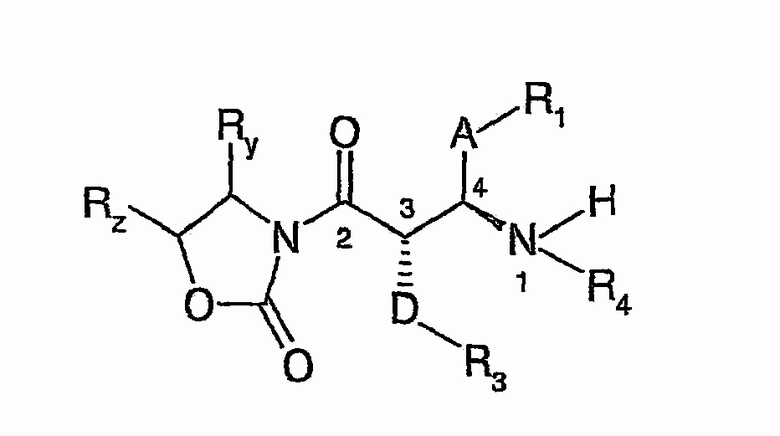
и посредством дальнейшего взаимодействия с Na- или Li-бистриметилсилиламидом циклизуют до
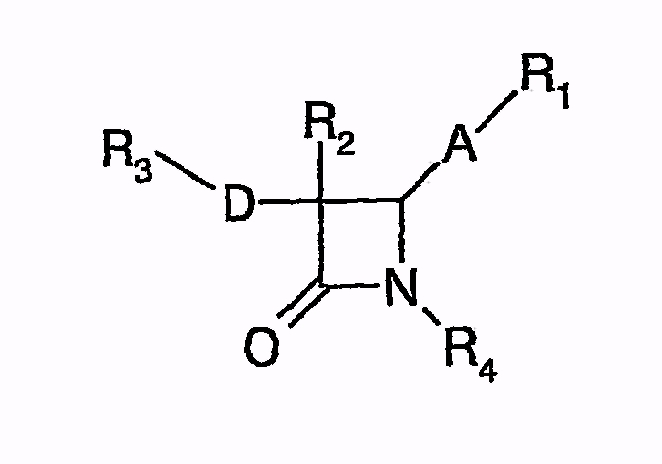
Однако TMEDA при многократном контакте может вызывать дерматит и наносит большой ущерб водной среде. Кроме того, циклизация с Na- или Li-бистриметилсилиламидом должна проводиться при низких температурах (-78°C), так как иначе образуется значительное количество побочных продуктов. Поэтому этот путь синтеза не подходит для промышленного процесса.
Из документа EP 0707567 B1 известен особый способ получения таких производных азетидинона, при котором (Q=H или, например, алкил)
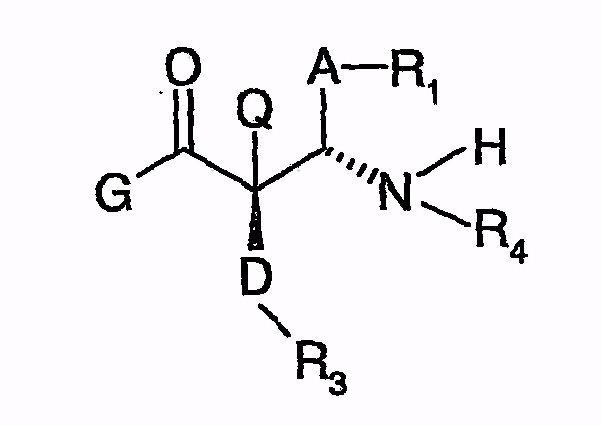
подходящим образом защищенные β-замещенные аминоамиды вышеуказанной формулы, причем G означает, в том числе, один из следующих остатков:
приводят во взаимодействие с агентом силилирования и катализатором, содержащим фторидные ионы, как агентом циклизации или с солью хирального соединения (G+-соль), в частности, с бис(триметилсилил)ацетамидом и тетра-н-бутиламмонийфторидом (TBAF).
Особый недостаток этой методики состоит в применении ядовитого и наносящего большой ущерб водной среде TBAF. Кроме того, гигроскопичность TBAF создает проблемы, так как слишком высокое содержание воды в реакционном растворе приводит к образованию значительного количества продуктов гидролиза.
Другие модификации соединений производных дифенилазетидинона описаны, например, в документе WO 02/50027, причем там по меньшей мере один из заместителей на трех, имеющихся в молекуле, фенильных остатках является остатком (C1-C30)-алкилен-(LAG), в котором один или несколько атомов C алкиленового радикала могут быть замещены, например, -O-, -CH=CH- или -NR- (R=H, C1-C6-алкил, C1-C6-алкилфенил), и LAG означает, например, остаток сахарида, дисахарида, трисахарида, аминокислоты или олигопептида.
В документе WO 02/066464 описаны следующие модификации соединений типа 1,4-дифенил-азетидинона, которые получают путем циклизации соединений нижеследующей общей формулы
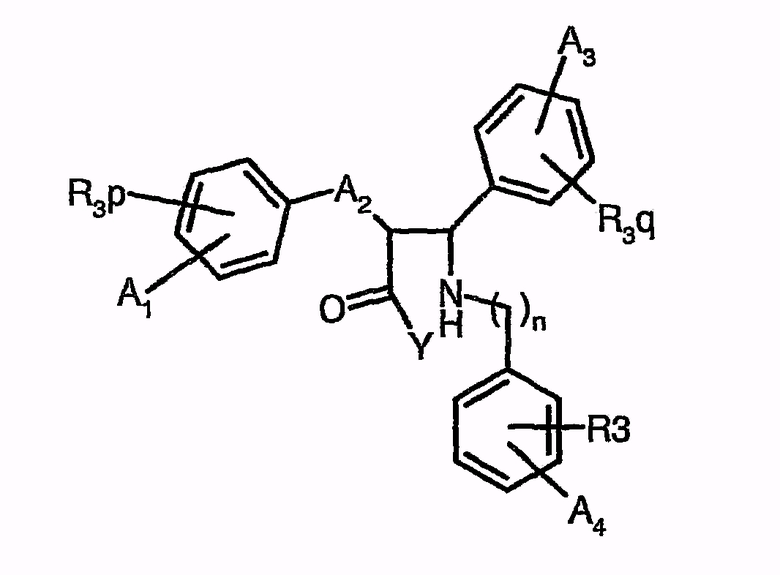
(A1, A3 и A4 означают, например, H, галоген, C1-C5-алкил; A2 означает, например, C1-C5-алкиленовую цепь или C1-C5-алкениленовую цепь; R3 означает, например, OH, OC(O)-R1 с R1, например, H или (C1-C5)алкил; n, p, q, r или равны нулю или кратны 1 или 2; Y является оптически активным производным сультама)
с TBAF и агентом силилирования.
Из-за ядовитости и большого ущерба TBAF для водных источников этот способ также невыгоден.
Задачей изобретения является выявить другой вариант синтеза вышеуказанных соединений, который может быть осуществлен также с высокой стереоспецифичностью и высоким выходом и который нуждается в таких вспомогательных реагентах, которые по возможности являются малотоксичными. Имея в виду применение в промышленном процессе, должно быть также возможным осуществление с каталитическими количествами агентов циклизации.
Поэтому одним решением является способ получения производных 1,4-дифенилазетидинона из подходящим образом защищенных β-замещенных аминоамидов в присутствии агента силилирования и по меньшей мере одного катализатора циклизации, причем этот катализатор циклизации как катион может быть представлен одной из нижеследующих общих формул
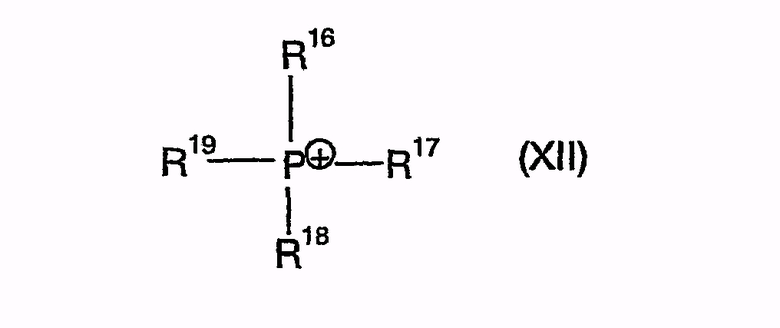
причем R16, R17, R18, R19 независимо друг от друга означают арил, (C1-C15)алкил, бензил,
R41 означает арил, (C1-C15)алкил, бензил,
R42 означает (C1-C15)алкил, бензил, (C5-C8)циклоалкил, арил, причем арил может быть замещен F, Cl, Br, I, -OH, -O(C1-C3)алкилом, -NH2, -NH(C1-C3)алкилом, -N[(C1-C3)алкил]2, -C(O)OH, -C(O)O(C1-C3)алкилом, -C(O)NH2, -C(O)NH(C1-C3)алкилом, -C(O)N[(C1-C3)алкил]2, -SO2NH2, -SO2NH(C1-C3)алкилом, -SO2N[(C1-C3)алкил]2, -CN, (C1-C12)алкилом и (C5-C8)циклоалкилом,
и как анион
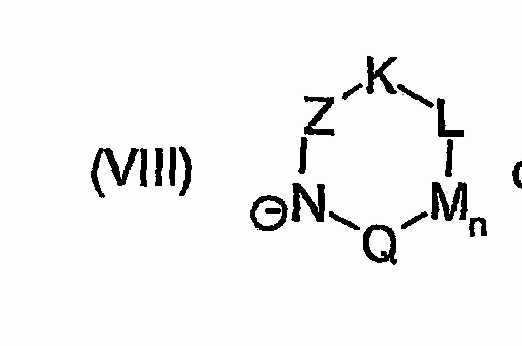 или
или 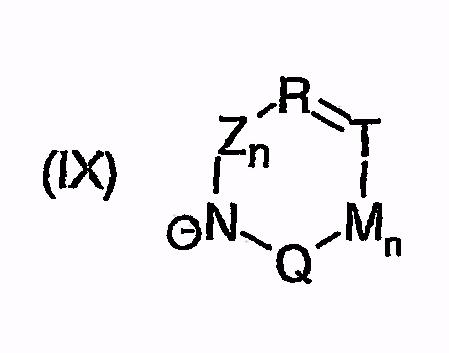 или
или 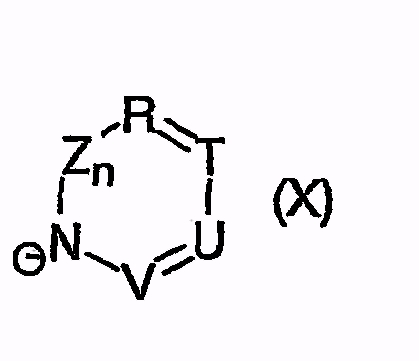
или
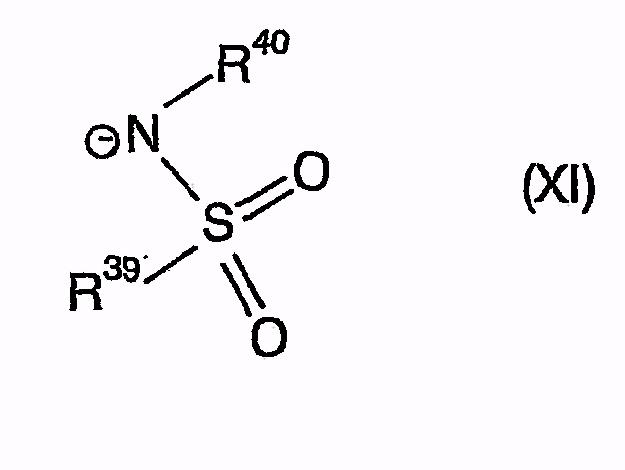
и символы, заместители и индексы имеют следующие значения:
причем остатки с R20 по R32 и с R34 по R38 независимо друг от друга означают H, (C1-C6)алкил, арил или гетероарил, и соответственно два алкильных остатка вместе могут образовывать циклоалкильный остаток с максимум 6 элементами C в цикле, который опять же может быть замещен
F, Cl, Br, I, CF3, NO2, COO(C1-C6)алкилом, CON[(C1-C6)алкил]2, циклоалкилом, (C1-C10)-алкилом, (C2-C6)алкенилом, O-(C1-C6)алкилом, O-CO-(C1-C6)алкилом, O-CO-(C1-C6)алкиленарилом, SO2N[(C1-C6)алкил]2, S-(C1-C6)алкилом, S-(CH2-)nарилом, SO-(C1-C6)алкилом, SO-(CH2-)nарилом, SO2-(C1-C6)алкилом, SO2-(CH2-)nарилом, SO2-N((C1-C6)-алкил)(CH2-)nарилом, или SO2-N((CH2-)nарил)2, причем n может быть равным от 0 до 6, и арильный остаток может быть до двух раз замещен F, Cl, Br, CF3, SF5, NO2, OCF3, O-(C1-C6)алкилом или (C1-C6)алкилом;
или N(C1-C6)алкил)2, NH-CO-NH-(C1-C6)алкилом, NH-CO-NH-арилом, N[(C1-C6)алкил]-CO-(C1-C6)алкилом, N[(C1-C6)алкил]-COO-(C1-C6)алкилом, N[(C1-C6)алкил]-CO-арилом, N[(C1-C6)алкил]-COO-арилом, N[(C1-C6)алкил]-CO-N((C1-C6)алкил)2, N[(C1-C6)алкил]-CO-N((C1-C6)алкил)-арилом, N[(C1-C6)алкил]-CO-N(арил)2, N(арил)-CO-(C1-C6)алкилом, N(арил)-COO-(C1-C6)алкилом, N(арил)-CO-арилом, N(арил)-COO-арилом, N(арил)-CO-N((C1-C6)алкил)2, N(арил)-CO-N[(C1-C6)алкил]-арилом, N(арил)-CO-N(арил)2, арилом, O-(CH2-)nарилом, причем n может быть равным от 0 до 6, причем арильный остаток может быть от одного до трех раз замещен F, Cl, Br, I, CF3, NO2, OCF3, O-(C1-C6)алкилом, (C1-C6)алкилом, N((C1-C6)алкил)2, SF5, SO2-CH3 или COO-(C1-C6)алкилом,
и причем R39 и R40 независимо друг от друга означают (C1-C6)алкил, причем один или несколько не соседних атомов C могут быть замещены NH или C=O, (C1-C6)перфторалкил, арил или гетероарил, или R39 и R40 вместе образуют 1,8-нафтил или 1,7,7-триметилбицикло[2.2.1]гептанил, R40 может также быть H,
или в этом катализаторе циклизации катион соответствует катиону общей формулы (XII), и анион является R41O-, или в этом катализаторе циклизации катион соответствует катиону общей формулы (XII), и анион является R42COO-, или в этом катализаторе циклизации катион соответствует катиону общей формулы (XII), и анион является Cl-, Br- или I,- и они скомбинированы с Ag2O.
При этом под арилом понимается ароматический углеводородный остаток, который содержит от 6 до 14 атомов C, например, фенильный, нафтильный, бифенильный, тетрагидронафтильный, альфа- или бета-тетралоновый, инданильный или индан-1-онильный остаток, и предпочтительно незамещен, но также может быть замещенным.
При этом типичными заместителями являются, например, F, Cl, Br, I, CF3, NO2, COO(C1-C6)алкил, CON[(C1-C6)алкил]2, циклоалкил, (C1-C10)алкил, (C2-C6)алкенил, O-(C1-C6)алкил, O-CO-(C1-C6)алкил, O-CO-(C1-C6)алкиленарил, SO2N[(C1-C6)алкил]2,
S-(C1-C6)алкил, S-(CH2-)nарил, SO-(C1-C6)алкил, SO-(CH2-)nарил, SO2-(C1-C6)алкил, SO2-(CH2-)nарил, SO2-N((C1-C6)алкил)(CH2-)nарил или SO2-N((CH2-)nарил)2, причем n может быть равным от 0 до 6 и арильный остаток может быть до двух раз замещен F, Cl, Br, CF3, SF5, NO2, OCF3, O-(C1-C6)алкилом или (C1-C6)-алкилом; а также N((C1-C6)алкил)2, NH-CO-NH-(C1-C6)алкил), NH-CO-NH-арил, N[(C1-C6)алкил]-CO-(C1-C6)алкил, N[(C1-C6)алкил]-COO-(C1-C6)алкил, N[(C1-C6)алкил]-CO-арил, N[(C1-C6)алкил]-COO-арил, N[(C1-C6)алкил]-CO-N((C1-C6)алкил)2, N[(C1-C6)алкил]-CO-N((C1-C6)алкил)-арил, N[(C1-C6)алкил]-CO-N(арил)2,
N(арил)-CO-(C1-C6)алкил, N(арил)-COO-(C1-C6)алкил, N(арил)-CO-арил, N(арил)-COO-арил, N(арил)-CO-N((C1-C6)алкил)2, N(арил)-CO-N[(C1-C6)алкил]-арил, N(арил)-CO-N(арил)2, арил, O-(CH2-)nарил, причем n может быть равным от 0 до 6, причем арильный остаток может быть от одного до трех раз замещен F, Cl, Br, I, CF3, NO2, OCF3, O-(C1-C6)алкилом, (C1-C6)алкилом, N((C1-C6)алкил)2, SF5, SO2-CH3 или COO-(C1-C6)алкилом.
Под гетероарилом при этом понимаются ароматические циклы и циклические системы, которые, помимо углерода, содержат также гетероатомы, такие как азот, кислород или сера. Кроме того, к этому определению относятся также циклические системы, в которых гетероциклический остаток конденсирован с бензольным ядром. Циклы предпочтительно являются 3-7-звенными.
Под алкильным остатком понимается линейная или разветвленная углеводородная цепь с одним или несколькими атомами углерода, предпочтительно с 1-8 атомами углерода, например метил, этил, пропил, бутил, гексил, изопропил, изобутил, неопентил, трет-бутил, гексил.
Под циклоалкильным остатком понимается остаток, который состоит из циклической системы, содержащей один или несколько циклов, которая является насыщенной или частично ненасыщенной (с одной или двумя двойными связями), которая образована исключительно из атомов углерода, например, циклопропил, циклопентил, циклопентинил, циклогексил или адамантил. Циклы предпочтительно являются 3-7-звенными. Возможными заместителями типично являются заместители, указанные выше.
Одна предпочтительная форма осуществления способа согласно изобретению исходит из известного способа получения производных 1,4-дифенилазетидинона общей формулы (I)
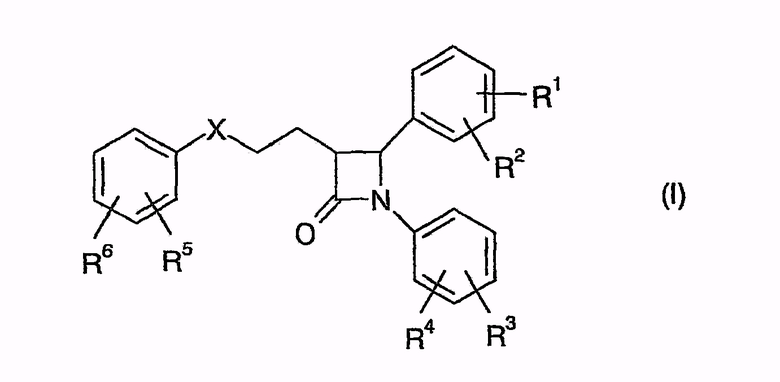
в которой символы, заместители и индексы имеют следующие значения:
в присутствии агента силилирования и катализатора циклизации.
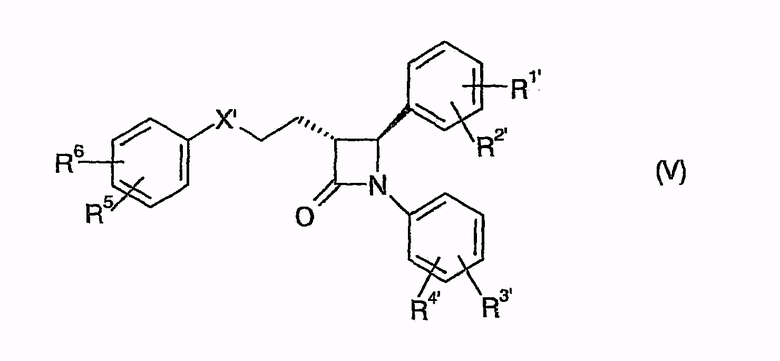
В этом случае способ согласно изобретению отличается тем, что соединения общей формулы (IV)
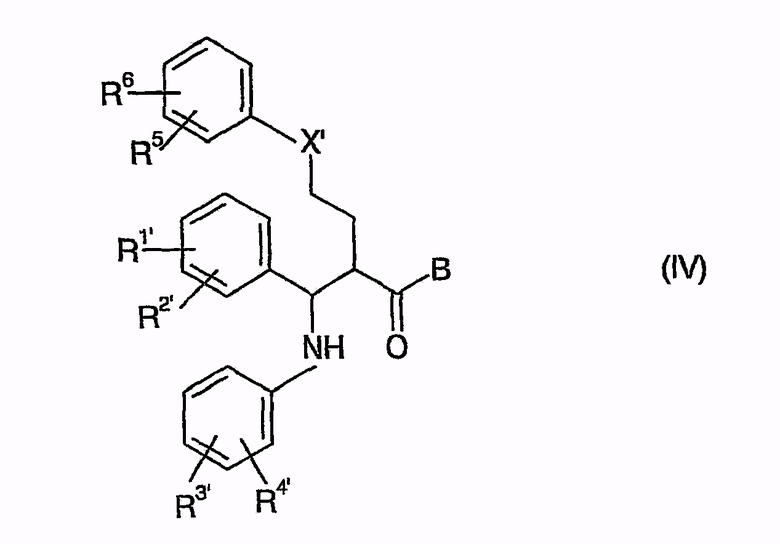
в которой, если не указано другое, символы, заместители и индексы имеют следующие значения:
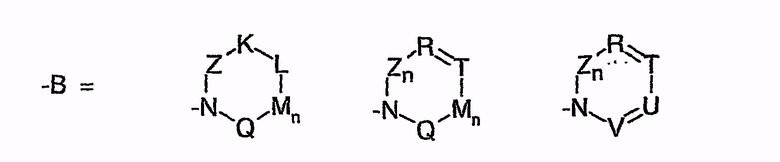
или
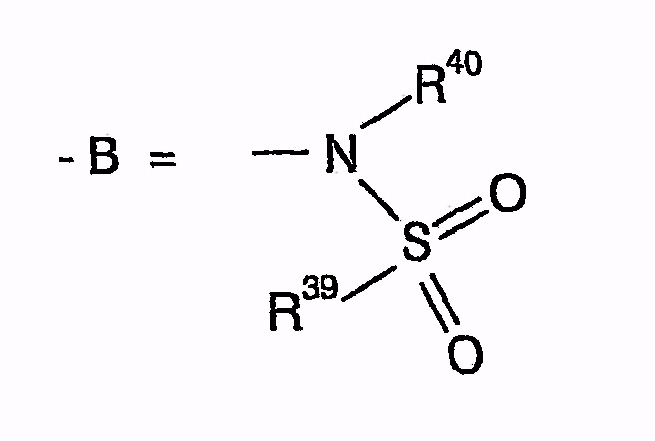
циклизуют с получением (фор)продуктов общей формулы (V)
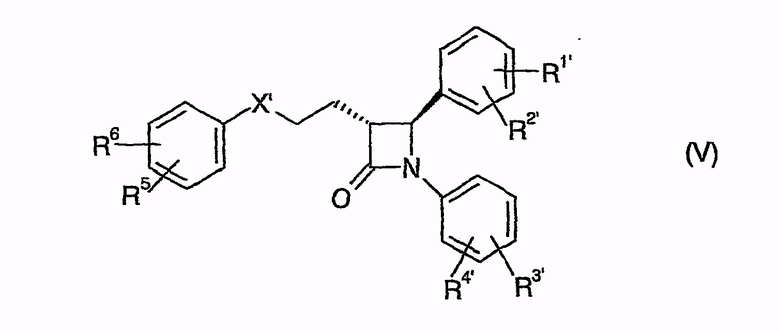
у которых для получения соединения (I) может быть удалена защита,
причем катализатор циклизации как катион представим одной из нижеследующих общих формул
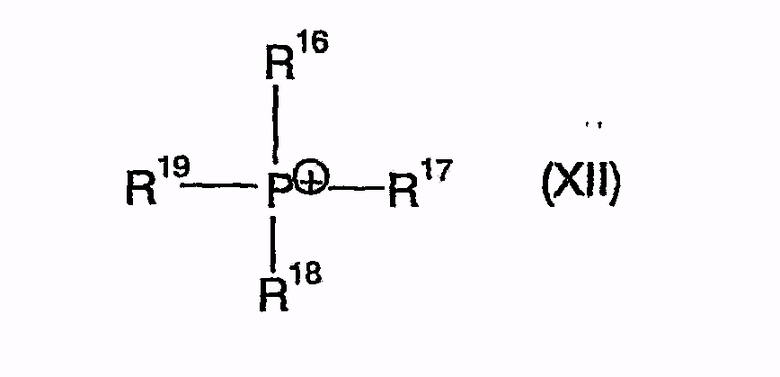
где R16, R17, R18, R19 независимо друг от друга означают арил, (C1-C15)алкил, в частности, (C1-C10)алкил, бензил, в частности бутил,
R41 означает арил, (C1-C15)алкил, в частности, (C1-C10) алкил, бензил,
R42 означает (C1-C15)алкил, в частности, (C1-C10)алкил, бензил, (C5-C8)циклоалкил, арил, причем арил может быть замещен F, Cl, Br, I, -OH, -O(C1-C3)алкилом, -NH2,
-NH(C1-C3)алкилом, -N[(C1-C3)алкил]2, -C(O)OH, -C(O)O(C1-C3)алкилом, -C(O)NH2, -C(O)NH(C1-C3)алкилом, -C(O)N[(C1-C3)алкил]2, -SO2NH2, -SO2NH(C1-C3)алкилом, -SO2N(C1-C3)алкил]2, -CN, (C1-C12)алкилом и (C5-C8)циклоалкилом,
и как анион
 или
или  или
или 
или

или причем в этом катализаторе циклизации катион соответствует катиону общей формулы (XII), и анион является R41O-, или в этом катализаторе циклизации катион соответствует катиону общей формулы (XII), и анион означает R42COO-, или в этом катализаторе циклизации катион соответствует катиону общей формулы (XII), и анион является Cl-, Br- или I-, и они скомбинированы с Ag2O.
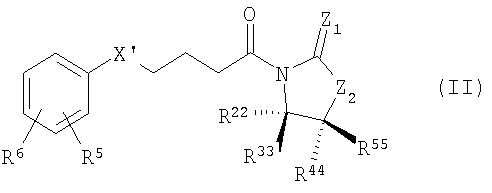
В одной особенно предпочтительной форме осуществления способ согласно изобретению отличается тем, что соединения общей формулы (II)
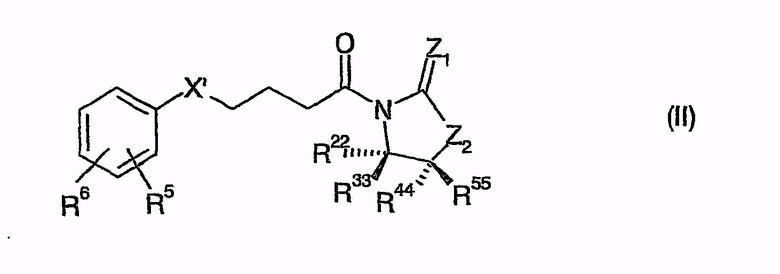
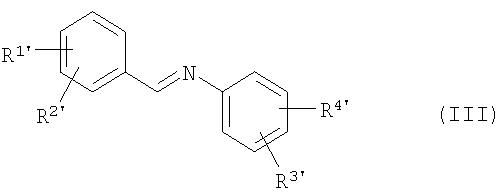
приводят во взаимодействие с иминами общей формулы (III)
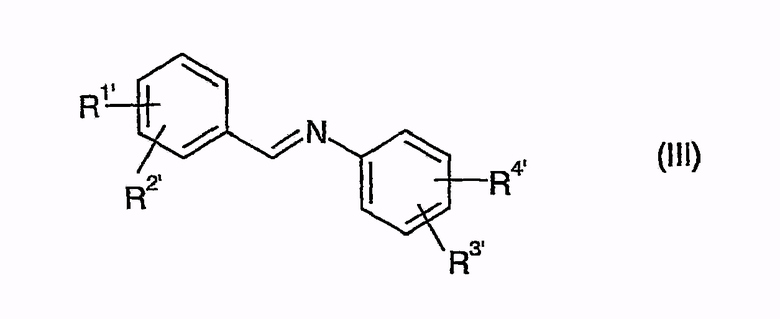
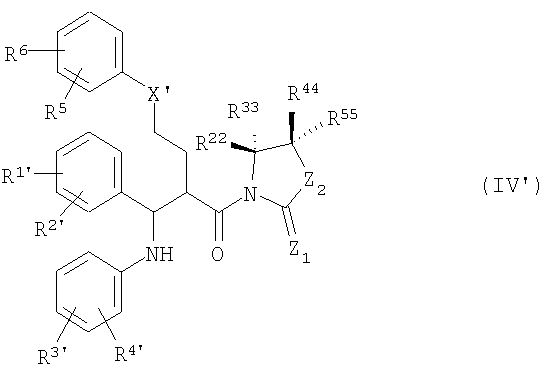
с образованием промежуточных соединений общей формулы (IV')
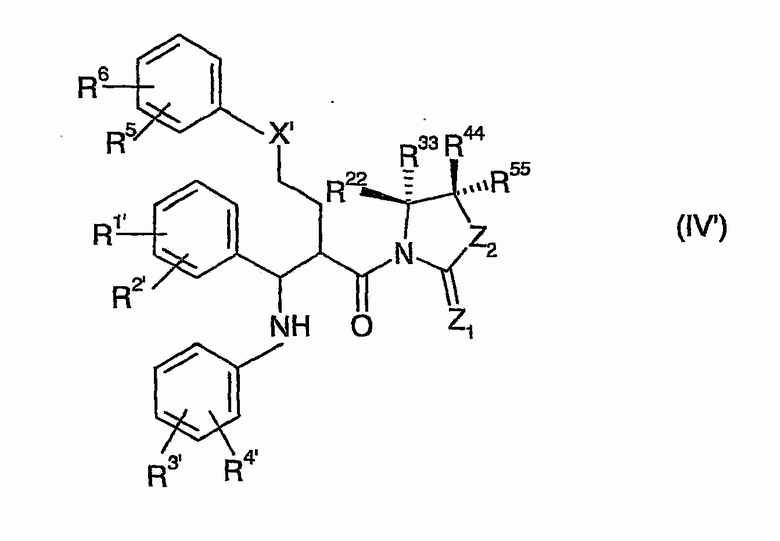
которые затем циклизуют в (фор)продукты общей формулы (V)
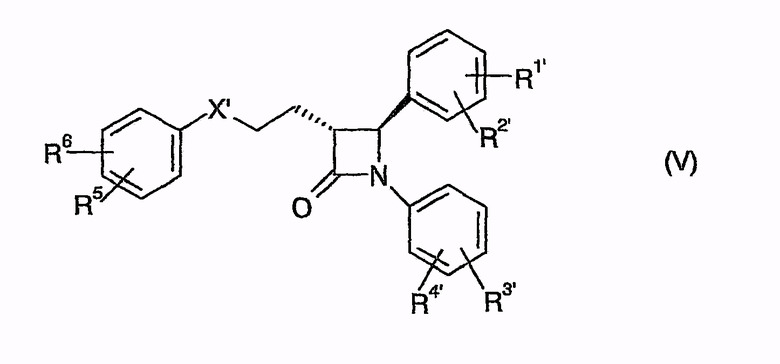
у которых для превращения в соединение (I) может быть удалена защита,
в которой, если не определено другое, символы, заместители и индексы имеют следующие значения:
CH2N[Si(алкил)o(арил)p] CO2CH2(C6H5),
CH2NHCO2-tBu, CH2N[Si(алкил)o(фенил)p]CO2-tBu,
CH2NHC(C6H5)3, CH2N=C(C6H5)2 или CH2N=CH[C6H4(R6)
причем катализатор циклизации представим общими формулами с (VIa) по (VII)
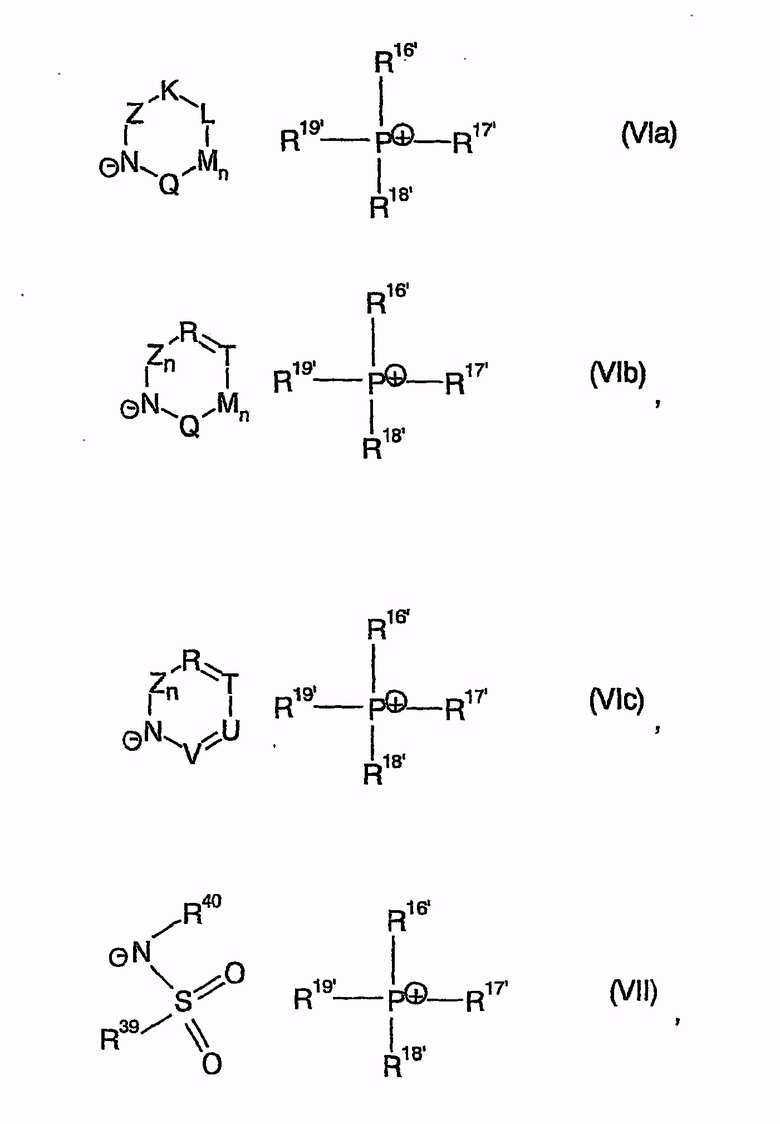
причем R16', R17', R18', R19' независимо друг от друга являются арилом, (C1-C15)алкилом.
В одной другой, особенно предпочтительной форме осуществления способ согласно изобретению отличается тем, что соединения общей формулы (II)
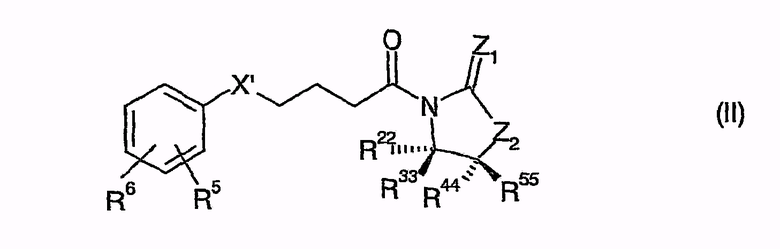
приводят во взаимодействие с иминами общей формулы (III)

с образованием промежуточных соединений общей формулы (IV')

которые затем циклизуют в (фор)продукты общей формулы (V), у которых для получения соединения (I) может быть удалена защита,
в которой, если не определено другое, символы, заместители и индексы имеют следующие значения:
CH2N[Si(алкил)o(арил)p]CO2CH2(C6H5),
CH2NHCO2-tBu, CH2N[Si(алкил)o(фенил)p]CO2-tBu,
CH2NHC(C6H5)3, CH2N=C(C6H5)2 или
CH2N=CH[C6H4(R6)],
причем в катализаторе циклизации катион соответствует катиону общей формулы (XII), и анион является R41O-.
В одной другой, особенно предпочтительной форме осуществления способ согласно изобретению отличается тем, что соединения общей формулы (II)

приводят во взаимодействие с иминами общей формулы (III)

с образованием промежуточных соединений общей формулы (IV'),

которые затем циклизуют в (фор)продукты общей формулы (V), у которых для получения соединения (I) может быть удалена защита,

в которой, если не определено другое, символы, заместители и индексы имеют следующие значения:
CH2NHCO2-tBu, CH2N[Si(алкил)о(фенил)p]CO2-tBu,
CH2NHC(C6H5)3, CH2N=C(C6H5)2 или
CH2N=CH[C6H4(R6)],
причем в катализаторе циклизации катион соответствует катиону общей формуле (XII), и анион является R42COO-.
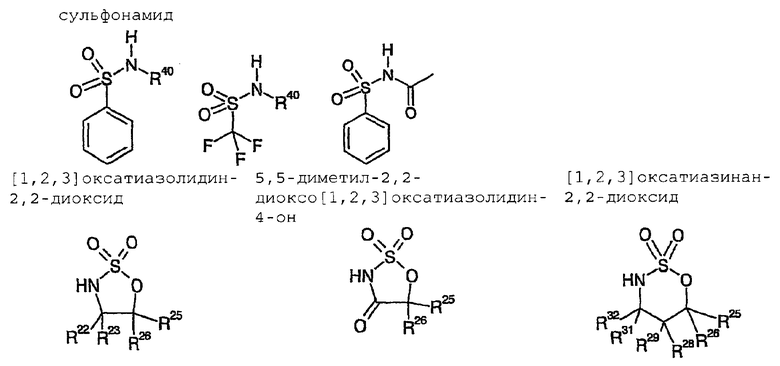
Особенно предпочтительными являются катализаторы циклизации с анионом, который выводится из:
оксазолидин-2-она
4-бензилоксазолидин-2-она
4-фенилоксазолидин-2-она
4-изопропилоксазолидин-2-она
4-трет-бутилоксазолидин-2-она
4-изопропил-5,5-диметилоксазолидин-2-она
4-бензил-5,5-диметилоксазолидин-2-она
4-фенил-5,5-диметилоксазолидин-2-она
4-изопропил-5,5-диметилоксазолидин-2-она
4-трет-бутил-5,5-диметилоксазолидин-2-она
4-метил-5-фенилоксазолидин-2-она
цис-4,5-дифенилоксазолидин-2-она
4-изопропил-5,5-дифенилоксазолидин-2-она
1-метил-4-метилен-имидазолидин-2-она
имидазола
фталимида
2,10-камфаросультама
1-фенил-3-пиразолидинона,
или является алкоксидом,
или является карбоксилатом,
в комбинации с тетраэтилфосфонием, тетрабутилфосфонием или тетраоктилфосфонием в качестве катиона.
Соединения дифенилазетидинона, которые могут быть получены согласно изобретению, на практике часто применяют в качестве фармацевтически приемлемой соли, так как они из-за своей высокой, по сравнению с исходными или базисными соединениями, водорастворимости особенно хорошо подходят для медицинских приложений. Эти соли должны содержать фармацевтически приемлемый анион или катион. Подходящими фармацевтически приемлемыми кислотно-аддитивными солями соединений, которые могут быть получены согласно изобретению, являются соли неорганических кислот, как соляная кислота, бромистоводородная, фосфорная, метафосфорная, азотная, сульфоновая и серная кислота, а также органических кислот, как, например, уксусная кислота, бензолсульфоновая, бензойная, лимонная, этансульфоновая, фумаровая, глюконовая, гликолевая, изотионовая, молочная, лактобионовая, малеиновая, яблочная, метансульфоновая, янтарная, п-толуолсульфоновая, винная и трифторуксусная кислота. Для медицинских целей особенно предпочтительным образом применяется поваренная соль. Подходящими фармацевтически приемлемыми основными солями являются соли аммония, соли щелочных металлов (как соли натрия и калия) и соли щелочноземельных металлов (как соли магния и кальция).
Соединения общей формулы (I) и их фармацевтически приемлемые соли и физиологически действующие производные представляют собой идеальное лекарственное средство для лечения нарушений жирового обмена, в частности, гиперлипидемии. Соединения общей формулы (I) подходят также для влияния на уровень холестерина в сыворотке, а также для профилактики и лечения проявлений артериосклероза.
Касательно других деталей самих соединений и их обработки, комбинаций с другими активными веществами и т.д. приводится прямо выраженная ссылка на документ WO 02/50027.
В нижеследующей таблице приведены типичные примеры для остатка -B общей формулы (IV), или в форме аниона для общих формул с (VIII) по (XI), причем в каждом случае в таблицах "H" на "HN" в кольце или на молекуле является лишним, чтобы получить остаток -B или соответствующий ему анион BΘ.
Примерами для H-B, соответственно H⊕BBΘ в общих формулах (II), (IV) и с (VIII) по (XI) являются
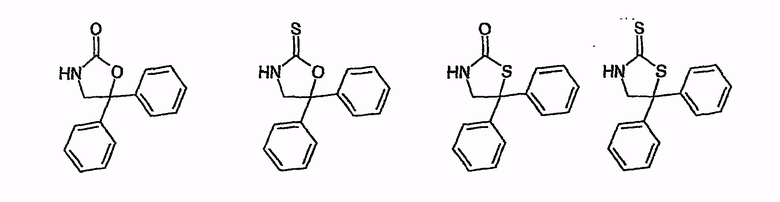
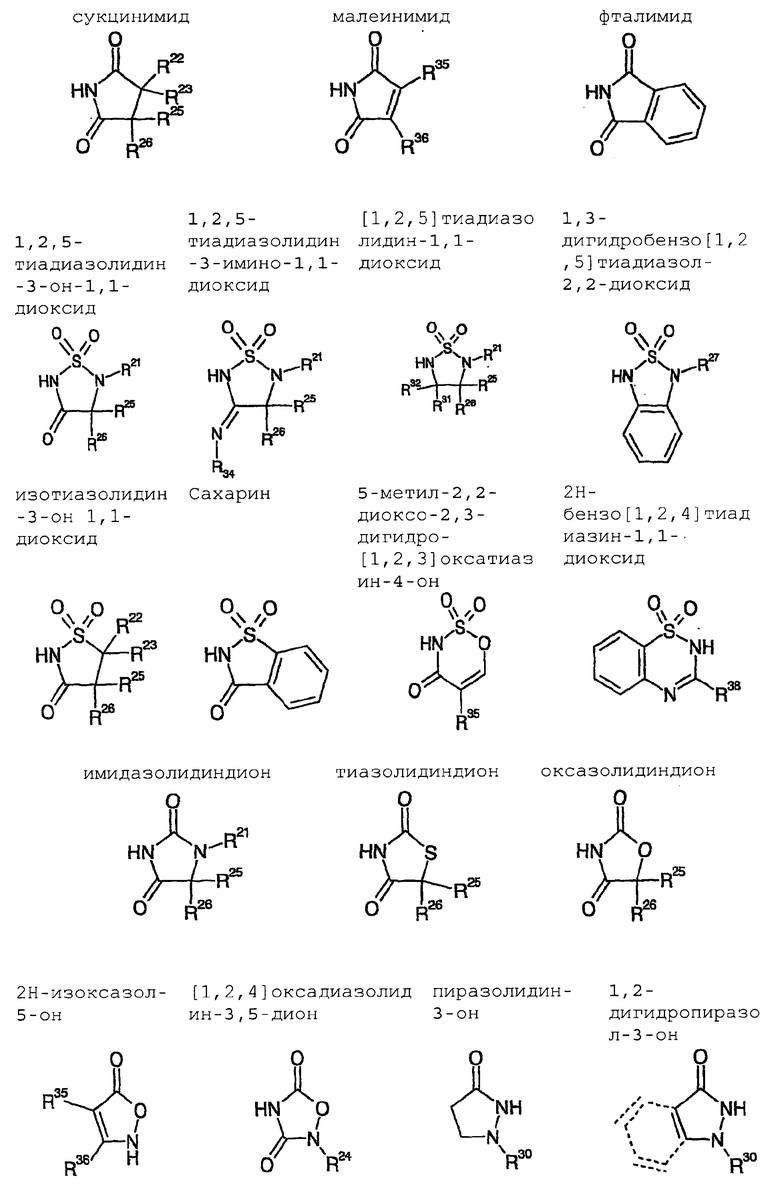
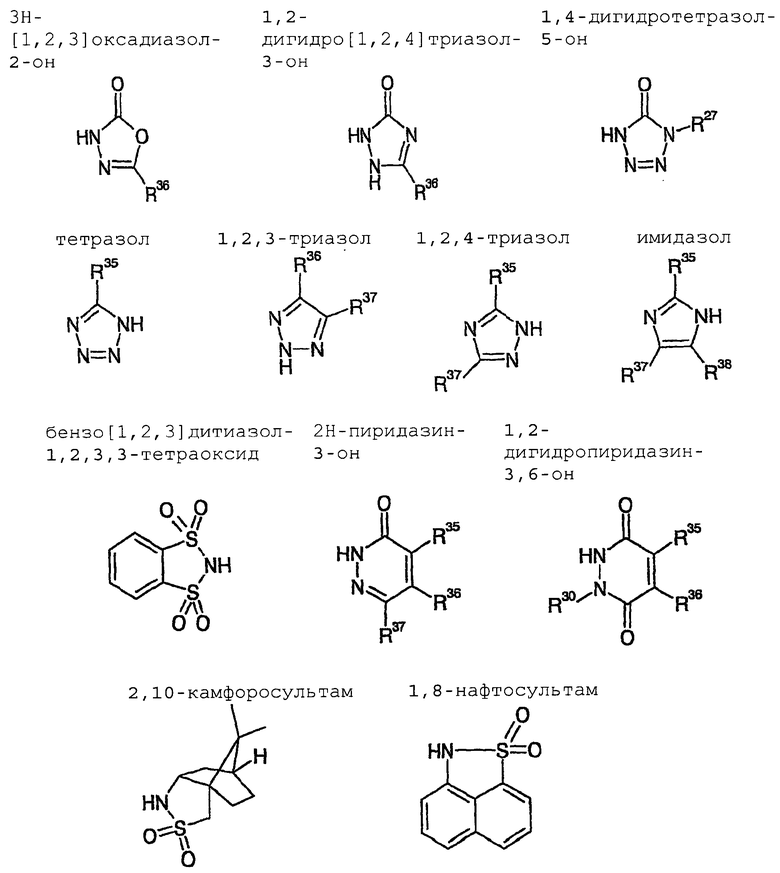
Описанные в начале азетидиноны общей формулы (V) получают, в частности, тем, что соединения общей формулы (IV) суспендируют в органическом растворителе, как, например, гексан, гептан, толуол, хлорбензол, диизопропиловый эфир, этилацетат, диметоксиэтан, дихлорметан или трет-бутилметиловый эфир, но предпочтительно в толуоле, диизопропиловом эфире или трет-бутилметиловом эфире и затем смешивают с мягким агентом силилирования, как, например, 2-6 эквивалентами N,O-бистриметилсилилацетамида, предпочтительно 4-6 эквивалентами, особенно предпочтительно 5-7 эквивалентами и с каталитическим количеством 1-25 мол.%, предпочтительно 5-15 мол.%, особенно предпочтительно 5 мол.% одного из вышеописанных катализаторов. Последовательность добавления реагентов не играет никакой роли. Смесь нагревают до температуры от 20°C до 100°C, предпочтительно от 40°C до 60°C, и перемешивают примерно от 1 до 20 часов, предпочтительно 6 часов, или до тех пор, пока превращение не пройдет полностью. Затем соединения общей формулы (V) выделяют обычными способами экстракции.
Если соединения общей формулы (V) дополнительно преобразуют, кроме того, в соединения общей формулы (I), в которой означают R1, R3=H и R2, R4=CH2NHR7 (R # H), то амины общей формулы (V), то есть такие соединения, в которых R2', R4' означают R2, R4 после удаления защиты, а именно CH2NHR7 с R=H, приводят во взаимодействие (с образованием пептидной связи) с соединениями нижеследующих общих формул (XIII) или (XIV)
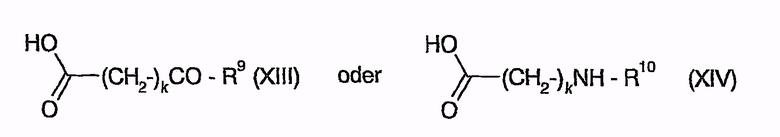 или
или 
с образованием желаемых соединений после предшествующего удаления защитных групп. Другие соединения общей формулы (I) образуются путем простого удаления защиты у соответствующих соединений общей формулы (V) без дополнительных реакций.
Для подробного описания условий процесса заявитель ссылается на нижеследующие примеры и цитированные в описании уровня техники документы, это относится и к обычно применяемым агентам силилирования.
Изобретение поясняется более подробно нижеследующими примерами.
Примеры
Пример 1
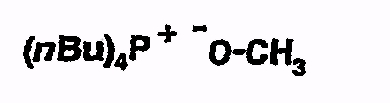
Тетрабутилфосфонийметоксид
При комнатной температуре и в атмосфере аргона метоксилат калия (475,5 мг) суспендируют в метаноле (7 мл). К этому добавляют метанольный раствор (3 мл) тетрабутилфосфонийхлорида (2 г). Перемешивают 2 часа при комнатной температуре, фильтруют под аргоном через шприцевой фильтр и растворитель удаляют. Остаток взвешивают и вводят в тетрагидрофуран (ТГФ)(5 мл). Получают 1,35-мольный раствор тетрабутилфосфонийметоксида.
Пример 2
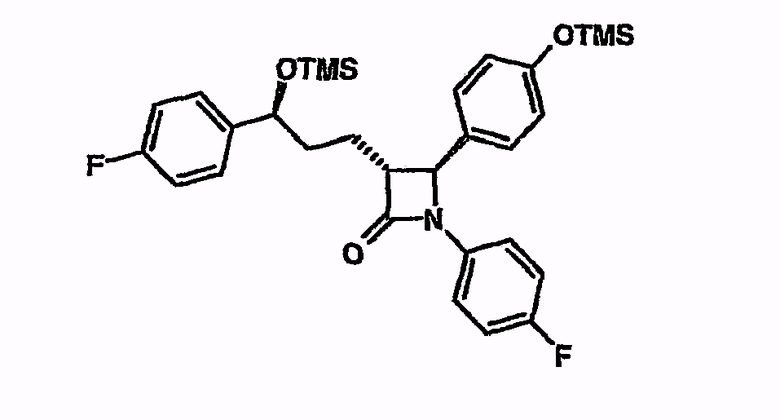
Циклизация 3-[5-(4-фторфенил)-2-[(4-фторфениламино)-(4-триметилсиланилоксифенил)метил]-5-триметилсиланилоксипентаноил]-4-фенилоксазолидин-2-она с соединением из примера 1
3-{5-(4-фторфенил)-2-[(4-фторфениламино)-(4-триметилсиланилоксифенил)метил]-5-триметилсиланилоксипентаноил}-4-фенилоксазолидин-2-он (10 мг) в атмосфере аргона и при охлаждении льдом суспендируют в метил-трет-бутиловом эфире (МТБЭ) (1 мл). Добавляют N,O-бистриметилсилилацетамид (20,75 мкл), затем тетрабутилфосфонийметоксид (20,65 мкл; 1,35 М в ТГФ). Перемешивают в течение одного часа при комнатной температуре. С помощью тонкослойной хроматографии и сопоставления ЖХ/МС (жидкостная хроматография/масс спектрометрия) было установлено превращение в 1-(4-фторфенил)-3-[3-(4-фторфенил)-3-триметилсиланилоксипропил]-4-(4-триметилсиланилоксифенил)азетидин-2-он (M+H, -TMS, -HOTMS: 392).
Пример 3
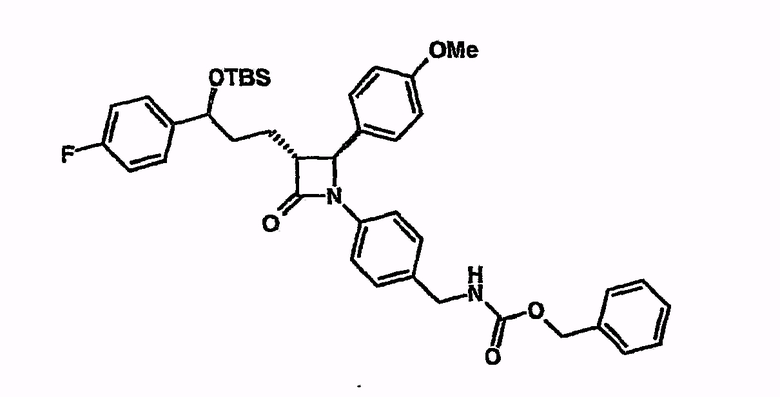
Циклизация бензилового эфира (4-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил)карбамиловой кислоты с соединением из примера 1
При охлаждении льдом и в атмосфере аргона бензиловый эфир {4-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил}карбамиловой кислоты (10 мг) суспендируют в МТБЭ (1 мл). Добавляют N,O-бистриметилсилилацетамид (17,5 мкл), затем тетрабутилфосфонийметоксид (23,6 мкл; 1 М в ТГФ). Перемешивают в течение двух часов при комнатной температуре. Реакцию останавливают водой и водную фазу экстрагируют этилацетатом. С помощью тонкослойной хроматографии и сопоставления ЖХ/МС было установлено превращение в бензиловый эфир {4-[3-[3-(трет-бутилдиметилсиланилокси)-3-(4-фторфенил)пропил]-2-(4-метоксифенил)-4-оксоазетидин-1-ил]бензил}карбамиловой кислоты.
1H-ЯМР (d6-ДМСО) - 0,18 (с, 3H), 0,02 (с, 3H), 0,85 (с, 9H), 1,75 (шир.с, 4H), 3,05 (шир.с, 1H), 3,7 (с, 3H), 4,1 (д, 2H), 4,72 (м, 1H), 4,82 (с, 1H), 5,0 (с, 2H), 6,9 (д, 2H), 7,12 (м, 5H), 7,35 (м, 10H), 7,73 (т, 1H).
Пример 4
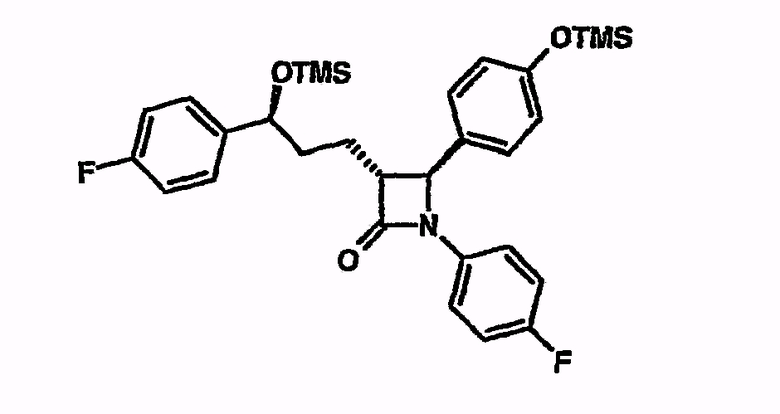
Циклизация 3-{5-(4-фторфенил)-2-[(4-фторфениламино)-(4-триметилсиланилоксифенил)метил]-5-триметилсиланилоксипентаноил}-4-фенилоксазолидин-2-она с тетрабутилфосфонийхлоридом и оксидом серебра(I)
3-{5-(4-фторфенил)-2-[(4-фторфениламино)-(4-триметилсиланилоксифенил)метил]-5-триметилсиланилоксипентаноил}-4-фенилоксазолидин-2-он (10 мг) в атмосфере аргона и при охлаждении льдом суспендируют в МТБЭ (1 мл). Добавляют N,O-бистриметилсилилацетамид (20,75 мкл), затем тетрабутилфосфонийхлорид (4,2 мг) и оксид серебра(I) (3,2 мг). Перемешивают при комнатной температуре. С помощью тонкослойной хроматографии и сопоставления ЖХ/МС было установлено превращение в 1-(4-фторфенил)-3-[3-(4-фторфенил)-3-триметилсиланилоксипропил]-4-(4-триметилсиланилоксифенил)азетидин-2-он (M+H, -TMS, -HOTMS: 392).
Пример 5

Тетрабутилфосфонийоксазолидин-2-он
Тетрабутилфосфонийхлорид (300 мг) растворяют в метаноле (3 мл) и добавляют оксид серебра(I) (203,85 мг). Перемешивают 16 часов в атмосфере аргона при комнатной температуре. Реакционный раствор фильтруют через шприцевой фильтр. К фильтрату добавляют оксазолидин-2-он (104,4 мг) и перемешивают 2 часа при комнатной температуре. Растворитель удаляют на роторном испарителе. Получают тетрабутилфосфонийоксазолидин-2-он (200 мг) в виде бесцветного масла. 1H-ЯМР (d6-ДМСО) 0,9 (м, 12H), 1,4 (м, 16H), 2,2 (м, 8H), 3,4 (т, 2H), 3,85 (т, 2H).
Пример 6
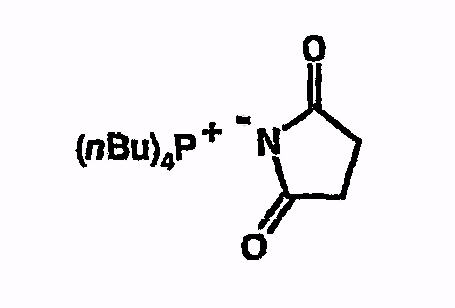
Тетрабутилфосфонийсукциниид
Соединение получают из сукцинимида аналогично указаниям в примере 5. 1H-ЯМР (d8-ТГФ) 0,95 (м, 12H), 1,4-1,6 (м, 16H), 2,3 (с, 4H), 2,55 (м, 8H).
Пример 7
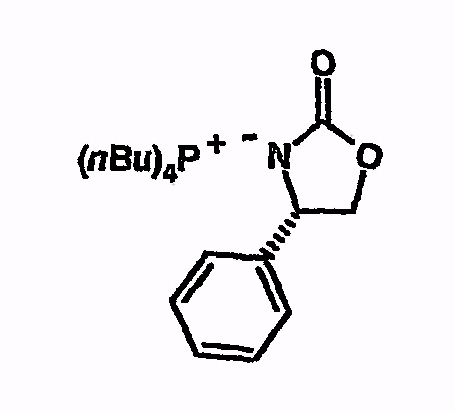
Тетрабутилфосфоний-4-фенилоксазолидин-2-он
Соединение получают из 4-фенилоксазолидин-2-она аналогично указаниям в примере 5. 1H-ЯМР (d6-ДМСО) 0,9 (м, 12H), 1,4 (м, 16H), 2,2 (м, 8H), 3,6 (т, 1H), 4,35 (т, 1H), 4,75 (м, 1H), 7,2-7,3 (м, 5H).
Пример 8
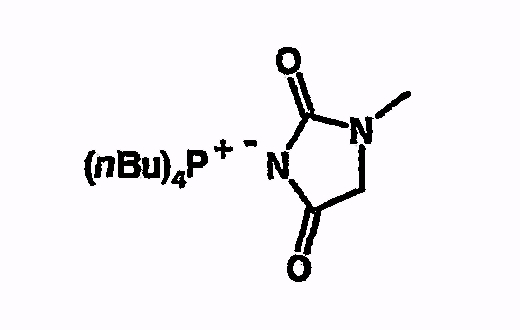
Тетрабутилфосфоний-1-метилимидазолидин-2,4-дион
Соединение получают из 1-метилимидазолидин-2,4-диона аналогично указаниям в примере 5. 1H-ЯМР (d6-ДМСО) 0,9 (м, 12H), 1,44 (м, 16H), 2,15 (м, 8H), 2,65 (с, 3H), 3,13 (с, 2H).
Пример 9
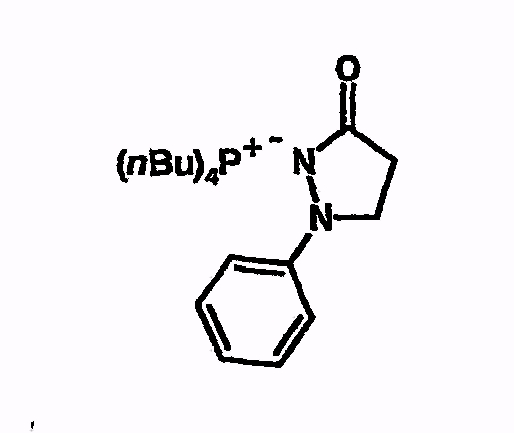
Тетрабутилфосфоний-1-фенилпиразолидин-3-он
Соединение получают из 1-фенилпиразолидин-3-она аналогично указаниям в примере 5. 1H-ЯМР (d6-ДМСО) 0,9 (т, 12H), 1,4 (м, 17H), 1,55 (м, 1H), 2,2 (м, 8H), 5,5 (шир.с, 1H), 6,95 (т, 1H), 7,28 (т, 2H), 7,53 (д, 2H), 7,9 (с, 1H).
Пример 10
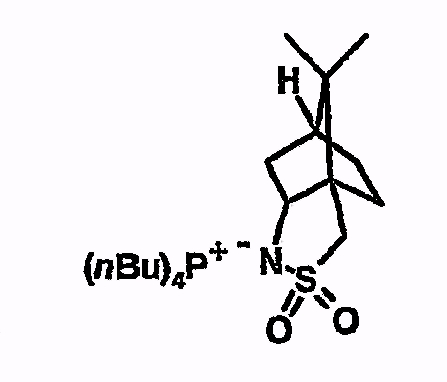
Тетрабутилфосфоний-10,10-диметил-3-тиа-4-аза-трицикло[5.2.1.01,5]декан-3,3-диоксид
Соединение получают из 2,10-камфаросультама аналогично указаниям в примере 5. 1H-ЯМР (d6-ДМСО) 0,75 (с, 3H), 0,9 (т, 12H), 1,0 (с, 3H), 1,1-1,25 (м, 2H), 1,4 (м, 16H), 1,5-1,8 (м, 4H), 2,2 (м, 8H), 2,5 (м, 2H), 3,05 (м, 1H), 3,15 (д, 1H).
Пример 11
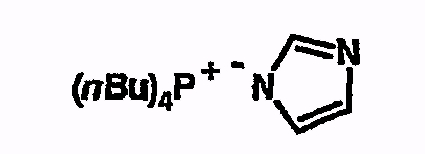
Тетрабутилфосфонийимидазолид
Соединение получают из имидазола аналогично указаниям в примере 5. 1H-ЯМР (d6-ДМСО) 0,9 (т, 12H), 1,4 (м, 16H), 2,2 (м, 8H), 6,7 (с, 2H), 7,15 (с, 1H).
Пример 12
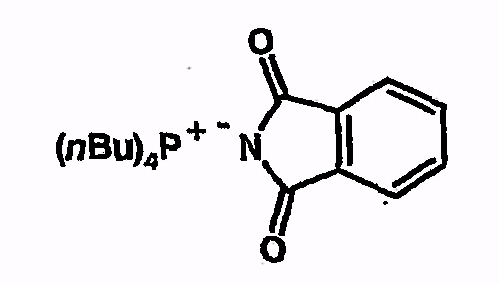
Тетрабутилфосфонийфталимид
Соединение получают из фталимида аналогично указаниям в примере 5. 1H-ЯМР (d6-ДМСО) 0,9 (т, 12H), 1,4 (м, 16H), 2,2 (м, 8H), 7,38 (м, 2H), 7,42 (м, 2H).
Пример 13
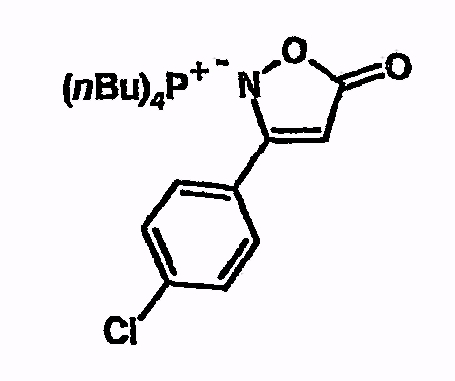
Тетрабутилфосфоний-3-(4-хлорфенил)-2H-изоксазол-5-он
Соединение получают из 3-(4-хлорфенил)-2H-изоксазол-5-она аналогично указаниям в примере 5. 1H-ЯМР (d6-ДМСО) 0,9 (т, 12H), 1,4 (м, 16H), 2,2 (м, 8H), 4,3 (шир.с, 1H), 7,35 (м, 2H), 7,55 (м, 2H).
Пример 14

Циклизация 3-{5-(4-фторфенил)-2-[(4-фторфениламино)-(4-триметилсиланилоксифенил)метил]-5-триметилсиланилоксипентаноил}-4-фенилоксазолидин-2-она с соединением из примера 5
3-{5-(4-фторфенил)-2-[(4-фторфениламино)-(4-триметилсиланилоксифенил)метил]-5-триметилсиланилоксипентаноил}-4-фенилоксазолидин-2-он (10 мг) в атмосфере аргона и при охлаждении льдом суспендируют в МТБЭ (1 мл). Добавляют N,O-бистриметилсилилацетамид (20,75 мкл), затем - каталитическое количество тетрабутилфосфонийоксазолидин-2-она (3 мг), растворенного в МТБЭ (100 мкл). Перемешивают 1 час при комнатной температуре. С помощью тонкослойной хроматографии и сопоставления ЖХ/МС было установлено превращение в 1-(4-фторфенил)-3-[3-(4-фторфенил)-3-триметилсиланилоксипропил]-4-(4-триметилсиланилоксифенил)азетидин-2-он (M+H, -TMS, -HOTMS: 392).
Пример 15
Циклизацию 3-{5-(4-фторфенил)-2-[(4-фторфениламино)-(4-триметилсиланилоксифенил)метил]-5-триметилсиланилоксипентаноил}-4-фенилоксазолидин-2-она в 1-(4-фторфенил)-3-[3-(4-фторфенил)-3-триметилсиланилоксипропил]-4-(4-триметилсиланилоксифенил)азетидин-2-она проводят аналогично тому, как указано в примере 14, но с тетрабутилфосфонийсукцинимидом из примера 6 в качестве катализатора циклизации. Данные спектроскопии совпадают с данными для продукта из примера 10 (M+H, -TMS, -HOTMS: 392).
Пример 16
Циклизацию 3-{5-(4-фторфенил)-2-[(4-фторфениламино)-(4-триметилсиланилоксифенил)метил]-5-триметилсиланилоксипентаноил}-4-фенилоксазолидин-2-она в 1-(4-фторфенил)-3-[3-(4-фторфенил)-3-триметилсиланилоксипропил]-4-(4-триметилсиланилоксифенил)азетидин-2-он проводят аналогично тому, как указано в примере 14, но с тетрабутилфосфоний-4-фенилоксазолидин-2-оном из примера 7 в качестве катализатора циклизации. Данные спектроскопии совпадают с данными для продукта из примера 10 (M+H, -TMS, -HOTMS: 392).
Пример 17
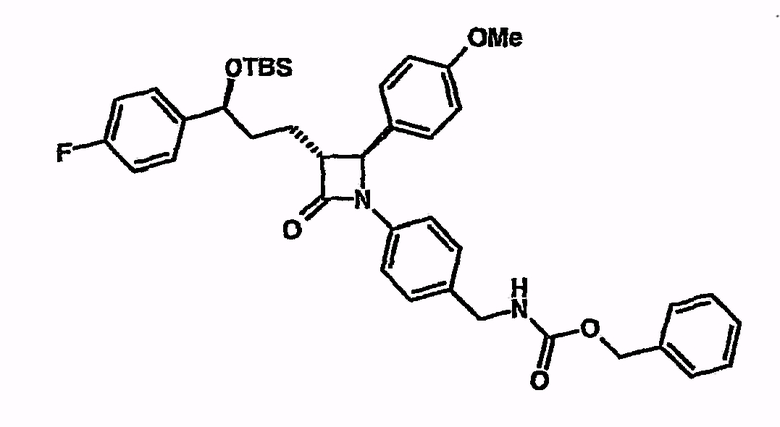
Циклизация бензилового эфира {4-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил}карбамиловой кислоты с соединением из примера 5
При охлаждении льдом и в атмосфере аргона бензиловый эфир {4-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил}карбамиловой кислоты (500 мг) суспендируют в МТБЭ (6 мл). Добавляют N,O-бистриметилсилилацетамид (1,0 мл), затем тетрабутилфосфонийоксазолидин-2-он (40,8 мг), растворенный в МТБЭ (1 мл). Перемешивают два часа при комнатной температуре. Затем добавляют 1н. водный раствор гидрохлорида (HCl(aq)) (1 мл), при охлаждении льдом - метанол (1 мл) и тетрагидрофуран (2 мл). Перемешивают в течение ночи при комнатной температуре. Реакционный раствор концентрируют и вводят в этилацетат. Органическую фазу последовательно промывают 2 н. раствором HCl(aq), насыщенным раствором бикарбоната натрия и насыщенным раствором поваренной соли. Затем сушат над сульфатом натрия, фильтруют и растворитель удаляют на роторном испарителе. После очистки хроматографией (1:6 этилацетат/н-гептан) через колонку с SiO2 (5 г) получают бензиловый эфир {4-[3-[3-(трет-бутилдиметилсиланилокси)-3-(4-фторфенил)пропил]-2-(4-метоксифенил)-4-оксоазетидин-1-ил]бензил}карбамиловой кислоты (240 мг). 1H-ЯМР (d6-ДМСО) - 0,18 (с, 3H), 0,02 (с, 3H), 0,85 (с, 9H), 1,75 (шир.с, 4H), 3,05 (шир.с, 1H), 3,7 (с, 3H), 4,1 (д, 2H), 4,72 (м, 1H), 4,82 (с, 1H), 5,0 (с, 2H), 6,9 (д, 2H), 7,12 (м, 5H), 7,35 (м, 10H), 7,73 (т, 1H).
Пример 18
Циклизацию бензилового эфира {4-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил}карбамиловой кислоты в бензиловый эфир {4-[3-[3-(трет-бутилдиметилсиланилокси)-3-(4-фторфенил)пропил]-2-(4-метоксифенил)-4-оксоазетидин-1-ил]бензил}карбамиловой кислоты проводят аналогично тому, как указано в примере 17, но с тетрабутилфосфоний-1-метилимидазолидин-2,4-дионом из примера 8 в качестве катализатора циклизации. Данные спектроскопии совпадают с данными для продукта из примера 17: 1Н-ЯМР (d6-ДМСО) - 0,18 (с, 3H), 0,02 (с, 3H), 0,85 (с, 9H), 1,75 (шир.с, 4H), 3,05 (шир.с, 1H), 3,7 (с, 3H), 4,1 (д, 2H), 4,72 (м, 1H), 4,82 (с, 1H), 5,0 (с, 2H), 6,9 (д, 2H), 7,12 (м, 5H), 7,35 (м, 10H), 7,73 (т, 1H).
Пример 19
Циклизацию бензилового эфира {4-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил}карбамиловой кислоты в бензиловый эфир {4-[3-(3-(трет-бутилдиметилсиланилокси)-3-(4-фторфенил)пропил]-2-(4-метоксифенил)-4-оксоазетидин-1-ил]бензил}карбамиловой кислоты проводят аналогично тому, как указано в примере 17, но с тетрабутилфосфоний-1-фенилпиразолидин-3-оном из примера 9 в качестве катализатора циклизации. Данные спектроскопии совпадают с данными для продукта из примера 17: 1Н-ЯМР (d6-ДМСО) - 0,18 (с, 3H), 0,02 (с, 3H), 0,85 (с, 9H), 1,75 (шир.с, 4H), 3,05 (шир.с, 1H), 3,7 (с, 3H), 4,1 (д, 2H), 4,72 (м, 1H), 4,82 (с, 1H), 5,0 (с, 2H), 6,9 (д, 2H), 7,12 (м, 5H), 7,35 (м, 10H), 7,73 (т, 1H).
Пример 20
Циклизацию бензилового эфира {4-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил}карбамиловой кислоты в бензиловый эфир {4-[3-[3-(трет-бутилдиметилсиланилокси)-3-(4-фторфенил)пропил]-2-(4-метоксифенил)-4-оксоазетидин-1-ил]бензил}карбамиловой кислоты проводят аналогично тому, как указано в примере 17, но с тетрабутилфосфоний-10,10-диметил-3-тиа-4-аза-трицикло[5.2.1.01,5]декан-3,3-диоксидом из примера 10 в качестве катализатора циклизации. Данные спектроскопии совпадают с данными для продукта из примера 17: 1Н-ЯМР (d6-ДМСО) - 0,18 (с, 3H), 0,02 (с, 3H), 0,85 (с, 9H), 1,75 (шир.с, 4H), 3,05 (шир.с, 1H), 3,7 (с, 3H), 4,1 (д, 2H), 4,72 (м, 1H), 4,82 (с, 1H), 5,0 (с, 2H), 6,9 (д, 2H), 7,12 (м, 5H), 7,35(м, 10H), 7,73 (т, 1H).
Пример 21
Циклизацию бензилового эфира {4-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил}карбамиловой кислоты в бензиловый эфир {4-[3-[3-(трет-бутилдиметилсиланилокси)-3-(4-фторфенил)пропил]-2-(4-метоксифенил)-4-оксоазетидин-1-ил]бензил}карбамиловой кислоты проводят аналогично тому, как указано в примере 17, но с тетрабутилфосфонийимидазолидом из примера 11 в качестве катализатора циклизации. Данные спектроскопии совпадают с данными для продукта из примера 17: 1Н-ЯМР (d6-ДМСО) - 0,18 (с, 3H), 0,02 (с, 3H), 0,85 (с, 9H), 1,75 (шир.с, 4H), 3,05 (шир.с, 1H), 3,7 (с, 3H), 4,1 (д, 2H), 4,72 (м, 1H), 4,82 (с, 1H), 5,0 (с, 2H), 6,9 (д, 2H), 7,12 (м, 5H), 7,35 (м, 10H), 7,73 (т, 1H).
Пример 22
Циклизацию бензилового эфира (4-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил}карбамиловой кислоты в бензиловый эфир {4-[3-[3-(трет-бутилдиметилсиланилокси)-3-(4-фторфенил)пропил]-2-(4-метоксифенил)-4-оксоазетидин-1-ил]бензил}карбамиловой кислоты проводят аналогично тому, как указано в примере 17, но с тетрабутилфосфонийфталимидом из примера 12 в качестве катализатора циклизации. Данные спектроскопии совпадают с данными для продукта из примера 17: 1H-ЯМР (d6-ДМСО) - 0,18 (с, 3H), 0,02 (с, 3H), 0,85 (с, 9H), 1,75 (шир.с, 4H), 3,05 (шир.с, 1H), 3,7 (с, 3H), 4,1 (д, 2H), 4,72 (м, 1H), 4,82 (с, 1H), 5,0 (с, 2H), 6,9 (д, 2H), 7,12 (м, 5H), 7,35 (м, 10H), 7,73 (т, 1H).
Пример 23
Циклизацию бензилового эфира {4-(5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил)карбамиловой кислоты в бензиловый эфир {4-[3-[3-(трет-бутилдиметилсиланилокси)-3-(4-фторфенил)пропил]-2-(4-метоксифенил)-4-оксоазетидин-1-ил]бензил}карбамиловой кислоты проводят аналогично тому, как указано в примере 17, но с тетрабутилфосфоний-3-(4-хлорфенил)-2H-изоксазол-5-оном из примера 13 в качестве катализатора циклизации. Данные спектроскопии совпадают с данными для продукта из примера 17: 1Н-ЯМР (d6-ДМСО) - 0,18 (с, 3H), 0,02 (с, 3H), 0,85 (с, 9H), 1,75 (шир.с, 4H), 3,05 (шир.с, 1H), 3,7 (с, 3H), 4,1 (д, 2H), 4,72 (м, 1H), 4,82 (с, 1H), 5,0 (с, 2H), 6,9 (д, 2H), 7,12 (м, 5H), 7,35 (м, 10H), 7,73 (т, 1H).
Пример 24
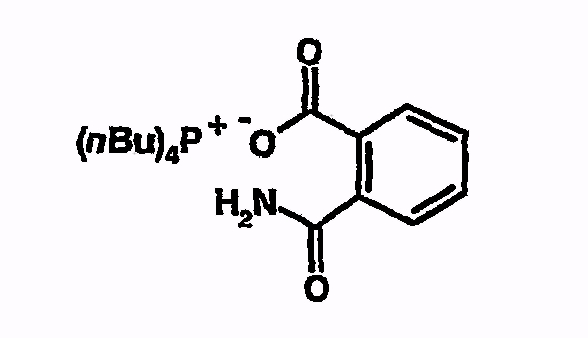
Тетрабутилфосфонийфталамат
Тетрабутилфосфонийфталамат получают следующим путем. Готовят раствор тетрабутилфосфонийгидроксида (12,5 г; 40% в воде). Затем добавляют фталимид (2,7 г) и реакционный раствор перемешивают в течение ночи при комнатной температуре. После этого воду удаляют на роторном испарителе и остаток вводят в толуол. Толуол удаляют на роторном испарителе и остаток снова вводят в толуол. Эту процедуру повторяют 4-5 раз. Затем растворитель удаляют досуха. 1H-ЯМР (d6-ДМСО) - 0,9 (т, 12H), 1,42 (м, 16H), 2,18 (м, 8H), 7,05 (шир, 1H), 7,18 (м, 1H), 7,29 (д, 2H), 7,74 (д, 1H), 10,35 (шир, 1H).
Пример 25
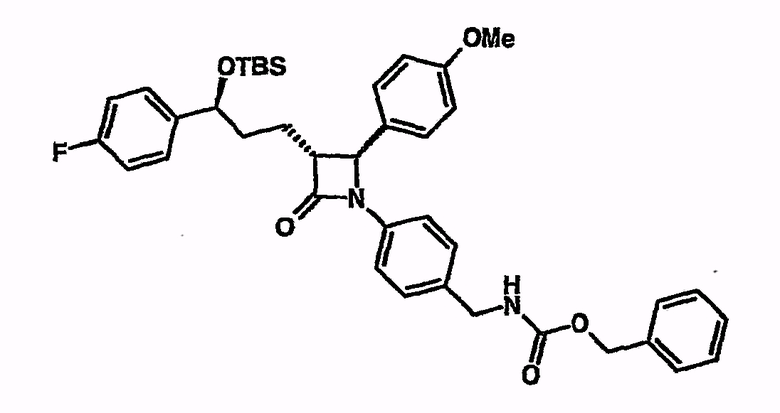
Циклизация бензилового эфира (4-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил)карбамиловой кислоты с тетрабутилфосфонийфталимидом из примера 24
При охлаждении льдом и в атмосфере аргона бензиловый эфир {4-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил}карбамиловой кислоты (100 мг) суспендируют в МТБЭ (5 мл). Добавляют N,O-бистриметилсилилацетамид (0,17 мл), затем - тетрабутилфосфонийфталамат (12 мг), растворенный в МТБЭ (1 мл). Перемешивают 2-3 часа при 50°C. Реакционный раствор концентрируют и вводят в этилацетат. Органическую фазу последовательно промывают 2н. раствором HCl(aq), насыщенным раствором бикарбоната натрия и насыщенным раствором поваренной соли. Затем сушат над сульфатом натрия, фильтруют и растворитель удаляют на роторном испарителе. После очистки путем хроматографии (прибор Flashmaster фирмы Jones Chromatography) получают бензиловый эфир {4-[3-[3-(трет-бутилдиметилсиланилокси)-3-(4-фторфенил)пропил]-2-(4-метоксифенил)-4-оксоазетидин-1-ил]бензил}карбамиловой кислоты (41 мг). 1H-ЯМР (d6-ДМСО) - 0,18 (с, 3H), 0,02 (с, 3H), 0,85 (с, 9H), 1,75 (шир.с, 4H), 3,05 (шир.с, 1H), 3,7 (с, 3H), 4,1 (д, 2H), 4,72 (м, 1H), 4,82 (с,1H), 5,0 (с, 2H), 6,9 (д, 2H), 7,12 (м, 5H), 7,35 (м, 10H), 7,73 (т, 1H).
Пример 26
Циклизацию бензилового эфира {4-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил}карбамиловой кислоты с тетрабутилфосфонийфталаматом из примера 24 проводят аналогично тому, как указано в примере 25, но в диизопропиловом эфире и при 50°C в течение 6 часов. Путем сопоставления ЖХ/МС (жидкостная хроматография/масс-спектрометрия) установлено превращение в продукт, аналогичный продукту из примера 25.
Пример 27
Циклизацию бензилового эфира {4-(5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил}карбамиловой кислоты с тетрабутилфосфонийфталаматом из примера 24 проводят аналогично тому, как указано в примере 25, но в толуоле и при 60°C в течение 13 часов. Путем сопоставления ЖХ/МС (жидкостная хроматография/масс-спектрометрия) установлено превращение в продукт, аналогичный продукту из примера 25.
Пример 28
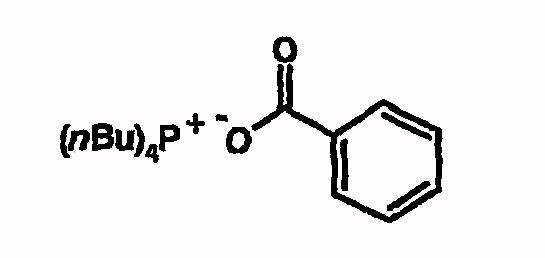
Тетрабутилфосфонийбензоат
Тетрабутилфосфонийбензоат получают следующим путем. Готовят раствор тетрабутилфосфонийгидроксида (4,7 г; 40% в воде). Затем добавляют бензойную кислоту (0,8 г) и реакционный раствор перемешивают 5 часов при комнатной температуре. После этого воду удаляют на роторном испарителе и остаток вводят в толуол. Толуол удаляют на роторном испарителе и остаток снова вводят в толуол. Эту процедуру повторяют 4-5 раз. Затем растворитель удаляют досуха.
Пример 29
Циклизацию бензилового эфира {4-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил}карбамиловой кислоты с тетрабутилфосфонийбензоатом из примера 28 проводят аналогично тому, как указано в примере 25, но в диизопропиловом эфире и при 60°C в течение 3 часов. Путем сопоставления ЖХ/МС (жидкостная хроматография/масс-спектрометрия) установлено превращение в продукт, аналогичный продукту из примера 25.
Пример 30
Циклизацию бензилового эфира {4-[5-(трет-бутилдиметилсиланилокси)-5-(4-фторфенил)-1-(4-метоксифенил)-2-(2-оксо-4-фенилоксазолидин-3-карбонил)пентиламино]бензил}карбамиловой кислоты с тетрабутилфосфонийацетатом (коммерческий продукт сушили в вакууме) проводят аналогично тому, как указано в примере 25, но в диизопропиловом эфире и при 60°C в течение 0,5 часов. Путем сопоставления ЖХ/МС (жидкостная хроматография/масс-спектрометрия) установлено превращение в продукт, аналогичный продукту из примера 25.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ДИФЕНИЛАЗЕТИДИНОНА, СОДЕРЖАЩИЕ ЭТИ СОЕДИНЕНИЯ ЛЕКАРСТВЕННЫЕ СРЕДСТВА И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2275370C2 |
| КАТИОНОЗАМЕЩЕННЫЕ ДИФЕНИЛАЗЕТИДИНОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННЫЕ СРЕДСТВА, СОДЕРЖАЩИЕ ЭТИ СОЕДИНЕНИЯ, И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2315753C2 |
| НОВЫЕ 1,2-ДИФЕНИЛАЗЕТИДИНОНЫ, ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ ЛИПИДНОГО ОБМЕНА, ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2286985C2 |
| ЦИКЛИЧЕСКИЗАМЕЩЕННЫЕ ДИФЕНИЛАЗЕТИДИНОНЫ, ПРИМЕНЕНИЕ ИХ ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2003 |
|
RU2315754C2 |
| ЗАМЕЩЕННЫЕ КИСЛОТНЫМИ ГРУППАМИ ДИФЕНИЛАЗЕТИДИНОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩИЕ ЭТИ СОЕДИНЕНИЯ ЛЕКАРСТВЕННЫЕ СРЕДСТВА И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2287522C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2013 |
|
RU2667788C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ В КАЧЕСТВЕ ИНГИБИТОРОВ КАТЕПСИНА | 2004 |
|
RU2346943C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2013 |
|
RU2638043C2 |
| КАРБОКСАМИДНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КАЛЬПАИНА | 2010 |
|
RU2567392C2 |
| СОСТАВ ДЛЯ ПОЛУЧЕНИЯ МЕТАТЕЗИСНЫХ ПОЛИМЕРИЗАТОВ | 1995 |
|
RU2171815C2 |
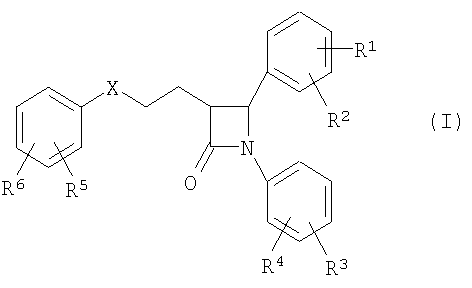
Описан способ получения производных 1,4-дифенилазетидинона из подходящим образом защищенных β-замещенных аминоамидов в присутствии агентов силилирования и по меньшей мере одного катализатора циклизации, причем производные 1,4-дифенилазетидинона соответствуют общей формуле (I), в которой символы, заместители и индексы имеют значения, указанные в формуле изобретения, причем этот катализатор циклизации используют как катион одной из нижеследующих общих формул (XII), причем R16, R17, R18, R19 независимо друг от друга означают (С1-С15)алкил, R41 означает (C1-C15) алкил, R42 означает арил, причем арил может быть замещен -C(O)NH2, и как анион соединения формул (VIII) или (IX) или (X) или (XI) и символы, заместители и индексы имеют указанные в формуле изобретения значения, причем остатки с R20 по R32 и с R34 по R38 независимо друг от друга означают Н (С1-С6)алкил, арил и соответственно два алкильных остатка вместе могут также образовывать арильный радикал, который опять же может быть замещен F, Cl, Br, I, и причем R39 и R40 вместе образуют 1,7,7-триметилбицикло[2.2.1]гептанил, или катион в этом катализаторе циклизации соответствует катиону общей формулы (XII), и анион означает R41O-, или катион в этом катализаторе циклизации соответствует катиону общей формулы (XII), и анион означает
R42COO-, причем соединения общей формулы (IV), в которой, если не определено другое, символы, заместители и индексы имеют указанные в формуле изобретения значения, циклизуют с получением (фор)продуктов общей формулы (V), у которых для получения соединения (I) может быть удалена защита. Технический результат - новый способ получения целевых соединений. 1 н. и 9 з.п. ф-лы.
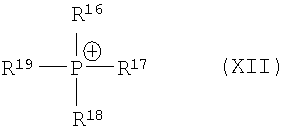
 ,
,  ,
,  ,
, 
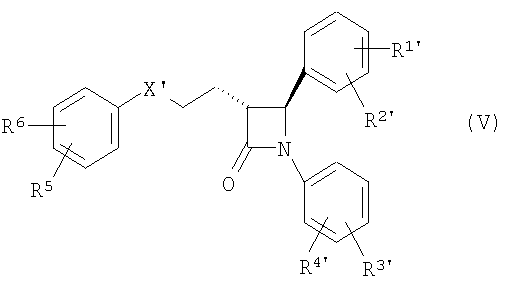
1. Способ получения производных 1,4-дифенилазетидинона из подходящим образом защищенных β-замещенных аминоамидов в присутствии агентов силилирования и по меньшей мере одного катализатора циклизации,
причем производные 1,4-дифенилазетидинона соответствуют общей формуле (I)
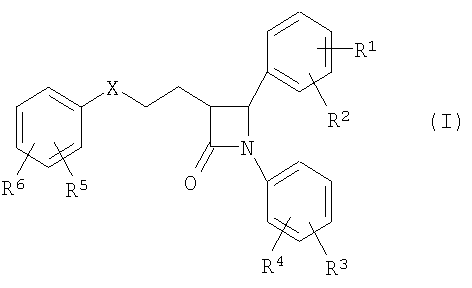
в которой символы, заместители и индексы имеют следующие значения:
Х = СН2, СНОН, СО или CHOCOR11,
R1, R2 = независимо друг от друга Н, O-(С1-С6)алкил,
R3, R4 = независимо друг от друга Н, F, Cl,
R5, R6 = независимо друг от друга Н, F, Cl,
Y = простая связь
m = от 0 до 5
причем этот катализатор циклизации используют как катион одной из нижеследующих общих формул
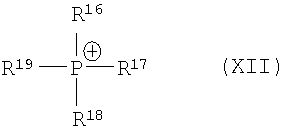
причем R16, R17, R18, R19 независимо друг от друга означают (С1-С15)алкил,
R41 означает (C1-C15)алкил,
R42 означает арил, причем арил может быть замещен -C(O)NH2, и как анион
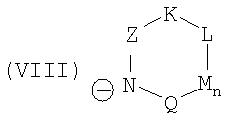 или
или 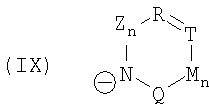 или
или 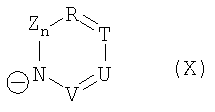
или 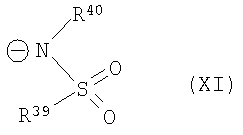
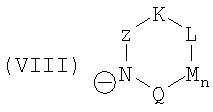
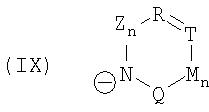
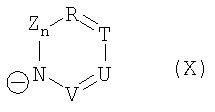
и символы, заместители и индексы имеют следующие значения:
Z = C=O,
К = О, NR21 или CR22R23,
L = NR24 или CR25R26,
n = 0 или 1,
М = О, C=O, NR27 или CR28R29,
Q = О, NR30, CR31R32, C=O или C=NR34,
R = CR35 или N,
Т = CR36 или N,
U = CR37 или N,
V = CR38 или N,
причем остатки с R20 по R32 и с R34 по R38 независимо друг от друга означают Н, (С1-С6)алкил, арил и соответственно два алкильных остатка вместе могут также образовывать арильный радикал, который опять же может быть замещен F, Cl, Br, I,
и причем R39 и R40 вместе образуют 1,7,7-триметилбицикло[2.2.1]гептанил,
или катион в этом катализаторе циклизации соответствует катиону общей формулы (XII), и анион означает R41O-, или катион в этом катализаторе циклизации соответствует катиону общей формулы (XII), и анион означает R42COO-,
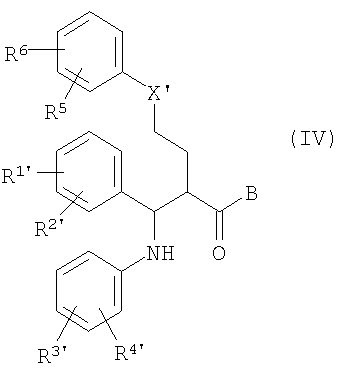
отличающийся тем, что соединения общей формулы (IV)
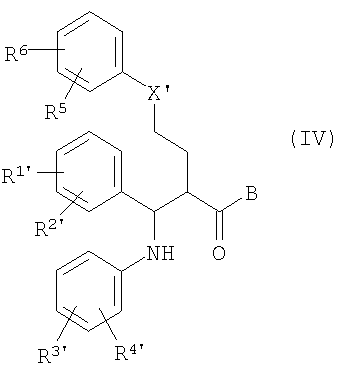
в которой, если не определено другое, символы, заместители и индексы имеют следующие значения:
X' = X, CHOSi(алкил)о(арил)р с о, р=1-3 и о+р=3, С(O-алкил)2 или циклический кеталь, как C[O(-CH2)q-O] с q=2, 3,
R1', R2' = R1, R2 и O-защитная группа,
R3', R4' = R3, R4, CH2NHCO2CH2(C6H5),
CH2N[Si(алкил)о(арил)р]CO2CH2(С6Н5), CH2NHCO2-tBu,
CH2N[Si(алкил)о(фенил)р]CO2-tBu, CH2NHC(С6Н5)3,
CH2N=С(С6Н5)2 или CH2N=CH[C6H4(R6)],
-B= 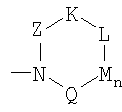
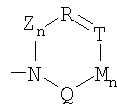
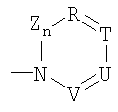
или
-B= 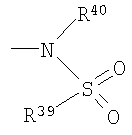
циклизуют с получением (фор)продуктов общей формулы (V)
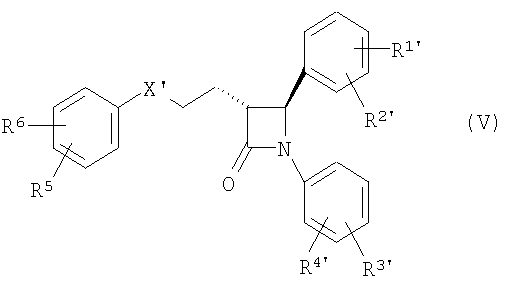
у которых для получения соединения (I) может быть удалена защита.
2. Способ получения производных 1,4-дифенилазетидинона по п.1, отличающийся тем, что соединения общей формулы (II)
приводят во взаимодействие с иминами общей формулы (III)
с образованием промежуточных соединений общей формулы (IV')
которые затем циклизуют в (фор)продукты общей формулы (V), у которых для получения соединения (I) может быть удалена защита,

в которой, если не определено другое, символы, заместители и индексы имеют следующие значения:
X' = X, CHOSi(алкил)о(арил)р с о, р=1-3 и о+р=3, С(O-алкил)2 или циклический кеталь, как C[O(-CH2)q-O] с q=2, 3,
R22, R33, R44, R55 = независимо друг от друга H, арил или (С1-С10)алкил,
Z1, Z2 = независимо друг от друга О, NH, NR15 или S,
R15 = арил или (С1-С10)алкил,
R1', R2' = R1, R2 и O-защитная группа,
R3', R4' = R3, R4, CH2NHCO2CH2(С6Н5),
CH2N[Si(алкил)о(арил)р]CO2CH2(С6Н5),
CH2NHCO2-tBu, CH2N[Si(алкил)о(фенил)р]CO2-tBu,
CH2NHC(С6Н5)3, CH2N=С(С6Н5)2 или
CH2N=СН[С6Н4(R6)],
причем катализатор циклизации имеет одну из общих формул (VIa)-(VII)
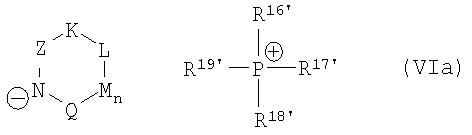 ,
,
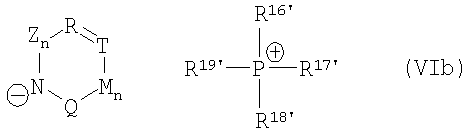 ,
,
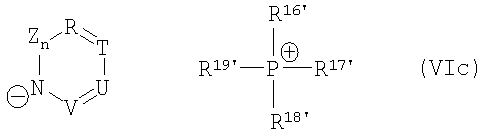 ,
,
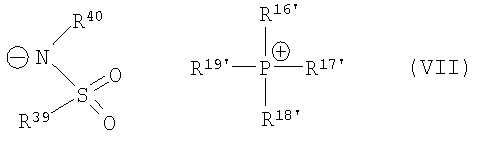 ,
,
где R16', R17', R18', R19' независимо друг от друга означают арил, (С1-С15)алкил, бензил.
3. Способ по п.1, отличающийся тем, что соединения общей формулы (II)

приводят во взаимодействие с иминами общей формулы (III)
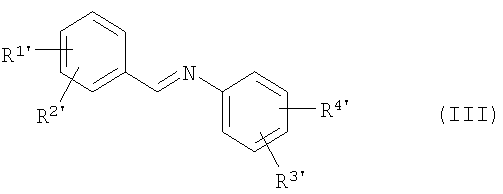
с образованием промежуточных соединений общей формулы (IV′),

которые затем циклизуют в (фор)продукты общей формулы (V), у которых для получения соединения (I) может быть удалена защита,

в которой, если не определено другое, символы, заместители и индексы имеют следующие значения:
X' = X, CHOSi(алкил)о(арил)р с о, р=1-3 и о+р=3, С(O-алкил)2 или циклический кеталь, как С[O(-СН2)q-O] с q=2, 3,
R22, R33, R44, R55 = независимо друг от друга Н, арил или (С1-С10)алкил,
Z1, Z2 = независимо друг от друга О, NH, NR15 или S,
R15 = арил или (С1-С10)алкил,
R1', R2' = R1, R2 и O-защитная группа,
R3', R4' = R3, R4, CH2NHCO2CH2(C6H5),
CH2N[Si(алкил)о(арил)р]CO2CH2(С6Н5),
CH2NHCO2-tBu, CH2N[Si(алкил)о(фенил)р]CO2-tBu,
CH2NHC(С6Н5)3, CH2N=C(C6H5)2 или
CH2N=CH[C6H4(R6)],
причем в катализаторе циклизации катион соответствует катиону общей формулы (XII), и анион является R41O-, или в этом катализаторе циклизации катион соответствует общей формуле (XII), и анион является R42COO-, причем
R16, R17, R18, R19 независимо друг от друга означают (С1-С15)алкил,
R41 означает (С1-С15)алкил,
R42 означает арил.
4. Способ по п.1, отличающийся тем, что соединения общей формулы (II)

приводят во взаимодействие с иминами общей формулы (III)
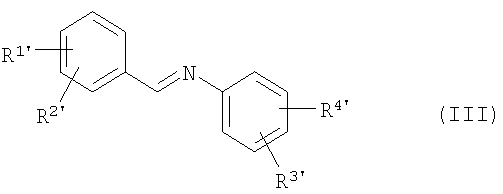
с образованием промежуточных соединений общей формулы (IV′),

которые затем циклизуют в (фор)продукты общей формулы (V), у которых для получения соединения (I) может быть удалена защита,

в которой, если не определено другое, символы, заместители и индексы имеют следующие значения:
X' = X, CHOSi(алкил)о(арил)р с о, р=1-3 и о+р=3, С(O-алкил)2 или циклический кеталь, как С[O(-СН2)q-O] с q=2, 3,
R22, R33, R44, R55 = независимо друг от друга Н, арил или (С1-С10)алкил,
Z1, Z2 = независимо друг от друга О, NH, NR15 или S,
R15 = арил или (С1-С10)алкил,
R1', R2' = R1, R2 и O-защитная группа,
R3', R4' = R3, R4, CH2NHCO2CH2(C6H5),
CH2N[Si(алкил)о(арил)р]CO2CH2(С6Н5),
CH2NHCO2-tBu, CH2N[Si(алкил)о(фенил)р]CO2-tBu,
CH2NHC(С6Н5)3, CH2N=C(C6H5)2 или
CH2N=CH[C6H4(R6)],
причем в катализаторе циклизации катион соответствует общей формуле (XII), и анион является R42COO-, причем
R16, R17, R18, R19 независимо друг от друга означают (С1-С10)алкил,
R41 означает (С1-С10)алкил,
R42 означает арил, причем арил может быть замещен -C(O)NH2.
5. Способ по одному из пп.1-4, отличающийся тем, что катион катализатора циклизации является катионом фосфония общей формулы (XII), в которой остатки с
R16 по R19, соответственно, с R16' по R19' означают (C1-С10)алкил, в частности, являются одинаковыми алкильными остатками.
6. Способ по п.5, отличающийся тем, что катион катализатора циклизации общей формулы (XII) является тетра-(н)-бутилфосфонием.
7. Способ по одному из п.1 или 2, отличающийся тем, что анион катализатора циклизации является анионом циклического имида общей формулы (VIII) или (IX).
8. Способ по одному из п.1 или 2, отличающийся тем, что анион катализатора циклизации является анионом оксазолидинона общей формулы (VIII).
9. Способ по п.1, отличающийся тем, что Н-В в общей формуле (IV) и протонированный анион катализатора общих формул с (VIII) по (XI) имеют одинаковые гетероциклы.
10. Способ по п.7, отличающийся тем, что гетероцикл является пятизвенным гетероциклом, который содержит по меньшей мере один атом N в кольце и при необходимости дополнительно содержит О в кольце.
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Клапан системы вентиляции картера двигателя внутреннего сгорания | 1985 |
|
SU1362855A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| ПРОИЗВОДНЫЕ АЗЕТИДИНОНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ГИПОХОЛЕСТЕРИНЕМИЧЕСКОЙ АКТИВНОСТЬЮ И СПОСОБ СНИЖЕНИЯ УРОВНЯ ХОЛЕСТЕРИНА В СЫВОРОТКЕ | 1994 |
|
RU2138480C1 |
Авторы
Даты
2010-01-27—Публикация
2005-05-20—Подача