Изобретение относится к новым соединениям, а именно к 1-замещенным 3-(2-хлор-1Н-индол-3-ил)-4-фенил-1Н-пиррол-2,5-дионам общей формулы I:
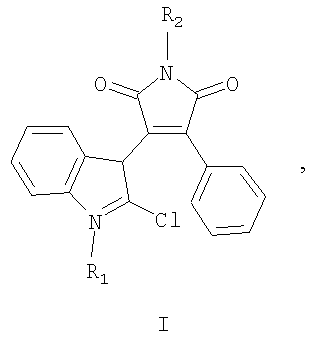
где R1=Н, C1-С6алкил; R2=C1-С6алкил, бензил, фенил.
Соединения I при облучении видимым светом генерируют стабильные флуоресцирующие вещества 2,8-замещенные бензо[а]пирроло[3,4-с]карбазол-1,3-(2Н,8Н)-дионы II.
Изобретение относится также к применению 3-(2-хлор-1Н-индол-3-ил)-4-фенил-1Н-пиррол-2,5-дионов выше приведенной общей формулы I в качестве соединений, способных к фотохимическому генерированию стабильных флуорофоров, что может быть использовано, например, в системах хранения информации, в частности, в качестве светочувствительной компоненты материала для трехмерной записи и хранения информации.
Изобретение относится также к новым соединениям, а именно к 2,8-замещенным бензо[а]пирроло[3,4-с]карбазол-1,3-(2Н,8Н)-дионам общей формулы II:
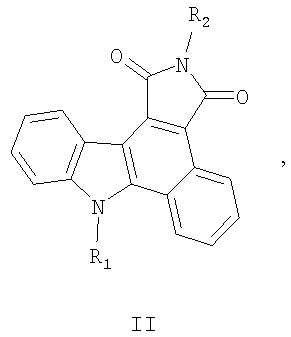
где R1=Н, C1-С6алкил; R2=C1-С6алкил, бензил, фенил, за исключением соединения, где R1=Н, a R2=СН3.
Изобретение относится также к применению 2,8-замещенных бензо[а]пирроло[3,4-с]карбазол-1,3-(2Н,8Н)-дионов выше приведенной общей формулы II в качестве соединений, обладающих флуоресценцией.
Наиболее близкими по структуре к соединениям общей формулы I являются замещенные 3-(7-этил-1Н-индол-3-ил)-4-(1-метил-1Н-индол-7-ил)-1Н-пиррол-2,5-дионы формулы III:
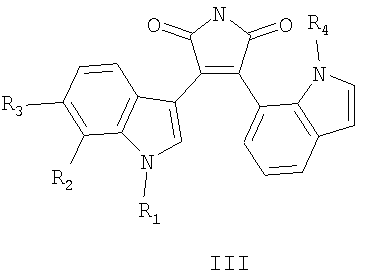
Соединения III /Margaret M. Paul, J.Org. Chem. 2004, 69, 2967-2975/ используются как исходные для получения окислительным фотосинтезом замещенных 3Н-индоло-[6,7-а]пирроло[3,4-с]карбазол-4,6(5Н,11Н)-дионов общей формулы IV:
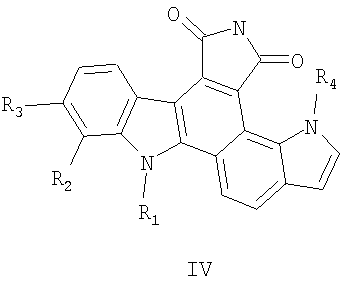
Наиболее близкими по структуре к соединениям общей формулы II являются вышеприведенные замещенные 3Н-индоло-[6,7-а]пирроло[3,4-с]карбазол-4,6(5Н,11Н)-дионы общей формулы IV, являющиеся ингибиторами циклин D1/CDK4 - комплекса протеинкиназы, регулирующей деление клеток /Margaret M. Faul, J.Org. Chem. 2004, 69, 2967-2975/.
Техническим результатом изобретения являются новые соединения в ряду 3-(1Н-индол-3-ил)-1Н-пиррол-2,5-дионов, проявляющие новые для данного ряда соединений свойства генерировать при действии света стабильные флуоресцирующие вещества.
Технический результат достигается соединениями общей формулы I и их применением в качестве веществ, образующих при действии света стабильные флуоресцирующие соединения II.
Техническим результатом изобретения являются также новые соединения в ряду бензо[а]пирроло[3,4-с]карбазол-1,3-(2Н,8Н)-дионов, проявляющие новые для данного ряда соединений флуоресцентные свойства.
Технический результат достигается соединениями общей формулы II и их применением в качестве флуоресцирующих веществ.
Изобретение удовлетворяет критерию изобретательского уровня: так, предлагаемые новые соединения проявляют новые свойства в ряду структурных аналогов.
Способ получения соединений I заключается во взаимодействии 3-(2-хлор-1Н-индол-3-ил)-4-фенилфуран-2,5-дионов V с алифатическими и ароматическими аминами:
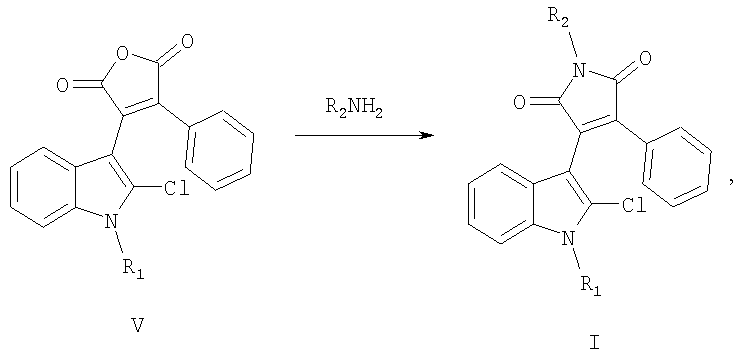
где R1=Н, C1-С6алкил; R2=C1-С6алкил, бензил, фенил.
Способ получения соединений II заключается в циклизации под действием видимого света 3-(1-алкил-2-хлор-1Н-индол-3-ил)-4-фенилфуран-2,5-дионов общей формулы I, где R1, R2 имеют вышеприведенные значения, сопровождающейся выделением хлористого водорода:
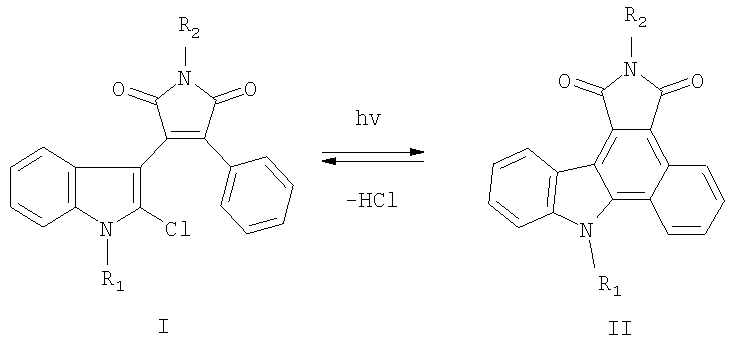
Ниже приведены примеры получения соединений I и II.
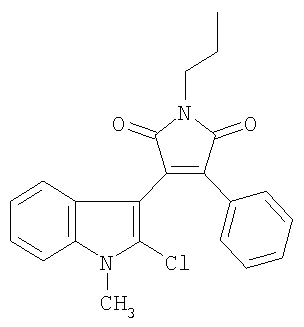
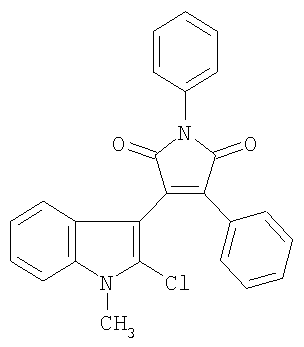
Пример 1. 3-(2-Хлор-1-метил-1H-индол-3-ил)-4-фенил-1-пропил-1H-пиррол-2,5-дион (R1=CH3, R2=н-пропил) (Ia).
К раствору 0.1 г (0.3 ммоля) 3-(2-хлор-1-метил-1Н-индол-3-ил)-4-фенил-фуран-2,5-диона V (R1=СН3) в 5 мл изопропилового спирта прикапывают 0.03 мл (0.45 ммоля) пропиламина. Смесь кипятят с обратным холодильником 1 час и охлаждают. Выпавший осадок отфильтровывают и кристаллизуют из изопропилового спирта. Выход 0.06 г (53%). Желтые кристаллы, т.пл. 129-130°С. ИК-спектр, ν/см-1: 687 (С-Cl), 1696 (С=O). Спектр ЯМР 1H (CDCl3, δ, м.д.): 1.00 т (3Н, СН3), 1.70-1.82 м (2Н, СН2), 3.66 т (2Н, СН2), 3.80 с (3Н, СН3), 7.00-7.38 м (7Н, аром), 7.54-7.60 м (2Н, аром). Найдено, %: С 69.69, Н 5.01, N 5.80. C22H19ClN2O2. Вычислено, %: С 69.72, Н 5.05, N 7.39.
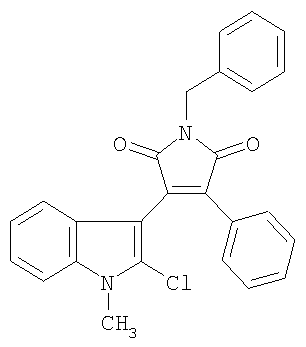
Пример 2. 1-Бензил-3-(2-хлор-1-метил-1H-индол-3-ил)-4-фенил-1H-пиррол-2,5-дион (R1=CH3, R2=бензил) (Ib).
Получен аналогично (1а) из 3-(2-хлор-1-метил-1Н-индол-3-ил)-4-фенил-фуран-2,5-диона V (R1=СН3) и бензиламина. Выход 0.07 г (55%). Желтые кристаллы, т.пл. 206-207°С. ИК-спектр, ν/см-1: 693 (С-Cl), 1700 (С=О). Спектр ЯМР 1H (CDCl3, δ, м.д.): 3.78 с (3Н, СН3), 4.82 с (2Н, СН2), 7.00-7.26 м (2Н, аром), 7.28-7.58 м (12Н, аром). Найдено, %: С 73.11, Н 4.46, N 6.50. C26H19ClN2O2. Вычислено, %: С 73.15, Н 4.49, N 6.56.
Пример 3. 3-(2-Хлор-1-метил-1H-индол-3-ил)-1,4-дифенил-1H-пиррол-2,5-дион (R1=СН3, R2=фенил) (Ic).
Получен аналогично (Ia) из 3-(2-хлор-1-метил-1Н-индол-3-ил)-4-фенил-фуран-2,5-диона V (R1=СН3) и анилина. Выход 0.09 г (73%). Желтые кристаллы, т.пл. 199-200°С. ИК-спектр, ν/см-1: 691 (С-Cl), 1707 (С=О). Спектр ЯМР 1H (CDCl3, δ, м.д.): 3.80-4.08 м (3Н, СН3), 4.82 с (2Н, СН2), 7.02-7.28 м (3Н, аром), 7.28-7.84 м (11Н, аром). Найдено, %: С 72.70, Н 4.11, N 6.75. C25H17ClN2O2. Вычислено, %: С 72.73, Н 4.15, N 6.78.
Пример 4. 8-Метил-2-пропилбензо[a]пирроло[3,4-с]карбазол-1,3(2H,6H)-дион (R1=СН3, R2=н-пропил) (IIa).
Раствор 20 мг (0.053 ммоля) 3-(2-хлор-1-метил-1Н-индол-3-ил)-4-фенил-1-пропил-1Н-пиррол-2,5-диона в 60 мл смеси толуол - гептан (1:2) облучают в кварцевой колбе суммарным светом ртутной лампы ДРШ-250. Ход реакции контролируют методом УФ-спектроскопии. Выпавший осадок отфильтровывают и перекристаллизовывают из бутанола. Выход 17 мг (93.8%). Желтые кристаллы, т.пл. 240-241°С. ИК-спектр, ν/см-1: 1693 (С=O). Спектр ЯМР 1H (CDCl3, δ, м.д.): 0.96 т (3Н, СН3), 1.62-1.78 м (2Н, CH2), 3.62 т (2Н, СН2), 4.42 с (3Н, СН3), 7.30-7.48 м (1Н, аром), 7.60-7.68 м (1Н, аром), 7.80-7.98 м (3Н, аром), 8.92-9.18 м (3Н, аром). Найдено, %: С 77.13, Н 5.28, N 8.15. C23H18N2O2. Вычислено, %: С 77.17, Н 5.30, N 8.18.
Пример 5. 2-Бензил-8-метилбензо[a]пирроло[3,4-с]карбазол-1,3(2H,6H)-дион (R1=СН3, R2=бензил) (IIb).
Получен аналогично (IIa) из 1-бензил-3-(2-хлор-1-метил-1H-индол-3-ил)-4-фенил-1Н-пиррол-2,5-диона. Выход 16 мг (87.6%). Желтые кристаллы, т.пл. 279-280°С. ИК-спектр, ν/см-1: 1696 (С-O). Спектр ЯМР 1H (CDCl3, δ, м.д.): 4.50 с (3Н, СН3), 4.94 с (2Н, СН2), 7.26-7.48 м (6Н, аром), 7.60-7.70 м (1Н, аром), 7.82-8.00 м (3Н, аром), 8.96-9.18 м (3Н, аром). Найдено, %: С 79.95, Н 4.61, N 7.15. C26H18N2O2. Вычислено, %: С 79.98, Н 4.65, N7.17.
Пример 6. 8-Метил-2-фенилбензо[а]пирроло[3,4-с]карбазол-1,3(2H,6H)-дион (R1=CH3, R2=фенил) (IIc).
Получен аналогично (IIa) из 3-(2-хлор-1-метил-1H-индол-3-ил)-1,4-ди-фенил-1Н-пиррол-2,5-диона. Выход 17 мг (93%). Желтые кристаллы, т.пл. 296-297°С. ИК-спектр, ν/см-1: 1704 (С=O). Спектр ЯМР 1H (CDCl3, δ, м.д.): 4.50 с (3Н, СН3), 7.10-7.28 м (4Н, аром), 7.40-7.70 м (3Н, аром), 7.82-8.04 м (3Н, аром), 8.88-9.24 м (3Н, аром). Найдено, %: С 79.74, Н 4.25, N 7.41. C25H16N2O2. Вычислено, %: С 79.77, Н 4.28, N 7.44.
У полученных соединений исследованы по стандартным методикам спектрально-абсорбционные и спектрально-флуоресцентные характеристики в толуоле при 293К.
Электронные спектры поглощения регистрировали на спектрофотометре «Сагу 100» (Varian).
Облучение растворов соединений I проводили в кварцевой кювете (l=1 см) светом 436 нм ртутной лампы ДРШ-250. Интенсивность падающего света, измеренная с помощью ферриоксалата калия, составляла 4.24·1015 квант·с-1.
Значения квантовых выходов фотореакций определяли по методике, описанной ранее / Экспериментальные методы химической кинетики, под редакцией Н.М.Эммануэля, М.Г.Кузьмина, Изд-во МГУ, Москва, 1985, с 1661/.
Флуоресцентные измерения проведены на спектрофлуориметре «Сагу Eclipse» (Varian). Значения квантовых выходов флуоресценции определяли методом Паркера - Риса /С.Паркер. Фотолюминесценция растворов. Москва, Мир, 1972, с.247/ с использованием 3-метоксибензантрона в толуоле (φ=0.1, λоблуч.=365 нм) в качестве стандартного люминофора /Б.М.Красовицкий, Б.М.Болотин. Органические люминофоры. Москва, Химия, 1984, с.292/.
В таблицах 1 и 2 приведены результаты исследований соединений Ia-с /по примерам 1-3/ и их фотопродуктов IIa-с /по примерам 4-6/.
л·моль-1·см-1)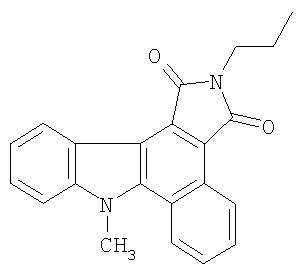
441 (8,68)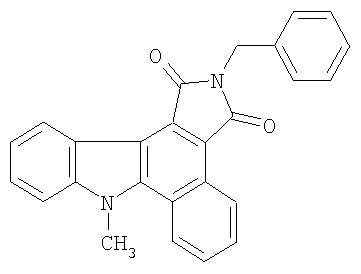
443 (6,06)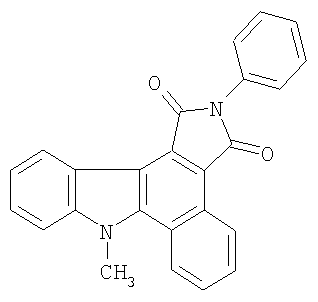
| название | год | авторы | номер документа |
|---|---|---|---|
| 4-ЗАМЕЩЕННЫЕ-3-(1-АЛКИЛ-2-ХЛОР-1Н-ИНДОЛ-3-ИЛ)ФУРАН-2,5-ДИОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ДЛЯ ФОТОХИМИЧЕСКОГО ГЕНЕРИРОВАНИЯ СТАБИЛЬНЫХ ФЛУОРЕСЦИРУЮЩИХ СОЕДИНЕНИЙ И (4,5-ЗАМЕЩЕННЫЕ-6-АЛКИЛ-1Н-ФУРО[3,4-c]КАРБАЗОЛ-1,3(6Н)-ДИОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФЛУОРОФОРОВ | 2009 |
|
RU2396267C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-R-6-R-5-АРИЛ-ПИРРОЛО[3,4-с]КАРБАЗОЛ-1,3(2Н,6Н)-ДИОНОВ | 2009 |
|
RU2404983C1 |
| 1-ЗАМЕЩЕННЫЕ-3-[(1Е)-1-АЛКЕНИЛ]-4-(5-АЛКОКСИ-1,2-ДИМЕТИЛ-1Н-ИНДОЛ-3-ИЛ)-1Н-ПИРРОЛ-2,5-ДИОНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФЛУОРЕСЦИРУЮЩИХ ФОТОХРОМОВ | 2008 |
|
RU2397979C2 |
| Способ получения замещенных 3-арилпирролов | 2024 |
|
RU2831117C1 |
| 1H-ПИРРОЛО[3,4-b]ХИНОЛИН-3,9(2H,4H)-ДИОНЫ, ОБЛАДАЮЩИЕ ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2009 |
|
RU2457208C2 |
| ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12 | 2011 |
|
RU2572593C2 |
| Способ получения 4-галоген-1Н-пирроло[3,4-с]пиридин-1,3(2Н)-дионов | 2022 |
|
RU2790399C1 |
| PROTAC, ЦЕЛЕНАПРАВЛЕННО ВОЗДЕЙСТВУЮЩИЕ НА ТАУ-БЕЛОК, И СВЯЗАННЫЕ С НИМИ СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2805523C2 |
| ПРОИЗВОДНЫЕ ЗАМЕЩЕННОГО ПИРРОЛОПИРИДИНОНА, ПРИГОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ | 2001 |
|
RU2267490C2 |
| 1,3-ДИЗАМЕЩЕННЫЕ 4-МЕТИЛ-1Н-ПИРРОЛ-2-КАРБОКСАМИДЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ИЗГОТОВЛЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2007 |
|
RU2463294C2 |
Изобретение относится к новым 1-замещенным 3-(2-хлор-1Н-индол-3-ил)-4-фенил-1Н-пиррол-2,5-дионам формулы I:
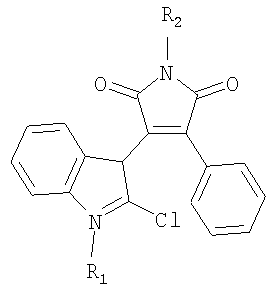
где R1 означает Н, C1-С6алкил; R2 означает C1-С6алкил, бензил, фенил, которые под действием видимого света образуют флуоресцирующие 2,8-замещенные бензо[а]пирроло[3,4-с]карбазол-1,3-(2Н,8Н)-дионы общей формулы II:
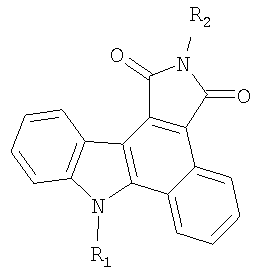
где значения R1 и R2 указаны выше. 4 н. и 6 з.п. ф-лы, 2 табл.
1. 1-Замещенные 3-(2-хлор-1Н-индол-3-ил)-4-фенил-1Н-пиррол-2,5-дионы общей формулы I:
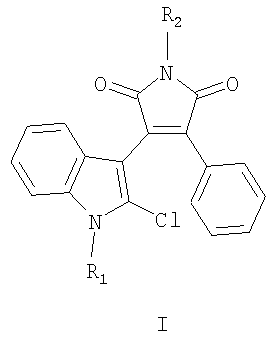 ,
,
где R1=H, С1-С6алкил; R2=C1-C6алкил, бензил, фенил.
2. 1-Замещенные 3-(2-хлор-1Н-индол-3-ил)-4-фенил-1Н-пиррол-2,5-дионы по п.1, где R1=СН3, R2=н-пропил-3-(2-хлор-1Н-индол-3-ил)-4-фенил-1-пропил-1Н-пиррол-2,5 -дион.
3. 1-Замещенные 3-(2-хлор-1Н-индол-3-ил)-4-фенил-1Н-пиррол-2,5-дионы по п.1, где R1=СН3, R2=бензол-1-бензил-3-(2-хлор-1Н-индол-3-ил)-4-фенил-1 Н-пиррол-2,5-дион.
4. 1-Замещенные 3-(2-хлор-1Н-индол-3-ил)-4-фенил-1Н-пиррол-2,5-дионы по п.1, где R1=СН3; R2=фенил-3-(2-хлор-1Н-индол-3-ил)-1,4-дифенил-1Н-пиррол-2,5-дион.
5. Применение 1-замещенных 3-(2-хлор-1Н-индол-3-ил)-4-фенил-1Н-пиррол-2,5-дионов общей формулы I по п.1 в качестве веществ, образующих под действием видимого света флуоресцирующие 2,8-замещенные бензо[а]пирроло[3,4-с]карбазол-1,3-(2Н,8Н)дионы общей формулы II:
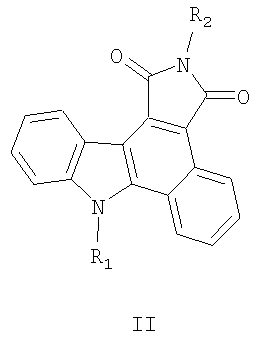 ,
,
где R1=H, C1-С6алкил; R2=C1-С6алкил, бензил, фенил.
6. 2,8-Замещенные бензо[а]пирроло[3,4-с]карбазол-1,3-(2Н,8Н)дионы общей формулы II:
 ,
,
где R1=H, C1-С6алкил; R2=С1-С6алкил, бензил, фенил, за исключением соединения, где R1=H, а R2=СН3.
7. Бензо[а]пирроло[3,4-с]карбазол-1,3-(2Н,8Н)дионы по п.6, где R1=метил, R2=пропил-8-метил-2-пропилбензо[а]пирроло[3,4-с]карбазол-1,3-(2Н,8Н)дион.
8. Бензо[а]пирроло[3,4-с]карбазол-1,3-(2Н,8Н)дионы по п.6, где R1=метил, R2=бензил-2-бензил-8-метилбензо[а]пирроло[3,4-с]карбазол-1,3-(2Н,8Н)дион.
9. Бензо[а]пирроло[3,4-с]карбазол-1,3-(2Н,8Н)дионы по п.6, где R1=метил, R2=фенил-8-метил-2-фенилбензо[а]пирроло[3,4-с]карбазол-1,3-(2Н,8Н)дион.
10. Применение 2,8-замещенных бензо[а]пирроло[3,4-с]карбазол-1,3-(2Н,8Н)-дионов общей формулы II, где R1=H, C1-С6алкил; R2=C1-C6алкил, бензил, фенил в качестве флуорофоров.
| Tetrahedron, 64, (2008), p.11012-11019 | |||
| Tetrahedron, 65, (2009), p.696-697 | |||
| Bioorg | |||
| Med | |||
| Chem | |||
| Letters, v.34, n 51, 1993, p.8361-8364 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| 0 |
|
SU234304A1 | |
Авторы
Даты
2010-10-27—Публикация
2009-08-13—Подача